Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ ФЕРМЕНТОВ ДЛЯ УДАЛЕНИЯ АЛЬДЕГИДОВ ИЗ ПРОДУКТОВ, СОДЕРЖАЩИХ АЛЬДЕГИДЫ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к ферментативному удалению формальдегида из композиций, содержащих формальдегид, и из продуктов, обработанных указанными композициями.
Уровень техники
Формальдегид (для удобства далее упоминается как "ФА") является важным химическим соединением, широко применяемым в промышленности при производстве строительных материалов и множества хозяйственных товаров. ФА применяется, например, при обработке для придания стойкости к сминанию в текстильной промышленности, при производстве и покрытии древесно-стружечных плит в деревообрабатывающей промышленности, и при производстве синтетических смол, таких как фенольные пластики и аминопластики, в химической промышленности. В результате высокой неустойчивости ФА выделяется в воздух в ходе производственных процессов и, как полагают, оказывает серьезное воздействие на здоровье людей и окружающую среду.
Выделяют четыре основные области применения ФА: в качестве промежуточного продукта при производстве смол; в качестве промежуточного продукта при производстве промышленных химических реагентов; в качестве биоцида; и в качестве компонента композиции изделий конечного потребления. Производство смол составляет около 65 процентов от общего потребления. Около одной трети применяется в крупномасштабном производстве химических производных, включая пентаэритрит, гексаметилентетрамин и бутандиол. Два процента применяется при обработке текстильных изделий, и небольшие количества ФА присутствуют в качестве консервантов или биоцидов в изделиях потребления и промышленных изделиях, таких как косметические продукты, шампуни и клеи. Наибольшие количества ФА применяются для получения конденсатов (то есть, смол) с мочевиной, меламином, нафталин-сульфонатом и фенолом, и, в меньшей степени, с их производными. Основная часть этих смол применяется для производства адгезивов и пропитывающих смол, которые применяются для производства древесностружечных плит, фанеры и мебели. Эти конденсаты также применяются для производства отверждаемых формовочных материалов; в качестве сырья для покрытия поверхностей и в качестве азотных удобрений с контролируемым высвобождением. Они применяются в качестве вспомогательных добавок в текстильной, кожевенной, резиновой и цементной промышленностях. Другие области применения включают связующие вещества для формовочного песка, маты из минерального войлока и стекловолокна для изоляционных материалов, абразивную бумагу и тормозные накладки. Очень небольшие количества конденсатов мочевина-формальдегид применяются при производстве вспененных смол, которые применяются в горной промышленности и при изоляции зданий и транспортных средств.
Некоторые продукты на основе ФА содержат непрореагировавший ФА в избытке, который может выделяться из продукта или высвобождаться в ходе последующего гидролиза. Одним примером является мочевиноформальдегидная смола. Мочевиноформальдегидная смола - это общий термин, который, на самом деле, включает целый класс родственных композиций. Около 60 процентов продуктов на основе мочевиноформальдегидных смол идут на производство древесностружечных плит и фанеры, где смола применяется в качестве клея. Мочевиноформальдегидные смолы также применяются в декоративных слоистых материалах, текстиле, бумаге и формовочном песке.
Наконец, формальдегидные смолы применяются для обработки текстиля в целях улучшения устойчивости предметов одежды к сминаемости. Обработка смолой или химическим реагентов в большинстве случаев является последней стадией современного процесса производства текстильных изделий. Целью является придание отбеленной, окрашенной или набивной ткани посредством механической и химической обработки подходящего для дальнейшей реализации состояния. Одним из наиболее важных процессов является обработка несмываемым красителем тканного и трикотажного полотен, состоящих из хлопка, других целлюлозных волокон и их смесей с синтетическими волокнами.
Прежде всего, обрабатывающие агенты на основе смолы были разработаны для улучшения усадки вискозного штабельного полотна. Эти соединения, как правило, получали из формальдегида и мочевины. Для улучшения конкурентоспособности хлопка на рынке текстильных товаров, гетероциклические сшивающие реагенты на основе формальдегида, мочевины и глиоксаля были разработаны и, в общем, применяются для обработки, облегчающей уход за одеждой и препятствующей сминанию. Из-за предположений о возможном вреде для здоровья людей, концентрации ФА в продуктах и промышленных процессах сохранялись настолько нисколько это возможно.
В уровне техники раскрываются различные технологии, направленные на удаление ФА, например, переносимого по воздуху, при высвобождении из продуктов или непосредственно из хорошо известных и широко применяемых смол, как указано выше. В патенте США 5,352,274 раскрывается воздушная фильтрация с применением множества гофрированных подложек, которые расположены друг на друге или прижаты друг к другу и которые включают угольную пыль для адсорбции примесей, таких как ФА, ацетальдегид и акролеин. Эта технология обеспечивает способ адсорбции молекул ФА физическим образом, без разложения посредством химической или биохимической реакции. В US 5,830,414 раскрывается обработка углеродных волокон с помощью активной маленькой молекулы, такой как сильная кислота, сильное основание или сильный окисляющий агент. Эти химические вещества могут применяться только для обработки волокон, имеющих высокую химическую устойчивость, как например, у активированных углеродных волокон. Кроме того, волокна, обработанные таким образом, потенциально опасны для применения. Применение ферментов, расщепляющих формальдегид, в воздушных фильтрах раскрывается в патенте JP2001340436.
С точки зрения текстильной промышленности и строительных материалов, агенты, удаляющие ФА, не должны оказывать отрицательное воздействие на свойства волокна, такие как восприятие на ощупь, сминаемость, способность сохранять форму и оттенок или белизну, или механические свойства древесностружечной плиты. И, конечно, их применение должно быть экономически выгонным для применения при производстве и эффективным на разумном уровне. В текстильной промышленности, соединения, имеющие активные метиленовые группы, применялись в качестве агентов для удаления ФА в целях уменьшения количества ФА, высвобождающегося из тканей, обработанных с целью исключения необходимости глажения, как описано в Textile Chemist and Colorist, Vol.16, No. 12, p.33, Dec. 1984 (публикация the American Association of Textile Chemists and Colorists). Агенты для удаления ФА, содержащие активные метиленовые группы, также могут добавляться в покрывающие композиции, содержащие мочевин/формальдегидную или меламин/формальдегидную смолу для уменьшения концентрации формальдегида (например, как описано в патенте США №5,795,933). Также известно добавление мочевины и ее производных для захвата формальдегида.
В уровне техники не раскрываются агенты, удаляющие ФА, которые эффективны при уменьшении высвобождающегося ФА до низких уровней, которые не оказывают пагубного воздействия на свойства материалов, обрабатываемых указанными смолами. В настоящее время агенты, удаляющие ФА, наиболее широко применяемые в композициях для обработки с целью исключения необходимости глажения, представляют собой многотомные спирты, такие как диэтиленгликоль и сорбит, и, при производстве древесностружечных плит, азотосодержащие соединения, такие как мочевина, меламин, диазин, триазин и аминосоединения (Патент США №4,559,097). Соединения, такие как эти, однако не являются достаточно эффективными для уменьшения уровней ФА с получением низких уровней, которые желательны в настоящее время. Более того, они только связывают ФА, но не катализируют его разложение. Также некоторые поглотители формальдегида, такие как мочевина, затормаживают реакционную способность сшивающих агентов для текстиля, уменьшая их эффективность.
Формальдегиддисмутазная (далее упоминаемая как "ФДМ") активность впервые была описана Като и его коллегами в 1983 году (Kato et al., 1983, Agric. Biol. Chem., 47(1), pages 39-46), но соответствующий ген не был обнаружен до 1995 (Yanase et al. 1995, Biosci. Biotechnol. Biochem., 59(2), 197-202). Первый протокол рекомбинантного получения и очищения растворимой ФДМ опубликовали в 2002 (Yanase et al. 2002, Biosci. Biotechnol. Biochem., 66(1), 85-91). Кристаллическая структура ФДМ (Hasegawa et al. 2002, Acta Crystallogr., Sect.A, 58, C102-C102) и других родственных ферментов доступна с 2002 года (Tanaka et al. 2002, Journal of Molecular Biology, 324, 519-533).
Сущность изобретения
Таким образом, техническое решение согласно настоящему изобретению заключается в обеспечении эффективных способов и средств уменьшения содержания ФА в композициях, которые применяются для обработки различных материалов, например, в текстильной или строительной промышленности, преодолевая недостатки, известные из уровня техники. Данное техническое решение достигается посредством объектов настоящего изобретения, а именно, изобретатели неожиданно обнаружили, что содержание формальдегида в смолах, которые применяются для обработки таких материалов, может быть эффективно уменьшено путем применения фермента, который катализирует разложение формальдегида.
Кроме того, в настоящем изобретении раскрываются модель, характеристика и кристаллические структуры мутантов ФДМ с улучшенной специфичностью в отношении формальдегида, усиленной активностью в отношении ацетальдегида и повышенной термостабильностью. В частности, мутант ФДМ I301L показывает повышенную активность в отношении формальдегида по сравнению с белком дикого типа и является более термостабильным. Этот фермент может быть легко получен с высоким выходом путем ферментации и сформирован в виде порошка, полученного распылительной сушкой.
Таким образом, настоящее изобретение относится к применению ферментного препарата, который катализирует разложение формальдегида, для уменьшения содержания формальдегида в композиции, содержащей формальдегид.
В предпочтительном варианте выполнения настоящего изобретения ферментный препарат включает фермент, который содержит аминокислотную последовательность SEQ ID NO:2 или ее варианты. В следующем варианте выполнения настоящего изобретения ферментом является формальдегиддисмутаза (ФДМ) из бактериального штамма, предпочтительно ЕС 1.2.99.4. или ЕС 1.2.1.46 согласно классификации ферментов, который является производной штамма Pseudomonas putida.
В особенно предпочтительном варианте выполнения настоящего изобретения ферментный препарат включает фермент, который содержит аминокислотную последовательность SEQ ID NO:8 или SEQ ID NO:10.
В следующем предпочтительном варианте выполнения настоящего изобретения композицией является смола. Смола может представлять собой сшивающий агент для текстиля или полимерный диспергирующий агент, применяемый для создания полимерных дисперсий. В предпочтительном варианте выполнения настоящего изобретения сшивающий агент применяется для текстильных материалов, которые содержат целлюлозные волокна, такие как хлопок или вискоза, или их смесь или смеси с синтетическими веществами.
Полученные полимерные дисперсии подходят для обработки материалов, например, таких как строительные или конструкционные материалы, кожа и шкура, древесноволокнистая плита, клееная фанера и/или ковровый настил, и подходят для применения в целях покрытия или производства бумаги.
В другом варианте выполнения настоящее изобретение относится к способу уменьшения содержания формальдегида в композиции, содержащей формальдегид, отличающемуся тем, что он содержит контакт композиции с ферментным препаратом, который катализирует разложение формальдегида.
Изобретение также относится к способу уменьшения содержания формальдегида в текстиле, включающему контакт текстиля с ферментным препаратом, который катализирует разложение формальдегида. Кроме того, оно относится к композициям, содержащим сшивающий агент для текстильных материалов или полимерный диспергирующий агент и ферментный препарат, который катализирует разложение формальдегида.
Другие варианты выполнения настоящего изобретения относятся к кодон-оптимизированной нуклеиновой кислоте, кодирующей дисмутазу, векторам, содержащим указанную нуклеиновую кислоту, и экспрессионному хозяину.
Кроме того, настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей новые варианты ФДМ, аминокислотной последовательности указанных вариантов ФДМ, а также, в частности, к их применению.
Описание чертежей
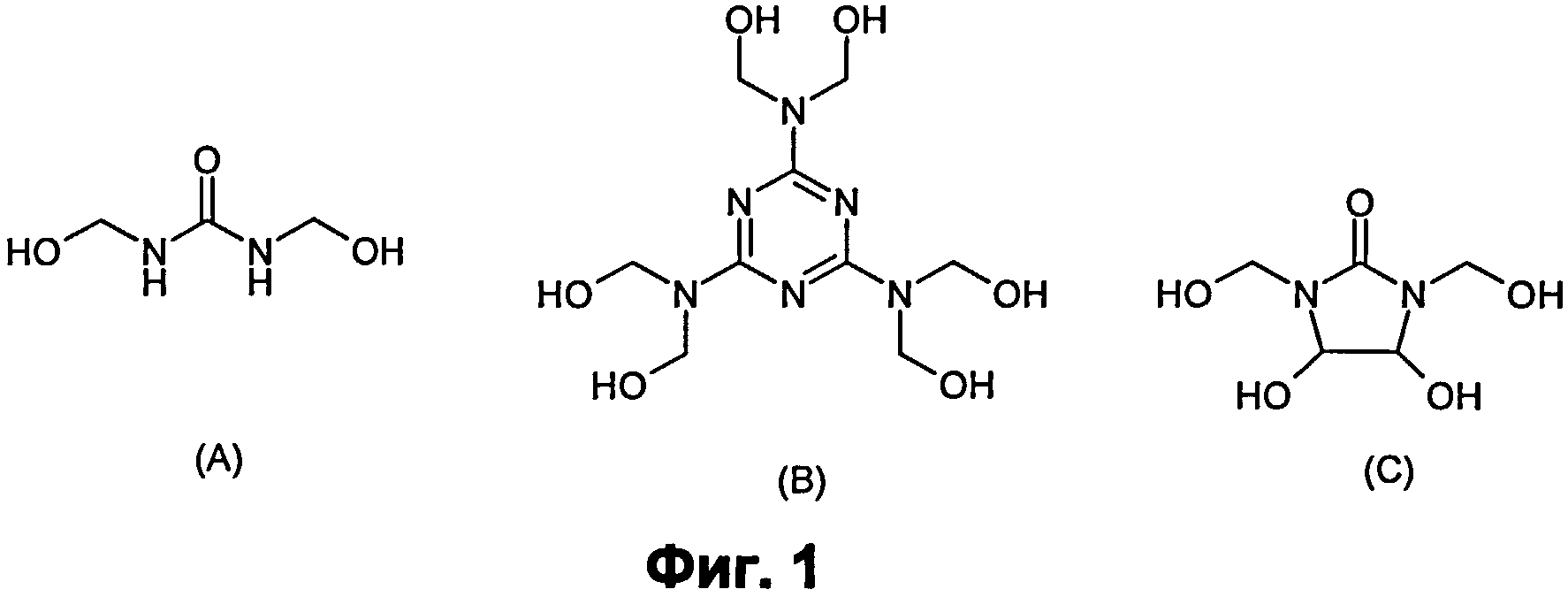
Фиг.1: Некоторые сшивающие агенты на основе формальдегида. (А) мочевина-ФА, (В) меламин-ФА, (С) диметилолдигидроксиэтиленмочевина (DMDHEU).
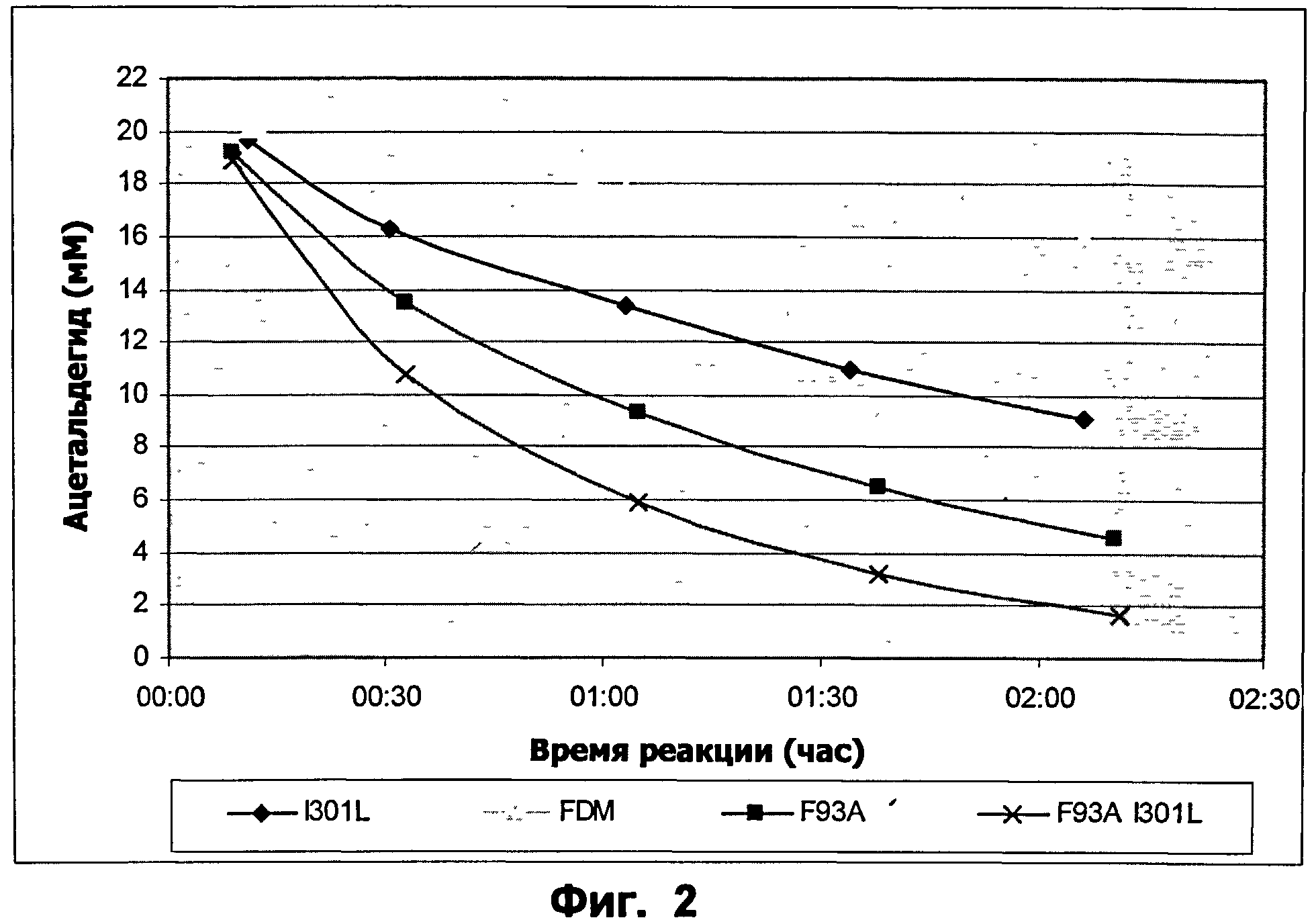
Фиг.2: Начальные скорости ацетальдегидной дисмутации (20 мМ в 50 мМ K2HPO4 рН 8, 100 мМ KCl) для ФДМ, ФДМ I301L, ФДМ F93A и ФДМ I301L/F93A, определенные с помощью ВЭЖХ. Концентрация фермента 50 мкг/мл.
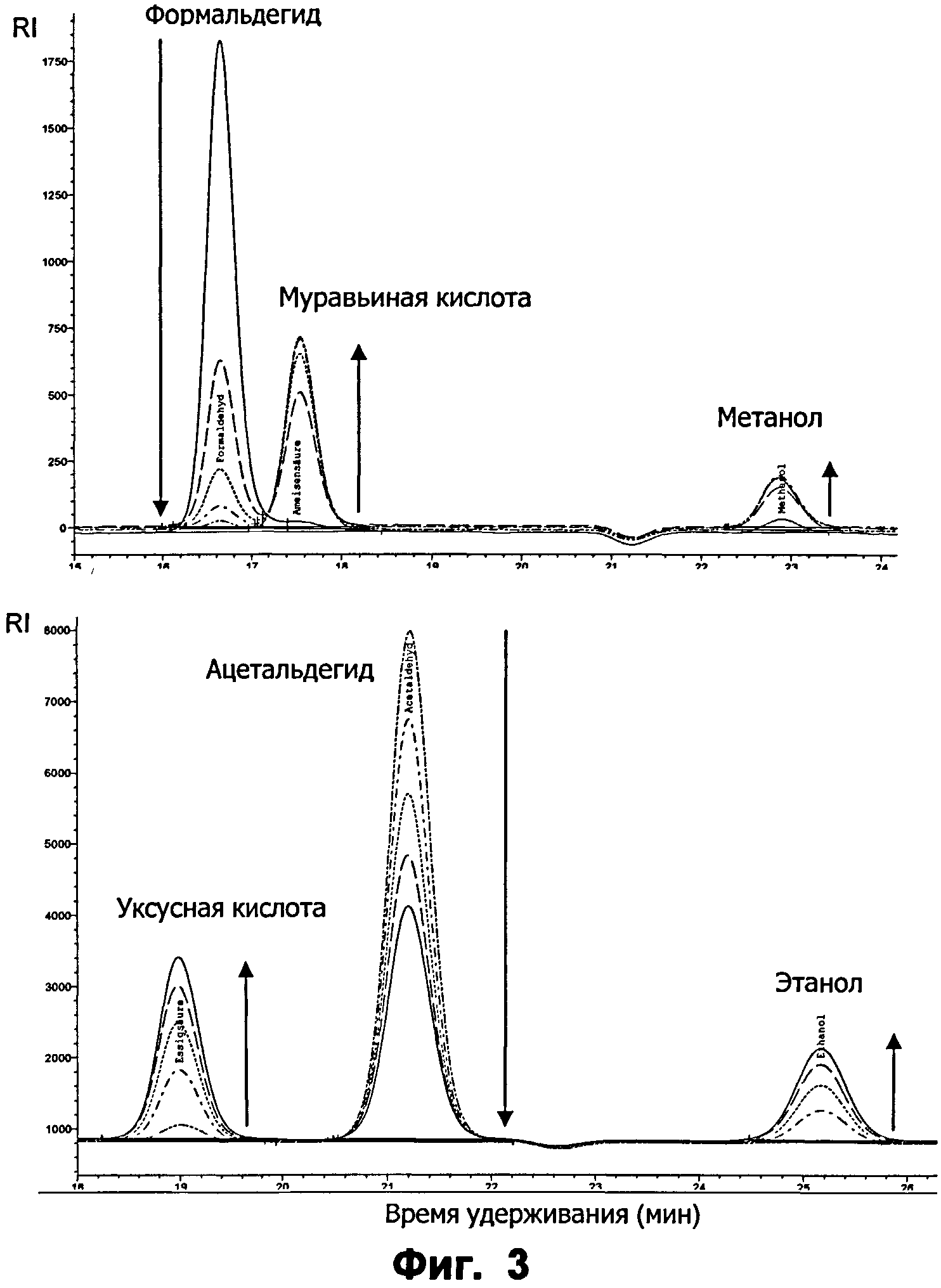
Фиг.3: Ферментативное превращение формальдегида (наверху) и ацетальдегида (внизу), за которым следили с помощью ВЭЖХ, с применением варианта ФДМ I301L. Реакционную смесь проанализировали в течение 2 часов для интервалов по 30 минут. Реакции проводили в 50 мМ K2HPO4 (рН 7.3 для формальдегида и рН 8 для ацетальдегида), 100 мМ KCl и 20 мМ альдегида. Концентрация фермента для ацетальдегида составляла 50 мкг/мл и для формальдегида - 2,4 мкг/мл. Время удерживания для формальдегида: 16.6 мин; муравьиной кислоты: 17,5 мин; метанола: 22,9 мин; ацетальдегида: 21,2 мин; уксусной кислоты: 18.9 мин; этанола: 25,2 мин. Образование продукта является эквимолярным. Обнаружение проводили с помощью RI.
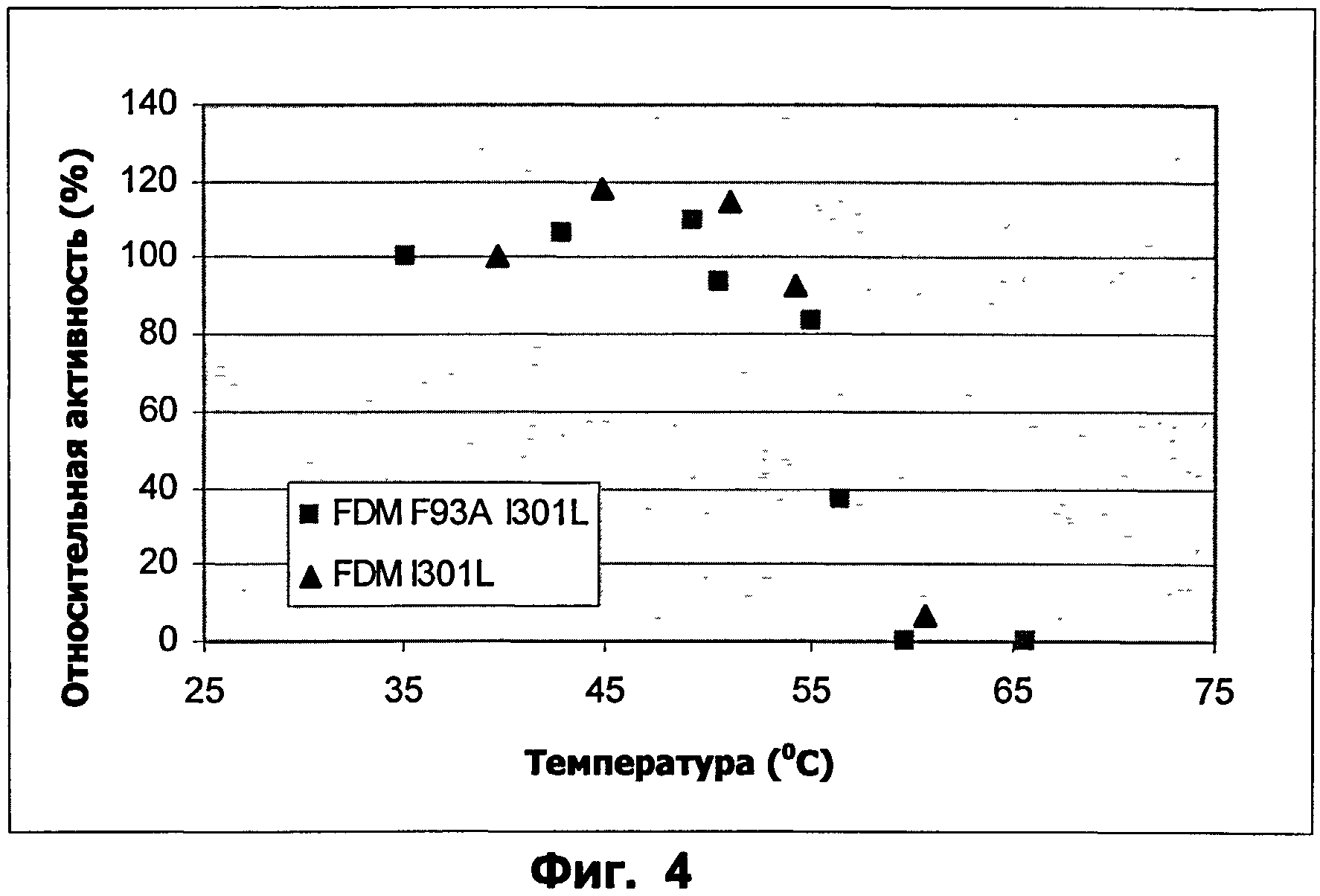
Фиг.4: Профиль температура - активность для ФДМ I301L и ФДМ I301L/F93A. Субстрат: ацетальдегид.
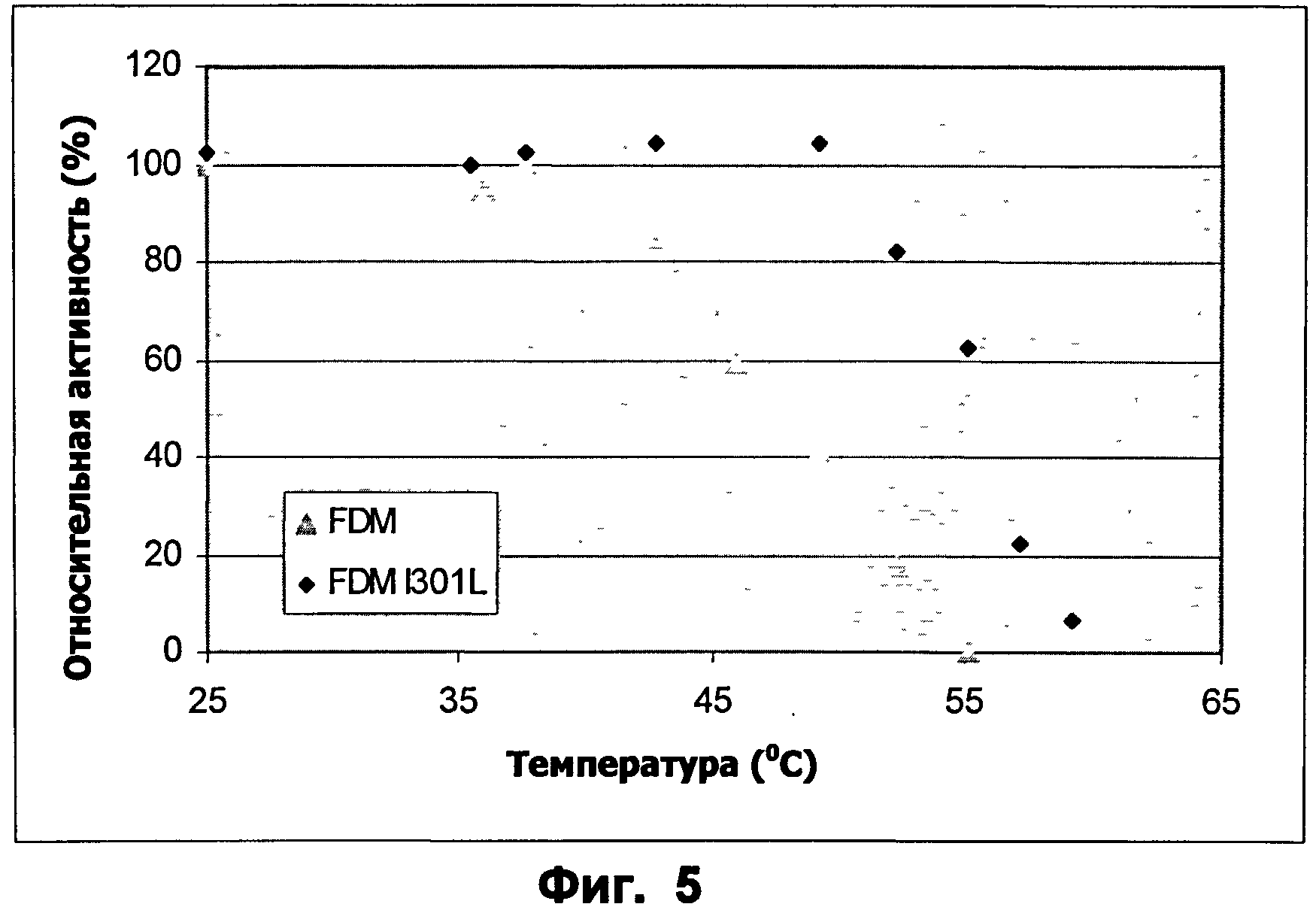
Фиг.5: Профиль температура-активность для ФДМ и ФДМ I301L. Субстрат: формальдегид.
Фиг.6: Phe 93 дикого типа показана вместе с картой электронной плотности для ФДМ I301L/F93A мутанта.
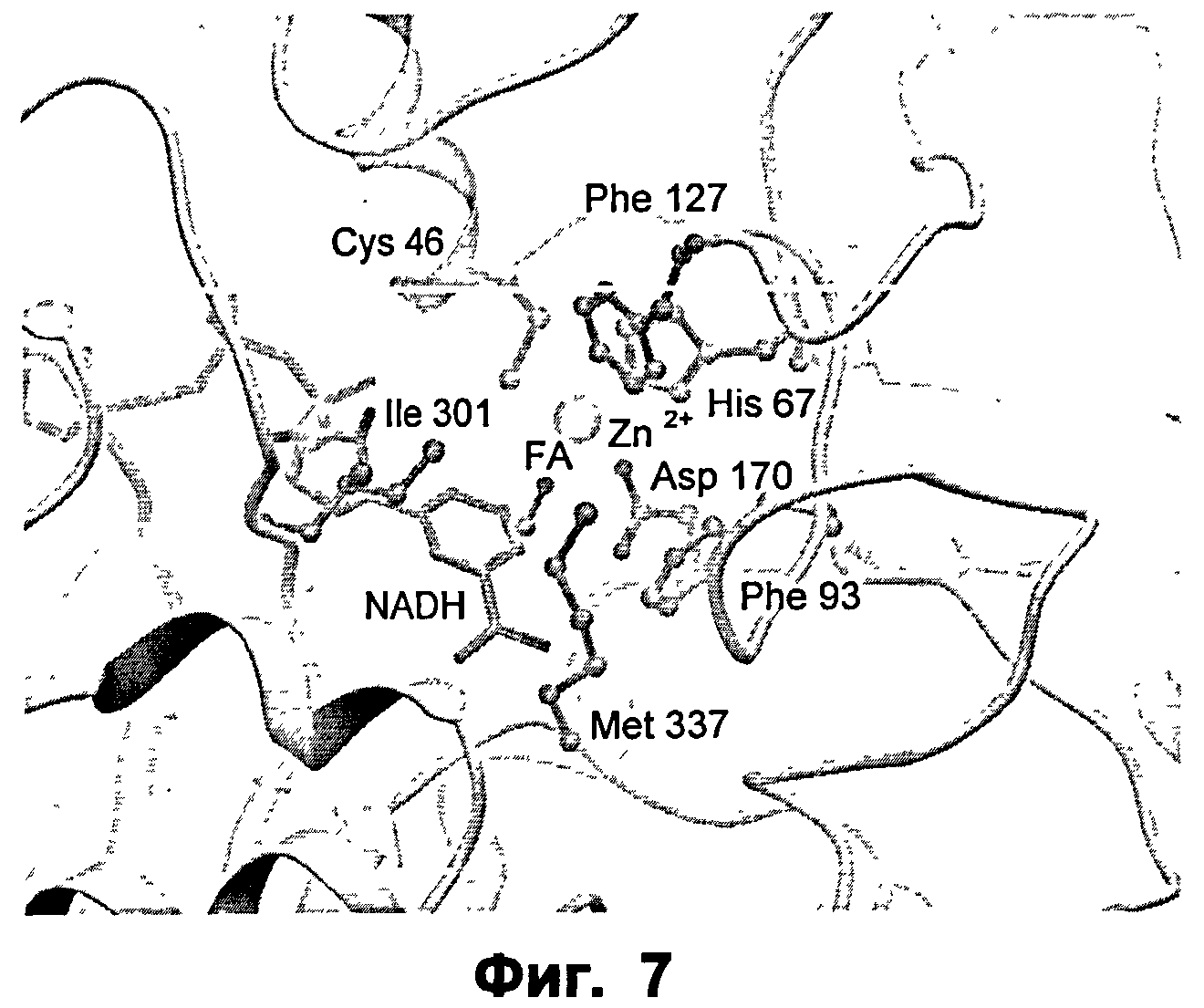
Фиг.7: крупный план активного сайта ФДМ дикого типа в комплексе с формальдегидом (ФА).
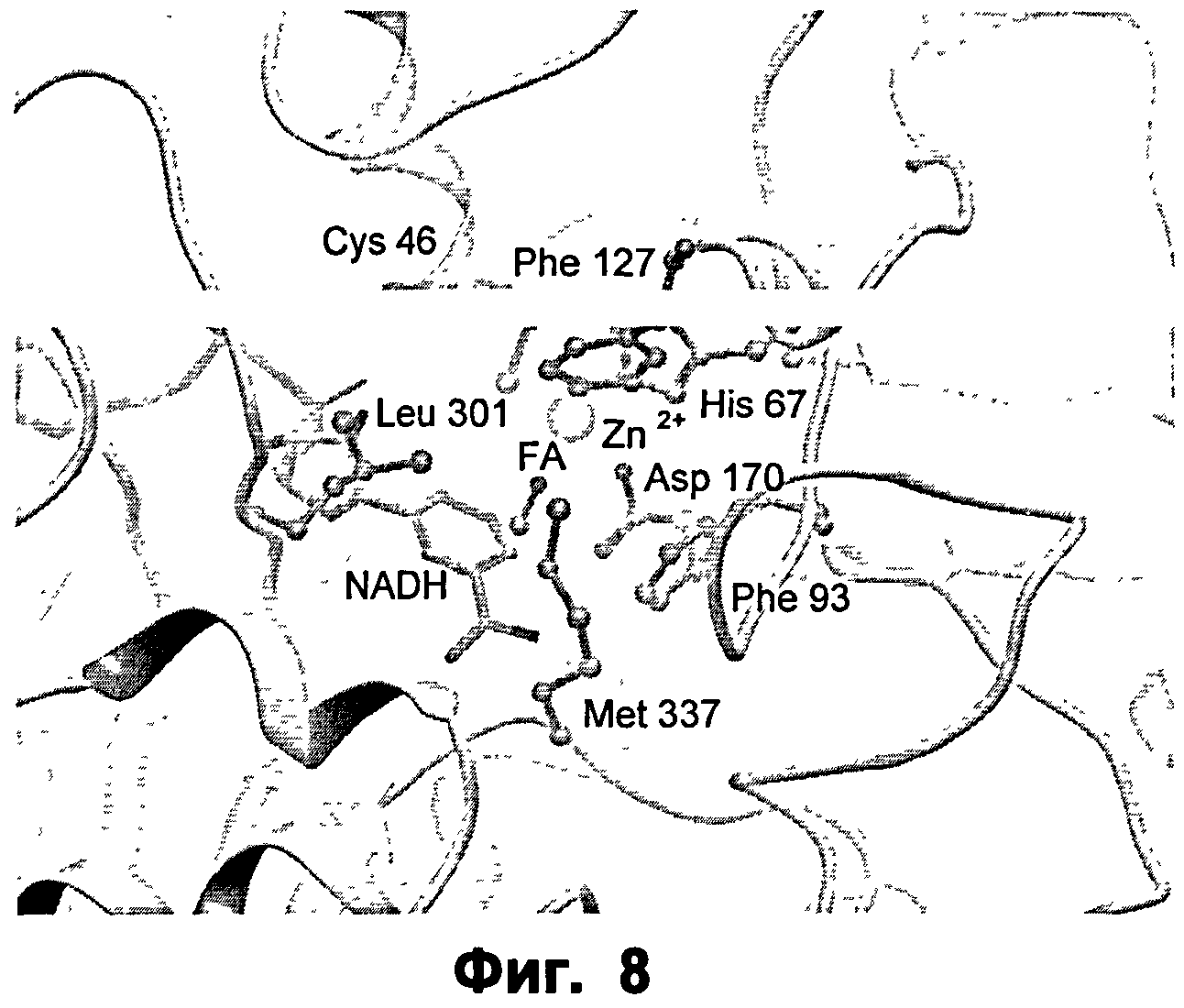
Фиг.8: крупный план активного сайта ФДМ I301L в комплексе с формальдегидом (ФА).
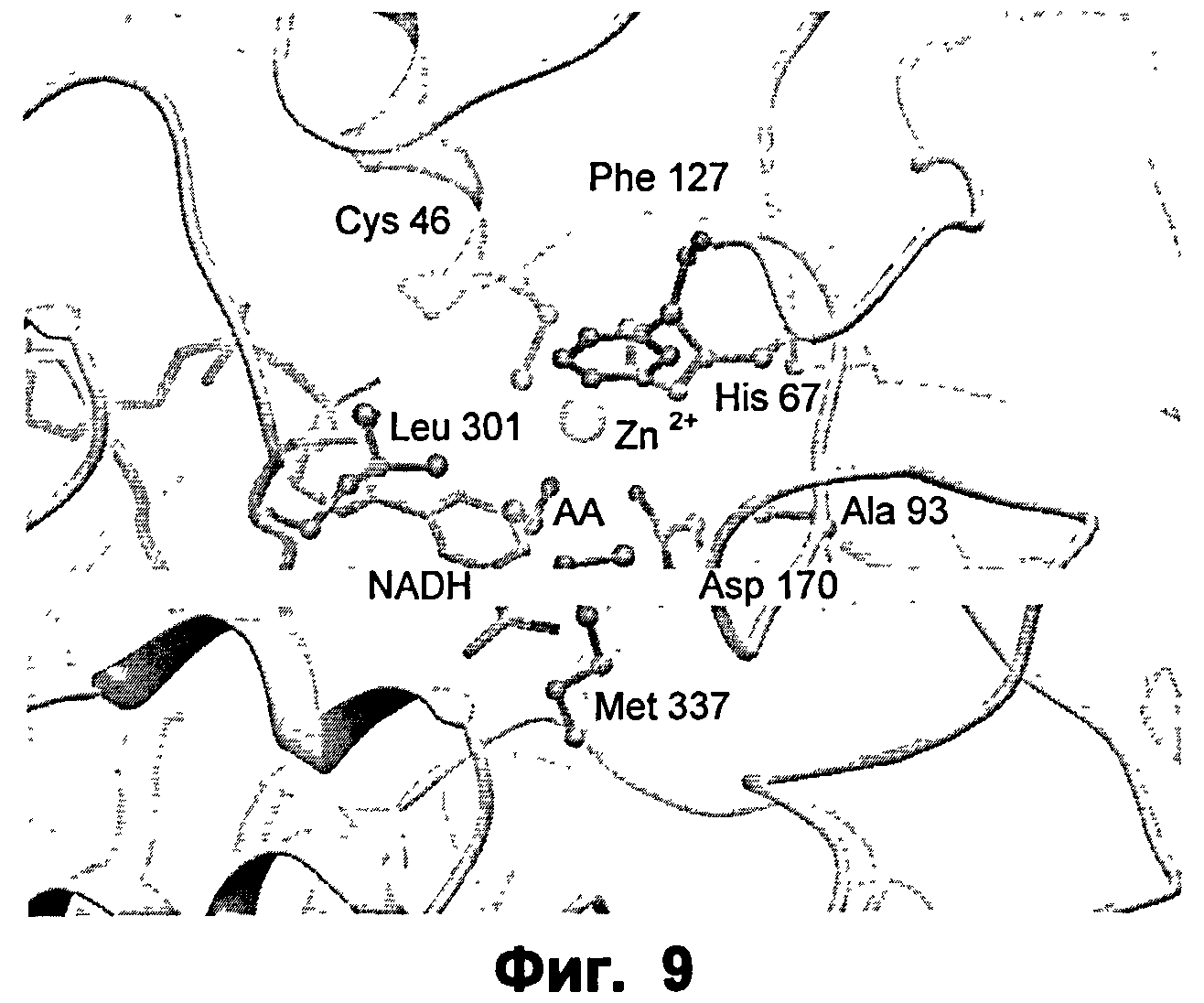
Фиг.9: крупный план активного сайта ФДМ I301L/F93A в комплексе с ацетальдегидом (АА).
Описание последовательностей
SEQ ID NO:1
Аминокислотная последовательность формальдегиддисмутазы, номер доступа в генном банке L25862 (CDS 323..1522)
SEQ ID NO:2
Последовательность белка формальдегиддисмутазы, номер доступа в генном банке L25862
SEQ ID NO:3
Оптимизированная ДНК последовательность для ФДМ из Pseudomonas putida F61 (1197 bp)
SEQ ID NO:4
Нуклеотидная последовательность pDHE-ФДМ
SEQ ID NO:5
Нуклеотидная последовательность pAgro
SEQ ID NO:6
Нуклеотидная последовательность pHSG
SEQ ID NO:7
Последовательность нуклеиновых кислот формальдегиддисмутазы Ile-301-Leu
SEQ ID NO:8
Последовательность белка формальдегиддисмутазы IIe-301-Leu
SEQ ID NO:9
Последовательность нуклеиновых кислот формальдегиддисмутазы Phe-93-Ala/Ile-301-Leu
SEQ ID NO:10
Последовательность белка формальдегиддисмутазы Phe-93-Ala/IIe-301-Leu
Определения
Должно быть понятно, что настоящее изобретение не ограничивается конкретной описанной методологией, протоколами, клеточными линиями, видами или родом растений, конструкциями и реагентами. Необходимо понимать, что терминология, используемая в настоящем документе, применяется в целях описания только конкретных вариантов выполнения настоящего изобретения и не предполагает ограничение объема настоящего изобретения, который ограничивается только приложенной формулой изобретения. Необходимо отметить, что при применении в описании и в формуле изобретения единственная форма включает также и множественную форму, если иного не указано. Так, например, термин "вектор" также относится к одному или более векторам и включает их эквиваленты, известные специалистам в данной области техники, и т.д. Термин "около" применяется в настоящем изобретении со значением приблизительно, грубо, примерно или в интервале. Когда термин "около" применяется в комбинации с интервалом значений, это означает возможный выход за пределы данного интервала значений, то есть выше и ниже приведенных численных значений. В общем, термин "около" применяется в настоящем изобретении для модификации численного значения, то есть для увеличения или уменьшения установленного значения на 20 процентов, предпочтительно 10 процентов, ниже или выше (более высокое или более низкое значение). Согласно настоящему изобретению предлог "или" означает любой один член конкретного списка и также включает любую комбинацию членов списка.
Термин "формальдегид" или "ФА" относится к соединению общей формулы CH2O, имеющему номер CAS 50-00-0. Это соединение также известно специалисту в данной области техники как формалин, метиленоксид, метилальдегид, метанал, НСНО, муравьиный альдегид, оксометан, формол, оксиметилен, морбицид, veracur, метилегликоль, формалин 40, BFV, фанноформ, формалит, FYDE, НОСН, карзан, лизоформ, суперлизоформ, метан 21. В чистой форме формальдегид представляет собой газ, но часто применяется в жидком виде после разбавления водой, в виде гидрата НО-(CH2O)n-Н, известного как метандиол. Водные растворы формальдегида обозначаются как формалин. Он представляет собой бесцветную весьма огнеопасную жидкость или газ с едким запахом, который обнаруживается при количестве 1 часть на миллион (ч.н.м.). Формальдегидные смеси (например, смеси с водой, ацетоном, бензолом, простым диэтиловым эфиром, хлороформом и этанолом) также охватываются в целях настоящего изобретения. Полимеры формальдегида, которые охватываются данным термином, включают полимеры с низкой и высокой молекулярной массой, в частности параформальдегид, а также линейные или циклические полиоксиметилены
Термин "ацетальдегид" или "АА" относится к соединению общей формулы СН3СНО, имеющему номер CAS 75-07-0. Это соединение также известно специалистам в данной области техники как этанал и представляет собой бесцветную жидкость с резким удушливым запахом, которая слегка благоухает при разбавлении. Ацетальдегид представляет собой промежуточный продукт в метаболизме растительных и животных организмов, в которых его можно обнаружить в небольших количествах. Более высокие количества ацетальдегида участвуют в биологических процессах. В качестве промежуточного продукта в процессах спиртового брожения он присутствует в небольших количествах во всех спиртосодержащих напитках, таких как пиво, вино и спирты. Ацетальдегид также был обнаружен в растительных соках и эфирных маслах, обжаренных зернах кофе и табачном дыме. При более высоких концентрациях (до 1000 частей на миллион) ацетальдегид раздражает слизистые оболочки. Предел осаждения ацетальдегида в воздухе находится в интервале от 0.07 до 0.25 частей на миллион. При таких концентрациях фруктовый запах ацетальдегида является очевидным. Конъюнктивальные раздражения были очевидны через 15 минут воздействия концентраций 25 и 50 частей на миллион, но транзиторный конъюнктивит и раздражение дыхательных путей были обнаружены только после воздействия 200 частей на миллион ацетальдегида в течение 15 минут.
Термин „метилглиоксаль" относится к соединению общей формулы (СН3-СО-СН=O), имеющему номер CAS 78-98-8 (Kato et al., 1983, Agric. Biol. Chem., 47(1), pages 39-46). Оно также известно специалистам в данной области техники как пирувальдегид, 2-оксопропаналь, 2-оксопропиональдегид, и образуется в качестве побочного продукта некоторых метаболических путей.
Термин "композиция", как применяется в настоящем изобретении, означает химическую композицию, полученную согласно конкретной формуле и/или составу. Она, таким образом, отличается от природных источников, содержащих формальдегид. Композицию получают, применяя добавление ФА. В некоторых случаях композиция также упоминается как "ФА конденсат".
Как применяется в настоящем изобретении термин "смола" означает низкомолекулярное вещество, которое затем вступает в реакцию с формированием высокомолекулярного полимера или сшитых функциональных полимерных цепей, как например, целлюлоза. В частности, термин «смола» относится к "синтетическим смолам", которые обозначают смолы, получаемые путем контролируемых химических реакций, таких как полиприсоединение или поликонденсация между конкретно определенными реагентами, включая формальдегид, который сам по себе не обладает признаками смолы. Синтетические смолы могут также означать смолы, полученные путем полимеризации ненасыщенных мономеров. Этот термин включает (i) углеводородные смолы, то есть, синтетические смолы из каменноугольной смолы, нефтепродукта и скипидарных фракций, полученные путем полимеризации. Эти смолы применяются, также как и природные, например, в комбинации с другими полимерами для придания специфических свойств материалу, таких как липкость, текучесть и твердость, и (ii) синтетические смолы, получаемые, главным образом, путем полиприсоединения и поликонденсации в присутствии формальдегида, которые являются промежуточными продуктами в синтезе пластмасс более высокой молекулярной массы. Примеры и предпочтительные варианты выполнения таких смол более подробно раскрываются далее.
Как применяется в настоящем документ термин "ферментный препарат", как предполагается, охватывает любой препарат фермента (полученного) с любой степенью чистоты (включая экспрессию фермента в хозяине, то есть Е.coli), пока препарат является ферментативно активным. Ферментные препараты согласно настоящему изобретению включают препараты, проявляющие множество отличных специфических активностей, и, как правило, применяемые в форме более или менее необработанных ферментных экстрактов в смеси с одним или более носителями.
Как применяется в настоящем документе термин "сшивающий агент" или "сшивающее средство" означает смолу, содержащую ФА, как определено выше, которая может применяться для сшивания молекул целлюлозы в текстильных материалах для улучшения свойств несминаемости и отсутствия необходимости глажения, особенно для целлюлозных тканей. Примеры предпочтительных вариантов таких сшивающих агентов далее раскрываются более подробно.
Термин "текстиль" или "ткань", как применяется в настоящем документе, означает продукты и объекты, изготовленные из природных материалов, таких как джут, сизаль, рами, конопля и хлопок, а также из синтетических волокон, таких как вискоза, искусственный шелк, сложные эфиры целлюлозы, волокна на основе винильных смол, полиакрилонитрил и его сополимеры, полимеры и сополимеры олефинов, как например, этилен, полиимид или нейлон, сложные полиэфиры и тому подобное. Применяемые ткани могут содержать одну композицию или смесь волокон.
Термин "полимерные диспергирующие агенты" относится к полиэлектролитам, которые легко растворяются в воде. Наиболее распространенными представителями являются поликарбонаты, полисульфонаты или полифосфаты щелочных металлов, как правило, натриевые соли. Предпочтительные диспергирующие агенты получают путем конденсации ароматических соединений с формальдегидом. Применение продуктов конденсации ароматической сульфоновой кислоты с формальдегидом очень широко распространено. Как правило, они либо представляют собой анионные формальдегидные смолы на основе нафталинсульфоната, меламинсульфоната или фенола, либо их производные. Другие полимерные диспергирующие агенты включают графт-полимеры на основе анионных основных цепей и неионных боковых цепей. Как правило, поликарбоксилаты применяются в качестве основных цепей, и полиалкиленгликоли применяются в качестве боковых цепей. Указанные полимерные диспергирующие агенты обеспечивают уменьшение содержания воды в гидравлических связующих смесях, таких как системы на основе цемента и сульфата кальция, соответственно без уменьшения работоспособности и реологических свойств. Они, кроме того, могут применяться для улучшения работоспособности гидравлических связующих или для увеличения нарастания прочности. Полимерные диспергирующие агенты также известны в уровне техники как "суперпластификаторы". Такие полимерные диспргирующие агенты также применяются в красильных растворах для текстиля для стабилизации окрашивающих дисперсий.
Термин "вариант" в отношении последовательности (например, последовательности полипептидов или нуклеиновых кислот, такой как, например, регулирующая транскрипцию нуклеотидная последовательность согласно изобретению), как предполагается, обозначает по существу подобные последовательности. Для нуклеотидных последовательностей, содержащих открытую рамку считывания, варианты включают те последовательности, которые, благодаря вырожденности генетического кода, кодируют идентичные аминокислотные последовательности нативного белка. Аллельные варианты природного происхождения, такие как эти, могут быть идентифицированы с применением хорошо известных методик молекулярной биологии, как например, с помощью полимеразной цепной реакции (ПЦР) и методик гибридизации. Варианты нуклеотидных последовательностей также включают синтетически полученные нуклеотидные последовательности, такие как полученные, например, путем сайт-направленного мутагенеза и для открытых рамок считывания, кодирующие нативный белок, а также те, которые кодируют полипептид, имеющий замещения аминокислот по сравнению с нативным белком. В общем, варианты нуклеотидных последовательностей согласно настоящему изобретению будут на по меньшей мере 30, 40, 50, 60-70%, например, предпочтительно 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%-79%, в общем, по меньшей мере 80%, например, 81%-84%, по меньшей мере 85%, например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%-98% и 99% "идентичны" нуклеотидной последовательности SEQ ID NO:1. Термин "вариант" полипептида, как предполагается, обозначает полипептид, полученный из белка SEQ ID NO:2, путем делеции (так называемого усечения) или добавления одной или более аминокислот к N-терминальному и/или C-терминальному концу нативного белка; делецией или добавлением одной или более аминокислот в одном или более сайтах в нативном белке; или замещением одной или более аминокислот в одном или более сайтах в нативном белке. Такие варианты могут быть результатом, например, генного полиморфизма или могут быть получены в результате человеческого воздействия. Пути такого воздействия известны в данной области техники.
Термин "идентичность последовательности" относится к степени, до которой две оптимально выровненные ДНК или аминокислотные последовательности неизменны в окне выравнивания компонентов, например, нуклеотидов или аминокислот. Термин "доля идентичности" для выровненных сегментов тестируемой последовательности и контрольной последовательности означает число идентичных компонентов, которые являются общими для двух выровненных последовательностей, поделенное на общее число компонентов в сегменте контрольной последовательности, то есть во всей контрольной последовательности или более маленькой определенной части контрольной последовательности. "Процент идентичности" означает долю идентичности, умноженную на 100. Оптимальное выравнивание последовательностей для выравнивания окна сравнения хорошо известно специалистам в данной области техники и может быть проведено с помощью инструментов, таких как алгоритм локального выравнивания Смита-Ватермана, алгоритм локального выравнивания Нидламана-Вунша, способ поиска подобия по Пирсону и Липману, и предпочтительно с помощью компьютерных воплощений указанных алгоритмов, как например, GAP, BESTFIT, FASTA и TFASTA, доступных как часть GCG.RTM. Wisconsin Package. RTM. (Accelrys Inc. Burlington, Mass.).
Термин "частей на миллион" (ч.н.м.) относится к массовым долям и эквивалентен "мг/кг".
Полипептид(ы)/белок(и)
Термины "полипептид" и "белок" применяются в настоящем документа взаимозаменяемо и относятся к аминокислотам в полимерной форме любой длины, связанным вместе пептидными связями.
Полинуклеотид(ы)/Нуклеиновая кислота(ы)/ Последовательность(и) нуклеиновых кислот/нуклеотидная последовательность(и)
Термины "полинуклеотид(ы)", "последовательностей) нуклеиновых кислот", "нуклеотидная последовательность(и)", "нуклеиновая кислота(ы)", "молекула нуклеиновой кислоты" применяются в настоящем документе взаимозаменяемо и относятся к нуклеотидам, либо рибонуклеотидам, либо деоксирибонуклеотидам, или комбинации обоих, в полимерной неразветвленной форме любой длины.
Гомолог(и)
"Гомологи" белка охватывают пептиды, олигопептиды, полипептиды, белки и ферменты, имеющие замещения, делеции и/или вставки аминокислот по сравнению с рассматриваемым немодифицированным белком, и имеющие подобную биологическую и функциональную активность по сравнению с немодифицированным белком, из которого они получены.
Делеция относится к удалению одной или более аминокислот из белка.
Вставка относится к введению одного или более аминокислотных остатков в конкретный сайт в белке. Вставки могут содержать N-терминальные и/или C-терминальные слияния, а также вставки одной или множества аминокислот внутри последовательности. В общем, вставки внутри аминокислотной последовательности будут меньше, чем N- или C-терминальные слияния, порядка около 1-10 остатка. Примеры N- или C-терминальных слитых белков или пептидов включают домен связывания или домен активации транскрипционного активатора, как применяется в дрожжевой двугибридной системе, фаговые белки оболочки, (гистидин)-6-tag, глутатион S-трансфераза-tag, белок А, мальтоза-связывающий белок, дигидрофолат-редуктазу, Tag·100 эпитоп, c-myc эпитоп, FLAG®-эпитоп, lacZ, CMP (пептид, связывающий кальмодулин), НА эпитоп, эпитоп белка С и VSV эпитоп.
Замещение относится к замещению аминокислот белка другими аминокислотами, имеющими подобные свойства (как например, подобная гидрофобность, гидрофильность, антигенность, склонность к образованию или разрушению структур α-спиралей или структур β-листов). Аминокислотные заместители, как правило, представляют собой отдельные остатки или могут находиться в форме кластеров, в зависимости от функциональных ограничений в полипептиде, и могут содержать от 1 до 10 аминокислот; вставки, как правило, будут составлять от 1 до 10 аминокислотных остатков. Аминокислотные замещения предпочтительно представляют собой консервативные аминокислотные замещения. Таблицы консервативных замещений хорошо известны в данной области техники (смотрите, например, Creighton (1984) Proteins. W.H. Freeman and Company (Eds).
Аминокислотные замещения, делеции и/или вставки могут быть легко осуществлены, применяя методики синтеза белков, хорошо известные в данной области техники, как например, твердофазный пептидный синтез и тому подобное, или путем манипуляций с рекомбинантной ДНК. Способы манипуляции с ДНК последовательностями для получения вариантов белков с замещением, вставкой или делецией, хорошо известны из уровня техники. Например, методики создания мутаций на основе замещения в определенных сайтах в ДНК хорошо известны специалистам в данной области техники и включают М13 мутагенез, Т7-ген in vitro мутагенез (USB, Cleveland, ОН), сайт-направленный мутагенез QuickChange (Stratagene, San Diego, CA), ПЦР-опосредованный сайт-направленный мутагенез или другие протоколы сайт-напрвленного мутагенеза.
Производные
"Производные" включают пептиды, олигопептиды, полипепиды, которые могут, по сравнению с аминокислотной последовательностью формы белка природного происхождения, как, например, рассматриваемого белка, содержать замещения аминокислот аминокислотными остатками неприродного происхождения или добавления аминокислотных остатков неприродного происхождения. "Производные" белка также охватывают пептиды, олигопептиды, полипептиды, которые содержат измененные аминокислотные остатки природного происхождения (гликозилированные, ацилированные, пренилированные, фосфорилированные, миристоилированные, сульфатированные и т.д.) или измененные аминокислотные остатки неприродного происхождения, измененные по сравнению с аминокислотной последовательностью формы полипептида природного происхождения. Производная может также содержать одно или более неаминокислотных замещений или добавлений, по сравнению с аминокислотной последовательностью, из которой она получена, например, репортерную молекулу или другой лиганд, ковалентно или нековалентно связанный с аминокислотной последовательностью, как например, репортерная молекула, которая присоединена для облегчения обнаружения, и аминокислотные остатки неприродного происхождения, по сравнению с аминокислотной последовательностью белка природного происхождения. Кроме того, "производные" также включают слияния формы белка природного происхождения с пептидами «метками», такими как FLAG, HIS6 или тиоредоксин (такие пептиды рассматриваются, например, в Terpe, Appl. Microbiol. Biotechnol. 60, 523-533, 2003).
Подробное описание изобретения
Настоящее изобретение относится к применению ферментного препарата, который катализирует разложение формальдегида, для уменьшения содержания формальдегида в композиции, содержащей формальдегид.
Ферменты, которые катализируют разложение формальдегида, известны в данной области техники. Например, в Bystrykh et al. (1993) J. Gen. Microbiol. 139, 1979-1985; Sakai, Y. et al (1995) FEMS Microbiol. Lett. 127, 229-234; или Ito et al. (1994) J. Bacterial. 176, 2483-2491 or Gonzalez et al., J. Biol. Chem., Vol.281, NO. 20, pp.14514-14522, May 19, 2006 раскрываются ферменты, такие как S-формилглутатионгидролаза, формальдегиддисмутаза, метилформиатсинтаза или глутатион-независимая формальдегиддегидрогеназа, которые могут применяться для разложения ФА.
Ферменты, принадлежащие семейству цинк-содержащих алкогольдегидрогеназ средней цепи, в частности, являются подходящими согласно настоящему изобретению (смотрите также Tanaka et al., J. Mol. Biol. (2002) 324, 519-533). В предпочтительном варианте выполнения настоящего изобретения пиридиновый нуклеотид NAD(H), который отличается от кофермента (в качестве ко-субстрата) характерными алкогольдегидрогеназами, тесно, но не ковалентно связан с ферментом и действует в качестве кофактора.
"Тесно связанный" означает, что кофактор связан с ферментом посредством взаимодействий, таких как ионные связи, внутримолекулярные силы, водородные связи, Ван-дер-ваальсовые силы, гидрофобные взаимодействия. Так как кофактор повторно используется в ходе реакции диспропорционирования (разложение ФА до метанола и окисление ФА до муравьиной кислоты одним и тем же ферментом), способ по настоящему изобретению обладает конкретными преимуществами, состоящими в минимизации затрат, так как кофактор не должен непрерывно подаваться в реакционную смесь для поддержания активности фермента.
Особенно подходящими для применения согласно настоящему изобретению являются оксидоредуктазы, которые действуют на альдегидную или оксо-группу доноров (ЕС 1.2). Предпочтительными являются оксидоредуктазы с акцепторами, отличными от NAD или NADP, цитрохромом, кислородом, дисульфидом, белком, содержащим железо и серу (ЕС 1.2.99). Предпочтительно ферментом является формальдегиддисмутаза (далее также упоминается как "ФДМ") из бактериального штамма, более предпочтительно ЕС 1.2.99.4. или ЕС 1.2.1.46 согласно классификации ферментов, которую получают из штамма Pseudomonas putida. Указанный фермент, кроме того, описывается в Kato, N., et al. (1983) Agric. Biol. Chem., 47(1), 39-46, Yanase, H., et al. (1995) Biosci. Biotechnol. Biochem., 59(2), 197-202 и Yanase, H., et al. (2002) Biosci. Biotechnol. Biochem., 66(1), 85-91.
В предпочтительном варианте выполнения изобретения ферментный препарат содержит фермент, который содержит аминокислотную последовательность SEQ ID NO:2 или ее вариант. В следующем предпочтительном варианте выполнения изобретения ферментный препарат содержит фермент, кодируемый нуклеиновой кислотой SEQ ID NO:1, или его варианты.
В предпочтительном варианте выполнения настоящего изобретения ферментный препарат содержит фермент, который содержит вариант или производную аминокислотной последовательности SEQ ID NO:2, как более подробно раскрывается далее, где фенилаланин в положении 93 и/или изолейцин в положении 301, и/или метионин в положении 337 и/или фенилаланин в положении 127 были замещены любой другой аминокислотой.
Для применения согласно настоящему изобретению ферментный препарат может применяться либо в очищенном виде с различной степенью чистоты, либо в виде неочищенного экстракта, например, в виде бактериального экстракта, то есть, экстракта из бактерий, которые естественными образом продуцируют желательный фермент, или бактерий, которые являются хозяевами для экспрессии. Альтернативно, также возможно применение растущих клеток, которые содержат нуклеиновые кислоты, кодирующие ФДМ, конструкции указанных нуклеиновых кислот или вектора, несущие указанные нуклеиновые кислоты, без включения какой-либо стадии очистки. Также возможно использовать покоящиеся клетки или разрушенные клетки. Термин «разрушенные клетки» означает, например, клетки, которые были сделаны проницаемыми посредством обработки, например, растворителями, или клетки, которые были разрушены посредством ферментативной обработки, посредством механической обработки (например, Френч-пресс или ультразвук) или другим способом. Неочищенные экстракты, полученные таким образом, предпочтительным образом подходят для применения согласно настоящему изобретению. Также возможно использовать очищенные или частично очищенные ферменты для способа согласно настоящему изобретению. Иммобилизованные микроорганизмы или ферменты, которые преимущественно могут применяться в реакции, подобным образом являются подходящими. Когда свободные организмы или ферменты применяются в способе согласно настоящему изобретению, они соответственно удаляются до экстракции, например, посредством фильтрации или центрифугирования.
В зависимости от композиции, содержащей ФА, с которой он вступает в контакт, ферментный препарат может применяться в свободной (растворимой или твердой) или иммобилизованной форме. Иммобилизованный фермент означает фермент, который фиксирован на инертном носителе. Подходящие в качестве носителей материалы и ферменты, иммобилизованные на них, раскрываются в ЕР-А-1149849, ЕР-А-1 069 183 и DE-A 100193773, и в цитируемых в настоящем документе ссылках. В данном случае ссылка делается на полное содержание данных документов. Примерами подходящих в качестве носителей материалов являются глины, глинистые материалы, такие как каолинит, диатомовая земля, перлит, диоксид кремния, оксид алюминия, карбонат натрия, карбонат кальция, порошок целлюлозы, анионообменные материалы, синтетические полимеры, такие как полистирол, акриловые смолы, фенолформальдегидные смолы, полиуретаны и полиолефины, такие как полиэтилен и полипропилен. Материалы-носители, как правило, применяются в форме тонко измельченных частиц для получения ферментов на носителях, где предпочтение отдается пористым формам. Конкретный размер материала носителя, как правило, составляет не более 5 мм, в частности не более 2 мм (размер ячеек сетки). Аналогично, при применении ФДМ в качестве катализатора из целой клетки, может быть выбрана свободная или иммобилизованная форма. Примерами материалов носителей являются альгинат кальция и каррагинан. Ферменты, так же как и клетки, могут быть связаны непосредственно с глютаральдегидом (сшивание с образованием CLEAs). Соответствующие и другие способы иммобилизации раскрываются, например, в J. Lalonde and A. Margolin "Immobilization of Enzymes" in K. Drauz and H. Waldmann, Enzyme Catalysis in Organic Synthesis 2002, Vol. III, 991-1032, Wiley-VCH, Weinheim.
Применяемое количество фермента зависит от степени чистоты ферментного препарата. Типичные количества для способа согласно настоящему изобретению находятся в интервале от 0.1 до 1000 единиц на грамм обрабатываемой композиции, содержащей ФА, предпочтительно от 1 до 500 единиц, более предпочтительно от 5 до 100 единиц, даже более предпочтительно от 8 до 30 единиц, более предпочтительно от 9 до 15 единиц на грамм обрабатываемой композиции, содержащей ФА. Одна единица (U) означает количество фермента, необходимое, чтобы катализировать образование 1 мкмоля муравьиной кислоты в минуту. Очищенная ФДМ обладает специфической активностью около 100-200 единиц/мг. Количества фермента представляют собой только приблизительные значения, которые могут варьироваться в зависимости от условий реакции, таких как температура и инкубационный период.
Оптимальное количество фермента может быть легко определено с помощью стандартных экспериментов.
Настоящее изобретение может применяться по отношению ко всем композициям, которые были обработаны формальдегидом. Наиболее большой группой композиций, содержащих формальдегид, является группа смол, содержащих мочевину, меламин, нафталин и фенол, и их производные, такие как DMDHEU. Настоящее изобретение также может применяться по отношению к добавкам, полученным методом распылительной сушки, и модификаторам реологических свойств, применяемым при производстве дисперсий, как например, поликонденсаты ФА с фенолсульфоновой кислотой или нафталин-сульфоновой кислотой. Другие композиции включают связующие вещества для формовочного песка, маты из минерального войлока и стекловолокна для изоляционных материалов, абразивную бумагу и тормозные накладки, или конденсаты мочевины и формальдегида, которые применяются при производстве вспененных смол. Другие композиции, содержащие формальдегид, включают пентаэритрит (применяемый, главным образом, в виде сырья для поверхностных покрытий и в предохранительных взрывчатых веществах) и гексаметилентетрамин, применяемый в качестве сшивающего агента для фенол-формальдегидных конденсатов и предохранительных взрывчатых веществах. В косметической промышленности формальдегид применяется в качестве консерванта в различных продуктах, таких как, например, мыла, дезодоранты, шампуни и отверждающиеся на ногтях составы. Растворы формальдегида, также известные в данной области техники, применяются в качестве консерванта для дубильного сока, дисперсий, средств для защиты урожая и консервирующих веществ для древесины. Кроме того, формальдегид находит применение в сахарной промышленности для предотвращения роста бактерий в ходе восстановления из сиропа.
Соответственно, в предпочтительном варианте выполнения настоящего изобретения композиция, содержащая формальдегид, с которой контактирует ферментный препарат, катализирующий разложение формальдегида, представляет собой смолу. Общее определение смолы, в частности синтетических смол, приводится выше.
Предпочтительно, настоящее изобретение может применяться по отношению к формальдегидным смолам, которые получают с помощью полиприсоединения и поликонденсации. Примеры включают фурановые смолы, кетоновые и альдегидные смолы, такие как ацетофенонформальдегидные смолы или ацеотнформальдегидные смолы, фенольные смолы, такие как новолачные и резольные, эпоксидные смолы, такие как жидкие эпоксидные смолы (DGEBA), твердые эпоксидные смолы на основе DGEBA, галогениорванные эпоксидные смолы, эпоксидные новолачные смолы, сульфонамидные смолы или анилиновые смолы.
Например, фенольные смолы, которые широко применяются для клееной фанеры, представляют собой конденсаты различных фенольных соединений и альдегидов. Фенольное соединение может представлять собой фенол сам по себе, многоатомные фенолы и алифатически или ароматически замещенные фенолы. Примерами фенольных соединений являются фенолы, такие как резорцин, алкилрезорцин, крезолы, этилфенол и ксиленол, а также фенольные соединения приордного происхождения, такие как таннины, карденол и кардол. Фенольные смолы на основе формальдегида в составе фенольной смолы включают резорцин-формальдегидные, фенол-резорцин-формальдегидные и таннин-формальдегидные смолы.
В особенно предпочтительном варианте выполнения настоящего изобретения формальдегидная смола представляет собой аминосмолу, такую как смола на основе мочевины, уретановая смола, меламиновая смола, цианамидная или дицианодиамидная смола.
Аминосмолы, в общем, применяются в качестве адгезивов; пропитывающих смол; формующих материалов; исходных материалов для создания поверхностных покрытий; вспомогательных добавок для бумаги, текстиля, кожи и флотации; упрочнителей для строительных материалов; суперпластификаторов; связующих веществ для стеклянных волокон и литья в формовочный песок; воспламенителей; наждачной бумаги; огнеустойчивых покрытий; жароустойчивых воспламеняемых предметов; вспененных смол для многих целей; шлифовальных кругов; ионообменных смол; коагулирующих агентов для сточных вод; и для микрокапсулярного производства.
Как применяется в настоящем документе термин "адгезив" означает клей для удержания материалов вместе, смолу для ламинирования и матричную смолу для удержания материалов вместе. Клеи и пропитывающие смолы представляют собой водные адгезивы, изготовленные из мочевины, меламина и/или фенола с формальдегидом. Клеи известны в данной области техники для производства панелей на основе дерева, таких как, например, древесно-стружечная плита, древесноволокнистая плита средней плотности МДФ, ориентированно-стружечная плита ОСП, фанера, картон для изготовления патронов или обшивка. Пропитывающие смолы применяются для пропитки бумаги, которая применяется для декоративного покрытия панелей на основе дерева, например, на поверхности мебели и ламинированного настила. Пропитывающие смолы применяются в качестве смоляных клеев при производстве древесностружечных плит, фанер, древесноволокнистых плит и мебели. Пропитывающие смолы также применяются для получения пропитанной бумаги для декоративных ламинатов и для покрытия древесностружечных плит.
Текстильные материалы в настоящее время, в общем, делают устойчивыми к сминанию или исключают необходимость глажения с помощью способа, известного как способ консервации на плюсовке с последующей сушкой, в общем, для сшивания молекул целлюлозы. Такое сшивание целлюлозы придает текстилю способность возвращать свою оригинальную форму и гладкость.
Некоторые классы смол DMDHEU, как описано выше, в значительной степени применялись ранее в качестве сшивающих агентов в таком способе.
Соответственно, в другом варианте выполнения настоящего изобретения, сшивающим агентом, с которым контактирует ферментный препарат, катализирующий разложение формальдегида, является сшивающий агент, подходящий для окончательной обработки текстильных тканей.
Сшивающие агенты, применяемые в текстиль-обрабатывающей промышленности, уже были широко описаны в уровне техники (Смотрите, например, Ullmann IVth Edition Vol 23). Сшивающие агенты, которые хорошо известны специалистам в данной области техники, включают "самосшивающиеся" (имеющие реакционноспособный атом водорода при атоме азота) и "взаимодействующие сшивающие" агенты (азот является частью гетероциклического кольца).
Мультифункциональные метилольные производные мочевины, замещенные мочевины или меламин, полученные путем реакции формальдегида с этими соединениями, представляют собой предпочтительные сшивающие агенты для обработки, обеспечивающей легкость ухода. Важную группу составляют гидроксиметильные соединения циклических производных мочевины; примерами являются дигидроксиметилэтиленмочевина, дигидроксиметилпропиленмочевина и дигидроксиметилурон. Ациклические соединения, такие как различные алкильные карбаматы, также представляют собой типичные агенты для обработки. В противоположность чистым мочевиноформальдегидным соединениям они проявляют небольшую тенденцию к образованию самосшивающихся смол и реакции преимущественно с целлюлозой, с сшиванием волокон.
Метилольные производные мочевины, сами по себе, применяются, в частности, в вискозе. Примерами являются диметилолмочевина, N,N"-бис(гидроксиметил)мочевина, простой диметиловый эфир триметилолмеламина, уроны, то есть тетрагидро-3,5-бис(гидроксиметил)-4H-1,3,5-оксадиазин-4-он, циклические продукты мочевины, метилольные производные карбаматов, особенно метилкарбамат и метоксиэтилкарбамат.
Предпочтительно метилольные производные дигидроксиэтиленмочевины, полученные путем реакции глиоксаля с мочевиной, применяются в качестве сшивающих агентов при облегчающей уход обработке, например, диметилолдигидроксиэтиленмочевины (DMDHEU), описанные, например, в WO98/029393, 1,3-диметоксиметил DHEU и полностью метилированный продукт. Все различные модификации продуктов типа глиоксаль-мочевина находят коммерческое применение. Продукты, которые были метилированы, а также содержат гидроксисоединение, обеспечивают наименьший потенциал выделения формальдегида для всех коммерчески доступных обрабатывающих средств метилольного типа, облегчающих уход. Многообразие сшивающих агентов раскрывается в Ullmann IV.th Edition Vol 23 Chap 7.
Так как описанные сшивающие агенты предпочтительно применяются для сшивания молекул целлюлозы, текстильные ткани, предпочтительно обрабатываемые, содержат целлюлозу или целлюлозные волокна.
Настоящее изобретение подходит для обработки волокнистых целлюлозных материалов, содержащих по меньшей мере 10%, предпочтительно по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, наиболее предпочтительно до 100% целлюлозных волокон. Примеры включают джут, льняную пряжу, лен, коноплю, вискозу, регенерированную целлюлозу, такую как искусственный шелк и предпочтительно хлопок. Целлюлозный материал может быть тканным, нетканым, вязанным или в форме волокон, линтера, пучков, лент, холстов или бумаги. Волокнистый целлюлозный материал может полностью состоять из хлопка или хлопка, смешанного с синтетическим волокном, таким как сложный полиэфир или нейлон.
Как описано выше, смолы, в частности меламиновые смолы или любой другой амино-s-триазин, как например, гуанамины, широко применяются в качестве строительных материалов или суперпластификаторов (также известны в качестве конкретных ожижителей). Для этих целей указанные смолы, как правило, модифицируют путем реакции с другими соединениями. Особенно полезными являются продукты конденсации на основе меламина, формальдегида и сульфита (смотрите, например, ЕР 0 336 165).
Эти полимеры могут быть получены обычным образом в виде дисперсий путем эмульсионной полимеризации, инициированной с помощью полимерных диспергирующих агентов, как определено в части «определения», в присутствии радикальных инициирующих агентов, эмульгаторов и/или защитных коллоидов, а также регуляторов и других добавок.
Соответственно, в следующем предпочтительном варианте выполнения настоящего изобретения, смолой является полимерный диспергирующий агент, содержащий формальдегид, или конденсат формальдегида, который применяется для получения полимерных дисперсий.
Термин "полимерная дисперсия" относится к сырью для сектора строительных химических реагентов. Продукты включают акриловые дисперсии, а также акриловые порошки и стирол/бутадиеновые дисперсии. Они увеличивают работоспособность и технические показатели строительных химических реагентов, строительных адгезивов и материалов для уплотнения. Высококачественные полимерные дисперсии и добавки применяются в качестве сырья для архитектурных покрытий, в комбинации с другими компонентами для получения готовых к применению продуктов, таких как краски, протравы для древесины или обрабатывающие агенты для придания текстуры. В частности, термин относится к дисперсиям, содержащим метакриловую кислоту (MAS), метилолметакриламид (MAMol) и/или метилолакриламид (AMol), гомо- и сополимеры акриламида, акриловой кислоты, акрилонитрила, сложные эфиры акриловой кислоты и стирол, также применяемые в качестве связующих веществ при пигментом печати на ткани и/или при покрытии ткани. Следующие примеры и предпочтительные варианты таких полимерных дисперсий раскрываются далее.
Термин "пигментная печать" относится к процессам нанесения цветного рисунка на пластинчатый текстильный материал, которые, в общем, известны в данной области техники, и которые практиковались в течение долгого периода времени во всем мире. При пигментной печати конкретные пигменты, как правило, наносятся на текстильное полотно с помощью водных паст для трафаретной печати вместе со системой связующего и затем сушатся. Последующая сушка с помощью тепловой обработки для отверждения системы связующего, предпочтительно на основе синтетической смолы, с последующей фиксаций нанесенного красителя завершает процесс печати.
Кроме того, для применения в качестве строительных материалов, продукты конденсации, такие как меламиновые смолы, модифицированные сульфитом, нафталинсульфонаты, комбинируют с водорастворимыми полимерами на виниловой или акриловой основе. Примерами соответствующих полимеров являются продукты винилацетата, винилпропионата, виниллаурата, винилхлорида, винилиденхлорида, неразветвленные или разветвленные сложные виниловые эфиры, содержащие от 3 до 18 атомов углерода, поли(виниловый спирт), поли(винилсульфаты), акриловые и метакриловые мономеры, в частности сложные эфиры, а также стирол и этан, сополимеры малеиновой кислоты и стирола, которые могут присутствовать в форме их гомо-, со-, терполимеров и в качестве графт-полимеров.
Предпочтительными областями применения таких полимерных дисперсий являются краски, декоративные и защитные покрытия и лаки, строительные химические реагенты, такие как добавки в цементные растворы и наполняющие соединения, вспомогательные материалы для производства бумаги и бумажных покрытий, текстильное покрытие и красители для пластмасс.
Кроме того, авторы настоящего изобретения установили различные способы применения ферментного препарата, который катализирует разложение ФА, в зависимости от применения.
Соответственно, другой объект настоящего изобретения относится к способу уменьшения содержания формальдегида в композиции, содержащей формальдегид, включающему контакт композиции с ферментным препаратом, который катализирует разложение формальдегида.
"Контакт" может происходить до или в ходе предполагаемого применения композиции. Контакт может означать добавление и/или смешивание, если композиция, содержащая ФА, является жидкой, или нанесение на поверхность, если композиция представляет собой скорее вязкий или твердый материал.
В одном примере ферментный препарат может добавляться непосредственно к мочевиноформальдегидной смоле, применяемой при производстве древесностружечной плиты, или разбавляться водой и распыляться на поверхность плиты перед прессованием. Наносимый или добавляемый фермент зависит от природы смолы, добавляемой в древесностружечную плиту, и условий отверждения. Однако надлежащее количество в любом конкретном случае может быть определено путем тестирования различных количеств фермента и оценки количества формальдегида, выделяемого плитой.
Авторы изобретения также обнаружили, что содержание формальдегида может быть уменьшено в текстильных материалах, когда ферментный препарат, который катализирует разложение формальдегида, наносится непосредственно на текстиль сам по себе.
Соответственно, другой объект настоящего изобретения относится к способу уменьшения содержания формальдегида в текстиле, включающему контакт текстильного материала с ферментным препаратом, который катализирует разложение формальдегида.
Предпочтительно, текстильные материалы представляют собой "сшитые материалы", которым придали свойства несминаемости и устойчивости к образованию складок, как во влажных, так и в сухих условиях, путем нагревания, сушки и отверждения с обрабатывающим агентом, таким как глиоксалевая смола, формалин, мочевиноформальдегидная смола, диметилолмочевина, простой диметиловый эфир мочевиноформальдегида, меламиноформальдегидные смолы, циклические этиленмочевиноформальдегидные смолы, например, диметилолмочевина, триазин-формальдегидные смолы, триазон-формальдегидные смолы и тому подобное, как описано выше.
Кратко, текстильные материалы, обработанные сшивающим агентом, как определено выше, пропитываются ферментным препаратом, как определено в части, где описываются примеры. Обнаружение остаточного ФА после инкубации с ферментным препаратом может осуществляться для влажного или высушенного текстильного материала.
Композиции, содержащие формальдегид, согласно настоящему изобретению показывают концентрацию формальдегида от около 1 до 50.000 частей на миллион. Как правило, количества составляют от 10 до 5.000 частей на миллион. Способ по настоящему изобретению обеспечивает значительное уменьшение содержания формальдегида.
Соответствующим образом, содержание формальдегида уменьшается на 10, 20, 30, 40, 50, 60-70%, например, предпочтительно 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%-79%, в общем, по меньшей мере 80%, например, 81%-84%, по меньшей мере 85%, например, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%-98% и 99%, и 100%, по сравнению с композициями и продуктами, с которыми не контактировал ферментный препарат.
Способы определения уменьшенного содержания ФА хорошо известны в данной области техники. Формальдегид может быть количественно определен либо физическими, либо химическими методами. Количественное определение чистых водных растворов формальдегида может быстро осуществляться путем измерения их удельной массы. Газовая хроматография и высокоэффективная жидкостная хроматография (ВЭЖХ) может также применяться для прямого определения. Наиболее важные химические способы определения формальдегида собраны в Н. Petersen, N. Petri, Melliand Textilber. 66 (1985) 217-222, 285-295, 363-369. Способ на основе сульфита натрия является наиболее общеиспользуемым. Он основан на количественном высвобождении основания, образующегося когда формальдегид реагирует с избытком сульфита натрия. Стехиометрически образованное основание определяется путем титрования кислотой. Формальдегид в воздухе может быть определен при концентрациях до диапазона мкл/м3, с помощью газового пробоотборника. Количественное определение формальдегида в воздухе с помощью способа на основе сульфита/парарозанилина описывается в Verein Deutscher Ingenieure (VDI): 1, Messen gasformiger Immissionen, Bestimmen der Formaldehydkonzentration nach dem Sulfit-Pararosanilin-Verfahren, Richtlinie VDI 3484, Blatt 1, Dusseldorf 1979.
Существует ряд других способов испытания, которые применяются для анализа высвобождения формальдегида из текстиля, как например Japanese Law112 (то есть, способ на основе ацетилацетоне), ААТСС-112 (то есть, способ на основе хромотроповой кислоты), Shirley I и II способы и другие. Предпочтительными способы определения ФА в текстиле являются LAW112 и ААТСС112 способы, применяемые согласно "Европейскому комитету по стандартизации", EN ISO 14184 часть 1 и часть 2. С помощью способа по настоящему изобретению можно уменьшить остаточное содержание формальдегида до менее 250, предпочтительно менее 100, более предпочтительно менее 50, далее более предпочтительно менее 20, и наиболее предпочтительно до менее 10 частей на миллион.
Температурный интервал, необходимый для осуществления способа по изобретению, может варьироваться в интервале от 10°С до 100°С, предпочтительно от 20°С до 40°С, более предпочтительно от 25°С до 35°С, наиболее предпочтительно при 30°С. Способ по настоящему изобретению, как правило, осуществляется при значениях рН, варьирующихся между 3 и 12, предпочтительно между 5 и 9, более предпочтительно между 7 и 8. Оптимальное значение рН может быть определено и установлено посредством способов, известных специалисту в данной области техники.
Инкубационный период может варьироваться в зависимости от выбранного количества фермента, температуры реакции и содержания формальдегида в композиции, а также в зависимости от природы композиции самой по себе. Как правило, инкубационный период находится в диапазоне от минут до часов, предпочтительно от 5 минут до 10 часов, более предпочтительно от 20 минут до 5 часов, более предпочтительно от 30 минут до 2 часов. Оптимальный инкубационный период может легко быть определен и установлен специалистом в данной области техники в зависимости от продукта, который подлежит обработке.
Способ по настоящему изобретению может осуществляться периодически, полунепрерывно или непрерывно в обычных биореакторах. Подходящие режимы и биореакторы известны специалистам в данной области техники и описываются, например, в Rompp Chemie Lexikon 9th edition, Thieme Verlag, entry header "Bioreactors" или Ullmann's Encyclopedia of Industrial Chemistry, 5th edition, volume B4, page 381 ff, которые включены в настоящий документ посредством ссылки. Работа реактора и режим процесса могут быть установлены специалистом в данной области техники в соответствии с конкретными требованиями желательной реакции разложения ФА. Если способ осуществляется периодически, ферментный препарат добавляется непосредственно после синтеза, полимеризации, выделения и при необходимости очистки композиции. После успешного разложения формальдегида, применяя ФА дисмутазу, фермент может быть отделен от композиции. Альтернативно, фермент может быть оставлен в композиции и инактивирован, например, путем нагрева или подкисления, если желательно, и обеспеченная таким образом инактивация не является вредной для композиции. Если процесс осуществляется непрерывно, ферментный препарат предпочтительно иммобилизован на носителе, который может быть упакован, например, в специфическую колонку. Как правило, композиция прокачивается через колонку при подходящих условиях. Для дальнейшего усиления эффекта уменьшения ФА возможно последовательно соединить несколько ферментных реакторов, один после другого.
В целях настоящего изобретения ферментный препарат может добавляться в любой форме, составе и композиции, известных специалисту в данной области техники. Специалисты в данной области техники оценят тот факт, что ферментный препарат, подходящий согласно настоящему изобретению, будет зависеть от нескольких факторов, включая, без ограничения к этому, точный состав композиции, содержащей формальдегид. Кроме того, специалисты в данной области техники оценят тот факт, что существует несколько способов составления ферментных препаратов. Ферментный препарат может быть составлен, применяя стандартные подходы получения ферментных гранулированных и/или жидких композиций. Описание стадий, связанных с получением ферментной гранулированной и/или жидкой композиции, приводится в "Industrial Enzymes and their Application", by Helmut Uhlig, John Wiley and Sons, 1998.
Подходящие ферментные препарата представляют собой, например, твердые ферментные препараты, полученные путем гранулирования, экструзии, распылительной сушки или лиофилизации ферментных растворов, а также предпочтительно концентрированных растворов фермента, при необходимости содержащих стабилизаторы. Альтернативно, ферментный препарат в твердой или жидкой форме может быть адсорбирован на твердом носителе и/или может быть инкапсулирован. Способы, которые были предложены для получения иммобилизованных ферментов, включают субстрат-связывающий способ, способ сшивающей полимеризации, способ включения в гель и т.п.
В некоторых вариантах выполнения настоящего изобретения, когда ферментный препарат, применяемый согласно настоящему изобретению, применяется в виде гранулированной композиции или в жидкой форме, желательно, чтобы ферментный препарат находился в форме инкапсулированной частицы для защиты такого фермента от других компонентов гранулированной композиции в ходе хранения. Кроме того, инкапсуляция также представляет собой средство контроля доступности ферментного препарата в ходе процесса разложения ФА и может усиливать эффективность ферментного препарата. Полагают, что любой подходящий инкапсулирующий материал найдет применение в настоящем изобретении. Инкапсулирующий материал, как правило, инкапсулирует по меньшей мере часть ферментного препарата. Как правило, инкапсулирующий материал является растворимым в воде и/или диспергируемым в воде. Кратко, ферментный препарат смешивается с соединениями, такими как альгинат натрия, агароза и сефадекс, и затем осаждается согласно способам, известным в данной области техники. Альтернативно, инкапсуляция может осуществляться путем распылительной сушки или экструзии ферментного препарата.
Примеры защитных покрывающих материалов для указанных ферментных гранул включают природные материалы, такие как сахариды, полисахариды, полипептиды, такие как коллаген, альбумин или желатин, масла, жирные кислоты, воска. Покрывающими материалами также являются полусинтетические материалы, такие как химически модифицированные целлюлозные соединения, производные крахмала или синтетические покрывающие материалы, такие как полиакрилаты, полиамиды. Покрытия могут, кроме того, содержать полиэлектролитические комплексы, которые образуются путем взаимодействия поликатионов и полианионов. Как правило, поликатионы включают природные соединения, такие как цитозан, а также синтетические полимеры.
Ферментный препарат может быть гранулирован вместе с химически инертным материалом-носителем или связывающим материалом. Материалы-носители включают силикаты, карбонаты или сульфаты. Связывающие материалы представляют собой, например, несшитые полимерные композиции, такие как полиакрилат, полиметакрилат, поливинилпирролидон, полисахариды.
Альтернативно, для защиты ферментного препарата от инактивации или денатурации, может быть подходящим добавление стабилизирующих соединений. Примеры стабилизирующие включают ингибиторы протеазы, такие как, бороновая кислота, а также ее производные, аминоспирты и низшие алифатические спирты. Ферментные препараты могут быть защищены от физического влияния или изменений рН с помощью соединений, таких как полиамидные олигомеры, или полимерных композиций, таких как лигнин, растворимые в воде виниловые сополимеры. Кроме того, антиокисляющие агенты, такие как дитиотреитол (DTT), представляют собой стандартно применяемые ферментные стабилизаторы.
Если ферментный препарат, который катализирует разложение формальдегида, должен быть непосредственно включен в композицию, содержащую ФА, в некоторых вариантах выполнения настоящего изобретения требуется, чтобы фермент присутствовал в высушенной форме. Если ферментный препарат, который катализирует разложение формальдегида, добавляется только в ходе применения композиции, содержащей ФА, ферментный препарат может находиться в жидкой, гелеобразной или подобной пасте форме. После очищения и выделения белка способами, хорошо известными специалистам в данной области техники, ферментный препарат может быть добавлен в виде концентрированного водного раствора, суспензии или эмульсии. Примеры растворителей, которые могут применяться для получения подходящих ферментных препаратов, включают спирты, алканоламины или гликоль или простые гликолевые эфиры, глицерин, сорбит, глюкозу, сахарин. В целях повышения вязкости, ферментный препарат может содержать один или более сгустителей, также известных как вещества, способствующие набуханию. Подходящие сгустители включают, например, альгинаты, пектины, крахмал, декстрин или такие синтетические сгустители, как например, поликарбоновые кислоты, полиэтиленгликоль, полиакриловые композиции, полиамиды или простые полиэфиры.
Для некоторых композиций желательно, чтобы ферментный препарат уже содержался в композиции, сохраняя содержание ФА в этих композициях таким низким, как это возможно.
В предпочтительном варианте выполнения настоящего изобретения ферментный препарат по настоящему изобретению содержит (а) 0.1-10% фермента, расщепляющего формальдегид, предпочтительно ФДМ, и (b) 1-80% одного или нескольких полиолов (гликоля, глицерина, сорбита, глюкозы, сахарозы, полиэтиленгликля и т.д.), и (с) 1-99% воды.
В другом варианте выполнения настоящего изобретения сухой (твердый) ферментный препарат добавляется в композицию твердого продукта. ФА снижающая активность запускается при добавлении воды к твердому препарату.
Таким образом, другой объект настоящего изобретения относится к композиции, подходящей для обработки текстиля, где композиция содержит сшивающий агент и ферментный препарат, который катализирует разложение формальдегида.
Ферментный препарат может применяться способом, аналогичным способам применения известных агентов, уменьшающих содержание формальдегида. Например, ферментный препарат может быть включен в сшивающий агент для обработки в целях придания сопротивления сминаемости, содержащий N-метилол сшивающую систему, такую как DMDHEU. Материал, состоящий либо полностью, либо частично из целлюлозных волокон, может быть обит, обработан пеной или иным образом пропитан композицией для обработки в целях придания сопротивления сминаемости.
Предпочтительно, сшивающий агент выбирается из группы, состоящей из соединений меламин-ФА, мочевины-ФА или мочевина-глиоксаль-ФА.
Другой объект настоящего изобретения относится к композиции, подходящей для обработки строительных материалов, в частности гидравлических связующих, таких как цемент, гипс, известковый раствор или тощая известь, древесноволокнистая плита, древесностружечная плита, фанера, дерево, кожа и/или ковровый настил, где композиция содержит полимерный диспергирующий агент, как описано выше, и ферментный препарат, который катализирует разложение формальдегида.
В предпочтительном варианте выполнения настоящего изобретения полимерный диспергирующий агент выбирается из группы, состоящей из конденсатов формальдегида и нафталина, конденсатов фенола и формальдегида, конденсатов мочевины и формальдегида, и конденсатов меламина и формальдегида.
Сшивающий агент или полимерный диспергирующий агент могут быть предварительно смешаны с ферментным препаратом или могут находиться в виде набора, где ферментный препарат добавляется к сшивающему агенту или полимерной дисперсии перед его предполагаемыми применениями, как описано выше, для уменьшения содержания ФА в конечном продукте. В некоторых случаях инкубационный период должен быть оптимизирован, чтобы избежать чрезмерного разложения конечного продукта.
В целях настоящего изобретения желательно иметь фермент, который является легко доступным в больших количествах. Соответствующим образом, фермент экспрессируется в бактерии, которая позволяет крупномасштабное получение гетерологически экспрессируемых белков. Для того чтобы оптимизировать экспрессию, то есть повысить выход экспрессируемого фермента, авторы настоящего изобретения сконструировали нуклеиновую кислоту, кодирующую фермент, который катализирует разложение формальдегида.
Соответственно, другой объект настоящего изобретения относится к выделенной нуклеиновой кислоте, кодирующей фермент, который катализирует разложение формальдегида, где последовательность нуклеиновой кислоты является кодон-оптимизированной для экспрессии в экспрессионном хозяине.
Предпочтительным экспрессионным хозяином является Escherichia coli.
Хотя Escherichia coli является одним примером бактериальной клетки-хозяина, в общем применяемой для экспрессии фермента, который катализирует разложение формальдегида, другие бактериальные клетки-хозяева также могут применяться согласно настоящему изобретению для экспрессии чужеродной ДНК, включая например, Escherichia, Enterobacter, Azotobacter, Erwinia, Bacillus, Pseudomonas, Bordetella, Rhodobacter, Xyella, Klebsielia, Proteus, Salmonella, Serratia, Shigella, Rhizobium, Vitreoscilla и Paracoccus, a также грибковые клетки-хозяева, включая, например, Aspergillus, Pichia, Trichoderma, Hansenula, Saccharomyces, Kluyveromyces, Schizosaccharomyces, Chrysosporium, Candida и Torulopsis.
Характеристики и преимущества кодон-оптимизации для экспрессии в Е.coli хорошо описаны в Burgess-Brown et al., Protein Expr Purif., 2008 May; 59(1):94-102.
В предпочтительном варианте выполнения настоящего изобретения последовательность нуклеиновой кислоты содержит последовательность SEQ ID NO:3 или ее вариант.
Другой объект настоящего изобретения относится к экспрессионному вектору, содержащему нуклеиновую кислоту по настоящему изобретению.
Подходящие вектора включают фаговые, плазмидные, вирусные и ретровирусные вектора, а также искусственные хромосомы, как например, бактериальные и дрожжевые искусственные хромосомы. Более того, термин также относится к нацеливающим конструкциям, которые позволяют случайное или сайт-направленное включение целевой конструкции в геномную ДНК. Такие целевые конструкции предпочтительно содержат ДНК достаточной длины для либо гомологичной, либо гетерологичной рекомбинации, как подробно описано ниже. Вектор, включающий полинуклеотиды по настоящему изобретению, предпочтительно, кроме того, содержит селективные маркеры для воспроизведения и/или селекции в хозяине. Вектор может быть включен в клетку-хозяина различными методами, хорошо известными специалистам в данной области техники. В случае введения в клетку-хозяина вектор может находиться в цитоплазме или может быть включен в геном. В последнем случае должно быть понятно, что вектор может, кроме того, содержать последовательности нуклеиновой кислоты, которые обеспечивают гомологичную рекомбинацию или гетерологичную вставку. Векторы могут быть введены в прокариотические или эукариотические клетки с помощью обычных методик трансформации или трансфекции. Термины "трансформация" и "трансфекция", конъюгация и трансдукция, применяемые в данном контексте, как подразумевается, содержат многообразие известных из уровня техники способов введения чужеродной нуклеиновой кислоты (например, ДНК) в клетку-хозяина, включая совместное осаждение фосфата кальция, хлорида рубидия или хлорида кальция, DEAE-декстран-опосредованную трансфекцию, липофекцию, природную компентенцию, кластеры на основе углерода, химически-опосредованный перенос, электропорацию или бомбардировку частицами (например, "генное ружье").
В предпочтительном варианте выполнения настоящего изобретения вектором, подходящим согласно настоящему изобретению, является нуклеиновая кислота, содержащая последовательность SEQ ID NO:4, 5 и/или 6.
Другой объект настоящего изобретения относится к применению ферментного препарата, который катализирует разложение ацетальдегида (АА) для уменьшения содержания ацетальдегида в композиции, содержащей ацетальдегид.
Как описывается в части, раскрывающей определения, АА присутствует в многообразии жидкостей и соединений, и является вредным для человека. Кроме того, ацетальдегид, как известно, является остаточным соединением в поливиниловом спирте. Поливиниловые спирты представляют собой полимеры винилового спирта. Так как последний не может существовать в свободной форме, все поливиниловые спирты до настоящего времени производились путем полимеризации винилацетата, который является стабильным в отличие от винилового спирта. Полученный поливинилацетат затем подвергается алкоголизу. Так как технические свойства поливинилового спирта зависят прежде всего от молярной массы и остаточного содержания ацетильных групп, промышленные производственные процессы, как подразумевается, обеспечивают точное соответствие этим параметрам.
В особенно предпочтительном варианте выполнения настоящего изобретения ферментный препарат содержит фермент, имеющий альдегиддисмутазную активность, который содержит вариант или производную аминокислотной последовательности SEQ ID NO:2, как более подробно описано ниже, где фенилаланин в положении 93 и/или изолейцин в положении 301, и/или метионин в положении 337 и/или фенилаланин в положении 127 замещен любой другой аминокислотой.
Как далее проиллюстрировано на приведенных чертежах, анализ кристаллической структуры фермента формальдгиддисмутазы Pseudomonas putida (SEQ ID NO:2) позволил идентифицировать отдельные аминокислотные остатки или части аминокислотных последовательностей, участвующие в образовании центра реакционной способности фермента, так что модельная система или контрольный фермент для других подходящих ферментов с альдегиддисмутазной активностью, в частности формальдегиддисмутазной или ацетальдегиддисмутазной активностью, могут быть установлены.
В частности, для указанного специфического контрольного фермента могут быть определены определенные ключевые аминокислотные остатки, которые, как предсказано, должны участвовать в образовании функционально различных частей субстратного кармана. Указанные функционально различные части обозначаются как каталитический сайт 1 (CS1), каталитический сайт 2 (CS2), каталитический сайт 3 (CS3), каталитический сайт 4 (CS4).
Первой функциональной частью является CS1, и ключевым аминокислотным остатком является Ile301.
Более того, было обнаружено, что части последовательности, которые не являются соседними в первичной аминокислотной последовательности, тем не менее, являются функционально связанными, посредством содействия одной и той же функциональной части кармана связывания. Таким образом, обнаружили, что функциональная часть CS2 содержит ключевой аминокислотный остаток Met337.
Также обнаружено, что указанный контрольный фермент образует области кармана связывания CS3 и CS4, аминокислотные остатки, связанные с ними, могут далее подразделяться на группы в соответствии с их предпочтительной ориентацией в отношении субстрата, присоединенного к ферменту. CS3 и CS4 содержат ключевые аминокислотные остатки Phe127 и Phe93.
Авторы настоящего изобретения неожиданно обнаружили, что путем замещения одного или более ключевых аминокислотных остатков активность фермента может быть увеличена на по меньшей мере 5%, предпочтительно на по меньшей мере 7%, более предпочтительно на по меньшей мере 10%, более предпочтительно на 10-20% по сравнению с активностью фермента Pseudomonas putida дикого типа с последовательностью SEQ ID NO:2. Кроме того, путем замещения одного или более ключевых аминокислотных остатков может быть повышена термосабильность фермента, приводя к стабильности при температуре, которая на по меньшей мере 1, 2, 3, 4, 5 градусов Цельсия выше температуры, при которой фермент Pseudomonas putida дикого типа с последовательностью SEQ ID NO:2 является стабильным. Благодаря этому фермент согласно настоящему изобретению обладает преимуществами в отношении условий очистки и экспрессии.
Соответственно, другой объект настоящего изобретения относится к выделенному полипептиду, имеющему альдегиддисмутазную активность и содержащему вариант SEQ ID NO:2, где фенилаланин в положении 93 последовательности SEQ ID NO:22 и/или изолейцин в положении 301 последовательности SEQ ID NO:2, и/или метионин в положении 337 последовательности SEQ ID NO:2, и/или фенилаланин в положении 127 последовательности SEQ ID NO:2 замещается любой ругой аминокислотой.
Специалистам в данной области техники понятно, что аминокислоты, локализованные в непосредственной близости к положениям аминокислот, упомянутым выше, могу также быть замещены. Таким образом, другой вариант выполнения настоящего изобретения относится к выделенному полипептиду, имеющему альдегиддисмутазную активность и содержащему вариант SEQ ID NO:2, где аминокислота ±3, ±2 или ±1 аминокислотных положений из фенилаланина в положении 93 последовательности SEQ ID NO:2, и/или аминокислота ±3, ±2 или ±1 аминокислотных положений из изолейцина в положении 301 последовательности SEQ ID NO:2, и/или аминокислота ±3, ±2 или ±1 аминокислотных положений из метионина в положении 337 последовательности SEQ ID NO:2, и/или аминокислота ±3, ±2 или ±1 аминокислотных положений из фенилаланина в положении 127 последовательности SEQ ID NO:2 замещаются любой другой аминокислотой.
На основе этого анализа может быть разработана весьма характерная модель последовательности, посредством которой могут быть найдены другие кандидаты белков с желательной ферментативной активностью.
Поиск других кандидатов в ферменты, применяя указанную модель последовательности, также входит в объем настоящего изобретения Специалистам в данной области техники будет понятно, что вышеуказанная модель последовательности не ограничена точным расстоянием между двумя соседними аминокислотными остатками указанной модели. Каждое из расстояний между двумя соседями в вышеуказанной модели может, например, варьироваться независимо друг от друга на до ±10, ±5, ±3, ±2 или ±1 аминокислотных положений, без существенного воздействия на желательную ферментативную активность.
В соответствии с указанным выше функциональным и пространственным анализом отдельных аминокислотных остатков, на основе кристаллографических данных, полученных согласно настоящему изобретению, уникальные характеристики частичных аминокислотных последовательностей потенциально полезных ферментов с альдегиддисмутазной активностью по настоящему изобретению могут быть идентифицированы.
Согласно следующему предпочтительному варианту выполнения настоящего изобретения реакция дисмутации осуществляется с выделенной или очищенной, при необходимости иммобилизованной альдегиддисмутазой, или путем культивирования микроорганизма, экспрессирующего фермент с альдегиддисмутазной активностью, как более подробно описано выше
Примеры мутантов, потенциально имеющих только незначительное влияние на ферментативную активность, представляют собой те, которые незначительно или вообще не влияют на геометрию или мобильность субстратного кармана вышеописанных структурных элементов (CS1, 2, 3 или 4).
Примеры мутантов, потенциально имеющих более выраженное влияние на ферментативную активность, могут представлять собой те, которые более сильно влияют на геометрию или мобильность субстратного кармана или вышеуказанных структурных элементов (CS1, 2, 3 или 4).
В отношении белка Pseudomonas putida последовательности SEQ ID NO:2 неограничивающие примеры ключевого аминокислотного замещения, которое может способствовать по меньшей мере одному из указанных видов мутаций, перечислены ниже.
|
Специалистам в данной области техники должно быть понятно, что любая аминокислота помимо упомянутых в таблице выше, может применяться в качестве заместителя. Анализа для тестирования функциональных возможностей таких мутантов хорошо известна из уровня техники, и соответственно, описывается в части примеров, приведенной в описании настоящего изобретения.
Настоящее изобретение также относится к нуклеиновой кислоте, как определено далее, кодирующей белок, имеющий альдегиддисмутазную активность, как определено выше.
Настоящее изобретение также относится к экспрессионной кассете, содержащей нуклеиновую кислоту, как определено выше, операбельно связанную с по меньшей мере одной регуляторной последовательностью нуклеиновой кислоты.
Настоящее изобретение также относится к экспрессионному вектору, содержащему по меньшей мере одну экспрессионную кассету или нуклеиновую кислоту, как определено выше.
Настоящее изобретение также относится к рекомбинантному микроорганизму, несущему по меньшей мере один экспрессионный вектор, как определено выше.
Настоящее изобретение также относится к биореактору, содержащему по меньшей мере один белок, имеющий альдегиддисмутазную активность, как определено выше, или рекомбинантный микроорганизм, как определено выше, при необходимости в иммобилизованной форме.
Настоящее изобретение также относится к способу получения фермента с альдегиддисмутазной активностью, где способ содержит культивирование рекомбинантного микроорганизма, как определено выше, и при необходимости выделение указанной альдегиддисмутазы из культуры.
Настоящее изобретение также относится к кристаллической форме белка, имеющего альдегиддисмутазную активность, в частности те формы, в которых белок, имеющий альдегиддисмутазную активность, является таким, как определено выше.
Настоящее изобретение также относится к способу получения кристаллической формы белка, имеющего альдегиддисмутазную активность, как определено выше, где способ содержит добавление к раствору, содержащему указанный белок (при концентрации от около 1 до 50 или от 5 до 20 мг/мл), агента кристаллизации (3 М - 3,5 М сульфат аммония, предпочтительно 3,2 М сульфат аммония или полиалкиленгликоль, такой как полиэтиленгликоль, в частности ПЭГ 400-3500, такой как ПЭГ 400), имеющего рН в интервале от 8,3 до 8,7, например 8,5, предпочтительно буферизованного Tris буфером.
Другие варианты выполнения настоящего изобретения
Белки согласно настоящему изобретению
Настоящее изобретение не ограничено специфически раскрытыми "белками с альдегиддисмутазной активностью", но также охватывает их функциональные эквиваленты.
"Функциональные эквиваленты" или аналоги конкретно раскрытых ферментов в рамках настоящего изобретения представляют собой их различные полипептиды, которые, кроме того, обладают желательной биологической функцией или активностью, например, ферментативной активностью.
Например, "функциональные эквиваленты" означают ферменты, которые в тесте на ферментативную активность показали активность на по меньшей мере 1-10%, или по меньшей мере 20%, или по меньшей мере 50%, или по меньшей мере 75%, или по меньшей мере 90% выше или ниже активности фермента, определенного в настоящем документе.
"Функциональные эквиваленты", согласно настоящему изобретению, также в частности означают мутанты, которые в по меньшей мере одном положении последовательности указанных выше аминокислотных последовательностей имеют аминокислоту, которая отличается от конкретно установленной, но тем не менее обладают одной из вышеупомянутых биологических активностей. "Функциональные эквиваленты", таким образом, содержат мутанты, полученные путем добавления, замещения, делеции и/или инверсии одной или более аминокислот, где указанные изменения могут происходить в любом положении последовательности, при условии, что они приводят к мутанту с профилем свойств в соответствии с настоящим изобретением. Функциональная эквивалентность также в частности обеспечивается, если модели реакционно-способности качественно совпадают между мутантом и неизмененным полипептидом, то есть, например, одни и те же субстраты превращаются при различной скорости. Примеры подходящих аминокислотных заместителей приводятся в следующей таблице:
|
"Функциональными эквивалентами" в изложенном выше понимании также являются "предшественники" описанных полипептидов, а также "функциональные производные" и "соли" полипептидов.
"Предшественники" в этом случае представляют собой природные или синтетические предшественники полипептидов с или без желательной биологической активности.
Термин "соли" означает соли карбоксильной группы, а также соли присоединения кислоты аминогрупп белковых молекул согласно изобретению. Соли карбоксильных групп могут быть получены известным путем и содержат неорганические соли, например, соли натрия, кальция, аммония, железа и цинка, и соли с органическими основаниями, например, амины, такие как триэтаноламин, аргинин, лизин, пиперидин и тому подобное. Соли добавления кислоты, например, соли с неорганическими кислотами, такие как, соляная кислота или серная кислота, и соли с органическими кислотами, такими как уксусная кислота и щавелевая кислота, также входят в объем настоящего изобретения.
"Функциональные производные" полипептидов согласно настоящему изобретению также могут быть получены при функциональных боковых группах аминокислот или при их N-терминальном или C-терминальном конце, применяя известные методики. Такие производные содержат, например, сложные алифатические эфиры групп карбоновых кислот, амиды групп карбоновых кислот, полученные путем реакции с аммиаком или с первичным или вторичным амином; N-ацильные производные свободных аминогрупп, полученные путем реакции с ацильными группами; или O-ацильные производные свободных гидрокси-групп, полученные путем реакции с ацильными группами.
"Функциональные эквиваленты" естественно также содержат полипептиды, которые могут быть получены из других организмов, а также варианты естественного происхождения. Например, участки гомологичных областей последовательностей могут быть установлены путем сравнения последовательностей, и эквивалентные ферменты могут быть определены на основе конкретных параметров изобретения.
"Функциональные эквиваленты" также содержат фрагменты, предпочтительно отдельные домены или мотивы последовательностей, полипептидов согласно настоящему изобретению, которые, например, проявляют желательную биологическую функцию.
"Функциональные эквиваленты", кроме того, представляют собой слитые белки, которые имеют одну из полипептидных последовательностей, указанных выше, или их функциональных эквивалентов, полученных из них, и по меньшей мере одну дополнительную функционально отличную гетерологичную последовательность при функциональном N-терминальном или C-терминальном объединении (то есть без существенного взаимного функционального повреждения частей слитого белка). Неограничивающие примеры этих гетерологичных последовательностей представляют собой, например, сигнальные пептиды, гистидиновые якори или ферменты.
"Функциональные эквиваленты", которые также включены в соответствии с настоящим изобретением, представляют собой гомологи описанных белков. Они обладают значениями процента идентичности, установленными выше. Указанные значения относятся к идентичности с описанными аминокислотными последовательностями, и могут быть вычислены согласно алгоритму Пирсона и Липмана, Proc. Natl. Acad, Sci. (USA) 85(8), 1988, 2444-2448. Значения идентичности в процентах также могут быть вычислены с помощью алгоритмов BLAST, алгоритма blastp (белок-белок BLAST) или применяя программу Clustal, как приведено ниже.
Процентная идентичность гомологичного полипептида согласно настоящему изобретению означает, в частности, процентную идентичность аминокислотных остатков относительно общей длины одной из аминокислотных последовательностей, описанных в настоящем документе.
В случае возможного гликозилирования белка, "функциональные эквиваленты" согласно настоящему изобретению содержат белки обозначенного выше вида в дегликозилированной или гликозилированной форме, а также модифицированных формах, которые могут быть получены путем изменения модели гликозилирования. Такие функциональные эквиваленты или гомологи белков или полипептидов согласно изобретению могут быть получены путем мутагенеза, например, путем точечной мутации, удлинения или укорочения белка.
Такие функциональные эквиваленты или гомологи белков согласно настоящему изобретению могут быть идентифицированы путем скрининга комбинаторных баз данных мутантов. Например, разнообразные базы данных вариантов белков могут быть получены путем комбинаторного мутагенеза на уровне нуклеиновых кислот, например, путем ферментативного лигирования смеси синтетических олигонуклеотидов. Существует очень много способов, которые могут применяться для получения баз данных потенциальных гомологов из дегенерированной олигонуклеотидной последовательности. Химический синтез дегенерированной генной последовательности может быть осуществлен в автоматическом ДНК синтезаторе, и синтетический ген может затем быть лигирован в подходящий экспрессионный вектор. Применение дегенерированного генома делает возможным доставлять все последовательности в смеси, которая кодирует желательный набор потенциальных белковых последовательностей. Способы синтеза дегенерированных олигонуклеотидов известны специалистам в данной области техники (например, Narang, S.A. (1983) Tetrahedron 39:3; Itakura et al. (1984) Annu. Rev. Biochem. 53:323; Itakura et al., (1984) Science 198:1056; Ike et al. (1983) Nucleic Acids Res. 11:477).
Из уровня техники известно несколько методик скрининга генных продуктов комбинаторных баз данных, которые были получены точечной мутацией или укорочением, и методик скрининга библиотек кДНК для генных продуктов с выбранным свойством. Эти методики могут быть адаптированы для быстрого скрининга генных банков, которые были получены путем комбинаторного мутагенеза гомологов согласно изобретению. Методики, наиболее часто применяемые для скрининга больших банков данных, которые основываются на анализах с высокой пропускной способностью, содержат клонирование генного банка в экспрессионные вектора, которые могут быть реплицированы, трансформацию подходящих клеток полученными векторами с базой данных и экспрессию комбинаторных генов в условиях, в которых обнаружение желательной активности облегчает выделение вектора, который кодирует ген, продукт которого был обнаружен. Рекурсивный множественный мутагенез (REM), методика, которая увеличивает частоту функциональных мутантов в базах данных, может применяться в комбинации со скринирующими тестами для идентификации гомологов (Arkin and Yourvan (1992) PNAS 89:7811-7815; Delgrave et al. (1993) Protein Engineering 6(3):327-331).
Согласно следующему варианту выполнения настоящего изобретения получают выделенный полипептид, выбранный из:
(i) аминокислотной последовательности, представленной любой из SEQ ID NO:8 или 10;
(ii) аминокислотной последовательности, на по меньшей мере 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичной аминокислотной последовательности, представленной любой из SEQ ID NO:8 или 10.
(iii) производных любой из аминокислотных последовательностей, приведенных в (i) или (ii) выше.
Кодирующие последовательности нуклеиновых кислот
Настоящее изобретение также относится к последовательностям нуклеиновых кислот, которые кодируют ферменты, как определено в настоящем изобретении.
Настоящее изобретение также относится к нуклеиновым кислотам с определенной степенью "идентичности" с последовательностями, специфически описанными в настоящем изобретении. "Идентичность" между двумя нуклеиновыми кислотами означает идентичность нуклеотидов, в каждом случае по всей длине нуклеиновой кислоты.
Например, идентичность может быть вычислена с помощью программы Vector NTI Suite 7.1 компании Informax (USA), применяющей способ Clustal (Higgins DG, Sharp PM. Fast and sensitive multiple sequence alignments on a microcomputer. Comput Appl. Biosci. 1989 Apr; 5(2):151-1) со следующими параметрами:
Параметры множественного выравнивания:
|
Параметры парного выравнивания:
|
Альтернативно идентичность может быть определена в соответствии с Chenna, Ramu, Sugawara, Hideaki, Koike, Tadashi, Lopez, Rodrigo, Gibson, Toby J, Higgins, Desmond G, Thompson, Julie D. Multiple sequence alignment with the Clustal series of programs. (2003) Nucleic Acids Res 31 (13):3497-500, веб-страница: http://www.ebi.ac.uk/Tools/clustalw/index.html, при следующих параметрах:
|
Все последовательности нуклеиновой кислоты, упомянутые в настоящем изобретении (последовательности одноцепочечной или двухцепочечной ДНК и РНК, например, кДНК и мРНК), могут быть получены известным путем, посредством химического синтеза из нуклеотидных строительных блоков, например, путем фрагментной конденсации отдельных перекрывающихся комплементарных строительных блоков нуклеиновых кислот двойной спирали. Химический синтез олигонуклеотидов может, например, быть осуществлен известным путем, посредством фосфоамидитного способа (Voet, Voet, 2nd edition, Wiley Press, New York, pages 896-897). Присоединение синтетических олигонуклеотидов и заполнение гэпов посредством фрагмента Кленова ДНК-полимеразы и реакций лигирования, а также общие методики клонирования раскрываются Sambrook et al. (1989), смотрите ниже.
Изобретение также относится к последовательностям нуклеиновых кислот (последовательности одноцепочечной и двухцепочечной ДНК и РНК, например, кДНК и мРНК), кодирующим один из вышеуказанных полипептидов и их функциональных эквивалентов, которые могут быть получены, например, применяя искусственные нуклеотидные аналоги.
Настоящее изобретение относится как к выделенным молекулам нуклеиновых кислот, которые кодируют полипептиды или пептиды согласно изобретению или их биологически активные сегменты, так и к фрагментам нуклеиновых кислот, которые могут применяться, например, в качестве гибридизационных зондов или праймеров для идентификации или амплификации кодирующих нуклеиновых кислот согласно изобретению.
Молекулы нуклеиновой кислоты согласно изобретению могут, кроме того, содержать нетранслируемые последовательности у 3' и/или 5' конца кодирующей генетической области.
Изобретение, кроме того, относится к молекулам нуклеиновой кислоты, которые комплементарны конкретно описанным нуклеотидным последовательностям, или их сегменту.
Согласно следующему варианту выполнения настоящего изобретения обеспечивается выделенная молекула нуклеиновой кислоты, выбранной из:
(i) нуклеиновой кислоты, представленной любой из SEQ ID NO:7 или 9;
(ii) комплемента нуклеиновой кислоты, представленной любой из SEQ ID NO:7 или 9;
(iii) нуклеиновой кислоты, кодирующей полипептид, представленный любой из SEQ ID NO:8 или 10, предпочтительно в результате вырожденности генетического кода указанная выделенная нуклеиновая кислота может быть получена на основании полипептидной последовательности, представленной любой из SEQ ID NO:8 или 10;
(iv) нуклеиновой кислоты, последовательность которой на по меньшей мере 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична любой из последовательностей нуклеиновой кислоты SEQ ID NO:7 или 9;
(v) молекулы нуклеиновой кислоты, которая гибридизуется с молекулой нуклеиновой кислоты (i) - (iv) в строгих условиях гибридизации;
(vi) нуклеиновой кислоты, кодирующей полипептид, имеющий альдегиддисмутазную активность, причем последовательность полипептида на по меньшей мере 50%, 51%, 52%, 53%, 54%, 55%, 56%, 57%, 58%, 59%, 60%, 61%, 62%, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична аминокислотной последовательности, представленной любой из SEQ ID NO:8 или 10.
Нуклеотидные последовательности согласно изобретению делают возможным получение зондов и праймеров, которые могут применяться для идентификации и/или клонирования гомологичных последовательностей в других клеточных типах и организмах. Такие зонды и праймеры, в общем, содержат область нуклеотидной последовательности, которая гибридизуется при "строгих" условиях (смотрите ниже) на по меньшей мере около 12, предпочтительно по меньшей мере около 25, например, около 40, 50 или 75 последующих нуклеотидах кодирующей смысловой нити последовательности нуклеиновой кислоты согласно изобретению или соответствующей антисмысловой нити.
"Выделенная" молекула нуклеиновой кислоты отделяется от других молекул нуклеиновой кислоты, которые присутствуют в природном источнике нуклеиновой кислоты и, более того, может быть по существу свободна от других клеточных материалов или культуральной среды, в случае получения посредством рекомбинантных методик, или может быть свободна от химических предшественников или других химических веществ, в случае химического синтеза.
Молекула нуклеиновой кислоты согласно настоящему изобретению может быть выделена с помощью стандартных методик молекулярной биологии и информации, раскрытой в настоящем изобретении. Например, кДНК может быть выделена из подходящей библиотеки кДНК, применяя одну из описанных полных последовательностей или ее фрагмент в качестве гибридизационного зонда и стандартные методики гибридизации (как раскрывается, например, в Sambrook, J., Fritsch, E.F. and Maniatis, Т. Molecular Cloning: A Laboratory Manual. 2nd edition, Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989). Кроме того, молекула нуклеиновой кислоты, содержащая одну из раскрытых последовательностей или ее сегмент, может быть выделена путем полимеразной цепной реакции, применяя олигонуклеотидные праймеры, которые были сконструированы на основе этой последовательности. Нуклеиновая кислота, амплифицированная таким путем, может быть клонирована в подходящем векторе и может быть охарактеризована с помощью ДНК секвенирования. Олигонуклеотиды согласно настоящему изобретению могут быть получены стандартными способами синтеза, например, применяя автоматический ДНК синтезатор.
Последовательности нуклеиновой кислоты согласно настоящему изобретению или их производные, гомологи или части этих последовательностей, могут, например, быть выделены с помощью обычных методик гибридизации или ПЦР методики из других бактерий, например, посредством геномной или кДНК библиотек. Эти ДНК последовательности гибридизуются в стандартных условиях с последовательностями согласно изобретению.
Термин "гибридизироваться" означает способность полинуклеотида или олигонуклеотида связываться с почти комплементарной последовательностью в стандартных условиях, тогда как неспецифическое связывание не происходит между некомплементарными партнерами в этих условиях. Для этого последовательности могут быть на 90-100% комплементарными. Свойство комплементарных последовательностей быть способными специфически связываться друг с другом применяется, например, в Нозерн Блоттинге или Саузерн Блоттинге, или при связывании праймера в ПЦР или ПЦР в реальном масштабе времени.
Короткие олигонуклеотиды консервативных областей преимущественно применяются для гибридизации. Однако также возможно использовать более длинные фрагменты нуклеиновых кислот согласно изобретению или полные последовательности для гибридизации. Эти стандартные условия очень зависят от применяемой нуклеиновой кислоты (олигонуклеотид, более длинный фрагмент или полная последовательность) или зависят от типа нуклеиновой кислоты (ДНК или РНК), применяемой для гибридизации. Например, температуры плавления для ДНК:ДНК гибридов являются на около 10°С ниже температур для ДНК:РНК гибридов такой же длины.
Например, в зависимости от конкретной нуклеиновой кислоты, стандартные условия означают температуру между 42 и 58°С в водном растворе буфера с концентрацией от 0.1 до 5×SSC (1×SSC=0.15 М NaCl, 15 мМ цитрата натрия, рН 7.2) или, кроме того, в присутствии 50% формамида, например 42°С в 5×SSC, 50% формамида. Предпочтительными условиями гибридизации для ДНК:ДНК гибридов являются следующими: 0.1×SSC и температуры между 20°С и 45°С, предпочтительно между около 30°С и 45°С. Для ДНК:РНК гибридов условиями гибридизации предпочтительно являются следующими: 0.1×SSC и температуры между около 30°С и 55°С, предпочтительно между около 45°С и 55°С. Эти стандартные температуры гибридизации представляют собой примеры вычисленных значений температуры плавления для нуклеиновой кислоты с длиной около 100 нуклеотидов и содержанием G+C 50% в отсутствии формамида. Экспериментальные условия для ДНК гибридизации раскрываются в относящихся к данной области учебниках по генетики, например, Sambrook et al., 1989, и могут быть вычислены, применяя формулы, известные специалиста в данной области техники, например, в зависимости от длины нуклеиновых кислот, типа гибридов или содержания G+C. Специалисты в данной области техники могут получить дополнительную информацию по гибридизации в следующих документах: Ausubel et al. (eds), 1985, Current Protocols in Molecular Biology, John Wiley & Sons, New York; Hames and Higgins (eds), 1985, Nucleic Acids Hybridization: A Practical Approach, IRL Press at Oxford University Press, Oxford; Brown (ed), 1991, Essential Molecular Biology: A Practical Approach, IRL Press at Oxford University Press, Oxford.
"Гибридизация" в частности может быть осуществлена при строгих условиях. Такие условия гибридизация раскрываются, например, Sambrook, J., Fritsch, E.F., Maniatis, Т., в: Molecular Cloning (A Laboratory Manual), 2nd edition, Cold Spring Harbor Laboratory Press, 1989, pages 9.31-9.57 или в Current Protocols в Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1-6.3.6.
"Строгие" условия гибридизации означают в частности: инкубацию при 42°С, всю ночь, в растворе, содержащем 50% формамида, 5×SSC (750 мМ NaCl, 75 мМ тринатрия цитрата), 50 мМ фосфата натрия (рН 7.6), 5× раствора Денхардта, 10% сульфата декстрана и 20 г/мл денатурированной ДНК из молок лососевых, деградированной в результате гидродинамического сдвига, с последующей промывкой фильтров с 0.1×SSC при 65°С.
Настоящее изобретение также относится к производным описанных или получаемых последовательностей нуклеиновых кислот.
Таким образом, другие последовательности нуклеиновых кислот согласно настоящему изобретению могут быть получены из последовательностей, описанных в настоящем изобретении, и могут отличаться от них добавлением, замещением, вставкой или делецией одного или нескольких нуклеотидов, и, кроме того, кодируют полипептиды с желательным профилем свойств.
Настоящее изобретение также охватывает последовательности нуклеиновых кислот, которые содержат так называемые молчащие мутации или были изменены по сравнению с конкретно установленной последовательностью, в соответствии с применением кодона специфического происхождения или организма хозяина, а также их варианты природного происхождения, например, сплайсинг варианты или аллельные варианты.
Изобретение также относится к последовательностям, которые могут быть получены путем консервативных нуклеотидных замещений (то есть, рассматриваемая аминокислота замещается аминокислотой с таким же зарядом, размером, полярностью и/или растворимостью).
Настоящее изобретение также относится к молекулам, полученным из конкретно описанных нуклеиновых кислот посредством полиморфизмов последовательностей. Эти генетические полиморфизмы могут существовать между отдельными представителями внутри популяции благодаря естественной изменчивости. Такие естественные изменчивости, как правило, приводят к различию от 1 до 5% в нуклеотидной последовательности гена.
Производные последовательностей нуклеиновых кислот согласно настоящему изобретению означают, например, аллельные варианты, имеющие гомологичность по меньшей мере 60% на уровне получаемой аминокислоты, предпочтительно гомологичность по меньшей мере 80%, наиболее предпочтительно гомологичность по меньшей мере 90% по всей области последовательности (в отношении гомологичности на аминокислотном уровне необходимо сделать ссылку на сведения, приведенные выше для полипептидов). Предпочтительно гомологи могут быть более высокими для отдельных областей последовательностей.
Кроме того, под производными также необходимо понимать гомологи последовательностей нуклеиновых кислот согласно изобретению, например, животные, растительные, грибковые и бактериальные гомологи, укороченные последовательности, одноцепочечную ДНК или РНК кодирующей и некодирующей ДНК последовательности. Например, гомологи имеют на ДНК уровне гомологичность по меньшей мере 40%, предпочтительно по меньшей мере 60%, особенно предпочтительно по меньшей мере 70%, наиболее предпочтительно по меньшей мере 80% по всей области ДНК, приведенной в последовательности, специфически раскрытой в настоящем изобретении.
Более того, под производными также понимаются, например, слияния с промоторами. Промоторы, которые добавляются к установленным нуклеотидным последовательностям, могут быть модифицированы посредством по меньшей мере одной нуклеотидной замены, по меньшей мере одной вставки, инверсии и/или делеции, но без уменьшения функциональности или эффективности промоторов. Более того, эффективность промоторов может быть увеличена путем изменения их последовательности или может быть полностью заменена более эффективными промоторами, даже организмов различного рода.
Конструкции согласно настоящему изобретению
Настоящее изобретение также относится к экспрессионным конструкциям, содержащим, под генетическим контролем регуляторных последовательностей нуклеиновой кислоты, последовательность нуклеиновой кислоты, кодирующая полипептид или слитый белок согласно изобретению, а также векторам, содержащим по меньшей мере одну из этих экспрессионных конструкций.
"Экспрессионная единица" означает согласно настоящему изобретению нуклеиновую кислоту с экспрессионной активностью, которая содержит промотор, как определено в настоящем изобретении, и, после функционального объединения с нуклеиновой кислотой, которая должна экспрессироваться, или геном, регулирует экспрессию, то есть транскрипцию и трансляцию этой нуклеиновой кислоты или этого гена. Таким образом, в этом контексте она также называется "регуляторной последовательностью нуклеиновой кислоты". В добавление к промотору могут присутствовать другие регуляторные элементы, например, энхансеры.
"Экспрессионная кассета" или "экспрессионная конструкция" означает согласно настоящему изобретению экспрессионную единицу, которая функционально связана с нуклеиновой кислотой, которая должна экспрессироваться, или геном, который должен экспрессироваться. В отличие от экспрессионной единицы, экспрессионная кассета, таким образом, содержит не только последовательности нуклеиновой кислоты, которые регулируют транскрипцию и трансляцию, но также последовательности нуклеиновой кислоты, которые должны экспрессироваться в виде белка в результате транскрипции и трансляции
Термины "экспрессия" или "сверхэкспрессия" обозначают, в контексте настоящего изобретения, получение или увеличение внутриклеточной активности одного или более ферментов в микроорганизме, которые кодируются соответствующей ДНК. Для этого возможно, например, вставить ген в организм, заменить существующий ген другим геном, повысить число копий гена или генов, применить сильный промотор или применить ген, который кодирует соответствующий фермент с высокой активностью, и при необходимости эти меры могут быть объединены.
Предпочтительно, такие конструкции согласно настоящему изобретению содержат промотор против хода транскрипции ближе к 5'-концу, чем соответствующая кодирующая последовательность, и терминаторную последовательность ближе к 3'-концу по ходу транскрипции, и при необходимости дополнительные обычные регуляторные элементы, в каждом случае функционально связанные с кодирующей последовательностью.
"Промотор", "нуклеиновая кислота с промоторной активностью" или "промоторная последовательность" означает согласно настоящему изобретению нуклеиновую кислоту, которая, будучи функционально связанной с нуклеиновой кислотой, которая должна транскрибироваться, регулирует транскрипцию нуклеиновой кислоты.
"Функциональное" или "оперативное" соединение означает в этом контексте, например, последовательное расположение одной из нуклеиновых кислот с промоторной активностью и последовательности нуклеиновой кислоты, которая транскрибируется, и при необходимости других регуляторных элементов, например, последовательностей нуклеиновой кислоты, которые активируют транскрипцию нуклеиновых кислот, и, например, терминатора, таким образом, что каждый из регуляторных элементов может выполнять свою функцию при транскрипции последовательности нуклеиновой кислоты. Не требуется непосредственного связывания в химическом смысле. Генные контрольные последовательности, такие как энхансерные последовательности, могут также оказывать свое влияние на целевую последовательность из более удаленных положений или даже из других молекул ДНК. Предпочтительными расположениями являются те, при которых последовательность нуклеиновой кислоты, которая должна быть транскрибирована, находится позади (то есть, при 3' конце) промоторной последовательности, так что две последовательности ковалентно связаны друг с другом. Расстояние между промоторной последовательностью и последовательностью нуклеиновой кислоты, которая должна быть экспрессирована трансгенно, может составлять менее 200 п.о. (пар оснований), или менее 100 п.о. или менее 50 п.о.
Помимо промоторов и терминаторов, примеры других регуляторных элементов, которые могут быть упомянуты, представляют собой нацеливающие последовательности, энхансеры, сигналы полиаденилирования, селектируемые маркеры, сигналы амплификации, точки начала репликации и тому подобное. Подходящие регуляторные последовательности описываются, например, в Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, CA (1990).
Конструкции нуклеиновой кислоты согласно изобретению содержат, в частности, последовательности, выбранные из специфически упомянутых в описании настоящего изобретения или их производные и гомологи, а также последовательности нуклеиновых кислот, которые могут быть получены из аминокислотных последовательностей, специфически упомянутых в настоящем изобретении, которые предпочтительно оперативно или функционально связаны с одним или более регулирующими сигналами для контроля, например, повышения генной экспрессии.
В дополнение к этим регуляторным последовательностям, естественная регуляция этих последовательностей может все еще присутствовать перед существующими структурными генами и при необходимости быть уже генетически изменена, так что естественная регуляция отключается, и экспрессия генов повышается. Конструкция нуклеиновой кислоты может также быть простой, то есть без каких-либо дополнительных регуляторных сигналов, вставленных перед кодирующей последовательностью и без удаления естественного промотора с его регуляцией. Вместо этого, природная регуляторная последовательность сделана молчащей, так что регуляция более не происходит, и генная экспрессия повышается.
Предпочтительная конструкция нуклеиновой кислоты предпочтительно также содержит одну или более вышеупомянутых энхансерных последовательностей, функционально связанных с промотором, который обеспечивают повышенную экспрессию последовательности нуклеиновой кислоты. Дополнительные предпочтительные последовательности, такие как другие регуляторные элементы или терминаторы, также могут быть вставлены при 3' конце ДНК последовательностей. Одна или более копий нуклеиновых кислот согласно изобретению могут содержаться в конструкции. Конструкция также может содержать другие маркеры, такие как гены устойчивости к антибиотикам или ауксотрофия-комплементарные гены, при необходимости для селекции по конструкции.
Примеры подходящих регуляторных последовательностей содержатся в промоторах, таких как cos-, tac-, trp-, let-, trp-tet-, lpp-, lac-, lpp-lac-, laclq-, T7-, T5-, T3-, gal-, trc-, ara-, rhaP (rhaPBAD)SP6-, lambda-PR-, или в lambda-PL промоторе, которые находят применение предпочтительно в грамотрицательных бактериях. Другие предпочтительные регуляторные последовательности содержатся, например, в грамположительных промоторах асе, amy и SPO2, в промоторах дрожжей или грибов ADC1, MFalpha, AC, P-60, CYC1, GAPDH, TEF, rp28, ADH. Искусственные промоторы также могут применяться для регуляции.
Для экспрессии конструкция нуклеиновой кислоты вставляется в организм-хозяин, предпочтительно в векторе, например, плазмиде или фаге, который позволяет оптимальную экспрессию генов в хозяине. В дополнение к плазмидам и фагам, вектора, как понимается, также представляют собой вектора, известные специалистам в данной области техники, как например, вирусы, такие как SV40, CMV, бакуловирусы и аденовирусы, транспозоны, IS элементы, фазмиды, космиды и линейные или кольцевые ДНК. Эти вектора могут реплицироваться автономно в организме-хозяине или могут реплицироваться хромосомно. Эти вектора представляют собой следующий вариант выполнения настоящего изобретения.
Подходящими плазмидами являются, например, в E.Coli: pLG338, pACYC184, pBR322, pUC18, pUC19, рКСЗО, pRep4, pHS1, pKK223-3, pDHE19.2, pHS2, pPLc236, pMBL24, pLG200, pUR290, pIN-III113-B1, λgt11 или pBdCl; в нокардиоформных актином ицетах: pJAM2; в стрептомицетах (Streptomyces): pIJ101, pIJ364, pIJ702 или pIJ361; в бациллах: pUB110, pC194 или pBD214; в коринебактериях (Corynebacterium): pSA77 или pAJ667; в грибах: pALS1, pIL2 или рВВ116; в дрожжах: 2alphaM, pAG-1, YEp6, YEp13 или pEMBLYe23, или в растениях: pLGV23, pGHlac+, pBIN19, pAK2004 или pDH51. Вышеуказанные плазмиды представляют собой небольшую часть возможных плазмид. Другие плазмиды также известны специалистам в данной области техники и раскрываются, например, в книге Cloning Vectors (Eds. Pouwels P.H. et al. Elsevier, Amsterdam-New York-Oxford, 1985, ISBN 0 444 904018).
В следующем варианте вектора, вектор, содержащий конструкцию нуклеиновой кислоты согласно изобретению или нуклеиновую кислоту согласно изобретению, предпочтительно может быть вставлен в форме линейной ДНК в микроорганизмы и интегрирован в геном организма-хозяина посредством гетерологичной или гомологичной рекомбинации. Линейная ДНК может содержать линеаризованный вектор, такой как плазмида или только конструкцию нуклеиновой кислоты или нуклеиновую кислоту согласно изобретению.
Для оптимальной экспрессии гетерологичных генов в организмах, предпочтительно изменить последовательности нуклеиновых кислот в соответствии со специфическим кодоном, обычно применяемым в организмах. Частота использования кодона может быть легко определена на основе компьютерной оценки других известных генов рассматриваемого организма.
Получение экспрессионной кассеты согласно изобретению основывается на слиянии подходящего промотора с подходящей кодирующей нуклеотидной последовательностью и терминаторным сигналом или сигналом полиаденилирования. Общие методики рекомбинации и клонирования, применяемые для этого, раскрываются, например, в Т. Maniatis, E.F. Fritsch and J. Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1989), а также в T.J. Silhavy, M.L. Berman and L.W. Enquist, Experiments with Gene Fusions, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1984) и в Ausubel, F.M. et al., Current Protocols в Molecular Biology, Greene Publishing Assoc. and Wiley Interscience (1987).
Рекомбинантная конструкция нуклеиновой кислоты или генная конструкция вставляется предпочтительно в вектор, специфичный по отношению к хозяину, для экспрессии в подходящем организме-хозяине, для обеспечения оптимальной экспрессии генов в хозяине. Вектора хорошо известны специалистам в данной области техники и раскрываются, например, в "Cloning Vectors" (Pouwels P.H. et al., Publ. Elsevier, Amsterdam-New York-Oxford, 1985).
Хозяева, которые могут применяться согласно настоящему изобретению
В зависимости от контекста, термин "микроорганизм" означает исходный микроорганизм (дикого типа) или генетически модифицированный микроорганизм согласно изобретению, или и то и другое.
Термин "дикий тип" означает согласно изобретению соответствующий исходный микроорганизм и не обязательно соответствует организму природного происхождения.
Посредством векторов согласно изобретению могут быть получены рекомбинантные микроорганизмы, которые были трансформированы с помощью, например, по меньшей мере одного вектора согласно изобретению, и могут применяться для получения полипептидов согласно изобретению. Предпочтительно, рекомбинантные конструкции согласно изобретению, описанные выше, вставляются в подходящую систему-хозяина и экспрессируются. Предпочтительно применяются обычные способы клонирования и трансфекции, которые известны специалистам в данной области техники, такие как, например, совместное осаждение, слияние протопластов, электропорация, ретровирусная трансфекция и тому подобное, для обеспечения экспрессии установленных нуклеиновых кислот в соответствующей экспрессионной системе. Подходящие системы описываются, например, в Current Protocols in Molecular Biology, F. Ausubel et al., Publ. Wiley Interscience, New York 1997, или Sambrook et al. Molecular Cloning: A Laboratory Manual. 2nd edition, Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989.
На самом деле, все прокариотические организмы могут рассматриваться в качестве рекомбинантных организмов-хозяев для нуклеиновой кислоты согласно изобретению или конструкции нуклеиновой кислоты. Предпочтительно в качестве организма-хозяина применяются бактерии. Хотя Escherichia coli является одним из примеров бактериальных клеток-хозяев, традиционно применяемым для экспрессии фермента, который катализирует разложение формальдегида, другие бактериальные клетки-хозяева также могут применяться согласно настоящему изобретению для экспрессии чужеродной ДНК, включая, например, Escherichia, Enterobacter, Azotobacter, Erwinia, Bacillus, Pseudomonas, Bordetella, Rhodobacter, Xyella, Klebsielia, Proteus, Salmonella, Serratia, Shigella, Rhizobium, Vitreoscilla и Paracoccus. Кроме того, эукариотические грибковые клетки-хозяева могут применяться согласно настоящему изобретению для экспрессии чужеродной ДНК, включая, например, Aspergillus, Pichia, Trichoderma, Hansenula, Saccharomyces, Kluyveromyces, Schizosaccharomyces, Chrysosporium, Candida и Torulopsis.
Организм-хозяин или организмы-хозяева согласно изобретению, кроме того, предпочтительно содержат по меньшей мере одну из последовательностей нуклеиновых кислот, конструкций нуклеиновых кислот или векторов, описанных в настоящем изобретении, которые кодируют ферментативную активность в соответствии с описанием, приведенным выше.
Организмы, применяемые в способе согласно изобретению, выращиваются или размножаются способом, известным специалисту в данной области техники, в зависимости от организма-хозяина. Как правило, микроорганизмы выращиваются в жидкой среде, которая содержит источник углерода обычно в форме Сахаров, источник азота, обычно в форме органических источников азота, таких как экстракт дрожжей или соли, такие как аммониевые соли, микроэлементы, такие как соли железа, марганца и магния, и при необходимости витамины, при температурах между 0°С и 100°С, предпочтительно между 10°С и 60°С, при насыщении кислородом. Значение рН жидкой питательной среды может быть фиксировано, то есть регулироваться или не регулироваться в ходе роста. Рост может осуществлять периодически, полупериодически или непрерывно. Питательные вещества могут подаваться в начале ферментации или могут подаваться позднее, либо полунепрерывно, либо непрерывно.
Рекомбинантное получение белков с альдегиддисмутазной активностью
Настоящее изобретение относится к способу получения белков согласно изобретению, путем культивирования микроорганизма, который экспрессирует указанный белок, и выделения желательного продукта из культуры.
Микроорганизмы, применяемые согласно настоящему изобретению, могут культивироваться непрерывно или периодически в периодическом процессе или периодическом процессе с подпиткой, или периодическом процесс с неоднократной подпиткой. Известные способы культивирования раскрываются в учебнике Chmiel (Bioprocesstechnik 1. Einfuhrung in die Bioverfahrenstechnik (Gustav Fischer Verlag, Stuttgart, 1991)) или в учебнике Storhas (Bioreaktoren und periphere Einrichtungen (Vieweg Verlag, Braunschweig/Wiesbaden, 1994)).
Культуральная среда, которая будет применяться, должна соответствовать требованиям конкретных штаммов, соответствующим образом. Описания культуральных сред для различных микроорганизмов приводятся в учебнике "Manual of Methods for General Bacteriology" of the American Society for Bacteriology (Washington D. C., USA, 1981).
Такие среды, которые могут применяться согласно настоящему изобретению, обычно содержат один или более источников углерода, источники азота, неорганические соли, витамины и/или микроэлементы.
Предпочтительные источники углерода представляют собой сахара, такие как моно-, ди- или полисахариды. Очень хорошими источниками углерода являются, например, глюкоза, фруктоза, манноза, галактоза, рибоза, сорбоза, рибулоза, лактоза, мальтоза, сахароза, рафиноза, крахмал или целлюлоза. Сахара могут также добавляться в среду посредством сложных соединений, таких как меласса или другие побочные продукты рафинирования сахара. Также может быть предпочтительно добавлять смеси различных источников углерода. Другими возможными источниками углерода являются масла или жиры, такие как соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло, жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота или линолевая кислота, спирты, такие как глицерин, метанол или этанол, и органические кислоты, такие как уксусная кислота или молочная кислота.
Источниками азота обычно являются органические или неорганические соединения азота или материалы, содержащие эти соединения. Примеры источников азота включают газообразный аммиак или аммониевые соли, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония или нитрат аммония, нитраты, мочевину, аминокислоты или сложные источники азота, такие как кукурузный сироп, соевая мука, соевый белок, экстракт дрожжей, мясной экстракт и другие. Источники могут применяться отдельно или в виде смеси. Соединения неорганических солей, которые могут присутствовать в среде, включают хлориды, фосфаты или сульфаты кальция, магния, натрия, кобальта, молибдена, калия, марганца, цинка, меди и железа. Неорганические соединения, содержащие серу, например, сульфаты, сульфиты, дитиониты, тетратионаты, тиосульфаты, сульфиды, но также органические соединения серы, такие как меркаптаны и тиолы, могут применяться в качестве источников серы.
Фосфорная кислота, дигидрофосфат калия или гидрофосфат дикалия или соответствующие соли, содержащие натрий, могут применяться в качестве источников фосфора. Хелатообразующие агенты могут добавляться в среду для сохранения металлических ионов в растворе. Особенно подходящие хелатообразующие агенты содержат дигидроксифенолы, такие как катехин или протокатехуат, или органические кислоты, такие как лимонная кислота. Ферментационная среда, применяемая согласно настоящему изобретению, может также содержать другие факторы роста, такие как витамины или промоторы роста, которые включают, например, биотин, рибофлавин, тиамин, фолиевую кислоту, никотиновую кислоту, пантотенат и пиридоксин. Источниками факторов роста и солей часто являются сложные компоненты среды, такие как экстракт дрожжей, меласса, кукурузный сироп и тому подобное. Кроме того, подходящие предшественники могут быть добавлены в культуральную среду. Точный состав соединений среды сильно зависит от конкретного эксперимента и должен определяться конкретно для каждого случая. Информацию по оптимизации среды можно найти в ученике "Applied Microbiol. Physiology, A Practical Approach" (Publ. P.M. Rhodes, P.F. Stanbury, IRL Press (1997) p.53-73, ISBN 0 19 963577 3). Среда для роста может также быть получена коммерческим путем у поставщиков, как например, Стандарт 1 (Merck) или BHI (сердечно-мозговая вытяжка, DIFCO) и т.д. Все компоненты среды стерилизуются либо путем нагревания (20 минут при 1.5 бар и 121°С), либо путем стерильной фильтрации. Компоненты могут стерилизоваться либо вместе, либо отдельно при необходимости. Все компоненты среды могут присутствовать в начале роста или при необходимости могут непрерывно добавляться или добавляться в виде периодической подпитки.
Температура культуры, как правило, составляет между 15°С и 45°С, предпочтительно от 25°С до 40°С, и может поддерживаться постоянной или может варьироваться в ходе эксперимента. Значение рН среды должно находиться в интервале от 5 до 8.5, предпочтительно оно должно составлять около 7.0. Значение рН для роста может контролироваться в ходе роста путем добавления основных соединений, таких как гидроксид натрия, гидроксид калия, аммиак или аммиачная вода, или кислотных соединений, таких как фосфорная кислота или серная кислота. Пеногасители, например, сложные полигликолевые эфиры жирных кислот, могут применяться для контроля ценообразования. Для поддержания стабильности плазмид в среду могут быть добавлены подходящие вещества с селективным действием, например, антибиотики. Кислородные или содержащие кислород газообразные смеси, например, окружающий воздух, подаются в культуру для поддержания аэробных условий. Температура культуры, как правило, составляет от 20°С до 45°С. Культивация продолжается до образования максимума желательного продукта. Как правило, он достигается в течение от 10 часов до 160 часов.
Клетки при необходимости могут быть разрушены с помощью высокочастотного ультразвука, при высоком давлении, например, во френч-прессе для клеток, посредством осмолиза, посредством действия детергентов, лизирующих ферментов или органических растворителей, с помощью гомогенизаторов или комбинации нескольких из перечисленных способов.
Применение фермента, имеющего альдегиддисмутазную активность
Настоящее изобретение относится к применению выделенного полипептида, имеющего альдегиддисмутазную активность и содержащему вариант последовательности SEQ ID NO:2, где фенилаланин в положении 93 последовательности SEQ ID NO:2, и/или изолейцин в положении 301 последовательности SEQ ID NO:2, и/или метионин в положении 337 последовательности SEQ ID NO:2, и/или фенилаланин в положении 127 последовательности SEQ ID NO:2 замещен любой другой аминокислотой, для уменьшения содержания альдегида в композиции, содержащей альдегид.
В предпочтительном варианте выполнения настоящего изобретения альдегид представляет собой ацетальдегид, как определено в части, в которой раскрываются определения.
В другом предпочтительном варианте выполнения настоящего изобретения альдегидом является метилглиоксаль.
Приведенные далее примеры служат только в целях иллюстрации настоящего изобретения. Настоящее изобретение также охватывает множество различных вариантов, которые очевидны специалистам в данной области техники.
Примеры
Пример 1: экспрессия и очистка ФДМ
Следующая методика основывается на ранее описанном протоколе (Yanase, Н., Moriya, K., Mukai, N., Kawata, Y., Okamoto, K., Kato, N. (2002) Effects of GroESL Coexpression on the Folding of Nicotinoprotein Formaldehyde Dismutase from Pseudomonas putida F61 Biosci. Bitechnol. Biochem., 66(1), 85-91) и, кроме того, была оптимизирована. Частота использования кодона гена, кодирующего ФДМ, была оптимизирована для E.coli. Новая ДНК последовательность была синтезирована и клонирована в pDHE, экспрессионный вектор, индуцируемый рамнозой (SEQ ID NO:4). Шапероны GroEL/S, которые необходимы для получения растворимой ФДМ, клонируются в IPTG-индуцируемом pAgro векторе (SEQ ID NO:5). Репрессор lac кодируется вектором pHSG (SEQ ID NO:6). Экспресия ФДМ была осуществлена с применением Е.coli TG10, TG1 производная без изомеразы рамнозы. TG10 клетки, содержащие pAgro и pHSG (TG10+) были трансформированы pDHE-ФДМ и культивированы в LB в течение 5 часов при 37°С в присутствии ампициллина (pDHE), спектиномицина (pAgro) и хлорамфеникола (pHSG). 5 мл этой культуры было перенесено в 500 мл такой же среды, содержащей 100 мкМ IPTG и 0.5 г/л рамнозы. Индукция осуществлялась при 37°С в течение около 18 часов. Клетки собрали посредством центрифугирования и ресуспендировали в лизисном буфере (10 мМ KH2PO4, рН 7, 0.5 мМ MgCl2, 140 мкМ PMSF). Клеточный лизис индуцировали с помощью обработки ультразвуком (〈1', 1s/1s〉×10, амплитуда 70%). Через 10 минут инкубации при 37°С и центрифугирования, сульфат аммония добавили к чистому лизату до насыщения 50%. Нежелательные белки (например, шапероны) осаждались в течение 2-4 часов на льду.
Осадок удалили с помощью центрифугирования, и чистый раствор, содержащий ФДМ, нанесли на фенилсефарозную колонку (гидрофобная хроматография HIC). Фракции, содержащие ФДМ, элюировали, применяя градиент сульфата аммония „40%-0%" (буфер: 10 мМ KH2PO4, 0.5 мМ MgCl2, рН 7.2). Присутствие ФДМ подтвердили с помощью быстрого колориметрического анализа: 10 мкл каждой фракции перенесли на 96-луночный МТР планшет и инкубировали с 250 мкл раствора формальдегида (12.5 частей на миллион в 100 мМ KH2PO4, рН 7, 30 минут). Непрореагировавший формальдегид обнаружили путем добавления 50 мкл реагента Purpald (10 мг/мл в 1 М NaOH, Sigma) к 50 мкл реакционной смеси. Проявление цвета указывает на отсутствие фермента в собранной фракции.
После стадии фенилсафарозной очистки элюированные фракции концентрировали с помощью ультрафильтрации (пропускная способность 10 кДа) и обессолили с помощью эксклюзионной хроматографии по размеру (HiPrep Desalting 26/10 мл, Amersham). 1×PBS, 0,5 мМ MgCl2 (рН 7.2) применяли в качестве подвижного буфера. Раствор белка концентрировали с помощью ультрафильтрации (пропускная способность 10 кДа), и добавили глицерин до конечной концентрации 50%. Стоковые растворы ФДМ (2-5 мг/мл) хранились при -20°С. Типичный выход после встряхиваемых колб составлял около 100 мг/л, а после ферментации около 1 г/л. Эта методика обеспечивает очищение белка до гомогенности, о чем свидетельствует окрашенная кумасси SDS-PAGE (данные не показаны).
Следующий способ также применим для мутантов ФДМ
Следующая методика основывается на ранее описанном протоколе (Yanase et al. 2002, Biosci. Biotechnol. Biochem., 66(1), 85-91) и была оптимизирована. Частота использования кодона гена, кодирующего ФДМ (или мутант), была оптимизировано для Е.coli (SEQ ID NO:3). Новая ДНК последовательность была синтезирована и клонирована в pDHE, экспрессионный вектор (SEQ ID NO:4) индуцируется рамнозой. Шапероны GroEL/S, которые необходимы для получения растворимой ФДМ, клонировали в IPTG-индуцируемом pAgro векторе (SEQ ID NO:5). Репрессор lac кодируется pHSG вектором (SEQ IN NO:6). Экспрессию ФДМ осуществили, применяя Е.coli TG10, производная TG1 без изомеразы рамнозы. TG10 клетки, содержащие pAgro и pHSG (TG10+) трансформировали pDHE-ФДМ и культивировали в LB в течение 5 часов при 37°С в присутствии ампициллина (pDHE), спектиномицина (рАдго) и хлорамфеникола (pHSG). 5 мл этой культуры переносится в 500 мл такой же среды, содержащей 100 мкМ IPTG и 0.5 г/л рамнозы. Индукцию осуществляли при 37°С в течение около 18 часов. Клетки собрали с помощью центрифугирования и ресуспендировали в лизисном буфере (10 мМ KH2PO4, рН 7, 0.5 мМ MgCl2). Клеточный лизис индуцировали посредством разрушения ультразвуком (〈3', 15s/15s〉×3, амплитуда 85%). Через 10 минут инкубации при 37°С и центрифугирования, сульфат аммония добавили к чистому лизату до насыщения 50%. Нежелательные белки (например, шапероны) осаждались в течение 1-2 часов на льду.
Осадок удалили с помощью центрифугирования, и чистый раствор, содержащий ФДМ, нанесли на фенилсефарозную колонку (гидрофобная хроматография HIC). Фракции, содержащие ФДМ, элюировали, применяя градиент сульфата аммония „40%-0%" (буфер: 10 мМ KH2PO4, 0.5 мМ MgCl2, рН 7.2). Присутствие ФДМ подтвердили с помощью быстрого колориметрического анализа: 10 мкл каждой фракции перенесли на 96-луночный МТР планшет и инкубировали с 250 мкл раствора формальдегида (12.5 частей на миллион в 100 мМ KH2PO4, рН 7, 30'). Непрореагировавший формальдегид обнаружили с помощью добавления 50 мкл реагента Purpald (10 мг/мл в 1 М NaOH, Sigma) к 50 мкл реакционной смеси. Проявление цвета свидетельствует об отсутствии фермента в собранной фракции.
После стадии фенилсефарозной очистки элюированные фракции концентрировали с помощью ультрафильтрации (пропускная способность 10 кДа) и обессолили с помощью эксклюзионной хроматографии по размеру (HiPrep Desalting 26/10 мл, Amersham). 10 мМ KH2PO4, 0,5 мМ MgCl2 (рН 7) применяли в качестве подвижного буфера. Раствор белка концентрировали с помощью ультрафильтрации (пропускная способность 10 кДа), и добавили глицерин до конечной концентрации 50%. Стоковые растворы ФДМ (2-5 мг/мл) хранили при -20°С. Эта методика обеспечила очистку белков до гомогенности, о чем свидетельствует окрашенная кумасси SDS-PAGE (данные не показаны).
Пример 2: Определение ФДМ с помощью рН-статического титрования
ФДМ активность оценили в стандартной реакционной смеси, содержащей 20 мМ формальдегида, 100 мМ KCl, 0.25 мМ KH2PO4 (рН 7). Реакцию проводили при комнатной температуре, посредством добавления 5 мкл раствора фермента к 25 мл стандартной смеси. Образование формиата контролировали через 5 минут с помощью рН-статического титрования с применением 5 мМ NaOH. Одну единицу определяли как количество фермента, необходимое для катализа образования 1 мкмоля муравьиной кислоты в минуту. ФДМ, экспрессированный в TG10+, обладал специфической активностью в интервале 100-200 единиц/мг.
Пример 3: Обнаружение формальдегида
Принцип обнаружения согласно способу LAW 112 основывается на реакции формальдегида с ацетилацетоном в присутствии аммиака с образованием соединения 3,5-диацетил-1,4-дигидролутидин желтого цвета (реакция Ганча) (Nash, Т. (1953) The Colorimetric Estimation of Formaldehyde by Means of the Hantzsch Reaction Biochem. J., 55(3), 416-421 and Fregert, S., Dahlquist, I., Gruvberger, B. (1984) A Simple Method for the Detection of Formaldehyde Contact Dermatitis, 10, 132-134). Для количественного определения формальдегида раствор реагентов получали следующим образом: 15 г ацетата аммония, 0,2 мл ацетилацетона, 0,3 мл уксусной кислоты смешивали в 100 мл дистиллированной воды (стабильность в течение 1 недели при 4°С). Водные растворы формальдегида в интервале от 5 частей на миллион до 25 частей на миллион приготовили для калибровочной кривой. Реакцию инициировали при смешивании 0,1 мл водного раствора образца (или стандарта, или воды в качестве контроля) с 0,15 мл раствора реагентов, и инкубировали при 60°С в течение 10 минут. После охлаждения раствора до комнатной температуры добавили дистиллированную воду до конечного объема 1 мл. Образование 3,5-диацетил-1,4-дигидролутидина контролировали при 412 нм.
Пример 4: Предварительное определение фермента
Для того чтобы определить эффективность формальдегиддисмутазы для применения на текстиле фермент при различных концентрациях инкубировали с 220 частями на миллион формальдегида в 100 мМ KH2PO4, рН 8, комнатная температура, 30 минут. Образцы проанализировали по ранее описанному способу на основе ацетилацетона. Специфическая активность стокового раствора фермента составляла 165 единиц/мг. Результаты приведены в Таблице 1.
|
Даже очень небольшие концентрации фермента являются более чем достаточными для почти полного удаления содержащегося формальдегида. Другим важным свойством для технических применений является толерантность к спиртам (этанол, изопропанол) или чистой воде вместо буфера. Для этого 17 мг/л формальдегиддисмутазы инкубировали при 30°С в 100 мМ KH2PO4 (рН 8), 220 частей на миллион формальдегида и 10 или 20% объем/объем растворителя (этанол или изопропанол). Альтернативно применялась дважды дистиллированная вода вместо фосфатного буфера. Результаты суммируются в Таблице 2.
|
Формальдегиддисмутаза из Р.putida F61 не эффективно реагирует с ФА в присутствии больших количеств этанола. Даже при 10% объем/объем ферментативная активность направленная на ФА сильно ингибирована. Относительно низкие концентрации изопропанола не являются проблематичными, но концентрация более 10% объем/объем оказывает отрицательный эффект на активность. Чистая вода инактивирует фермент; образование муравьиной кислоты индуцирует сдвиг рН в кислотную область (рН падает от значения 7 до около 4).
Пример 5: Обработка готового текстиля с помощью ФДМ
Хлопковое волокно, обработанное сшивающим агентом на основе димети-лолдигидроксиэтиленмочевины, обработали ФДМ. После конденсации сшивающего агента с хлопковым волокном около 114 частей на миллион свободного формальдегида в текстиле можно было определит способом на основе ацетилацетона. Этот текстильный образец затем пропитали растворами фермента с различными концентрациями (100 мМ KH2PO4, рН 8, 0-150 мг/л фермента) и сразу пропустили через два вращающиеся металлические цилиндры (Фиг.3). Влажный образец инкубировали в течение 60 минут при 30°С. Формальдегид, экстрагированный из 1 г текстильного образца, количественно определили способом на основе ацетилацетона (LAW 112). В Таблице 3 суммировали полученные данные.
|
Содержание формальдегида без дисмутазы уменьшилось до около 70 частей на миллион (95 для сухого текстиля) предпочтительно в результате некоторого эффекта „вымывания" в ходе процесса пропитки. В общем, формальдегиддисмутаза способна явным образом понижать количество экстрагируемого формальдегида до уровней между 20 и 40 частями на миллион. Различая между обнаруживаемым формальдегидом во влажном и сухом текстиле предпочтительно обуславливаются различиями в содержании воды в текстиле. Таблица 4 показывает тот же самый эксперимент, осуществленный для текстиля, сшитого альтернативным сшивающим агентом на основе диметилолдигидроксиэтиленмочевины, содержащего более высокое количество ФА (641 частей на миллион формальдегида в текстиле до ферментативной обработки).
|
В результате эффекта „вымывания" образцы без дисмутазы показали явное падение содержания формальдегида. Тем не менее, применение повышенных количеств дисмутазы приводит к явному уменьшению формальдегида, высвобождающегося из обработанного текстиля. Водопоглощение около 70% означает, что около 100 мг дисмутазы на кг текстиля является более чем достаточным для существенного уменьшения содержания формальдегида.
Для того чтобы уменьшить время и затраты энергии на сушку текстиля после ферментативной обработки, было бы полезно уменьшить содержание воды. Для этого сшитые текстильные образцы обрабатывали слегка отличным образом: концентрированный раствор фермента (1350 мг/л в 1×PBS, 25% глицерина) распыляли на текстиль. Водопоглощение точно регулировали, обеспечивая анализируемый диапазон влажности 0-50% (Таблица 5). Все образцы инкубировали в течение 60 минут при 30°С.
|
Даже при применении фермента в виде спрея "вымывание" формальдегида было неизбежным (20% поглощение буфера, 465 частей на миллион высвободившегося формальдегида). Тем не менее, применение фермента с таким же водопоглощением (270 мг фермента на кг текстиля) все же приводил к 50% уменьшению высвобождающегося формальдегида. По сравнению с нанесением ферментов посредством металлических цилиндров, когда содержание воды в текстиле достигает 70%, эффективность применения спрея является менее выраженным.
Пример 6: Влияние ФДМ содержание формальдегида в различных текстильных продуктах
Альтернативной стратегией уменьшения формальдегида в текстилях является нанесение дисмутазы непосредственно на раствор сшивающего агента перед стадией конденсации с текстилем. С этой целью протестировали 3 продукта с формальдегиддисмутазой: композиция диметилолдигидроксиэтиленмочевины (композиция 1), композиция метоксиметилированного меламина (композиция 2) и композиция поликонденсированного метоксиметилированного меламина с низким содержанием ФА (композиция 3). Сшивающая композиция 1 представляет собой высококонцентрированный, слегка кислотный (рН 5-6) водный раствор, который содержит между 0,1 и 1% формальдегида (1000-10.000 частей на миллион). Композиция 2 представляет собой концентрированный водный раствор (рН 8-9), содержащий между 1,5 и 2,5% формальдегида. Композиция 3 представляет собой слегка основный водный раствор, содержащий между 0,2 и 1% формальдегида (рН 8-9).
Как правило, 87 мкл чистого продукта смешивают с 10 мкл 3 М KH2PO4 (рН 7) и 3 мкл 50% глицерина (отрицательный контроль). В образцах, обработанных ферментом, стоковые растворы фермента (4,8 мг/мл) применялись вместо глицерина. Конечная концентрация фермента в растворе продукта составляла около 150 мг/л. Формальдегид обнаруживали с помощью способа на основе ацетилацетона. Таблица 6 показывает влияние ФДМ на сшивающие растворы.
|
Наилучшие результаты были получены для композиции 1 с уменьшением содержания формальдегида около 70%. Содержание формальдегида в композиции 3 было уменьшено на около 50%. Обработка композиции 2 с помощью ФДМ только уменьшила высокое содержание формальдегида на 20%. Необходимо отметить, что пролонгированное воздействие ФДМ может привести к разрушению продукта.
В общем, эти предварительные результаты показывают, что ФДМ потенциально может наноситься непосредственно на растворы продукта.
Пример 7: Применение ФДМ для уменьшения содержания формальдегида в соединениях, модифицированных диметилолдигидроксиэтиленмочевиной
Сшивающие агенты применяются для облегчающей уход обработки текстиля, изготовленного из целлюлозных волокон и их смесей с синтетическими волокнами. Важным классом этих химических веществ является класс модифицированных соединений диметилолдигидроксиэтиленмочевины. 4 различные композиции продукта обработали формальдегиддисмутазой (ФДМ), и измерили оставшийся формальдегид в продукте. Более того, продукт, обработанный ферментом, применялся при обработке хлопка. Количественно определили содержание формальдегида в продукте (хлопке) и эффективность обработки.
Композиции продукта обрабатывали следующим образом: 17.4 г сшивающего агента (в виде концентрированного водного раствора) и 2 мл 3М KH2PO4 (рН 7) осторожно смешали с 0.6 мл ФДМ (4.8 мг/мл). Конечная концентрация фермента составляла около 140 мг/л. Ферментативный процесс осуществляли при комнатной температуре в течение около 3 часов. Содержание формальдегида определяли как указано ранее (способ на основе ацетилацетона) (смотрите Таблицу 7).
|
Содержание формальдегида в растворах продукта было уменьшено на 70-80%. Удаление формальдегида в продукте 1 (незащищенные метилольные группы) может привести к разрушению продукта со временем.
Обработанные и необработанные ферментом композиции применялись при обработке хлопка (текстиль: CO-Popelin, применяя следующий состав: 57.5 г/л сшивающего реагента, 10 г/л MgCl2·6H2O, pH 5.0 (путем добавления уксусной кислоты). Образцы хлопка (впитывание около 70%) высушивали при 110°С до конечной влажности около 6%. Следующую стадию отверждения проводили при 150°С в течение 3 минут. Содержание формальдегида в образце хлопка определяли с помощью LAW 112 (значения в частях на миллион). Дополнительными индикаторами эффективности были углы упругого восстановления сухого волокна (dcra) (в °), предел прочности на разрыв (прочность в Н на 40*100 мм), оценка гладкости по отсутствию необходимости в глажке (DP оценка), оценка гладкости по Monsanto (Monsanto оценка), усадка (основа (w) и уток (f) в %). В приведенной далее таблице (Таблица 8) суммируются полученные результаты (1: необработанный хлопок, 2: композиция 1, 3: композиция 1 + ФДМ, 4: композиция 2, 5: композиция 2 + ФДМ, 6: композиция 3, 7: композиция 3 + ФДМ, 8: композиция 4, 9: композиция 4 + ФДМ).
|
Пример 8: Применение ФДМ для уменьшения содержания формальдегида в сульфонированных поликонденсатах меламина и формальдегида, применяемых в качестве полимерных диспергирующих агентов/суперпластификаторов
Сульфонированные поликонденсаты меламина и формальдегида в частности оптимизированы для пластификации и уменьшения воды смесей на основе цемента и сульфата кальция. Как правило, эти продукты применяются в виде 20% масса/объем водного раствора, и значение рН составляет около 9-11.4 (образец 1) и 7-10 (образец 2). В данном случае (смотрите Таблицу 9) обработали 20% масса/объем рабочие растворы обоих образцов с помощью ФДМ (конечная концентрация 140 мг/л), и количественно определили оставшийся формальдегид через различные периоды инкубации, применяя ранее описанный способ на основе ацетилацетона (значения в частях на миллион).
|
На эффективность продукта после одного часа ферментативной обработки не оказывалось отрицательное воздействие с точки зрения установленного времени, потока и силы. Подобные результаты могут быть получены, применяя хотя бы 1/5 концентрации фермента. В этих продуктах удаление формальдегида может приводить к изменениям в распределении молекулярной массы полимера с течением времени.
Пример 9: Применение ФДМ для уменьшения содержания формальдегида в модифицированной анионной полиалкилгликль-фенолформальдегидной смоле
Модифицированные анионные полиалкил-фенолальдегидные смолы, в частности оптимизируют для пластификации и уменьшения воды в смесях на основе цемента и сульфата кальция. Продукт получают в виде концентрированного водного раствора (рН 5-8). Ферментную обработку осуществляют путем добавления ФДМ непосредственно в продукт. Необработанный продукт содержит около 250 частей на миллион формальдегида, как определено способом на основе ацетилацетона. Следующая таблица (Таблица 10) показывает оставшийся формальдегид (в частях на миллион) после инкубации в течение 0.5 часов, 3 часов и 24 часов с ФДМ.
|
На эффективность продукта через 1 час ферментной обработки не оказывалось отрицательного воздействия с точки зрения установленного времени, потока и силы.
Подобные результаты могут быть получены, применяя неочищенные клеточные экстракты или целые клетки, продуцирующие ФДМ.
Пример 10: Конструктивная разработка ФДМ для расширенной субстратной эффективности
Активный сайт ФДМ показывает молекулу формальдегида, связанную в относительно узком преимущественно гидрофобном кармане. Стратегически расположенный ион цинка действует в качестве кислоты Льюиса и активирует субстрат для нуклеофильной атаки посредством гидридного иона, донором которого является тесно связанная кофакотрная молекула NADH. Постулированный механизм реакции дисмутации заключается в двух связанных полуреакциях. В первой полуреакции одна молекула формальдегида необратимо окисляется ферментным комплексом (E)-NAD+ с образованием муравьиной кислоты и (E)-NADH комплекса. Во второй полуреакции другая молекула формальдегида связывается с (E)-NADH комплексом и необратимо расщепляется до метанола, оставаясь связанной с комплексом (E)-NAD+ для следующей реакции. Постулированный механизм реакции дисмутации, катализированной ФДМ, описан и проиллюстрирован в Tanaka et al. (2002), Journal of Molecular Biology, 324, 519-533. Активный сайт ФДМ из Р. putida F61 при разрешении 2.3А описан и проиллюстрирован в Hasegawa et al. (2002), Acta Crystal-logr., Sect.A, 58, C102-C102. Формальдегид плотно упакован в гидрофобном кармане (Met 337, Ile 301, Phe 93 and Phe 127) и находится в непосредственной близости к иону цинка и NAD(Н)-кофактору.
ФДМ из Р. putida F61, как было показано, имеет ограниченную степень субстратной разнородности (Kato et al Agric., 1983, Biol. Chem., 47(1), 39-46). Фермент дикого типа показывает слабую активность в отношении ацетальдегида (5-10%, наши результаты предполагают даже меньшую активность) и метилглиоксаля (22%), относительно активности в отношении формальдегида, составляющей 100%, но не в отношении более стерически требовательных субстратов, таких как пропиональдегид, бутиральдегид, гептальдегид, глицеральдегид, гликольальдегид, бензальдегид, глиоксаль или глутаральдегид. Для того чтобы улучшить субстратную специфичность в отношении объемных альдегиды, особенно ацетальдегид, было решено модифицировать активный карман ФДМ путем замещения больших гидрофобных остатков, определяющих границы активного сайта, более маленькими аналогами в положениях 337, 301, 127 и 93. Таким образом, были получены и охарактеризованы следующие мутанты с одной мутацией:
|
Пример 11: Активность ФДМ мутантов, определенная с помощью рН-статического титрования и ВЭЖХ
Активность ФДМ и ее вариантов проанализировали с помощью рН-статического титрования в стандартной реакционной смеси, содержащей 20 мМ формальдегида, 100 мМ KCl, 0.25 мМ KH2PO4(рН 7). Реакцию проводили при комнатной температуре путем добавления 5 мкл раствора фермента к 25 мл стандартной смеси (как правило, 0,1-0,5 мкг/мл фермента, в зависимости от активности). Образование формиата контролировали через 5 минут путем титрования 5 мМ NaOH. Одну единицу определяли как количество фермента, необходимое для катализа образования одного мкмоля муравьиной кислоты в минуту. ФДМ F93A/I301L (0,7 мкг/мл) протестировали только на мутантах с помощью рН-статического титрования с 20 мм ацетальдегида вместо формальдегида при рН 7. Обнаружили, что активность ФДМ и всех мутантов с одной мутацией в отношении ацетальдегида является слишком слабой, что определили с помощью рН-статического титрования, поэтому было решено сравнить ФДМ и его варианты с помощью ВЭЖХ (Aminex HPX-87 Н колонка, в 5 мМ H2SO4, обнаружили с помощью RI, 0,5 мл/мин). Ферментативные реакции осуществили в 50 мМ KH2PO4 (рН 8), 100 мМ KCl и 20 мМ ацетальдегида. Реакции запустили путем добавления ФДМ или ее вариантов (50 мкг/мл). Ацетальдегид, этанол и уксусную кислоту количественно определяли через 30 минутные интервалы (время удерживания: ацетальдегид: 21,2 минут; этанол: 25,2 минут; уксусная кислота: 18,9 минут). Определили первоначальные скорости реакции (значения для 30 минут), и единицы вычислили как количество фермента, необходимое для образования 1 мкмоля уксусной кислоты за 1 минуту.
Результаты ясно показывают, что большинство мутаций оказывают отрицательное воздействие на специфическую активность в отношении обоих альдегидов. Исключением являются только I301L и F93A, которые обладают желательными свойствами. Введение лейцина в положении 300 приводит к 2,5-кратному повышению ацетальдегидной активности, тогда как специфическая активность в отношении формальдегида повышается на 10-20%. Вариант F92A почти полностью потерял активность в отношении формальдегида, тогда как специфическая активность в отношении ацетальдегида повысилась почти в 3 раза по сравнению с ферментом дикого типа и подобна активности ФДМ I301L мутанта (Таблица 11).
|
Мутации в положениях 301 и 93 были объединены с образованием ФДМ I301L/F93A варианта. Этот мутант с двумя мутациями не обладает какой-либо активностью в отношении формальдегида, но обладает пятикратным увеличением активности в отношении ацетальдегида. Оба замещения обладают синергетическим эффектом при повышении активности в отношении ацетальдегида (Фиг.2).
В то время как I301L показывает расширенную субстратную специфичность, ФДМ F93A вариант, особенно мутант с двумя мутациями, показывает изменение субстратной специфичности от формальдегида к ацетальдегиду. На Фиг.3 показан профиль ФДМ I301L полученный с помощью ВЭЖХ.
Пример 12: Термостабильность ФДМ, ФДМ I301L и ФДМ I301L/F93A
Важным свойством ФДМ и ее вариантов является толерантность к повышенным температурам, как в ходе ферментной очистки (стерилизация), так и в ходе технического применения. Сравнили термостабильность ФДМ, ФДМ I301L и ФДМ I301L/F93A путем предварительного инкубации фермента при различных температурах в течение 20 минут (25-65°С) и затем путем тестирования образца с ацетальдегидом или формальдегидом. ФДМ I301L и ФДМ I301L/F93A образцы протестировали на активность в отношении ацетальдегида с помощью ВЭЖХ, как описано выше. Данные приводятся в виде относительных активностей по сравнению со значениями, полученными при комнатной температуре (Фиг.4)
ФДМ и ФДМ I301L образцы протестировали на активность в отношении формальдегида с помощью рН-статического титрования, описанного выше. Данные приведены в виде относительных активностей по сравнению со значениями, полученными при комнатной температуре (смотрите Фиг.5). Интересным является то, что ФДМ I301L мутант показывает увеличение термостабильности по сравнению с белком дикого типа (+5°С, Фиг.5). F301L и F301L/F93A мутанты показывают такой же профиль термостабильности для ацетальдегида (Т50 составляет около 55°С).
Пример 13: Кристаллические структуры ФДМ, ФДМ I301L и ФДМ I301L/F93A
Кристаллы ФДМ I301L/F93A и ФДМ I301L измерили на Synchrotron SLS в Филлингене, Швейцария (Таблица 12).
|
Структуру ФДМ I301L/F93A определили способом молекулярного замещения, применяя структуру дикого типа в качестве структурного эталона (код pdb: 2DPH). В качестве примера качества данных остаток фенилаланина дикого типа в положении 93, применяемый для структурного определения, показан вместе с картой электронной плотности для ФДМ I301L/F93A мутанта (Фиг.6). Электронная плотность красного цвета указывает на то, что фенилаланин должен быть смоделирован в виде аланина, и молекула воды располагается в Cε-положении фенильного кольца. Общая структура всего фермента не изменяется в результате мутаций. Влияние мутаций ограничено мутагенизированными положениями и их близкими соседями. На Фиг.7 приведен крупный план ФДМ дикого типа. Белок изображен в ленточном виде. Следующие аминокислоты показаны в виде шаров и брусков: Cys 46, His 67 и Asp 170 координируют каталитический цинк; Ile 301 и Phe 93 представляют собой сайты, где вводятся мутации; Met 337 и Phe 127 представляют собой аминокислоты, которые изменяют свою конформацию под влиянием мутаций. Ион цинка и кофактор (NADH) также показаны.
Структура мутанта ФДМ I301L:
Мутация изолейцина 301 до лейцина отчетливо видна на карте электронной плотности. Боковая цепь принимает ориентацию в направлении от активного сайта, приводя к более сильному гидрофобному контакту с Val 303, Phe 265 и Phe 57. Это усиленное взаимодействие может приводить к повышенной температурной стабильности. Мутация также оказывает эффект на фенилаланин 127. Вся боковая цепь немного перемещается, и фенильное кольцо поворачивается на около 70° по сравнению с ферментом дикого типа (Фиг.8). Фенильное кольцо является частью кармана, связывающего субстрат, и новое положение боковой цепи сжимает карман связывания таким образом, что карбонильная группа формальдегида и ацетальдегида оказывается в более благоприятном положении для переноса гидрида от NADH кофактора. Более того, мутация изолейцина 301 до лейцина открывает связывающий карман на противоположном сайте, позволяя лучше принимать более стерически требовательный ацетальдегид в виде субстрата по сравнению с ферментом дикого типа.
Структура ФДМ I301L/F93A:
Мутация изолейцина 301 до лейцина оказывает такое же влияние на Leu 301 и на Phe 127, как и в структуре мутанта с одной мутацией. Вторая мутация (Phe 93 превращается в Ala) обеспечивает место для молекулы воды (H2O 339), которая расположена рядом с Cε-положением фенильного кольца дикого типа. Молекула воды связана водородной связью с никотинамидным кислородом NADH и с карбоксильным кислородом Asp 170, которая является одним из лигандов каталитического цинка. Третья слабая водородная связь формируется с карбоксильным кислородом основной цепи Ala 338. Сильная водородная связь молекулы воды с Asp 170 нарушает конформацию боковой цепи и, таким образом, ослабляет координацию цинка. Для формирования водородной связи боковая цепь Asp 170 должна повернуться на около 14° (Фиг.9). При таком повороте расстояние между ионом цинка и ее карбоксильным кислородом увеличивается от 2.0 до 2.4 Å. Потеря оптимальной координации цинка может объяснить общее уменьшение активности мутанта с двумя мутациями. Более того, больший активный сайт по сравнению с ферментом дикого типа или I301L мутантом, как оказалось, предотвращает возможность формальдегида принимать благоприятную ориентацию для катализа. Это может объяснить наблюдаемое изменение специфичности от формальдегида к ацетальдегиду. Вторым эффектом мутации является измененная конформация Met 337. Cε-атом Met 337 поворачивается на 90° по отношению к положению предшествующего фенильного кольца. Эта конформация представляет собой конформацию с очень низкой энергией, поэтому она представляет собой наиболее предпочтительный ротамер для метионинов в белках.
Все эти результаты подтверждают, что мутант ФДМ I301L с одной мутацией наиболее предпочтителен для технических применений.
Пример 14: Применение сухой композиции ФДМ I301L мутанта для уменьшения содержания формальдегида в модифицированной анионной полиалкилгликоль-фенолформальдегидной смоле
Модифицированная анионная полиалкилгликоль-фенолформальдегидная смола с остаточным содержанием формальдегида около 120 частей на миллион была обработана сухой композицией ФДМ I301L (специфическая активность композиции: около 50 единиц/мг). Тестирование проводили путем добавления 50 мг/л порошка фермента к смоле, с последующей инкубацией при комнатной температуре. В приведенной далее таблице (Таблица 13) показан оставшийся формальдегид (в частях на миллион) через 5 часов и через 42 дня.
|
Содержание формальдегида определили с помощью способа на основе ацетилацетона, как описывается в Примере 3.
Пример 15: Применение сухой композиции ФДМ I301L мутанта для уменьшения содержания формальдегида в модифицированной смоле бета-нафталин-ФА сульфонат
Раствор водорастворимого полимера (модифицированная смола бета-нафталин-ФА сульфонат) обработали различными количествами сухой композиции ФДМ I301L (20-200 мг композиции на 1 литр раствора полимера) и инкубировали при комнатной температуре в течение 5 часов. В это время такое же количество фермента добавили и инкубировали в течение до 11 дней. В приведенной далее таблице (Таблица 14) показан остаточный формальдегид (в частях на миллион) через 5 часов, 24 часа, 4 дня, 7 дней и 11 дней, применяя 2×50 мг/л сухой композиции фермента.
|
Содержание формальдегида определили с помощью способа на основе ацетилацетона, как описывается в Примере 3.
Пример 16: Применение сухой композиции ФДМ I301L мутанта для уменьшения содержания формальдегида в стабилизированной анионной акрилат-сополимерной дисперсии
Стабилизированная анионная акрилат-сополимерная дисперсия в воде (содержание твердых веществ 54%) была обработана 10 мг/л сухой композиции ФДМ I301L при комнатной температуре. После центрифугирования (2-4 часа при 14.000 оборотах в минуту, комнатная температура) определили содержание формальдегида в чистой водной фазе. В приведенной далее таблице (Таблица 15) показано содержание формальдегида (в частях на миллион) в дисперсии через 5 часов, 24 часа и 96 часов ферментной обработки.
|
Содержание формальдегида определили с помощью способа на основе ацетилацетона, как описывается в Примере 3.