Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ СОКРИСТАЛЛОВ ТРАМАДОЛА И КОКСИБОВ
Вид РИД
Изобретение
Настоящее изобретение относится к пероральным фармацевтическим композициям, содержащим сокристаллы трамадола и целекоксиба, к способам их получения, и к их применению в качестве лекарственных средств, более конкретно, для лечения боли.
Боль представляет собой комплексную реакцию, которая функционально подразделяется на сенсорные, вегетативные, двигательные и аффективные компоненты. Сенсорный аспект включает в себя информацию о локализации и интенсивности стимула, а адаптивный компонент может считаться активацией эндогенной модуляции боли и планированием двигательной реакции избегания. Аффективный компонент предположительно включает в себя оценку болевого неприятного ощущения и угрозы стимула, а также отрицательных эмоций, вызванных памятью и обстоятельствами болезненных стимулов.
Болевые состояния в общем можно разделить на хронические и острые. Хроническая боль включает в себя нейропатическую боль и хронические воспалительные боли, такие как артрит, боли неизвестного происхождения, например фибромиалгия. Причиной острой боли обычно является повреждение ткани ненейрогенного характера, например повреждение тканей при хирургическом вмешательстве или воспалении, или мигрень.
Множество известных лекарств, полезных для лечения или контроля боли, включают опиоиды, при этом производные морфина показаны для лечения хронической и острой боли у человека от умеренной до тяжелой степени. Обезболивающий эффект достигается посредством их действия на морфиновые рецепторы, предпочтительно, на µ-рецепторы. Одним из морфиновых производных, показавших очень хорошие результаты при пероральном введении, является трамадол. Трамадол имеет химическое название 2-(диметиламинометил)-1-(3-метоксифенил)циклогексанол и следующую формулу:
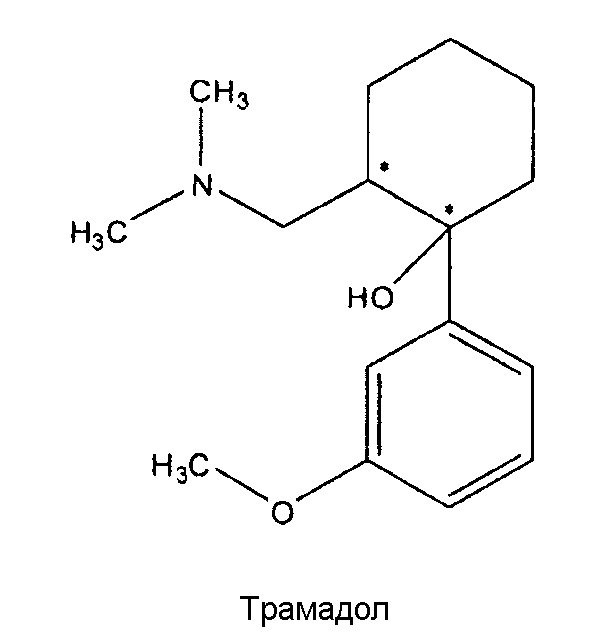
На этой структуре показаны два разных хиральных центра и, следовательно, она может существовать в виде разных диастереоизомеров, из которых трамадол является цис-диастереоизомером: (1R, 2R) или (1S, 2S), также называемых (+)-трамадолом и (-)-трамадолом, оба из которых оказывают свое действие разными путями. Несмотря на широкое применение, препарат трамадол по-прежнему проявляет ряд побочных эффектов (большинство из которых зависят от дозы), таких как запор, диарея, головокружение, сонливость, сухость во рту, головная боль, тошнота, бессонница, рвота, слабость. Таким образом, для достижения обезболивающего эффекта при лечении боли некоторое преимущество будет иметь снижение необходимой дозы трамадола (например, с помощью новой лекарственно-ориентированной формы и/или рецептуры, включающей в себя трамадол).
Еще одним общеизвестным анальгетическим соединением является целекоксиб. Целекоксиб представляет собой противовоспалительное и обезболивающее лекарственное средство и является одним из наиболее часто применяемых препаратов в лечении хронических воспалительных заболеваний опорно-двигательного аппарата. Целекоксиб под химическим названием 4-[5-(4-метилфенил)-3-(трифторметил)пиразол-1-ил]бензолсульфонамид имеет следующую формулу:
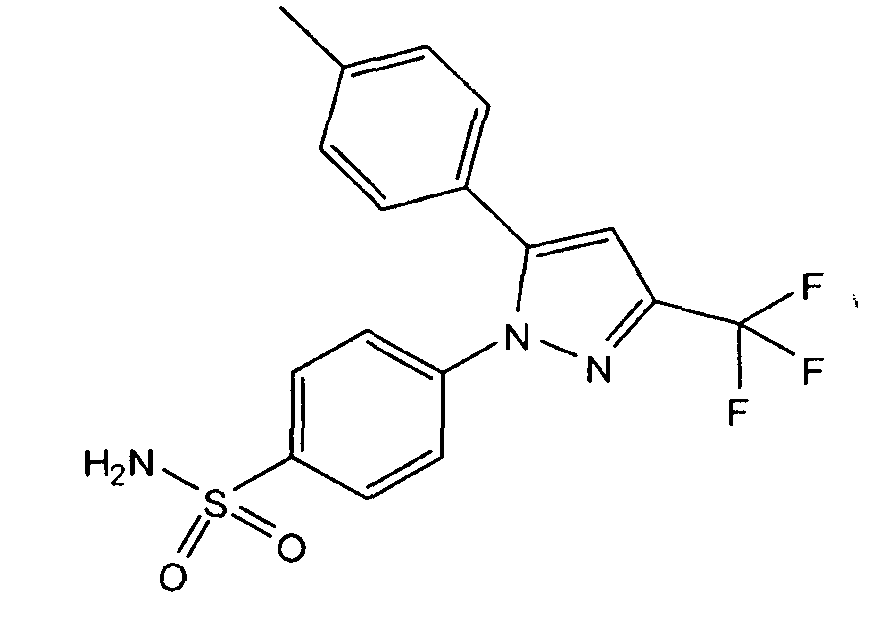
Целекоксиб представляет собой пероральный высоко селективный ингибитор циклооксигеназы-2 (COX-2), который назначают для облегчения симптомов при лечении остеоартрита, ревматоидного артрита и анкилозирующего спондилита (Goldenberg ММ. (1999). Селективный ингибитор циклооксигеназы-2 целекоксиб применяют для лечения ревматоидного артрита и остеоартрита. (Clin. Ther. 21, 1497-513). Свойство высокой селективности позволяет целекоксибу и другим ингибиторам ЦОГ-2 уменьшать воспаление (боль) при минимальных желудочно-кишечных побочных реакциях (например, язвы желудка), которые часто возникают с неселективными нестероидными противовоспалительными препаратами (НПВП).
Фермент циклооксигеназа отвечает за образование простагландинов. Выделяют две изоформы: ЦОГ-1 и ЦОГ-2. Обнаружено, что ЦОГ-2 представляет собой изоформу фермента, которая индуцируется провоспалительными стимулами, и предполагается, что ЦОГ-2 в первую очередь отвечает за синтез простаноидных медиаторов боли, воспаления и лихорадки. ЦОГ-2 также участвует в процессах овуляции, имплантации и закрытия артериального протока, регуляции функции почек и центральной нервной системы (индукция лихорадки, восприятие боли и когнитивные функции). Она также может играть важную роль в заживлении язвы. ЦОГ-2 была обнаружена в тканях, окружающих язву желудка у человека, но не установлено ее значение для заживления язвы.
Хорошо известно, что целекоксиб практически нерастворим в воде, что ставит явные ограничения на его использование в фармацевтических препаратах.
Целекоксиб представляет собой молекулу очень слабой кислоты (pKa 11,1) (http://www.medsafe. govt. nz/profs/Datasheet/c/Celebrexcap. htm), которая во всех физиологических диапазонах рН не является ионизированной формой. Этот препарат обладает высокой проницаемостью, но имеет очень низкую растворимость в воде (7 мкг/мл) (Neelam Seedher, Somm Bhatia, 2003 "Solubility enhancement of Cox-2 Inhibitors Using various Solvent Systems", AAPS Pharm.Sci. Tech, 4(3), 1 -9). Эти физико-химические свойства заставляют относить целекоксиб к классу II в системе биофармацевтической классификации (BCS) (Mehran Yazdanian, Katherine Briggs, Corinne Jankovskty, Amale Hawi, 2004, "The "High solubility" Definition of the Current FDA Guidance on Biopharmaceutical Classification System May Be Too Strict for Acidic Drugs", Pharm Res, 21 (2), 295). Следовательно, степень пероральной абсорбции целекоксиба, по-видимому, ограничена его плохой растворимостью и низкой скоростью растворения, что приводит к недостаточной растворимости в жидкостях желудочно-кишечного тракта (Susan K. Paulson, Margaret B. Vaughn, Susan M. Jessen, Yvette Lawal, Christopher J. Gresk, Bo Yan, Timothy J. Maziasz, Chyung S. Cook. Aziz Karim, 2001, "Pharmacokinetics of Celecoxib after Oral Administration in Dogs and Humans: Effect of Food Site of Absorption", J. Pharmacol. & Experim Therapeutics, 297(2), 638-645).
Продаваемая лекарственная форма для перорального введения Целебрекс (Celebrex®) содержит кристаллическую форму целекоксиба (свободная кислота) и имеет абсолютную биодоступность в диапазоне от 20 до 40% у собак с пониженной абсорбцией (Susan K. Paulson et al., 2001; см. выше). Такая малая биодоступность ограничивает распространение и доставку препарата в орган-мишень, и, следовательно, эффективность этого препарата.
Недавно опубликованная заявка PCT WO 2010/043412 в примере 4 описывает новые сокристаллы трамадола и целекоксиба, которые представляют собой сокристаллы (рац)-трамадол-HCl - целекоксиб (1:1), и в упомянутом примере 4 подробно приведены их свойства. Этот сокристалл образует очень стабильную и лекарственно-ориентированную новую химическую структурную единицу, которая обеспечивает новый способ улучшения свойств трамадола, особенно в отношении лечения боли. По сравнению с целекоксибом и трамадолом сокристаллы проявляют явный синергизм при показаниях, связанных с болью. Дополнительно, предполагается, что сокристалл может показывать (in vivo) улучшенную биодоступность для действия целекоксиба по сравнению с введением целекоксиба единственного и по сравнению с введением физической смеси целекоксиба и трамадола.
Тем не менее, в данной области пока отсутствует какая-либо конкретная описанная фармацевтическая рецептура, которая позволит демонстрировать эти преимущества или даже усилить эти преимущества упомянутого нового сокристалла в случае реального медицинского применения этого нового сокристалла, например, при его использовании лекарства для человека. Соответственно, существует потребность в рецептуре этого нового сокристалла, упомянутого в качестве примера 4 в опубликованной заявке WO 2010/043412, которая сохраняет свойства сокристалла или даже способна их улучшать.
В этой связи общей целью настоящего изобретения является получение пероральной рецептуры, содержащей сокристалл (рац)-трамадол-HCl и целекоксиб (1:1), согласно описанию WO 2010/043412, пример 4.
Желательная пероральная рецептура, будучи целью настоящего изобретения, должна сохранять сокристаллическую структуру (рац)трамадола-HCl и целекоксиба (1:1). Это свойство имеет или может иметь то преимущество, что сохраняются улучшенные свойства, остающиеся в кристаллической структуре сокристалла, и в целом сохранение кристаллических структур в пероральной рецептуре часто является весьма полезным.
Дополнительными свойствами желательной пероральной рецептуры, представляющей собой цель настоящего изобретения, которые также могут иметь достаточное преимущество, являются повышение стабильности и/или растворимости активных веществ, содержащихся в сокристалле.
Особенно желательные улучшения/преимущества рецептуры сокристалла (рац)-трамадола-HCl - целекоксиба (1:1) будут включать в себя:
- сохранение свойств и физических характеристик созданных сокристаллов,
- улучшение физико-химических свойств сокристаллов для повышения абсорбции и/или биодоступности,
- легкую доступность, простоту производства,
- возможность повышения скорости растворения, особенно при растворении в водной физиологической среде,
- модуляцию пероральной абсорбции для обоих активных веществ,
- сохранение или улучшение биодоступности трамадола и улучшение растворимости целекоксиба как такового или любой фармацевтической композиции, содержащей целекоксиб,
- одинаковое воздействие для трамадола и/или улучшение абсорбции целекоксиба как такового или любой фармацевтической композиции, содержащей трамадол или целекоксиб, соответственно,
- не зависимое от размера частиц сокристалла его существование, или
- по существу отсутствие агломератов и/или по существу сохранение отсутствия агломератов, или
при введении пациенту:
- уменьшение вариабельности содержания в крови у разных субъектов и у одного субъекта, или
- проявление хорошей скорости абсорбции (например, повышение уровня содержания в плазме или области под кривой AUC), или
- проявление высокой максимальной концентрации в плазме (например, Cmax), или
- проявление уменьшенного времени достижения пиковой концентрации препарата в плазме (tmax), или
- проявление изменения периода полувыведения соединения (t2), в зависимости от предпочтительности направления этих изменений.
Другие желательные улучшения/преимущества новой пероральной композиции будут включать эффективность (повышение эффективности) при заболеваниях или симптомах, которые присутствуют или связаны с болью и ее подтипами, в частности, при заболеваниях или симптомах, для которых недостаточно текущее лечение, например, пояснично-крестцовый радикулит или плечелопаточный периартрит, или при болях, связанных с центральной сенсибилизацией (синдром центральной боли).
Наиболее желательные новые лекарственно-ориентированные формы должны сочетать более одного и большинство из указанных преимуществ.
Эта цель была достигнута путем получения (пероральной) фармацевтической композиции, содержащей сокристалл (рац)-трамадол-HCl - целекоксиб (1:1) и по меньшей мере один усилитель растворимости полимера. Предпочтительно такая фармацевтическая композиция будет содержать сокристалл (рац)-трамадол-HCl - целекоксиб (1:1) в количестве от 10 до 50% вес., предпочтительно от 15 до 40% вес., наиболее предпочтительно от 20 до 30% вес.
Как более подробно показано в экспериментальной части описания, в одном из примеров (пероральная) фармацевтическая композиция согласно изобретению проявляет одинаковое действие трамадола и в то же время может модулировать пиковые концентрации трамадола в сторону уменьшения значений по сравнению с коммерческим продуктом трамадола Адолонта (Adolonta®), тем самым обеспечивая эффективность при одновременном снижении побочных эффектов. В отношении целекоксиба (пероральная) фармацевтическая композиция согласно изобретению также проявляет увеличенную абсорбцию, что приводит к улучшению биодоступности.
"Полимер - усилитель растворимости" относится к полимерам, способным улучшать систему пероральной доставки плохо растворимого активного вещества (например, целекоксиба). Примеры включают в себя привитой сополимер поливинилкапролактам - поливинилацетат - полиэтиленгликоль, коповидон или циклодекстрин. Полимером - усилителем растворимости можно считать такие полимеры, включение которых в рецептуру приводит к высвобождению вещества, имеющего коэффициент растворения >1 по сравнению с рецептурой, не содержащей какого-либо из упомянутых примеров (см. пример 1 и фиг. 1 и 2.). В общем, функция "полимера - усилителя растворимости" определяется его названием и состоит в повышении растворимости, в особенности перорально вводимых лекарств. Это понятие является общеупотребимым и понятным в данной области (см., например, публикацию под заголовком (и соответствующий реферат) авторов Kim and Park, американский журнал Drug Delivery, Vol. 2, № 2, (2004) стр. 113-130 (18).
Соотношение (1:1), указанное в изобретении, означает, что молекулярное соотношение (рац)-трамадола - HCl и целекоксиба в сокристалле составляет 1:1.
В фармацевтической композиция по изобретению преимущественно сохранена структура сокристалла в рецептуре и при растворении в ней повышается скорость высвобождения целекоксиба и/или трамадола по сравнению с сокристаллом единственным. Очевидно, что это представляет собой увеличение биодоступности по сравнению с очищенным лекарственным сырьем целекоксиба и трамадола и с препаратами сравнения. Также рецептура сокристалла (рац)-трамадола-HCl - целекоксиба (1:1) имеет повышенную стабильность.
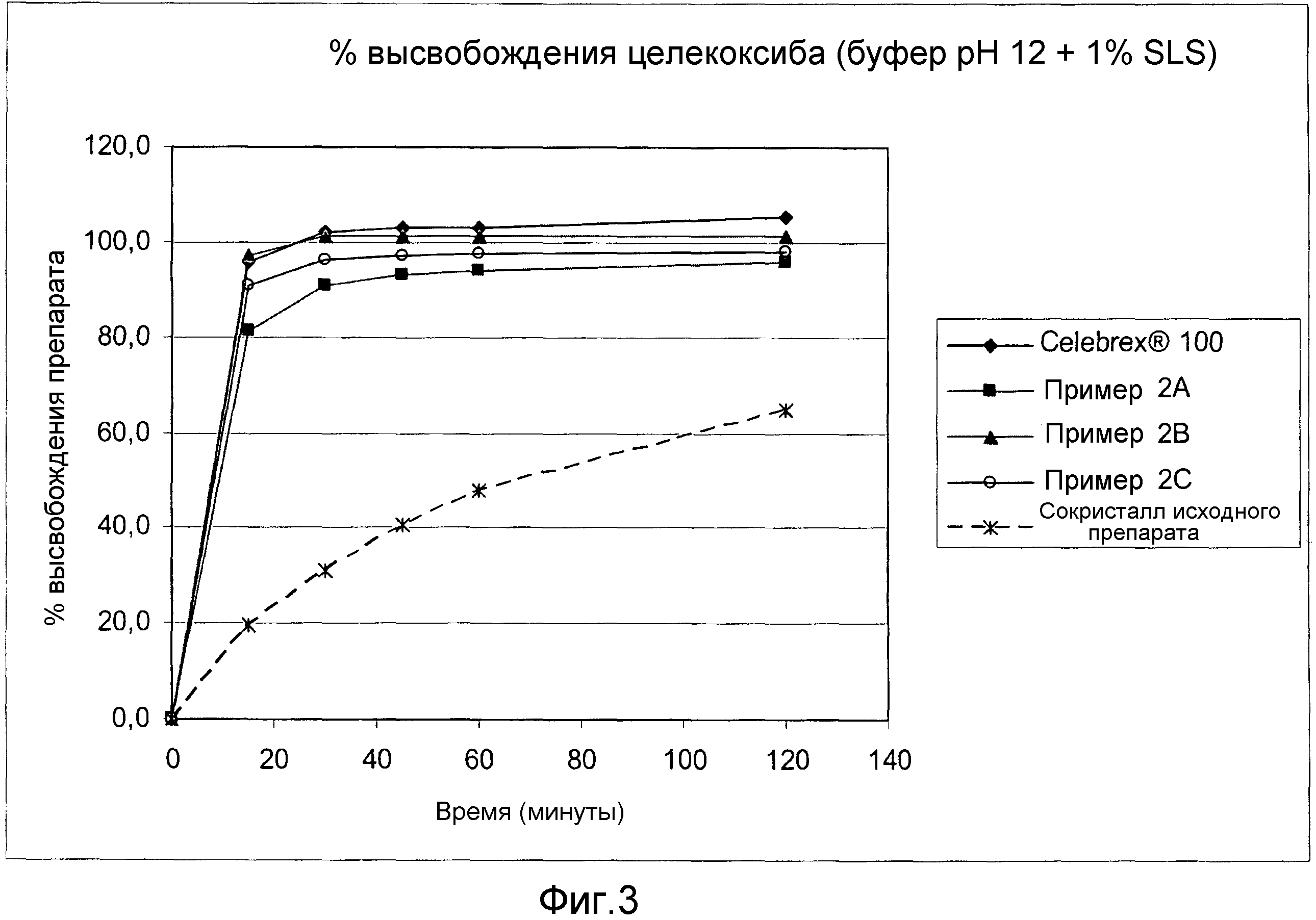
В предпочтительном варианте осуществления процентная доля сокристалла (рац)-трамадола-HCl - целекоксиба (1:1) из фармацевтической композиции согласно изобретению, растворенная в физиологической жидкости или в жидкости, имитирующей физиологические жидкости (например, 0,1 N раствор HCl с 2% SLS (лаурилсульфат натрия), или в буферном растворе с уровнем рН 12 с 1% SLS), в частности, особенно в щелочной жидкости, в течение первых 30 минут будет составлять более чем 85% и/или в течение первых 45 минут будет составлять более чем 90% (например, в тесте USP на растворимость с лопастью-мешалкой).
В предпочтительном варианте осуществления "полимеры - усилители растворимости" выбирают из следующего: привитой сополимер капролактам-поливинилацетат - полиэтиленгликоль (Soluplus® (Солюплюс)) или другие гидрофильные полимеры, такие как коповидон (сополимер 1-винил-2-пирролидона и винилацетата; Kollidon® VA 64 (Коллидон)), повидон, полоксамеры (неионные сополимеры полиоксиэтилена-полиоксипропилена, например, p.ex Lutrol® (Лутрол)), циклодекстрин (Kleptose® (Клептоза)), полиэтиленгликоль и его производные (ПЭГ) и глицерилбегенат (Gelucire® (Гелуцир)), или выбирают из привитого сополимера поливинилкапролактам - поливинилацетат - полиэтиленгликоль (Soluplus®) или других гидрофильных полимеров, таких как коповидон (сополимер 1-винил-2-пирролидона и винилацетата; Kollidon® VA 64), повидон, полоксамеры (неионные сополимеры полиоксиэтилена-полиоксипропилена р.ex Lutrol®), циклодекстрин (Kleptose®), полиэтиленгликоля и его производных (ПЭГ) и лауроил макрогол-32 глицеридов EP (Gelucire 44/14®). Предпочтительно, "полимеры - усилители растворимости" выбирают из следующего: привитой сополимер капролактам - поливинилацетат - полиэтиленгликоль (Soluplus®) или другие гидрофильные полимеры, выбираемые из коповидона (сополимер 1-винил-2-пирролидона и винилацетата; Kollidon® VA 64), повидона или полоксамеров (неионные сополимеры полиоксиэтилена-полиоксипропилена, например, p.ex Lutrol®) или из подобных вышеперечисленным, или выбирают из привитого сополимера поливинилкапролактам - поливинилацетат - полиэтиленгликоль (Soluplus®) или других гидрофильных полимеров, выбираемых из коповидона (сополимеры 1-винил-2-пирролидона и винилацетата; Kollidon® VA 64), повидона или полоксамеров (неионные сополимеры полиоксиэтилена -полиоксипропилена, например, p.ex Lutrol®), или подобных вышеперечисленным. Наилучшие результаты были получены с Soluplus® и коповидоном (Kollidon® VA 64).
Соответственно, в одном из предпочтительных вариантов осуществления фармацевтической композиции согласно изобретению полимер - усилитель растворимости выбирают из привитого сополимера поливинилкапролактам - поливинилацетат - полиэтиленгликоль или других гидрофильных полимеров, таких как коповидон, повидон, полоксамеры, циклодекстрин, полиэтиленгликоль и лауроил макрогол-32 глицериды EP, и предпочтительно выбирают из привитого сополимера поливинилкапролактам - поливинилацетат - полиэтиленгликоль или других гидрофильных полимеров, выбираемых из коповидона, повидона или полоксамеров. В другом варианте осуществления фармацевтической композиции по изобретению полимер - усилитель растворимости выбирают из привитого сополимера капролактам - поливинилацетат - полиэтиленгликоль или других гидрофильных полимеров, таких как коповидон, повидон, полоксамеры, циклодекстрин, полиэтиленгликоль и глицерилбегенат, и предпочтительно выбирают из привитого сополимера капролактам - поливинилацетат - полиэтиленгликоль или других гидрофильных полимеров, выбираемых из коповидона, повидона или полоксамеров, или подобных вышеперечисленным.
В очень предпочтительном варианте осуществления фармацевтической композиции по изобретению полимер - усилитель растворимости представляет собой привитой сополимер поливинилкапролактам - поливинилацетат - полиэтиленгликоль (Soluplus®). В другом варианте осуществления фармацевтической композиции по изобретению полимер - усилитель растворимости представляет собой привитой сополимер капролактам - поливинилацетат - полиэтиленгликоль (Soluplus®).
Soluplus® (зарегистрированная торговая марка BASF Corporation) представляет собой привитой сополимер поливинилкапролактам - поливинилацетат - полиэтиленгликоль.
В другом очень предпочтительном варианте фармацевтической композиции согласно изобретению полимером - усилителем растворимости является коповидон.
Коповидон представляет собой сополимер 1-винил-2-пирролидона и винилацетата. Коммерческим продуктом в качестве примера является Kollidon® VA 64 (зарегистрированный товарный знак компании BASF Corporation). Kollidon® VA 64 (коповидон) представляет собой сополимер винилпирролидона-винилацетата, который растворим в воде и спирте. Соотношение винилпирролидон:винилацетат в сополимере составляет 6:4. Этот полимер является высоко гидрофильным, что приводит к более сильному увлажнению сокристалла трамадола и целекоксиба и к улучшению растворимости препарата.
Количество полимера - усилителя растворимости, используемого в фармацевтической композиции согласно изобретению, находится в диапазоне от 2 до 50% вес., предпочтительно от 8 до 12% вес. По видимому, нет заметного увеличения в скорости высвобождения целекоксиба при повышении уровня содержания в фармацевтической композиции согласно изобретению полимера - усилителя растворимости в пределах 8-12% вес. Поэтому, с учетом этих результатов, предпочтительный уровень содержания полимера - усилителя растворимости будет составлять около 8% вес.
Соответственно, в предпочтительном варианте осуществления фармацевтической композиции по изобретению содержание полимера - усилителя растворимости, используемого в рецептуре согласно изобретению, находится в пределах от 2 до 50% вес., предпочтительно от 8 до 12% вес. или около 8% вес.
Можно создавать рецептуру сокристалла (рац)-трамадола-HCl - целекоксиба (1:1) в виде таблеток, полученных способом прямой компрессии, который хорошо известен в данной области. Это наиболее подходящая технология производства, поскольку она является менее агрессивной по отношению к структуре сокристалла, по-видимому, показывает наилучшие результаты по улучшению растворимости, а также представляет собой самый экономичный способ, по меньшей мере один из самых экономичных способов производства. Кроме того, рецептуру сокристаллов (рац)-трамадола-HCl - целекоксиба (1:1) можно создавать в виде порошковых капсул, сухого гранулята, суспензий и способом сухого вальцевания.
В другом предпочтительном варианте осуществления форму фармацевтической композиции согласно изобретению выбирают из таблетки, порошковой капсулы, или композицию создают путем сухого гранулирования, суспендирования и сухого вальцевания, предпочтительно, в таблетированном виде, и наиболее предпочтительно, в виде таблетки, производимой способом прямого прессования.
Соответственно, в другом предпочтительном варианте осуществления фармацевтическую композицию согласно изобретению делают в таблетированной форме, содержащей сокристалл (рац)-трамадола-HCl - целекоксиба (1:1) и по меньшей мере один полимер - усилитель растворимости, и упомянутую таблетку получают способом прямого прессования.
Параллельный аспект изобретения относится к (пероральной) фармацевтической композиции в виде таблетки, содержащей сокристалл (рац)-трамадола-HCl - целекоксиба (1:1), которую получают способом прямого прессования, и упомянутая таблетка предпочтительно содержит по меньшей мере один полимер - усилитель растворимости (как указано выше), или перед прямым прессованием изготовляют смесь, для чего перед воздействием прямого прессования эту композицию наиболее предпочтительно смешивают по меньшей мере с одним полимером - усилителем растворимости. Фармацевтическая композиция предпочтительно будет содержать сокристалл (рац)-трамадола-HCl - целекоксиба (1:1) в количестве от 10 до 50% вес., предпочтительно от 15 до 40% вес., наиболее предпочтительно от 20 до 30% вес.
С целью повышения растворимости целекоксиба сокристалл (рац)-трамадола-HCl - целекоксиба (1:1) можно смешивать (например, с полимером - усилителем растворимости) и осуществлять прямое прессование по меньшей мере с одним полимером - усилителем растворимости. В таблетках, изготовленных способами прямого прессования или смешивания/прямого прессования, улучшено высвобождение целекоксиба. Таким образом, способ прямого прессования рекомендован по экономическим соображениям и для предотвращения возможных структурных изменений сокристалла.
В некоторых предпочтительных вариантах осуществления, рассматривающих прямое прессование, сила сжатия, прикладываемая в ходе прямого прессования, может составлять от 0,5 кН до 75 кН.
Поверхностно-активные вещества (или полимеры - сурфактанты) могут способствовать повышению растворимости препарата. Сурфактанты можно выбирать из анионных, катионных или нейтральных веществ. Выбирают следующие сурфактанты/полимеры: лаурилсульфат натрия (SLS), Sepitrap 80® (микроинкапсулированный полисорбат 80) и Sepitrap 4000® (микроинкапсулированный полиоксил 40 - гидрогенизированное касторовое масло). Предпочтительно фармацевтическая композиция по изобретению будет содержать сурфактант/сурфактанты в количестве от 1 до 20% вес., предпочтительно от 2 до 15% вес., наиболее предпочтительно от 3 до 10% вес.
В другом предпочтительном варианте осуществления фармацевтическая композиция по изобретению, содержащая сокристалл (рац)-трамадола-HCl - целекоксиба (1:1), дополнительно содержит по меньшей мере один сурфактант, предпочтительно, сурфактант - полимер, выбираемый из микроинкапсулированного полисорбата 80, микроинкапсулированного полиоксила 40 - гидрогенизированного касторового масла и лаурилсульфата натрия. В таких предпочтительных вариантах осуществления фармацевтическая композиция по изобретению, содержащая сокристалл (рац)-трамадола-HCl - целекоксиба (1:1) и по меньшей мере один полимер - усилитель растворимости, которую получают способом прямого прессования, дополнительно содержит по меньшей мере один сурфактант, предпочтительно полимер - сурфактант, выбираемый из микроинкапсулированного полисорбата 80, микроинкапсулированного полиоксила 40 - гидрогенизированного касторового масла и лаурилсульфата натрия.
Для способа прямого прессования необходимы подходящие реологические параметры и подходящая сжимаемость создаваемой смеси, а также подходящая однородность смеси для обеспечения правильного дозирования и надлежащей производительности в промышленных масштабах. Обычными ингредиентами рецептуры таблеток являются наполнители. При выборе наполнителя необходимо учитывать деформационное поведение наполнителя и реологические свойства. Для получения сбалансированной формулы используют сыпучие совместно обрабатываемые наполнители, специально предназначенные для прямого прессования, общеизвестные наполнители со свойствами пластической деформации. Кроме того, также необходимо учитывать растворимость наполнителей в воде, что будет способствовать хорошей дезинтеграции таблетки и быстрому растворению активного фармацевтического ингредиента (API). Растворимые наполнители выбирают из семейства сахаров, таких как ксилит, сорбит, изомальт, эритрит, сахароза, фруктоза, глюкоза, и наиболее предпочтительным является высушенный распылением маннит и семейство лактозы; для создания рецептуры сокристалла используют в качестве нерастворимого наполнителя фосфат кальция, карбонат кальция и наиболее предпочтительно микрокристаллическую целлюлозу (МСС): MCC 102 (90 мкм) и MCC 200 (200 мкм) или такие соединения, как силикатизированная микрокристаллическая целлюлоза или Prosolv® Easytab (композит, содержащий микрокристаллическую целлюлозу, коллоидный диоксид кремния, крахмал натрия и стеарилфумарат натрия) или Prosolv SMCC (композит силикатизированной микрокристаллической целлюлозы).
Выбранные для примеров наполнители представляют собой высушенный распылением маннит и микрокристаллическую целлюлозу, которые являются наполнителями с хорошей текучестью.
Скользящие вещества (лубриканты-наполнители) можно вводить в рецептуру в целях оптимизации реологических свойств рецептуры и предотвращения адгезии пробивных штампов во время компрессии. Скользящие вещества можно выбирать из стеарилфумарата, магния стеарата, талька, гидрофильного коллоидного диоксида кремния (Aerosil® 200). Выбранными для примеров скользящими веществами являются стеарилфумарат и тальк.
Дезинтегрирующее вещество можно вводить в рецептуру для облегчения разрушения таблетки в водной среде на более мелкие фрагменты, способствуя тем самым более быстрому высвобождению лекарственной субстанции. Дезинтегрирующее вещество может действовать посредством трех основных механизмов: набухания, капиллярного пропитывания и деформации. Дезинтегрирующее вещество можно выбирать из кросповидона, натрия кроскармелозы, натрия крахмала гликолята, предварительно желатинизированного крахмала, крахмала, полакрилина калия, гидроксипропилцеллюлозы с низкой степенью замещения (L-HPC), кальция карбоксиметилцеллюлозы, альгиновой кислоты. Выбранным для примеров дезинтегрирующим веществом является кросповидон.
Таким образом, в предпочтительном варианте осуществления фармацевтической композиции по изобретению эта композиция содержит по меньшей мере один дополнительный фармацевтически приемлемый наполнитель, такой как наполнитель, дезинтегрирующее вещество и/или скользящее вещество.
В предпочтительном варианте осуществления фармацевтической композиции по изобретению наполнитель выбирают из сахаров, таких как ксилит, сорбит, изомальт, эритрит, сахароза, фруктоза, декстроза, и наиболее предпочтительными являются высушенный распылением маннит и семейство лактозы, или из нерастворимых наполнителей, таких как кальция фосфат, кальция карбонат или микрокристаллическая целлюлоза, например, MCC 102 (90 мкм) и MCC 200 (200 мкм) или из других соединений, таких как силикатизированная микрокристаллическая целлюлоза или композиции, содержащие микрокристаллическую целлюлозу, коллоидный диоксид кремния, крахмал натрия и стеарилфумарат натрия, предпочтительно выбирают из сахаров, таких как ксилит, сорбит, изомальт, эритрит, сахароза, фруктоза, декстроза, при этом наиболее предпочтительными являются высушенный распылением маннит и семейство лактозы, или выбирают из микрокристаллической целлюлозы, и наиболее предпочтительно выбирают из высушенного распылением маннита и микрокристаллической целлюлозы. Предпочтительное содержание наполнителя/наполнителей в фармацевтической композиции по изобретению выбирают в диапазоне от 20 до 80% вес., предпочтительно от 30 до 70% вес. или от 40 до 60% вес.
В предпочтительном варианте осуществления фармацевтической композиции согласно изобретению скользящее вещество выбирают из стеарилфумарата, магния стеарата, талька, гидрофильного коллоидного диоксида кремния (например, Aerosil® 200), и предпочтительно выбирают из стеарилфумарата и талька. Содержание скользящего вещества/веществ в фармацевтической композиции по изобретению предпочтительно будет составлять от 0,5 до 10% вес., предпочтительно от 1 до 5% вес.
В предпочтительном варианте осуществления фармацевтической композиции по изобретению дезинтегрирующее вещество выбирают из кросповидона, натрия кроскармелозы, натрия крахмала гликолята, предварительно желатинизированного крахмала, крахмала, полакрилина калия, гидроксипропилцеллюлозы с низкой степенью замещения (L-HPC), кальция карбоксиметилцеллюлозы, альгиновой кислоты, предпочтительно, кросповидона. Содержание дезинтегрирующего вещества в фармацевтической композиции по изобретению предпочтительно будет составлять от 1 до 20% вес., предпочтительно от 2 до 15% вес., наиболее предпочтительно от 3 до 10% вес.
Наиболее предпочтительно сокристалл (рац)-трамадола-HCl и целекоксиба (1:1), который содержится в (пероральной) фармацевтической композиции по изобретению, представляет собой сокристалл (рац)-трамадола-HCl и целекоксиба (1:1), описание и свойства которого (а также примеры получения) приведены в примере 4 заявки WO 2010/043412.
Таким образом, в наиболее предпочтительном варианте осуществления фармацевтической композиции по изобретению сокристалл (рац)-трамадола-HCl и целекоксиба (1:1), содержащийся в (пероральной) фармацевтической композиции, проявляет характер рентгеновской порошковой дифракции с пиками [2Θ] при 7,1, 9,3, 10,2, 10,7, 13,6, 13,9, 14,1, 15,5, 16,1, 16,2, 16,8, 17,5, 18,0, 19,0, 19,5, 19,9, 20,5, 21,2, 21,3, 21,4, 21,8, 22,1, 22,6, 22,7, 23,6, 24,1, 24,4, 25,2, 26,1, 26,6, 26,8, 27,4, 27,9, 28,1, 29,1, 29,9, 30,1, 31,1, 31,3, 31,7, 32,5, 32,8, 34,4, 35,0, 35,8, 36,2 и 37,2 [°]. Значения 2Θ были получены с использованием медного излучения (CuKa1 1,54060Å).
Дополнительно в наиболее предпочтительном варианте осуществления фармацевтической композиции по изобретению сокристалл (рац)-трамадола-HCl и целекоксиба (1:1), содержащийся в (пероральной) фармацевтической композиции, показывает полосы абсорбции в инфракрасном спектре с преобразованием Фурье при 3481,6 (m), 3133,5 (m), 2923,0 (m), 2667,7 (m), 1596,0 (m), 1472,4 (m), 1458,0 (m), 1335,1 (m), 1288,7 (m), 1271,8 (m), 1168,7 (s), 1237,3 (m), 1168,7 (s), 1122,6 (s), 1100,9 (m), 1042,2 (m), 976,8 (m), 844,6 (m), 820,1 (m), 786,5 (m) 625,9 (m) см-1.
Дополнительно в наиболее предпочтительном варианте осуществления фармацевтической композиции по изобретению сокристалл (рац)-трамадола-HCl и целекоксиба (1:1), содержащийся в (пероральной) фармацевтической композиции, имеет ромбические элементарные ячейки со следующими размерами:
а=11,0323 (7) Å
b=18,1095 (12) Å
с=17,3206 (12) Å
Дополнительно в наиболее предпочтительном варианте осуществления фармацевтической композиции по изобретению сокристалл (рац)-трамадола-HCl и целекоксиба (1:1), содержащийся в (пероральной) фармацевтической композиции, показывает эндотермический острый пик сокристалла, соответствующий температуре плавления, начинается в точке 164°C.
Другой вариант осуществления настоящего изобретения относится к способу производства пероральной фармацевтической композиции согласно изобретению, как описано выше, и указанный способ содержит следующие этапы:
(a) смешивание сокристалла (рац)-трамадола-HCl - целекоксиба (1:1) (как описано, например, в примере 4 из WO 2010/043412), по меньшей мере с одним полимером - усилителем растворимости и, необязательно, с одним или больше наполнителем, дезинтегрирующим веществом или полимером - сурфактантом, или с любой их комбинацией;
(b) необязательно добавление по меньшей мере одного скользящего вещества;
(c) прямое прессование таблеток из смеси, полученной на этапе (а) или из смеси с добавлением скользящего вещества из этапа (b).
В предпочтительном варианте осуществления способа согласно изобретению в смесь из этапа (а) подмешивают наполнитель.
Фармацевтические композиции согласно настоящему изобретению полезны для лечении боли, предпочтительно острой боли, хронической боли, нейропатической боли, ноцицептивной боли (висцеральной и/или соматической боли), боли от легкой и умеренной до тяжелой, гипералгезии, боли, связанной с центральной сенсибилизацией, аллодинии или боли при раке, в том числе боли при диабетической нейропатии и диабетической периферической нейропатии и остеоартрите, фибромиалгии, ревматоидном артрите, анкилозирующем спондилите, плечелопаточном периартрите или пояснично-крестцовом радикулите.
Таким образом, еще в одном аспекте изобретение также относится к фармацевтической композиции согласно настоящему изобретению, содержащей сокристалл (рац)-трамадола-HCl и целекоксиба (1:1) для лечения боли, предпочтительно острой боли, хронической боли, нейропатической боли, ноцицептивной боли (висцеральной и/или соматической боли), боли от легкой и умеренной до тяжелой, гипералгезии, боли, связанной с центральной сенсибилизацией, аллодинии или боли при раке, в том числе боли при диабетической нейропатии и диабетической периферической нейропатии и остеоартрита, фибромиалгии, ревматоидном артрите, анкилозирующем спондилите, плечелопаточном периартрите или пояснично-крестцовом радикулите. В другом аспекте изобретение также относится к использованию фармацевтической композиции по настоящему изобретению, содержащей сокристалл (рац)-трамадола-HCl и целекоксиба (1:1), в производстве лекарственного средства для лечения боли, предпочтительно острой боли, хронической боли, нейропатической боли, ноцицептивной боли (висцеральной и/или соматической боли), боли от легкой и умеренной до тяжелой, гипералгезии, боли, связанной с центральной сенсибилизацией, аллодинии или боли при раке, в том числе боли при диабетической нейропатии и диабетической периферической нейропатии и остеоартрита, фибромиалгии; ревматоидном артрите, анкилозирующем спондилите, плечелопаточном периартрите или пояснично-крестцовом радикулите. В дополнительном аспекте изобретение также относится к способу лечения боли, предпочтительно острой боли, хронической боли, нейропатической боли, ноцицептивной боли (висцеральной и/или соматической боли), боли от легкой и умеренной до тяжелой, гипералгезии, боли, связанной с центральной сенсибилизациией, аллодинии или боли при раке, в том числе боли при диабетической нейропатии и диабетической периферической нейропатии и остеоартрите, фибромиалгии; ревматоидном артрите, анкилозирующем спондилите, плечелопаточном периартрите или пояснично-крестцовом радикулите, посредством введения нуждающемуся в этом пациенту достаточного количества сокристалла путем применения фармацевтической композиции согласно изобретению, как описано выше.
По определению Международной ассоциации по изучению боли (IASP) "боль" представляет собой "неприятное сенсорное и эмоциональное переживание, связанное с реальным или потенциальным повреждением ткани или описываемое в терминах такого повреждения (IASP, классификация хронических болей, 2-е издание, IASP Press (2002), 210). Несмотря на то, что боль всегда субъективна, ее причины или синдромы могут быть классифицированы. По одной классификации для обозначения подтипов боли общий болевой синдром разделяют на подтипы острой и хронической боли или, в зависимости от интенсивности боли, на легкую, умеренную и сильную боль. В других терминах общий болевой синдром также разделяют на "ноцицептивную" боль (связанную с активацией ноцицепторов), "нейропатическую" (вызванную повреждением или нарушением функции нервной системы) и боль, связанную с центральной сенсибилизацией (центральный болевой синдром).
В соответствии с определением IASP "аллодиния" представляет собой "боль, обусловленную стимулом, который обычно не вызывает боли" (IASP, классификация хронических болей, 2-е издание, IASP Press (2002), 210). Несмотря на то, что симптомы аллодинии вероятно ассоциируются с симптомами нейропатической боли, это не является обязательным, поскольку встречаются симптомы аллодинии, не связанные с нейропатической болью, хотя в некоторых районах аллодиния распространена шире, чем нейропатическая боль.
Дополнительно IASP отмечает следующие различия между "аллодинией", "гипералгезией» и «гиперпатией" (IASP, классификация хронических болей, 2-е издание, IASP Press (2002), 212):
|
В соответствии с определением IASP "нейропатией" называют "первичное поражение или дисфункцию нервной системы" (IASP, классификация хронических болей, 2-е издание, IASP Press (2002), 211). Нейропатическая боль может иметь центральное или периферическое происхождение.
"Ишиалгия (пояснично-крестцовый радикулит)" или "неврит седалищного нерва" означает в изобретении набор симптомов, включающих в себя боль, обусловленную раздражением седалищного нерва или его корешков.
"Плечелопаточный периартрит" или "адгезивный капсулит" означает в изобретении симптом, при котором соединительная ткань, окружающая плечевой сустав или непосредственно плечевую капсулу, вызывает хронические боли при воспалении и возникновении тугоподвижности сустава.
"Анкилозирующий спондилит" или "болезнь Бехтерева" является хроническим воспалительным артритом и аутоиммунным заболеванием. При этом в основном поражаются суставы позвоночника и крестцово-подвздошное сочленение в области таза, что приводит к возможному сращению позвоночника.
"Боли, связанные с центральной сенсибилизацией"/"центральный болевой синдром", в настоящей заявке означают неврологическое состояние, вызванное повреждением или дисфункцией центральной нервной системы (ЦНС), которая включает в себя мозг, ствол мозга и спинной мозг. Этот синдром может быть вызван inter alia инсультом, рассеянным склерозом, опухолями, эпилепсией, травмой головного или спинного мозга или болезнью Паркинсона.
"Ноцицептивной болью" называют вид боли, вызванной активацией ноцицепторов. Этот вид боли можно разделить на соматическую и висцеральную боли. "Висцеральная боль" представляет собой боль, обычно возникающую в органах, тогда как "(глубокая) соматическая боль" локализуется в связках, сухожилиях, костях, кровеносных сосудах, фасциях и мышцах.
Суточная доза для применения у человека и животных в отношении использования фармацевтической композиции согласно изобретению может варьировать в зависимости от факторов, которые основаны на принадлежности к соответствующему виду, или от других факторов, таких как возраст, пол, вес и степень тяжести болезни и так далее. Суточная доза для человека предпочтительно составляет от 20 до 1000 мг, предпочтительно от 50 до 250 миллиграммов сокристалла (рац)-трамадола-HCl и целекоксиба (1:1), содержащихся в фармацевтической композиции по изобретению, которую можно вводить в течение одного или несколько приемов в день. В предпочтительном варианте осуществления лекарственная форма фармацевтической композиции по изобретению (например, таблетка) содержит от 50 до 250 (или от 100 до 150) мг сокристалла (рац)-трамадола-HCl и целекоксиба (1:1).
Применение фармацевтической композиции по изобретению (описанной выше) или соответствующего способа лечения предпочтительно связано с болью, в том числе с ноцицептивной болью (в том числе с соматической и висцеральной болью). Эти предпочтительные варианты осуществления изобретения также могут быть связаны с нейропатической болью и/или с болью, обусловленной центральной сенсибилизацией (так называемый "центральный болевой синдром»).
Применение фармацевтической композиции по изобретению (описанной выше) или соответствующего способа лечения предпочтительно также может быть связано с острой и хронической болью.
Применения фармацевтической композиции по изобретению (описанной выше) или соответствующего способа лечения, предпочтительно могут быть также связаны с болью от легкой до умеренной и сильной болью.
Далее настоящее изобретение показано с помощью следующих чертежей и примеров. Этот иллюстративный материал приведен исключительно в качестве примеров и не ограничивает объем изобретения.
Краткое описание чертежей:
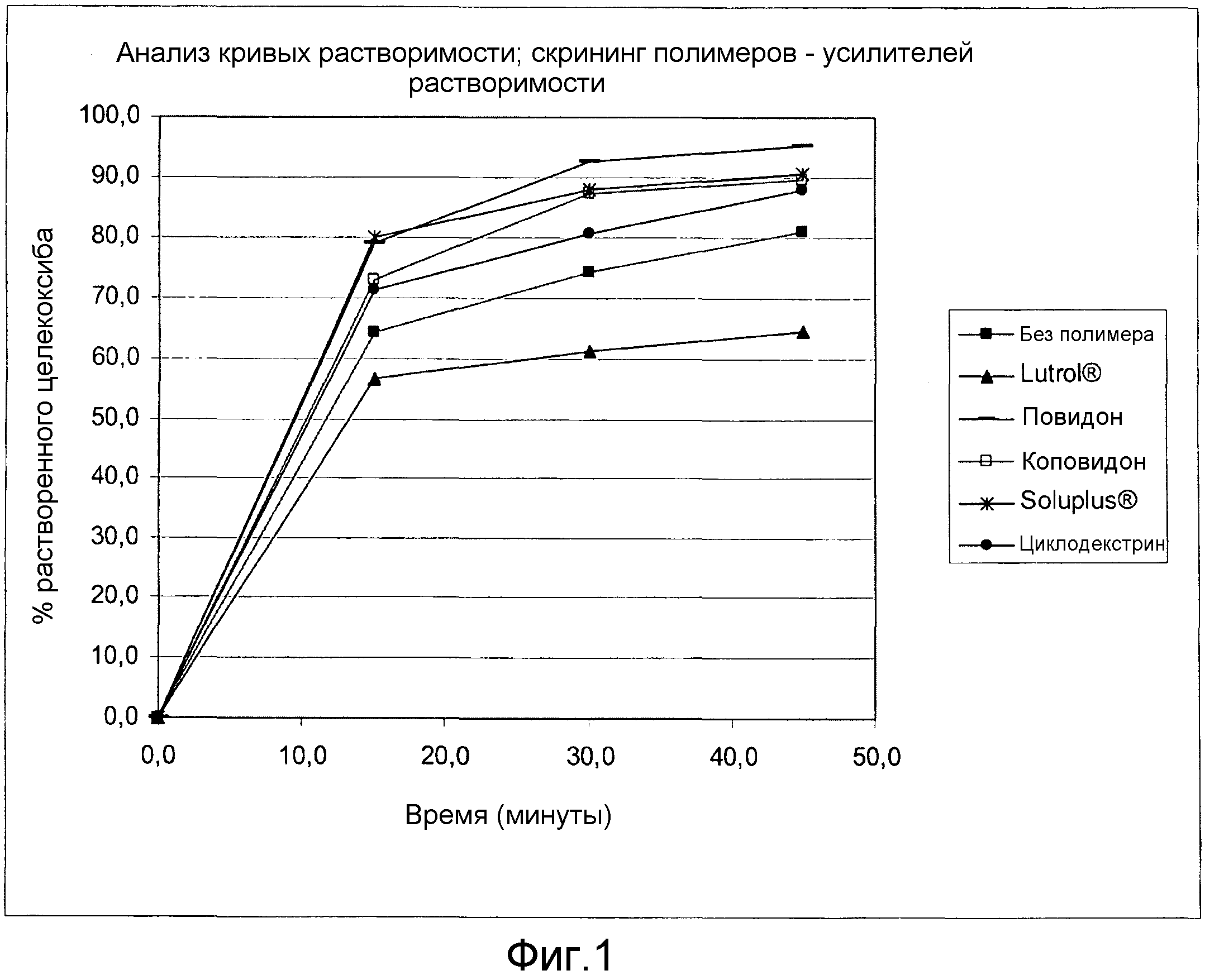
Фиг. 1:
Скрининговое исследование полимеров - усилителей растворимости. Сравнительные данные растворимости in vitro.
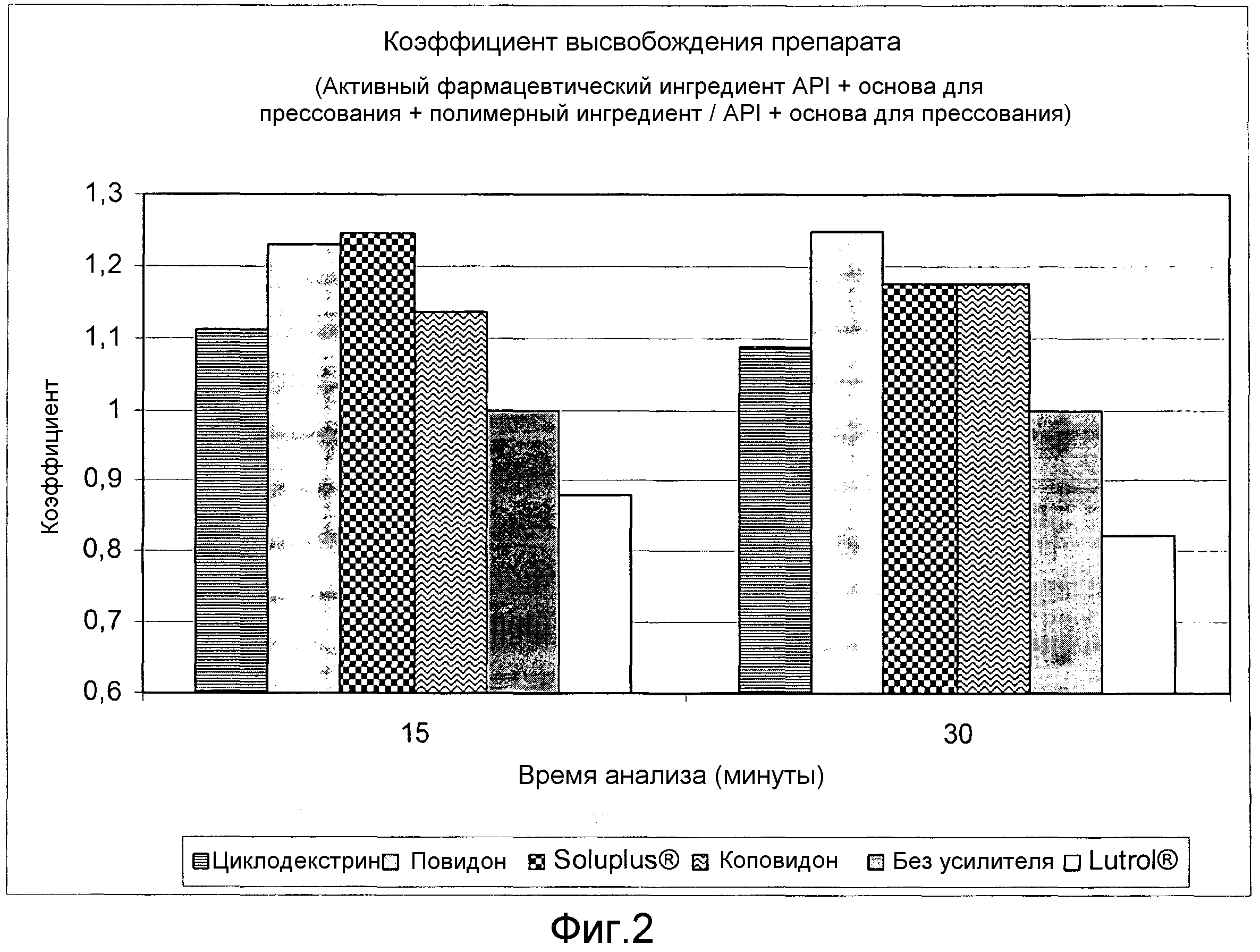
Фиг. 2:
Скрининговое исследование полимеров - усилителей растворимости. Коэффициент высвобождения лекарственного вещества.
Фиг. 3:
Сравнительные данные растворимости in vitro (буферный раствор рН 12 + 1% SLS (лаурилсульфат натрия)).
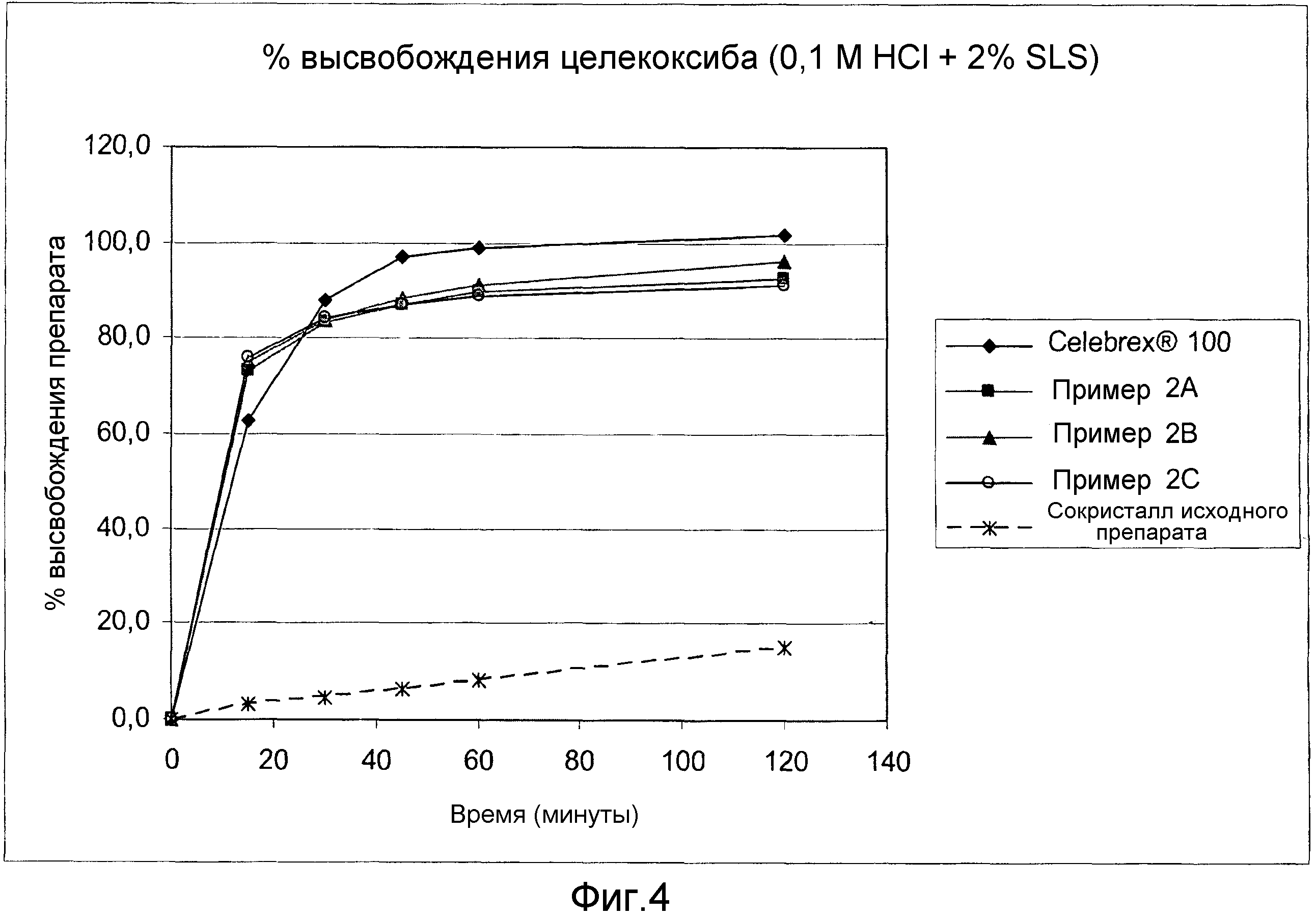
Фиг. 4:
Сравнительные данные растворимости in vitro (0,1 N раствор HCl + 2% SLS (лаурилсульфат натрия)).
Фиг. 5:
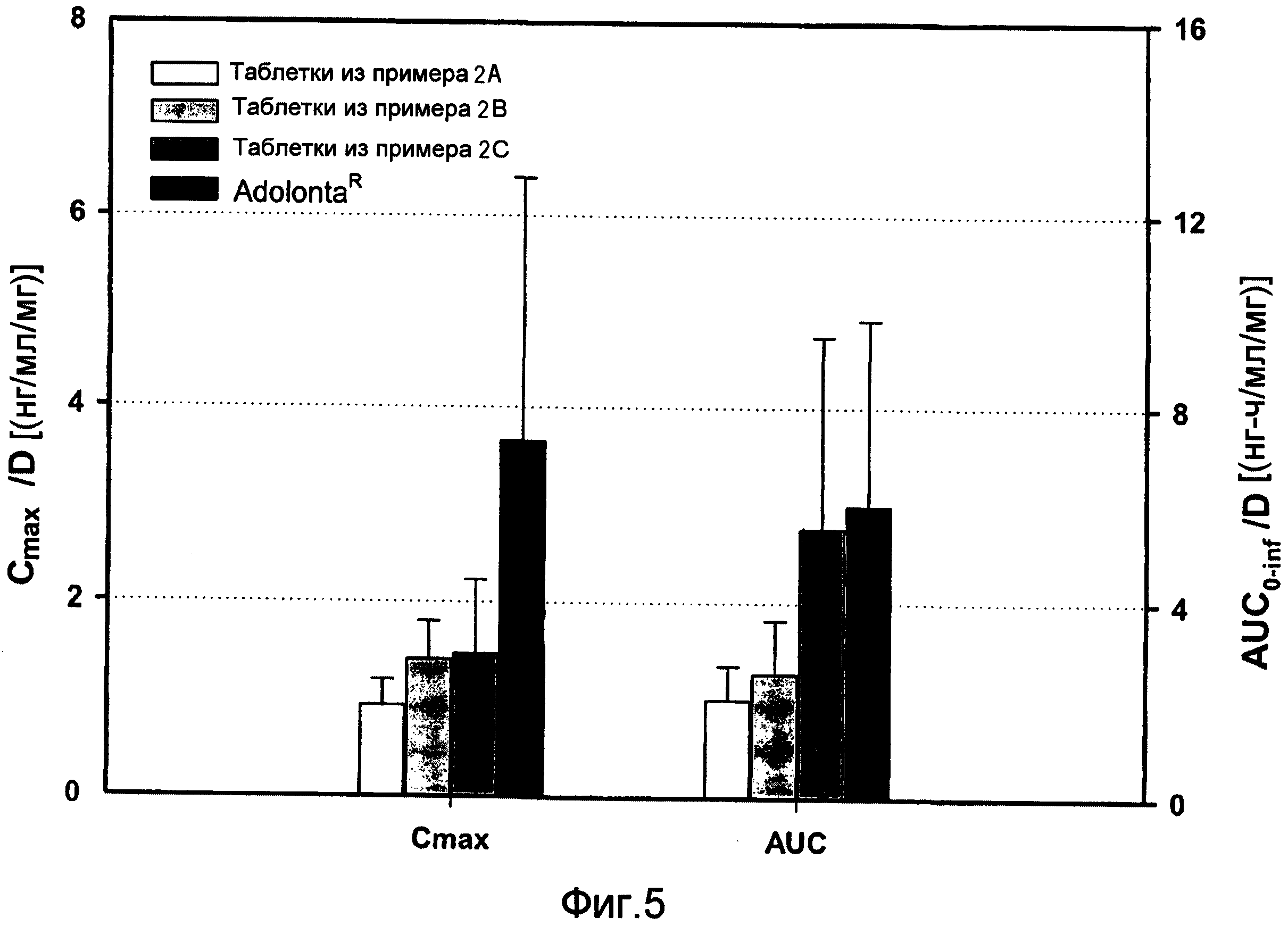
Сравнительные фармакокинетические параметры трамадола (Cmax и AUC) в трех рецептурах (рац)-трамадола - целекоксиба (1:1) и коммерческие доступные рецептуры.
Фиг. 6:
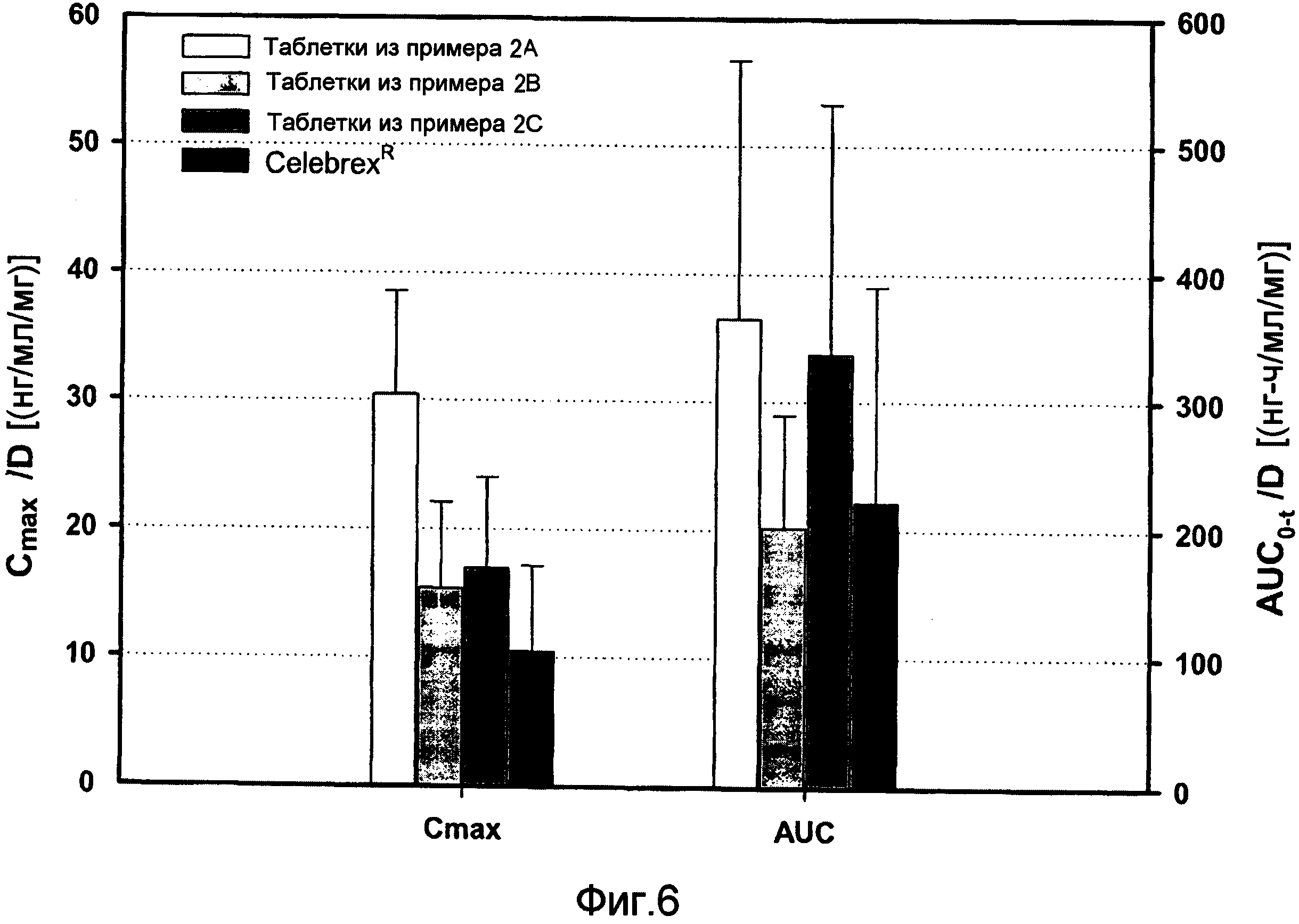
Сравнительные фармакокинетические параметры целекоксиба (Cmax и AUC) в трех рецептурах (рац)-трамадола - целекоксиба (1:1) и коммерческие доступные рецептуры.
ПРИМЕРЫ
Пример 1: Скрининговое исследование полимеров - усилителей растворимости
Цель данного исследования состояла в оценке эффекта включения различных полимерных ингредиентов в рецептуру сокристалла (рац)-трамадола-HCl - целекоксиба (1:1) в тесте на профиль растворимости. Были приготовлены разные таблетированные формы, в том числе сокристалл (рац)-трамадола-HCl - целекоксиба (1:1), основа для прессования (содержащая микроинкапсулированный полисорбат 80, микроинкапсулированный полиоксил 40 - гидрогенизированное касторовое масло, лаурилсульфат натрия, кросповидон, высушенный распылением маннит, микрокристаллическую целлюлозу и натрия стеарилфумарат), и проведено тестирование различных полимерных ингредиентов.
Тестировали следующие полимерные ингредиенты: полоксамеры (неионные сополимеры полиоксиэтилена-полиоксипропилена: Lutrol®), повидон (Plasdone K30), коповидон (сополимер 1-винил-2-пирролидона и винилацетата; Kollidon® VA 64), привитой сополимер поливинилкапролактама - поливинилацетата - полиэтиленгликоля (Soluplus®) и циклодекстрин (Kleptose®).
Согласно способу, описанному в примерах 2, были подготовлены разные рецептуры. Полученные после прессования разные таблетки тестировали с определением профиля растворимости.
Тест с получением кривой растворимости in vitro проводили на устройстве USP III (с лопастями) при 37°C и 50 оборотах в минуту с фосфатным буфером 0,04 М рН 12 в количестве 1000 мл в каждом флаконе в течение 45 мин. Результаты теста с кривыми растворимости показаны в фиг. 1. Быстрый рост растворимости был получен при включении в таблетки повидона, коповидона или Soluplus®. Включение Lutrol® вызывало замедление растворимости по сравнению с растворимостью таблеток, которые не содержат какой-либо полимер.
Рассчитывали соотношение количества растворенного целекоксиба в точках 15 минут и 30 минут в разных рецептурах с полимерным ингредиентом и без полимерного ингредиента, исходя из результатов, полученных в тесте с кривыми растворимости. В фиг. 2 показаны разные соотношения. На основании полученных результатов можно считать полимерами - усилителями растворимости полимеры, включение которых в рецептуру приводит к высвобождению с коэффициентом растворимости >1, по сравнению с рецептурой без какого-либо из упомянутых полимеров.
Пример 2: Фармацевтические рецептуры/таблетки, изготовленные согласно изобретению
Таблетки по изобретению были изготовлены согласно описанному ниже способу.
Сокристалл (рац)-трамадола - целекоксиба (1:1) из примера 4 заявки WO 2010/043412 на первом этапе смешивали с микроинкапсулированным полисорбатом 80, микроинкапсулированным полиоксилом 40 - гидрогенизированным касторовым маслом, с лаурилсульфатом натрия, кросповидоном, высушенным распылением маннитом, микрокристаллической целлюлозой и коповидоном (сополимером 1-винил-2-пирролидона/винилацетата) или Soluplus.
После этого первого этапа смешивания в смесь вводили скользящее вещество, добавляя стеарилфумарат натрия и тальк. Пластифицированную смесь на роторном таблетирующем прессе прессовали в таблетки, содержащие 113,5 мг сокристалла (рац)-трамадола HCl - целекоксиба (1:1) (480 мг в одной таблетке).
Пример 2А: Таблетки сокристалла (рац)-трамадола-HCl - целекоксиба (1:1), изготовленные прямым прессованием с использованием коповидона в качестве полимера - усилителя растворимости
|
|
Пример 2В: Таблетки сокристалла (рац)-трамадола-HCl - целекоксиба (1:1), изготовленные прямым прессованием с использованием Soluplus® в качестве полимера - усилителя растворимости
|
|
Пример 2С: Таблетки сокристалла (рац)-трамадола-HCl - целекоксиба (1:1), изготовленные прямым прессованием с использованием Soluplus® в качестве полимера - усилителя растворимости
|
Пример 3: Анализы таблеток на растворимость согласно примерам 2А, 2В и 2С
Фиг. 3 и 4 показывают результаты анализов на растворимость in vitro, проведенных с таблетками, полученными в примерах 2А, 2В и 2С. Высвобождение сокристалла (рац)-трамадола-HCl - целекоксиба (1:1) из фармацевтических композиций по изобретению анализировали в устройстве USP 2 (с лопастями) при 37°C и 50 оборотах в минуту в течение 2-х часов в буферном растворе с уровнем рН 12 + 1% лаурилсульфат натрия (фиг. 3) и в растворе 0,1 N HCl + 2% лаурилсульфат натрия (фиг. 4). Оба анализа показали увеличение высвобождения лекарственного препарата целекоксиб из сокристалла (рац)-трамадола-HCl - целекоксиба (1:1), который содержится в фармацевтической композиции по изобретению.
Пример 4: Определение in vivo профиля периода действия после перорального приема таблеток из примеров 2A, 2B, 2C по сравнению с коммерческой лекарственной формой целекоксиба (капсулы Celebrex®) и трамадола-HCl (капсулы Adolonta® IR)
Целью данного исследования было сравнение перорального действия таблеток из примеров 2А, 2В и 2С у собак при совместном введении готовых пероральных форм целекоксиба (Celebrex®) и трамадола-HCl (капсулы Adolonta® IR).
В этом примере определяли показатели зависимости концентрации трамадола и целекоксиба в плазме от времени после перорального введения однократной дозы голодным самкам и самцам собак. Аналогично рассчитывали фармакокинетические параметры некомпартментным способом.
В анализе 1 оценивали введение таблеток из примеров 2А и 2В, и в анализе 2 оценивали таблетки из примера 2C и готовые лекарственные формы целекоксиба и трамадола-HCl.
Фармакокинетические параметры из обоих анализов были стандартизированы по вводимой дозе для сравнения их фармакокинетических кривых.
Пример 4a: Анализ 1
В этом анализе оценивали воздействие на плазму и фармакокинетику трамадола и целекоксиба у 3 самцов и 3 самок собак породы бигль после перорального введения натощак однократной дозы таблеток из примеров 2А и 2В. Количество сокристалла (рац)-трамадола-HCl-целекоксиба в каждой рецептуре составляло 113,5 мг, что соответствовало 50 мг трамадола-HCl и 63,5 мг целекоксиба. Применяли перекрестную схему с перерывом между введениями 1 неделя. Образцы забирали до точки времени 48 часов после введения.
Для трамадола общее среднее значение времени, в течение которого выявляли максимальную концентрацию в плазме (tmax), составляло 1,5 часа для таблеток из примера 2А и 1,0 час для таблеток из примера 2B, и предполагается, что абсорбция трамадола происходит быстро и не зависит от рецептуры. Скорость воздействия как общее среднее значение Cmax составляла 47,2 нг/мл для таблеток из примера 2А и 70,5 нг/мл для таблеток из примера 2B, и продолжительность воздействия как общее среднее значение AUC0-∞ составляла 101,2 нг·ч/мл при введении таблеток из примера 2А и 127,8 нг·ч/мл для таблеток из примера 2B.
Для целекоксиба общее среднее значение времени, в течение которого выявляли максимальную концентрацию в плазме (tmax), составляло 2,5 часа для таблеток из примера 2А и 1,5 часа для таблеток из примера 2B. Скорость воздействия как общее среднее значение Cmax для целекоксиба составляла 1933,3 нг/мл для таблеток из примера 2А и 975,0 нг/мл для таблеток из примера 2B. Продолжительность воздействия как общее среднее значение AUC0-t составляла 23158,5 нг·ч/мл для таблеток из примера 2А и 12828,0 нг·ч/мл для таблеток из примера 2B.
Пример 4b: Анализ 2
Целью второго исследования была оценка и сравнение воздействия и фармакокинетики трамадола и целекоксиба у 3 самцов и 3 самок собак породы бигль после однократного перорального введения натощак дозы таблеток из примера 2C по сравнению с одновременным введением коммерчески доступных рецептур трамадола-HCl (капсулы Adolonta® IR) и целекоксиба (капсулы Celebrex®). Сокристалл (рац)-трамадола-HCl - целекоксиба (1:1) вводили в количестве 2 таблеток по 100 мг из примера 2С, что соответствует 88 мг трамадола-HCl и 112 мг целекоксиба. Для сравнения совместно вводили 2 капсулы по 50 мг трамадола-HCl (Adolonta® IR) и 1 капсулу 100 мг целекоксиба (Celebrex®).
Применяли перекрестную схему с перерывом между введениями 1 неделя. Образцы забирали до точки времени 48 часов после введения.
Как и в предыдущем анализе 1, для трамадола были получены сходные общие средние значения Tmax, а именно 1,3 ч для рецептуры из примера 2C и 1,0 ч для Adolonta®, что позволяет предположить, что абсорбция трамадола происходит быстро и не зависит от рецептуры. Скорость воздействия трамадола как общее значение Cmax составляла 129,3 нг/мл для таблеток из примера 2С и 365,5 нг/мл для Adolonta®. Для трамадола продолжительность общего воздействия AUC0-∞ составляла 486,5 нг·ч/мл при введении таблеток из примера 2С и 599,7 нг·ч/мл для Adolonta®.
Для целекоксиба общее среднее значение времени, в течение которого выявляли максимальную концентрацию в плазме (Tmax), составляло 2,3 часа для таблеток из примера 2С и 14,5 часа для Celebrex®. Скорость воздействия как общее среднее значение Cmax составляла 1898,1 нг/мл для таблеток из примера 2С и 1048,5 нг/мл для Celebrex®. Продолжительность общего воздействия AUC0-∞ составляла 37780,2 нг·ч/мл при введении таблеток из примера 2С и 22159,8 нг·ч/мл при введении Celebrex®.
Пример 4c: Итоговые данные доклинической фармакокинетики у собаки
При сравнении стандартизированной продолжительности воздействия Adolonta® и трамадола в трех рецептурах сокристалла (рац)-трамадола-HCl - целекоксиба (1:1) 2А, 2В и 2С были отмечены сходные характеристики общего воздействия AUC0-∞ для рецептуры из примера 2C (отличия в 0,9 раза). С другой стороны, другие две рецептуры из примера 2А и примера 2B показали более низкие значения AUC0-∞: отличия в 0,3 и 0,4 раза, соответственно. В отношении стандартизированной Cmax все рецептуры проявляли более низкую скорость воздействия (от 0,3 до 0,4 раз) по сравнению с Adolonta®. Снижение максимальной концентрации в плазме будет обеспечивать более высокую безопасность трамадола в отношении побочных действий на ЦНС. Сходные значения tmax получены для упомянутых рецептур и Adolonta® (см. фиг. 5).
|
Для целекоксиба рецептура таблеток из примера 2B показывала значение стандартизированной AUC0-t, сходное с этим показателем для Celebrex® (в 0,9 раз), а в рецептурах из примера 2А и примера 2C выявлены более высокие значения (в 1,6 и 1,5 раза, соответственно). В отношении стандартизированной Cmax этот показатель превышал показатель для Celebrex® в 1,5-, 1,6- и в 2,9 раз, чем для рецептур из примера 2B, примера 2C и примера 2A, соответственно (см. фиг. 6).
|
В заключении, сравнение таблеток сокристалла (рац)-трамадола-HCl - целекоксиба (1:1) из примеров 2А, 2В и 2С с отдельными коммерчески доступными продуктами показало, что не превышено воздействие для трамадола и выявило модуляцию пиковой концентрации в сторону уменьшения значения по сравнению с Adolonta® IR. По сравнению с коммерческой формой эти характеристики обеспечивают эффективность на фоне уменьшения побочных эффектов трамадола, что приводит к улучшению. Для целекоксиба было достигнуто увеличение абсорбции и в отношении скорости и продолжительности, что означает улучшенную биодоступность по отношению к коммерческой форме.
В заключении таблетки сокристалла (рац)-трамадола-HCl - целекоксиба (1:1) из примера 2A, 2B, 2C достоверно модулируют пероральную абсорбцию обоих активных веществ и показывают, что можно получить параметры воздействия трамадола и целекоксиба, соответствующие требованиям заказчика в таблетированной рецептуре сокристалла (рац)-трамадола-HCl - целекоксиба (1:1).