Результат интеллектуальной деятельности: РАДИОФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ С РЕНИЕМ-188 ДЛЯ ТЕРАПИИ КОСТНЫХ ПОРАЖЕНИЙ СКЕЛЕТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к способу получения стерильного раствора, состоящего из монокалиевой соли 1-гидроксиэтилидендифосфоновой кислоты дигидрата, восстановителя и антиоксиданта, в который затем вводят нерадиоактивный рений в виде перрената натрия (NaReO4). Полученный раствор нейтрализуют, фильтруют, замораживают и лиофильно высушивают с последующим введением раствора радиоактивного рения-188 (188Re) (Na188ReO4) с протеканием реакции комплексообразования 188Re с лигандом. Изобретение позволяет получить стерильный радиофармпрепарат (РФП), время приготовление которого сокращено до 30-60 минут за счет упрощения технологического цикла до одной стадии.
Изобретение также относится к радиофармацевтическому средству для терапии костных поражений скелета.
Известен способ получения дифосфоната, меченного 188Re [1]. Способ получения меченного дифосфоната осуществляется следующим образом: во флаконе смешивают 15 мг натриевой соли 1-гидроксиэтилидендифосфоновой кислоты (Na2HEDP), 4.5 мг хлористого олова (SnCl2·Н2О) и 4.0 мг гентизиновой кислоты. Полученную смесь растворяют в соответствующем количестве дистиллированной воды, замораживают и подвергают сублимационной сушке. К высушенной смеси добавляют 1.0 мл раствора, содержащего 0.01-0.1 мг неактивного перрената аммония (NH4ReO4). Затем смесь нагревают на кипящей водяной бане в течение 15 минут. После этого смесь охлаждают до комнатной температуры и доводят pH до 5-6 путем прибавления 1 мл 0.3 М раствора ацетата натрия. Связывание 188Re с лигандом (Na2HEDP) составляет 95.2-95.6%. Стабильность комплексного соединения 188Re-(Na2HEDP) сохраняется в течение 2 часов. В последующие сроки комплекс разрушается и количество связанного 188Re с лигандом через 3 часа составляет около 94%, через 24 часа - около 93%.
Недостаток этого способа состоит в сложности получения препарата в клинических условиях и сравнительно невысокая его стабильность.
Известен способ получения дифосфоната, меченного 188Re [2], применимый в лабораторных условиях. Способ состоит в том, что в смесь реагентов, состоящую из 2-20 мг (0.01-0.15 М) натриевой соли 1-гидроксиэтилидендифосфоновой кислоты (Na2HEDP), 2.5 мг (0.0005-0.02 М) хлористого олова (SnCl2·H2O) и 0.5-5 мг (3·10-3·3.5·10-2 М) гентизиновой кислоты, добавляют раствор перрената (l86Re или 188Re), содержащий стабильный рений с концентрацией 5·10-6-2·10-3 М. Полученную смесь нагревают и выдерживают при 80-100°C в течение 10-30 минут. Затем ее охлаждают и доводят pH раствора до 5.0-6.0. Радиохимические примеси перрената и диоксида рения в препарате не превышали 1.5%.
Недостаток этого способа состоит в сложности получения препарата в клинических условиях.
Прототипом предлагаемого технического решения является способ [3], заключающийся в том, что на первой стадии готовят стерильный раствор, содержащий смесь радиоактивного перрената натрия (Na188ReO4) с объемной активностью 148 до 2960 МБк/мл и нерадиоактивного перрената натрия (NaReO4) с концентрацией 10-4-10-3 моль/л. На второй стадии приготовленный раствор добавляют к лиофилизованной смеси реагентов, в состав которой входит лиганд (1-гидроксиэтилидендифосфоновая кислота), восстановитель (SnCl2·Н2О) и антиоксидант (аскорбиновая кислота). Далее смесь нагревают и выдерживают при 90 - 100°C в течение 15-30 минут. На третьей стадии смесь охлаждают и нейтрализуют до pH не более 7. В результате получают стерильный инъекционный радиофармацевтический препарат.
Недостаток способа состоит в технологической сложности, которая приводит к увеличению продолжительности его приготовления в клинических условиях. Сложность обусловлена наличием трех стадий получения радиофармрпепарата. Для его приготовления в условиях клиники необходимо иметь три флакона со стерильными реагентами: один флакон с лиофилизованной смесью, содержащий лиганд, восстановитель и антиоксидант; флакон со стабильным рением в виде перрената натрия и третий флакон с раствором для нейтрализации радиофармпрепарата. Реализация способа требует контроль и корректировку pH получаемого раствора, что накладывает дополнительные трудности, так как для корректировки pH продукта необходимо иметь стерильный раствор фармацевтического качества, необходимо использовать дополнительное оборудование и проводить контроль продукта после корректировки кислотности, а также проводить все эти манипуляции в асептических условиях. Помимо этого большее количество операций, при приготовлении РФП, в условиях медицинского учреждения потребует дополнительных мер по обеспечению радиационной безопасности и их реализации.
Наличие стерильного набора реагентов, содержащий три флакона, значительно увеличивает стоимость конечного продукта и время его приготовления, что приводит к нежелательному повышению облучения персонала клиники. Таким образом, предложенный способ получения радиофармпрепарта неудобен для практического применения.
Техническим результатом предлагаемого изобретения является упрощение способа получения радиофармацевтического препарата за счет эффекта, получаемого при объединении нерадиоактивного (NaReO4) и радиоактивного (Na188ReO4) рения с лиофилизатом в условиях одной стадии. При этом представляется возможным сократить время приготовления стерильного радиофармпрепарата до 30-60 минут за счет упрощения технологического цикла до одной стадии.
Суть предлагаемого изобретения заключается в том, что в способе, включающем получение стерильного раствора, состоящего из монокалиевой соли 1-гидроксиэтилидендифосфоновой кислоты дигидрата, восстановителя и антиоксиданта, вводят нерадиоактивный рений в виде перрената натрия (NaReO4). Полученный раствор нейтрализуют, фильтруют, замораживают и лиофильно высушивают с последующим введением раствора радиоактивного рения-188 (Na188ReO4). Затем нагревают до проявления реакции образования комплексного соединения 188Re с лигандом. После охлаждения полученный радиофармпрепарат пригоден для использования в клинике.
Таким образом, по предложенному способу получен радиофармпрепарат, пригодный для терапии костных поражений скелета, приготавливаемый в одну стадию в клинических условиях.
Приведенные примеры иллюстрируют реализацию способа.
Пример 1
В колбу с круглым дном и двумя горловинами емкостью 250 мл, снабженную капельной воронкой и магнитной мешалкой, помещают 10 мл 20% раствора монокалиевой соли 1-гидроксиэтилидендифосфоновой кислоты (КОЭДФ - лиганд) (2 г, 8.16·10-3 моль), добавляют 100 мл воды, добавляют 1.12 г (5.91·10-3 моль) двухлористого олова (SnCl2) -восстановитель и перемешивают до полного его растворения. К полученному раствору добавляют 0.7 г (3.97·10-3 моль) аскорбиновой кислоты (антиоксидант) и перемешивают до полного растворения. После этого добавляют 0.0365 г (1.335·10-3 моль) перрената натрия (NaReO4) и перемешивают в течение 20 минут. Полученную смесь нейтрализуют 0.1 М раствором гидроксида натрия (NaOH) до pH 3.0. Раствор доводят до общего объема 150 мл, перемешивают в течение 10 минут и проводят стерилизующую фильтрацию. Полученный раствор расфасовывают во флаконы для инъекций емкостью 10 см3 по 1.5 мл. Содержимое флаконов замораживают при температуре жидкого азота и помещают их в камеру сублиматора, охлажденную до -20°C. В камере создают давление 0.1-0.2 мм рт.ст. с помощью вакуумного насоса. При этих условиях проводят лиофильную сушку в течение 23-х часов, температуру камеры поднимают до +20°C и проводят сушку в течение 1 часа. В содержимое флакона вводят 5 мл раствора радиоактивного рения-188 (Na188ReO4), перемешивают до полного растворения содержимого флакона, нагревают на кипящей водяной бане до 95-100°C и выдерживают в течение 30 минут для проведения
реакции образования комплексного соединения 188Re с лигандом, охлаждают до комнатной температуры. После охлаждения раствор радиофармпрепарата готов для инъекций.
Пример 2
В колбу с круглым дном и двумя горловинами емкостью 250 мл, снабженную капельной воронкой и магнитной мешалкой, помещают 10 мл 20% раствора монокалиевой соли 1-гидроксиэтилидендифосфоновой кислоты (КОЭДФ - лиганд) (2 г, 8.16·10-3 моль), добавляют 100 мл воды, добавляют 1.12 г (5.91·10-3 моль) двухлористого олова (SnCl2) -(восстановитель) и перемешивают до полного его растворения. К полученному раствору добавляют 0.7 г (3.97·10-3 моль) аскорбиновой кислоты (антиоксидант) и перемешивают до полного растворения. После этого добавляют 0.0365 г (1.335·10-3 моль) перрената натрия (NaReO4) и перемешивают в течение 20 минут. Полученную смесь титруют 0.1 М раствором гидроксида натрия (NaOH) до pH 3.0. Раствор доводят до общего объема 150 мл, перемешивают в течение 10 минут и фильтруют через фильтр с размером пор 0.22 мкм. Полученный раствор расфасовывают во флаконы для инъекций емкостью 10 см3 по 1.5 мл. Содержимое флаконов замораживают при температуре жидкого азота и помещают их в камеру сублиматора охлажденную до -20°C. В камере создают давление 0.1-0.2 мм рт. ст. с помощью вакуумного насоса. При этих условиях проводят лиофильную сушку в течение 23-х часов, температуру камеры поднимают до +20°C и проводят сушку в течение 1 часа. В содержимое флакона вводят 5 мл раствора радиоактивного рения-188 (Na188Re04), перемешивают до полного растворения содержимого флакона, нагревают на кипящей водяной бане до 95-100°C и выдерживают в течение 60 минут для проведения реакции образования комплексного соединения 188Re с лигандом, охлаждают до комнатной температуры. После охлаждения раствор радиофармпрепарата готов для инъекций.
Подтверждение технического результата
В результате объединения нерадиоактивного и радиоактивного рения-188 получен новый технический результат в предлагаемом изобретении. Он состоит в упрощении способа получения радиофармпрепарата «Фосфорен, 188Re», заключающегося в получении РФП в одну стадию вместо трех, как это выполнялось по прототипу. Вместе с тем исключена стадия нейтрализации готового радиофармпрепарата. Предложенное решение позволяет сократить время его приготовления в медицинском учреждении и тем самым дает возможность существенно снизить дозовую нагрузку на медицинский персонал во время получения меченного препарата.
Клинические исследования радиофармпрепарата «Фосфорен, 188Re», приготовленного из лиофилизованной композиции реагентов с введенным радиоактивным рением-188 (Na188ReO4), проводились в исследовательских центрах:
- отделение радиохирургического лечения открытыми радионуклидами ФГБУ «МРНЦ» МЗРФ, Обнинск,
- отдел ядерной и радиационной медицины ФГБУ «Российского научного центра Рентгенорадиологии» МЗРФ, Москва.
Клиническое исследование проведено в соответствии с принципами Хельсинской декларации по проведению биомедицинских исследований с участием людей, в соответствии с местными требованиями и Правилами проведения качественных клинических испытаний, а также в соответствии с действующими нормативными требованиями, а именно: ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ, ГОСТ Р 52379-2005 НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА, Москва 2005; РОССИЙСКАЯ ФЕДЕРАЦИЯ ФЕДЕРАЛЬНЫЙ ЗАКОН ОБ ОБРАЩЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, N61-ФЗ, 12 апреля 2010 года; Постановление Правительства РФ от 13 сентября 2010 г. N 714 «Об утверждении Типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата».
Основной (первичной) целью исследования являлось сравнение эффективности паллиативной терапии болевого синдрома при костных метастазах РФП «Фосфорен, 188Re» и «Стронция хлорид, 89Sr» путем оценки степени анальгетического действия. Дополнительными (вторичными) целями исследования являлось сравнение безопасности и переносимости РФП «Фосфорен, 188Re» и «Стронция хлорид, 89Sr» на основании оценки нежелательных явлений в ответ на введение препарата и степени гемотоксичности по уровню тромбоцито- и лейкопении.
Исследование проводилось среди пациентов, страдающих злокачественными новообразованиями, у которых при клиническом, рентгенологическом и/или сцинтиграфическом исследовании были выявлены метастазы в кости, сопровождающиеся выраженным болевым синдромом, и/или наблюдалось прогрессирование костных метастазов на фоне проводимого предшествующего лечения.
Для участия в исследование были рекрутированы 57 больных. Из них, согласно критериям отбора, включены 50 больных: 30 с применением радиофармпрепарата «Фосфорен, 188Re» (опыт) и 20 с применением препарата сравнения «Стронция хлорид, 89Sr» (контроль).
В обеих группах у пациентов наблюдался достаточно выраженный болевой синдром, определенные по шкале интенсивности костных болей.
Каждый из терапевтических радиофармпрепаратов вводился однократно внутривенно, при условии соблюдения правил радиационной безопасности.
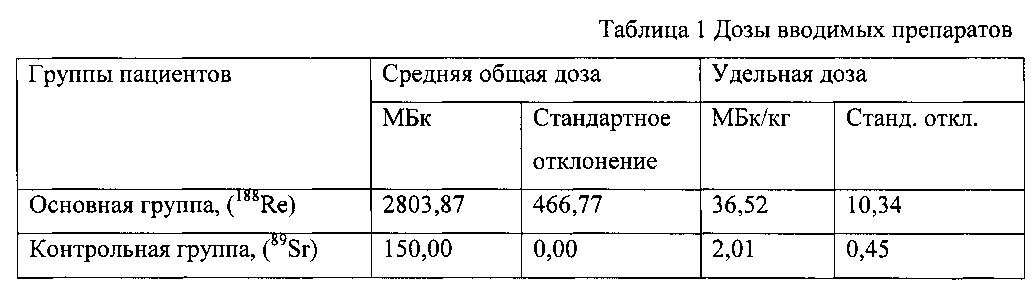
Средняя терапевтическая доза препарата «Фосфорен, 188Re» составляла 3120 МБк (80,4 мКи). Однако у пациентов с избытком или недостатком массы тела рекомендуемая доза определялась из расчета 44,0 МБк/кг массы тела. Поэтому проявлялась девиация доз в зависимости от массы тела больных. Препарат « 89Sr хлорид» вводился внутривенно, в соответствии с рекомендуемой по Инструкции терапевтической дозе 150 МБк (4,0 мКи).
Средняя и удельная доза для препарата «Фосфорен, 188 Re» приведена в таблице 1.
После введения препарата проводился мониторинг состояния пациента, в ходе которого проводилась регистрация нежелательных явлений и, по необходимости, их коррекция. Еженедельно выполнялся забор крови для лабораторного исследования.
Всем пациентам проводили:
1. Анализ крови с определением следующих параметров: количество лейкоцитов, тромбоцитов, концентрации тромбоцитов с последующий оценкой гематологической токсичности по критериям CTC-NCIC.
2. Биохимический анализ показателей крови (креатинин, мочевина, электролиты, АЛТ, ACT, билирубин).
3. Оценку динамики и интенсивности костных болей.
В ходе проведения исследования производился учет всей сопутствующей терапии. Отдельно оценивалась терапия направленная на уменьшение болей, связанных с костными метастазами. Производился раздельный учет опиатных и неопиатных анальгетиков. Особое внимание уделялось учету приема опиатных анальгетиков, что отражено в таблице 2.

Как видно из данных таблицы 2, частота приема опиатных анальгетиков не отличалась в исследуемых группах больных.
Эффект лечения больных раком предстательной, молочной и щитовидной железы оценивался через 1, 3 и 6 месяцев после инъекции. Для остальных групп этот период был ограничен 3 месяцами. Это было связано, с тем, что при трех упомянутых выше заболеваниях прогрессирование обусловлено, в основном, костными метастазами и основной проблемой - долгое время могут быть боли в костях и снижение активности. При других опухолях (рак легких, рак желудка др.) в такие сроки, как 6 и более месяцев после введения, наиболее значимую роль начинают играть внескелетные поражения, что обычно и определяет ухудшение общего состояния пациентов в этот период.
Результат лечения был оценен в каждом клиническом случае для каждого больного по отдельности. Оценка производилась как по критерию лечение эффективно, неэффективно, так и с использованием 5-балльной шкалы оценки эффективности.
Несмотря на больший терапевтический эффект в основной группе (эффект лучше на 12%) статистически значимых различий не выявлено (р=0,089, тест Спирмена), что демонстрирует сходную эффективность лечения обоих исследуемых препаратов в целом по группам.
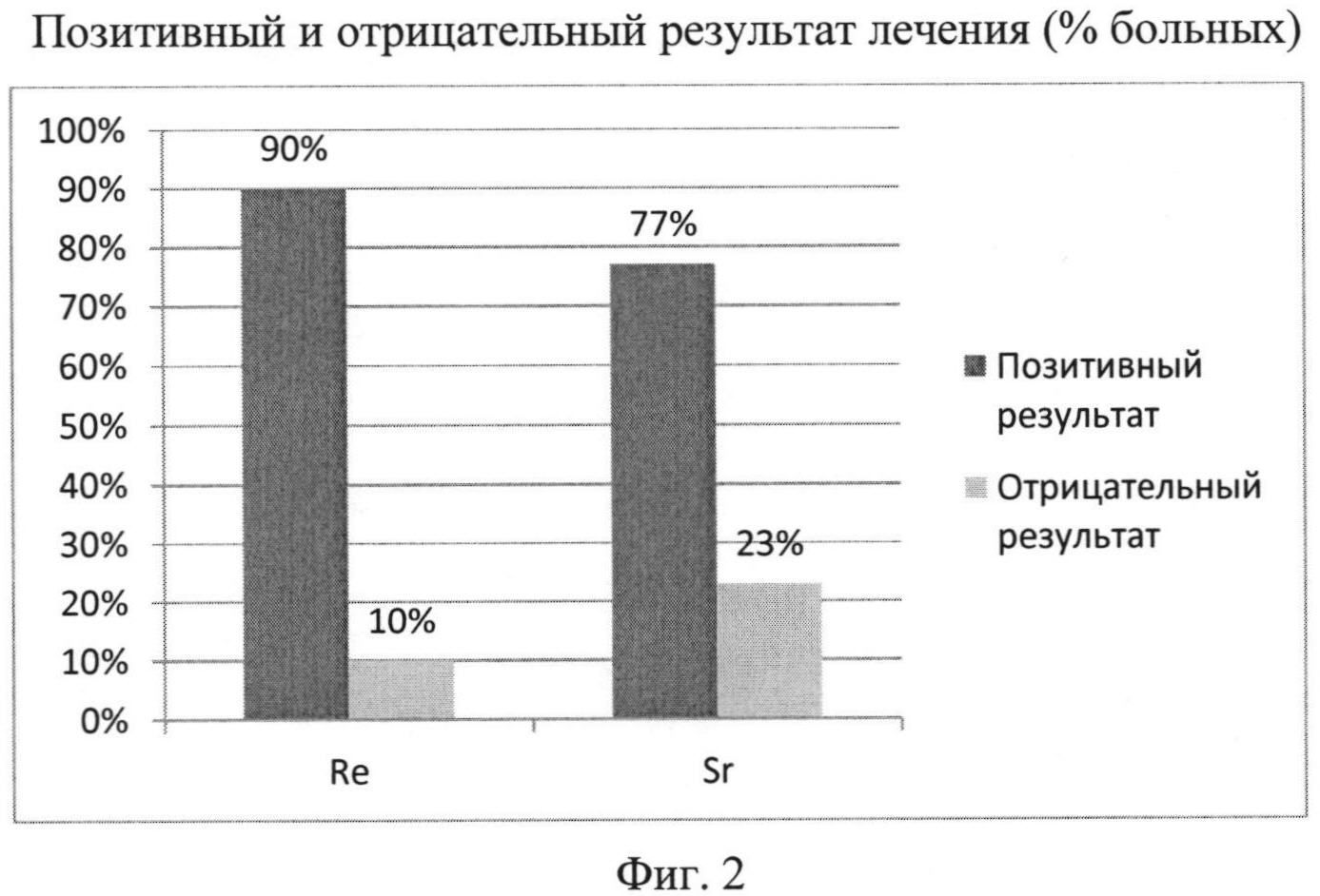
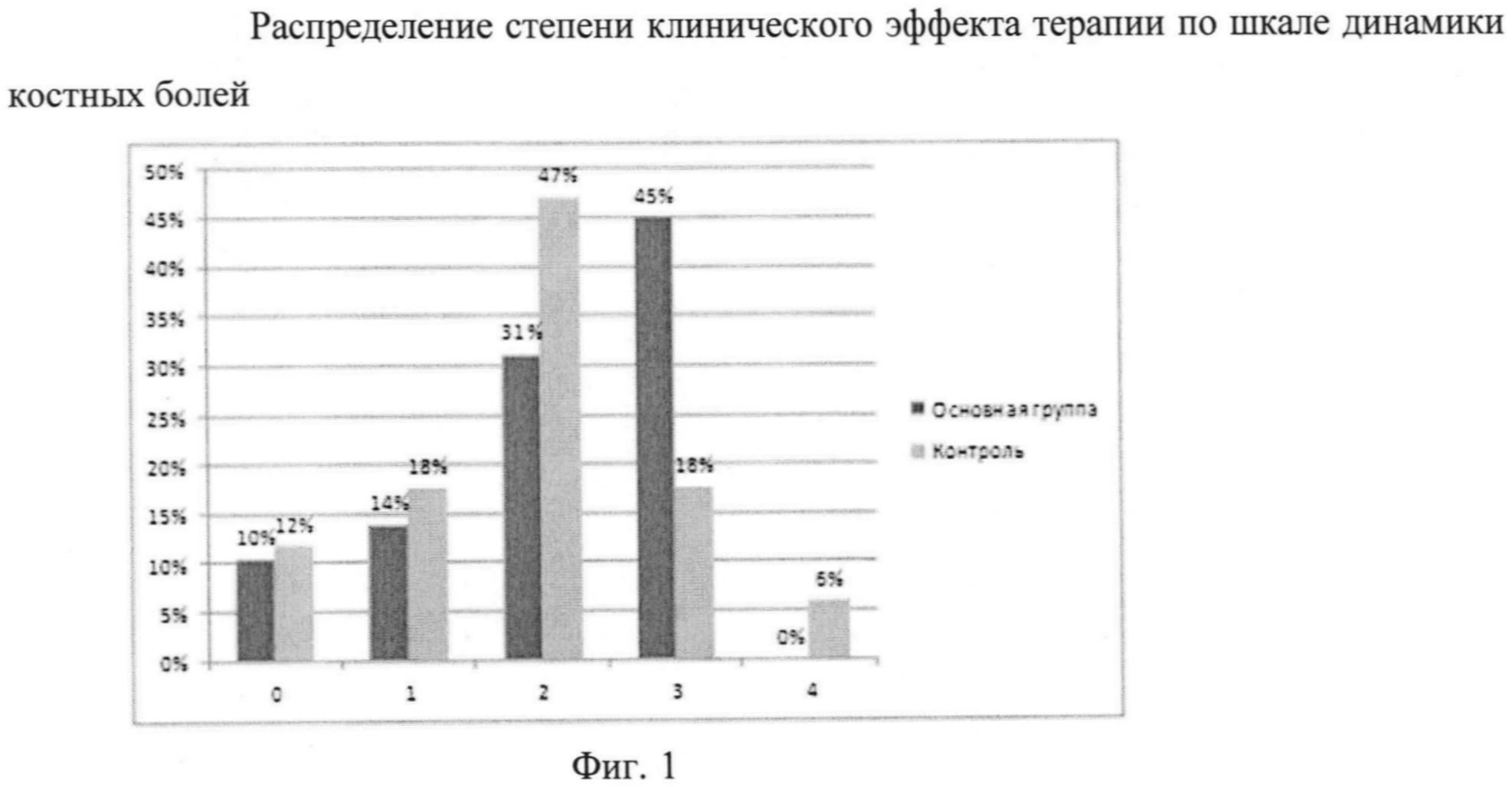
С другой стороны, при анализе клинического эффекта обезболивания путем оценки распределения больных по степени (баллам) снижения по шкале оценки динамики костных болей было выявлено существенное преимущество терапии в основной группе по числу больных, у которых болевой синдром снизился на 3 балла (фиг. 1)
Различия в числе больных, у которых болевой синдром не снизился или снизился на 1 и 2 балла, были недостоверны (р>0,08 - тест Спирмена). С другой стороны, основное число больных, у которых отмечено снижение боли на 3 балла (47%) было существенно больше в основной группе (47%), по сравнению с контролем (18%). Эта разница оказалась достоверной (р<0,02 - тест Спирмена).
Общий результат эффективности лечения обеими препаратами приведен на фиг. 2. В основной группе позитивный результат терапии составил 90%, в контроле 77%. В целом препарат «Фосфорен, 188Re» продемонстрировал достоверно лучший результат по сравнению с контролем (р=0,012, тест Мак Немара).
Начальный уровень показателей крови, которые оценивались с целью анализа переносимости терапии, представлен в таблице 3.
Как видно из таблицы 3, начальный уровень показателей крови не отличался у пациентов основной и контрольной групп (р>0,09).

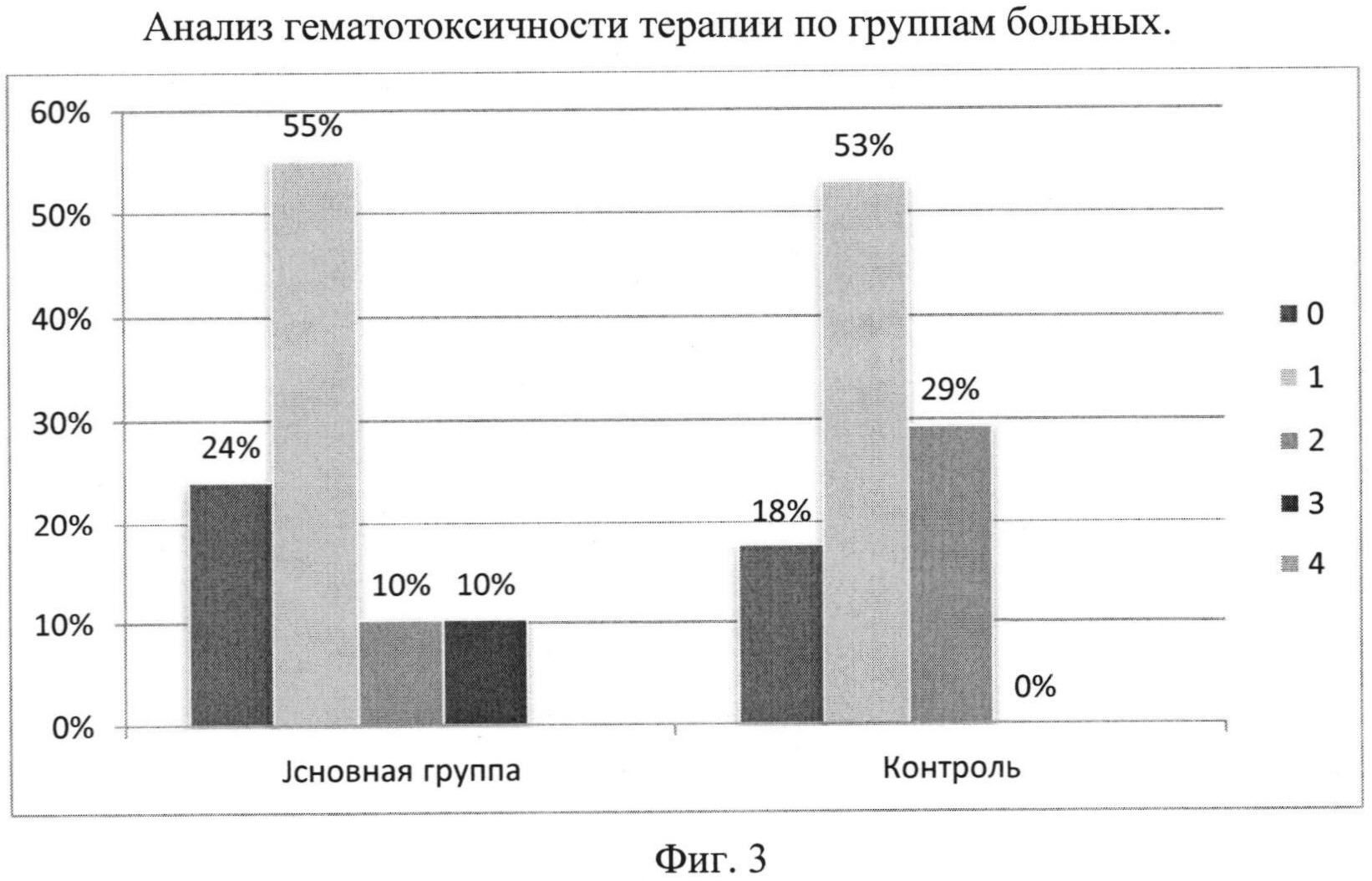
Результаты оценки гематотоксичности в баллах, полученные по шкале СТС - NCIC, представлены в таблице 14 на фиг. 3.

Средние уровни гематотоксичности не отличались у больных обеих групп (р>0,5) Ни в одной из групп не было выявлено 4 - самой тяжелой степени гематотоксичности. В то же время число больных с гематотоксичностью 2 степени было достоверно больше в группе контроля (29% и 10%, соответственно, р<0,05, тест Спирмена). Число больных с остальными степенями токсичности в группе пациентов, получавших препарат «Фосфорен, 188Re», по сравнению с группой больных, получавших препарат «Стронция хлорид, 89Sr» - не отличалось, (р=0,367, тест Спирмена).
Результаты выполненного клинического исследования свидетельствуют, что оба препарата «Фосфорен, 188Re» и «Стронция хлорид, 89Sr» демонстрируют сходную эффективность в плане лечения болей, связанных с костным метастазированием злокачественных новообразований различной локализации.
Однако препарат «Фосфорен, 188Re» проявил достоверно большую терапевтическую активность.
В то же время было установлено, что «Фосфорен, 188Re» демонстрирует лучший профиль безопасности как по переносимости, так и по числу серьезных нежелательных явлений по сравнению с контрольным препаратом сравнения «Стронция хлорид, 89Sr». Таким образом, по результатам проведенного исследования радиофармацевтический
препарат «Фосфорен, 188Re» может быть рекомендован для внедрения в широкую клиническую практику, в условиях специализированных отделений медицинских учреждений, занимающихся лечением больных онкологического профиля [4].
Источники информации
1. Lin W.Y., Hsieh J.F., Lin С.Р., Hsieh В.Т., Ting G., Wang S.J., Knapp F.F. Effect of reaction conditions on preparations of rhenium-188 hydroxyethylidene diphosphonate complexes, Nucl. Med. Biol., 1999, V. 26 P. 455-459.
2. Piprs D.W. Preparation of rhenium phosphonate therapeutic agents for bone cancer without purification. Патент США №5021235 (1991).
3. Басманов В.В., Колесник О.В. Способ получения радиотерапевтического препарата. Авт. свид. №2164420 (2001).
4. Отчет о клинических исследованиях с целью установления эффективности генераторного терапевтического радиофармпрепарата с рением-188 для пациентов с определенным заболеванием по государственному контракту от 19.06.2012 №12411.0810200.13.В15 НИОКР «Клинические исследования генераторного терапевтического радиофармпрепарата с рением-188. Организация опытно-промышленного производства» шифр «Изотоп 4.1».