Результат интеллектуальной деятельности: ВНУТРИКАМЕРНЫЕ ИМПЛАНТАТЫ С ПРОЛОНГИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ ТЕРАПЕВТИЧЕСКОГО АГЕНТА
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка претендует на приоритет предварительной заявки на патент США Номер 61/297,660, поданной 22 января 2010 года, полное раскрытие каждой из которых полностью включено в настоящий документ посредством ссылки.
Область техники
[0002] Настоящее изобретение относится к внутрикамерным имплантатам с пролонгированным высвобождением и способам их изготовления и использования.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0003] Здесь описаны внутриглазные системы и способы лечения заболеваний глаз. В частности, описывается местное введение системы доставки с пролонгированным высвобождением терапевтического агента в переднюю камеру и/или в передней камере стекловидного тела глаза для лечения повышенного внутриглазного давления в передней камере глаза.
[0004] Далее здесь описываются способы лечения глазных заболеваний, включающие следующие этапы: обеспечение, по меньшей мере, двумя биоразлагаемыми имплантатами с пролонгированным высвобождением, содержащими, по меньшей мере, один терапевтический агент; имплантация, по меньшей мере, двух биоразлагаемых имплантатов с пролонгированным высвобождением в переднюю камеру глаза; и лечение заболевания глаз, где, по меньшей мере, два биоразлагаемых имплантата с пролонгированным высвобождением высвобождают, приблизительно, 100 нг в день, по меньшей мере, одного биоактивного агента в течение, приблизительно, более 1 месяца.
[0005] Более того, здесь описываются способы лечения глаукомы в глазу, включающие следующие этапы: обеспечение, по меньшей мере, двумя биоразлагаемыми имплантатами с пролонгированным высвобождением, содержащими, по меньшей мере, один терапевтический агент; имплантация, по меньшей мере, двух биоразлагаемых имплантатов с пролонгированным высвобождением в переднюю камеру глаза; обеспечение достаточного времени для устанавливания в нижнем углу, по меньшей мере, двух биоразлагаемых имплантатов с пролонгированным высвобождением; обеспечение достаточного времени для высвобождения, по крайней мере, двумя биоразлагаемыми имплантатами с пролонгированным высвобождением, по меньшей мере, одного терапевтического агента; и лечении глаукомы, где, по меньшей мере, два биоразлагаемых имплантата с пролонгированным высвобождением высвобождают, приблизительно, 100 нг в день, по меньшей мере, одного биоактивного агента в течение, приблизительно, более 1 месяца.
[0006] В одном варианте воплощения заболеванием глаз является глаукома и/или повышенное внутриглазное давление. Имплантаты с пролонгированным высвобождением могут высвобождать, приблизительно, 70%, по меньшей мере, одного терапевтического агента в течение первого месяца. В некоторых вариантах воплощения, по меньшей мере, один терапевтический агент может составлять, приблизительно, 30%, по меньшей мере, двух биоразлагаемых имплантатов с пролонгированным высвобождением, и он отбирается из группы, состоящей из латанопроста, биматопроста и травопроста, а также их солей, эфиров и неактивных форм лекарств.
[0007] В другом варианте воплощения, по меньшей мере, два имплантата с пролонгированным высвобождением содержат, приблизительно, от 5% до, приблизительно, 70% поли(DL-лактида). В других вариантах воплощения, по меньшей мере, два имплантата с пролонгированным высвобождением содержат, приблизительно, от 5% до, приблизительно, 40% поли(DL-лактида-ко-гликолида). В других, помимо этого, вариантах воплощениях, по меньшей мере, два имплантата с пролонгированным высвобождением содержат, приблизительно, от 5% до, приблизительно, 40% полиэтилен гликоля.
[0008] Кроме этого, в других вариантах воплощениях, по меньшей мере, два имплантата с пролонгированным высвобождением содержат, приблизительно, 30% терапевтического агента, 65% поли(D,L-лактида) и 5% полиэтилен гликоля или, приблизительно, 20% терапевтического агента, 55% поли(D,L-лактида), 10% поли(DL-лактида-ко-гликолида) и 5% полиэтилен гликоля.
[0009] Сами имплантаты могут быть введены в ткань глаза с использованием соответствующего аппликатора. После имплантации, по меньшей мере, два имплантата с пролонгированным высвобождением могут установиться в нижнем углу в течение 24 часов после имплантации в переднюю камеру.
[0010] В одном варианте воплощения время, достаточное для высвобождения, по меньшей мере, двумя имплантатами, по меньшей мере, одного терапевтического агента, более, приблизительно, 42 дней.
КРАТКОЕ ОПИСАНИЕ ФИГУР
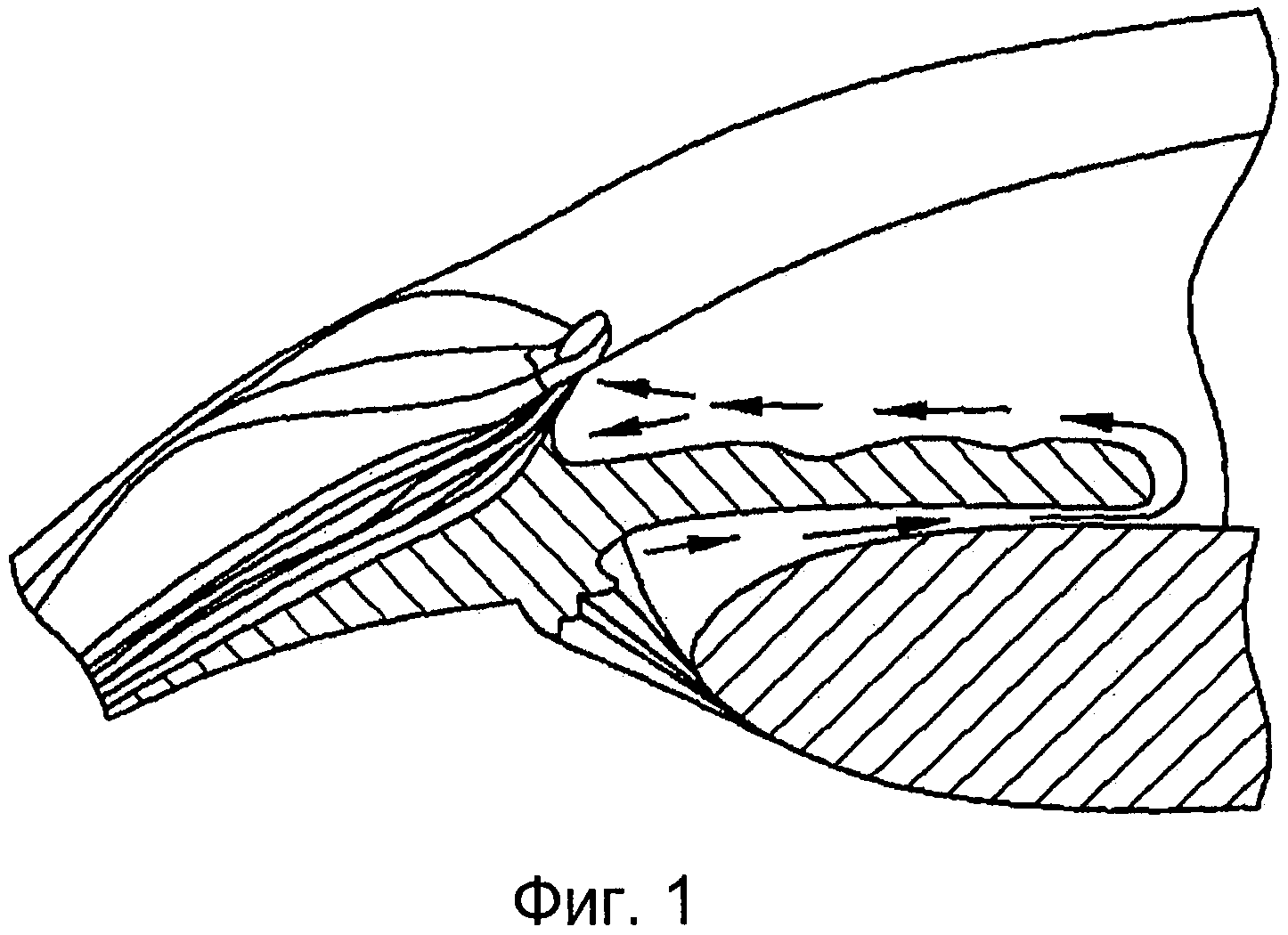
[0011] Фигура 1 иллюстрирует два различных пути оттока внутриглазной жидкости из передней камеры глаза, оба они расположены в иридокорнеальном углу.
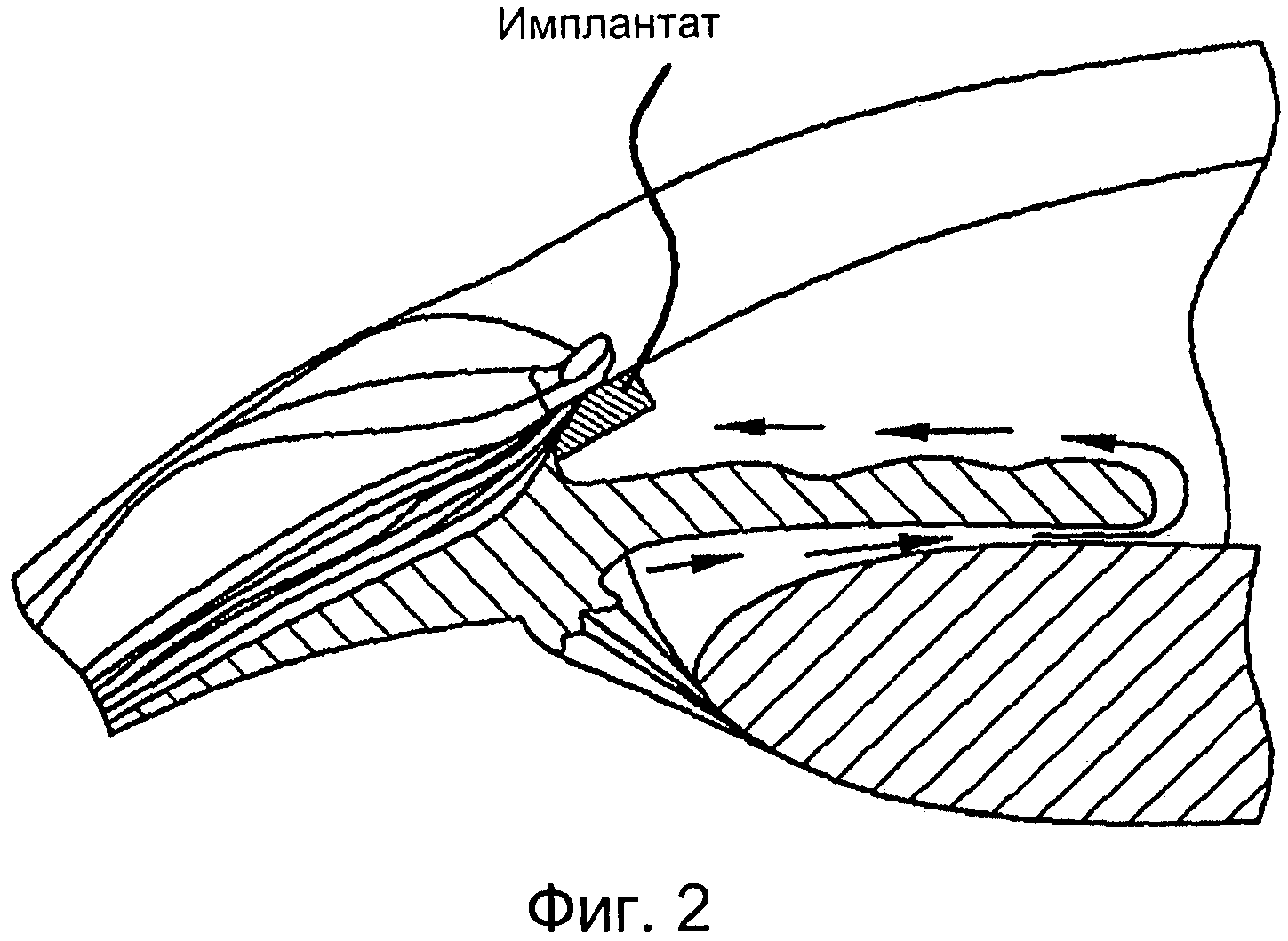
[0012] Фигура 2 иллюстрирует помещение имплантата, как было здесь описано, в месте оттока внутриглазной жидкости из передней камеры.
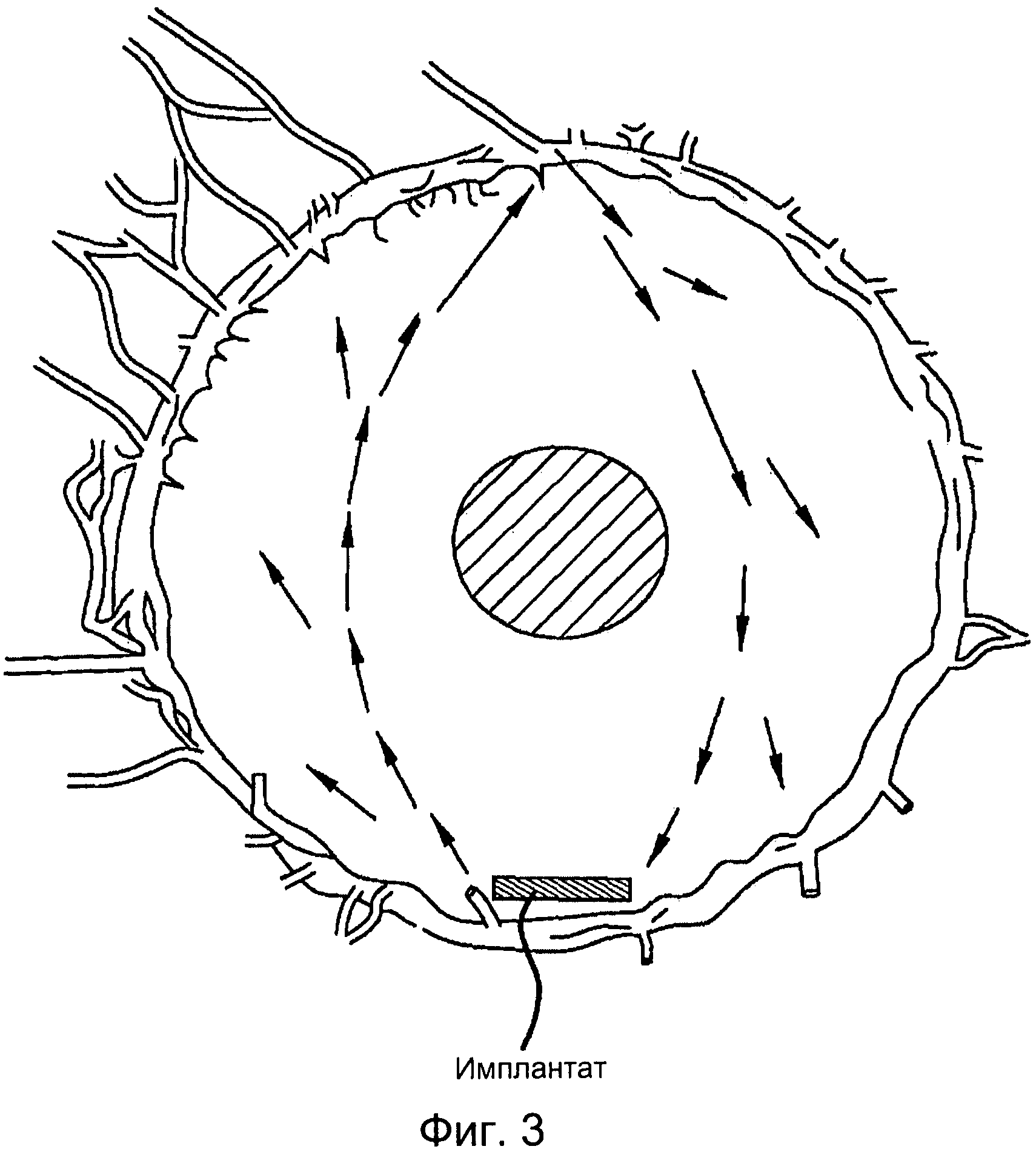
[0013] Фигура 3 иллюстрирует потоки, распложенные в передней камере глаза, наряду с возможным расположением имплантата или имплантатов, как здесь описано.
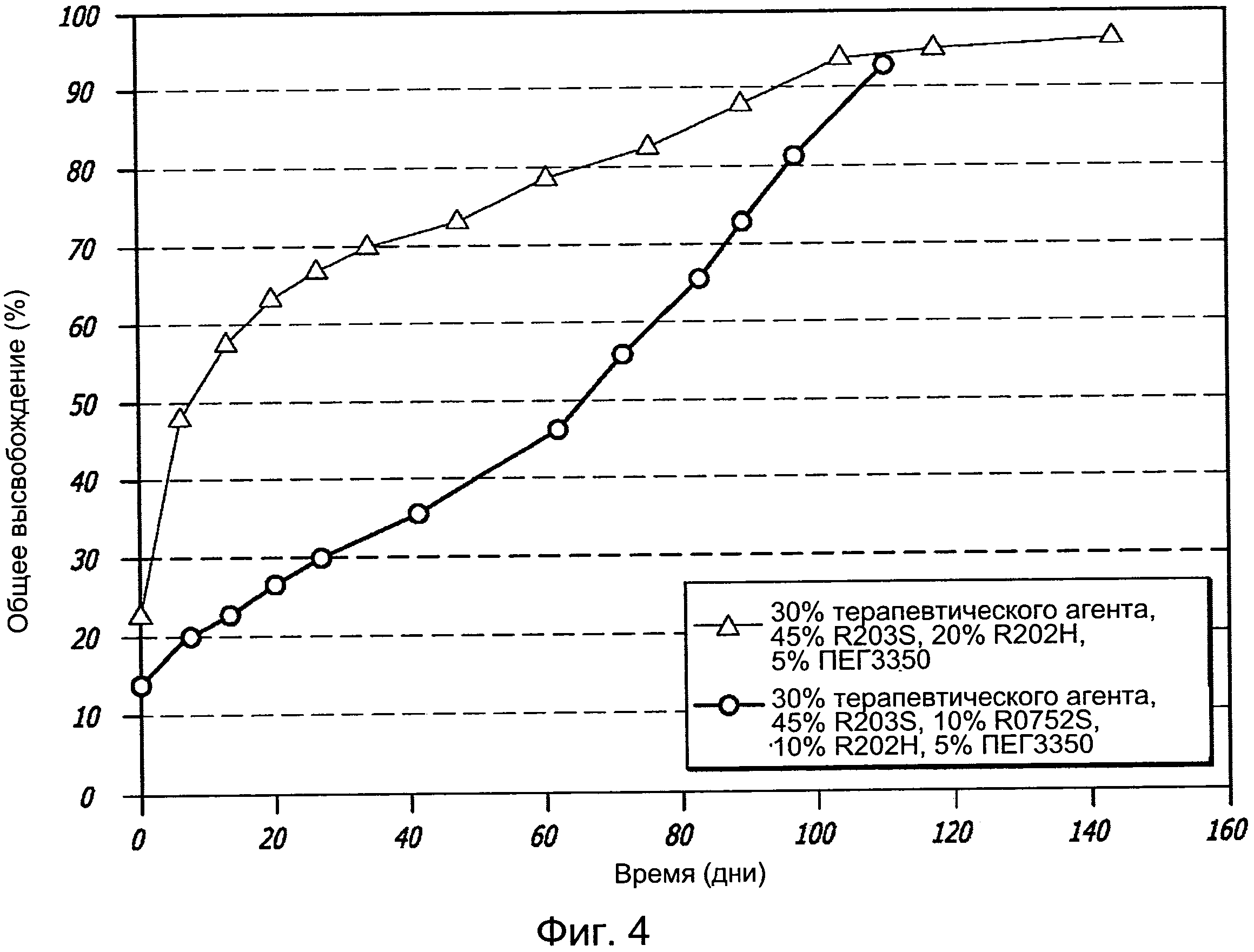
[0014] Фигура 4 графически иллюстрирует профиль высвобождения у имплантатов в настоящем описании.
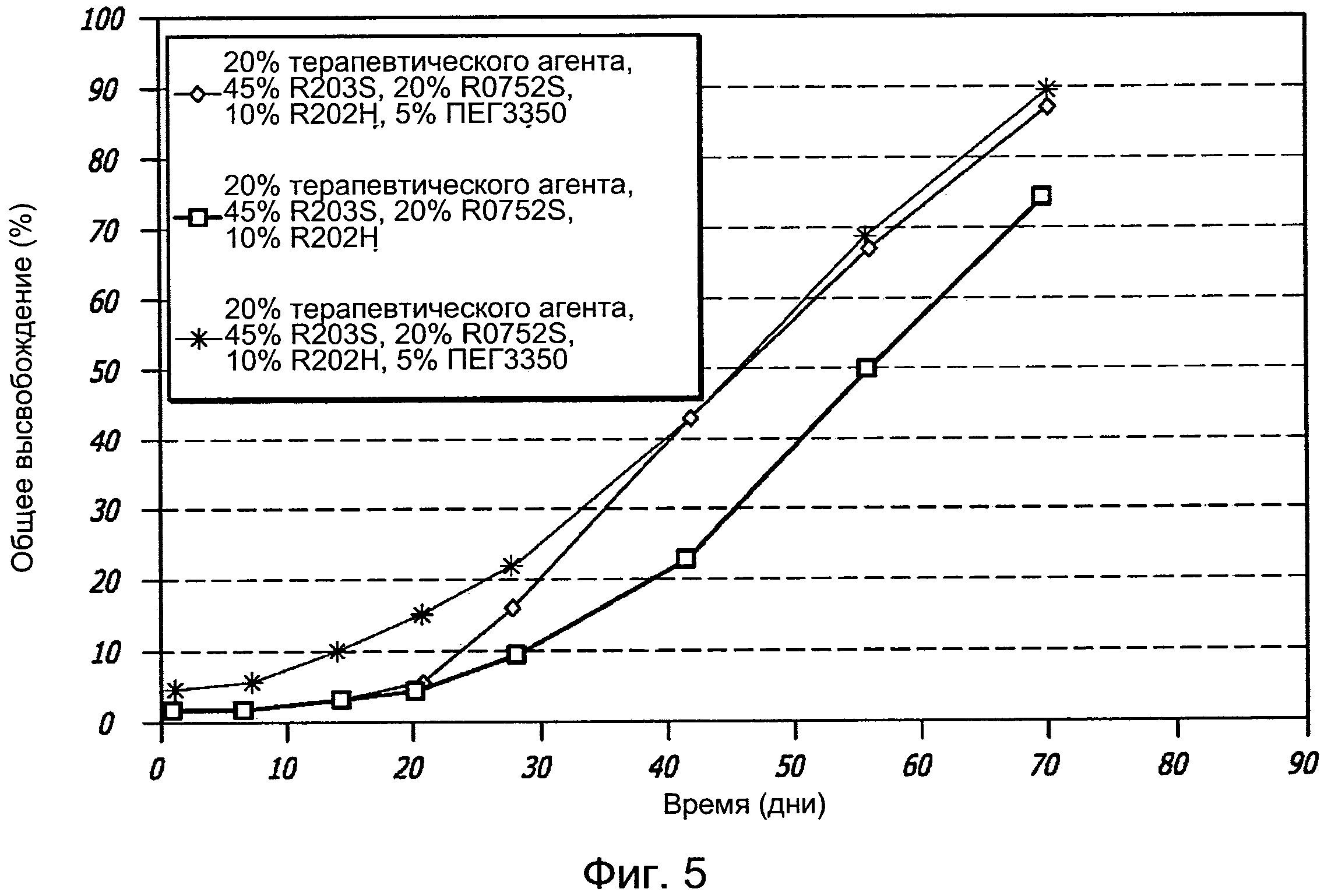
[0015] Фигура 5 графически иллюстрирует профиль высвобождения у имплантатов в настоящем описании.
[0016] Фигура 6 иллюстрирует помещение имплантата в соответствии с настоящим описанием.
Определение терминов
[0017] "Приблизительно" означает плюс или минус десять процентов от числа, параметра или характеристики, определенных таким образом.
[0018] "Биоразлагаемый полимер" означает полимер или полимеры, которые разлагаются in vivo, и где со временем происходит эрозия полимера или полимеров, происходящая одновременно или последовательно с высвобождением терапевтического агента. Использованные здесь термины "биоразлагаемый" и "биоразрушаемый" взаимозаменяемы. Биоразлагаемый полимер может быть гомополимером, сополимером или полимером, содержащим более двух различных полимерных единиц. Полимер может быть типа гелевого или гидрогелевого полимера, полимером молочной кислоты или сополимером молочной и гликолевой кислот, полимером полиэтилен гликоля или смесью их производных.
[0019] "Заболевание глаз" означает заболевание, нездоровье или состояние, которое поражает или затрагивает область глаза. В наиболее широком смысле, глаз включает в себя глазное яблоко и ткани, и жидкости, которые входят в состав глаза, окологлазные мышцы (такие, как косая и прямая мышцы) и часть глазного нерва в составе глазного яблока или прилегающую к нему.
[0020] Заболевание передней части глаза - это заболевание, нездоровье или состояние, которое поражает или затрагивает переднюю сторону (то есть переднюю часть глаза) глазной области или участок, такой, как окологлазная мышца, веко или ткань глазного яблока, или жидкость, которые расположены спереди от задней стенки капсулы хрусталика или ресничной мышцы. Таким образом, заболевание передней части глаза поражает или затрагивает конъюнктиву, роговицу, переднюю камеру, радужку, заднюю камеру (за сетчаткой, но перед задней стенкой капсулы хрусталика), хрусталик или капсулу хрусталика и кровеносные сосуды, и нервы, снабжающие кровью или иннервирующие область или участок глаза.
[0021] Таким образом, заболевание передней части глаза может включать заболевание, нездоровье или состояние, такое как, например, афакия, псевдофакия, астигматизм, блефароспазм, катаракта, заболевания конъюнктивы; конъюнктивит; заболевания роговицы; язву роговицы; синдромы сухого глаза; заболевания века; заболевания слезного аппарата; закупорка слезного протока; миопия; пресбиопия; нарушения зрачка; нарушения рефракции и страбизм. Глаукома также может считаться заболеванием передней части глаза, так как клинической целью лечения глаукомы может явиться снижение повышенного давления внутриглазной жидкости в передней камере глаза (то есть снижение внутриглазного давления).
[0022] Заболевание задней части глаза - это заболевание, нездоровье или состояние, которое первоначально поражает или включает заднюю часть глаза или участок, такой, как сосудистая оболочка глаза или склера (в положении позади плоскости, проходящей через заднюю стенку капсулы хрусталика), стекловидное тело, камеру стекловидного тела, сетчатую оболочку, зрительный нерв (то есть диск зрительного нерва) и кровеносные сосуды и нервы, которые снабжают кровью или иннервируют заднюю область или участок глаза.
[0023] Таким образом, заболевание задней части глаза может включать заболевание, нездоровье или состояние, такое как, например, острая макулярная нейроретинопатия, Болезнь Бехчета, неоваскуляризация хороидеи, диабетический увеит, гистоплазмоз, инфекции, такие как грибковые или вирус-индуцированные; макулярная дегенерация, такая как острая макулярная дегенерация, не-экссудативная возрастная макулярная дегенерация и экссудативная возрастная макулярная дегенерация; отек, такой как макулярный отек, цистоидный макулярный отек и диабетический макулярный отек; мультифокальный хороидит; травма глаза, поражающая задний участок глаза или область; глазные опухоли; нарушения сетчатки, такие как окклюзия центральной вены сетчатки, диабетическая ретинопатия (включая пролиферативную диабетическую ретинопатию), пролиферативная витроретинопатия (ПВР), окклюзивное заболевание ретинальной артерии, отслоение сетчатки, воспаление сосудистой оболочки сетчатки; симпатическая офтальмия; синдром Фогта-Коянаги-Харада (ФКХ); увеальная диффузия; состояние задней части глаза, вызванное или связанное с лазерной терапией глаза; состояние задней части глаза, вызванное или связанное с фотодинамической терапией, фотокоагуляцией, радиационной ретинопатией, расстройства эпиретинальных мембран, закупорка боковой ретинальной вены, передняя ишемическая нейропатия глазного нерва, диабетическая ретинальная дисфункция неретинопатического происхождения; пигментная дистрофия сетчатки и глаукома. Глаукома может рассматриваться как заболевание задней части глаза, так как целью лечения является предотвращение или снижение случаев потери зрения из-за повреждения или утраты клеток сетчатки или клеток зрительного нерва (то есть нейропротекторное действие).
[0024] "Область глаза" или "участок глаза" означает любую зону глазного яблока, включая передние и задние сегменты глаза, и которые, в основном, включают любые функциональные (например, для зрения) или структурные ткани, обнаруживаемые в глазном яблоке, или тканях, или в клеточных слоях, которые полностью или частично выстилают внутреннюю или наружную часть глазного яблока, но не ограничиваются этим. Индивидуальные примеры зон глазного яблока включают переднюю (глазную) камеру, заднюю камеру, полость стекловидного тела, сосудистую оболочку глаза, супрахороидальное пространство, конъюнктиву, субконъюнктивальное пространство, эписклеральное пространство, интракорнеальное пространство, эпикорнеальное пространство, склеру, плоскую часть ресничного тела, аваскулярные участки, образовавшиеся в результате операции, макулу и сетчатку.
[0025] "Пролонгированное высвобождение" или "контролируемое высвобождение" относится к высвобождению, по меньшей мере, одного терапевтического биоактивного агента или препарата из имплантата с заранее предопределенной скоростью. Пролонгированное высвобождение предполагает, что терапевтический биоактивный агент не высвобождается из имплантата спорадично, непредсказуемым способом, и не «прорывается» из имплантата при контакте с биологическим окружением (что также здесь называется кинетикой первого порядка), кроме тех случаев, когда это намеревались произвести специально. Однако термин «пролонгированное высвобождение», используемый здесь, не исключает «прорывного явления», связанного с выпуском агента. В некоторых примерных вариантах воплощения согласно настоящему описанию может быть желателен первоначальный прорыв, по меньшей мере, одного терапевтического агента, сопровождающийся впоследствии более постепенным высвобождением. Скорость высвобождения может быть постоянной (в большинстве случаев называется «рассчитанное по времени высвобождение» или кинетика нулевого порядка), так что, по меньшей мере, один терапевтический агент высвобождается в равных количествах в течение предопределенного времени (с начальной прорывной фазой или без нее), или может происходить равномерное высвобождение. Например, у пролонгированного высвобождения могут, в основном, отсутствовать колебания при доставке терапевтического агента по сравнению с топическим введением.
[0026] "Терапевтически эффективное количество" означает уровень или количество агента, необходимое для лечения состояния глаз или для снижения, или предотвращения повреждения или нарушения глаза без индукции значительных негативных или нежелательных побочных эффектов для глаза, или для глазной зоны. С учетом вышеизложенного, терапевтически эффективное количество терапевтического агента, такого, как латанопрост, - это количество, эффективное для снижения, по меньшей мере, одного симптома глазного заболевания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0027] Здесь описываются внутрикамерные имплантаты, включающие, по меньшей мере, один терапевтический агент. Описанные здесь имплантаты размещаются в передней камере глаза, однако они не закреплены в ткани глаза. В большей мере, имплантаты удерживаются на месте потоками и силой тяжести, присутствующими в передней камере глаза. Имплантаты предпочтительно имеют полимерную природу, они биоразлагаемые и обеспечивают высвобождение, по меньшей мере, одного терапевтического агента как в трабекулярную сеть (ТС), так и в связанные с ней ткани глаза и жидкости в передней камере глаза, куда помещается имплантат.
[0028] Прямое введение в камеру или в переднюю часть стекловидного тела имплантатов с пролонгированным высвобождением или систем доставки терапевтического агента, как здесь изложено, эффективно для лечения ряда указанных здесь глазных заболеваний. В таких состояниях глаукома характеризуется повышенным внутриглазным давлением, которое можно лечить описанным здесь способом путем обхода сложных склеральных механизмов выведения лекарственных веществ (например, топических капель).
[0029] Изменение внутриглазного давления (ВГД) является независимым фактором риска глаукоматозного повреждения. Традиционнее лечение повышенного глазного давления или глаукомы состоит в применении анти-гипертензивных топических глазных капель для снижения ВГД. К сожалению, болюсное дозирование топическими глазными каплями приводит к пиковым и минимальным значениям уровней терапевтического агента в передней камере, что приводит к вариабельности контролирования ВГД во времени. Это колебание ВГД может приводить к прогрессированию глаукоматозного поля, особенно у пациентов с развитой глаукомой. Описываемые здесь внутрикамерные имплантаты с пролонгированным высвобождением предназначены для обеспечения этой неудовлетворенной потребности пациентов с повышенным внутриглазным давлением, требующим медицинского лечения. Данные имплантаты могут обеспечивать низкие колебания ВГД в течение дня и ночи, когда применение топических капель не представляется удобным. Ночной пик ВГД происходит между 23 часами ночи и 6 часами утра у пациентов с открытоугольной глаукомой, и это может способствовать прогрессирующей потере поля зрения у некоторых пациентов. Дополнительным ограничением топической терапии является отсутствие равновесных концентраций препарата в передней камере глаза при болюсным дозировании, которое не контролирует ночные повышения ВГД у ряда пациентов. Описываемые здесь имплантаты устанавливают низкие колебания ВГД также в течение ночи, тем самым смягчая осложнения топического введения в ночные часы.
[0030] Несоблюдение медицинского режима, включающего одни топические глазные капли или более для лечения повышенного глазного давления, происходит у более 50% пациентов, и это может иметь отношение к колебаниям ВГД в течение дня, когда капли не используются в соответствии с регулярным расписанием. Описываемые здесь имплантаты не требуют такого соблюдения, и поэтому они более благоприятны для пациентов.
[0031] Здесь описываются внутрикамерные имплантаты с пролонгированным высвобождением терапевтического агента, которые обеспечивают постоянное высвобождение терапевтического агента, тем самым избегая пиковых и минимальных уровней терапевтического агента, которые имеют место во внутриглазной жидкости при топическом дозировании. Равновесные концентрации препарата, достигаемые во внутриглазной жидкости с описываемыми здесь имплантатами, могут значительно снизить колебания ВГД в течение дня и ночи, в отличие от традиционного топического введения препаратов.
[0032] Передняя и задняя камеры глаза наполнены внутриглазной жидкостью, жидкость постоянно выделяется ресничным телом и имеет ионный состав, подобный составу крови. Внутриглазная жидкость имеет двойную функцию: 1) снабжение питательными веществами аваскулярных структур глаза, таких как хрусталик и роговица, 2) поддерживает ВГД в физиологическом диапазоне. Поддержание ВГД и снабжение питательными веществами переднего сегмента являются определяющими факторами для поддержания нормальной остроты зрения.
[0033] Внутриглазная жидкость, в основном, выделяется в заднюю камеру глаза при помощи мерцательных процессов ресничного тела и путем второстепенного механизма образования внутриглазной жидкости через ультрафильтрацию из артериальной крови (Фигура 1). Внутриглазная жидкость затем достигает передней камеры, пересекая зрачок, и здесь существуют конвекционные потоки, где течение жидкости, прилегающей к радужной оболочке, направлено вверх, а течение жидкости, прилегающей в роговице, направлено вниз (Фигура 2).
[0034] Существуют два различных пути оттока внутриглазной жидкости, оба они расположены в иридокорнеальном углу глаза (Фигура 1). Увеосклеральный или нетрадиционный путь относится к оттоку внутриглазной жидкости из передней камеры путем диффузии через межклеточные пространства между волокнами цилиарных мышц. Хотя это представляется второстепенным путем оттока у человека, увеосклеральный или нетрадиционный путь является мишенью специфических анти-гипертензивных препаратов, таких как гипотензивные липиды, увеличивающие функциональность данного пути путем ре-моделирования внеклеточного матрикса.
[0035] Внутриглазная жидкость дренирует пространство в 360 градусов в трабекулярную сеть, которая первоначально имеет у человека поры диаметром от 10 до менее 30 микрон. Внутриглазная жидкость просачивается через канал Шлема и выходит из глаза через 25-30 коллекторных каналов в водянистые вены и, в конечном счете, в эписклеральные сосуды и вены глазницы (см. Фигуру 3). Фигура 3 представляет собой схему, где стрелками обозначены конвекционные течения внутриглазной жидкости в передней камере глаза. Имплантат, который, как здесь описывается, высвобождает, по меньшей мере, один терапевтический агент, показан расположенным ниже. Свободные терапевтические агенты, элиюруемые из имплантата, вливаются в конвекционные потоки внутриглазной жидкости (стрелки). Затем терапевтические агенты рассеиваются по передней камере и поступают в таргетную ткань, такую как трабекулярная сеть и участок ресничного тела, через зону корня радужки.
[0036] Преимущество внутрикамерного впрыскивания и размещения описываемого здесь биоразлагаемого имплантата состоит в том, что передняя камера является иммунологически привилегированным местом в организме и менее склонна реагировать на чужеродный материал, такой как полимерные системы доставки терапевтического агента. Это не относится к субтенонову пространству, где широко распространены воспалительные реакции на чужеродные материалы. В дополнение к передней камере, содержащей иммунорегуляторные факторы, которые обеспечивают иммунологическую привилегированность, частицы с диаметром более 30 микрон являются менее иммуногенными и имеют меньшую склонность вызывать воспаление глаза. Оседлые макрофаги глаза являются первой линией защиты от чужеродных тел или инфекционных агентов; однако им трудно фагоцитировать частицы размером более 30 микрон. Поэтому частицы размером более 30 микрон менее склонны активировать макрофаги и запускать последующий каскад воспалительных реакций. Это снижение воспалительного ответа для пациента является преимуществом.
[0037] Эффективность доставки терапевтических агентов или препаратов во внутриглазную жидкость с полимерными системами высвобождения намного выше с внутрикамерным расположением по сравнению с использованием субтенонова пространства. Так, менее 1% терапевтического агента, доставленного в субтеноново пространство, попадет во внутриглазную жидкость, в то время как 100% препарата, который высвободился внутри камеры, попадет во внутриглазную жидкость. Поэтому для внутрикамерных систем доставки требуются более низкие нагрузки терапевтическими агентами по сравнению с использованием субтенонова пространства.
[0038] Как таковая, при этом будет иметь место более низкая экспозиция конъюнктивы к терапевтическим агентами, и в результате, меньшая склонность к развитию гиперемии конъюнктивы при доставке топических терапевтических агентов, таких, как простагландины и протамины. Наконец, после внутрикамерной имплантации терапевтический(-ие) агент(-ы) напрямую через водянистые вены попадут в конъюнктивальный/эписклеральный кровеносный сосуд. Это минимизирует гиперемию конъюнктивы с, например, аналогами простагландина по сравнению с введением в субтеноново пространство, где многочисленные сосуды подвержены риску расширения из-за наличия высоких концентраций терапевтического агента, диффузно распространившегося по экстраваскулярному пространству конъюнктивы. Прямая внутрикамерная имплантация также устраняет потребность в консервантах, которые, при использовании в топических каплях, могут раздражать поверхность глаза.
[0039] Описываемые здесь имплантаты изготовлены из полимерного материала для обеспечения максимального прилегания имплантата к иридокорнеальному углу. В дополнение, размер имплантата, который находится в диапазоне диаметра, ширины и поперечного среза от, приблизительно, 0,1 мм до, приблизительно, 1 мм, и диапазоне длины от, приблизительно, 0,1 мм до, приблизительно, 6 мм, обеспечивает введение имплантата в переднюю камеру путем использования аппликатора с иглой малого размера, находящегося в диапазоне от, приблизительно, 22G до, приблизительно, 30G.
[0040] Полимерный материал, использованный для формирования описанных здесь имплантатов, может быть любой комбинацией полимолочной кислоты, гликолевой кислоты и/или полиэтилен гликоля, что со временем обеспечивает пролонгированное высвобождение терапевтического агента в систему оттока в глазу. Для снижения ВГД также могут внутрикамерно использоваться системы доставки с пролонгированным высвобождением терапевтического агента, основанные на других полимерных системах.
[0041] Описываемые здесь внутрикамерные имплантаты могут высвобождать загруженные терапевтические агенты в течение различных периодов времени. Эти имплантаты, введенные внутрь камеры, или в переднюю часть стекловидного тела, обеспечивают терапевтические уровни, по меньшей мере, одного терапевтического агента в течение длительных периодов времени. Длительными периодами времени могут быть, приблизительно, 1 неделя, приблизительно, 6 недель, приблизительно, 6 месяцев, приблизительно, 1 год или более.
[0042] Подходящие полимерные материалы или составы для использования в имплантатах включают те материалы, которые обладают совместимостью, обладают биосовместимостью с глазом, так, что они не вызывают значительной помехи для функционирования или для физиологии глаза. Такие материалы, предпочтительно, по меньшей мере, частично, и что более предпочтительно, в значительной степени, подвергаются биоразложению или биоразрушению.
[0043] В одном варианте воплощения примеры пригодных материалов включают, без ограничения, такие материалы, получаемые из органических сложных и простых эфиров, и/или включающие органические сложные и простые эфиры, которые при разложении дают физиологически приемлемые продукты разложения, включая мономеры. Полимерные материалы, полученные из ангидридов, амидов, ортоэфиров и тому подобных, и/или включающие их самих по себе или в комбинации с другими мономерами, также могут найти применение. Полимерными материалами могут быть ступенчатополимеризованные или конденсационные полимеры, предпочтительнее, конденсационные полимеры. Полимерные материалы могут быть поперечно-сшитыми и не поперечно-сшитыми, например, не более, чем слегка поперечно-сшитыми, так, например менее чем приблизительно 5% или менее чем приблизительно 1% поперечно-сшитого полимерного материала. В большинстве случаев, кроме углерода и водорода, полимеры будут включать, по меньшей мере, один кислород и азот, предпочтительнее, кислород. Кислород может быть представлен в форме окси-, например, гидрокси- или эфира, карбонила, например, нон-оксо-карбонил, такой как эфир карбоновой кислоты, и тому подобные. Азот может присутствовать как амидо-, циано- и амино-.
[0044] В одном варианте воплощения для использования в имплантатах пригодны полимеры гидрокси-алифатических карбоновых кислот, гомополимеры или сополимеры, и полисахариды. Полиэфиры могут включать полимеры D-молочной кислоты, L-молочной кислоты, рацемической молочной кислоты, гликолевой кислоты, поликапролактона и их комбинации. В основном, с использованием D-лактата и L-лактата, достигается медленное разрушение полимера или полимерного материала, в то время как разрушение значительно ускоряется с добавление лактата рацемата. Пригодные полисахариды и полиэфиры могут включать без ограничений полиэтилен гликоль (ПЭГ), кальция альгинат и замещенные целлюлозы, в частности, например, эфиры карбоксиметил целлюлозы, характеризующиеся нерастворимостью в воде и имеющие молекулярный вес от, приблизительно, 5кД до, приблизительно, 500 кД.
[0045] Другие представляющие интерес полимеры включают, без ограничений, поливиниловый спирт, полиэфиры и их комбинации, которые являются биосовместимыми и могут подвергаться биоразрушению и/или биоразложению. Некоторые предпочтительные характеристики полимеров или полимерных материалов могут включать биосовместимость, совместимость с избранным терапевтическим агентом, легкость в использовании полимера при изготовлении описываемой здесь системы доставки терапевтического агента, желательный полупериод распада в физиологической среде и нерастворимость в воде.
[0046] В одном варианте воплощения внутрикамерный имплантат в соответствии с настоящим описанием, имеет состав из 30% терапевтического агента, 45% R203S поли(D,L-лактида), 20% R202H поли(D,L-лактида) и 5% ПЭГ 3350. В другом варианте воплощения состав состоит из 20% терапевтического агента, 45% R203S поли(D,L-лактида), 10% R202H поли(D,L-лактида), 20% RG752S поли(DL-лактид-ко-гликолида), и 5% ПЭГ 3350. Диапазоны концентраций составных частей, которые могут быть использованы, составляют от, приблизительно, 5% до, приблизительно, 40% терапевтического агента, от, приблизительно, 10% до, приблизительно, 60% R203S, от, приблизительно, 5% до, приблизительно, 20% R202H, от, приблизительно, 5% до, приблизительно, 40% RG752S и от, приблизительно, 0 до, приблизительно, 15% ПЭГ 3350. Для регулирования скорости высвобождения терапевтического агента отдельные полимеры могут быть исключены и другие типы могут быть добавлены. Использованные полимеры являются коммерчески доступными.
[0047] Полимеры, используемые для формирования имплантата, имеют свои независимые свойства с тем, чтобы в комбинации придавать свойства, необходимые для пролонгированного высвобождения, по меньшей мере, одного терапевтического агента после имплантации. Например, R203S поли(D,L-лактид) обладает собственной вязкостью, или его средняя вязкость составляет, от, приблизительно, 0,25 до, приблизительно, 0,35 дл/г, в то время, как R202H поли(D,L-лактид) обладает меньшей собственной вязкостью, составляющей от, приблизительно, 0,16 до, приблизительно, 0,24 дл/г. Как таковая, описанная здесь полимерная композиция может иметь смесь поли(D,L-лактида) с более низким и более высоким молекулярным весом. Подобным образом, RG752S поли(DL-лактид-ко-гликолид) имеет молекулярное соотношение D,L-лактид : гликолид, от, приблизительно, 73:27 до, приблизительно, 77:23 и собственную вязкость от, приблизительно, 0,16 до, приблизительно, 0,24 дл/г. Используемый здесь полиэтилен гликоль может иметь молекулярный вес, например от, приблизительно, 3000 до, приблизительно, 3500 г/моль, предпочтительно, приблизительно, 3350 г/моль. Полимеры, имеющие различную собственную вязкость и/или молекулярный вес, могут быть скомбинированы для получения полимерной композиции, подходящей для пролонгированного высвобождения определенного терапевтического агента или агентов.
[0048] Биоразлагаемые полимерные материалы, которые включаются для формирования полимерной матрицы имплантата, предпочтительно подвержены нестабильности, связанной с энзиматическим или гидролизным разложением. Водорастворимые полимеры могут быть поперечно-связанными гидролизируемыми или биоразлагаемыми поперечными связями для обеспечения пригодными водо-нерастворимыми полимерами. Уровень стабильности может широко варьировать, в зависимости от выбора мономера, использования гомополимера или сополимера, от применения смесей полимеров и от того, включает ли полимер концевые кислотные группы.
[0049] Одинаково важно контролировать биоразложение полимера и поэтому профиль длительного высвобождения имплантата зависит от среднего молекулярного веса полимерной композиции, использованной в имплантатах. Для модуляции профиля высвобождения, по меньшей мере, одного терапевтического агента, могут быть использованы различные молекулярные веса одного и того же компонента, а также могут быть включены различные полимерные составы.
[0050] Описываемые здесь имплантаты могут быть цельными, то есть несущими, по меньшей мере, один терапевтический агент, равномерно распределенный по полимерному матриксу, или инкапсулированными, когда резервуар с терапевтическим агентом окружен капсулой из полимерного матрикса. Вдобавок, терапевтический агент может быть распределен не-гомогенным образом по матриксу. Например, имплантаты могут включать в себя часть, имеющую большую концентрацию терапевтического агента по сравнению со второй частью имплантата, которая может иметь меньшую концентрацию.
[0051] Общий вес имплантата зависит от объема внешней камеры и от активности и растворимости терапевтического агента. Зачастую, доза терапевтического агента составляет, в основном, от приблизительно, 0,1 мг до, приблизительно, 200 мг имплантата на дозу. Например, имплантат может весить, приблизительно, 1 мг, приблизительно, 3 мг, приблизительно, 5 мг, приблизительно, 8 мг, приблизительно, 10 мг, приблизительно, 100 мг, приблизительно, 150 мг, приблизительно, 175 мг или, приблизительно, 200 мг, включая помещенный внутрь терапевтический агент.
[0052] Нагруженный терапевтический агент, связанный с имплантатом, будет обладать ассоциированным с ним свойством или профилем пролонгированного высвобождения. Например, в течение первых 30 дней после имплантации описываемые здесь имплантаты могут высвобождать, от приблизительно, 1 мкг/день до, приблизительно, 20 мкг/день. В течение жизни имплантата может быть выделено от, приблизительно, 100 нг/день до, приблизительно, 900 нг/день. В других вариантах воплощения высвобождение терапевтического агента составляет, приблизительно, 300 нг/день, приблизительно, 675 нг/день или, приблизительно, 700 нг/день.
[0053] Соотношения терапевтического агента, полимера и других модификаторов могут быть эмпирически определены путем разработки рецептуры нескольких партий имплантата с различными средними соотношениями. Скорости высвобождения можно определить, например, путем использования метода многократных стоков, взвешенный образец имплантатов добавляется к отмеренному объему раствора, содержащего 0,9% NaCl в воде, где объем раствора будет таким, что концентрация терапевтического агента после высвобождения будет составлять менее 5% насыщения. Смесь выдерживают при температуре 37°С с медленным перемешиванием. Появление растворенного терапевтического агента как функции времени можно прослеживать различными известными современными методами, такими как спектрофотометрия, ВЭЖХ, масс-спектрофотометрия и подобными до установления постоянного поглощения, или до тех пор, пока не высвободится более 90% терапевтического агента.
[0054] Терапевтическими агентами, которые могут быть использованы с описываемыми здесь имплантатами, являются простагландины, аналоги простагландинов и простамиды. Примеры включают агонисты рецепторов простагландинов, включая простагландин E1 (альпростадил), простагландин E2 (динопростон), латанопрост и травопрост. Латанопрост и травопрост являются неактивными формами простагландинов (например, 1-изопропиловые эфиры простагландина); однако они относятся к простагландинам, так как действуют на рецептор простагландина F после их гидролиза до 1-карбоновой кислоты. Простамид (также называемый простагландин-этаноламидом) является аналогом простагландина, и представляет собой фармакологически уникальное соединение группы простагландинов (например, поскольку простамиды действуют на другой клеточный рецептор [рецептор простамида], который отличается от рецептора простагландинов), и представляет собой нейтральный липид, образующийся в качестве продукта окисления при помощи фермента цикло-оксигеназы-2 ("ЦОГ-2") эндоканнабиноида (такого, как анандамид). В дополнение к этому, простамиды не гидролизируются in situ до 1-карбоновой кислоты. Примерами простамидов могут служить биматопрост (этил амид 17-фенил простагландина F2α, полученный путем синтеза) и простамид F2α. Другие аналоги простагландинов, которые могут быть использованы в качестве терапевтических агентов, включают унопростон и агонисты рецепторов ЕР2/ЕР4, но не ограничиваются этим.
[0055] Простагландины, используемые здесь, также включают один или более типов производных простагландинов, аналогов простагландинов, включая простамиды и производные простамидов, неактивные формы препаратов, их соли и их смеси. В определенных имплантатах простагландин включает состав, имеющий структуру
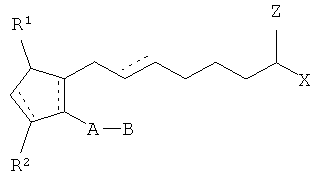
где связи, обозначенные пунктиром, представляют собой единичную или двойную связь, которая может иметь конфигурацию cis или trans; А - это алкилен или алкиленовый радикал, имеющий от двух до шести атомов углерода, этот радикал может прерываться одним или более оксидных радикалов и замещаться одним или более гидрокси-, окси-, алкилокси- или алкилкарбокси-группами там, где алкиловый радикал включает от одного до шести атомов углерода; В - это циклоалкиловый радикал, имеющий от трех до шести атомов углерода или ариловый радикал, выбранный из гидрокарбил ариловых и гетероариловых радикалов, имеющих от четырех до десяти атомов углерода, где гетероатом выбран из атомов азота, кислорода и серы; Х - это - OR4 или -N(R4)2 где R4 выбран из водорода, низший алкильный радикал, имеющий от одного до шести атомов углерода,
 или
или 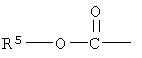
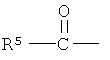
где R5 - низший алкильный радикал, имеющий от одного до шести атомов углерода; Z=0 или представляет собой два водородных радикала; один из R1 и R2=0, -ОН или группа -O(CO)R6, а другой представляет собой -ОН или -O(CO)R6, или R1=0 и R2 - водород, где R6 представляет собой насыщенную или ненасыщенную ациклическую углеводородную группу, имеющую от 1 до, приблизительно, 20 атомов углерода, или -(CH2)mR7, где m равно 0 или целому числу между 1 и 10, и R7 - циклоалькильный радикал, имеющий от трех до семи атомов углерода, или гидрокарбил ариловый или гетероариловый радикал, как определено выше, или его фармакологически приемлемая соль.
[0056] Фармакологически приемлемые соли присоединения кислот описанных соединений - это соли, образованные из кислот, которые образуют нетоксические соли присоединения кислоты, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, малеат, фумарат, оксалат, лактат, тартрат, цитрат, глюконат, сахарат и сульфонатные соли p-толуола.
[0057] В одном примере варианта воплощения имплантат включает простагландин, имеющий структуру
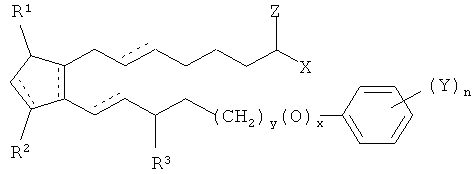
где y равен 0 или 1, x равен 0 или 1, и x и y оба не равны 1, Y представляет собой отобранную группу, состоящую их алкильной, галогеновой, нитро-, амино-, тиоловой, гидроксильной, алкилоксидной, алкилкарбоксильной групп, и также алкильной группы, замещенной галогеном, где указанный алкильный радикал состоит из от одного до шести атомов, n равно 0 или целому числу от 1 до 3 и R3=0, -ОН или O(CO)R6.
[0058] В дополнительном примере варианта воплощения простагландин имеет формулу
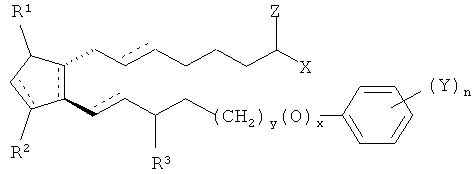
где заштрихованные линии указывают на альфа конфигурацию, а сплошные треугольники указывают на бета конфигурацию.
[0059] В некоторых описываемых здесь имплантатах простагландин имеет формулу
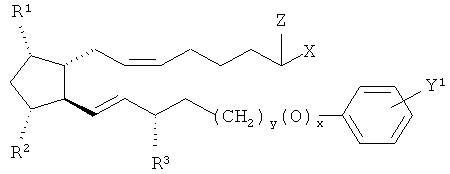
где Y1 представляет собой Cl или трифторметил.
[0060] Другие простагландины могут иметь следующую формулу
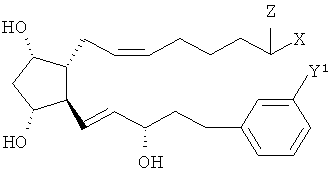
и 9-, 11- и/или 15 их эфиров.
[0061] В одном примере варианта воплощения простагландиновый компонент включает соединение с формулой
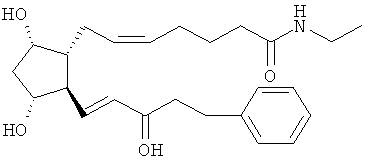
[0062] Этот соединение также известно как биматопрост и является общедоступным в качестве топического офтальмологического раствора под торговым названием LUMIGAN® (Allergan, Inc., Irvine, CA).
[0063] В другом примере варианта воплощения внутриглазного имплантата простагландин включает соединение, имеющее структуру
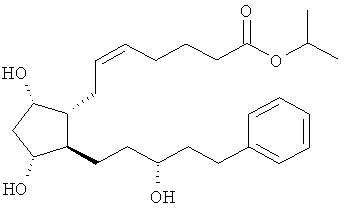 .
.
[0064] Этот простагландин известен как латанопрост и является общедоступным в качестве топического офтальмологического раствора под торговым названием XALATAN®. Таким образом, имплантаты могут включать, по меньшей мере, один терапевтический биоактивный агент, который включает в себя, содержит преимущественно или состоит из латанопроста, его соли, изомера, неактивной формы или их смесей.
[0065] Простагландиновый компонент может быть в виде частиц или порошка, и он может быть заключен в биоразлагаемый полимерный матрикс. Обычно простагландиновые частицы имеют эффективный средний размер менее чем, приблизительно, 3000 нанометров. В некоторых имплантатах частицы могут иметь эффективный средний размер, приблизительно, на порядок меньший, чем 3000 нанометров. Например, частицы могут иметь эффективный средний размер менее чем, приблизительно, 500 нанометров. В дополнительных имплантатах частицы могут иметь эффективный средний размер менее чем, приблизительно, 400 нанометров и, еще в других вариантах воплощения средний размер менее чем, приблизительно, 200 нанометров.
[0066] Другие терапевтические агенты, пригодные для описываемых здесь внутрикамерных имплантатов, включают антагонисты бета-адренергических рецепторов (такие, как тимолол, бетаксолол, левобетаксолол, картеолол, левобунолол и пропранолол, которые снижают выработку внутриглазной жидкости ресничным телом); агонисты альфа адренергического рецептора, такие как бримонидин и апраклонидин (иодипин) (которые имеют двойной механизм действия, снижая выработку внутриглазной жидкости и повышая увеосклеральный отток); менее селективные симпатомиметики, такие как эпинефрин и дипивефрин (действие связано с повышением оттока внутриглазной жидкости через трабекулярную сеть и, возможно, через путь увеосклерального оттока, вероятно, посредством действия бета 2-агониста); ингибиторы карбоновой ангидразы, такие как дорзоламид, бринзоламид, ацетазоламид (снижают секрецию внутриглазной жидкости путем ингибирования карбоновой ангидразы в ресничном теле); ингибиторы rho-киназы (снижают ВГД путем разрушения цитоскелета актина трабекулярной сети); ваптаны (антагонисты рецептора вазопрессина); анекортава ацетат и аналоги; этакриновая кислота; каннабиноиды; холинэргические агонисты, включая холинэргические агонисты с прямым действием (мистические агенты, парасимпатомиметики), такие как карбахол, пилокарпина гидрохлорид; пилокарпина нитрат и пилокарпин (действуют путем сокращения ресничной мышцы, уплотняя трабекулярную сеть и вызывая повышение оттока внутриглазной жидкости); ингибиторы холинэстеразы, такие, как демекариум, эхотиофат и физостигмин; антагонисты глютамата; блокаторы кальциевых каналов, включая мемантин, амантадин, римантадин, нитроглицерин, декстрофан, детрометорфан, дигидропиридины, верапамил, эмопамил, бензодиазепины, бепридил, дифенилбутилпиперидины, дифенилпиперазины, флюспирилен, элипродил, ифенпродил, тибалосин, флюнаризин, никардипин, нифедипин, нимодипин, барнидипин, верапамил, лидофлазин, прениламина лактат и амилорид; простамиды, такие как биматопрост, или его фармацевтически приемлемые соли или его неактивные формы; и простагландины, включая травопрост, хлопростенол, флюпростенол, 13,14-дигидро-хлопростенол, изопропил унопростон и латанопрост; AR-I 02 (агонист рецептора простагландина F, доступный от Aerie Pharmaceuticals, Inc.); AL-3789 (анекортава ацетат, ангиостатический стероид, доступный от Alcon); AL-6221 (травопрост рраватан] агонист рецепора простагландина F; PF-03187207 (простагландин - донор окиси азота, доступный от Pfizer) PF-04217329 (также доступный от Pfizer); INS1 15644 (соединение лантрункулин В, доступное от Inspire Pharmaceuticals) и INS1 17548 (ингибитор Rho-киназы, также доступный от Inspire Pharmaceuticals), но не ограничиваются ними.
[0067] В описываемых здесь системах доставки может также использоваться комбинация глазных анти-гипертензивных препаратов, таких как бета блокаторы, и аналоги простагландина/простамида. Они включают биматопроститимолол, травопроститимолол, латанопроститимолол, бримонидин/тимолол и дорзоламид/тимолол. В комбинацию с терапевтическим агентом, снижающим ВГД, в систему доставки также может быть помещен агент, обладающий нейропротекторным действием, включая мемантин и серотонергики [например, агонисты 5-НТ 2 подтипа, такие как S-(+)-I-(2-аминопрпил)-индазол-6-01)], но не ограничиваясь ними.
[0068] Для лечения различных глазных заболеваний с внутрикамерными имплантатами могут использоваться другие терапевтические агенты, не относящиеся к глазным анти-гипертензивным агентам. Например, ингибитор фактора роста эндотелия сосудов и другие анти-ангиогенные соединения могут использоваться для лечения неоваскулярной глаукомы. Другой пример - использование кортикостероидов или ингибиторов кальциневрина, которые могут быть использованы для лечения таких заболеваний, как увеит и отторжение пересаженной роговицы. Эти имплантаты также могут располагаться в субконъюнктивальном пространстве и в стекловидном теле.
[0069] В дополнение к этому здесь описываются новые способы создания имплантатов. Терапевтический агент настоящих имплантатов в основном, составляет от, приблизительно, 1% до, приблизительно, 90% веса имплантата. Более предпочтительно, чтобы терапевтический агент составлял от, приблизительно, 5% до, приблизительно, 30% веса имплантата. В более предпочтительном варианте воплощения терапевтический агент - это анти-гипертензивный агент и он составляет, приблизительно, 15% веса имплантата (например, 5%-30% веса). В другом варианте воплощения терапевтический агент составляет, приблизительно, 20% или, приблизительно, 30% от веса имплантата.
[0070] В дополнение к терапевтическому агенту описываемые здесь имплантаты могут включать или могут доставляться в составах, включающих эффективные количества буферных агентов, консервантов и тому подобные. Подходящие водорастворимые буферные агенты включают, в том числе, щелочи и щелочноземельные карбонаты, фосфаты, бикарбонаты, цитраты, бораты, ацетаты, сукцинаты и тому подобные, такие как натрия фосфат, цитрат, борат, ацетат, бикарбонат, карбонат и тому подобные. Данные агенты могут быть представлены в количествах, достаточных для поддержания рН системы от приблизительно, 2 до, приблизительно, 9 и более, предпочтительно, от, приблизительно, 4 до, приблизительно, 8. Как такового, буферного агента может быть, приблизительно, до 5% веса всего имплантата. Подходящие водорастворимые консерванты включают натрия бисульфит, натрия бисульфат, натрия тиосульфат, аскорбат, бензалкония хлорид, хлоробутанол, тимеросал, фенилмеркурцетат, фенилмеркурборат, фенилмеркурнитрат, парабены, метилпарабен, поливиниловый спирт, бензиловый спирт, фенил этанол и подобные, а также их смеси. Эти агенты могут присутствовать в количествах от, приблизительно, 0,001% до, приблизительно, 5% веса и, предпочтительно, от приблизительно, 0,01% до, приблизительно, 2% веса имплантата.
[0071] В одном варианте воплощения в имплантат заключается такой консервант, как бензалкония хлорид. В другом варианте воплощения имплантат может включать как бензалкония хлорид, так и биматопрост.В еще одном варианте воплощения биматопрост замещен латанопростом.
[0072] Для производства описываемых здесь имплантатов могут быть использованы различные техники. Полезные техники включают методы само-эмульгации, методы сверхкритической жидкости, методы выпаривания растворителя, методы раздела фаз, методы сушки распылением, методы размалывания, межфазные методы, методы формования, их комбинации и подобные, однако не обязательно ограничиваются ими
[0073] В одном варианте воплощения способы производства имплантатов включают в себя растворение соответствующих полимеров и терапевтических агентов в растворителе. Выбор растворителя будет зависеть от избранных полимеров и терапевтических агентов. Для описываемых здесь имплантатов, включающих терапевтический агент, такой как латанопрост, подходящим растворителем является дихлорометан (ДХМ). После растворения полимеров и терапевтического(-ких) агента(-тов), полученная в результате смесь заливается в матрицу определенной формы.
[0074] Затем, после помещения в матрицу, растворитель, использованный для растворения полимеров и терапевтического(-ких) агента(-тов), выпаривается при температуре между, приблизительно, 20°С и, приблизительно, 30°С, предпочтительно, приблизительно, 25°С. Полимер может быть высушен при комнатной температуре или даже в вакууме. Например, залитые в матрицу полимеры, содержащие терапевтические агенты, могут быть высушены путем испарения в вакууме.
[0075] Этапы растворения и заливки в матрицу образуют имплантаты, так как растворение полимеров и терапевтических агентов позволяет системе разделиться естественным образом и сформироваться в свою наиболее естественную конфигурацию, базирующуюся на таких свойствах, как вязкость полимеров и, отсюда, молекулярного веса, гидрофобности/гидрофильности полимеров, молекулярного веса терапевтического агента, гидрофобности/гидрофильности терапевтического агента, и тому подобных.
[0076] Как только формованные полимеры высушены, их можно далее переработать в имплантаты, используя для этого любой современный метод. В примере варианта воплощения высушенный формованный полимер может быть разрезан на маленькие части и отштампован в виде круглых или квадратных структур в форме стержней при температуре между, приблизительно, 50°С и, приблизительно, 120°С, предпочтительно, приблизительно, 90°С. В других примерах вариантов воплощения просто могут быть отлиты пленки без штампования.
[0077] Другие способы включают в себя штамповку сухих полимерных порошков и сухих или жидких терапевтических агентов. Имплантаты также штампуются или формуются с образованием случайной ориентации в зависимости от самой сухой порошковой смеси, не основываясь на физических свойствах компонентов. Простагландины, такие как латанопрост, очень трудно внедрить в расплав штампованных имплантатов, потому что они, в основном, при нагревании выделяют Простагландины на поверхность. Поэтому температура штамповки удерживается настолько низкой, насколько это возможно для избегания потери и распада простагландина. Это может быть осуществлено путем использования избранной комбинации подходящих молекулярных весов полимеров и пластификатора, подобного (полиэтиленгликолю) ПЭГ, которые совместимы с простагландином. Простагландин и ПЭГ пластифицируют полимеры до той степени, которая позволяет смеси быть отштампованной при такой температуре, при которой не будет происходить распад и потеря простагландина.
[0078] Раскрываемые здесь имплантаты, содержащие терапевтические агенты, могут быть использованы для лечения других заболеваний глаз, отличных от глаукомы и/или повышенного ВГД, таких как нижеследующие: макулопатии/дегенерация сетчатки: макулярная дегенераия, включая возрастную макулярную дегенерация (ВМД), такую, как не-экссудативная возрастная макулярная дегенерация и экссудативная возрастная макулярная дегенерация, хороидальную неоваскуляризацию, ретинопатию, включая диабетическую ретинопатию, острую и хроническую макулярную нейроретинопатию, центральную серозную хориоретинопатию и макулярный отек, включая цистоидный макулярный отек и диабетический макулярный отек. Увеит/ретинит/хороидит: острая мультифокальная плакоидная пигментная эпителиопатия, болезнь Бехчета, дробьевидная ретинохороидопатия, инфекции (сифилис, болезнь Лайма, туберкулез, токсоплазмоз), увеит, включая интермедиарный увеит (pars planitis) и передний увеит, мультифокальный хороидит, идиопатический мультифокальный синдром белых точек (ИМСБТ), саркоидоз глаз, задний склерит, серпигинозный хороидит, субретинальный фиброз, ивеит-синдром и синдром Фогта-Коянаги-Харада. Сосудистые заболевания/экссудативные заболевания: окклюзивное заболевание ретинальной артерии, окклюзия центральной вены сетчатки, диссеминирующая внутрисосудистая коагулопатия, окклюзия боковой ретинальной вены, гипертензивные изменения глазного дна, ишемический синдром глаз, микроаневризмы ретинальной артерии, болезнь Коутса, парафовеальная телеангиэктазия, окклюзия гемиретинальной вены, папиллофлебит, окклюзия центральной ретинальной артерии, окклюзия боковой ретинальной артерии, заболевание каротидной артерии (ЗКА), глазурный боковой васкулит, веретено-клеточная ретинопатия и другие гемоглобинопатии, ангиоидные полосы сетчатки, семейная экссудативная витреоретинопатия, болезнь Илза. Травматические/хирургические: симпатическая офтальмия, увеальная болезнь сетчатки, отслоение сетчатки, травма, лазер, фотодинамическая терапия, фотокоагуляция, гипоперфузия во время операции, радиационная ретинопатия, ретинопатия пересадки костного мозга. Пролиферативные расстройства: пролиферативная витреальная ретинопатия и эпиретинальные мембраны, пролиферативная диабетическая ретинопатия. Инфекционные расстройства: гистоплазмоз глаз, токсокариаз глаз, синдром предполагаемого гистоплазмоза глаз (СПГГ), эндофтальмит, токсоплазмоз, заболевания сетчатки, связанные с ВИЧ-инфекцией, заболевание сосудистой оболочки, связанные с ВИЧ-инфекцией, увеальное заболевание, связанное с ВИЧ-инфекцией, вирусный ретинит, острый некроз сетчатки, прогрессирующий наружный некроз сетчатки, грибковые заболевания сетчатки, сифилис глаз, туберкулез глаз, диффузный односторонний подострый нейроретинит и миаз. Генетические нарушения: пигментная дистрофия сетчатки, системные нарушения с ассоциированными дистрофиями сетчатки, врожденная постоянная ночная слепота, дистрофии колбочек сетчатки, болезнь Штаргардта, желтопятнистая абиотрофия сетчатки, болезнь Беста, узорчатая дистрофия пигментного эпителия сетчатки, ретиносхизис, связанный с Х-хромосомой, дистрофия глазного дна Сорсби, доброкачественная концентрическая макулопатия, дистрофия хрусталика Биетти, эластическая псевдоксантома. Разрывы/отверстия сетчатки: отслоение сетчатки, макулярное отверстие, гигантский разрыв сетчатки. Опухоли: заболевания сетчатки, ассоциированные с опухолями, врожденная гипертрофия пигментного эпителия сетчатки, задняя увеальная меланома, хороидальная гемангиома, хороидальная остеома, хороидальный метастаз, комбинированная гамартома сетчатки и пигментного эпителия сетчатки, ретинобластома, вазопролиферативные опухоли глазного дна, астроцитома сетчатки, внутриглазные лимфоидные опухоли. Разное: точечная наружная хороидопатия, острая задняя мультифокальная плакоидная пигментная эпителиопатия, миопическая дегенерация сетчатки, острый пигментный эпителиит сетчатки и подобное.
[0079] В одном примере варианта воплощения используется имплантат, состоящий из полилактида, ПЭГ и полилактид-гликолида и включающий анти-гипертензивный агент, так как имплантаты с таким составом обладают значительно меньшим воспалительным эффектом (например, меньшая гиперемия роговицы) при внутрикамерном или переднем интравитреальном введении. Другой вариант воплощения может включать систему доставки терапевтического агента со многими анти-гипертензивными агентам, содержащимися в различных сегментах одного и того же имплантата. Например, один сегмент имплантата может содержать мускариновый анти-гипертензивный агент, второй сегмент имплантата может содержать анти-гипертензивный простагландин и третий сегмент имплантата может содержать анти-гипертензивный бета-блокатор. Такой имплантат может быть введен для увеличения оттока внутриглазной жидкости через трабекулярную сеть, для усиления увеального потока и для снижения выработки внутриглазной жидкости. Множественные анти-гипертензивные агенты с различным механизмом действия могут быть более эффективными для снижения ВГД, чем монотерапия, то есть использование единичного типа анти-гипертензивного агента. Множественный сегментированный имплантат имеет преимущество - он позволяет использовать более низкие дозы каждого отдельно использованного терапевтического агента, чем доза, необходимая для монотерапии, тем самым снижая побочные эффекты каждого использованного терапевтического агента.
[0080] В одном варианте воплощения, когда используется множественно сегментированный имплантат, каждый сегмент предпочтительно имеет длину не более чем, приблизительно, 2 мм. Предпочтительно, общее количество введенных сегментов через ширококанальную иглу диаметром от 22G до 25G равняется, приблизительно, четырем. С иглой диаметром 27G общая длина сегментов в ширококанальной игле или в полости может быть до, приблизительно, 12 мм.
[0081] Действие по забору внутриглазной жидкости трабекулярной сетью может быть использовано для удержания имплантатов, которые имеют соответствующую геометрию, от перемещения по наружной камере, вызывающего затуманивание зрения. Сила тяжести влечет эти имплантаты вниз на положение, приблизительно, на 6 часов, например с, приблизительно, плюс или минус 20 градусов, и имплантаты в этом положении стабильны (неподвижны). Имплантаты, которые могут быть введены внутрь глаза при помощи иглы диаметром от 22 до 30G с общей длиной, составляющей не более, чем, приблизительно, от 6 до 8 мм, наиболее предпочтительны для использования преимущества механизма забора внутриглазной жидкости трабекулярной сетью, что в результате приводит к неподвижности внутриглазного имплантата без затуманивания зрения. Таким образом, будучи надежно размещенными в положении на 6 часов в передней камере благодаря эффекту забора внутриглазной жидкости трабекулярной сетью, имплантаты могут высвобождать уровни, превышающие уровни эффекта забора жидкости трабекулярной сетью, и это позволяет терапевтическим агентам быстро наполнять переднюю камеру и хорошо распределяться в ткани-мишени в соответствии со схемой распределения на 360 градусов. Исследование имплантатов в углу передней камеры при помощи гониоскопии продемонстрировало отсутствие инкапсуляции и воспалительной ткани рядом с имплантатами.
[0082] Доставка терапевтических агентов в переднюю часть глаза (переднюю камеру) может как снижать внутриглазное давление (ВГД), так и избегать агрессивного клиренса транссклеральных барьеров. Внутрикамерные инъекции (то есть прямые инъекции в переднюю камеру) описываемых здесь имплантатов и их инъекции в переднюю часть стекловидного тела через плоскую часть ресничного тела эффективно обходят транссклеральные барьеры и улучшают эффективность глазных анти-гипертензивных соединений. Важным является то, что настоящие имплантаты нуждались в разработке новых систем доставки с пролонгированным высвобождением терапевтического агента с особыми физическими свойствами и необходимой терапевтической эффективностью из-за уникальной анатомии и физиологии передней камеры.
[0083] В одном варианте воплощения в описываемых здесь имплантатах может использоваться биматопрост. Биматопрост может улучшать отток внутриглазной жидкости через трабекулярную сеть (ТС), опосредованный рецептором простамида. В человеческом глазу основным путем оттока является трабекулярный или традиционный путь оттока. Эта ткань содержит три различных слоя. От внутренней до самой наружной части слоем ткани, наиболее близко прилегающим к наружной камере, является увеальная сеть, образованная удлинениями соединительной ткани, происходящем из стромы радужной оболочки и ресничного тела, и покрытая эндотелиальными клетками. Этот слой не обеспечивает значительного сопротивления оттоку внутриглазной жидкости из-за большого размера межклеточных пространств. Следующий слой, известный как корнеосклеральная сеть, характеризуется наличием ламелл, покрытых клетками, подобными клеткам эндотелия на базальной мембране. Ламеллы образуются гликопротеинами, коллагеном, гиалуроновой кислотой и эластичными волокнами. Более упорядоченная организация корнеосклеральной сети по сравнению с увеальной сетью, а также более узкие межклеточные пространства ответственны за повышение сопротивления потоку. Третий слой, который находится в прямом контакте с внутренней стенкой эндотелиальных клеток канала Шлема, является юкстаканаликулярной сетью. Он образуется клетками, встроенными в плотный экстрацеллюлярный матрикс, и большая часть сопротивления ткани течению внутриглазной жидкости обусловлена этим слоем благодаря его узким межклеточным пространствам. Слой эндотелиальных клеток из канала Шлема имеет растяжимые поры, которые переносят внутриглазную жидкость в канал и ответственны за, приблизительно, 10% всей сопротивляемости. Считается, что внутриглазная жидкость пересекает эндотелий внутренней стенки Шлеммова канала благодаря двум различным механизмам: парацеллюлярный путь через соединения, образующиеся между эндотелиальными клетками, и трансцеллюлярный путь через внутриклеточные растяжимые поры тех же клеток. После попадания в Шлеммов канал (Фигура 2), внутриглазная жидкость просачивается прямо в коллекторные протоки и в водянистые вены, которые соединяются посредством анастомоза с эписклеральными и конъюнктивальными сосудистыми сетями. Отток внутриглазной жидкости через трабекулярную сеть зависим от ВГД, обычно он измеряется как активация оттока и выражается в микролитрах за минуту на миллиметр ртутного столбика.
[0084] Эписклеральное венозное давление контролирует отток через коллекторные каналы и является одним фактором, вносящим вклад во внутриглазное давление. Повышения эписклерального венозного давления, такие как наблюдаются при каротид-кавернозных свищевых фистулах, варикозе глазниц и синдроме Стерджа-Вебера, могут приводить к затруднениям в лечения глаукомы. Снижение эписклерального венозного давления при болезненных состояниях, таких как угрожающая каротид-кавернозная свищевая фистула, может нормализовать эписклеральное венозное давление и снизить внутриглазное давление. Фармакотерапевтическое воздействие на каналы и сосуды оттока для снижения эписклерального венозного давления может снизить ВГД.
Пример 1
[0085] Была проведена серия из трех экспериментов, в которой сравнивались колебания ВГД в динамике по времени в группах животных, подвергнутых лечению глазными каплями биматопроста, либо описываемым здесь внутрикамерным имплантатом с прологированным высвобождением биматопроста. Значения ВГД записывались во времени, и после дозирования рассчитывалось среднее значение ВГД для каждого животного. Для сравнения вариабельности контроля ВГД для каждого животного использовали стандартное отклонение (СО) от среднего значения и рассчитывали среднее от всех значений СО. Более низкие значения, например, относятся к меньшим колебания ВГД. Данное конечное значение СО было рассчитано для всех животных в группе топического дозирования и также рассчитано для всех животных, получающих внутрикамерный имплантат, значения сравнивались для определения того, были ли внутрикамерные имплантаты более эффективными в снижении колебаний ВГД.
[0086] Эксперимент 1: Шесть нормальных собак - биглей имели инсталляции в левый глаз по одной капле офтальмологического раствора 0,03% биматопроста (LUMIGAN®) один раз в день. Запись ВГД производилась при помощи пневмотонометра в, приблизительно, 10 часов утра. Таблица 1 демонстрирует записи в мм ртутного столбика, сделанные в недельные интервалы на протяжении 1 месяца у 6 собак, получавших ежедневно глазные капли биматопроста. Среднеарифметическое от средних значений СО для каждого животного составляет 1,38 мм рт.ст.
|
[0087] Эксперимент 2: Имплантат биматопроста, содержащий состав с 30% терапевтического агента, 45% R203S, 20% R202H и 5% ПЭГ 3350 был произведен с общим весом имплантата 900 мкг (нагрузка препаратом 270 мкг). Скорости высвобождения агента этого имплантата in vitro графически проиллюстрированы на Фигуре 4. Имплантат высвобождает, приблизительно, 70% в течение первых 30 дней. Имплантат с нагрузкой препарата в 270 мкг высвободит 189 мкг в течение первых 30 дней или 6,3 мкг в день. Остаток имплантата (81 мкг) высвобождается в течение следующих четырех месяцев (например, 675 мкг в день).
[0088] Нормальные собаки бигли получали общий наркоз и для введения в переднюю камеру правых глаз было использовано кератомическое лезвие шириной 3 мм. В переднюю камеру глаза был помещен имплантат биматопроста и он установился в нижнем углу в течение 24 часов. Результаты ВГД показаны в Таблице 2. Среднее значение средних показателей СО для каждого животного составляет 0,57 мм рт.ст., при этом у Собаки №4 значение СО в первый месяц составило 0.
|
[0089] Эксперимент 3: Был произведен дополнительный состав имплантата биматопроста, имеющий состав с 20% терапевтического агента, 45% R203S, 10% R202H, 20% RG752S и 5% ПЭГ 3350 с общим весом имплантата, приблизительно, 300 мкг (нагрузка препаратом составила, приблизительно, 60 мкг). Веса имплантатов указаны в Таблице 3, каждое животное получило по два имплантата. Скорости высвобождения препарата in vitro у этого имплантата показаны на Фигуре 5. Таблица 3 иллюстрирует вес имплантатов и нагрузки терапевтическим агентом, использованные у собак для Эксперимента 3. Каждое животное получило по 2 внутрикамерных имплантата в 1 глаз. Имплантаты высвобождали, приблизительно, 15% нагруженного препарата в течение первого месяца. Имплантат с 60 мкг нагруженного препарата высвободит 9 мкг в течение первых 30 дней или, соответственно, 300 нг в день. Другими словами, имплантат выделяет, приблизительно, 50 мкг в течение 60 дней или, приблизительно, 700 мкг в день.
|
[0090] Имплантаты были загружены в адаптированные аппликаторы со специальными иглами с ультратонкими стенками размера 25G. Под общим наркозом нормальным собакам биглям вводили имплантат в правую переднюю камеру через прозрачную роговицу и рана самостоятельно затягивалась. Каждое животное (n=3) получало два имплантата в правый глаз. Клинически имплантаты не демонстрировали воспаления, репрезентативный снимок имплантата в передней камере приведен на Фигуре 6. Результаты ВГД и СО средних значений в течение первого месяца приведены в Таблице 2. Среднеарифметическое от средних значений СО в Таблице 2 четырех собак (сумма) из экспериментов 2 и 3, получавших лечение имплантатами биматопроста, составило 0,57 мм рт.ст.
[0091] Вариабельность ВГД у собак в Эксперименте 1, получавших глазные капли биматопроста, по данным конечных значений СО составляла 1,38 мм рт.ст. В отличие от этого, конечное СО с имплантатами с пролонгированным высвобождением биматопроста составило 0,57 мм рт.ст. Наблюдалось, приблизительно, трехкратное снижение значения СО, демонстрирующее, что описываемый здесь имплантат с пролонгированным высвобождением биматопроста превосходит болюсное дозирование топическим биматопростом в снижении колебаний ВНД во времени.
[0092] Если не указано иначе, все числа, выражающие количество ингредиентов, свойства, такие как молекулярный вес, условия реакции и так далее, использованные в спецификации и заявке, следует понимать как модифицируемые во всех случаях при помощи термина «приблизительно». Соответственно, если не указано обратное, числовые параметры, указанные в спецификации и в прилагаемой формуле изобретения, являются приблизительными значениями, которые могут варьировать в зависимости от желаемых свойств, которые предполагается получить при настоящем изобретении. По крайней мере, и не в качестве попытки ограничить применение доктрины эквивалентов до масштаба формулы изобретения, каждый числовой параметр должен, по меньшей мере, истолковываться с учетом количества. Несмотря на то что числовые диапазоны и параметры, устанавливающие широкий объем изобретения, являются приблизительными значениями, числовые значения, указанные в отдельных примерах, приводятся настолько точно, насколько это возможно. Любое числовое значение, однако, по своей природе содержит определенные ошибки, которые обязательно возникают из стандартного отклонения, обнаруживаемого в соответствующих аналитических измерениях.
[0093] Обозначения (в английском языке - прим. переводчика) "a," "an," "the" и тому подобные ссылки, используемые в контексте описания изобретения (особенно в контексте следующей формулы изобретения), следует истолковывать как таковые, которые покрывают как единичное, так и множественное число, если при этом не указано иначе, или если этому нет явных противоречий в контексте. При этом перечисление диапазонов значений имеет единственную цель - служить методом сокращения индивидуального упоминания каждого отдельного значения, подпадающего под диапазон. Если здесь не указано иначе, каждое индивидуальное значение помещено в спецификацию так, как если бы на него была здесь сделана индивидуальная ссылка. Все описанные здесь методы могут быть выполнены любым подходящим способом, если не указано иначе, или если этому нет явных противоречий в контексте. Приведенное здесь использование любого и всех примеров или выражения, указывающего на примеры (например, «такой, как»), предназначено исключительно для лучшего освещения изобретения и не ставит ограничений для объема изобретения, заявляемого иным образом. Никакую формулировку в спецификации не следует рассматривать как указывающую на какой-либо незаявленный элемент, необходимый для осуществления данного изобретения.
[0094] Группирование альтернативных элементов или вариантов воплощения раскрываемого здесь изобретения не следует рассматривать как ограничения. Каждый член группы может упоминаться и заявляться отдельно или в какой-либо комбинации с другими членами группы, или другими обнаруживаемыми здесь элементами. Предполагается, что один или более членов группы может быть включен в группу или исключен из нее по причинам удобства и/или патентоспособности. Когда происходит подобное включение или исключение, спецификация считается содержащей группу с изменениями, тем самым выполняя письменное описание всех групп Маркуша, использованное в прилагаемой формуле изобретения.
[0095] Определенные варианты воплощения данного изобретения описываются здесь, включая наилучший способ, известный изобретателям, для осуществления данного изобретения. Естественно, после прочтения вышеизложенного описания, вариации данных описываемых вариантов воплощения станут очевидными для специалистов в данной области. Изобретатели надеются, что подобные вариации будут осуществляться специалистами в данной области надлежащим образом, и изобретатели предполагают, что изобретение будет применяться на практике иным образом, отличным от конкретно изложенного здесь способа. Соответственно, данное изобретение включает все модификации и эквиваленты объекта изобретения, перечисленные в прилагаемой формуле изобретения, в соответствии с действующим законодательством. Более того, любая комбинация вышеописанных элементов во всех возможных вариациях заключается в изобретении, если здесь не указано иначе или если этому нет явных противоречий в контексте.
[0096] Более того, в этой спецификации были сделаны многочисленные ссылки на патенты и печатные публикации. Каждая цитированная выше ссылка и печатная публикация здесь приведены отдельно путем ссылки на их полный объем.
[0097] В заключение, следует понимать, что варианты воплощения описываемого здесь изобретения являются иллюстрацией принципов данного изобретения. Могут быть применены другие модификации в рамках объема изобретения. Так, только приводя пример, но не ставя ограничений, может быть использована альтернативная структура настоящего изобретения в соответствии с указанными здесь доктринами. Соответственно, настоящее изобретение не ограничено строго тем, что было показано и описано.