Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ СИММЕТРИЧНОГО И НЕСИММЕТРИЧНОГО ДИБЕНЗО-КРАУН-ЭФИРОВ
Вид РИД
Изобретение
Изобретение относится к способам получения макроциклического полиэфира (дибензо-краун-эфира) общей формулы 3, который находит применение в качестве селективных экстрагентов катионов металлов, в том числе радиоактивных [Успехи химии, 2000, т. 69, №9, С. 769-782].
Известны способы получения соединения общей формулы 3 взаимодействием бис(2-гидроксифенил)ового эфира олигоэтиленгликоля общей формулы 1 с дихлор-замещенным олигоэтиленгликолем общей формулы 2 в органическом растворителе, в присутствии щелочного агента при нагревании, в токе инертного газа.
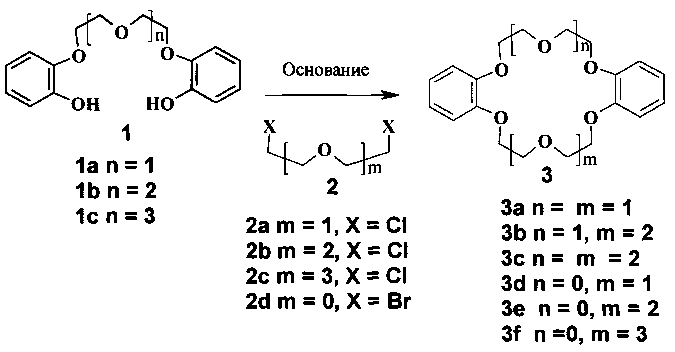
В патенте РФ №2178788 описан способ синтеза дибензо-21-краун-7 (3b) взаимодействием эквимолярных количеств 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a и 1,5-дихлор-3-оксапентана (β,β′-дихлорэтилового эфира) 2a в абсолютном изо-пропаноле в присутствии гидроксида калия при нагревании в токе инертного газа при повышенной скорости перемешивания (до 1500 об/мин). По окончании реакции (10 часов) реакционную массу подкисляют, целевой продукт высаживают водой, очищают перекристаллизацией из абсолютного изо-пропанола. Выход соединения 3b по данным авторов составляет 81-83%, при этом не приведены физико-химические свойства получаемого соединения 3b, не указано содержание основного вещества в продукте. О чистоте продукта авторы судят по пробе смешения с заведомо чистым образцом соединения 3b, при этом температура плавления полученного ими образца 100.5-106°C может свидетельствовать о его недостаточной чистоте. По нашим данным, в условиях, указанных в этом патенте, выход дибензо-21-краун-7 (3b) не превышает 40% (по результатам ГЖХ), что связано с низкой хемоселективностью реакции в условиях, описанных авторами патента. К недостаткам патента следует отнести необходимость использования абсолютного растворителя и сложное аппаратурное оформление процесса.
В авторском свидетельстве СССР №1728246 описано получение несимметричного дибензо-краун-эфира 3d-f путем взаимодействия бис(2-гидроксифенил)ового эфира олигоэтиленгликоля 1a-c с 1,2-дибромэтаном 2d в присутствии щелочи (KOH или NaOH) при кипении изоамилового спирта с водоотделителем Дина-Старка в атмосфере азота. Время реакции 10 часов. Целевой продукт экстрагируют тремя порциями по 100 мл кипящей смеси бензол-гептан (2:3), очищают перекристаллизацией из минимального количества гептана. Получают дибензо-15-краун-5 (3d) (выход 50%), [2,4]дибензо-18-краун-6 (3e) (выход 42%), [2,5]дибензо-21-краун-7 (3f) (выход 33%). Недостатками способа являются сложная очистка целевых продуктов и их низкие выходы, большой расход органических растворителей, а также сложное аппаратурное оформление процесса.
Описан способ синтеза симметричного и несимметричного дибензо-краун-эфиров формулы 3a, 3b, 3d, 3e [J.Am.Chem.Soc, 1977, v. 89, p. 2564-2571], который выбран нами в качестве прототипа. Способ осуществляют взаимодействием эквимолярных количеств бис(2-гидроксифенил)ового эфира олигоэтиленгликоля общей формулы 1a-c с дихлор-замещенным олигоэтиленгликолем общей формулы 2a-c в н-бутаноле в присутствии гидроксида натрия при нагревании в токе инертного газа. По окончании реакции (через 20 часов) н-бутанол отгоняют, реакционную массу подкисляют, высаживают водой, технический продукт отфильтровывают, побочные продукты экстрагируют ацетоном. Целевой продукт промывают ацетоном и сушат. По этому способу дибензо-18-краун-6 (3a) получают с выходом 80%, дибензо-21-краун-7 (3b) с выходом 36%, дибензо-15-краун-5 (3d) с выходом 43%, [2,4]дибензо-18-краун-6 (3e) с выходом 25%. Недостатками данного способа являются большой расход органических растворителей, длительность процесса и его сложное аппаратурное оформление. Способ отличает низкая универсальность - его эффективность заметно снижается при переходе от симметричного к несимметричному дибензо-краун-эфиру, что выражается в значительном снижении выхода целевого продукта.
С целью создания способа получения симметричного и несимметричного дибензо-краун-эфиров, который сочетал бы универсальность, экологическую безопасность и возможность его промышленного использования, предлагается новый способ получения соединения 3a-f, отличающийся использованием гетерогенного катализатора - оксида металла или кремния, преимущественно наноразмерного. Новый способ получения симметричного и несимметричного дибензо-краун-эфиров общей формулы 3 осуществляют путем взаимодействия бис(2-гидроксифенил)ового эфира олигоэтиленгликоля общей формулы 1 с дихлор-замещенным олигоэтиленгликолем общей формулы 2 в присутствии катализатора и гидроксида натрия при температуре 100-110°C в ДМФА. В качестве катализатора может использоваться оксид кремния, а также основный либо амфотерный оксид металла, преимущественно наноразмерный. По окончании реакции (12 часов) продукт высаживают водой, фильтруют, промывают ацетоном и сушат.
Предлагаемый способ отличается от способа-прототипа использованием гетерогенного катализатора - оксида металла или кремния, что значительно повышает хемоселективность процесса. Это происходит за счет особых свойств оксидов металлов или кремния, особенно наноразмерных - высокоразвитой поверхности и наличия активных центров различной природы [A. Davydov. Molecular Spectroscopy of Oxide Catalyst Surfaces. Wiley, 2002]. Сорбция реагентов способствует их активации и прохождению реакции в нужном направлении, а также ингибированию побочных процессов [Кинетика и катализ, 2010, №4, С. 590-596]. Использование этого явления в заявляемом изобретении позволяет достичь технического результата, заключающегося в увеличении хемоселективности реакции, что выражается в увеличении выхода целевых соединений, снижении продолжительности реакции, а также значительном упрощении аппаратурного оформления процесса.
В предлагаемом способе, так же, как и в прототипе, исходные бис(2-гидроксифенил)овый эфир олигоэтиленгликоля общей формулы 1a-c и дихлор-замещенный олигоэтиленгликоль общей формулы 2a-c берутся в эквимолярных количествах, в качестве щелочного агента используется гидроксид натрия. Отличается процедура выделения целевого продукта. Исключена стадия отгонки растворителя и подкисления реакционной массы. Реакционную массу после окончания реакции сразу разбавляют водой, технический продукт отделяют фильтрованием. Основным отличием от прототипа является использование гетерогенного катализатора - оксида кремния или оксида металла (амфотерного или основного), преимущественно наноразмерного. За счет повышения хемоселективности процесса выходы целевых продуктов повышаются, снижается продолжительность процесса, отпадает необходимость в использовании инертного газа, упрощается процесс выделения целевого продукта.
Предлагаемый способ осуществляют взаимодействием эквимолярных количеств бис(2-гидроксифенил)ового эфира олигоэтиленгликоля общей формулы 1, дихлор-замещенного олигоэтиленгликоля общей формулы 2 и гидроксида натрия, в присутствии 25 мол.% катализатора - оксида кремния или оксида металла (амфотерного или основного), преимущественно наноразмерного, при перемешивании в ДМФА, при температуре 100-110°C. По окончании реакции (12 часов) катализатор отделяют фильтрованием, продукт высаживают водой, фильтруют, промывают водой, ацетоном и сушат. Получают чистые соединения 3a-f с выходами 43.1-85.9% (3a - 85.9%, 3b - 85.3%, 3c - 68.0%, 3d - 65.2%, 3e - 52.6%, 3f - 43.1%). Содержание основного вещества в соединениях 3a-f составляет не менее 99% по данным газожидкостной хроматографии. Физико-химические характеристики соединений 3a-f соответствуют литературным данным.
Патентуемый способ более универсален, нежели известные способы, поскольку позволяет получать как симметричные, так и несимметричные дибензо-краун-эфиры с хорошими выходами.
Изобретение иллюстрируется следующими примерами
Пример 1.
В реактор загружают 150 мл ДМФА, 61.7 г (2.0 ммоль) 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a, 16.0 г (4.0 ммоль) гидроксида натрия и 4.07 г (0.5 ммоль) наноразмерного ZnO, реакционную массу перемешивают при температуре 70-80°C до образования динатриевой соли 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a (около 30 мин). После чего добавляют 28.60 г (2.0 ммоль) 1,5-дихлор-3-оксапентана (β,β′-дихлорэтилового эфира) 2a, температуру реакционной массы поднимают до 105-110°C и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (200 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 20 мл и сушат на воздухе. Получают 61.88 г чистого соединения 3a с выходом 85.9%.
Пример 2.
В реактор загружают 150 мл ДМФА, 61.7 г (2.0 ммоль) 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a, 16.0 г (4.0 ммоль) гидроксида натрия и 2.02 г (0.5 ммоль) наноразмерного MgO, реакционную массу перемешивают при температуре 70-80°C до образования динатриевой соли 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a (около 30 мин). После чего добавляют 28.60 г (2.0 ммоль) 1,5-дихлор-3-оксапентана (β,β′-дихлорэтилового эфира) 2a, температуру реакционной массы поднимают до 105-110°C и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (200 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 20 мл и сушат на воздухе. Получают 61.81 г чистого соединения 3a с выходом 85.8%.
Пример 3.
В реактор загружают 150 мл ДМФА, 61.7 г (2.0 ммоль) 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a, 16.0 г (4.0 ммоль) гидроксида натрия и 1.40 г (0.5 ммоль) наноразмерного SiO2, реакционную массу перемешивают при температуре 70-80°C до образования динатриевой соли 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a (около 30 мин). После чего добавляют 28.60 г (2.0 ммоль) 1,5-дихлор-3-оксапентана (β,β′-дихлорэтилового эфира) 2a, температуру реакционной массы поднимают до 105-110°C и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (200 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 20 мл и сушат на воздухе. Получают 61.59 г чистого соединения 3a с выходом 85.5%.
Пример 4.
В реактор загружают 150 мл ДМФА, 70.46 г (2.0 ммоль) 1,8-бис(2-гидроксифенокси)-3,6-диоксаоктана моногидрата 1b, 16.0 г (4.0 ммоль) гидроксида натрия и 7.77 г (0.5 ммоль) наноразмерного BaO, реакционную массу перемешивают при температуре 70-80°C до образования динатриевой соли 1,8-бис(2-гидроксифенокси)-3,6-диоксаоктана lb (около 30 мин). После чего добавляют 37.40 г (2.0 ммоль) 1,8-дихлор-3,6-диоксаоктана 2b, температуру реакционной массы поднимают до 105-110°C и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (200 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 20 мл и сушат на воздухе. Получают 68.92 г чистого соединения 3b с выходом 85.3%.
Пример 5.
В реактор загружают 150 мл ДМФА, 70.46 г (2.0 ммоль) 1,8-бис(2-гидроксифенокси)-3,6-диоксаоктана моногидрата 1b, 16.0 г (4.0 ммоль) гидроксида натрия и 2.39 г (0.5 ммоль) наноразмерного TiO2, реакционную массу перемешивают при температуре 70-80°С до образования динатриевой соли 1,8-бис(2-гидроксифенокси)-3,6-диоксаоктана 1b (около 30 мин). После чего добавляют 37.40 г (2.0 ммоль) 1,8-дихлор-3,6-диоксаоктана 2b, температуру реакционной массы поднимают до 105-110°C и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (200 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 20 мл и сушат на воздухе. Получают 68.73 г чистого соединения 3b с выходом 85.0%.
Пример 6.
В реактор загружают 150 мл ДМФА, 79.26 г (2.0 ммоль) 1,11-бис(2-гидроксифенокси)-3,6,9-триоксаундекана моногидрата 1 с, 16.0 г (4.0 ммоль) гидроксида натрия и 5.10 г (0.5 ммоль) наноразмерного Al2O3, реакционную массу перемешивают при температуре 70-80°C до образования динатриевой соли 1,11-бис(2-гидроксифенокси)-3,6,9-триоксаундекана моногидрата 1 с (около 30 мин). После чего добавляют 46.20 г (2.0 ммоль) 1,11-дихлор-3,6,9-триоксаундекан 2 с, температуру реакционной массы поднимают до 105-110°C и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (200 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 20 мл и сушат на воздухе. Получают 60.93 г чистого соединения 3c с выходом 68.0%.
Пример 7.
В реактор загружают 150 мл ДМФА, 79.26 г (2.0 ммоль) 1,11-бис(2-гидроксифенокси)-3,6,9-триоксаундекана моногидрата 1c, 17.6 г (4.0 ммоль) гидроксида натрия и 3.98 г (0.5 ммоль) наноразмерного CuO, реакционную массу перемешивают при температуре 70-80°C до образования динатриевой соли 1,11-бис(2-гидроксифенокси)-3,6,9-триоксаундекана моногидрата 1 с (около 30 мин). После чего добавляют 46.20 г (2.0 ммоль) 1,11-дихлор-3,6,9-триоксаундекан 2c, температуру реакционной массы поднимают до 105-110°C и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (200 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 20 мл и сушат на воздухе. Получают 60.93 г чистого соединения 3c с выходом 68.0%.
Пример 8.
В реактор загружают 150 мл ДМФА, 61.7 г (2.0 ммоль) 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a, 16.0 г (4.0 ммоль) гидроксида натрия и 4.07 г (0.5 ммоль) наноразмерного ZnO, реакционную массу перемешивают при температуре 70-80°C до образования динатриевой соли 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a (около 30 мин). После чего добавляют 37.57 г (2.0 ммоль) дибромэтана 2d, температуру реакционной массы поднимают до 105-110°C и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (200 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 20 мл и сушат на воздухе. Получают 47.07 г чистого соединения 3d с выходом 65.2%.
Пример 9.
В реактор загружают 150 мл ДМФА, 61.7 г (2.0 ммоль) 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a, 16.0 г (4.0 ммоль) гидроксида натрия и 11.16 г (0.5 ммоль) наноразмерного PbO, реакционную массу перемешивают при температуре 70-80°C до образования динатриевой соли 1,5-бис(2-гидроксифенокси)-3-оксапентана моногидрата 1a (около 30 мин). После чего добавляют 37.57 г (2.0 ммоль) дибромэтана 2d, температуру реакционной массы поднимают до 105-110°C и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (200 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 20 мл и сушат на воздухе. Получают 47.07 г чистого соединения 3d с выходом 65.2%.
Пример 10.
В реактор загружают 400 мл ДМФА, 70.46 г (2.0 ммоль) 1,8-бис(2-гидроксифенокси)-3,6-диоксаоктана моногидрата lb, 16.0 г (4.0 ммоль) гидроксида натрия и 7.77 г (0.5 ммоль) ВаО, реакционную массу перемешивают при температуре 70-80°C до образования динатриевой соли 1,8-бис(2-гидроксифенокси)-3,6-диоксаоктана 1b (около 30 мин). После чего добавляют 37.57 г (2.0 ммоль) дибромэтана 2d, температуру реакционной массы поднимают до 105-110°c и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (300 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 50 мл и сушат на воздухе. Получают 37.87 г чистого соединения 3e с выходом 52.6%.
Пример 11.
В реактор загружают 150 мл ДМФА, 79.26 г (2.0 ммоль) 1,11-бис(2-гидроксифенокси)-3,6,9-триоксаундекана моногидрата 1 с, 16.0 г (4.0 ммоль) гидроксида натрия и 5.10 г (0.5 ммоль) Al2O3, реакционную массу перемешивают при температуре 70-80°C до образования динатриевой соли 1,11-бис(2-гидроксифенокси)-3,6,9-триоксаундекана моногидрата 1 с (около 30 мин). После чего добавляют 37.57 г (2.0 ммоль) дибромэтана 2d, температуру реакционной массы поднимают до 105-110°C и продолжают интенсивно перемешивать в течение 12 часов. Реакционную массу охлаждают, фильтруют от катализатора, разбавляют водой (200 мл), выделившийся осадок отделяют фильтрованием, промывают тремя порциями ацетона по 20 мл и сушат на воздухе. Получают 34.82 г чистого соединения 3f с выходом 43.1%.
Способ получения симметричного и несимметричного дибензо-краун-эфиров взаимодействием эквимолярных количеств бис(2-гидроксифенил)ового эфира олигоэтиленгликоля с дихлорзамещенным олигоэтиленгликолем в присутствии щелочного агента в среде органического растворителя при нагревании, отличающийся тем, что в качестве органического растворителя используют ДМФА, а процесс ведут в присутствии катализатора - оксида кремния либо оксида металла амфотерного или основного характера, преимущественно наноразмерного.
