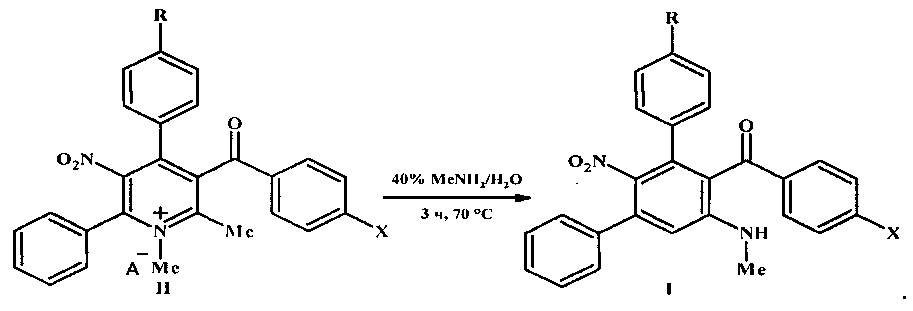
Результат интеллектуальной деятельности: СПОСОБ СИНТЕЗА ЗАМЕЩЕННЫХ МЕТА-ТЕРФЕНИЛОВ
Вид РИД
Изобретение
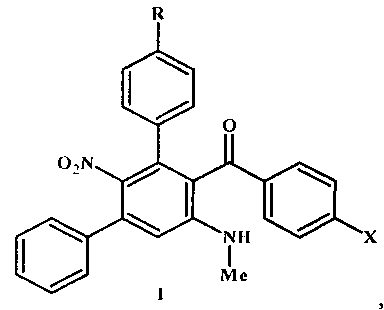
Изобретение относится к области органической химии и конкретно к способу получения несимметричных замещенных мета-терфенилов: (арил)[5′-(метиламино)-2′-нитро-1,1′:3′,1″-терфенил-4′-ил]метанонов общей формулы I
где R=Н, ОМе; X=Me, ОМе, Cl, Br, которые могут найти применение в органическом синтезе, в производстве биологически активных веществ, в том числе лекарственных препаратов.
Близкие структурные аналоги соединения формулы I используются при создании электронпроводящих материалов для высокоэффективных фосфоресцирующих светодиодов (OLED) [Н. Sasabe, Y. Seino, М. Kimura, J. Kido, A m-Terphenyl-Modifed Sulfone Derivative as a Host Material for High-Efficiency Blue and Green Phosphorescent OLEDs // J. Chem. Mater., 2012, Vol. 24, №8, p. 1404-1406; C.-A. Wu, H.-H. Chou, C.-H. Shih, F.-I. Wu, C.-H. Cheng, H.-L. Huang, T.-C. Chao, M.-R. Tseng, Synthesis and physical properties of meta-terphenyloxadiazole derivatives and their application as electron transporting materials for blue phosphorescent and fluorescent devices // J. Mater. Chem., 2012, Vol. 22, №34, p.17792-17779]; в качестве строительных блоков в синтезе циклофанов, используемых для молекулярного распознавания ионов металлов, а также в качестве лигандов металлокомплексных катализаторов полимеризации [D. Н. Camacho, E.V. Salo, Z. Guan, Synthesis and Structure of m-Terphenyl-Based Cyclophanes with Nitrogen Intra-annular Functional Groups // Org. Lett., 2004, Vol. 6, №6, p. 865-868]; жесткоцепных ароматических полиамидов, обладающих уникальными механическими и оптическими свойствами [I. К. Spiliopoulos, J. A. Mikroyannidis, Soluble Phenyl-or Alkoxyphenyl-Substituted Rigid-Rod Polyamides and Polyimides Containing m-Terphenyls in the Main Chain // Macromolecules. 1998, Vol. 31, №4, p.1236-1245], координационных сетчатых полимеров, имеющих структуру цеолитов [D. A. Dickie, М. С.Jennings, Н. A. Jenkins, J. А. С.Clyburne, A Zinc Carboxylate Network Containing Metal Sites with Low Coordination Numbers // Inorg. Chem., 2005, Vol. 44, №4, p. 828-830].
Природный мета-терфенил - диктиотерфенил А, выделенный из плодовых тел слизевика Dictyostelium polycephalum, ингибирует пролиферацию раковых клеток клеточных линий человека: К562 (лейкемия), HeLa (рак шейки матки), НСТ116 (рак кишечника) и MCF-7 (аденокарцинома груди) в концентрации IC50 мкМ [Н. Kikuchi, Y. Matsuo, Y. Katou, Y. Kubohara, Y. Oshima, Isolation, synthesis, and biological activity of biphenyl and m-terphenyl-type compounds from Dictyostelium cellular slime molds // Tetrahedron, 2012, Vol. 68, №43, p. 8884-8889]. Лигнаны ряда мета-терфенилов - макрантол, дунниалол и симосинол, выделенные из околоплодников и коры китайского растения Illucium macranthum, проявляют антидепрессантную активность [J.-K. Liu, Natural Terphenyls:D Developments since 1877 // Chem. Rev., 2006, Vol. 106, №6, p. 2209-2223].
Известны также синтетические производные мета-терфениламинов, которые были разработаны как селективные ингибиторы дигидрооротатдегидрогеназы [А. Е Sutton, J. Clardy, The synthesis of potentially selective inhibitors of dihydroorotate dehydrogenase. The utilization of chemoselective Suzuki cross-coupling reactions in a parallel synthesis // Tetrahedron. Lett., 2001, Vol. 42, №4, p. 547-551; J. D. Bauer, M. S. Foster, J. D. Hugdahl, K.L. Burns, S.W. May, S.H. Pollock, H.G. Cutler, S.J. Cutler, Synthesis and pharmacological evaluation of m-terphenyl amines as cyclooxygenase inhibitors // Med. Chem. Res., 2007, Vol. 16, №3, p. l19-129; T. Li, Y. Yang, C. Cheng, A.K. Tiwari, K. Sodani, Y. Zhao, I. Abraham, Z.-S. Chen, Design, synthesis and biological evaluation of N-arylphenyl-2,2-dichloroacetamide analogues as anti-cancer agents // Bioorg. Med. Chem. Lett., 2012, Vol. 22, №23, p. 7268-7271].
Известно три основных препаративных метода синтеза мета-терфенилов. Первый из них основан на перегруппировке пирилиевых солей под действием С-нуклеофилов [К. Dimroth, G. Neubauer. Kondensationen von 2,4,6-Triphenylpyrilium-fluoroborat mit Malonsaure-diathylester und mit Malonodinitril // Chem. Ber., 1959, Vol. 92, №9, S.. 2046-2051; K. Dimroth, K. Vogel, W. Krafft, Arylierte Benzoesauren aus Pyryliumsalzen // Chem. Ber., 1968, Bd 101, 2215-2223; T. Zimmermann, G. W. Fischer, Pyryliumverbindungen. 31 Reaktion 3-alkylsubstituierter 2,4,6- Triaryl-pyryliumsalze mit 1,3-Diketonaten: Ein Weg zur Darsstellung 3-acylsubstituierter Benzophenone // J. Prakt. Chem.- 1986, Bd 328, №3, S. 359-372]. Примером первого подхода является синтез мета-терфенилов с нитрогруппой в центральном бензольном кольце рециклизацией 1,3,5-трифенилпирилиевых солей под действием карбаниона нитрометана, генерируемого депротонированием нитрометана тpeт-бутилатом калия в трет-бутиловом спирте [К. Dimroth, Neuere Methoden der präparativen organischen Chemie III. 3. Aromatische Verbindungen aus Pyryliumsalzen // Angew. Chem., 1960, Vol. 72, №10, p. 331-342; A. Markovac, M. P. LaMontagne, Antimalarials. 12. Preparation of Carbon Isosteres of Selected 4-Pyridinemethanols as Suppressive Antimalarials // J. Med. Chem., 1980, Vol. 23, №11, p. 1198-1201]. Рециклизация протекает с включением реагента в структуру продукта реакции. Недостатком метода является необходимость использования абсолютных растворителей и низкий выход функционально замещенных пирилиевых солей.
Второй метод синтеза м-терфенилов - взаимодействие халконов с СН-кислотными соединениями с образованием 3,5-диарилциклогексен-2-онов, с последующим превращением кольца циклогексен-2-онов в бензольный цикл центрального ядра м-терфенилов в четыре стадии («халконный путь»). [Griot R.G. Substituted Terphenyls, Патент US 3741974; Grot R.G. Aminoalkoxy-Terphenyls and the salts thereof, Патент US 3928449]. Недостатком метода является высокая стадийность синтеза м-терфенилов.
Третьим методом синтеза мета-терфенилов являются палладий и никель катализируемые реакции кросс-сочетания между арилгалогенидами (либо псевдогалогенидами) и металлорганическими соединениями [Yin L., Liebscher J. Carbon -Carbon Coupling Reactions Catalyzed by Heterogeneous Palladium Catalysts // Chem. Rev., 2007, Vol. 107, №1, p. 133-173; Littke A. F., Fu G. C. Palladium-Catalyzed Coupling Reactions of Aryl Chlorides // Angew. Chem. Int. Ed. Engl., 2002, Vol. 41, №22, p. 4176-4211]. Этот метод использован в синтезе несимметричных м-терфенилов последовательным взаимодействием арилбороновых кислот с фенил- и арилбромидами через промежуточное образование бифенила [Sharp М. J. Cheng W., Snieckus V. Synthetic connections to the aromatic directed metalation reaction. Functionalized aryl boronic acids by ipso borodesilylation. General syntheses of unsymmetrical biphenyls and m-terphenyls, Tetrahedron Lett., 1987, Vol. 28, №43, p. 5093-5096; Sutton A. E., Clardy J. The synthesis of potentially selective inhibitors of dihydroorotate dehydrogenase. The utilization of chemoselective Suzuki cross-coupling reactions in a parallel synthesis, Tetrahedron Lett., 2001, Vol. 42, №1, p. 547-551]. Симметричные м-терфенилы с нитрогруппой в центральном бензольном кольце были синтезированы кросс-сочетанием нитродибромидов с 4-цианофенилборными кислотами [D.A. Patrick, Ismail М. A., Arafa R. К., Wenzler Т., Zhu X., Pandharkar Т., Jones S. К., Werbovetz К. A., Brun R., Boykin D. W., Tidwell R. R. Synthesis and Antiprotozoal Activity of Dicationic m-terphenyl and 1,3-Dipyridylbenzene Derivatives // J. Med. Chem., 2013, Vol. 56, №13, p. 5473-5494]. Недостатком реакции кросс-сочетания является высокая стоимость палладиевых катализаторов (солей палладия и лигандов) и токсичность палладия.
Технической задачей настоящего изобретения является разработка принципиально нового метода синтеза несимметричных замещенных мета-терфенилов, характеризующегося малой стадийностью, низкими материальными и временными затратами, высоким выходом целевых продуктов, а также получение ранее неизвестных мета-терфенилов перегруппировкой четвертичных пиридиниевых солей, синтез которых осуществляется алкилированием доступных нитропиридинов, получаемых в две стадии по реакции Ганча.
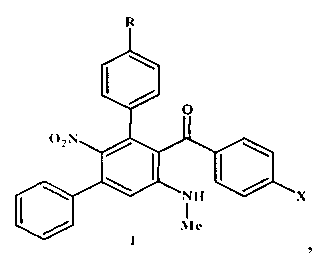
Технический результат достигается тем, что предложен способ синтеза замещенных мета-терфенилов: (арил)[5′-(метиламино)-2′-нитро-1,1′:3′,1″-терфенил-4′-ил]метанонов общей формулы I
где R=Н, ОМе; X=Me, ОМе, Cl, Br,
заключающийся в том, что четвертичные соли 4-арил-3-ароил-1,2-диметил-5-нитро-6-фенилпиридиния общей формулы II подвергают перегруппировке под действием 40%-ного водного метиламина в замещенные мета-терфенилы общей формулы I
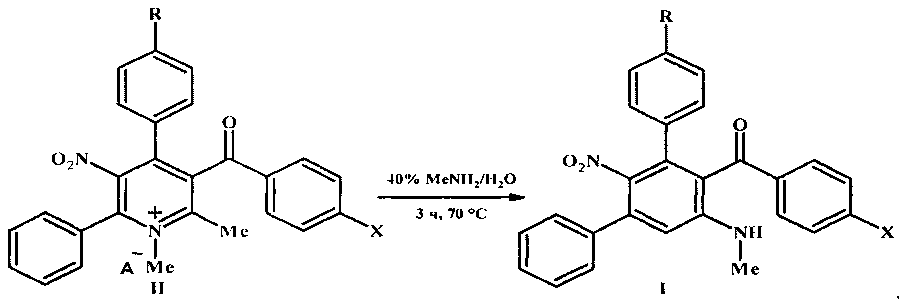
где I, II R=Н, ОМе; X=Me, ОМе, Cl, Br;
II R=Н, А-=MeOSO3; R=ОМе, А-=ClO4.
Возможность достижения технического результата обеспечивается тем, что в способе получения мета-терфенилов формулы I четвертичные соли 5-нитропиридиния формулы II при нагревании с 40%-ным водным метиламином перегруппировываются в соединения формулы I. Перегруппировка Коста-Сагитуллина солей пиридиния II протекает как изомеризационный процесс - с разрывом связи 1,2 ядра пиридина и замыканием новой связи С-С центрального бензольного цикла мета-терфенилов I:
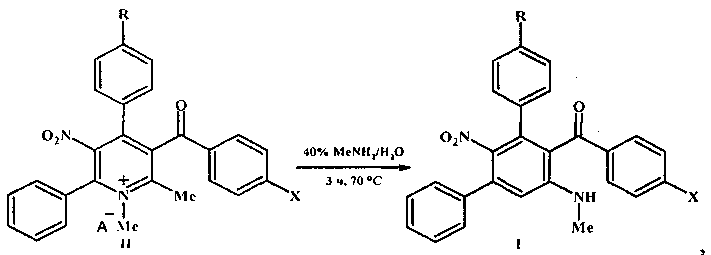
где I, II R=Н, ОМе; X=Me, ОМе, Cl, Br;
II R=Н, А-=MeOSO3; R=ОМе, А-=ClO4.
Соли пиридиния формулы II получали нагреванием нитропиридинов формулы III с диметилсульфатом при температуре 80°C:
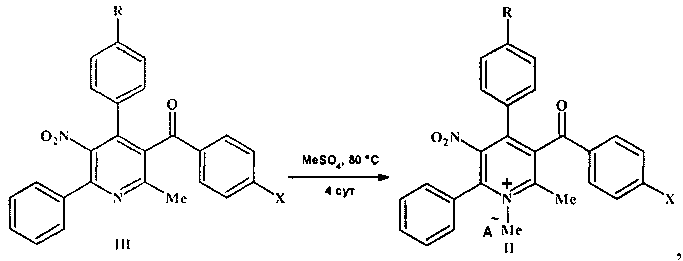
где II, III R=Н, ОМе; X=Me, ОМе, Cl, Br;
IIR=Н, А-=MeOSO3; R=ОМе, А-=ClO4.
Нитропиридины формулы III получали окислением 1,4-дигидропиридинов формулы IV нитритом натрия в уксусной кислоте при температуре 60-70°С. Исходные 1,4-дигидропиридины синтезировали гетероциклизацией нитрохалконов формулы VI с енаминами формулы V в уксусной кислоте при комнатной температуре:
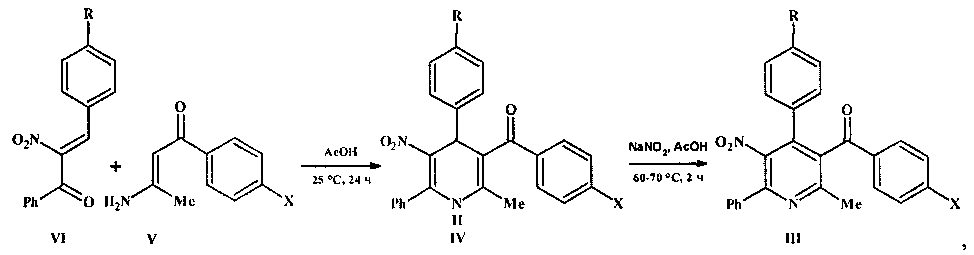
где III-VI R=Н, ОМе; X=Me, ОМе, Cl, Br.
Возможность достижения технического результата заявляемого решения, также раскрывается на следующих примерах: предварительного этапа синтеза - А), Б), В) с получением соединений формул (IV), (III), (II) и заключительного этапа синтеза - Г) с получением соединений формулы I.
А) Общая методика синтеза 4-арил-5-нитро-6-фенил-1,4-дигидропиридинов (IV)
Раствор 10 ммоль α,β-непредельного нитрокетона VI [Соколов Н.А, Тищенко И.Г., Карпицкая Н.В., Гринкевич В.Г. Синтез и свойства некоторых α-нитрохалконов // Вест. Белорусского университета, 1978, Сер. 2, №3, с. 29-33], 10 ммоль енамина V [Singh В., Lesher G. Y., A facile and novel synthesis of l,6-naphthyridin-2(lH)-ones // J. Heterocycl. Chem., 1990, Vol. 27, №7, p. 2085-2091; Valduga C.J., Squizani A., Braibante H.S., Braibante M.E. F. The Use of К-10/Ultrasound in the Selective Synthesis of Unsymmetrical β-Enamino Ketones // Synthesis, 1998, №7, p. 1019-1022] в 15 мл ледяной уксусной кислоты перемешивают в течение 24 часов при комнатной температуре. Реакционную смесь разбавляют диэтиловым эфиром (20 мл) и отфильтровывают выпавшие кристаллы. Продукт чист для дальнейшего использования.
(2-Метил-5-нитро-4,6-дифенил-1,4-дигидропиридин-3-ил)(4-метилфенил)метанон. Выход 55%, Тпл=204-205°C (изопропанол). Найдено, %: С 76.10; Н 5.48; N 6.73. C26H22N2O3. Вычислено, %: С 76.08; Н 5.40; N 6.82. ИК-спектр, (ν, см-1): 3306 (NH); 1633 (С=O), 1493, 1294 (NO2). Спектр ЯМР 1H(CDCl3, δ, м.д.): 1.81 (с, 3Н, 2-СН3), 2.38 (с, 3Н, 4′-СН3), 5.57 (с, 1Н, 4-Н), 6.02 (уш. с, 1Н, NH), 7.15-7.21 (м, 3Н, Ph), 7.25-7.28 (м, 4Н, С6Н4), 7.38-7.52 (м, 7Н, Ph).
(2-Метил-5-нитро-4,6-дифенил-1,4-дигидропиридин-3-ил)(4-метоксифенил)метанон. Выход 60%, Тпл=200-201°C (этанол). Найдено, %: С 73.30; Н 5.27; N 6.60. C26H22N2O4. Вычислено, %: С 73.22; Н 5.20; N 6.57. ИК-спектр, (ν, см-1): 3252 (NH); 1629 (С=O), 1492, 1252 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.78 (с, 3Н, 2-СН3), 3.84 (с, 3Н, 4′-CH3O), 5.54 (с, 1Н, 4-Н), 6.07 (уш. с, 1Н, NH), 6.83-6.88 (м, 2Н, С6Н4), 7.14-7.20 (м, 1H, Ph), 7.23-7.29 (м, 4Н, Ph), 7.37-7.48 (м, 5Н, Ph), 7.56-7.60 (м, 2Н, С6Н4).
(2-Метил-5-нитро-4,6-дифенил-1,4-дигидропиридин-3-ил)(4-хлорфенил)метанон. Выход 56%, Тпл=193-194°C (изопропанол). Найдено, %: С 69.70; Н 4.47; N 6.62. C25H19CIN2O3. Вычислено, %: С 69.69; Н 4.44; N 6.50. ИК-спектр, (ν, см-1): 3303 (NH); 1642 (С=O), 1487, 1295 (NO2). Спектр ЯМР 1H(CDCl3, δ, м.д.): 1.80 (с, 3Н, 2-СН3), 5.53 (с, 1Н, 4-Н), 6.10 (уш. с, 1Н, NH), 7.17-7.27 (м, 5Н, С6Н4, Ph), 7.34-7.51 (м, 9Н, С6Н4, Ph).
(2-Метил-5-нитро-4,6-дифенил-1,4-дигидропиридин-3-ил)(4-бромфенил)метанон. Выход 57%, Тпл=205-206°C (изопропанол). Найдено, %: С 63.22; Н 4.07; N 5.99. C25H19BrN2O3. Вычислено, %: С 63.17; Н 4.03; N 5.89. ИК-спектр, (ν, см-1): 3295 (NH); 1637 (С=O), 1483, 1300 (NO2). Спектр ЯМР 1H(CDCl3, δ, м.д.): 1.83 (с, 3Н, 2-СН3), 5.54 (с, 1Н, 4-Н), 6.01 (уш. с, 1H, NH), 7.18-7.27 (м, 5Н, С6Н4, Ph), 7.37-7.56 (м, 9Н, С6Н4, Ph).
[2-Метил-(4-метоксифенил)-5-нитро-6-фенил-1,4-дигидропиридин-3-ил](4-метилфенил)метанон. Выход 50%, Тпл=185-186°C (этанол). Найдено, %: С 73.68; Н 5.53; N 6.30. C27H24N2O4. Вычислено, %: С 73.62; Н 5.49; N 6.36. ИК-спектр, (ν, см-1): 3310 (NH); 1640 (С=O), 1505, 1262 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.76 (с, 3Н, 2-СН3), 2.40 (с, 3Н, 4′-СН3), 3.74 (с, 3Н, 4′-CH3O), 5.48 (с, 1H, 4-Н), 6.36 (уш. с, 1Н, NH), 6.76-6.83 (м, 2Н, С6Н4), 7.15-7.23 (м, 4Н, С6Н4), 7.32-7.52 (м, 7Н, Ph, С6Н4).
[2-Метил-(4-метоксифенил)-5-нитро-6-фенил-1,4-дигидропиридин-3-ил](4-метоксифенил)метанон. Выход 60%, Тпл=215-216°C (изопропанол). Найдено, %: С 71.10; Н 5.27; N 6.10. C27H24N2O5. Вычислено, %: С 71.04; Н 5.30; N 6.14. ИК-спектр, (ν, см-1): 3278 (NH); 1625 (С=O), 1510, 1258 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.85 (с, 3Н, 2-СН3), 3.75 (с, 3Н, 4′-CH3O (фенил)), 3.86 (с, 3Н, 4'-CH3O (бензоил)), 5.52 (с, 1H, 4-Н), 5.83 (уш. с, 1Н, NH), 6.77-6.84 (м, 2Н, С6Н4), 6.86-6.93 (м, 2Н, С6Н4), 7.18-7.24 (м, 2Н, С6Н4), 7.40-7.54 (м, 5Н, Ph), 7.61-7.69 (м, 2Н, С6Н4).
[2-Метил-(4-метоксифенил)-5-нитро-6-фенил-1,4-дигидропиридин-3-ил](4-хлорфенил)метанон. Выход 50%, Тпл=165-166°C (этанол). Найдено, %: С 67.80; Н 4.63; N 6.12. C26H21ClN2O4. Вычислено, %: С 67.75; Н 4.59; N 6.08. ИК-спектр, (ν, см-1): 3302 (NH); 1638 (С=O), 1503, 1272 (NO2). Спектр ЯМР 1H(CDCl3, δ, м.д.): 1.81 (с, 3Н, 2-СН3), 3.75 (с, 3Н, 4′-CH3O), 5.47 (с, 1Н, 4-Н), 6.18 (уш. с, 1H, NH), 6.72-6.89 (м, 2Н, С6Н4), 7.08-7.24 (м, 2Н, С6Н4), 7.31-7.57 (м, 9Н, Ph, С6Н4).
[2-Метил-(4-метоксифенил)-5-нитро-6-фенил-1,4-дигидропиридин-3-ил](4-бромфенил)метанон. Выход 50%, Тпл=133-134°C (этанол). Найдено, %: С 61.82; Н 4.23; N 5.60. C26H21BrN2O4. Вычислено, %: С 61.79; Н 4.19; N 5.54. ИК-спектр, (ν, см-1): 3260 (NH); 1620 (С=O), 1495, 1254 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.78 (с, 3Н, 2-СН3), 3.74 (с, 3Н, 4′-CH3O), 5.45 (с, 1Н, 4-Н), 6.52 (уш. с, 1Н, NH), 6.76-6.82 (м, 2Н, С6Н4), 7.14-7.19 (м, 2Н, С6Н4), 7.31-7.36 (м, 2Н, С6Н4), 7.37-7.46 (м, 5Н, Ph), 7.50-7.56 (м, 2Н, С6Н4).
Б) Общая методика синтеза 4-арил-5-нитро-6-фенилпиридинов (III)
К суспензии 10 ммоль 1,4-дигидропиридина IV в 25 мл ледяной уксусной кислоты при температуре 60-70°C и при перемешивании прибавляют частями 1.04 г (15 ммоль) NaNO2. Реакционную смесь перемешивают 1 час при нагревании, затем охлаждают и разбавляют в 4 раза водой. Выпавшие кристаллы пиридина отфильтровывают, промывают водой и перекристаллизовывают из этанола.
(2-Метил-5-нитро-4,6-дифенилпиридин-3-ил)(4-метилфенил)метанон. Выход 90%, Тпл=134-135°C (этанол). Найдено, %: С 76.51; Н 4.90; N 6.83. C26H20N2O3. Вычислено, %: С 76.45; Н 4.94; N 6.86. ИК-спектр, (ν, см-1): 1666 (С=O), 1527, 1358 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.37 (с, 3Н, 4′-СН3), 2.55 (с, 3Н, 2-СН3), 7.12-7.26 (м, 7Н, С6Н4, Ph), 7.47-7.52 (м, 3Н, Ph), 7.53-7.58 (м, 2Н, С6Н4), 7.67-7.73 (м, 2Н, Ph).
(2-Метил-5-нитро-4,6-дифенилпиридин-3-ил)(4-метоксифенил)метанон. Выход 97%, Тпл=185-186°C (этанол). Найдено, %: С 73.64; Н 4.80; N 6.68. C26H20N2O4. Вычислено, %: С 73.57; Н 4.75; N 6.60. ИК-спектр, (ν, см-1): 1651 (С=О), 1529, 1358 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.56 (с, 3Н, 2-СН3), 3.83 (с, 3Н, 4′-CH3O), 6.81-6.87 (м, 2Н, С6Н4), 7.09-7.26 (м, 5Н, Ph), 7.46-7.51 (м, 3Н, Ph), 7.61-7.66 (м, 2Н, С6Н4), 7.66-7.71 (м, 2Н, Ph).
(2-Метил-5-нитро-4,6-дифенилпиридин-3-ил)(4-хлорфенил)метанон. Выход 90%, Тпл=147-148°C (этанол). Найдено, %: С 70.10; Н 4.07; N 6.60. C25H17ClN2O3. Вычислено, %: С 70.01; Н 4.00; N 6.53. ИК-спектр, (ν, см-1): 1668 (С=O), 1529, 1358 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.57 (с, 3Н, 2-СН3), 7.11-7.17 (м, 2Н, Ph), 7.19-7.26 (м, 3Н, Ph), 7.31-7.36 (м, 2Н, С6Н4), 7.47-7.52 (м, 3Н, Ph), 7.54-7.60 (м, 2Н, С6Н4), 7.67-7.73 (м, 2Н, Ph).
(2-Метил-5-нитро-4,6-дифенилпиридин-3-ил)(4-бромфенил)метанон. Выход 80%, Тпл=154-155°C (этанол). Найдено, %: С 63.50; Н 3.68; N 5.99. C25H17BrN2O3. Вычислено, %: С 63.44; Н 3.62; N 5.92. ИК-спектр, (ν, см-1): 1666 (С=O), 1529, 1356 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.56 (с, 3Н, 2-СН3), 7.11-7.17 (м, 2Н, Ph), 7.19-7.25 (м, 3Н, Ph), 7.46-7.53 (м, 7Н, С6Н4, Ph), 7.67-7.73 (м, 2Н, Ph).
[2-Метил-(4-метоксифенил)-5-нитро-6-фенилпиридин-3-ил](4-метилфенил)метанон. Выход 80%, Тпл=171-172°C (этанол). Найдено, %: С 74.00; Н 5.10; N 6.44. C27H22N2O4. Вычислено, %: С 73.96; Н 5.06; N 6.39. ИК-спектр, (ν, см-1): 1670 (С=O), 1535, 1358 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.38 (с, 3Н, 4′-СН3), 2.55 (с, 3Н, 2-СН3), 3.71 (с, 3Н, 4′-CH3O), 6.68-6.78 (м, 2Н, С6Н4), 7.06-7.15 (м, 2Н, С6Н4), 7.16-7.23 (м, 2Н, С6Н4), 7.46-7.52 (м, 3Н, Ph), 7.55-7.60 (м, 2Н, С6Н4), 7.67-7.74 (м, 2Н, Ph).
[2-Метил-(4-метоксифенил)-5-нитро-6-фенилпиридин-3-ил](4-метоксифенил)метанон. Выход 92%, Тпл=155-156°C (этанол). Найдено, %: С 71.39; Н 4.92; N 6.20. C27H22N2O5. Вычислено, %: С 71.35; Н 4.88; N 6.16. ИК-спектр, (ν, см-1): 1670 (С=O), 1532, 1360 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.55 (с, 3Н, 2-СН3), 3.72 (с, 3Н, 4′-CH3O (фенил)), 3.85 (с, 3Н, 4′-CH3O (бензоил)), 6.70-6.78 (м, 2Н, С6Н4), 6.83-6.89 (м, 2Н, С6Н4), 7.07-7.16 (м, 2Н, С6Н4), 7.46-7.52 (м, 3Н, Ph), 7.61-7.67 (м, 2Н, С6Н4), 7.68-7.74 (м, 2Н, Ph).
[2-Метил-(4-метоксифенил)-5-нитро-6-фенилпиридин-3-ил](4-хлорфенил)метанон. Выход 80%, Тпл=136-137°C (этанол). Найдено, %: С 68.09; Н 4.20; N 6.13. C26H19ClN2O4. Вычислено, %: С 68.05; Н 4.17; N 6.10. ИК-спектр, (ν, см-1): 1663 (С=O), 1536, 1350 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.56 (с, 3Н, 2-СН3), 3.72 (с, 3Н, 4′-CH3O), 6.68-6.80 (м, 2Н, С6Н4), 7.02-7.15 (м, 2Н, С6Н4), 7.30-7.41 (м, 2Н, С6Н4), 7.44-7.54 (м, 3Н, Ph), 7.56-7.64 (м, 2Н, С6Н4), 7.66-7.77 (м, 2Н, Ph).
[2-Метил-(4-метоксифенил)-5-нитро-6-фенилпиридин-3-ил](4-бромфенил)метанон. Выход 85%, Тпл=153-154°C (этанол). Найдено, %: С 62.09 Н 3.84; N 5.53. C26H19BrN2O4. Вычислено, %: С 62.04; Н 3.80; N 5.57. ИК-спектр, (ν, см-1): 1662 (С=O), 1533, 1362 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.56 (с, 3Н, 2-СН3), 3.72 (с, 3Н, 4′-CH3O), 6.71-6.78 (м, 2Н, С6Н4), 7.05-7.12 (м, 2Н, С6Н4), 7.46-7.55 (м, 7Н, Ph, С6Н4), 7.67-7.73 (м, 2Н, С6Н4).
В) Общая методика синтеза четвертичных солей 4-арил-5-нитро-6-фенилпиридиния (II)
Смесь 1 ммоль нитропиридина III и 1.26 г (10 ммоль) диметилсульфата нагревают при температуре 80°C в течение 4 суток. Смесь охлаждают, промывают сухим диэтиловым эфиром (5×15 мл), эфир сливают декантацией. Гигроскопичные метилсульфатные соли 4-метоксифенилпиридиния переводят в перхлораты следующим образом: метилсульфатную соль растворяют при нагревании в 10 мл 50%-ного водного этанола, добавляют к нему насыщенный водный раствор 0.13 г (1.1 ммоль) NaClO4. Кристаллы солей II отфильтровывают, сушат и перекристаллизовывают.
1,2-Диметил-3-(4-метилбензоил)-5-нитро-4,6-дифенилпиридиния метилсульфат. Выход 96%, Тпл=169-170°C (ацетонитрил). Найдено, %: С 62.99; Н 4.99; N 5.32. C28H26N2O7S. Вычислено, %: С 62.91; Н 4.90; N 5.24. Спектр ЯМР 1Н (DMSO-d6, δ, м.д.): 2.36 (с, 3Н, 4′-СН3), 2.74 (с, 3Н, 2-СН3), 3.38 (с, 3Н, CH3SO4), 3.99 (с, 3Н, N-CH3), 7.09-7.24 (м, 2Н, Ph), 7.30-7.44 (м, 5Н, С6Н4, Ph), 7.64-7.80 (м, 7Н, С6Н4, Ph).
1,2-Диметил-3-(4-метоксибензоил)-5-нитро-4,6-дифенилпиридиния метилсульфат. Выход 90%, Тпл=158-159°C (ацетонитрил). Найдено, %: С 61.11; Н 4.79; N 5.12. C28H26N2O8S. Вычислено, %: С 61.08; Н 4.76; N 5.09. Спектр ЯМР 1Н (DMSO-d6, δ, м.д.): 2.74 (с, 3Н, 2-СН3), 3.39 (с, 3Н, CH3SO4), 3.84 (с, 3Н, 4′-CH3O), 3.99 (с, 3Н, N-CH3), 6.98-7.05 (м, 2Н, С6Н4), 7.11-7.25 (м, 2Н, Ph), 7.31-7.45 (м, 3Н, Ph), 7.65-7.79 (м, 5Н, Ph), 7.82-7.88 (м, 2Н, С6Н4).
1,2-Диметил-3-(4-хлорбензоил)-5-нитро-4,6-дифенилпиридиния метилсульфат. Выход 85%, Тпл=235-236°С (ацетонитрил). Найдено, %: С 58.49; Н 4.24; N 5.00. C27H23C1N207S. Вычислено, %: С 58.43; Н 4.18; N 5.05. Спектр ЯМР 1Н (DMSO-d6, δ, м.д.): 2.77 (с, 3Н, 2-СН3), 3.38 (с, 3Н, CH3SO4), 3.99 (с, 3Н, N-CH3), 7.10-7.24 (м, 2Н, Ph), 7.29-7.45 (м, 3Н, Ph), 7.57-7.62 (м, 2Н, С6Н4), 7.64-7.79 (м, 5Н, Ph), 7.84-7.90 (м, 2Н, С6Н4).
1,2-Диметил-3-(4-бромбензоил)-5-нитро-4,6-дифенилпиридиния метилсульфат. Выход 98%, Тпл=240-241°C (ацетонитрил). Найдено, %: С 54.15; Н 3.90; N 4.70. C27H23BrN2O7S. Вычислено, %: С 54.10; Н 3.87; N 4.67. Спектр ЯМР 1Н (DMSO-d6, δ, м.д.): 2.76 (с, 3Н, 2-СН3), 3.38 (с, 3Н, CH3SO4), 3.99 (с, 3Н, N-CH3), 7.08-7.25 (м, 2Н, Ph), 7.33-7.44 (м, 3Н, Ph), 7.65-7.80 (м, 9Н, С6Н4, Ph).
4-(4-Метоксифенил)-1,2-диметил-3-(4-метилбензоил)-5-нитро-6-фенилпиридиния перхлорат. Выход 94%, Тпл=214-215°C (этанол). Найдено, %: С 60.87; Н 4.61; N 5.14. C28H25ClN2O8. Вычислено, %: С 60.82; Н 4.56; N 5.07. Спектр ЯМР 1H(DMSO-d6, δ, м.д.): 2.38 (с, 3Н, 4′-СН3), 2.72 (с, 3Н, 2-СН3), 3.69 (с, 3Н, 4′-CH3O), 3.97 (с, 3Н, N-СН3), 6.89-6.98 (м, 2Н, С6Н4), 7.07-7.17 (м, 2Н, С6Н4), 7.31-7.41 (м, 2Н, С6Н4), 7.63-7.81 (м, 7Н, Ph, С6Н4).
4-(4-Метоксифенил)-1,2-диметил-3-(4-метоксибензоил)-5-нитро-6-фенилпиридиния перхлорат. Выход 95%, Тпл=184-185°C (этанол). Найдено, %: С 59.16; Н 4.48; N 5.02. C28H25ClN2O9. Вычислено, %: С 59.11; Н 4.43; N 4.92. Спектр ЯМР 1H(DMSO-d6, δ, м.д.): 2.74 (с, 3Н, 2-СН3), 3.69 (с, 3Н, 4′-CH3O (фенил)), 3.86 (с, 3Н, 4′-CH3O (бензоил)), 3.97 (с, 3Н, N-CH3), 6.91-6.99 (м, 2Н, С6Н4), 7.01-7.09 (м, 2Н, С6Н4), 7.11-7.19 (м, 2Н, С6Н4), 7.63-7.80 (м, 5Н, Ph), 7.82-7.90 (м, 2Н, С6Н4).
4-(4-Метоксифеиил)-1,2-диметил-3-(4-хлорбензоил)-5-нитро-6-фенилпиридиния перхлорат. Выход 89%, Тпл=211-212°C (этанол). Найдено, %: С 56.60; Н 3.92; N 4.93. C27H22Cl2N2O8. Вычислено, %: С 56.56; Н 3.87; N 4.89. Спектр ЯМР 1Н (DMSO-d6, δ, м.д.): 2.76 (с, 3Н, 2-СН3), 3.71 (с, 3Н, 4′-CH3O), 3.98 (с, 3Н, N-CH3), 6.74-7.28 (м, 4Н, С6Н4), 7.47-8.08 (м, 9Н, Ph, С6Н4).
4-(4-Метоксифснил)-1,2-диметил-3-(4-бромбензоил)-5-нитро-6-фенилпиридиния перхлорат. Выход 98%, Тпл=181-182°C (изопропанол). Найдено, %: С 52.53; Н 3.63; N 4.53. C27H22BrClN2O8. Вычислено, %: С 52.49; Н 3.59; N 4.53. Спектр ЯМР 1Н (DMSO-d6, δ, м.д.): 2.76 (с, 3Н, 2-СН3), 3.70 (с, 3Н, 4′-CH3O), 3.99 (с, 3Н, N-CH3), 6.86-7.23 (м, 4Н, С6Н4), 7.56-7.92 (м, 9Н, Ph, С6Н4).
Г) Общая методика синтеза мета-терфенилов (I) перегруппировкой четвертичных солей 4-арил-5-нитро-6-фенилпиридиния (II) под действием водного раствора метиламина
К раствору 1 ммоль четвертичной соли II в 2 мл ДМФА при перемешивании прибавляют 20 мл 40%-ного водного раствора метиламина и нагревают при температуре 60-70°C в течение 3 часов. Охлаждают, отфильтровывают выпавший осадок и промывают холодной водой. Очищают мета-терфенилы I колоночной хроматографией (Silicagel, Merk 60А, 0.060-0.200 мм, элюент хлороформ), перекристаллизовывают из этанола.
[5′-(Метиламино)-2′-нитро-1,1′:3′,1″-терфенил-4′-ил](4-метилфенил)метанон. Выход 82%, Тпл=178-179°С (этанол). Найдено, %: С 76.82; Н 5.30; N 6.70. C27H22N2O3. Вычислено, %: С 76.76; Н 5.25; N 6.63. ИК-спектр, (ν, см-1): 3390 (NH); 1655 (С=O), 1514, 1357 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.29 (с, 3Н, 4′-СН3), 2.88 (с, 3Н, N-CH3), 4.49 (уш. с, 1H, NH), 6.72 (с, 1H, 6-Н), 6.98-7.02 (м, 2Н, С6Н4), 7.05-7.12 (м, 5Н, Ph), 7.37-7.41 (м, 2Н, С6Н4), 7.42-7.50 (м, 5Н, Ph).
[5′-(Метиламино)-2′-нитро-1,1′:3′,1″'-терфенил-4′-ил](4-метоксифенил)метапон. Выход 85%, Тпл=199-200°С (этанол). Найдено, %: С 73.90; Н 5.00; N 6.43. C27H22N2O4. Вычислено, %: С 73.96; Н 5.06; N 6.39. ИК-спектр, (ν, см-1): 3395 (NH); 1650 (С=O), 1511, 1357 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.87 (с, 3Н, N-CH3), 3.78 (с, 3Н, 4′-CH3O), 4.61 (уш. с, 1H, NH), 6.67-7.73 (м, 3Н, 6-Н, С6Н4), 7.06-7.16 (м, 5Н, Ph), 7.41-7.49 (м, 5Н, Ph), 7.49-7.54 (м, 2Н, С6Н4).
[5′-(Метиламино)-2′-нитро-1,1′:3′1″-терфенил-4′-ил](4-хлорфенил)метанон. Выход 70%, Тпл=209-210°C (этанол). Найдено, %: С 70.55; Н 4.37; N 6.38. C26H19ClN2O3. Вычислено, %: С 70.51; Н 4.32; N 6.33. ИК-спектр, (ν, см-1): 3386 (NH); 1659 (С=O), 1516, 1356 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.90 (с, 3Н, N-CH3), 4.85 (уш. с, 1Н, NH), 6.71 (с, 1Н, 6-Н), 7.05-7.11 (м, 5Н, Ph), 7.12-7.17 (м, 2Н, С6Н4), 7.33-7.38 (м, 2Н, С6Н4), 7.42-7.48 (м, 5Н, Ph).
[5′-(Метиламино)-2′-нитро-1,1′:3′,1″-терфенил-4′-ил](4-бромфенил)метанон. Выход 86%, Тпл=210-211°C (этанол). Найдено, %: С 64.12; Н 4.00; N 5.82. C26H19BrN2O3. Вычислено, %: С 64.08; Н 3.93; N 5.75. ИК-спектр, (ν, см-1): 3389 (NH); 1660 (С=O), 1510, 1355 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.89 (с, 3Н, N-CH3), 4.97 (уш. с, 1H, NH), 6.69 (с, 1Н, 6-Н), 7.05-7.11 (м, 5Н, Ph), 7.26-7.33 (м, 4Н, С6Н4), 7.42-7.48 (м, 5Н, Ph).
[5′-(Метиламино)-4″-метокси-2′-нитро-1,1′:3′,1″-терфенил-4′-ил](4-метилфенил)метанон. Выход 50%, Тпл=200-201°C (этанол). Найдено, %: С 74.36; Н 5.37; N 6.25. C28H24N2O4. Вычислено, %: С 74.32; Н 5.35; N 6.19. ИК-спектр, (ν, см-1): 3390 (NH); 1662 (С=O), 1515, 1357 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.31 (с, 3Н, 4′-СН3), 2.85 (с, 3Н, N-СН3), 3.65 (с, 3Н, 4′-CH3O), 5.09 (уш. с, 1Н, NH), 6.57-6.64 (м, 2Н, С6Н4), 6.65 (с, 1H, 6-Н), 6.99-7.11 (м, 4Н, С6Н4), 7.38-7.55 (м, 7Н, Ph, С6Н4).
[5′-(Метиламино)-4″-метокси-2′-нитро-1,1′:3′,1″-терфенил-4′-ил](4-метоксифенил)метанон. Выход 69%, Тпл=196-197C (этанол). Найдено, %: С 71.82; Н 5.21; N 6.05. C28H24N2O5. Вычислено, %: С 71.78; Н 5.16; N 5.98. ИК-спектр, (ν, см-1): 3400 (NH); 1672 (С=O), 1505, 1360 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.84 (с, 3Н, N-CH3), 3.66 (с, 3Н, 4′-CH3O (фенил)), 3.78 (с, 3Н, 4′-CH3O (бензоил)), 4.96 (уш. с, 1H, NH), 6.60-6.67 (м, 3Н, 6-Н, С6Н4), 6.69-6.76 (м, 2Н, С6Н4), 7.04-7.11 (м, 2Н, С6Н4), 7.41-7.51 (м, 5Н, Ph), 7.53-7.59 (м, 2Н, С6Н4).
[5′-(Метиламино)-4″-метокси-2′-нитро-1,1′:3′,1″-терфенил-4′-ил](4-хлорфенил)метаном. Выход 50%, Тпл=162-163°C (этанол). Найдено, %: С 68.63; Н 4.50; N 5.96. C27H21ClN2O4. Вычислено, %: С 68.57; Н 4.48; N 5.92. ИК-спектр, (ν, см-1): 3396 (NH); 1653 (С=O), 1513, 1362 (NO2). Спектр ЯМР 1H(CDCl3, δ, м.д.): 2.89 (с, 3Н, N-CH3), 3.68 (с, 3Н, 4′-CH3O), 5.45 (уш. с, 1Н, NH), 6.57-6.65 (м, 2Н, С6Н4), 6.66 (с, 1H, 6-Н), 6.95-7.05 (м, 2Н, С6Н4), 7.13-7.22 (м, 2Н, С6Н4), 7.35-7.55 (м, 7Н, Ph, С6Н4).
[5′-(Метиламино)-4″-метокси-2′-нитро-1,1′:3′,1″-терфенил-4′-ил](4-бромфенил)метанон. Выход 50%, Тпл=185-186°C (этанол). Найдено, %: С 62.72; Н 4.12; N 5.46. C27H21BrN2O4. Вычислено, %: С 62.68; Н 4.09; N 5.41. ИК-спектр, (ν, см-1): 3398 (NH); 1660 (С=O), 1512, 1357 (NO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.88 (с, 3Н, N-CH3), 3.69 (с, 3Н, 4′-CH3O), 5.49 (уш. с, 1H, NH), 6.58-6.65 (м, 2Н, С6Н4), 6.66 (с, 1Н, 6-Н), 7.28-7.36 (м, 4Н, С6Н4), 7.42-7.51 (м, 5Н, Ph).
Таким образом, в результате последовательного синтеза ранее неизвестных мета-терфенилов, осуществляемого перегруппировкой четвертичных солей 4-арил-3-ароил-1,2-диметил-5-нитро-6-фенилпиридиния, под действием 40%-ного водного метиламина, образуются несимметричные замещенные мета-терфенилы: (арил)[5′-(метиламино)-2′-нитро-1,1′:3′,1″-терфенил-4′-ил]метаноны. Данный способ характеризуется малой стадийностью, низкими материальными и временными затратами, высоким выходом целевых продуктов.
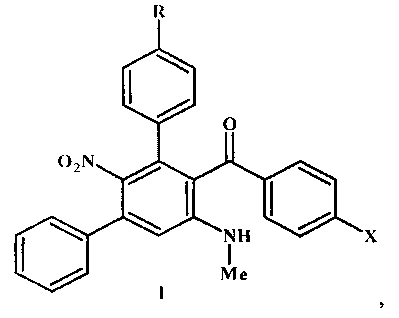
Способ синтеза замещенных мета-терфенилов - (арил)[5′-(метиламино)-2′-нитро-1,1′:3′,1″-терфенил-4′-ил]метанонов общей формулы I где R=Н, ОМе; X=Me, ОМе, Cl, Br,заключающийся в том, что четвертичные соли 4-арил-3-ароил-1,2-диметил-5-нитро-6-фенилпиридиния общей формулы II подвергают перегруппировке под действием 40%-ного водного метиламина в замещенные мета-терфенилы общей формулы I ,где в I, II R=Н, ОМе; X=Me, ОМе, Cl, Br;в II R=Н, А=MeOSO; R=ОМе, А=ClO.