Результат интеллектуальной деятельности: КРИСТАЛЛИЧЕСКАЯ β-МОДИФИКАЦИЯ 2,3-БИС-(ГИДРОКСИМЕТИЛ)ХИНОКСАЛИН-N,N'-ДИОКСИДА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕЁ ОСНОВЕ
Вид РИД
Изобретение
Изобретение относится к органической химии и касается новой кристаллической модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида (диоксидина), названной авторами β-модификацией, способа ее получения и фармацевтической композиции на основе этой модификации, которая может быть использована в фармацевтической промышленности и медицине в качестве противомикробного, антибактериального и бактерицидного средства.
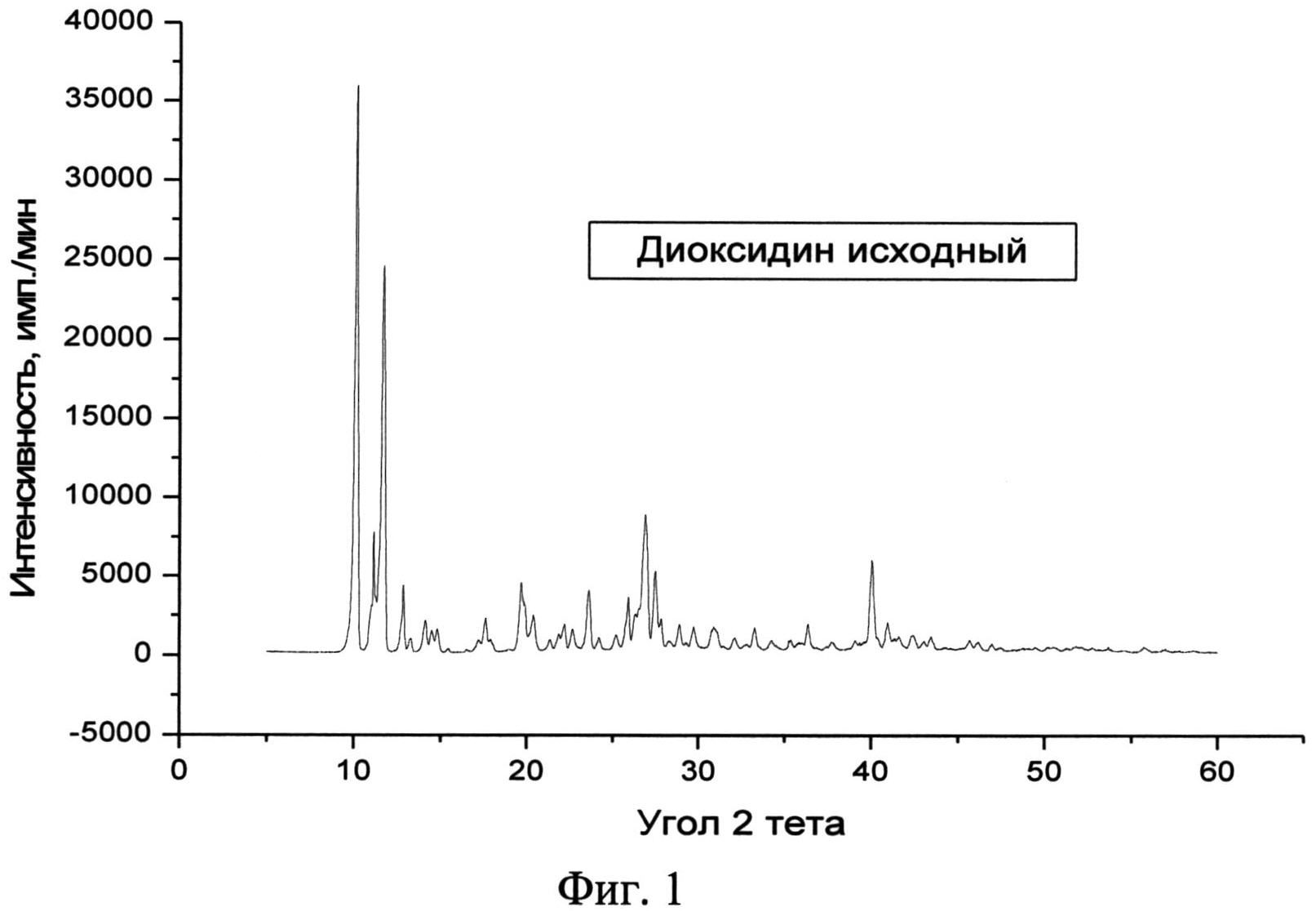
Известна кристаллическая модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида (диоксидин - международное непатентованное название) и способ ее получения [А.С. СССР №207917, опубл. в Б.И. №3,19, 1968; Химико-фармацевтический журнал, т. 24, с. 80-84, 1990]. Эта модификация характеризуется: методом рентгенофазового анализа (РФА) -определенным набором дифракционных максимумов (d, Å), углов 2θ и их интенсивностью (Iотн, %) (табл. 1, фиг. 1), а также ИК - спектроскопическими исследованиями в области от 400 до 4000 см-1 - определенными частотами характеристических полос поглощения [Фармакопейная Статья 42-2308-97] (фиг. 3). Эту модификацию получают гидролизом хиноксидина [2,3-бис-(ацетоксиметил)хиноксалин-N,N′-диоксида] в присутствии метанола и каталитического количества КОН с последующим выделением диоксидина из спиртового раствора.
Известная кристаллическая модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида представляет собой желто-зеленые кристаллы без запаха, горького вкуса, мало растворимые в воде, этаноле и хлороформе.
Сходство заявляемой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида с известной модификацией диоксидина заключается в идентичности их химических составов.
Отличие заявляемой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида от известной кристаллической модификации диоксидина заключается в различии их дифрактограмм рентгенофазового анализа: определенного набора межплоскостных расстояний (d, Å), углов 2θ, 0 и их интенсивностей (Iотн,=Ii/Imax×100, %).
Отличие способа получения заявляемой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида от способа получения известной модификации диоксидина состоит в том, что выделение кристаллитов проводят из водного раствора диоксидина, имеющего температуру от 20°C до 100°C, замораживанием при скорости не менее 60 град/мин с последующей сублимационной сушкой в течение 22-27 часов.
Отличие заявляемой фармацевтической композиции, содержащей кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, обладающей противомикробной, антибактериальной и бактерицидной активностью, от известной композиции [ФСП 42-0008-4523-05] состоит в том, что в качестве действующего вещества используют терапевтически эффективное количество не известной ранее кристаллической β-модификации диоксидина.
Целью изобретения является получение не известной ранее кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, разработка способа ее получения и применение ее для приготовления фармацевтической композиции, обладающей противомикробной, антибактериальной и бактерицидной активностью.
Поставленная цель достигнута настоящим изобретением, а именно кристаллической β-модификацией 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, характеризующейся следующим набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн,=Ii/Imax×100, %): 8,740 - 100,0%; 8,026 - 94,2%; 7,546 - 22,3%; 6,899 - 57,8%; 6,681 - 24,4%; 6,288 - 50,9%; 5,978 - 43,4%; 5,723 - 9,7%; 5,371 - 11,5%; 5,177 - 17,1%; 4,952 - 29,5%; 4,498 - 19,4%; 4,345 - 23,9%; 4,072 - 25,3%; 4,013 - 17,6%; 3,905 - 20,5%; 3,678 - 28,4%; 3,526 - 12,7%; 3,440 - 30,0%; 3,358 - 99,3%; 3,304 - 67,6%; 3,206 - 31,6%; 3,145 - 18,3%; 2,981 - 11,4%; 2,890 - 12,9%; 2,793 - 9,7%; 2,677 - 7,5%; 2,613 - 9,8%; 2,535 - 8,9%; 2,470 - 8,1%; 2,370 - 9,9%; 2,287 - 7,5%; 2,244 - 9,0%; 2,079 - 7,1%; 1,963 - 6,7%; 1,703 - 7,0%.
Поставленная цель достигнута также разработкой способа получения новой, не известной ранее кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, который состоит в том, что водный раствор диоксидина, имеющий температуру от 20°C до 100°C, замораживают при скорости не менее 60 град/мин с последующей сублимационной сушкой в течение 22-27 часов.
Кроме того, поставленная цель достигнута применением кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида для приготовления фармацевтической композиции, обладающей противомикробной, антибактериальной и бактерицидной активностью, содержащей терапевтически эффективное количество кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, и, по крайней мере, один фармацевтически приемлемый растворитель.
Из патентной и научно-технической литературы не известны кристаллическая β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, способ ее получения и применение ее для приготовления фармацевтической композиции, обладающей противомикробной, антибактериальной и бактерицидной активностью.
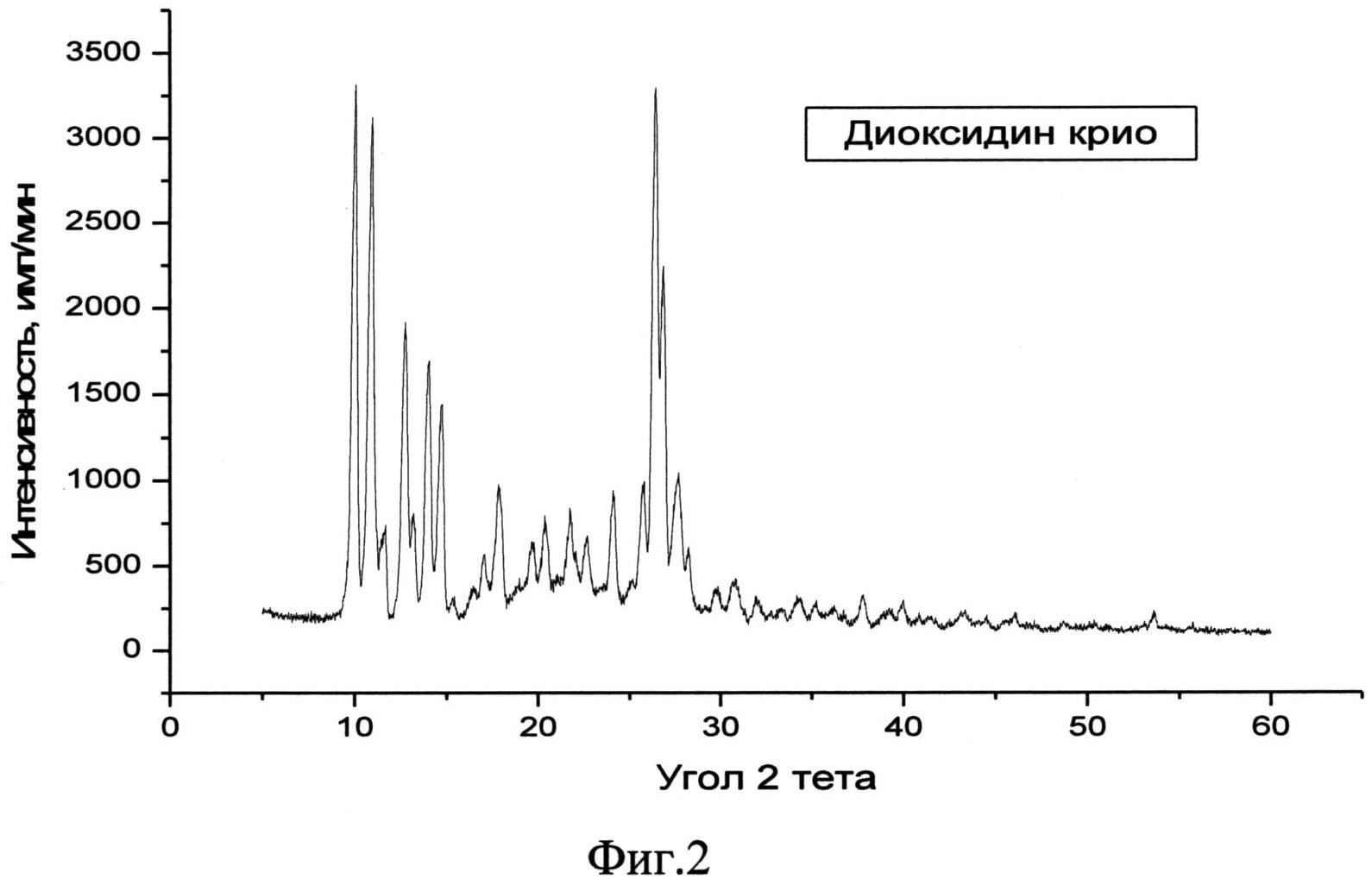
Авторами обнаружена новая кристаллическая β-модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, характеризующаяся определенным набором дифракционных максимумов (d, Å) и их интенсивностью (Iотн, %) (табл. 2, фиг. 2), предложены способ ее получения и применение ее для приготовления фармацевтической композиции, обладающей противомикробной, антибактериальной и бактерицидной активностью.
Заявляемая новая β-модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида представляет собой легкий пушистый порошок от желтоватого до белого цвета, без запаха, горького вкуса, мало растворимый в воде, этаноле и хлороформе.
Для пояснения сущности заявляемого технического решения к описанию приложены следующие таблицы и фигуры.
Таблица 1. Углы 2Θ, межплоскостные расстояния (d, Å) и их интенсивности (Iотн, %) известной модификации диоксидина - исходной фармакопейной субстанции 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
Таблица 2. Углы 2Θ, межплоскостные расстояния (d, Å) и их интенсивности (Iотн., %) новой, не известной ранее кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
Таблица 3. Величины зон подавления роста тест микроорганизмов при использовании исходной субстанции диоксидина и полученной из нее новой, не известной ранее, кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
Таблица 4. Величины зон подавления роста тест микроорганизмов при использовании фармацевтических композиций на основе исходной субстанции диоксидина и полученной из нее новой, не известной ранее, кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
Фиг. 1. Дифрактограмма исходной фармакопейной субстанции диоксидина.
Фиг. 2. Типичная дифрактограмма новой, не известной ранее кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
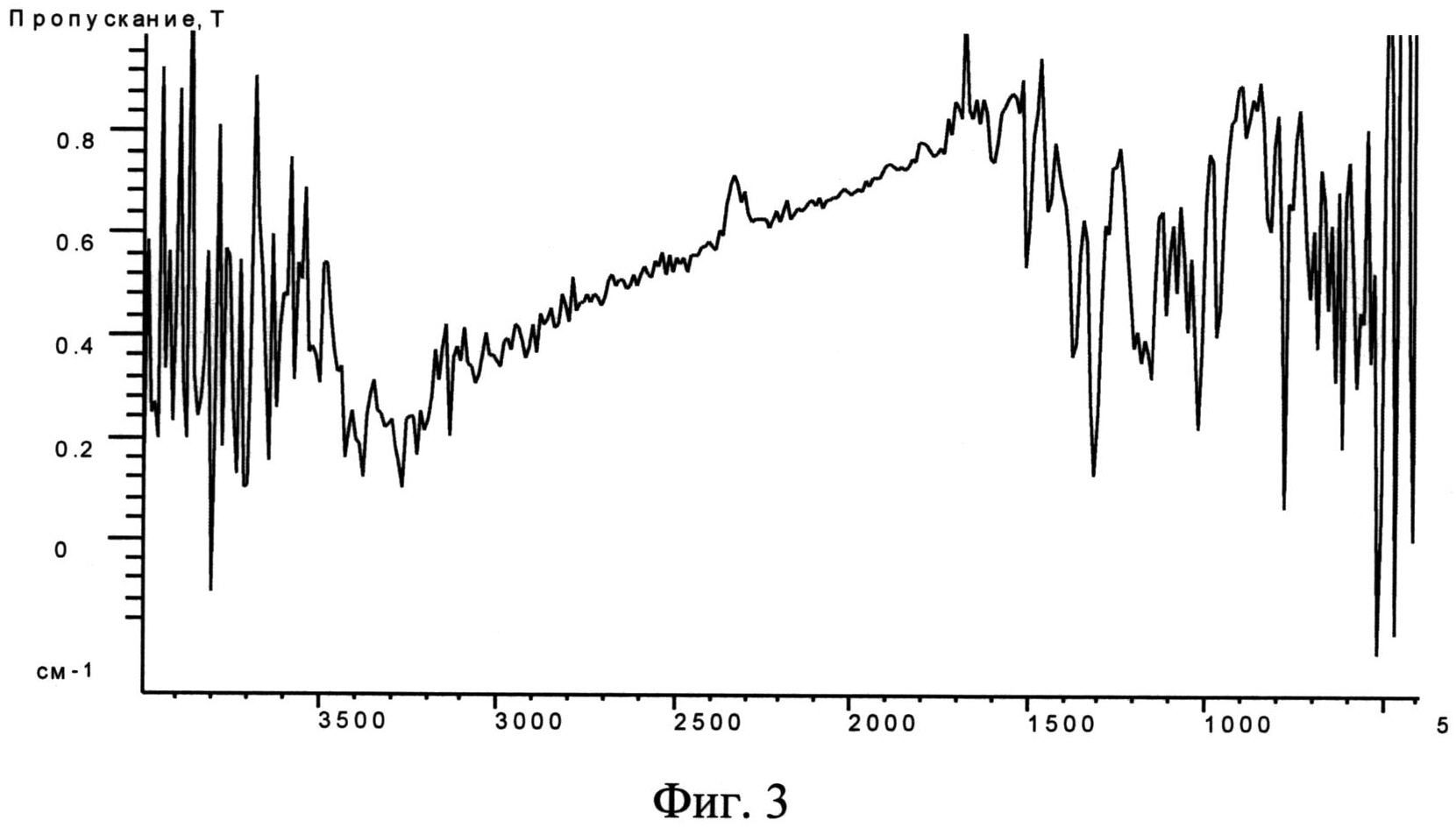
Фиг. 3. ИК-спектр исходной фармакопейной субстанции диоксидина.
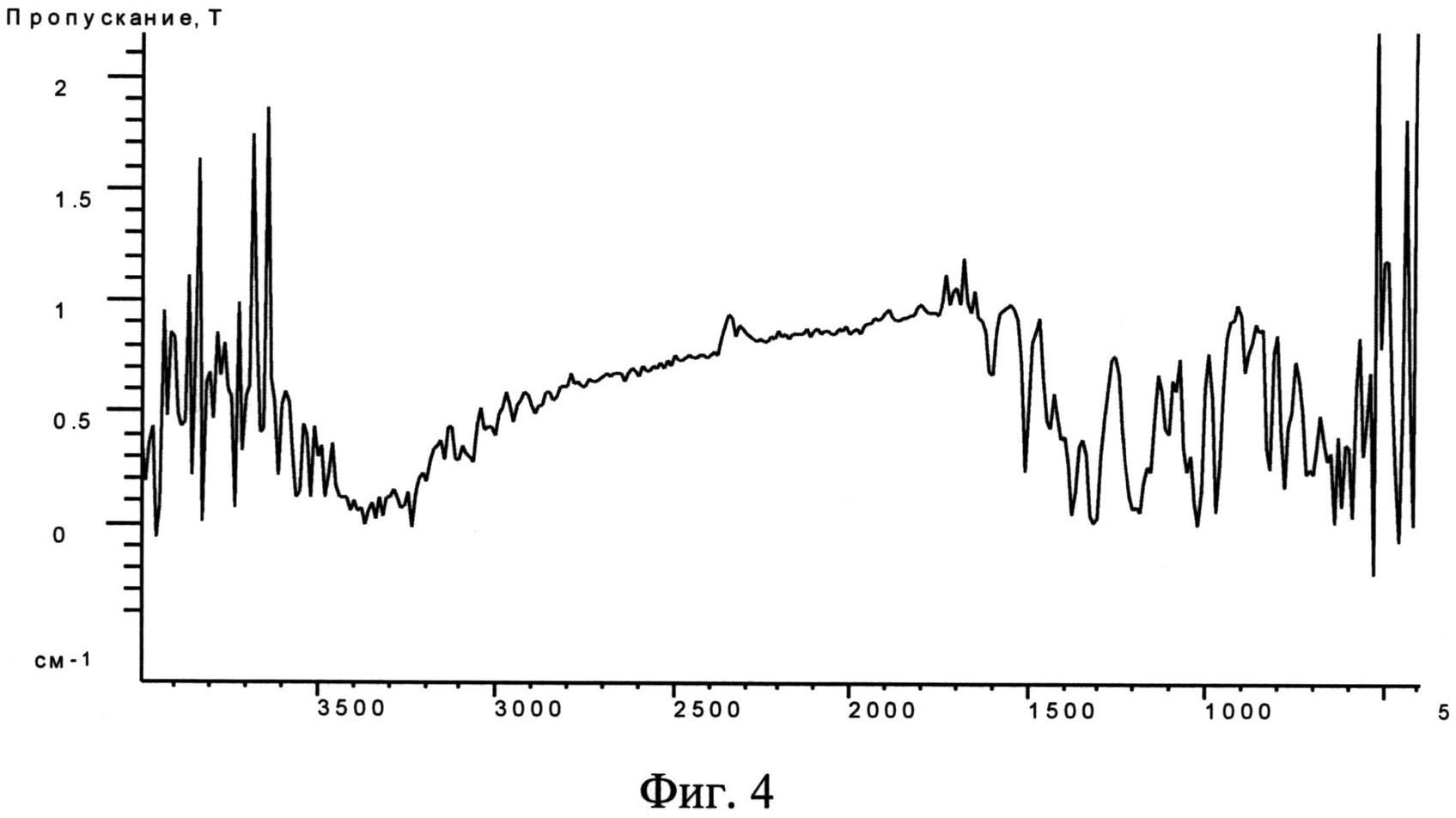
Фиг. 4. Типичный ИК-спектр не известной ранее кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
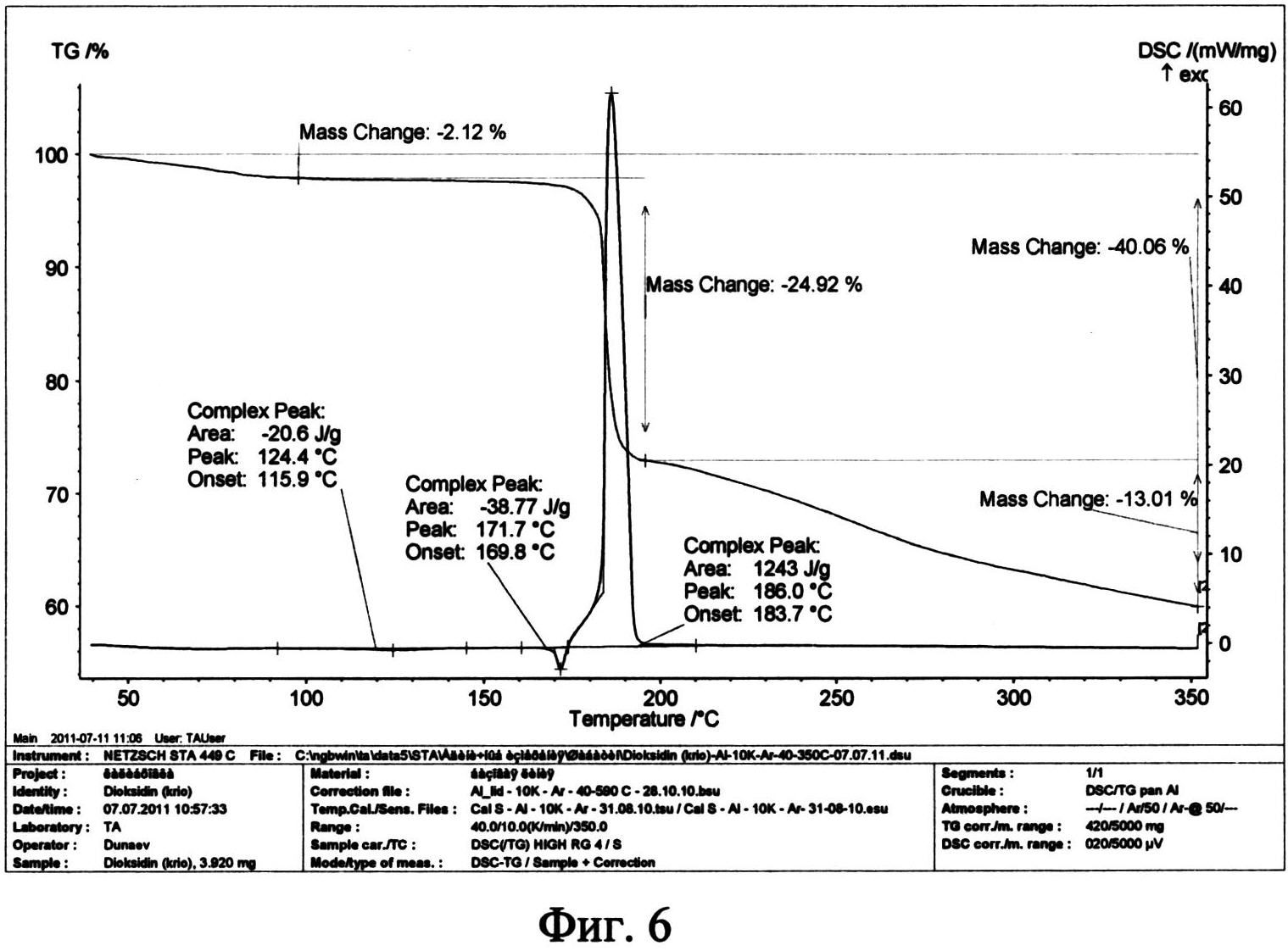
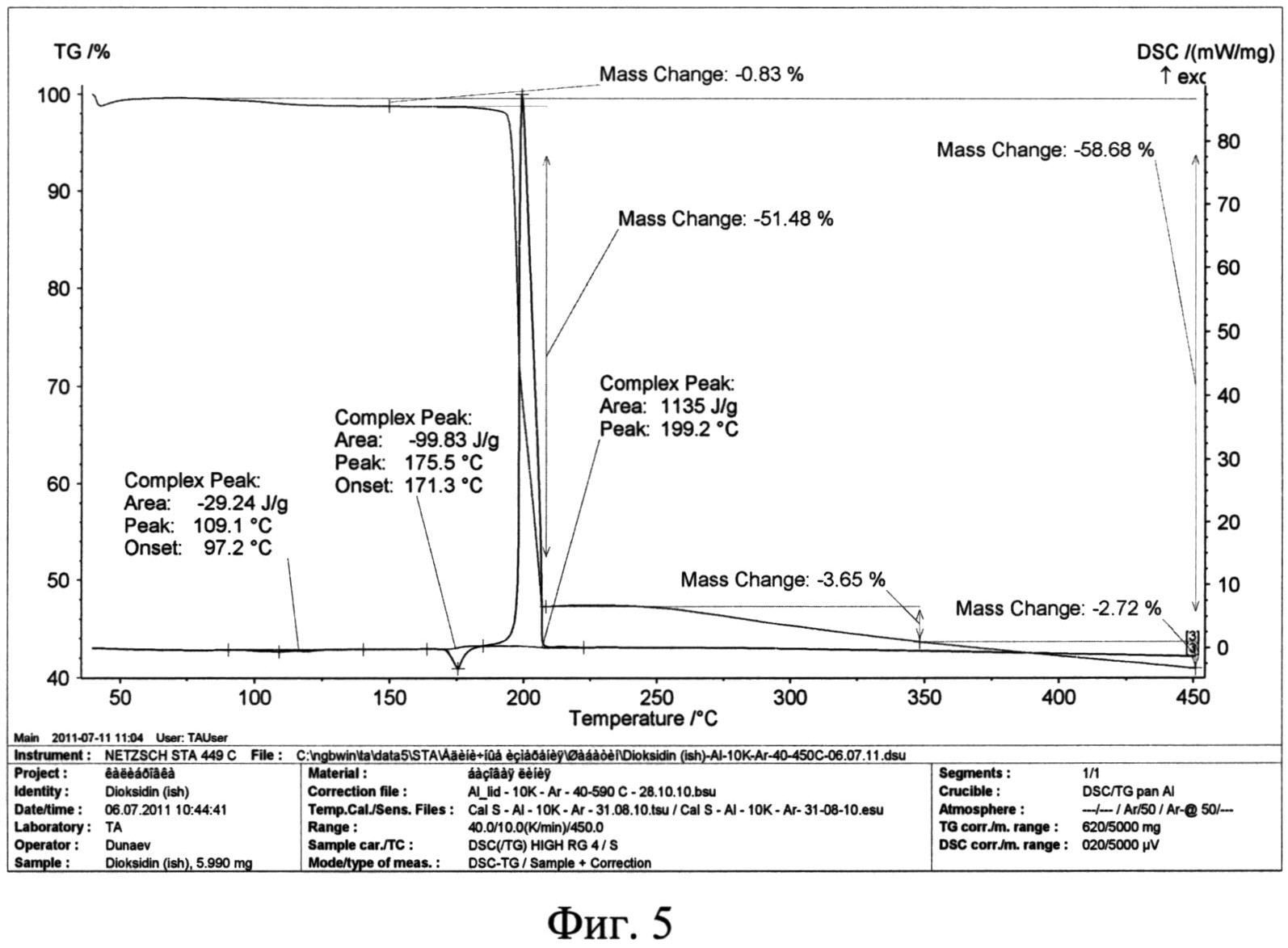
Фиг. 5. Термограмма исходной фармакопейной субстанции диоксидина.
Фиг. 6. Типичная термограмма новой, не известной ранее кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
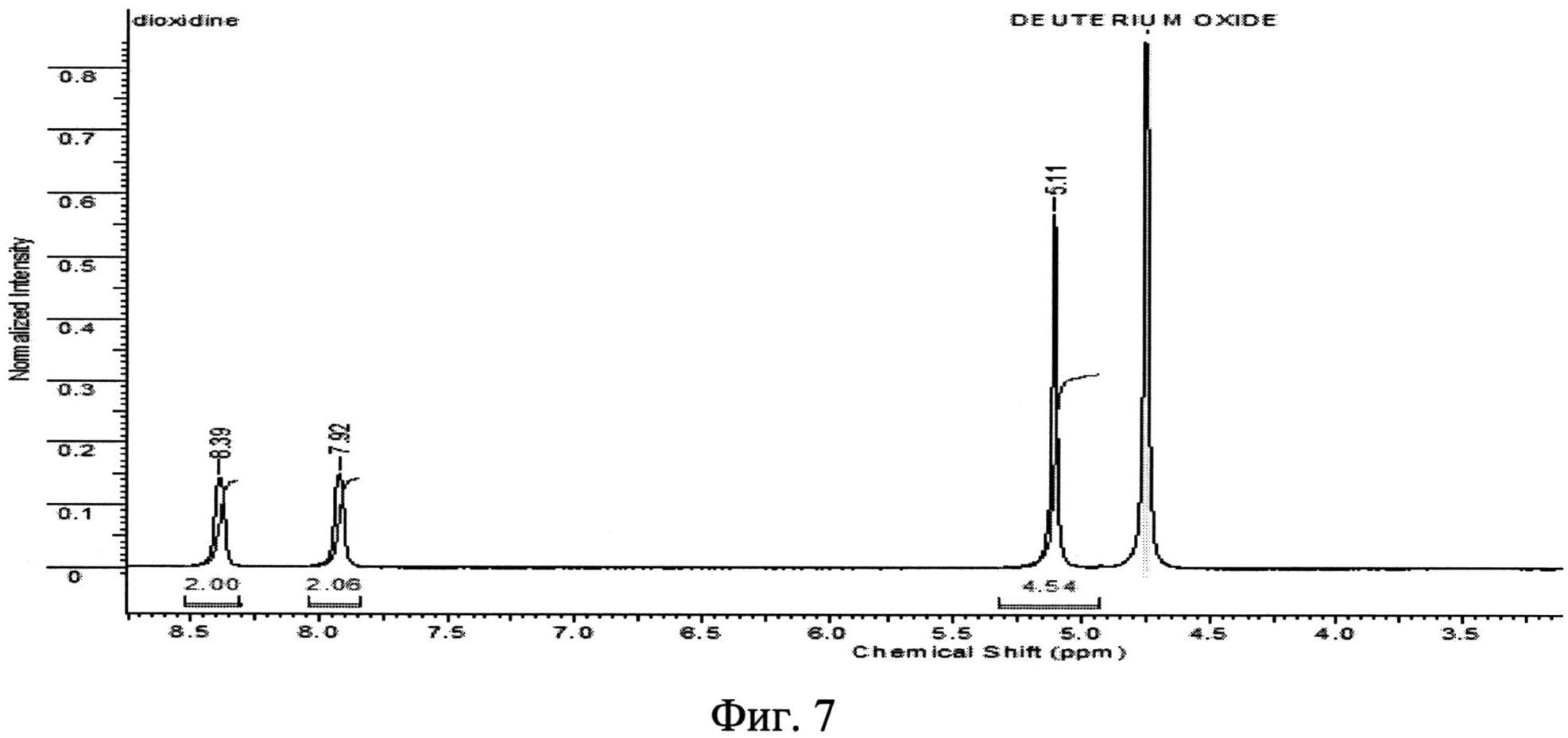
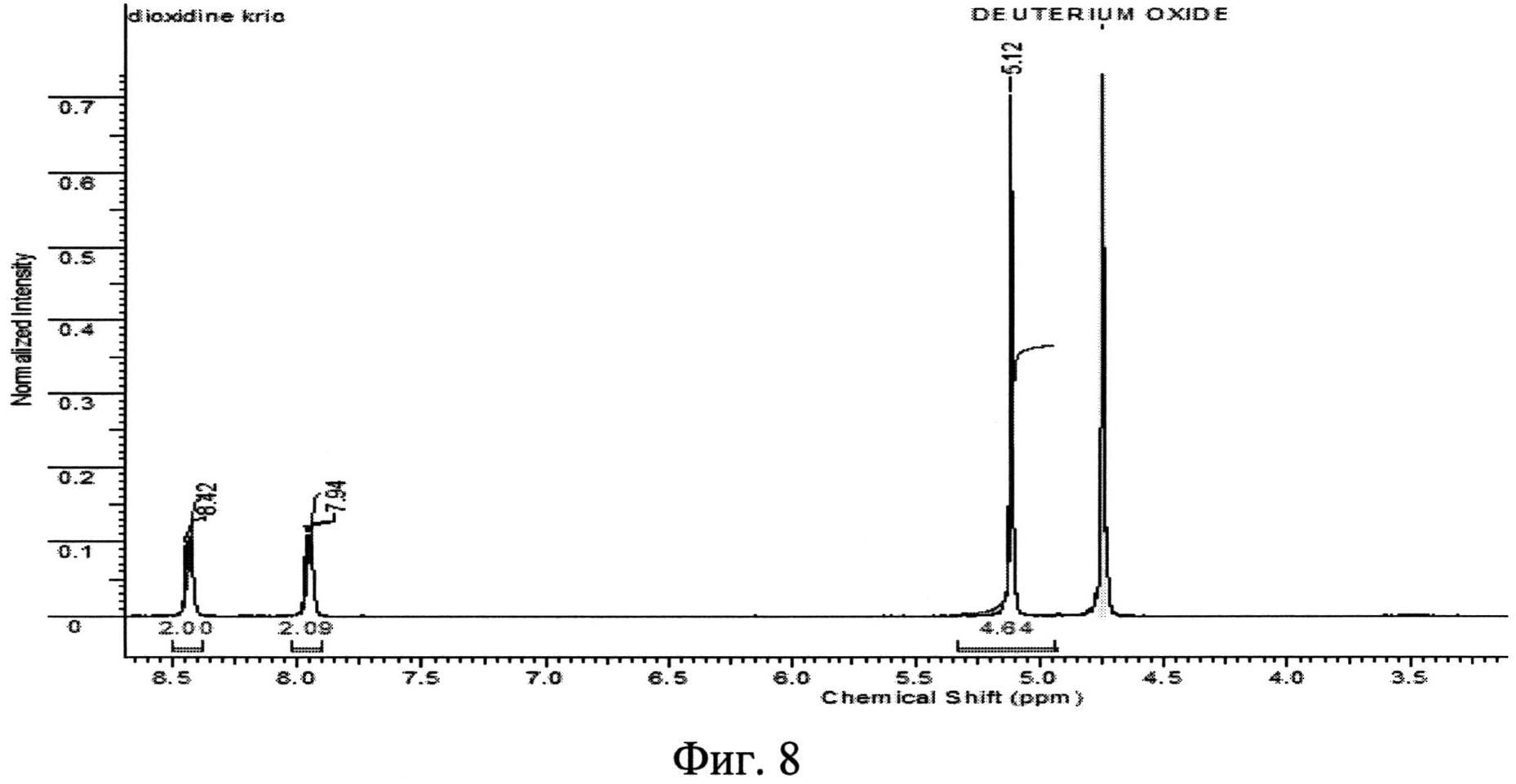
Фиг. 7. ЯМР 1H - спектр исходной фармакопейной субстанции диоксидина.
Фиг. 8. ЯМР 1H - спектр новой, не известной ранее кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
Для идентификации полученного вещества был проведен комплекс физико-химических методов анализа.
Первоначально, методами ядерного магнитного резонанса (ЯМР-1H) и газовой хроматографии была установлена идентичность химических формул исходной субстанции диоксидина по ФС 42-2308-97 и новой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
Определение химических сдвигов исходного и полученного вещества было проведено в его насыщенном растворе в дейтерированной воде (D2O) на ЯМР-спектрометре высокого разрешения VXR-400 фирмы "VARIAN" (США). Полученные данные приведены на фиг. 7 и 8. Сравнение результатов, представленных на фиг. 7 (исходная субстанция диоксидина), с данными, приведенными на фиг. 8 (новая кристаллическая β-модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида), показывает, что ЯМР - 1H - спектры исходного и полученного авторами вещества идентичны, т.е. полученное вещество является 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксидом.
Хроматографическую подвижность исходной субстанции диоксидина и полученной из него кристаллической β-модификации определяли методом газовой хроматографии на газовом хроматографе «КристаллЛюкс - 4000» (хроматографическая колонка - набивная, фаза - SE - 30, длина 3 м; температура испарителя - 220°C; температура детектора - 245°C; газ-носитель - азот, скорость потока газа-носителя - 30 см3/мин). Для хроматографирования образцов использовали насыщенный спиртовой раствор исходного диоксидина и новой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
Оказалось, что времена удерживания 3,96 мин для исходной субстанции и 3,95 мин для полученного из нее вещества, а также хроматографические индексы удерживания Ковача j=1218 для исходной субстанции и j=1218 для полученного из нее модификации одинаковы. Это свидетельствует о том, что химические составы исходной субстанции диоксидина и полученного из него вещества идентичны друг другу и отвечают составу 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида. Кроме того, на хроматограммах исходной субстанции и полученного из него вещества, кроме хроматографических пиков растворителя и диоксидина, других пиков, которые показывают наличие примесей, на хроматограммах не обнаружено.
Таким образом, проведенные эксперименты свидетельствуют о том, что при получении кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида из исходной субстанции диоксидина распада вещества не происходит. Экспериментальные результаты ядерного магнитного резонанса (ЯМР-1H) и газовой хроматографии однозначно свидетельствуют о том, что полученное из исходного фармакопейного диоксидина вещество является 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксидом.
Для подтверждения того, что полученное вещество является новой кристаллической модификацией 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, названной авторами β-модификацией, были проведены рентгенофазовый анализ (РФА), ИК-спектроскопические и термоаналитические исследования.
Рентгенофазовый анализ (РФА) исходной субстанции диоксидина и полученного из нее вещества проводили на дифрактометре Rigaku D/MAX-2500 (Rigaku, Япония) на CuKα излучении (λ=1,54056 Å). Полученные результаты для исходной субстанции приведены в табл. 1 и на фиг. 1, а для полученного из него вещества - в табл. 2 и на фиг. 2. Сравнение полученных данных, представленных в табл. 1 и табл. 2, а также на фиг. 1 и фиг. 2 свидетельствует о том, что полученный порошок диоксидина является новой, не известной ранее, кристаллической β-модификацией 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида.
ИК-спектры исходной субстанции диоксидина и полученной из нее кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида получали на ИК-фурье-спектрометре марки "Икар" опытного производства ФИАН РАН. Регистрацию ИК спектров порошкообразных образцов осуществляли по стандартной методике в прессованных таблетках бромистого калия. Содержание диоксидина по массе в смеси с бромистым калием составляло 0,6 мас. %, толщина таблетки 0,5 мм. Полученные результаты приведены на фиг. 3 и фиг. 4. Видно, что в диапазоне 800-1500 см-1 спектры различаются.
Таким образом, проведенные эксперименты показали, что использование ИК-спектроскопии позволяет различать исходную субстанцию и полученную из нее новую кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида и позволяют идентифицировать новую модификацию диоксидина.
Термоаналитические исследования проводили на термоанализаторе STA 449 С Jupiter (NETZSCH) в токе аргона при повышении температуры 10 град/мин. В качестве держателей образцов использовали алюминиевые кюветы. Навески проб составляли 3,9-6,0 мг. Полученные данные приведены на фиг. 5 и фиг. 6. Видно, что кривые ДСК исходной субстанции диоксидина (фиг. 5) и полученной из него новой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида (фиг. 6) различаются положением и величиной: эндотермических эффектов плавления, а также экзотермических эффектов термического разложения. Для исходной субстанции диоксидина плавление происходит при температуре (175,5±0,5)°C с тепловым эффектом - (99,8±0,4) Дж/г, а термолиз протекает при температуре (199,2±0,5)°C с тепловым эффектом (1135±4) Дж/г. Для новой кристаллической β-модификации диоксидина плавление происходит при температуре (171,7±0,5)°C с тепловым эффектом - (38,8±0,4) Дж/г, а термолиз протекает при температуре (186,0±0,5)°C с тепловым эффектом (1243±4) Дж/г.
Таким образом, проведенные термоаналитические эксперименты показали, что полученная новая кристаллическая β-модификация диоксидина более активна к процессам плавления и термического разложения. Кроме того, термоаналитические исследования позволяют различать исходную субстанцию диоксидина и полученную из нее новую кристаллическую β-модификацию 2,3-бис-(гидроксиметил) хиноксалин-N,N′-диоксида.
Определение активности исходной субстанции диоксидина и полученной из нее новой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида осуществляли по изучению устойчивости микроорганизмов диско-диффузионным методом [Определение чувствительности к антибактериальным препаратам. Под ред. Онищенко Г.Г. «Клиническая микробиология, антимикробная химиотерапия», 2004 г., том 6, №4, с. 306-359]. В качестве тест культур использовали бактерии, полученные из коллекции культур кафедры микробиологии, биологического факультета МГУ им. М.В. Ломоносова: Escherichia coli 52 и Mycobacterium cyaneum 98. Эксперименты проводили в стерильных чашках Петри, содержащих по 20 мл агаризованной (ПД - агар) питательной среды (толщина слоя 4 мм), выдержанной в течение суток. Приготовление бактериальной суспензии исследуемого тест микроорганизма и посев ею среды проводили следующим образом. Одну или две полные микробиологические петли с культурой вносили в 5 мл стерильной дистиллированной воды, взбалтывали полученную суспензию в течение 30 секунд и определяли ее концентрацию по оптической плотности [спектрофотометр ПЭ - 530 ВИ (РФ)] при λ=625 нм, сравнивали полученную величину с оптической плотностью приготовленного предварительно 0,5 стандарта МакФарланда (эквивалентна 1,5×108 КОЕ/мл). После этого 100 мкл суспензии культуры помещали на поверхность среды в чашки Петри, тщательно растирали стерильным шпателем, через 15 мин в них вносили исходную субстанцию диоксидина или, полученную из нее, новую кристаллическую β-модификацию 2,3-бис-(гидроксиметил) хиноксалин-N,N′-диоксида в виде дисков диаметром (6,00±0,02) мм, высотой (3,11±0,06) мм и массой (96±2) мг, помещали в термостат и инкубировали при 30°C. Для получения надежных результатов в параллельных сериях опытов использовали не менее 5-ти дисков. Контроль результатов роста тест культур и измерение зон подавления их роста проводили через 16, 24 и 48 часов инкубации. Диаметр зон подавления роста (ЗПР) измеряли линейкой в 3-х направлениях для каждого диска, с точностью до 0,5 мм. Полученные в микробиологических экспериментах результаты приведены в табл. 3. Видно, что зоны подавления роста тест культур новой кристаллической β-модификацией 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида больше при всех временах инкубации, чем при использовании дисков из исходной субстанции диоксидина и, следовательно, полученная авторами новая модификация более активна к процессам подавления роста микроорганизмов, то есть обладает более выраженным противомикробным, антибактериальным и бактерицидным действием.
Таким образом, экспериментальные результаты рентгенофазового анализа, ИК-спектроскопии, дифференциальной сканирующей калориметрии и микробиологических опытов однозначно свидетельствуют о том, что полученное вещество является новой, не известной ранее, кристаллической β-модификацией 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида. Она характеризуется отличными от других набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн, %): 8,740 - 100,0%; 8,026 - 94,2%; 7,546 - 22,3%; 6,899 - 57,8%; 6,681 - 24,4%; 6,288 - 50,9%; 5,978 - 43,4%; 5,723 - 9,7%; 5,371 - 11,5%; 5,177 - 17,1%; 4,952 - 29,5%; 4,498 - 19,4%; 4,345 - 23,9%; 4,072 - 25,3%; 4,013 - 17,6%; 3,905 - 20,5%; 3,678 - 28,4%; 3,526 - 12,7%; 3,440 - 30,0%; 3,358 - 99,3%; 3,304 - 67,6%; 3,206 - 31,6%; 3,145 - 18,3%; 2,981 - 11,4%; 2,890 - 12,9%; 2,793 - 9,7%; 2,677 - 7,5%; 2,613 - 9,8%; 2,535 - 8,9%; 2,470 - 8,1%; 2,370 - 9,9%; 2,287 - 7,5%; 2,244 - 9,0%; 2,079 - 7,1%; 1,963 - 6,7%; 1,703 - 7,0%, а также определенными ПК - спектрами в области от 400 до 4000 см-1 и, конкретно, в диапазоне 800 - 1500 см-1, определенными значениями эндотермического эффекта плавления, равного (38,8±0,4) Дж/г при температуре (171,7±0,5)°C, экзотермического эффекта термического разложения, равного (1243±4) Дж/г при температуре (186,0±0,5)°C. Кроме того, новая кристаллическая β-модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида отличается повышенной противомикробной, антибактериальной и бактерицидной активностью по сравнению с исходной субстанцией диоксидина.
Способ получения новой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида заключается в том, что выделение кристаллитов проводят из водного раствора диоксидина, имеющего температуру от 20°C до 100°C, замораживают при скорости не менее 60 град/мин с последующей сублимационной сушкой в течение 22-27 часов.
Отличиями предложенного способа получения заявляемой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида являются: температура водного раствора диоксидина от 20°C до 100°C, скорость замораживания не менее 60 град/мин и время сублимационной сушки в течение 22-27 часов.
Приготовление раствора исходного диоксидина при повышенных температурах было использовано для ускорения процесса его растворения.
Уменьшение температуры водного раствора диоксидина ниже комнатной температуры (20°C) не целесообразно поскольку требует дополнительных затрат энергии на охлаждение системы.
Увеличение температуры водного раствора диоксидина выше 100°C также не целесообразно из-за необходимости применения специального оборудования.
При уменьшении скорости замораживания менее 60 град/мин скорость криокристаллизации раствора диоксидина уменьшается и приближается к равновесному процессу. Это приводит к частичному получению уже известной кристаллической модификации. Новую кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида в чистом виде получить не удается.
Уменьшение времени сублимационной сушки меньше 22 ч приводит к получению невысохшего продукта: «порошок диоксидина - его замороженный раствор». Система при комнатной температуре плавится, порошок частично растворяется и перекристаллизовывается, частично образуя известную кристаллическую модификацию. Новую кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида в чистом виде получить не удается.
Увеличение времени сублимационной сушки больше 27 ч нецелесообразно, так как не приводит к увеличению выхода целевого продукта - новой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида и лишь удорожает процесс.
Возможность осуществления предлагаемого изобретения иллюстрируется следующими примерами, но не ограничивается ими.
Пример 1. 1,00 г диоксидина растворяют при комнатной температуре в 99,00 г дистиллированной воды при интенсивном перемешивании. Полученный раствор при комнатной температуре (20°C) наливают в поддон из нержавеющей стали и замораживают его со скоростью 60 град/мин погружением дна поддона в смесь «ацетон - сухой лед» (Т=-78°C). Полученный замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -50…-55°C; на продукте -196…+40°C и остаточном давлении в камере (8-6)·10-2 Торр в течение 22 ч. Выход продукта составил 0,98 г (98 масс. %). По данным РФА полученное вещество является новой кристаллической β-модификацией 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида. Оно характеризуется типичной дифрактограммой, представленной на фиг. 2 и набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой кристаллической β-модификации диоксидина, представленными в табл. 2. По результатам ИК - спектроскопии полученный порошок характеризуется ИК - спектрами, присущими новой кристаллической β-модификации диоксидина (фиг. 4). Термоаналитические исследования полученного вещества показали, что эндотермический эффект плавления равен (38,7±0,4) Дж/г при температуре (171,8±0,5)°C, а экзотермический эффект термического разложения равен (1244±4) Дж/г при температуре (186,1±0,5)°C, что совпадает с величинами эндотермического и экзотермического эффектов и их температурами, характерными для новой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида (фиг. 6).
Пример 2. 8,00 г диоксидина растворяют при температуре 100°C в 192,00 г дистиллированной воды при интенсивном перемешивании и замораживают его со скоростью (3-4)×102 град/мин вливанием раствора в предварительно охлажденный и наполненный жидким азотом (Ткип=-196°C) поддон из нержавеющей стали. Полученный замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -50…-55°C; на продукте - 196…+30°C, и остаточном давлении в камере (4-6)·10-2 Торр в течение 27 ч. Выход продукта составил 7,78 г (97,2 масс. %). По данным РФА полученное вещество является новой кристаллической β-модификацией 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида. Оно характеризуется типичной дифрактограммой, представленной на фиг. 2, и набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой β-модификации диоксидина, представленными в табл. 2. По результатам ИК-спектроскопии полученный порошок характеризуется ИК-спектрами, присущими новой кристаллической β-модификации диоксидина (фиг. 4). Термоаналитические исследования полученного вещества показали, что эндотермический эффект плавления равен (38,8±0,4) Дж/г при температуре (171,7±0,5)°C, а экзотермический эффект термического разложения равен (1243±4) Дж/г при температуре (185,9±0,5)°C, что совпадает с величинами эндотермического и экзотермического эффектов и их температурами, характерными для новой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида (фиг. 6).
Пример 3. 6,00 г диоксидина растворяют в 294,00 г дистиллированной воды при интенсивном перемешивании при температуре 60°C и замораживают его со скоростью 2×103 град/мин распылением раствора пневматической форсункой при избыточном давлении 0,7 кг/см2 в реактор, наполненный жидким азотом (Ткип.=-196°C). Полученный замороженный продукт на поддоне переносят в сублимационную камеру и подвергают сублимационной сушке при температурах: на конденсаторе -50…-55°C; на продукте -196…+50°C, и остаточном давлении в камере (5-6)·10-2 Торр в течение 25 ч. Выход продукта составил 5,95 г (99,2 мас. %). По данным РФА полученное вещество является новой кристаллической β-модификацией 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида. Оно характеризуется типичной дифрактограммой, представленной на фиг. 2, и набором межплоскостных расстояний и их интенсивностями, совпадающих с соответствующими значениями для новой β-модификации диоксидина, представленными в табл. 2. По результатам ПК-спектроскопии полученный порошок характеризуется ПК-спектрами, присущими новой кристаллической β-модификации диоксидина (фиг. 4). Термоаналитические исследования полученного вещества показали, что эндотермический эффект плавления равен (38,8±0,4) Дж/г при температуре (171,7±0,5)°C, а экзотермический эффект термического разложения равен (1243±4) Дж/г при температуре (186,0±0,5)°C, что совпадает с величинами эндотермического и экзотермического эффектов и их температурами, характерными для новой кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида (фиг. 6).
Пример 4. Фармацевтическая композиция. Для приготовления 100,0 г композиции: «Диоксидин раствор для инъекций 0,5% и 1%» (ФСП 420036145701), включающей в качестве действующего вещества кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида и вспомогательные вещества в соотношении (мас. %):
|
(ФС 42-2620-97)
1,00 г новой, не известной ранее, кристаллической β-модификации 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида растворяют в 99,00 г воды для инъекций (ФС 42-2620-97) при 40°C. Полученный раствор охлаждали до комнатной температуры и в дальнейшем использовали в микробиологических опытах.
Определение активности фармацевтических композиций, включающих исходную субстанцию диоксидина или полученную из нее новую кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, осуществляли по изучению устойчивости микроорганизмов диско-диффузионным методом [Определение чувствительности к антибактериальным препаратам. Под ред. Онищенко Г.Г. «Клиническая микробиология, антимикробная химиотерапия», 2004 г., том 6, №4, с. 306-359]. В качестве тест-культур использовали бактерии, полученные из коллекции культур кафедры микробиологии, биологического факультета МГУ им. М.В. Ломоносова: Escherichia coli 52. Эксперименты проводили в стерильных чашках Петри, содержащих по 20 мл агаризованной (ПД - агар) питательной среды (толщина слоя 4 мм), выдержанной в течение суток. Приготовление бактериальной суспензии исследуемого тест микроорганизма и посев ею среды проводили следующим образом. Одну или две полные микробиологические петли с культурой вносили в 5 мл стерильной дистиллированной воды, взбалтывали полученную суспензию в течение 30 секунд и определяли ее концентрацию, по оптической плотности [спектрофотометр ПЭ - 530ВИ (РФ)] при λ=625 нм и сравнивали полученную величину с оптической плотностью приготовленного предварительно 0,5 стандарта МакФарланда (эквивалентна 1,5×108 КОЕ/мл). После этого 100 мкл суспензии культуры помещали на поверхность среды в чашки Петри, тщательно растирали стерильным шпателем, через 15 мин в них вносили исходный диоксидин или полученную из него новую кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида в виде дисков диаметром (6,0±0,1) мм из стерильной фильтровальной бумаги, пропитанных соответствующими растворами с концентрацией 2 мг/мл (0,2 мас. %), помещали в термостат и инкубировали при 30°C. Для получения надежных результатов в параллельных сериях опытов использовали не менее 5-ти дисков. Контроль результатов роста культур и измерение зон подавления их роста проводили через 24 и 40 часов инкубации. Диаметр зон подавления роста измеряли линейкой в 3 направлениях для каждого диска с точностью до 0,5 мм. Полученные в микробиологических экспериментах результаты приведены в табл. 4. Видно, что зоны подавления роста культур дисками, пропитанными фармацевтической композицией, содержащей новую кристаллическую β-модификацию 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, больше, чем при использовании дисков, пропитанных фармацевтической композицией, содержащей исходную субстанцию диоксидина и, следовательно, полученная авторами новая β-модификация более активна к процессам подавления роста микроорганизмов, то есть обладает более выраженным противомикробным, антибактериальным и бактерицидным действием при использовании ее в фармацевтической композиции.
Таким образом, авторами обнаружена новая кристаллическая β-модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, предложены способ ее получения и применение ее для приготовления фармацевтической композиции, обладающей противомикробной, антибактериальной и бактерицидной активностью.
Полученная кристаллическая β-модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида характеризуется отличным от исходной субстанции диоксидина набором межплоскостных расстояний (d, Å) и соответствующих им интенсивностей (Iотн, %): 8,740 - 100,0%; 8,026 - 94,2%; 7,546 - 22,3%; 6,899 - 57,8%; 6,681 - 24,4%; 6,288 - 50,9%; 5,978 - 43,4%; 5,723 - 9,7%; 5,371 - 11,5%; 5,177 - 17,1%; 4,952 - 29,5%; 4,498 - 19,4%; 4,345 - 23,9%; 4,072 - 25,3%; 4,013 - 17,6%; 3,905 - 20,5%; 3,678 - 28,4%; 3,526 - 12,7%; 3,440 - 30,0%; 3,358 - 99,3%; 3,304 - 67,6%; 3,206 - 31,6%; 3,145 - 18,3%; 2,981 - 11,4%; 2,890 - 12,9%; 2,793 - 9,7%; 2,677 - 7,5%; 2,613 - 9,8%; 2,535 - 8,9%; 2,470 - 8,1%; 2,370 - 9,9%; 2,287 - 7,5%; 2,244 - 9,0%; 2,079 - 7,1%; 1,963 - 6,7%; 1,703 - 7,0%.
Кроме того, новая кристаллическая β-модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида отличается повышенной противомикробной, антибактериальной и бактерицидной активностью как в виде спрессованного порошка, так и в составе фармацевтической композиции по сравнению с действием исходной субстанцией диоксидина.
Из вышеизложенного можно сделать вывод о том, что заявляемая кристаллическая β-модификация 2,3-бис-(гидроксиметил)хиноксалин-N,N′-диоксида, способ ее получения и применение ее для приготовления фармацевтической композиции, обладающей противомикробной, антибактериальной и бактерицидной активностью, являются новыми и удовлетворяют критериям «изобретательский уровень» и «промышленная применимость».
|
|
|
|