Результат интеллектуальной деятельности: СПОСОБ ЗАМЕНЫ ЭНДОКАРДИАЛЬНЫХ ЭЛЕКТРОДОВ ИМПЛАНТИРУЕМЫХ АНТИАРИТМИЧЕСКИХ УСТРОЙСТВ ПОСЛЕ ОРТОТОПИЧЕСКОЙ ТРАНСПЛАНТАЦИИ СЕРДЦА ПО БИАТРИАЛЬНОЙ МЕТОДИКЕ
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к сердечно-сосудистой хирургии, и может быть использовано в интервенционной аритмологии для лечения жизнеугрожающих нарушений ритма у больных после ортотопической трансплантации сердца по биатриальной методике.
В настоящее время проблеме замены электрокардиостимуляторов и деимплантации скомпроментированнных эндокардиальных электродов (ЭЭ) придается значительное внимание, это связано и с увеличением общего количества имплантаций, которое превысило в мире 1 млн, и увеличением числа двух- и трехкамерных ЭКС. Осложнения замены ЭКС включают инфекцию, повреждение электрода и асистолию во время переключения со старого на новый генератор. При этом к настоящему времени Американским кардиологическим колледжем (АСС) совместно с Американской Ассоциацией Сердца (AHA) разработаны рекомендации по удалению ЭЭ ЭКС.
Известен способ хирургического удаления эндокардиальных электродов для постоянной электрокардиостимуляции (Бокерия Л.А. Опыт хирургического удаления эндокардиальных электродов для постоянной электрокардиостимуляции / Л.А. Бокерия, А.Ш. Ревишвили, А.А. Дюжиков, Г.В. Чудинов // Анналы аритмологии. - 2006. - №2. - С.78-81), при котором в условиях искусственного кровообращения с использованием открытого коронарного доступа выполняют иссечение электродов вместе с фиброзной периэлектродной капсулой. Недостатком известного способа является значительное увеличение риска кровотечения и фатальных тромбоэмболических осложнений.
Известен способ интервенционной механической дезоблитерации эндокардиальных электродов (Byrd C.L. Is there an optimal method of lead extraction? // Cardiac Pacing: New advances / Ed. M. Rosenqvist. - Philadelphia: WB Saunders Co., 1997. - P.293-317). Способ включает использование активного наконечника телескопической системы, разрушающего фиброзную периэлектродную ткань лазерным воздействием, после чего экстракция электродов осуществляется контртракцией посредством телескопической системы.
Недостатком является то, что клиническое применение указанного способа сопровождается развитием жизнеугрожающих осложнений, таких как травмы камер сердца и стенок сосудов, сопровождаемые гемоперикардом и гемотораксом, кроме того, во время тракции возможен отрыв фрагментов электродов. Наконец, эффективность применения телескопических систем составляет не более 89%.
В то же время вопросы замены ЭЭ у пациента с нарушениями ритма после ортотопической трансплантации сердца недостаточно изучены и требуют особого подхода. При выполнении трансплантации сердца по биатриальной методике спустя в среднем три недели после операции примерно 30-35% пациентов нуждаются в повторной имплантации постоянных эндокардиальных систем в основном в связи с брадиаритмиями. Это связано с тем, что главный водитель ритма (синусовый узел) реципиента электрически изолируется от правого предсердия сердца донора швом, соединяющим правые предсердия сердец донора и реципиента.
Наиболее близким к заявляемому является способ удаления электродов для постоянной электрокардиостимуляции, при котором в условиях нормотермического параллельного искусственного кровообращения (ИК) выполняют правостороннюю поперечную атриотомию и под прямым визуальным контролем мобилизуют интрапредсердный участок эндокардиального электрода из рубцовых сращений и пересекают его, отделяя проксимальные и дистальные сегменты ЭЭ (Чудинов Г.В. Сспособ удаления электродов для постоянной электрокардиостимуляции с использованием параллельного искусственного кровообращения / Г.В. Чудинов, А.В. Пономарев, А.С. Додонов // Вестник аритмологии. - 2013. - №73. - с.64), после чего дистальную часть ЭЭ вместе с ЭКС удаляют тракцией через рану в проекции ложа ЭКС, а проксимальные отрезки правожелудочковых ЭЭ удаляют с использованием механической противотракции. Отрезок проксимального конца ЭЭ продевают сквозь специально изготовленную проволочную петлю, при этом одновременно натягивают электрод, погружая петлю в правый желудочек, сдвигая ее до места электродно-эндокардиального контакта.
Недостатком прототипа является то, что на фоне иммуносупрессивной терапии, проводимой в послеоперационном периоде, значительно хуже идет заживление послеоперационной раны, повышается риск развития местных инфекционных осложнений, связанных с оставлением пустого ложа антиаритмического устройства после удаления последнего. Кроме того, при последующей реимплантации новой системы стимуляции в процессе проведения ЭЭ через измененные ткани подключичной области возможно развитие таких осложнений, как кровотечения, артериовенозные фистулы, пневмоторакс и пр.
Техническим результатом изобретения является повышение безопасности и уменьшение количества осложнений при замене ЭЭ имплантируемых антиаритмических устройств после ортотопической трансплантации сердца по биатриальной методике.
Технический результат достигается за счет того, что во время проведения у реципиента кардиоэктомии эндокардиальные электроды деимплантируемого антиаритмического устройства пересекают на уровне устья верхней полой вены и удаляют сердце вместе с проксимальными сегментами электродов. Дистальные же сегменты рассеченных электродов и генератор оставляют в исходной позиции, а их удаление или замену осуществляют по истечении трех недель послеоперационного периода.
Предложен способ замены ЭЭ имплантируемых антиаритмических устройств после ортотопической трансплантации сердца по биатриальной методике, включающий поперечное рассечение ЭЭ деимплантируемого антиаритмического устройства на уровне устья верхней полой вены, удаление сердца реципиента вместе с проксимальными сегментами рассеченных эндокардиальных электродов и выполнение имплантации аллотрансплантата донора.
Отличием является то, что дистальные сегменты рассеченных эндокардиальных электродов и генератор антиаритмического устройства оставляют в исходной проекции, а их удаление и замену выполняют не ранее чем через три недели после трансплантации сердца, при этом реимплантацию новой системы стимуляции осуществляют одномоментно с удалением дистальных сегментов эндокардиальных электродов и генератора антиаритмического устройства. Новые эндокардиальные электроды проводят по проводникам, вводимым через шахту для стилета внутри дистальных сегментов оставленных эндокардиальных электродов.
Ранний послеоперационный период является наиболее сложным и ответственным при адаптации донорского сердца к новым условиям функционирования. Несмотря на кажущуюся эффективность и мощность работы трансплантированного органа, практически у всех больных в послеоперационном периоде обнаруживаются нарушения ритма (у 81,2% - суправентрикулярные, у 87,5% - желудочковые). Наряду с нарушениями ритма донорского сердца у пациентов довольно часто регистрируются аритмии оставшейся части предсердий реципиента, синдром слабости синусового узла. У некоторых пациентов возникает необходимость в реимплантации постоянных водителей ритма.
В случае развития у пациента после трансплантации сердца жизнеугрожающих нарушений ритма и/или проводимости имплантацию новой системы стимуляции осуществляют одномоментно с удалением дистальных сегментов оставленных эндокардиальных электродов. Перед удалением старой системы вначале выполняется отсоединение генератора антиаритмического устройства от дистальных сегментов рассеченных эндокардиальных электродов. Новые эндокардиальные электроды устанавливают по проводникам, введенным через шахты для стилета внутри дистальных сегментов эндокардиальных электродов.
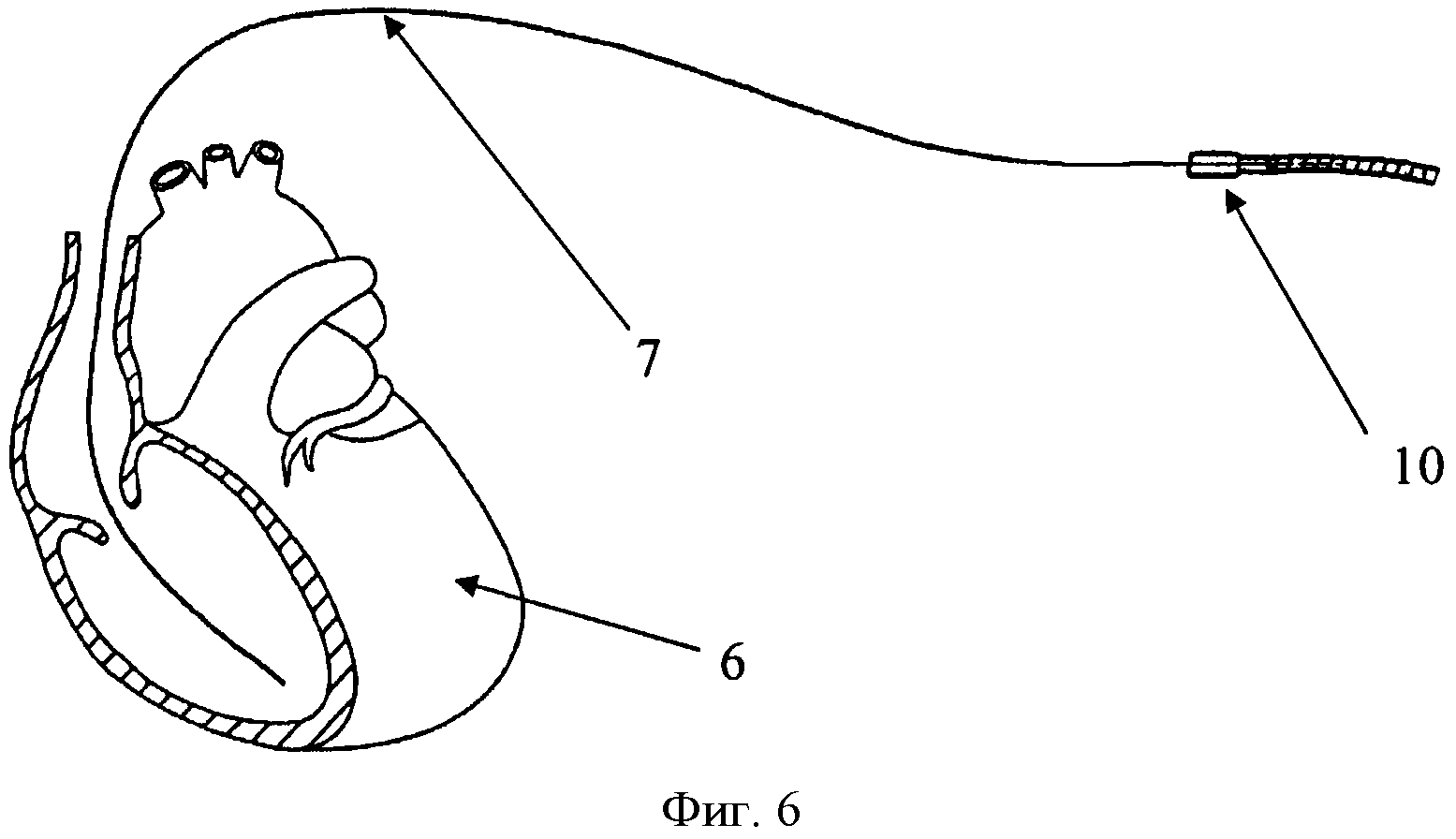
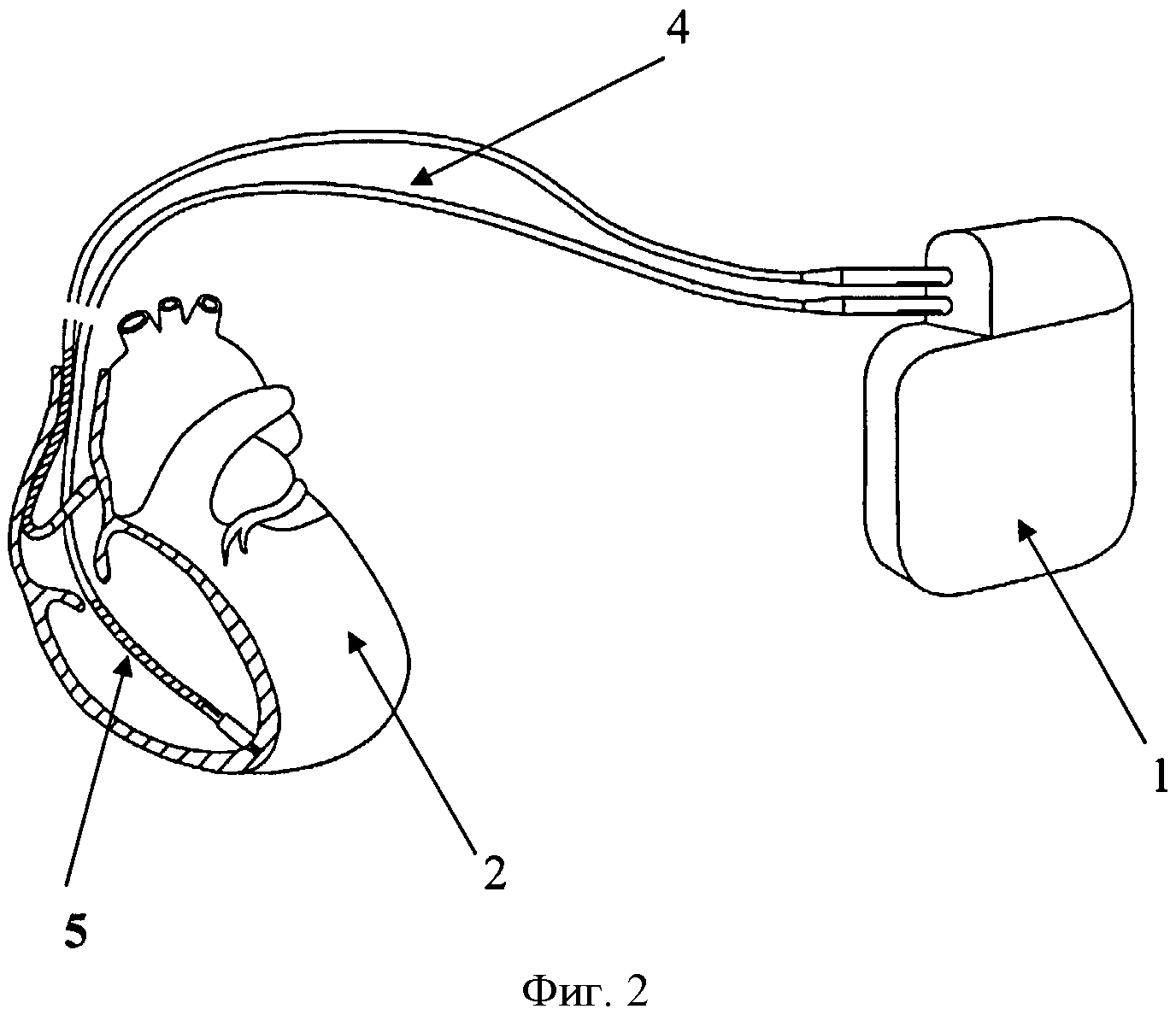
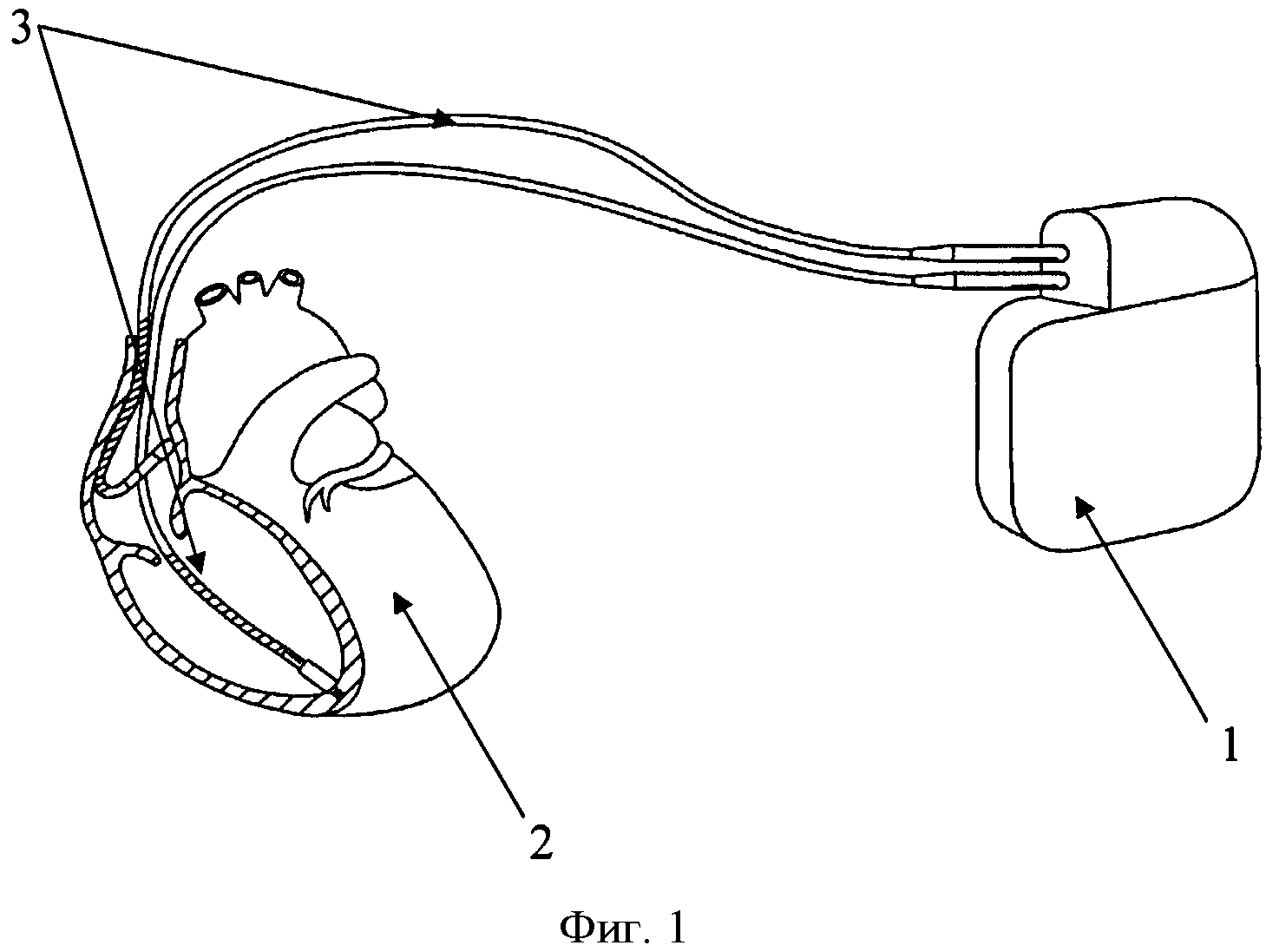
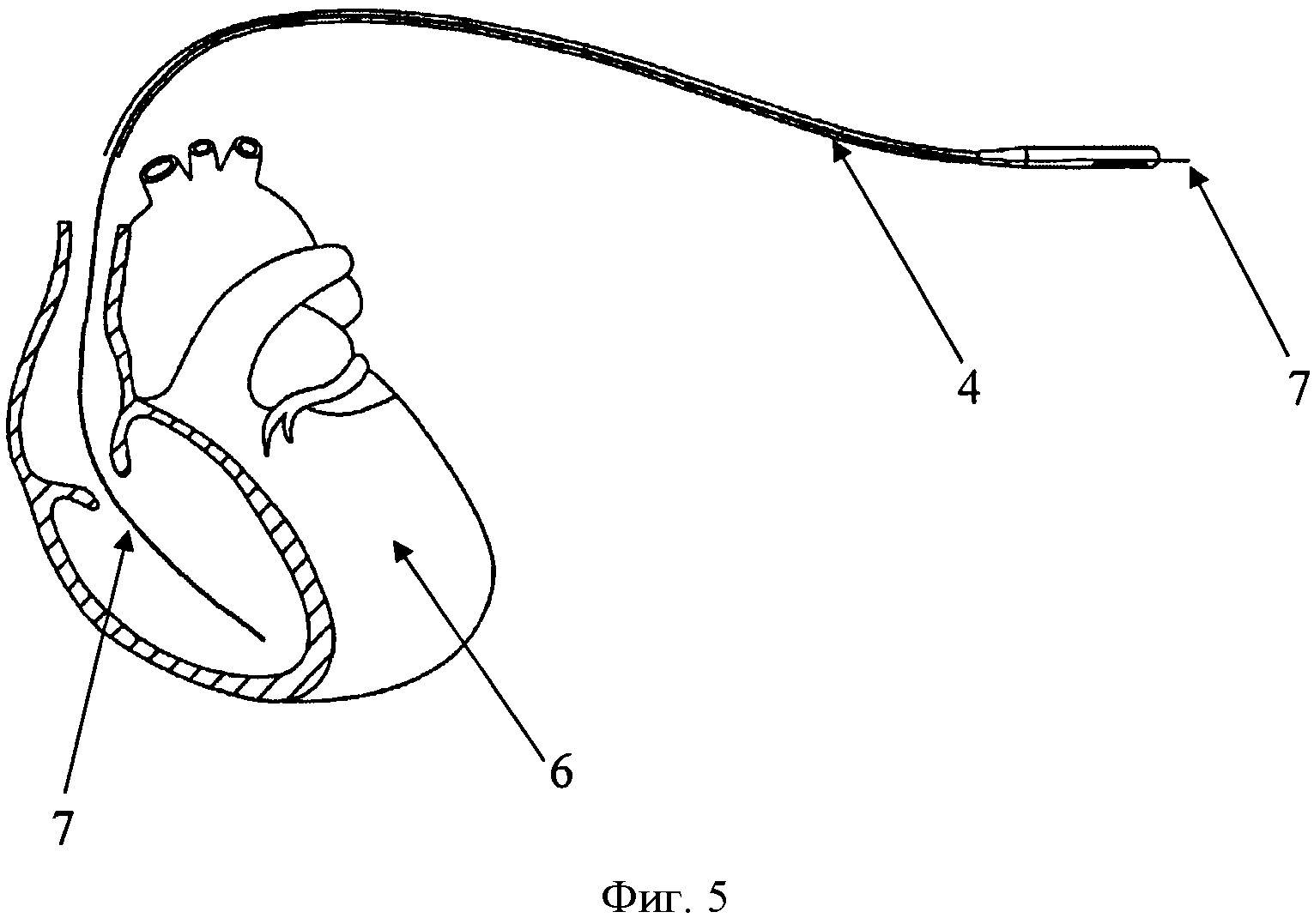
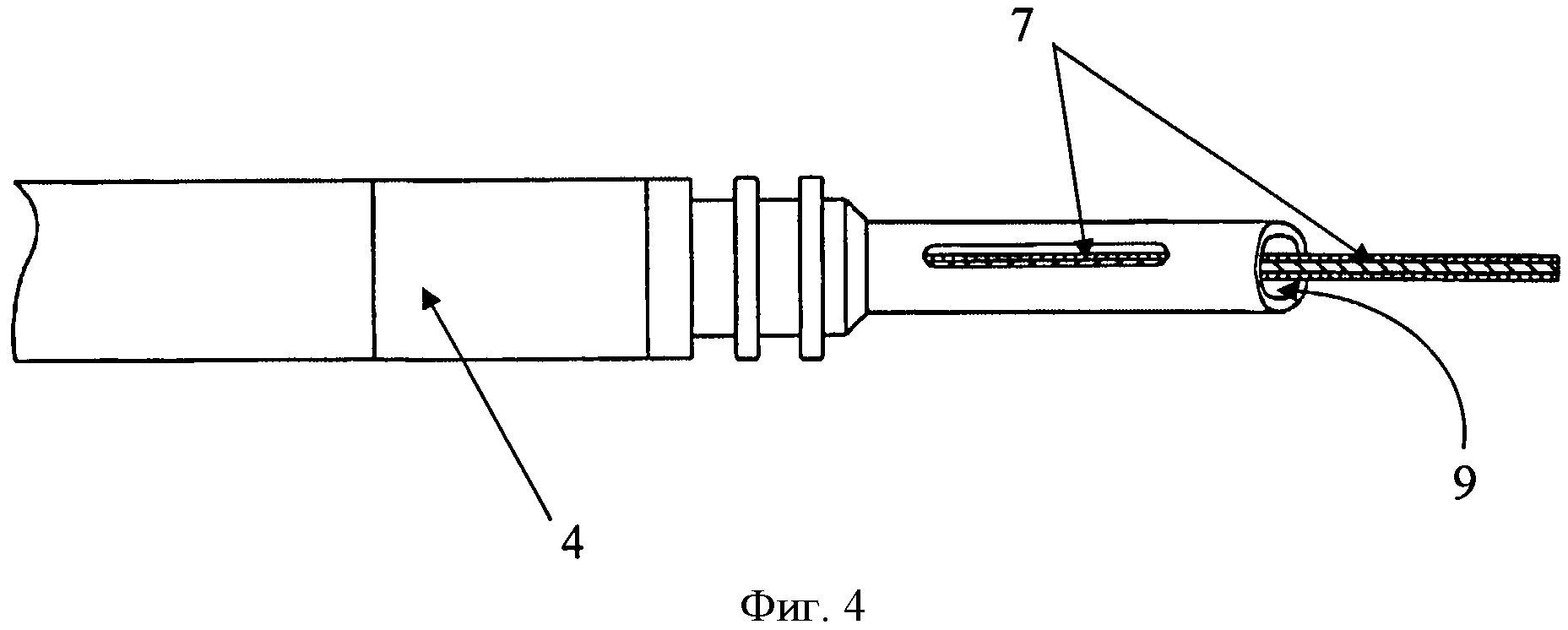
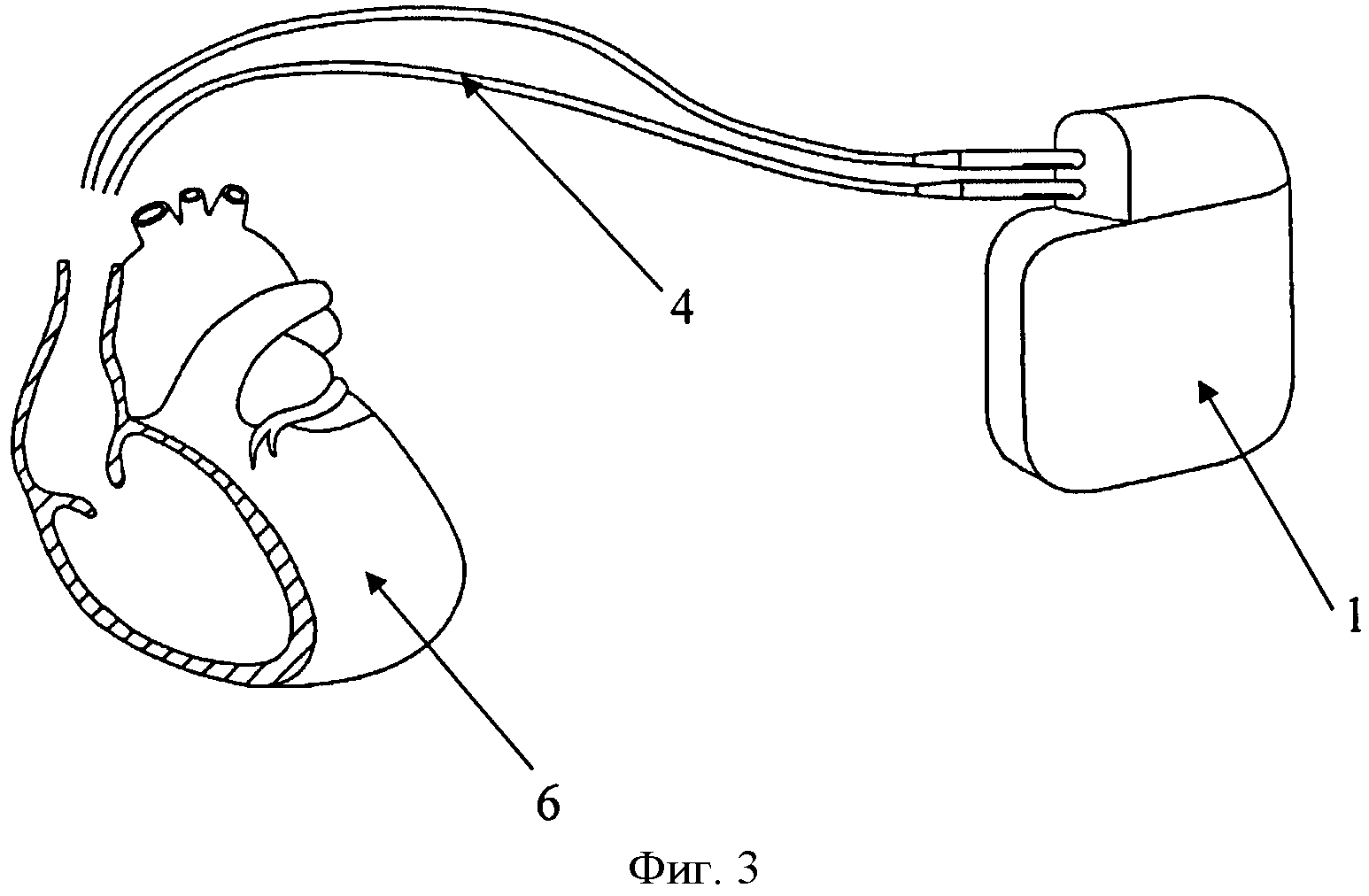
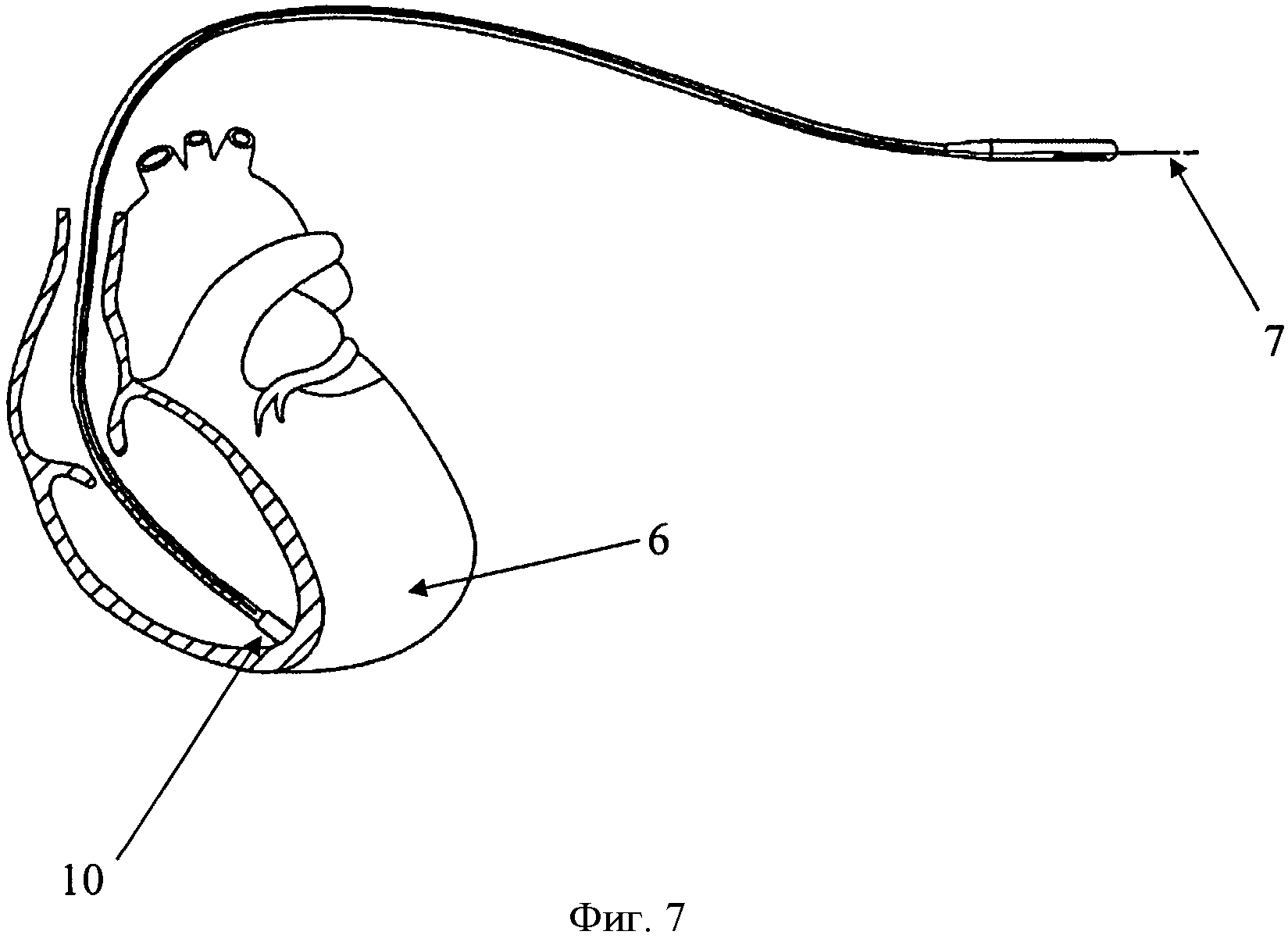
Изобретение поясняется чертежами, где на фиг. 1 показана схема расположения элементов антиаритмического устройства в сердце реципиента до выполнения способа, где 1 - генератор антиаритмического устройства, 2 - сердце реципиента, 3 - эндокардиальные электроды; на фиг. 2 изображено рассечение эндокардиальных электродов 3 на дистальный 4 и проксимальный 5 сегменты; на фиг. 3 изображена схема расположения антиаритмического устройства 1 с дистальными 5 сегментами ЭЭ и сердца донора 6; на фиг. 4 изображена схема дистального 4 сегмента ЭЭ, где 7 - проводник, 9 - шахта для стилета; на фиг. 5 изображено введение проводника 7 внутрь дистального 4 сегмента ЭЭ до правого желудочка трансплантированного донорского сердца 6; на фиг. 6 изображена установка заменяемого эндокардиального электрода 10 по проводнику 7, на фиг.7 заменяемый электрод 10 установлен в правом желудочке аллотрансплантата 6.
Способ замены эндокардиальных электродов имплантируемых антиаритмических устройств после ортопической трансплантации сердца состоит из двух отсроченных по времени этапов.
На первом этапе при кардиоэктомии у реципиента эндокардиальные электроды 3 антиаритмического устройства 1 пересекают на уровне устья верхней полой вены, разделяя их таким образом на дистальные 4 и проксимальные 5 сегменты. Сердце реципиента 2 удаляют вместе с проксимальными сегментами эндокардиальных электродов 5 деимплантируемого антиаритмического устройства 1.
После этого выполняется трансплантация донорского сердца 6. Дистальные сегменты 4 рассеченных эндокардиальных электродов 3 и антиаритмическое устройство 1 оставляют на прежнем месте, завершая хирургический этап трансплантации. В послеоперационном периоде пациенту проводят коррекцию гемодинамики, назначают иммуносупрессивную терапию и антибиотикотерапию.
Спустя три недели после трансплантации выполняют второй этап. Если при этом необходимости в повторной имплантации антиаритмического устройства с электродами нет, антиаритмическое устройство 1 удаляют вместе с дистальными сегментами 4 рассеченных эндокардиальных электродов 3.
В случае положительного решения вопроса о необходимости реимплантации новой системы стимуляции выполняют удаление антиаритмического устройства 1, предварительно отсоединив его от дистальных сегментов 4 рассеченных эндокардиальных электродов 3.
Последующую имплантацию новых эндокардиальных электродов 10 осуществляют с использованием шахт 9 для стилета дистального сегмента 4 эндокардиальных электродов 3, по которым проводят проводник 7 до места предполагаемой имплантации эндокардиального электрода 10. Затем дистальный сегмент 4 рассеченного электрода удаляют путем тракции по проводнику 7 (техника, также известная как «over-the-wire»), оставляя последний в прежней позиции. Далее проводится имплантация нового эндокардиального электрода 10 путем проведения его по проводнику 7 техникой «over-the-wire» с использованием или без разрывного интродьюсера, также предварительно установленного по проводнику 7.
После имплантации электрода 10 с пассивной фиксацией проводник 7 извлекается путем тракции. В том случае, когда имплантируется эндокардиальный электрод 10 с активной фиксацией, его винтовой наконечник выдвигается, после чего проводник 7 извлекается путем тракции.
Таким образом, интродьюсер и новый эндокардиальный электрод 10 проводят по ранее сформированному ложу, исключая необходимость в повторных катетеризациях подключичной вены и проведении интродьюсера и эндокардиального электрода 10 через фиброзно измененные и кальцинированные ткани подключичной области. Благодаря этому снижается риск местных осложнений (кровотечений, артериовенозной фистулы, пневмоторакса и пр.). При необходимости в имплантации более одного эндокардиального электрода имплантация остальных проводится аналогичным способом. В дальнейшем подключение вновь имплантированных эндокардиальных электродов к антиаритмическому устройству производится обычным способом; генератор антиаритмического устройства также имплантируется в ранее сформированное ложе.
Методика может использоваться у всех пациентов, позволяя улучшить заживление послеоперационной раны, снизить риск развития местных инфекционных осложнений после удаления антиаритмического устройства с эндокардиальными электродами, а также снизить риск осложнений последующей повторной имплантации антиаритмического устройства с эндокардиальными электродами.
Пример 1. Пациентка 3., 52 года, находилася в отделении сердечно-сосудистой хирургии с 14.01.2013 по 14.03.2013 с терминальной стадией хронической сердечной недостаточности на фоне дилатационной кардиомиопатии. Ранее с целью первичной профилактики внезапной сердечной смерти ей была выполнена имплантация однокамерного кардиовертера-дефибриллятора с эндокардиальным электродом в правом желудочке.
15.01.2013 пациентке выполнена ортотопическая трансплантация сердца по биатриальной методике в условиях искусственного кровообращения и антероградной кристаллоидной кардиоплегии. Непосредственно перед деимплантацией сердца реципиента выполнена правосторонняя поперечная атриотомия, под прямым визуальным контролем мобилизован интрапредсердный участок эндокардиального электрода из рубцовых сращений и пересечен, разделив его таким образом на проксимальный и дистальный сегменты. После этого дистальная часть ЭЭ вместе с кардиовертером-дефибриллятором удалены тракцией через рану в проекции ложа антиаритмического устройства. Проксимальный отрезок ЭЭ, поскольку не было необходимости в его отделении от сердца реципиента, эксплантирован вместе с последним.
Затем была выполнена имплантация донорского сердца, отключение искусственного кровообращения, подшивание к правому предсердию и правому желудочку электродов для временной электрокардиостимуляции, сведение краев перикарда и послойное ушивание стернотомной раны с остеосинтезом грудины и дренированием перикарда. Одномоментно наглухо было ушито ложе ранее имплантированного антиаритмического устройства.
В связи с адекватной хронотропной функцией трансплантата электроды для временной электрокардиостимуляции были удалены на третьи сутки после операции. Однако к концу второй недели послеоперационного периода у пациента отмечено развитие синусовой брадикардии, явившейся показанием к имплантации постоянного эндокардиального ЭКС. Однако в процессе катетеризации левой подключичной вены произошло повреждение одноименной артерии, что повлекло за собой развитие гематомы в левой над- и подключичной области, несмотря на предпринятые профилактические мероприятия. От продолжения имплантации с правой стороны было решено воздержаться. Принято решение об имплантации устройства с «неудачной» правой стороны (пациентка оказалась правшой).
В процессе катетеризации правой подключичной вены для имплантации новых эндокардиальных электродов произошло повреждение плевры в области верхушки легкого, повлекшее за собой наступление напряженного пневмоторакса. В этой связи в экстренном порядке проведено пункционное дренирование правой плевральной полости, после чего ЭКС все же был имплантирован в правую подключичную область.
В ближайшем послеоперационном периоде отмечались местные воспалительные явления в области ложа имплантированного ЭКС, потребовавшие неоднократного пункционного дренирования и назначения комбинированной антибактериальной терапии.
Пациентка была выписана 14.03.2013 ввиду того, что имевшие место осложнения потребовали продления госпитализации на три недели по сравнению с планируемой датой выписки.
Спустя шесть месяцев после реимплантации ЭКС пациентка перенесла травму правой нижней конечности, в связи с чем была вынуждена более полугода ходить, опираясь правой рукой на трость. Это привело к миопотенциальному ингибированию ЭКС, которое удалось разрешить путем коррекции программы устройства.
В данном клиническом случае выполнение реимплантации ЭКС при помощи способа-прототипа привело к четырем последовательно развившимся осложнениям (гематома, пневмоторакс, воспаление ложа, миопотенциальное ингибирование), потребовавшим вначале продления госпитализации, а затем коррекции программы ЭКС.
Пример 2. Пациент П., 45 лет, находился в отделении сердечно-сосудистой хирургии с 30.12.2012 по 28.01.2013 с терминальной стадией хронической сердечной недостаточности на фоне ишемической кардиомиопатии. Ранее с целью первичной профилактики внезапной сердечной смерти ему была выполнена имплантация двухкамерного кардиовертера-дефибриллятора с эндокардиальными электродами в правом желудочке и правом предсердии.
31.12.2012 пациенту выполнена ортотопическая трансплантация сердца по биатриальной методике в условиях искусственного кровообращения и антероградной кристаллоидной кардиоплегии. Непосредственно перед деимплантацией сердца реципиента выполнено поперечное рассечение эндокардиальных электродов ранее имплантированного кардиовертера-дефибриллятора на уровне устья верхней полой вены с дальнейшим удалением сердца реципиента вместе с проксимальными сегментами рассеченных эндокардиальных электродов. Затем была выполнена имплантация донорского сердца, отключение искусственного кровообращения, подшивание к правому предсердию и правому желудочку электродов для временной электрокардиостимуляции, сведение краев перикарда и послойное ушивание стернотомной раны с остеосинтезом грудины и дренированием перикарда.
В ближайшем послеоперационном периоде отмечались явления хронотропной некомпетентности на фоне синдрома малого сердечного выброса (ударный объем донорского сердца оказался в два раза меньше, чем сердца реципиента) при относительно нормальной функции естественного водителя ритма. Снижение минутного объема кровообращения и сердечного выброса были компенсированы работой временной системы электрокардиостимуляции на частоте 90-100 импульсов в минуту. На вторые сутки произведено удаление дренажей. В течение недели была достигнута адекватная потребностям организма насосная функция сердца на фоне спонтанного предсердного ритма, в связи с чем электроды для временной электрокардиостимуляции были удалены. По окончании второй недели послеоперационного периода стала прогрессировать брадикардия, по поводу которой 21.01.2013 выполнена одновременная деимплантация кардиовертера-дефибриллятора вместе с дистальными сегментами рассеченных эндокардиальных электродов и одномоментной имплантацией постоянной системы электрокардиостимуляции с эндокардиальными электродами в правый желудочек и правое предсердие по предложенному способу.
В послеоперационном периоде осложнений не наблюдалось, раны зажили первичным натяжением, 28.01.2013 пациент выписан в удовлетворительном состоянии.
В течение последующего года наблюдения осложнений, в том числе местных, не зарегистрировано. Дважды проводилась проверка функции имплантированной эндокардиальной системы постоянной электрокардиостимуляции, показавшая нормальное ее функционирование.
В данном клиническом случае выполнение предложенного способа позволило эффективно провести замену эндокардиальных электродов имплантируемых антиаритмических устройств после ортотопической трансплантации сердца по биатриальной методике, избежав при этом местных осложнений.
Предложенный способ использован на 6 пациентах, в результате чего получены данные о его высокой эффективности и безопасности.
Способ замены эндокардиальных электродов имплантируемых антиаритмических устройств после ортотопической трансплантации сердца по биатриальной методике, включающий поперечное рассечение эндокардиальных электродов деимплантируемого антиаритмического устройства, удаление сердца реципиента вместе с проксимальными сегментами рассеченных эндокардиальных электродов и выполнение имплантации аллотрансплантата донора, отличающийся тем, что дистальные сегменты рассеченных эндокардиальных электродов и генератор антиаритмического устройства оставляют в исходной проекции, а их удаление и замену выполняют одномоментно с реимплантацией новой системы стимуляции не ранее чем через три недели после трансплантации сердца; при этом заменяемые эндокардиальные электроды реимпланитируемого устройства проводят по проводникам, установленным через шахту для стилета внутри дистальных сегментов оставленных эндокардиальных электродов.