Результат интеллектуальной деятельности: СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА
Вид РИД
Изобретение
Настоящее изобретение относится к соединениям 8-метил-1-фенилимидазо[1,5-a]пиразина и их фармацевтически приемлемым солям, к фармацевтическим композициям, содержащим указанные соединения, и к применению указанных производных для получения лекарственных средств для лечения хронических Т-клеточных нарушений, а также острых воспалительных нарушений, опосредуемых Т-клетками.
Нерецепторные тирозинкиназы представляют собой внутриклеточные ферменты, которые в присутствии АТР фосфорилируют белки в положении остатков тирозана. Указанные ферменты являются главными регуляторами сигнальной трансдукции в клетках, которая вызывает активацию, пролиферацию и дифференцировку клеток. Семейство Src нерецепторных тирозинкиназ включает восемь членов: Src, Yes, Fyn, Lck, Lyn, Hck, Blk и Fgr, из которых первые три киназы экспрессированы в разных системах и последние пять киназ обнаружены главным образом в гемопоэтической системе (Benatie et al., Current medical chemistry, 2008, 15, 1154-1165; Bogon et al., Oncogene 2004, 23, 7918-7927; Parsons et al., Oncogene, 2004, 23, 7906-7909). Члены семейства Src характеризуются консервативной организацией доменов, которая включает уникальный миристилированный N-концевой домен, Src-гомологичный 2 (SH2) домен, SH3 домен, домен тирозинкиназы и С-концевой отрицательный регуляторный домен.
Члены семейства Scr, экспрессированные в гемопоэтической системе, играют важную роль в регулировании клеток иммунной системы, и повышенная активность указанных киназ имеет место в целом ряде злокачественных и незлокачественных пролиферативных нарушений. Особенно интересной киназой семейства Src является лимфоцитоспецифическая киназа (Lck) р56, которая экспрессирована главными образом в Т-лимфоцитах и естественных Т-клетках-киллерах. Lck, проксимальная тирозинкиназа, имеет важное значение для инициации сигнальной трансдукции Т-клеточным рецептором (TCR), активирующим Т-лимфоциты. После распознавания антигена в результате взаимодействия МНС-TCR/пептида Lck рекрутируется в комплекс TCR корецептором CD4/8, где указанная киназа фосфорилирует специфические остатки тирозина в активирующих фрагментах на основе иммунотирозина (ITAM), локализованных в ξ-цепи TCR. Указанное фосфорилирование имеет важное значение для рекрутинга киназы ZAP70 семейства Syk в результате взаимодействия с SH2. Последующее фосфорилирование ZAP70 киназой Lck активирует сигнальную трансдукцию в нижней области, вызывая активацию и рекрутинг других членов семейства киназ и ферментов, в результате чего происходит высвобождение Са2+, вызывающее полную активацию Т-клетки (Palacios et al., Oncogene, 2004; 23, 7990-8000; Iwashima et al., 1994, 263, 1136-1139; Weiss A. et al., 1994; 76, 263-274). Ингибирование активности киназы Lck блокирует TCR-опосредуемую активацию ZAP70 и мобилизацию в нижней области высвобождения Са2+, подавляя таким образом антигензависимую активацию Т-лимфоцитов.
Ингибиторы киназы Lck используют для лечения хронических Т-клеточных нарушений, таких как рассеянный склероз и ревматоидный артрит, а также острых воспалительных нарушений, опосредуемых Т-клетками, которые включают отторжение трансплантата, атопический дерматит и аллергическую реакцию замедленного типа (DTH). Существует насущная потребность в низкомолекулярных ингибиторах фермента Lck для лечения хронических Т-клеточных нарушений.
В заявке на патент WO2001019829 наряду с другими способами описан способ ингибирования Lck при помощи производных пиразолопиримидина. В производных пиразолопиримидина, представленных в указанной заявке на патент, которая включена в настоящее описание изобретения в качестве ссылки, допускается использование многих разных заместителей, что следует из определений заместителей G, R2 и R3 в указанных производных пиразолопиримидина, приведенных в публикации WO2001019829. В патенте США № 7459554 описаны ингибиторы тирозинкиназ, в том числе Lck, на основе имидазопиразинов. В указанных соединениях также допускается использование многих разных заместителей, что следует из определений R1 и Q1 и их заместителей, приведенных в столбцах 10-15 патента США № 7459554. Соединения, представленные в заявке на патент WO2001019829 или в патенте США № 7459554, включают необязательно замещенную замещающую 8-аминогруппу (соответственно NHR3 или NH2) (нумерация в соответствии с формулой I). Кроме того, допускается большое разнообразие типов и размеров заместителей.
Кристаллические структуры трех членов семейства Src; Src, Hck и Lck позволили детально исследовать механизм регулирования семейства Src киназ и то, каким образом низкомолекулярные ингибиторы могут инактивировать указанные ферменты [Williams et al., JBC, 284, 284-291 (2009)].
Исследования связывания Lck с лигандами, такими как 4-амино-1-циклогексил-3-фенилпиразоло[3,4-d]пиримидины, показали, что 4-амииногруппа (положение 4 в данном соединении сравнимо с положением 8 в формуле I) обеспечивает контактирование главного донора Н-связи с С=О Glu317 в остове, в то время как атом азота N5 пиримидина контактирует с NH Met319 в остове [Barbani et al., Bioorg. Med. Chem. Lett. 14, 2004, 2613; Abbott et al., Bioorg. Med. Chem. Lett. 17, 1167-1171 (2007)]. Все указанные исследования свидетельствует о наличии такой Н-связи с С=О Glu317 в остове. Аналогичная связь была обнаружена для аналогов АТР и имидазо[1,5-a]пиразинов (Structure 7(6) p651 (1999)) (EMBOj 27(14) 1985-1994 (2008)).
Исследования связывания Lck с лигандами, такими как 4-амино-1-циклогексил-3-фенилпиразоло[3,4-d]пиримидины, далее показывают, что 3-фенильная группа и ее заместители (соответствующие R3 в формуле 1) входят в гидрофобный карман Lck и 1-циклогексильная группа и ее заместители (соответствующие R4 в формуле 1) входят в область, подверженную воздействию растворителя, связывающего кармана Lck [Barbani et al., Bioorg. Med. Chem. Lett. 14, 2004 2613; Abbott et al., Bioorg. Med. Chem. Lett. 17, 1167-1171 (2007)].
Авторы настоящего изобретения обнаружили ряд соединений, которые не способны быть донорами Н-связи и образовывать Н-связь с С=О Glu317 в остове и поэтому являются эффективными ингибиторами Lck.
Настоящее изобретение относится к производным 8-метил-1-фенилимидозо[1,5-a]пиразина.
Настоящее изобретение, в частности, относится к производным 8-метил-1-фенилимидазо[1,5-a]пиразина формулы I или их фармацевтически приемлемым солям.

Формула I
В указанной формуле заместители имеют следующие значения:
R1 означает одну или две группы, независимо выбираемые из водорода, гидрокси, (1-6С)алкокси, (1-6С)алкила, галогена или циано;
R2 означает Н или (1-6С)алкил;
R3 означает группу, способную входить в гидрофобный карман связывающего кармана Lck;
R4 означает группу, входящую в область, подверженную воздействию растворителя, связывающего кармана Lck, которая необязательно может взаимодействовать при помощи Н-связи с боковой цепью Asp326 связывающего кармана Lck.
Соединения по настоящему изобретению характеризуются ингибирующей активностью в отношении Lck и могут быть использованы для лечения Lck-опосредованного заболевания или Lck-опосредованного состояния, в частности, для лечения хронических Т-клеточных нарушений и острых воспалительных нарушений, опосредуемых Т-клетками. Указанные заболевания или состояния включают аллергии, лейкоз, воспалительное заболевание кишечника, ревматоидный артрит, гломерулонефрит, фиброз легких, псориаз, аллергические реакции кожи, атеросклероз, рестеноз, аллергическую астму, рассеянный склероз, диабет 1-го типа, ревматоидный артрит, атопический дерматит, аллергическую реакцию замедленного типа (DTH), острое отторжение трансплантированных органов, а также гомологичную болезнь (GvHD). Ингибиторы Lck могут быть использованы для лечения вышеуказанных показаний.
Термин ”гетероциклил” означает гетероциклический заместитель, состоящий из одного или нескольких атомов С и по меньшей мере одного атома, выбираемого из N, O или S, в кольцевой структуре из 3, 4, 5, 6, 7 атомов. В объем настоящего изобретения не входят комбинации с О и S в одном кольце. Предпочтительными гетероатомами являются N или О. Более предпочтительным гетероатомом является N. Предпочтительное число гетероатомов равно 1 или 2. Предпочтительное число атомов в кольцевой структуре равно 5 или 6. Гетероциклил может быть насыщенным, частично ненасыщенным, ненасыщенным или ароматическим. Гетероциклил предпочтительно является насыщенным. Примеры гетероциклильных групп включают, не ограничиваясь ими, азиридин, азирин, диоксиран, ацетидин, оксетан, тиетан, диоксетан, дитиетан, дитиет, тетрагидропиррол, азолидин, пирролидин, дигидропиррол, пирролин, пирролтетрагидрофуран, дигидрофуран, пиразин, тетрагидротиофен, дигидротиофен, арсол, азолы, тиазолы, изотиазолы, дитиоланы, имидазолидин, пиразол, имидазол, оксазолидин, оксазол, изоксазол, тиазолидин, тиазол, изотиазол, диоксолан, дитиазолы, триазол, тетразол, пиперидин, пиридин, тетрагидропиран, пиран, тиан, тиин, пиперазин, диазины, оксазин, тиазин, дитиан, диоксан, диоксин, триазин, триоксан, тетразин, азепин, тиепин, диазепин и морфолин. Предпочтительными гетероциклильными группами являются имидазол, триазол, пиразин, пирролидин, пиперазин, морфолин, азетидин, пиран и пиперидин. Гетероциклил может быть присоединен при помощи одного из атомов С или одного из гетероатомов. N-присоединенный гетероциклил означает, что гетероциклил содержит по меньшей мере один атом N в кольцевой структуре и присоединен при помощи одного из указанных атомов N.
Термины, использованные в настоящем описании изобретения, имеют следующие значения:
(1-2С)алкил означает алкильную группу, имеющую 1-2 атома углерода, и является метилом или этилом.
(1-3С)алкил означает алкильную группу с разветвленной или неразветвленной цепью, имеющую 1-3 атома углерода, и является метилом, этилом, пропилом или изопропилом.
(1-4С)алкил означает алкильную группу с разветвленной или неразветвленной цепью, имеющую 1-4 атома углерода, и является метилом, этилом, пропилом, изопропилом, бутилом, изобутилом, втор-бутилом и трет-бутилом. (1-3C)алкильные группы являются более предпочтительными.
(1-5С)алкил означает алкильную группу с разветвленной или неразветвленной цепью, имеющую 1-5 атомов углерода, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил и изопентил. (1-4С)алкильные группы являются более предпочтительными.
(1-6С)алкил означает алкильную группу с разветвленной или неразветвленной цепью, имеющую 1-6 атомов углерода, например, метил, этил, пропил, изопропил, бутил, трет-бутил, н-пентил и н-гексил. (1-5С)алкильные группы являются более предпочтительными. (1-4С)алкил является наиболее предпочтительным.
(2-3С)алкил означает алкильную группу с разветвленной или неразветвленной цепью, имеющую 2-3 атома углерода, например, этил, пропил, изопропил.
(2-4С)алкил означает алкильную группу с разветвленной или неразветвленной цепью, имеющую 2-4 атома углерода, например, этил, пропил, изопропил, бутил и трет-бутил.
(2-5С)алкил означает алкильную группу с разветвленной или неразветвленной цепью, имеющую 2-5 атомов углерода, например, этил, пропил, изопропил, бутил, трет-бутил и н-пентил, (2-4С)алкил является более предпочтительным.
(2-6С)алкил означает алкильную группу с разветвленной или неразветвленной цепью, имеющую 2-6 атомов углерода, например, этил, пропил, изопропил, бутил, трет-бутил, н-пентил и н-гексил. (2-5С)алкильные группы являются более предпочтительными. (2-4С)алкил является наиболее предпочтительным.
(1-2С)алкокси означает алкоксильную группу, имеющую 1-2 атома углерода, в которой алкильная часть имеет вышеуказанные значения.
(1-3С)алкокси означает алкоксильную группу, имеющую 1-3 атома углерода, в которой алкильная часть имеет вышеуказанные значения. (1-2С)алкоксильные группы являются более предпочтительными.
(1-4С)алкокси означает алкоксильную группу, имеющую 1-4 атома углерода, в которой алкильная часть имеет вышеуказанные значения. (1-3С)алкоксильные группы являются более предпочтительными. (1-2С)алкоксильные группы являются наиболее предпочтительными.
(1-5С)алкокси означает алкоксильную группу, имеющую 1-5 атомов углерода, в которой алкильная часть имеет вышеуказанные значения. (1-4С)алкоксильные группы являются более предпочтительными. (1-3С)алкоксильные группы являются наиболее предпочтительными.
(1-6С)алкокси означает алкоксильную группу, имеющую 1-6 атомов углерода, в которой алкильная часть имеет вышеуказанные значения. (1-5С)алкоксильные группы являются более предпочтительными. (1-4С)алкоксильные группы являются наиболее предпочтительными.
(2-4С)алкокси означает алкоксильную группу, имеющую 2-4 атома углерода, в которой алкильная часть является этилом, пропилом, изопропилом, бутилом, изобутилом, втор-бутилом и трет-бутилом.
(1-6С)алкокси означает алкоксильную группу, имеющую 1-6 атомов углерода, в которой алкильная часть имеет вышеуказанные значения. (1-4С)алкоксильные группы являются более предпочтительными.
(3-6С)циклоалкил означает циклоалкильную группу, имеющую 3-6 атомов углерода, такую как циклопропил, этилциклопропил, циклопропилметил, циклобутил, метилциклобутил, циклопентил и циклогексил.
(3-7С)циклоалкил означает циклоалкильную группу, имеющую 3-7 атомов углерода, такую как циклопропил, этилциклопропил, циклопропилметил, циклобутил, метилциклобутил, циклопентил, циклогексил и циклогептил. (3-6С)циклоалкильные группы являются более предпочтительными.
(3-6С)циклоалкокси означает циклоалкильную группу, содержащую 3-6 атомов углерода и имеющую вышеуказанные значения, которая присоединена при помощи атома углерода в кольце к экзоциклическому атому кислорода.
(3-7С)циклоалкокси означает циклоалкильную группу, содержащую 3-7 атомов углерода и имеющую вышеуказанные значения, которая присоединена при помощи атома углерода в кольце к экзоциклическому атому кислорода.
(1-6С)алкокси(1-4С)алкил означает алкоксиалкильную группу, в которой алкоксильная группа содержит 1-6 атомов углерода, имеет вышеуказанные значения и присоединена к алкильной группу, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
(1-6С)алкокси(2-6С)алкил означает алкоксиалкильную группу, в которой алкоксильная группа содержит 1-6 атомов углерода, имеет вышеуказанные значения и присоединена к алкильной группе, содержащей 2-6 атомов углерода и имеющей вышеуказанные значения.
(1-6С)алкокси(3-6С)циклоалкил означает алкоксициклоалкильную группу, в которой алкоксильная группа содержит 1-6 атомов углерода, имеет вышеуказанные значения и присоединена к циклоалкильной группе, содержащей 3-6 атомов углерода и имеющей вышеуказанные значения.
(1-4С)алкилкарбонил означает алкилкарбонильную группу, в которой алкильная группа содержит 1-4 атома углерода и имеет вышеуказанные значения.
(1-2С)алкоксикарбонил означает алкоксикарбонильную группу, в которой алкоксильная группа содержит 1-2 атома углерода и имеет вышеуказанные значения.
(1-4С)алкоксикарбонил означает алкоксикарбонильную группу, в которой алкоксильная группа содержит 1-4 атома углерода и имеет вышеуказанные значения. (1-2С)алкоксикарбонильные группы являются более предпочтительными.
(1-6С)алкоксикарбонил означает алкоксикарбонильную группу, в которой алкоксильная группа содержит 1-6 атомов углерода и имеет вышеуказанные значения. (1-4С)алкоксикарбонильные группы являются более предпочтительными. (1-2С)алкоксикарбонильные группы являются наиболее предпочтительными.
(2-4С)алкоксикарбонил означает алкоксикарбонильную группу, в которой алкоксильная группа содержит 2-4 атома углерода и имеет вышеуказанные значения.
(1-4С)алкоксикарбонил означает алкоксикарбонильную группу, в которой алкоксильная группа содержит 1-4 атома углерода и имеет вышеуказанные значения. (1-2С)алкоксикарбонильные группы являются более предпочтительными.
амино(1-4С)алкил означает аминоалкильную группу, в которой аминогруппа присоединена к алкильной группе, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
амино(2-4С)алкокси означает аминоалкоксильную группу, в которой аминогруппа присоединена к алкоксильной группе, содержащей 2-4 атома углерода и имеющей вышеуказанные значения.
амино(2-4С)алкоксикарбонил означает аминоалкоксикарбонильную группу, в которой аминогруппа присоединена к (2-4С)алкоксикарбонильной группе, имеющей вышеуказанные значения.
аминокарбонил(1-4С)алкил означает аминокарбонилалкильную группу, в которой аминокарбонильная группа присоединена к алкильной группе, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
аминокарбонил(1-6С)алкокси означает аминокарбонилалкоксильную группу, в которой аминокарбонил присоединен к алкоксильной группе, содержащей 1-6 атомов углерода и имеющей вышеуказанные значения.
(1-4С)алкилкарбонилокси означает алкилкарбонилоксигруппу, в которой алкильная группа содержит 1-4 атома углерода и имеет вышеуказанные значения.
(1-3С)алкокси(2-4С)алкокси означает алкоксиалкоксильную группу, в которой (1-3С)алкоксильная часть содержит 1-3 атома углерода, имеет вышеуказанные значения и присоединена к алкоксильной группе, содержащей 2-4 атома углерода и имеющей вышеуказанные значения.
[(1-4C)алкил]амино означает алкиламиногруппу, в которой алкильная группа содержит 1-4 атома углерода и имеет вышеуказанные значения.
[(1-6C)алкил]амино означает алкиламиногруппу, в которой алкильная группа содержит 1-6 атомов углерода и имеет вышеуказанные значения.
(1-4С)алкиламинокарбонилокси означает алкиламинокарбонилоксигруппу, в которой алкильная группа содержит 1-4 атома углерода, имеет вышеуказанные значения и присоединена к аминокарбонилоксигруппе.
[(1-6C)алкокси(2-6С)алкил]аминокарбонил(1-4С)алкил означает [алкоксиалкил]аминокарбонилалкильную группу, в которой аминогруппа замещена (1-6С)алкокси(2-6С)алкильной группой, имеющей вышеуказанные значения. Аминокарбонильная группа присоедина к алкильной группе, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
(1-6С)алкоксикарбониламино означает алкоксикарбониламиногруппу, в которой алкоксильная группа содержит 1-6 атомов углерода и имеет вышеуказанные значения.
(1-6С)алкиламинокарбониламино означает алкиламинокарбониламиногруппу, в которой алкильная группа содержит 1-6 атомов углерода и имеет вышеуказанные значения.
(1-6С)алкилкарбониламино означает алкилкарбониламиногруппу, в которой алкильная группа содержит 1-6 атомов углерода и имеет вышеуказанные значения.
(3-6С)циклоалкокси(1-4С)алкил означает циклоалкоксиалкильную группу, в которой циклоалкоксильная группа содержит 3-6 атомов углерода, имеет вышеуказанные значения и присоединена к алкильной группе, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
(3-6С)циклоалкил(1-3С)алкил означает циклоалкилалкильную группу, в которой циклоалкильная группа содержит 3-6 атомов углерода, имеет вышеуказанные значения и присоединена к алкильной группе, содержащей 1-3 атома углерода и имеющей вышеуказанные значения.
(3-6С)циклоалкиламинокарбонилокси означает циклоалкиламинокарбонилоксигруппу, в которой циклоалкильная группа содержит 3-6 атомов углерода, имеет вышеуказанные значения и присоединена к аминокарбонилоксигруппе.
циклил-N означает N-присоединенный гетероциклил, имеющий вышеуказанные значения.
(циклил-N)(1-4С)алкил означает гетероциклилалкильную группу, в которой гетероциклильная группа содержит по меньшей мере один атом N в кольцевой структуре и присоединена при помощи одного из указанных атомов N к алкильной группе, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
(циклил-N)(2-4С)алкокси означает алкоксильную группу, которая содержит 2-4 атома углерода, имеет вышеуказанные значения и замещена циклил-N группой, имеющей вышеуказанные значения.
(циклил-N)карбонил означает циклил-N группу, которая присоединена к карбонильной группе и имеет вышеуказанные значения.
(циклил-N)карбонил(1-6С)алкокси означает вышеуказанную алкоксильную группу, содержащую 1-6 атомов углерода и замещенную вышеуказанной (циклил-N)карбонильной группой.
(циклил-N)карбониламино означает карбониламиногруппу, в которой карбонил замещен вышеуказанной циклил-N группой.
(1-4С)алкиламино означает аминогруппу, монозамещенную алкильной группой, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
(ди)[(1-4С)алкил]амино означает аминогруппу, дизамещенную одной или несколькими алкильными группами, каждая из которых независимо содержит 1-4 атома углерода и имеет вышеуказанные значения.
(1-6С)алкиламино означает аминогруппу, монозамещенную алкильной группой, содержащей 1-6 атомов углерода и имеющей вышеуказанные значения.
(ди)[(1-6С)алкил]амино означает аминогруппу, дизамещенную одной или несколькими алкильными группами, каждая из которых независимо содержит 1-6 атомов углерода и имеет вышеуказанные значения.
(ди)[(1-6С)алкил]амино(1-4С)алкил означает вышеуказанную (ди)[(1-6С)алкил]аминогруппу, присоединенную к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
(ди)[(1-6С)алкил]амино(2-4С)алкокси означает (ди)алкиламиноалкоксильную группу, в которой (ди)алкиламиногруппа имеет вышеуказанные значения и присоединена к алкоксильной группе, содержащей 2-4 атома углерода и имеющей вышеуказанные значения.
(ди)[(1-6C)алкил]аминокарбонил означает (ди)алкиламинокарбонильную группу, в которой (ди)алкиламиногруппа имеет вышеуказанные значения.
(ди)[(1-6С)алкил]аминокарбонил(1-4С)алкил означает (ди)алкиламинокарбонильную группу, в которой (ди)алкиламиногруппа имеет вышеуказанные значения и присоединена при помощи аминогруппы к карбонильной группе, присоединенной к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
(ди)[(1-6С)алкил]аминокарбонил(1-6С)алкокси означает (ди)алкиламинокаронилалкоксильную группу, в которой (ди)алкиламиногруппа имеет вышеуказанные значения и присоединена при помощи аминогруппы к карбонильной группе, присоединенной к вышеуказанной алкоксильной группе, содержащей 1-6 атомов углерода.
[(1-6С)алкокси(2-6С)алкил]амино означает алкоксиалкиламиногруппу, в которой аминогруппа замещена алкоксиалкильной группой, алкоксильная группа содержит 1-6 атомов углерода и имеет вышеуказанные значения и алкильная группа содержит 2-6 атомов углерода и имеет вышеуказанные значения.
[(1-6С)алкокси(2-6С)алкил]аминокарбонил означает алкоксиалкиламинокарбонильную группу, в которой алкоксиалкиламиногруппа имеет вышеуказанные значения.
[(1-6С)алкокси(2-6С)алкил]амино(1-4С)алкил означает алкоксиалкиламиноалкильную группу, в которой алкоксиалкиламиногруппа имеет вышеуказанные значения и присоединена при помощи аминогруппы к алкильной группе, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
[(1-6С)алкокси(2-6С)алкил]амино(2-4С)алкокси означает алкоксиалкиламиноалкоксильную группу, в которой алкоксиалкиламиногруппа имеет вышеуказанные значения и присоединена при помощи аминогруппы к алкоксильной группе, содержащей 2-4 атома углерода и имеющей вышеуказанные значения.
[(1-6С)алкоксикарбонмил(1-6С)алкил]амино означает аминогруппу, замещенную (1-6С)алкоксикарбонил(1-6С)алкильной группой, в которой (1-6С)алкоксикарбонильная группа имеет вышеуказанные значения и присоединена к вышеуказанной (1-6С)алкильной группе.
[(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино означает аминогруппу, замещенную вышеуказанной алкильной группой, имеющей 1-6 атомов углерода, и алкоксиалкильной группой, в которой алкоксильная группа содержит 1-6 атомов углерода, имеет вышеуказанные значения и присоединена к алкильной группе, содержащей 2-6 атомов углерода и имеющей вышеуказанные значения.
[(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]аминокарбонил означает вышеуказанную [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]аминогруппу, присоединенную при помощи аминогруппы к карбонильной группе.
[(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино(1-4С)алкил означает вышеуказанную [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]аминогруппу, присоединенную при помощи аминогруппы к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино(2-4С)алкокси означает вышеуказанную [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]аминогруппу, присоединенную при помощи аминогруппы к вышеуказанной алкоксильной группе, содержащей 2-4 атома углерода.
[(1-6С)алкил][(1-6С)алкилкарбонил]амино(1-4С)алкил означает аминогруппу, замещенную вышеуказанной алкильной группой, имеющей 1-6 атомов углерода, и алкилкарбонильной группой, в которой алкильная группа содержит 1-6 атомов углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[(1-4С)алкил][(1-4С)алкилкарбонил]амино(1-4С)алкил означает аминогруппу, замещенную вышеуказанной алкильной группой, содержащей 1-4 атома углерода, и алкилкарбонильной группой, в которой алкильная группа содержит 1-4 атома углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[(1-4С)алкилкарбонил]амино(1-4С)алкил означает аминогруппу, замещенную алкилкарбонильной группой, в которой алкильная группа содержит 1-4 атома углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[(1-4С)алкоксикарбонил]амино(1-4С)алкил означает аминогруппу, замещенную алкоксикарбонильной группой, в которой алкильная группа содержит 1-4 атома углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[(1-4С)алкил][(1-4С)алкоксикарбонил]амино(1-4С)алкил означает аминогруппу, замещенную вышеуказанной алкильной группой, содержащей 1-4 атома углерода, и алкоксикарбонильной группой, в которой алкильная группа содержит 1-4 атома углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[(1-6С)алкил][(1-6С)алкилкарбонил]амино(1-6С)алкокси означает аминогруппу, замещенную вышеуказанной алкильной группой, имеющей 1-6 атомов углерода, и алкилкарбонильной группой, в которой алкильная группа содержит 1-6 атомов углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к вышеуказанной алкоксильной группе, содержащей 1-6 атомов углерода.
[(1-6С)алкил][(3-6C)циклоалкилкарбонил]амино(1-6С)алкокси означает аминогруппу, замещенную вышеуказанной алкильной группой, имеющей 1-6 атомов углерода, и циклоалкилкарбонильной группой, которая содержит 3-6 атомов углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к вышеуказанной алкоксильной группе, содержащей 1-6 атомов углерода.
[(1-6С)алкил][гидрокси(1-6С)алкил]аминокарбонил(1-4С)алкил означает аминогруппу, замещенную вышеуказанной алкильной группой, имеющей 1-6 атомов углерода, и гидроксиалкильной группой, в которой алкильная группа содержит 1-6 атомов углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к карбонильной группе, присоединенной к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[(1-6С)алкил][гидрокси(2-6С)алкил]амино означает аминогруппу, замещенную вышеуказанной алкильной группой, имеющей 1-6 атомов углерода, и гидроксиалкильной группой, в которой алкильная группа содержит 2-6 атомов углерода и имеет вышеуказанные значения.
[(1-6С)алкил][гидрокси(2-6С)алкил]амино(1-4С)алкил означает вышеуказанную [(1-6С)алкил][гидрокси(2-6С)алкил]аминогруппу, присоединенную при помощи аминогруппы к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[(1-6C)алкил][гидрокси)2-6С)алкил]аминокарбонил означает вышеуказанную [(1-6С)алкил][гидрокси(2-6С)алкил]аминогруппу, присоединенную при помощи аминогруппы к карбонильной группе.
[(1-6С)алкил][гидрокси(2-6С)алкил]амино(2-4С)алкокси означает вышеуказанную [(1-6С)алкил][гидрокси(2-6С)алкил]аминогруппу, присоединенную при помощи аминогруппы к алкоксильной группе, в которой вышеуказанная алкильная часть имеет 2-4 атома углерода.
[(1-6С)алкил]амино(1-4С)алкил означает алкиламиноалкильную группу, в которой алкильная группа алкиламиногруппы содержит 1-6 атомов углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к алкильной группе, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
[(1-6С)алкил]амино(2-4С)алкокси означает алкиламиноалкоксильную группу, в которой алкильная группа содержит 1-6 атомов углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к алкоксильной группе, содержащей 2-4 атома углерода и имеющей вышеуказанные значения.
[(1-6С)алкил]амино(2-4С)алкоксикарбонил означает вышеуказанную [(1-6С)алкил]амино(2-4С)алкоксильную группу, присоединенную при помощи атома кислорода алкоксильной группы к карбонильной группе.
[(1-6С)алкил]аминокарбонил означает алкиламинокарбонильную группу, в которой алкильная группа содержит 1-6 атомов углерода, имеет вышеуказанные значения и присоединена при помощи аминогруппы к карбонильной группе.
[(1-6С)алкил]аминокарбонил(1-4С)алкил означает вышеуказанную [(1-6С)алкил]аминокарбонильную группу, присоединенную при помощи карбонильной группы к алкильной группе, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
[(1-6С)алкил]аминокарбонил(1-6С)алкокси означает вышеуказанную [(1-6С)алкил]аминокарбонильную группу, присоединенную при помощи карбонильной группы к вышеуказанной алкоксильной группе, содержащей 1-6 атомов углерода.
[(1-6С)алкилкарбонил][(1-6С)алкокси(2-6С)алкил]амино означает аминогруппу, замещенную алкилкарбонильной группой, в которой вышеуказанная алкильная группа содержит 1-6 атомов углерода, и алкоксиалкильной группой, в которой вышеуказанная алкоксильная группа содержит 1-6 атомов углерода и алкильная группа содержит 2-6 атомов углерода и имеет вышеуказанные значения.
[(1-6С)алкилкарбонил]амино(1-4С)алкил означает аминогруппу, замещенную алкилкарбонильной группой, в которой вышеуказанная алкильная группа содержит 1-6 атомов углерода и присоединена при помощи аминогруппы к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[(1-6С)алкилкарбонил]амино(1-6С)алкокси означает аминогруппу, замещенную алкилкарбонильной группой, в которой вышеуказанная алкильная группа содержит 1-6 атомов углерода и присоединена при помощи аминогруппы к вышеуказанной алкоксильной группе, содержащей 1-6 атомов углерода.
[(3-6С)циклоалкилкарбонил]амино(1-6С)алкокси означает аминогруппу, замещенную циклоалкилкарбонильной группой, в которой вышеуказанная циклоалкильная группа, имеющая 3-6 атомов углерода, присоединена при помощи аминогруппы к вышеуказанной алкоксильной группе, содержащей 1-6 атомов углерода.
[гидрокси(1-6С)алкил]аминокарбонил(1-4С)алкил означает аминогруппу, замещенную гидроксиалкильной группой, в которой вышеуказанная алкильная группа, имеющая 1-6 атомов углерода, присоединена при помощи аминогруппы к карбонильной группе, присоединенной к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[гидрокси(1-6С)алкил]аминокарбонил(1-6С)алкокси означает аминогруппу, замещенную гидроксиалкильной группой, в которой вышеуказанная алкильная группа содержит 1-6 атомов углерода и присоединена при помощи аминогруппы к карбонильной группе, присоединенной к вышеуказанной алкоксильной группе, содержащей 1-6 атомов углерода.
[гидрокси(2-6С)алкил]амино означает аминогруппу, замещенную гидроксиалкильной группой, в которой вышеуказанная алкильная группа содержит 2-6 атомов углерода.
[гидрокси(2-6С)алкил]амино(1-4С)алкил означает гидроксиалкиламиноалкильную группу, в которой вышеуказанная [гидрокси(2-6С)алкил]аминогруппа присоединена при помощи аминогруппы к вышеуказанной алкильной группе, содержащей 1-4 атома углерода.
[гидрокси(2-6С)алкил]аминокарбонил означает гидроксиалкиламинокарбонильную группу, в которой вышеуказанная [гидрокси(2-6С)алкил]аминогруппа присоединена при помощи аминогруппы к карбонильной группе.
[гидрокси(2-6С)алкил]амино(2-4С)алкокси означает гидроксиалкиламиноалкоксильную группу, в которой вышеуказанная {гидрокси(2-6С)алкил}аминогруппа присоединена при помощи аминогруппы к вышеуказанной алкоксильной группе, содержащей 2-4 атома углерода.
5- или 6-членный гетероциклил означает вышеуказанный гетероциклил с кольцевой структурой из 5 или 6 атомов.
(ди)[(1-6С)алкил]амино(1-4С)алкил означает диалкиламиногруппу, в которой алкильные группы содержат 1-6 атомов углерода, имеют вышеуказанные значения и присоединены при помощи аминогруппы к алкильной группе, содержащей 1-4 атома углерода и имеющей вышеуказанные значения.
Галоген означает фтор, хлор, бром или иод. Фтор является более предпочтительным.
Термин ”гетероарил” в использованном здесь значении означает гетероциклические и полигетероциклические ароматические части, содержащие 5-14 атомов в кольце, из которых 1-5 атомов являются гетероатомами. Гетероарильные группы могут быть необязательно замещены. Примеры типичных гетероарильных колец включают 5-членные моноциклические кольцевые группы, такие как тиенил, пирролил, имидазолил, пиразолил, фурил, изотиазолил, фуразанил, изоксазолил, тиазолил и тому подобные; 6-членные моноциклические группы, такие как пиридил, пиразинил, пиримидинил, пиридазинил, триазинил и тому подобные; и полициклические гетероциклические кольцевые группы, такие как бензо[b]тиенил, нафто[2,3-b]тиенил, тиантренил, изобензофуранил, хроменил, ксантенил, феноксатиенил, индолизинил, изоиндолил, индолил, индазолил, пуринил, изохинолил, хинолил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, бензотиазол, бензимидазол, тетрагидрохинолин, циннолинил, птеридинил, карбазолил, бета-карболинил, фенантридинил, акридинил, перимидинил, фенантролинил, феназинил, изотиазолил, фенотиазинил, феноксазинил и тому подобные. Предпочтительные гетероарильные кольца включают 2-фуранил, 3-фуранил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-оксадиазолил, 5-оксадиазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 1-пирролил, 2-пирролил, 3-пирролил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-пиримидил, 3-пиридазинил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 5-тетразолил, 2-триазолил, 5-триазолил, 2-тиенил, 3-тиенил, карбазолил, бензимидазолил, бензотиенил, бензофуранил, индолил, хинолинил, бензотриазолил, бензотиазолил, бензооксазолил, бензимидазолил, изохинолинил, индолил, изоиндолил, акридинил или бензоизоксазолил.
Гетероарильные группы далее включают группу, в которой гетероароматическое кольцо конденсировано с одним или несколькими гетероароматическими или гетеронеароматическими кольцами, где радикал или точка присоединения находится на гетероароматическом кольце. Примеры включают тетрагидрохинолин, тетрагидроизохинолин, индол и пиридо[3,4-d]пиримидинил, имидазо[1,2-а]пиримидил, имидазо[1,2-а]пиразинил, имидазо[1,2-a]пиридинил, имидазо[1,2-c]пиримидил, пиразоло[1,5-a][1,3,5]триазинил, пиразоло[1,5-c]пиримидил, имидазо[1,2-b]пиридазинил, имидазо[1,5-a]пиримидил, пиразоло[1,5-b][1,2,4]триазин, хинолил, изохинолил, хиноксалил, имидазотриазинил, тиено[2,3-b]пиррол, пирроло[2,3-d]пиримидил, триазолопиримидил, пиридопиранил. Предпочтительными являются бициклические гетероароматические кольцевые системы с 6-9 атомами углерода и 1-3 гетероатомами, независимо выбираемыми из N, S или О, в которых гетероароматическое кольцо конденсировано с одним или несколькими ароматическими или неароматическими кольцами, при этом радикал или точка присоединения находится на гетероароматическом кольце. Более предпочтительными являются бициклические гетероароматические кольцевые системы с 6-8 атомами углерода и 1 или 2 гетероатомами, независимо выбираемыми из N или S. Наиболее предпочтительными кольцевыми системами являются индол и тиено[2,3-b]пиррол. Термин ”гетероарил” также означает необязательно замещенные кольца. Термин ”гетероарил” может быть использован взаимозаменяемо с термином ”гетероарильное кольцо” или с термином ”гетероароматический”.
Гидрокси(1-4С)алкил означает гидроксиалкильную группу, в которой вышеуказанная алкильная группа имеет 1-4 атома углерода.
Гидрокси(1-6С)алкокси означает гидроксиалкоксильную группу, в которой вышеуказанная алкоксильная группа имеет 1-6 атомов углерода.
R621-(2-4C)алкокси означает вышеуказанную алкоксильную группу, содержащую 2-4 атома углерода и замещенную группой R621.
R732карбонил означает группу R732, присоединенную при помощи карбонильной группы, в которой R732 имеет указанные значения.
R733карбонил означает группу R733, присоединенную при помощи карбонильной группы, в которой R733 имеет указанные значения.
R735карбонил означает группу R735, присоединенную при помощи карбонильной группы, в которой R735 имеет указанные значения.
В вышеуказанных определениях многофункциональных групп точка присоединения находится в последней группе.
Когда в определении заместителя указано, что ”все алкильные группы” указанного заместителя необязательно замещены, данное определение также включает алкильную часть алкоксильной группы.
Термин ”замещенный” означает, что один или несколько атомов водорода, присоединенных к обозначенному атому, заменены указанной группой, при условии, что в существующих условиях не превышается нормальная валентность обозначенного атома, и в результате замещения образуется устойчивое соединение. Комбинации заместителей и/или переменных допустимы только тогда, когда такие комбинации позволяют получить устойчивые соединения. “Устойчивое соединение” или “устойчивая структура” определяются как соединение или структура, которые обладают достаточной устойчивостью, позволяющей выделить их из реакционной смеси с необходимой степенью чистоты и ввести в эффективное терапевтическое средство.
Термин ”необязательно замещенный” означает необязательное замещение указанными группами, радикалами или частями.
Термин ”фармацевтически приемлемая соль” хорошо известен в данной области. Фармацевтически приемлемые соли могут быть получены на последней стадии выделения и очистки соединений по настоящему изобретению или отдельно в результате осуществления взаимодействия свободного основания с приемлемой минеральной кислотой, такой как хлористоводородная кислота, фосфорная кислота или серная кислота, или с органической кислотой, такой как, например, аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота, метансульфоновая кислота и тому подобные. Функциональная группа кислоты может быть подвергнута взаимодействию с органическим или минеральным основанием, таким как гидроксид натрия, гидроксид калия или гидроксид лития.
Термины ”Lck-опосредованное заболевание” или “Lck-опосредованное состояние” в использованном здесь значении означают любое заболевание или другое вредное состояние, вызываемое Lck. Термины ”Lck-опосредованное заболевание” или “Lck-опосредованное состояние” также означают заболевания или состояния, поддающиеся лечению ингибитором Lck. Lck-опосредованные заболевания или состояния включают, не ограничиваясь ими, хронические Т-клеточные нарушения и острые воспалительные нарушения, опосредуемые Т-клетками. Указанные заболевания или состояния включают аллергии, лейкоз, воспалительное заболевание кишечника, ревматоидный артрит, гломерулонефрит, фиброз легких, псориаз, аллергические реакции кожи, атеросклероз, рестеноз, аллергическую астму, рассеянный склероз, диабет 1-го типа, ревматоидный артрит, атопический дерматит, аллергическую реакцию замедленного типа (DTH), острое отторжение трансплантированных органов, а также гомологичную болезнь (GvHD). Ингибиторы Lck могут быть использованы для лечения вышеуказанных показаний.
Одним объектом настоящего изобретения является соединение формулы 1, в котором:
R3 означает (R31)(R32)CH-O;
R3 означает (3-7С)циклоалкокси, необязательно замещенный одним или несколькими атомами фтора или гидроксилами; или
R3 означает гетероарил, необязательно замещенный одной или несколькими группами, выбираемыми из R34, R35, R36, галогена, гидроксила или циано;
R31 означает Н или (1-5С)алкил, необязательно замещенный одним или несколькими атомами фтора, гидроксилами или (1-6С)алкокси;
R32 означает (1-5С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R34 означает (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R35 означает (1-6С)алкокси, необязательно замещенный одним или несколькими атомами фтора;
R36 означает водород или (1-6С)алкил, необязательно замещенный одним или несколькими гидроксилами или галогенами, при этом фтор является более предпочтительным заместителем;
R4 означает
 или
или
 или
или
R4 означает (1-4С)алкил, независимо необязательно замещенный одним или несколькими заместителями, выбираемыми из R8, фтора, гидроксила;
где
m равно 1, 2 или 3;
n равно 1, 2 или 3;
r равно 1 или 2;
Y означает CR5 или N;
Х означает О, CHR6, C(R66)(R67), NR7, C=O;
Z означает О, или
Z образует с R9 5- или 6-членный гетероциклил, необязательно замещенный R91;
R5 означает Н или (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R6 означает R61, R62, R63, R65, H, гидрокси, фтор;
R7 означает R71, R72, R73, R74, H;
R8 означает гетероарил, необязательно замещенный одной или несколькими группами, выбираемыми из (1-4С)алкила, гидрокси, (1-6С)алкокси, амино, (ди)[(1-4С)алкил]амино, [(1-4С)алкил]амино, галогена;
R9 означает Н или (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R61 означает (1-6С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, амино(1-4С)алкил, [(1-6С)алкил]амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкоксикарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкоксикарбонил]амино(1-4С)алкил; все алкильные группы в R61 необязательно замещены одним или несколькими атомами фтора;
R62 означает (1-6С)алкокси, гидрокси(1-6С)алкокси, (1-3С)алкокси(2-4С)алкокси, R621-(2-4С)алкокси, (1-4С)алкилкарбонилокси, (1-4С)алкиламинокарбонилокси, (3-6С)циклоалкиламинокарбонилокси; все алкильные группы в R62 необязательно замещены одним или несколькими атомами фтора;
R63 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, [гидрокси(2-6С)алкил]амино, [(1-6С)алкил][гидрокси(2-6С)алкил]амино, (1-6С)алкоксикарбониламино, (1-6С)алкиламинокарбониламино, [(1-6С)алкокси(2-6С)алкил]амино, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино, (1-6С)алкилкарбониламино, [(1-6С)алкилкарбонил][(1-6C)алкокси(2-6С)алкил]амино; все алкильные группы в R63 необязательно замещены одним или несколькими атомами фтора;
R65 означает N-присоединенный гетероциклил, необязательно замещенный одной или несколькими оксогруппами, одним или несколькими атомами фтора или одной или несколькими группами R651;
R66 означает (1-6С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, амино(1-4С)алкил, [(1-6С)алкил]амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкоксикарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкоксикарбонил]амино(1-4С)алкил; все алкильные группы в R66 необязательно замещены одним или несколькими атомами фтора;
R67 означает гидрокси, (1-4С)алкокси или фтор;
R71 означает (1-6С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил; все алкильные группы в R71 необязательно замещены одним или несколькими атомами фтора;
R72 означает (1-4С)алкил, замещенный одной группой, выбираемой из R721, R722, R724 и R725;
R73 означает R732карбонил, R733карбонил или R735карбонил;
R74 означает гетероциклил, необязательно замещенный одной или несколькими группами, независимо выбираемыми из фтора или R741;
R91 означает (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R621 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, где любые алкильные группы необязательно замещены одним или несколькими атомами фтора; или
R621 означает N-присоединенный гетероциклил, необязательно замещенный одним или несколькими атомами фтора;
R651 означает (1-4С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, (1-4С)алкилкарбонил; все алкильные группы в R651 необязательно замещены одной или несколькими группами, независимо выбираемыми из фтора, гидроксила;
R721 означает (1-6С)алкокси, (3-6С)циклоалкокси, (1-6С)алкокси(3-6С)циклоалкил, (1-3С)алкокси(2-4С)алкокси, амино(2-4С)алкокси, [(1-6С)алкил]амино(2-4С)алкокси, (ди)[(1-6С)алкил]амино(2-4С)алкокси, [гидрокси(2-6С)алкил]амино(2-4С)алкокси, [(1-6С)алкил]{гидрокси(2-6С)алкил}амино(2-4С)алкокси, [(1-6С)алкокси(2-6С)алкил]амино-(2-4С)алкокси, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино(2-4С)алкокси, (циклил-N)-(2-4С)алкокси, [(1-6С)алкилкарбонил]амино(1-6С)алкокси, [(1-6С)алкил][(1-6С)алкилкарбонил]амино(1-6С)алкокси, [(3-6С)циклоалкилкарбонил]амино(1-6С)алкокси, [(1-6С)алкил][(3-6С)циклоалкилкарбонил]амино(1-6С)алкокси, аминокарбонил(1-6С)алкокси, [(1-6С)алкил]аминокарбонил(1-6С)алкокси, (ди)[(1-6С)алкил]аминокарбонил(1-6С)алкокси, [гидрокси(1-6С)алкил]аминокарбонил(1-6С)алкокси, (циклил-N)карбонил(1-6С)алкокси; все алкильные группы в R721 необязательно замещены одной или несколькими группами, независимо выбираемыми из фтора или гидроксила;
R722 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, [гидрокси(2-6С)алкил]амино, [(1-6С)алкил][гидрокси(2-6С)алкил]амино, [(1-6С)алкокси(2-6С)алкил]амино, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино, циклил-N; все алкильные группы в R722 необязательно замещены одним или несколькими атомами фтора;
R724 означает (1-6С)алкоксикарбониламино, [(1-6С)алкоксикарбонил-(1-6С)алкил]амино, (1-6С)алкиламинокарбониламино, (циклил-N)карбониламино;
R725 означает аминокарбонил, [(1-6С)алкил]аминокарбонил, (ди)[(1-6С)алкил]аминокарбонил, [гидрокси(2-6С)алкил]аминокарбонил, [(1-6С)алкил][гидрокси(2-6С)алкил]аминокарбонил, [(1-6С)алкокси(2-6С)алкил]аминокарбонил, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]аминокарбонил, (циклил-N)карбонил, амино(2-4С)алкоксикарбонил, [(1-6С)алкил]амино(2-4С)алкоксикарбонил; все алкильные группы в R725 необязательно замещены одним или несколькими атомами фтора;
R732 означает (1-4С)алкил, амино(1-4С)алкил, [(1-6С)алкил]амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [гидрокси(2-6С)алкил]амино(1-4С)алкил, [(1-6С)алкил][гидрокси(2-6С)алкил]амино(1-4С)алкил, [(1-6С)алкокси(2-6С)алкил]амино(1-4С)алкил, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино(1-4С)алкил, (циклил-N)(1-4С)алкил, [(1-6С)алкилкарбонил]амино(1-4С)алкил, [(1-6С)алкил][(1-6C)алкилкарбонил]амино(1-4С)алкил, гидрокси(1-4С)алкил, (1-6С)алкокси(1-4С)алкил, (3-6С)циклоалкокси(1-4С)алкил, аминокарбонил(1-4С)алкил, [(1-6С)алкил]аминокарбонил(1-4С)алкил, (ди)[(1-6С)алкил]аминокарбонил(1-4С)алкил, [гидрокси(1-6С)алкил]аминокарбонил(1-4С)алкил, [(1-6С)алкил][гидрокси(1-6С)алкил]аминокарбонил(1-4С)алкил, [(1-6С)алкокси(2-6С)алкил]аминокарбонил(1-4С)алкил; все алкильные группы в R732 необязательно замещены одним или несколькими атомами фтора;
R733 означает (1-6С)алкокси;
R735 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, циклил-N; все алкильные группы в R735 необязательно замещены одним или несколькими атомами фтора;
R741 означает (1-4С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, (1-6С)алкокси, (1-4С)алкилкарбонил; все алкильные группы в R741 необязательно замещены одной или несколькими группами, независимо выбираемыми из фтора или гидроксила.
Другим объектом настоящего изобретения является соединение формулы I, в котором R1 означает одну или две группы, независимо выбираемые из водорода, гидроксила, (1-6С)алкокси или галогена.
Другим объектом настоящего изобретения является соединение формулы I, в котором R1 означает одну или две группы, независимо выбираемые из водорода, гидроксила, (1-3С)алкокси или галогена. Настоящее изобретение предпочтительно относится к соединению формулы I, в котором R1 означает одну или две группы, независимо выбираемые из водорода, гидроксила, метокси или фтора.
Другим объектом настоящего изобретения является соединение формулы I, в которой R2 означает водород или (1-3С)алкил, причем настоящее изобретение предпочтительно относится к соединению формулы I, в котором R2 означает водород.
Другим объектом настоящего изобретения является соединение формулы I, в котором R3 означает (R31)(R32)CH-O; R31 означает Н или (1-5С)алкил, необязательно замещенный одним или несколькими гидроксилами; R32 означает (1-5С)алкил, необязательно замещенный одним или несколькими атомами фтора. R31 и R32 предпочтительно независимо означают (1-3С)алкил, и R31 необязательно замещен гидроксилом.
Другим объектом настоящего изобретения является соединение формулы I, в котором R3 означает (3-7С)циклоалкокси, необязательно замещенный одним или несколькими заместителями, выбираемыми из группы, состоящей из фтора и гидроксила.
Другим объектом настоящего изобретения является соединение формулы I, в котором R3 означает гетероарил, необязательно замещенный одной или несколькими группами, выбираемыми из R34, R35, R36, галогена или гидроксила. R3 предпочтительно означает индол, индазол, азаиндол, тиенопирол или пиролопиридин. R34 означает (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора, и R35 означает (1-6С)алкокси, необязательно замещенный одним или несколькими атомами фтора. R34 предпочтительно означает (1-3С)алкил, наиболее предпочтительно R34 означает метил. R35 предпочтительно означает (1-3С)алкокси, наиболее предпочтительно R35 означает метокси. R36 означает водород или (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора. R36 предпочтительно означает (1-3С)алкил, более предпочтительно R36 означает метил. Предпочтительными замещающими галогенами R3 являются фтор и хлор. Фтор является более предпочтительным заместителем.
Другим объектом настоящего изобретения является соединение формулы I, где
R3 означает
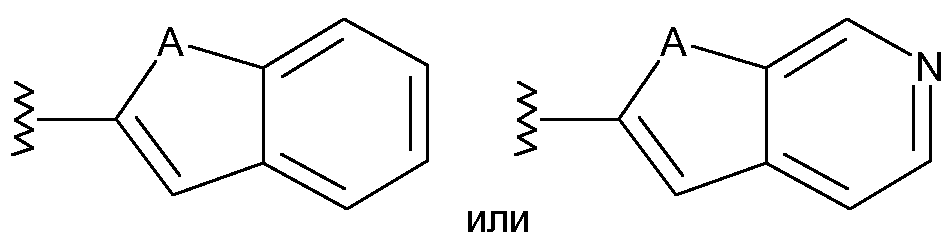 ,
,
где А означает О или NR36, предпочтительно А означает NR36, и каждый атом С необязательно замещен одной или несколькими группами, выбираемыми из R34, R35 и фтора, где
R34 означает (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R35 означает(1-6С)алкокси, необязательно замещенный одним или несколькими атомами фтора;
R36 означает водород или (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора.
Другим объектом настоящего изобретения является соединение формулы I, где
R3 означает
 ,
,
где
А означает О или NR36, предпочтительно А означает NR36, и каждый атом С необязательно замещен одной или несколькими группами, выбираемыми из R34, R35 и фтора, где
R34 означает (1-6С)алкил;
R35 означает (1-6С)алкокси;
R36 означает водород или (1-6С)алкил, R36 предпочтительно означает (1-3С)алкил, более предпочтительно R36 означает метил.
Другим объектом настоящего изобретения является соединение формулы I, где
R3 означает
 ,
,
где
А означает О или NR36, предпочтительно А означает NR36, и каждый атом С необязательно замещен одной или несколькими группами, выбираемыми из R34, R35 и фтора; R34 и R35 являются предпочтительными заместителями, в которых
R34 означает (1-3С)алкил, предпочтительно R34 означает метил;
R35 означает (1-3С)алкокси, предпочтительно R35 означает метокси;
R36 означает (1-6С)алкил, предпочтительно R36 означает (1-3С)алкил, более предпочтительно R36 означает метил.
Другим объектом настоящего изобретения является соединение формулы I, где
R3 означает
 ,
,
где
А означает О или NR36, предпочтительно А означает NR36, и каждый атом С необязательно замещен одной или несколькими группами, выбираемыми из R34, R35 и фтора, где
R34 означает (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора, предпочтительно R34 означает (1-3С)алкил, необязательно замещенный одним или несколькими атомами фтора, более предпочтительно R34 означает (1-3С)алкил;
R35 означает (1-6С)алкокси, необязательно замещенный одним или несколькими атомами фтора. R35 предпочтительно означает (1-3С)алкокси, необязательно замещенный одним или несколькими атомами фтора; более предпочтительно R35 означает (1-3С)алкокси;
R36 означает водород или (1-6С)алкил, необязательно замещенный гидроксилом или одним или несколькими атомами фтора, предпочтительно R36 означает водород или (1-3С)алкил, необязательно замещенный гидроксилом или одним или несколькими атомами фтора, более предпочтительно R36 означает водород или (1-3С)алкил, наиболее предпочтительно R36 означает метил.
Другим объектом настоящего изобретения является соединение формулы I, где
R3 означает
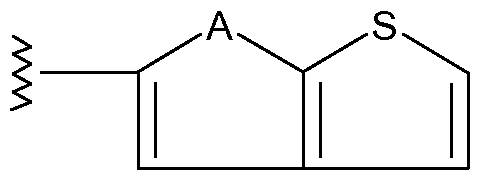 ,
,
где
А означает О или NR36 и каждый атом С необязательно замещен одной или несколькими группами, выбираемыми из R34 и R35, где R34 означает (1-3С)алкил, предпочтительно R34 означает метил; R35 означает (1-3С)алкокси, предпочтительно R35 означает метокси; R36 означает водород или (1-6С)алкил, предпочтительно R36 означает водород или (1-3С)алкил, более предпочтительно R36 означает водород или метил.
Другим объектом настоящего изобретения является соединение формулы I, где R4 означает
 или
или
 или
или
R4 означает (1-4С)алкил, независимо необязательно замещенный одним или несколькими заместителями, выбираемыми из R8, фтора, гидрокси, где
m равно 1, 2 или 3;
n равно 1, 2 или 3;
r равно 1 или 2;
Y означает CR5 или N;
Х означает О, CHR6, C(R66)(R67), NR7, C=O;
Z означает О или
Z образует с R9 5- или 6-членный гетероциклил, необязательно замещенный R91;
R5 означает Н или (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R6 означает R61, R62, R63, R65, H, гидрокси, фтор;
R7 означает R71, R72, R73, R74, H;
R8 означает гетероарил, необязательно замещенный одной или несколькими группами, выбираемыми из (1-4С)алкила, гидрокси, (1-6С)алкокси, амино, (ди)[(1-4С)алкил]амино, [(1-4С)алкил]амино, галогена;
R9 означает Н или (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R61 означает (1-6С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, амино(1-4С)алкил, [(1-6С)алкил]амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкоксикарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкоксикарбонил]амино(1-4С)алкил, все алкильные группы в R61 необязательно замещены одним или несколькими атомами фтора;
R62 означает (1-6С)алкокси, гидрокси(1-6С)алкокси, (1-3С)алкокси(2-4С)алкокси, R621-(2-4С)алкокси, (1-4С)алкилкарбонилокси, (1-4С)алкиламинокарбонилокси, (3-6С)циклоалкиламинокарбонилокси, все алкильные группы в R62 необязательно замещены одним или несколькими атомами фтора;
R63 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, [гидрокси(2-6С)алкил]амино, [(1-6С)алкил][гидрокси(2-6С)алкил]амино, (1-6С)алкоксикарбониламино, (1-6С)алкиламинокарбониламино, [(1-6С)алкокси(2-6С)алкил]амино, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино, (1-6С)алкилкарбониламино, [(1-6С)алкилкарбонил][(1-6C)алкокси(2-6С)алкил]амино, все алкильные группы в R63 необязательно замещены одним или несколькими атомами фтора;
R65 означает N-присоединенный гетероциклил, необязательно замещенный одной или несколькими оксогруппами, одним или несколькими атомами фтора или одной или несколькими группами R651;
R66 означает (1-6С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, амино(1-4С)алкил, [(1-6С)алкил]амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкоксикарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкоксикарбонил]амино(1-4С)алкил, все алкильные группы в R66 необязательно замещены одним или несколькими атомами фтора;
R67 означает гидрокси, (1-4С)алкокси или фтор;
R71 означает (1-6С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, где любые алкильные группы необязательно замещены одним или несколькими атомами фтора;
R72 означает (1-4С)алкил, замещенный R725;
R73 означает R732карбонил, R733карбонил или R735карбонил;
R74 означает гетероциклил, необязательно замещенный одной или несколькими группами, независимо выбираемыми из фтора или R741;
R91 означает (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R621 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, все алкильные группы в R621 необязательно замещены одним или несколькими атомами фтора, или
R621 означает N-присоединенный гетероциклил, необязательно замещенный одним или несколькими атомами фтора;
R651 означает (1-4С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, (1-4С)алкилкарбонил, все алкильные группы в R651 необязательно замещены одной или несколькими группами, независимо выбираемыми из фтора или гидроксила;
R725 означает аминокарбонил, [(1-6С)алкил]аминокарбонил, (ди)[(1-6С)алкил]аминокарбонил, [гидрокси(2-6С)алкил]аминокарбонил, [(1-6С)алкил][гидрокси(2-6С)алкил]аминокарбонил, [(1-6С)алкокси(2-6С)алкил]аминокарбонил, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]аминокарбонил, (циклил-N)карбонил, амино(2-4С)алкоксикарбонил, [(1-6С)алкил]амино(2-4С)алкоксикарбонил, все алкильные группы в R725 необязательно замещены одним или несколькими атомами фтора;
R732 означает (1-4С)алкил, амино(1-4С)алкил, [(1-6С)алкил]амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [гидрокси(2-6С)алкил]амино(1-4С)алкил, [(1-6С)алкил][гидрокси(2-6С)алкил]амино(1-4С)алкил, [(1-6С)алкокси(2-6С)алкил]амино(1-4С)алкил, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино(1-4С)алкил, (циклил-N)(1-4С)алкил, [(1-6С)алкилкарбонил]амино(1-4С)алкил, [(1-6С)алкил][(1-6C)алкилкарбонил]амино(1-4С)алкил, гидрокси(1-4С)алкил, (1-6С)алкокси(1-4С)алкил, (3-6С)циклоалкокси(1-4С)алкил, аминокарбонил(1-4С)алкил, [(1-6С)алкил]аминокарбонил(1-4С)алкил, (ди)[(1-6С)алкил]аминокарбонил(1-4С)алкил, [гидрокси(1-6С)алкил]аминокарбонил(1-4С)алкил, [(1-6С)алкил][гидрокси(1-6С)алкил]аминокарбонил(1-4С)алкил, [(1-6С)алкокси(2-6С)алкил]аминокарбонил(1-4С)алкил, все алкильные группы в R732 необязательно замещены одним или несколькими атомами фтора;
R733 означает (1-6С)алкокси;
R735 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, циклил-N, все алкильные группы в R735 необязательно замещены одним или несколькими атомами фтора;
R741 означает (1-4С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, (1-6С)алкокси, (1-4С)алкилкарбонил, все алкильные группы в R741 необязательно замещены одним или несколькими атомами фтора или гидроксилами.
Другим объектом настоящего изобретения является соединение формулы I, где R4 означает
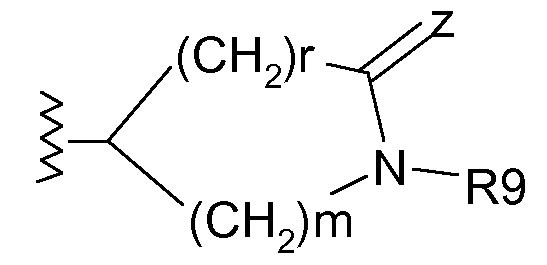 ,
,
где
m равно 1, 2 или 3, предпочтительно m равно 1 или 2; r равно 1 или 2; Z означает О или Z образует с R9 5- или 6-членный гетероциклил, необязательно замещенный R91, предпочтительно Z образует с R9 триазоловое кольцо, необязательно замещенное R91;
R9 означает Н или (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R91 означает (1-6С)алкил, предпочтительно (1-3С)алкил, необязательно замещенный одним или несколькими атомами фтора.
Другим объектом настоящего изобретения является соединение формулы I, где
R4 означает
 ,
,
где
m равно 1 или 2 и r равно 1 или 2, предпочтительно r равно 1; Z означает О и R9 означает Н или (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора, предпочтительно R9 означает (1-3С)алкил, более предпочтительно R9 означает метил.
Другим объектом настоящего изобретения является соединение формулы I, где
R4 означает
 ,
,
где m равно 1 или 2, r равно 1, Z означает О, R9 означает Н или (1-3С)алкил, предпочтительно R9 означает метил.
Другим объектом настоящего изобретения является соединение формулы I, где R4 означает (1-4С)алкил, независимо необязательно замещенный одним или несколькими заместителями, выбираемыми из R8, фтора и гидроксила, где R8 означает гетероарил, независимо необязательно замещенный одним или несколькими заместителями, выбираемыми из (1-4С)алкила, гидрокси, (1-6С)алкокси, амино, (ди)[(1-4С)алкил]амино, [(1-4С)алкил]амино и галогена.
Другим объектом настоящего изобретения является соединение формулы I, где R4 означает (1-4С)алкил, независимо необязательно замещенный одним или несколькими заместителями, выбираемыми из R8 или гидрокси. R8 означает гетероарил, предпочтительно R8 означает имидазол.
Другим объектом настоящего изобретения является соединение формулы I, где
R4 означает
 ,
,
где
m равно 1, 2 или 3;
n равно 1, 2 или 3;
Y означает CR5 или N;
Х означает О, CHR6, C(R66)(R67), NR7, C=O;
R5 означает Н или (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R6 означает R61, R62, R63, R65, H, гидрокси, фтор;
R7 означает R71, R72, R73, R74, H;
R61 означает (1-6С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, амино(1-4С)алкил, [(1-6С)алкил]амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкоксикарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкоксикарбонил]амино(1-4С)алкил, все алкильные группы в R61 необязательно замещены одним или несколькими атомами фтора;
R62 означает (1-6С)алкокси, гидрокси(1-6С)алкокси, (1-3С)алкокси(2-4С)алкокси, R621-(2-4С)алкокси, (1-4С)алкилкарбонилокси, (1-4С)алкиламинокарбонилокси, (3-6С)циклоалкиламинокарбонилокси, все алкильные группы в R62 необязательно замещены одним или несколькими атомами фтора;
R63 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, [гидрокси(2-6С)алкил]амино, [(1-6С)алкил][гидрокси(2-6С)алкил]амино, (1-6С)алкоксикарбониламино, (1-6С)алкиламинокарбониламино, [(1-6С)алкокси(2-6С)алкил]амино, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино, (1-6С)алкилкарбониламино, [(1-6С)алкилкарбонил][(1-6C)алкокси(2-6С)алкил]амино, все алкильные группы в R63 необязательно замещены одним или несколькими атомами фтора;
R65 означает N-присоединенный гетероциклил, необязательно замещенный одной или несколькими оксогруппами, одним или несколькими атомами фтора или одной или несколькими группами R651;
R66 означает (1-6С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, амино(1-4С)алкил, [(1-6С)алкил]амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкилкарбонил]амино(1-4С)алкил, [(1-4С)алкоксикарбонил]амино(1-4С)алкил, [(1-4С)алкил][(1-4С)алкоксикарбонил]амино(1-4С)алкил, все алкильные группы в R66 необязательно замещены одним или несколькими атомами фтора;
R67 означает гидрокси, (1-4С)алкокси или фтор;
R71 означает (1-6С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, все алкильные группы в R71 необязательно замещены одним или несколькими атомами фтора;
R72 означает (1-4С)алкил, замещенный R725;
R73 означает R732карбонил, R733карбонил или R735карбонил;
R74 означает гетероциклил, необязательно замещенный одной или несколькими группами, независимо выбираемыми из фтора или R741;
R91 означает (1-6С)алкил, необязательно замещенный одним или несколькими атомами фтора;
R621 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, где любые алкильные группы необязательно замещены одним или несколькими атомами фтора, или
R621 означает N-присоединенный гетероциклил, необязательно замещенный одним или несколькими атомами фтора;
R651 означает (1-4С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, (1-4С)алкилкарбонил, все алкильные группы в R651 необязательно замещены одной или несколькими группами, независимо выбираемыми из фтора или гидроксила;
R725 означает аминокарбонил, [(1-6С)алкил]аминокарбонил, (ди)[(1-6С)алкил]аминокарбонил, [гидрокси(2-6С)алкил]аминокарбонил, [(1-6С)алкил][гидрокси(2-6С)алкил]аминокарбонил, [(1-6С)алкокси(2-6С)алкил]аминокарбонил, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]аминокарбонил, (циклил-N)карбонил, амино(2-4С)алкоксикарбонил, [(1-6С)алкил]амино(2-4С)алкоксикарбонил, все алкильные группы в R725 необязательно замещены одним или несколькими атомами фтора;
R732 означает (1-4С)алкил, амино(1-4С)алкил, [(1-6С)алкил]амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [гидрокси(2-6С)алкил]амино(1-4С)алкил, [(1-6С)алкил][гидрокси(2-6С)алкил]амино(1-4С)алкил, [(1-6С)алкокси(2-6С)алкил]амино(1-4С)алкил, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино(1-4С)алкил, (циклил-N)(1-4С)алкил, [(1-6С)алкилкарбонил]амино(1-4С)алкил, [(1-6С)алкил][(1-6C)алкилкарбонил]амино(1-4С)алкил, гидрокси(1-4С)алкил, (1-6С)алкокси(1-4С)алкил, (3-6С)циклоалкокси(1-4С)алкил, аминокарбонил(1-4С)алкил, [(1-6С)алкил]аминокарбонил(1-4С)алкил, (ди)[(1-6С)алкил]аминокарбонил(1-4С)алкил, [гидрокси(1-6С)алкил]аминокарбонил(1-4С)алкил, [(1-6С)алкил][гидрокси(1-6С)алкил]аминокарбонил(1-4С)алкил, [(1-6С)алкокси(2-6С)алкил]аминокарбонил(1-4С)алкил, все алкильные группы в R732 необязательно замещены одним или несколькими атомами фтора;
R733 означает (1-6С)алкокси;
R735 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, циклил-N, все алкильные группы в R735 необязательно замещены одним или несколькими атомами фтора;
R741 означает (1-4С)алкил, (3-6С)циклоалкил, (3-6С)циклоалкил(1-3С)алкил, (1-6С)алкокси, (1-4С)алкилкарбонил, все алкильные группы в R741 необязательно замещены одним или несколькими атомами фтора или гидроксилами.
Другим объектом настоящего изобретения является соединение формулы I, где
R4 означает
 ;
;
где
m равно 1 или 2;
n равно 1 или 2;
Y означает CR5;
Х означает О, CHR6, C(R66)(R67) или NR7;
R5 означает Н или (1-6С)алкил;
R6 означает R61, R62, R63, R65, H или гидрокси;
R7 означает R72, R73, R71, R74 или H;
R61 означает амино(1-4С)алкил, [(1-6С)алкил]амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [(1-4С)алкилкарбонил]амино(1-4С)алкил или [(1-4С)алкоксикарбонил]амино(1-4С)алкил; предпочтительно R61 означает амино(1-3С)алкил, [(1-3С)алкил]амино(1-3С)алкил, (ди)[(1-3С)алкил]амино(1-3С)алкил, [(1-3С)алкилкарбонил]амино(1-3С)алкил или [(1-3С)алкоксикарбонил]амино(1-3С)алкил;
R62 означает (1-4С)алкилкарбонилокси, (3-6С)циклоалкиламинокарбонилокси;
R63 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, [(1-6С)алкокси(2-6С)алкил]амино, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино, [(1-6С)алкилкарбонил][(1-6С)алкокси(2-6С)алкил]амино, все алкильные группы в R63 необязательно замещены одним или несколькими атомами фтора;
R65 означает N-присоединенный гетероциклил, необязательно замещенный одной или несколькими оксогруппами, одним или несколькими атомами фтора или одной или несколькими группами R651; предпочтительно R65 означает азетидин, пирролидин, пиперидин, пиперазин или морфолин, необязательно замещенный одной или несколькими оксогруппами, одним или несколькими атомами фтора или одной или несколькими группами R651; более предпочтительно R65 означает пиперазин, необязательно замещенный одной или несколькими оксогруппами, одним или несколькими атомами фтора или одной или несколькими группами R651;
R66 означает [(1-6С)алкил]амино(1-4С)алкил;
R67 означает гидроксил;
R71 означает (1-6С)алкил;
R72 означает (1-4С)алкил, замещенный R725;
R73 означает R732карбонил, R733карбонил или R735карбонил;
R74 означает гетероциклил, необязательно замещенный одной или несколькими группами, независимо выбираемыми из фтора или R741;
R651 означает (1-4С)алкил, (1-4С)алкилкарбонил, предпочтительно R651 означает метил или метилкарбонил;
R725 означает (ди)[(1-6С)алкил]аминокарбонил;
R732 означает (1-4С)алкил, амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [гидрокси(2-6С)алкил]амино(1-4С)алкил, гидрокси(1-4С)алкил, (1-6С)алкокси(1-4С)алкил;
R733 означает (1-6С)алкокси;
R735 означает амино;
R741 означает (1-4С)алкилкарбонил.
Другим объектом настоящего изобретения является соединение формулы 1, где
R4 означает
 ;
;
m равно 1 или 2, предпочтительно m равно 2, n равно 1 или 2; Y означает CR5; X означает CHR6 или NR7;
R5 означает Н или (1-6С)алкил, предпочтительно R5 означает Н;
R6 означает R63 или R65;
R7 означает R71, R72, R73 или R74, предпочтительно R7 означает R73;
R63 означает амино, [(1-6С)алкил]амино, (ди)[(1-6С)алкил]амино, [(1-6С)алкокси(2-6С)алкил]амино, [(1-6С)алкил][(1-6С)алкокси(2-6С)алкил]амино или [(1-6C)алкилкарбонил][(1-6С)алкокси(2-6С)алкил]амино, любые алкильные группы в R63 необязательно замещены одним или несколькими атомами фтора; предпочтительно R63 означает амино, [(1-3С)алкил]амино, (ди)[(1-3С)алкил]амино, [(1-3С)алкокси(2-3С)алкил]амино, [(1-3С)алкил][(1-3С)алкокси(2-3С)алкил]амино, [(1-3С)алкилкарбонил][(1-3C)алкокси(2-3С)алкил]амино, все алкильные группы в R63 необязательно замещены одним или несколькими атомами фтора.
R65 означает азетидин, пирролидин, пиперидин, пиперазин или морфолин, необязательно замещенный одной или несколькими оксогруппами, одним или несколькими атомами фтора или одной или несколькими группами R651; предпочтительно R65 означает пиперазин, необязательно замещенный одной или несколькими оксогруппами, одним или несколькими атомами фтора или одной или несколькими группами R651;
R71 означает (1-6С)алкил; предпочтительно R71 означает (1-3С)алкил, наиболее предпочтительно R71 означает метил;
R72 означает (1-4С)алкил, замещенный R725; предпочтительно R72 означает метил, замещенный R725;
R73 означает R732карбонил, R733карбонил или R735карбонил; предпочтительно R73 означает R732карбонил;
R74 означает гетероциклил, необязательно замещенный одной или несколькими группами, независимо выбираемыми из фтора или R741; предпочтительно R74 означает пиран или пиперидин, необязательно замещенный R741;
R651 означает (1-4С)алкил, (1-4С)алкилкарбонил, предпочтительно R651 означает (1-3C)алкил, (1-3С)алкилкарбонил, более предпочтительно R651 означает метил или метилкарбонил;
R725 означает (ди)[(1-6С)алкил]аминокарбонил, предпочтительно R725 означает (ди)[(1-3С)алкил]аминокарбонил, более предпочтительно R725 означает (ди)[метил]аминокарбонил;
R732 означает (1-4С)алкил, амино(1-4С)алкил, (ди)[(1-6С)алкил]амино(1-4С)алкил, [гидрокси(2-6С)алкил]амино(1-4С)алкил, гидрокси(1-4С)алкил, (1-6С)алкокси(1-4С)алкил; предпочтительно R732 означает (1-3С)алкил, амино(1-3С)алкил, (ди)[(1-3С)алкил]амино(1-3С)алкил, [гидрокси(2-3С)алкил]амино(1-3С)алкил, гидрокси(1-3С)алкил, (1-3С)алкокси(1-3С)алкил;
R733 означает (1-6С)алкокси, предпочтительно R733 означает (1-3С)алкокси;
R735 означает амино, [(1-6С)алкил]амино, (ди)[(1-6C)алкил]амино;
R741 означает (1-4С)алкилкарбонил, предпочтительно R741 означает метилкарбонил.
Другим объектом настоящего изобретения является соединение формулы 1, выбираемое из группы, включающей:
N-[2-метокси-4-[8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин]фенил]-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-((транс)-4-(4-ацетилпиперазин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-4-(3-(азетидин-1-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
(S)-пентан-2-ил-4-(3-((R)-1-(2-(диметиламино)ацетил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
(транс)-4-(1-(3-метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетат;
N-(4-(3-((транс)-4-гидроксициклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-((цис)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-((цис)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-2-метокси-4-(3-((транс)-4-(2-метоксиэтиламино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
N-(2-метокси-4-(8-метил-3-((транс)-4-морфолиноциклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-(3-метилоксетан-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-(гидроксиметил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-((1Н-имидазол-1-ил)метил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)азетидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-(пиперидин-4-ил)имидазо-[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-(1-(2-(диметиламино)-2-оксоэтил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-(1-(2-(диметиламино)ацетил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-(1-(2-аминоацетил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-(1-карбамоилпиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
метил-4-(1-(3-метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилат;
N-(2-метокси-4-(8-метил-3-(4-метилпиперазин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
N-(2-метокси-4-(8-метил-3-(морфолин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
изопропил-2-метокси-4-(8-метил-3-(4-морфолинопиперидин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
(S)-пентан-2-ил-2-метокси-4-(3-((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
N-(4-(3-((транс)-4-(диметиламино)циклогексил)-8-метилимидазо-[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(3-((цис)-4-((2-метоксиэтил)(метил)амино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-((цис)-4-морфолиноциклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-((цис)-4-(диметиламино)циклогексил)-8-метилимидазо-[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-4-(3-((цис)-4-(4-ацетилпиперазин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
(S)-пентан-2-ил-4-(3-((цис)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
(S)-пентан-2-ил-2-метокси-4-(8-метил-3-((1r,3r)-3-(4-метилпиперазин-1-ил)циклобутил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
(S)-пентан-2-ил-2-метокси-4-(8-метил-3-(3-(4-метилпиперазин-1-ил)циклопентил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
(S)-пентан-2-ил-2-метокси-4-(3-((транс)-4-(N-(2-метоксиэтил)ацетамидо)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
4-метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-4-(3-(4-ацетилпиперазин-1-ил)-8-метилимидазо-[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
N-(4-(3-(4-(1-ацетилпиперидин-4-ил)пиперазин-1-ил)-8-метилимидазо-[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
2,2,2-трифторацетат N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамида;
N-(4-(3-((транс)-4-(4-ацетилпиперазин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-4-(3-((транс)-4-(4-ацетилпиперазин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
(R)-N-(4-(3-(1-(2-(диметиламино)ацетил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-2-метокси-4-(8-метил-3-((цис)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
N-(4-(3-(4-ацетилпиперазин-1-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-(4-(тетрагидро-2Н-пиран-4-ил)пиперазин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
(R)-4-метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пирролидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
(S)-4-метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пирролидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-(3-(трифторметил)-5,6-дигидро-[1,2,4]триазоло[4,3-a]пиразин-7(8Н)-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-(1-метил-2-оксопиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-((транс)-4-аминоциклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-((транс)-4-(2,2-дифторэтиламино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
изопропил-4-(3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил(метил)карбамат;
5-метокси-N-(2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-пирроло[3,2-b]пиридин-2-карбоксамид;
N-(2-метокси-4-(8-метил-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
(S)-4-гидроксибутан-2-ил-2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
4-фтор-N-(2-метокси-4-(8-метил-3-(1-метилпиперидин-4-ил)имидазо-[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
N-(5-фтор-2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
5-гидроксипентан-2-ил-5-фтор-2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
(S)-втор-бутил-2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
N-(4-(3-(1'-ацетил-1,4'-бипиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-2-метокси-4-(3-((S)-1-(2-метоксиацетил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
(транс)-4-(1-(3-метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилциклопентилкарбамат;
(R)-N-(4-(3-(1-(2-(диметиламино)-2-оксоэтил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(R)-N-(4-(3-(1-(2-гидроксиацетил)пирролидин-3-ил)-8-метилимидазо-[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(пиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-хлор-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-пиррол-2-карбоксамид;
N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-6-метил-6Н-тиено[2,3-b]пиррол-5-карбоксамид;
N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-6Н-тиено[2,3-b]пиррол-5-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-индол-2-карбоксамид;
4-гидрокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-4-(3-((транс)-4-(аминометил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
1-метил-N-(4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-индол-2-карбоксамид;
N-(2-гидрокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-((метиламино)метил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-((транс)-4-((диметиламино)метил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-4-(3-((транс)-4-((диметиламино)метил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
6-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-индазол-3-карбоксамид;
5-хлор-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-пирроло[2,3-b]пиридин-2-карбоксамид;
N-(4-(3-((транс)-4-(ацетамидометил)циклогексил)-8-метилимидазо-[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-4-(3-((транс)-4-(ацетамидометил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
(S)-пентан-2-ил-4-(3-((транс)-4-(метоксикарбонилметил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
4-метокси-N-(2-метокси-4-(8-метил-3-(4-оксоциклогексил)имидазо-[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-((транс)-4-гидрокси-4-((метиламино)метил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-(1-метил-5-оксопирролидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метил-3-оксопиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
5-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-пирроло[2,3-с]пиридин-2-карбоксамид;
Еще одним объектом настоящего изобретения являются соединения формулы 1, выбираемые из группы, включающей:
4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-морфолиноциклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
(S)-пентан-2-ил-2-метокси-4-(8-метил-3-((транс)-4-морфолиноциклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
(S)-пентан-2-ил-4-(3-(1-(2-(диметиламино)ацетил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
(S)-пентан-2-ил-4-(3-(1-(2-(диметиламино)-2-оксоэтил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
(S)-пентан-2-ил-2-метокси-4-(8-метил-3-морфолиноимидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
изопропил-2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
4-фтор-N-(2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
трет-бутил-2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
N-(4-(3-(1-(2-(диметиламино)-2-оксоэтил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-(азетидин-1-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид;
5-гидроксипентан-2-ил-2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
(S)-пентан-2-ил-4-(3-(1-(2-аминоацетил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
N-(4-(3-(1-(2-аминоацетил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-((транс)-4-(аминометил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-2-метокси-4-(8-метил-3-((цис)-4-морфолиноциклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
(S)-пентан-2-ил-2-метокси-4-(8-метил-3-(4-морфолинопиперидин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат;
4-метокси-N-(2-метокси-4-(8-метил-3-(4-морфолинопиперидин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-3-(4-метилпиперазин-1-ил)циклобутил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(3-((транс)-4-(2-метоксиэтиламино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(3-((транс)-4-(N-(2-метоксиэтил)ацетамидо)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(8-метил-3-морфолиноимидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
4-метокси-N-(2-метокси-4-(3-((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид;
N-(4-(3-(1-(2-(диметиламино)ацетил)пиперидин-4-ил)-8-метилимидазо-[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид;
(S)-пентан-2-ил-4-(3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат;
(S)-пентан-2-ил-2-метокси-4-(8-метил-3-(4-(тетрагидро-2Н-пиран-4-ил)пиперазин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат и
N-(4-(3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид.
Настоящее изобретение также относится к соединениям, в которых все конкретные определения символов А, Х, Y, Z, m, n, r, R1-R9 и всех замещающих групп в разных вышеуказанных объектах изобретения встречаются в любой комбинации в определении соединения 8-метил-1-фенилимидазо[1,5-a]пиразина формулы I.
Соединения 8-метил-1-фенилимидазо[1,5-a]пиразина по настоящему изобретению стимулируют рецептор Lck. Все соединения по настоящему изобретению характеризуются значением IC50, равным 10 мкМ или меньше.
Другим объектом настоящего изобретения являются соединения формулы I, имеющие значение IC50 менее 100 нМ.
Еще одним объектом настоящего изобретения являются соединения формулы I, имеющие значение IC50 менее 10 нМ.
Термин IC50 означает концентрацию испытуемого соединения, необходимую для 50% ингибирования in vitro.
Ингибирование активности киназы можно измерить методом иммобилизованного металла для анализа фосфохимических веществ (IMAP). IMAP представляет собой анализ гомогенной поляризации флуоресценции (FP) на основе улавливания фосфорилированных пептидных субстратов по сродству. При выполнении анализа методом IMAP используют меченные флуоресцеином пептидные субстраты, которые при фосфорилировании протеинкиназой связываются с так называемыми наночастицами IMAP, образующими производные с комплексами трехвалентных металлов. Связывание вызывает изменение скорости молекулярного движения пептида и вследствие этого увеличение значения поляризации флуоресценции (FP) в флуоресцеиновой метке, присоединенной к пептиду субстрата (Gaudet et al. A homogeneous fluorescence polarization assay adaptable for a range of protein serine/threonine and tyrosine kinases. J. Biomol. Screen (2003) 8, 164-175).
Соединения по настоящему изобретению могут образовывать гидраты или сольваты. Специалистам в данной области известно, что заряженные соединения образуют гидратированные продукты при лиофилизации водой или образуют сольватированные продукты при концентрировании в растворе c соответствующим органическим растворителем. Соединения по настоящему включают пролекарства, гидраты или сольваты указанных соединений.
Пролекарства рассмотрены в публикациях T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems (1987), Vol. 14 of the A.C.S. Symposium Series и in Bioreversible Carriers in Drug Design, (1987) Edward B. Roche, ed., American Pharmaceutical Association and Pergamon Press. Термин ”пролекарство” означает соединение (например, предшественник лекарственного средства), которое трансформируется in vivo с образованием соединения формулы (I) или фармацевтически приемлемой соли, гидрата или сольвата указанного соединения. Трансформация может происходить в соответствии с разными механизмами (например, в результате метаболических или химических процессов), таких как, например, гидролиз в крови. Применение пролекарств рассмотрено в публикациях T. Higuchi and V. Stella, Pro-drugs as Novel Delivery Systems (1987), Vol. 14 of the A.C.S. Symposium Series и in Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987.
Одно или несколько соединений по настоящему изобретению могут находиться в несольватированной форме, а также в сольватированной форме при использовании фармацевтически приемлемых растворителей, таких как вода, этанол и тому подобные, поэтому предполагается, что в объем изобретения входят как сольватированные, так и несольватированные формы. Термин “сольват” означает физическую ассоциацию соединения по настоящему изобретению с одной или несколькими молекулами растворителя. Указанная физическая ассоциация предполагает разные степени ионного и ковалентного связывания, включая образование водородной связи. В определенных случаях сольват может быть выделен, например, при включении одной или нескольких молекул растворителя в кристаллическую решетку твердого кристаллического вещества. В определение термина ”сольват” входят как фаза раствора, так и выделяемые сольваты. Неограничивающие примеры приемлемых сольватов включают этаноляты, метаноляты и тому подобные. ”Гидрат” является сольватом, в котором молекулой растворителя является Н2О.
Соединения формулы I могут образовывать соли, которые также входят в объем настоящего изобретения. В определение соединения формулы I в настоящем описании изобретения также входят его соли за исключением особо оговоренных случаев. Термин ”соль” в использованном здесь значении означает кислые соли, образованные с неорганическими и/или органическими кислотами, а также основные соли, образованные с неорганическими и/или органическими основаниями. Кроме того, в тех случаях, когда соединение формулы I может содержать как основную часть, включающую, не ограничиваясь ими, пиридин или имидазол, так и кислотную часть, могут быть образованы цвиттерионы (”внутрикомплексные соли”), входящие в определение термина ”соль”, использованного в настоящем описании изобретения. Фармацевтически приемлемые (то есть нетоксичные, физиологически приемлемые) соли являются более предпочтительными, хотя другие соли также являются полезными. Соли соединений формулы I могут быть получены, например, в результате осуществления взаимодействия соединения формулы I с определенным количеством кислоты или основания, таким как эквивалентное количество, в среде, в которой происходит осаждение соли или в водной среде с последующей лиофилизацией.
Настоящее изобретение также относится к меченным изотопами соединениям по настоящему изобретению, которые идентичны описанным соединениям за исключением того, что в таких соединениях один или несколько атомов заменены атомом, у которого атомная масса или массовое число отличаются от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть введены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фтора и хлора, такие как 2Н, 3Н, 13С, 14С, 15N, 18O, 17O, 35S, 18F и 36Cl.
Определенные меченные изотопами соединения формулы I (например, соединения, меченные изотопами 3Н и 14С) могут быть использованы при выполнении анализов распределения соединения и/или субстрата в тканях. Изотопы трития (то есть 3Н) или углерода-14 (то есть 14С) являются особенно предпочтительными благодаря простоте получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (то есть 2Н), обеспечивает определенные терапевтические преимущества благодаря большей метаболической устойчивости (например, более продолжительное время полужизни in vivo или возможность использования более низкой дозы) и поэтому могут быть более предпочтительным в некоторых случаях. Меченные изотопами соединения формулы I могут быть получены методами, аналогичными описанным в публикации Schemes и/или в приведенных ниже примерах, путем замещения немеченного изотопом реагента соответствующим меченным изотопом реагентом.
Соединения формулы I могут содержать асимметричные или хиральные центры и поэтому могут существовать в разных стереоизомерных формах. В объем настоящего изобретения входят все стереоизомерные формы соединений формулы (I), а также их смеси, включая рацемические смеси. Кроме того, настоящее изобретение относится ко всем геометрическим изомерам и изомерам положения. Например, если соединение формулы (I) включает двойную связь или конденсированное кольцо, в объем настоящего изобретения входят цис- и транс-формы, а также их смеси.
Смеси диастереомеров могут быть разделены на отдельные диастереомеры на основании их физических и химических отличий методами, хорошо известными специалистам в данной области, такими как, например, хроматография и/или фракционированная кристаллизация. Энантиомеры могут быть разделены путем превращения смеси энантиомеров в смесь диастереомеров в результате осуществления взаимодействия с соответствующим оптически активным соединением (таким как хиральное вспомогательное вещество, такое как хиральный спирт или хлорангидрид кислоты Мошера), разделения диастереомеров и превращения (например, путем гидролиза) отдельных диастереомеров в соответствующие чистые энантиомеры. Кроме того, некоторые соединения формулы (I) могут быть атропизомерами (например, замещенными биарилами), которые также входят в объем настоящего изобретения. Энантиомеры могут быть также разделены на колонке для хиральной ВЭЖХ.
Соединения формулы (I) также могут существовать в разных таутомерных формах, и все такие формы входят в объем настоящего изобретения. Например, в объем настоящего изобретения входят все кето-еноловые и имин-енаминовые формы соединений.
В объем настоящего изобретения входят все стереоизомеры (например, геометрические изомеры, оптические изомеры и тому подобные) соединений по настоящему изобретению (в том числе стереоизомеры солей, сольватов, сложных эфиров и пролекарств соединений, а также солей, сольватов и сложных эфиров пролекарств), которые могут существовать благодаря асимметричным атомам углерода в разных заместителях, включая энантиомерные формы (которые могут существовать даже при отсутствии асимметричных атомов углерода), ротамерные формы, атропизомеры и диастереомерные формы, а также изомеры положения. Отдельные стереоизомеры соединений по настоящему изобретению, например, могут по существу не содержать других изомеров или могут находиться в смеси с другими изомерами, например, в виде рацематов, или со всеми другими или другими отобранными стереоизомерами. Хиральные центры по настоящему изобретению могут иметь S или R конфигурацию, определенную в Рекомендациях IUPAC 1974. Термины ”соль”, “сольват”, “сложный эфир”, “пролекарство” в равной степени относятся к соли, сольвату, сложному эфиру и пролекарству энантиомеров, стереоизомеров, ротамеров, таутомеров, изомеров положения, рацематов или пролекарств соединений по настоящему изобретению.
Настоящее изобретение также относится к фармацевтической композиции, включающей производное 8-метил-1-фенилимидазо[1,5-a]пиразина или фармацевтически приемлемые соли соединений общей формулы I в смеси с фармацевтически приемлемыми вспомогательными веществами и необязательно с другими терапевтическими средствами. Вспомогательные вещества должны быть ”приемлемыми” в точки зрения совместимости с другими ингредиентами композиции и безопасными для реципиентов.
Настоящее изобретение далее относится к соединению формулы (I) в комбинации с одним или несколькими другими лекарственными средствами.
Композиции включают, например, композиции, пригодные для перорального, подъязычного, подкожного, внутривенного, внутримышечного, назального, местного, ректального или подобного введения в составе единичных дозированных форм.
В композициях, предназначенных для перорального введения, активный ингредиент может присутствовать в виде дискретных единиц, таких как таблетки, капсулы, порошки, гранулы, растворы, суспензии и тому подобные.
Композиции по настоящему изобретению, предназначенные для парентерального введения, могут находиться в контейнерах для одной дозы или множества доз, например, в виде жидкостей для инъекций в заранее определенных количествах, например, в запаянных пузырьках или ампулах, а также могут храниться в высушенном вымораживанием (лиофилизованном) состоянии, требующем только добавления перед использованием стерильного жидкого носителя, например, воды.
После смешивания с фармацевтически приемлемыми вспомогательными веществами, например, описанными в стандартном справочнике Gennaro, A.R. et al., Remington: The Science and Practice of Pharmacy (20th Edition., Lippincott Williams & Wilkins, 2000, see especially Part 5: Pharmaceutical Manufacturing), активный агент может быть спрессован в твердые дозированные формы, такие как пилюли, таблетки, или может быть введен в капсулы или суппозитории. При использовании фармацевтически приемлемых жидкостей активный агент может быть получен в виде жидкой композиции, например, в виде инъекционного препарата, в форме раствора, суспензии, эмульсии или аэрозоля, например, аэрозоля, распыляемого в нос.
Для получения твердых дозированных форм могут быть использованы обычные добавки, такие как наполнители, красители, полимерные связывающие вещества и тому подобные. Как правило, может быть использована любая фармацевтическим приемлемая добавка, которая не влияет на действие активных соединений. Приемлемые носители, с которыми активный агент по настоящему изобретению можно вводить в виде твердых композиций, включают лактозу, крахмал, производные целлюлозы и тому подобные или их смеси, используемые в приемлемых количествах. Для парентерального введения могут быть использованы водные суспензии, изотонические физиологические растворы и стерильные инъецируемые растворы, содержащие фармацевтически приемлемые диспергирующие агенты и/или смачивающие вещества, такие как пропиленгликоль или бутиленгликоль.
Настоящее изобретение далее относится к вышеуказанной фармацевтической композиции в комбинации с упаковочным материалом, пригодным для упаковки такой композиции, который включает инструкции по применению указанной композиции.
Точная доза и схема введения активного ингредиента или фармацевтической композиции могут изменяться в зависимости от конкретного соединения, способа введения, возраста и состояния здоровья субъекта, которому должно быть введено данное лекарственное средство.
Как правило, при парентеральном введении необходимы меньшие дозы, чем при других способах введения, которые в большей степени зависят от абсорбции. Однако приемлемая доза для человека может составлять 0,05-25 мг/кг массы тела. Требуемая доза может представлять собой однократную дозу или многократные дозы меньшей величины, вводимые через определенные периоды времени в течение суток или, в случае женщин, дозы, вводимые через определенное число дней на протяжении менструального цикла. Доза и схема введения могут быть различными для женщин и мужчин.
Соединения по настоящему изобретению могут быть использованы в терапии.
Еще одним объектом настоящего изобретения является применение соединений 8-метил-1-фенилимидазо[1,5-a]пиразина или их фармацевтически приемлемых солей общей формулы I для получения лекарственного средства для лечения Lck-опосредованных заболеваний или Lck-опосредованных состояний.
Другим объектом настоящего изобретения является применение соединений 8-метил-1-фенилимидазо[1,5-a]пиразина общей формулы I для получения лекарственного средства для лечения хронических Т-клеточных нарушений, а также острых воспалительных нарушений, опосредуемых Т-клетками.
Другим объектом настоящего изобретения является применение соединений 8-метил-1-фенилимидазо[1,5-a]пиразина общей формулы I для получения лекарственного средства для лечения Lck-опосредованных заболеваний или состояний. Указанные заболевания включают, не ограничиваясь ими, хронические Т-клеточные нарушения и острые воспалительные нарушения, опосредуемые Т-клетками. Такие заболевания или состояния включают аллергии, лейкоз, воспалительное заболевание кишечника, ревматоидный артрит, гломерулонефрит, фиброз легких, псориаз, аллергические реакции кожи, атеросклероз, рестеноз, аллергическую астму, рассеянный склероз, диабет 1-го типа, ревматоидный артрит, атопический дерматит, аллергическую реакцию замедленного типа (DTH), острое отторжение трансплантированных органов, а также гомологичную болезнь (GvHD).
Соединения по настоящему изобретения, в частности, могут быть использованы для лечения псориаза, ревматоидного артрита (RA), рассеянного склероза (MS) и отторжения трансплантатов.
Приемлемые способы получения производных 8-метил-1-фенилимидазо[1,5-a]пиразина
Соединения формулы I могут быть получены из соединений формулы II, в которых заместитель Х означает хлор, бром или иод, при помощи реакций сшивания, опосредуемых палладием, таких как реакции Сузуки, Стилле или Негиши. Соединения формулы II могут быть получены из соединений формулы III при помощи галогенирующих реагентов, таких как N-хлорсукцинимид, N-бромсукцинимид, N-иодсукцинимид или бром (схема 1).
Схема 1
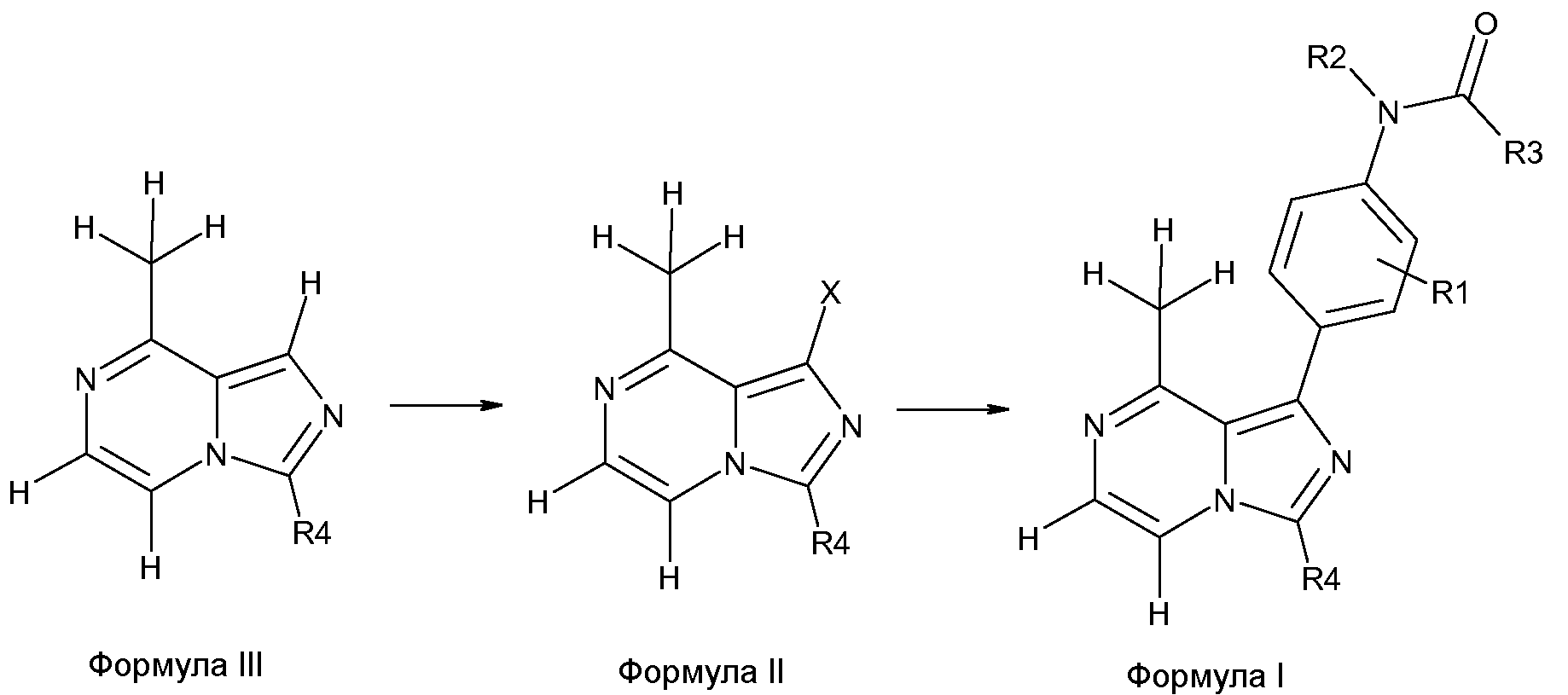
Соединения формулы III могут быть получены из соединений формулы IV при помощи реакции, опосредуемой палладием, в результате выполнения которой замещающий атом 8-хлора превращается в замещающую 8-метильную группу. Приемлемыми реагентами являются, например, комплекс хлорида бис(дифенилфосфино)ферроценпалладия(II) с дихлорметаном в качестве источника палладия и триметилбороксин для получения метильной группы (схема 2). Соединения формулы IV описаны в научной литературе (например, в публикациях WO2007112005, WO2009008992).
Схема 2
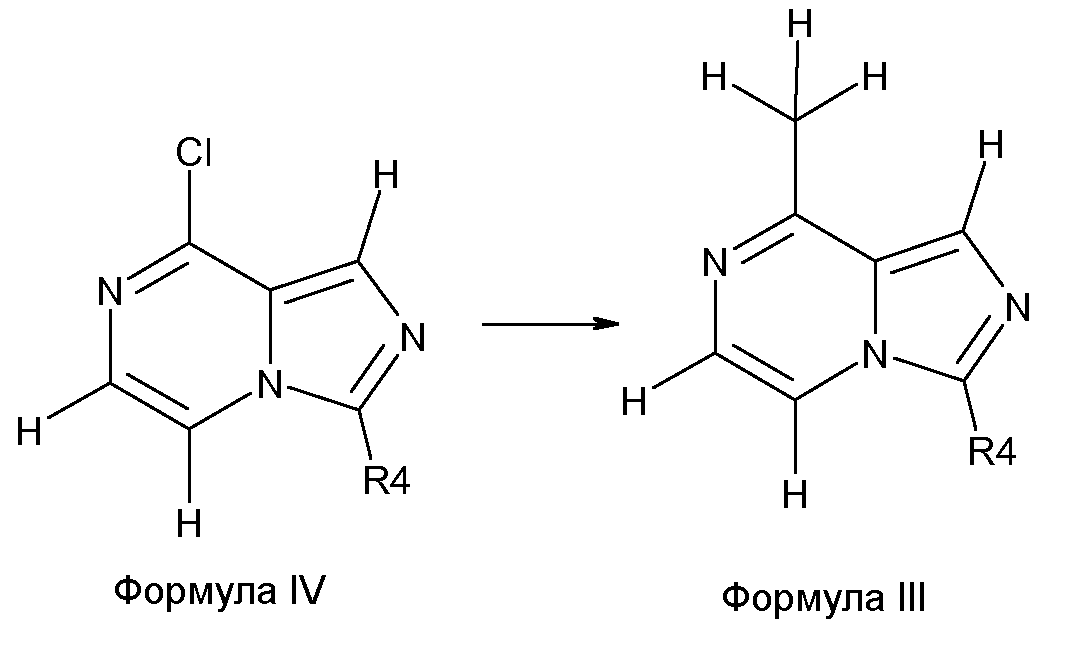
Другим способом получения соединений формулы III является использование соединений формулы V в условиях циклизации, таких как нагревания с фосфороксихлоридом. Соединения формулы V могут быть получены в соответствии со схемой 3 из соединений формулы VI при помощи реакции, опосредуемой палладием, в результате выполнения которой замещающий атом хлора превращается в замещающую метильную группу, как было описано выше для превращения соединений формулы IV в соединения формулы III.
Схема 3

В процессе превращения соединений формул II-VI часть R4 может содержать функциональные группы, защищенные приемлемой защитной группой, часть R4 может быть модифицирована или часть R4 может быть подвергнута комбинации стадий защиты/удаления защитной группы и модификации. Несколько защитных групп, известных в данной области, описаны в публикации ”Protective Groups in Organic Synthesis” by Greene T.W. and Wuts P.G.M. (John Wiley & Sons, New York). В качестве примера такого метода синтеза можно привести использование бензилоксикарбонильной защитной группы для защиты амина в R4 и превращение полученного амина в ацетамид после удаления защитной группы.
Схема 4
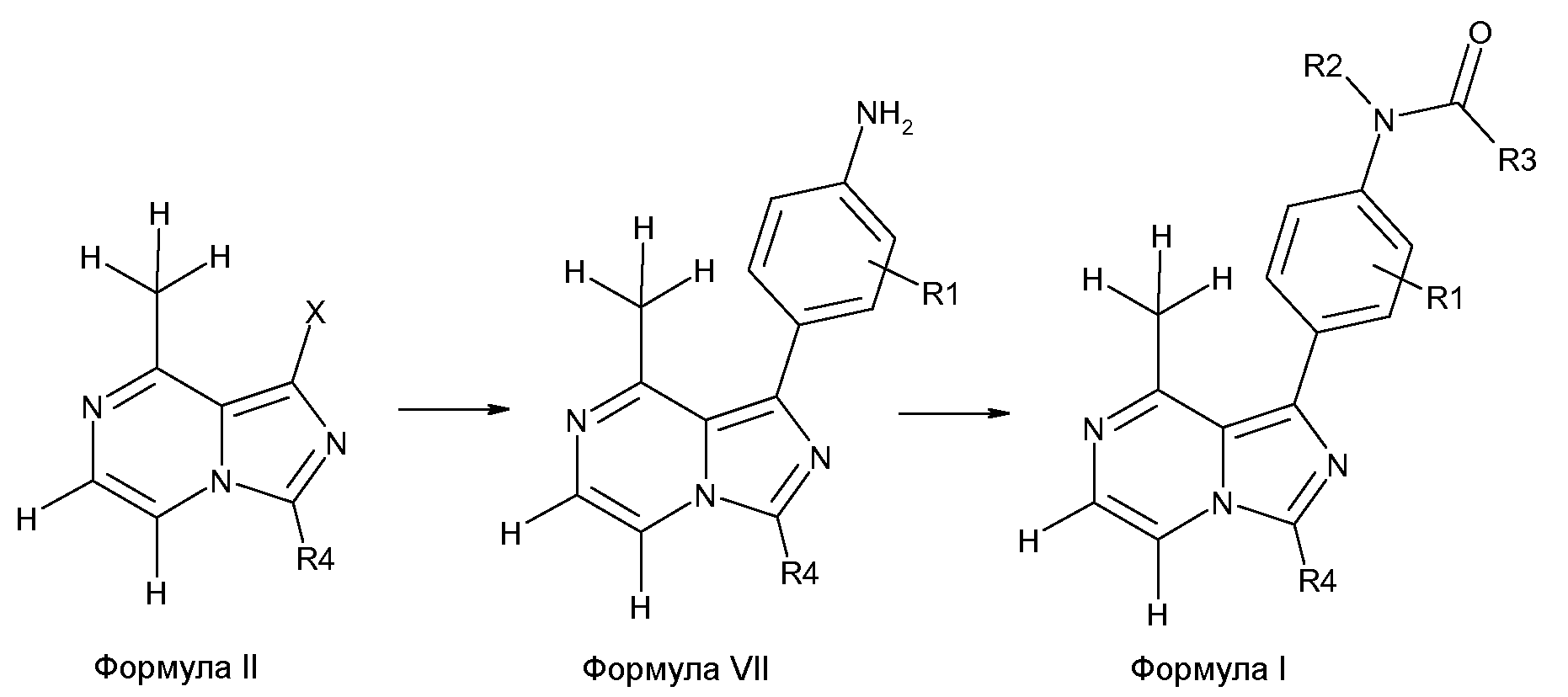
Другим способом получения соединений формулы I является использование соединений формулы VII при выполнении реакции образования амида, такой как обработка соединения формулы VII хлорангидридами кислот, или реакции образования карбамата, такой как обработка соединения формулы VII хлорформиатом. Соединения формулы VII могут быть получены из соединений формулы II при помощи реакций сшивания, опосредуемых палладием, таких как реакции Сузуки, Стилле или Негиши, необязательно в сочетании с использованием защитных групп (схема 4).
Альтернативным способом получения соединений формулы VII является восстановление соответствующих нитросоединений формулы VIII (например, использование цинка в уксусной кислоте). Соединения формулы VIII могут быть получены из соединений формулы IX при помощи реакции, опосредуемой палладием, в результате выполнения которой замещающий атом 8-хлора превращается в замещающую 8-метильную группу (схема 5). Приемлемыми реагентами являются, например, комплекс хлорида бис(дифенилфосфино)ферроценпалладия(II) с дихлорметаном в качестве источника палладия и триметилбороксин для получения метильной группы.
Схема 5

Соединения формулы IX могут быть получены из соединений формулы Х при помощи реакции образования кольца с условиях обработки фосфороксихлоридом. Соединения формулы Х могут быть получены из соединений формулы XI при помощи реакции образования амида, такой как обработка соединения формулы XI хлорангидридами кислот или кислотой и пептидсвязывающим реагентом, таким как тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (схема 6).
В процессе синтеза с использованием соединений формул VII-XI часть R4 может содержать защитные группы или может быть модифицирована.
Схема 6

Соединения формулы XI могут быть получены из соединений формулы XII методами синтеза, хорошо известными в данной области для превращения спирта в амин (схема 7). Одним таким методом является превращение спирта в хлорид с использованием тионилхлорида. Затем хлорид превращают в амин, используя аммиак. Хлорид можно также превратить в азид, используя азид натрия, после чего указанный азид восстанавливают, например, при помощи реакции Стаудингера с использованием трифенилфосфина. Соединения формулы XII могут быть получены из альдегидов формулы XIII и 2-хлорпиразина в результате удаления защитной группы из вышеуказанного соединения при помощи сильного основания, такого как тетраметилпиперидин лития, в условиях, описанных в научной литературе (например, в публикации Bioorg. Med. Chem. 16, 1359, (2008)).
Схема 7

В процессе всех указанных превращений часть R1 может оставаться без изменения, может содержать защитную группу или может быть модифицирована. Примером модификации является превращение метоксильной группы в гидроксильную группу.
Настоящее изобретение проиллюстрировано следующими примерами.
ПРИМЕРЫ
Общие комментарии
Структуры, представленные в примерах, были преобразованы в названия с помощью программы ChemDraw, версия 9.0.7. Дескрипторы цис и транс были использованы для описания взаимосвязи между двумя лигандами, присоединенными для разделения атомов, соединенных двойной связью или находящихся в кольце (Pure and Applied Chemistry 68, 2193-2222 (1996)).
Спектры 1Н ЯМР были зарегистрированы в спектрометре Брукера (400 МГц) при использовании дейтерохлороформа в качестве растворителя за исключением особо оговоренных случаев. Химические сдвиги указаны в виде δ значений (миллионные доли) относительно тетраметилсилана в качестве внутреннего эталона.
МС: электрораспылительные спектры были зарегистрированы в масс-спектрометре ядерного квадрупольного резонанса с одинарной фокусировкой API-165 Applied Biosystems в чередующемся режиме положительных и отрицательных ионов с распылением потока. Диапазон масс составил 120-2000 Да, при этом сканирование производилось в пошаговом режиме, равном 0,2 Да, и капиллярное напряжение было задано равным 5000 В. Для распыления был использован газообразный N2.
Масс-спектрометрический детектор ЖХ-МС (Waters): PDA (200-320 нм), детектор массы: ZQ.
Элюенты: А: ацетонитрил с 0,05% трифторуксусной кислоты; В: ацетонитрил/вода = 1/9 (об./об.) с 0,05% трифторуксусной кислоты.
Колонка 1: Chromolith Performance, RP-18e, 4,6×100 мм
Градиентный метод: поток: 4 мл/мин
|
Колонка 2: XBridge C18, 3,5 мкм, 4,6×20 мм
Градиентный метод: поток: 4 мл/мин
|
СВЭЖХ: система Acquity UPLC (сверхпроизводительная жидкостная хроматография) компании Water; колонка: BEH С18 1,7 мкм, 2,1×100 мм, детектор: PDA (200-320 нм), детектор массы: SQD
Элюенты: А: ацетонитрил с 0,035% трифторуксусной кислоты; В: ацетонитрил/вода = 1/9 (об./об.) с 0,035% трифторуксусной кислоты.
|
Пример 1
N-[2-Метокси-4-[8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин]фенил]-1-метил-1Н-индол-2-карбоксамид
1а. Синтез N-[(3-хлор-2-пиразинил)метил](тетрагидро-2Н-пиран)-4-карбоксамида

Гидрохлорид 2-аминометил-3-хлорпиразина (содержание 70%; 133 ммоль, 17,36 г) растворяли в дихлорметане (200 мл) и добавляли N,N-диизопропилэтиламин (445 ммоль; 77 мл) и тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (133 ммоль, 42,8 г) (наблюдалось повышение температуры). Реакционную смесь перемешивали в течение 15 минут в атмосфере азота при комнатной температуре, добавляли тетрагидро-2Н-пиран-4-карбоновую кислоту (89 ммоль, 27,5 г) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем к реакционной смеси добавляли воду (600 мл). Образовавшуюся эмульсию фильтровали через декалит и промывали дихлорметаном и водой. Слои разделяли, органический слой промывали насыщенным раствором соли и водный слой дважды экстрагировали дихлорметаном. Органические слои объединяли и концентрировали досуха. Остаток растворяли в этилацетате и добавляли толуол. Этилацетат выпаривали и кристаллы собирали, получив при этом 9,25 г мелких серых игл указанного в заголовке соединения. В результате кристаллизации маточного раствора был получен второй сбор указанного в заголовке соединения в количестве 2,04 г.
1H ЯМР: δ 1,82-1,93 (м, 4H), 2,48-2,57 (м, 1H), 3,42-3,52 (м, 2H), 4,02-4,09 (м, 2H), 4,70 (д, J=4 Гц, 2H), 7,02 (ушир.с, 1H), 8,35 (д, J=2 Гц, 1H), 8,47 (д, J=2 Гц, 1H).
1b. Синтез 8-хлор-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина

К N-[(3-хлор-2-пиразинил)метил](тетрагидро-2Н-пиран)-4-карбоксамиду (43,8 ммоль, 11,2 г) в ацетонитриле (280 мл) при 55°С в атмосфере азота добавляли N,N-диметилформамид (25,7 ммоль, 2 мл) и оксихлорид фосфора (219 ммоль, 20,4 мл) (наблюдалось небольшое повышение температуры до 60°С). Через три часа реакционную смесь концентрировали досуха и дважды упаривали с толуолом. Остаток растворяли в ацетонитриле и по каплям добавляли к 7н раствору безводного аммиака в метаноле (140 мл). Смесь снова концентрировали и добавляли дихлорметан и насыщенный водный раствор гидрокарбоната натрия. Слои разделяли и водный слой дважды экстрагировали дихлорметаном. Органические слои объединяли и концентрировали досуха с образованием 10,48 г указанного в заголовке соединения. 2,2 грамма неочищенного продукта очищали хроматографией на колонке (силикагель, этилацетат), получив при этом 1,78 грамма 8-хлор-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина.
1H ЯМР: δ 1,87-1,96 (м, 2H), 2,10-2,22 (м, 2H), 3,20-3,29 (м, 1H), 3,58-3,65 (м, 2H), 4,12-4,18 (м, 2H), 7,35 (д, J=5 Гц, 1H), 7,65 (д, J=5 Гц, 1H), 7,82 (c, 1H).
1с. Синтез 8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина

Через суспензию 8-хлор-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина (2,23 ммоль, 531 мг) и карбоната калия (3,35 ммоль, 463 мг) в диоксане (1,5 мл) барботировали азот в течение 5 минут и затем триметилбороксин (4,47 ммоль, 1,249 мл, 50% мас. раствор в тетрагидрофуране) и добавляли комплекс хлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(II) с дихлорметаном (0,223 ммоль, 181 мг). Реакционную смесь нагревали при 100°С в течение одного часа, фильтровали и концентрировали в вакууме. Добавляли дихлорметан и воду, органический слой отделяли, сушили (сульфат натрия) и концентрировали в вакууме, получив при этом 374 мг 8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина.
1H ЯМР: δ 1,89-1,97 (м, 2H), 2,10-2,21 (м, 2H), 2,69 (c, 3H), 3,20-3,28 (м, 1H), 3,58-3,66 (м, 2H), 4,11-4,17 (м, 2H), 7,43 (д, J=5 Гц, 1H), 7,56 (д, J=5 Гц, 1H), 7,71 (c, 1H).
1d. Синтез 1-бром-8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина

К раствору 8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина (0,888 ммоль, 193 мг) в дихлорметане (10 мл) добавляли N-бромсукцинимид (0,888 ммоль, 158 мг) и реакционную смесь нагревали при 50°С (температура бани) в течение 15 минут. Добавляли дихлорметан и воду, органический слой отделяли, промывали водным раствором гидрокарбоната натрия, сушили (сульфат натрия) и концентрировали в вакууме, получив при этом 246 мг 1-бром-8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина.
1H ЯМР: δ 1,83-1,91 (м, 2H), 2,08-2,20 (м, 2H), 2,90 (c, 3H), 3,13-3,22 (м, 1H), 3,54-3,62 (м, 2H), 4,10-4,15 (м, 2H), 7,40 (д, J=5 Гц, 1H), 7,54 (д, J=5 Гц, 1H).
1е. Синтез N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида

1-Метилиндол-2-карбоновую кислоту (35,4 ммоль, 6,2 г) суспендировали в дихлорметане (300 мл), добавляли N,N-диметилформамид (0,389 ммоль, 0,030 мл) и смесь охлаждали до 0°С. Затем по каплям добавляли оксалилхлорид (38,9 ммоль, 3,70 мл) и суспензию перемешивали в течение 6 часов. Затем реакционную смесь упаривали досуха, получив при этом 1-метил-1Н-индол-2-карбонилхлорид (6,9 г).
К раствору 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (4,01 ммоль, 1 г) и 4-диметиламинопиридина (0,401 ммоль, 0,049 г) в дихлорметане (5 мл) и пиридине (5 мл) добавляли 1-метил-1Н-индол-2-карбонилхлорид (5,22 ммоль, 1,010 г) и полученный раствор перемешивали при комнатной температуре в течение четырех дней. Реакционную смесь концентрировали и упаривали с толуолом. К остатку добавляли дихлорметан и воду. Органический слой отделяли, сушили (сульфат натрия) и концентрировали в вакууме. Продукт очищали флэш-хроматографией (силикагель, дихлорметан), получив при этом N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (1,5 г).
Колонка для ЖХ-МС 1: Rt 5,05 мин (М+Н)+ = 407.
1f. Синтез N-[2-метокси-4-[8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин]фенил]-1-метил-1Н-индол-2-карбоксамида
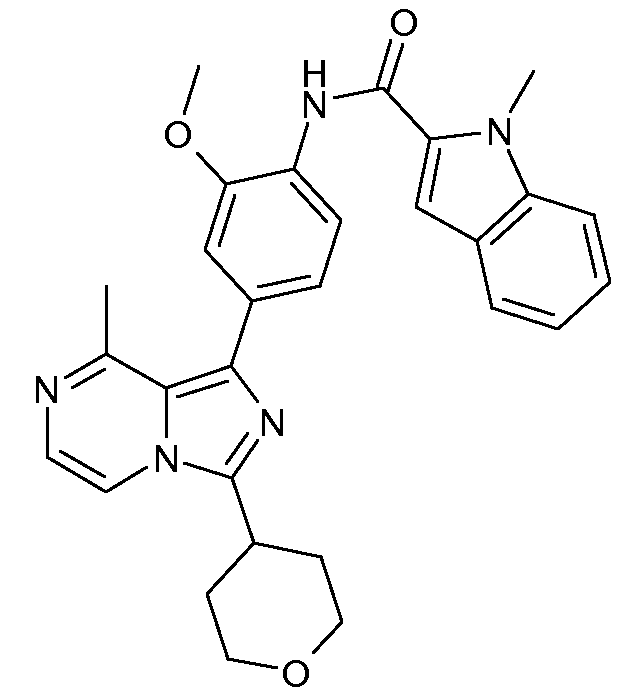
К раствору 1-бром-8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина (0,101 ммоль, 30 мг), и N-[2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1-метил-1Н-индол-2-карбоксамида (0,101 ммоль, 41,2 мг) в диоксане (1 мл) добавляли 2М раствор карбоната калия (водный) (0,406 ммоль, 203 мкл) и комплекс хлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(II) с дихлорметаном (0,020 ммоль, 16,38 мг). Реакционную смесь нагревали в микроволновой печи при 140°С в течение 12 минут. Добавляли дихлорметан и воду, органический слой отделяли, сушили (сульфат натрия) и концентрировали. Продукт очищали хроматографией на колонке (силикагель; градиент от гептанов/этилацетата, 3/10, до этилацетата), получив при этом 30 мг указанного в заголовке соединения.
1H ЯМР: δ 1,92-1,99 (м, 2H), 2,17-2,31 (м, 2H), 2,50 (c, 3H), 3,23-3,32 (м, 1H), 3,59-3,66 (м, 2H), 4,01 (c, 3H), 4,13-4,19 (м, 2H), 4,15 (c, 3H), 7,08 (c, 1H), 7,17-7,21 (м, 3H), 7,34-7,44 (м, 3H), 7,58 (д, J=5 Гц, 1H), 7,71 (д, J=8 Гц, 1H), 8,57 (д, J=9 Гц, 1H), 8,69 (ушир.с, 1H).
UPCL: метод 40_80; Rt = 0,96 мин, (М+Н)+ = 496.
Пример 2
N-(4-(3-((Транс)-4-(4-ацетилпиперазин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
2а. Синтез N-((3-хлорпиразин-2-ил)метил)-4-оксоциклогексанкарбоксамид

К перемешиваемой суспензии гидрохлорида 2-аминометил-3-хлорпиразина (3,89 ммоль, 0,70 г) в дихлорметане (25 мл) при комнатной температуре последовательно добавляли триэтиламин (7,78 ммоль, 1,08 мл), гексафторфосфат О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (4,67 ммоль, 1,77 г) и наконец 4-оксоциклогексанкарбоксилат (3,89 ммоль, 553 мг). Суспензию перемешивали в течение 16 часов и фильтровали через декалит. Декалит промывали дихлорметаном. Фильтрат промывали водой, сушили (сульфат натрия) и концентрировали в вакууме. Полученный неочищенный продукт очищали хроматографией на колонке с силикагелем (этилацетат). Продукт растворяли в дихлорметане, промывали водой и концентрировали в вакууме, получив при этом 1,09 г указанного в заголовке соединения.
1H ЯМР: δ 2,03-2,14 (м, 2H), 2,22-2,30 (м, 2H), 2,35-2,45 (м, 2H), 2,52-2,60 (м, 2H), 2,68-2,78 (м, 1H), 4,73 (д, J=4 Гц, 2H), 6,93 (ушир.с, 1H), 8,34-8,37 (м, 1H), 8,46 (д, J=2 Гц, 1H).
2b. Синтез бензил-4-[4-[(3-хлорпиразин-2-ил)метилкарбамоил]-циклогексил]пиперазин-1-карбоксилата

N-((3-хлорпиразин-2-ил)метил)-4-оксоциклогексанкарбоксамид (3,7 ммоль, 1 г) растворяли в дихлорметане (10 мл) и добавляли уксусную кислоту (0,1 мл). К полученному раствору последовательно добавляли бензил-1-пиперазинкарбоксилат (11,2 ммоль, 2,16 мл) и цианоборогидрид натрия (7,47 ммоль, 0,47 г). Смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь гасили водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Объединенные органические слои сушили над фазоразделяющим фильтром, концентрировали при пониженном давлении и очищали хроматографией на колонке (силикагель; дихлорметан/метанол), получив при этом 2,35 г указанного в заголовке соединения в виде смеси цис- и транс-изомеров, который использовали на следующей стадии без дальнейшей очистки.
Колонка для ЖХ-МС 1: Rt 2,78 мин, (М+Н)+ = 472, Rt 2,85 мин, (М+Н)+ = 472.
2с. Синтез бензил-транс-4-(4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил)пиперазин-1-карбоксилата
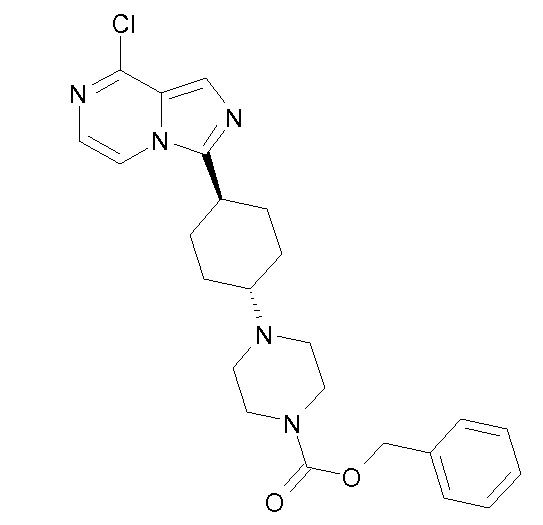
Бензил-4-[4-[(3-хлорпиразин-2-ил)метилкарбамоил]циклогексил]пиперазин-1-карбоксилат (4,03 ммоль, 1,9 г) подвергали взаимодействию при 70°С в течение одного часа способом, описанным в примере 1, стадия 1b, с образованием неочищенного продукта. Неочищенный продукт очищали хроматографией на колонке (силикагель; градиент толуола/ацетона от 85/15 с 0,1% триэтиламимна до 1/1 с последующим использованием дихлорметана/метанола, 4/1), получив при этом 0,14 г цис-изомера и 0,30 г указанного в заголовке соединения.
1H ЯМР: δ 1,38-1,54 (м, 2H), 1,79-1,91 (м, 2H), 2,04-2,17 (м, 4H), 2,43-2,64 (м, 5H), 2,83-2,95 (м, 1H), 3,50-3,58 (м, 4H), 5,14 (c, 2H), 7,14-7,39 (м, 6H), 7,60 (д, J=4 Гц, 1H), 7,79 (c, 1H).
2d. Синтез бензил-транс-4-(4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)пиперазин-1-карбоксилата
К бензил-транс-4-(4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил)пиперазин-1-карбоксилату (0,66 ммоль, 300 мг) и карбонату калия (0,991 ммоль, 137 мг) в диоксане (2 мл) добавляли триметилбороксин (1,982 ммоль, 0,559 мл, 50% мас. раствор в тетрагидрофуране) и в течение двух минут через суспензию барботировали азот. Затем добавляли комплекс хлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(II) с дихлорметаном (0,066 ммоль, 53,4 мг) и реакционную смесь перемешивали при 100°С. Через два часа реакционную смесь охлаждали, фильтровали через декалит, промывали этилацетатом и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке (силикагель; дихлорметан/метанол, 9/1), получив при этом 224 мг бензил-транс-4-(4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)пиперазин-1-карбоксилата.
1H ЯМР: δ 1,39-1,52 (м, 2H), 1,77-1,92 (м, 2H), 2,03-2,17 (м, 4H), 2,43-2,65 (м, 5H), 2,67 (c, 3H), 2,85-2,94 (м, 1H), 3,51-3,57 (м, 4H), 5,15 (c, 2H), 7,30-7,39 (м, 5H), 7,42 (д, J=4 Гц, 1H), 7,53 (д, J=4 Гц, 1H), 7,68 (c, 1H).
2е. Синтез 1-(4-((транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)пиперазин-1-ил)этанона

Бензил-транс-4-(4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил)пиперазин-1-карбоксилат (0,507 ммоль, 0,22 г) растворяли в 37% хлористоводородной кислоте (23,70 ммоль, 2 мл), перемешивали в течение 16 часов при комнатной температуре и добавляли воду (4 мл). Смесь промывали диэтиловым эфиром (5 мл), водную фракцию концентрировали при пониженном давлении и упаривали с этанолом и дихлорметаном, получив при этом 190 мг амина.
К указанному амину добавляли дихлорметан (2 мл), полученную суспензию перемешивали и охлаждали до 0°С. Добавляли триэтиламин (5,66 ммоль, 0,79 мл) и затем ацетилхлорид (0,849 ммоль, 0,061 мл). Ход реакции контролировали при помощи ЖХ-МС (Rt продукта: 0,49 мин). После полного превращения реакционную смесь гасили, добавляя насыщенный водный раствор гидрокарбоната натрия, и дважды экстрагировали дихлорметаном. Органические слои объединяли, сушили над фазоразделяющим фильтром и концентрировали при пониженном давлении. Продукт очищали хроматографией на силикагеле (градиент дихлорметана (содержащего 1% триэтиламина)/метанола от 100/0 до 85/15), получив при этом 144 мг указанного в заголовке соединения.
1H ЯМР: δ 1,40-1,57 (м, 2H), 1,79-1,92 (м, 2H), 2,05-2,18 (м, 4H), 2,11 (c, 3H), 2,48-2,72 (м, 5H), 2,77 (c, 3H), 2,86-2,96 (м, 1H), 3,47-3,71 (м, 4H), 7,42 (д, J=4 Гц, 1H), 7,54 (д, J=4 Гц, 1H), 7,68 (c, 1H).
2f. Синтез 1-(4-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)пиперазин-1-ил)этанона
К перемешиваемому раствору 1-(4-((транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)пиперазин-1-ил)этанона (0,422 ммоль, 144 мг) в N,N-диметилформамиде (2 мл) добавляли N-бромсукцинимид (0,422 ммоль, 75 мг). Реакционную смесь выдерживали в течение двух часов при 60°С, затем гасили насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали этилацетатом. Органические экстракты дважды промывали водой и насыщенным раствором соли, сушили (сульфат натрия) и концентрировали при пониженном давлении. Неочищенный продукт очищали хроматографией на колонке с силикагелем (дихлорметан/метанол), получив при этом 176 мг указанного в заголовке соединения.
1H ЯМР: δ 1,40-1,57 (м, 2H), 1,78-1,92 (м, 2H), 2,04-2,13 (м, 4H), 2,11 (c, 3H), 2,44-2,72 (м, 5H), 2,81-2,90 (м, 1H), 2,88 (c, 3H), 3,46-3,71 (м, 4H), 7,38 (д, J=4 Гц, 1H), 7,51 (д, J=4 Гц, 1H).
2g. Синтез 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида

К 4-метокси-1-метил-1Н-индол-2-карбоновой кислоте (24,4 ммоль, 5 г) и оксалилхлориду (24,4 ммоль, 2,3 мл) в дихлорметане (60 мл) добавляли N,N-диметилформамид (1,22 ммоль, 95 мкл) и смесь перемешивали при комнатной температуре до образования прозрачного раствора (примерно 4 часа). Смесь концентрировали в вакууме. Остаток, 4-метокси-1-метил-1Н-индол-2-карбонилхлорид, добавляли к раствору пинаконового эфира 4-амино-3-метоксифенилбороновой кислоты (24,2 ммоль, 6,03 г) и 4-диметиламинопиридина (2,419 ммоль, 0,296 г) в пиридине (30 мл) и дихлорметане (30 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи и разбавляли дихлорметаном и 2н раствором хлористоводородной кислоты. Органический слой отделяли и водный слой экстрагировали дихлорметаном. Объединенные органические слои сушили (сульфат натрия) и концентрировали в вакууме, получив при этом 10,55 г указанного в заголовке соединения.
1H ЯМР: δ 1,35 (c, 12H) 3,99 (c, 6H) 4,10 (c, 3H), 6,55 (д, J=9 Гц, 1H), 7,02 (д, J=9 Гц, 1H), 7,02 (c, 1H), 7,24-7,51 (м, 3H), 8,51 (д, J=9 Гц, 1H), 8,73 (ушир.с, 1H).
2h. Синтез N-(4-(3-((транс)-4-(4-ацетилпиперазин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамида
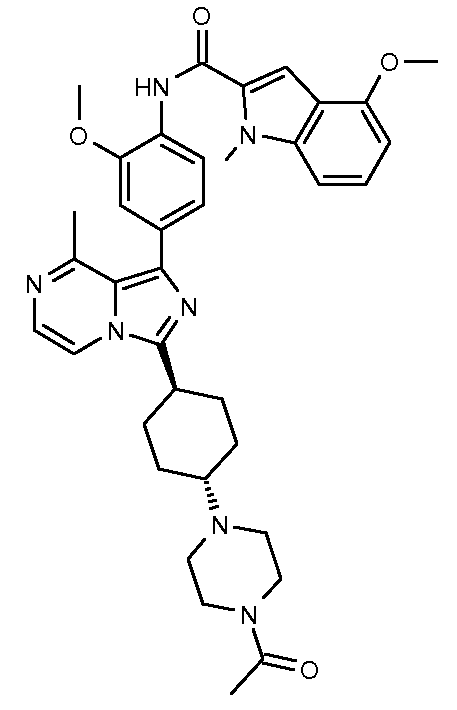
Способом, описанным в примере 1, стадия 1f, при использовании 1-(4-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)пиперазин-1-ил)этанона (0,059 ммоль, 25 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (0,059 ммоль, 26 мг) после очистки продукта препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды при постоянном содержании 0,003М трифторуксусной кислоты) было получено 11 мг указанного в заголовке соединения.
1H ЯМР: δ 1,35-2,15 (м, 8H), 2,03 (c, 3H), 2,41 (c, 3H), 2,42-2,58 (м, 5H), 2,83-2,93 (м, 1H), 3,40-3,59 (м, 4H), 3,93 (c, 3H), 3,94 (c, 3H), 4,06 (c, 3H), 6,50 (д, J=9 Гц, 1H), 6,97 (д, J=9 Гц, 1H), 7,08 (c, 1H), 7,09-7,23 (м, 3H), 7,36 (д, J=5 Гц, 1H), 7,54 (д, J=5 Гц, 1H), 8,49 (д, J=9 Гц, 1H), 8,61 (ушир.с, 1H).
СВЭЖХ: метод 0_60; Rt = 2,25 мин, (М+Н)+ = 650.
Пример 3
(S)-Пентан-2-ил-4-(3-(азетидин-1-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат
3а. Синтез N-((3-хлорпиразин-2-ил)метил)азетидин-1-карбоксамида

Перемешиваемый раствор трихлорметилхлорформиата (105 ммоль, 12,68 мл) в тетрагидрофуране (100 мл) охлаждали до 0°С и в течение 25 минут медленно добавляли раствор азетидина (88 ммоль, 5 г) и N,N-диизопропилэтиламина (193 ммоль, 33,6 мл) в тетрагидрофуране (100 мл). Смесь перемешивали при 0°С в течение одного часа, твердые вещества удаляли фильтрованием и фильтрат концентрировали под давлением 50 мбар (температура бани 50°С). Остаток добавляли к раствору гидрохлорида 2-аминометил-3-хлорпиразина (66,7 ммоль, 12 г) и триэтиламина (200 ммоль, 27,9 мл) в дихлорметане (200 мл) и реакционную смесь перемешивали в течение трех часов. Твердые вещества удаляли фильтрованием и фильтрат концентрировали в вакууме. Продукт очищали хроматографией на колонке (силикагель; градиент дихлорметана/метанола от 100:0 до 95:5), получив при этом 9,5 г N-((3-хлорпиразин-2-ил)метил)азетидин-1-карбоксамида.
1H ЯМР: δ 2,30 (квинтет, J=9 Гц, 2H), 4,06 (т, J=9 Гц, 4H), 4,66 (д, J=4 Гц, 2H), 5,3 (ушир.с, 1H), 8,29 (д, J=2 Гц, 1H), 8,45 (д, J=2 Гц, 1H).
3b. Синтез 3-(азетидин-1-ил)-8-хлоримидазо[1,5-a]пиразина

К перемешиваемому раствору N-((3-хлорпиразин-2-ил)метил)азетидин-1-карбоксамида (41,9 ммоль, 9,5 г) в ацетонитриле (130 мл) добавляли N,N-диметилформамид (7,12 ммоль, 0,55 мл), пиридин (419 ммоль, 33,8 мл) и затем оксихлорид фосфора (210 ммоль, 19,5 мл). Через 7 минут реакционную смесь гасили, добавляя к охлажденной (0°С) смеси 7н раствор безводного аммиака в метаноле (150 мл) и ацетонитрила (200 мл), и концентрировали в вакууме. Остаток растворяли в дихлорметане, добавляли воду (150 мл) и насыщенный водный раствор гидрокарбоната натрия (150 мл) и смесь шесть раз экстрагировали дихлорметаном (100 мл). Объединенные органические экстракты сушили (сульфат натрия) и концентрировали в вакууме. Продукт очищали хроматографией на колонке (силикагель; дихлорметан/метанол), получив при этом 4,5 г указанного в заголовке соединения.
1H ЯМР: δ 2,49 (квинтет, J=9 Гц, 2H), 4,23 (т, J=9 Гц, 4H), 7,07 (д, J=5 Гц, 1H), 7,27 (д, J=5 Гц, 1H), 7,53 (c, 1H).
3с. Синтез (S)-пентан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата
К пинаконовому эфиру 4-амино-3-метоксифенилбороновой кислоты (24,08 ммоль, 6 г) и углю (0,29 г) в этилацетате (50 мл) добавляли трихлорметилхлорформиат (48,2 ммоль, 5,81 мл) и смесь перемешивали при 70°С в течение двух часов. Смесь охлаждали до комнатной температуры, твердые вещества удаляли фильтрованием и фильтрат концентрировали в вакууме, получив при этом 6,7 г 2-(4-изоцианато-3-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана.
К раствору (S)-(+)-2-пентанола в дихлорметане добавляли молекулярные сита, 2-(4-изоцианато-3-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (9,09 ммоль, 2,5 г) и N,N-диметилпиридин-4-амин (1,82 ммоль, 0,22 г) и реакционную смесь перемешивали при 40°С в течение ночи. Твердые вещества удаляли фильтрованием, фильтрат концентрировали в вакууме и неочищенный продукт очищали хроматографией на колонке (силикагель; гептаны/этилацетат, 1/1), получив при этом 2,6 г указанного в заголовке соединения.
1H ЯМР: δ 0,93 (т, J=8 Гц, 3H), 1,25-1,70 (м, 4H), 1,28 (д, J=7 Гц, 3H), 1,35 (c, 12 H), 3,91 (c, 3H), 4,88-4,97 (м, 1H), 7,24-7,26 (м, 1H), 7,32 (ушир.с, 1H), 7,42-7,46 (м, 1H), 8,10-8,15 (м, 1H).
3d. Синтез (S)-пентан-2-ил-4-(3-(азетидин-1-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамата
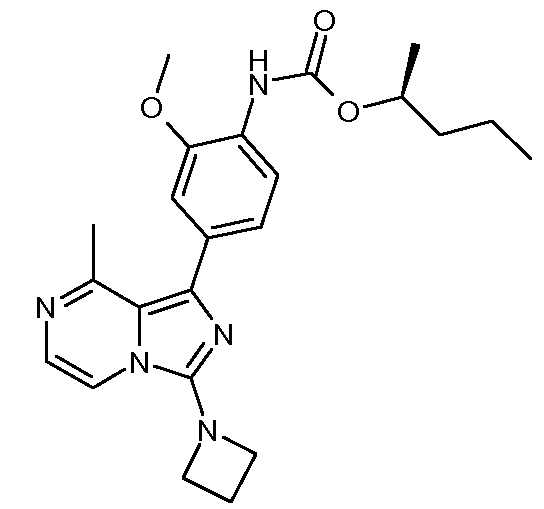
При использовании 3-(азетидин-1-ил)-8-хлоримидазо[1,5-a]пиразина (0,16 ммоль, 33 мг) способом, описанным в примере 2, стадия 2d, в примере 1, стадия 1d, и примере 2, стадия 2g (при использовании (S)-пентан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата на указанной последней стадии) было получено 11 мг указанного в заголовке соединения.
1H ЯМР: δ 0,94 (т, J=8 Гц, 3H), 1,25-1,72 (м, 4H), 1,30 (д, J=7 Гц, 3H), 2,38 (c, 3H), 2,48 (квинтет, J=9 Гц, 2H), 3,93 (c, 3H), 4,24 (т, J=9 Гц, 4H), 4,90-4,99 (м, 1H), 7,07-7,31 (м, 5H), 8,13-8,20 (м, 1H).
UPCL: метод 40_80: Rt = 1,15 мин, (М+Н)+ = 424.
Пример 4
(S)-Пентан-2-ил-4-3-((R)-1-(2-(диметиламимно)ацетил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат
4а. Синтез (R)-бензил-3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-имл)пирролидин-1-карбоксилата

Способом, описанным для получения N-[(3-хлор-2-пиразинил)метил]-(тетрагидро-2Н-пиран)4-карбоксамида (пример 1а), при использовании (R)-1-cbz-пирролидин-3-карбоновой кислоты (8,02 ммоль, 2 г) после очистки продукта хроматографией на колонке (силикагель, дихлорметан/метанол) был получен (R)-бензил-3-((3-хлорпиразин-2-ил)метилкарбамоил)пирролидин-1-карбоксилат (5,90 ммоль, 2,21 г).
(R)-бензил-3-((3-хлорпиразин-2-ил)метилкарбамоил)пирролидин-1-карбоксилат (5,90 ммоль, 2,21 г) растворяли в этилацетате (20 мл) и N,N-диметилформамиде (1,538 мл). Перемешиваемую реакционную смесь охлаждали до 0°С и добавляли оксихлорид фосфора (23,58 ммоль, 2,198 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, охлаждали до 0°С и добавляли избыток твердого гидрокарбоната натрия. Суспензию перемешивали 10 минут при 0°С и 20 минут при комнатной температуре. Затем смесь охлаждали до 0°С и добавляли воду. Органический слой отделяли и водный слой трижды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (сульфат натрия) и концентрировали в вакууме, получив при этом (R)-бензил-3-(8-хлоримидазо[1,5-a]пиразин-3-ил)пирролидин-1-карбоксилат (2,11 г).
Способом, описанным в примере 2, стадия 2b, при использовании (R)-бензил-3-(8-хлоримидазо[1,5-a]пиразин-3-ил)пирролидин-1-карбоксилата (2,11 г) после очистки продукта хроматографией на колонке (силикагель; дихлорметан/метанол) было получено 1,94 г (R)-бензил-3-(8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-карбоксилата.
К (R)-бензил-3-(8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-карбоксилату (1,332 ммоль, 448 мг) в N,N-диметилформамиде (5 мл) добавляли N-бромсукцинимид (1,332 ммоль, 237 мг). Реакционную смесь перемешивали при комнатной температуре в течение пяти минут, добавляли насыщенный водный раствор гидрокарбоната натрия, органический слой отделяли и водный слой трижды экстрагировали этилацетатом. Объединенные органические слои промывали водой, насыщенным раствором соли, сушили (сульфат натрия) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан/метанол (градиент от 0 до 10% метанола)), получив при этом (R)-бензил-3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-карбоксилат (531 мг).
Колонка для ЖХ-МС 1: Rt 3,11 мин, (М+Н)+ = 415 и 416 (хроматограмма с изотопом Br).
4b. Синтез (R)-1-(3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-ил)-2-(диметиламино)этанона

(R)-бензил-3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-карбоксилат (1,264 ммоль, 525 мг) растворяли в 37% хлористоводородной кислоте (76 ммоль, 6 мл) и перемешивали при комнатной температуре. Через четыре часа добавляли воду (10 мл) и смесь дважды промывали диэтиловым эфиром. Водный слой концентрировали при пониженном давлении и упаривали с толуолом и этанолом, получив при этом 0,42 г (R)-1-бром-8-метил-3-(пирролидин-3-ил)имидазо[1,5-a]пиразина в виде гидрохлорида. К 100 мг полученного вещества в дихлорметане (5 мл) и N,N-диизопропилэтиламине (1,778 ммоль, 0,31 мл) добавляли N,N-диметилглицин (0,534 ммоль, 55,0 мг) и гексафторфосфат О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU, 0,534 ммоль, 203 мг) и перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли дихлорметаном, промывали насыщенным водным раствором гидрокарбоната натрия, насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан/метанол (градиент 0→35% метанола)), получив при этом (R)-1-(3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-ил)-2-(диметиламино)этанон (77 мг).
Колонка для ЖХ-МС 1: Rt 0,50 мин, (М+Н)+ = 366 и 368 (хроматограмма с изотопом Br).
4с. Синтез (S)-пентан-2-ил-4-(3-((R)-1-(2-(диметиламино)ацетил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамата
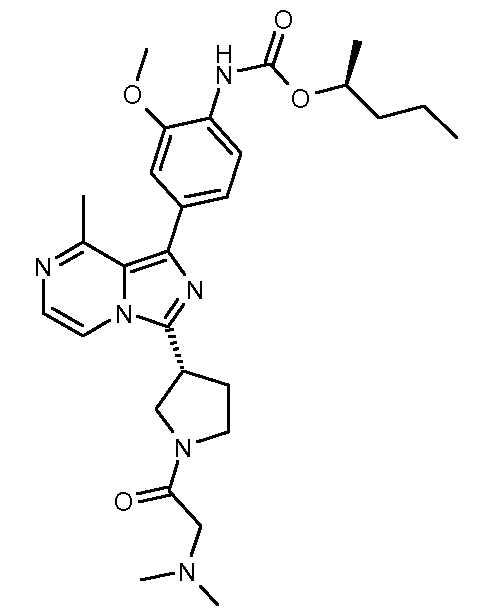
К раствору (R)-1-(3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-ил)-2-(диметиламино)этанона (0,068 ммоль, 25 мг) в диоксане (1,5 мл) добавляли 2н водный раствор карбоната калия (0,273 ммоль, 273 мкл), N-[2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1-метил-1Н-индол-2-карбоксамид (0,075 ммоль, 27,3 мг) и комплекс хлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(II) с дихлорметаном (0,014 ммоль, 11,04 мг). Реакционную смесь нагревали в микроволновой печи при 140°С в течение 12 минут. Добавляли ацетонитрил и сульфат натрия, смесь фильтровали и фильтрат концентрировали в вакууме. Продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды при постоянном содержании 0,003М трифторуксусной кислоты), получив при этом 9 мг указанного в заголовке соединения.
1H ЯМР: δ 0,8-1,8 (м, 10H), 2,32 (c, 3H), 2,35 (c, 3H), 2,48 (c, 3H), 2,3-2,8 (м, 3H), 3,06-3,22 (м, 3H), 3,51-4,19 (м, 4H), 3,93 (c, 3H), 7,08 (c, 1H), 7,05-7,12 (м, 2H), 7,25-7,29 (м, 1H), 7,44-7,60 (м, 2H), 8,2 (ушир.с, 1H).
СВЭЖХ: метод 0_60: Rt = 2,09 мин, (М+Н)+ = 523.
Пример 5
(Транс)-4-(1-(3-метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетат
5а. Синтез (транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетата

Гидрохлорид 2-аминометил-3-хлорпиразина (содержание 77%; 34,7 ммоль, 6,47 г), транс-4-гидроксициклогексанкарбоновую кислоту (34,7 ммоль, 5 г), N,N-диизопропилэтиламин (104 ммоль, 18,12 мл, 13,45 г), 4-диметиламинопиридин (3,47 ммоль, 0,424 г) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (45,1 ммоль, 8,64 г) в дихлорметане (100 мл) перемешивали при комнатной температуре. Через 16 часов реакционную смесь разбавляли 2н раствором хлористоводородной кислоты и трижды экстрагировали дихлорметаном. Органический слой сушили (сульфат натрия) и концентрировали в вакууме. Неочищенный продукт растирали в порошок в дихлорметане, получив при этом 2 г твердого (транс)-N-((3-хлорпиразин-2-ил)метил)-4-гидроксициклогексанкарбоксамида. Маточный раствор растворяли в этилацетате и промывали водным раствором гидрокарбоната натрия, сушили (сульфат натрия) и концентрировали, получив при этом дополнительно 0,7 г (транс)-N-((3-хлорпиразин-2-ил)метил)-4-гидроксициклогексанкарбоксамида.
Общее количество (транс)-N-((3-хлорпиразин-2-ил)метил)-4-гидроксициклогексанкарбоксамида (10 ммоль, 2,7 г) и 4-диметиламинопиридин (1,0 ммоль, 0,12 г) растворяли в пиридине (25 мл), добавляли уксусный ангидрид (10,51 ммоль, 0,994 мл) и смесь перемешивали при комнатной температуре. Через 1 час реакционную смесь гасили в 185 мл 2н раствора хлористоводородной кислоты (рН равно четырем) и трижды экстрагировали этилацетатом. Объединенные органические слои сушили (сульфат натрия) и концентрировали, получив при этом 2,8 г (транс)-4-((3-хлорпиразин-2-ил)метилкарбамоил)циклогексилацетата.
(Транс)-4-((3-хлорпиразин-2-ил)метилкарбамоил)циклогексилацетат (2,8 г) превращали в (транс)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексилацетат (2,2 г) способом, описанным в примере 1, стадия 1b, выполняя реакцию при температуре 60°С в течение 16 часов. При осуществлении взаимодействия вышеуказанного соединения (2,6 г) способом, описанным в примере 2, стадия 2d, был получен (транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетат (1,6 г).
1H ЯМР: δ 1,50-1,62 (м, 2H), 1,87-1,98 (м, 2H), 2,06-2,24 (м, 4H), 2,07 (c, 3H), 2,77 (c, 3H), 2,92-3,00 (м, 1H), 4,81-4,89 (м, 1H), 7,42 (д, J=5 Гц, 1H), 7,54 (д, J=5 Гц, 1H), 7,69 (c, 1H).
5b. Синтез (транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетата

К (транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетату (5,49 ммоль, 1,5 г) в N,N-диметилформамиде (15 мл) добавляли N-бромсукцинимид (5,49 ммоль, 0,977 г) и смесь перемешивали при комнатной температуре. Через один час добавляли насыщенный водный раствор гидрокарбоната натрия и трижды экстрагировали дихлорметаном. Объединенные органические экстракты сушили (сульфат натрия) и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке (силикагель; дихлорметан/метанол (градиент от 0 до 5% метанола), получив при этом указанное в заголовке соединение (1,8 г).
1H ЯМР: δ 1,47-1,59 (м, 2H), 1,86-1,97 (м, 2H), 2,03-2,11 (м, 2H), 2,07 (c, 3H), 2,16-2,23 (м, 2H), 2,86-2,97 (м, 1H), 2,89 (c, 3H), 4,78-4,88 (м, 1H), 7,39 (д, J=5 Гц, 1H), 7,51 (д, J=5 Гц, 1H).
5с. Синтез (транс)-4-(1-(3-метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетата
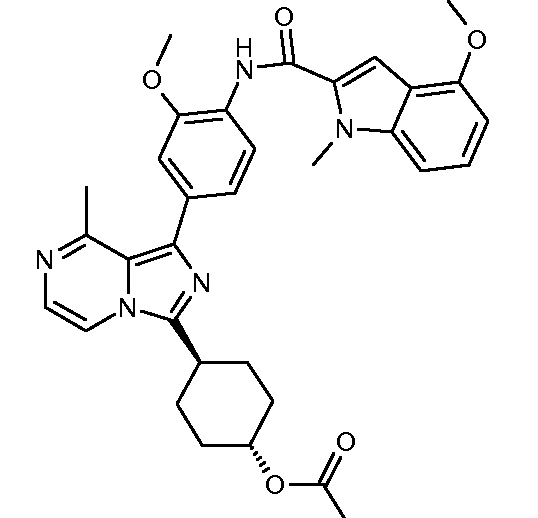
Способом, описанным в примере 1, стадия 1f, при использовании (транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетата (0,568 ммоль, 200 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (0,568 ммоль, 248 мг) после очистки продукта хроматографией на колонке (силикагель; градиент гептанов/этилацетата, 1/1, до этилацетата) было получено указанное в заголовке соединение (245 мг).
1H ЯМР:δ 1,51-1,63 (м, 2H), 1,96-2,27 (м, 6H), 2,08 (c, 3H), 2,50 (c, 3H), 2,96-3,04 (м, 1H), 4,00 (c, 6H), 4,12 (c, 3H), 4,82-4,89 (м, 1H), 6,58 (д, J=9 Гц, 1H), 7,03-7,31 (м, 5H), 7,43 (д, J=5 Гц, 1H), 7,55 (д, J=5 Гц, 1H), 8,57 (д, J=10 Гц, 1H), 8,69 (ушир.с, 1H).
СВЭЖХ: метод 40_80: Rt = 1,64 мин, (М+Н)+ = 582.
Пример 6
N-(4-(3-((Транс)-4-гидроксициклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид

К (транс)-4-(1-(3-метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетату (0,034 ммоль, 20 мг) в ацетонитриле (0,5 мл) и воде (0,5 мл) добавляли гидроксид калия (0,172 ммоль, 9,65 мг) и смесь перемешивали при 110°С. Через один час реакционную смесь нейтрализовали 2н раствором хлористоводородной кислоты и трижды экстрагировали дихлорметаном, объединенные органические слои сушили (сульфат натрия) и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке (силикагель; градиент от дихлорметана до дихлорметана/метанола, 25/1), получив при этом указанное в заголовке соединение (7 мг).
1H ЯМР: δ 1,45-1,63 (м, 2H), 1,88-2,22 (м, 6H), 2,49 (c, 3H), 2,92-3,00 (м, 1H), 3,77-3,83 (м, 1H), 4,00 (c, 3H), 4,01 (c, 3H), 4,12 (c, 3H), 6,57 (д, J=9 Гц, 1H), 7,02-7,31 (м, 5H), 7,42 (д, J=5 Гц, 1H), 7,56 (д, J=5 Гц, 1H), 8,56 (д, J=10 Гц, 1H), 8,69 (ушир.с, 1H).
СВЭЖХ: метод 40_80: Rt = 1,11 мин, (М+Н)+ = 540.
Пример 7
4-Метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
7а. Синтез (транс)-N-((3-хлорпиразин-2-ил)метил)-4-(4-метилпиперазин-1-ил)циклогексанкарбоксамида

К перемешиваемому раствору N-((3-хлорпиразин-2-ил)метил)-4-оксоциклогексанкарбоксамида (40,7 ммоль, 10,9 г) в дихлорметане (145 мл) и уксусной кислоте (1,450 мл) при комнатной температуре добавляли 1-метилпиперазин (52,9 ммоль, 5,87 мл, 5,30 г) и цианоборогидрид натрия (81 ммоль, 5,12 г). Реакционную смесь выдерживали в течение 16 часов при комнатной температуре, добавляли дихлорметан и насыщенный водный раствор гидрокарбоната натрия (15 мл) и органический слой отделяли. Органический слой промывали насыщенным раствором соли. Водные слои дважды промывали дихлорметаном и объединенные органические экстракты сушили (сульфат натрия). Смесь концентрировали в вакууме с образованием неочищенного продукта (смесь цис- и транс-изомеров), который очищали хроматографией на колонке (силикагель; градиент дихлорметана/метанола (от 0 до 20% метанола), получив при этом цис-изомер (275 мг), транс-изомер (2,5 г) и смесь цис- и транс-изомеров (5,5 г).
Транс-изомер: 1H ЯМР: δ 1,23-2,75 (м, 18H), 2,22 (c, 3H), 4,69 (д, J=5 Гц, 3H), 6,78-6,83 (м, 1H), 8,33 (д, J=3 Гц, 1H), 8,46 (д, J=3 Гц, 1H).
Цис-изомер: 1H ЯМР: δ 1,25-2,75 (м, 18H), 2,22 (c, 3H), 4,71 (д, J=5 Гц, 3H), 6,86-6,93 (м, 1H), 8,33 (д, J=3 Гц, 1H), 8,45 (д, J=3 Гц, 1H).
7b. Синтез 4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамида
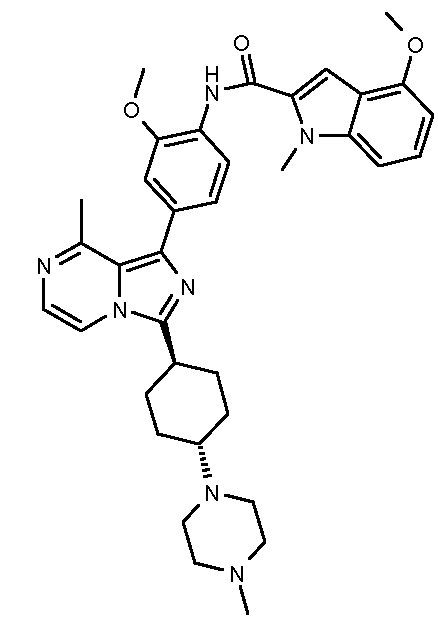
Способом, описанным в примере 1, стадия 1b, (транс)-N-((3-хлорпиразин-2-ил)метил)-4-(4-метилпиперазин-1-ил)циклогексанкарбоксамид (7,10 ммоль, 2,5 г) превращали в 8-хлор-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин. Неочищенный продукт очищали кристаллизацией из ацетона с образованием 8-хлор-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразина (0,98 г). Маточный раствор очищали хроматографией на колонке (силикагель; дихлорметан/градиент метанола от 0% до 20%), получив дополнительно 0,30 г 8-хлор-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразина.
Способом, описанным в примере 2, стадия 2d, при использовании 8-хлор-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразина (6,98 ммоль, 2,33 г) был получен 8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин (1,8 г).
К 8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразину (2,086 ммоль, 654 мг) в N,N-диметилформамиде (10 мл) добавляли N-бромсукцинимид (2,295 ммоль, 408 мг) и смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь упаривали досуха. Остаток растворяли в дихлорметане/метаноле, 9/1, (100 мл) и полученный раствор промывали смесью воды (2 мл), насыщенного водного раствора гидрокарбоната натрия (2 мл) и нескольких капель 2н раствора гидроксида натрия, органический слой сушили (сульфат натрия) и упаривали досуха, получив при этом неочищенный 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин (1,04 г).
К перемешиваемой суспензии 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразина (1,04 г) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (2,227 ммоль, 0,972 г) в диоксане (18 мл) и 2М водном растворе карбоната калия (10,6 ммоль, 5,3 мл) в атмосфере азота добавляли комплекс хлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(iI) с дихлорметаном (0,212 ммоль, 0,171 г) и реакционную смесь нагревали на предварительно нагретой масляной бане при 100°С. Через два часа реакционную смесь охлаждали до комнатной температуры, добавляли воду и экстрагировали дихлорметаном/метанолом, 9/1. Органический слой отделяли и водный слой экстрагировали дихлорметаном/метанолом, 9/1. Объединенные органические слои промывали насыщенным раствором соли, сушили (сульфат натрия) и упаривали досуха с образованием неочищенного продукта, который очищали хроматографией на колонке (силикагель; дихлорметан/градиент метанола (от 0 до 15% метанола)). Продукт растирали в порошок в этаноле, получив при этом 4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (0,44 г).
1H ЯМР: δ 1,42-2,77 (м, 17H), 2,32, (ушир.с, 3H), 2,48 (c, 3H), 2,89-2,99 (м, 1H), 4,00 (c, 3H), 4,01 (c, 3H), 4,12 (c, 3H), 6,57 (д, J=9 Гц, 1H), 7,03-7,31 (м, 5H), 7,42 (д, J=5 Гц, 1H), 7,54 (д, J=5 Гц, 1H), 8,56 (д, J=10 Гц, 1H), 8,68 (ушир.с, 1H).
СВЭЖХ: метод 0_60: Rt = 2,07 мин, (М+Н)+ = 622.
Пример 8
4-Метокси-N-(2-метокси-4-(8-метил-3-((цис)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
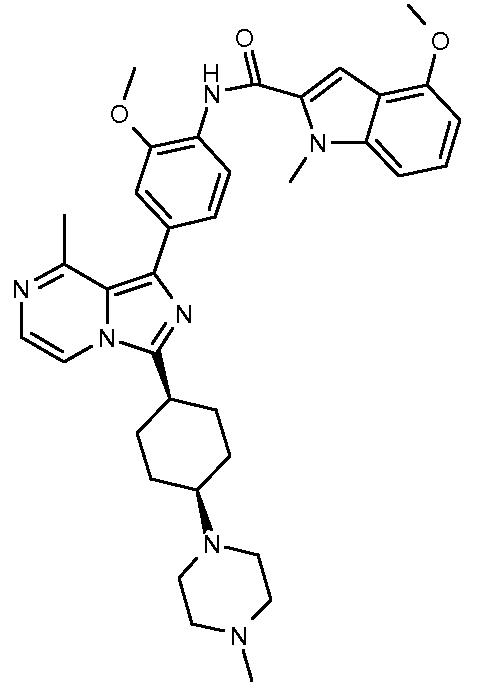
Указанное в заголовке соединение было получено способами, описанными в примере 7.
1H ЯМР: δ 1,4-3,5 (м, 18H), 2,32, (ушир.с, 3H), 2,50 (c, 3H), 2,89-2,99 (м, 1H), 4,00 (c, 3H), 4,01 (c, 3H), 4,13 (c, 3H), 6,57 (д, J=9 Гц, 1H), 7,03-7,33 (м, 5H), 7,41 (д, J=5 Гц, 1H), 7,66 (ушир.д, J=5 Гц, 1H), 8,57 (д, J=10 Гц, 1H), 8,68 (ушир.с, 1H).
СВЭЖХ: метод 0_60: Rt = 2,06 мин, (М+Н)+ = 622.
Пример 9
N-(4-(3-((Транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
9а. Синтез (транс)-N-((3-хлорпиразин-2-ил)метил)-4-(3,3-дифторазетидин-1-ил)циклогексанкарбоксамида
Гидрохлорид 3,3-дифторазетидина (5,60 ммоль, 0,726 г) растворяли в дихлорметане/метаноле (20 мл, 1/1) и добавляли 15 г карбоната кремния (Silicycle, наполнение 0,7 ммоль/г). Через 20 минут указанную взвесь вводили в колонку с 7 г карбоната кремния (Silicycle, наполнение 0,7 ммоль/г) и элюировали дихлорметаном/метанолом (40 мл, 1/1). Раствор концентрировали (900 мбар, баня 45°С) до объема, равного 30 мл. К полученному раствору добавляли N-((3-хлорпиразин-2-ил)метил)-4-оксоциклогексанкарбоксамид (3,74 ммоль, 1 г), уксусную кислоту (0,1 мл) и цианоборогидрид натрия (7,47 ммоль, 0,469 г) и реакционную смесь перемешивали при комнатной температуре. Через 3 дня реакционную смесь концентрировали, добавляли дихлорметан и промывали водным раствором гидрокарбоната натрия и водой. Оба водных слоя четыре раза экстрагировали дихлорметаном. Объединенные органические экстракты сушили (сульфат натрия) и концентрировали в вакууме. Продукт очищали хроматографией на колонке (силикагель; градиент от гептанов/этилацетата, 2/1, до этилацетата), получив при этом (транс)-N-((3-хлорпиразин-2-ил)метил)-4-(3,3-дифторазетидин-1-ил)циклогексанкарбоксамид (0,47 г) и (цис)-N-((3-хлорпиразин-2-ил)метил)-4-(3,3-дифторазетидин-1-ил)циклогексанкарбоксамид (0,49 г).
Транс-изомер: 1H ЯМР: δ 1,09-1,21 (м, 2H), 1,51-1,63 (м, 2H), 1,83-2,26 (м, 6H), 3,57 (т, J=11 Гц, 4H), 4,69 (д, J=5 Гц, 3H), 6,8 (ушир.с, 1H), 8,33 (д, J=3 Гц, 1H), 8,46 (д, J=3 Гц, 1H).
Цис-изомер: 1H ЯМР: δ 1,04-1,72 (м, 6H), 1,89-2,01 (м, 2H), 2,28-2,42 (м, 2H), 3,50 (т, J=12 Гц, 4H), 4,69 (д, J=5 Гц, 3H), 6,87 (ушир.с, 1H), 8,32 (д, J=3 Гц, 1H), 8,47 (д, J=3 Гц, 1H).
9b. Синтез N-(4-(3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамида

8-Хлор-3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)имидазо-[1,5-a]пиразин (0,405 г) был получен из (транс)-N-((3-хлорпиразин-2-ил)метил)-4-(3,3-дифторазетидин-1-ил)циклогексанкарбоксамида (0,46 г) способами, описанными в примере 3, стадия 3b, и очищен хроматографией на колонке (силикагель; этилацетат).
8-Хлор-3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)имидазо-[1,5-a]пиразин (0,40 г) был превращен в 3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин (336 мг) способами, описанными в примере 2, стадия 2b, и продукт был очищен хроматографией на колонке (силикагель; этилацетат/10% метанола).
1-Бром-3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин (374 мг) был получен из 3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразина (333 мг) способом, описанным в примере 2, стадия 2f.
Способом, описанным в примере 1, стадия 1f, при использовании 1-бром-3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразина (58 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан/метанол, 20/1) был получен N-(4-(3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (44 мг).
1H ЯМР: δ 1,23-1,37 (м, 2H), 1,85-2,28 (м, 7H), 2,49 (с, 3H), 2,90-3,00 (м, 1H), 3,60 (т, J=11 Гц, 4H), 4,00 (с, 3H), 4,01 (с, 3H), 4,12 (с, 3H), 6,57 (д, J=9 Гц, 1H), 7,02-7,32 (м, 5H), 7,43 (д, J=5 Гц, 1H), 7,55 (д, J=5 Гц, 1H), 8,57 (д, J=10 Гц, 1H), 8,68 (ушир.с, 1H).
СВЭЖХ: метод 0_60: Rt = 2,46 мин, (М+Н)+ = 615.
Пример 10
N-(4-(3-((Цис)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид

Указанное в заголовке соединение было получено способами, описанными в примере 9.
1H ЯМР: δ 1,56-2,54 (м, 9H), 2,48 (c, 3H), 3,02-3,11 (м, 1H), 3,53 (т, J=12 Гц, 4H), 4,00 (c, 3H), 4,01 (c, 3H), 4,12 (c, 3H), 6,57 (д, J=9 Гц, 1H), 7,02-7,31 (м, 5H), 7,41 (д, J=5 Гц, 1H), 7,58 (д, J=5 Гц, 1H), 8,57 (д, J=10 Гц, 1H), 8,69 (ушир.с, 1H).
СВЭЖХ: метод 0_60: Rt = 2,48 мин, (М+Н)+ = 615.
Пример 11
(S)-Пентан-2-ил-2-метокси-4-(3-((транс)-4-(2-метоксиэтиламино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат
11а. Синтез бензил-(транс)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил(2-метоксиэтил)карбамата

Способом, описанным в примере 7, стадия 7а, при использовании N-((3-хлорпиразин-2-ил)метил)-4-оксоциклогексанкарбоксамида (1 г) и 2-метоксиэтанамина (0,281 г) был получен N-((3-хлорпиразин-2-ил)метил)-4-(2-метоксиэтиламино)циклогексанкарбоксамид (1,15 г, смесь цис- и транс-изомеров).
К раствору N-((3-хлорпиразин-2-ил)метил)-4-(2-метоксиэтиламино)циклогексанкарбоксамида (3,15 ммоль, 1,03 г) в диоксане (10 мл) и воде (10 мл) добавляли триэтиламин (3,36 ммоль, 0,47 мл) и N-(бензилоксикарбонилокси)сукцинимид (3,31 ммоль, 825 мг). Смесь перемешивали в течение двух часов при комнатной температуре, добавляли воду и 2н раствор хлористоводородной кислоты (1,5 мл) и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали насыщенным водным раствором гидрокарбоната натрия, сушили (сульфат натрия) и концентрировали в вакууме, получив при этом бензил-4-((3-хлорпиразин-2-ил)метилкарбамоил)циклогексил(2-метоксиэтил)карбамат (1,45 г).
Способом, описанным в примере 2, стадия 2f, вышеуказанное соединение (1,45 г) было превращено в бензил-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил(2-метоксиэтил)карбамат после очистки продукта хроматографией на колонке (силикагель; дихлорметан/метанол, 20/1). В результате выполнения хроматографии на колонке (силикагель; гептаны/этилацетат, 1/1) было получено 337 мг смеси цис- и транс-изомеров и 422 мг в основном транс-изомера.
Транс-изомер: 1H ЯМР: δ 1,61-2,17 (м, 8H), 2,83-2,97 (м, 1H), 3,26-3,58 (м, 7H), 3,87-3,98 (м, 1H), 5,17 (c, 2H), 7,30-7,40 (м, 6H), 7,59 (д, J=5 Гц, 1H), 7,78 (c, 1H).
Цис-изомер: 1H ЯМР: δ 1,62-2,25 (м, 8H), 3,25-3,58 (м, 8H), 4,08-4,20 (м, 1H), 5,17 (c, 2H), 7,30-7,39 (м, 6H), 7,56 (д, J=5 Гц, 1H), 7,80 (ушир.с, 1H).
11b. Синтез (S)-пентан-2-ил-2-метокси-4-(3-((транс)-4-(2-метоксиэтиламино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамата

Способом, описанным в примере 2, стадия 2f, при использовании бензил-(транс)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил(2-метоксиэтил)карбамата (422 мг) после очистки продукта хроматографией на колонке (силикагель; градиент гептанов/этилацетата от 1/0 до 0/1) был получен бензил-2-метоксиэтил-((транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)карбамат (264 мг).
К раствору 2-метоксиэтил((транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)карбамата (264 мг) в дихлорметане добавляли N-бромсукцинимид (0,687 ммоль, 122 мг) и реакционную смесь нагревали при комнатной температуре в течение одного часа. Реакционную смесь промывали насыщенным водным раствором гидрокарбоната натрия, сушили (сульфат натрия) и концентрировали, получив при этом 295 мг бензил-(транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил(2-метоксиэтил)карбамата.
Полученное соединение (295 мг) растворяли в 37% хлористоводородной кислоте (3,4 мл), перемешивали в течение одного часа при комнатной температуре и добавляли воду (4 мл). Смесь дважды промывали диэтиловым эфиром (5 мл), водный слой охлаждали и подщелачивали 2н водным раствором гидроксида натрия. Основную водную смесь дважды экстрагировали дихлорметаном. Объединенные органические экстракты сушили (сульфат натрия) и концентрировали, получив при этом (транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-N-(2-метоксиэтил)циклогексанамин (188 мг).
Способом, описанным в примере 1, стадия 1f, при использовании вышеуказанного соединения (23 мг) и (S)-пентан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата (23 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан/метанол, 20/1) был получен (S)-пентан-2-ил-2-метокси-4-(3-((транс)-4-(2-метоксиэтиламино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат (9 мг).
1H ЯМР: δ 0,95 (т, J=8 Гц, 3H), 1,30 (д, J=7 Гц, 3H), 1,35-2,22 (м, 11H), 2,44 (c, 3H), 2,70-2,79 (м, 1H), 2,92-3,03 (м, 3H), 3,40 (c, 3H), 3,57-3,62 (м, 2H), 3,92 (c, 3H), 4,91-4,99 (м, 1H), 7,07-7,12 (м, 2H), 7,24-7,92 (м, 1H), 7,41 (д, J=5 Гц, 1H), 7,55 (д, J=5 Гц, 1H), 8,15-8,21 (м, 1H).
СВЭЖХ: метод 0_60: Rt = 2,46 мин, (М+Н)+ = 424.
Пример 12
N-(2-Метокси-4-(8-метил-3-((транс)-4-морфолиноциклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

Способом, описанным в примере 7, стадия 7а, при использовании N-((3-хлорпиразин-2-ил)метил)-4-оксоциклогексанкарбоксамида (1 г) и морфолина (0,44 мл) был получен N-((3-хлорпиразин-2-ил)метил)-4-морфолиноциклогексанкарбоксамид (1,28 г). Неочищенный продукт использовали на следующей стадии без дальнейшей очистки.
К N-((3-хлорпиразин-2-ил)метил)-4-морфолиноциклогексанкарбоксамиду (3,78 ммоль, 1,28 г) в ацетонитриле (20 мл) добавляли оксихлорид фосфора (18,9 ммоль, 1,71 мл) и нагревали при 70°С. Через четыре часа реакционную смесь концентрировали досуха и дважды упаривали с толуолом. Остаток растворяли в ацетонитриле и по каплям добавляли к 7н раствору безводного аммиака в метаноле (27 мл). Добавляли дихлорметан, смесь фильтровали и снова концентрировали. Неочищенный продукт (1,37 г) очищали через силикагель (толуол/ацетон, 15/85) и промывали колонку дихлорметаном/метанолом, 4/1, получив при этом 4-((цис)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил)морфолин (412 мг) и 4-((транс)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил)морфолин (387 мг), который содержал некоторое количество цис-изомера.
Способом, описанным в примере 2, стадия 2d, при использовании 4-((транс)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил)морфолина (387 мг) был получен 4-((транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)морфолин (238 мг), который все еще содержал некоторое количество цис-изомера после очистки хроматографией на колонке (силикагель; дихлорметан/метанол, 95/5). В результате дополнительной очистки 114 мг вышеуказанного вещества было получено 94 мг 4-((транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)морфолина.
Способом, описанным в примере 2, стадия 2f, при использовании 4-((транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)морфолина (91 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан/градиент метанола от 0 до 15%) был получен 4-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)морфолин (87 мг).
Способом, описанным в примере 1, стадия 1f, при использовании вышеуказанного соединения (40 мг) и N-[2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1-метил-1Н-индол-2-карбоксамида (47 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан/градиент метанола от 0 до 15%) был получен N-(2-метокси-4-(8-метил-3-((транс)-4-морфолиноциклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (37 мг).
1H ЯМР: δ 1,40-1,53 (м, 2H), 1,88-2,00 (м, 2H), 2,11-2,21 (м, 4H), 2,37-2,46 (м, 1H), 2,48 (c, 3H), 2,60-2,65 (м, 4H), 2,90-2,99 (м, 1H), 3,73-3,78 (м, 4H), 4,00 (c, 3H), 4,14 (c, 3H), 7,08 (c, 1H), 7,16-7,46 (м, 6H), 7,55 (д, J=5 Гц, 1H), 7,71 (д, J=5 Гц, 1H), 8,77 (д, J=9 Гц, 1H), 8,68 (ушир.с, 1H).
СВЭЖХ: метод 0_60: Rt = 2,28 мин, (М+Н)+ = 579.
Пример 13
4-Метокси-N-(2-метокси-4-(8-метил-3-(3-метилоксетан-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
13а. Синтез N-((3-хлорпиразин-2-ил)метил)-3-метилоксетан-3-карбоксамида

К перемешиваемой суспензии гидрохлорида 2-аминометил-3-хлорпиразина (содержание 77%; 4,34 ммоль, 0,81 г) в дихлорметане (150 мл) добавляли 3-метил-2-оксетанкарбоновую кислоту (4,34 ммоль, 0,504 г), триэтиламин (9,56 ммоль, 1,33 мл), 4-диметиламинопиридин (0,434 ммоль, 0,053 г) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (8,69 ммоль, 1,67 г). Суспензию перемешивали в течение 16 часов при комнатной температуре, фильтровали через декалит и промывали декалит дихлорметаном. Объединенные фильтраты промывали 0,3н раствором хлористоводородной кислоты (350 мл), 0,03н раствором хлористоводородной кислоты (350 мл) и водным раствором гидрокарбоната натрия. Все водные слои дважды экстрагировали дихлорметаном. Объединенные органические экстракты сушили (сульфат натрия) и концентрировали в вакууме с образованием неочищенного вещества. Ко всем водным слоям добавляли твердый хлорид натрия и пять раз экстрагировали дихлорметаном. Объединенные органические экстракты сушили (сульфат натрия) и концентрировали в вакууме, в результате чего была получена вторая порция неочищенного вещества. Объединенные неочищенные продукты очищали хроматографией (силикагель, этилацетат), получив при этом N-((3-хлорпиразин-2-ил)метил)-3-метилоксетан-3-карбоксамид (0,58 г).
1H ЯМР: δ 1,68 (c, 3H), 4,52 (д, J=6 Гц, 2H), 4,76 (д, J=5 Гц, 2H), 4,98 (д, J=6 Гц, 2H), 7,13 (ушир.с, 1H), 8,35 (д, J=2 Гц, 1H), 8,47 (д, J=2 Гц, 1H).
13b. Синтез 4-метокси-N-(2-метокси-4-(8-метил-3-(3-метилоксетан-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамида

К перемешиваемому раствору N-((3-хлорпиразин-2-ил)метил)-3-метилоксетан-3-карбоксамида (1,945 ммоль, 0,47 г) в дихлорметане (10 мл), охлаждаемому на бане со льдом, добавляли пиридин (27,2 ммоль, 2,198 мл) и трифторметансульфоновый ангидрид (11,67 ммоль, 1,971 мл). Баню со льдом удаляли и реакционную смесь перемешивали при комнатной температуре. Через 2 часа реакционную смесь охлаждали на бане со льдом, разбавляли этилацетатом (5 мл) и гасили водным раствором гидрокарбоната натрия. Органический слой отделяли и водный слой четыре раза промывали этилацетатом. Объединенные органические экстракты сушили (сульфат натрия) и концентрировали в вакууме. Продукт очищали хроматографией на колонке (силикагель, этилацетат), получив при этом 8-хлор-3-(3-метилоксетан-3-ил)имидазо[1,5-a]пиразин (0,56 г).
Способом, описанным в примере 2, стадия 2d, при использовании 8-хлор-3-(3-метилоксетан-3-ил)имидазо[1,5-a]пиразина (0,5 г) после очистки продукта хроматографией на колонке (силикагель; этилацетат/метанол, 9/1) был получен 8-метил-3-(3-метилоксетан-3-ил)имидазо[1,5-a]пиразин (0,56 г).
Способом, описанным в примере 2, стадия 2f, при использовании 8-метил-3-(3-метилоксетан-3-ил)имидазо[1,5-a]пиразина (0,2 г) после очистки продукта хроматографией на колонке (силикагель; дихлорметан/метанол = 100/3) был получен 1-бром-8-метил-3-(3-метилоксетан-3-ил)имидазо[1,5-a]пиразин (88 мг).
Способом, описанным в примере 1, стадия 1f, при использовании 1-бром-8-метил-3-(3-метилоксетан-3-ил)имидазо[1,5-a]пиразина (40 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (68 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан/метанол = 100/3) был получен 4-метокси-N-(2-метокси-4-(8-метил-3-(3-метилоксетан-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил-1-метил-1Н-индол-2-карбоксамид (44 мг).
1H ЯМР: δ 1,91 (c, 3H), 2,53 (c, 3H), 4,01 (c, 6H), 4,13 (c, 3H), 4,83 (д, J=5 Гц, 2H), 5,53 (д, J=5 Гц, 2H), 6,57 (д, J=9 Гц, 1H), 7,03-7,31 (м, 5H), 7,37 (д, J=5 Гц, 1H), 7,46 (д, J=5 Гц, 1H), 8,58 (д, J=9 Гц, 1H), 8,69 (ушир.с, 1H).
СВЭЖХ: метод 40_80: Rt = 1,07 мин, (М+Н)+ = 512.
Пример 14
N-(4-(3-Гидроксиметил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
14а. Синтез 1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)метанола
Способом, описанным в примере 13, стадия 13а, при использовании ацетоксиуксусной кислоты (0,667 г) и гидрохлорида 2-аминометил-3-хлорпиразина (содержание 77%; 0,81 г) после очистки продукта хроматографией на колонке (силикагель; градиент от дихлорметана до дихлорметана/этилацетата, 1/1) был получен 2-((3-хлорпиразин-2-ил)метиламино)-2-оксоэтилацетат (0,99 г).
2-((3-Хлорпиразин-2-ил)метиламино)-2-оксоэтилацетат (0,765 г) превращали в (8-хлоримидазо[1,5-a]пиразин-3-ил)метилацетат (0,11 г) способами, описанными в примере 3, стадия 3b, при использовании оксихлорида фосфора в ацетонитриле и пиридина без N,N-диметилформамида и после очистки продукта хроматографией на колонке (силикагель; дихлорметан/этилацетат, 1/1).
Способом, описанным в примере 2, стадия 2d, при использовании (8-хлоримидазо[1,5-a]пиразин-3-ил)метилацетата (0,19 г) после очистки продукта хроматографией на колонке (силикагель; этилацетат/метанол, 9/1) был получен (8-метилимидазо[1,5-a]пиразин-3-ил)метилацетат (153 мг).
Способом, описанным в примере 2, стадия 2f, при использовании (8-метилимидазо[1,5-a]пиразин-3-ил)метилацетата (0,15 г) после очистки продукта хроматографией на колонке (силикагель; этилацетат) был получен (1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)метилацетат (0,19 г).
К (1-бром-8-метилимидазо[1,5-а]пиразин-3-ил)метилацетату (0,669 ммоль, 0,19 г) в этаноле (1 мл) добавляли 2М раствор гидроксида натрия (1,337 ммоль, 0,669 мл). Смесь выдерживали при комнатной температуре в течение 15 минут и добавляли 2М раствор хлористоводородной кислоты (0,4 мл). Затем добавляли насыщенный водный раствор гидрокарбоната натрия (3 мл) и смесь четыре раза экстрагировали этилацетатом. Экстракты сушили (сульфат натрия) и концентрировали в вакууме, получив при этом 1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)метанол (145 мг).
1H ЯМР: δ 2,30 (т, J=7 Гц, 1H), 2,92 (c, 3H), 5,02 (д, J=7 Гц, 2H), 7,48 (д, J=5 Гц, 1H), 7,85 (д, J=5 Гц, 1H).
14b. Синтез N-(4-(3-(гидроксиметил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамида

Способом, описанным в примере 1, стадия 1f, при использовании (1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)метанола (25 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (50 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%) был получен N-(4-(3-гидроксиметил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (31 мг).
1H ЯМР: δ 2,53 (c, 3H), 3,99 (c, 3H), 4,01 (c, 3H), 4,12 (c, 3H), 5,08 (ушир.с, 2H), 6,57 (д, J=9 Гц, 1H), 7,03-7,32 (м, 5H), 7,49 (д, J=5 Гц, 1H), 7,84 (д, J=5 Гц, 1H), 8,57 (д, J=9 Гц, 1H), 8,68 (ушир.с, 1H).
СВЭЖХ: метод 40_80: Rt = 1,04 мин, (М+Н)+ = 472.
Пример 15
N-(4-(3-((1Н-имидазол-1-ил)метил)-8-метилимидазо[1,5-a]пиразин-1-ил)2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
15а. Синтез 3-((1Н-имидазол-1-ил)метил)-1-бром-8-метилимидазо[1,5-a]пиразина

К суспензии 1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)метанола (0,475 ммоль, 115 мг) в дихлорметане (5 мл) при 0°С добавляли тионилхлорид (0,950 ммоль, 0,069 мл). Реакционную смесь оставляли нагреваться до комнатной температуры и добавляли ацетонитрил (4 мл). Через один час добавляли имидазол (2,375 ммоль, 162 мг) и еще через один час добавляли триэтиламин (1,900 ммоль, 0,265 мл). Реакционную смесь перемешивали в течение 3 дней при комнатной температуре и концентрировали в вакууме. К остатку добавляли дихлорметан и насыщенный водный раствор гидрокарбоната натрия. Органический слой отделяли и водный слой дважды промывали дихлорметаном. Объединенные органические экстракты сушили (сульфат натрия) и концентрировали в вакууме. Продукт очищали хроматографией на колонке (силикагель; дихлорметан/метанол, 10/1), получив при этом 3-((1Н-имидазол-1-ил)метил)-1-бром-8-метилимидазо[1,5-a]пиразин (0,11 г).
1H ЯМР: δ 2,94 (c, 3H), 5,52 (c, 2H), 6,94-7,70 (м, 5H).
15b. Синтез N-(4-(3-((1Н-имидазол-1-ил)метил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамида
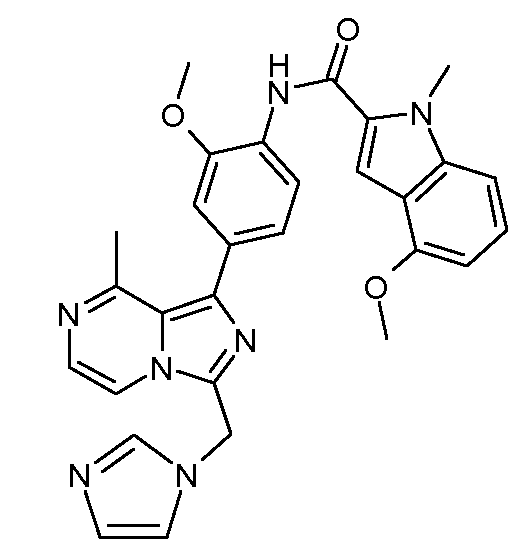
Способом, описанным в примере 1, стадия 1f, при использовании 3-((1Н-имидазол-1-ил)метил)-1-бром-8-метилимидазо[1,5-a]пиразина (32 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (60 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 10 до 17%) был получен N-(4-(3-((1Н-имидазол-1-ил)метил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (35 мг).
1H ЯМР: δ 2,56 (c, 3H), 4,01 (c, 3H), 4,03 (c, 3H), 4,13 (c, 3H), 5,60 (c, 2H), 6,57 (д, J=9 Гц, 1H), 7,00-7,68 (м, 9H), 8,62 (д, J=9 Гц, 1H), 8,71 (ушир.с, 1H).
СВЭЖХ: метод 0_60: Rt = 2,26 мин, (М+Н)+ = 522.
Пример 16
4-Метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)азетидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
16а. Синтез бензил-3-((3-хлорпиразин-2-ил)метилкарбамоил)азетидин-1-карбоксилата
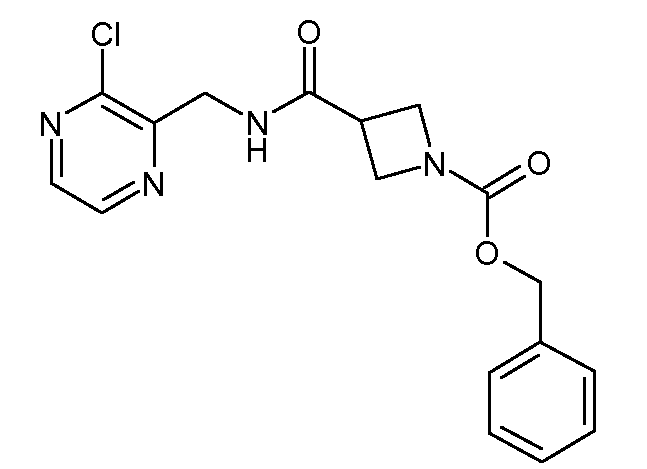
К азетидин-3-карбоновой кислоте (49,5 ммоль, 5 г) в диоксане (150 мл), воде (150 мл) и триэтиламине (54,4 ммоль, 7,58 мл) добавляли N-(бензилоксикарбонилокси)сукцинимид (51,9 ммоль, 12,94 г) и перемешивали при комнатной температуре в течение получаса. Реакционную смесь гасили водой и 30 мл 2н раствора хлористоводородной кислоты и трижды экстрагировали дихлорметаном. Органические слои объединяли, фильтровали через фазоразделяющий фильтр и концентрировали в вакууме. Остаток растворяли в дихлорметане и трижды экстрагировали насыщенным водным раствором гидрокарбоната натрия. Водные слои объединяли, подкисляли 2н раствором хлористоводородной кислоты и трижды экстрагировали дихлорметаном. Органические слои объединяли, промывали насыщенным раствором соли, фильтровали через фазоразделяющий фильтр и концентрировали в вакууме, получив при этом 1-(бензилоксикарбонил)азетидин-3-карбоновую кислоту (10,27 г).
К раствору 1-(бензилоксикарбонил)азетидин-3-карбоновой кислоты (21,25 ммоль, 5 г) в дихлорметане (60 мл) в атмосфере азота добавляли N,N-диметилформамид (1,063 ммоль, 0,083 мл) и оксалилхлорид (2М раствор в дихлорметане, 25,00 ммоль, 12,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение двух часов и концентрировали в вакууме, получив при этом 5,53 грамма неочищенного бензил-3-(хлоркарбонил)азетидин-1-карбоксилата.
N,N-диизопропилэтиламин (109 ммоль, 18,01 мл) и раствор бензил-3-(хлоркарбонил)азетидин-1-карбоксилата (5,53 г) в дихлорметане (32,5 мл) добавляли к перемешиваемой суспензии гидрохлорида 2-аминометил-3-хлорпиразина (содержание 77%; 21,80 ммоль, 5,10 г) в дихлорметане (55 мл) при комнатной температуре с образованием темно-коричневого раствора. Реакционную смесь перемешивали при комнатной температуре в течение двух часов, гасили водой и фильтровали через декалит. Слои разделяли, к водному слою добавляли насыщенный водный раствор гидрокарбоната натрия и трижды экстрагировали дихлорметаном. Органические слои объединяли, промывали насыщенным раствором соли, сушили (сульфат натрия) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан/градиент метанола от 10/0 до 9/1), получив при этом бензил-3-((3-хлорпиразин-2-ил)метилкарбамоил)-азетидин-1-карбоксилат (6,46 г).
1Н ЯМР: δ 3,37-3,45 (м, 1H), 4,16-4,30 (м, 4H), 4,71 (д, J=5 Гц, 2H), 5,10 (c, 2H), 6,92-6,97 (м, 1H), 7,28-7,47 (м, 5H), 8,33 (д, J=2 Гц, 1H), 8,44 (д, J=2 Гц, 1H).
16b. Синтез 4-метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)азетидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид; IDR 0998, IDR 0993, IDR 0988, IDR 0989, IDR 0983, IDR 0981
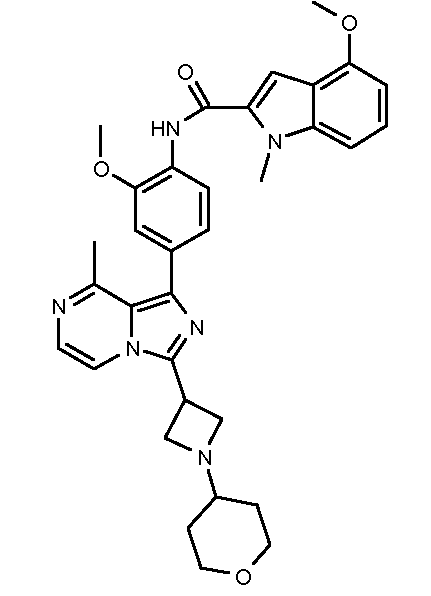
Бензил-3-((3-хлорпиразин-2-ил)метилкарбамоил)азетидин-1-карбоксилат (5,88 г) превращали в бензил-3-(8-хлоримидазо[1,5-a]пиразин-3-ил)азетидин-1-карбоксилат (4,99 г) способами, описанными в примере 3, стадия 3b, перемешивая реакционную смесь при комнатной температуре в течение одного часа и очищая полученный продукт хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%).
Способом, описанным в примере 2, стадия 2d, при использовании 3-(8-хлоримидазо[1,5-a]пиразин-3-ил)азетидин-1-карбоксилата (4,99 г) после очистки продукта хроматографией на колонке (силикагель; дихлорметан/градиент метанола от 95/5 до 8/2) был получен бензил-3-(8-метилимидазо[1,5-a]пиразин-3-ил)азетидин-1-карбоксилат (3,98 г).
Способом, описанным в примере 2, стадия 2f, при использовании бензил-3-(8-метилимидазо[1,5-a]пиразин-3-ил)азетидин-1-карбоксилата (1 г) после очистки продукта хроматографией на колонке (силикагель; дихлорметан/градиент метанола от 10/0 до 9/1) был получен бензил-3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)азетидин-1-карбоксилат (1,58 г).
Бензил-3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)азетидин-1-карбоксилат (1,58 г) растворяли в 37% хлористоводородной кислоте (14,84 мл) и перемешивали при комнатной температуре. Через один час реакционную смесь концентрировали в вакууме и упаривали с толуолом. Затем остаток растворяли в дихлорметане/метаноле, добавляли 15 граммов карбоната кремния (0,77 ммоль/грамм) и суспензию перемешивали в течение 15 минут. Суспензию фильтровали, твердые вещества промывали метанолом и фильтрат концентрировали в вакууме, получив при этом неочищенный 3-(азетидин-3-ил)-1-бром-8-метилимидазо[1,5-a]пиразин (1,1 г).
К тетрагидро-4Н-пиран-4-ону (3,74 ммоль, 0,346 мл) в дихлорметане (5 мл) и уксусной кислоте (0,306 мл) добавляли 3-(азетидин-3-ил)-1-бром-8-метилимидазо[1,5-a]пиразин (1,872 ммоль, 500 мг) в дихлорметане (10 мл), перемешивали в течение 20 минут в атмосфере азота при комнатной температуре и порциями добавляли цианоборогидрид натрия (3,74 ммоль, 235 мг). Через один час реакционную смесь гасили водой, добавляли насыщенный водный раствор гидрокарбоната натрия (рН реакционной смеси ~7) и затем 2М раствор гидроксида натрия до достижения рН 11 и трижды экстрагировали дихлорметаном. Органические слои объединяли, фильтровали через фазоразделяющий фильтр и концентрировали в вакууме. Продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%), получив при этом 1-бром-8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)азетидин-3-ил)имидазо[1,5-a]пиразин (38 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 1-бром-8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)азетидин-3-ил)имидазо[1,5-a]пиразина (37,8 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1H-индол-2-карбоксамида (47,0 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 10 до 15%) было получено 83 мг продукта с примесями. В результате дополнительной очистки препаративной ВЭЖХ (колонка Luna С18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003 М трифторуксусной кислоты) было получено 6 мг 4-метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)азетидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1H-индол-2-карбоксамида.
1H ЯМР: δ 1,35-1, 77 (м, 4H), 2,42-2, 52 (м, 1H), 2,50 (с, 3H), 3,36-3, 44 (м, 2H), 3,57-3, 63 (м, 2H), 3,87-4,14 (м, 5H), 4,01 (с, 6H), 4,13 (с, 3H), 6,57 (д, J=9 Гц, 1H), 7,03-7, 32 (м, 5H), 7,46 (д, J=5 Гц, 1H), 7,65 (д, J=5 Гц, 1H), 8,58 (д, J=9 Гц, 1H), 8,69 (ушир. с, 1H).
СВЭЖХ: метод 0_60: Rt=2,43 мин, (М+Н)+=581.
Пример 17
4-Метокси-N-(2-метокси-4-(8-метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1H-индол-2-карбоксамид

Способами, описанными в примере 16, стадия 16a, 1-[(бензилокси)карбонил]пиперидин-4-карбоновая кислота (2,5 г) была превращена в 2,75 г неочищенного бензил-4-(хлоркарбонил)пиперидин-1-карбоксилата, после чего вышеуказанное соединение связывали с гидрохлоридом 2-аминометил-3-хлорпиразина (содержание 77%; 2,28 г), и после очистки продукта хроматографией на колонке (силикагель; дихлорметан/градиент метанола от 100/0 до 90/10) был получен бензил-4-((3-хлорпиразин-2-ил)мсетилкарбамоил)пиперидин-1-карбоксилат (3,08 г).
Бензил-4-((3-хлорпиразин-2-ил)метилкарбамоил)пиперидин-1-карбоксилат (3,08 г) превращали в бензил-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилат (2,97 г) способами, описанными в примере 1, стадия 1b, перемешивая реакционную смесь при 70°С в течение 1,5 часа и очищая продукт хроматографией на колонке (силикагель; димхлорметан с градиентом метанола от 0 до 10%).
Бензил-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилат (2 г) превращали в бензил-4-(8-метилимидазо[1,5-а]пиразин-3-ил)пиперидин-1-карбоксилат (1,50 г) способом, описанным в примере 2, стадия 2d, экстрагируя реакционную смесь этилацетатом/насыщенным водным раствором гидрокарбоната натрия и очищая продукт хроматографией на колонке (силикагель; дихлорметан/градиент метанола от 10/0 до 9/1).
Способом, описанным в примере 2, стадия 2f, при использовании бензил-4-(8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилата (165 мг) и осуществлении реакции при комнатной температуре без очистки продукта хроматографией на колонке был получен неочищенный бензил-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилат (239 мг), который использовали на следующей стадии без очистки.
Бензил-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилат (0,471 ммоль, 202 мг) растворяли в 37% хлористоводородной кислоте (32,9 ммоль, 2,745 мл). Реакционную смесь перемешивали при комнатной температуре в течение одного часа. Добавляли воду и водную смесь дважды промывали диэтиловым эфиром. Водный слой подщелачивали водным раствором гидроксида натрия и дважды экстрагировали дихлорметаном. Объединенные органические экстракты сушили (сульфат натрия) и концентрировали в вакууме, получив при этом 1-бром-8-метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразин (100 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 1-бром-8-метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразина (30 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (44 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%) было получено 18 мг продукта с примесями. В результате дополнительной очистки препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты) было получено 3,3 мг 4-метокси-N-(2-метокси-4-(8-метил-3-(пиперидин-4-ил)имидазо[1,5-a[пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамида.
СВЭЖХ: метод 0_60: Rt = 2,15 мин, (М+Н)+ = 525.
Пример 18
N-(4-(3-(1-(2-(Диметиламино)-2-оксоэтил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид
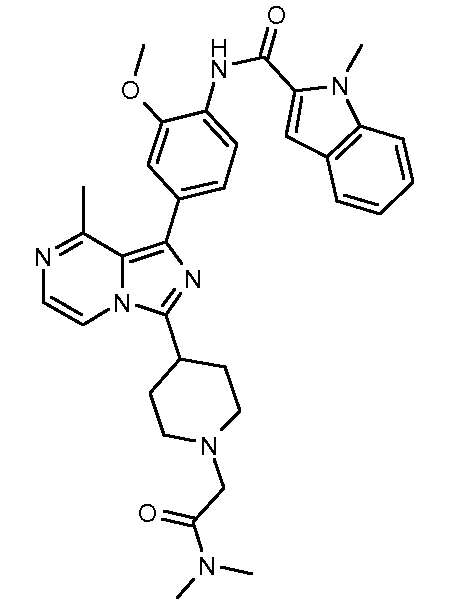
К 1-бром-8-метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразину (0,447 ммоль, 132 мг) в толуоле (1 мл) и N,N-диметилформамиде (1 мл) добавляли триэтиламин (0,894 ммоль, 0,125 мл) и 2-хлор-N,N-диметилацетамид (0,447 ммоль, 0,046 мл). Смесь перемешивали при комнатной температуре в течение двух часов, добавляли воду и дихлорметан, фильтровали через фазоразделяющий фильтр и концентрировали в вакууме. Продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%), получив при этом 2-(4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-ил)-N,N-диметилацетамид (100 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 2-(4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-ил)-N,N-диметилацетамида (33 мг) и N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (35,3 мг) после очистки продукта препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды при постоянном содержании 0,003М трифторуксусной кислоты) был получен N-(4-(3-(1-(2-(диметиламино)-2-оксоэтил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид (6 мг).
СВЭЖХ: метод 0_60: Rt = 2,34 мин, (М+Н)+ = 580.
Пример 19
N-(4-(3-(1-(2-(Диметиламино)ацетил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид

К N,N-диметилглицину (0,445 ммоль, 45,9 мг) в дихлорметане (1 мл) и N,N-диметилформамиде (0,5 мл) добавляли N,N-диизопропилэтиламин (1,762 ммоль, 0,291 мл) и тетрафторборат О-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (0,617 ммоль, 198 мг) и перемешивали при комнатной температуре в течение 10 минут. Затем 1-бром-8-метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразин (0,440 ммоль, 130 мг) растворяли в дихлорметане (2 мл) и добавляли N,N-диметилформамид (0,5 мл). Смесь перемешивали при комнатной температуре в течение двух часов, добавляли дихлорметан, фильтровали через фазоразделяющий фильтр и концентрировали в вакууме. Продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%), получив при этом 1-(4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-ил)-2-(диметиламино)этанон (141 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 1-(4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-ил)-2-(диметиламино)этанона (46 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (40 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%) был получен продукт с примесями. В результате дополнительной очистки препаративной ВЭЖХ (колонка Luna C18(20; градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты) было получено 15 мг N-(4-(3-(1-(2-(диметиламино)ацетил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамида.
СВЭЖХ: метод 0_60: Rt = 2,31 мин, (М+Н)+ = 580.
Пример 20
N-(4-(3-(1-(2-Аминоацетил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид

Вос-аминооксиуксусную кислоту (78 мг) подвергали взаимодействию с 1-бром-8-метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразином (130 мг) с образованием трет-бутил-2-(4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-ил)-2-оксоэтилкарбамата (319 мг) в виде неочищенного продукта, который использовали без дальнейшей очистки. Способами, описанными в примере 19, при использовании вышеуказанного соединения (50 мг) был получен трет-бутил-2-(4-(1-(3-метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-ил)-2-оксоэтилкарбамат (31 мг). Полученное соединение (31 мг) растворяли в дихлорметане (2 мл) и добавляли трифторуксусную кислоту (1,2 мл). Смесь перемешивали при комнатной температуре в течение 18 часов и добавляли воду, водный раствор гидрокарбоната натрия и гидроксид калия (до рН >9). Продукт дважды экстрагировали дихлорметаном/метанолом (9/1), фильтровали через фазоразделяющий фильтр и концентрировали в вакууме, получив при этом N-(4-(3-(1-(2-аминоацетил)пиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид (14 мг).
СВЭЖХ: метод 0_60: Rt = 2,22 мин, (М+Н)+ = 552.
Пример 21
N-(4-(3-(1-Карбамоилпиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид

1-Бром-8-метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразин (0,169 ммоль, 50 мг) растворяли в дихлорметане (1 мл) и добавляли триэтиламин (0,545 ммоль, 76 мкл) и триметилсилилизоцианат (0,186 ммоль, 25,3 мкл) при 0°С. Смесь перемешивали при комнатной температуре в течение одного часа, добавляли воду и 2н раствор хлористоводородной кислоты и продолжали перемешивать еще 15 минут. Реакционную смесь подщелачивали 2н водным раствором гидроксида натрия до достижения рН=10 и трижды экстрагировали дихлорметаном. Объединенные органические экстракты сушили (сульфат натрия) и концентрировали в вакууме, получив при этом 4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксамид (40 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксамида (20 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (26 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%) был получен N-(4-(3-(1-карбамоилпиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (10,5 мг).
СВЭЖХ: метод 0_60: Rt = 2,45 мин, (М+Н)+ = 568.
Пример 22
Метил-4-(1-(3-метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилат

1-Бром-8-метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразин (0,169 ммоль, 50 мг) растворяли в дихлорметане (1 мл) и добавляли триэтиламин (0,337 ммоль, 47 мкл) и метилхлорформиат (0,186 ммоль, 14,40 мкл) при 0°С. Смесь перемешивали при комнатной температуре в течение одного часа и добавляли воду и дихлорметан. Органический слой отделяли, сушили (сульфат натрия) и концентрировали в вакууме, получив при этом метил-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилат (51 мг).
Способом, описанным в примере 4, стадия 4с, при использовании метил-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилата (25 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (31 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%) был получен продукт с примесями. В результате дополнительной очистки препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты) был получен метил-4-(1-(3-метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилат (5 мг).
СВЭЖХ: метод 40_80: Rt = 1,00 мин, (М+Н)+ = 583.
Пример 23
N-(2-Метокси-4-(8-метил-3-(4-метилпиперазин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
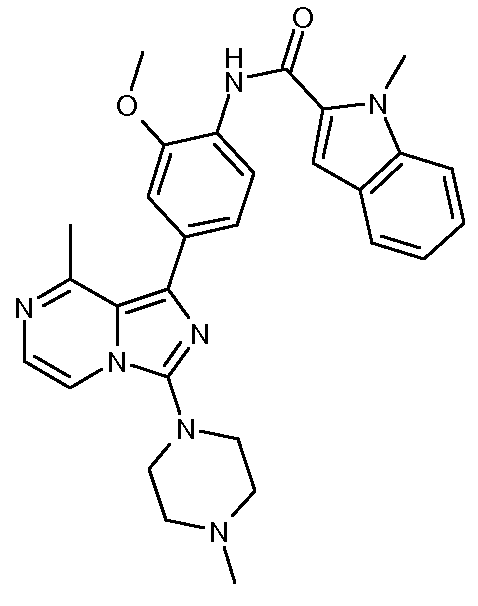
К гидрохлориду 2-аминометил-3-хлорпиразина (содержание 80%; 4,44 ммоль, 1 г) и N,N-диизопропилэтиламину (17,77 ммоль, 3,10 мл) в дихлорметане (20 мл) в атмосфере N2 при 0°С добавляли гидрохлорид N-метилпиперазин-4-карбамоилхлорида (4,89 ммоль, 0,973 г). Смесь перемешивали при комнатной температуре в течение 18 часов, добавляли воду и трижды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (сульфат натрия) и концентрировали в вакууме. Продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%), получив при этом N-((3-хлорпиразин-2-ил)метил)-4-метилпиперазин-1-карбоксамид (513 мг).
К N-((3-хлорпиразин-2-ил)метил)-4-метилпиперазин-1-карбоксамиду (485 мг) в ацетонитриле (3 мл) в потоке N2 добавляли оксихлорид фосфора (878 мкг) и нагревали пять часов при 60°С (температура бани) и один час при 80°С. Затем реакционную смесь концентрировали в вакууме. Добавляли толуол и смесь концентрировали в вакууме. Остаток поглощали ацетонитрилом, добавляли 7н раствор аммиака в метаноле при охлаждении, суспензию перемешивали в течение 16 часов, фильтровали и фильтрат концентрировали в вакууме. К остатку добавляли дихлорметан, снова фильтровали и фильтрат концентрировали в вакууме, получив при этом 8-хлор-3-(4-метилпиперазин-1-ил)имидазо[1,5-a]пиразин (400 мг).
8-Хлор-3-(4-метилпиперазин-1-ил)имидазо[1,5-a]пиразин (51 мг) превращали в 8-метил-3-(4-метилпиперазин-1-ил)имидазо[1,5-a]пиразин (31 мг) способом, описанным в примере 2, стадия 2d, и очищали хроматографией на колонке (силикагель; этилацетат).
Способом, описанным в примере 1, стадия 1d, при использовании 8-метил-3-(4-метилпиперазин-1-ил)имидазо[1,5-a]пиразина (31 мг), который подвергали взаимодействию при 50°С в течение одного часа, после очистки продукта хроматографией на колонке (силикагель; этилацетат) был получен 1-бром-8-метил-3-(4-метилпиперазин-1-ил)имидазо[1,5-a]пиразин (16 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 1-бром-8-метил-3-(4-метилпиперазин-1-ил)имидазо[1,5-a]пиразина (16 мг) и N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (23 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 5%) был получен продукт с примесями. В результате дополнительной очистки препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты) был получен N-(2-метокси-4-(8-метил-3-(4-метилпиперазин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (12 мг).
СВЭЖХ: метод 0_60: Rt = 2,29 мин, (М+Н)+ = 510.
Пример 24
N-(2-Метокси-4-(8-метил-3-(морфолин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

Указанное в заголовке соединение было получено способами, описанными в примере 23, при использовании морфолин-4-карбонилхлорида вместо N-метилпиперазин-4-карбамоилхлорида.
СВЭЖХ: метод 40_80: Rt = 1,08 мин, (М+Н)+ = 497.
Пример 25
Изопропил-2-метокси-4-(8-метил-3-(4-морфолинопиперидин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат
25а. Синтез изопропил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата
К раствору трифосгена (1,485 ммоль, 0,441 г) в тетрагидрофуране (20 мл) по каплям добавляли раствор пинаконового эфира 4-амино-3-метоксифенилбороновой кислоты (4,01 ммоль, 1 г) и N,N-диизопропилэтиламина (5,02 ммоль, 0,829 мл) в тетрагидрофуране (30 мл) при комнатной температуре. Температуру поддерживали в интервале от 20°С до 30°С. Через 30 минут к реакционной смеси, находящейся при температуре 20-30°С, по каплям добавляли раствор 2-пропанола (8,03 ммоль, 0,614 мл) и N,N-диизопропилэтиламина (5,02 ммоль, 0,829 мл) в тетрагидрофуране (20 мл). Реакционную смесь нагревали до температуры кипения с обратным холодильником. Через два часа добавляли еще 10 мл 2-пропанола и реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 3 дней. Реакционную смесь выливали в воду (150 мл) и экстрагировали этилацетатом (150 мл). Органический слой промывали 10% раствором хлорида натрия (10 мл), сушили (сульфат магния) и упаривали досуха, получив при этом изопропил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамат (1,18 г) в виде темно-коричневого масла.
1H ЯМР: δ 1,30 (д, J=7 Гц, 6H), 1,34 (c, 12 H), 3,91 (c, 3H), 5,03 (гептед, 1H), 7,24-7,26 (м, 1H), 7,31 (ушир.с, 1H), 7,42-7,46 (м, 1H), 8,09-8,15 (м, 1H).
25b. Синтез изопропил-2-метокси-4-(8-метил-3-(4-морфолинопиперидин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамата

К трихлорметилхлорформиату (4,19 ммоль, 0,505 мл) в этилацетате (5 мл) при 0°С по каплям добавляли 1,4-диокса-8-азаспиро[4.5]декан (6,98 ммоль, 0,895 мл) в этилацетате (5 мл) и N,N-диизопропилэтиламин (6,98 ммоль, 1,217 мл). Через один час смесь концентрировали, остаток растворяли в дихлорметане (25 мл) и добавляли гидрохлорид 2-аминометил-3-хлорпиразина (содержание 60%; 10,00 ммоль, 3 г) и триэтиламин (27,9 ммоль, 3,89 мл). Реакционную смесь перемешивали в течение 16 часов при комнатной температуре, разбавляли водой, фильтровали через декалит, промывали водой, фильтровали через фазоразделяющий фильтр и концентрировали в вакууме. Неочищенный продукт растворяли в дихлорметане, содержащем 1% триэтиламина, и очищали хроматографией на колонке (силикагель; дихлорметан, содержащий 1% триэтиламина), получив при этом N-((3-хлорпиразин-2-ил)метил)-1,4-диокса-8-азаспиро[4.5]декан-8-карбоксамид (1,5 г).
N-((3-хлорпиразин-2-ил)метил)-1,4-диокса-8-азаспиро[4.5]декан-8-карбоксамид (1,2 г) превращали в 8-(8-хлоримидазо[1,5-a]пиразин-3-ил)-1,4-диокса-8-азаспиро[4.5]декан (0,44 г) способом, описанным в примере 3, стадия 3b, и очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10% и постоянным содержанием 1% триэтиламина).
8-(8-Хлоримидазо[1,5-a]пиразин-3-ил)-1,4-диокса-8-азаспиро-[4.5]декан (840 мг) превращали в 8-(8-метилимидазо[1,5-a]пиразин-3-ил)-1,4-диокса-8-азаспиро[4.5]декан (650 мг) способом, описанным в примере 2, стадия 2d, и очищали хроматографией на колонке (силикагель; дихлорметан/метанол, 99/1, и постоянное содержание 1% триэтиламина).
Способом, описанным в примере 2, стадия 2f, при использовании 8-(8-метилимидазо[1,5-a]пиразин-3-ил)-1,4-диокса-8-азаспиро[4.5]декана (650 мг), который подвергали взаимодействию при комнатной температуре, после очистки продукта хроматографией на колонке (силикагель; дихлорметан/метанол, 99/1, и постоянное содержание 1% триэтиламина) был получен 8-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-1,4-диокса-8-азаспиро[4.5]декан (280 мг).
К 8-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-1,4-диокса-8-азаспиро[4.5]декану (1,246 ммоль, 440 мг) в ацетоне (5 мл) добавляли 36% хлористоводородную кислоту (12,46 моль, 1,3 мл). Реакционную смесь выдерживали при 60°С в течение 16 часов и концентрировали, остаток растворяли в дихлорметане, нейтрализовали насыщенным водным раствором гидрокарбоната натрия, фильтровали через фазоразделяющий фильтр и концентрировали. Неочищенный продукт растворяли в дихлорметане и очищали хроматографией на колонке с силикагелем (градиент гептана/этилацетата от 1:1 до 0:1), получив при этом 0,2 г смеси исходного вещества и продукта. Полученную смесь растворяли в тетрагидрофуране (1 мл), добавляли 10% водный раствор H2SO4 (2 мл) и перемешивали при комнатной температуре. Смесь нейтрализовали твердым гидрокарбонатом натрия, экстрагировали дихлорметаном, сушили (сульфат натрия) и концентрировали в вакууме. Неочищенный продукт растворяли в дихлорметане и очищали хроматографией на колонке с силикагелем (дихлорметан), получив при этом 1-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-4-он (60 мг).
Способом, описанным в примере 2, стадия 2b, при использовании 1-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-4-она (60 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан) был получен 4-(1-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-4-ил)морфолин (70 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 4-(1-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-4-ил)морфолина (30 мг) и изопропил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата (26,4 мг) после очистки продукта препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды при постоянном содержании 0,003М трифторуксусной кислоты) был получен изопропил-2-метокси-4-(8-метил-3-(4-морфолинопиперидин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат (7 мг).
СВЭЖХ: метод 0_60: Rt = 2,03 мин, (М+Н)+ = 509.
Пример 26
Способами, описанными в предыдущих экспериментах, в частности, в примерах 2, 7, 9 и 12, при использовании N-((3-хлорпиразин-2-ил)метил)-4-оксоциклогексанкарбоксамида были получены следующие соединения.
26а. (S)-Пентан-2-ил-2-метокси-4-(3-((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат

СВЭЖХ: метод 0_60: Rt = 2,28 мин, (М+Н)+ = 538.
26b. N-(4-(3-((Транс)-4-(диметиламино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид

СВЭЖХ: метод 0_60: Rt = 2,25 мин, (М+Н)+ = 567.
26с. 4-Метокси-N-(2-метокси-4-(3-((цис)-4-((2-метоксиэтил)(метил)амино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

СВЭЖХ: метод 0_60: Rt = 2,43 мин, (М+Н)+ = 611.
26d. 4-Метокси-N-(2-метокси-4-(8-метил-3-((цис)-4-морфолиноциклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

СВЭЖХ: метод 0_60: Rt = 2,42 мин, колонка для ЖХ-МС 1: Rt 2,45 мин, (М+Н)+ = 609.
26е. N-(4-(3-((цис)-4-(диметиламино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
СВЭЖХ: метод 0_60: Rt = 2,32 мин, (М+Н)+ = 567.
26f. (S)-Пентан-2-ил-4-(3-((цис)-4-(4-ацетилпиперазин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат
СВЭЖХ: метод 0_60: Rt = 2,17 мин, (М+Н)+ = 577.
26g. (S)-Пентан-2-ил-4-(3-((цис)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8--метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат

СВЭЖХ: метод 0_60: Rt = 2,43 мин, (М+Н)+ = 542.
Пример 27
(S)-Пентан-2-ил-2-метокси-4-(8-метил-3-((1r,3r)-3-(4-метилпиперазин-1-ил)циклобутил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат
Способами, описанными в примере 2, стадия 2а, при использовании 3-оксоциклобутанкарбоновой кислоты вместо 4-оксоциклогексанкарбоксилата был получен N-((3-хлорпиразин-2-ил)метил)-3-оксоциклобутанкарбоксамид. Способами, описанными в примере 7, при использовании вышеуказанного соединения был получен (S)-пентан-2-ил-2-метокси-4-(8-метил-3-((1r,3r)-3-(4-метилпиперазин-1-ил)циклобутил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат.
СВЭЖХ: метод 0_60: Rt=2,04 мин, колонка для ЖХ-МС 2: Rt 2,31 мин, (М+Н)+=521.
Пример 28
(S)-Пентан-2-ил-2-метокси-4-(8-метил-3-(3-(4-метилпиперазин-1-ил)циклопентил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат

Способом, описанным в примере 2, стадия 2a, при использовании 3-оксо-1-циклопентанкарбоновой кислоты вместо 4-оксоциклогексанкарбоксилата был получен N-((3-хлорпиразин-2-ил)метил)-3-оксоциклобутанкарбоксамид. Способами, описанными в примере 7, при использовании вышеуказанного соединения был получен (S)-пентан-2-ил-2-метокси-4-(8-метил-3-(3-(4-метилпиперазин-1-ил)циклопентил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат, который был выделен в виде рацемической смеси цис- и транс-изомеров.
СВЭЖХ: метод 0_60: Rt=2,68 мин и 2,72 мин, (М+Н)+=535.Пример 29
(S)-Пентан-2-ил-2-метокси-4-(3-((транс)-4-(N-(2-метоксиэтил)ацетамидо)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат

К (Транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-N-(2-метоксиэтил)циклогексанамину (0,182 ммоль, 67 мг) в дихлорметане (2 мл) и триэтиламине (0,912 ммоль, 0,127 мл) при 0°С добавляли ацетилохлорид (0,274 ммоль, 0,020 мл). Смесь перемешивали в течение 1 часа и добавляли дихлорметан и воду. Органический слой отделяли, сушили, фильтровали через фазоразделяющий фильтр и концентрировали в вакууме, получив при этом N-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)-N-(2-метоксиэтил)ацетамид (72 мг).
Способом, описанным в примере 4, стадия 4с, при использовании N-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)-N-(2-метоксиэтил)ацетамида (22 мг) и (S)-пентан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата (19,5 мг) после очистки продукта препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусаной кислоты) был получен (S)-пентан-2-ил-2-метокси-4-(3-((транс)-4-(N-(2-метоксиэтил)ацетамидо)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат (10 мг).
СВЭЖХ: метод 40_80: Rt = 0,91 мин, колонка для ЖХ-МС 2: Rt 2,61 мин, (М+Н)+ = 566.
Пример 30
4-Метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

Бензил-4-(8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-1-карбоксилат (3,71 ммоль, 1,30 г) растворяли в 37% хлористоводородной кислоте (240 ммоль, 20 мл). Реакционную смесь перемешивали при комнатной температуре в течение двух часов, затем выливали в воду и дважды промывали диэтиловым эфиром. Водный слой концентрировали в вакууме и упаривали с толуолом и этанолом. Остаток растворяли в метаноле и дважды элюировали на колонке с карбонатом кремния (Silicycle, наполнение 0,7 ммоль/г), получив при этом 8-метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразин (0,93 г).
8-Метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразин (172 мг) превращали в 8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-ил)имидазо[1,5-a]пиразин (103 мг) способом, описанным в примере 2, стадия 2b, используя дополнительное количество водного раствора гидроксида калия для доведения значения рН водного слоя в процессе экстракции до рН 10 и выполняя очистку хроматографией на колонке (силикагель; градиент от дихлорметана до дихлорметана/метанола, 9/1, с постоянным содержанием 1% триэтиламина).
8-Метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-ил)имидазо[1,5-a]пиразин (0,303 ммоль, 91 мг) растворяли в дихлорметане (2 мл) и уксусной кислоте (30,3 ммоль, 1,734 мл). Перемешивая смесь, добавляли бром (0,303 ммоль, 0,016 мл) в дихлорметане (0,2 мл). Смесь перемешивали при комнатной температуре в течение одного часа, добавляли воду и концентрировали в вакууме. К остатку добавляли насыщенный водный раствор гидрокарбоната натрия и смесь дважды экстрагировали дихлорметаном/метанолом. Объединенные органические слои концентрировали в вакууме, получив при этом 1-бром-8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-ил)имидазо[1,5-a]пиразин (88 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 1-бром-8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-ил)имидазо[1,5-a]пиразина (29 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (33,4 мг) после очистки продукта препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты) был получен 4-метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (5,7 мг).
СВЭЖХ: метод 0_60: Rt = 2,28 мин, (М+Н)+ = 609.
Пример 31
(S)-Пентан-2-ил-4-(3-(4-ацетилпиперазин-1-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат

Трихлорметилхлорформиат (5,45 ммоль, 0,657 мл) в тетрагидрофуране (20 мл) охлаждали до 0°С и по каплям добавляли раствор бензил-1-пиперазинкарбоксилата (4,54 ммоль, 0,876 мл) и N,N-диизопропилэтиламина (9,99 ммоль, 1,651 мл) в тетрагидрофуране (20 мл). Смесь перемешивали в течение одного часа при 0°С, твердые вещества удаляли фильтрованием через декалит и фильтрат концентрировали в вакууме с образованием неочищенного бензил-4-(хлоркарбонил)пиперазин-1-карбоксилата. Вышеуказанное соединение добавляли к гидрохлориду 2-аминометил-3-хлорпиразина (содержание 69%; 3,49 ммоль, 0,91 г) в дихлорметане (15 мл) и триэтиламине (10,46 ммоль, 1,458 мл) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь фильтровали через декалит и промывали дихлорметаном. Фильтрат концентрировали и неочищенный продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%), получив при этом бензил-4-((3-хлорпиразин-2-ил)метилкарбамоил)пиперазин-1-карбоксилат (1,15 г).
Бензил-4-((3-хлорпиразин-2-ил)метилкарбамоил)пиперазин-1-карбоксилат (1,15 г) превращали в бензил-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)пиперазин-1-карбоксилат (522 мг) способами, описанными в примере 1, стадия 1b, выполняя реакцию при 70°С в течение 2 часов и очищая продукт хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%).
Бензил-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)пиперазин-1-карбоксилат (522 мг) превращали в бензил-4-(8-метилимидазо[1,5-a]пиразин-3-ил)пиперазин-1-карбоксилат (486 мг) способом, описанным в примере 2, стадия 2d, и очищали продукт хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%).
Бензил-4-(8-метилимидазо[1,5-a]пиразин-3-ил)пиперазин-1-карбоксилат (486 мг) в 37% хлористоводородной кислоте (97 ммоль, 8 мл) перемешивали при комнатной температуре в течение двух часов. Затем добавляли воду (16 мл) и смесь дважды промывали диэтиловым эфиром. Водный слой концентрировали в вакууме и упаривали с толуолом и этанолом, получив при этом гидрохлорид 8-метил-3-(пиперазин-1-ил)имидазо[1,5-a]пиразина (322 мг).
К гидрохлориду 8-метил-3-(пиперазин-1-ил)имидазо[1,5-a]пиразина (0,359 ммоль, 91 мг) и триэтиламину (1,793 ммоль, 0,250 мл) в дихлорметане (5 мл) добавляли уксусный ангидрид (0,538 ммоль, 0,051 мл). Смесь перемешивали при комнатной температуре в течение 20 часов, добавляли насыщенный водный раствор гидрокарбоната натрия и трижды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (сульфат натрия) и концентрировали в вакууме с образованием 24 мг неочищенного продукта. К водному слою добавляли твердый хлорид натрия и смесь трижды экстрагировали дихлорметаном/метанолом (4/1). Объединенные органические слои промывали насыщенным раствором соли, сушили (сульфат натрия) и концентрировали в вакууме с образованием еще 47 мг неочищенного продукта. Объединенные неочищенные продукты очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%), получив при этом 1-(4-(8-метилимидазо[1,5-a]пиразин-3-ил)пиперазин-1-ил)этанон (56 мг).
К 1-(4-(8-метилимидазо[1,5-a]пиразин-3-ил)пиперазин-1-ил)этанону (0,208 ммоль, 54 мг) в дихлорметане (1 мл) при комнатной температуре добавляли N-бромсукцинимид (0,208 ммоль, 37,1 мг). Смесь перемешивали при комнатной температуре в течение 5 минут, добавляли воду и трижды экстрагировали дихлорметаном. Объединенные органические экстракты сушили, фильтровали через фазоразделяющий фильтр и концентрировали в вакууме, получив при этом 1-(4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперазин-1-ил)этанон (62 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 1-(4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперазин-1-ил)этанона (30 мг) и (S)-пентан-2-ил-2-метокси-4-(4,4,5,5-татраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата (35,4 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%) был получен ((S)-пентан-2-ил-4-(3-(4-ацетилпиперазин-1-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат (23 мг).
СВЭЖХ: метод 40_80: Rt = 0,94 мин, (М+Н)+ = 495.
Пример 32
N-(4-(3-(4-(1-Ацетилпиперидин-4-ил)пиперазин-1-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид

К гидрохлориду 8-метил-3-(пиперазин-1-ил)имидазо[1,5-a]пиразина (299 мг) в метаноле добавляли небольшое количество карбоната кремния (Silicycle, наполнение 0,7 ммоль/г) и растворитель удаляли в вакууме. Остаток вводили в колонку с карбонатом кремния (3 г) и элюировали дихлорметаном/метанолом (4:1) с образованием 8-метил-3-(пиперазин-1-ил)имидазо[1,5-a]пиразина (196 мг). Вышеуказанное соединение (50 мг) превращали в 1-(4-(4-(8-метилимидазо[1,5-a]пиразин-3-ил)пиперазин-1-ил)пиперидин-1-ил)этанон (99 мг) способом, описанным в примере 2, стадия 2b, и очищали продукт хроматографией на колонке (силикагель; градиент от дихлорметана до дихлорметана/метанола, 85/15).
К 1-(4-(4-(8-метилимидазо[1,5-a]пиразин-3-ил)пиперазин-1-ил)пиперидин-1-ил)этанону (0,102 ммоль, 35 мг) в дихлорметане (1 мл) при комнатной температуре добавляли N-бромсукцинимид (0,102 ммоль, 18,19 мг). Смесь перемешивали при комнатной температуре в течение 5 минут, добавляли воду и трижды экстрагировали дихлорметаном. Объединенные органические экстракты сушили, фильтровали через фазоразделяющий фильтр и концентрировали в вакууме, получив при этом 1-(4-(4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперазин-1-ил)пиперидин-1-ил)этанон (32 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 1-(4-(4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пиперазин-1-ил)пиперидин-1-ил)этанона (30 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (34,2 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%) был получен продукт с примесями. В результате дополнительной очистки препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты был получен N-(4-(3-(4-(1-ацетилпиперидин-4-ил)пиперазин-1-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (11 мг).
СВЭЖХ: метод 0_60: Rt = 2,22 мин, (М+Н)+ = 651.
Пример 33
Способами, аналогичными способу, описанному в примере 4, стадия 4с, при использовании производных 1-бром-8-метилимидазо[1,5-a]пиразина были получены следующие соединения.
33а. (S)-Пентан-2-ил-2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат

СВЭЖХ: метод 0_60: Rt = 2,06 мин, (М+Н)+ = 549.
33b. 2,2,2-Трифторацетат N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамида

СВЭЖХ: метод 0_60: Rt = 2,27 мин, (М+Н)+ = 592.
33с. N-(4-(3-((Транс)-4-(4-ацетилпиперазин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-1-метил-1Н-индол-2-карбоксамид

СВЭЖХ: метод 0_60: Rt = 2,23 мин, (М+Н)+ = 620.
33d. (S)-Пентан-2-ил-4-(3-((транс)-4-(4-ацетилпиперазин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат
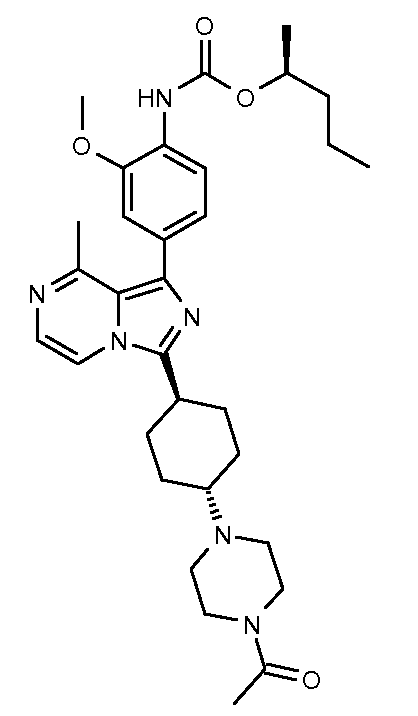
СВЭЖХ: метод 0_60: Rt = 2,19 мин, (М+Н)+ = 577.
33е. (R)-N-(4-(3-(1-(2-Диметиламино)ацетил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
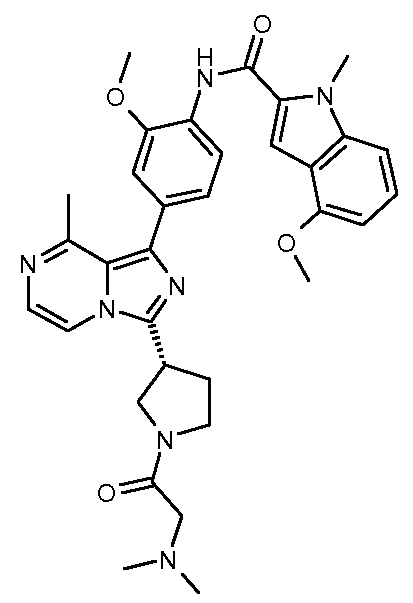
СВЭЖХ: метод 0_60: Rt = 2,17 мин, (М+Н)+ = 596.
33f. (S)-Пентан-2-ил-2-метокси-4-(8-метил-(3-((цис)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат

СВЭЖХ: метод 0_60: Rt = 1,96 мин, (М+Н)+ = 549.
33g. N-(4-(3-(4-Ацетилпиперазин-1-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
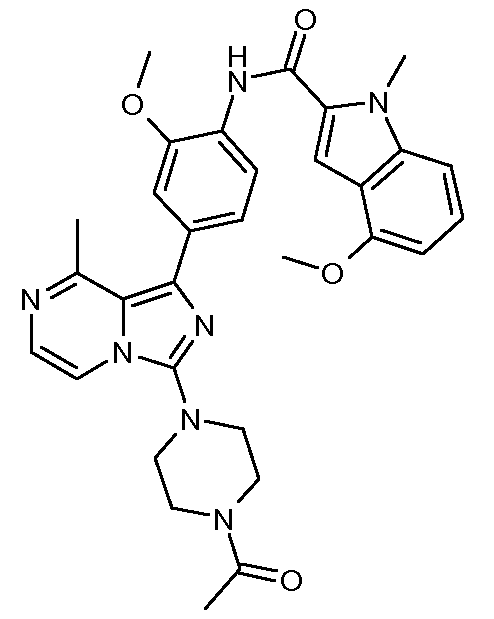
СВЭЖХ: метод 40_80: Rt = 0,92 мин, (М+Н)+ = 568.
Пример 34
4-Метокси-N-(2-метокси-4-(8-метил-3-(4-(тетрагидро-2Н-пиран-4-ил)пиперазин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
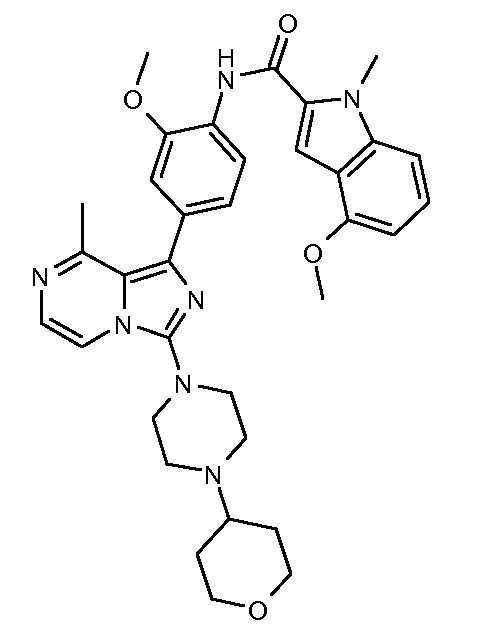
4-Метокси-N-(2-метокси-4-(8-метил-3-(4-(тетрагидро-2Н-пиран-4-ил)пиперазин-1-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид был получен из 8-метил-3-(пиперазин-1-ил)имидазо[1,5-a]пиразина и тетрагидро-4Н-пиран-4-она способами, описанными в примере 32.
СВЭЖХ: метод 0_60: Rt = 2,19 мин, (М+Н)+ = 610.
Пример 35
(R)-4-Метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пирролидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
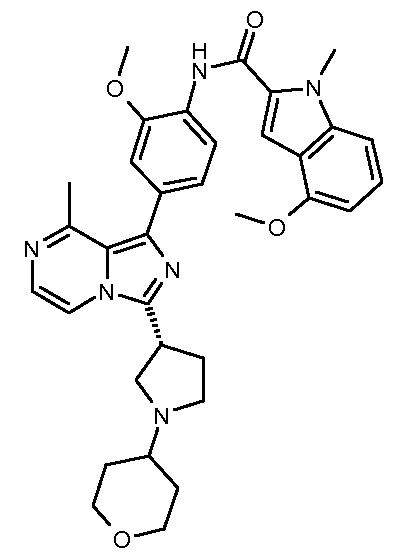
Способами, описанными в примере 32, гидрохлорид (R)-1-бром-8-метил-3-(пирролидин-3-ил)имидазо[1,5-a]пиразина был превращен в (R)-4-метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пирролидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид.
СВЭЖХ: метод 0_60: Rt = 2,59 мин, (М+Н)+ = 595.
Пример 36
(S)-4-Метокси-N-(2-метокси-4-(8-метил-3-(1-(тетрагидро-2Н-пиран-4-ил)пирролидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
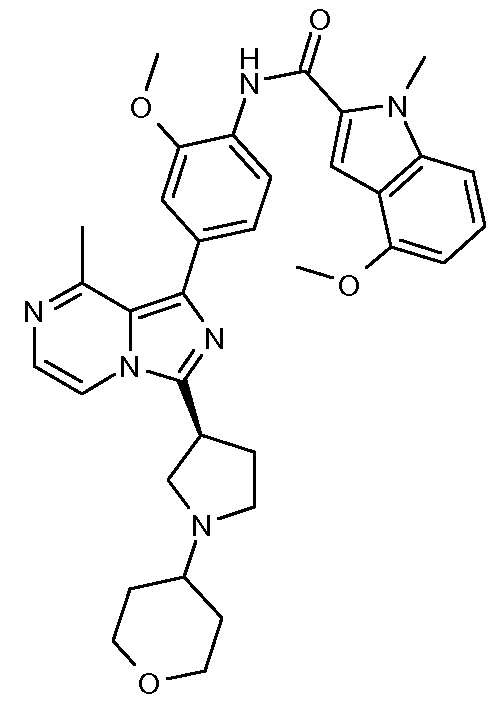
Указанное в заголовке соединение было получено теми же способами, что и R-изомер.
СВЭЖХ: метод 0_560: Rt = 2,51 мин, (М+Н)+ = 595.
Пример 37
4-Метокси-N-(2-метокси-4-(8-метил-3-(3-(трифторметил)-5,6-дигидро-[1,2,4]триазоло[4,3-a]пиразин-7(8Н)-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

Суспензию гидрохлорида 3-(трифторметил)-1,2,4-триазоло[4,3-a]пиперазина (10,94 ммоль, 2,5 г) в смеси тетрагидрофурана (50 мл) и N,N-диизопропилэтиламина (32,8 ммоль, 5,42 мл) добавляли к трихлорметилхлорформиату (13,12 ммоль, 1,583 мл) в тетрагидрофуране (50 мл) при 0°С. Реакционную смесь выдерживали в течение одного часа при 0°С, фильтровали через декалит и фильтр промывали тетрагидрофураном. Затем фильтрат концентрировали в вакууме. Остаток (4,52 г, неочищенный) добавляли к гидрохлориду 2-аминометил-3-хлорпиразина (содержание 77%; 8,43 ммоль, 1,97 г) в смеси дихлорметана (50 мл) и триэтиламина (25,3 ммоль, 3,52 мл) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь фильтровали через декалит и фильтр промывали дихлорметаном. Фильтрат промывали водой. Водный слой трижды экстрагировали дихлорметаном. Объединенные органические экстракты промывали насыщенным раствором соли, сушили (сульфат натрия) и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%), получив при этом N-((3-хлорпиразин-2-ил)метил)-3-(трифторметил)-5,6-дигидро-[1,2,4]триазоло[4,3-a]пиразин-7(8Н)карбоксамид (2,707 г).
К N-((3-хлорпиразин-2-ил)метил)-3-(трифторметил)-5,6-дигидро-[1,2,4]триазоло[4,3-a]пиразин-7(8Н)карбоксамиду (1,382 ммоль, 500 мг) в этилацетате (5 мл) при 0°С добавляли оксихлорид фосфора (5,53 ммоль, 0,515 мл). Реакционную смесь перемешивали при комнатной температуре в течение двух дней и при 60°С в течение одного дня. Реакционную смесь охлаждали до 0°С, добавляли избыток твердого гидрокарбоната натрия и суспензию перемешивали при 0°С в течение 10 минут и при комнатной температуре в течение 20 минут. Затем суспензию снова охлаждали до 0°С, добавляли воду и трижды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (сульфат натрия) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%), получив при этом 7-(8-хлоримидазо[1,5-a]пиразин-3-ил)-3-(трифторметил)-5,6,7,8-тетрагидро-[1,2,4]триазоло[4,3-a]пиразин (119 мг).
7-(8-Хлоримидазо[1,5-a]пиразин-3-ил)-3-(трифторметил)-5,6,7,8-тетрагидро-[1,2,4]триазоло[4,3-a]пиразин (269 мг) превращали в 7-(8-метилимидазо[1,5-a]пиразин-3-ил)-3-(трифторметил)-5,6,7,8-тетрагидро-[1,2,4]триазоло[4,3-a]пиразин (178 мг) способом, описанным в примере 2, стадия 2d, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%).
Способом, описанным в примере 2, стадия 2f, 7-(8-метилимидазо[1,5-a]пиразин-3-ил)-3-(трифторметил)-5,6,7,8-тетрагидро-[1,2,4]триазоло-[4,3-a]пиразин (178 мг) превращали в 7-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-3-(трифторметил)-5,6,7,8-тетрагидро-[1,2,4]триазоло-[4,3-a]пиразин (151 мг) и очищали продукт хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%).
Способом, описанным в примере 4, стадия 4с, при использовании 7-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-3-(трифторметил)-5,6,7,8-тетрагидро[1,2,4]триазоло[4,3-a]пиразина (30 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил)-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (35,8 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%) был получен 4-метокси-N-(2-метокси-4-(8-метил-3-(3-(трифторметил)-5,6-дигидро-[1,2,4]триазоло-[4,3-a]пиразин-7(8Н)-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (43 мг).
СВЭЖХ: метод 40_80: Rt = 1,33 мин, (М+Н)+ = 632.
Пример 38
4-Метокси-N-(2-метокси-4-(8-метил-3-(1-метил-2-оксопиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

Гидрохлорид 2-аминометил-3-хлорпиразина (содержание 77%; 5,36 ммоль, 1,0 г) и 1-метил-2-оксопиперидин-4-карбоновую кислоту (5,36 ммоль, 0,843 г) использовали в соответствии со способом, описанным в примере 13, стадия 13а, продукт очищали хроматографией на колонке (силикагель; дихлорметан с 10% метанола), получив при этом N-((3-хлорпиразин-2-ил)метил)-1-метил-2-оксопиперидин-4-карбоксамид (940 мг).
Способом, описанным в примере 3, стадия 3b, N-((3-хлорпиразин-2-ил)метил)-1-метил-2-оксопиперидин-4-карбоксамид (407 мг) превращали в 4-(8-хлоримидазо[1,5-a]пиразин-3-ил)-1-метилпиперидин-2-он (140 мг) и очищали продукт хроматографией на колонке (силикагель; дихлорметан с 10% метанола).
4-(8-Хлоримидазо[1,5-a]пиразин-3-ил)-1-метилпиперидин-2-он (140 мг) превращали в 1-метил-4-(8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-2-он (50 мг) способом, описанным в примере 2, стадия 2d, и очищали продукт хроматографией на колонке (силикагель; градиент гептанов/этилацетата от 1/0 до 0/1, после чего колонку промывали дихлорметаном, содержащим 10% метанола).
К раствору 1-метил-4-(8-метилимидазо[1,5-a]пиразин-3-ил)пиперидин-2-она (0,205 ммоль, 50 мг) в N,N-диметилформамиде (0,6 мл) добавляли N-бромсукцинимид (0,225 ммоль, 40,1 мг) и реакционную смесь перемешивали при комнатной температуре в течение 15 минут. Реакционную смесь экстрагировали дихлорметаном/водным раствором гидрокарбоната натрия, сушили (сульфат натрия) и концентрировали в вакууме с образованием неочищенного продукта. Продукт очищали хроматографией на колонке (силикагель; дихлорметан с 10% метанола), получив при этом 4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-1-метилпиперидин-2-он (46 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-1-метилпиперидин-2-она (46 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (62,1 мг) после очистки продукта препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты) был получен 4-метокси-N-(2-метокси-4-(8-метил-3-(1-метил-2-оксопиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (15 мг).
СВЭЖХ: метод 40_80: Rt = 0,94 мин, (М+Н)+ = 553.
Пример 39
N-(4-(3-((Транс)-4-аминоциклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
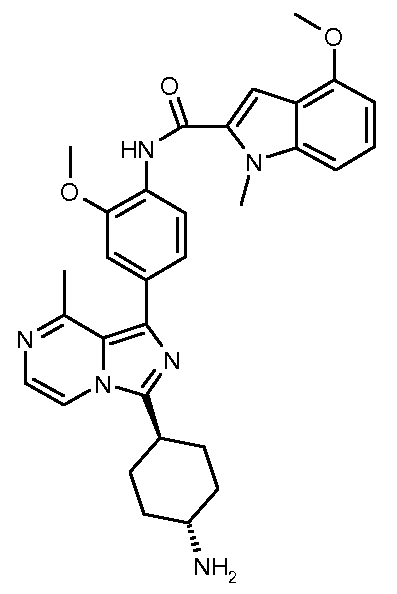
Способами, описанными в примере 17, при использовании (транс)-4-(бензилоксикарбониламино)циклогексанкарбоновой кислоты был получен N-(4-(3-((транс)-4-аминоциклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид.
СВЭЖХ: метод 0_60: Rt = 2,25 мин, (М+Н)+ = 539.
Пример 40
N-(4-(3-((Транс)-4-(2,2-дифторэтиламино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид

Способами, описанными в примере 17, при использовании (транс)-4-(бензилоксикарбониламино)циклогексанкарбоновой кислоты был получен (транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексанамин. Вышеуказанное соединение (0,217 ммоль, 67,1 мг) растворяли в N,N-диметилформамиде, добавляли карбонат калия (0,651 ммоль, 90 мг), затем 2-бром-1,1-дифторэтан (0,217 ммоль, 17,47 мкл, 31,5 мг) и реакционную смесь перемешивали в микроволновой печи при 60°С. Через один час добавляли дополнительное количество 2-бром-1,1-дифторэтана (0,217 ммоль, 17,47 мкл, 31,5 мг) и реакционную смесь перемешивали в микроволновой печи при 60°С еще один час. Реакционную смесь фильтровали, фильтр промывали ацетонитрилом и фильтрат концентрировали. Остаток очищали хроматографией на колонке (силикагель, градиент дихлорметана/метанола от 10/0 до 9/1), получив при этом (транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-N-(2,2-дифторэтил)циклогексанамин (39,8 мг).
Способом, описанным в примере 4, стадия 4с, при использовании (транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-N-(2,2-дифторэтил)циклогексанамина (20 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (23,4 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан/метанол, 4/1) был получен продукт с примесями. В результате дополнительной очистки препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты) был получен N-(4-(3-((транс)-4-(2,2-дифторэтиламино)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (9 мг).
СВЭЖХ: метод 0_60: Rt = 2,34 мин, (М+Н)+ = 603.
Пример 41
Изопропил-4-(3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил(метил)карбамат
41а. Синтез изопропил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил(метил)карбамата

К изопропил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамату (0,298 ммоль, 0,10 г) в тетрагидрофуране (1 мл) при комнатной температуре последовательно добавляли гидрид натрия (60% дисперсия в минеральном масле, 0,350 ммоль, 0,014 г) и иодметан (0,803 ммоль, 0,05 мл). Через 1 час добавляли водный раствор хлорида аммония и смесь экстрагировали дихлорметаном (три раза). Объединенные органические экстракты сушили (сульфат натрия) и концентрировали в вакууме, получив при этом изопропил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил-(метил)карбамат (0,14 г), который использовали без дальнейшей очистки.
Колонка для ЖХ-МС 1: Rt 4,43 мин, (М+Н)+ = 350.
41b. Синтез изопропил-4-(3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил(метил)карбамата

Способом, описанным в примере 4, стадия 4с, при использовании 1-бром-3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразина (20 мг) и изопропил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил(метил)карбамата (23,4 мг) после очистки продукта хроматографией на колонке (силикагель; этилацетат с градиентом метанола от 0% до 5%) был получен изопропил-4-(3-((транс)-4-(3,3-дифторазетидин-1-ил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил(метил)карбамат (20 мг).
СВЭЖХ: метод 0_60: Rt = 1,88 мин, (М+Н)+ = 528.
Пример 42
5-Метокси-N-(2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-пирроло[3,2-b]пиридин-2-карбоксамид

5-Метокси-1Н-пирроло[3,2-b]пиридин-2-карбоновую кислоту (0,602 ммоль, 116 мг) и гексафторфосфат О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (0,662 ммоль, 252 мг) добавляли к раствору пинаконового эфира 4-амино-3-метоксифенилбороновой кислоты (0,602 ммоль, 150 мг) в дихлорметане (2,5 мл) и пиридине (0,5 мл) при 0°С. Реакционную смесь перемешивали в течение ночи при комнатной температуре и концентрировали в вакууме. К остатку добавляли дихлорметан и воду, органический слой отделяли и промывали водой. Оба водных слоя экстрагировали дихлорметаном. Объединенные органические слои сушили (сульфат натрия) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан), получив при этом 5-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-пирроло[3,2-b]пиридин-2-карбоксамид (278 мг).
Способом, описанным в примере 4, стадия 4с, при использовании 1-бром-8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина (21 мг) и 5-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-пирроло[3,2-b]пиридин-2-карбоксамида (23,4 мг) после очистки продукта хроматографией на колонке (силикагель; гептаны с градиентом этилацетата от 30% до 100%) был получен 5-метокси-N-(2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-пирроло[3,2-b]пиридин-2-карбоксамид (14 мг).
СВЭЖХ: метод 0_60: Rt = 1,88 мин, (М+Н)+ = 513.
Пример 43
N-(2-Метокси-4-(8-метил-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
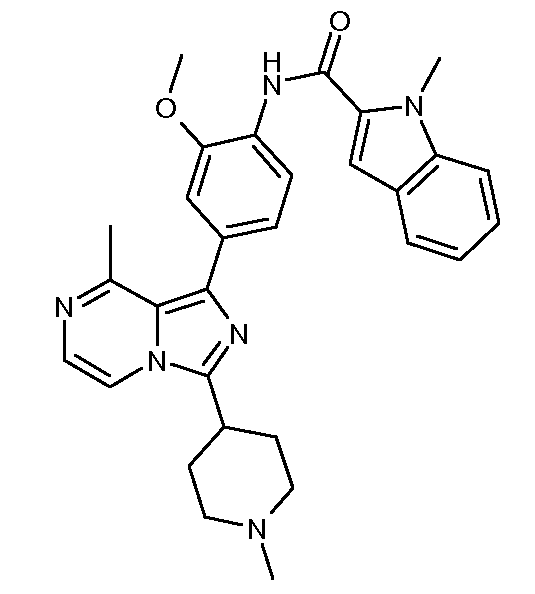
К суспензии гидрохлорида 1-метилпиперидин-4-карбоновой кислоты (11,36 ммоль, 2,04 г) и N,N-диметилформамида (0,129 ммоль, 0,01 мл, 9,40 мг) в дихлорметане (10 мл) при 0°С по каплям добавляли оксалилхлорид (14,76 ммоль, 1,40 мл). Охлаждающую баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 20 часов. Затем реакционную смесь концентрировали в вакууме, получив при этом гидрохлорид 1-метилпиперидин-4-карбонилхлорида (2,5 г).
К раствору гидрохлорида 2-аминометил-3-хлорпиразина (содержание 70%; 7,85 ммоль, 1,7 г) в N,N-диизопропилэтиламине (39,3 ммоль, 6,84 мл) и дихлорметане (30 мл) при 0°С осторожно добавляли гидрохлорид 1-метилпиперидин-4-карбонилхлорида (9,42 ммоль, 2,2 г). Затем охлаждающую баню удаляли. Через два часа добавляли насыщенный водный раствор гидрокарбоната натрия (40 мл) и смесь пять раз экстрагировали дихлорметаном (30 мл). Органические экстракты объединяли, сушили, концентрировали и дважды упаривали с толуолом, получив при этом N-((3-хлорпиразин-2-ил)метил)-1-метилпиперидин-4-карбоксамид (1,75 г).
К раствору N-((3-хлорпиразин-2-ил)метил)-1-метилпиперидин-4-карбоксамида (6,51 ммоль, 1,75 г) в ацетонитриле (10 мл) добавляли оксихлорид фосфора (65,1 ммоль, 6,36 мл) и полученный раствор нагревали при 80°С в течение четырех часов. Реакционную смесь концентрировали в вакууме и упаривали с толуолом. Остаток охлаждали на бане со льдом и гасили 7н раствором аммиака в метаноле (50 мл) и дихлорметане (50 мл). Твердые вещества удаляли фильтрованием и фильтрат концентрировали. К остатку добавляли дихлорметан (50 мл) и 7н раствор аммиака в метаноле (1 мл). Смесь выдерживали в течение 10 минут при комнатной температуре, твердые вещества удаляли фильтрованием и фильтрат концентрировали. К остатку добавляли дихлорметан (50 мл). Смесь выдерживали в течение 10 минут при комнатной температуре, твердые вещества удаляли фильтрованием и фильтрат концентрировали, получив при этом 8-хлор-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразин (1,5 г).
8-Хлор-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразин (0,6 г) превращали в 8-метил-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразин (0,2 г) способами, описанными в примере 1, стадия 1с, и очищали продукт хроматографией на колонке (силикагель, градиент дихлорметана/метанола от 10/0 до 9/1).
Способом, описанным в примере 2, стадия 2f, при использовании 8-метил-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразина (0,19 г) был получен неочищенный 1-бром-8-метил-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразин (0,40 мг), который не очищали хроматографией на колонке. Вышеуказанное неочищенное вещество (0,032 ммоль, 10 мг) и N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (0,039 ммоль, 15,77 мг) растворяли в этаноле (0,8 мл) и толуоле (0,2 мл). Добавляли карбонат калия (0,194 ммоль, 0,097 мл) и тетракис(трифенилфосфин)-палладий(0) (1,617 мкмоль, 1,869 мг) и реакционную смесь перемешивали в течение 10 минут при 140°С (в микроволновой печи). Добавляли дихлорметан и воду, органический слой отделяли, сушили (сульфат натрия) и концентрировали. Продукт очищали препаративной ВЭЖХ (колонка Luna C18(2): градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты), получив при этом N-(2-метокси-4-(8-метил-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (8,3 мг).
СВЭЖХ: метод 0_60: Rt = 2,22 мин, (М+Н)+ = 509.
Пример 44
(S)-4-Гидроксибутан-2-ил-2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат

(S)-(+)-Бутан-1,3-диол (3,00 ммоль, 0,270 г) добавляли к перемешиваемому раствору имидазола (5,99 ммоль, 0,41 г) и трет-бутилдиметилсилилхлорида (3,00 ммоль, 0,45 г) при комнатной температуре. Смесь выдерживали в течение шести часов при комнатной температуре, затем добавляли воду (50 мл) и дважды экстрагировали дихлорметаном (20 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили (сульфат натрия) и концентрировали в вакууме, получив при этом (S)-4-(трет-бутилдиметилсилилокси)бутан-2-ол (0,654 г).
К (S)-4-(трет-бутилдиметилсилилокси)бутан-2-олу (1,649 ммоль, 337 мг) в дихлорметане (4 мл) добавляли молекулярные сита (4Å), 2-(4-изоцианато-3-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (1,374 ммоль, 378 мг) и 4-диметиламинопиридин (0,275 ммоль, 33,6 мг) и смесь перемешивали при 40°С (температура масляной бани) в течение 18 часов. Молекулярные сита удаляли фильтрованием и фильтрат промывали водой, сушили (сульфат натрия) и концентрировали в вакууме с образованием неочищенного продукта, который очищали хроматографией на колонке (силикагель, гептаны с градиентом этилацетата от 10% до 50%), получив при этом (S)-4-(трет-бутилдиметилсилилокси)бутан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамат (443). К (S)-4-(трет-бутилдиметилсилилокси)бутан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамату (240 мг) в тетрагидрофуране (1 мл) при комнатной температуре добавляли фторид тетрабутиламмония (1М раствор в тетрагидрофуране, 1,22 ммоль, 1,22 мл). Через 20 часов к реакционной смеси добавляли воду, экстрагировали дихлорметаном, органический экстракт сушили (сульфат натрия) и концентрировали в вакууме, получив при этом (S)-4-гидроксибутан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамат (268 мг), который использовали на следующей стадии без дальнейшей очистки.
Способом, описанным в примере 4, стадия 4с, при использовании 1-бром-8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразина (35 мг) и (S)-4-гидроксибутан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата (61,7 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%) был получен (S)-4-гидроксибутан-2-ил-2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат (15,5 мг).
СВЭЖХ: метод 0_60: Rt = 1,65 мин, (М+Н)+ = 455.
Пример 45
4-Фтор-N-(2-метокси-4-(8-метил-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
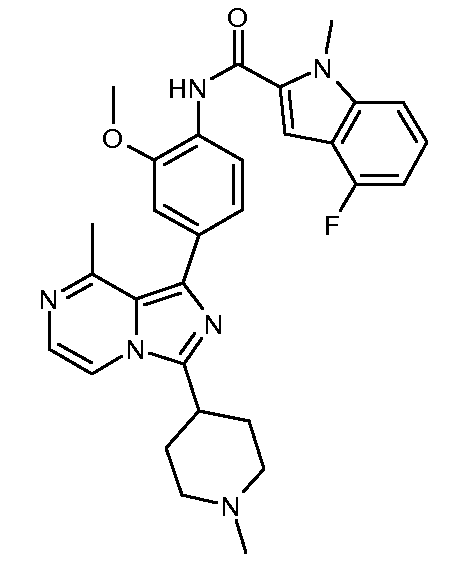
К метил-4-фтор-1Н-индол-2-карбоксилату (1,211 ммоль, 234 мг) в N,N-диметилформамиде (10 мл) при 0°С добавляли гидрид натрия (1,817 ммоль, 72,7 мг). Реакционную смесь перемешивали в течение одного часа при комнатной температуре и добавляли иодметан (1,817 ммоль, 0,113 мл, 258 мг). Смесь перемешивали в течение трех часов и добавляли воду, продукт экстрагировали дихлорметаном и концентрировали в вакууме с образованием метил-4-фтор-1-метил-1Н-индол-2-карбоксилата (264 мг). Вышеуказанное соединение растворяли в этаноле (5 мл). Затем добавляли 2н водный раствор гидроксида натрия (5,84 ммоль, 2,92 мл) и гидроксид калия (1,168 ммоль, 65,5 мг) и реакционную смесь перемешивали при 80°С в течение ночи. К реакционной смеси добавляли 2н раствор хлористоводородной кислоты и трижды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (сульфат натрия) и концентрировали, получив при этом 4-фтор-1-метил-1Н-индол-2-карбоновую кислоту (189 мг).
4-Фтор-1-метил-1Н-индол-2-карбоновую кислоту (189 мг) и пинаконовый эфир 4-амино-3-метоксифенилбороновой кислоты (244 мг) превращали в 4-фтор-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (280 мг) способом, описанным в примере 1, стадия 1е, и очищали хроматографией на колонке (силикагель, гептаны с градиентом этанола от 0 до 20%).
Способом, описанным в примере 4, стадия 4с, при использовании неочищенного 1-бром-8-метил-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразина (см. пример 43, 43,7 мг) и 4-фтор-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамида (60 мг) после очистки продукта препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты) был получен 4-фтор-N-(2-метокси-4-(8-метил-3-(1-метилпиперидин-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (4,8 мг).
СВЭЖХ: метод 0_60: Rt = 2,39 мин, (М+Н)+ = 527.
Пример 46
N-(5-Фтор-2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
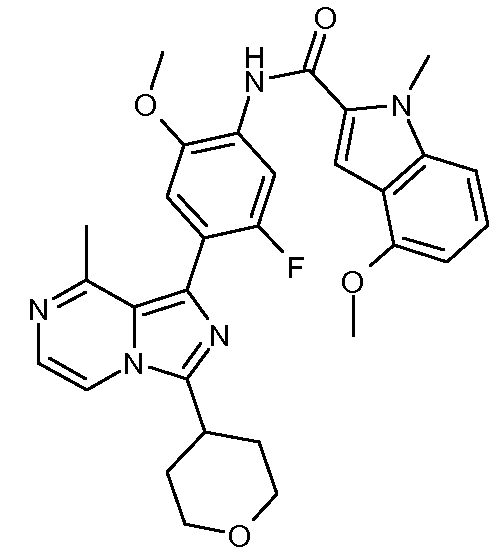
4-Метокси-1-метил-1Н-индол-2-карбоновую кислоту (0,225 ммоль, 46,1 мг) и гексафторфосфат О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (0,247 ммоль, 94 мг) добавляли при 0°С к раствору 5-фтор-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (0,225 ммоль, 60 мг) в дихлорметане (2,5 мл) и пиридине (0,5 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре и концентрировали в вакууме. К остатку добавляли воду и экстрагировали дихлорметаном. Органические экстракты промывали водой. Объединенные органические слои сушили (сульфат натрия) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель, гептаны/этилацетат), получив при этом N-(5-фтор-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид с примесями (45 мг). Вышеуказанное соединение и 1-бром-8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин подвергали взаимодействию способами, описанными в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель, гептаны/этилацетат), получив при этом N-(5-фтор-2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (9,7 мг).
СВЭЖХ: метод 40_80: Rt = 1,36 мин, (М+Н)+ = 544.
Пример 47
5-Гидроксипентан-2-ил-5-фтор-2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат, FEIJ 0247, FEIJ 0251A001

5-(Трет-бутилдиметилсилилокси)пентан-2-ил-5-фтор-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамат (полученный способами, описанными в примере 44, 82 мг) и 1-бром-8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин (47,5 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты), получив при этом 5-гидроксипентан-2-ил-5-фтор-2-метокси-4-(8-метил-3-(тетрагидро-2Н-пиран-4-ил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат (14 мг).
СВЭЖХ: метод 0_60: Rt = 2,47 мин, (М+Н)+ = 487.
Пример 48
(S)-втор-Бутил-2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат

2-(4-Изоцианато-3-метоксифенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (0,5 г) и (S)-бутан-2-ол (0,135 г) подвергали взаимодействию способом, описанным в примере 3, стадия 3с, получив при этом (S)-втор-бутил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамат (0,70 г).
Способом, описанным в примере 4, стадия 4с, при использовании 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразина (25 мг) и (S)-втор-бутил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата (22 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%) был получен (S)-втор-бутил-2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамат (15,5 мг).
СВЭЖХ: метод 0_60: Rt = 1,87 мин, (М+Н)+ = 535.
Пример 49
N-(4-(3-(1'-Ацетил-1,4'-бипиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид

К 1-ацетил-4-пиперидону (0,877 ммоль, 0,109 мл) в дихлорметане (3 мл) и уксусной кислоте (0,143 мл) в атмосфере азота добавляли 8-метил-3-(пиперидин-4-ил)имидазо[1,5-a]пиразин (0,797 ммоль, 172 мг) в дихлорметане (4 мл) и метаноле (1 мл). Через 20 минут добавляли цианоборогидрид натрия (0,877 ммоль, 55,1 мг). Смесь перемешивали при комнатной температуре в течение одного часа и добавляли 1-ацетил-4-пиперидон (0,877 ммоль, 0,109 мл) и уксусную кислоту (0,05 мл). Через 1,5 часа к реакционной смеси добавляли воду, к водному слою добавляли насыщенный водный раствор гидрокарбоната натрия и подщелачивали (рН 10) гидроксидом калия. Водную основную смесь экстрагировали дихлорметаном/метанолом (9/1) и органические экстракты концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан, содержащий 1% триэтиламина, с градиентом метанола от 0 до 10%), получив при этом 1-(4-(8-метилимидазо[1,5-a]пиразин-3-ил)-1,4'-бипиперидин-1'-ил)этанон (174 мг).
К 1-(4-(8-метилимидазо[1,5-a]пиразин-3-ил)-1,4'-бипиперидин-1'-ил)этанону (0,249 ммоль, 85 мг) в дихлорметане (2 мл) и уксусной кислоте (1,425 мл) добавляли бром (0,249 ммоль, 0,013 мл). Реакционную смесь перемешивали при комнатной температуре в течение одного часа и концентрировали в вакууме. К остатку добавляли насыщенный водный раствор гидрокарбоната натрия. Значение рН доводили до десяти, добавляя гидроксид натрия, водную основную смесь дважды экстрагировали дихлорметаном/метанолом (9/1) и органические экстракты концентрировали в вакууме, получив при этом 1-(4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-1,4'-бипиперидин-1'-ил)этанон (68 мг).
1-(4-(1-Бром-7-метилимидазо[1,5-a]пиразин-3-ил)-1,4'-бипиперидин-1'-ил)этанон (22 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (23 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты), получив при этом N-(4-(3-(1'-ацетил-1,4'-бипиперидин-4-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (5,1 мг).
СВЭЖХ: метод 0_60: Rt = 2,22 мин, (М+Н)+ = 650.
Пример 50
(S)-Пентан-2-ил-2-метокси-4-(3-((S)-1-(2-метоксиацетил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат
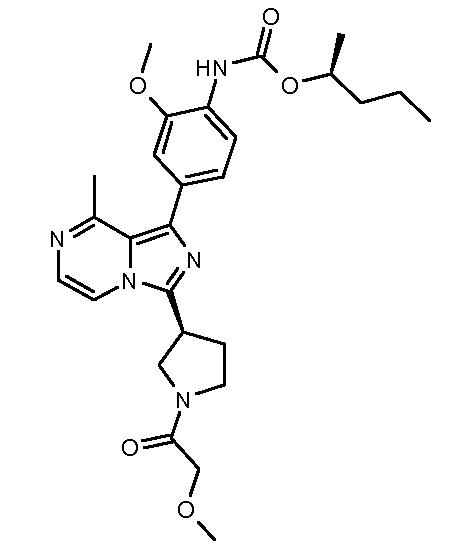
Гидрохлорид (S)-1-бром-8-метил-3-(пирролидин-3-ил)имидазо[1,5-a]пиразина был получен аналогично гидрохлориду (R)-1-бром-8-метил-3-(пирролидин-3-ил)имидазо[1,5-a]пиразина. К гидрохлориду (S)-1-бром-8-метил-3-(пирролидин-3-ил)имидазо[1,5-a]пиразина (0,31 ммоль, 100 мг) в дихлорметане (5 мл) и N,N-диизопропилэтиламине (1,778 ммоль, 0,311 мл) при 0°С добавляли раствор метоксиацетилхлорида (0,534 ммоль, 0,049 мл) в дихлорметане (0,5 мл). Реакционную смесь перемешивали в течение одного часа при комнатной температуре, разбавляли дихлорметаном, промывали насыщенным водным раствором гидрокарбоната натрия, водой, насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%), получив при этом (S)-1-(3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-ил)-2-метоксиэтанон (80 мг).
Способом, описанным в примере 4, стадия 4с, при использовании (S)-1-(3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-ил)-2-метоксиэтанона (40 мг) и (S)-пентан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата (45,3 мг) после очистки продукта хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%) был получен продукт с примесями. В результате дополнительной очистки препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты) был получен (S)-пентан-2-ил-2-метокси-4-(3-((S)-1-(2-метоксиацетил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)фенилкарбамат (29 мг).
СВЭЖХ: метод 0_60: Rt = 2,53 мин, (М+Н)+ = 510.
Пример 51
(транс)-4-(1-(3-Метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилциклопентилкарбамат
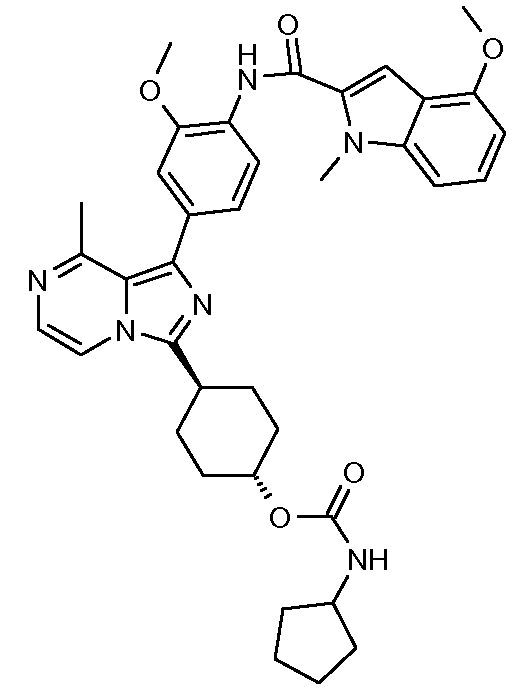
К N-(4-(3-((транс)-4-гидроксициклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамиду (0,037 ммоль, 20 мг) и N,N-диметилпиридин-4-амину (7,41 мкмоль, 0,906 мг) в дихлорметане (2 мл) добавляли циклопентилизоцианат (0,185 ммоль, 20,60 мг) и смесь перемешивали при комнатной температуре в течение ночи. Затем добавляли пиридин (2 мл) и смесь перемешивали в течение ночи при 90°С. Реакционную смесь разбавляли этилацетатом и полученную суспензию фильтровали. Фильтрат очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 5%), получив при этом (транс)-4-(1-(3-метокси-4-(4-метокси-1-метил-1Н-индол-2-карбоксамидо)фенил)-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилциклопентилкарбамат (6 мг).
СВЭЖХ: метод 40_80: Rt = 1,53 мин, (М+Н)+ = 651.
Пример 52
(R)-N-(4-(3-(1-(2-Диметиламино)-2-оксоэтил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид ТНА 1803, ТНА 1816, ТНА 1819

К гидрохлориду (R)-1-бром-8-метил-3-(пирролидин-3-ил)имидазо[1,5-a]пиразина (0,23 ммоль, 75 мг) в N,N-диметилформамиде (4 мл) и N,N-диизопропилэтиламине (1,334 ммоль, 0,233 мл) по каплям добавляли раствор 2-хлор-N,N-диметилацетамида (0,280 ммоль, 0,029 мл) в N,N-диметилформамиде (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, выливали в воду и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали водой и насыщенным раствором соли, сушили (сульфат магния), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%), получив при этом (R)-2-(3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-ил)-N,N-диметилацетамид (60 мг).
(R)-2-(3-(1-Бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-ил)-N,N-диметилацетамид (22 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-1-карбоксамид (23 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты), получив при этом (R)-N-(4-(3-(1-(2-(диметиламино)-2-оксоэтил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (28,6 мг).
СВЭЖХ: метод 0_60: Rt = 2,22 мин, (М+Н)+ = 650.
Пример 53
(R)-N-(4-(3-(1-(2-Гидроксиацетил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид

К гидрохлориду (R)-1-бром-8-метил-3-(пирролидин-3-ил)имидазо[1,5-a]пиразина (0,15 ммоль, 50 мг) в дихлорметане (4 мл) и N,N-диизопропилэтиламине (0,889 ммоль, 0,155 мл) при 0°С по каплям добавляли раствор ацетоксиацетилхлорида (0,187 ммоль, 0,020 мл) в дихлорметане (0,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение одного часа, разбавляли дихлорметаном, промывали насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 10%), получив при этом (R)-2-(3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-ил)-2-оксоэтилацетат (45 мг).
К (R)-2-(3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-ил)-2-оксоэтилацетату (0,105 ммоль, 40 мг) в метаноле (4 мл) добавляли карбонат калия (0,126 ммоль, 17,40 мг). Реакционную смесь перемешивали при комнатной температуре в течение одного часа, твердые вещества удаляли фильтрованием и фильтрат концентрировали в вакууме, получив при этом (R)-1-(3-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-1-ил)-2-гидроксиэтанон (35,6 мг). Вышеуказанное соединение (35,6 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (50 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты), получив при этом ((R)-N-(4-(3-(1-(2-гидроксиацетил)пирролидин-3-ил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (25,8 мг).
СВЭЖХ: метод 0_60: Rt = 2,38 мин, (М+Н)+ = 569.
Пример 54
4-Метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(пиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

К 1-(4-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)пиперазин-1-ил)этанону (0,108 ммоль, 45,4 мг) в этаноле добавляли 2М раствор хлористоводородной кислоты (4,32 ммоль, 2,16 мл) и перемешивали при нагревании с обратным холодильником в течение четырех часов. Реакционную смесь охлаждали, концентрировали в вакууме, дважды упаривали с толуолом и дважды промывали дихлорметаном, получив при этом гидрохлорид 1-бром-8-метил-3-((транс)-4-(пиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразина (56 мг), который использовали без дальнейшей очистки.
Гидрохлорид 1-бром-8-метил-3-((транс)-4-(пиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразина (40 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (42 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%), получив при этом 4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(пиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (8 мг).
СВЭЖХ: метод 0_60: Rt = 2,11 мин, колонка для ЖХ-МС 2: Rt 2,29 мин, (М+Н)+ = 608.
Пример 55
4-Хлор-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-пиррол-2-карбоксамид

Способами, описанными в примере 1, стадия 1е, 4-хлор-1-метил-1Н-пиррол-2-карбоновую кислоту (200 мг) превращали в хлорангидрид кислоты и подвергали взаимодействию с 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилином, получив после очистки продукта хроматографией на колонке (силикагель; градиент от гептанов до гептанов/этилацетата, 4/1) 4-хлор-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-пиррол-2-карбоксамид (240 мг).
4-Хлор-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-пиррол-2-карбоксамид (30 мг) и 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин (30 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%), получив при этом 4-хлор-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-пиррол-2-карбоксамид (21 мг).
СВЭЖХ: метод 0_60: Rt = 1,87 мин, колонка для ЖХ-МС 2: Rt 2,20 мин, (М+Н)+ = 576.
Пример 56
N-(2-Метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-6-метил-6Н-тиено[2,3-b]пиррол-5-карбоксамид
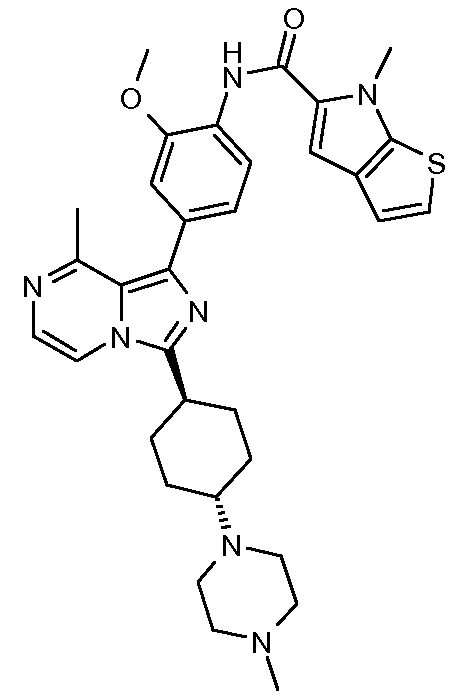
К пинаконовому эфиру 4-амино-3-метоксифенилбороновой кислоты (1340 мг, 5,38 ммоль) в тетрагидрофуране (20 мл) в атмосфере азота медленно добавляли 2М раствор этилмагний хлорида в тетрагидрофуране (2,69 мл, 5,38 ммоль) и полученный раствор нагревали с обратным холодильником в течение одного часа. Добавляли метил-6-метил-6Н-тиено[2,3-b]пиррол-5-карбоксилат (500 мг, 2,56 ммоль) и реакционную смесь нагревали с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры и выливали в насыщенный раствор соли. Смесь трижды экстрагировали этилацетатом и объединенные органические слои последовательно промывали водой и насыщенным раствором соли. Органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; гептан с градиентом этилацетата от 0 до 50%). Продукт растворяли в горячем дихлорметане и оставшиеся твердые вещества удаляли фильтрованием. Фильтрат концентрировали, остаток растворяли в горячем дихлорметане и добавляли диэтиловый эфир. Образовавшиеся твердые вещества собирали фильтрованием, промывали диэтиловым эфиром и сушили, получив при этом N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-6-метил-6Н-тиено[2,3-b]пиррол-5-карбоксамид (343 мг).
N-(2-Метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-6-метил-6Н-тиено[2,3-b]пиррол-5-карбоксамид (32 мг) и 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин (30 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%), получив при этом N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-6-метил-6Н-тиено[2,3-b]пиррол-5-карбоксамид (13 мг).
СВЭЖХ: метод 0_60: Rt = 2,07 мин, (М+Н)+ = 598.
Пример 57
N-(2-Метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фкенил)-6Н-тиено[2,3-b]пиррол-5-карбоксамид
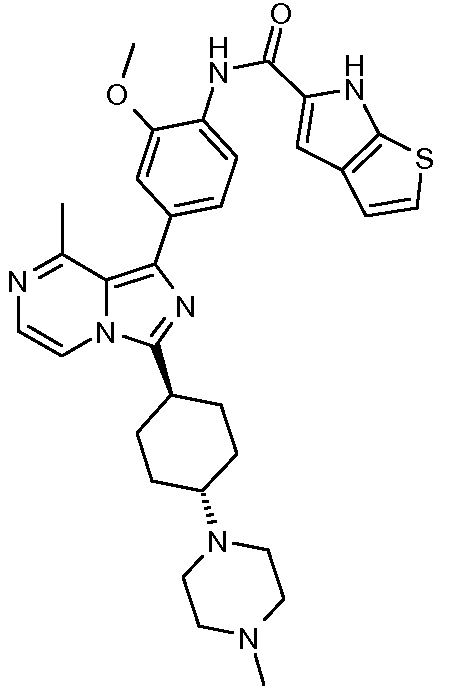
Способом, описанным в примере 56, при использовании метил-6Н-тиено[2,3-b]пиррол-5-карбоксилата вместо метил-6-метил-6Н-тиено[2,3-b]пиррол-5-карбоксилата был получен N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-6Н-тиено[2,3-b]пиррол-5-карбоксамид.
СВЭЖХ: метод 0_60: Rt = 1,80 мин, (М+Н)+ = 584.
Пример 58
N-Метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-индол-2-карбоксамид

К 4-метокси-1Н-индол-2-карбоновой кислоте (0,844 г, 4,42 ммоль) и 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилину (1 г, 4,01 ммоль) в дихлорметане (20 мл) при 0°С в атмосфере азота добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,846 г, 4,42 ммоль) и 1-гидрокси-7-азабензотриазол (0,546 г, 4,01 ммоль). Полученный коричневый раствор перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду, твердые вещества собирали фильтрованием и промывали некоторым количеством воды. Твердое вещество сушили в вакуумном сушильном шкафу при 40°С. Твердые вещества суспендировали в ацетонитриле (50 мл) и метаноле (10 мл) и нагревали при 60°С в течение 1 часа. Твердые вещества собирали фильтрованием и промывали горячим ацетонитрилом. Затем твердые вещества перемешивали в дихлорметане в течение ночи. Смесь фильтровали через фильтр. Фильтрат концентрировали в вакууме, получив при этом 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-индол-2-карбоксамид (1,1 г).
4-Метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-индол-2-карбоксамид (32 мг) и 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин (30 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%), получив при этом 4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-индол-2-карбоксамид (11 мг).
СВЭЖХ: метод 0_60: Rt = 1,95 мин, (М+Н)+ = 608.
Пример 59
4-Гидрокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
59а. Синтез 2-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамоил)-1-метил-1Н-индол-4-илацетата
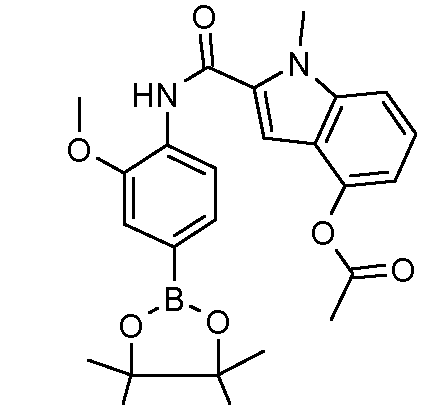
К 4-метокси-1-метил-1Н-индол-2-карбоновой кислоте (2,92 ммоль, 600 мг) в дихлорметане (30 мл) в атмосфере азота добавляли трибромид бора (6,96 ммоль, 671 мкл, 1745 мг), поддерживая температуру в интервале от 0 до 5°С. Реакционную смесь перемешивали при комнатной температуре в течение трех часов, обрабатывали 2н водным раствором гидроксида натрия (рН 9) и перемешивали еще 10 минут. Водную фазу отделяли и нейтрализовали 2н раствором хлористоводородной кислоты при 0°С (рН между 6 и 7). Образовавшийся осадок собирали фильтрованием и дважды упаривали с толуолом, получив при этом 4-гидрокси-1-метил-1Н-индол-2-карбоновую кислоту (223 мг).
К 4-гидрокси-1-метил-1Н-индол-2-карбоновой кислоте (0,262 ммоль, 50 мг) в дихлорметане (1 мл) и триэтиламине (2,62 ммоль, 365 мкл) при 0°С добавляли ацетилхлорид (0,266 ммоль, 19 мкл) и реакционную смесь перемешивали при комнатной температуре в течение одного часа. Реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия и дважды экстрагировали дихлорметаном. Органические слои объединяли, сушили (Na2SO4) и концентрировали при пониженном давлении, получив при этом 4-ацетокси-1-метил-1Н-индол-2-карбоновую кислоту (67 мг).
К 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилину (0,201 ммоль, 50 мг) и N,N-диизопропилэтиламину (0,401 ммоль, 0,066 мл) в дихлорметане в атмосфере азота при 0°С добавляли 4-ацетокси-1-метил-1Н-индол-2-карбоновую кислоту (0,201 ммоль, 46,8 мг) и гексафторфосфат О-(7-азобензотриазол-1-ил)-1,1,3,3-тетраметилурония (0,221 ммоль, 84 мг). Реакционную смесь перемешивали при комнатной температуре в течение 5 дней. Реакционную смесь концентрировали в вакууме и очищали хроматографией на колонке (силикагель; дихлорметан), получив при этом 2-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамоил)-1-метил-1Н-индол-4-илацетат (53 мг).
1H ЯМР: δ 1,35 (с, 12H), 2,45 (с, 3H), 3,99 (с, 3H), 4,10 (с, 3H), 6,90 (с, 1H), 6,92 (м, 1H), 7,25-7,38 (м, 3H), 7,50 (д, J=9 Гц, 1H), 8,48 (д, J=9 Гц, 1H), 8,68 (ушир.с, 1H).
59b. Синтез 4-гидрокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамида
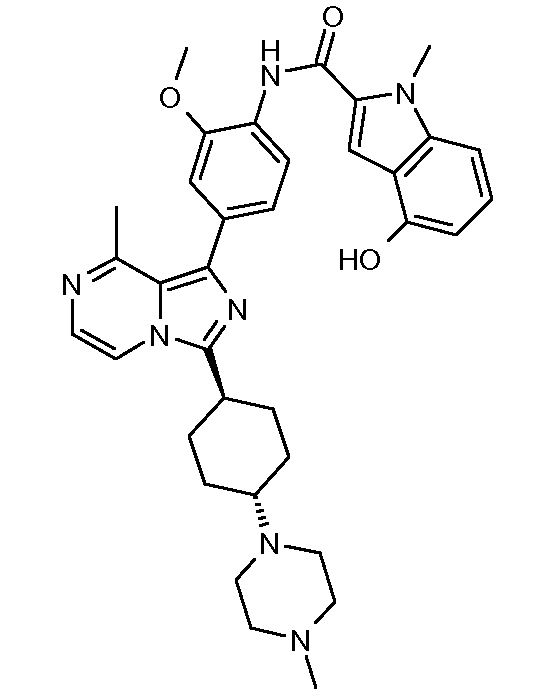
2-(2-Метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамоил)-1-метил-1Н-индол-4-илацетат (36 мг) и 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин (30 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20% (с несколькими каплями аммиака)), получив при этом 2-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенилкарбамоил)-1-метил-1Н-индол-4-илацетат. Указанный продукт перемешивали с 7н раствором аммиака в метаноле в течение 1 часа при комнатной температуре, концентрировали в вакууме, растворяли в ацетонитриле и фильтровали. Фильтрат концентрировали в вакууме, получив при этом 4-гидрокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (15 мг).
СВЭЖХ: метод 0_60: Rt = 2,07 мин, (М+Н)+ = 608.
Пример 60
(S)-Пентан-2-ил-4-(3-((транс)-4-(аминометил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат

К (транс)-4-(аминометил)циклогексанкарбоновой кислоте (10 г, 44,5 ммоль) в 1,4-диоксане (75 мл) и воде (75 мл) по каплям добавляли бензилхлорформиат (6,99 мл, 49,0 ммоль). Значение рН сохраняли в интервале от 7 до 8, добавляя насыщенный водный раствор карбоната натрия. Реакционную смесь перемешивали в течение двух часов и концентрировали в вакууме до половины объема. Добавляли 1М водный раствор гидроксида натрия до рН=9 и смесь экстрагировали диэтиловым эфиром. Добавляли 2М раствор хлористоводородной кислоты до рН=1 и смесь дважды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (Na2SO4) и концентрировали с образованием (транс)-4-((бензилоксикарбониламино)метил)циклогексанкарбоновой кислоты (12,03 г).
Смесь гидрохлорида (3-хлорпиразин-2-ил)метанамина (5 г, 21,38 ммоль), (транс)-4-((бензилоксикарбониламино)метил)циклогексанкарбоновой кислоты (6,23 г, 21,38 ммоль), гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (4,51 г, 23,52 ммоль), 1-гидрокси-7-азабензотриазола (1,455 г, 10,69 ммоль) и триэтиламина (4,76 мл, 34,2 ммоль) в дихлорметане (60 мл) перемешивали при комнатной температуре в течение ночи. Смесь концентрировали и остаток очищали хроматографией на колонке (силикагель, дихлорметан с градиентом метанола от 0,5 до 5%), получив при этом бензил((транс)-4-((3-хлорпиразин-2-ил)метилкарбамоил)циклогексил)метилкарбамат (8,79 г).
К бензил((транс)-4-((3-хлорпиразин-2-ил)метилкарбамоил)циклогексил)метилкарбамату (8,79 г, 18,98 ммоль) в безводном ацетонитриле (90 мл) добавляли оксихлорид фосфора (5,31 мл, 56,9 ммоль) и N,N-диметилформамид (одну каплю) и смесь перемешивали при 60°С в течение ночи. Затем смесь концентрировали, остаток растворяли в дихлорметане и гасили избытком 7М раствора аммиака в метаноле. Смесь снова концентрировали и остаток очищали хроматографией на колонке (силикагель, дихлорметан с градиентом метанола от 0 до 5%), получив при этом бензил((транс)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил)метилкарбамат (6,58 г).
К суспензии бензил((транс)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексил)метилкарбамата (6,58 г, 16,50 ммоль) и карбоната калия (3,42 г, 24,74 ммоль) в 1,4-диоксане (200 мл) добавляли (после промывки азотом) триметилбороксин (13,84 мл, 49,5 ммоль) и дихлорид 1,1'-бис(дифенилфосфино)ферроценпалладия(II) (1,217 г, 1,650 ммоль). Реакционную смесь перемешивали при 100°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры, фильтровали через целит и целит промывали этилацетатом. Фильтрат концентрировали и остаток очищали хроматографией на колонке (силикагель, этилацетат с градиентом метанола от 0 до 10%), получив при этом бензил((транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метилкарбамат (3,52 г).
К бензил((транс)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метилкарбамату (3,52 г, 9,05 ммоль) в N,N-диметилформамиде (35 мл) добавляли N-бромсукцинимид (1,611 г, 9,05 ммоль) и смесь перемешивали при комнатной температуре в течение четырех часов. Реакционную смесь гасили насыщенным водным раствором гидрокарбоната натрия и трижды экстрагировали дихлорметаном. Объединенные органические слои промывали насыщенным раствором соли, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель, дихлорметан с градиентом метанола от 0 до 5%), получив при этом бензил((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метилкарбамат (3,01 г).
Бензил((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метилкарбамат (1,5 г, 3,28 ммоль) растворяли в 33% растворе бромистоводородной кислоты в уксусной кислоте (15 мл, 3,28 ммоль) и полученную смесь перемешивали при комнатной температуре. Через восемь часов реакционную смесь концентрировали в вакууме и сушили в вакуумном сушильном шкафу (40°С) в течение трех дней, получив при этом гидробромид ((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метанамина (1,77 г).
Способом, описанным в примере 4, стадия 4с, при использовании гидробромида ((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метанамина (30 мг) и (S)-пентан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамата (34 мг) был получен (S)-пентан-2-ил-4-(3-((транс)-4-(аминометил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат (13 мг).
СВЭЖХ: метод 0_60: Rt = 2,33 мин, (М+Н)+ = 480.
Пример 61
1-Метил-N-(4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-индол-2-карбоксамид
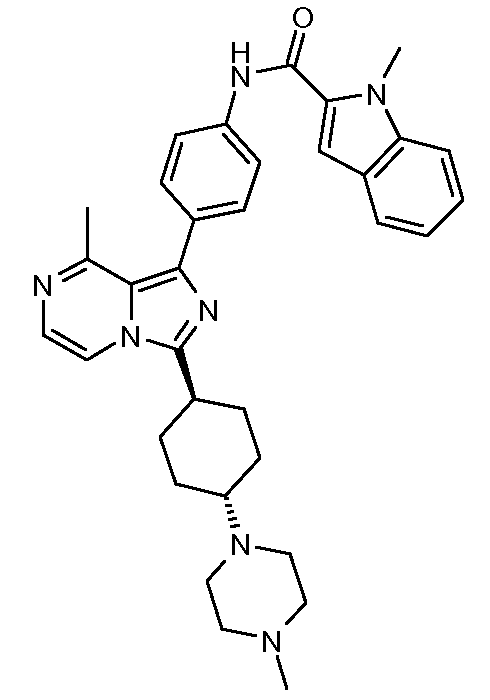
1-Метил-N-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-индол-2-карбоксамид (29 мг), полученный из 1-метил-1Н-индол-2-карбоновой кислоты, который сначала был превращен в хлорангидрид кислоты и затем подвергнут взаимодействию с 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилином, и 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин (30 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%), получив при этом 1-метил-N-(4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-индол-2-карбоксамид (12 мг).
СВЭЖХ: метод 0_60: Rt = 2,00 мин, (М+Н)+ = 562.
Пример 62
N-(2-Гидрокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид

К суспензии 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразина (0,714 ммоль, 280 мг) и 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (0,714 ммоль, 178 мг) в диоксане (5 мл) добавляли 2М водный раствор карбоната калия (3,57 ммоль, 1,78 мл). Смесь дегазировали и помещали в атмосферу азота. Затем добавляли комплекс хлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(II) с дихлорметаном (0,050 ммоль, 40,4 мг) и реакционную смесь нагревали до 89°С. Через три часа реакционную смесь разбавляли ацетонитрилом (9 мл) и фильтровали через декалит. Фильтрат концентрировали в вакууме и остаток очищали хроматографией на колонке (силикагель; градиент от дихлорметана до дихлорметана/метанола, 5/1), получив при этом 2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)анилин (115 мг).
К 2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)анилину (0,152 ммоль, 66 мг) в дихлорметане (1,4 мл) при 0-5°С добавляли трибромид бора (0,758 ммоль, 73 мкл) в атмосфере азота. Реакционную смесь перемешивали в течение трех часов при комнатной температуре. Затем добавляли дополнительное количество трибромида бора (0,758 ммоль, 73 мкл). Через 30 минут реакционную смесь гасили метанолом и перемешивали в течение ночи. Образовавшееся твердое вещество удаляли фильтрованием и фильтрат концентрировали в вакууме. Добавляли воду и смесь дважды упаривали с толуолом. Неочищенный продукт растворяли в метаноле, добавляли силикагель, концентрировали в вакууме и остаток вводили в колонку с силикагелем для очистки (градиент от дихлорметана до дихлорметана/метанола, 5/1), получив при этом 2-амино-5-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенол с примесями (116 мг, содержание примесей примерно 20%), который использовали без дальнейшей очистки.
4-Метокси-1-метил-1Н-индол-2-карбонилхлорид (описанный в примере 2g) (0,048 ммоль, 10,64 мг) добавляли в атмосфере азота при 0°С к раствору 2-амино-5-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенола (116 мг вещества с примесями) и N,N-диизопропилэтиламина (0,145 ммоль, 24 мкл) в дихлорметане. Смесь перемешивали при комнатной температуре в течение одного часа. Продукт очищали хроматографией на колонке (силикагель; градиент от дихлорметана до дихлорметана/метанола, 5/1) и затем ВЭЖХ (колонка: X-bridge; элюенты: ацетонитрил/метанол/вода с постоянным содержанием 0,003М трифторуксусной кислоты). Требуемые фракции собирали, подщелачивали водным раствором карбоната натрия и экстрагировали дихлорметаном, органический слой сушили (Na2SO4) и концентрировали в вакууме, получив при этом N-(2-гидрокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (7 мг).
СВЭЖХ: метод 0_60: Rt = 1,92 мин, (М+Н)+ = 608.
Пример 63
4-Метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-((метиламино)метил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид
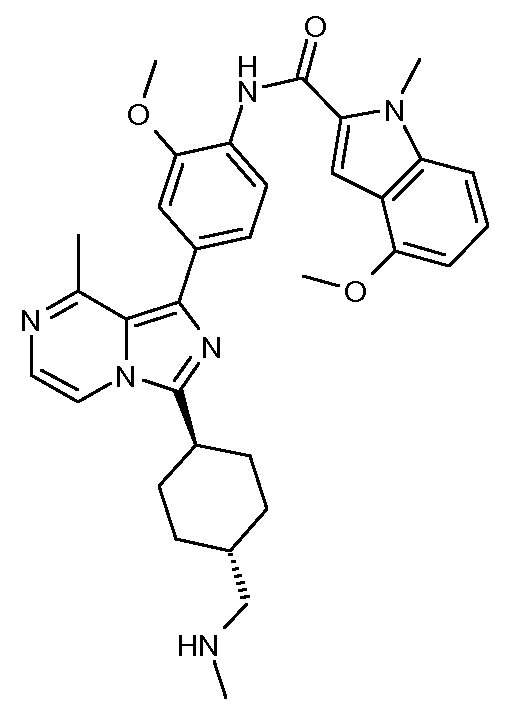
К бензил((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метилкарбамату (0,656 ммоль, 300 мг) в N,N-диметилформамиде (6 мл) добавляли гидрид натрия (60% мас./мас. в минеральном масле, 0,656 ммоль, 26,2 мг). Реакционную смесь перемешивали в течение пяти минут, добавляли иодметан (0,659 ммоль, 41 мкл) и перемешивали в течение 18 часов при комнатной температуре. Затем реакционную смесь по каплям вводили в смесь воды со льдом, добавляли этилацетат и слои разделяли. Органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; градиент от гептана до этилацетата) с образованием продукта (141 мг) в виде смеси требуемого бензил((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метил(метил)карбамата и исходного вещества.
Бензил((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метил(метил)карбамат с примесями (0,299 ммоль, 141 мг) в 37% хлористоводородной кислоте (20,94 ммоль, 1,745 мл) перемешивали в течение 18 часов при комнатной температуре и в течение одного часа при 40°С. Реакционную смесь концентрировали в вакууме. Остаток растворяли в воде и дважды промывали диэтиловым эфиром. Водный слой подщелачивали 2н водным раствором гидроксида натрия и дважды экстрагировали дихлорметаном. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме, получив при этом 1-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)-N-метилметанамин с примесями (91 мг).
1-((Транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)-N-метилметанамин с примесями (20 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (26 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20% (содержащим 0,1% гидроксида аммония), получив при этом 4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-((метиламино)метил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (5,6 мг).
СВЭЖХ: метод 0_60: Rt = 2,26 мин, (М+Н)+ = 567.
Пример 64
N-(4-(3-((Транс)-4-((диметиламино)метил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
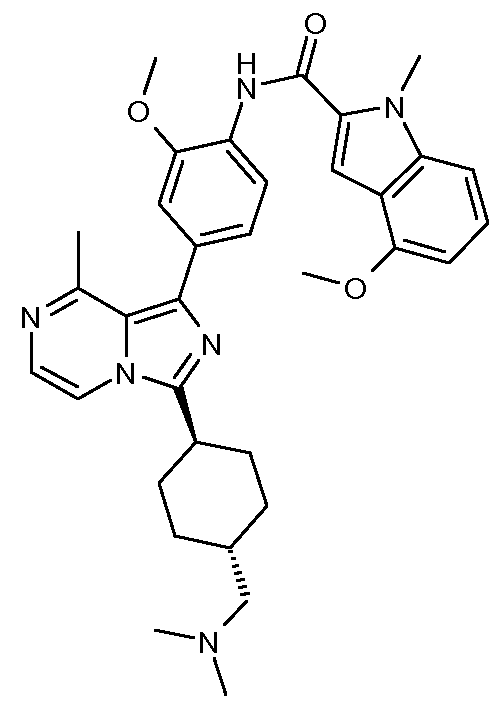
К перемешиваемой смеси 1-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)-N-метилметанамина (0,148 ммоль, 50 мг) и 37% водного раствора формальдегида (0,445 ммоль, 33,4 мкл) добавляли цианоборогидрид натрия (0,163 ммоль, 10,25 мг). Реакционную смесь перемешивали в течение 30 минут, добавляли уксусную кислоту до достижения нейтрального значения рН реакционной смеси. Смесь продолжали перемешивать еще один час, в течение которого сохраняли нейтральное значение рН, добавляя уксусную кислоту. Реакционную смесь концентрировали в вакууме. К остатку добавляли дихлорметан и 2н водный раствор гидроксида натрия и органический слой отделяли. Водный слой дважды промывали дихлорметаном. Объединенные органические слои сушили (Na2SO4) и концентрировали в вакууме, получив при этом 1-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)-N,N-диметилметанамин (57 мг).
1-((Транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)-N,N-диметилметанамин (26 мг) и 4-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (32 мг) использовали в соответствии со способом, описанным в примере 4, стадия 4с, и неочищенный продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты). Требуемые фракции собирали и подщелачивали водным раствором гидрокарбоната натрия, экстрагировали дихлорметаном, органический слой сушили (Na2SO4) и концентрировали в вакууме, получив при этом N-(4-(3-((транс)-4-((диметиламино)метил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (12 мг).
СВЭЖХ: метод 0_60: Rt = 2,24 мин, (М+Н)+ = 581.
Пример 65
(S)-Пентан-2-ил-4-(3-((транс)-4-((диметиламино)метил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат
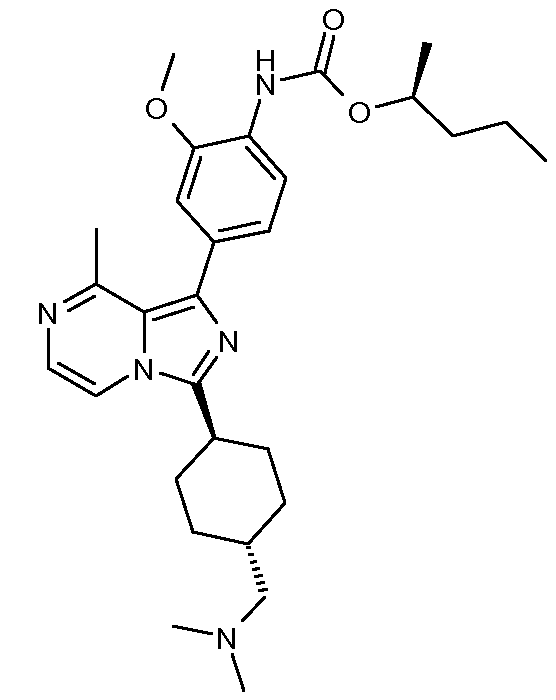
1-((Транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)-N,N-диметилметанамин (26 мг) и (S)-пентан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамат (27 мг) использовали в соответствии со способом, описанным в примере 4, стадия 4с, и неочищенный продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты). Требуемые фракции собирали, подщелачивали водным раствором гидрокарбоната натрия и экстрагировали дихлорметаном, органический слой сушили (Na2SO4) и концентрировали в вакууме, получив при этом (S)-пентан-2-ил-4-(3-((транс)-4-((диметиламино)метил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат (9 мг).
СВЭЖХ: метод 0_60: Rt = 2,20 мин, (М+Е)+ = 508.
Пример 66
6-Метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-индазол-3-карбоксамид

К этил-6-метокси-1Н-индазол-3-карбоксилату (0,415 ммоль) в метаноле (5 мл) добавляли 4н водный раствор гидроксида натрия (8 мл, 32,0 ммоль). Реакционную смесь перемешивали в течение двух часов, причем к концу указанного периода реакция все еще не закончилась, и добавляли 6 мл 4н раствора NaOH. После окончания реакции метанол выпаривали и водный слой промывали этилацетатом. Затем водный слой подкисляли и дважды экстрагировали этилацетатом. Органические слои объединяли, сушили (Na2SO4) и концентрировали в вакууме с образованием 6-метокси-1Н-индазол-3-карбоновой кислоты (64 мг) в виде коричневого твердого вещества.
К 6-метокси-1Н-индазол-3-карбоновой кислоте (64 мг, 0,333 ммоль) в дихлорметане (10 мл) добавляли 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (166 мг, 0,666 ммоль), гексафторфосфат О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (190 мг, 0,500 ммоль) и N,N-диизопропилэтиламин (0,174 мл, 0,999 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на колонке (силикагель; дихлорметан/метанол, 99/1) и еще раз хроматографией на колонке (силикагель; гептан/этилацетат, 2/1), получив при этом 6-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-индазол-3-карбоксамид (54 мг).
6-Метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-индазол-3-карбоксамид (28 мг) и 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин (26 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты). Требуемые фракции собирали, подщелачивали водным раствором гидрокарбоната натрия и экстрагировали дихлорметаном, органический слой сушили (Na2SO4) и концентрировали в вакууме, получив при этом 6-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1Н-индазол-3-карбоксамид (7,5 мг).
СВЭЖХ: метод 0_60: Rt = 1,61 мин, (М+Н)+ = 609.
Пример 67
5-Хлор-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-пирроло[2,3-b]пиридин-2-карбоксамид

К перемешиваемому раствору метил-5-хлор-1Н-пирроло[2,3-b]пиридин-2-карбоксилата (0,986 г, 4,68 ммоль) и N,N-диметилформамида (20 мл) при комнатной температуре в атмосфере азота добавляли карбонат калия (0,647 г, 4,68 ммоль). Через 30 минут добавляли иодметан (0,321 мл, 5,15 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный раствор соли и смесь трижды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (Na2SO4) и концентрировали в вакууме. Остаток наносили на водяную матрицу и очищали хроматографией на колонке (силикагель; гептан/этилацетат, 4/1) с образованием метил-5-хлор-1-метил-1Н-пирроло[2,3-b]пиридин-2-карбоксилата (0,89 г).
К 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилину (2,073 г, 8,32 ммоль) в безводном тетрагидрофуране (20 мл) в атмосфере азота добавляли 2М раствор этилмагний хлорида в тетрагидрофуране (4,16 мл, 8,32 ммоль) и смесь нагревали с обратным холодильником в течение одного часа. К теплой реакционной смеси добавляли метил-5-хлор-1-метил-1Н-пирроло[2,3-b]пиридин-2-карбоксилат (0,89 г, 3,96 ммоль) в тетрагидрофуране (10 мл) и полученную смесь нагревали в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали. Остаток поглощали этилацетатом и четыре раза промывали 0,5н раствором хлористоводородной кислоты. Органический слой промывали насыщенным раствором соли, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; градиент от гептана до гептана/этилацетата, 1/1), получив при этом 5-хлор-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-пирроло[2,3-b]пиридин-2-карбоксамид (1,47 г).
5-Хлор-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-пирроло[2,3-b]пиридин-2-карбоксамид (34 мг) и 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин (30 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20% (содержащим 0,1% гидроксида аммония), получив при этом 5-хлор-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-пирроло[2,3-b]пиридин-2-карбоксамид (27 мг).
СВЭЖХ: метод 0_60: Rt = 1,98 мин, (М+Н)+ = 627.
Пример 68
N-(4-(3-((Транс)-4-(ацетамидометил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид

К ((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метанамину (0,464 ммоль, 150 мг) в дихлорметане (5 мл) при 0°С добавляли триэтиламин (0,466 ммоль, 65 мкл) и ацетилхлорид (0,510 ммоль, 36,4 мкл). Смесь перемешивали при комнатной температуре в течение одного часа и добавляли воду. Органический слой отделяли, сушили (Na2SO4) и концентрировали в вакууме, получив при этом N-(((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил))циклогексил)метил)ацетамид (96 мг).
6-Метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-индазол-3-карбоксамид (24 мг) и N-(((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метил)ацетамид (20 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты). Требуемые фракции собирали, подщелачивали водным раствором гидрокарбоната натрия и экстрагировали дихлорметаном, органический слой сушили (Na2SO4) и концентрировали в вакууме, получив при этом N-(4-(3-((транс)-4-(ацетамидометил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (15 мг).
СВЭЖХ: метод 40_80: Rt = 0,79 мин, (М+Н)+ = 595.
Пример 69
(S)-Пентан-2-ил-4-(3-((транс)-4-(ацетамидометил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат

(S)-Пентан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамат (20 мг) и N-(((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метил)ацетамид (20 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты). Требуемые фракции собирали, подщелачивали водным раствором гидрокарбоната натрия и экстрагировали дихлорметаном, органический слой сушили (Na2SO4) и концентрировали в вакууме, получив при этом (S)-пентан-2-ил-4-(3-((транс)-4-(ацетамидометил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат (16 мг).
СВЭЖХ: метод 40_80: Rt = 0,81 мин, (М+Н)+ = 522.
Пример 70
(S)-Пентан-2-ил-4-(3-((транс)-4-(метоксикарбонилметил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат

К ((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метанамину (0,464 ммоль, 150 мг) в дихлорметане (5 мл) при 0°С добавляли триэтиламин (0,464 ммоль, 64,7 мкл) и метилкарбохлоридат (0,505 ммоль, 39 мкл). Смесь перемешивали при комнатной температуре в течение одного часа и добавляли воду. Органический слой отделяли, сушили (Na2SO4) и концентрировали в вакууме, получив при этом метил((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метилкарбамат (97 мг).
(S)-Пентан-2-ил-2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенилкарбамат (19 мг) и метил((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)метилкарбамат (20 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты). Требуемые фракции собирали, подщелачивали водным раствором гидрокарбоната натрия и экстрагировали дихлорметаном, органический слой сушили (Na2SO4) и концентрировали в вакууме, получив при этом (S)-пентан-2-ил-4-(3-((транс)-4-(метоксикарбонилметил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенилкарбамат (16 мг).
СВЭЖХ: метод 40_80: Rt = 1,08 мин, (М+Н)+ = 538.
Пример 71
4-Метокси-N-(2-метокси-4-(8-метил-3-(4-оксоциклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

К гидрохлориду 2-аминометил-3-хлорпиразина (содержание 76%, 69,4 ммоль, 16,43 г), цис-4-гидроксициклогексанкарбоновой кислоте (69,4 ммоль, 10 г), гидрохлориду 1-(3-диметиламинопропил-3-этилкарбодиимида (104 ммоль, 19,95 г), 4-диметиламинопиридину (6,94 ммоль, 0,847 г) в дихлорметане (200 мл) добавляли N,N-диизопропилэтиламин (173 ммоль, 30,3 мл, 22,41 г) до достижения рН 8 и реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Смесь концентрировали в вакууме, добавляли этилацетат и воду и органический слой отделяли. Водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0% до 7%). Все фракции, содержащие продукт, объединяли и концентрировали в вакууме. Остаток растворяли в дихлорметане (400 мл) и промывали 2М водным раствором гидроксида натрия (три раза, 100 мл) и насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме, получив при этом (цис)-N-((3-хлорпиразин-2-ил)метил)-4-гидроксициклогексанкарбоксамид (15,47 г).
К (цис)-N-((3-хлорпиразин-2-ил)метил)-4-гидроксициклогексан-карбоксамиду (57,4 ммоль, 15,47 г) и 4-диметиламинопиридину (5,74 ммоль, 0,701 г) в пиридине (125 мл) при 0°С по каплям добавляли уксусный ангидрид (60,2 ммоль, 5,69 мл) и смесь перемешивали при комнатной температуре в течение одного часа. Затем реакционную смесь гасили 4н раствором хлористоводородной кислоты до достижения рН 4 и трижды экстрагировали этилацетатом. Объединенные органические слои сушили (MgSO4) и концентрировали в вакууме. Остаток поглощали толуолом и снова концентрировали в вакууме. Остаток растворяли в дихлорметане (100 мл) и промывали 1М раствором хлористоводородной кислоты (100 мл). Органический слой промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме, получив при этом (цис)-4-((3-хлорпиразин-2-ил)метилкарбамоил)циклогексилацетат (16,5 г).
К (цис)-4-((3-хлорпиразин-2-ил)метилкарбамоил)циклогексилацетату (52,9 ммоль, 16,5 г) в ацетонитриле (150 мл) по каплям последовательно добавляли оксихлорид фосфора (159 ммоль, 14,80 мл) и N,N-диметилформамид (2,65 ммоль, 0,206 мл). Реакционную смесь перемешивали при 70°С в течение одного часа. Затем реакционную смесь охлаждали до комнатной температуры и по каплям добавляли к смеси 25% гидроксида аммония (125 мл) и измельченного льда (350 мл). Смесь перемешивали в течение 30 минут при комнатной температуре и не совсем белое твердое вещество отделяли фильтрованием и промывали водой. Твердые вещества растворяли в дихлорметане (200 мл) и промывали водой (50 мл) и насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме с образованием (цис)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексилацетата (10,9 г). Вторая порция вещества была получена в результате двукратной экстракции фильтрата дихлорметаном/метанолом (10/1, 275 мл). Органические слои объединяли и промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме, получив при этом дополнительное количество (цис)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексилацетата (3,2 г).
К (цис)-4-(8-хлоримидазо[1,5-a]пиразин-3-ил)циклогексилацетату (48,0 ммоль, 14,09 г) в безводном диоксане (275 мл) в атмосфере азота добавляли сухой карбонат калия (71,9 ммоль, 9,94 г), триметилбороксин (144 ммоль, 20,03 мл, 50% мас. раствор в тетрагидрофуране) и комплекс 1,1'-бис(дифенилфосфино)ферроценпалладия(II) с дихлорметаном (4,80 ммоль, 3,88 г) и реакционную смесь перемешивали при 95°С в течение одного часа. Реакционную смесь охлаждали до комнатной температуры, фильтровали через декалит, фильтр промывали диоксаном и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 6%), получив при этом (цис)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетат (12,8 г).
К (цис)-4-(8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетату (46,8 ммоль, 12,8 г) в N,N-диметилформамиде (100 мл) добавляли N-бромсукцинимид (46,8 ммоль, 8,33 г). Реакционную смесь перемешивали при комнатной температуре в течение одного часа, выливали в воду и дважды экстрагировали дихлорметаном. Объединенные органические слои дважды промывали водой и затем промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 3%), получив при этом (цис)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетат (15,34 г).
К раствору (цис)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексилацетата (43,6 ммоль, 15,34 г) в ацетонитриле (40 мл) добавляли гидроксид калия (218 ммоль, 12,22 г) в воде (40 мл) и смесь перемешивали при 100°С в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры, подкисляли 2н раствором хлористоводородной кислоты и дважды экстрагировали дихлорметаном. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали в вакууме, получив при этом (цис)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексанол (9,37 г).
К (цис)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексанолу (16,12 ммоль, 5 г) и N-оксиду 4-метилморфолина (32,2 ммоль, 3,78 г) в ацетоне (60 мл) добавляли перрутенат(VII) тетра-N-пропиламмония (0,806 ммоль, 0,283 г) и реакционную смесь перемешивали при комнатной температуре в течение одной ночи. Затем реакционную смесь фильтровали через декалит, фильтр промывали этилацетатом и фильтрат концентрировали в вакууме. К остатку последовательно добавляли ацетон (40 мл), N-оксид 4-метилморфолина (32,2 ммоль, 3,78 г) и перрутенат(VII) тетра-N-пропиламмония (0,806 ммоль, 0,283 г) и реакционную смесь перемешивали при комнатной температуре в течение двух часов. Затем реакционную смесь фильтровали через декалит, фильтр промывали этилацетатом и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 4%), в результате чего было получено вещество с примесями (3,53 г), которое затвердело через одну ночь. Твердое вещество растирали в порошок в диэтиловом эфире (8 мл), и твердые вещества собирали и сушили в вакууме, получив при этом 4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексанон (2,7 г).
6-Метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-индазол-3-карбоксамид (111 мг) и 4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексанон (75 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 4%), получив при этом вещество с примесями. В результате дополнительной очистки хроматографией на колонке (силикагель; градиент от гептана/этилацетата, 3/7, до этилацетата с последующим использованием дихлорметана с градиентом метанола от 0 до 10%) был получен 4-метокси-N-(2-метокси-4-(8-метил-3-(4-оксоциклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (12 мг).
СВЭЖХ: метод 0_60: Rt = 2,73 мин, (М+Н)+ = 538.
Пример 72
N-(4-(3-((Транс)-4-гидрокси-4-((метиламино)метил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид
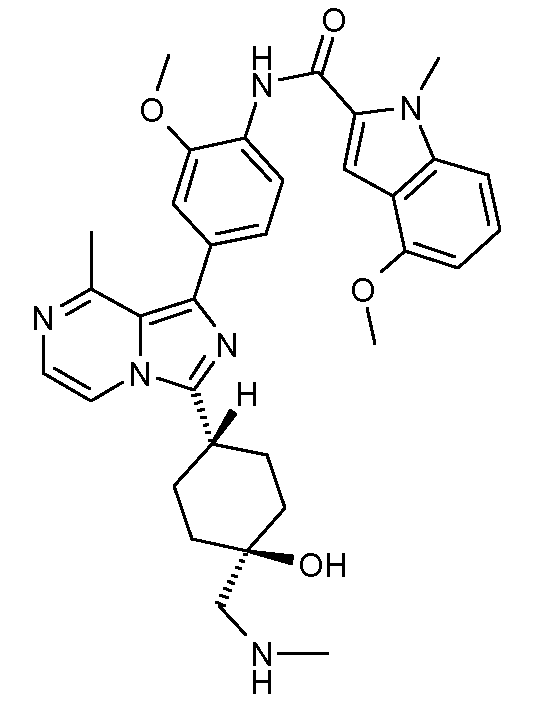
К иодиду триметилсульфоксония (0,243 ммоль, 53,6 мг) в безводном диметилсульфоксиде (0,5 мл) в атмосфере азота при комнатной температуре добавляли трет-бутоксид калия (0,243 ммоль, 27,3 мг). Смесь перемешивали в течение 30 минут и добавляли 4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексанон (0,162 ммоль, 50 мг) в виде твердого вещества. Через один час добавляли воду (5 мл) и смесь пять раз экстрагировали дихлорметаном. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме. Продукт очищали хроматографией на колонке (силикагель; дихлорметан/метанол, 10/1) получив при этом 1-бром-8-метил-3-((транс)-1-оксаспиро[2.5]октан-6-ил)имидазо[1,5-a]пиразин (47 мг).
1-Бром-8-метил-3-((транс)-1-оксаспиро[2.5]октан-6-ил)имидазо[1,5-a]пиразин (22 мг) растворяли в 33% растворе метиламина в этаноле (32,1 ммоль, 4 мл). Реакционную смесь выдерживали в течение 16 часов при комнатной температуре и концентрировали в вакууме с образованием неочищенного (транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-1-((метиламино)метил)циклогексанола (26 мг).
6-Метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-индазол-3-карбоксамид (33 мг) и (транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-1-((метиламино)метил)циклогексанол (22 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%) с образованием вещества с примесями. К указанному продукту добавляли ацетонитрил (5 мл) и твердые вещества удаляли фильтрованием. Фильтрат концентрировали в вакууме, промывали несколькими миллилитрами гептанов и сушили в вакууме, получив при этом N-(4-(3-((транс)-4-гидрокси-4-((метиламино)метил)циклогексил)-8-метилимидазо[1,5-a]пиразин-1-ил)-2-метоксифенил)-4-метокси-1-метил-1Н-индол-2-карбоксамид (23 мг).
СВЭЖХ: метод 0_60: Rt = 2,17 мин, (М+Н)+ = 583.
Пример 73
4-Метокси-N-(2-метокси-4-(8-метил-3-(1-метил-5-оксопирролидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

Гидрохлорид (3-хлорпиразин-2-ил)метанамина (содержание 77%, 1,634 г, 6,99 ммоль) и 1-метил-5-оксопирролидин-3-карбоновую кислоту (1,000 г, 6,99 ммоль) суспендировали в дихлорметане (20 мл) и реакционную смесь охлаждали до 0°С в атмосфере аргона. Добавляли N,N-диизопропилэтиламин (3,05 мл, 17,48 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,474 г, 7,69 ммоль) и 1-гидрокси-7-азабензотриазол (0,476 г, 3,50 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Из реакционной смеси выпаривали растворители с образованием темно-коричневого масла. Неочищенный продукт очищали хроматографией на колонке (силикагель; дихлорметан/метанол, 96/4), в результате чего было получено вещество с примесями, которое очищали хроматографией на колонке (силикагель; дихлорметан/метанол, 99/1), получив при этом N-((3-хлорпиразин-2-ил)метил)-1-метил-5-оксопирролидин-3-карбоксамид (1,24 г).
К перемешиваемой суспензии N-((3-хлорпиразин-2-ил)метил)-1-метил-5-оксопирролидин-3-карбоксамида (700 мг, 2,61 ммоль) и карбоната калия (540 мг, 3,91 ммоль) в 1,4-диоксане (10 мл) в атмосфере азота добавляли триметилбороксин (981 мг, 7,82 ммоль) и дихлорид 1,1'-бис(дифенилфосфино)ферроцен)палладия (214 мг, 0,261 сммоль). Реакционную смесь нагревали при 100°С в течение одного часа. Затем реакционную смесь фильтровали через целит и целит трижды промывали этилацетатом. Объединенные фильтраты концентрировали в вакууме и неочищенный продукт очищали хроматографией на колонке (силикагель; дихлорметан/метанол, 96/5), получив при этом 1-метил-N-((3-метилпиразин-2-ил)метил)-5-оксопирролидин-3-карбоксамид (440 мг).
1-Метил-N-((3-метилпиразин-2-ил)метил-5-оксопирролидин-3-карбоксамид (330 мг, 1,329 ммоль) растворяли в реагенте Итона (2 мл) и реакционную смесь перемешивали при 60°С в течение 18 часов. Затем реакционную смесь выливали на баню со льдом и подщелачивали 7н раствором аммиака в метаноле (20 мл). Полученную смесь пять раз экстрагировали хлороформом/изопропанолом (9/1). Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме. Остаток (280 мг) дважды упаривали с толуолом и дважды с дихлорметаном. Дополнительная порция (53 мг) была получена в результате двукратной экстракции водного слоя хлороформом/изопропанолом (9/1) и вышеописанного концентрирования. Было получено в общей сложности 333 мг неочищенного 1-метил-4-(8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-2-она, который использовали на следующей стадии без дальнейшей очистки.
1-Метил-4-(8-метилимидазо[1,5-a]пиразин-3-ил)пирролидин-2-он (293 мг, 1,27 ммоль) растворяли в N,N-диметилформамиде (12 мг), добавляли N-бромсукцинимид (227 мг, 1,27 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем к реакционной смеси добавляли воду и трижды экстрагировали хлороформом/изопропанолом (9/1). Объединенные органические слои сушили (Na2SO4) и концентрировали в вакууме с образованием коричневого масла. Остаток очищали хроматографией на колонке (силикагель; дихлорметан/метанол/гептан = 9/1/4), получив при этом 4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-1-метилпирролидин-2-он (200 мг).
6-Метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-индазол-3-карбоксамид (28 мг) и 4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)-1-метилпирролидин-2-он (20 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали препаративной ВЭЖХ (колонка Luna C18(2); градимент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты). Требуемые фракции собирали и подщелачивали водным раствором гидрокарбоната натрия и экстрагировали дихлорметаном, органический слой сушили (Na2SO4) и концентрировали в вакууме, получив при этом 4-метокси-N-(2-метокси-4-(8-метил-3-(1-метил-5-оксопирролидин-3-ил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (15 мг).
СВЭЖХ: метод 0_60: Rt = 2,45 мин, (М+Н)+ = 539.
Пример 74
4-Метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метил-3-оксопиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид

Гидрохлорид 1-метилпиперазин-2-она (0,844 ммоль, 127 мг) в дихлорметане вводили в колонку с карбонатом кремния (Silicycle, 1 г) и элюировали дихлорметаном с образованием свободного основания 1-метилпиперазин-2-она. К полученному соединению в 2-пропаноле (1 мл) последовательно добавляли 4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексанон (0,649 ммоль, 200 мг) и изопропоксид алюминия (1,469 ммоль, 300 мг) и смесь перемешивали при 60°С в течение одного часа. Добавляли триацетоксиборогидрид натрия (1,298 ммоль, 275 мг) и смесь перемешивали при 60°С в течение ночи. Затем реакционную смесь разбавляли дихлорметаном и водой, слой дихлорметана отделяли при помощи фазоразделяющего фильтра и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на колонке (силикагель; градиент от дихлорметана до дихлорметана/метанола, 92/8), получив при этом 4-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)-1-метилпиперазин-2-он (50 мг).
6-Метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1Н-индазол-3-карбоксамид (54 мг) и 4-((транс)-4-(1-бром-8-метилимидазо[1,5-a]пиразин-3-ил)циклогексил)-1-метилпиперазин-2-он (20 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 5%), получив при этом вещество с примесями. В результате дополнительной очистки препаративной ВЭЖХ (колонка Luna C18(2); градиент ацетонитрила/воды с постоянным содержанием 0,003М трифторуксусной кислоты) был получен 4-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метил-3-оксопиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-индол-2-карбоксамид (11 мг).
СВЭЖХ: метод 0_60: Rt = 2,19 мин, (М+Н)+ = 636.
Пример 75
5-Метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-пирроло[2,3-с]пиридин-2-карбоксамид
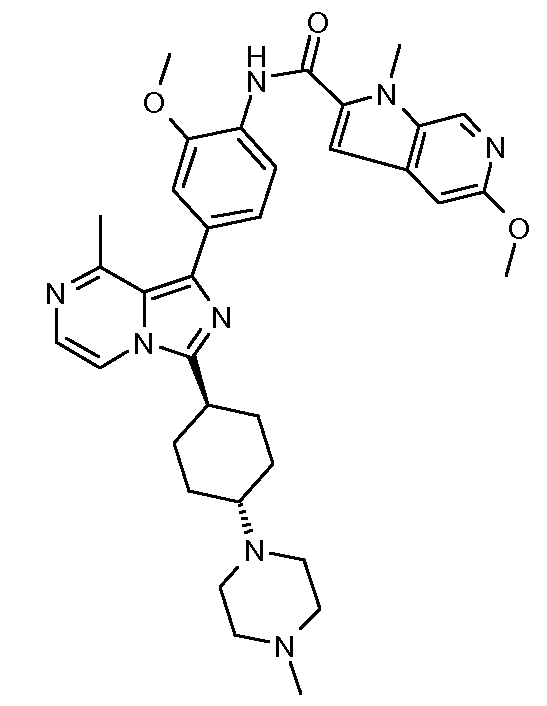
К 5-метокси-1Н-пирроло[2,3-с]пиридин-2-карбоновой кислоте (1 г, 5,20 ммоль) в метаноле (100 мл) добавляли серную кислоту (0,014 мл, 0,260 ммоль). Полученный раствор нагревали до температуры кипения с обратным холодильником и перемешивали при указанной температуре в течение ночи. Затем добавляли дополнительное количество серной кислоты (0,277 мл, 5,20 ммоль) и смесь нагревали с обратным холодильником в течение пяти дней. Нагревание прекращали и реакционную смесь концентрировали до меньшего объема. Полученную суспензию разбавляли этилацетатом и промывали насыщенным водным раствором гидрокарбоната натрия. Водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (Na2SO4) и концентрировали в вакууме, получив при этом метил-5-метокси-1Н-пирроло[2,3-с]пиридин-2-карбоксилат (910 мг).
К перемешиваемому раствору метил-5-метокси-1Н-пирроло[2,3-с]пиридин-2-карбоксилата (910 мг, 4,41 ммоль) в N,N-диметилформамиде (35 мл) при комнатной температуре в атмосфере азота медленно добавляли гидрид натрия (60% мас./мас. в минеральном масле, 177 мг, 4,41 ммоль). Через 30 минут добавляли иодметан (0,302 мл, 4,85 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1,5 часа. Затем реакционную смесь гасили водой и трижды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали флэш-хроматографией (градиент от гептана до гептана/этилацетата, 1/1), получив при этом 5-метокси-1-метил-1Н-пирроло[2,3-с]пиридин-2-карбоксилат (878 мг).
К 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилину (2,09 г, 8,37 ммоль) в тетрагидрофуране (20 мл) в атмосфере азота добавляли 2,0М раствор этилмагний хлорида в тетрагидрофуране (4,19 мл, 8,37 ммоль) и смесь нагревали с обратным холодильником в течение одного часа. К теплой реакционной смеси добавляли метил-5-метокси-1-метил-1Н-пирроло[2,3-с]пиридин-2-карбоксилат (878 мг, 3,99 ммоль) в тетрагидрофуране (10 мл) и полученную смесь нагревали в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры и концентрировали. Остаток поглощали этилацетатом и промывали водой. Водный слой дважды экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным раствором соли, сушили (Na2SO4) и концентрировали в вакууме. Остаток наносили на водяную матрицу и очищали флэш-хроматографией (градиент от гептана до гептана/этилацетата, 1/1), получив при этом 5-метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-пирроло[2,3-с]пиридин-2-карбоксамид (1,05 г).
5-Метокси-N-(2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-1-метил-1Н-пирроло[2,3-с]пиридин-2-карбоксамид (22 мг) и 1-бром-8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин (20 мг) подвергали взаимодействию способом, описанным в примере 4, стадия 4с, и продукт очищали хроматографией на колонке (силикагель; дихлорметан с градиентом метанола от 0 до 20%), получив при этом 5-метокси-N-(2-метокси-4-(8-метил-3-((транс)-4-(4-метилпиперазин-1-ил)циклогексил)имидазо[1,5-a]пиразин-1-ил)фенил)-1-метил-1Н-пирроло[2,3-c]пиридин-2-карбоксамид (19 мг).
СВЭЖХ: метод 0_60: Rt = 1,08 мин, (М+Н)+ = 623.
Пример 76
Вышеописанными способами могут быть получены следующие соединения:


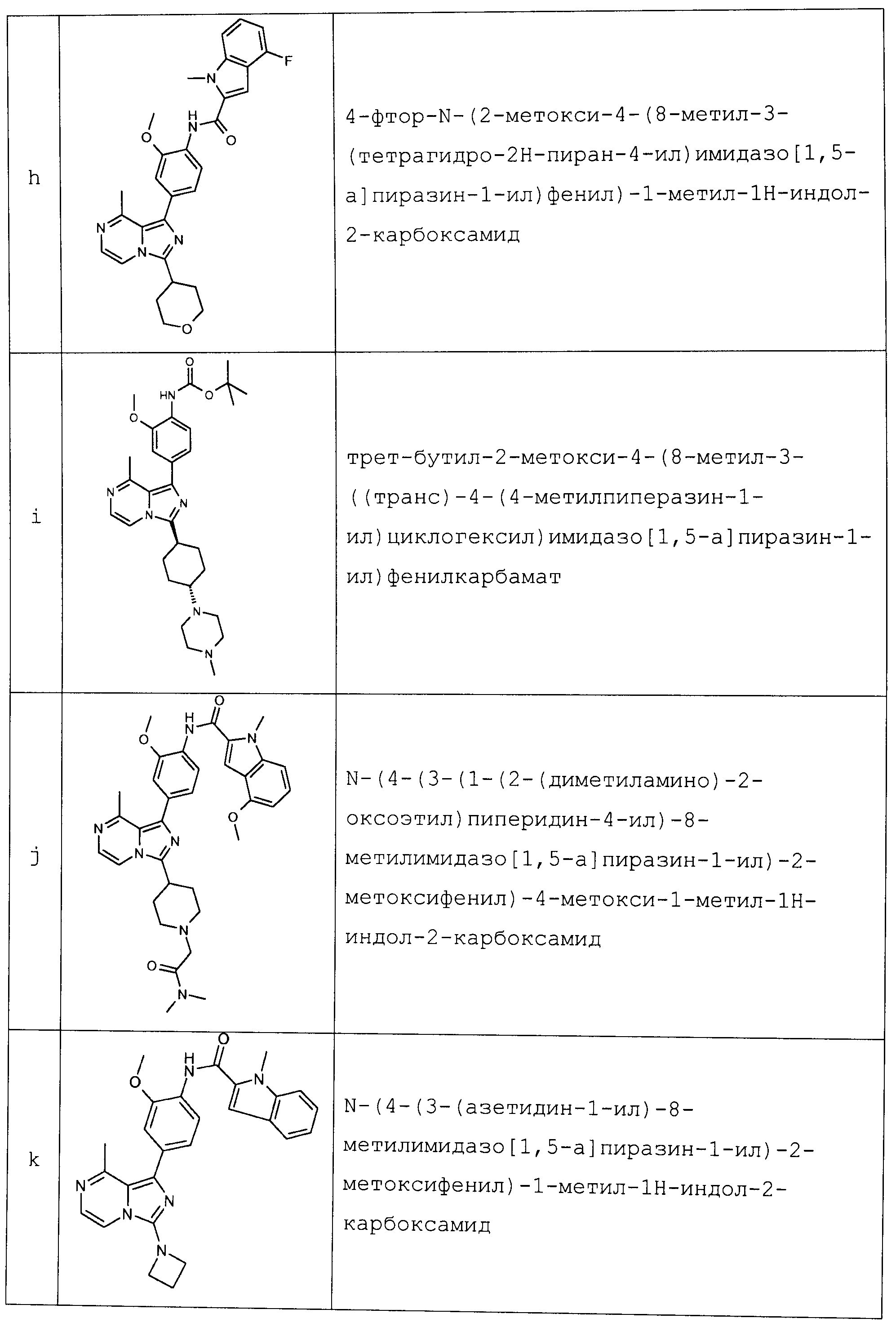


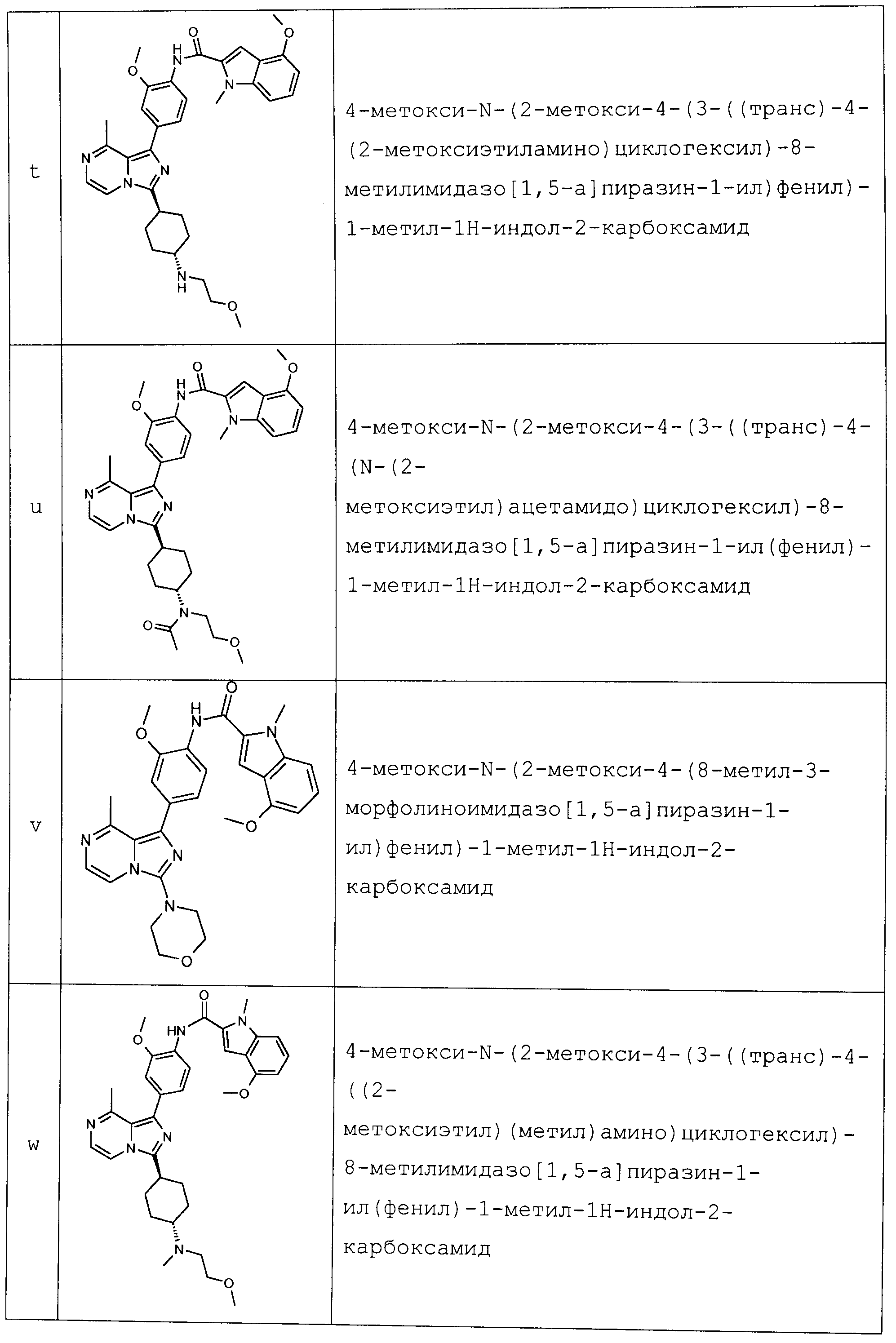

Пример 77
Анализ IMAP фермента Lck
В качестве фермента был использован His6-меченный у N-конца рекомбинантный непроцессированный фермент Lck человека компании Millipore. В качестве фосфорилирующего субстрата был использован меченный флуоресцеином пептид (5FAM-KVEKIGEGTYGVV-NH2), выделенный из p34cdc2, компании Molecular Devices. Ферменты, субстрат и АТР разводили в буфере для взаимодействия с киназой (10 мМ трис-буфера с HCl, 10 мМ MgCl2, 0,01% твина-20, 0,05% NaN3, рН 7,2, 1 мМ DTT (дитиотреитол). Конечный объем на стадии взаимодействия с киназой при выполнении анализа на 384-луночном планшете был равен 20 мкл. Конечное количество фермента в реакционной смеси было равно 0,1 ед/мл. Фермент предварительно инкубировали с соединениями, разведенными в 1% ДМСО (диметилсульфоксид), в течение 60 минут при комнатной температуре в темноте. Затем добавляли пептидный субстрат до конечной концентрации 100 нМ и АТР до конечной концентрации 6 мкМ и смесь инкубировали в течение 120 минут при комнатной температуре в темноте. Добавляли буфер для последовательного связывания при выполнении анализа IMAP (75% однократного буфера А, 25% однократного буфера В с реагентом для последовательного связывания в отношении 1:600; Molecular Devices) и инкубировали в течение 60 минут при комнатной температуре в темноте. И наконец, сигнал поляризации флуоресценции (FP) считывали спектрофотометром Envision Multilabel (Perkin Elmer).
Все биохимические анализы выполняли при КM,ATP фермента в ненасыщенных условиях, из чего следует, что во время инкубации увеличение сигнала происходило в линейной зависимости от времени. При выполнении всех биохимических анализов на каждом планшете был использован эталонный образец. Вновь приобретенные партии ферментов исследовали методом серийных разведений вместе с эталоном для гарантии получения сравнимого значения pIC50 для соединений при выполнении всех анализов с использованием разных партий ферментов.
При исследовании соединений в отношении зависимости доза-эффект были произведены серийные разведения с использованием коэффициента разведения √10. При выполнении анализов IMAP фермента Lck начальная концентрация была равна 10-6М. Кривые зависимости доза-эффект строили по результатам выполнения двух экспериментов с использованием дублирующих планшетов (N=1; n=2). Все данные были нормализованы в процентном выражении на основании максимальных (Max) и минимальных (Min) контрольных значений. На каждом 384-луночном планшете 16 лунок были лунками с минимальным эффектом (лунки с АТР, 0% эффект) и 16 лунок были лунками с максимальным эффектом (лунки без АТР, 100% эффект). 16 лунок были использованы для измерения фонового сигнала, полученного из реакционной смеси киназы, содержащей все компоненты за исключением субстрата с меченым пептидом. График процентного значения эффекта в зависимости от логарифмической концентрации разведения соединения строили для получения сигмоидальной кривой зависимости доза-эффект. Значения pIC50 вычисляли при помощи программы ActivityBase.
Полученные значения приведены в таблице 1.
|
![СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА](https://fips.edrid.ru/images/rid/ef/40/ac/5688a30e02cb22486d98338c24d48c4f.png)
![СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА](https://fips.edrid.ru/images/rid/ef/40/ac/bdd0952616ec180cf57d0f8fcda0494a.png)
![СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА](https://fips.edrid.ru/images/rid/ef/40/ac/b80a96f5e8561fb48b1b447c8e23978d.png)
![СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА](https://fips.edrid.ru/images/rid/ef/40/ac/62d1e52ca7937e84b93b9e5cc7bf8426.png)
![СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА](https://fips.edrid.ru/images/rid/ef/40/ac/4d25dc8ecc2b134dbbe77087f69db280.png)
![СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА](https://fips.edrid.ru/images/rid/ef/40/ac/d3db9e94bc1d346f77818883f9d59a77.png)
![СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА](https://fips.edrid.ru/images/rid/ef/40/ac/b9cde04a0c10a1b83db04b1c59f46590.png)
![СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА](https://fips.edrid.ru/images/rid/ef/40/ac/d484f470a62ec92550dc6d5f81b8912c.png)

