Результат интеллектуальной деятельности: ПЕПТИД, ОБЛАДАЮЩИЙ ЛЕЧЕБНЫМ ДЕЙСТВИЕМ ПРОТИВ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
Вид РИД
Изобретение
Изобретение относится к области биохимии, конкретно к новому биологически активному соединению - пептиду, обладающему лечебным действием против болезни Альцгеймера, и может быть использовано для создания препарата для терапии болезни Альцгеймера.
Болезнь Альцгейметра (БА) представляет собой тяжелое нейродегенеративное заболевание, приводящее к потере памяти, психическим расстройствам и неизбежной смерти. В настоящее время в медицинской практике применяют препараты для симптоматического лечения БА методами компенсаторной терапии. Использование этих препаратов позволяет в некоторой мере задержать процесс прогрессирования болезни, но не излечить ее.
Наиболее широко применяемым классом препаратов являются ингибиторы холинэстераз (ИХЭ). ИХЭ увеличивают время действия нейромедиатора ацетилхолина на постсинаптические рецепторы, что ведет к увеличению холинергической иннервации. Эффективность применения ИХЭ существенно снижается на поздних стадиях БА. ИХЭ характеризуются достаточно высокой токсичностью и рядом других побочных эффектов [Watkins, P. B. et all. J. Am. Med. Assoc. 1994. V. 271. P. 992-998]. Известен препарат другого класса для симптоматического лечения БА - модулятор глутаматэргической системы, мемантин [Raina P. at all // Ann. Intern. Med. 2008. V. 148 (5). P. 379-397]. Наилучшие результаты дает его применение у больных с мягкой и умеренной деменцией альцгеймеровского типа, вместе с тем, препарат не обеспечивает полного излечивания БА. Важным недостатком компенсаторной терапии является то, что разрабатываемые внутри данного направления методы не воздействуют на механизм развития БА. Поэтому интенсивные исследования ведутся по поиску лекарств для радикальной терапии БА, способные не только компенсировать симптоматические нарушения, но и излечивать заболевание.
Одна из современных гипотез предполагает, что пептиды β-амилоидного ряда, в частности βА-(1-42) в результате нарушения обменных процессов способны образовывать скопления в центральной нервной системе в виде амилоидных бляшек, что приводит к разрушению мозговой ткани [Hardy J., Selkoe D.J. The amyloid hypothesis of Alzheimer′s disease: progress and problems on the road to therapeutics. Science. 2002. V. 297 (5580). P. 353-356].
В последние годы активно разрабатывались иммунотерапевтические методы предотвращения развития БА, направленные на коррекцию содержания в организме βА. Инъекции препаратами на основе βА вызывают образование специфических антител, которые способствуют удалению βА из мозга [Shenk D., Barbour R., Dunn W. Immunization with amyloid-β attenuates Alzheimer-disease-like pathology in the PDAPP mouse. // Nature. 1999. V. 400( 6740). P. 173-177]. Ведущими западными фирмами разработано несколько препаратов [www.affiris.com/press_releases/press_release_mimoVAX_dec_11_06.pdf; www.clinicaltrials.gov/ct2/show/NCT00411580], однако, ни один из них не прошел успешно клинические испытания. Исследования были приостановлены в связи с тем, что у 6% пациентов, которые получали инъекцию бета-амилоида, обнаружился асептический менингоэнцефалит [Shenk D. Amyloid-β immunotherapy for Alzheimer′s disease: the end of the beginning. // Nat. Rev. Neurosci. 2002. V. 3 (10). P. 824-828; Senior K. Dosing in Phasell trial of Alzheimer′s vaccine suspended. Lancet. Neurol. 2002. V. 1 (1). P. 3; Orgogozo J.M., Gilman S., Dartigues J.F., Laurent В., Puel M., Kirby L.C., Jouanny P., Dubois В., Eisner L., Flitman S., Michel B.F., Boada M., Frank A., Hock C. Subacute meningoencephalitis in a subset of patients with AD after Aβ1-42 immunization. Neurology. 2003. V. 61 (1). P. 46-54]. Данные результаты ставят под сомнение безопасность использования препаратов на основе βА в качестве иммунотерапевтических средств.
Принципиально новым подходом является использование фрагментов белка рецептора конечных продуктов гликозилирования (RAGE) для лечения БА. Рецептор RAGE характеризуется многофункциональностью, способен специфически связываться со многими лигандами, участвует в процессах роста клеток нервной системы, а при гиперэкспрессии в пожилом возрасте способствует развитию ряда патологий, таких как сахарный диабет, рост опухолей, болезнь Альцгеймера. Предполагают, что связывание рецептора RAGE с β-амилоидом способствует проникновению последнего через гематоэнцефалический барьер центральной нервной системы и накоплению в виде амилоидных бляшек - основной причины болезни Альцгеймера [Leclerc Е., Sturchler Е., Vetter S. The S100B/RAGE Axis in Alzheimer′s Disease. Cardiovasc. Psychiatry Neurol. 2010. V. 2010. P. 1-11]. Помимо RAGE, закрепленного в мембране и связывающегося с бета-амилоидом на поверхности нейронов мозга, в крови имеется также растворимая форма RAGE, состоящая из внеклеточной части белка. Растворимый RAGE, связывая бета-амилоид и препятствуя его проникновению в мозг, проявляет протективное действие и восстанавливает состояние пространственной памяти у экспериментальных животных. [Deane R., Du Yan S, Submamaryan RK, LaRue B, Jovanovic S, Hogg E, Welch D, Manness L, Lin C, Yu J, Zhu H, Ghiso J, Frangione B, Stern A, Schmidt AM, Armstrong DL, Arnold B, Liliensiek B, Nawroth P, Hofman F, Kindy M, Stern D, Zlokovic B. RAGE mediates amyloid-beta peptide transport across the blood-brain barrier and accumulation in brain. Nature medicine. 2003. V. 9. P. 907-913]. Эти данные служат теоретическим обоснованием нашей гипотезы о том, что введенный в организм фрагмент RAGE будет способен восстанавливать пространственную память животных с экспериментально индуцированной формой болезни Альцгеймера.
Изобретение решает задачу расширения ассортимента препаратов, обладающих лечебным действием против болезни Альцгеймера.
Поставленная задача решается за счет пептида, обладающего лечебным действием против болезни Альцгеймера, формулы
Ala-Trp-Lys-Val-Leu-Ser-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp-Ser-Val-Ala.
Сущностью изобретения является новый пептидный фрагмент белка RAGE формулы Ala-Trp-Lys-Val-Leu-Ser-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp-Ser-Val-Ala (I), получаемый с помощью стандартных методик пептидного синтеза. Предлагаемый препарат относится к терапевтическим средствам лечения БА. При интраназальном введении заявляемый синтетический пептид связывается с β-амилоидом и препятствует формированию комплекса, способного проникать через гематоэнцефалический барьер. Техническим результатом изобретения является отсутствие побочных эффектов при использовании пептида, высокая терапевтическая эффективность.
Интраназальное введение заявляемого препарата (I) препятствует ухудшению пространственной памяти у числа животных с экспериментально индуцированной формой БА. Вместе с тем введение данного пептида не приводит к ухудшению пространственной памяти у контрольных животных.
В качестве модели БА используют мышей, перенесших операцию удаления обонятельных луковиц головного мозга (ольфакторной бульбэктомии), после которой у животных развиваются морфологические и поведенческие признаки БА.
Синтез целевого продукта осуществляют твердофазным методом с использованием алкоксибензильного полимера. Конденсации осуществляют при помощи гексафторфосфата бензтриазол-1-ил-N-окси-бис(диметиламино)урония. Для отделения пептида от полимерного носителя и конечного деблокирования используют трифторуксусную кислоту с добавкой тиоанизола, фенола, этандитиола, триизопропилсилана и воды.
Структуру и гомогенность целевого продукта подтверждают данными аминокислотного анализа, масс-спектра и высокоэффективной жидкостной хроматографии.
Пример 1. Синтез пептида Ala-Trp-Lys-Val-Leu-Ser-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp-Ser-Val-Ala.
Операция 1.
0,3 г алкоксибензильного полимера с содержанием ОН-групп 0,5 ммоль/г полимера помещают в проточный реактор, промывают диметилформамидом (2×10 мл), снова добавляют 10 мл диметилформамида и оставляют набухать в течение 5-10 мин, затем диметилформамид удаляют. Синтез пептида ведут в проточном реакторе при комнатной температуре.
Операция 2. Получение Fmoc-Ala - полимера (I).
В 4 мл диметилформамида растворяют 0,467 г (1,5 ммоль) Fmoc-Ala-OH, добавляют 116 мкл (0,75 ммоль) N,N′-диизопропилкарбодиимида и 1,8 мг (0,015 ммоль) 4-диметиламинопиридина. Раствор перемешивают при температуре 0°C. Через 10 мин раствор добавляют к алкоксибензильному полимеру, находящемуся в проточном реакторе. Полученную смесь выдерживают при периодическом перемешивании 12 часов. Полученный Fmoc-Ala-полимер промывают диметилформамидом (2×10 мл), этанолом (2×10 мл) и снова диметилформамидом (2×10 мл). Непрореагировавшие аминогруппы ацилируют смесью 2 мл уксусного ангидрида, 2 мл пиридина и 6 мл диметилформамида в течение 2 ч. Промывки повторяют. Содержание Fmoc-Ala в продукте составляет 1,05 ммоль на 0,3 г полимера.
Операция 3. Получение Fmoc-Val-Ala-полимера (II).
а) Полученный Fmoc-Ala - полимер (I) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,153 г (0,45 ммоль) Fmoc-Val-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 4. Получение Fmoc-Ser(But)-Val-Ala-полимера (III).
а) Fmoc-Val-Ala-полимер (II) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,173 г (0,45 ммоль) Fmoc-Ser(But)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 5. Получение Gmoc-Asp(But)-Ser(But)-Val-Ala - полимера (IV).
а) Ser(But)-Val-Ala-полимер (III) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,185 г (0,45 ммоль) Fmoc-Asp(But)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 6. Получение Fmoc-Trp-Asp(But)-Ser(But)-Val-Ala - полимера (V).
а) Fmoc-Asp(But)-Ser(But)-Val-Ala - полимер (IV) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,192 г (0,45 ммоль) Fmoc-Trp-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полученный полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 7. Получение Fmoc-Trp-Asp(But)-Ser(But)-Val-Ala - полимера (VI).
а) Fmoc-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (V) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,152 г (0,45 ммоль) Fmoc-Pro-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 8. Получение Fmoc-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимера (VII).
а) Fmoc-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (VI) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,134 г (0,45 ммоль) Fmoc-Gly-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 9. Получение Fmoc-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимера (VIII).
а) Fmoc-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (VII) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,134 г (0,45 ммоль) Fmoc-Gly-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 10. Получение Fmoc-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимера (IX).
а) Fmoc-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (VIII) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,134 г (0,45 ммоль) Fmoc-Gly-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) JV-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 11. Получение Fmoc-Gly-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимера (X).
a)Fmoc-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (IX) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,166 г (0,45 ммоль) Fmoc-Gln-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 12. Получение Fmoc-Pro-Gly-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимера (XI).
а) Fmoc-Gln-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (X) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,152 г (0,45 ммоль) Fmoc-Pro-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 13. Получение Fmoc-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)Val-Ala - полимера (XII).
а) Fmoc-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (XI) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,172 г (0,45 ммоль) Fmoc-Ser(But)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 14. Получение Fmoc-Leu-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимера (XIII).
а) Fmoc-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (XII) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,159 г (0,45 ммоль) Fmoc-Leu-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 15. Получение Fmoc-Val-Leu-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимера (XIV).
а) From-Leu-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (XIII) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,153 г (0,45 ммоль) Fmoc-Val-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 16. Получение Fmoc-Lys(Boc)-Val-Leu-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-SerBut)-Val-Ala - полимера (XV).
a) Fmoc-Val-Leu-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (XIV) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,211 г (0,45 ммоль) Fmoc-Lys(Boc)-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 17. Получение Fmoc-Trp-Lys(Boc)-Val-Leu-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимера (XVI).
a) Fmoc-Lys(Boc)-Val-Leu-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (XV) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,192 г (0,45 ммоль) Fmoc-Trp-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°C в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают раствором 43 мкл (0,45 ммоль) уксусного ангидрида и 77 мкл (0,45 ммоль) N-этилдиизопропиламина в 4 мл диметилформамида в течение 20 мин, промывают диметилформамидом (2×10 мл), этанолом (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 18. Получение H-Ala-Trp-Lys(Boc)-Val-Leu-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Тrp-Asp(But)-Ser(But)-Val-Ala - полимера (XVII).
a) Fmoc-Trp-Lys(Boc)-Val-Leu-Ser(But)-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp(But)-Ser(But)-Val-Ala - полимер (XVI) обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
б) 0,140 г (0,45 ммоль) Fmoc-Ala-OH и 0,145 г (0,45 ммоль) TBTU растворяют в 4 мл диметилформамида. В раствор добавляют 77 мкл (0,45 ммоль) N-этилдиизопропиламина и перемешивают при 0°С в течение 10 мин. Раствор добавляют к полимеру и при периодическом перемешивании оставляют на 2 ч. Полимер промывают диметилформамидом (2×10 мл).
в) Полимер обрабатывают 10 мл 20%-ного раствора пиперидина в диметилформамиде 20 мин, промывают диметилформамидом (2×10 мл), раствором диоксана в воде (2:1) (2×10 мл), снова диметилформамидом (2×10 мл).
Операция 19. Получение целевого пептида Ala-Trp-Lys-Val-Leu-Ser-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp-Ser-Val-Ala (XVII). 0,3 г пептидил-полимера (XVI) обрабатывают 4 мл смеси трифторуксусная кислота-тиоанизол-фенол-вода-этандитиол-триизопропилсилан в объемном соотношении 81,5:5:5:5:2,5:1 в течение 2 ч. Полимер отфильровывают, раствор упаривают, сухой остаток промывают сухим диэтиловым эфиром (2×50 мл). Растворяют в 10-% уксусной кислоте и очищают на препаративной ВЭЖХ при следующих условиях: колонка Phenomenex (США) Jupiter 10µ С18 300А (250×10 мм), растворитель А: 0,1%-ная трифторуксусная кислота в воде, растворитель Б: 0,1%-ная трифторуксусная кислота в ацетонитриле, градиент растворителя А в Б - 10-70% за 1 ч, скорость потока элюента - 3 мл/мин, выход пептида регистрируют при оптической длине волны 226 нм. Собранную после ВЭЖХ фракцию, содержащую целевой продукт лиофилизуют.
Данные аминокислотного анализа Asp 1,0 (1), Ser 1,8 (2), Glu 1,1 (1), Pro 1,7 (2), Gly 3,3 (3), Ala 1,8 (2), Val 2,0 (2), Leu 1,0 (1), Lys 1,0(1).
По данным масс-спектрометрии MH+1755. По данным аналитической ВЭЖХ время удерживания составляет 23,65 мин, условия: колонка Phenomenex (США) Jupiter 5µ С18 300А (250×4,6 мм), растворитель А: 0,1%-ная трифторуксусная кислота в воде, растворитель Б: 0,1%-ная трифторуксусная кислота в ацетонитриле, градиент растворителя А в Б - 10-70% за 1 ч, скорость потока элюента - 1 мл/мин, выход пептида регистрируют при оптической длине волны 226 нм.
Пример 2. Проведение биологических испытаний. Эксперименты проводят на мышах NMRI весом 20-30 г.
а) Операцию ольфакторной бульбэктомии проводят в стерильных условиях под гексеналовым наркозом (40 мг/кг внутрибрюшинно) с применением 0,5% раствора новокаина для местного обезболивания при скальпировании. Двустороннее удаление обонятельных луковиц проводят путем аспирации через трепанационное отверстие. Контрольных животных подвергают аналогичной манипуляции, но без удаления обонятельных луковиц.
б) Из пептида, полученного по изобретению, готовят раствор в концентрации 5 мг/мл в физрастворе и через две недели после операции ольфакторной бульбэктомии начинают вводить мышам интраназально в объеме 4 мкл на одно животное ежедневно.
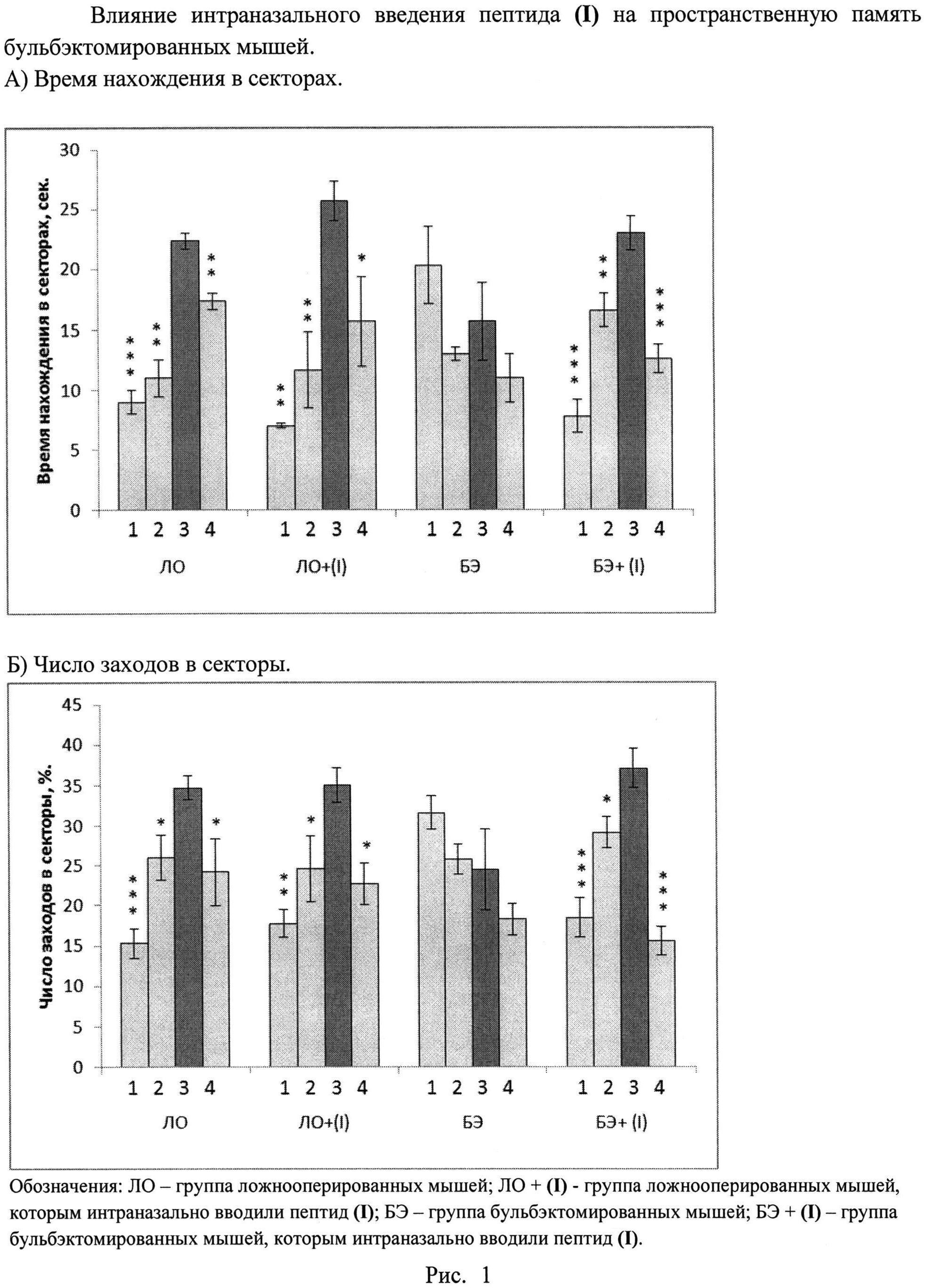
в) Через 4 недели после операции ольфакторной бульбэктомии проводят обучение животных в водном лабиринте Морриса. Экспериментальная камера представляет собой пластиковый круглый бассейн с диаметром 80 см, заполненный на 30 см водой с температурой 23°С. Площадь бассейна условно делится на четыре равных сектора, в одном из которых находится спасательная платформа диаметром 5 см. Вода забеляется молоком для того, чтобы животные не могли визуально обнаружить спасательную платформу.
Для опытов отбирают мышей, умеющих хорошо плавать и быстро находить спасательную платформу. В течение 5 дней проводят по четыре сеанса обучения ежедневно. В результате всех животных обучают находить спасательную платформу менее, чем за 10 сек. Затем в течение одной минуты у животных тестируют уровень пространственной памяти при отсутствии спасательной платформы. Состояние пространственной памяти каждого животного оценивают по его способности помнить отсек обучения и выделять его из 3-х других отсеков. В течение 1 минуты учитывают время пребывания животных в каждом отсеке. Обучившимися считают животных, время нахождения которых в отсеке обучения достоверно превышает время нахождения в каждом из других отсеков.
Результаты биологических испытаний заявляемого препарата приведены на рис. 1.
В ходе биологических испытаний показано, что бульбэктомированные мыши, интраназально получавшие дозу исследуемого пептида (I) выделяли (находили) сектор со спасательной платформой (сектор 3) достоверно чаще по сравнению с бульбэктомированными мышами, не получавшими дозу пептида (I). Аналогичные результаты получены при измерении времени нахождения животных в секторе 3. Также показано, что интраназальное введение пептида (I) не ухудшает пространственную память ложнооперированным мышам.
г) Токсичность полученного пептида исследуют на экспериментальных животных в системе in vivo. Исследование проводят на линейных мышах линии Balb/c весом 20 г с использованием максимальной дозы пептида 1 мг, вводимой подкожно. Животных держат под наблюдением в течение суток. По результатам наблюдения острой токсичности исследуемого препарата не выявлено.
Таким образом, получен новый пептид формулы Ala-Trp-Lys-Val-Leu-Ser-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp-Ser-Val-Ala, который обладает лечебным действием против болезни Альцгеймера.
Пептид, обладающий лечебным действием против болезни Альцгеймера, формулы:Ala-Trp-Lys-Val-Leu-Ser-Pro-Gln-Gly-Gly-Gly-Pro-Trp-Asp-Ser-Val-Ala.