Результат интеллектуальной деятельности: СПОСОБЫ ОБНАРУЖЕНИЯ КОНТАМИНАНТОВ ПОЛИМЕРОВ ГЛЮКОЗЫ
Вид РИД
Изобретение
Настоящее изобретение относится к способам обнаружения контаминантов полимеров глюкозы, в частности, линий получения полимеров глюкозы, более конкретно, полимеров для перитонеального диализа.
В более широком смысле, данный способ также позволяет обнаружить контаминанты полимеров глюкозы, в частности, линий получения полимеров глюкозы для энтерального и парентерального питания, или даже для кормления новорожденных.
Предметом настоящего изобретения также является необходимость идентификации провоспалительных контаминантов.
Технические предпосылки изобретения
Компания-заявитель выбрала для разработки своего изобретения область, известную опасностью контаминантов, которые могут быть введены посредством полимеров глюкозы, указанные контаминанты являются ответственными за воспалительные реакции, которые чрезвычайно вредны для здоровья человека, область перитонеального диализа.
Перитонеальный диализ представляет собой тип диализа, задачей которого является удаление продуктов жизнедеятельности, таких как мочевина, креатинин, избыток калия или избытки воды, с которыми почки не справляются или более не справляются, чтобы очистить плазму крови. Такое медицинское лечение показано в случае терминальной стадии хронической почечной недостаточности.
При такой интракорпоральной очистке брюшину применяют в качестве диализной мембраны. Токсичные продукты жизнедеятельности из крови проходят через полупроницаемую мембрану брюшины в раствор, известный как диализат. Диализат вводят в брюшную полость через постоянный катетер. Существуют два типа перитонеального диализа:
- CAPD (непрерывный амбулаторный перитонеальный диализ), лечение, основанное на пропускании четырех пакетов диализата в день по медицинскому назначению,
- APD (автоматизированный перитонеальный диализ), непрерывное ночное лечение, которое соответствует примерно 15 литрам диализата на 8 часов по медицинскому назначению.
Наиболее часто применяемый диализаты состоят из буферного раствора (лактата или бикарбоната) с кислым pH (5,2-5,5) или физиологическим pH (7,4), к которому добавляют электролиты (натрий, кальций, магний, хлор) и осмотическую кислоту (глюкозу или полимер глюкозы, такой как "икодекстрин", находящийся в растворе для амбулаторного перитонеального диализа Extraneal®, выпускаемом фирмой Baxter).
Полимер глюкозы, такой как икодекстрин, упомянутый выше, предпочтительнее глюкозы в качестве осмотического средства, поскольку благодаря своему небольшому размеру глюкоза, которая быстро пересекает брюшину, приводит к потере осмотического градиента в течение 2-4 часов инфузии.
Стандартные полимеры глюкозы получают путем кислотного или ферментативного гидролиза крахмала из злаков или клубневых растений.
Кислотный гидролиз крахмала, который является полностью случайным, или его ферментативный гидролиз, который является немного более упорядоченным, обеспечивает смеси глюкозы (мономера) и цепочек глюкозы, которые включают очень короткие молекулы (олигомеры) с низкой степенью полимеризации (DP) и очень длинные молекулы (полимеры) с высокой DP. Кроме того, полимеры глюкозы имеют чрезвычайно разнообразную молекулярную массу.
В более конкретной области применения полимеров глюкозы для непрерывного амбулаторного перитонеального диализа очень быстро стало очевидным, что данные гидролизаты крахмала (смесь глюкозы, а также олигомеров и полимеров глюкозы) не могут применяться как таковые.
В европейской патентной заявке ЕР 207676 сообщают, что полимеры глюкозы, образующие прозрачные и бесцветные растворы при 10% концентрации в воде, со средневесовой молекулярной массой (Mw) от 5000 до 100000 дальтон и среднечисловой молекулярной массой (Mn) менее 8000 дальтон, являются предпочтительными.
Такие полимеры глюкозы также предпочтительно содержат по меньшей мере 80% полимеров глюкозы, молекулярная масса которых составляет от 5000 до 50000 дальтон, незначительно или совсем не содержат глюкозу или полимеры глюкозы с DP менее или равной 3 (молекулярная масса 504) и незначительно или совсем не содержат полимеры глюкозы с молекулярной массой более 100000 (DP приблизительно 600).
Другими словами, предпочтительными полимерами глюкозы являются полимеры глюкозы с низким индексом полидисперсности (значение, полученное путем расчета отношения Mw/Mn).
Предложенные в данной патентной заявке ЕР 207676 способы получения таких полимеров глюкозы с низким индексом полидисперсности из гидролизатов крахмала заключаются:
- либо в проведении фракционного осаждения мальтодекстрина с помощью водорастворимого растворителя,
- либо в проведении молекулярной фильтрации того же мальтодекстрина через различные мембраны с соответствующим порогом отсечения или исключения.
В этих двух случаях данные способы нацелены на удаление одновременно полимеров с очень высокой молекулярной массой и мономеров или олигомеров с низкой молекулярной массой.
Однако эти способы не являются удовлетворительными как с точки зрения их реализации, так и с точки зрения выхода и качества продукции, которую они позволяют получить.
В интересах разработки способа получения полностью водорастворимого полимера глюкозы с низким индексом полидисперсности, предпочтительно менее 2,5, предпочтительно с Mn менее 8000 дальтон и Mw от 12000 до 20000 дальтон, при этом в указанном способе отсутствуют недостатки предшествующего уровня техники, компания-заявитель пыталась решить эту проблему в своем патенте ЕР 667356 исходя из гидролизованного крахмала, а не из мальтодекстрина.
Полимер глюкозы, полученный путем хроматографического фракционирования, при этом предпочтительно содержит менее 3% глюкозы и полимеров глюкозы с DP менее или равной 3, и менее 0,5% полимеров глюкозы с DP более 600.
В конечном итоге с тех пор специалистами в области перитонеального диализа принято, что данные полимеры глюкозы, применяемые для их осмотической мощности, являются вполне удовлетворительными.
Однако риски микробного загрязнения данных препаратов, предназначенных для перитонеального диализа, подлежат критике.
На самом деле известно, что линии получения полимеров глюкозы могут быть загрязнены микроорганизмами или провоспалительными веществами, содержащимися в указанных микроорганизмах.
Загрязнение крахмала кукурузы или пшеницы микроорганизмами различных видов дрожжей, плесени и бактерий, а также более конкретно, ацидо-термофильными бактериями вида Alicyclobacillus acidocaldarius (экстремофильные бактерии, которые растут в горячей и кислой зонах линии) описано, например, при получении крахмала.
Основным риском для пациента, который получает такие зараженные продукты, является перитонит.
Клиническое подозрение на перитонит диагностируется, когда присутствует мутный диализат с различными клиническими проявлениями, а именно болью в животе, тошнотой, рвотой, диареей и лихорадкой.
Такие эпизоды перитонита вызваны внутрибрюшинной бактериальной инфекцией, и диагноз обычно легко устанавливается посредством положительных культур диализата.
"Стерильный перитонит", который также описан как асептический, химический или культурально-негативный перитонит, в свою очередь, как правило, вызван химическим раздражителем или инородным телом.
После внедрения икодекстрина для получения растворов для перитонеального диализа сообщалось об отдельных случаях асептического перитонита, которые могут быть связаны с различными причинами, в частности, с индуцированием потенциально присутствующими провоспалительными веществами.
Таким образом, асептические воспалительные эпизоды являются основными осложнениями, наблюдаемыми после инъекций диализных растворов.
Хотя некоторые из этих воспалительных эпизодов связаны с проблемой химической природы (случайная инъекция химических загрязнителей или неправильные дозы некоторых соединений), большинство случаев непосредственно связаны с наличием контаминантов микробного происхождения, которые присутствуют в растворах, применяемых для подготовки диализных растворов.
Липополисахариды (LPS) и пептидогликаны (PGN) являются основными контаминантами микробного происхождения, которые представляют высокий риск инициации воспаления, когда присутствуют в следовых количествах.
Стандартные анализы теоретически позволяют отбраковать партии, содержащие контаминанты данного типа и таким образом представляют риск для здоровья. Однако такие анализы не являются удовлетворительными, поскольку все еще сообщается об асептических воспалительных эпизодах, несмотря на то, что растворы были заявлены как безопасные.
Таким образом, несмотря на постоянное внимание со стороны тех, кто занимается данной областью, исходя из снижения риска загрязнений, в частности, путем улучшения их обнаружения, все еще остается необходимость в улучшении уровней производительности обнаружения контаминантов, которые могут индуцировать воспаление.
Подробное описание изобретения
Заслугой компании-заявителя стало принятие во внимание присутствия молекул, способных обострить воспалительный ответ, индуцированный другими контаминантами, в частности, LPS или PGN, особенно посредством механизма взаимодействия между TLR (толл-подобными рецепторами) и NOD (нуклеотид-связывающим белком, содержащим домен олигомеризации)-подобными рецепторами. Фактически, рассмотрение только эффекта выделенных контаминантов на воспаление является упрощенным.
В отличие от LPS, который представляет собой лиганд, распознаваемый рецепторами типа TLR4 (толл-подобный рецептор), PGN (а также многочисленные гликолипиды и липопептиды) представляет собой лиганд, распознаваемый рецепторами типа TLR2, которые индуцируют слабый воспалительный ответ на моделях in vitro и in vivo, тем самым подразумевая, что эти молекулы должны присутствовать в более высоких концентрациях для того, чтобы быть обнаруженными.
Таким образом, на моделях с применением мононуклеарных клеток (РВМС, первичные моноциты/макрофаги или линии моноцитов) LPS индуцирует существенный ответ в концентрациях от приблизительно 1 нг/мл, тогда как требуются по меньшей мере в 100 раз более высокие концентрации PGN, чтобы получить аналогичный ответ (отношение вес/вес).
Кроме того, хотя растворимые PGN (Mw≈125 кДа) индуцируют воспалительный ответ посредством активации TLR2, их продукты деполимеризации, минимальная структура которых остается биологически активной, представляющая собой мурамилдипептид (MDP), взаимодействуют с NOD-подобными внутриклеточными рецепторами.
Такие производные, рассматриваемые отдельно, не свидетельствуют однозначно о воспалении in vitro и дают существенный ответ при значениях >1 мкг/мл.
С другой стороны, присутствие этих молекул оказывает синергический эффект на воспалительный ответ посредством механизма взаимодействия TLR и NOD-подобных рецепторов независимо от применяемой экспериментальной модели (мышиная, линии моноцитов/макрофагов, мононуклеарные клетки крови).
В дополнение к продуктам деполимеризации PGN формулированные микробные пептиды, прототипом которых является f-MLP (трипептид формил-Met-Leu-Phe), также обладают существенной синергической активностью. Первоначально эти пептиды были идентифицированы по их хемоаттрактантной активности относительно лейкоцитов, хотя они не способны индуцировать цитокиновый ответ per se.
Однако в комбинации с агонистами TLR они способствуют повышению продуцирования цитокинов путем сенсибилизации клеток-мишеней.
Поэтому важно не игнорировать эти "малые молекулы", поскольку они могут косвенно отвечать за асептические воспалительные эпизоды, усиливая эффекты следовых количеств PGN и/или LPS.
За последние несколько лет было разработано множество анализов с применением эмбриональных клеток для того, чтобы заменить животные модели в анализах воспалительного ответа.
Однако эти модели in vitro подвержены значительной индивидуальной вариабельности, которая может быть ответственна за систематические экспериментальные ошибки.
С другой стороны, клеточные линии моноцитов дают постоянные ответы, что объясняет таким образом, почему в анализах, находящихся в настоящее время на стадии разработки, все чаще применяют клетки данного типа в культуре. Однако эти анализы имеют недостаток, допуская общий воспалительный ответ на все контаминанты, присутствующие в виде смеси в растворе, и, следовательно, не позволяют охарактеризовать природу контаминанта.
Важно также отметить, что усиленный воспалительный ответ является видимым в отношении цитокинов острой фазы воспаления, таких как TNF-α (фактор некроза опухолей альфа), IL-1β (интерлейкин-1β), и хемокинов, таких как CCL5 (хемокиновый (С-С мотив) лиганд 5)/RANTES (регулируемый при активации, экспрессируемый нормальными Т-клетками, а также секретируемый), но совсем или почти не видим в отношении IL-6 (интерлейкин-6). Таким образом, способы на основе продуцирования последнего (US 2009/0239819 и US 2007/0184496) не подходят для обнаружения контаминантов в виде смеси в растворе.
Таким образом, компания-заявитель пришла к следующим выводам:
(i) трудно обнаружить бактериальные контаминанты, присутствующие в следовых количествах в биологических растворах,
(ii) важно не ограничиваться обнаружением PGN и LPS вследствие синергических эффектов,
(iii) необходимо разработать новые способы обнаружения, которые являются чувствительными и воспроизводимыми, и
(iv) выгодно применять чувствительные и воспроизводимые способы обнаружения, способные охарактеризовать природу контаминантов.
Таким образом, заслугой компании-заявителя стала разработка чувствительных и эффективных способов обнаружения микробных контаминантов, обладающих провоспалительным действием, ниже порога чувствительности способов, применяемых в настоящее время и/или описанных в литературе, и затем для идентификации семейства или даже природы провоспалительных молекул, присутствующих в следовых количествах в партиях, полученных на производственных линиях.
Фактически, очень чувствительный способ измерения воспалительных ответов in vitro позволит задержать или не задержать партии исходя из уровней загрязнения, которые являются "не значимыми" в том смысле, что эти уровни будут ниже, чем уровни, измеряемые в настоящее время с применением стандартных анализов.
Станет возможным предложить такие партии для изготовления композиции растворов для терапевтического применения у человека (например, растворов для перитонеального диализа).
Кроме того, идентификация молекул, ответственных за воспалительные ответы, должна позволить обнаружить источники загрязнений во время способов получения и вводить корректирующие модификации для того, чтобы снизить уровни контаминантов или даже устранить их.
Способ в соответствии с настоящим изобретением, таким образом, относится к способу обнаружения провоспалительных контаминантов полимеров глюкозы, в частности, полимеров для подготовки раствора для перитонеального диализа, включающему анализ воспалительного ответа in vitro.
Данные полимеры глюкозы могут быть предназначены для перитонеального диализа, энтерального и парентерального питания, а также кормления новорожденных. В одном предпочтительном варианте осуществления полимеры глюкозы, которые могут быть испытаны с применением способов настоящего изобретения, представляют собой икодекстрин или мальтодекстрины. Они могут быть испытаны на одной или нескольких стадиях их получения и, в частности, на уровне сырья, на любом этапе способа их получения и/или на уровне конечного продукта способа. Они также могут быть испытаны в виде образца раствора для перитонеального диализа.
Как упомянуто ранее, некоторые молекулы бактериального происхождения, такие как MDP и f-MLP, являются слабыми индукторами воспаления, но они могут действовать в комбинации или в синергии и повышать ответ, индуцированный другими контаминантами.
Это свойство основано на том, что молекулы действуют посредством вмешательства рецепторов, отличных от TLR.
Кроме LPS, который реагирует с TLR4, большинство молекул с воспалительным потенциалом, которые могут присутствовать в партиях, являются агонистами TLR2.
Такие контаминанты трудно обнаружить, так как они присутствуют в низких концентрациях, и воспалительный ответ, который они будут стимулировать, чаще всего близок к фоновому шуму.
Следовательно, присутствие молекул с синергической активностью может усиливать воспалительный ответ, индуцированный лигандами TLR2, что может быть использовано для обнаружения низких доз контаминантов.
Образцы, загрязненные MDP (агонист NOD2), f-MLP (микробный пептидный лиганд рецептора) или даже LPS (для инициирования синергии TLR4/TLR2), будут в результате стимулировать воспалительный ответ in vitro.
Таким образом, провоспалительные контаминанты, обнаруженные при помощи способа по настоящему изобретению, способны стимулировать отдельно или в комбинации воспалительную реакцию. В частности, такие контаминанты могут быть слабыми индукторами воспаления, когда рассматриваются отдельно, но могут индуцировать существенную воспалительную реакцию, когда находятся в комбинации. Способ согласно настоящему изобретению позволяет учитывать эффект набора контаминантов, присутствующих в рассматриваемом препарате полимера глюкозы, а не только конкретный эффект каждого из них.
Способ согласно настоящему изобретению включает, по меньшей мере, один анализ воспалительного ответа in vitro с применением клеточной линии, которая позволяет обнаружить по меньшей мере один фактор воспалительного ответа. Предпочтительно клеточная линия представляет собой клеточную линию макрофагов либо дифференцируемую в макрофаги, или клетки, экспрессирующие один или несколько TLR или NOD-подобных рецепторов, таких как TLR2, TLR4 или NOD2, или их комбинацию.
Согласно первому варианту осуществления клеточная линия, применяемая в анализе воспалительного ответа, является клеточной линией макрофагов либо дифференцируемой в макрофаги. В частности, данная клеточная линия продуцирует TNF-α и хемокин CCL5/RANTES. Предпочтительно анализ проводят на клетках ТНР-1, дифференцируемых в макрофаги.
В одном предпочтительном варианте осуществления макрофаги или клетки, дифференцируемые в макрофаги, в частности клетки ТНР-1, дифференцируемые в макрофаги, применяют при плотности от 0,5 до 1×106 клеток/мл культуральной среды, предпочтительно от 0,7 до 0,8×106 клеток/мл, и еще более предпочтительно приблизительно 0,75×106 клеток/мл.
Анализ воспалительного ответа in vitro может быть основан на продуцировании TNF-α и/или хемокина CCL5/RANTES макрофагами, в частности, клетками ТНР-1, дифференцируемыми в макрофаги, при условии, что синергический эффект (эффект, полученный посредством комбинации этих различных контаминантов) заметен главным образом в отношении цитокинов острой фазы воспаления (TNF-α, IL-1β, хемокинов), но не в отношении цитокинов замедленной фазы, таких как IL-6.
Таким образом, согласно одному конкретному варианту осуществления анализ воспалительного ответа заключается в размещении клеток клеточной линии, предпочтительно макрофагов, в присутствии препарата полимеров глюкозы, которые могут содержать провоспалительные контаминанты, и в измерении продуцирования цитокинов острой фазы воспаления, в частности, TNF-α, IL-1β и/или хемокинов, в частности, CCL5/RANTES, продуцирование данных цитокинов указывает на то, что данный препарат содержит контаминанты, способные стимулировать воспалительную реакцию. В одном особенно предпочтительном варианте осуществления анализ включает измерение продуцирования TNF-α и/или CCL5/RANTES, предпочтительно CCL5/RANTES. Анализ на цитокины может быть выполнен любым способом, хорошо известным специалистам в данной области техники, и, в частности, с помощью ELISA. В одном предпочтительном варианте осуществления анализ включает измерение продуцирования TNF-α через 8 ч стимуляции. В другом предпочтительном варианте осуществления анализ включает измерение продуцирования RANTES через 20 ч стимуляции, в частности, с помощью анализа ELISA.
Для того чтобы увеличить клеточный ответ, индуцированный провоспалительными контаминантами, например, LPS и/или PGN, компонент, который позволяет действовать в синергизме с контаминантами, может быть добавлен к исследуемому образцу. Фактически, это может позволить обнаружить низкие дозы контаминантов. Предпочтительно данный компонент может представлять собой MDP или родственную молекулу (N-гликолил-MDP, L18-MDP), формулированный микробный пептид (f-MLP) или LPS. Предпочтительно данный компонент является MDP, f-MLP или LPS. Еще более предпочтительно данный компонент является MDP или LPS. В частности, LPS представляет собой LPS из Е. coli.
В одном предпочтительном варианте осуществления MDP, в частности, MDP из S. aureus, добавляют к образцу. Предпочтительно MDP добавляют к образцу в концентрации более 1 мкг/мл, предпочтительно в концентрации от 1 до 100 мкг/мл. В одном из наиболее предпочтительных вариантов осуществления MDP добавляют к образцу в концентрации 10 мкг/мл.
В другом предпочтительном варианте осуществления f-MLP добавляют к образцу в концентрации более 10 нМ, предпочтительно по меньшей мере 50, 100, 150, 200, 300, 400 или 500 нМ.
В еще одном предпочтительном варианте осуществления LPS, в частности LPS из E. coli, могут добавлять к образцу в концентрации по меньшей мере 10 пг/мл, например, в концентрации 25 пг/мл.
В одном предпочтительном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы от 5 до 50 мг/мл, предпочтительно от 5 до 10, 20, 30 или 40 мг/мл. В одном конкретном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы приблизительно 5 мг/мл. В одном предпочтительном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы приблизительно 25 мг/мл.
Необязательно образец препарата полимера глюкозы может быть обработан мутанолизином перед анализом. Этот фермент благодаря его мурамидазной активности способен к деполимеризации PGN. Например, данный фермент в концентрации приблизительно 2500 Ед/мл может быть размещен в присутствии образца, необязательно разбавленного таким образом, чтобы концентрация полимера глюкозы составляла от 7,5 до 37,5% (масса/объем), в течение 6-16 ч, предпочтительно приблизительно 16 ч Обработанный таким образом образец затем подвергают анализу с макрофагами согласно настоящему изобретению. Необязательно результат, т.е. продуцирование цитокинов, полученное с образцом, обработанным мутанолизином, можно сравнить с результатом, полученным без обработки.
Необязательно в другой альтернативе образец препарата полимера глюкозы может быть отфильтрован перед анализом. Целью данной фильтрации по существу является удаление молекул с высоким молекулярным весом, таких как высокомолекулярный PGN, и выполнение анализа на фильтрате для того, чтобы проанализировать особым образом контаминанты малых размеров. Порог отсечения для фильтрации может составлять, например, от 30 кДа до 150 кДа, предпочтительно от 30 до 100 кДа или от 30 до 50 кДа, и, в частности, приблизительно 30 кДа. Предпочтительно фильтрацию проводят путем ультрафильтрации. Ее также можно провести любым способом, известным специалистам в данной области техники. Таким образом, профильтрованный подобным образом образец, фильтрат, будет подвергнут анализу с помощью макрофагов согласно настоящему изобретению. Необязательно результат, т.е. продуцирование цитокинов, полученное с фильтратом, можно сравнить с результатом, полученным без фильтрации или перед фильтрацией. Это позволит установить специфический вклад в воспаление молекул малых размеров.
В одном предпочтительном и конкретном варианте осуществления способ имеет одну или несколько следующих характеристик:
- клеточную линию применяют при плотности от 0,5 до 1×106 клеток/мл, предпочтительно от 0,7 до 0,8×106 клеток/мл, и еще более предпочтительно приблизительно 0,75×106 клеток/мл; и/или
- концентрация полимера глюкозы составляет менее 50 мг/мл, предпочтительно приблизительно 25 мг/мл; и/или
- продуцирование цитокинов измеряют через 20 ч стимуляции для RANTES и/или 8 ч стимуляции для TNF-α; и/или
- MDP добавляют к препарату полимера глюкозы в концентрации от 1 до 100 мкг/мл, предпочтительно приблизительно 10 мкг/мл.
Предпочтительно способ включает все характеристики.
Таким образом, в одном наиболее конкретном режиме настоящий способ включает:
- размещение макрофагов в присутствии в течение приблизительно 20 ч препарата полимера глюкозы, который может содержать провоспалительные контаминанты, в присутствии MDP, предпочтительно в концентрации от 1 до 100 мкг/мл, концентрации полимера глюкозы, составляющей менее 50 мг/мл, предпочтительно приблизительно 25 мг/мл, и макрофагов с плотностью от 0,5 до 1×106 клеток/мл, предпочтительно от 0,7 до 0,8×106 клеток/мл, и еще более предпочтительно приблизительно 0,75×106 клеток/мл; и
- измерение продуцирования CCL5/RANTES, продуцирования CCL5/RANTES, указывающего на, что препарат содержит контаминанты, способные стимулировать воспалительную реакцию.
Совершенно конкретно, этот первый вариант осуществления позволяет обнаружить загрязнение полимера глюкозы PGN и/или LPS, предпочтительно PGN среднего размера (в частности, приблизительно 120 кДа) и/или LPS, еще более конкретно LPS.
В частности, способ может включать количественное определение контаминантов. Например, это количественное определение может быть выполнено с применением кривой доза-ответ. Эта кривая доза-ответ может, в частности, быть получена на тех же клетках, в тех же условиях с возрастающими дозами контаминантов. Предпочтительно такую кривую доза-ответ можно получить с возрастающими дозами LPS.
Этот первый вариант осуществления может быть осуществлен в способах согласно настоящему изобретению индивидуально или в комбинации со вторым вариантом осуществления.
Согласно второму варианту осуществления клеточная линия, применяемая для проведения анализа воспаления in vitro, является линией, которая позволяет обнаружить активность одного или нескольких рецепторов врожденного иммунитета.
В частности, данная клеточная линия может быть получена путем стабильной трансфекции одним или несколькими векторами, кодирующими один или несколько рецепторов врожденного иммунитета.
Активность рецептора врожденного иммунитета может быть обнаружена, например, с применением репортерного гена, который находится под непосредственным контролем сигнального пути, связанного с указанным рецептором. Предпочтительно данный репортерный ген кодирует окрашенный или флуоресцирующий белок, или кодирует белок, активность которого может быть измерена с помощью субстрата или без него. В частности, репортерный ген кодирует щелочную фосфатазу.
Таким образом, способ включает размещение одной или нескольких клеточных линий, экспрессирующих один или несколько TLR или NOD-подобных рецепторов, в присутствии препарата полимеров глюкозы и измерение активности рецепторов, в частности, посредством сигнала репортерного гена. Этот сигнал репортерного гена указывает на присутствие в препарате контаминанта, который является агонистом данного рецептора.
Предпочтительно клеточная линия позволяет обнаружить активность одного или нескольких TLR или NOD-подобных рецепторов, таких рецепторов, как TLR2, 3, 4, 5, 7, 8, 9 или NOD2. Предпочтительно клеточная линия позволяет обнаружить активность одного или нескольких рецепторов, выбранных из TLR2, TLR4 и NOD2. В одном конкретном варианте осуществления клеточная линия экспрессирует рецепторы TLR2, TLR4 и NOD2, а также позволяет обнаружить их активность.
Применяемые клеточные линии могут представлять собой, например, линии HEK-Blue™ (выпускается компанией InvivoGen), модифицированные путем стабильной трансфекции векторами, кодирующими рецепторы врожденного иммунитета. Тем не менее, следует отметить, что специалисты в данной области техники могут применять и другие коммерчески доступные линии (Imgenex) или они могут приготовить их.
Такие клетки могут также быть одновременно трансфицированы репортерным геном, продуцирующим, например, секретируемую форму щелочной фосфатазы (SEAP: секретируемая эмбриональная щелочная фосфатаза), синтез которой находится под непосредственным контролем сигнального пути, связанного с рецептором (рецепторами), экспрессируемыми в той же клеточной линии. В одном предпочтительном варианте осуществления ферментативную реакцию проводят с применением отношения 1:3 анализируемой среды к реагенту SEAP (например, 50 мкл среды и 150 мкл реагента SEAP). Кроме того, время реакции по меньшей мере 60 минут будет предпочтительным.
Клеточные линии могут, например, быть выбраны из группы, состоящей из:
- линии HEK-Blue™ hTLR2 (линия, которая специфически реагирует на агонисты TLR2),
- линии HEK-Blue™ hNOD2 (линия, которая эффективно реагирует на продукты деполимеризации PGN и родственные молекулы (MDP, L18-MDP, и т.д.) и
- линии Raw-Blue™ (линия макрофагов мыши, трансфицированная таким образом, что экспрессирует щелочную фосфатазу). Линия Raw-Blue™ экспрессирует рецепторы врожденного иммунитета, а именно рецепторы TLR2, TLR4 и NOD2.
Эти линии подробно описаны ниже в данном описании.
В одном предпочтительном варианте осуществления будет использована линия, экспрессирующая TLR2 и позволяющая обнаружить его активность, и/или линия, экспрессирующая рецепторы TLR2, TLR4 и NOD2, а также позволяющая обнаружить их активность. В качестве примера будут использованы клеточные линии HEK-Blue™ hTLR2 и/или Raw-Blue™. Более конкретно, с помощью способа будут осуществлять анализ с применением клеточных линий HEK-Blue™ hTLR2 и Raw-Blue™.
В другом предпочтительном варианте осуществления будут использованы две линии, экспрессирующие, соответственно, TLR2 и NOD2, а также позволяющие обнаружить их активность (по отдельности), и одна линия, экспрессирующая рецепторы TLR2, TLR4 и NOD2, а также позволяющая обнаружить их активность. В качестве примера будут использованы клеточные линии HEK-Blue™ hTLR2, HEK-Blue™ hNOD2 и Raw-Blue™. Более конкретно, с помощью способа будут осуществлять анализ с применением клеточных линий HEK-Blue™ hTLR2, HEK-Blue™ hNOD2 и Raw-Blue™.
Применение таких линий, следовательно, позволяет заменить анализ на цитокины ферментативным анализом (фосфатазная активность), а также выявить некоторые семейства молекул бактериального происхождения в соответствии с рецептором(ами), экспрессируемым линией.
Кроме того, такие линии позволяют обнаружить контаминанты при очень низких порогах, в частности, для агонистов TLR2 (PGN, LTA (липотейхоевая кислота), LM (липоманнан), и т.д.) и агонистов NOD2 (продукты деполимеризации PGN и MDP). Таким образом, линия, экспрессирующая NOD2, в частности, HEK-Blue™ hNOD2, позволяет более конкретно обнаружить контаминацию продуктами деполимеризации PGN и MDP, предпочтительно MDP. Линия, экспрессирующая TLR2, в частности, HEK-Blue™ hTLR2 и/или Raw-Blue™, позволяет наиболее конкретно обнаружить контаминацию PGN.
Согласно этому второму варианту осуществления анализ воспалительного ответа in vitro заключается в размещении клеток клеточной линии, позволяющей обнаружить активность одного или нескольких рецепторов врожденного иммунитета, в присутствии препарата полимеров глюкозы, которые могут содержать провоспалительные контаминанты, и измерении активности рецептора или сигнала репортерного гена, который связан с ним.
Обнаружение данной активности или данного сигнала указывает на то, что препарат содержит контаминанты, способные к активации одного или нескольких рецепторов врожденного иммунитета и инициации воспалительной реакции.
В одном предпочтительном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы от 5 до 50 мг/мл, предпочтительно от 5 до 10, 20, 30 или 40 мг/мл. В одном конкретном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы приблизительно 5 мг/мл. В предпочтительном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы приблизительно 37,5 мг/мл при использовании клеток HEK-Blue™ hTLR2 и/или HEK-Blue™ hNOD2. В другом предпочтительном варианте осуществления испытываемый препарат полимера глюкозы имеет концентрацию полимера глюкозы приблизительно 50 мг/мл при использовании клеток Raw-Blue™.
Необязательно образец препарата полимера глюкозы может быть обработан мутанолизином перед анализом. Этот фермент благодаря его мурамидазной активности способен к деполимеризации PGN. Например, данный фермент в концентрации приблизительно 2500 Ед/мл может быть размещен в присутствии образца, необязательно разбавленного так, чтобы концентрация полимера глюкозы составляла от 7,5% до 37,5% (масса/объем), в течение 6-16 ч, предпочтительно приблизительно 16 ч. Обработанный таким образом образец затем подвергают способам согласно второму варианту осуществления. Необязательно результат, полученный в образце, обработанном мутанолизином, можно сравнивать с результатом, полученным без обработки.
Необязательно в другой альтернативе, образец препарата полимера глюкозы может быть отфильтрован перед анализом. Целью данной фильтрации по сути является удаление молекул с высоким молекулярным весом, таких как высокомолекулярный PGN, и проведение анализа на фильтрате для того, чтобы проанализировать наиболее детально контаминанты малых размеров. Порог отсечения для фильтрации может составлять, например, от 30 кДа до 150 кДа, предпочтительно от 30 до 100 кДа или от 30 до 50 кДа, и, в частности, приблизительно 30 кДа. Предпочтительно фильтрацию проводят путем ультрафильтрации. Ее также можно выполнить любым способом, известным специалистам в данной области техники. Таким образом, профильтрованный подобным образом образец, фильтрат, будут подвергать способам согласно второму варианту осуществления. Необязательно результат, полученный с фильтратом, можно сравнивать с результатом, полученным без или до фильтрации. Это позволит установить специфический вклад в воспаление молекул малых размеров.
В одном предпочтительном и конкретном варианте осуществления этого второго варианта осуществления способ имеет одну или несколько следующих характеристик:
- клеточную линию применяют при плотности приблизительно 50000 клеток/лунку 96-луночного планшета для HEK-Blue™ hTLR2 или Raw-Blue™ и 10000 клеток/лунку 96-луночного планшета для HEK-Blue™ hNOD2; и/или
- анализируемый препарат полимера глюкозы имеет концентрацию полимера глюкозы от 5 до 50 мг/мл, предпочтительно концентрацию полимера глюкозы приблизительно 37,5 мг/мл при использовании клеток HEK-Blue™ hTLR2 и/или HEK-Blue™ hNOD2, а также концентрацию полимера глюкозы приблизительно 50 мг/мл при использовании клеток Raw-Blue™; и/или
- приведение препарата полимера глюкозы в контакт с клетками продолжительностью приблизительно от 16 до 24 ч и/или
- сигнал репортерного гена SEAP обнаруживают с отношением культуральный супернатант:субстрат SEAP 20:180, предпочтительно 50:150, предпочтительно через по меньшей мере 60 минут инкубации, в идеале 60 минут.
В одном конкретном варианте осуществления способ включает все эти характеристики.
В частности, способ может включать количественное определение контаминантов. Например, данное количественное определение может быть проведено с применением кривой доза-ответ. Эта кривая доза-ответ может, в частности, быть получена на тех же клетках, в тех же условиях с возрастающими дозами контаминантов. Предпочтительно такую кривую доза-ответ можно получить для клеток, экспрессирующих TLR2 (например, HEK-Blue™ hTLR2 и Raw-Blue™), с возрастающими дозами PGN и для клеток, экспрессирующих NOD2 (например, HEK-Blue™ hNOD2), с возрастающими дозами MDP.
Способ согласно настоящему изобретению может также включать этап, заключающийся в идентификации контаминанта(ов), способного к инициации воспалительной реакции.
Для этого клеточную линию, позволяющую обнаружить активность рецептора врожденного иммунитета или нескольких рецепторов врожденного иммунитета, как описано выше, размещают в присутствии препарата полимера глюкозы, подлежащего анализу. Измеряют активность данного рецептора или сигнал репортерного гена, связанного с этим рецептором. Обнаружение данной активности или данного сигнала указывает на присутствие в препарате контаминанта, являющегося агонистом данного рецептора.
Таким образом, линия, экспрессирующая NOD2, в частности HEK-Blue™ hNOD2, позволяет наиболее конкретно обнаружить загрязнение продуктами деполимеризации PGN и MDP, предпочтительно MDP. Линия, экспрессирующая TLR2, в частности HEK-Blue™ hTLR2 и/или Raw-Blue™, позволяет наиболее конкретно обнаружить контаминацию PGN. Кроме того, макрофаги, в частности макрофаги ТНР-1, позволяют наиболее конкретно обнаружить контаминацию LPS.
Согласно одному варианту осуществления способ согласно настоящему изобретению включает этапы, заключающиеся в
(a) выполнении по меньшей мере одного анализа воспалительного ответа in vitro, как описано выше в первом варианте осуществления, заключающегося в размещении клеток клеточной линии, предпочтительно макрофагов, в присутствии препарата полимеров глюкозы, которые могут содержать провоспалительные контаминанты, и в измерении продуцирования цитокинов острой фазы воспаления, в частности, TNF-α, IL-1β и/или хемокинов, таких как CCL5/RANTES, продуцирование таких цитокинов указывает на то, что препарат содержит контаминанты, способные к инициации воспалительной реакции, и/или
(b) размещении клеточной линии, которая позволяет обнаружить активность рецептора врожденного иммунитета или нескольких рецепторов врожденного иммунитета, как описано выше во втором варианте осуществления, в присутствии препарата и обнаружении активности рецептора или сигнала репортерного гена, связанного с этим рецептором, обнаружении данной активности или данного сигнала, указывающих на присутствие в препарате контаминанта, который является агонистом данного рецептора.
Согласно одному предпочтительному варианту осуществления способ согласно настоящему изобретению включает этапы, заключающиеся в
(а) выполнении по меньшей мере одного анализа воспалительного ответа in vitro, заключающегося в размещении клеток клеточной линии, предпочтительно макрофагов, в присутствии препарата полимеров глюкозы, которые могут содержать провоспалительные контаминанты, и в измерении продуцирования цитокинов острой фазы воспаления, в частности, TNF-α, IL-1β, и/или хемокинов, таких как CCL5/RANTES, продуцирование таких цитокинов указывает на то, что препарат содержит контаминанты, способные к инициации воспалительной реакции, и,
(b) когда препарат содержит контаминанты, размещении клеточной линии, которая позволяет обнаружить активность рецептора врожденного иммунитета или нескольких рецепторов врожденного иммунитета, как описано выше, в присутствии препарата и обнаружении активности рецептора или сигнала репортерного гена, связанного с этим рецептором, обнаружение данной активности или данного сигнала, указывает на присутствие в препарате контаминанта, являющегося агонистом данного рецептора.
Этапы а) и b) данного способа выполняют согласно деталям, предоставленным выше. Предпочтительно настоящий способ включает два этапа.
В одном предпочтительном варианте осуществления будет применяться клеточная линия, экспрессирующая рецептор TLR2 и позволяющая обнаружить его активность, такая как HEK-Blue™ hTLR2, и/или линия, экспрессирующая несколько рецепторов врожденного иммунитета, как описано выше, в частности, TLR2, TLR4 и NOD2, такая как Raw-Blue™. Более конкретно, с помощью способа будут осуществлять анализ с применением клеточных линий HEK-Blue™ hTLR2 и Raw-Blue™.
В другом предпочтительном варианте осуществления будет применяться клеточная линия, экспрессирующая рецептор TLR2 и позволяющая обнаружить его активность, такая как HEK-Blue™ hTLR2, клеточная линия, экспрессирующая рецептор NOD2 и позволяющая обнаружить его активность, такая как HEK-Blue™ hNOD2, и/или линия, экспрессирующая несколько рецепторов врожденного иммунитета, как описано выше, в частности, TLR2, TLR4 и NOD2, такая как Raw-Blue™. Более конкретно, способ будет осуществлять анализ с применением клеточных линий HEK-Blue™ hTLR2, HEK-Blue™ hNOD2 и Raw-Blue™.
Данный способ, таким образом, позволяет не только обнаружить присутствие провоспалительных контаминантов в препарате полимера глюкозы, но также получить информацию о природе этих контаминантов. Он, в частности, позволяет определить, являются ли эти контаминанты агонистами TLR или NOD-подобных рецепторов, таких как TLR2, TLR4 или NOD2. Согласно одному предпочтительному варианту осуществления несколько линий могут быть использованы для предоставления дополнительной информации к полученной, например, при анализах цитокинового ответа на дифференцируемых клетках ТНР-1:
- линия HEK-Blue™ hTLR4: эта линия специфически отвечает на агонисты TLR4. Она позволяет, в частности, анализировать LPS;
- линия HEK-Blue™ hTLR2: эта линия специфически отвечает на агонисты TLR2. Она позволяет, в частности, анализировать PGN.
Их применение, таким образом, позволяет определить вклад этих контаминантов в инициацию воспалительных ответов.
В одном конкретном варианте осуществления образец препарата полимера глюкозы может быть отфильтрован, как описано выше, предпочтительно с порогом отсечения 30 кДа, в частности, путем ультрафильтрации, для того, чтобы удалить PGN, в частности, PGN большого размера. Таким образом, липопептиды и гликопептиды малого размера, которые также являются агонистами TLR2, сохранены в фильтрате, и только их ответ будет измерен при анализе фильтрата.
Кроме того, обработка растворов лизоцимом и/или β-глюканазой позволяет устранить PGN и/или β-глюканы, и таким образом определить значимость других агонистов TLR2, которые могут присутствовать в загрязненных партиях (гликолипиды и липопептиды). Кроме того, образец препарата полимера глюкозы может быть обработан мутанолизином перед анализом, в частности, как подробно описано выше;
- линия HEK-Blue™ hNOD2: эта линия специфически отвечает на агонисты NODS. Она позволяет, в частности, анализировать MDP.
Применение данной линии, таким образом, позволяет обнаружить их при низких концентрациях. Данный анализ является наиболее выгодным, поскольку присутствие PGN означает, что продукты его деградации также присутствуют и что они могут действовать синергически с агонистами TLR;
- линия HEK-Blue™ Null2: это контрольная линия, применение которой необходимо для того, чтобы проверить, что растворы полимера глюкозы не индуцируют продуцирование фермента посредством внутреннего механизма;
- линия Raw-Blue™: это линия макрофагов мыши, трансфицированная SEAP.
Преимуществом данной линии заключается в том, что она естественным образом экспрессирует практически все рецепторы врожденного иммунитета.
Она служит в качестве положительного контроля в анализах, так как должна реагировать на микробные контаминанты любого типа.
Предметом настоящего изобретения также является способ идентификации провоспалительных контаминантов.
Анализы LPS и PGN могут проводить любым способом, известным специалистам в данной области техники. Например, содержание пептидогликана может быть определено согласно двум анализам:
- стандартный анализ SLP, выпускаемый компанией WAKO Pure Chemical Industries Ltd.,
- анализ SLP-HS, высокочувствительный анализ, разработанный и утвержденный компанией-заявителем, как подробно описано в ее патентной заявке WO 2010/125315.
Данные анализы имеют различные реагенты (реагенты SLP, стандарты PGN), проявляющие биологические реакционные способности к существенно различным примесям PGN, и, таким образом, различные критерии эффективности:
- Стандартный анализ SLP: реагент SLP n°297-51501-Micrococcus luteus, стандарт PGN n°162-18101.
- Анализ SLP-HS (высокочувствительный): набор SLP-HS n°293-58301 (включая стандарт PGN из Staphylococcus aureus).
Способ SLP-HS, разработанный компанией-заявителем, является более чувствительным. Он имеет пределы обнаружения (LD) и пределы количественного определения (LQ) ниже, чем у стандартного способа SLP:
в анализе SLP-HS LD составляет 1 нг/г и LQ 3 нг/г;
в стандартном анализе SLP LD составляет 20 нг/г и LQ 40 нг/г.
Таким образом, если не указано иное, количественный анализ PGN согласно общепринятым способам проводят в настоящей заявке с применением анализа SLP-HS, поскольку, как будет показано в последующих примерах и описано ниже, анализ SLP-*HS является более чувствительным, чем стандартный анализ SLP.
Анализы "воспалительного ответа", как описано выше, например, с применением клеток HEK-Blue™, позволяют идентифицировать природу основных контаминантов (LPS, PGN, β-глюканов, MDP и родственных молекул) и оценить их вклад в индуцирование воспалительного ответа.
Другие контаминанты, которые могут присутствовать в испытываемых партиях, по существу являются гликолипидами и липопептидами, которые являются агонистами TLR2, или микробными пептидами;
- для гликолипидов и липопептидов проводят процедуру фракционирования на основе их амфифильной природы для того, чтобы извлечь и сконцентрировать их.
Обработка смесью хлороформ/метанол позволяет экстрагировать эти молекулы из растворов полимера глюкозы и сконцентрировать их после выпаривания хлороформа.
Как только эти молекулы будут извлечены, их берут в минимальном объеме DMSO (или любого другого растворителя, являющегося нетоксичным для клеток) и затем анализируют в анализах воспалительного ответа, описанных ранее.
Таким образом, применение клеточной линии, которая позволяет обнаружить активность рецептора, такого как TLR2, например, линии HEK-Blue™ hTLR2, позволяет подтвердить наличие или отсутствие следовых количеств агонистов TLR2, отличных от PGN, в партиях, которые будут проанализированы.
Данные соединения также могут быть испытаны на модели с применением клеток, экспрессирующих все типы рецепторов, таких как клетки Raw-Blue™, но в данном случае растворы полимера глюкозы предварительно обрабатывают Detoxi-gel так, чтобы удалить следовые количества LPS.
В зависимости от извлеченных количеств выполняют более тонкий анализ контаминантов.
В частности, образец может быть отфильтрован. Например, образец препарата полимера глюкозы может быть отфильтрован с порогом отсечения 30 кДа, в частности путем ультрафильтрации. Это позволяет удалить PGN, в частности PGN большого размера. Таким образом, липопептиды и гликопептиды малого размера, также являющиеся агонистами TLR2, сохранены в фильтрате, и фильтрат может быть проанализирован для того, чтобы определить природу контаминантов.
Кроме того, обработка смесью хлороформ/метанол позволяет экстрагировать продукты, которые затем фракционируют на колонке со смолой С18 и/или угольной колонке. Затем соединения элюируют с применением градиента вода/ацетонитрил. В зависимости от чистоты фракций и количества материала более тонкий анализ позволяет определить биохимическую природу этих соединений, или даже их структуру.
Для микробных пептидов этап ультрафильтрации на фильтре 5 кДа позволяет экстрагировать их из растворов полимера глюкозы. Если необходимо, пропускание через угольную колонку позволяет избавить фильтрат от более гидрофобных соединений размером <5 кДа.
Эти растворы в дальнейшем концентрируют и затем испытывают в отношении их биологических свойств. Поскольку эти пептиды являются хемоаттрактантами для лейкоцитов, их присутствие может быть обнаружено при анализе миграции клеток in vitro, доступном в лаборатории.
Возможно, что полимеры глюкозы загрязнены другими молекулами, известными как инициаторы воспалительных ответов, такими как флагеллин, который является белком-агонистом TLR5, и производными нуклеиновых кислот и родственных молекул, агонистами TLR3, 7, 8 и 9 (первые три участвуют в реакциях с соединениями вирусного происхождения, в то время как TLR9 активируется ДНК бактериального происхождения).
В этом случае клеточные линии, которые позволяют обнаружить активность различных TLR, в частности, линии HEK-Blue™, доступны и могут быть использованы для анализа влияния этих молекул на воспалительный ответ.
Кроме того, присутствие олигонуклеотидных соединений может быть подтверждено или исключено биохимическим анализом.
Способ по настоящему изобретению позволяет обнаружить контаминанты полимеров глюкозы для перитонеального диализа, причем указанные контаминанты, способны к действию в синергизме друг с другом для того, чтобы стимулировать воспалительную реакцию, отличающийся тем, что он включает по меньшей мере один анализ воспалительного ответа in vitro с применением модифицированных клеточных линий.
В одном конкретном варианте осуществления настоящее изобретение также предоставляет способ количественного определения PGN в образце, в частности полимеров глюкозы для перитонеального диализа, который включает инкубирование образца с клеточной линией, что позволяет обнаружить активность рецептора TLR2 и измерить активацию сигнального пути, связанного с TLR2, что таким образом позволяет определить количество PGN, содержащегося в образце.
В частности, эта линия представляет собой линию, модифицированную путем трансфекции (предпочтительно стабильной трансфекции) вектором, кодирующим рецептор TLR2. Предпочтительно эта линия не экспрессирует другие рецепторы врожденного иммунитета. Кроме того, эта линия может содержать репортерный ген, который находится под непосредственным контролем сигнального пути, связанного с рецептором TLR2. Предпочтительно данный репортерный ген кодирует окрашенный или флуоресцирующий белок или кодирует белок, активность которого может быть измерена с помощью субстрата или без него. В частности, репортерный ген кодирует щелочную фосфатазу. Эти клетки могут, например, быть одновременно трансфицированы репортерным геном, продуцирующим, например, секретируемую форму щелочной фосфатазы (SEAP: секретируемая эмбриональная щелочная фосфатаза), синтез которой находится под непосредственным контролем сигнального пути, связанного с рецептором TLR2. Эта линия может быть, например, линией HEK-Blue™ hTLR2.
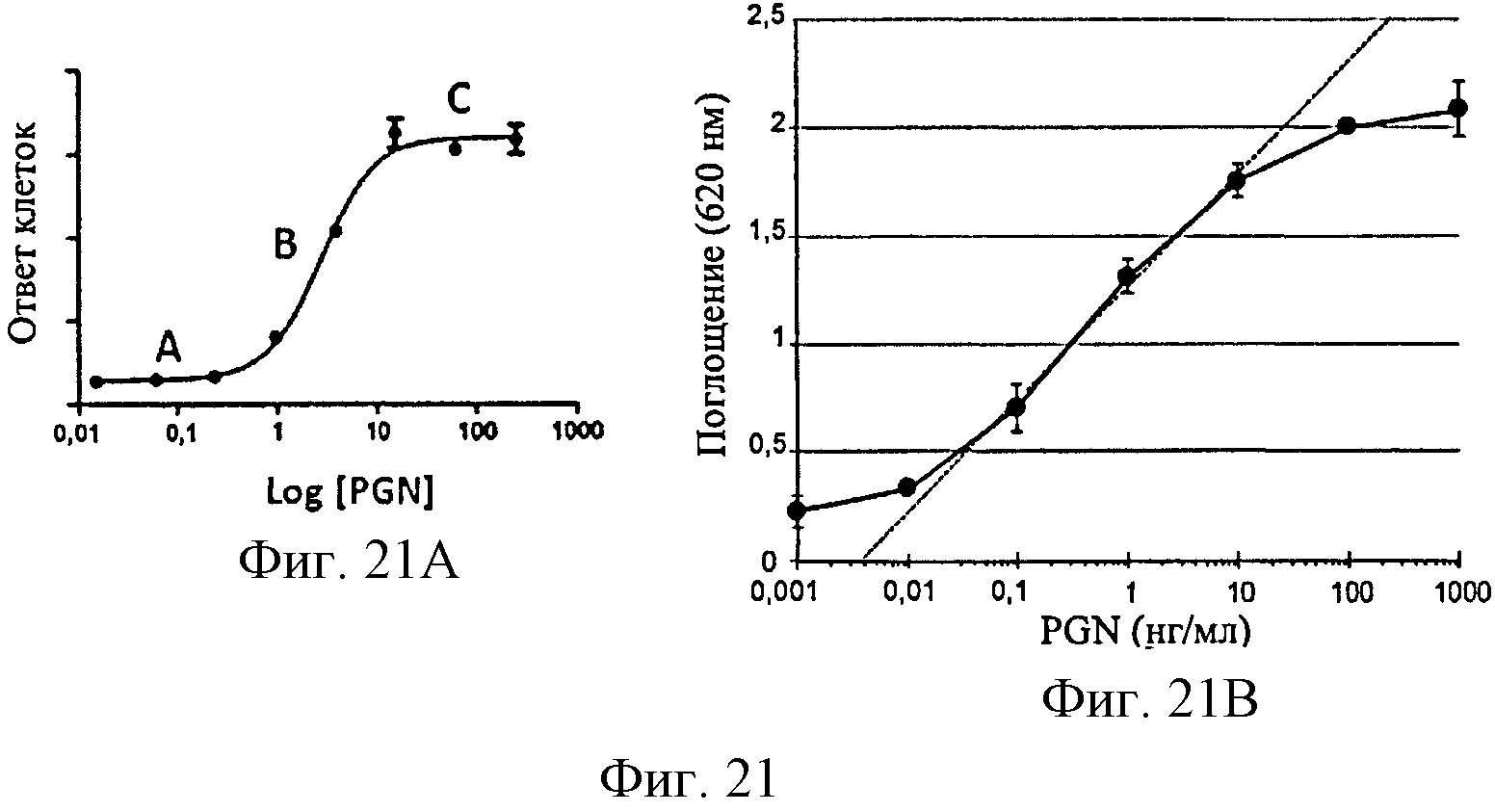
Для того чтобы определить количество PGN, содержащегося в образце, на основе измерения активации сигнального пути, связанного с TLR2, одновременно строится кривая доза-ответ с диапазоном калибровки, содержащим возрастающие концентрации PGN, предпочтительно PGN из S. aureus.
Перед проведением анализа исследуемый образец может быть необязательно частично очищен для того, чтобы удалить, например, любые побочные контаминанты. Гликопептиды и липопептиды могут быть удалены из образца с помощью экстракции хлороформом. После центрифугирования анализ будет проводиться в водной фазе, из которой контаминанты липофильной природы были удалены обычным путем. Может выполняться фракционирование на микроконцентраторе с фильтрами отсечения от 30 до 50 кДа, после чего анализ проводят на ретентате. Предварительная обработка β-глюканазой может позволить повысить качество анализа путем устранения родственных молекул.
Альтернативно и предпочтительно исследуемый образец обрабатывают перед анализом мутанолизином. Например, фермент в концентрации приблизительно 2500 Ед/мл может быть размещен в присутствии образца, предпочтительно разбавленного таким образом, чтобы концентрация полимера глюкозы составляла от 7,5% до 37,5% (масса/объем), если это необходимо. Обработка может длиться от 6 до 16 ч., предпочтительно в течение приблизительно 16 ч. В предпочтительном варианте осуществления обработку проводят в течение приблизительно 16 ч при приблизительно 37°C в образце с концентрацией полимера глюкозы приблизительно 7,5% (масса/объем). Обработанные таким образом образцы будут затем приведены в контакт с клетками, экспрессирующими TLR2, в частности, клетками HEK-Blue™ hTLR2. Необязательно результат, полученный в образце, обработанном мутанолизином, можно сравнивать с результатом, полученным без обработки.
Аналогичный способ может также быть проведен для обнаружения контаминантов полимеров глюкозы для энтерального и парентерального питания, или даже для кормления новорожденных.
Настоящее изобретение будет более понятным при помощи следующих примеров, которые предназначены быть иллюстративными, а неограничивающими.
Краткое описание графических материалов
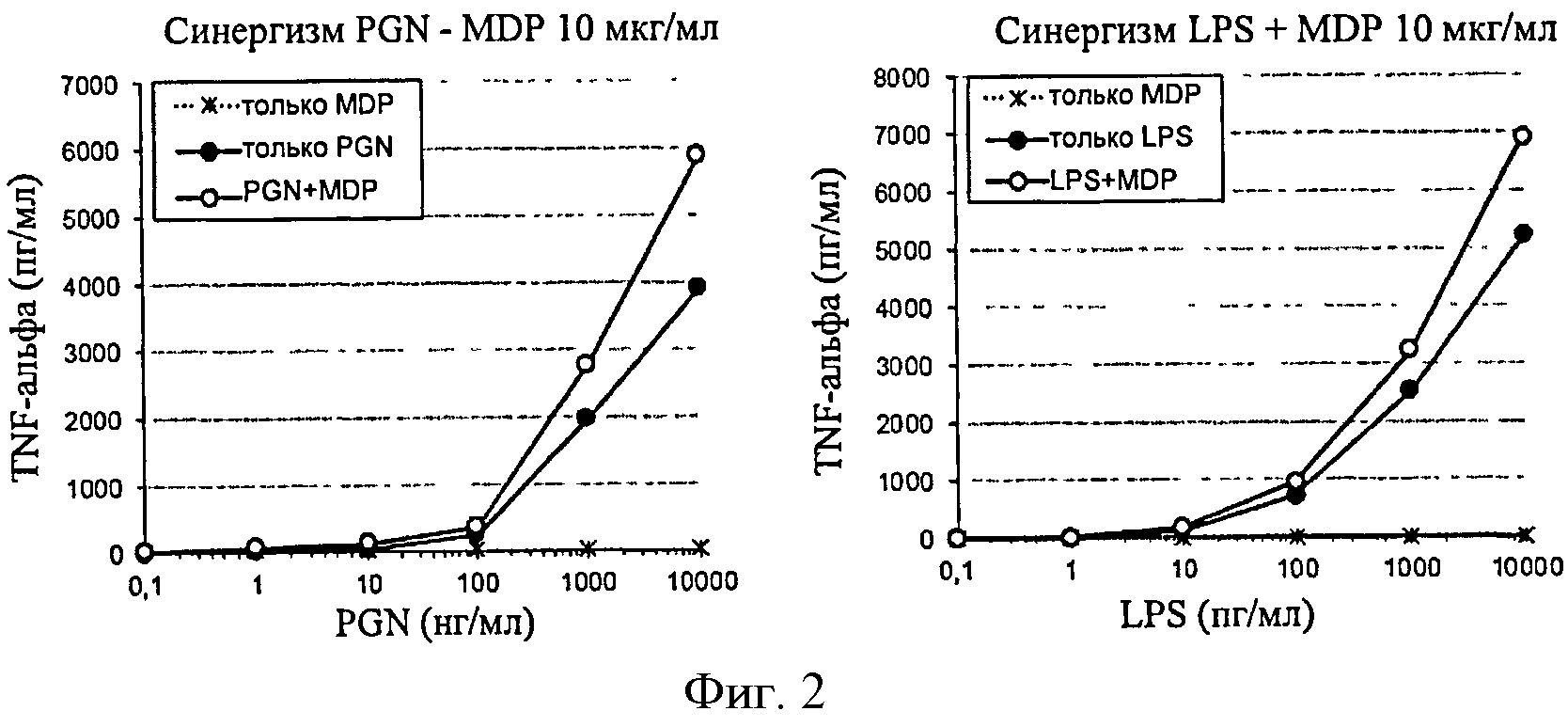
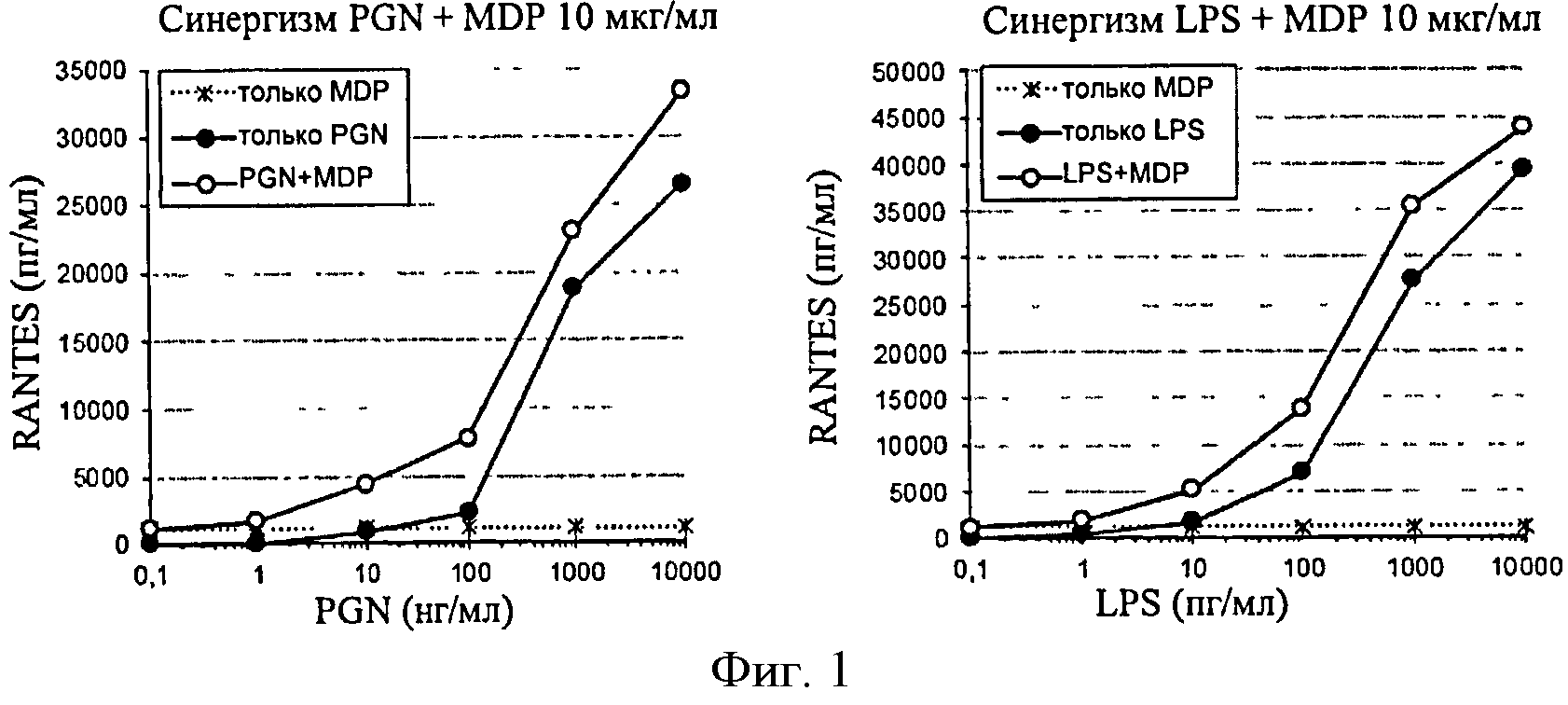
Фигура 1: Продуцирование RANTES в ответ на PGN и на LPS в клетках ТНР-1, сенсибилизированных MDP в концентрации 10 мкг/мл.
Фигура 2: Продуцирование TNF-α в ответ на PGN и на LPS в клетках ТНР-1, сенсибилизированных MDP в концентрации 10 мкг/мл.
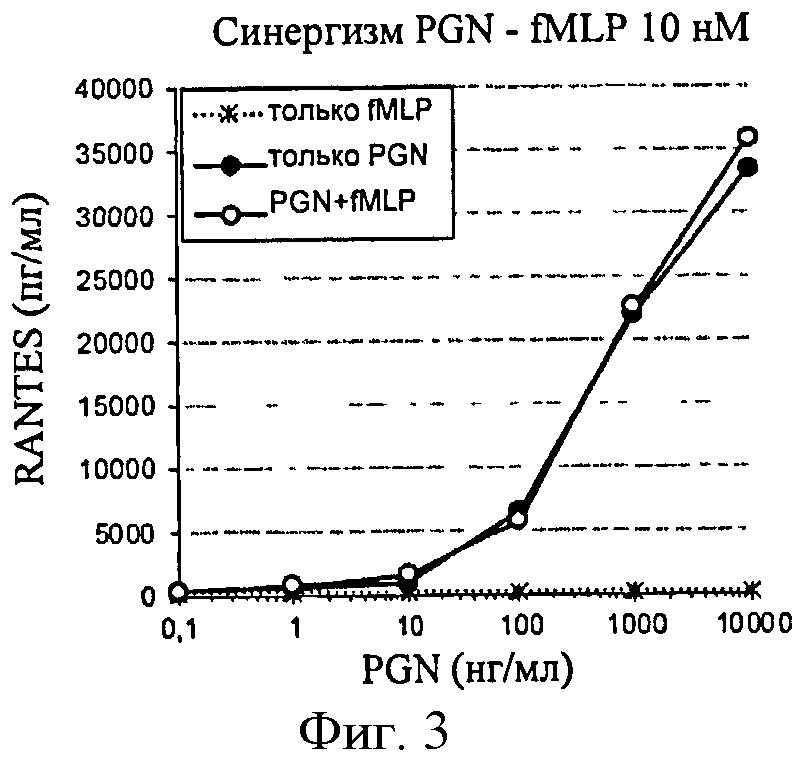
Фигура 3: Продуцирование RANTES в ответ на PGN в клетках ТНР-1, сенсибилизированных f-MLP (10 нМ).
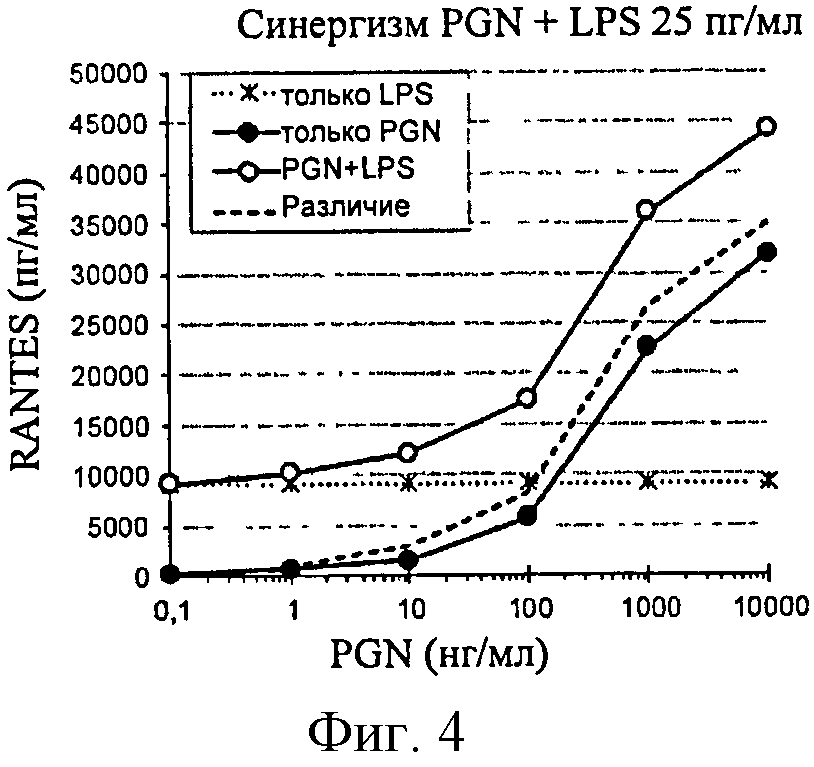
Фигура 4: Продуцирование RANTES в ответ на PGN в клетках ТНР-1, сенсибилизированных LPS (25 пг/мл).
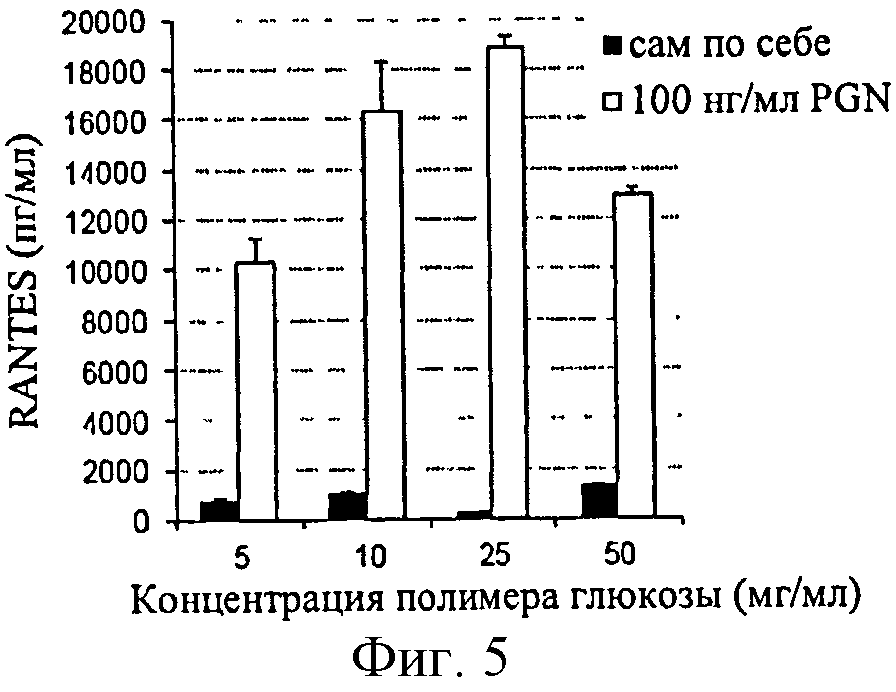
Фигура 5: Эффект концентрации полимера глюкозы на продуцирование RANTES, индуцированное PGN в клетках ТНР-1.
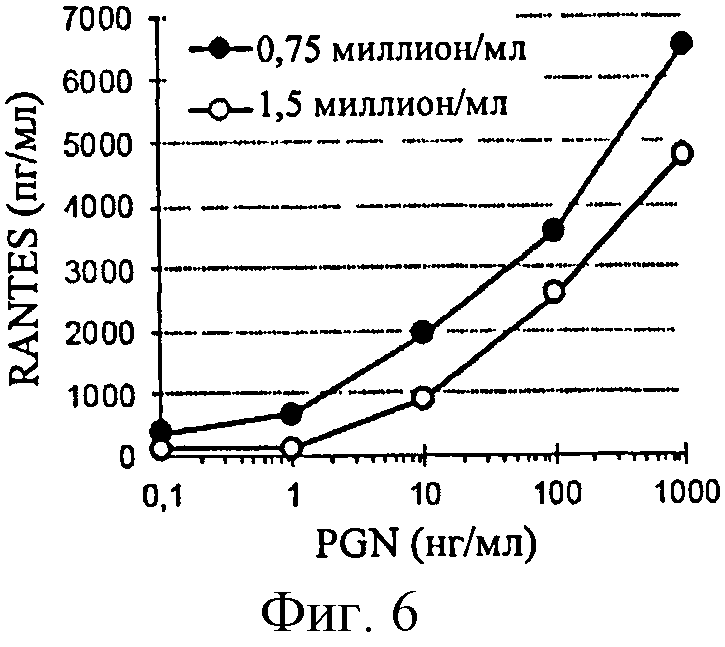
Фигура 6: Эффект концентрации клеток ТНР-1 на продуцирование RANTES, индуцированное PGN.
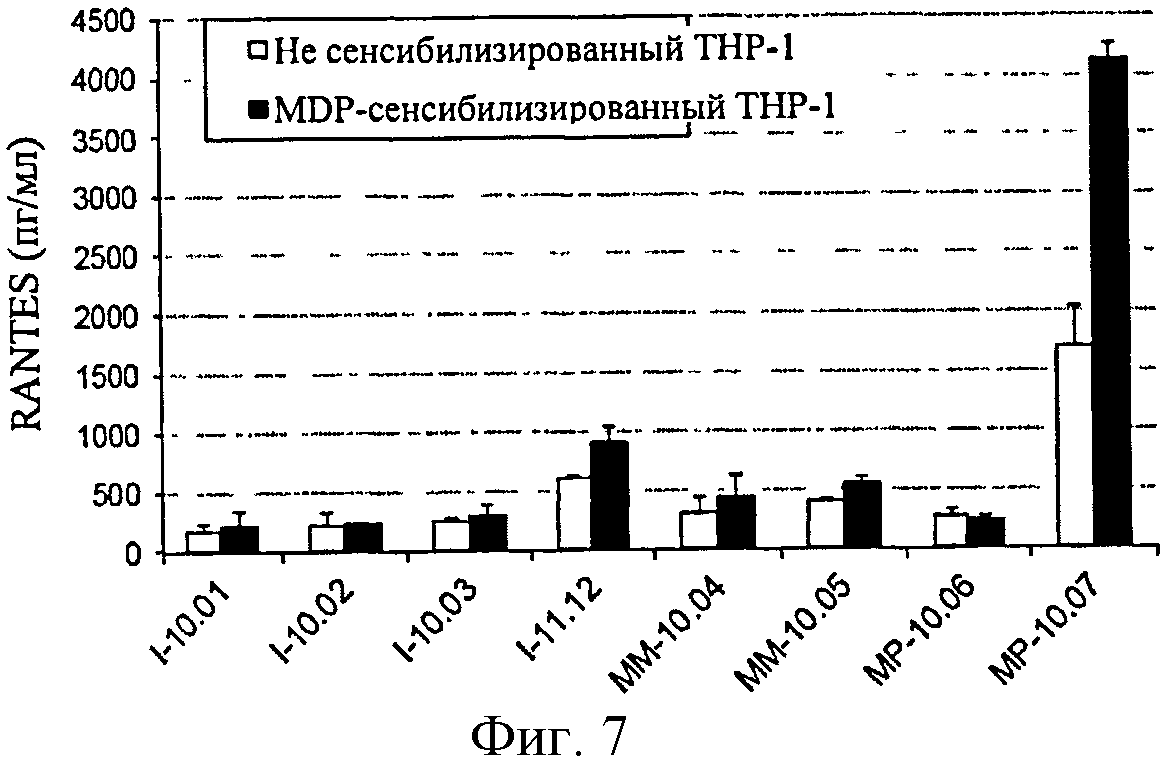
Фигура 7: Продуцирование RANTES сенсибилизированными клетками ТНР-1 в ответ на различные образцы полимера глюкозы.
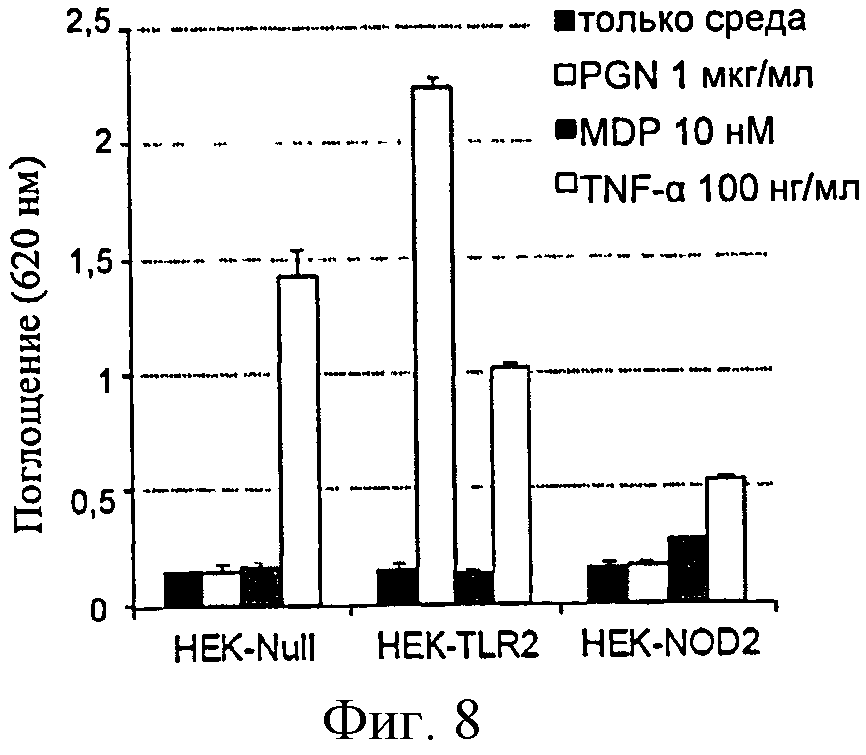
Фигура 8: Анализ ответа клеток HEK-Blue. Клетки стимулировали PGN, MDP и TNF-α, который является положительным контролем стимуляции клеток HEK-Blue™.
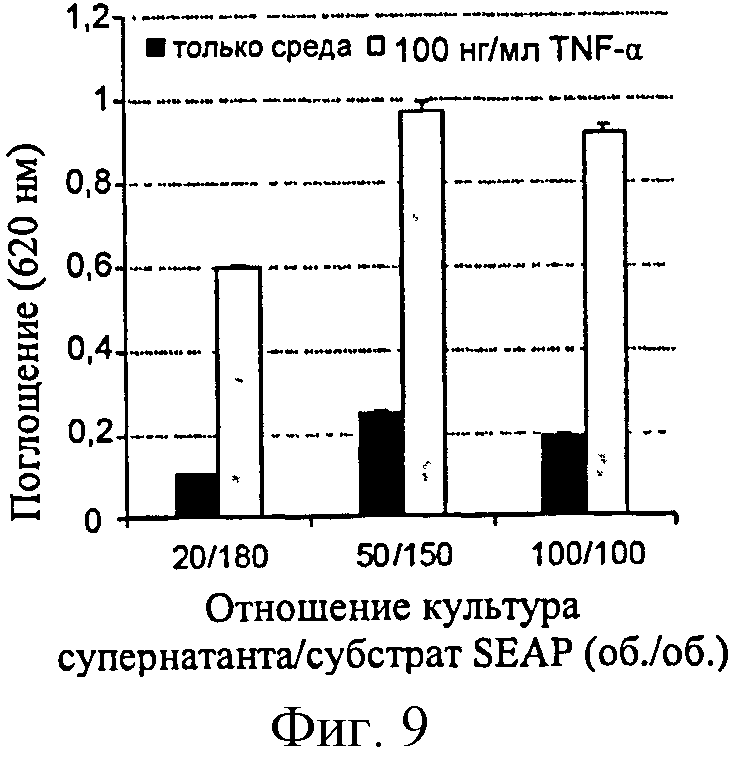
Фигура 9: Ответ SEAP в зависимости от объема культурального супернатанта, добавленного к реакционной среде. Активацию клеток (HEK-TLR2) выполнили с применением TNF-α.
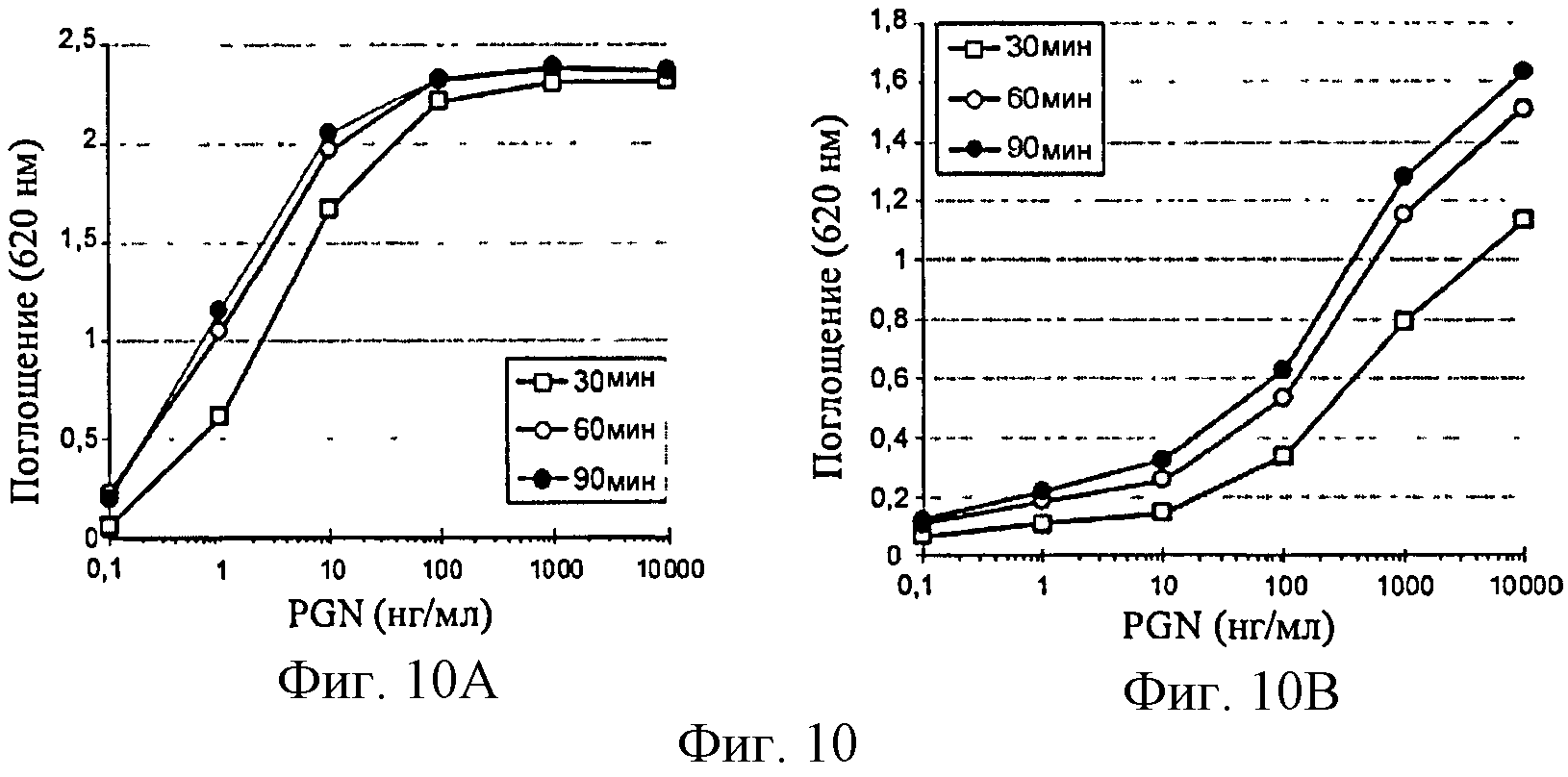
Фигура 10: Оптимизация времени реакции между SEAP и ее субстратом. Клетки HEK-TLR2 (фиг.10А) и Raw-Blue (фиг.10В) стимулировали в присутствии возрастающих концентраций PGN. Через 20 ч стимуляции супернатанты, содержащие SEAP, инкубировали в присутствии раствора Quanti-blue в указанные моменты времени и затем измерили оптическую плотность при 620 нм.
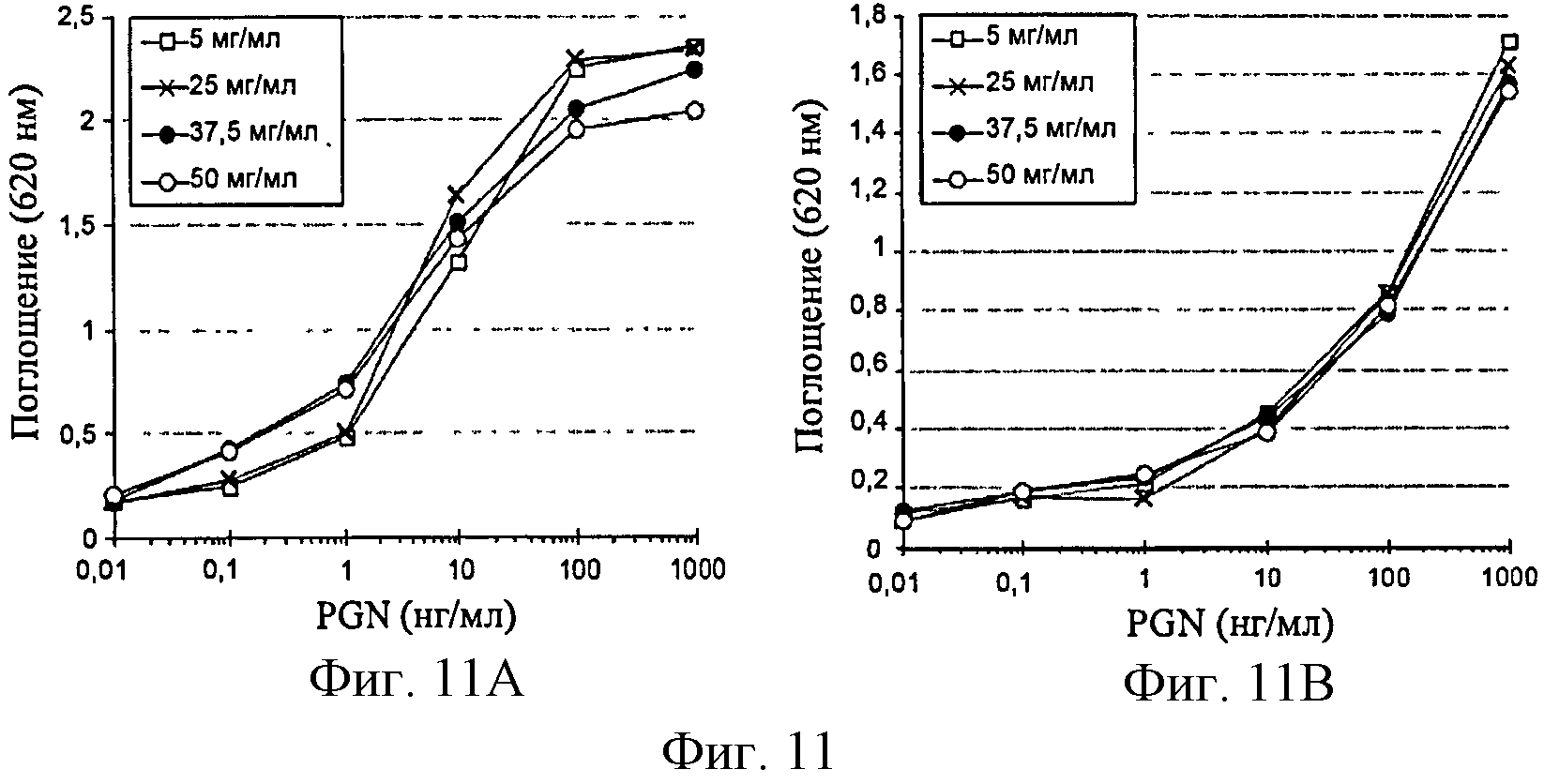
Фигура 11: Эффект концентрации полимера глюкозы на продуцирование SEAP клетками HEK-TLR2 (фиг.11А) и Raw-Blue (фиг.11В) в ответ на возрастающие концентрации PGN.
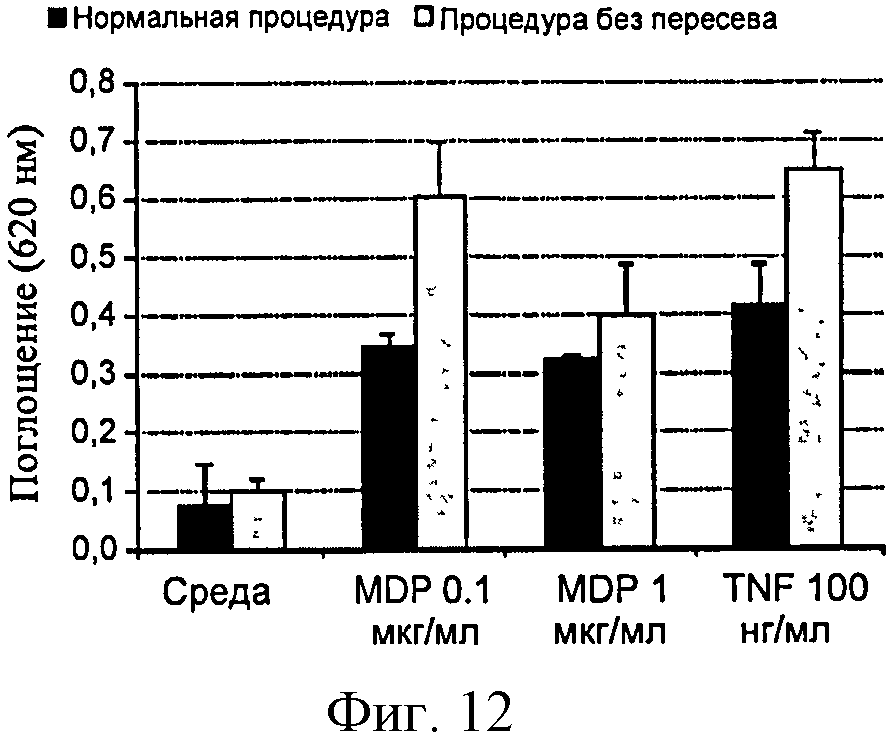
Фигура 12: Сравнение ответов SEAP клеток HEK-NOD2, культивированных согласно способу, предоставляемому поставщиком по сравнению с усовершенствованной процедурой без этапа пересева перед стимуляцией.
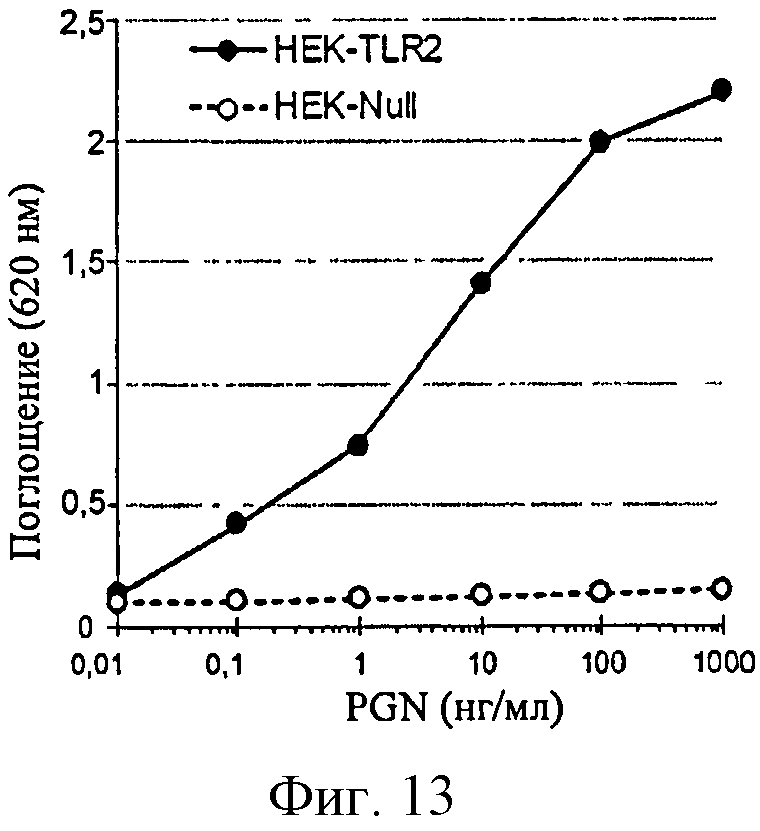
Фигура 13: Продуцирование SEAP в ответ на PGN в клетках HEK-TLR2 и НЕК-Null.
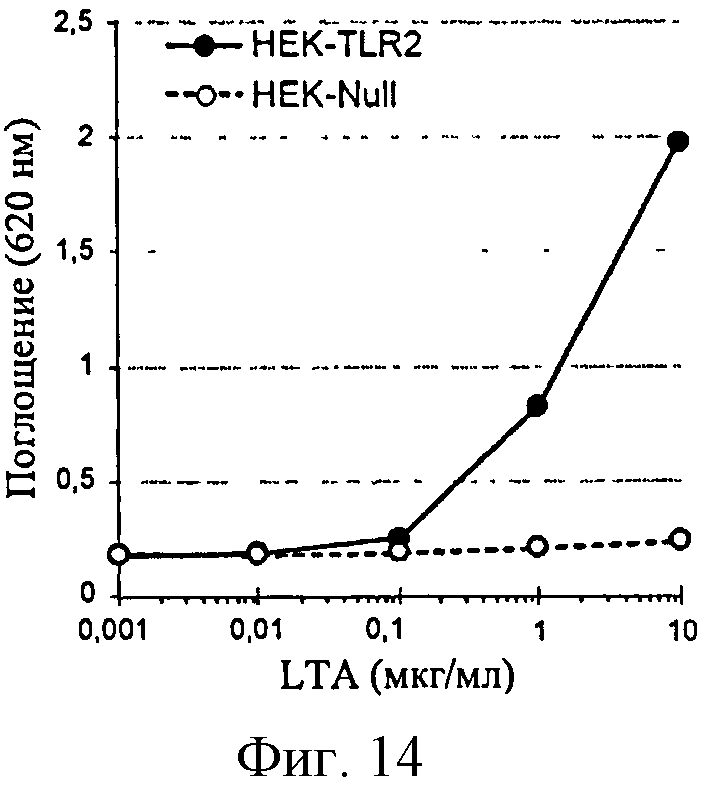
Фигура 14: Продуцирование SEAP в ответ на LTA в клетках HEK-TLR2 и НЕК-Null.
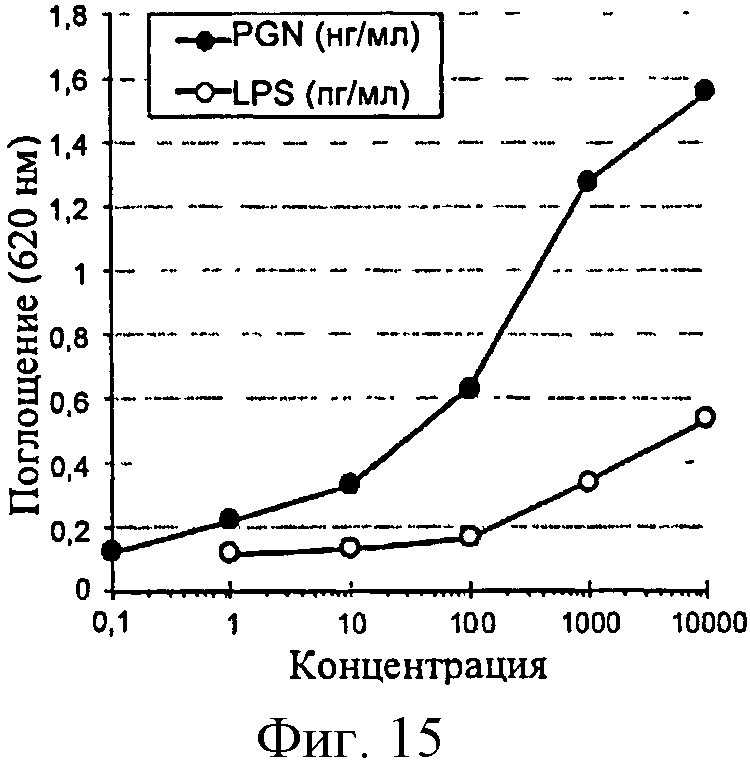
Фигура 15: Продуцирование SEAP в ответ на PGN и на LPS в клетках Raw-Blue.
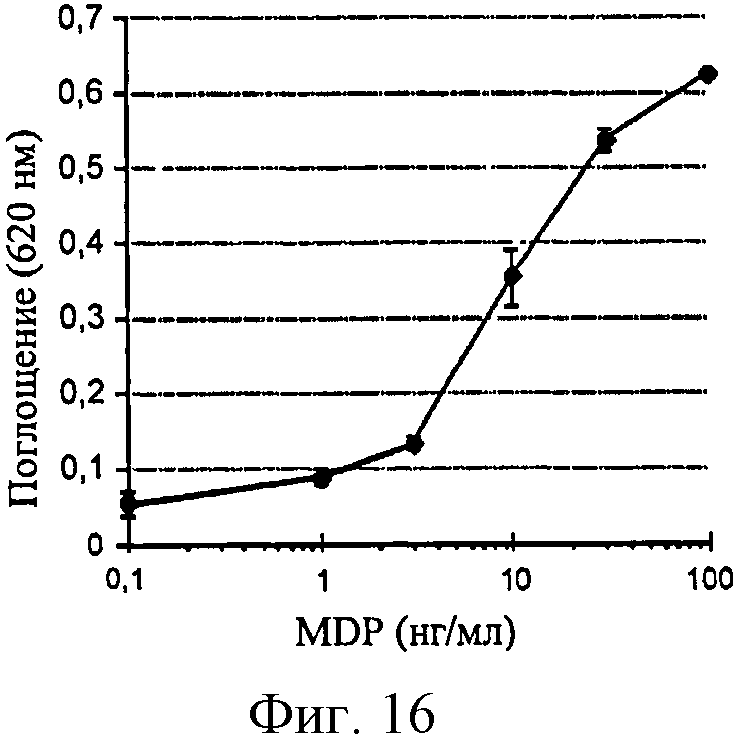
Фигура 16: Продуцирование SEAP в ответ на MDP в клетках HEK-NOD2.
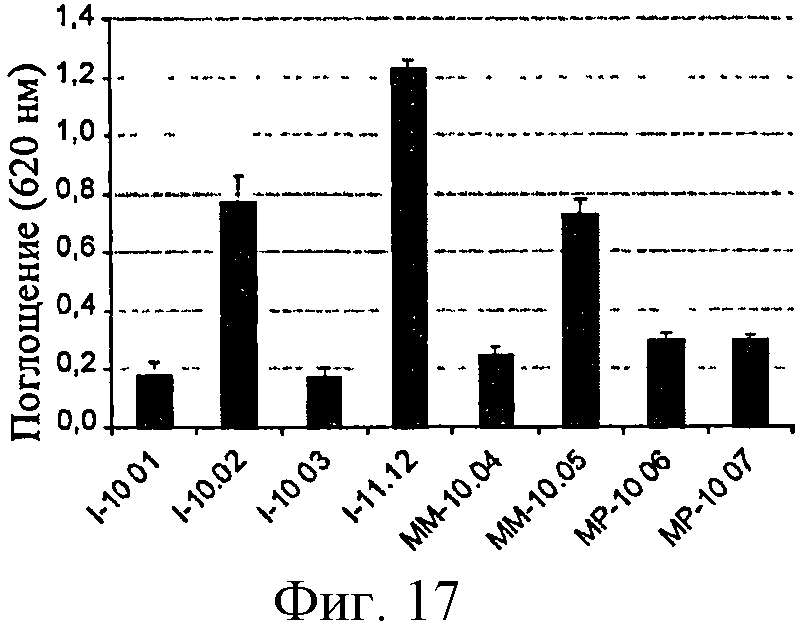
Фигура 17: Активность SEAP в клетках HEK-TLR2 в ответ на различные образцы полимера глюкозы.
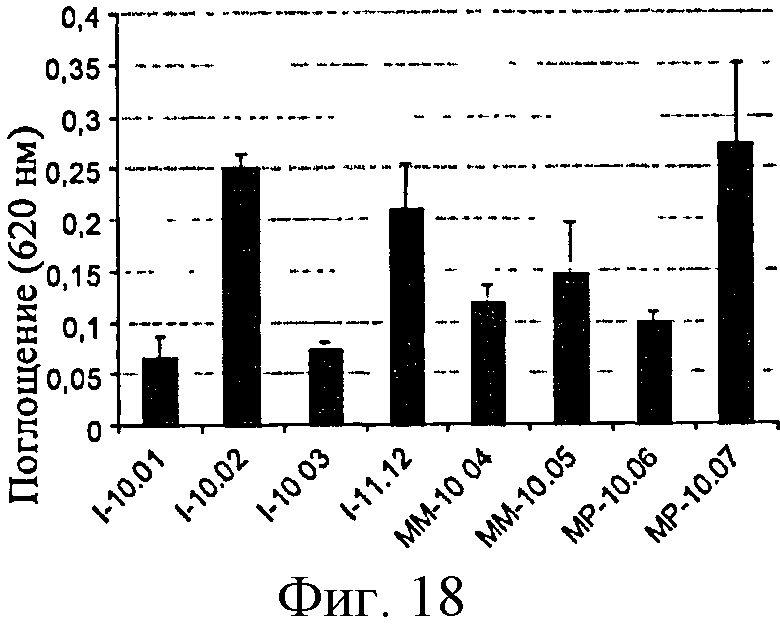
Фигура 18: Активность SEAP в клетках Raw-Blue в ответ на различные образцы полимера глюкозы.
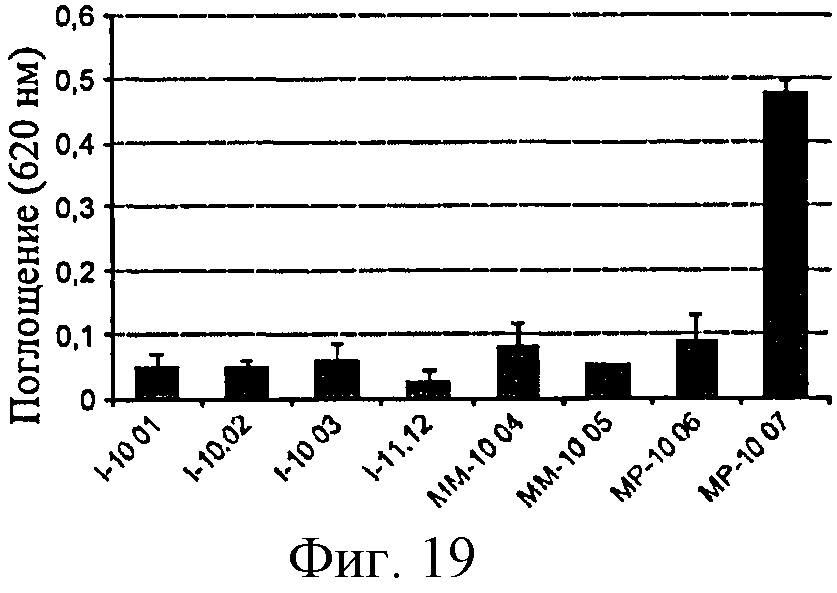
Фигура 19: Активность SEAP в клетках HEK-NOD2 в ответ на различные образцы полимера глюкозы.
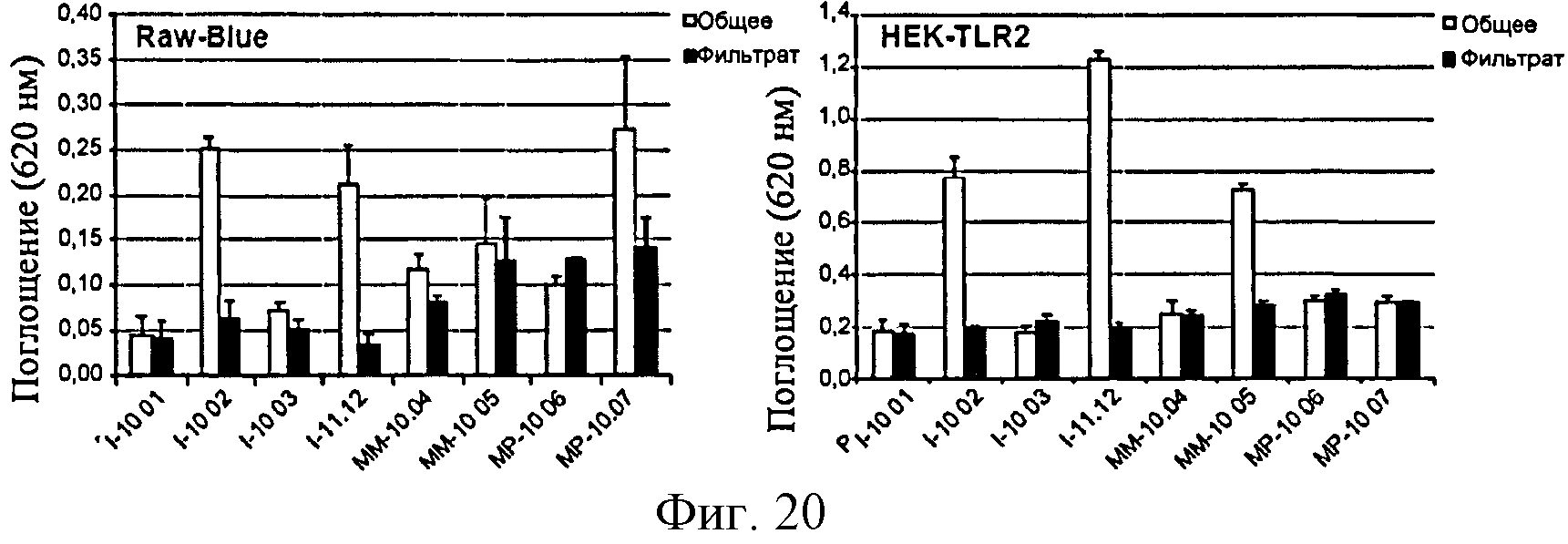
Фигура 20: Продуцирование SEAP в клетках Raw-Blue и HEK-TLR2 в ответ на различные образцы полимера глюкозы до (общий) и после ультрафильтрации при 30 кДа (фильтрат).
Фигура 21: Калибровочная кривая клеточного ответа в зависимости от уровня PGN из S. aureus. Фиг 21А, теоретическая кривая. Фиг 21В, кривая, полученная на клетках HEK-Blue™-hTLR2.
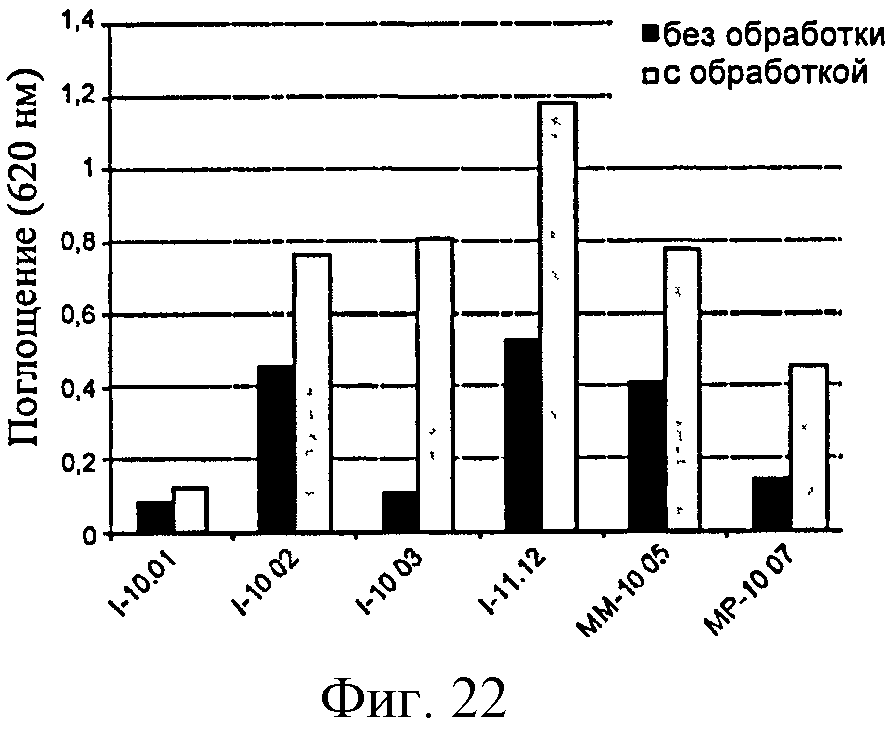
Фигура 22: Активность SEAP в клетках HEK-TLR2 в ответ на различные образцы полимера глюкозы до и после обработки мутанолизином.
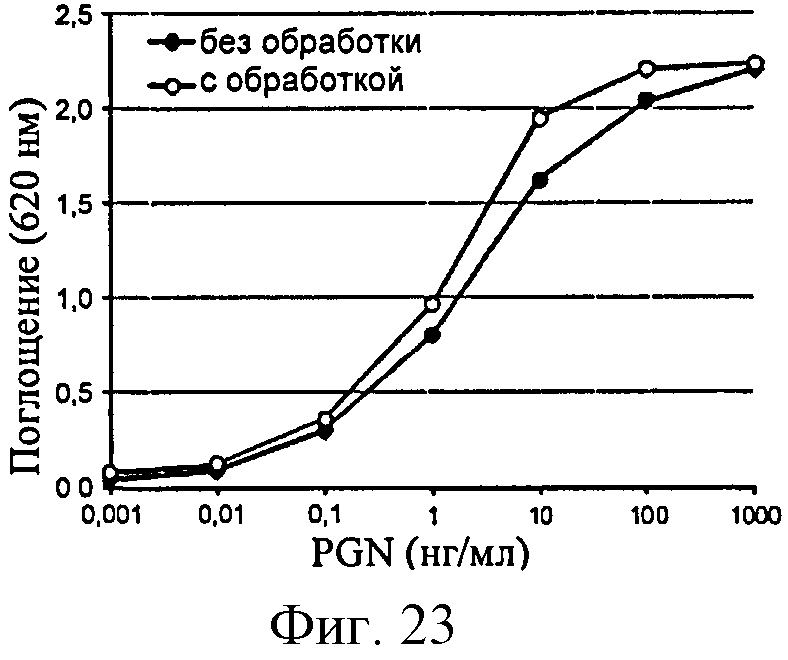
Фигура 23: Продуцирование SEAP клетками HEK-TLR2 в ответ на PGN до и после обработки мутанолизином.
Пример 1: Подготовка полимеров глюкозы для перитонеального диализа
Сырье для получения полимеров глюкозы согласно настоящему изобретению получают из крахмала восковидной кукурузы следующим образом:
- очистка кукурузы таким образом, чтобы сохранить исключительно цельные зерна кукурузы,
- замачивание очищенной таким образом кукурузы в присутствии молочной кислоты так, чтобы размягчить зерна,
- мокрый помол и затем разделение различных компонентов, т.е. зародыша, целлюлозной шелухи, белков и крахмала,
- очистка крахмала в режиме противотока очищенной водой, чтобы очистить крахмал как физико-химически, так и бактериологически,
- центрифугирование и высушивание крахмала,
- суспендирование крахмала в очищенной воде при конечном содержании сухого вещества 40% и при температуре от 45°C до 50°C,
- подкисление суспензии крахмала путем добавления HCl при pH <2 и повышение температуры от 115 до 120°C в течение от 6 до 8 минут,
- флоккуляция белков и жиров при данном pH,
- нейтрализация суспензии при pH 5,
- фильтрация суспензии через диатомовую землю (с тем, чтобы задержать остаточные белки, жиры и целлюлозу),
- деминерализация на сильной катионной смоле и слабой анионной смоле,
- обработка активированным углем при температуре 70-80°C и при pH от 4 до 4,5; при которой удаляют окрашенные примеси и снижают уровень микробиологических примесей.
Порошок активированного угля, который добавляют в концентрации от 0,2% до 0,5% на сухое вещество, удерживают на 10 мкм керамическом фильтре, заранее заполненном фильтрующим средством,
- концентрирование путем пропускания через испаритель с падающей пленкой,
- распылительная сушка концентрированного раствора в распылительной сушилке MSD, выпускаемой компанией Niro.
Данный гидролизат крахмала соответствует требованиям монографии Европейской Фармакопеи (ссылка Мальтодекстрины: 1542).
- pH: 4,0-7,0 для раствора при 10%,
- I.d.: соответствует,
- Потери при сушке: макс.6%,
- DE:<20
- Сульфатированная зола: макс.0,5%
- SO2: макс 20 ppm
- Тяжелые металлы: <10 ppm
- Е. coli: отсутствует/г
- Сальмонелла: отсутствует/10 г
- Общее содержание жизнеспособных микроорганизмов: макс. 100 KOE/г (ЕР 1000 KOE/г)
- Плесневые грибы: макс. 100 KOE/г
В дополнение к этому полученные партии анализируют на основе значений:
- загрязнение дрожжами + плесневыми грибами: макс. 150 KOE/10 г, т.е. макс. 15/г
- аэробные микроорганизмы: макс. 500 KOE/10 г, т.е. макс. 50/г
- эндотоксины (гель-тромб LAL-анализ конечных результатов): макс. 20 ЕЭ/г
- пептидогликаны: макс. 2700 нг/г
Условия получения полимеров глюкозы в соответствии с настоящим изобретением из гидролизата крахмала, полученного таким образом, следующие:
1) Водоподготовка/качество воды
- очистка воды путем фильтрации через 3 мкм, обработка на активированном угле, деминерализация на катионных и анионообменных смолах и повторная фильтрация (UA),
- применяют два резервуара:
- 10 м3 для растворения гидролизата крахмала и этапов промывки с распылительной сушкой и очистки,
- 60 м3 для основного способа (очистка резервуаров, его суспензии активированного угля и хроматография).
3) Хроматография
- солюбилизация гидролизата крахмала очищенной водой таким образом, чтобы достичь содержания сухого вещества 35-45% при температуре от 60 до 85°C,
- стерилизующую фильтрацию гидролизата крахмала путем пропускания его через 0,45 мкм и 0,22 мкм проводят при ΔP<3 бар,
- разделение эксклюзионной хроматографией (SEC) проводят с применением непрерывной системы, состоящей из шести серий двойных пластин, каждая из 1 м3 смолы. Применяют смолу PCR145K, выпускаемую компанией Purolite.
Раствор, который проходит через данную смолу, имеет температуру от 75 до 85°C при содержании сухого вещества 35-45%.
Продолжительность каждой последовательности определяет данный способ.
В данном случае продолжительность каждой последовательности составляет 15 минут.
Контроль осуществляют с помощью анализа молекулярно-массового распределения и анализа хроматографического выхода следующим образом: (количество сухого вещества желаемой фракции) / (количество сухого вещества сырья).
Самые низкие молекулярные массы взаимодействуют со смолой, а высокие молекулярные массы элюируют очищенной водой.
Концентрирование проводят путем испарения с падающей пленкой при содержании сухого вещества 35-45%.
Тепловую обработку проводят при температуре 120°C в течение 2 минут.
Активированный уголь добавляют от 0,5% до 1,5% от общего веса гидролизата крахмала при 75°C с катионными смолами (от 1 до 3 л) для регулирования pH (4-4,5) и анионными смолами (от 5 до 10 л) для регулирования pH (5,5-6).
Проводят фильтрацию через полипропиленовые пакетные фильтры с ΔP<5 бар от 5 до 6 часов на партию.
Проводят вторую и третью фильтрацию через 1,5 и 0,45 мкм, а затем через 0,22 и 0,1 мкм, и ультрафильтрацию через мембрану с порогом отсечения приблизительно 40000 Да.
Для распылительной сушки: сырье подают при 500 кг/ч в растворе с содержанием сухого вещества 40% и при 250°C в распылительную сушилку MSD, выпускаемую компанией Niro.
Высушенный распылением продукт имеет на выходе содержание влаги менее 6%.
Затем продукт охлаждают в псевдоожиженном воздушном слое, содержащем три зоны охлаждения, подаваемые с воздухом при 40, 30 и 20°C. Затем полученный продукт просеивают через 800 мкм для того, чтобы удалить агрегаты.
Приблизительно 500 кг конечного продукта получают из 800 кг исходных мальтодекстринов, т.е. выход составляет приблизительно 60%.
Определение возможного загрязнения линии проводят путем анализа содержания пептидогликанов и эндотоксинов в конечном продукте.
Например, содержание, обычно наблюдаемое и измеряемое в партиях конечного продукта (выраженное на г полимера глюкозы) составляет, для критериев, указанных выше, следующее:
- дрожжи и плесневые грибы: 0/г
- аэробные микроорганизмы: 0/г
- эндотоксины (гель-тромб LAL-анализ конечных результатов): ≤0,3 ЕЭ/г
- пептидогликаны: <3 нг/г
- В. acidocaldarius: 1/г
Пример 2: Применение "сенсибилизированной" клеточной линии ТНР-1 для обнаружения провоспалительных контаминантов
Материалы и методы
Клетки ТНР-1 (88081201, ЕСАСС) культивируют в лаборатории в установленном порядке.
Для экспериментов по провоспалительной активации клетки ТНР-1 дифференцируют в течение 3 дней в присутствии форболового эфира (РМА). В частности, клетки культивируют в 200 мкл полной среды в присутствии 20 нМ РМА в течение 72 ч (конечная плотность клеток: 0,75×106 клеток/мл).
Образцы полимера глюкозы получают согласно Примеру 1.
|
Стандартными молекулами для установления калибровочных диапазонов являются для:
- LAL-анализа: LPS из E. coli O55B5
- Стандартного анализа SLP:PGN из М. luteus - Wako
- Анализа SLP-HS:PGN из S. aureus - Wako.
Проанализированные значения PGN отличаются от одного теста Wako к другому из-за различий в реакционной способности и чувствительности этих тестов и, возможно, из-за их ограниченной и относительной специфичности (в частности, возможного ответа на β-глюканы).
Оптимизационные исследования проводят с растворами полимера глюкозы I-10.01 (Таблица 1), искусственно несущими стандартные воспалительные молекулы: PGN и MDP (источник: S. aureus), LPS (источник: Е. coif), f-MLP (синтетический пептид).
Раствором для разбавления стандартов является I-10-01 с<0,3 ЕЭ/г LPS (LAL-анализ), <20 нг/г PGN (стандартный анализ SLP) и <3 нг/г (анализ SLP-HS), применяемый в конечной концентрации 5 мг/мл.
Затем проводят анализ с первой серией образцов, соответствующих различным партиям, выбранным на основе уровней загрязнения примесями, измеренных с применением анализов LAL и SLP (PGN, LPS и β-глюканы).
Наборы ELISA для количественного анализа TNF-α и CCL5/RANTES приобретают у AbCys, стандартные агонисты (PGN, LPS, f-MLP и MDP) у Sigma Aldrich и InvivoGen.
Дифференцируемые клетки ТНР-1 (0,75×106 клеток/мл) культивируют в 200 мкл полной среды и затем инкубируют в присутствии различных исследуемых образцов.
Каждый анализ проводят в трех повторностях.
Клеточные супернатанты собирают для того, чтобы проанализировать секрецию цитокинов через 8 ч стимуляции для TNF-α, а через 20 ч для RANTES.
Анализы ELISA выполняют согласно указаниям, предоставленным поставщиком.
Результаты
Первые анализы заключались в анализе синергического потенциала MDP и f-MLP, а также комбинации PGN/LPS относительно продуцирования провоспалительных цитокинов дифференцируемыми клетками ТНР-1.
MDP анализировали в дозах 1, 10 и 100 мкг/мл. Минимальная доза не индуцировала существенного синергического эффекта. С другой стороны, дозы 10 и 100 мкг/мл имели сходную синергическую активность относительно продуцирования RANTES и TNF-α в ответ на PGN и LPS.
Результаты, представленные в фигурах 1 и 2, четко демонстрируют синергический эффект MDP на продуцирование RANTES. С другой стороны, этот синергический эффект не очень выражен для TNF-α. Кроме того, порог обнаружения (количество PGN или LPS, вызывающее ответ, больший, чем три SD фонового шума) для RANTES является более низким (см. таблицу 2).
f-MLP применяли в дозах 1 нМ, 10 нМ и 100 нМ. Однако никакого синергического эффекта на клетках ТНР-1 не наблюдалось (фигура 3).
синергический эффект LPS проанализировали путем добавления субоптимальной дозы (25 пг/мл) к возрастающим дозам PGN (фигура 4). Синергический эффект этих двух агонистов выявляют после количественного анализа двух цитокинов. Однако индуцированный LPS синергический эффект на продуцирование RANTES остается меньшим, чем эффект, индуцированный MDP.
Ответ количественно определили путем измерения производства RANTES и TNF-α. Во всех случаях синергизм четко выявляли для анализа RANTES с высокой чувствительностью. Данный анализ, таким образом, будет предпочтительным и сохранится в остальных экспериментах.
Данные результаты демонстрируют, что добавление MDP в концентрации 10 мкг/мл к клеткам ТНР-1, в свою очередь, с количественным анализом RANTES, является наиболее эффективным способом сенсибилизации для обнаружения низких уровней PGN и LPS. Теоретически, данные пороги обнаружения должны позволить обнаружить контаминанты, присутствующие в промышленной продукции.
Эти первые анализы провели путем разбавления стандартных воспалительных молекул в присутствии полимера I-10.01. Растворы добавили к клеткам ТНР-1 таким образом, чтобы получить конечную концентрацию полимера глюкозы 5 мг/мл и конечную плотность клеток 0,75×106 клеток/мл. Для того чтобы увеличить чувствительность анализа, испытания провели с изменением этих двух параметров.
Присутствие полимера глюкозы не препятствует продуцированию RANTES при концентрациях менее или равных 25 мг/мл. Это увеличение чувствительности не связано с провоспалительным эффектом полимера на клетки, поскольку данный ответ идентичен фоновому шуму при отсутствии PGN (фигура 5).
С другой стороны, увеличение плотности клеток свыше 0,75×106/мл снижает продуцирование RANTES в ответ на PGN (истощение культуральной среды или модификация клеток) (фигура 6).
Анализы чувствительности с MDP в концентрации 10 мкг/мл воспроизвели три раза для LPS и шесть раз для PGN с клетками ТНР-1, происходящими из различных препаратов. Полученные данные позволили определить пороги обнаружения и ЕС50 (таблица 2). Для оценки чувствительности значения приведены на г полимера с рассматриваемой концентрацией 25 мг/мл.
Синергический эффект, индуцированный MDP, идентичен для LPS и PGN, поскольку он позволяет увеличить чувствительность клеток ТНР-1 в 5 раз в обоих случаях.
|
Эти исследования показывают, что сенсибилизированные клетки ТНР-1 могут быть использованы для разработки чувствительного анализа воспалительного ответа для обнаружения следовых количеств контаминантов в препаратах полимера глюкозы.
Выбраны следующие экспериментальные условия:
- конечная концентрация дифференцируемых клеток ТНР-1: 0,75×106 клеток/мл,
- сенсибилизирующее средство: MDP (S. aureus) в концентрации 10 мкг/мл,
- конечная концентрация полимера глюкозы: 25 мг/мл,
- ответ: анализ ELISA продуцирования RANTES через 20 ч стимуляции.
Для проверки настоящего способа анализы на MDP-сенсибилизированных клетках ТНР-1 выполнили с образцами, представленными в таблице 1.
Анализ, основанный на продуцировании RANTES сенсибилизированными клетками ТНР-1, позволил обнаружить образцы полимеров, загрязненных LPS: полимеры, обозначенные I-11.12, МР-10.07 и, в меньшей степени, ММ-10.04 и ММ-10.05 (фигура 7).
С другой стороны, образцы, загрязненные только PGN (например, I10-02) не дают ответ, указывая тем самым на то, что данный клеточный анализ является более подходящим для обнаружения эндотоксинов. Однако амплитуда ответов не является прямо пропорциональной уровню LPS, измеренному с помощью LAL-анализа (см., например, ответы, полученные с I-11.12 по сравнению с ММ-10.05), тем самым свидетельствуя о том, что другие контаминанты помимо PGN возможно действуют с LPS на ответ клеток ТНР-1.
Клетки ТНР-1 отвечали на растворы контрольного PGN, но слабо или совсем не отвечали на образцы, происходящие из партий, загрязненных только природным PGN.
Размер PGN является очень гетерогенным, и некоторые из этих молекул могут достигать внушительной массы (>106 Да). Последние имеют низкую растворимость, что влияет на их провоспалительную мощность, но способствует их удалению фильтрацией. С другой стороны, PGN, которые являются растворимыми и, соответственно, активными, имеют среднюю массу 120 кДа и не удаляются фильтрацией. Таким образом, можно предположить, что эти два анализа SLP Wako способны к общему количественному анализу всех PGN, тогда как клеточный анализ обнаруживает только активные PGN.
Пример 3: Применение клеточных линий HEK-Blue™ (hTLR2, hNOD2, Null2) и Raw-Blue™ (InvivoGen) для обнаружения контаминантов
Материалы и методы
Клеточные линии HEK-Blue™ (InvivoGen) являются линиями, модифицированными стабильной трансфекцией векторами, кодирующими рецепторы врожденного иммунитета. Эти клетки также одновременно трансфицированы репортерным геном, который продуцирует секретируемую форму щелочной фосфатазы (SEAP: секретируемая эмбриональная щелочная фосфатаза), синтез которой находится под непосредственным контролем сигнального пути, связанного с рецептором(и), экспрессируемым в той же клеточной линии.
Для экспериментов, связанных с обнаружением воспалительных контаминантов, применяют четыре линии:
- линия HEK-Blue™ hTLR2 (HEK-TLR2): эта линия специфически реагирует на агонисты TLR2 (в частности, PGN и большинство гликолипидов и липопептидов),
- линия HEK-Blue™ hNOD2 (HEK-NOD2): эта линия специфически реагирует на MDP и родственные молекулы, такие как мономеры PGN,
- линия HEK-Blue™ Null2 (HEK-Null): это контрольная линия, применение которой необходимо для того, чтобы проверить, что растворы полимера глюкозы не индуцируют производство фермента через внутренний механизм,
- линия Raw-Blue™: это линия макрофагов мыши, трансфицированная SEAP. Эту линию, которая естественным образом экспрессирует практически все рецепторы врожденного иммунитета, применяют в качестве положительного контроля в анализах.
Клетки Raw-Blue™ и HEK-Blue™ культивируют согласно рекомендациям поставщика. В частности, давление отбора для плазмид, кодирующих рецепторы воспалительных молекул (TLR2 или NOD2) и кодирующих SEAP, обеспечивают добавлением к культуральной среде антибиотиков HEK-Blue Selection/бластицидин. При 75% слиянии клетки ресуспендируют при плотности клеток 0,28×106 клеток/мл. Перед стимуляцией 180 мкл клеточной суспензии распределяют в лунки для культивирования (96-луночный планшет), т.е. 50000 клеток/лунку. Затем клетки стимулируют в течение 24 ч путем добавления 20 мкл анализируемых образцов (в десять раз концентрированной форме). Стимуляция длится от 16 до 24 ч.
Продуцирование SEAP в ответ на загрязненные молекулы оценивают путем измерения активности фосфатазы согласно протоколу, поставляемому изготовителем: 20 мкл культурального супернатанта разбавляют в 180 мкл Quanti-blue. Окрашивание развивается при 37°C и считывание выполняют в различные моменты времени при 620 нм. Результаты выражают в виде поглощения после вычитания фонового шума, полученного добавлением такого же объема некондиционированной культуральной среды в реакционную среду фермента.
Оптимизацию исследований выполняют с растворами полимера глюкозы I-10.01 (таблица 1), искусственно несущими стандартные воспалительные молекулы: PGN, LTA и MDP (источник: S. aureus) и LPS (источник: E. coli). Затем проводят анализ на сериях образцов, соответствующих различным партиям, выбранным на основе уровней загрязнения PGN и LPS (таблица 1).
Результаты
Клетки HEK-Blue получают в виде замороженных флаконов. Перед началом анализов воспалительного ответа необходимо быть уверенным в возобновлении роста клеток и в их способности отвечать на воспалительные молекулы. Кроме того, эти трансфицированные клетки быстро вырождаются после нескольких пассажей, что может привести к потере векторов экспрессии для рецепторов врожденного иммунитета или даже вектора, кодирующего SEAP.
Таким образом, рекомендуется проверить способность этих клеток отвечать на воспалительные факторы в начале культивирования и затем через несколько этапов пересева. Эти анализы проводят с PGN для HEK-TLR2, MDP для HEK-NOD2 и TNF-α, последний является мощным активатором пути NF-κВ. Фактически, клетки НЕК естественным образом обладают рецептором к этому цитокину и, таким образом, будут производить SEAP (вектор экспрессии которого находится под контролем пути NF-κВ) в ответ на TNF-α.
Результаты, представленные в фигуре 8, показывают анализы, проведенные для того, чтобы проверить возобновление роста трех линий. Как ожидалось, клетки НЕК-TLR2 и HEK-Null отвечают на TNF-α эквивалентным продуцированием SEAP. Кроме того, линия HEK-Null является нечувствительной к PGN и к MDP, тогда как клетки НЕК-TLR2 эффективно отвечают только на PGN. Эти две линии, таким образом, приобрели свои фенотипические характеристики, и их можно будет применить для остальной части экспериментов. В этом примере линия HEK-NOD2 очень слабо отвечает на TNF-α и на MDP, указывая таким образом, что она не приобрела ожидаемых характеристик.
Ответ клеток HEK-Blue и Raw-Blue на провоспалительные молекулы напрямую связан с продуцированием SEAP. Поставщик рекомендует добавить 20 мкл культурального супернатанта к 180 мкл субстрата SEAP. Эксперименты, таким образом, проводят в данных условиях и затем оптимизируют, увеличивая объем культурального супернатанта и, таким образом, количество фермента в растворе (фигура 9).
Результаты показывают, что соотношение 50/150 дает более высокий ответ, чем соотношение, рекомендованное поставщиком. С другой стороны, соотношение 100/100 не является более эффективным, возможно, из-за нехватки субстрата SEAP в реакционной среде.
Интенсивность окрашивания (620 нм) пропорциональна количеству SEAP, секретированному клетками, а также времени гидролиза субстрата ферментом. Различные моменты времени для визуализации были таким образом испытаны с применением тех же супернатантов PGN-активированных клеток HEK-TLR2 и Raw-Blue (фигура 10).
Оптимальное окрашивание достигается, начиная с 60 мин. реакции между SEAP и ее субстратом для клеток HEK-TLR2. Небольшое увеличение также наблюдается через 90 мин. для клеток Raw-Blue, но данное увеличение возможно связано с тем, что эти клетки производят меньше SEAP.
Эффект концентрации полимера глюкозы на ответы клеток проанализировали путем стимулирования клеток HEK-TLR2 и Raw-Blue стандартным PGN, разбавленным в среде с добавлением полимера I-10.01. Затем растворы добавляли к клеткам таким образом, чтобы получить конечные концентрации полимера в диапазоне от 5 до 50 мг/мл (фигура 11).
Концентрации до 37,5 мг/мл существенно не изменяют амплитуду ответа на PGN у линии HEK-TLR2. Улучшение ответа на низкие концентрации PGN, отмечаемое для концентраций полимера выше 25 мг/мл, возможно связано с лучшей дисперсией контаминанта. Что касается клеток Raw-Blue, продуцирование SEAP не изменяется вне зависимости от концентрации полимера глюкозы.
Линия HEK-NOD2 показывает низкую амплитуду ответа на MDP и даже на TNF-α, что, по всей видимости, связано с высоким фоновым шумом. В этих клетках ген SEAP находится под контролем слабого промотора, который более чувствителен к клеточному стрессу, чем использованный в других клетках HEK-Blue. Для того чтобы снизить фоновый шум и увеличить амплитуду ответа на контаминанты, условия культивирования модифицируют таким образом, чтобы снизить стресс клеток.
Согласно рекомендациям поставщика клетки при 75% слиянии ресуспендируют при плотности 0,28×106 клеток/мл и затем 180 мкл клеточной суспензии распределяют в лунки для культивирования (96-луночный планшет), т.е. 50000 клеток/лунку, перед стимуляцией в течение дня.
В новой процедуре, указанной, как процедура без пересева, клетки HEK-NOD2 обрабатывают в лунках (10000/лунку) и культивируют в течение трех дней. Перед стимуляцией культуральную среду удаляют и заменяют средой, содержащей 1% FCS и растворы для анализа. В данном случае ответ SEAP в 5-6 раз больше, чем отрицательный контроль, что соответствует анализу для обнаружения MDP в загрязненных растворах (фигура 12).
Эти первые исследования показывают, что клетки HEK-Blue и Raw-Blue могут быть использованы для разработки чувствительных анализов воспалительного ответа для обнаружения следовых количеств контаминантов в препаратах полимера глюкозы.
Выбрали следующие экспериментальные условия:
- конечная концентрация полимера глюкозы: 37,5 мг/мл для клеток HEK-Blue и 50 мг/мл для клеток Raw-Blue,
- ферментативная реакция: 50 мкл кондиционированной среды+150 мкл реагента SEAP,
- минимальное время реакции: 60 мин.
На фигурах 13-16 показаны примеры анализов активности SEAP, произведенной клетками HEK-TLR2 и Raw-Blue в ответ на различные воспалительные молекулы.
Клетки HEK-TLR2 очень эффективно отвечают на PGN, тогда как ответ на LTA слабее. Эти ответы, однако, более эффективны, чем наблюдаемые на клетках типа моноциты/макрофаги. Кроме того, полимер глюкозы не имеет непосредственного влияния на продуцирование SEAP, поскольку не наблюдается ответа в супернатантах клеток НЕК-Null.
Клетки Raw-Blue хорошо отвечали на PGN, но менее чувствительны, чем клетки HEK-TLR2. Ответ на LPS является слабым и остается намного более низким, чем наблюдаемый при измерении продуцирования RANTES клетками ТНР-1.
В отличие от других клеточных линий клетки HEK-NOD2 эффективно отвечали на MDP, что может быть использовано для обнаружения продуктов деградации PGN.
Эксперименты со стандартными PGN, LPS и MDP были воспроизведены на различных клеточных препаратах, которые позволили определить характеристики, представленные в таблице 3. Для оценки чувствительности значения представлены на г полимера с рассматриваемой концентрацией 37,5 мг/мл для клеток HEK-Blue и 50 мг/мл для клеток Raw-Blue.
|
Линии HEK-TLR2 и Raw-Blue являются очень эффективными для обнаружения PGN в низких концентрациях. В частности, линия HEK-TLR2 обнаруживает уровни PGN ниже 2 нг/г полимера глюкозы, т.е. порог чувствительности в 50 раз выше, чем полученный на сенсибилизированных клетках ТНР-1. Линия Raw-Blue эффективно обнаруживает небольшие следовые количества PGN, но не слишком реакционно-способна по отношению к LPS с порогом обнаружения приблизительно в 50 раз выше, чем для сенсибилизированных клеток ТНР-1.
Для того чтобы проверить данные анализы, провели анализы с образцами полимера глюкозы.
Линия HEK-TLR2 позволяет обнаружить загрязнения в партиях I-10.02, I-11.12 и ММ-10.05, и, в меньшей степени, в партиях МР-10.06 и МР-10.07 (ответ, наблюдаемый с ММ-10.04, является незначительным по сравнению с I-10.01 и поэтому не сохранен).
С другой стороны, образец I-10.03 не обнаружен, что может быть связано с очень низким уровнем PGN, близким к пределу обнаружения при анализе SLP-Wako (фигура 17).
Хотя положительные ответы, полученные с I-10.02, I-11.12, ММ-10.05 и МР-10.07, были ожидаемыми, учитывая высокий уровень PGN, присутствующий в этих четырех образцах, следует отметить, что нет пропорциональности между концентрацией, полученной в анализе SLP, и ответом клеток.
Фактически, полимеры глюкозы I-10.02 и I-11.12 дают самые высокие ответы, в то время как уровни PGN составляют менее 1 мкг/г. С другой стороны, образец МР-10.07, который имеет самую высокую нагрузку PGN, дает ответ, близкий к фоновому шуму. PGN представляют собой макромолекулы с очень разнообразной массой, и было показано, что их реакционная способность обратно пропорциональна молекулярной массе. Таким образом, можно предположить, что PGN из I-10.02 и I-11.12 меньше по размеру, чем PGN, присутствующие в образцах ММ-10.05 и MP-10.07, что может объяснить их более высокий провоспалительный потенциал.
Удивительно также видеть ответ с партией MP 10-06 при том, что она не содержит PGN. Однако клетки HEK-TLR2 реагируют с другими воспалительными молекулами, такими как липопептиды, LTA или LAM (липоарабиноманнаны), все из которых являются агонистами TLR2. Таким образом, данный результат свидетельствует о том, что этот образец, который является незагрязненным исходя из отсутствия LPS и PGN, содержит другие провоспалительные молекулы, являющиеся агонистами TLR2.
За исключением образцов I-10.01 и I-10.03 все образцы дают положительный ответ с клетками Raw-Blue (фигура 18).
Уровень LPS, присутствующий в образце I-10.02, близок к порогу обнаружения LAL-анализа, указывая на то, что наблюдаемый ответ обусловлен присутствием PGN. Этот результат подтверждает, что в отличие от клеток ТНР-1, которые не отвечают на этот образец, клетки Raw-Blue являются эффективными для обнаружения небольших загрязнений PGN. Сильный ответ партий I-11.12, ММ-10.05 и МР-10.07, таким образом, по-видимому обусловлен присутствием двух контаминантов (PGN и LPS).
Подобно клеткам HEK-TLR2 клетки Raw-Blue положительно отвечали на МР-10.06, что подтверждает присутствие контаминанта помимо LPS и PGN в этом образце.
Наконец, клетки HEK-NOD2 сильно реагируют в присутствии МР-10.07 и дают слабый, но существенный ответ с образцами I-10.03, ММ-10.04 и МР-10.06, что указывает на то, что эти образцы были загрязнены PGN во время этапа их производства, и что последние были частично деградированы в ходе производства продукта (фигура 19).
Клетки HEK-TLR2 и Raw-Blue являются эффективными для обнаружения следовых количеств воспалительных контаминантов в продуктах типа I-10.01 и I-10.03.
Они даже обладают характеристиками, дополнительными к таковым у сенсибилизированных клеток ТНР-1. Фактически, анализы с применением трех из них позволяют обнаружить большинство воспалительных контаминантов, которые могут присутствовать в образцах полимера глюкозы.
- ТНР-1: любой воспалительный контаминант с высокой реакционной способностью в отношении LPS.
- Raw-Blue: любой воспалительный контаминант с высокой реакционной способностью в отношении PGN.
- HEK-TLR2: специфические для агонистов TLR2 с высокой реакционной способностью в отношении PGN.
- HEK-NOD2: специфические для MDP и, соответственно, для продуктов деградации PGN. Как и в случае клеток ТНР-1, также отмечено отсутствие пропорциональности между уровнями PGN и/или LPS и амплитудами клеточных ответов.
Данная проблема, несомненно, связана с размером этих макромолекул и/или их присутствием в виде агрегатов, что влияет на их реакционную способность по отношению к клеткам. Таким образом, было обнаружено, что прохождение стандартного PGN через 0,22 мкм фильтр снижает приблизительно на 50% его реакционную способность на клетках HEK-TLR2. Следовательно, во всех испытаниях растворы полимера глюкозы подготавливают в асептических условиях, но без этапа фильтрации стандартных молекул.
Пример 4: Исследование контаминантов с помощью сенсибилизированных клеточных линий ТНР-1, HEK-Blue™ (hTLR2, hNOD2) и Raw-Blue™
Примеры 2 и 3 показывают, что сенсибилизированные линии ТНР-1, HEK-TLR2, HEK-NOD2 и Raw-Blue являются эффективными для обнаружения следовых количеств воспалительных контаминантов в образцах полимера глюкозы. В дополнение к LPS и MDP, присутствие которых обнаруживают посредством рецепторов TLR4 и NOD2, другие контаминанты, которые могут присутствовать в образцах, являются преимущественно лигандами TLR2 (PGN, LTA и липопептиды). Следовательно, линии не позволяют установить вклад PGN в ТЕР2-специфический ответ. Однако PGN являются макромолекулами, масса которых находится в диапазоне от ~100 кДа до нескольких миллионов Да. С другой стороны, LTA и липопептиды имеют низкую массу, менее 15 кДа. Таким образом, введение этапа ультрафильтрации (30 кДа) должно позволить задержать PGN и измерить ответ только на лиганды TLR2 малых размеров.
Экспериментальные процедуры
Для экспериментов, относящихся к данному примеру, применяют пять линий клеток, представленных в примерах 2 и 3:
- линия моноцитов ТНР-1: ответ на любой воспалительный контаминант с высокой реакционной способностью в отношении LPS,
- линия Raw-Blue™: ответ на любой воспалительный контаминант с высокой реакционной способностью в отношении PGN,
- линия HEK-Blue™ hTLR2: специфическая для агонистов TLR2 с высокой реакционной способностью в отношении PGN,
- линия HEK-Blue™ hNOD2: специфическая для продуктов полной деполимеризации PGN (MDP),
- линия HEK-Blue™ Null: контроль отрицательного ответа.
Образцы полимера глюкозы представлены в примере 2 (таблица 1). Эти образцы подготавливают в растворе в концентрациях, описанных в примерах 2 и 3. Клеточные ответы (продуцирование RANTES для клеток ТНР-1 и секреция SEAP для клеток Blue™) анализируют либо с нефильтрованными образцами: Общий ответ, либо с фильтратами, полученными ультрафильтрацией на микроконцентраторе с порогом отсечения 30 кДа (Sartorius): Ответ фильтрата.
Перед применением микроконцентраторы обработали солевым раствором (150 мМ NaCl), подготовленным на апирогенной воде. Ретентаты и фильтраты испытали с клеточными линиями, и только фильтры с отрицательным ответом в каждом испытании, сохранили для анализов с образцами полимера глюкозы.
Результаты
Результаты, представленные на фигуре 20, показывают ответы клеток HEK-TLR2 и Raw-Blue, полученные в присутствии различных образцов до и после ультрафильтрации.
Общие ответы аналогичны тем, которые наблюдали в примере 3 (фигуры 17 и 18).
Ответы фильтратов существенно снижены для образцов I-10.02 и I-11.12 на двух типах клеток со значениями, близкими к или равными порогам обнаружения. Эти данные подтверждают, что эти два образца загрязнены PGN, который был задержан фильтром.
Ответ фильтрата ММ-10.05 снижен на клетках HEK-TLR2, но не на клетках Raw-Blue, указывая на то, что этот образец загрязнен комбинацией нескольких молекул, со значительной частью, представленной PGN.
Образцы ММ-10.04, МР-10.06 и МР-10.07 незначительно загрязнены PGN, поскольку общий ответ и ответ фильтрата в клетках HEK-TLR2 идентичны. С другой стороны, 50% снижение ответа фильтрата можно отметить для МР-10.07 на клетках Raw-Blue. LAL-анализ показал, что этот образец несет LPS. Хотя масса эндотоксинов составляет менее 30 кДа, эти молекулы способны образовывать агрегаты, что может быть причиной потери ответа после фильтрации.
Общий ответ и ответ фильтрата проанализированы на ТНР-1, Raw-Blue, НЕК-TLR2 и HEK-NOD2 типах клеток. Результаты приведены в таблице 4.
Для клеток HEK-NOD2 общий ответ и ответ фильтрата идентичны, что ожидаемо, поскольку MDP и родственные молекулы имеют массу намного меньше 30 кДа (Mw~500 Да). В таблице 4 приведен только общий ответ.
|
Эти данные позволяют охарактеризовать типы контаминантов, присутствующие в каждом растворе полимера глюкозы, и установить их вклад в воспалительный ответ:
I-10.01: образец не загрязнен.
I-10.02: образец сильно загрязнен PGN. Отсутствие ответа клеток ТНР-1 и НЕК-NOD2 и фильтратов указывает на то, что вклад других контаминантов несущественен.
I-10.03: образец слабо загрязнен остатками, вероятно, происходящими из продуктов деградации малого размера. Фактически, общий ответ и ответ фильтрата находятся на пределе фонового шума во всех испытаниях.
I-11.12: образец сильно загрязнен PGN. Слабый ответ клеток ТНР-1 также указывает на следовые количества LPS.
ММ-10.04: образец слабо загрязнен LPS и TLR2-активирующими молекулами малого размера (LTA, липопептиды). Присутствие MDP также указывает на продукты деградации PGN.
ММ-10.05: образец загрязнен PGN и другими молекулами малых размеров. Слабые ответы в других испытаниях свидетельствуют о присутствии следовых количеств LPS и других лигандов TLR2.
МР-10.06: образец загрязнен многочисленными малыми молекулами. С другой стороны, слабые ответы ТНР-1 и HEK-TLR2 указывают на отсутствие PGN и LPS.
МР-10.07: образец загрязнен многочисленными малыми молекулами с высокой долей LPS и MDP.
Следует отметить, что результаты соответствуют анализам Wako SLP-HS для образцов I-10.01, I-10.02, I-10.03 и I-11.12, которые являются конечными продуктами, и образцов ММ-10.04 и МР-10.06, которые были идентифицированы как не содержащие PGN.
С другой стороны, два образца ММ-10.05 и МР-10.07 дали ответы PGN более слабые, чем ожидалось по результатам анализов SLP. Однако возможно, что эти образцы дали ложно-положительный результат в анализах SLP из-за перекрестной реакции с β-глюканами, например. Другая возможность состоит в том, что эти образцы содержат очень крупные PGN, низкая растворимость которых предотвращает инициацию ответа в испытаниях на клетках.
Пример 5: Способ анализа пептидогликанов
Этот анализ основан на специфическом распознавании PGN линией, экспрессирующей рецептор TLR2, и на продуцировании ферментативной активности, измеряемой путем активации сигнального пути, связанного с TLR2.
Экспериментальные процедуры
Для экспериментов, относящихся к данному анализу, применяют две линии:
- линия HEK-Blue™ hTLR2;
- линия HEK-Blue™ Null2.
Эти две линии представлены в примере 3.
Построение кривой доза-ответ
Кривая доза-ответ была получена со стандартным PGN из S. aureus (фигура 21).
Клетки HEK-Blue™ инкубируют с возрастающими концентрациями стандарта и измеряют клеточный ответ путем количественной оценки полученной ферментативной активности.
Результатом является обычная сигмовидная кривая клеточного ответа:
- часть (А) соответствует ответам, полученным с низкими концентрациями PGN, ниже тех, которые дают эффективную активацию TLR2. Эта нелинейная зона, таким образом, соответствует пороговому пределу обнаружения настоящего способа. Для того, чтобы таким образом включить вариабельность способа, этот порог обнаружения оценивают по значению фонового шума в три момента времени (ответ, полученный при отсутствии стимула);
- часть (В) является наиболее интересной, поскольку наблюдается линейный ответ. Эта зона эффективного ответа позволяет определить прямую взаимосвязь между клеточным ответом и уровнем PGN. Она, таким образом, является зоной количественного анализа;
- часть (С) соответствует насыщению клеточного ответа в присутствии концентраций PGN, которые являются слишком высокими. Это фактически насыщение рецепторов TLR2.
Стандартная кривая для ответа клеток HEK-TLR2 на PGN демонстрирует зону линейности для концентраций от 0,07 до 10 нг/мл (т.е. от 2 до 267 нг/г).
В случае образцов, которые могут быть сильно загрязнены PGN, будет необходимо выполнить несколько последовательных разбавлений таким образом, чтобы всегда они находились в зоне линейности. И наоборот, низкие концентрации PGN требуют этапа концентрирования образца, если желательно повысить чувствительность анализа.
Подготовка образцов
Анализы PGN проводят на растворах полимера глюкозы. Образец, требующий количественной оценки PGN, инкубируют с клетками HEK-Blue™ hTLR2 и измеряют клеточный ответ путем количественного определения произведенной ферментативной активности. Количество PGN, содержащегося в образце, можно определить при, обращении к кривым доза-ответ.
Первые испытания были проведены с загрязненными образцами, происходящими из промышленных партий полимера глюкозы (пример 3, фигура 15).
Клетки HEK-TLR2 позволяют обнаружить присутствие PGN в большинстве образцов. С другой стороны, наблюдалось отсутствие корреляции между уровнями PGN, измеренными способом SLP-Wako, и амплитудами клеточных ответов на PGN. Фактически, образцы с самой высокой нагрузкой PGN не являются теми, которые индуцируют самое сильное продуцирование SEAP.
В качестве иллюстрации образец МР-10.07, который является одним из наиболее нагруженных PGN (645 нг/мг), не дает заметного клеточного ответа на клетках НЕК-TLR2. С другой стороны, образцы I-10.02 и I-11.12 являются наименее загрязненными (253 и 393 нг/г, соответственно), но наиболее реакционно-способными исходя из клеточного ответа.
PGN имеют очень гетерогенные размеры. Тяжелые формы (>106 Да) имеют низкую растворимость и, таким образом, не очень реакционно-способны в испытаниях на клетках. С другой стороны, они количественно определяются в анализе SLP-Wako. PGN промежуточного размера (~100 кДа) хорошо растворимы и являются мощными индукторами TLR2. Несмотря на низкие уровни, они способны стимулировать сильный воспалительный ответ. Эта дисперсия размера и, таким образом, дисперсия активности, является главным недостатком для связи уровня загрязнения с риском развития воспалительного ответа при использовании обычных количественных анализов (LAL и SLP-Wako).
PGN, присутствующие в образцах I-10.02 и I-11.12, являются растворимыми и, таким образом, очень реакционно-способными. И наоборот, образец МР-10.07, вероятно, содержит PGN большого размера, которые будут удалены в процессе получения конечного продукта.
На основе этих первых результатов способ анализа PGN, основанный на применении клеток HEK-TLR2, позволит количественно определить биологически активные PGN, способные вызывать воспалительные реакции in vivo.
Особенно преимущественной процедурой для количественного анализа PGN, способных к инициации воспалительного ответа, является снижение их размера и, таким образом, повышение их растворимости для анализа клеточного ответа in vitro.
Мутанолизин представляет собой фермент, который благодаря своей мурамидазной активности способен к деполимеризации PGN. Для того, чтобы испытать его активность, растворы стандартного (S. aureus) PGN подготовили путем разбавления молекул в культуральной среде в отсутствии или в присутствии полимера I-10.01 (незагрязненный полимер) в концентрациях от 7,5% до 37,5% (масса/объем).
Образцы обработали в присутствии 2500 Ед/мл мутанолизина в течение 16 ч при 37°C и затем добавили к клеткам HEK-TLR2. Клеточный ответ измерили по продуцированной впоследствии активности SEAP согласно условиям, описанным в примере 3.
При отсутствии полимера глюкозы обработка мутанолизином в течение 16 ч снижает ответ клеток HEK-TLR2 более чем на 50%, что указывает на то, что деполимеризация была слишком сильной и снизила реакционную способность PGN в отношении клеток. В свою очередь, присутствие полимера глюкозы снижает активность фермента, поскольку ответ клеток даже улучшается в присутствии 7,5% полимера и не изменен в присутствии 37,5% полимера.
Мутанолизин сам по себе не индуцирует клеточный ответ, что указывает на то, что он не загрязнен и не имеет активирующего эффекта на клетки.
Для того, чтобы проверить эффект данной обработки, полимеры I-10.01, I-10.02, I-10.03, I-11.12, ММ-10.05 и МР-10.07 разбавили до концентрации 7,5% и затем обработали в течение 16 ч при 37°C в отсутствии или в присутствии 2500 Ед/мл мутанолизина.
Клеточный ответ индуцировали добавлением от 40 мкл до 160 мкл клеточной суспензии (конечная концентрация полимера: 15 мг/мл).
Результаты
Ответы клеток HEK-TLR2 в присутствии необработанных полимеров являются слабыми, что было ожидаемо, учитывая более низкие концентрации полимера по сравнению с примером 3.
После обработки мутанолизином ответы на растворы полимера глюкозы явно увеличены (фигура 22). Кроме того, можно отметить, что полимер I-10.03 дает ответ эквивалентно полимерам I-10.02 и ММ-10.05, хотя он не был реакционно-способным в предыдущих испытаниях.
Эти результаты указывают на то, что мутанолизин частично деполимеризует и, таким образом, солюбилизирует PGN, которые были полностью или частично нерастворимыми из-за их чрезмерно большого размера.
Значения поглощения представили на калибровочных кривых, построенных при тех же условиях со стандартным PGN (фигура 23), так чтобы определить концентрации PGN, присутствующие в полимерах глюкозы.
Результаты, выраженные в нг PGN/г полимера глюкозы, представлены в таблице 5. После обработки мутанолизином полученные значения ниже, чем в анализах SLP-Wako, но они отражают нагрузку полимеров глюкозы исходя из PGN с провоспалительной активностью (таблица 1).
Полимер I-10.03 дает высокое значение, близкое к I-10.02, после обработки мутанолизином. Этот фрагмент данных интересен том, что эти два полимера были предметом жалобы вследствие эпизодов асептического перитонита. Обработка мутанолизином I-10.03, таким образом, позволила выявить нагрузку активным PGN, вероятно, давая загрязнителю возможность быть растворимым.
Значения для образцов ММ-10.05 и МР-10.07 остаются ниже, чем полученные в анализах SLP. Однако эти образцы загрязнены другими воспалительными молекулами помимо PGN. Эти молекулы, в частности β-глюканы, вероятно, вмешиваются в анализы SLP, увеличивая ответ в анализах SLP.
|