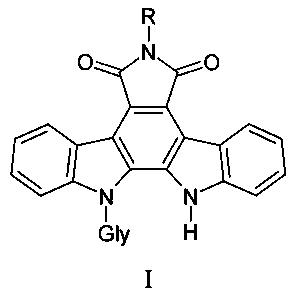
Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ИНДОЛОКАРБАЗОЛОВ, БЛОКИРУЮЩИЕ ВАСКУЛОГЕННУЮ МИМИКРИЮ В ОПУХОЛИ
Вид РИД
Изобретение
Изобретение относится к области медицины и фармацевтической химии и касается производных индолокарбазолов, блокирующих васкулогенную мимикрию в опухоли.
Формирование васкулярных каналов агрессивными опухолевыми клетками без участия эндотелиальных клеток (ЭК) и фибробластов, ограниченных базальной мембраной, получило название васкулогенная мимикрия (ВМ). Образование таких структур является уникальной способностью клеток с высокозлокачественным клеточным фенотипом. Предполагается, что формирование сети таких каналов внутри опухоли может поддерживать гомеостаз и предотвращать ранний некроз внутри опухоли (Hendrix, M.J. et al. 2003, Oncogene, 22, 3070-3075). Клинические испытания препаратов, потенциально направленных на снижение кровоснабжения опухоли, выявили, что антиангиогенная терапия опухоли не всегда является эффективной (Azam, F. Et al. 2010, Eur J Cancer, 46(8), 1323-1332). Одной из причин выживаемости опухолевых клеток может быть гетерогенность кровеносных сосудов: формирование сосудов в опухолях происходит на фоне неконтролируемой митогенной стимуляции и измененного внеклеточного матрикса. Это приводит к развитию неполноценных сосудов, имеющих нередко нарушенную эндотелиальную выстилку. Эндотелий может замещаться опухолевыми клетками или отсутствовать в сосудах опухоли. Феномен ВМ объясняет нечувствительность многих злокачественных опухолей к антиангиогенной терапии. Ранее в экспериментах in vitro было выявлено и подтверждено in vivo, что ингибитор протеинкиназы С (РКС) Ro32-0234, являющийся производным индолокарбазола, доза-зависимо снижает плотность васкулярных каналов, сформированных опухолевыми клетками (A. Vartanian et al. Melanoma Res, 2011, 21(2), 91-98).
Задачей заявляемого изобретения является создание новых производных индолокарбазолов, блокирующих ВМ в опухоли.
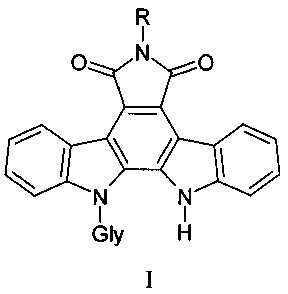
Задача решается тем, что предложены N-гликозиды индолокарбазолов, представляющие собой малеимид индоло[2,3-a]карбазола, в котором один из индольных атомов связан гликозидной связью с остатками различных моносахаридов и содержит различные заместители по имидному атому азота общей формулы I:
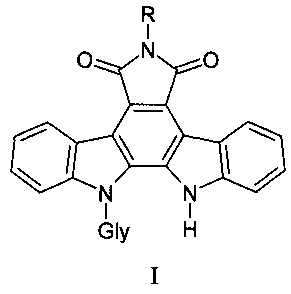
где Gly - остатки пентоз и гексоз, R представляет амино-группу - 6-амино-12-(α-L-арабинопиранозил)индоло [2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (1); формамидо-группу - 6-формамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (2); оксиэтиламино-группу - 6-(2-цианоэтил)амино-12-(β-D-галактопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (3), цианоэтиламино-группу - 6-(2-цианоэтил)амино-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединения (4) и 6-(2-оксиэтил)амино-12-(α-L-арабинопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (5);
пиколиноамидо-группу - 6-пиколинамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (6).
Для получения соединений (1-6) в качестве исходных были использованы N-гликозиды индоло[2,3-a]фурано[3,4-c]карбазол-5,7-дионов, которые конденсировали с гидразингидратом и различными производными гидразина, с последующим удалением защитных групп углеводного фрагмента, синтезированные по способу, описанному в патенте РФ №2427585.
Полученные соединения охарактеризованы данными спектров 1H-ЯМР и масс-спектров высокого разрешения. Спектры 1H-ЯМР записаны на приборе Bruker DRX-500 с программным обеспечением, внутренний стандарт - тетраметилсилан, химические сдвиги δ приведены в миллионных долях (м.д.). При описании формы сигналов приведены следующие сокращения: с - синглет, д - дублет, т - триплет, м - мультиплет, дд - дублет дублетов, уш. с. - уширенный синглет; значения констант спин-спинового взаимодействия J приведены в герцах. Масс-спектры зарегистрированы на масс-спектрометре Finnigan MAT 8430 с системой обработки данных SS-300 при ускоряющем напряжении 3 кВ, энергии ионизирующих электронов 70 эВ, температуре источника ионов 250°C, температуре испарения образца 170-250°C, с применением системы прямого ввода вещества в область ионизации. Приведены значения m/z (отношение массы частиц к заряду). За ходом реакций следили с помощью тонкослойной хроматографии (ТСХ). ТСХ проводили на силуфоле.
Получение 6-амино-12-(α-L-арабинопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (1)
К 550 мг (0.9 ммоль) 13-формил-12-(2,3,4-три-O-ацетил-α-L-арабинопиранозил)индоло[2,3-a]фурано[3,4-c]карбазол-5,7-диона [патент РФ №2427585] добавили 3.2 мл (65.25 ммоль) гидразин-гидрата, смесь выдержали при температуре 50°C в течение двух часов, охладили до температуры 22°C, выливали в воду. Выпавший осадок отфильтровали, промыли 10% спиртом. Выход 6-амино-12-(α-L-арабино-пиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона составил 370 мг (89%).
Масс-спектр: M+ 457 m/z.
1H-ЯМР (DMSO-d6, δ м.д.): 12.15 (с, 1H, NH-индол), 9.23 (д, 1H, Ar), 9.14 (д, 1H, Ar), 7.94 (д, 1H, Ar), 7.70 (д, 1H, Ar), 7.62 (т, 1H, Ar), 7.59 (т, 1H, Ar), 7.41 (т, 1H, Ar), 7,37 (т, 1H, Ar), 6.11 (д, 1H, H1′, J1′2′ 9.1), 6.86, 5.38, 5.24 (3 уш с, 3H, 2′,3′,4′-OH), 4.99 (2H, с, ΝΗ2), 4.20-4.05 (м, 3H, H2′, H3′, H5″), 4.25 (м, 1H, H5′), 3.85 (м, 1H, H4′).
Получение 6-формамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (2)
Смесь, состоящую из 100 мг (0,17 ммоль) 12-(2,3,4-три-O-ацетил-β-D-ксилопиранозил)индоло[2,3-a]фурано[3,4-c]карбазол-5,7-диона и 80 мг (1,33 ммоль) формилгидразида в 1,5 мл диметилфорамида, перемешивали при 75°C в течение 30 мин Растворитель упарили. К остатку добавили 10 мл воды. Выпавший осадок отфильтровали, промыли водой (10 мл), высушили, получили 65 мг ацетилированного 6-формамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона.
К 65 мг (0,1 ммоль) ацетилированного 6-формамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона в 2 мл абсолютного метанола добавили 0,3 мл 0,1 N раствора метилата натрия в метаноле. Реакционную смесь перемешивали при 22°C в течение 30 мин, добавили 1,0 мл воды. Выпавший осадок отфильтровали, промыли водой (10 мл), высушили.
Выход 6-формамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона (6) 26,0 мг (50%).
1H-ЯМР ((CD3)2CO): 10.62 (с, 1H, NH), 9.88 (с, 1H, NH индол), 9.27 (д, 1H, Ar), 9.20 (д, 1H, Ar), 7.95 (д, 1H, Ar), 7.81 (д, 1H, Ar), 7.58 (т, 1H, Ar), 7.55 (т, 1H, Ar), 7.38 (т, 1H, Ar), 7.36 (т, 1H, Ar), 6.24 (уш. д., 1H, H1′), 4.70-3.75 (м, 5H, H2′, H3′, H4′, H5′, H5″).
Масс-спектр: M+ 457.
Получение соединения 6-{2-цианоэтил)амино-12-(β-D-галактопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (3)
Смесь, состоящую из 100 мг (0,16 ммоль) 12-(2,3,43,5-тетра-O-ацетил-β-D-галактопиранозил)индоло[2,3-a]фурано[3,4-c]карбазол-5,7-диона и 40 мг и 40 мг (0,47 ммоль) 2-цианоэтилгидразина в 1,5 мл диметилформида, перемешивали при 75°C в течение 1 часа. Растворитель упарили. К остатку добавили 10 мл воды. Выпавший осадок отфильтровали, промыли водой (10 мл), высушили, получили 70 мг ацетилированного 6-(2-цианоэтил)амино-12-(β-D-галактопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона.
К 70 мг (0,1 ммоль) ацетилированного 6-(2-цианоэтил)амино-12-(β-D-галактопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона в 2 мл абсолютного метанола добавили 0,5 мл 0,1 N раствора метилата натрия. Реакционную смесь перемешивали при 22°C в течение 30 мин. Выпавший осадок отфильтровали, промыли водой (10 мл), высушили. Выход 6-(2-цианоэтил)амино-12-(β-D-галактопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона составил 29 мг (54%).
1H-ЯМР (DMSO-d6): 12.17 (с, 1H, NH), 11.07 (с, 1H, NH индол), 9.20 (д, 1H, Ar), 9.09 (д, 1H, Ar), 7.95 (д, 1H, Ar), 7.70 (д, 1H, Ar), 7.59 (м, 2Н, Ar), 7.37 (м, 2Н, Ar), 6.18 (д, 1H, H1′, J1′2′ 7.0), 6.82, 5.35, 5.21, 4.86 (4 уш. С., 4H, 4-OH), 4.23 (м, 1H, H2′), 3.84 (м, 1H, H3′), 4.20-4.10 (м, 2H, H4′, H5′), 3.80-3.60 (м, 2H, H6′, H6″).
Масс-спектр: M+ 487.
Получение соединения 6-(2-цианоэтил)амино-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (4)
6-(2-Цианоэтил)амино-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона (4) получили из 12-(2,3,4-три-O-ацетил-β-D-ксилопиранозил)индоло[2,3-a]фурано[3,4-c]карбазол-5,7-диона аналогично способу поучения соединения (3).
Общий выход 6-(2-цианоэтил)амино-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона (4) составил 45 мг (33,4%).
%. 1H-ЯМР ((CD3)2CO): 10.62 (с, 1H, NH), 9.88 (с, 1H, NH индол), 9.27 (д, 1H, Ar), 9.20 (д, 1H, Ar), 7.95 (д, 1H, Ar), 7.81 (д, 1H, Ar), 7.58 (т, 1H, Ar), 7.55 (т, 1H, Ar), 7.38 (т, 1H, Ar), 7.36 (т, 1H, Ar), 6.24 (уш. д., 1H, H1′), 4.70-3.75 (м, 5H, H2′, H3′, H4′, H5′, H5″).
Масс-спектр: M+ 457.
Получение соединения 6-(2-оксиэтил)амино-12-(α-L-арабинопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (5)
Смесь, состоящую из 150 мг (0.25 ммоль) 12-(2,3,4-три-O-ацетил-α-L-арабинопиранозил)индоло[2,3-a]фурано[3,4-c]карбазол-5,7-диона и 137 мг (1,8 ммоль) 2-оксиэтиламиногидрозина в 2 мл диметилформамида, перемешивали при 22°C в течение 16 часов. Растворитель упарили. К остатку добавили 10 мл воды. Выпавший осадок отфильтровали, промыли водой (10 мл), высушили, получили 90 мг ацетилированного 6-(2-оксиэтил)амино-12-(α-L-арабинопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона.
К 90 мг (0,14 ммоль) ацетилированного 6-(2-оксиэтил)амино-12-(α-L-арабинопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона в 2 мл абсолютного метанола добавили 0,3 мл 0,1 N раствора метилата натрия в метаноле. Реакционную смесь перемешивали при 22°C в течение 30 мин. Выпавший осадок отфильтровали, промыли водой (10 мл), высушили. Выход 6-(2-оксиэтил)амино-12-(α-L-арабинопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона составил 48 мг (66,3%).
1H-ЯМР (DMSO-d6): 12.07 (с, 1H, NH), 9.97 (с, 1H, NH индол), 9.19 (д, 1H, Ar), 9.09 (д, 1H, Ar), 7.89 (д, 1H, Ar), 7.67 (д, 1H, Ar), 7.54 (м, 2H, Ar), 7.35 (м, 2H, Ar), 6.05 (уш д, 1H, H1′, J1′2′ 9.0), 6.75, 5.26, 5.14 (3 уш. С., 3H, 3-OH), 4.22 (м, 1H, H2′), 4.30-4.10 (м, 3H, H3′, H5′, H5″), 3.89 (м, 1H, H4′).
Масс-спектр: M+ 457.
Получение соединения 6-пиколинамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона, соединение (6)
Смесь, состоящую из 105 мг (0,18 ммоль) 12-(2,3,4-три-O-ацетил-β-D-ксилопиранозил)индоло[2,3-a]фурано[3,4-c]карбазол-5,7-диона и 110 мг (0,8 ммоль) α-пиколиногидразида в 1,5 мл диметилфорамида, перемешивали при 75°C в течение 1,5 мин. Растворитель упарили. К остатку добавили 10 мл воды. Выпавший осадок отфильтровали, промыли водой (10 мл), высушили, получили 70 мг ацетилированного 6-пиколинамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона.
К 70 мг (0,1 ммоль) ацетилированного 6-пикалинамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона. в 2 мл абсолютного метанола добавили 0,3 мл 0,1 N раствора метилата натрия в метаноле. Реакционную смесь перемешивали при 22°C в течение 30 мин. Выпавший осадок отфильтровали, промыли водой (10 мл), высушили. Выход 6-пиколинамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона (6) составил 37 мг (64,4%).
1H-ЯМР ((CD3)2CD): 10.62 (с, 1H, NH), 9.88 (с, 1H, NH индол), 9.27 (д, 1H, Ar), 9.20 (д, 1H, Ar), 7.95 (д, 1H, Ar), 7.81 (д, 1H, Ar), 7.58 (т, 1H, Ar), 7.55 (т, 1H, Ar), 7.38 (т, 1H, Ar), 7.36 (т, 1H, Ar), 6.24 (уш. д., 1H, H1′), 4.70-3.75 (м, 5H, H2′, H3′, H4′, H5′, H5″).
Масс-спектр: M+ 457.
Исследование цитотоксической активности соединений (1-6) in vitro
Исследование цитотоксической активности соединений (1-6) проводили на клетках рака толстой кишки человека HCT-116 и на клетках метастатической меланомы Mel Kor,
Mel Cher, полученных из опухолевого материала больных диссеминированной меланомой в ФГБУ РОНЦ им Н.Н. Блохина РАМН
Опухолевые клетки выращивали на среде RPMI 1640, содержащей 10% эмбриональной сыворотки теленка, при 5% содержании CO2 и температуре 37°C. Цитотоксическую активность соединений (1-6) оценивали с помощью стандартного MTT-теста с использованием MTT-реагента (3,4,5-диметилтиазол2-ил-2,5-дифенилтетразолиум бромид), основанного на способности дегидрогеназ живых метаболически активных клеток восстанавливать MTT-реагент до голубых нерастворимых кристаллов формазана [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ, М., 2005, с. 649-651].
Исследования выполняли на 96-луночных микропланшетах. Опухолевые клетки рассеивали в 180 мкл культуральной среды и выращивали в течение 24 часов, затем добавляли соединения (1-6) в концентрациях от 0,01 до 100 мкМ в объеме 20 мкл. Время инкубации соединений (1-6) с опухолевыми клетками составляло 48 часов. Контролем служили образцы клеток, к которым соединения (1-6) не добавляли. Через 48 часов к клеткам добавляли MTT-реагент в конечной концентрации 0.5 мг/мл. Клетки инкубировали еще 4 часа, далее клетки осаждали центрифугированием планшетов при 1000 об/мин в течение 2-3 мин, затем среду забирали и добавляли к клеткам 200 мкл ДМСО для растворения формазана. Опухолевые клетки ресуспендировали и инкубировали 10 мин при 37°C, после чего немедленно определяли оптическую плотность раствора формазана на анализаторе иммуноферментных реакций «Униплан» при 540 нм, используя DMSO как нулевой контроль.
Процент живых клеток вычисляли по формуле:
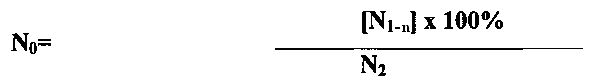
где N0 - процент живых клеток;
Ν1 - средняя оптическая плотность лунок, содержащих клетки и тестируемый образец;
N2 - средняя оптическая плотность контрольных лунок, содержащих только клетки;
n - оптическая плотность лунок, содержащих только тестируемый образец.
Для каждого соединения строили график зависимости «доза-эффект» и определяли ID50. Ошибка измерений в экспериментах не превышала 5%. В исследовании были использованы полученные соединения (1-6).
Изобретение иллюстрируется таблицей и фигурами 1-3.
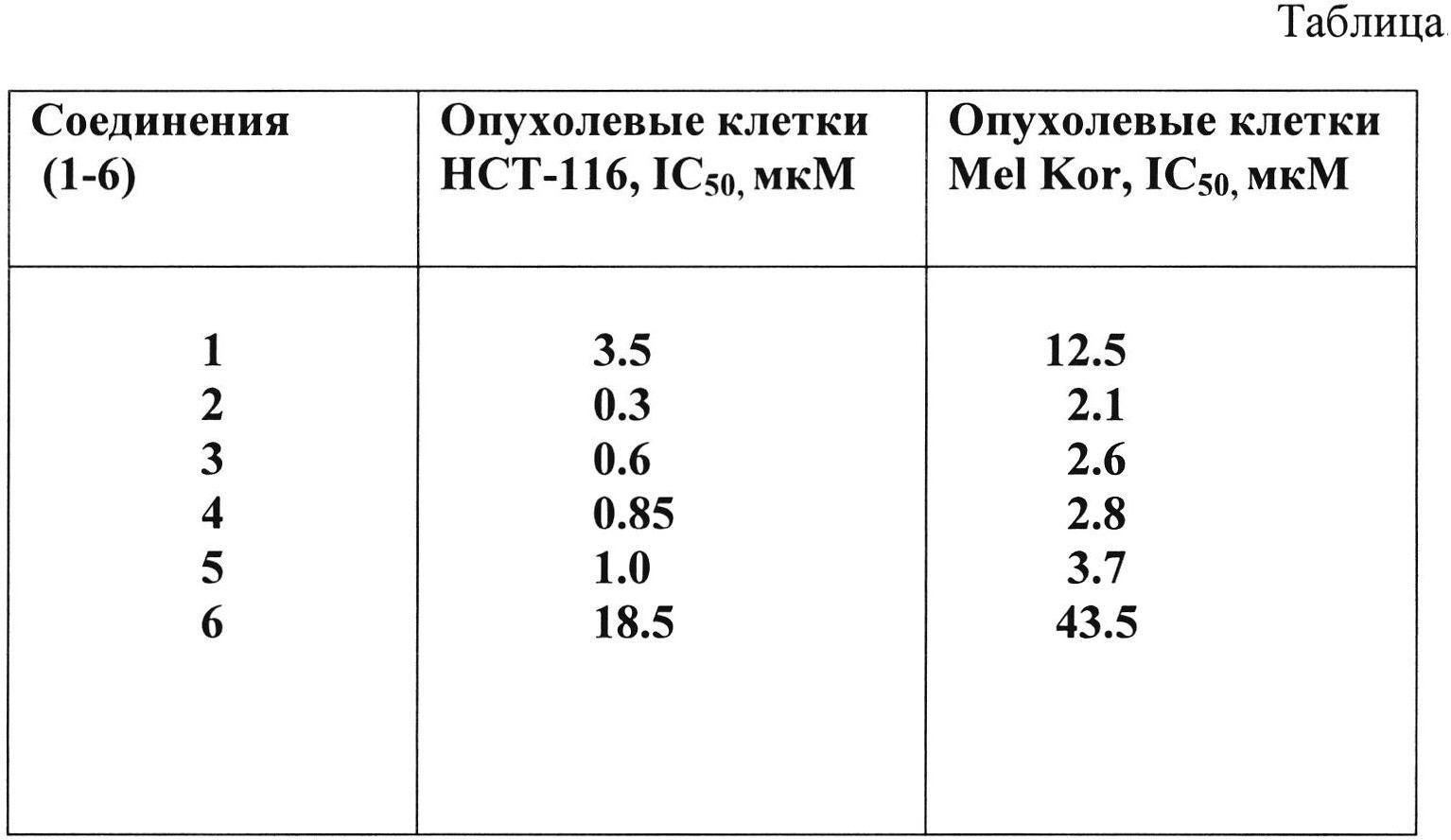
В таблице представлены показатели цитотоксической активности соединений (1-6) на клетках рака толстой кишки человека HCT-116 и меланомы Mel Kor in vitro.
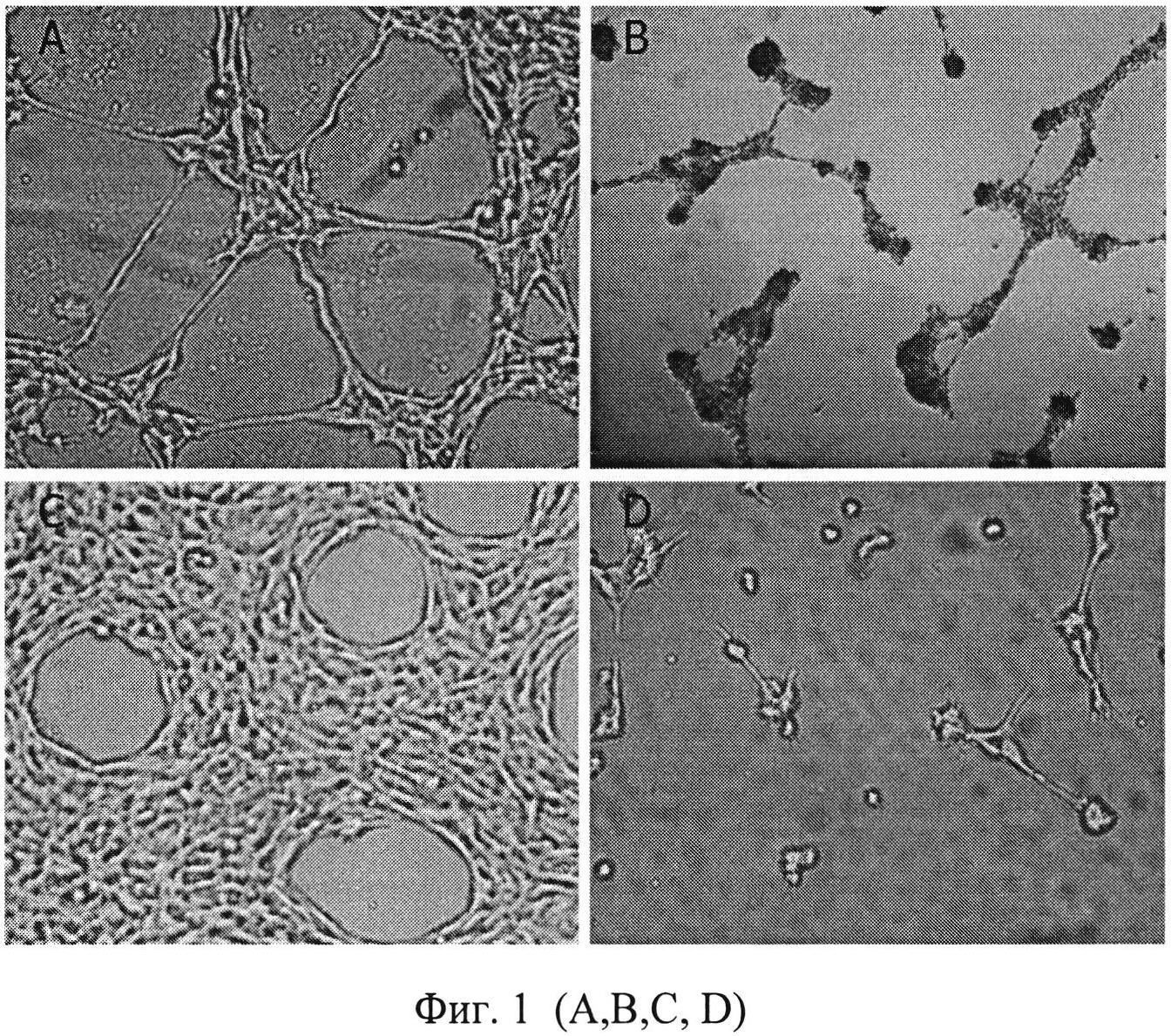
На фиг. 1 (A, B, C, D) представлено влияние соединений (1-6) на формирование СПС клетками меланомы Mel Kor и рака толстой кишки HCT-116.
На фиг. 2 (A, B, C) представлено исследование влияния соединений (1-6) на блокирование миграции опухолевых клеток меланомы Mel Kor (тест на «заживление раны»).
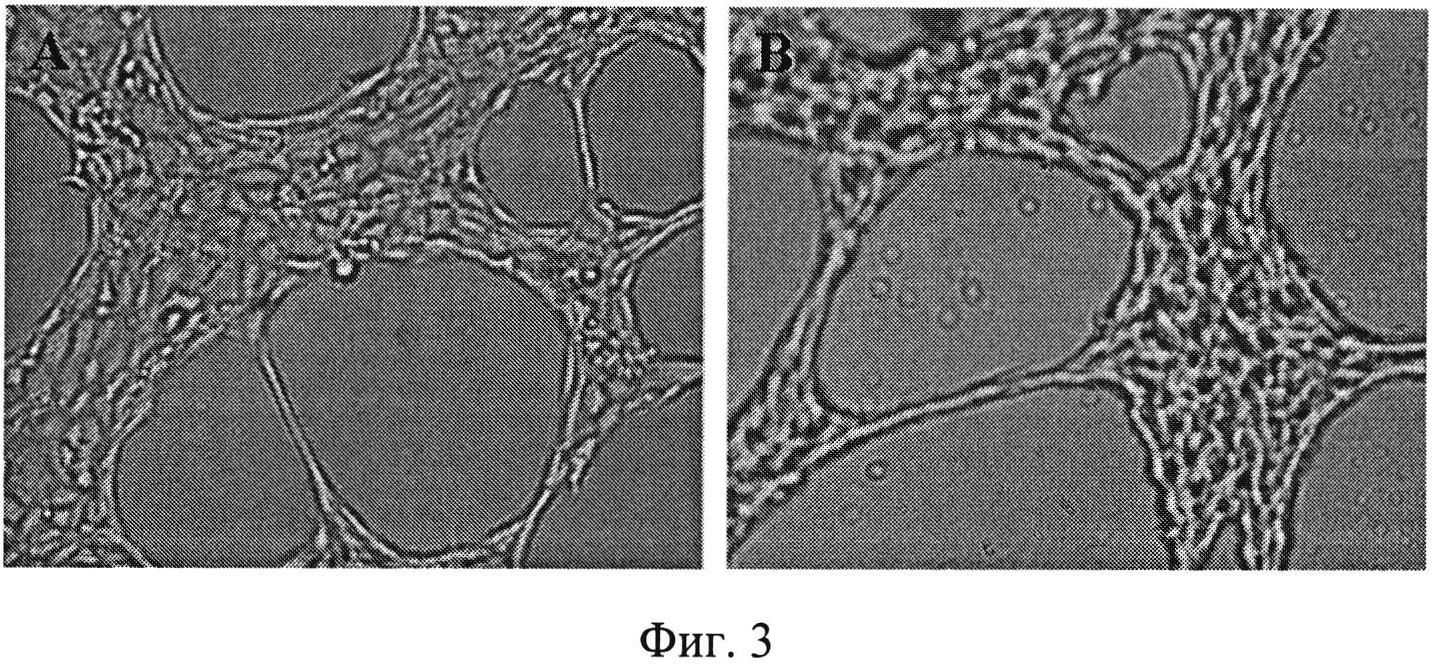
На фиг. 3 представлено влияние соединения (6) на формирование СПС эндотелиальными клетками SVEC4-10.
В таблице представлены значения ID50-показателя концентрации соединений (1-6), необходимых для 50% ингибирования опухолевых клеток рака толстой кишки HCT-116. и меланомы Mel Kor. Показано, что наибольшей цитотоксической активностью обладало соединение (2).
Для исследования формирования васкулярной сети опухолевыми клетками in vitro, миграционной и антиангиогенной активности были подобраны концентрации соединений (1-6), при инкубации с которыми в течение 24 часов 90-95% опухолевых клеток оставались живыми (нецитотоксические дозы). Использование нецитотоксических доз соединений (1-6) позволяло избежать ложноположительного результата, при котором эффект блокирования миграции на 60% связан с гибелью опухолевых клеток в течение 24 часов по сравнению с контролем.
Исследование влияния соединений (1-6) на формирование васкулогенной мимикрии in vitro.
24-луночный планшет покрывали Матригелем (100 мкл/лунка, плотность 8.4 мг/мл), инкубировали 10 минут в ламинаре при комнатной температуре, затем 30 минут в CO2 инкубаторе при 37°C до его полной полимеризации. Клетки Mel P, Mel Kor и HCT-116 в количестве 200 тыс. инкубировали в 0.5 мл полной среды RPMI 1640 с добавлением нецитотоксических концентраций соединений (1-6) в течение 30 минут при 37°C. Затем клетки переносили в лунки, покрытые Матригелем, и инкубировали в CO2-инкубаторе от 20 до 24 часов. В качестве контроля использовали клетки, инкубировавшиеся в среде ДМЕМ без добавления соединений (1-6). Оценивали длину трубочек и количество контактов между трубочками в СПС. Максимальной активностью обладало соединение (6).
На фиг. 1 (A, B, C и D) показано влияние соединения (6) на формирование СПС клетками меланомы Mel Kor и клетками рака толстой кишки HCT-116. На фиг. 1 (A и C) соединение (6) в концентрации 1×10-7 Μ, в 480 раз меньшей IC50, блокировало формирование СПС клетками меланомы Mel Kor и клетками рака толстой кишки HCT-116. На Фиг. 1 (B и D) представлены клетки меланомы Mel Kor и рака толстой кишки HCT-116 на Матригеле без добавления соединения (6), видны типичные для ВМ структуры, подобные «пчелиным сотам». На фиг. 1 (B и D) показана полная потеря опухолевыми клетками меланомы Mel Kor и рака толстой кишки HCT-116 способности коммуникации, необходимой для формирования СПС, на Матригеле имелись лишь небольшие кластеры округлых клеток после инкубация с соединением (6) в концентрации 1×10-7 М.
Изучение влияния соединений (1-6) на миграционную активность опухолевых клеток
Формирование сосудисто-подобных структур (СПС) в 3D-культуре характеризуется рядом последовательных событий: миграцией опухолевых клеток, формированием контактов клетка-клетка, вытягивание клетки и образованием структур, подобных пчелиным сотам (honey-like comb).
Миграцию клеток меланомы и эндотелиальных клеток SVEC 4-10 определяли методом «заживления раны» с некоторыми модификациями. Клетки меланомы Mel P, Mel Kor в количестве 3×105 клеток/мл вносили в лунки 24-луночного планшета в среде RPMI 1640, содержащей 10% эмбриональной сыворотки, 2 мМ глутамина, антибиотик, и инкубировали до образования полного монослоя. Затем монослой разрушали путем соскабливания части клеток по прямой линии наконечником в 200 мкл. В течение 24 часов клетки инкубировали в среде RPMI 1640, содержащей 10% эмбриональной сыворотки, 2 мМ глутамина и нецитотоксические дозы (от 10-6 до 10-8 М) соединения (6). Контролем служили опухолевые клетки, растущие в полной среде RPMI 1640 и 10 нг/мл VEGFA. Результаты оценивали по изменению ширины миграционной поверхности через 24 часа инкубации после добавления соединений (1-6) относительно контроля.
На фиг. 2 (A, B, C) показано, что добавление соединений (1-6) в нецитотоксических концентрациях не оказывало влияния на миграцию клеток меланомы Mel Kor. На фиг. 2A представлена миграция клеток меланомы Mel Kor, растущих в среде без эмбриональной сыворотки; на фиг. 2B показана миграция клеток меланомы Mel Kor, растущих в полной среде с добавлением 10% эмбриональной сыворотки; на фиг. 2C представлена миграция клеток, растущих в среде RPMI 1640, содержащей 10% эмбриональной сыворотки, 2 мМ глутамина с добавлением нецитотоксических доз (10-7 М) соединения (6). Показано, что различий в ширине миграционного поля по сравнению с контролем не выявлено (стрелками обозначена ширина миграционного поля).
Исследование антиангиогенной активности производных индолокарбазолов
Соединение (6) в концетрации 10-7 М, вызывающее блокаду формирования СПС опухолевыми клетками, исследовали на способность блокировать ангиогенез опухоли, т.е. формирование кровеносных сосудов ЭК. С этой целью использовали клеточную линию SVEC4-10, полученную из регионарных лимфатических узлов мышей C3H/HeJ (H-2k) и трансформированную большим T-антигеном вируса SV40, из коллекции ATCC (США), широко применяемую в мировой практике для скрининга про- и антиангиогенных препаратов. ЭК мыши SVEC4-10 растут в культуре без добавления эндогенных эндотелиальных ростовых факторов и компонентов экстрацеллюлярного матрикса, сохраняя при этом функциональные характеристики нормальных микроваскулярных ЭК. SVEC-4-10 клетки в количестве 2×105 клеток/мл инкубировали в среде ДМЕМ с добавлением соединения (6) в нецитотоксических дозах 1×10-8 М, проявивших активность в блокировании ВМ, в течение 30 минут при 37°C и затем переносили на Матригель. На фиг. 3 показано, что соединение (6) не оказывало влияния на формирование СПС ЭК мыши SVEC4-10.
Производные индолокарбазолов, блокирующие васкулогенную мимикрию в опухоли,общей формулы I: где Gly - остатки пентоз и гексоз, R представляет амино-группу 6-амино-12-(α-L-арабинопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона; формамидо-группу 6-формамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона; оксиэтиламино-группу 6-(2-оксиэтил)амино-12-(α-L-арабинопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона; цианоэтиламино-группу 6-(2-цианоэтил)амино-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона и 6-(2-цианоэтил)амино-12-(β-D-галактопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона; пиколиноамидо-группу 6-пиколинамидо-12-(β-D-ксилопиранозил)индоло[2,3-a]пирроло[3,4-c]карбазол-5,7-диона.