Результат интеллектуальной деятельности: КАТАЛИТИЧЕСКИ АКТИВНЫЕ ПЕРФТОРКАРБОКСИЛАТНЫЕ СОЕДИНЕНИЯ ЧЕТЫРЕХВАЛЕНТНОЙ ПЛАТИНЫ
Вид РИД
Изобретение
Изобретение относится к получению ранее неизвестных карбоксилатных соединений четырехвалентной платины Pt(RfCOO)4, M2[Pt(RfCOO)6], где Rf=CF3, C2F5; M=Li, К, Na. Rb, Cs, NMe4. Они могут быть использованы для синтеза других соединений платины, для получения металлических покрытий, в гомогенном и гетерогенном катализе в качестве катализаторов и их прекурсоров, а также в качестве исходных соединений для получения наноразмерных частиц платины и интерметаллидов на ее основе.
В отличие от карбоксилатов других платиновых металлов, которые давно применяются в промышленности, например ацетат палладия, ацетаты и перфторкарбоксилаты четырехвалентной платины практически неизвестны. Так, в работе [C.D. Garner, В. Hughes, "Inorganic Compounds Containing the Trifluoroacetate Group" в сб. Advances in Inorganic Chemistry and Radiochemistry, ed. by H.J. Emeletis and A.G. Sharpe, Academic Press, New York-London, v. 17, p. 22, 1975] указано, что трифторацетат четырехвалентной платины неизвестен. До настоящего времени это соединение никем не получено, какие-либо упоминания о нем и других перфторкарбоксилатах четырехвалентной платины в литературе не выявлены.
Известно получение ацетата двухвалентной платины реакцией обмена хлорида четырехвалентной платины с ацетатом серебра в эфире с последующей обработкой выпавшего осадка смесью уксусной и муравьиной кислот [DE 1948837 (D. Wright, Chemical Abstracts, 1970, v. 72, 123514P)].
Недостатком метода является использование муравьиной кислоты в качестве восстановителя, что приводит к заведомо низкому выходу целевого продукта.
Известно также получение ацетата двухвалентной платины последовательной обработкой Na2[Pt(OH)6] азотной кислотой и смесью уксусной и муравьиной кислот, описанное в 1965 г. [Т.А. Stephenson, S.M. Morehouse, A.R. Powell, J.P. Heffer, G. Wilkinson, Journal of Chemical Society, 1965, N6, p. 3652].
Недостатком этого метода является то, что реакция нередко завершается взрывом [J.M. Davidson, С. Triggs, Chemistry and Industry (London), 1966, N 2, p. 306], а вместо ацетата платины выделяется нитрозильное производное Pt4(OAc)6(NO)2 [M.A.A.F. de С.Т. Carrondo, А.С. Scapski, Journal of Chemical Society, Chemical Communications, 1976, N 11, p. 410; Meester P., Skapski A.C., Journal of Chemical Society, Chemical Communications, 1972, N18, p. 1039].
Известен также ацетат трехвалентной платины Рt4(ОАс)12, полученный по схожей методике последовательной обработкой K2[Pt(OH)6] уксусной и муравьиной кислот, отличающейся тем, что мольное соотношение НСООН: Pt не превышает 0,5 [Р.И. Рудый, Н.В. Черкашина, Г.Я. Мазо, Я.В. Салынь, И.И. Моисеев. Изв. АН СССР, сер. Хим., 1980, №4, с. 754].
Недостатком является то, что муравьиная кислота, особенно в присутствии сильных кислот, легко разлагается с образованием воды и летучей окиси углерода, что вносит дополнительную неопределенность в расчет стехиометрии реакции:
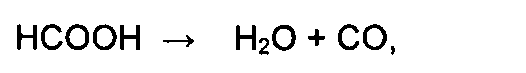
а это в свою очередь приводит к заведомо низкому выходу целевого продукта.
Известен способ получения трифторацетата двухвалентной платины [Н.В. Гэрбэлэу, Г.А. Тимко, К.М. Индричан, А.С. Бацанов, О.С. Маноле, Ю.Т. Стручков. Координационная химия, 1994, т. 20, №11, с. 846], заключающийся в том, что исходный гидроксоплатинат калия K2[Pt(OH)6] подвергают длительному кипячению в трифторуксусной кислоте до появления в реакционной смеси металлической платины.
К основному недостатку вышеприведенного способа относится то, что при длительном кипячении происходит термолиз, т.е. термораспад трифторацетатных соединений платины вплоть до появления в реакционной смеси металлической платины.
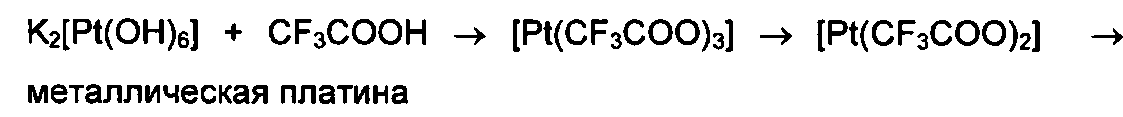
Как следствие, по указанной методике трифторацетат двухвалентной платины в принципе не может быть получен с высоким выходом, т.к. является промежуточным соединением, разлагаясь в конце концов до металла.
Известен также трифторацетат трехвалентной платины [Черкашина Н.В. Ацетатные комплексы платины. Диссертация на соискание ученой степени кандидата хим. наук, М., 1986] (прототип). В качестве исходного соединения и в этом случае применен K2[Pt(OH)6], который сначала обрабатывали смесью уксусной и муравьиной кислот и получали ацетат трехвалентной платины:
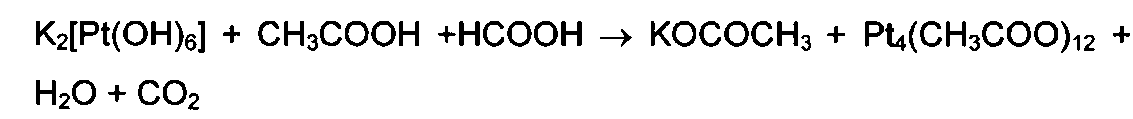
Далее выделенный ацетат трехвалентной платины растворяли в воде и оставляли стоять в течение 1-3 суток, после чего раствор отфильтровывали и упаривали до выпадения осадка промежуточного продукта - аквагидроксокомплекса [Рt4(ОАс)4(Н3О2)2(ОН)6]·2Н2О. Этот продукт при кипячении в трифторуксусной кислоте в течение 1 часа превращался в трифторацетат трехвалентной платины, при выпаривании раствора на воздухе из него был выделен гидрат [Pt(CF3COO)3]4·8H2O.
К основному недостатку прототипа можно отнести многостадийность методики получения трифторацетата платины, вследствие чего выход конечного продукта сравнительно невелик, не более 40%.
Вторым недостатком является то, что трифторацетат трехвалентной платины существует в форме гидрата, который нерастворим в органических растворителях, что существенно ограничивает возможность его применения.
Изобретение направлено на получение неизвестных ранее перфторкарбоксилатных соединений четырехвалентной платины с высоким выходом продукта.
Технический результат достигается тем, что предложены каталитически активные перфторкарбоксилатные соединения четырехвалентной платины, характеризующиеся устойчивостью при хранении без доступа воздуха, которые получают реакцией гидроксосоединения четырехвалентной платины K2[Pt(OH)6] или свежеприготовленного гидрата двуокиси платины РtO2·4Н2O с перфторкарбоновой кислотой RfCOOH, где Rf=CF3, C2F5, при температурах от 40 до 70°С для Rf=CF3 и от 70 до 90°С для Rf=C2F5 до получения гомогенного раствора, из которого затем удаляют остатки кислоты в вакууме при температуре не выше 60°С, полученные соединения отвечают формуле K2[Pt(RfCOO)6] или Pt(RfCOO)4, при этом перфторкарбоксилатные соединения четырехвалентной платины общей формулы M2[Pt(RfCOO)6] (M=Li, К, Na, Rb, Cs, NMe4) получают также нагреванием перфторкарбоксилата четырехвалентной платины Pt(RfCOO)4 или гидрата двуокиси платины РtO2·4Н2O со стехиометрическим количеством соли M(RfCOO) в соответствующей кислоте RfCOOH с последующим удалением ее остатков в вакууме при температуре не выше 60°С.
Заявленные интервалы температур выбирают из тех соображений, что их нижние пределы позволяют проводить реакцию с относительно высокой скоростью, за 0,2÷1,5 часа, а верхние пределы отвечают границам температурной устойчивости образующихся соединений четырехвалентной платины.
Сущность изобретения заключается в том, что для получения неизвестных перфторкарбоксилатных соединений четырехвалентной платины используют простую кислотно-основную реакцию гидроксо- и оксокомплексов четырехвалентной платины с перфторкарбоновыми кислотами:
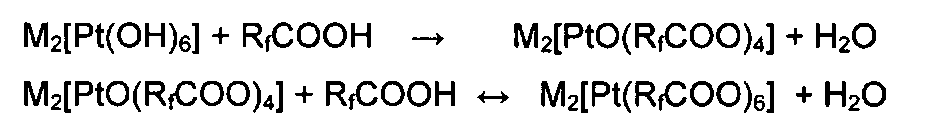
или
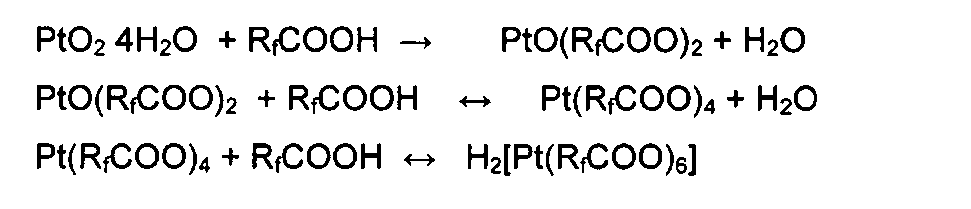
В этих кислотно-основных реакциях не участвуют никакие восстановители, что значительно упрощает реакцию и позволяет получать соединения четырехвалентной платины количественно, т.е. с высоким выходом.
При этом высокая степень диссоциации кислот обеспечивает высокую скорость кислотно-основной реакции, а устойчивость кислот и перфторкарбоксилатных групп к окислению - высокий выход и сравнительную устойчивость образующихся соединений четырехвалентной платины, которые обладают более широким диапазоном применения, например, они могут заменить соединения двухвалентной платины в процессах получения металлических пленок и покрытий.
Кроме того, перфторкарбоксилатные соединения четырехвалентной платины являются сильными окислителями, взаимодействующими не только с ароматическими, но и с различными алифатическими соединениями. В нижеприведенных примерах показано, что они избирательно действуют на связи С-Н углеводородов, при этом из метана и углеводородов нефти (алканов и циклоалканов) образуются соответствующие сложные эфиры:
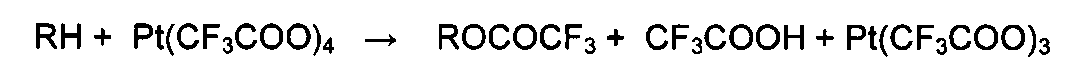
В присутствии кислорода и других окислителей (NO2, Н2O2, CF3COOOH) реакции окисления алканов и циклоалканов в сложные эфиры протекают в присутствии каталитических количеств этих соединений:
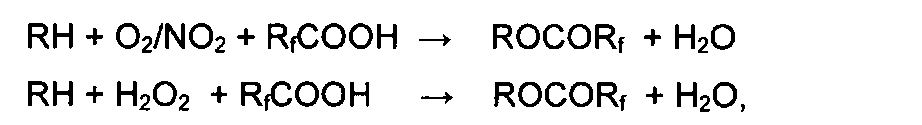
что указывает на то, что заявляемые соединения платины могут служить катализаторами парциального окисления алканов.
Известно, что окисление алканов в сложные эфиры впервые было осуществлено стехиометрической реакцией Шилова [А.Е. Шилов, Г.Б. Шульпин. Активация и каталитические реакции углеводородов. Москва, «Наука», стр. 173, 1995] под действием H2PtCl6 в присутствии Na2PtCl4:
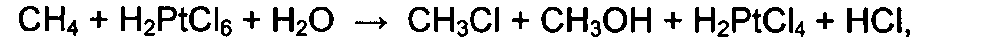
выход органических производных не достигает 1 моля на 1 моль соединений платины. Все попытки проведения каталитической реакции в присутствии таких окислителей, как бензохинон и хлорид меди(2+), не привели к существенным результатам.
Перфторкарбоксилатные соединения четырехвалентной платины получают в виде твердых веществ от оранжевого до желто-коричневого цвета. Они устойчивы при комнатной температуре в отсутствие влаги и восстановителей. Растворяются в перфторкарбоновых кислотах и других полярных растворителях, устойчивых к окислению. Реагируют с раствором хлорида калия в соляной кислоте с образованием желтого осадка хлорплатината:
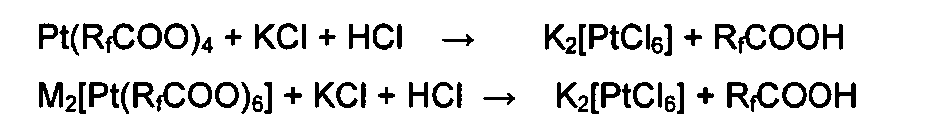
С азотсодержащими гетероциклическими соединениями (пиридин, 2,2'-дипиридил, 1,10-фенантролин и др.) реагируют с образованием оранжевых комплексов четырехвалентной платины:
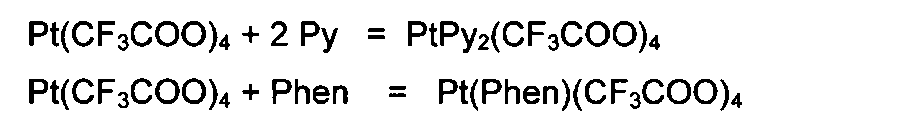
Химический анализ полученных соединений проводили на CHN-анализаторе ЕА3000 фирмы EuroVector. ИК-спектры регистрировали на ИК-Фурьеспектрофотометре Nexus фирмы Nicolet методом нарушенного полного внутреннего отражения (НПВО) в диапазоне 4000-550 см-1. Образец твердого вещества наносили на алмазный кристалл. Данные приведены в Таблице: «ИК-спектры НПВО». Масс-спектры (электрораспыление в ацетонитриле) получали на масс-спектрометре MSL 2020 фирмы Shimadzu.
Достижение заявленного технического результата подтверждается следующими примерами. Примеры иллюстрируют, но не ограничивают предложенное техническое решение.
Используемые в синтезе реактивы: 1) гидроксоплатинат K2[Pt(OH)6] получали согласно методике из книги "Синтез комплексных соединений металлов платиновой группы" / Под ред. акад. И.И. Черняева. Москва, Наука, 1964, стр. 102; 2) гидрат двуокиси платины РtO2·4Н2O (H2Pt(OH)6) получали согласно «Руководству по неорганическому синтезу» / Под ред. Г. Брауэра. Т. 5, М.: Мир, 1986, с. 1820; 3) перфторкарбоновые кислоты: трифторуксусную и пентафторпропионовую, чистоты 99% производства фирм Acros Organics (США) или Alfa Aesar (Германия) использовали без какой-либо очистки; 4) соли M(RfCOO), где М=Li, К, Na, Rb, Cs, NMe4, получали реакцией нейтрализации соответствующих кислот гидроксидами МОН в водной среде до рН 7 с последующим удалением воды в вакууме.
Пример 1. Получение K2[Pt(CF3COO)6] из гидроксосоединения платины
Кристаллический гидроксоплатинат калия K2[Pt(OH)6] (0,3753 г, 1 ммоль) нагревали до 60°С в круглодонной колбе с обратным холодильником при перемешивании с 10 мл трифторуксусной кислоты. Осадок гидроксосоединения полностью растворялся в течение 40 мин с образованием желто-оранжевого раствора. Остатки трифторуксусной кислоты из раствора удаляли в вакууме 30 Торр при 60°С. Получили твердое желтое вещество, состав которого отвечает K2[Pt(CF3COO)6]. Выход 99%. Данные химанализа: %С 15,38, %Pt 20,39 (рассч. %С 15,14, %Pt 20,51). Данные масс-спектроскопии (электрораспыление в ацетонитриле MeCN): положительный ион 1031 K3[Pt(CF3COO)6(MeCN)]+, отрицательные ионы 912 K[Pt(CF3COO)6]-, 1064 K2[Pt(CF3COO)7]-. ИК-спектры НПВО приведены в таблице.
Вещество устойчиво при хранении без доступа воздуха, поэтому рекомендуется хранить его в герметичной упаковке. При хранении на воздухе вещество, не изменяя своей окраски, постепенно гидролизуется с образованием оксокомплекса K2[PtO(CF3COO)4], который превращается в исходное соединение при растворении в трифторуксусной кислоте.
Пример 2. Получение M2[Pt(CF3COO)6], где М=Na, Li, Rb, Cs из гидрата двуокиси платины
Осажденный из водного раствора гидрат двуокиси платины РtO2·4 Н2O (Н2Рt(ОН)6) тщательно промывали метилацетатом или ацетоном и высушивали в вакууме над гидроксидом калия. Освобожденный от избытка адсорбированной воды гидрат двуокиси платины РtO2·4Н2O (0,280 г, 1 ммоль) нагревали до 60°С в круглодонной колбе с обратным холодильником при перемешивании со стехиометрическим количеством (2 ммоля) трифторацетатов M(CF3COO), где М=Na, Li, Rb, Cs. Осадок гидроксосоединения полностью растворялся в течение 60 мин с образованием желто-оранжевого раствора. Остатки трифторуксусной кислоты из раствора удаляли в вакууме 30 Торр при 60°С. Получили оранжевое твердое вещество, состав которого отвечает формуле M2[Pt(CF3COO)6]. Выход количественный. ИК-спектры НПВО приведены в таблице.
Вещества устойчивы при хранении без доступа воздуха.
Пример 3. Получение (NMe4)2[Pt(CF3COO)6] из трифторацетатного соединения Pt(CF3COO)4
0,200 г Pt(CF3COO)4 и 0,230 г [NMe4](CF3COO) растворяли 5 мл CF3COOH при нагревании с обратным холодильником до 70°С в течение 60 мин. Полученный бледно-желтый раствор с небольшой взвесью фильтровали через стеклянный пористый фильтр и удаляли остатки кислоты в вакууме 30 Торр при 60°С. Получили желтое гигроскопичное твердое вещество, состав которого отвечает формуле (NMe4)2[Pt(CF3COO)6]. Выход 95%. Вещество растворимо в метилацетате и нитрометане, нерастворимо в хлороформе. Данные масс-спектроскопии (электрораспыление в ацетонитриле): положительный ион 1095 [NMe4]3[Pt(CF3COO)6(MeCN)]+, отрицательные ионы 664 [Pt(CF3COO)4OH]-, 947 NMe4[Pt(CF3COO)6]-. ИК-спектры НПВО приведены в таблице. Строение соединения установлено методом рентгеноструктурного анализа.
Вещество устойчиво при хранении без доступа воздуха.
Пример 4. Получение K2[Pt(C2F5COO)6] из гидроксосоединения платины
Кристаллический гидроксоплатинат калия K2[Pt(OH)6] (0,1640 г, 0,44 ммоль) нагревали до 90°С в круглодонной колбе с обратным холодильником с 10 мл пентафторпропионовой кислоты. Осадок гидроксосоединения в ходе реакции полностью растворяется в течение 30 мин с образованием желто-коричневого раствора. Остатки пентафторпропионовой кислоты из раствора удаляли в вакууме 30 Торр при 60°С. Получили желто-оранжевое вещество состава K2[Pt(C2F5COO)6]. Выход 95% (0,4100 г). Данные химанализа: %С 17,86, %Pt 15,39 (рассч. %C 17,26, %Pt 15,59). Данные масс-спектроскопии (электрораспыление в ацетонитриле): положительный ион 556 [Pt(OH)(C2F5COO)2]+, отрицательные ионы 864 [Pt(C2F5COO)4(OH)]-, 1212 K[Pt(C2F5COO)6]-, 1769 K[Pt2(OH)2(C2F5COO)7(MeCN)4]-. ИК-спектры НПВО приведены в таблице.
Вещество устойчиво при хранении без доступа воздуха, поэтому рекомендуется хранить его в герметичной упаковке. При хранении на воздухе вещество, не изменяя своей окраски, постепенно гидролизуется с образованием оксокомплекса K2[PtO(C2F5COO)4], который превращается в исходное соединение при растворении в пентафторпропионовой кислоте.
Пример 5. Получение M2[Pt(C2F5COO6)], где М=Li, Na, Rb, Cs, NMe4 из гидрата двуокиси платины и солей пентафторпропионовой кислоты
Осажденный из водного раствора гидрат двуокиси платины РtO2·4Н2O (H2Pt(OH)6) тщательно промывали метилацетатом или ацетоном и высушивали в вакууме над гидроксидом калия. Освобожденный от избытка адсорбированной воды гидрат двуокиси платины РtO2·4Н2O (0,280 г, 1 ммоль) со стехиометрическим количеством (2 ммоля) пентафторпропионатов M(C2F5COO), где М=Na, Li, Rb, Cs, NMe4, нагревали при перемешивании до 80°С в круглодонной колбе с обратным холодильником с 10 мл пентафторпропионовой кислоты. Осадок гидроксосоединения в ходе реакции полностью растворялся в течение 160 мин с образованием желто-оранжевого раствора. Остатки пентафторпропионовой кислоты из раствора удаляли в вакууме 30 Торр при 60°С. Получено оранжевое твердое вещество, состав которого отвечает формуле M2[Pt(C2F5COO)6]. Выход количественный. ИК-спектры НПВО приведены в таблице.
Вещество устойчиво при хранении без доступа воздуха.
Пример 6. Получение Pt(CF3COO)4
Осажденный из водного раствора гидрат двуокиси платины РtO2·4Н2O (H2Pt(OH)6) тщательно промывали метилацетатом или ацетоном и высушивали в вакууме над гидроксидом калия. Освобожденный от избытка адсорбированной воды гидрат двуокиси платины РtO2·4Н2O (0,280 г, 1 ммоль) нагревали до 70°С при перемешивании в круглодонной колбе с обратным холодильником с 10 мл трифторуксусной кислоты. Осадок гидроксосоединения почти полностью растворялся в течение 60 мин с образованием желто-оранжевого раствора, небольшой осадок удаляли фильтрованием через стеклянный пористый фильтр. Остатки трифторуксусной кислоты из раствора удаляли в вакууме 30 Торр при 60°С. Получено оранжевое твердое вещество, состав которого отвечает формуле Pt(CF3COO)4. Выход 95%. Данные химанализа: %С 15,08, %Pt 30,19 (рассч. %С 14,84, %Pt 30,15). Данные масс-спектроскопии (электрораспыление в ацетонитриле): отрицательные ионы 664 [Pt(CF3COO)4(OH)]-, 682 [Pt(CF3COO)4(H2O)(OH)]-, 778 [Pt(CF3COO)5(H2O)]-, 1215 [Pt2(CF3COO)7(OH)]2-, 1365 [Pt2(CF3COO)8(H2O)3OH]-, 1592 [Pt3(CF3COO)8(H2O)(OH)5]-, 1595 [Pt3(CF3COO)8(H2O)4(OH)2]-, 1689 [Pt3(CF3COO)9(H2O)2(OH)3]-. ИК-спектры НПВО приведены в таблице.
Вещество устойчиво при хранении без доступа воздуха, поэтому рекомендуется хранить его в герметичной упаковке. При хранении на воздухе оно гидролизуется с образованием желтого оксокомплекса PtO(CF3COO)2, который превращается в исходное соединение при растворении в трифторуксусной кислоте.
Пример 7. Получение Pt(C2F5COO)4
Осажденный из водного раствора гидрат двуокиси платины РtO2·4Н2O (H2Pt(OH)6) тщательно промывали метилацетатом или ацетоном и высушивали в вакууме над гидроксидом калия. Освобожденный от избытка адсорбированной воды гидрат двуокиси платины РtO2·4Н2O (0,280 г, 1 ммоль) нагревали при перемешивании в круглодонной колбе с обратным холодильником до 90°С с 10 мл перфторпропионовой кислоты. Осадок гидроксосоединения в течение 1,5 часов почти полностью растворялся с образованием темно-коричневого раствора, небольшой осадок удаляли фильтрованием через стеклянный пористый фильтр. Остатки пентафторпропионовой кислоты из раствора удаляли в вакууме 30 Торр при 60°С. Получили желтое твердое вещество, состав которого отвечает формуле Pt(C2F5COO)4. Выход 90%. Данные химанализа: %С 17,38, %Pt 22,89 (рассч. %С 17,00, %Pt 23,03). Данные масс-спектроскопии (электрораспыление в ацетонитриле): отрицательные ионы 882 [Pt(CF3COO)4(OH)(H2O)]-. ИК-спектры НПВО приведены в таблице.
Вещество устойчиво при хранении без доступа воздуха в темноте. При хранении на свету в течение нескольких суток оно темнеет и разлагается.
|
Ниже приведены примеры, иллюстрирующие промышленную применимость заявляемых каталитически активных перфторкарбоксилатных соединений четырехвалентной платины.
Пример 8. Окисление циклогексана
В стеклянной ампуле 20 мг Pt(CF3COO)4 растворяли в 0,40 мл CF3COOH и прибавляли 0,05 мл циклогексана (ЦГ), после чего ампулу охлаждали и запаивали. Ампулу выдерживали в течение 0,5 ч при 100°С до почернения первоначально бледно-желтого раствора. Содержимое анализировали методом хроматомасс-спектрометрии. Единственный продукт окисления ЦГ - циклогексил-трифторацетат цикло-С6Н11ОСОСF3.
Пример 9. Окисление адамантана C10H16
В стеклянной ампуле 20 мг Pt(CF3COO)4 растворяли в 0,40 мл CF3COOH и прибавляли 0,50 г адамантана, после чего ампулу охлаждали и запаивали. Ампулу выдерживали в течение 0,5 ч при 100°С до почернения первоначально бледно-желтого раствора. Содержимое анализировали методом хроматомасс-спектрометрии. Единственный продукт окисления адамантана - 1-адамантилтрифторацетат C10H15OCOCF3.
Пример 10. Окисление бензола
В стеклянной ампуле 20 мг Pt(CF3COO)4 растворяли в 0,40 мл CF3COOH и прибавляли 0,05 мл бензола, после чего ампулу охлаждали и запаивали. Ампулу выдерживали в течение 1 ч при 100°С до изменения цвета раствора с бледно-желтого на темно-синий. Содержимое анализировали методом хроматомасс-спектрометрии. Единственный продукт окисления бензола - дифенил Ph2.
Пример 11. Окисление диэтилового эфира
В стеклянной ампуле 20 мг Pt(CF3COO)4 растворяли в 0,40 мл CF3COOH и прибавляли 0,1 мл диэтилового эфира, после чего ампулу охлаждали в жидком азоте и запаивали. Ампулу выдерживали в течение 4 ч при 100°С до изменения цвета раствора с бледно-желтого на темно-синий. Содержимое анализировали методом хроматомасс-спектрометрии. Единственный продукт окисления эфира - сложный эфир этиленгликоля 1,2-C2H4(OCOCF3)2.
Пример 12. Окисление пентана
В стеклянной ампуле 40 мг Pt(CF3COO)4 растворяли в 0,40 мл CF3COOH и прибавляли 0,05 мл н-пентана, после чего ампулу охлаждали и запаивали. Ампулу выдерживали в течение 2 ч при 100°С до почернения первоначально бледно-желтого раствора. Содержимое анализировали методом хроматомасс-спектрометрии. Продукты окисления н-пентана - сложные эфиры вторичных спиртов, два изомера пентилтрифторацетата C5H11OCOCF3.
Пример 13. Окисление гептана
В стеклянной ампуле 20 мг Pt(CF3COO)4 растворяли в 0,40 мл CF3COOH и прибавляли 0,05 мл н-гептана, после чего ампулу охлаждали и запаивали. Ампулу выдерживали в течение 3 ч при 100°С до почернения первоначально бледно-желтого раствора. Содержимое анализировали методом хроматомасс-спектрометрии. Продукты окисления н-гептана - три изомера вторичных гептилтрифторацетатов C7H15OCOCF3.
Пример 14. Каталитическое окисление алканов (RH) в присутствии K2[Pt(CF3COO)6] или Pt(CF3COO)4 (RH = циклогексан, н-пентан, н-гексан, н-гептан и др.)
К 3,0 мл трифторуксусного ангидрида малыми порциями при охлаждении холодной водой прибавляли 0,250 мл 50%-ной перекиси водорода и растворяли 0,050 г K2[Pt(CF3COO)6] или 0,040 г Pt(CF3COO)4. В стеклянные ампулы вносили 0,40 мл полученного бледно-желтого раствора и 0,05 мл алкана; образовывались две жидкие фазы, которые не смешивались между собой. Ампулу охлаждали в жидком азоте и запаивали. При комнатной температуре без перемешивания содержимое ампул постепенно становилось однофазным: слой углеводорода в ампуле уменьшался и полностью исчезал за 24 ч в результате окисления алкана с образованием втор-алкилтрифторацетатов. В реакционной смеси методом хроматомасс-спектрометрии обнаружились те же продукты, что и в реакциях стехиометрического окисления алканов под действием соединений четырехвалентной платины (примеры 8, 12 и 13), и следы исходных алканов. При этом каталитически активный комплекс платины не разрушался - раствор оставался бледно-желтым.
Пример 15. Каталитическое окисление метана
Аналогично окислению жидких алканов окисляли метан. Рассчитанное количество последнего конденсировали при -196°С в ампуле с 0,4 мл раствора окислителя, кислоты и катализатора, после чего ампулу запаивали и оставляли при комнатной температуре под давлением метана 20 атм. Метан за 24 ч окислялся в метилтрифторацетат, что подтверждено анализом содержимого ампулы методом хроматомасс-спектрометрии.
Таким образом, предлагаемое изобретение позволяет получить устойчивые перфторкарбоксилатные соединения четырехвалентной платины с высоким выходом.
Каталитически активные перфторкарбоксилатные соединения четырехвалентной платины, характеризующиеся устойчивостью при хранении без доступа воздуха, которые получают реакцией гидроксосоединения четырехвалентной платины K[Pt(OH)] или свежеприготовленного гидрата двуокиси платины РtO·4НO с перфторкарбоновой кислотой RCOOH, где R=CF, CF, при температурах от 40 до 70°С для R=CF и от 70 до 90°С для R=CF до получения гомогенного раствора, из которого затем удаляют остатки кислоты в вакууме при температуре не выше 60°С, полученные соединения отвечают формуле K[Pt(RCOO)] или Pt(RCOO), при этом перфторкарбоксилатные соединения четырехвалентной платины общей формулы M[Pt(RCOO)] (M=Li, К, Na, Rb, Cs, NMe) получают также нагреванием перфторкарбоксилата четырехвалентной платины Pt(RCOO) или гидрата двуокиси платины РtO·4НO со стехиометрическим количеством соли M(RCOO) в соответствующей кислоте RCOOH с последующим удалением ее остатков в вакууме при температуре не выше 60°С.
