Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ ГИСТОННОГО БЕЛКА В КАЧЕСТВЕ ИНГИБИТОРА АДЕНОВИРУСНОЙ ТРАНСДУКЦИИ
Вид РИД
Изобретение
Изобретение относится к применению гистонного белка для ингибирования аденовирусной инфекции эукариотических клеток и может быть использовано в медицине, ветеринарии, биологии для получения противовирусных лекарственных препаратов.
В настоящее время ведется активный поиск новых препаратов для терапии аденовирусной инфекции. Одним из направлений и наиболее близким аналогом настоящего изобретения является использование нейтрализирующих антитела к разным серотипам аденовирусов [1]. Нейтрализирующие антитела инактивируют инфекционный и/или репликативный потенциал аденовируса. Также потенциальными агентами в терапии аденовирусных инфекций можно рассматривать биспецифичные конъюгаты антител, которые имеют специфичность к нескольким поверхностным компонентам вируса [2]. Недостатками использования нейтрализирующих антител является их специфичность к определенному серотипу аденовуса, что ограничивает их применимость.
Использование рекомбинантного гистонного белка позволяет существенно снизить аденовирусную трансдукцию и расширить арсенал средств против аденовирусной инфекции.
Технический результат достигают тем, что для снижения трансдукции (инфекции) эукариотческих клеток аденовирусом используют рекомбинантный гистонный белок.
Под определением гистонный белок (гистон) подразумевают гистоны различных типов (коровые гистоны Н2А, Н2В, Н3, Н4 и линкерный гистон H1), включая N-бисметионин-гистона человека H1.3
Под определением АДЕНОВИРУС подразумевают любой вирус семейства Adenoviridae. Все представители семейства Adenoviridae обладают схожим строением и жизненным циклом. Это семейство безоболочечных ДНК-содержащих вирусов, представляющих из себя нуклеокапсиды икосаэдрической формы размером 90-100 нм. Аденовирусы вызывают различные заболевания у человека, в том числе инфекции дыхательных путей и желудочно-кишечного тракта. Особенно опасны аденовирусные инфекции для пациентов с ослабленным иммунитетом [3].
В качестве примера метода ингибирования аденовирусной инфекции мы используем рекомбнантный аденовирус серотипа 5 (Ad5-EGFP), сконструированный по технологии Gateway® (Invitrogen) и сохранивший основные свойства аденовируса дикого типа.
Аденовирус серотипа 5 связывается с рецептором CAR (англ. Coxsackie and adenovirus receptor) на поверхности клетки через головку фибры. Затем интегрины взимодействуют с пептидным мотивом RGD в пентонном основании (капсидный белок на основании фибры), и аденовирус проникает внутрь клетки посредством эндоцитоза, после чего вирус проникает в ядро клетки, где происходит его репликация (для аденовируса дикого типа).
Так как подобные стадии жизненного цикла присущи всем представителям семейства Adenoviridae, то предложенный метод будет эффективным и для других серотипов представителей семейства.
Возможность осуществления изобретения иллюстрируют примеры. Способ производят последовательно, например, в пять этапов.
Пример 1
Первый этап. Культивирование эукариотических клеток.
Все работы с культурой клеток проводят в стерильном ламинарном боксе согласно общепринятым правилам работы в лаборатории 2-го класса биобезопасности.
Культура клеток НЕК293А (фирма-производитель - Invitrogen, США) - иммортализированная линия первичных человеческих эмбриональных клеток почки, трансформированных фрагментами ДНК аденовируса типа 5 [4-5]. Клеточная линия содержит стабильно интегрированную в геном копию гена e1, который экспрессирует белки E1 (Е1а и E1b), необходимые для получения рекомбинантного аденовируса. Белки Е1а и E1b участвуют в трансактивации некоторых вирусных промоторов, что позволяет этим клеткам производить большое количество белка. Ген e1 также дополняет Е1-делецию в рекомбинантных аденовирусных векторах, что необходимо для репликации вируса.
Культура клеток HeLa - анеуплоидная линия эпителий-подобных клеток человека, поддерживаемая с 1951 года (АТСС number: CCL-2). Клетки HeLa получены из опухоли шейки матки пациентки Генриетты Лаке (Henrietta Lacks) они способны к бесконечному делению в отличие от обычных клеток, имеющих барьер Хейфлика.
Культуры эукариотических клеток НЕК293А и HeLa культивируют в среде DMEM (англ. Dulbecco′s modified Eagle′s medium) с добавлением 10% сыворотки крови плодов коровы (англ. Fetal Bovine Serum, FBS), 2 мМ L-глутамина и 1х смеси антибиотиков пенициллина и стрептомицина (фирма-производитель - ПанЭко, Россия). Клетки инкубируют при плюс 37°C, во влажной атмосфере, содержащей 5% СО2. Пересев клеток проводят при плотности клеточного монослоя 90% с применением 0,25% раствора трипсина-ЭДТА (фирма-производитель - Sigma-Aldrich, США).
Таким путем завершают получение клеточных культур НЕК293А и HeLa и приступают ко второму этапу.
Второй этап. Получение рекомбинантного аденовируса (Ad5-EGFP).
Рекомбинантный аденовирус Ad5-EGFP получают в несколько этапов.
Клонирование гена улучшенного зеленого флуоресцентного белка egfp (англ. Enhanced green fluorescent protein) из вектора-донора pDONR221-EGFP (plasmid ID №25899, фирма-производитель - AddGene) в аденовирусный плазмидный вектор pAd/CMV/V5-DEST (фирма-производитель - Invitrogen, США) проводят по технологии Gateway в результате реакции LR-рекомбинации. Плазмида pDONR221-EGFP. Плазмидный вектор pAd/CMV/V5-DEST содержит промотор CMV для эффективной экспрессии трансгена, геном аденовируса, рекомбинационные последовательности, участок начала репликации из pUC плазмиды, гены устойчивости к ампициллину и хлорамфениколу и сайты рестрикции РасI (фирма-производитель - Thermo Fisher Scientific Inc., США).
Рекомбинантного аденовируса Ad5-EGFP получают путем перевода аденовирусного вектора pAd/CMV/V5-DEST со вставкой гена egfp (pAd-EGFP) из кольцевой в линейную форму с помощью рестрикции ферментом РасI. Расщепление вектора способствует взаимодействию левого и правого инвертированных концевых повторов (англ. Inverted terminal repeats, ITRs) и удалению бактериальных последовательностей (а именно участка начала репликации pUC и гена устойчивости к ампициллину).
Сборка и репликация рекомбинантного аденовируса происходит в клетках линии НЕК293А. Трансфекцию клеток линии НЕК293А линейной плазмидой pAd-EGFP проводят трансфекционным агентом TurboFect (фирма-производитель - Thermo Fisher Scientific Inc., США) по методике, рекомендуемой производителем. После трансфекции каждые 2-3 суток меняют культральную среду на свежую, пока не станут заметны области цитопатического эффекта.
Цитопатический эффект является следствием продукции аденовируса, при которой нарушается нормальная жизнедеятельность клеток. При этом клетки становятся округлыми и открепляются от поверхности чашки. На 10 сутки после трансфекции клетки соскребают в культуральной среде, суспензию из лунки собирают в стерильную 2 мл пробирку. После сбора суспензии клеток проводили криолиз (несколько циклов замораживания (30 мин на -80°C)/оттаивания (15 мин 37°C)) с последующим центрифугированием (3000 об/мин 15 мин) для подготовки неочищенного вирусного лизата. Циклы замораживания/оттаивания способствуют лизису клеток и выходу внутриклеточных вирусных частиц. Вирусный сток хранят в 1 мл криофлаконах при -80°C.
Таким путем завершают получение раствора рекомбинантного аденовируса Ad5-EGFP и приступают к третьему этапу.
Третий этап. Приготовление раствора рекомбинантного гистона Н1.3.
Для приготовления рекомбинантного гистона Н1.3 (гистонного белка) делают навеску гистона HI.3 «Онкогист» (фирма-производитель - ИБХ РАН, Россия [6, 7]), растворяют в стерильной воде MilliQ до концентрации 50 мкг/мкл. Рабочий раствор гистона H1.3 хранят при плюс 4°C.
Четвертый этап. Трансдукция клеток НЕК293А рекомбинантным аденовирусом Ad5-EGFP.
Эксперименты проводят, например, в 6-луночных культуральных планшетах. Клетки НЕК293А культивируют в 6-луночном культуральном планшете до плотности монослоя 80-90%. Далее клетки инфицируют рекомбинантным аденовирусом Ad5-EGFP, экспрессирующим EGFP. Для этого к клеткам НЕК293А добавляют рекомбинантный аденовирус в серийных разведениях (от 10-4 до 10-9). После добавления раствора клетки инкубировали в течение ночи при 37°C во влажной атмосфере, содержащей 5% СО2. После инкубации культуральную среду меняют на среду, содержащую 0,8% агарозы (2 мл на лунку), и инкубируют в течение 48 часов при 37°C во влажной атмосфере, содержащей 5% СО2, после чего добавляют еще 1 мл среды, содержащей 0,8% агарозы. Через 5-7 дней в лунки добавляют 300 мкл раствора Crystal Violet (фирма-производитель - Invitrogen, США) в концентрации 100 мкг/мкл, инкубируют в течение 1 часа при 37°C во влажной атмосфере, содержащей 5% СО2, после чего лунки промывали дважды раствором DPBS и определяли количество бляшек в каждом разведении.
Для определения влияния рекомбинантного гистона Н 1.3 на способность аденовирусных частиц к образованию бляшек к рекомбинантному аденовирусу Ad5-EGFP в серийных разведениях добавляют гистон Н1.3 до конечной концентрации 250 мкг/мл и инкубируют смесь в течение 1 часа при комнатной температуре. После инкубации смесь добавляют к клеткам НЕК293А.
Пятый этап. Трансдукция клеток HeLa рекомбинантным аденовирусом Ad5-EGFP.
Эксперименты проводят, например, в 24-луночных культуральных планшетах. Клетки HeLa культивируют в 24-луночном планшете до плотности клеточного монослоя 50%. Далее клетки инфицируют рекомбинантным аденовирусом Ad5-EGFP, экспрессирующим EGFP. Для этого к клеткам HeLa добавляют рекомбинантный аденовирус с добавлением протамина сульфата (фирма-производитель - Sigma-Aldrich, США) до конечной концентрации 10 мкг/мл.
Клетки инкубируют в течение 48 часов при плюс 37°C, во влажной атмосфере, содержащей 5% СО2, после чего определяют степень инфицирования клеток рекомбинантным аденовирусом.
Инфицирование клеток определяют по экспрессии и флуоресценции EGFP, например, на проточном цитометре Guava easyCyte 8НТ Flow Cytometry System (фирма-производитель - Millipore, Германия) согласно инструкциям производителя. Ген egfp входит в состав генома рекомбинантного аденовируса и, таким образом, ведет себя как типичный вирусный ген. Таким образом, наличие зеленой флуоресценции клеток свидетельствует об успешной вирусной трансдукции.
Пример 2
Отличается от примера 1 тем, что на 5 этапе клетки HeLa (вместо протамина сульфата) обрабатывают смесью рекомбинантного аденовируса Ad5-EGFP и гистона Н1.3. Гистон Н1.3 добавляют в конечной концентрации 250 мкг/мл.
Концентрация 250 мкг/мл - максимально нетоксичная концентрация гистона для клеток HeLa (на сроках 24, 48 и 72 часа после добавления гистона H1.3). Эта концентрация - максимально безопасная (с точки зрения цитотоксичности) концентрация гистона Н1.3, которая является эффективной в данном случае, - была выбрана на основании проведенных нами ранее экспериментов [8]. В каждом конкретном случае количество гистона Н1.3 будет зависеть от клеточной культуры, от используемого аденовируса и возможно других факторов.
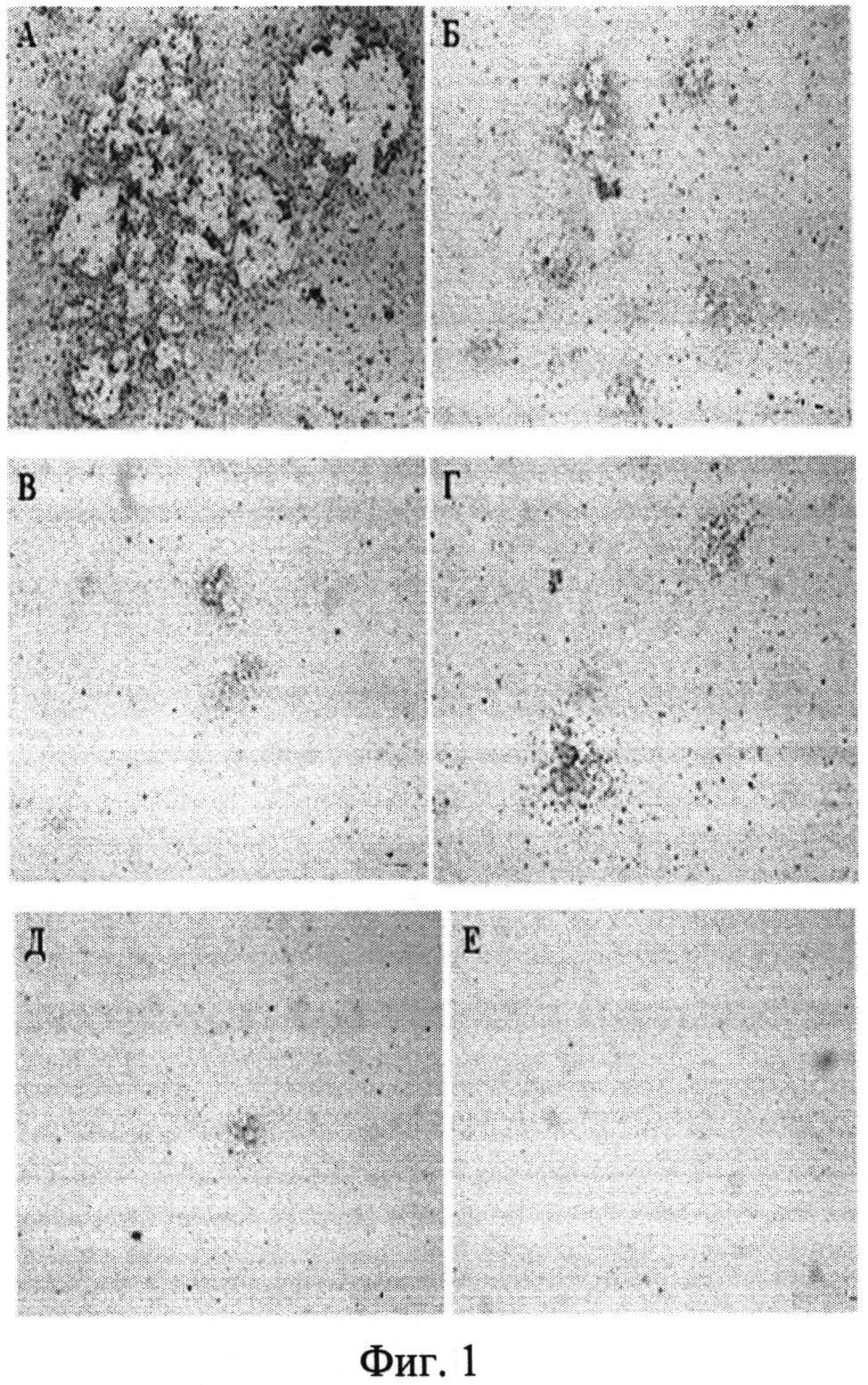
На Фигурах приведены данные проточной цитофлуориметрии и микроскопии клеток, трансдуцированных рекомбинантным аденовирусом серотипа 5, экспрессирующим улучшенный зеленый флуоресцентный белок EGFP. Фиг. 1. Влияние гистона Н1.3 на аденовирусную инфекцию. Клетки линии НЕК293А на 7 день после добавления рекомбинантного аденовируса Ad5-EGFP. А, Б, В - добавления аденовируса без добавления гистона. Г, Д, Е - добавление аденовируса преинкубированного с гистоном Н1.3. А, Г - разведение Ad5-EGFP 10-5. Б, Д - разведение Ad5-EGFP 10-6. В, Е - разведение Ad5-EGFP 10-7. Шкала: 500 мкм.
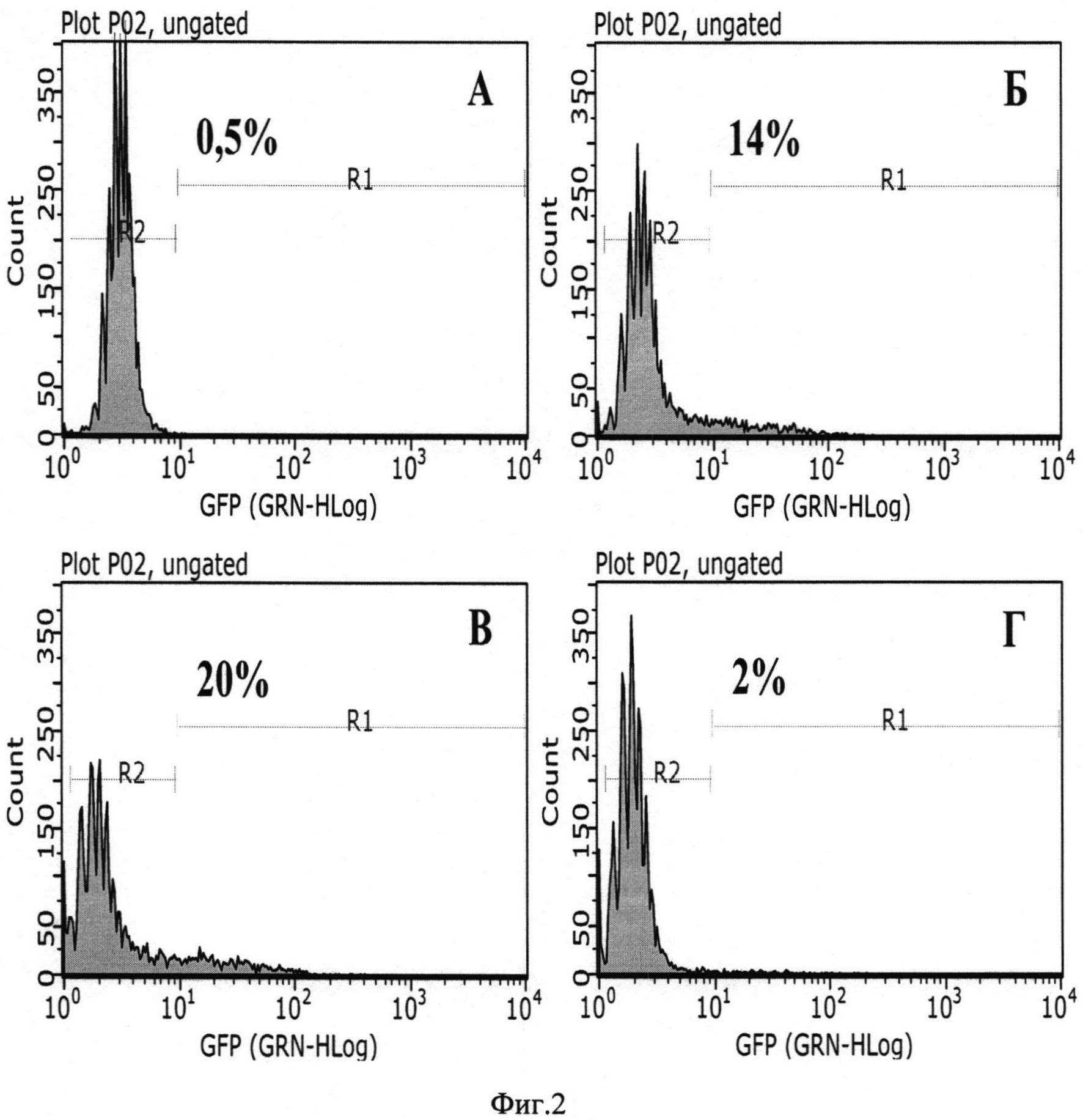
Фиг. 2А. Нетрансдуцированные клетки (контроль фоновой флуоресценции). В связи с тем, что популяция клеток обладает естественной гетерогенностью по уровню автофлуоресценции, пороговое значение флуоресценции было выбрано таким образом, что 99,5% клеток считались нефлуоресцирующими, а 0,5% клеток, соответственно, считались ложно-положительными по флуоресценции.
Фиг. 2. Проточная цитофлуориметрия клеток линии HeLa через 48 часов после аденовирусной трансдукции. А - нетрансдуцированный контроль (контроль фоновой флуоресценции, 0,5% GFP-позитивных клеток). Б - клетки HeLa, трансдуцированные рекомбинантным аденовирусом Ad5-EGFP (14% EGFP-позитивных клеток). В - клетки, трансдуцированные Ad5-EGFP с добавлением протамина сульфата (20% EGFP-позитивных клеток). Г - клетки, трансдуцированные смесью Ad5-EGFP и гистона Н1.3 (2% EGFP-позитивных клеток).
Анализ образования бляшек при инфицировании клеток линии НЕК293А рекомбинантным аденовирусом Ad5-EGFP показал, что преинкубация аденовируса с гистоном Н1.3 приводит к ингибированию процесса образования бляшек (Таблица). Было показано, что рекомбинантный гистон Н1.3 подавляет цитопатический эффект аденовируса Ad5-EGFP. Добавление гистона Н1.3 к аденовирусу в разведении 10-6 привело к сокращению образования бляшек на 87%. Добавление гистона Н1.3 к аденовирусу в разведении 10-7 привело к полному ингибированию образования бляшек (Фиг. 1).

Проточная цитофлуориметрия клеток линии HeLa через 48 часов после аденовирусной трансдукции показана на Фиг. 2
Фиг. 2Б. - Клетки, трансдуцированные рекомбинантным аденовирусом Ad5-EGFP. 14% клеток обладали флуоресценцией, что свидетельствует о трансдукции Ad5-EGFP.
Фиг. 2В. - Клетки, трансдуцированные рекомбинантным аденовирусом Ad5-EGFP с добавлением протамина сульфата. 20% клеток обладали флуоресценцией, что свидетельствует о трансдукции Ad5-EGFP. Таким образом, добавление протамина сульфата повысило эффективность вирусной трансдукции на 42% по отношению с Ad5-EGFP без дополнительных добавок.
Фиг. 2Г. - Клетки, трансдуцированные смесью рекомбинантного аденовируса Ad5-EGFP и рекомбинантного гистона Н1.3. 2% клеток обладали флуоресценцией, что свидетельствует об ингибировании вирусной трансдукции рекомбинантным гистоном Н1.3. Таким образом, смесь Ad5-EGFP с гистоном H1.3 снизила эффективность вирусной трансдукции на 86% по отношению с Ad5-EGFP без дополнительных добавок.
Приведенные примеры показывают возможную полезность изобретения в антиаденовирусной терапии. Применение рекомбинантного гистонного белка Н1.3 для ингибирования аденовирусной инфекции может найти применение в клеточной биологии, биотехнологии, ветеренарии и иммунологии.
Данное техническое решение также может найти применение для лечения заболеваний, связанных с аденовирусной инфекцией, посредством использования известных стандартных технических устройств и оборудования.
Источники информации
1. Sumida, S.M., et al., Neutralizing antibodies to adenovirus serotype 5 vaccine vectors are directed primarily against the adenovirus hexon protein. J Immunol, 2005. 174(11): p. 7179-85.
2. Cao, Y. and L. Lam, Bispecific antibody conjugates in therapeutics. Adv Drug Deliv Rev, 2003. 55(2): p. 171-97.
3. Kinchington, P.R., E.G. Romanowski, and Y. Jerold Gordon, Prospects for adenovirus antivirals. J Antimicrob Chemother, 2005. 55(4): p. 424-9.
4. Graham, F.L., et al., Characteristics of a human cell line transformed by DNA from human adenovirus type 5. J Gen Virol, 1977. 36(1): p. 59-74.
5. Harrison, Т., F. Graham, and J. Williams, Host-range mutants of adenovirus type 5 defective for growth in HeLa cells. Virology, 1977. 77(1): p. 319-29.
6. Gross P., J.H., Thiry M., Formicka-Zeppezauer G., Zeppezauer M., Bis-Met Histones, in World Intellectual Property Organization Patent Application. 2008, WO 2008/122434 A1.
7. Giglione, С., O. Vallon, and T. Meinnel, Control of protein life-span by N-terminal methionine excision. EMBO J, 2003. 22(1): p. 13-23.
8. Соловьева В.В. и др. Влияние рекомбинантного гистона Н1.3 на эффективность лентовирусной трансдукции клеток человека in vitro. Клеточная трансплантология и тканевая инженерия, 2012. 7(3): р. 151-154.
Применение рекомбинантного гистонного белка Н1.3 в качестве ингибитора аденовирусной трансдукции эукариотических клеток.