Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ 2Н-ХРОМЕНА В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩИХ СРЕДСТВ
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к лекарственным средствам, обладающим анальгезирующим действием.
Известны анальгезирующие средства, являющиеся по фармакологическому действию ненаркотическими анальгетиками, такие как ацетилсалициловая кислота, анальгин и другие [1]. Данные по активности на модели «уксусные корчи» (ED50) и острой токсичности (LD50) известных лекарственных средств приведены в [2] и отражены в таблице 1.
|
Недостатками ацетилсалициловой кислоты являются низкая активность и гастротоксичность; анальгина - возможное угнетение кроветворения, вплоть до полного агранулоцитоза.
Наиболее близким к заявляемому средству по фармакологическому действию - прототипом - является диклофенак натрия [3].
Недостатками диклофенака натрия являются желудочно-кишечные расстройства и гастротоксичность.
Задача, на решение которой направлено изобретение, заключается в поиске новых эффективных низкотоксичных лекарственных средств, обладающих анальгезирующей активностью.
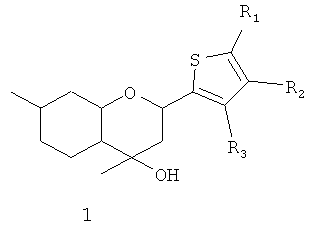
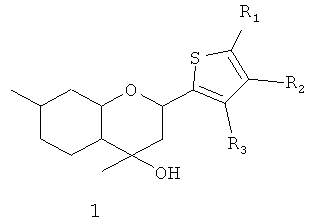
Поставленная задача решается путем использования в качестве анальгезирующего средства соединения общей формулы 1, включая его пространственные изомеры, в том числе оптически активные,

где R1, R2, R3, могут быть одинаковы или отличаться; и могут быть атомом водорода, алкильной группой, нитрогруппой, галогеном.
Соединение 1а, где R1=R2=R3=Н, было ранее синтезировано взаимодействием изопулегола 2 с тиофен-2-карбальдегидом в присутствии модифицированной монтмориллонитовой глины Н-К10 в условиях микроволнового облучения с выходом 50% [4].
Производные соединения 1а по ароматическому кольцу ранее не были описаны в литературе.

Нами показано, что соединение 1а может быть получено с выходом 78% взаимодействием изопулегола 2 с тиофен-2-карбальдегидом в присутствии коммерчески доступной монтмориллонитовой глины К10, без какой-либо ее предварительной химической модификации, и в отсутствии микроволнового облучения простым выдерживанием реакционной смеси без растворителя в течение 1-2 ч.
Производные соединения 1а по ароматическому кольцу могут быть синтезированы взаимодействием изопулегола 2 с замещенными тиофен-2-карбальдегидами в присутствии глины К10.
Для получения соединений общей формулы 1 в виде различных стереоизомеров, в том числе и в оптически активном виде, можно использовать в качестве исходных веществ различные пространственные изомеры соединения 2, в том числе и обладающие оптической активностью.
Анальгетическая активность соединений общей формулы 1 изучалась на моделях висцеральной боли «уксусные корчи» и термического раздражения «горячая пластинка» на белых беспородных мышах массой 20-22 г в группах по 8 животных при однократном введении в дозах 1÷20 мг/кг.
«Уксусные корчи» воспроизводили путем внутри брюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Оценка активности осуществлялась по количеству корчей в течение 3 мин.
Тест «горячая пластинка» характеризует термическое раздражение. Животных помещали на медную пластину, Т=54°С. Эффект оценивали по продолжительности нахождения животного на горячей пластине до первой «вокализации».
Обнаружено, что соединения общей формулы 1 в дозе 10 мг/кг обладают высокой анальгетической активностью в тесте «уксусные корчи», причем соединения 1a (R1=R2=R3=H) и 1г (R1=Н, R2=Br, R3=Н) превосходят по эффективности диклофенак натрия, взятый в той же дозе (таблица 2).
|
Данные по изучению анальгетической активности в тесте «горячая пластинка» представлены в Таблице 3. Достоверную анальгетическую активность в этом тесте проявило соединение 1а (R1=R2=R3=Н).
|
Для соединения 1а, проявившего высокую активность в обоих тестах, был изучен дозозависимый эффект (Таблица 4). Из полученных данных видно, что соединение 1а сохраняет высокую анальгетическую активность в обоих тестах в дозе 1 мг/кг, не уступая при этом по эффективности препарату сравнения диклофенаку натрия, взятому в дозе 10 мг/кг (Таблицы 2 и 3).
|
Острую токсичность соединения 1а определяли на белых беспородных мышах массой 20-22 г при однократном внутрижелудочном введении по методу Кербера. Показано, что соединение 1а является умереннотоксичным веществом: ЛД50 превышает 1500 мг/кг, а терапевтический индекс (IS50) составляет более 1500. Таким образом, соединение 1а существенно менее токсично, чем диклофенак натрия (ЛД50 370 мг/кг [2]), и значительно превосходит его по широте терапевтического индекса (IS50 диклофенака натрия равен 74 [2]).
Исходя из вышесказанного можно заключить, что соединения общей формулы 1 проявляют высокую анальгетическую активность в тесте висцеральной боли «уксусные корчи». Соединение 1а сочетает высокую анальгетическую активность в тестах «уксусные корчи» и «горячая пластинка» и низкую острую токсичность.
Соединения общей формулы 1, после проведения углубленных фармакологических исследований, могут использоваться как в чистом виде, так и в качестве компонента новых низкотоксичных высокоэффективных анальгезирующих лекарственных форм.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез 4,7-диметил-2-(тиофен-2-ил)октагидро-2H-хромен-4-ола 1а.

К суспензии 1.3 г глины К10 в 5 мл CH2Cl2 прибавили раствор 0.29 г тиофен-2-карбоксальдегида в 3 мл CH2Cl2, затем прибавили раствор 0.400 г изопулегола 2 в 3 мл CH2Cl2. Растворитель отогнали и оставили реакционную смесь при комнатной температуре на 60 минут. Затем добавили 10 мл EtOAc, отфильтровали катализатор и отогнали растворитель. Полученную смесь делили на колонке с 13 г силикагеля, элюент - раствор, содержащий от 0 до 100% этилацетата в гексане. Получили 0.543 г (78%) соединения 1а. Спектр ЯМР 1H соединения 1а соответствует спектру, опубликованному в литературе [4].
Пример 2. Синтез 4,7-диметил-2-(3-метилтиофен-2-ил)октагидро-2H-хромен-4-ола 1б.

Аналогично Примеру 1, взаимодействием 0.300 г изопулегола 2 с 0.25 г 3-метилтиофен-2-карбоксальдегида в присутствии 1.1 г глины К10 в течение 120 минут получили 0.381 г (70%) соединения 1б.
Спектр ЯМР 1Н (CDCl3): 0.88-0.97 (m, 1Н, Ha-8); 0.92 (d, J(16, 9a)=6.6 Hz, 3H, H-16); 1.03 (dddd, J(7a, 7e)=J(7a, 8a)=12.8 Hz, J(7a, 6a)=12.1 Hz, J(7a, 8e)=3.3 Hz, 1Н, Ha-7); 1.11 (ddd, J(10a, 10e)=J(10a, 9a)=12.2 Hz, J(10a, 1a)=10.8 Hz, 1Н, Ha-10); 1.28 (d, J(15, 4a)=0.7 Hz, 3H, H-15); 1.31 (ddd, J(6a, 7a)=12.1 Hz, J(6a, 1a)=10.2 Hz, J(6a, 7e)=3.3 Hz, 1Н, Ha-6); 1.40-1.53 (m, 2H, Ha-9, OH); 1.72 (ddddd, J(8e, 8a)=12.9 Hz, J(8e, 7a)=J(8e, 9a)=J(8e, 7e)=3.3 Hz, J(8e, 10e)=2.0 Hz, 1Н, He-8); 1.85 (ddq, J(4a, 4e)=12.7 Hz, J(4a, 3a)=11.7 Hz, J(4a, 15)=0.7 Hz, 1Н, Ha-4); 1.91-1.97 (m, 1Н, He-7); 1.95 (dd, J(4e, 4a)=12.7 Hz, J(4e, 3a)=2.4 Hz, 1Н, He-4); 1.99 (dm, J(10e, 10a)=12.2 Hz, 1Н, He-10); 2.19 (s, 3H, H-17); 3.26 (ddd, J(1a, 10a)=10.8 Hz, J(1a, 6a)=10.2 Hz, J(1a, 10e)=4.3 Hz, 1Н, Ha-1); 4.71 (dd, J(3a, 4a)=11.7 Hz, J(3a, 4e)=2.4 Hz, 1Н, Ha-3); 6.75 (d, J(13, 12)=5.0 Hz, 1Н, H-13); 7.09 (d, J(12, 13)=5.0 Hz, 1Н, H-12). Спектр ЯМР 13С (CDCl3): 77.63 (d, C-1); 71.09 (d, C-3); 49.70 (t, C-4); 70.64 (s, C-5); 51.91 (d, C-6); 22.94 (t, C-7); 34.26 (t, C-9); 41.32 (t, C-10); 138.34 (s, C-11); 122.92 (d, C-12); 129.72 (d, C-13); 133.29 (s, C-14); 21.09 (q, C-15); 22.03 (q, C-16); 13.63 (q, C-17). MC: найдено 280.1488 (M+, (C16H24O2S)+; расч. 280.1492).
Пример 3. Синтез 4,7-диметил-2-(5-метилтиофен-2-ил)октагидро-2H-хромен-4-ола 1в.

Аналогично Примеру 1, взаимодействием 0.300 г изопулегола 2 с 0.25 г 5-метилтиофен-2-карбоксальдегида в присутствии 1.1 г глины К10 в течение 120 минут получили 0.386 г (71%) соединения 1в.
Спектр ЯМР 1Н (CDCl3): 0.87-0.96 (m, 1Н, Ha-8); 0.92 (d, J(16, 9a)=6.6 Hz, 3H, H-16); 1.02 (dddd, J(7a, 7e)=J(7a, 8a)=12.8 Hz, J(7a, 6a)=12.2 Hz, J(7a, 8e)=3.3 Hz, 1Н, Ha-7); 1.09 (ddd, J(10a, 10e)=J(10a, 9а)-12.3 Hz, J(10a, 1a)=10.8 Hz, 1H, Ha-10); 1.25 (d, J(15, 4a)=0.8 Hz, 3H, H-15); 1.28 (ddd, J(6a, 7a)=12.2 Hz, J(6a, 1a)=10.2 Hz, J(6a, 7e)=3.3 Hz, 1H, Ha-6); 1.39-1.52 (m, 2H, Ha-9, OH); 1.72 (ddddd, J(8e, 8a)=12.8 Hz, J(8e, 7a)=J(8e, 9a)-J(8e, 7e)=3.3 Hz, J(8e, 10e)=2.0 Hz, 1H, He-8); 1.86 (ddq, J(4a, 4e)=12.7 Hz, J(4a, 3a)=11.7 Hz, J(4a, 15)=0.8 Hz, 1H, Ha-4); 1.93 (dddd, J(7e, 7a)=12.8 Hz, J(7e, 6a)=J(7e, 8a)=J(7e, 8e)=3.3 Hz, 1H, He-7); 1.99 (dm, J(10e, 10a)=12.3 Hz, 1H, He-10); 2.01 (dd, J(4e, 4a)=12.7 Hz, J(4e, 3a)=2.2 Hz, 1H, He-4); 2.42 (d, J(17, 13)=1.1 Hz, 3H, H-17); 3.24 (ddd, J(1a, 10a)=10.8 Hz, J(1a, 6a)=10.2 Hz, J(1a, 10e)=4.3 Hz, 1H, Ha-1); 4.59 (dd, J(3a, 4a)=11.7 Hz, J(3a, 4e)=2.2 Hz, 1H, Ha-3); 6.56 (dq, J(13, 14)=3.4 Hz, J(13, 17)=1.1 Hz, 1H, H-13); 6.73 (d, J(14, 13)=3.4 Hz, 1H, H-14). Спектр ЯМР 13С (CDCl3): 77.43 (d, C-1); 72.54 (d, C-3); 49.58 (t, C-4); 70.69 (s, C-5); 51.89 (d, C-6); 22.93 (t, C-7); 34.26 (t, C-8); 31.38 (d, C-9); 41.35 (t, C-10); 142.89 (s, C-11); 139.12 (s, C-12); 124.26 (d, C-13); 123.50 (d, C-14); 21.17 (q, C-15); 22.04 (q, C-16); 15.16 (q, C-17). MC: найдено 280.1491 (М+, (C16H24O2S)+; расч. 280.1492).
Пример 4. Синтез 4,7-диметил-2-(4-бромтиофен-2-ил)октагидро-2H-хромен-4-ола 1г.

Аналогично Примеру 1, взаимодействием 0.300 г изопулегола 2 с 0.37 г 4-бромтиофен-2-карбоксальдегида в присутствии 1.4 г глины К10 в течение 120 минут получили 0.499 г (74%) соединения 1г.
Спектр ЯМР 1Н (CDCl3): 0.87-0.96 (m, 1H, На-8); 0.93 (d, J(16, 9а)=6.6 Hz, 3H, Н-16); 1.02 (dddd, J(7a, 7e)=J(7a, 8a)=12.8 Hz, J(7a, 6a)=12.1 Hz, J(7a, 8e)=3.2 Hz, 1H, Ha-7); 1.10 (ddd, J(10a, 10e)=J(10a, 9a)=12.2 Hz, J(10a, 1a)=11.1 Hz, 1H, Ha-10); 1.26 (d, J(15, 4a)=0.7 Hz, 3H, H-15); 1.29 (ddd, J(6a, 7a)=12.1 Hz, J(6a, 1a)=10.1 Hz, J(6a, 7e)=3.2 Hz, 1H, Ha-6); 1.39-1.50 (m, 1H, Ha-9); 1.56 (br. s, OH); 1.72 (dm, J(8e, 8a)=12.8 Hz, другие J<3.5 Hz, 1H, He-8); 1.82 (ddq, J(4a, 4e)=12.7 Hz, J(4a, 3a)=l 1.7 Hz, J(4a, 15)=0.7 Hz, 1H, Ha-4); 1.93 (dddd, J(7e, 7a)=12.8 Hz, J(7e, 6a)=J(7e, 8a)=J(7e, 8e)=3.2 Hz, 1H, He-7); 1.99 (dddd, J(10e, 10a)=12.8 Hz, J(10e, 1a)=4.3 Hz, J(10e, 9a)=3.7 Hz, J(10e, 8e)=2.0 Hz, 1H, He-10); 2.01 (dd, J(4e, 4a)=12.7 Hz, J(4e, 3a)=2.2 Hz, 1H, He-4); 3.26 (ddd, J(1a, 10a)=11.1 Hz, J(1a, 6a)=10.1 Hz, J(1a, 10e)=4.3 Hz, 1H, Ha-1); 4.62 (ddd, J(3a, 4a)=11.7 Hz, J(3a, 4e)=2.2 Hz, J(3a, 14)=0.8 Hz, 1H, Ha-3); 6.86 (dd, J(14, 12)=1.5 Hz, J(14, 3a)=0.8 Hz, 1H, H-14); 7.11 (d, J(12, 14)=1.5 Hz, 1H, H-12). Спектр ЯМР 13С (CDCl3): 77.65 (d, C-1); 72.07 (d, C-3); 49.54 (t, C-4); 70.52 (s, C-5); 51.82 (d, C-6); 22.89 (t, C-7); 34.20 (t, C-8); 31.36 (d, C-9); 41.22 (t, C-10); 146.74 (s, C-11); 121.72 (d, C-12); 108.88 (s, C-13); 126.11 (d, C-14); 21.16 (q, C-15); 22.02 (q, C-16). MC: найдено 344.0442 (M+, (C15H21O2SBr)+; расч. 344.0440).
Пример 5. Синтез 4.7-диметил-2-(5-бромтиофен-2-ил)октагидро-2H-хромен-4-ола 1д.

Аналогично Примеру 1, взаимодействием 0.300 г изопулегола 2 с 0.37 г 5-бромтиофен-2-карбоксальдегида в присутствии 1.4 г глины К10 в течение 120 минут получили 0.512 г (76%) соединения 1д.
Спектр ЯМР 1Н (CDCl3): 0.87-0.96 (m, 1H, На-8); 0.92 (d, J(16, 9а)=6.6 Hz, 3H, H-16); 1.02 (dddd, J(7a, 7e)=J(7a, 8a)=12.8 Hz, J(7a, 6a)=12.2 Hz, J(7a, 8e)=3.3 Hz, 1H, Ha-7); 1.09 (ddd, J(10a, 10e)=J(10a, 9a)=12.2 Hz, J(10a, 1a)=10.8 Hz, 1H, Ha-10); 1.25 (d, J(15, 4a)=0.8 Hz, 3H, H-15); 1.28 (ddd, J(6a, 7a)=12.2 Hz, J(6a, 1a)=10.2 Hz, J(6a, 7e)=3.3 Hz, 1H, Ha-6); 1.37-1.50 (m, 2H, Ha-9, OH); 1.72 (dm, J(8e, 8a)=12.8 Hz, другие J<3.5 Hz, 1H, He-8); 1.81 (ddq, J(4a, 4e)=12.7 Hz, J(4a, 3a)=11.8 Hz, J(4a, 15)=0.8 Hz, 1H, Ha-4); 1.92 (dddd, J(7e, 7a)=12.8 Hz, J(7e, 6a)=J(7e, 8a)=J(7e, 8e)=3.3 Hz, 1H, He-7); 1.98 (dddd, J(10e, 10a)=12.2 Hz, J(10e, 1a)=4.3 Hz, J(10e, 9a)=3.7 Hz, J(10e, 8e)=2.0 Hz, 1H, He-10); 2.01 (dd, J(4e, 4a)=12.7 Hz, J(4e, 3a)=2.2 Hz, 1H, He-4); 3.24 (ddd, J(1a, 10a)=10.8 Hz, J(1a, 6a)=10.2 Hz, J(1a, 10e)=4.3 Hz, 1H, Ha-1); 4.59 (ddd, J(3a, 4a)=11.8 Hz, J(3a, 4e)=2.2 Hz, J(3a, 14)=0.8 Hz, 1H, Ha-3); 6.68 (dd, J(14, 13)=3.8 Hz, J(14, 3a)=0.8 Hz, 1H, H-14); 6.86 (d, J(13, 14)=3.8 Hz, 1H, H-13). Спектр ЯМР 13С (CDCl3): 77.58 (d, C-1); 72.53 (d, C-3); 49.42 (t, C-4); 70.54 (s, C-5); 51.84 (d, C-6); 22.89 (t, C-7); 34.20 (t, C-8); 31.35 (d, C-9); 41.23 (t, C-10); 147.17 (s, C-11); 111.45 (s, C-12); 129.01 (d, C-13); 123.55 (d, C-14); 21.16 (q, C-15); 22.02 (q, C-16). MC: найдено 344.0442 (M+, (C15H21O2SBr)+; расч. 344.0440).
Пример 6. Синтез 4,7-диметил-2-(5-нитротиофен-2-ил)октагидро-2H-хромен-4-ола 1е.

Аналогично Примеру 1, взаимодействием 0.400 г изопулегола 2 с 0.407 г 5-нитротиофен-2-карбоксальдегида в присутствии 1.6 г глины К10 в течение 60 минут получили 0.400 г (50%) соединения 1е.
Спектр ЯМР 1Н (CDCl3): 0.86-0.95 (m, 1Н, Ha-8); 0.93 (d, J(16, 9а)=6.6 Hz, 3Н, Н-16); 1.01 (dddd, J(7a, 7e)=J(7a, 8a)=12.8 Hz, J(7a, 6a)=12.1 Hz, J(7a, 8e)=3.4 Hz, 1Н, Ha-7); 1.09 (ddd, J(10a, 10e)=J(10a, 9a)=12.2 Hz, J(10a, 1a)=10.9 Hz, 1Н, Ha-10); 1.26 (d, J(15, 4a)-0.7 Hz, 3Н, H-15); 1.29 (ddd, J(6a, 7a)=12.1 Hz, J(6a, 1a)=10.2 Hz, J(6a, 7e)=3.2 Hz, 1Н, Ha-6); 1.39-1.50 (m, 1Н, Ha-9); 1.72 (dm, J(8e, 8a)=12.8 Hz, другие J<3.5 Hz, 1Н, He-8); 1.75 (ddq, J(4a, 4e)=12.8 Hz, J(4a, 3a)=11.9 Hz, J(4a, 15)=0.7 Hz, 1Н, Ha-4); 1.92 (dddd, J(7e, 7a)=12.8 Hz, J(7e, 6a)=J(7e, 8a)=J(7e, 8e)=3.2 Hz, 1Н, He-7); 1.99 (dddd, J(10e, 10a)=12.2 Hz, J(10e, 1a)=4.3 Hz, J(10e, 9a)=3.7 Hz, J(10e, 8e)=1.9 Hz, 1Н, He-10); 2.04 (dd, J(4e, 4a)=12.8 Hz, J(4e, 3a)=2.2 Hz, 1Н, He-4); 3.27 (ddd, J(1a, l0a)=10.9 Hz, J(1a, 6a)=10.2 Hz, J(1a, 10e)=4.3 Hz, 1Н, Ha-1); 4.65 (ddd, J(3a, 4a)=11.9 Hz, J(3a, 4e)=2.2 Hz, J(3a, 14)=0.9 Hz, 1Н, Ha-3); 6.82 (dd, J(14, 13)=4.2 Hz, J(14, 3a)=0.9 Hz, 1Н, H-14); 7.75 (d, J(13, 14)=4.2 Hz, 1Н, H-13). Спектр ЯМР 13C (CDCl3): 77.81 (d, C-1); 72.38 (d, C-3); 49.42 (t, C-4); 70.25 (s, C-5); 51.68 (d, C-6); 22.78 (t, C-7); 34.09 (t, C-8); 31.25 (d, C-9); 41.04 (t, C-10); 154.79 (s, C-11); 150.56 (s, C-12); 128.17 (d, C-13); 121.75 (d, C-14); 21.01 (q, C-15); 21.95 (q, C-16). MC: найдено 311.1185 (M+, (C15H21O4NS)+; расч. 311.1186).
Пример 7. Исследование анальгетической активности соединений общей формулы 1 в тесте «уксусные корчи».
Эксперимент проводили на беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой. «Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на одно животное. Исследуемые агенты вводили однократно внутрижелудочно за час до воспроизведения модели. Контролем являлись животные с введением только уксусной кислоты. Оценка активности осуществлялась по количеству корчей в течение 3 мин.
Результаты приведены в таблицах 2 и 4.
Установлено, что соединения общей формулы 1 обладают высокой анальгетической активностью в тесте «уксусные корчи».
Пример 8. Исследование анальгетической активности соединения 1 в тесте «горячая пластинка».
Опыты проводили на беспородных мышах-самцах массой 22-25 г. Экспериментальные группы были сформированы по 8 животных в каждой. Животных помещали на медную пластину Т=54°С. Эффект оценивали по продолжительности нахождения животного на горячей пластине до первой «вокализации», в секундах.
Исследуемые агенты вводились однократно внутрижелудочно за час до воспроизведения модели. Контрольным животным вводили соответствующий растворитель. Результаты представлены в таблицах 3 и 4.
Установлено, что соединение 1а обладает высокой анальгетической активностью в тесте «горячая пластинка».
Источники информации
1. Машковский М.Д. Лекарственные средства. Т.1. М.: Медицина. 2007.
2. Сюбаев Р.Д., Машковский М.Д., Шварц Г.Я., Покрышкин В.И. Сравнительная фармакологическая активность современных нестероидных противовоспалительных препаратов. Хим.-фарм. журн. 1986. Т.20. №1. С.33-39.
3. Справочник Видаль. Лекарственные препараты в России: Справочник. М.: АстраФармСервис. 2002. З-90.
4. Baishya G., Sarmah В., Hazarika N. Synlett 2013, Vol. 24, P. 1137-1141.
Применение соединения общей формулы 1, включая его пространственные изомеры, в том числе оптически активные, где R, R, R могут быть одинаковы или отличаться, и могут быть атомом водорода, алкильной группой, нитрогруппой, галогеном, в качестве анальгезирующего средства.