Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ РАБЕПРАЗОЛ НАТРИЯ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к фармацевтической промышленности и медицине, а именно к производству лекарственных препаратов для лечения кислотозависимых заболеваний, таких как язвенная болезнь желудка и двенадцатиперстной кишки, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), но не ограничивается этим [1].
Изобретение представляет собой фармацевтическую композицию в форме таблетки, покрытой кишечнорастворимой оболочкой, состоящую из активного вещества - рабепразола натрия, вспомогательных веществ таблетки-ядра, разделительной прослойки и кишечнорастворимой оболочки, а также способ ее получения.
Основное направление применения изобретения - лечение заболеваний, таких как:
- язвенная болезнь двенадцатиперстной кишки в стадии обострения;
- язвенная болезнь желудка в стадии обострения и язва анастомоза;
- эрозивная и язвенная гастроэзофагеальная рефлюксная болезнь (ГЭРБ) или рефлюкс-эзофагит;
- поддерживающая терапия ГЭРБ;
- неэрозивная рефлюксная болезнь (НЭРБ);
- синдром Золлингера-Эллисона или другие состояния, характеризующиеся патологической гиперсекрецией.
В составе комбинированной терапии с антибактериальными средствами:
- эрадикация Helicobacter pylori у пациентов с язвенной болезнью желудка и 12-перстной кишки или хроническим гастритом;
- лечение и предупреждение рецидивов язвы у пациентов с язвенной болезнью, связанной с Helicobacter pylori [2].
По классификации АТХ в группу A02B «Противоязвенные препараты и препараты для лечения гастроэзофагеального рефлюкса» входят пять подгрупп:
- A02BA Блокаторы Н2-гистаминовых рецепторов;
- A02BB Простагландины;
- A02BC Ингибиторы протонового насоса (ингибиторы протонной помпы);
- A02BD Комбинации препаратов для эрадикации Helicobacter pylori;
- A02BX Прочие противоязвенные препараты и препараты для лечения гастроэзофагеального рефлюкса.
В практической медицине применяется две группы антисекреторных препаратов: H2-блокаторы гистаминовых рецепторов (ранитидин, фамотидин, низатидин, роксатидин) и ингибиторы протонной помпы (омепразол, лансопразол, рабепразол, пантопразол, эзомепразол), позволяющие поддерживать оптимальный уровень pH желудка в течение суток и обладающие минимумом побочных эффектов. Ингибиторы протонной помпы (ИПП) являются последней генерацией антисекреторных средств, действующих непосредственно на протонную помпу париетальной клетки, необратимо ингибируя ее активность и обеспечивая выраженный антисекреторный эффект независимо от природы кислотостимулирующего фактора [4].
Недостатком H2-блокаторов является отсутствие ингибирующего влияния на секрецию соляной кислоты, вызванную повышением вагусного тонуса, что делает их менее эффективными у больных с черепно-мозговой травмой или после нейрохирургических вмешательств. Наиболее частым побочным эффектом H2-блокаторов являются: головная боль, диспепсия, диарея. Более редко отмечено возникновение тромбоцитопении, аритмии, гипотензии и др. Антагонисты H2-гистаминовых рецепторов выделяются почками, поэтому их дозу следует корректировать у пациентов со сниженным клиренсом креатинина. H2-блокаторы взаимодействуют с широким спектром лекарственных средств (опиоидные анальгетики, анксиолитики, снотворные, нейролептики, антиаритмические препараты). Фамотидин и низатидин участвуют в лекарственных взаимодействиях в меньшей степени, чем остальные представители группы H2-блокаторов.
Преимущества ИПП перед H2-блокаторами обусловлены отсутствием способности вызывать тахифилаксию. Это позволяет рассматривать ИПП как препараты с лучшей предсказуемостью эффекта, обеспечивающие более точный контроль pH, чем H2-блокаторы.
Преимуществом представителей группы ИПП по сравнению H2-блокаторами является доказанная клиническая эффективность в профилактике и лечении повреждений ЖКТ и ЖКК вследствие более сильного подавления секреции соляной кислоты [5].
В целом при лечении кислотозависимых заболеваний ИПП имеют ряд преимуществ перед прочими антисекреторными средствами, в первую очередь блокаторами H2-рецепторов гистамина, что обусловлено их более сильным, быстрым, продолжительным и достаточно предсказуемым антисекреторным действием. При этом для достижения антисекреторного эффекта обычно требуется небольшая доза препарата. Лекарственные средства данной группы практически не имеют побочных эффектов, что делает возможным их продолжительное применение в качестве поддерживающей терапии. Длительный прием ИПП сопровождается низким риском развития диспепсических расстройств и лекарственного взаимодействия [4].
Рабепразол отличается от омепразола структурой радикалов на пиридиновом и имидазольном кольцах. Особенность его химического строения обеспечивает более быстрое ингибирование протонной помпы благодаря способности активироваться в достаточно широком диапазоне pH. Кроме того, часть рабепразола метаболизируется неферментным путем. Биодоступность рабепразола составляет 51,8% (не изменяется после повторного приема препарата), связывание с белками плазмы - 96,3%, максимальная концентрация препарата в плазме достигается через 3-4 часа после приема, а период полужизни составляет 1 час. Подавление желудочной секреции при применении этого препарата является дозозависимым. Так, при использовании рабепразола в дозе 20 мг/сут уровень pH на седьмой день приема составил 4,2 (до лечения - 1,86, в первый день приема - 3,7), а в дозе 40 мг/сут - 4,7 (до лечения - 2,0, в первый день приема - 4,4). По результатам ряда исследований прием пищи достоверно влияет на фармакокинетику препарата. Частота рубцевания язв ДНК при приеме рабепразола в дозе 40 мг/сут через четыре недели лечения достигает 91% [4].
Известны лекарственные препараты, с активным веществом рабепразол натрия с дозировкой 10 мг и 20 мг - «Париет®», «Золиспан», «Зульбекс®», «Хайрабезол», «Нофлюкс», «Берета» в форме таблеток, покрытых кишечнорастворимой оболочкой.
Наиболее близким аналогом (прототипом) настоящего изобретения является лекарственный препарат «Париет®».
Состав препарата для дозировки 10 мг:
- активное вещество: рабепразол натрий, 10 мг, что в пересчете соответствует 9,42 мг рабепразола, соответственно;
- вспомогательные вещества: маннит (маннитол) - 26,0 мг, магния оксид - 44,7 мг, гидроксипропилцеллюлоза слабозамещенная (гипролоза) - 13 мг, гидроксипропилцеллюлоза (гипролоза) - 4,0 мг, магния стеарат - 1,0 мг, этилцеллюлоза - 0,7 мг, гипромеллозы фталат - 8,5 мг, диацетилированный моноглицерид - 0,85 мг, тальк - 0,80 мг, титана диоксид (E171) - 0,43 мг, железа оксид красный (E172) - 0,02 мг, карнаубский воск - 0,0015 мг, чернила пищевые серые F6 (белый шеллак, железа оксид черный, этанол дегидратированный, 1-Бутанол) [3].
Состав препарата для дозировки 20 мг:
- активное вещество: рабепразол натрий, 20 мг, что в пересчете соответствует 18,85 мг рабепразола, соответственно;
- вспомогательные вещества: маннит (маннитол) - 40,0 мг, магния оксид - 63,0 мг, гидроксипропилцеллюлоза слабозамещенная (гипролоза) - 19,5 мг, гидроксипропилцеллюлоза (гипролоза) - 3,0 мг, магния стеарат - 1,5 мг, этилцеллюлоза - 1,0 мг, гипромеллозы фталат - 12,0 мг, диацетилированный моноглицерид - 1,2 мг, тальк - 1,13 мг, титана диоксид (E171) - 0,6 мг, железа оксид желтый - 0,07 мг, карнаубский воск - 0,02 мг, чернила пищевые красные A1 (белый шеллак, железа оксид красный, карнаубский воск, сложный эфир глицериновой кислоты, этанол дегидратированный, 1-Бутанол) [3].
Недостатком данного лекарственного средства является образование и увеличение посторонних примесей при хранении, которые не обладают антисекреторной активностью и, как следствие, могут снижать активность действующего вещества.
Цель настоящего изобретения - разработка новой фармацевтической композиции в форме таблетки, покрытой кишечнорастворимой оболочкой, стабильной при хранении, состоящей из активного вещества - рабепразола натрия, вспомогательных веществ таблетки-ядра, разделительной прослойки и кишечнорастворимой оболочки, а также способа ее получения.
Техническим результатом изобретения является:
1. Улучшение стабильности при хранении фармацевтической композиции, выполненной в форме таблетки, покрытой кишечнорастворимой оболочкой, содержащей в качестве активного вещества рабепразол натрия.
2. Расширение арсенала лекарственных средств для лечения язвенной болезни желудка.
Технический результат изобретения достигается за счет разработки фармацевтической композиции в форме таблетки, покрытой кишечнорастворимой оболочкой, состоящей из активного вещества - рабепразола натрия, вспомогательных веществ таблетки-ядра, разделительной прослойки и кишечнорастворимой оболочки, содержащей следующие компоненты, % масс.:
- активное вещество:
рабепразол натрия - 5-15
- вспомогательные вещества таблетки-ядра:
кальция карбонат - 15-35
лактоза - 35-50
крахмал - 10-30
гидроксипропилметилцеллюлоза - 0,5-3
соль стеариновой кислоты - 0,5-1
итого - 100% масс.
- разделительная прослойка таблетки - 1-5% масс. от массы таблетки-ядра
кишечнорастворимая оболочка таблетки - 8-20% масс. от массы таблетки-ядра
В качестве наполнителя в данной твердой лекарственной форме используется любая фармацевтически приемлемая лактоза по причине ее хорошей прессуемости, дешевизны, а также приятных вкусовых качеств. Дозировка лактозы - 35-50% масс., предпочтительная дозировка - 43% масс.
Для предотвращения увеличения гигроскопичности лактозы в состав фармацевтической композиции вводится фармацевтически приемлемый наполнитель - кальция карбонат в дозировке 15-35% масс., преимущественно 25% масс.
Также кальция карбонат в указанной фармацевтической композиции применяется как щелочной агент для повышения стабильности рабепразола натрия (стабильность рабепразола зависит от кислотности среды - он быстро разрушается в умеренных кислотах и более стабилен в щелочной среде).
Крахмал выполняет функцию дезинтегранта, то есть вещества, улучшающего растворение таблетки. Дозировка крахмала - 10-30% масс., предпочтительно 20% масс. В качестве крахмала используется любой фармацевтически приемлемый нативный крахмал, в том числе крахмал кукурузный, крахмал картофельный, крахмал пшеничный, но не ограничиваясь этим.
Гидроксипропилметилцеллюлоза в составе фармацевтической композиции выполняет функцию связующего вещества в виде гранулирующего раствора.
Дозировка гидроксипропилметилцеллюлозы - 0,5-3% масс., предпочтительно 1% масс.
С целью повышения текучести таблетируемого гранулята, предотвращения его налипания на пуансоны и стенки отверстий матрицы в качестве смазывающего вещества используется соль стеариновой кислоты. В качестве соли стеариновой кислоты используется, предпочтительно (но не ограничиваясь), стеарат кальция или стеарат магния, преимущественно с дозировкой 0,5-1% масс., предпочтительно 1% масс.
Предлагаемое сочетание активного вещества и вспомогательных веществ определено экспериментально и является оптимальным. В результате получают гранулят, обладающий хорошими технологическими свойствами в процессе таблетирования, а получаемые при этом таблетки обладают свойствами, удовлетворяющими требованиям на лекарственное средство, то есть имеют товарный вид без сколов и трещин и обладают достаточной прочностью.
Разделительная прослойка наносится на таблетки-ядра распылением суспензии, приготовленной из готовой смеси, обычно применяемой для производства таблеток, покрытых пленочной оболочкой. В качестве готовой смеси могут использоваться Aquarius Prime (например, Aquarius Prime BAP 218010 White), Vivacoat (например, Vivacoat PA-1P-000 White), Opadry (например, Opadry II YS-1-7027 White), но не ограничиваясь этим.
Содержание разделительной прослойки в фармацевтической композиции - от 1 до 5% масс. от массы таблетки-ядра, предпочтительно - 2% масс. от массы таблетки-ядра.
Разделительная прослойка предотвращает взаимодействие рабепразола натрия с кислотными соединениями энтеросолюбильной (кишечнорастворимой) оболочки, которое может привести к обесцвечиванию рабепразола натрия и к потере его количества с течением времени.
Таблетки-ядра, покрытые разделительной прослойкой, покрываются кишечнорастворимой оболочкой.
Наличие кишечнорастворимой оболочки придает фармацевтической композиции стабильность при хранении, улучшает ее внешний вид и защищает ингибитор протонного насоса (рабепразол натрия) от контакта с кислотным желудочным соком.
Под термином «кишечнорастворимая оболочка» в настоящем изобретении следует понимать распыленную на таблетки-ядра, покрытые разделительной прослойкой, суспензию, приготовленную из готовой смеси, обычно применяемой в фармацевтической промышленности для приготовления кишечнорастворимой оболочки, и пластификатора (предпочтительно, но не обязательно).
В качестве готовой смеси может использоваться Aquarius Control ΕΝΑ (например, Aquarius Control ΕΝΑ MAY 310019 Pink и Aquarius Control ΕΝΑ MAY 314037 Yellow), «Акрилиз» (Acryl-EZE (например, Acryl-EZE 93A38076 YELLOW или Acryl-EZE 93A240008 PINK)), но не ограничиваясь этим.
При приготовлении суспензии для кишечнорастворимой оболочки, перед добавлением вышеуказанной готовой смеси, предпочтительно (но не обязательно), добавлять в воду пластификатор. Пластификатор придает пластичность и твердость кишечнорастворимой оболочке.
В качестве пластификатора используется любой фармацевтически приемлемый пластификатор, предпочтительно полиэтиленгликоль (макрогол), триэтилцитрат, пропиленгликоль, но, не ограничиваясь этим.
Содержание кишечнорастворимой оболочки в фармацевтической композиции составляет 8-20% масс. от таблетки-ядра, предпочтительно 10% масс. от таблетки-ядра, в том числе (но не обязательно) пластификатор 0,5-3% масс. от таблетки-ядра.
Возможность осуществления изобретения иллюстрируется примерами (но, не ограничивается ими), представленными в таблице 1.
|
Способ получения фармацевтической композиции включает перемешивание рабепразола натрия с кальция карбонатом, лактозой и крахмалом, приготовление 3% раствора гидроксипропилметилцеллюлозы, увлажнение 3% раствором гидроксипропилметилцеллюлозы смеси рабепразола натрия, кальция карбоната, лактозы и крахмала, влажное гранулирование, сушку, сухое гранулирование, опудривание солью стеариновой кислоты, таблетирование, приготовление разделительной прослойки, покрытие полученных таблеток-ядер разделительной прослойкой, приготовление кишечнорастворимой оболочки, покрытие таблеток кишечнорастворимой оболочкой.
Проанализированы физико-химические свойства полученных образцов фармацевтической композиции по примерам 1-5.
Прочность на сжатие определяли на приборе модели ТВТ фирмы «Эрвека».
Тест «Растворение», характеризующий скорость высвобождения активного вещества из фармацевтической композиции в среде, приближенной к среде желудочно-кишечного тракта, проводили в соответствии с ОФС 42-0003-04.
Количественное определение содержания рабепразола натрия в таблетках, а также содержание примесей определяли методом ВЭЖХ.
Полученные результаты представлены в таблице 2.
В таблице 2 также представлены нормативные значения показателей в соответствии с требованиями проекта фармакопейной статьи предприятия, разработанного ОАО «Татхимфармпрепараты».
Данный проект фармакопейной статьи разработан на основе действующих требований Государственной фармакопеи.
Так, нормативное значение показателя «Растворение» в проекте ФСП соответствует нормативному значению, указанному в ОФС 42-0003-04 «Растворение»: кислотная стадия - не более 10% через 2 ч, буферная стадия - не менее 75% (Q).
Интервал количественного содержания рабепразола натрия в таблетках, указанный в проекте ФСП (от 0,009 до 0,011 г для дозировки 10 мг), рассчитан исходя из предельного значения отклонения количественного содержания активного вещества в таблетках ±10%, установленного ГФ XI (том 2, Общие статьи на лекарственные формы, таблетки).
Нормативные значения содержания примесей рабепразола сульфона, рабепразола сульфида, меркаптоимидазола не указаны ни в ГФ, ни в Европейской фармакопее. В связи с этим в проекте ФСП прописаны нормативные значения, указанные в научно-технической литературе, посвященной разработке лекарственных препаратов с активным веществом рабепразол натрия: рабепразола сульфон - не более 0,5%, рабепразола сульфид - не более 0,5%, меркаптоимидазол - не более 0,5%, сумма неидентифицированных примесей - не более 1,5%.
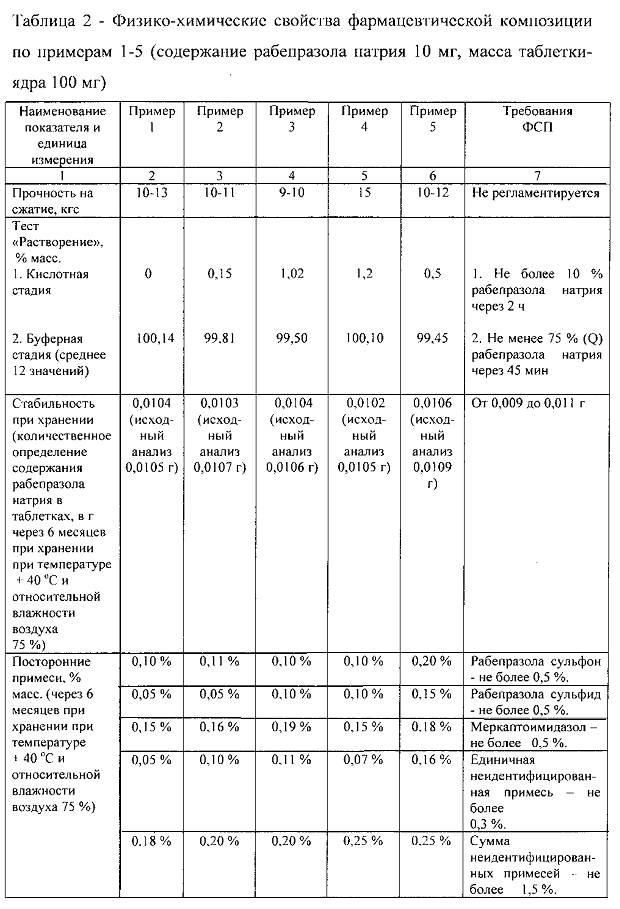
В таблице 2 показаны результаты анализов содержания посторонних примесей, проведенных через 6 месяцев после изготовления таблеток, причем анализы проводились после хранения при температуре +40°C и относительной влажности воздуха 75%.
Как видно из таблицы 2, все примеры осуществления изобретения соответствуют требованиям проекта фармакопейной статьи предприятия, что свидетельствует о высоком качестве продукции.
По совокупности физико-химических показателей оптимальным примером является пример 1 со следующим составом компонентов, % масс.:
- активное вещество:
рабепразол натрия - 10
- вспомогательные вещества таблетки-ядра:
кальция карбонат - 25
лактоза - 43
крахмал кукурузный - 20
гидроксипропилметилцеллюлоза - 1
магния стеарат - 1
итого - 100% масс.
- разделительная прослойка- 3% масс. от таблетки-ядра
- кишечнорастворимая оболочка таблетки - 11% масс. от таблетки-ядра
Проведены экспериментальные исследования с целью сравнения стабильности при хранении изобретения (примеры 1-5) с лекарственным препаратом «Париет®» (в примерах 1-5 и в лекарственном препарате «Париет®» дозировка рабепразола натрия составляет 10 мг).
Для достоверности исследования анализы проводили в одинаковых условиях - через 1,5 года после изготовления таблеток при хранении при температуре 25±2°C и относительной влажности 65±5°C.
Результаты анализов представлены в таблице 3.
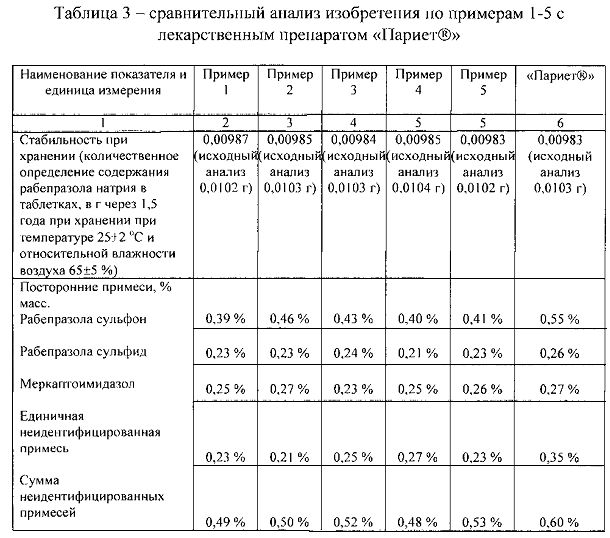
Из таблицы 3 следует, что разработанные фармацевтические композиции обладают лучшей стабильностью по сравнению с лекарственным препаратом «Париет®».
Так, при хранении в заданных условиях стабильность разработанных фармацевтических композиций выше, чем у оригинального лекарственного препарата «Париет®», так как количественное содержание рабепразола натрия снижается незначительно, а содержание посторонних примесей ниже, чем в оригинальном лекарственном препарате «Париет®».
Проведенные экспериментальные исследования позволяют сделать вывод, что технический результат изобретения - повышение стабильности фармацевтической композиции, содержащей рабепразол натрия, выполненной в форме таблетки, покрытой кишечнорастворимой оболочкой, при хранении достигается.
Разработанные фармацевтические композиции позволяют расширить арсенал лекарственных средств для лечения язвенной болезни желудка.
Источники информации
1. Лазебник Л.Б., Бордин Д.С., Машарова А.А. Длительная терапия ингибиторами протонной помпы: баланс пользы и рисков / Л.Б. Лазебник, Д.С. Бордин, А.А. Машарова // Экспериментальная и клиническая гастроэнтерология. - 2010. - №9. - С. 3-8.
2. Проект инструкции по применению лекарственного препарата для медицинского применения «Рабепразол таблетки, покрытые кишечнорастворимой оболочкой» ОАО «Татхимфармпрепараты».
3. Государственный реестр лекарственных средств [Электронный ресурс]. - Режим доступа: http://www.grls.rosminzdrav.ru (дата обращения 21.06.14).
4. Самсонов А.А. Ингибиторы протонной помпы - препараты выбора в лечении кислотозависимых заболеваний // Фарматека. - 2007. - №6. - С. 10-15.
5. Никода В.В., Хартукова Н.Е. Применение ингибиторов протонной помпы в интенсивной терапии и реанимации / В.В. Никода, Н.Е. Хартукова // Фарматека. - 2008. - №13. - С. 10-16.

