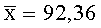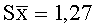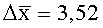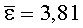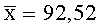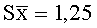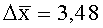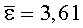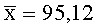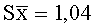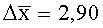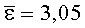СПОСОБ ОПРЕДЕЛЕНИЯ О-(2,3-ДИГИДРО-2,2-ДИМЕТИЛ-7-БЕНЗОФУРАНИЛ)-N-МЕТИЛКАРБАМАТА В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ
Вид РИД
Изобретение
Изобретение относится к биологии, токсикологической и аналитической химии, а именно к способам определения O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата в биологическом материале, и может быть использовано в практике санэпидстанций, химико-токсикологических, экспертно-криминалистических и ветеринарных лабораторий. Способ относится к числу массовых.
Известен способ определения производных карбаминовой кислоты (1-нафтил-N-метилкарбамата) в биологических объектах путем измельчения биологической ткани, ее обработки гексаном в присутствии безводного сульфата натрия в течение 2-3 часов, отделения гексанового извлечения, упаривания до сухого остатка, растворения остатка в смеси вода-метанол, взятых в объемном отношении 3:2, прибавления к водно-метанольному раствору хлорида натрия, экстракции раствора хлороформом, отделения хлороформного экстракта, упаривания до сухого остатка, растворения остатка в гексане с последующим хроматографированием в тонком слое силикагеля на пластинах «Силуфол» с использованием подвижной фазы гексан-ацетон в соотношении 3:1 по объему и проявлением хроматограмм путем последовательной обработки водно-этанольным раствором гидроксида калия и раствором соли диазония (Лабораторные исследования в ветеринарии. Химико-токсикологические методы / Под ред. Б.И. Антонова. - М.: Агропромиздат, 1989. - С.160-162).
Способ характеризуется недостаточно высокой степенью извлечения O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата, относительно низкими точностью и чувствительностью определения.
Известен способ определения O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата в биологическом материале, заключающийся в том, что биологическую пробу измельчают, обрабатывают хлороформом в течение 20 минут, хлороформную вытяжку отделяют, фильтруют через безводный сульфат натрия, хлороформ из фильтрата испаряют до сухого остатка, остаток растворяют в воде, полученный раствор экстрагируют дважды хлороформом, экстракты объединяют, фильтруют через слой безводного сульфата натрия, фильтрат упаривают при 80°C до незначительного объема, хроматографируют в тонком слое силикагеля на пластинках «Силуфол» с применением подвижной фазы гексан-ацетон в соотношении 3:2 по объему, а полученные хроматограммы проявляют путем последовательной обработки водно-этанольным раствором гидроксида калия и раствором соли диазония (Методы определения микроколичеств пестицидов в продуктах питания, кормах и внешней среде. T.1. - М.: Колос, 1992. - С.402-406).
Способ характеризуется недостаточно высокими чувствительностью и точностью.
Наиболее близким является способ определения O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата в биологическом материале, заключающийся в том, что биологический объект измельчают, неоднократно (дважды) обрабатывают смесью этилацетата и ацетона, взятых в соотношении 1:1 по объему, каждый раз в течение 30 минут, полученные извлечения объединяют, экстрагент испаряют, остаток растворяют в диэтиловом эфире, полученный раствор вносят в колонку с сорбентом, в качестве которого используется силикагель, растворитель испаряют, процесс хроматографирования осуществляют, используя двухкомпонентную подвижную фазу, которой является смесь растворителей гексан-ацетон (9:1), фракции элюата, содержащие O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамат, объединяют, элюент испаряют, остаток растворяют в смеси растворителей ацетонитрил-вода в соотношении 5:5 по объему и проводят определение физико-химическим методом, которым является метод ВЭЖХ, в колонке с неподвижной фазой «Новопак С-18» с применением подвижной фазы ацетонитрил-вода в соотношении 5:5 по объему и детектора на основе фотодиодной матрицы (Патент 2269780 Российская Федерация, МПК G01N 33/50 (2006.01) / Способ определения O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата в биологическом материале / Шорманов В.К., Коваленко Е.А., Иванов В.П., Королев В.А., Дурицын Е.П., Пистунович Е.В.; заявители и патентообладатели Шорманов В.К., Коваленко Е.А., Иванов В.П., Королев B.A. (RU) - №2004117514/15; Заяв. 08.06.2004; Опуб. 10.02.2006 // Изобретения (Заявки и патенты). - 2006. - №4. - 9 с.).
Способ характеризуется недостаточно высокой чувствительностью определения.
Техническим результатом настоящего изобретения является повышение чувствительности определения.
Технический результат достигается тем, что биологический объект измельчают, неоднократно (трижды) обрабатывают смесью этилацетата и ацетона, взятых в соотношении 1:1 по объему, каждый раз в течение 30 минут, полученные извлечения объединяют, экстрагент испаряют, остаток растворяют в ацетонитриле, полученный раствор разбавляют водой в соотношении 1:4 по объему, дважды экстрагируют этилацетатом при соотношении объемов водной и органической фаз 1:1 на каждом этапе экстракции, этилацетатные экстракты объединяют, упаривают до сухого остатка, остаток растворяют в ацетонитриле, к раствору прибавляют воду до достижения объемного соотношения между ацетонитрилом и водой 4:6, полученный раствор вносят в колонку сорбента «Силасорб С-18», процесс хроматографирования осуществляют, используя двухкомпонентную подвижную фазу, которой является смесь растворителей ацетонитрил-вода в соотношении 4:6 по объему, фракции элюата, содержащие O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамат, объединяют, элюент испаряют, остаток растворяют в метаноле и проводят определение физико-химическим методом, которым является хромато-масс-спектрометрия, в капиллярной колонке DB-5 MS EVIDEX длиной 25 м и внутренним диаметром 0,2 мм с неподвижной фазой, представляющей собой 5%-фенил-95%-метилполисилоксан, при толщине пленки неподвижной фазы 0,33 мкм, используя газ-носитель гелий, подаваемый со скоростью 0,6 мл/мин, и масс-селективный детектор, работающий в режиме электронного удара, начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата по площади хроматографического пика.
Способ осуществляется следующим образом: биологический объект, содержащий O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамат, измельчают, неоднократно (трижды) обрабатывают смесью этилацетата и ацетона, взятых в соотношении 1:1 по объему, каждый раз в течение 30 минут, полученные извлечения объединяют, экстрагент испаряют, остаток растворяют в ацетонитриле, полученный раствор разбавляют водой в соотношении 1:4 по объему, дважды экстрагируют этилацетатом при соотношении объемов водной и органической фаз 1:1 на каждом этапе экстракции, этилацетатные экстракты объединяют, упаривают до сухого остатка, остаток растворяют в ацетонитриле, к раствору прибавляют воду до достижения объемного соотношения между ацетонитрилом и водой 4:6, полученный раствор вносят в колонку сорбента «Силасорб С-18», процесс хроматографирования осуществляют, используя двухкомпонентную подвижную фазу ацетонитрил-вода в соотношении 4:6 по объему, фракции элюата, содержащие O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамат, объединяют, элюент испаряют, остаток растворяют в метаноле и проводят определение физико-химическим методом, которым является хромато-масс-спектрометрия, в капиллярной колонке DB-5 MS EVIDEX длиной 25 м и внутренним диаметром 0,2 мм с неподвижной фазой, представляющей собой 5%-фенил-95%-метилполисилоксан, при толщине пленки неподвижной фазы 0,33 мкм, используя газ-носитель гелий, подаваемый со скоростью 0,6 мл/мин, и масс-селективный детектор, работающий в режиме электронного удара, начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата по площади хроматографического пика. Способ иллюстрируется следующими примерами.
Пример 1
Определение O-(2,3-дигидро-2,2-диметил-7-бензо-фуранил)-N-метилкарбамата в ткани печени
К 10 г мелкоизмельченной ткани печени прибавляют 10 мг O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата, тщательно перемешивают биологическую ткань с веществом и оставляют на сутки при температуре 18-20°C. По истечении указанного времени биологический объект, содержащий анализируемое вещество, неоднократно (трижды) обрабатывают смесью этилацетата и ацетона, взятых в соотношении 1:1 по объему, каждый раз в течение 30 минут. При этом биологический объект заливают 20 г смеси этилацетата и ацетона, взятых в соотношении 1:1 по объему, и оставляют на 30 минут при перемешивании. Извлечение отделяют, операцию настаивания повторяют в вышеописанных условиях еще дважды. Все полученные извлечения объединяют, встряхивают с 7 г безводного сульфата натрия, фильтруют через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, сульфат натрия и фильтр дополнительно промывают 20 г смеси этилацетат-ацетон в соотношении 1:1 по объему, фильтрат и промывную жидкость объединяют, экстрагент испаряют в токе воздуха при 18-20°C до полного удаления растворителя, остаток растворяют в 10 мл ацетонитрила, полученный раствор разбавляют водой в соотношении 1:4 по объему, прибавляя 40 мл воды, образующийся раствор дважды экстрагируют порциями этилацетата по 50 мл каждая, обеспечивая соотношение объемов водной и органической фаз 1:1 на каждом этапе экстракции. Отдельные этилацетатные экстракты объединяют, упаривают в токе воздуха при температуре 18-20°C до получения сухого остатка.
Остаток растворяют в 0,8 мл ацетонитрила, к раствору прибавляют 1,2 мл воды до достижения объемного соотношения между ацетонитрилом и водой 4:6, полученный раствор вносят в хроматографическую макроколонку размерами 490×11 мм, заполненную 7,5 г сорбента «Силасорб С-18» с размером частиц 30 мкм, предварительно промытую смесью растворителей ацетонитрил-вода в соотношении 4:6 по объему. Процесс хроматографирования осуществляют, используя двухкомпонентную подвижную фазу, которой является смесь растворителей ацетонитрил-вода в соотношении 4:6 по объему. Элюат собирают отдельными фракциями по 2 мл каждая. Фракции элюата с 9 по 13 включительно, содержащие O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамат, объединяют, элюент испаряют при 18-20°C вначале в токе воздуха до объема 0,5-1 мл, а затем - в токе азота до полного удаления растворителя.
Остаток растворяют в 10 мл метанола (раствор А). 2,0 мл раствора А вносят в мерную колбу вместимостью 25 мл, доводят метанолом до метки (раствор Б) и проводят определение физико-химическим методом, которым является хромато-масс-спектрометрия.
В процессе определения 4 мкл раствора Б вводят в хромато-масс-спектрометр.
Определение проводят, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой, представляющей собой 5%-фенил-95%-метилполисилоксан, при толщине пленки неподвижной фазы 0,33 мкм.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата по площади хроматографического пика.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
Пик на хроматограмме с временем удерживания 9,68 мин соответствует O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метил-карбамату. В масс-спектре данного соединения, снятом по полному ионному току, обнаруживаются сигналы ряда характеристических заряженных частиц с массовыми числами 41, 51, 77, 91, 103, 122, 131, 149, 164, 221. Наиболее интенсивной является частица с массовым числом 164, интенсивность которой принимается за 100%.
O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамат идентифицируют по сочетанию времени удерживания в неподвижной фазе колонки и специфического набора сигналов характеристических заряженных частиц в его масс-спектре.
По площади хроматографического пика, полученного при регистрации интенсивности по полному ионному току, определяют количественное содержание O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата, используя уравнение градуировочного графика, и пересчитывают на навеску анализируемого вещества, внесенную в биологический материал.
Построение градуировочного графика
В ряд мерных колб вместимостью 25 мл вносят 0,02, 0,1, 0,5, 2,0 мл 0,125% раствора и 1,0, 5,0 и 10,0 мл 1,25% раствора O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата в метаноле и доводят объем содержимого каждой колбы до метки метанолом.
4 мкл каждого из полученных растворов вводят в хромато-масс-спектрометр.
Определение проводят, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой, представляющей собой 5%-фенил-95%-метилполисилоксан, при толщине пленки неподвижной фазы 0,33 мкм.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата по площади хроматографического пика.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
По результатам измерений на хромато-масс-спектрометре строят график зависимости площади пика от концентрации определяемого вещества. График линеен в интервале концентраций 2·10-9-1,0·10-5 г.
Методом наименьших квадратов рассчитывают уравнение градуировочного графика, которое в данном случае имеет вид:
S=5326·C+3036,
где S - площадь хроматографического пика; C - концентрация определяемого вещества в хроматографируемой пробе, нг.
Результаты количественного определения O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата в ткани печени представлены в таблице 1.
Пример 2
Определение O-(2,3-дигидро-2,2-диметил-7-бензо-фуранил)-N-метилкарбамата в ткани легких
К 10 г мелкоизмельченной ткани легких прибавляют 10 мг O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата, тщательно перемешивают биологическую ткань с веществом и оставляют на сутки при температуре 18-20°C. По истечении указанного времени биологический объект, содержащий анализируемое вещество, неоднократно (трижды) обрабатывают смесью этилацетата и ацетона, взятых в соотношении 1:1 по объему, каждый раз в течение 30 минут. При этом биологический объект заливают 20 г смеси этилацетата и ацетона, взятых в соотношении 1:1 по объему, и оставляют на 30 минут при перемешивании. Извлечение отделяют, операцию настаивания повторяют в вышеописанных условиях еще дважды. Все полученные извлечения объединяют, встряхивают с 7 г безводного сульфата натрия, фильтруют через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, сульфат натрия и фильтр дополнительно промывают 20 г смеси этилацетат-ацетон в соотношении 1:1 по объему, фильтрат и промывную жидкость объединяют, экстрагент испаряют в токе воздуха при 18-20°C до полного удаления растворителя, остаток растворяют в 10 мл ацетонитрила, полученный раствор разбавляют водой в соотношении 1:4 по объему, прибавляя 40 мл воды, образующийся раствор дважды экстрагируют порциями этилацетата по 50 мл каждая, обеспечивая соотношение объемов водной и органической фаз 1:1 на каждом этапе экстракции. Отдельные этилацетатные экстракты объединяют, упаривают в токе воздуха при температуре 18-20°C до получения сухого остатка.
Остаток растворяют в 0,8 мл ацетонитрила, к раствору прибавляют 1,2 мл воды до достижения объемного соотношения между ацетонитрилом и водой 4:6, полученный раствор вносят в хроматографическую макроколонку размерами 490×11 мм, заполненную 7,5 г сорбента «Силасорб С-18» с размером частиц 30 мкм, предварительно промытую смесью растворителей ацетонитрил-вода в соотношении 4:6 по объему. Процесс хроматографирования осуществляют, используя двухкомпонентную подвижную фазу, которой является смесь растворителей ацетонитрил-вода в соотношении 4:6 по объему. Элюат собирают отдельными фракциями по 2 мл каждая. Фракции элюата с 9 по 13 включительно, содержащие O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамат, объединяют, элюент испаряют при 18-20°C вначале в токе воздуха до объема 0,5-1 мл, а затем - в токе азота до полного удаления растворителя.
Остаток растворяют в 10 мл метанола (раствор А). 2,0 мл раствора А вносят в мерную колбу вместимостью 25 мл, доводят метанолом до метки (раствор Б) и проводят определение физико-химическим методом, которым является хромато-масс-спектрометрия.
В процессе определения 4 мкл раствора Б вводят в хромато-масс-спектрометр.
Определение проводят, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой, представляющей собой 5%-фенил-95%-метилполисилоксан, при толщине пленки неподвижной фазы 0,33 мкм.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата по площади хроматографического пика.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
Пик на хроматограмме с временем удерживания 9,68 мин соответствует O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метил-карбамату. В масс-спектре данного соединения, снятом по полному ионному току, обнаруживаются сигналы ряда характеристических заряженных частиц с массовыми числами 41, 51, 77, 91, 103, 122, 131, 149, 164, 221. Наиболее интенсивной является частица с массовым числом 164, интенсивность которой принимается за 100%.
O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамат идентифицируют по сочетанию времени удерживания в неподвижной фазе колонки и специфического набора сигналов характеристических заряженных частиц в его масс-спектре.
По площади хроматографического пика, полученного при регистрации интенсивности по полному ионному току, определяют количественное содержание O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата, используя уравнение градуировочного графика, и пересчитывают на навеску анализируемого вещества, внесенную в биологический материал.
Построение градуировочного графика
Построение градуировочного графика и его уравнение приводятся в примере 1.
Результаты количественного определения O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата в ткани легких представлены в таблице 2.
Пример 3
Определение O-(2,3-дигидро-2,2-диметил-7-бензо-фуранил)-N-метилкарбамата в ткани корнеплодов сахарной свеклы
К 10 г мелкоизмельченной ткани корнеплодов сахарной свеклы прибавляют 10 мг O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата, тщательно перемешивают биологическую ткань с веществом и оставляют на сутки при температуре 18-20°C. По истечении указанного времени биологический объект неоднократно (трижды) обрабатывают смесью этилацетата и ацетона, взятых в соотношении 1:1 по объему, каждый раз в течение 30 минут. При этом биологический объект заливают 20 г смеси этилацетата и ацетона, взятых в соотношении 1:1 по объему, и оставляют на 30 минут при перемешивании. Извлечение отделяют, операцию настаивания повторяют в вышеописанных условиях еще дважды. Все полученные извлечения объединяют, встряхивают с 7 г безводного сульфата натрия, фильтруют через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, сульфат натрия и фильтр дополнительно промывают 20 г смеси этилацетат-ацетон в соотношении 1:1 по объему, фильтрат и промывную жидкость объединяют, экстрагент испаряют в токе воздуха при 18-20°C до полного удаления растворителя, остаток растворяют в 10 мл ацетонитрила, полученный раствор разбавляют водой в соотношении 1:4 по объему, прибавляя 40 мл воды, образующийся раствор дважды экстрагируют порциями этилацетата по 50 мл каждая, обеспечивая соотношение объемов водной и органической фаз 1:1 на каждом этапе экстракции. Отдельные этилацетатные экстракты объединяют, упаривают в токе воздуха при температуре 18-20°C до получения сухого остатка.
Остаток растворяют в 0,8 мл ацетонитрила, к раствору прибавляют 1,2 мл воды до достижения объемного соотношения между ацетонитрилом и водой 4:6, полученный раствор вносят в хроматографическую макроколонку размерами 490×11 мм, заполненную 7,5 г сорбента «Силасорб С-18» с размером частиц 30 мкм, предварительно промытую смесью растворителей ацетонитрил-вода в соотношении 4:6 по объему. Процесс хроматографирования осуществляют, используя двухкомпонентную подвижную фазу, которой является смесь растворителей ацетонитрил-вода в соотношении 4:6 по объему. Элюат собирают отдельными фракциями по 2 мл каждая. Фракции элюата с 9 по 13 включительно, содержащие O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамат, объединяют, элюент испаряют при 18-20°C вначале в токе воздуха до объема 0,5-1 мл, а затем - в токе азота до полного удаления растворителя.
Остаток растворяют в 10 мл метанола (раствор А). 2,0 мл раствора А вносят в мерную колбу вместимостью 25 мл, доводят метанолом до метки (раствор Б) и проводят определение физико-химическим методом, которым является хромато-масс-спектрометрия.
В процессе определения 4 мкл раствора Б вводят в хромато-масс-спектрометр.
Определение проводят, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой, представляющей собой 5%-фенил-95%-метилполисилоксан, при толщине пленки неподвижной фазы 0,33 мкм.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата по площади хроматографического пика.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
Пик на хроматограмме с временем удерживания 9,68 мин соответствует O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метил-карбамату. В масс-спектре данного соединения, снятом по полному ионному току, обнаруживаются сигналы ряда характеристических заряженных частиц с массовыми числами 41, 51, 77, 91, 103, 122, 131, 149, 164, 221. Наиболее интенсивной является частица с массовым числом 164, интенсивность которой принимается за 100%.
O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамат идентифицируют по сочетанию времени удерживания в неподвижной фазе колонки и специфического набора сигналов характеристических заряженных частиц в его масс-спектре.
По площади хроматографического пика, полученного при регистрации интенсивности по полному ионному току, определяют количественное содержание O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата, используя уравнение градуировочного графика, и пересчитывают на навеску анализируемого вещества, внесенную в биологический материал.
Построение градуировочного графика
Построение градуировочного графика и его уравнение приводятся в примере 1.
Результаты количественного определения O-(2,3-дигидро-2,2-диметил-7-бензофуранил)-N-метилкарбамата в ткани корнеплодов сахарной свеклы представлены в таблице 3.
Предлагаемый способ по сравнению с прототипом в 6 раз повышает чувствительность определения в детектируемой пробе и в 3 раза - в биологическом материале.
Сравнительные характеристики предлагаемого и известного способов представлены в таблице 4.
|
|
|
|