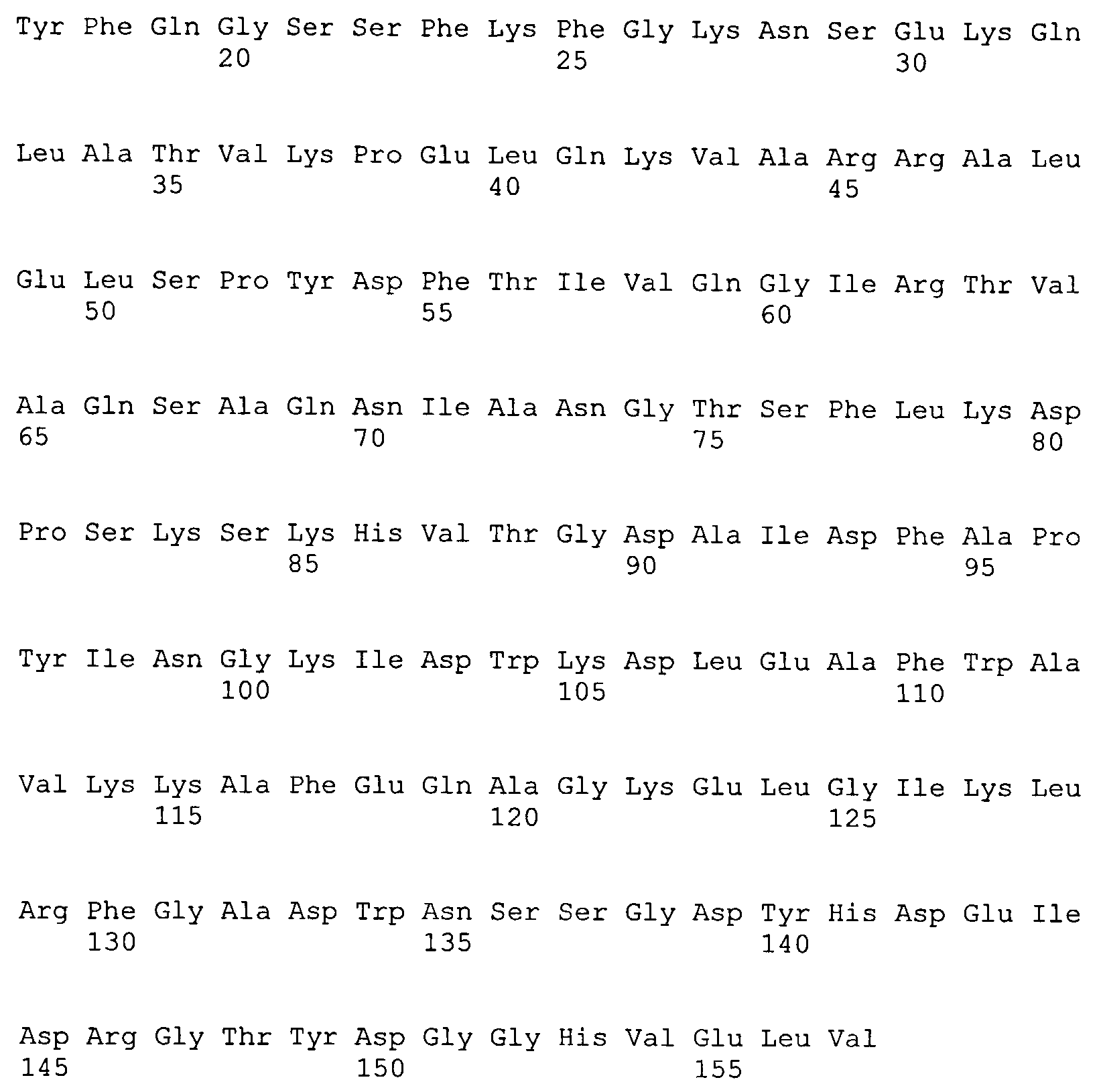Результат интеллектуальной деятельности: ГИДРОЛАЗА ПЕПТИДОГЛИКАНА, ЭКСПРЕССИОННАЯ ПЛАЗМИДА, СОДЕРЖАЩАЯ ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ГИДРОЛАЗУ ПЕПТИДОГЛИКАНА, БАКТЕРИЯ-ПРОДУЦЕНТ И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ГИДРОЛАЗЫ ПЕПТИДОГЛИКАНА
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к биотехнологии, в частности к технологии микробиологического синтеза гидролазы пептидогликана, а именно гидролазы пептидогликана бактериофага S-394.
Уровень техники
Гидролазы пептидогликана бактериофагов (муреингидролазы бактериофагов, эндолизины бактериофагов) - это ферменты, используемые бактериофагами на конечной стадии своего развития для разрушения клеточной стенки бактерий с целью выхода синтезированных частиц бактериофагов изнутри бактериальной клетки-хозяина наружу.
Гидролазы пептидогликана бактериофагов представляют собой класс ферментов, катализирующих гидролиз пептидогликанов различных видов бактерий. Различные гидролазы пептидогликана бактериофагов гидролизуют разные связи в пептидогликане. По типу гидролизуемой связи гидролазы пептидогликана делят на 4 группы: N-ацетилмурамидазы (лизоцимы) и N-ацетил-β-D-глюкозаминидазы (гликозидазы), которые гидролизуют гликозидную связь в пептидогликане, N-ацетилмурамоил-L-аланин амидазы, гидролизующие связь между звеньями сахара и олигопептидной цепочки пептидогликана, эндопептидазы, гидролизующие связи между остатками аминокислот в пептидогликане [Р.R. Mark Fenton Olivia McAuliffe, Jim O′Mahony, Aidan Coffey, ″Recombinant bacteriophage lysins as antibacterials,″ Bioengineered Bugs, vol. 1, no. 1, pp. 9-16, 2010]. Гидролазы пептидогликана характеризуются высокой специфичностью по отношению к составу пептидогликана бактериальной стенки, что позволяет их рассматривать в качестве новых антимикробных агентов, способных строго специфично воздействовать на определенные группы бактерий, значительно снижая их численность, и использовать эти ферменты для производства препаратов, предназначенных для лечения и профилактики бактериальных инфекций.
В настоящее время лечение бактериальных инфекций осложняется появлением штаммов бактерий, устойчивых к антибиотикам. Гидролазы пептидогликана рассматриваются как эффективные средства контроля бактериальной микрофлоры, обладающие огромным потенциалом, благодаря тому что видовое разнообразие бактерифагов огромно [J.L.G. Juan A Hermoso Pedro Garci′a, ″Taking aim on bacterial pathogens: from phage therapy to enzybiotics,″ Current Opinion in Microbiology, vol. 10, pp. 461-472, 2007.]. Применение гидролаз бактериофагов имеет ряд преимуществ по сравнению с фаготерапией. Так, фаготерапия характеризуется риском множества побочных эффектов, связанных с тем, что фаги могут нести гены факторов вирулентности или токсинов [Harald Brüssow, Carlos Canchaya, Wolf-Dietrich Hardt, ″Phages and the evolution of bacterial pathogens: from genomic rearrangements to lysogenic conversion,″ Microbiology and Molecular Biology Reviews, vol. 68, no. 3, pp. 560-602, 2004], также фаги могут являться переносчиками токсинов холеры [М.W. Brigid Davis, ″Filamentous phages linked to virulence of Vibrio cholerae,″ Current Opinion in Microbiology, vol. 6, no. 1, pp. 35-42, 2003] или ботулизма [Harald Brüssow, Carlos Canchaya, Wolf-Dietrich Hardt, ″Phages and the evolution of bacterial pathogens: from genomic rearrangements to lysogenic conversion,″ Microbiology and Molecular Biology Reviews, vol. 68, no. 3, pp. 560-602, 2004]]. Другим ограничением фаготерапии является высокая вероятность спонтанной мутации в популяции 106-108 бактерий, в результате которой происходит потеря или изменение рецептора фага, что снижает эффективность фаготерапии [М.K.S. Ryu, ″Characterization of a T5-Like Cohphage, SPC35, and Differential Development of Resistance to SPC35 in Salmonella enterica Serovar Typhimurium and Escherichia coli,″ Applied and Environmental Microbiology, vol. 77, no. 6, pp. 2042-2050, 2011]. Контроль патогенной микрофлоры с помощью высокоочищенных гидролаз пептидогликана выше обозначенными недостатками не обладает, поэтому их использование в качестве антибактериальных агентов рассматривается, как альтернатива фаготерапии.
В источниках информации имеются сведения о микроорганизмах - продуцентах гидролаз пептидогликана, представляющих собой природные штаммы бактериофагов. Известен бактериофаг штамма S-394, обладающий специфичностью по отношению к Salmonella typhimurium и Escherichia coli: [RU 2412243, C12N 7/00, 20.02.2011], выделенный из сточных вод в г. Кольцове, Новосибирской области.
Также из уровня техники известен бактериофаг EPS7, выделенный исследователями в Южной Корее [K.-Р.K. Junwoo Hong Sunggi Heu, Sang Jun Lee, Sankar Adhya, Sangryeol Ryu, ″Identication of host receptor and receptor-bindingmodule of a newly sequencedT5-like phage EPS7,″ FEMS Microbiol Lett, vol. 289, pp. 202-209, 2008]. Существенными недостатками данного бактериофага в качестве продуцента гидролаз пептидогликана являются низкий выход фермента и трудоемкая процедура очистки. Повышение уровня продукции гидролаз пептидогликана является необходимым этапом создания высокоэффективных технологических антибактериальных агентов, способных контролировать патогенные микроорганизмы, и может быть достигнуто путем использования гетерологичных микроорганизмов, на что и направлена заявляемая группа изобретений.
Ближайшим аналогом заявляемой бактерии-продуцента является полученный методом генной инженерии рекомбинантный штамм бактерий BL21 (DE3), несущий плазмиду, содержащую ген гидролазы пептидогликана бактериофага Т5 - продуцент гидролазы пептидогликана бактериофага Т5 [Galina V. Mikoulinskaia, Irina V. Odinokova, Andrei A. Zimin, Valentina Ya. Lysanskaya, Sergei A. Feofanov and Olga A. Stepnaya, ″Identification and characterization of the metal ion-dependent L-alanoyl-D-gluiamate peptidase encoded by bacteriophage Т5,″ FEBS, vol. 276, pp. 7329-7342, 2009]. Этот штамм создан с целью получения чистого фермента и изучения его структуры и свойств и по уровню синтеза гидролазы пептидогликана бактериофага Т5 не охарактеризован.
Таким образом, на сегодняшний день существует необходимость разработки технологии, обеспечивающей высокий уровень биосинтеза гидролазы пептидогликана.
Раскрытие изобретения
Задачей и техническим результатом группы изобретений является разработка технологии микробиологического синтеза гидролазы пептидогликана из бактериофага S-394 с высокой продуктивностью. Получаемая в процессе реализации изобретения гидролаза пептидогликана позволяет контролировать грамотрицательную микрофлору, в частности грамотрицательную микрофлору, устойчивую к синтетическим антибиотикам.
Технический результат настоящего изобретения заключается в разработке бактерии-продуцента, способной продуцировать гидролазу пептидогликана из бактериофага S-394. Кроме того, предложенные частные варианты бактерии-продуцента гидролазы пептидогликана бактериофага S-394 обеспечивают более высокий уровень синтеза пептидогликана бактериофага S-394, а также упрощают выделение и очистку синтезируемой гидролазы. Также настоящее изобретение предоставляет эффективный способ микробиологического синтеза гидролазы пептидогликана бактериофага S-394.
Поставленная задача была решена за счет определения аминокислотной последовательности гидролазы пептидогликана бактериофага S-394, а также за счет обнаружения того факта, что штаммы бактерии, принадлежащие к роду Escherichia, устойчивые к синтезу токсичных веществ, будучи трансформированными плазмидой, несущей ген, кодирующий гидролазу пептидогликана бактериофага S-394, сохраняют жизнеспособность в процессе экспрессии гена и внутриклеточного синтеза активной гидролазы пептидогликана бактериофага S-394 и обеспечивают высокий уровень биосинтеза указанной гидролазы.
Поставленная задача решается за счет предоставления белка, обладающего активностью гидролазы пептидогликана бактериофага S-394, характеризующегося тем, что указанный белок имеет аминокислотную последовательность, представленную в SEQ ID NO:2, или его варианта, содержащего делецию, вставку или замену одного или нескольких аминокислотных остатков и обладающего активностью белка, представленного в SEQ ID NO:2.
Также поставленная задача решается за счет предоставления упомянутого выше белка, характеризующегося тем, что указанный белок имеет аминокислотную последовательность, гомологичную более чем на 97% последовательности, представленной в SEQ ID NO:2.
Также поставленная задача решается за счет предоставления упомянутого выше белка, характеризующегося тем, что указанный белок содержит аминокислотную последовательность His-Tag.
Одним из частных вариантов упомянутого выше белка, является белок, дополнительно содержащий аминокислотную последовательность His-Tag и сайт гидролиза для протеазы вируса табачной мозаики и имеющий аминокислотную последовательность, представленную SEQ ID NO:4.
Также поставленная задача решается за счет разработки экспрессионной плазмиды, содержащей фрагмент ДНК, кодирующий белок, обладающий активностью гидролазы пептидогликана, выбранный из группы, включающей:
- фрагмент ДНК, содержащий последовательность, представленную в SEQ ID NO:1;
- фрагмент ДНК, кодирующий белок, содержащий аминокислотную последовательность, представленную в SEQ ID NO:2;
- фрагмент ДНК, кодирующий белок, содержащий аминокислотную последовательность, гомологичную более чем на 97% последовательности, представленной в SEQ ID NO:2;
- фрагмент ДНК, кодирующий вариант белка, содержащий делецию, вставку или замену одного или нескольких аминокислотных остатков и обладающий активностью белка, представленного в SEQ ID NO:2
Также поставленная задача решается за счет разработки упомянутой выше экспрессионной плазмиды, содержащей фрагмент ДНК, кодирующий белок, обладающий активностью гидролазы пептидогликана, и слитый с последовательностью нуклеотидов, кодирующей His-Tag.
Также поставленная задача решается за счет разработки упомянутой выше экспрессионной плазмиды, содержащей фрагмент ДНК, кодирующий белок, обладающий активностью гидролазы пептидогликана, под контролем Т7 промотора.
Также поставленная задача решается за счет разработки упомянутой выше экспрессионной плазмиды, содержащей фрагмент ДНК, кодирующий белок, обладающий активностью гидролазы пептидогликана, под контролем Т7 промотора, слитый с последовательностью нуклеотидов, кодирующей His-Tag, характеризующейся нуклеотидной последовательностью, представленной в SEQ ID NO:3.
Также поставленная задача решается за счет разработки бактерии, принадлежащей к роду Escherichia, - продуцента гидролазы пептидогликана, характеризующейся тем, что указанная бактерия трансформирована упомянутой выше плазмидой.
Также поставленная задача решается за счет разработки упомянутой выше бактерии, характеризующейся тем, что указанная бактерия представляет собой штамм E.coli C41 (DE3) или штамм E.coli C43 (DE3).
Также поставленная задача решается за счет разработки упомянутой выше бактерии, характеризующейся тем, что указанная выше бактерия представляет собой штамм E.coli C41 (DE3), трансформированный упомянутой выше плазмидой.
Также поставленная задача решается за счет разработки упомянутой выше бактерии, характеризующейся тем, что указанная выше бактерия представляет собой штамм E.coli C41 (DE3)/pEE3lys, трансформированный плазмидой, характеризующейся нуклеотидной последовательностью, представленной в SEQ ID NO:3.
Также поставленная задача решается за счет разработки упомянутой выше бактерии, характеризующейся тем, что указанная выше бактерия представляет собой штамм E.coli C43 (DE3), трансформированный упомянутой выше плазмидой.
Также поставленная задача решается за счет разработки упомянутой выше бактерии, характеризующейся тем, что указанная бактерия представляет собой штамм E.coli C43(DE3)/pEE3lys, трансформированный плазмидой, характеризующейся нуклеотидной последовательностью, представленной в SEQ ID NO:3.
Также поставленная задача решается за счет разработки способа получения упомянутой выше бактерии-продуцента, включающего:
а) получение экспрессионной плазмиды, содержащей фрагмент ДНК, выбранный из группы, включающей:
- фрагмент ДНК, включающий последовательность, представленную в SEQ ID NO:1;
- фрагмент ДНК, кодирующий белок, включающий аминокислотную последовательность, представленную в SEQ ID NO:2;
- фрагмент ДНК, кодирующий белок, включающий аминокислотную последовательность, по крайней мере, на 97% гомологичную последовательности, представленной в SEQ ID NO:2;
- фрагмент ДНК, кодирующий вариант белка, содержащий делецию, вставку, добавление или замену одного или нескольких аминокислотных остатков и обладающий активностью белка, представленного в SEQ ID NO:2.
б) трансформацию бактерии, принадлежащей к роду Escherichia, полученной экспрессионной плазмидой.
Также поставленная задача решается за счет разработки упомянутого выше способа, характеризующегося тем, что бактерия представляет собой бактерию Escherichia соli.
Также поставленная задача решается за счет разработки упомянутого выше способа, характеризующегося тем, что указанная бактерия представляет собой бактерию штамма E.coli C41 (DE3) или штамма E.coli. C43 (DE3).
Также поставленная задача решается за счет разработки способа микробиологического синтеза гидролазы пептидогликана, включающего культивирование упомянутой выше бактерии в культуральной жидкости и выделение полученной гидролазы пептидогликана из клеточного экстракта культивируемых бактерий.
Также поставленная задача решается за счет разработки упомянутого выше способа микробиологического синтеза, характеризующегося тем, что выделение гидролазы пептидогликана из клеточного экстракта культивируемых бактерий осуществляют методом металл-хелатирующей хроматографии.
Также поставленная задача решается за счет разработки упомянутого выше способа микробиологического синтеза, характеризующегося тем, что культуральная жидкость содержит изопропил-β-D-тиогалактозид в качестве индуктора.
Также поставленная задача решается за счет разработки фармацевтической композиции для терапии сальмонеллезов, бактериальных поражений кожи и слизистых, вызванных бактериями рода Pseudomonas, включающей в качестве активно-действующего вещества упомянутый выше белок и фармацевтически приемлемый носитель.
Также поставленная задача решается за счет разработки фармацевтической композиции для терапии заболеваний, вызванных грамотрицательной микрофлорой, включающей в качестве активнодействующего вещества упомянутый выше белок и фармацевтически приемлемый носитель.
Также поставленная задача решается за счет разработки упомянутой выше фармацевтической композиции, характеризующейся тем, что грамотрицательная микрофлора представляет собой бактерию семейства Enterobacteriaceae или Pseudomonadaceae.
Также поставленная задача решается за счет разработки упомянутой выше фармацевтической композиции, характеризующейся тем, что бактерия семейства Enterobacteriaceae представляет собой бактерию рода Shigella, Escherichia или Salmonella.
Также поставленная задача решается за счет разработки упомянутой выше фармацевтической композиции, характеризующейся тем, что бактерия семейства Pseudomonadaceae представляет собой бактерию рода Pseudomonas.
Также поставленная задача решается за счет разработки упомянутой выше фармацевтической композиции, характеризующейся тем, что указанные заболевания, вызванные грамотрицательной микрофлорой, представляют собой сальмонеллезы или бактериальные поражения кожи или слизистых.
Термин «гидролаза пептидогликана» означает фермент, катализирующий гидролиз какой-либо химической связи в пептидогликане, кроме того, гидролаза пептидогликана может быть также названа «муреингидролаза», «фаговый эндолизин», «фаговый лизин». Настоящее изобретение относится к гидролазе пептидогликана бактериофага S-394, для обозначения которой используются термины «гидролаза пептидогликана бактериофага S-394» или «гидролаза пептидогликана». Далее по тексту термин «гидролаза пептидогликана», если не указано иное, относится к гидролазе пептидогликана бактериофага S-394.
Авторами настоящего изобретения был выявлен полноразмерный ген, кодирующий гидролазу пептидогликана бактериофага S-394, нуклеотидная последовательность которого представлена в SEQ ID NO:1, и установлена соответствующая аминокислотная последовательность белка, представленная в SEQ IDNO:2.
Согласно настоящему изобретению термин «вариант белка» означает белок, содержащий делецию, вставку или замену одного или нескольких аминокислотных остатков в SEQ ID NO:2, при условии, что активность белка, представленного в SEQ ID NO:2, сохраняется. Наличие гидролитической активности гидролазы пептидогликана бактериофага S-394 и ее уровень может быть измерен, например, методом просветления суспензии хлороформ-обработанных клеток Е.coli штамма CR63 по аналогии с методом, описанным в источнике [Н.В. Jensen and K. Kleppe, ″Affinity for Chitin and the Use of Chitin in the Purification of the Enzyme,″ European Journal of Biochemistry, vol. 26, no. 3, pp. 305-312, 1972].
В частности, белок, обладающий активностью гидролазы пептидогликана бактериофага S-394, может иметь аминокислотную последовательность, гомологичную, по крайней мере, на 97%, в частности на 98% и более, последовательности, представленной в SEQ ID NO:2. Гомология между аминокислотными последовательностями может быть установлена с использованием хорошо известных методов, например с помощью утилиты BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi).
Частным вариантом настоящего изобретения является белок, обладающий активностью гидролазы пептидогликана, и содержащий аминокислотную последовательность His-Tag и сайт гидролиза для протеазы вируса табачной мозаики, и имеющий аминокислотную последовательность, представленную SEQ ID NO:4.
Согласно настоящему изобретению термин «экспрессионная плазмида» означает плазмиду, функционирующую, по крайней мере, в бактериальной клетке и обеспечивающую экспрессию клонированного в нее целевого гена. В частности, экспрессионная плазмида может содержать генетические элементы, необходимые для экспрессии целевой последовательности в бактериальной клетке, такие как промотор, терминатор. Настоящее изобретение предоставляет экспрессионную плазмиду, содержащую фрагмент ДНК, кодирующий гидролазу пептидогликана бактериофага S-394. Согласно настоящему изобретению фрагмент ДНК, кодирующий гидролазу пептидогликана бактериофага S-394, может содержать последовательность, представленную в SEQ ID NO:1; либо последовательность, кодирующую белок, включающий аминокислотную последовательность, представленную в SEQ ID NO:2; либо последовательность, кодирующую белок, включающий аминокислотную последовательность, по крайней мере, на 97% гомологичную последовательности, представленной в SEQ ID NO:2; либо последовательность, кодирующую вариант белка, содержащий делецию, вставку или замену одного или нескольких аминокислотных остатков и обладающий активностью белка, представленного в SEQ ID NO:2.
Кроме того, согласно настоящему изобретению экспрессионная плазмида может содержать один из упомянутых выше фрагментов ДНК, кодирующих белок, обладающий активностью гидролазы пептидогликана, слитый с последовательностью нуклеотидов, кодирующей His-Tag. Термин «His-Tag» («гексагистидиновая последовательность», «олигогистидиновая последовательность», «6×His») обозначает аминокислотную последовательность, по крайней мере, из пяти остатков гистидина, которая может содержаться в синтезируемом целевом белке, как правило, ближе к С-концу или N-концу его аминокислотной последовательности [Hengen P., ″Purification of His-Tag fusion proteins from Escherichia coli,″ Trends Biochem Sci, vol. 20, no. 7, pp. 285-286, 1995]. Кроме того, экспрессионная плазмида, содержащая последовательность, кодирующую His-Tag, может также содержать последовательность, кодирующую сайт гидролиза протеазы вируса табачной мозаики (TEV-протеазы).
Согласно настоящему изобретению в качестве бактерии-продуцента гидролазы пептидогликана может быть использована бактерия, принадлежащая к роду Escherichia. Термин «бактерия-продуцент гидролазы пептидогликана» обозначает бактерию, обладающую способностью синтезировать внутри клетки гидролазу пептидогликана и сохранять при этом жизнеспособность. Согласно настоящему изобретению в качестве бактерии-продуцента гидролазы пептидогликана могут быть использованы бактерии, устойчивые к токсичным белкам, сохраняющие жизнеспособность при внутриклеточном синтезе белков, наличие которых в цитоплазме клеток E. coli штамма BL21 (DE3) вызывает их гибель или подавление роста. Частными примерами таких бактерий являются штаммы Escherichia coli, C41 (DE3) и C43 (DE3), полученные на основе штамма BL21 (DE3). Штаммы C41 (DE3) и C43 (DE3) являются коммерчески доступными штаммами, производства компании Lucigen Corporation (http://lucigen.com/store/OverExpress-C41-DE3-and-C43-DE3-Competent-Cells).
Благодаря наличию в геноме штаммов Escherichia coli C41 (DE3) и C43 (DE3) гена РНК-полимеразы фага Т7 под контролем lac-промотора и lac-оператора, синтез РНК-полимеразы фага Т7 индуцируется при наличии в культуральной среде изопропил-β-D-тиогалактозида (ИПТГ) (http://lifeserv.bgu.ac.il/wb/zarivach/media/protocols/Novagen%20pET%20system%20manual.pdf). При этом за счет увеличения уровня синтеза РНК-полимеразы фага Т7 обеспечивается индукция экспрессии целевого гена, клонированного в экспрессионную плазмиду под контролем Т7 промотора.
При этом для специалиста очевидно, что перечень промоторов, функционирующих в бактериальной клетке, под контролем которого может быть клонирован фрагмент, кодирующий гидролазу пептидогликана, не ограничен каким-либо специальным образом, например, могут быть использованы такие промоторы, как Т5, tac, lac, trp, lacUV5 или подобные им, в частности промоторы, способные репрессироваться lac-репрессором.
Согласно настоящему изобретению бактерия-продуцент гидролазы пептидогликана может быть получена за счет трансформации исходной бактериальной клетки плазмидой, несущей фрагмент ДНК, кодирующий гидролазу пептидогликана бактериофага S-394. При этом трансформация может быть осуществлена стандартными хорошо известными специалисту способами, например, как описано в книге [Sambrook, J., Fritsch, E.F., and Maniatis, Т., Molecular Cloning: a Laboratory Manual. Cold Spring Harbor: Cold Spring Harbor Laboratory, 1989].
Термин «способ микробиологического синтеза» означает способ получения гидролазы пептидогликана бактериофага S-394, включающий культивирование бактерии-продуцента гидролазы пептидогликана с последующим выделением полученной гидролазы пептидогликана бактериофага S-394 из клеточного экстракта.
Согласно настоящему изобретению культивирование бактерии-продуцента может осуществляться как в жидких культуральных средах, так и на поверхности твердых питательных сред. Например, для культивирования бактерии-продуцента может быть использована среда LB, содержащая 10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl, среда 2×TY содержит 16 г/л триптона, 10 г/л дрожжевого экстракта, 10 г/л NaCl. Твердые питательные среды могут содержать 15 г/л агара.
После проведения синтеза гидролазы пептидогликана клеточный экстракт бактерий-продуцентов может быть получен стандартными хорошо известными специалисту методами, например, приведенными в источнике [Sambrook, J., Fritsch, E.F., and Maniatis, Т., Molecular Cloning: a Laboratory, Manual. Cold Spring Harbor: Cold Spring Harbor Laboratory, 1989], в частности высаживанием клеток с помощью центрифугирования с последующим разрушением клеток ультразвуком.
При наличии в экспрессионной плазмиде, содержащей фрагмент ДНК, кодирующий гидролазу пептидогликана, последовательности, кодирующей His-Tag, синтезируемый белок может быть выделен из клеточного экстракта, например, методом металл-хелатирующей хроматографии. Термин «металл-хелатирующая хроматография» означает тип хроматографического разделения смеси белков, основанный на образовании аффинного комплекса между олигогистидиновой последовательностью белка и металлом, которым модифицирован хроматографический носитель [Hengen P., ″Purification of His-Tag fusion proteins from Escherichia coli,″ Trends Biochem Sci, vol. 20, no. 7, pp. 285-286, 1995].
Полученная гидролаза пептидогликана позволяет контролировать грамотрицательную микрофлору, устойчивую к синтетическим антибиотикам, и может быть использована в качестве активнодействующего вещества в составе фармацевтической композиции, предназначенной, в частности, для терапии сальмонеллезов, бактериальных поражений кожи и слизистых, вызванных грамотрицательной микрофлорой. Фармацевтическая композиция может также содержать фармацевтически приемлемый носитель. Упомянутая выше фармацевтическая композиция может применяться перорально в виде капсул или пилюль для лечения сальмонеллезов, в виде спреев или мазей для лечения заболеваний кожи и слизистых.
Фармацевтические композиции на основе полученной гидролазы пептидогликана бактериофага S-394 могут применяться для контроля роста грамотрицательной микрофлоры, например бактерий семейства Enterobacteriaceae или Pseudomonadaceae. Частными примерами бактерий, рост которых может контролироваться благодаря использованию фармацевтических композиций на основе полученной гидролазы пептидогликана, являются бактерии рода Pseudomonas, Salmonella, Escherichia или Shigella. Способность бактериофага S-394 лизировать культуры бактерий рода Salmonella, Escherichia или Shigella показана в патенте RU 2412243.
Механизм действия гидролазы пептидогликана бактериофага S-394, в виду высокой степени гомологии с лизоцимом бактериофага Т5, предположительно заключается в гидролизе связи между остатками L-аланина и D-глутаминовой кислоты в пептидогликане [Galina V. Mikoulinskaia, Irina V. Odinokova, Andrei A. Zimin, Valentina Ya. Lysanskaya, Sergei A. Feofanov and Olga A. Stepnaya, ″Identification and characterization of the metal ion-dependent L-alanoyl-D-glutamate peptidase encoded by bacteriophage Т5,″ FEBS, vol. 276, pp. 7329-7342, 2009]. Гидролиз пептидогликана вызывает дальнейшее разрушение клеточной стенки грамотрицательных бактерий за счет высокого осмотического давления.
Краткое описание фигур
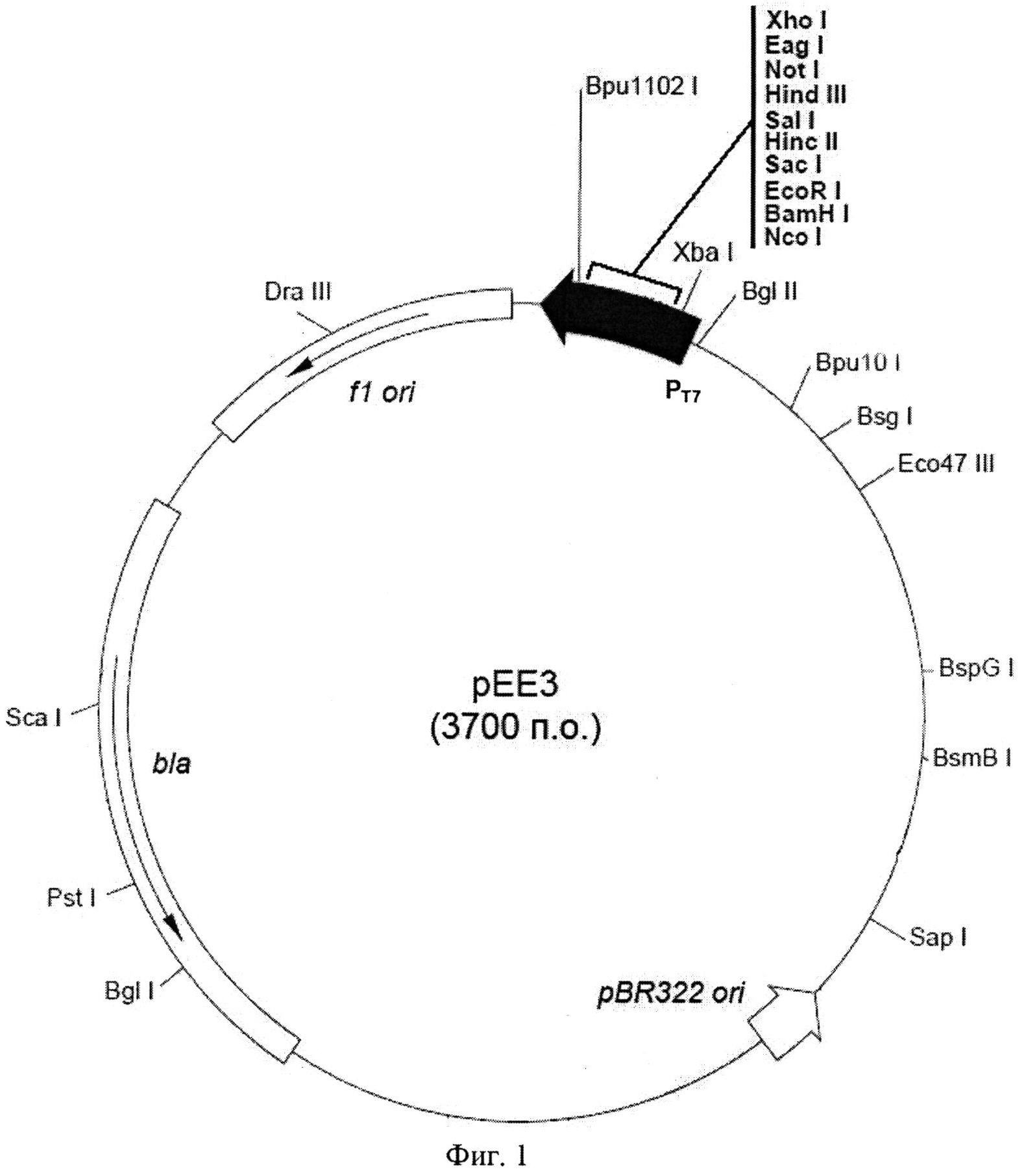
На Фигуре 1 показана схема плазмидной ДНК рЕЕ3. Плазмидный вектор рЕЕ3: Т7 промотор (337-353 п.о.); полилинкер (BamН I - Xho I) (158-209); bla (2245-3102); участок инициации репликации fl ori (3234-3689); участок инициации репликации pBR322 (1484).
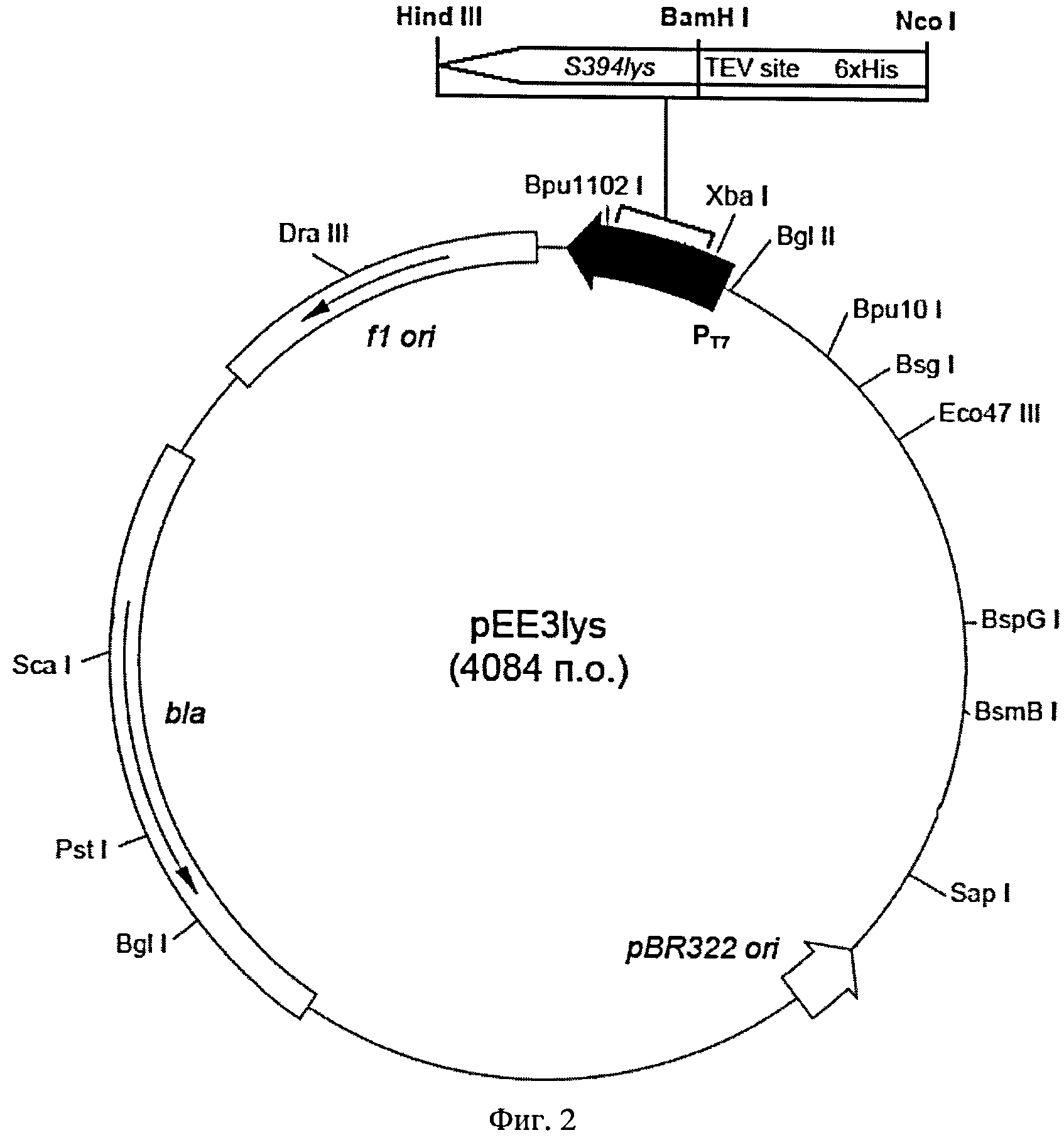
На Фигуре 2 показана схема рекомбинантной плазмидной ДНК pEE3lys. Плазмидный вектор pEE3lys: Т7 промотор (337-353 п.о.); ген гидролазы пептидогликана (177-650); bla (2629-3476); участки инициации репликации fl ori (3618-4073); участок инициации репликации pBR322 (1868).
Осуществление изобретения
Пример 1. Конструирование рекомбинантной плазмидной ДНК pEE3lys, содержащей ген S394lys, кодирующий гидролазу пептидогликана из бактериофага S-394
Плазмиду pEE3lys конструируют путем клонирования ПЦР-фрагмента, содержащего ген S394lys в экспрессионный вектор pEE3 (Фиг. 1). Этот вектор создан на основе вектора рЕТ23 (Novagen) и отличается от рЕТ23 измененной полилинкерной последовательностью, которая позволяет синтезировать гидролазу пептидогликана из бактериофага S-394 с последовательностью из 6 гистидинов на N-конце, отделенной от гена-вставки сайтом гидролиза протеазы вируса табачной мозаики (TEV-протеазы). Вектор pEE3 размером 3700 пар оснований содержит Т7 промотор (337-353 п.о.); последовательность, кодирующую His-Tag (237-254); полилинкер BamHI-XhoI (158-209); последовательность, кодирующую His-Tag (140-157); терминатор Т7 (26-72); кодирующую область гена bla (2245-3102), обеспечивающую устойчивость штаммов E.coli к ампициллину; участок инициации репликации f1 (3234-3689); участок инициации репликации pBR322 (1484) (Фиг. 1).
Все стандартные генно-инженерные и микробиологические манипуляции проводили по известным методикам [Sambrook, J., Fritsch, E.F., and Maniatis, Т., Molecular Cloning: a Laboratory Manual. Cold Spring Harbor: Cold Spring Harbor Laboratory, 1989].
Для получения биомассы бактериофага S-394 к суспензии клеток Е. coli штамма CR63 в среде LB добавляют частицы бактериофага из расчета 3 частица фага на 1 клетку Е. coli. Смесь инкубируют 6 часов при 37°C. Из полученной биомассы выделяют геномную ДНК, которую используют в качестве матрицы для ПЦР.
Кодирующую часть гена S394lys амплифицируют используя в качестве матрицы ДНК бактериофага S-394. Для амплификации кодирующей части гена S394lys используют праймеры, содержащие сайты рестрикции BamHI и HindIII (394for 5′-ATAggATCCAgTTTTAAATTTggTAAAAATA-3′ и 394rev 5′-ATAAAgCTTAgACTAATTCTACgTgACCAC-3′, сайты узнавания рестриктаз подчеркнуты), и Taq ДНК-полимеразу (Fermentas). Полимеразную цепную реакцию проводят согласно методике компании Fermentas. Полученный ПЦР-продукт включает кодирующую область гена S394lys размером 414 п.о.
С целью получения плазмидной конструкции для экспрессии гидролазы пептидогликана из бактериофага S-394 ПЦР-продукт, содержащий кодирующую область гена S394lys, клонируют в экспрессионный вектор рЕЕ3. Для этого вектор рЕЕ3 и ПЦР-продукт обрабатывают рестриктазами BamHI и HindIII. Из рестрикционной смеси выделяют фрагмент вектора размером 3669 п.о. и фрагмент ПЦР-продукта размером 415 п.о. Выделенные фрагменты смешивают и лигируют; полученной лигазной смесью трансформируют клетки Е. coli NovaBlue. Селекцию клонов проводят на агаризованной среде LB с ампициллином. В результате получают рекомбинантный штамм Е. coli NovaBlue/pEE3lys, содержащий плазмиду pEE3lys. Правильность клонирования и отсутствие ошибок в последовательности гена S394lys подтверждают секвенированием плазмидной вставки. Штамм Е. coli NovaBlue/pEE3lys не синтезирует гидролазу эфиров альфа-аминокислот из-за отсутствия в клетках штамма Е. coli NovaBlue Т7 РНК полимеразы.
Рекомбинантная плазмидная ДНК pEE3lys (SEQ ID NO:3) имеет размер 4084 пар нуклеотидов (п.н.) и содержит ген гидролазы пептидогликана из бактериофага S-394, регулируемый Т7 промотором и терминатором; ген bla, обеспечивающий устойчивость Е. coli к ампициллину; участки инициации репликации pBR322 и f1. На N-конце открытой рамки считывания, включающей кодирующую часть гена S394lys, расположены последовательности, кодирующие 6 His и сайт гидролиза для протеазы вируса табачной мозаики (TEV-протеазы) (Фиг. 2).
Пример 2. Получение штамма Е. coli C41 (DE3)/pEE3lys
С целью получения рекомбинантного штамма Е. coli - продуцента гидролазы пептидогликана, клетки штамма Е. coli C41 (DE3) трансформируют плазмидой pEE3lys методом химической трансформации. Селекцию трансформантов проводят на LB-агаре, содержащем ампициллин (100 мкг/л). В результате получают заявляемый штамм Е. coli C41 (DE3)/pEE3lys, синтезирующий гидролазу пептидогликана из бактериофага S-394 (пример 4).
Заявляемый штамм C41 (DE3)/pEE3lys имеет следующие морфологические и физиолого-биохимические характеристики.
Морфологические признаки
Клетки прямые, палочковидные, подвижные, грамотрицательные, неспорообразующие. При выращивании в течение 24-72 час при температуре 30-37°C на агаризованных средах (LB, 2YT), содержащих ампициллин (100 мг/л), колонии гладкие, круглые, блестящие, край ровный.
Состав среды LB, мас.%:
Бакто-триптон - 1
дрожжевой экстракт - 0,5
NaCl - 1,
вода - остальное.
Состав среды 2YT, мас.%:
Бакто-триптон - 1,6
дрожжевой экстракт - 1,0
NaCl - 0,5
вода - остальное.
Физиолого-биохимические признаки
Штамм растет при температуре от 25 до 40°C (оптимум 37°C). В качестве источника азота использует органический азот в виде пептона, аминокислот.
Штамм Е. coli C41 (DE3)/pEE3lys синтезирует гидролазу пептидогликана из бактериофага S-394 после индукции 0,5 мМ ИПТГ (изопропил-β-D-тиогалактозидом).
Генотипические признаки
Штамм Е. coli C41 (DE3)/pEE3lys устойчив к ампициллину.
Штамм Е. coli C41 (DE3)/pEE3lys содержит на плазмиде pEE3lys ген гидролазы пептидогликана из бактериофага S-394 под контролем Т7 промотора.
Пример 3. Получение штамма Е. coli C43 (DE3)/pEE3lys
Получение заявляемого штамма Е. coli C43 (DE3)/pEE3lys происходит аналогично примеру 2 за исключением того, что плазмидой pEE3lys трансформируется штамм Е. coli C43 (DE3).
Морфологические признаки
Клетки прямые, палочковидные, подвижные, грамотрицательные, неспорообразующие. При выращивании в течение 24-72 ч при температуре 30-37°C на агаризованных средах (LB, 2YT), содержащих ампициллин (100 мг/л), колонии гладкие, круглые, блестящие, край ровный.
Физиолого-биохимические признаки
Штамм растет при температуре от 25 до 40°C (оптимум 37°C). В качестве источника азота использует органический азот в виде пептона, аминокислот.
Штамм Е. coli C43 (DE3)/pEE3lys синтезирует гидролазу пептидогликана из бактериофага S-394 после индукции 0,5 мМ ИПТГ (изопропил-β-D-тиогалактозидом).
Генотипические признаки
Штамм Е. coli C43 (DE3)/pEE3lys устойчив к ампициллину.
Штамм Е. coli C43 (DE3)/pEE3lys содержит на плазмиде pEE3lys ген гидролазы пептидогликана из бактериофага S-394 под контролем Т7 промотора.
Пример 4. Биосинтез гидролазы пептидогликана с использованием штамма Е. coli C41 (DE3)/pEE3lys и добавлением индуктора ИПТГ
Исходным посевным материалом служит культура Е. coli C41 (DE3)/pEE3lys, выращенная на чашках Петри с агаризованной средой. Посевной материал выращивают путем инкубации клеток при температуре 37°C в течение 15-17 часов на среде LB, содержащей 100 мкг/мл ампициллина.
Процесс биосинтеза ведут к колбах Эрленмейера объемом 2 л, содержащих 500 мл среды LB с ампициллином (100 мкг/л). Посевной материал вносят в ферментационную среду в количестве, необходимом для создания его концентрации около 0,5 об. %. Процесс культивирования продуцента ведут при температуре 37°C на круговой качалке со скоростью вращения 200-220 об/мин до достижения оптической OD600=0,6-0,8 ОЕ (около 3 часов культивирования), после чего в культуральную жидкость добавляют ИПТГ до концентрации 0.5 мМ. Ферментацию продолжают при тех же условиях в течение еще 3 часов.
Биомассу клеток отделяют центрифугированием при 5000 об/мин.
Из 0,5 л ферментационной среды получают 1,9 г влажной биомассы.
Содержание сухих веществ весовым методом после высушивания препарата при (105±1)°C до постоянной массы. Содержание белка в биомассе клеток определяют методом Брэдфорда [М. Bradford, ″A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding,″ Analytical Biochemistry, vol. 72, pp. 248-254, 1976], предварительно разрушая клетки с помощью ультразвука.
Активность ферментных препаратов по гидролизу пептидогликана определяют по начальной скорости просветления суспензии клеток Е. coli штамма CR63, предварительно обработанных хлороформом [R. Lavigne K. Hertveldt, J. Robben, G. Volckaert, Y Briers ″Identification and characterization of a highly thermostable bacteriophage lysozyme,″ Cellular and Molecular Life Sciences, vol. 61, no. 21, pp. 2753-2759, 2004.] в следующих условиях: pH 8,5, (22±1)°C, начальная оптическая плотность клеток Е. coli CR63, обработанных хлороформом, составляет 0,5 единиц оптической плотности при длине волны 600 нм. Величину ферментативной активности выражают в единицах оптической плотности в секунду (е.О.П./с) или в единицах оптической плотности в минуту (е.О.П./мин).
Полученная биомасса клеток характеризуется следующими показателями:
- содержание сухих веществ: 20,7%;
- гидролазная активность: 450 е.О.П./мин·г влажн.; 2200 е.О.П./мин·г сух.;
- удельная активность: 5,3 е.О.П./мин·мг белка.
Пример 5. Биосинтез гидролазы пептидогликана с использованием штамма Е. coli C41 (DE3)/pEE3lys без добавления индуктора
Способ осуществляют по примеру 3, с той разницей, что культивирование ведут в течение 6 часов без добавления индуктора ИПТГ.
Из 0,5 л культуральной жидкости получают 2.05 г влажной биомассы.
Полученная биомасса клеток характеризуется следующими показателями:
- содержание сухих веществ - 18,8%;
- гидролазная активность: 35 е.О.П./мин·г влажн.; 202 е.О.П./мин·г сух.;
- удельная активность: 0,42 е.О.П./мин·мг белка.
Пример 6 (контроль). Биосинтез гидролазы эфиров альфа-аминокислот с использованием штамма Е. coil C41 (DE3)
Способ осуществляют по примеру 4, используя для ферментации культуру штамма Е. coli C41 (DE3), отличающегося от заявляемого штамма Е. coli C41 (DE3)/pEE3lys отсутствием плазмиды pEE3lys.
Из 200 мл культуральной жидкости получают 1,1 г влажной биомассы. Полученная биомасса клеток характеризуется следующими показателями:
- содержание сухих веществ - 18,8%;
- гидролазная активность по отношению к пептидогликану не детектируется.
Пример 7. Биосинтез гидролазы пептидогликана с использованием штамма Е. coli C43 (DE3)/pEE3lys и добавлением индуктора ИПТГ
Способ осуществляется по примеру 4 с той разницей, что в качестве посевного материала используется штамм C43(DE3)/PEE3lys.
Полученная биомасса клеток характеризуется следующими показателями:
- содержание сухих веществ: 20,5%;
- гидролазная активность: 150 е.О.П./мин·г влажн.; 730 е.О.П./мин·г сух.;
- удельная активность: 5,1 е.О.П./мин·мг белка.
Пример 8. Биосинтез гидролазы пептидогликана с использованием штамма Е. coli C43 (DE3)/pEE3lys без добавления индуктора
Способ осуществляют по примеру 7, с той разницей, что культивирование ведут в течение 6 часов без добавления индуктора ИПТГ.
Из 0,5 л культуральной жидкости получают 2.0 г влажной биомассы.
Полученная биомасса клеток характеризуется следующими показателями:
- содержание сухих веществ - 19,0%;
- гидролазная активность: 11 е.О.П./мин·г влажн.; 65 е.О.П./мин·г сух.;
- удельная активность: 0,40 е.О.П./мин·мг белка.
Пример 9 (контроль). Биосинтез гидролазы пептидогликана с использованием штамма Е. coli C43 (DE3)
Способ осуществляют по примеру 4, используя для ферментации культуру штамма E. coli C41 (DE3), отличающегося от заявляемого штамма Е. coli C43 (DE3)/pEE3lys отсутствием плазмиды pEE3lys.
Из 200 мл культуральной жидкости получают 1,0 г влажной биомассы. Полученная биомасса клеток характеризуется следующими показателями:
- содержание сухих веществ - 18,8%;
- гидролазная активность по отношению к пептидогликану не детектируется.
Высокий уровень гидролазной активности гидролазы пептидогликана в биомассах рекомбинантных штаммов Е. coli C41 (DE3)/pEE3lys и Е. coli C43 (DE3)/pEE3lys после индукции экспрессии, по сравнению с неиндуцированной культурой, подтверждает экспрессию гена S394lys из бактериофага S-394, находящегося в E. coli под действием промотора Т7 (табл. 1 и табл. 2)
Результаты биосинтеза гидролазы пептидогликана из бактериофага S-394 различными штаммами-продуцентами данного фермента сопоставлены в табл. 1 и 2.
|
|
Таким образом, продемонстрирована возможность получения генетически модифицированных бактерий Е. coli, способных к биосинтезу гидролазы пептидогликана из бактериофага S-394 с высоким уровнем биосинтеза целевого продукта.
Заявляемая технология позволяет синтезировать внутриклеточную гидролазу пептидогликана в значительных количествах и создает возможности для разработки высокоэффективных технологичных средств контроля грамотрицательной микрофлоры.
Заявляемые рекомбинантные штаммы-продуценты гидролазы пептидогликана относят к виду E. coli, природные представители которого не способны синтезировать данный фермент. Введение нового вида бактерий в число высокоэффективных продуцентов гидролазы пептидогликана предоставляет дополнительные возможности для разработки эффективных способов ее биосинтеза.