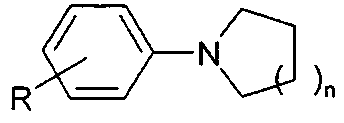
СПОСОБ ПОЛУЧЕНИЯ N-АРИЛПИРРОЛИДИНОВ И N-АРИЛПИПЕРИДИНОВ
Вид РИД
Изобретение
Предлагаемое изобретение относится к области органического синтеза, в частности к способу получения N-арилпирролидинов и N-арилпиперидинов.
Циклические амины ряда N-арилпирролидинов и N-арилпиперидинов находят широкое применение в производстве фармацевтических препаратов, агрохимикатов, гербицидов, фунгицидов, красителей и т.д. [Tan W., Li С, Zheng J., Shi L., Sun Q., He Y. Nat. Gas Chem.,2008, 17 (4), 383].
N-Фенилпирролидин и N-фенилпиперидин получают взаимодействием анилина с 1,4-бутан- и 1,5-пентандиолами в присутствии 1,3,5-триазо-2,4,6-трифосфин-2,2,4,4,6,6-гексанхлорида (TAPC тример фосфонитрилхлорида, стоимость 5 г 38€ [http://www.acros.com]). Реакция проходит в жестких условиях: 200°C, 36 ч в 1,2,4-триметилбензоле [Du Y., Oishi S., Saito S. Chem. Eur. J., 2011, 17, 12262].
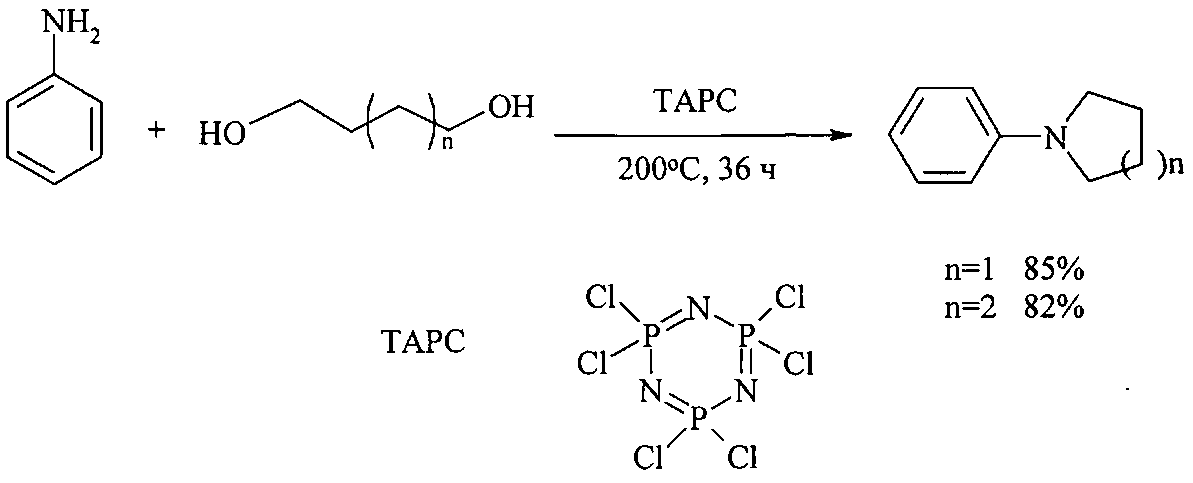
Недостатки метода:
1. Значительная продолжительность реакции (36 ч).
2. Проведение реакции при повышенной температуре (200°C).
3. Использование в качестве растворителя высококипящего 1,2,4-триметилбензола, который создает трудности при выделении и очистке целевых продуктов.
4. Применение в качестве катализатора высокотоксичного и дорогостоящего 1,3,5-триазо-2,4,6-трифосфин-2,2,4,4,6,6-гексанхлорида (TAPC).
В работе [Tan W., Li СМ., Zheng J., Shi L., Sun Q., He Y.H. J. Nat. Gas Chem., 2008, 17 (4), 383; Li С.М., Miao Z.L., Shi L., Sun Q., He Y.H. Chin. Chem. Lett., 2006, 17(12), 1540] синтез N-фенилпиперидина осуществлен взаимодействием анилина с 1,5-пентандиолом в присутствии γ-Al2O3. Катализатор γ-Al2O3 (SBET=290 м2/г, 20-40 меш) получают в результате обжига активного оксида алюминия при 500°C в течение 4 часов. Выход продукта зависит от микроструктуры Al2O3, он выше для катализатора с большим общим объемом пор.
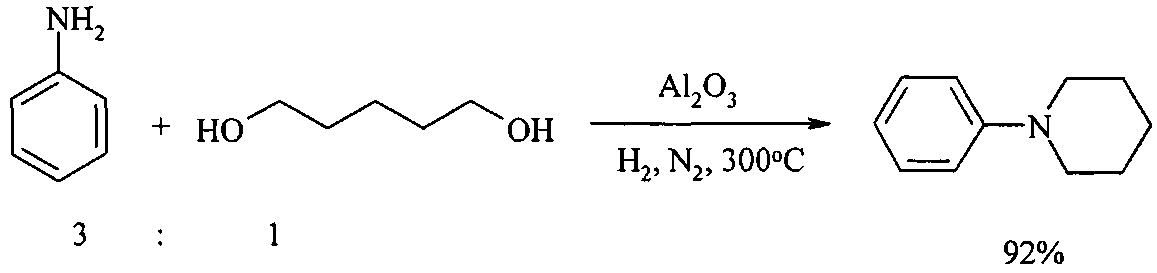
Недостатки метода:
1. Необходимость проведения реакции при повышенной температуре (300°C).
2. Активация Al2O3 перед использованием проводится прокаливанием при высокой температуре (500°C), что приводит к большим энергозатратам.
3. Реакция проходит под давлением.
Снизить температуру реакции удается за счет использования нанесенных катализаторов. Так, циклические амины были получены N-гетероциклизацией анилинов с α,ω-диолами под действием гетерогенного катализатора Pt-Sn/γ-Al2O3 (0,5 мас % Pt, Pt/Sn соотношения=1:3), обладающего дегидрирующими свойствами [Не W., Wang L, Sun С, Wu К., Не S., Chen J., Wu P., Z. Yu, Chem. Eur. J., 2011, 17, 13308].
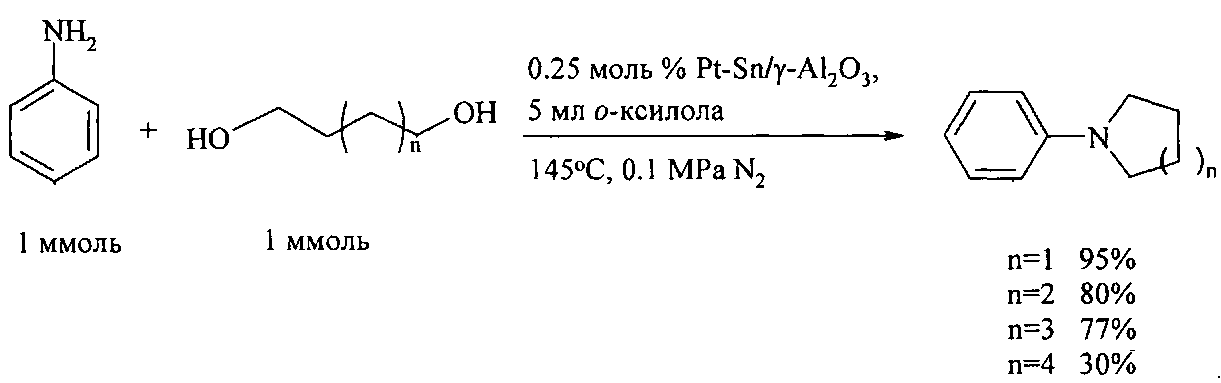
Для синтеза N-арилпирролидинов и N-арилпиперидинов широко используются гомогенные катализаторы. Так, взаимодействие анилинов с 1,4-бутандиолом под действием пентаметилциклопентадиенильного комплекса иридия Cp∗Ir в присутствии основания NaHCO3 (эквимолярное количество по отношению к катализатору) приводит к N-фенилпирролидину и N-(4-метоксифенил)пирролидину с выходом 70% и 90% соответственно. Электронодорный заместитель в фенильном кольце анилина способствует значительному увеличению выхода целевого продукта [Fujita K. - I., Fujii Т., Yamaguchi R. Org. Lett., 2004, 6 (20), 3525].
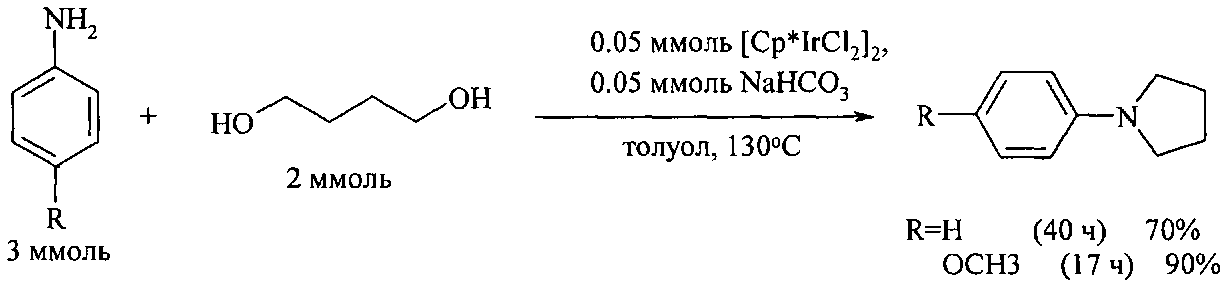
Недостатки метода:
1. Необходимость использования дорогостоящего иридиевого катализатора.
2. Значительная продолжительность реакции (17-40 ч).
Для синтеза циклических аминов ряда пирролидина и пиперидина гетероциклизацией анилинов с диолами широко используются рутенийсодержащие катализаторы.
Так, N-фенилпиперидин получают реакцией анилина с 1,5-пентандиолом. Реакция катализируется комплексами рутения RuCl2(PPh3)3 [Tsuji Y., Huh K. - T., Ohsugi Y., Watanabe Y., J. Org. Chem., 1985, 50 (9), 1985].
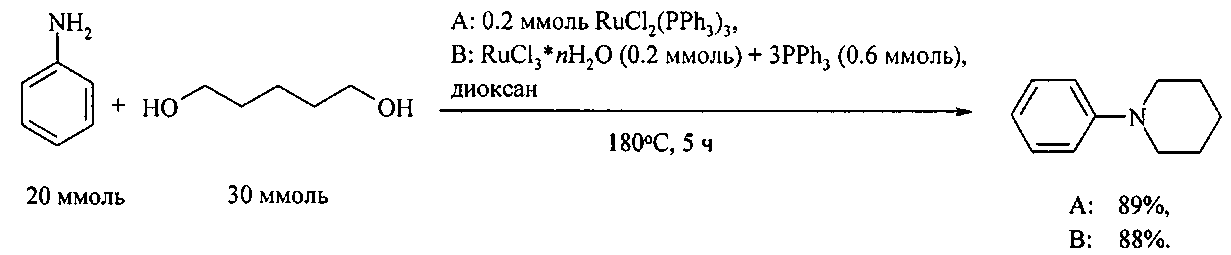
N-фенилпирролидин и N-фенилпиперидин получают реакцией анилина с 1,4-бутандиолом и 1,5-пентандиолом под действием комплексов рутения(II) RuCl2(PPh3)3 и RuCl3·xH2O/3PPh3 [Abbenhuis R., Boersma J., Koten G. J. Org. Chem., 1998, 63, 4282].
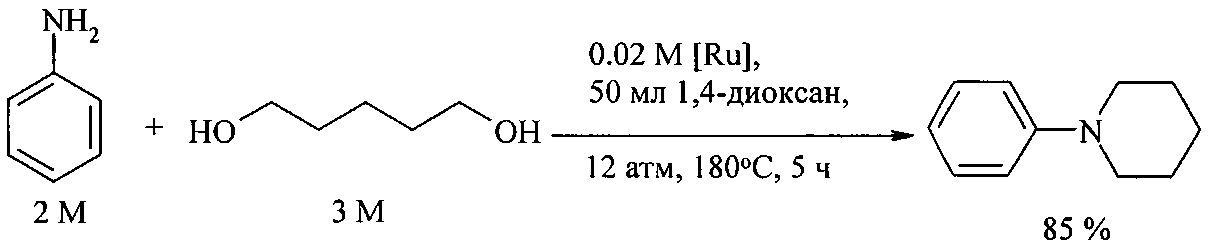
Недостатки метода:
1. Дороговизна рутенийсодержащих катализаторов.
2. Необходимость проведения процесса под давлением.
Циклические амины (N-фенилпирролидин и N-фенилпиперидин) были получены взаимодействием анилина с диолами в присутствии катализатора [Ru(p-cymene)Cl2]2, активированного бидентатным фосфиновым лигандом - бис [(2-дифенилфосфин)фениловым] эфиром (DPEphos), [Hamid M.H.S.A, Allen C.L., Lamb G.W., Maxwell A.C., Maytum H.C., Watson AJ.A., Williams J.M.J. J. Am. Chem. Soc, 2009, 131, 1766].

Использование микроволнового излучения позволяет сократить продолжительность реакции с 24 до 1,5 ч. Избыток диола способствует увеличению выхода целевого продукта. [Watson A., Maxwell A.,J. Williams J. Org. Chem., 2011, 76, 2328].

N-фенилпиперидин получают реакцией 1,5-пентандиола с анилином под действием рутенийсодержащего катализатора [Ru(p-cymene)Cl2]2, активированного лигандом 1,1′-бис(дифенилфосфин)ферроценом (dppf) и в присутствии молекулярных сит. При использовании катализатора менее 5 мол.% наряду с N-фенилпиперидином образуются лактоны и другие побочные продукты [Hamid М., Williams J. Chem. Commun., 2007, 725].

Недостатки методов:
1. Значительная продолжительность реакции (24 ч).
2. Необходимость использования дорогостоящего рутениевого катализатора.
3. Использование дорогостоящих лигандов: dppf- и DPEphos.
4. Трудность масштабирования из-за использования микроволнового излучения.
Авторами предлагается способ получения циклических аминов, не имеющий вышеперечисленных недостатков.
Сущность способа заключается во взаимодействии анилинов общей формулы R-C6H4NH2 (где R=H, o-, м-, n-CH3, o-C2H5, о-, м-, n-Cl, n-F) с α,ω-диолами (1,4-бутандиол, 1,5-пентандиол) в присутствии катализатора FeCl3·6H2O в среде четыреххлористого углерода при 180°C в течение 4-8 ч при мольном соотношении [FeCl3·6H2O]:[RC6H4NH2]:[диол]:[CCl4]=0.2-0.5:100:100-400:20-100. Оптимальными для проведения реакции являются следующие соотношения катализатора и реагентов: [FeCl3·6H2O]:[RC6H4NH2]:[диол]:[CCl4]=0.5:100:200:30. При температуре 180°C и продолжительности реакции 6 ч выход N-арилпирролидинов (1-9) достигает 45-88%, а N-арилпиперидинов (10-18) - 33-85%. Синтез проводят в атмосфере аргона.
В отсутствие катализатора и CCl4 реакция не проходит.
Оптимальные условия реакции отрабатывали на примере взаимодействия анилина с 1,5-пентандиолом под действием FeCl3·6H2O в среде CCl4. Примеры, подтверждающие способ, приведены в таблице 1.
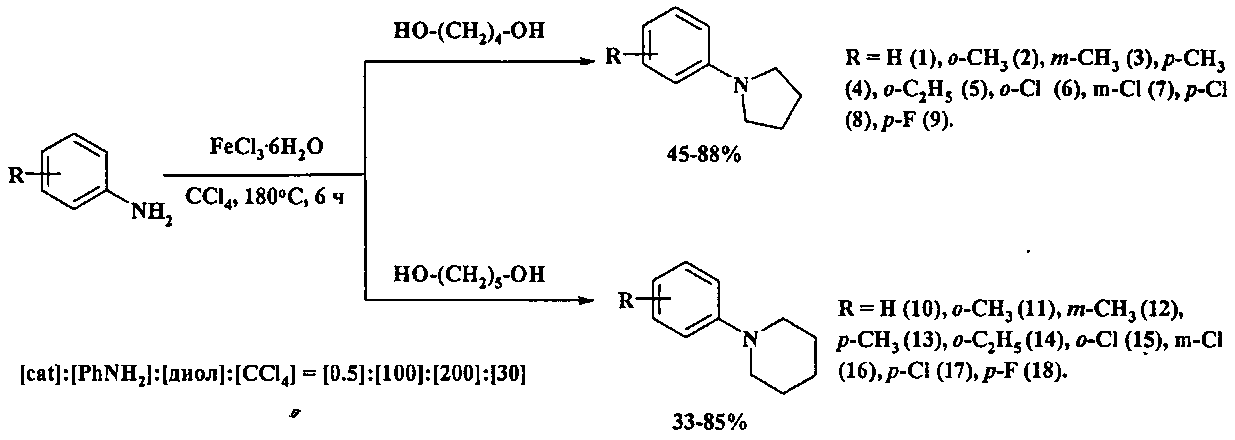
Существенные отличия предлагаемого способа от прототипа.
Для получения циклических аминов из замещенных анилинов и α,ω-диолов используют катализатор FeCl·6H2O, реакция проводится в среде СС14.
Преимущества предлагаемого метода.
1. Высокий выход целевых продуктов.
2. Селективность процесса.
3. Доступность и дешевизна исходных реагентов и катализатора.
4. Удешевление себестоимости и упрощение технологии в целом за счет уменьшения энерго- и трудозатрат.
Строение полученных N-арилпирролидинов (1-9) и N-арилпиперидинов (10-18) доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и литературными данными.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. Получение N-фенилпиперидина (10).
В ампулу в токе аргона загружали 2.9 мг (0.5 ммоль) FeCl3·H2O, 0.2 мл (100 ммоль) анилина, 0.45 мл (200 ммоль) 1,5-пентандиола, 0.06 мл (30 ммоль) CCl4. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 180°C в течение 6 ч, затем автоклав охлаждали до ~20°C, ампулу вскрывали, реакционную массу нейтрализовали 10% водным раствором Na2CO3, органический слой экстрагировали хлористым метиленом и отфильтровывали. Растворители отгоняли, остаток перегоняли под вакуумом.
N-Фенилпиперидин (10)
Выход 85%. Бесцв. масло, т. кип. 73-74°C/0.4 мм рт.ст. (Tкип 86°C/1 мм рт.ст. [Abbenhuis R., Boersma J., Koten G. J. Org. Chem., 1998, 63, 4282-4290]).
Спектр ЯМР 13C (δ, м.д.): 152.22 (C-1), 129.04 (C-3, C-5), 119.36 (C-4), 116.66 (C-2, C-6), 50.81 (C-2′, C-6′), 25.88 (C-3′, C-5′), 24.34 (C-4′). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.25-7.35 м (2H, C3,5H), 7.00 д (2H, C2,6H, J 8.0 Гц), 6.80-6.96 м (1H, C4H), 3.15-3.26 м (4H, C2′,6′H2), 1.70-1.80 м (4Н, C3′,5′H2), 1.55-1.68 м (2H, C4′H2).
ПРИМЕРЫ 2-16 (см. табл.1). Аналогично примеру 1.
ПРИМЕР 17. Получение N-(2-метилфенил)пиперидина (11).
Аналогично примеру 1, но вместо анилина использовали 0.2 мл (100 ммоль) 2-метиланилина.
N-(2-метилфенил)пиперидин (11)
Выход 42%. Светло-желт. масл. ж., т. кип. 96-97°C/2 мм рт.ст. (Tкип 274.8°C/760 мм рт.ст. [http://www.lookchem.com]).
Спектр ЯМР 13C (δ, м.д.): 149.87 (C-1), 131.56 (C-3), 126.74 (C-5), 132.41 (C-2), 124.31 (C-4), 119.32 (C-6), 18.31 (C-7), 54.08 (C-2′, C-6′), 25.74 (C-3′, C-5′), 23.76 (C-4′). Спектр ЯМР 1H (CDCl3, δ, м.д.): 6.80-6.92 м (1H, C5H), 7.08-7.20 м (1H, C3H), 7.09-7.28 м (1H, C4H), 6.91-7.05 м (1H, C6H), 2.41 с (3H, C7H3), 2.99 уш с (4H, C2′,6′H2), 1.86 уш с (4H, C3′,5′H2), 1.50-1.70 м (2H, C4′H2).
Масс-спектр, m/z (Iотн. (%)): 175 [M]+ (86), 176 (11), 174 (100), 146 (28), 134 (12), 132 (18), 130 (7), 120 (15), 119 (21), 118 (86), 117 (12), 91 (38), 77 (8), 65 (22), 55 (6).
ПРИМЕР 18. Получение N-(3-метилфенил)пиперидина (12).
Аналогично примеру 1, но вместо анилина использовали 0.2 мл (100 ммоль) 3-метиланилина.
N-(3-метилфенил)пиперидин (12)
Выход 47%. Светло-желт. масл. ж., т. кип. 95-97°C/0.5 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 148.34 (C-1), 139.45 (C-3), 129.32 (C-5), 124.56 (C-4), 119.90 (C-2), 115.62 (C-6), 53.49 (C-2′, C-6′), 24.69 (C-3′, C-5′), 23.18 (C-4′), 21.64 (C-7). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.05-7.30 м (1H, C5H), 6.80-6.90 м (1H, C6H), 6.53 с (1H, C2H), 6.45-6.70 м (1H, C4H), 3.23-3.26 м (4H, C2′,6′H2), 2.33 с (3H, C7H3), 2.14-2.25 м (4H, C3′,5′H2), 1.48-1.73 м(2H, C4′H2).
Масс-спектр, m/z (Iотн. (%)): 175 [M]+ (81), 174 (100), 160 (7), 146 (12), 134 (15), 120 (9), 119 (36), 118 (28), 91 (38), 65 (16).
ПРИМЕР 19. Получение N-(4-метилфенил)пиперидина (13).
Аналогично примеру 1, но вместо анилина использовали 0.2 г (100 ммоль) 4-метиланилина.
N-(4-метилфенил)пиперидин (13)
Выход 61%. Светло-желт. масл. ж., т. кип. 106-107°C/1 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 142.18 (C-1), 137.94 (C-4), 129.92 (C-3, C-5), 120.42 (C-2, C-6), 56.15 (C-2′, C-6′), 23.17 (C-3′, C-5′), 21.94 (C-4′), 20.86 (C-7). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.56 д (1H, C3,5H, J 8.0 Гц), 7.11 д (1H, C2,6H, J 8.0 Гц), 3.30-3.45 м (4H, C2′,6′H2), 2.24 с (3H, C7H3), 1.70-2.15 м (4H, C3′,5′H2), 1.52-2.05 м (2H, C4′H2).
Масс-спектр, m/z (Iотн. (%)): 175 [M]+ (98), 174 (100), 160 (12), 146 (9), 134 (13), 120 (9), 119 (32), 118 (24), 91 (29), 64 (10).
ПРИМЕР 20. Получение N-(2-этилфенил)пиперидина (14).
Аналогично примеру 1, но вместо анилина использовали 0.2 мл (100 ммоль) 2-этиланилина.
N-(2-этилфенил)пиперидин (14)
Выход 38%. Желт. масл. ж., т. кип. 75-77°C/0.3 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 152.29 (C-1), 139.26 (C-2), 128.87 (C-3), 126.36 (C-5), 123.62 (C-4), 119.85 (C-6), 54.36 (C-2′, C-6′), 26.60 (C-3′, C-5′), 24.36 (C-7), 23.44 (C-4′), 14.89 (C-8). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.27 м (1H, C5H), 7.19 м (1H, C3H), 7.10 м (1H, C4H), 6.81 м (1H, C6H), 3.51-3.69 кв (2H, C7H2), 2.69-3.02 м (4H, C2′,6′H2), 1.69-1.93 м (4H, C3′,5′H2), 1.51-1.69 м (2H, C4′H2), 1.30 т (3H, C8H3, J 7.6 Гц).
ПРИМЕР 21. Получение N-(2-хлорфенил)пиперидина (15).
Аналогично примеру 1, но вместо анилина использовали 0.16 мл (100 ммоль) 2-хлоранилина.
N-(2-хлорфенил)пиперидин (15)
Выход 33%. Светло-желт. масл. ж., т. кип. 89-90°C/0.2 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 148.74 (C-1), 130.49 (C-3), 128.87 (C-4), 127.48 (C-5), 123.22 (C-2), 120.55 (C-6), 52.89 (C-2′, C-6′), 26.25 (C-3′, C-5′), 24.26 (C-4′). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.33 м (1H, C3H, J 8.0 Гц), 7.15-7.22 м (1H, C5H), 7.04 д (1H, C6H, J 8.0 Гц), 6.92 т (1H, C4H), 2.75-3.18 м (4H, C2′,6′H2), 1.65-1.88 м (4H, C3′,5′H2), 1.45-1.88 м (2H, C4′H2).
ПРИМЕР 22. Получение N-(3-хлорфенил)пиперидина (16).
Аналогично примеру 1, но вместо анилина использовали 0.17 мл (100 ммоль) 3-хлоранилина.
N-(3-хлорфенил)пиперидин (16)
Выход 35%. Светло-желт. масл. ж., т. кип. 115-116°C/0.08 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 152.80 (C-1), 134.85 (C-3), 130.26 (C-5), 118.95 (C-4), 116.16 (C-6), 114.49 (C-2), 50.34 (C-2′, C-6′), 25.52 (C-3′, C-5′), 24.14 (C-4′). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.15 т (1H, C5H, J 8.0 Гц), 6.84 д (1H, C4H, J 8.0 Гц), 6.92 с (1H, C2H), 6.79 д (1H, C6H, J 8.0 Гц), 3.10-3.22 м (4H, C2′,6′H2), 1.53-1.78 м (4H, C3′,5′H2), 1.53-1.63 м (2H, C4′H2).
ПРИМЕР 23. Получение N-(4-хлорфенил)пиперидина (17).
Аналогично примеру 1, но вместо анилина использовали 0.2 г (100 ммоль) 4-хлоранилина.
N-(4-хлорфенил)пиперидин (17)
Выход 40%. Светло-желт. масл. ж., т. кип. 92-94°C/0.5 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 144.90 (C-1), 128.95 (C-3, C-5), 123.07 (C-4), 118.11 (C-2, C-6), 51.19 (C-2′, C-6′), 25.46 (C-3′, C-5′), 23.94 (C-4′). Спектр ЯМР 1H (CDCl3, δ, м.д.): 6.93 д (2H, C3,5H, J 8.0 Гц), 6.60 д (2H, C2,6H, J 8.0 Гц), 3.07-3.20 м (4H, C2′,6′H2), 1.69-1.83 м (4H, C3′,5′H2), 1.52-1.66 м (2H, C4′H2).
Масс-спектр, m/z (Iотн. (%)): 195.5 [M]+ (91), 197 (36), 196 (41), 194 (100), 154 (25), 141 (16), 140 (30), 139 (42), 138 (37), 125 (14), 111 (50), 77 (18), 75 (32), 56 (15), 55 (39).
ПРИМЕР 24. Получение N-(4фторфенил)пиперидина (18).
Аналогично примеру 1, но вместо анилина использовали 0.17 мл (100 ммоль) 4-фторанилина.
N-(4фторфенил)пиперидин (18)
Выход 35%. Светло-желт. масл. ж., т. кип. 100-101°C/2 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 143.02 (C-1), 160.09 (C-4, J13C19F 244 Гц), 116.28 (C-3, C-5, J13C19F 22 Гц), 121.47 (C-2, C-6), 55.00 (C-2′, C-6′), 24.20 (C-3′, C-5′), 22.35 (C-4′). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.46 уш с (2H, C3,5H), 6.59 уш с (2H, C2,6H), 3.22 уш с (4H, C2′,6′H2), 1.93 уш с (4H, C3′,5′H2), 1.59 уш с (2H, C4′H2). Спектр ЯМР 19F (CDCl3, δ, м.д.): 116.13.
ПРИМЕР 25. Получение N-фенилпирролидина (1).
Аналогично примеру 1, но вместо диола использовали 0.38 мл (200 ммоль) 1,4-бутандиола.
N-фенилпирролидин (1)
Выход 88%). Бесцв. масл. ж., т. кип. 89-90°C/1 мм рт.ст. (T. кип. 81°C/0.5 мм.рт.ст. [Abbenhuis R., Boersma J., Koten G. J. Org. Chem., 1998, 63, 4282-4290]).
Спектр ЯМР 13C (δ, м.д.): 148.06 (C-1), 129.22 (C-3, C-5), 115.53 (C-4), 111.81 (C-2, C-6), 47.72 (C-2′, C-5′), 25.56 (C-3′, C-4′). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.30-7.38 м (2H, C3,5H), 6.74-6.82 м (1H, C4H), 6.69 д (2H, C2,6H, J 8.0 Гц), 3.30-3.40 м (4H, C2′,5′H2), 2.05-2.15 м (4H, C3′,4′H2).
Масс-спектр, m/z (Iотн. (%)): 147 [M]+ (94), 148 (10), 146 (100), 119 (9), 118 (7), 104 (25), 92 (6), 91 (72), 77 (46), 65 (7), 51 (19).
ПРИМЕР 26. Получение N-(2-метилфенил)пирролидина (2).
Аналогично примеру 25, но вместо анилина использовали 0.2 мл (100 ммоль) 2-метиланилина.
N-(2-метилфенил)пирролидин (2)
Выход 50%. Светло-желт. масл. ж., т. кип. 122-124°C/10 мм рт.ст. (Т. кип. 255°C/760 мм рт.ст. [http://www.lookchem.com]).
Спектр ЯМР 13C (δ, м.д.): 148.14 (C-1), 131.92 (C-3), 129.20 (C-5), 126.56 (C-2), 121.68 (C-4), 116.59 (C-6), 49.74 (C-2′, C-5′), 24.52 (C-3′, C-4′), 20.35 (C-7). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.12-7.30 м (1H, C5H), 6.98-7.12 м (1H, C3H), 6.88-6.98 м (1H, C4H 6.60-6.80 м (1H, C6H), 3.25-3.45 м (4H, C2′,5′H2), 1.96-2.15 м (4H, C3′,4′H2).
ПРИМЕР 27. Получение N-(3-метилфенил)пирролидина (3).
Аналогично примеру 25, но вместо анилина использовали 0.2 мл (100 ммоль) 3-метиланилина.
N-(3-метилфенил)пирролидин (3)
Выход 63%). Светло-желт. масл. ж., т. кип. 93-95°C/0.08 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 148.15 (C-1), 138.83 (C-3), 129.11 (C-5), 116.61 (C-4), 112.53 (C-2), 109.14 (C-6), 47.79 (C-2′, C-5′), 25.55 (C-3′, C-4′), 21.98 (C-7). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.20-7.35 м (1H, C5H), 6.63 д (1H, C6H, J 8.0 Гц), 6.53 с (H, C2H), 6.52 д (1H, C4H J 8.0 Гц), 3.37-3.40 м (4H, C2′,5′H2), 2.45 с (3H, C7H3), 2.08-2.11 м (4H, C3′,4′H2).
Масс-спектр, m/z (Iотн. (%)): 161 [M]+ (72), 160 (100), 118 (22), 117 (9), 105 (69), 91 (56), 89 (11), 77 (14), 65 (34), 63 (10), 51 (11).
ПРИМЕР 28. Получение N-(4-метилфенил)пирролидина (4).
Аналогично примеру 25, но вместо анилина использовали 0.2 г (100 ммоль) 4-метиланилина.
N-(4-метилфенил)пирролидин (4)
Выход 75%. Светло-желт. масл. ж., т. кип. 108-110°C/0.1 мм рт.ст. (Т. кип. 274.1°C/760 мм рт.ст. [http://www.weiku.com/chemicals/]).
Спектр ЯМР 13C (δ, м.д.): 145.85 (C-1), 129.68 (C-3, C-5), 124.98 (C-4), 112.19 (C-2, C-6), 48.26 (C-21, C-5′), 25.39 (C-3′, C-4′), 20.36 (C-7). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 7.07 д (2H, C3,5H, J 8.0 Гц), 6.56 д (2H, C2,6H, J 8.0 Гц), 3.20-3.40 м (4H, C2′,5′H2), 2.28 с (3H, C7H3), 2.01 м (4H, C3′,4′H2).
Масс-спектр, m/z (Iотн. (%)): 161 [M]+ (76), 160 (100), 118 (31), 117 (12), 105 (79), 91 (64), 89 (16), 78 (9), 77 (18), 65 (38), 63 (10), 51 (13).
ПРИМЕР 29. Получение N-(2-этилфенил)пирролидина (5).
Аналогично примеру 25, но вместо анилина использовали 0.2 мл (100 ммоль) 2-этиланилина.
N-(2-этилфенил)пирролидин (5)
Выход 47%. Желт. масл. ж., т. кип. 88-90°C/0.8 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 148.40 (C-1), 135.60 (C-2), 129.46 (C-3), 126.27 (C-5), 121.42 (C-4), 116.88 (C-6), 52.03 (C-2′, C-5′), 25.31 (C-3′, C-4′), 24.91 (C-7), 14.49 (C-8). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.22 д (1H, C3H, J 7.2 Гц), 7.14 д (1H, C6H, J 8.0 Гц), 6.94-7.01 м (1H, C4H), 6.63-6.77 м (1H, C5H), 3.12-3.40 уш с (4H, C2′,5′H2), 2.68-2.85 кв (2H, C7H2), 1.90-2.12 уш с (4H, C3′,4′H2), 1.29 т (3H, C8H3, J 7.6 Гц).
Масс-спектр, m/z (Iотн. (%)): 175 [M]+ (80), 174 (100), 160 (7), 146 (12), 134(15), 120 (9), 119(35), 118 (27), 91 (37), 65 (16).
ПРИМЕР 30. Получение N-(2-хлорфенил)пирролидина (6).
Аналогично примеру 25, но вместо анилина использовали 0.16 мл (100 ммоль) 2-хлоранилина.
N-(2-хлорфенил)пирролидин (6)
Выход 51%. Светло-желт. масл. ж., т. кип. 115-117°C/0.6 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 146.98 (C-1), 131.29 (C-3), 127.29 (C-5), 126.44 (C-2), 123.59 (C-4), 120.91 (C-6), 51.26 (C-2′, C-5′), 25.20 (C-3′, C-4′). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.28-7.40 м (1H, C3H), 7.11-7.22 м (1H, C5H), 6.92-7.08 м (1H, C6H), 6.75-6.90 м (1H, C4H), 3.32-3.51 уш с (4H, C2′,5′H2), 1.88-2.08 уш с (4Н, C3′,4′H2).
Масс-спектр, m/z (Iотн. (%)): 181.5 [M]+ (100), 182 (29), 180 (95), 140 (24), 138 (42), 124 (85), 118 (17), 117 (37), 111 (45), 90 (29), 88 (31), 77 (36), 74 (25), 73 (20), 62 (16), 50 (30).
ПРИМЕР 31. Получение N-(3-хлорфенил)пирролидина (7).
Аналогично примеру 25, но вместо анилина использовали 0.17 мл (100 ммоль) 3-хлоранилина.
N-(3-хлорфенил)пирролидин (7)
Выход 50%. Светло-желт. масл. ж., т. кип. 120-122°C/0.4 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 148.83 (C-1), 134.78 (C-3), 129.98 (C-5), 114.95 (C-4), 111.27 (C-2), 109.89 (C-6), 47.57 (C-2′, C-5′), 25.41 (C-3′, C-4′). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.04-7.08 м (1H, C5H), 6.55 д (1H, C4H, J 8.0 Гц), 6.46 с (1H, C2H), 6.37 д (1H, C6H, J 8.0 Гц), 3.05-3.32 уш с (4H, C2′,5′H2), 1.85-2.05 уш с (4H, C3′,4′H2).
ПРИМЕР 32. Получение N-(4-хлорфенил)пирролидина (8).
Аналогично примеру 25, но вместо анилина использовали 0.2 г (100 ммоль) 4-хлоранилина.
N-(4-хлорфенил)пирролидин (8)
Выход 60%. Светло-желт. масл. ж., т. кип. 132-134°C/0.3 мм рт.ст. (Т. кип. 288.4°C/760 мм рт.ст. [http://www.lookchem.com]).
Спектр ЯМР 13C (δ, м.д.): 146.51 (C-1), 128.90 (C-3, C-5), 120.04 (C-4), 112.73 (C-2, С-6), 47.78 (C-2′, C-5′), 25.56 (C-3′, С-4′). Спектр ЯМР 1H (CDCl3, δ, м.д.): 7.14 д (2H, C3,5H, J 8.0 Гц), 6.46 д (2H, C2,6H, J 8.0 Гц), 3.17-3.31 м (4H, C2′,5′H2), 1.96-2.09 м (4H, С3′,4′H2).
Масс-спектр, m/z (Iотн. (%)): 181.5 [M]+ (88), 183 (23), 182 (30), 180 (100), 138 (37), 127 (17), 125 (66), 111 (19), 110 (46), 91 (16), 89 (19), 75 (20), 63 (18), 52 (19), 51 (18).
ПРИМЕР 33. Получение N-(4-фторфенил)пирролидина (9).
Аналогично примеру 25, но вместо анилина использовали 0.17 мл (100 ммоль) 4-фторанилина.
N-(4-фторфенил)пирролидин (9)
Выход 45%. Светло-желт. масл. ж., т. кип. 92-94°C/1 мм рт.ст.
Спектр ЯМР 13C (δ, м.д.): 144.83 (C-1), 154.83 (C-4, J13C19F 232 Гц), 112.14 (C-3, C-5, J13C19F 8 Гц), 115.43 (C-2, C-6, J13C19F 22 Гц), 48.18 (C-2′, C-5′), 25.53 (C-3′, C-4′). Спектр ЯМР 1H (CDCl3, 5, м.д.): 6.91-7.00 м (2H, C3,5H), 6.44-6.53 м (2H, С2,6H), 3.18-3.32 м (4H, C2′,5′H2), 1.92-2.10 м (4H, C3′,4′H2).
Спектр ЯМР 19F (CDCl3, δ, м.д.): - 130.73.
Масс-спектр, m/z (Iотн (%)): 165 [M]+ (94), 164 (73), 136 (11), 124 (15), 123 (19), 122 (63), 111 (12), 110 (21), 109 (100), 95 (10), 94 (46), 75 (14), 64 (9). 50 (10).
|