Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 6-ИМИНО-2,7-ДИОКСАБИЦИКЛО[3.2.1]ОКТАН-4,4,5-ТРИКАРБОНИТРИЛОВ
Вид РИД
Изобретение
Изобретение относится к области органической химии, а именно к способам получения функционально замещенных конденсированных гетероциклических молекул - 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилов общей формулы (А), которые могут быть использованы в качестве биологически активных соединений, подавляющих рост опухолевых клеток и проявляющих цитотоксическую активность по отношению к раку прямого кишечника, почек, молочной железы и меланомы (О.Е. Nasakin, A.N. Lyshchikov, Ya.S. Kayukov, V.P. Sheverdov // Pharmaceutical Chemistry Journal Vol.34, No. 4, 2000, p.170-185).

где R1=R2=Me, R3=Et (A1); R1=R2=Me, R3=Pr (A2); R1=R2=Me, R3=i-Pr (A3); R1=R2=Me, R3=Bu (A4); R1=R2=Me, R3=Ph (A5); R1=R2=Me, R3=4-Me-C6H4 (A6); R1=R2=Me, R3=3-F-C6H4 (A7); R1=R2=Me, R3=4-MeO-C6H4 (A8); R1=R2=Me, R3=4-NO2-C6H4 (A9); R1=R2=Me, R3=2-Fu (A10); R1=R2=Me. R3=2-Thi (A11); R1=Et, R2=Me, R3=Ph (A12); R1=Et, R2=Me, R3=4-MeO-C6H4 (A13); R1=Et, R2=Me, R3=4-NO2-C6H4 (A14); R1=Et, R2=Me, R3=2-Pyr (A15); R1=Et, R2=Me, R3=2-Fu (A16); R1=Me, R2=Pr, R3=Pr (A17); R1=Me, R2=Pr, R3=i-Pr (A18); R1=Me, R2=Pr, R3=Ph (A19); R1=Me, R2=Ph, R3=Et (A20); R1=Me, R2=Ph, R3=i-Pr (A21); R1=Me, R2=Ph, R3=Bu (A22); R1=Me, R2=Ph, R3=Ph (A23); R1=Me, R2=Ph, R3=3-F-C6H4 (A24); R1=Me, R2=Ph, R3=4-NO2-C6H4 (A25); R1=Me, R2-Ph, R3=2-Fu (A26); R1+R2=(CH2)4, R3=Pr (A27); R1+R2=(CH2)4, R3=i-Pr (A28); R1+R2=(CH2)4, R3=Ph (A29); R1+R2=(CH2)4, R3=3-F-C6H4 (A30); R1+R2=(CH2)4, R3=4-МеО-С6Н4 (A31); R1+R2=(CH2)4, R3=4-NO2-C6H4 (A32); R1+R2=(CH2)4, R3=2-Pyr (A33); R1+R2=(CH2)4, R3=2-Fu (A34); R1+R2=(CH2)4, R3=2-Thi (A35); R1+R2=(CH2)5, R3=Ph (A36); R1+R2=(CH2)5, R3=3-F-C6H4 (A37):R1+R2=(CH2)5, R3=2-Pyr (A38).
Известен способ получения 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилов общей формулы (1),

где R=Ph, R′=H (1a); R=Me, R′=Me (1б); R=Et, R′=H (1в); R=Pr, R′=H (1г); R=Me, R′=Ph (1д); R=Et, R′=Et (1e) путем взаимодействия тетрацианоэтилена с двукратным мольным избытком альдегида в среде 1,4-диоксана в присутствии катализатора - 10% соляной кислоты, с последующим разбавлением реакционной массы водой и выделением конечного продукта. Выходы 38-72% (A.V. Eremkin. O.V. Ershov, S.N. Mol′kov. V.P. Sheverdov, O.E. Nasakin, Ya.S. Kayukov, V.A. Tafeenko // Russian Journal of Organic Chemistry, 2006, Vol.42, №2, p.193-197).
Однако данный способ не позволяет получать 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилы общей формулы (А) с заместителем R1, а также накладывает ограничения в плане варьирования заместителей во 2-м и 5-м положении пиранового кольца молекулы. В источнике информации также описан способ получения соединения (А34) на основе трехкомпонентной системы тетрацианоэтилен-циклогексанон-фурфурол в среде 1,4-диоксана в присутствии каталитического количества 10% соляной кислоты.

Однако на данный способ также накладываются значительные ограничения. В ходе анализа способа выявлено, что в случае альдегидов, склонных к енолизации, и кетонов со стерически объемными заместителями результатом взаимодействия будут являться смеси веществ, что делает способ неприемлемым в качестве общего. Также к недостаткам можно отнести токсичность растворителя 1,4-диоксана.
Наиболее близким по технической сущности к заявляемому изобретению является способ получения 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилов общей формулы (А), где R1=R2=Me, R3=Et (A1); R1=R2=Me, R3=Pr (A2); R1=R2=Me, R3=i-Pr (A3); R1=R2=Me, R3=Ph (A5); R1=R2=Me, R3=2-Fu (A10); R1+R2=(CH2)4 R3=Pr (A27); R1+R2=(CH2)4, R3=i-Pr (A28); R1+R2=(CH2)4, R3=Ph (A29); R1+R2=(CH2)4, R3=2-Fu (A34), заключающийся в том, что свежеприготовленный высушенный 4-оксоалкан-1,1,2,2-тетракарбонитрил общей формулы (2) суспендируют в пропаноле-2 и при перемешивании в атмосфере азота при комнатной температуре прибавляют в одну порцию небольшой мольный избыток альдегида, растворенного в пропаноле-2.
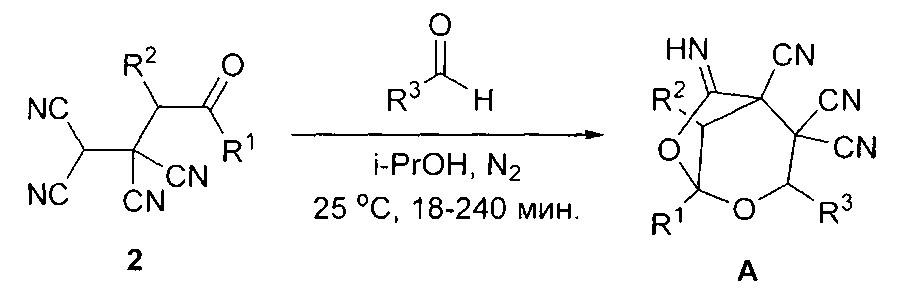
После перемешивания в течение 0,3-4 часов выпавшие кристаллы фильтруют (при необходимости реакционную массу разбавляют водой). Выходы 84-96% (О.Е. Насакин, Е.Г. Николаев, П.Б. Терентьев, А.Х. Булай, Б.А. Хаскин, К. Дагер // Химия гетероциклических соединений, 1984, №11, с.1462-1466).
Первоначально авторами предполагалось, что в результате взаимодействия происходит формирование 3-имино-2,6-диоксабицикло[2.2.2]октан-4,8,8-трикарбонитрилов строения (А*).

Позже структура была уточнена методом рентгеноструктурного анализа, и доказано, что конечными продуктами являются именно 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилы (А) (Я.С. Каюков, П.М. Лукин, О.Е. Насакин, В.Н. Хрусталев, В.Н. Нестеров, М.Ю. Антипин, В.В. Шевердов // Химия гетероциклических соединений, 1997, №4, С.432-577).
К недостаткам описанного способа можно отнести его трудоемкость, а именно необходимость использования инертной атмосферы азота, а также свежеперегнанных альдегидов и абсолютированных растворителей. В ходе анализа данного способа, также было выявлено, что при несоблюдении данных требований происходит загрязнение конечных продуктов трудноудаляемыми флуоресцирующими примесями - результатами побочного взаимодействия 4-оксоалкан-1,1,2,2-тетракарбонитрилов с водой.
Задачей данного изобретения является разработка усовершенствованного способа получения функционально замещенных конденсированных гетероциклических молекул, конкретно, 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилов общей формулы (А).
Техническим результатом является усовершенствование способа получения 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилов (А) за счет сокращения времени получения, увеличенного количественного выхода, использования нетоксичного растворителя и без специальных условий (инертной атмосферы).
Технический результат достигается тем, что способ получения 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилов общей формулы (А),

где R1=R2=Me, R3=Et (A1); R1=R2=Me, R3=Pr (A2); R1=R2=Me, R3=i-Pr (A3); R1=R2=Me, R3=Bu (A4); R1=R2=Me, R3=Ph (A5); R1=R2=Me, R3=4-Me-C6H4 (A6): R1=R2=Me, R3=3-F-C6H4 (A7); R1=R2=Me, R3=4-MeO-C6H4 (A8); R1=R2=Me, R3-4-NO2-C6H4 (A9); R1=R2=Me, R3=2-Fu (A10); R1=R2=Me, R3=2-Thi (A11); R1=Et, R2=Me, R3=Ph (A12); R1=Et, R2=Me, R3=4-MeO-C6H4 (A13); R1=Et, R2=Me, R3=4-NO2-C6H4 (A14); R1=Et, R2=Me, R3=2-Pyr (A15); R1=Et, R2=Me, R3=2-Fu (A16); R1=Me, R2=Pr, R3=Pr (A17); R1=Me, R2=Pr, R3=i-Pr (A18); R1=Me, R2=Pr, R3=Ph (A19); R1=Me, R2=Ph, R3=Et (A20); R1=Me, R2=Ph, R3=i-Pr (A21); R1=Me, R2=Ph, R3=Bu (A22); R1=Me, R2=Ph, R3=Ph (A23); R1=Me, R2=Ph, R3=3-F-C6H4 (A24); R1=Me, R2=Ph, R3=4-NO2-C6H4 (A25); R1=Me, R2=Ph, R3=2-Fu (A26); R1+R2=(CH2)4, R3=Pr (A27); R1+R2=(CH2)4, R3=i-Pr (A28); R1+R2=(CH2)4, R3=Ph (A29); R1+R2=(CH2)4, R3=3-F-C6H4 (A30); R1+R2=(CH2)4, R3=4-MeO-C6H4 (A31); R1+R2=(CH2)4, R3-4-NO2-C6H4 (A32); R1+R2=(CH2)4, R3=2-Pyr (A33); R1+R2=(CH2)4, R3=2-Fu (A34); R1+R2=(CH2)4, R3=2-Thi (A35); R1+R2=(CH2)5, R3=Ph (A36); R1+R2-(CH2)5, R3=3-F-C6H4 (A37); R1+R2=(CH2)5, R3=2-Pyr (A38), включающий суспендирование соответствующего 4-оксоалкан-1,1,2,2-тетракарбонитрила, согласно изобретению суспендирование проводят в водном растворе уксусной кислоты с концентрацией 50-85%, после чего к реакционной массе добавляют соответствующий 1,3,5-тризамещенный 2,4-диазапента-1,4-диен в мольном соотношении 2:1 и реакционную массу перемешивают в течение 20-30 минут до получения целевого продукта.
Способ осуществляется по следующей схеме реакции:

где R1=R2=Me, (2а); R1=Et, R2=Me, (2б); R1=Me, R2=Pr, (2в); R1=Me, R2=Ph, (2г); R1+R2=(CH2)4 (2д); R1+R2=(CH2)5 (2e); R3=Et (3a); R3=Pr (36); R3=i-Pr (3в); R3=Bu (3г); R3=Ph (3д); R3=4-Me-C6H4 (3e); R3=3-F-C6H4 (3ж); R3=4-MeO-C6H4 (3з); R3=4-NO2-C6H4 (3и); R3=2-Fur (3к); R3=2-Thi (3л); R3=2-Pyr (3м).
Сопоставительный анализ заявляемого решения с известными показывает, что предлагаемый способ является более простым, эффективным и универсальным. Метод характеризуется простотой исполнения, отсутствием специальных требований, в частности инертной атмосферы, а также значительным сокращением времени протекания реакции с сохранением высокого выхода конечного продукта. Стоит также отметить, что продукты реакции не содержат трудноудаляемых примесей - продуктов конкурирующей реакции 4-оксоалкан-1,1,2,2-тетракарбонитрилы с водой, что свидетельствует о высокой скорости и селективности протекания процесса взаимодействия тетрацианоэтилированных кетонов (2) с азометинами (3). Исходные 4-оксоалкан-1,1,2,2-тетракарбонитрилы (2) являются легкодоступными соединениями, получаемыми из тетрацианоэтилена и соответствующего кетона в 1,4-диоксане (О.Е. Насакин, П.Б. Терентьев, Б.А. Хаскин, В.Г. Петров // Журн. орг. химии. 1984. Т.20. №1. С.205-206; АС СССР №759507, опубл. 30.08.1980). 1,3,5-Тризамещенные 2,4-диазапента-1,4-диены (3) являются коммерчески доступными, а также могут быть легко синтезированы взаимодействием альдегидов с аммиаком (Н. Strain // Journal of the American Chemical Society. 1927. Vol.49. №6. P.1558-1571), ацетатом аммония (L. Levai, D. Bozsing, P. Benko, Gy. Lax, Gy. Mikite, P. Tömpe, A. Nagy, E. Furdyga // Synthetic Communications. 1992. Vol.22. №1. P.47-61) или 1,1,1,3,3,3-гексаметилдисилазаном в присутствии кислот Льюиса (К. Nishiyama, М. Saito, М. Oba // Bulletin of the Chemical Society of Japan. 1988. Vol.61. №2. P.609-611).
Строение полученных соединений подтверждается данными ЯМР 1H спектроскопии и масс-спектрометрии.
Сущность изобретения заключается в описанном способе получения 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилов общей формулы (А):
0,005 моль 4-оксоалкан-1,1,2,2-тетракарбонитрила (2) суспендируют в 15 мл 50-85% уксусной кислоты. Затем к реакционной массе при интенсивном перемешивании прибавляют 0,0025 моль соответствующего 1,3,5-тризамещенного 2,4-диазапента-1,4-диена (3), происходит полное растворение исходных компонентов, затем через 5-10 минут спонтанная выкристаллизация продукта реакции. Для более полного осаждения реакционную массу перемешивают еще около 15-20 минут, затем выпавшие кристаллы отделяют фильтрованием. Промывают водой до нейтральной реакции, затем охлажденным пропанолом-2, диэтиловым эфиром.
Пример 1. Способ получения 6-имино-3-этил-1,8-диметил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А1). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) и 1,3,5-триэтил-2,4-диазапента-1,4-диена (3а). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 89%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.13 т (3Н, CH3CH2), 1.28 д (3Н, CH3CH), 1.58 с (3Н, СН3С), 1.80-1.99 м (2Н, СН2), 2.83 к (1Н, CH3CH), 4.19 дд (1Н, OCHCH2), 9.40 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 258 (2.7) [М+].
Пример 2. Способ получения 6-имино-3-пропил-1,8-диметил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А2). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) и 1,3,5-трипропил-2,4-диазапента-1,4-диена (3б). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 84%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 0.99 т (3Н, CH3CH2), 1.26 д (3Н, CH3CH), 1.46-1.69 м (2Н, СН2), 1.58 с (3Н, СН3С), 1.78-1.89 м (2Н, СН2), 2.87 к (1Н, CH3CH), 4.21 дд (1Н, OCHCH2), 9.44 с (1Н, NH). Масс-спектр, m/z(Iотн., %): 272 (1.5) [М+].
Пример 3. Способ получения 3-изопропил-6-имино-1,8-диметил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (A3). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) и 1,3,5-триизопропил-2,4-диазапента-1,4-диена (3в). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 87%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.11 д (3Н, CH3CH2), 1.19 д (3Н, CH3CH), 1.25 д (3Н, CH3CH), 1.58 с (3Н, СН3С), 2.02-2.14 м (1Н, CH(CH3)2), 2.81 к (1Н, CH3CH), 3.92 д (1Н, ОСН), 9.38 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 272 (1.7) [М+].
Пример 4. Способ получения 3-бутил-6-имино-1,8-диметил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А4). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) и 1,3,5-трибутил-2,4-диазапента-1,4-диена (3г). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 81%. Спектр ЯМР 1Н (ДМСО-d6), δ. м.д.: 0.89 т (3Н, CH3CH2), 1.20 д (3Н, CH3CH), 1.31-1.52 м (4Н, 2СН2), 1.53 с (3Н, СН3С), 1.75-1.89 м (2Н, СН2), 2.89 к (1Н, CH3CH), 4.26 дд (1Н, OCHCH2), 9.61 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 286 (2.6) [М+].
Пример 5. Способ получения 6-имино-1,8-диметил-3-фенил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А5). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) и 1,3,5-трифенил-2,4-диазапента-1,4-диена (3д). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 91%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.31 д (3Н, CH3CH), 1.69 с (3Н, СН3С), 3.12 к (1Н, CH3CH), 5.50 с (1Н, ОСН), 7.45-7,62 м (5Н, С6Н5), 9.59 с (1H, NH). Масс-спектр, m/z (Iотн., %): 306 (2.9) [М+].
Пример 6. Способ получения 6-имино-1,8-диметил-3-n-толил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А6). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) и 1,3,5-три-n-толил-2,4-диазапента-1,4-диена (3е). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 89%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.32 д (3Н, CH3CH), 1.69 с (3Н, СН3С), 2.42 с (3Н, CH3C6H4), 3.09 к (1Н, CH3CH), 5.40 с (1Н, ОСН), 7.29 д (2Н, С6Н4), 7.47 д (2Н, С6Н4), 9.48 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 320 (2.9) [М+].
Пример 7. Способ получения 6-имино-1,8-диметил-3-(3-фторфенил)-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А7). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) и 1,3,5-три(3-фторфенил)-2,4-диазапента-1,4-диена (3ж). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 85%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.32 д (3Н, CH3CH), 1.69 с (3Н, СН3С), 3.12 к (1Н, CH3CH), 5.57 с (1Н, ОСН), 7.25-7,58 м (4Н, C6H4F), 9.46 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 324 (3.5) [М+].
Пример 8. Способ получения 6-имино-1,8-диметил-3-(4-метоксифенил)-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А8). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) и 1,3,5-три(4-метоксифенил)-2,4-диазапента-1,4-диена (3з). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 79%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.31 д (3Н, CH3CH), 1.67 с (3Н, СН3С), 3.09 к (1Н, CH3CH), 3.86 с (3Н, CH3O), 5.37 с (1Н, ОСН), 6.99 д (2Н, С6Н4), 7.50 д (2Н, С6Н4), 9.45 с (1H, NH). Масс-спектр, m/z (Iотн., %): 336 (2.6) [М+].
Пример 9. Способ получения 6-имино-1,8-диметил-3-(4-нитрофенил)-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А9). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) и 1,3,5-три(4-нитрофенил)-2,4-диазапента-1,4-диена (3и). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 93%. Спектр ЯМР 1Н (ДМСО-d6). δ. м.д.: 1.36 д (3Н, CH3CH), 1.70 с (3Н, СН3С), 3.18 к (1Н, CH3CH), 5.81 с (1Н, ОСН), 7.91 д (2Н, С6Н4), 8.36 д (2Н, С6Н4), 9.59 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 351 (3.3) [М+].
Пример 10. Способ получения 6-имино-1,8-диметил-3-(фуран-2-ил)-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А10). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) и 1,3,5-трифуран-2-ил-2,4-диазапента-1,4-диена (3к). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 91%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.31 д (3Н, CH3CH), 1.68 с (3Н, СН3С), 3.08 к (1Н, CH3CH), 5.52 с (1Н, ОСН), 6.52 д (1H, фурил), 6.81 т (1Н, фурил), 7.72 д (1Н, фурил), 9.49 с (1H, NH). Масс-спектр, m/z (Iотн., %): 296 (1.7) [М+].
Пример 11. Способ получения 6-имино-1,8-диметил-3-(тиофен-2-ил)-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А11). Получали аналогично описанному способу с использованием 3-метил-4-оксопентан-1,1,2,2-тетракарбонитрила (2а) 1,3,5-тритиофен-2-ил-2,4-диазапента-1,4-диена (3л). Суспендирование проводили в 50% растворе уксусной кислоты. Выход: 86%. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.32 д (3Н, CH3CH), 1.69 с (3Н, СН3С), 3.09 к (1Н, CH3CH), 5.81 с (1H, ОСН), 7.14 т (1Н, тиенил), 7.42 д (1Н, тиенил), 7.64 д (1Н, тиенил), 9.47 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 312 (1.5) [М+].
Пример 12. Способ получения 6-имино-8-метил-3-фенил-1-этил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А12). Получали аналогично описанному способу с использованием 3-метил-4-оксогексан-1,1,2,2-тетракарбонитрила (2б) и 1,3,5-трифенил-2,4-диазапента-1,4-диена (3д). (А12). Суспендирование проводили в 65% растворе уксусной кислоты. Выход: 79%. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.08 т (3Н, CH3CH2), 1.33 д (3Н, CH3CH), 2.00 к (2Н, СН2), 3.09 к (1H, CH3CH), 5.46 с (1Н, ОСН), 7.49-7,61 м (5Н, С6Н5), 9.51 с (1H, NH). Масс-спектр, m/z (Iотн., %): 320 (2.1) [М+].
Пример 13. Способ получения 6-имино-8-метил-3-(4-метоксифенил)-1-этил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А13).
Получали аналогично описанному способу с использованием 3-метил-4-оксогексан-1,1,2,2-тетракарбонитрила (2б) и 1,3,5-три(4-метоксифенил)-2,4-диазапента-1,4-диена (3з). Суспендирование проводили в 65% растворе уксусной кислоты. Выход: 81%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.06 т (3Н, CH3CH2), 1.33 д (3Н, CH3CH), 1.99 к (2Н, СН2), 3.06 к (1Н, CH3CH), 3.83 с (3Н, CH3O), 5.36 с (1Н, ОСН), 7.01 д (2Н, С6Н4), 7.49 д (2Н, С6Н4), 9.47 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 350 (1.9) [М+].
Пример 14. Способ получения 6-имино-8-метил-3-(4-нитрофенил)-1-этил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А14). Получали аналогично описанному способу с использованием 3-метил-4-оксогексан-1,1,2,2-тетракарбонитрила (2б) и 1,3,5-три(4-нитрофенил)-2,4-диазапента-1,4-диена (3и). Суспендирование проводили в 65% растворе уксусной кислоты. Выход: 89%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.09 т (3Н, CH3CH2), 1.32 д (3Н, CH3CH), 2.01 к (2Н, СН2), 3.18 к (1Н, CH3CH) 5.87 с (1H, ОСН), 7.96 д (2Н, С6Н4), 8.39 д (2Н, С6Н4), 9.61 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 365 (3.2) [М+].
Пример 15. Способ получения 6-имино-8-метил-3-(пиридин-2-ил)-1-этил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А15). Получали аналогично описанному способу с использованием 3-метил-4-оксогексан-1,1,2,2-тетракарбонитрила (26) и 1,3,5-трипиридин-2-ил-2,4-диазапента-1,4-диена (3м). Суспендирование проводили в 65% растворе уксусной кислоты. Выход: 92%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.13 т (3Н, CH3CH2), 1.32 д (3Н, CH3CH), 1.95 к (2Н, СН2), 3.01 к (1Н, CH3CH), 5.59 с (1Н, ОСН), 7.51 дд (1Н, пиридинил), 7.61 д (1Н, пиридинил), 7.97 т (1Н, пиридинил), 8.71 д (1Н, пиридинил), 9.51 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 321 (3.3) [М+].
Пример 16. Способ получения 6-имино-8-метил-3-(фуран-2-ил)-1-этил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А16). Получали аналогично описанному способу с использованием 3-метил-4-оксогексан-1,1,2,2-тетракарбонитрила (26) и 1,3,5-трифуран-2-ил-2,4-диазапента-1,4-диена (3к). Суспендирование проводили в 65% растворе уксусной кислоты. Выход: 84%. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.08 т (3Н, CH3CH2), 1.31 д (3Н, CH3CH), 1.99 к (2Н, СН2), 3.06 к (1Н, CH3CH), 5.52 с (1Н, ОСН), 6.56 д (1H, фурил), 6.81 т (1Н, фурил), 7.75 д (1Н, фурил), 9.53 с (1Н, NH). Масс-спектр, m/z(Iотн., %): 310 (1.8) [М+].
Пример 17. Способ получения 6-имино-1-метил-3,8-дипропил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А17). Получали аналогично описанному способу с использованием 3-пропил-4-оксопентан-1,1,2,2-тетракарбонитрила (2в) и 1,3,5-трипропил-2,4-диазапента-1,4-диена (3б). Суспендирование проводили в 55% растворе уксусной кислоты. Выход: 78%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 0.99-1.07 м (6Н, 2CH3CH2), 1.48-1.70 м (6Н, 3СН2), 1.61 с (3Н, СН3С), 1.79-1.87 м (2Н, СН2), 2.58 т (1Н, CH2CH), 4.18 дд (1Н, OCHCH2), 9.33 с (1H, NH). Масс-спектр, m/z (Iотн., %): 300 (2.3) [М+].
Пример 18. Способ получения 3-изопропил-6-имино-1-метил-8-пропил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А18). Получали аналогично описанному способу с использованием 3-пропил-4-оксопентан-1,1,2,2-тетракарбонитрила (2в) и 1,3,5-триизопропил-2,4-диазапента-1,4-диена (3в). Суспендирование проводили в 55% растворе уксусной кислоты. Выход: 76%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.00 т (3Н, CH3CH2), 1.12 д (3Н, CH3CH), 1.20 д (3Н, CH3CH), 1.52-1.73 м (4Н, 2СН2), 1.61 с (3Н, СН3С), 2.02-2.15 м (1Н, CH(CH3)2), 2.58 т (1Н, CH2CH), 3.89 д (1H, ОСН), 9.28 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 300 (2.5) [М+].
Пример 19. Способ получения 6-имино-1 -метил-8-пропил-3-фенил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А19). Получали аналогично описанному способу с использованием 3-пропил-4-оксопентан-1,1.2,2-тетракарбонитрила (2в) и 1,3,5-трифенил-2,4-диазапента-1,4-диена (3д). Суспендирование проводили в 55% растворе уксусной кислоты. Выход 87%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.05 т (3Н, CH3CH2), 1.54-1.77 м (4Н, 2СН2), 1.70 с (3Н, СН3С), 2.89 т (1Н, CH2CH), 5.49 д (1H, ОСН), 7.48-7,62 м (5Н, С6Н5), 9.59 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 334 (2.9) [М+].
Пример 20. Способ получения 6-имино-1-метил-8-фенил-3-этил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А20). Получали аналогично описанному способу с использованием 3-фенил-4-оксопентан-1,1,2,2-тетракарбонитрила (2г) и 1,3,5-триэтил-2,4-диазапента-1,4-диена (3а). Суспендирование проводили в 85% растворе уксусной кислоты. Выход: 85%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.18 т (3Н. CH3CH2), 1.39 с (3Н, СН3), 1.90-2.06 м (2Н, СН2), 3.98 с (1H, CHC6H5), 4.34 дд (1Н, ОСН), 7.31-7,52 м (5Н, С6Н5), 9.78 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 320 (2.1) [М+].
Пример 21. Способ получения 3-изопропил-6-имино-1-метил-8-фенил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А21). Получали аналогично описанному способу с использованием 3-фенил-4-оксопентан-1,1,2,2-тетракарбонитрила (2г) и 1,3,5-триизопропил-2,4-диазапента-1,4-диена (3в). Суспендирование проводили в 85% растворе уксусной кислоты. Выход: 91%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.17 д (3Н, CH3CH), 1.25 д (3Н, CH3CH), 1.40 с (3Н, СН3С), 2.11-2.25 м (1Н, CH(CH3)2, 3.98 с (1Н, CHC6CH5), 4.12 д (1Н, ОСН), 7.32-7,51 м (5Н, С6Н5), 9.72 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 334 (2.6) [М+].
Пример 22. Способ получения 3-бутил-6-имино-1-метил-8-фенил-2.7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А22). Получали аналогично описанному способу с использованием 3-фенил-4-оксопентан-1,1,2,2-тетракарбонитрила (2г) и 1,3,5-трибутил-2,4-диазапента-1,4-диена (3г). Суспендирование проводили в 85% растворе уксусной кислоты. Выход: 87%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 0.99 т (3Н, CH3CH2), 1.38 с (3Н, СН3С), 1.41-1.67 м (4Н, 2СН2), 1.89-1.98 м (2Н, СН2), 3.91 с (1Н, CHC6H5), 4.35 т (1Н, ОСН), 7.32-7,51 м (5Н, С6Н5), 9.62 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 348 (2.4) [М+].
Пример 23. Способ получения 6-имино-1-метил-3,8-дифенил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А23). Получали аналогично описанному способу с использованием 3-фенил-4-оксопентан-1,1,2,2-тетракарбонитрила (2г) и 1,3,5-трифенил-2,4-диазапента-1,4-диена (3д). Суспендирование проводили в 85% растворе уксусной кислоты. Выход: 93%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.49 с (3Н, СН3С), 4.30 с (1H, CHC6H5), 5.64 с (1Н, OCHC6H5), 7.38-7,72 м (10Н, 2С6Н5), 9.84 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 368 (3.1) [М+].
Пример 24. Способ получения 6-имино-1-метил-8-фенил-3-(3-фторфенил)-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А24). Получали аналогично описанному способу с использованием 3-фенил-4-оксопентан-1,1,2,2-тетракарбонитрила (2г) и 1,3,5-три(3-фторфенил)-2,4-диазапента-1.4-диена (3ж). Суспендирование проводили в 85% растворе уксусной кислоты. Выход: 84%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.49 с (3Н, СН3С), 4.31 с (1Н, CHC6H5), 5.71 с (1Н, OCHC6H5), 7.27-7,59 м (9Н, С6Н5, C6H4F), 9.71 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 386 (3.4) [М+].
Пример 25. Способ получения 6-имино-1-метил-3-(4-нитрофенил)-8-фенил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А25). Получали аналогично описанному способу с использованием 3-фенил-4-оксопентан-1,1,2,2-тетракарбонитрила (2г) и 1,3,5-три(4-нитрофенил)-2,4-диазапента-1,4-диена (3и). Суспендирование проводили в 85% растворе уксусной кислоты. Выход: 90%. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.51 с (3Н, СН3С), 4.47 с (1Н, CHC6H5), 5.99 с (1Н, OCHC6H5), 7.38-7,52 м (5Н, С6Н5), 8.16 д (2Н, C6H4NO2), 8.38 д (2Н, C6H4NO2), 10.17 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 413 (3.1) [М+].
Пример 26. Способ получения 6-имино-1-метил-3-фуран-2-ил-8-фенил-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрила (А26). Получали аналогично описанному способу с использованием 3-фенил-4-оксопентан-1,1,2,2-тетракарбонитрила (2г) и 1,3,5-трифуран-2-ил-2,4-диазапента-1,4-диена (3к). Суспендирование проводили в 85% растворе уксусной кислоты. Выход: 87%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.46 с (3Н, СН3С), 4.21 с (1Н, CHC6H5), 5.78 с (1Н, ОСН), 6.60 т (1Н, фурил), 6.92 д (1Н, фурил), 7.40-7,54 м (5Н, С6Н5) 7.85 д (1H, фурил), 9.92 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 358 (2.6) [М+].
Пример 27. Способ получения 12-имино-9-пропил-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикарбонитрила (А27). Получали аналогично описанному способу с использованием 1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрила (2д) и 1,3,5-трипропил-2,4-диазапента-1,4-диена (36). Суспендирование проводили в 80% растворе уксусной кислоты. Выход: 76%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.02 т (3Н, CH3CH2), 1.04-2.16 м (12Н, 6СН2), 2.70 дд (1Н, СН), 4.24 м (1Н, OCHCH2), 9.48 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 298 (1.9) [М+].
Пример 28. Способ получения 9-изопропил-12-имино-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикарбонитрила (А28). Получали аналогично описанному способу с использованием 1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрила (2д) и 1,3,5-триизопропил-2,4-диазапента-1,4-диена (3в). Суспендирование проводили в 80% растворе уксусной кислоты. Выход: 83%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.11 д (3Н, CH3CH), 1.20 д (3Н, CH3CH), 1.33-2.17 м (9Н, 4СН2, CH(CH3)2, 2.67 дд (1H, СН), 3.98 д (1Н, ОСН2), 9.48 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 298 (2.0) [М+].
Пример 29. Способ получения 12-имино-9-фенил-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикарбонитрила (А29). Получали аналогично описанному способу с использованием 1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрила (2д) и 1,3,5-трифенил-2,4-диазапента-1,4-диена (3д). Суспендирование проводили в 80% растворе уксусной кислоты. Выход: 94%. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.06-2.15 м (8Н, 4СН2), 3.04 дд (1Н, СН), 5.67 с (1H, ОСН), 7.51-7,66 м (5Н, С6Н5). 9.87 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 332 (2.7) [М+].
Пример 30. Способ получения 12-имино-9-(3-фторфенил)-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикарбонитрила (А30). Получали аналогично описанному способу с использованием 1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрила (2д) и 1,3,5-три(3-фторфенил)-2,4-диазапента-1,4-диена (3ж). Суспендирование проводили в 80% растворе уксусной кислоты. Выход: 86%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.12-2.21 м (8Н, 4СН2), 2.98 дд (1Н, СН), 5.50 с (1Н, ОСН), 7.24-7,57 м (4Н, C6H4F), 9.54 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 350 (3.2) [М+].
Пример 31. Способ получения 12-имино-9-(4-метоксифенил)-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикарбонитрила (А31). Получали аналогично описанному способу с использованием 1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрила (2д) и 1,3,5-три(4-метоксифенил)-2,4-диазапента-1,4-диена (3з). Суспендирование проводили в 80% растворе уксусной кислоты. Выход: 81%. Спектр ЯМР 1H (ДМСО-d6), 8, м.д.: 1.11-2.20 м (8Н, 4СН2), 2.97 дд (1H, CH), 3.85 с (3Н, ОСН3), 5.41 с (1H, ОСН), 7.02 д (2Н, C6H4OCH3), 7.53 д (2Н, C6H4OCH3), 9.59 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 362 (2.1) [М+].
Пример 32. Способ получения 12-имино-9-(4-нитрофенил)-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикарбонитрила (А32). Получали аналогично описанному способу с использованием 1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрила (2д) и 1,3,5-три(4-нитрофенил)-2,4-диазапента-1,4-диена (3и). Суспендирование проводили в 80% растворе уксусной кислоты. Выход: 89%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.13-2.24 м (8Н, 4СН2), 3.03 дд (1Н, СН), 5.86 с (1Н, ОСН), 7.94 д (2Н, C6H4NO2), 8.38 д (2Н, C6H4NO2), 9.62 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 377 (3.3) [М+].
Пример 34. Способ получения 12-имино-9-фуран-2-ил-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикарбонитрила (А33). Получали аналогично описанному способу с использованием 1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрила (2д) и 1,3,5-трифуран-2-ил-2,4-диазапента-1,4-диена (3к). Суспендирование проводили в 80% растворе уксусной кислоты. Выход: 77%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.04-2.12 м (8Н, 4СН2), 2.98 дд (1Н, СН), 5.72 с (1Н, ОСН), 6.61 т (1Н, фурил), 6.89 д (1H, фурил), 7.89 д (1Н, фурил), 9.82 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 322 (2.2) [М+].
Пример 35. Способ получения 12-имино-9-тиофен-2-ил-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикарбонитрила (А34). Получали аналогично описанному способу с использованием 1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрила (2д) и 1,3.5-тритиофен-2-ил-2,4-диазапента-1,4-диена (3л). Суспендирование проводили в 80% растворе уксусной кислоты. Выход: 75%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.12-2.22 м (8Н, 4СН2), 2.91 дд (1Н, СН), 5.88 с (1Н, ОСН), 7.14 т (1Н, тиенил), 7.42 д (1Н, тиенил), 7.64 д (1Н, тиенил), 9.62 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 338 (2.1)[М+].
Пример 33. Способ получения 12-имино-9-пиридин-2-ил-10,11-диоксатрицикло[5.3.2.01,6]додекан-7,8,8-трикарбонитрила (А35). Получали аналогично описанному способу с использованием 1-(2-оксоциклогексил)этан-1,1,2,2-тетракарбонитрила (2д) и 1,3,5-трипиридин-2-ил-2,4-диазапента-1,4-диена (3м). Суспендирование проводили в 80% растворе уксусной кислоты. Выход: 90%. Спектр ЯМР 1H (ДМСО-d6), δ, м.д.: 1.16-2.27 м (8Н, 4СН2), 2.87 дд (1Н, СН), 5.50 с (1Н, ОСН), 7.49 м (1Н, пиридинил), 7.63 д (1Н, пиридинил), 7.94 т (1H, пиридинил), 8.70 д (1Н, пиридинил), 9.61 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 333 (3.4) [М+].
Пример 36. Способ получения 13-имино-10-фенил-11,12-диоксатрицикло[6.3.2.01,7]тридекан-8,8,9-трикарбонитрила (А36). Получали аналогично описанному способу с использованием 1-(2-оксоциклогептил)этан-1,1,2,2-тетракарбонитрила (2е) и 1,3,5-трифенил-2,4-диазапента-1,4-диена (3д). Суспендирование проводили в 70% растворе уксусной кислоты. Выход: 85%. Спектр ЯМР 1H (ДМСО-d6), δ. м.д.: 1.41-2.31 м (10Н, 5СН2), 3.19 дд (1Н, СН), 6.06 с (1Н, ОСН), 7.51-7,65 м (5Н, С6Н5), 9.51 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 346 (2.7) [М+].
Пример 37. Способ получения 13-имино-10-(3-фторфенил)-11,12-диоксатрицикло[6.3.2.01,7]тридекан-8,8,9-трикарбонитрила (А37). Получали аналогично описанному способу с использованием 1-(2-оксоциклогептил)этан-1,1,2,2-тетракарбонитрила (2е) и 1,3,5-три(3-фторфенил)-2,4-диазапента-1,4-диена (3ж). Суспендирование проводили в 70% растворе уксусной кислоты. Выход: 81%. Спектр ЯМР 1Н (ДМСО-d6), δ, м.д.: 1.44-2.34 м (10Н, 5СН2), 2.92 дд (1Н, СН), 5.58 с (1Н, ОСН), 7.21-7,55 м (4Н, C6H4F), 9.46 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 364 (3.1) [М+].
Пример 38. Способ получения 13-имино-10-пиридин-2-ил-11,12-диоксатрицикло[6.3.2.01,7]тридекан-8,8,9-трикарбонитрила (А38). Получали аналогично описанному способу с использованием 1-(2-оксоциклогептил)этан-1,1,2,2-тетракарбонитрила (2е) и 1,3,5-трипиридин-2-ил-2,4-диазапента-1,4-диена (3м). Суспендирование проводили в 70% растворе уксусной кислоты. Выход: 88%. Спектр ЯМР 1H (ДМСО-d6), 8, м.д.: 1.45-2.48 м (10Н, 5СН2), 2.80 дд (1Н, СН), 5.49 с (1Н, ОСН), 7.50 м (1Н, пиридинил), 7.63 д (1Н, пиридинил), 7.94 т (1Н, пиридинил), 8.70 д (1Н, пиридинил), 9.52 с (1Н, NH). Масс-спектр, m/z (Iотн., %): 347 (3.3) [М+].
Таким образом, предлагаемый усовершенствованный способ позволяет получить 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилов общей формулы (А), которые могут быть использованы в качестве биологически активных соединений, а именно соединений, подавляющих рост опухолевых клеток и проявляющих цитотоксическую активность по отношению к раку прямого кишечника, почек, молочной железы и меланомы.
Способ получения 6-имино-2,7-диоксабицикло[3.2.1]октан-4,4,5-трикарбонитрилов общей формулы (А) где R=R=Me, R=Et (A1); R=R=Me, R=Pr (A2); R=R=Me, R=i-Pr (A3); R=R=Me, R=Bu (A4); R=R=Me, R=Ph (A5); R=R=Me, R=4-Me-CH (A6); R=R=Me, R=3-F-CH (A7); R=R=Me, R=4-МеО-СН (A8); R=R=Me, R=4-NO-CH (A9); R=R=Me, R=2-Fu (A10); R=R=Me, R=2-Thi (A11); R=Et, R=Me, R=Ph (A12); R=Et, R=Me, R=4-MeO-CH (A13); R=Et, R=Me, R=4-NO-CH (A14); R=Et, R=Me, R=2-Pyr (A15); R=Et, R=Me, R=2-Fu (A16); R=Me, R=Pr, R=Pr (A17); R=Me, R=Pr, R=i-Pr (A18); R=Me, R=Pr, R=Ph (A19): R=Me, R=Ph, R=Et (A20); R=Me, R=Ph, R=i-Pr (A21); R=Me, R=Ph, R=Bu (A22); R=Me, R=Ph, R=Ph (A23); R=Me, R=Ph, R=3-F-CH (A24); R=Me, R=Ph, R=4-NO-CH (A25); R=Me, R=Ph, R=2-Fu (A26); R+R=(CH), R=Pr (A27); R+R=(CH), R=i-Pr (A28); R+R=(CH), R=Ph (A29); R+R=(CH), R=3-F-CH (A30); R+R=(CH), R=4-MeO-CH (A31); R+R=(CH), R=4-NO-CH (A32); R+R=(CH), R=2-Pyr (A33); R+R=(CH), R=2-Fu (A34); R+R=(CH), R=2-Thi (A35); R+R=(CH), R=Ph (A36); R+R=(CH), R=3-F-CH (A37); R+R=(CH), R=2-Pyr (A38), включающий суспендирование соответствующего 4-оксоалкан-1,1,2,2-тетракарбонитрила, отличающийся тем, что суспендирование проводят в водной уксусной кислоте концентрации 50-85%, после чего к реакционной массе добавляют соответствующий 1,3,5-тризамещенный 2,4-диазапента-1,4-диен в мольном соотношении 2:1 и реакционную массу перемешивают в течение 20-30 минут до получения целевого продукта.![СПОСОБ ПОЛУЧЕНИЯ 6-ИМИНО-2,7-ДИОКСАБИЦИКЛО[3.2.1]ОКТАН-4,4,5-ТРИКАРБОНИТРИЛОВ](https://fips.edrid.ru/images/rid/70/57/73/6420d2a3d04355dfb70fbdc4bac160de.png)
![СПОСОБ ПОЛУЧЕНИЯ 6-ИМИНО-2,7-ДИОКСАБИЦИКЛО[3.2.1]ОКТАН-4,4,5-ТРИКАРБОНИТРИЛОВ](https://fips.edrid.ru/images/rid/70/57/73/dce6a6286066d5a40dc85dd97483487d.png)

