Результат интеллектуальной деятельности: ПИРАЗИНЫ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ МОДУЛЯТОРОВ ДЕЛЬТА-ОПИОИДНЫХ РЕЦЕПТОРОВ
Вид РИД
Изобретение
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СМЕЖНЫЕ ИЗОБРЕТЕНИЯ
Настоящая заявка истребует приоритет, заявленный в предварительной заявке на патент США № 61/256392, поданной 30 октября 2009 года, содержание которой полностью включено в настоящий документ путем ссылки.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к созданию новых модуляторов опиоидных рецепторов формулы (I). Настоящее изобретение также относится к способам получения таких соединений, фармацевтических композиций, содержащих такие соединения, а также к их применению для лечения расстройств, модулируемых опиоидными рецепторами.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Термин «опиат» применяется для обозначения фармакологически активных алкалоидов, получаемых из опия, например морфина, кодеина и многих полусинтетических аналогов морфина. После выделения пептидных соединений с аналогичным морфину действием был введен термин «опиоид» для обобщенного обозначения любых препаратов с аналогичным морфину действием. В класс опиоидов входят различные пептиды с аналогичным морфину действием, такие как эндорфины, энкефалины и динорфины. Однако в ряде источников термин «опиат» используется в обобщенном смысле, и в таких контекстах термины «опиат» и «опиоид» являются взаимозаменяемыми. Кроме того, термин «опиоид» также применяется для обозначения антагонистов морфиноподобных препаратов, а также для охарактеризования рецепторов или сайтов связывания, которые могут взаимодействовать с такими агентами.
Опиоиды широко применяются как анальгетики, однако они также могут иметь и множество других фармакологических действий. Морфин и родственные опиоиды оказывают наиболее выраженное действие на центральную нервную и пищеварительную системы. Спектр действия достаточно широк и включает обезболивающее воздействие, сонливость, смену настроения, угнетение дыхательной функции, головокружение, помутнение рассудка, дисфорию, кожный зуд, повышение давления в желчных путях, угнетение моторики желудочно-кишечного тракта, тошноту, рвоту, а также изменения в эндокринной и вегетативной нервной системах.
При введении пациентам с болями морфина в терапевтических дозировках отмечается снижение интенсивности болей, снижение связанного с болями дискомфорта или полное исчезновение болей. Помимо облегчения патологического состояния ряд пациентов также испытывает чувство эйфории. Однако при введении морфина в рекомендованных для достижения обезболивающего эффекта дозировках пациентам, не страдающим от болей, эффект не всегда благоприятный, нередко отмечается тошнота и даже рвота. Возможны также сонливость, неспособность к концентрации, снижение умственной активности, апатия, снижение физической активности, снижение остроты зрения и заторможенность.
С опиодными рецепторами могут связываться два класса опиоидных молекул: указанные выше опиоидные пептиды (например, энкефалины, динорфины и эндорфины) и алкалоидные опиаты (например, морфин, эторфин, дипренорфин и налоксон). После первой демонстрации сайтов связывания опиатов (Pert, C. B. and Snyder, S. H., Science (1973) 179:1011-1014) для классификации множества опиоидных рецепторов были использованы различия в фармакологических и физиологических действиях пептидных аналогов опиоидов и алкалоидных опиатов. Соответственно, были описаны три в молекулярном и фармакологическом отношении разных типа опиоидных рецепторов: дельта, каппа и мю. Более того, в каждом типе принято также выделять подтипы (Wollemann, M., J Neurochem (1990) 54:1095-1101; Lord, J. A., et al., Nature (1977) 267:495-499).
Опиоидные рецепторы трех указанных типов имеют общие функциональные механизмы на клеточном уровне. Например, опиоидные рецепторы вызывают ингибирование аденилатциклазы и секреции нейромедиатора путем как активации калиевых каналов, так и ингибирования Ca2+-каналов (Evans, C. J., In: Biological Basis of Substance Abuse, S. G. Korenman & J. D. Barchas, eds., Oxford University Press (in press); North, A. R., et al., Proc Natl Acad Sci USA (1990) 87:7025-29; Gross, R. A., et al., Proc Natl Acad Sci USA (1990) 87:7025-29; Sharma, S. K., et al., Proc Natl Acad Sci USA (1975) 72:3092-96). Несмотря на то что указанные функциональные механизмы одинаковы, поведенческие проявления селективных к типу рецептора препаратов значительно различаются (Gilbert, P. E. & Martin, W. R., J Pharmacol Exp Ther (1976) 198:66-82). Такие различия могут быть частично связаны с анатомической локализацией рецепторов различного типа.
Рецепторы типа дельта распределены в ЦНС млекопитающих более дискретно, чем рецепторы типа мю и каппа, их концентрации высоки в миндалевидном теле, полосатом теле, черной субстанции, обонятельной луковице, обонятельных бугорках, гиппокампальной формации и коре головного мозга (Mansour, A., et al., Trends in Neurosci (1988) 11:308-14). Примечательным является полное отсутствие опиоидных рецепторов, включая дельта-опиоидные рецепторы, в мозжечке крысы.
Есть постоянная потребность в разработке новых модуляторов дельта-опиоидных рецепторов для использования их в качестве анальгетиков. Также есть потребность в разработке селективных агонистов дельта-опиоидных рецепторов для использования их в качестве анальгетиков со сниженными побочными эффектами. Кроме того, есть потребность в антагонистах дельта-опиоидных рецепторов для использования их в качестве иммунодепрессантов, противовоспалительных агентов, агентов для лечения неврологических и психиатрических состояний, агентов для лечения урологических состояний и расстройств репродуктивной системы, препаратов для лечения алкогольной и наркотической зависимости, агентов для лечения гастрита и диареи, агентов для лечения сердечно-сосудистой системы и агентов для лечения респираторных заболеваний со сниженными побочными эффектами.
Есть постоянная потребность в разработке новых модуляторов опиоидных рецепторов для использования их в качестве анальгетиков. Также есть потребность в разработке агонистов дельта- и мю-опиоидных рецепторов для использования их в качестве анальгетиков со сниженными побочными эффектами. Также есть потребность в разработке агонистов мю-опиоидных рецепторов для использования их в качестве анальгетиков со сниженными побочными эффектами при лечении болевого синдрома, модуляции иммунной функции, лечении желудочно-пищеводного рефлюкса и кашля. Кроме того, также есть потребность в агонистах дельта-опиоидных рецепторов для использования их в качестве обезболивающих агентов, агентов для лечения респираторных заболеваний, агентов для лечения сердечно-сосудистой системы, агентов для лечения урологических расстройств и агентов для лечения неврологических и психиатрических состояний. Также есть потребность в разработке агонистов двойного действия для дельта- и мю-опиоидных рецепторов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
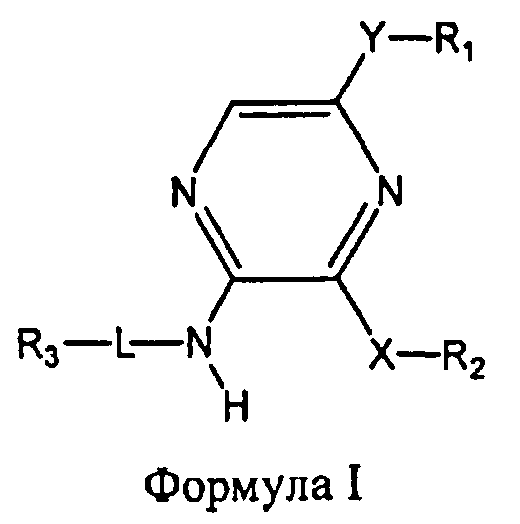
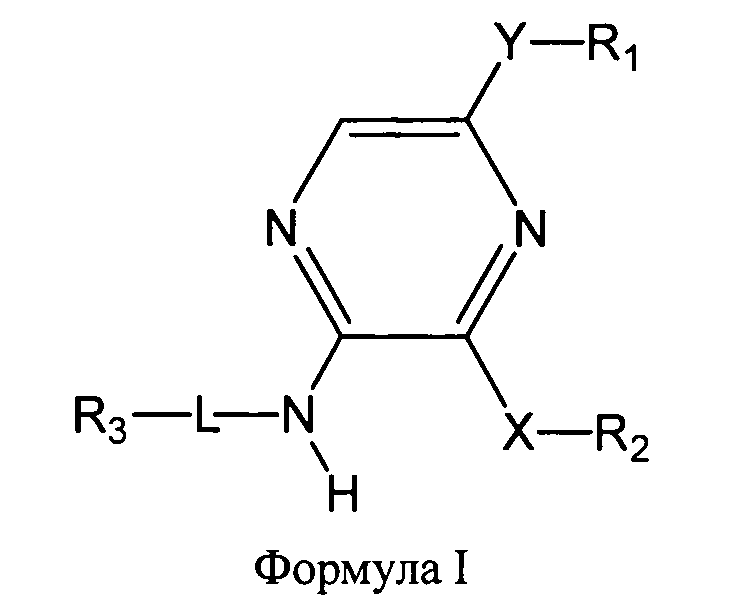
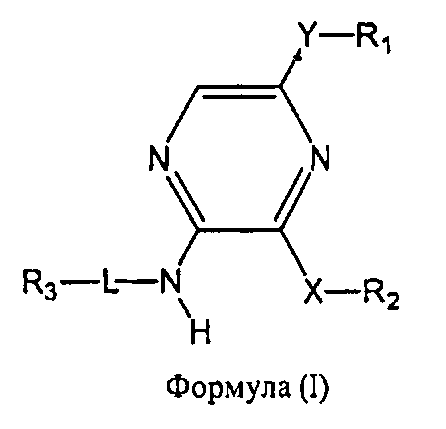
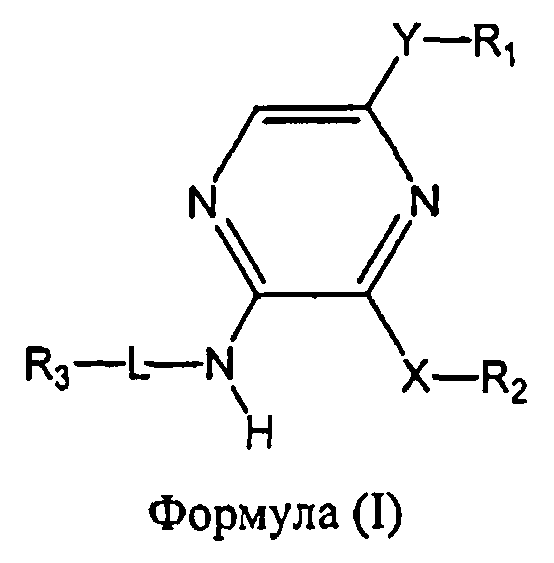
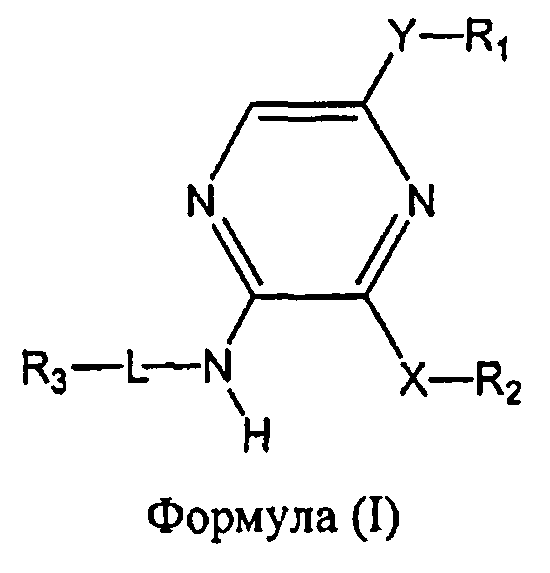
Настоящее изобретение относится к соединению формулы I

где
R1 выбран из группы, состоящей из
i) фенила, необязательно имеющего от одного до двух заместителей, независимо выбранных из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, хлора и фтора;
ii) пиридинила, необязательно имеющего один заместитель, выбранный из группы, состоящей из C1-4алкила, C1-4алкокси, C1-4алкилтио, гидрокси, фтора, хлора и циано; и
iii) пиримидин-5-ила;
или R1 необязательно представляет собой метоксиметил, когда Y представляет собой этинил;
Y представляет собой этинил или связь;
R2 представляет собой фенил, бензофуранил, 2,3-дигидробензофуранил, бензо[1,3]диоксол-5-ил, индолил или пиридинил, необязательно замещенный метилом, при этом фенил необязательно имеет от одного до двух заместителей, независимо выбранных из группы, состоящей из C1-4алкила, C1-4алкокси, фтора, хлора, циано, цианометила, дифторметокси, трифторметокси и гидрокси;
или R2 представляет собой фенил, имеющий один C1-4алкилкарбониламино или 1H-имидазол-1-ильный заместитель;
X представляет собой O или CH2;
L отсутствует, а R3 представляет собой 4-аминоциклогексил, или L представляет собой метилен, а R3 выбран из группы, состоящей из
i) пирролидин-2-ила;
ii) 1-аминоэт-1-ила; и
iii) 1-аминоциклопент-1-ила;
или R3 объединен в один цикл с L и атомом азота, к которому присоединен L, с образованием пиперазинила, необязательно замещенного 4-C1-4алкилом;
а также его энантиомеров, диастереомеров, сольватов и фармацевтически приемлемых солей.
Настоящее изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение формулы (I) или его фармацевтически приемлемую соль.
Также в настоящем изобретении предложены способы получения фармацевтической композиции, включающие смешивание соединения формулы (I) и фармацевтически приемлемого носителя.
Настоящее изобретение также относится к способам лечения или облегчения симптомов расстройств, модулируемых опиоидными рецепторами. В частности, способы настоящего изобретения направлены на лечение или облегчение симптомов расстройств, модулируемых опиоидными рецепторами, включая, помимо прочего, воспалительные боли, боли, опосредуемые центральной нервной системой, боли, опосредуемые периферической системой, висцеральные боли, боли, связанные со структурными нарушениями, онкологические боли, боли, связанные с травмой мягких тканей, боли, связанные с прогрессирующим заболеванием, невропатические боли и острые боли, связанные с острым поражением, острые боли, связанные с травмой, острые боли, связанные с хирургическим вмешательством, хронические головные боли, хронические боли при невропатических состояниях, хронические боли при постинсультных состояниях и хронические боли при мигрени.
В настоящем изобретении также предложены способы получения указанных соединений и фармацевтических композиций, а также лекарственных препаратов, изготовленных на их основе.
Для целей настоящего документа следующие термины имеют следующие определения:
«Ca-b» (где a и b являются целыми значениями) относится к радикалу, содержащему от a до b атомов углерода включительно. Например, C1-3 обозначает радикал, содержащий 1, 2 или 3 атома углерода.
По отношению к заместителям термин «независимо» обозначает, что при возможности ввести более одного из таких заместителей вводимые заместители могут быть одинаковыми или разными. Таким образом, указанное число атомов углерода (например, C1-8) независимо обозначает количество атомов углерода в алкильном или циклоалкильном фрагменте или алкильной части более крупного заместителя, в названии которого присутствует корень «алкил».
Если особо не указано иное, термин «алкил», используемый в настоящем документе, самостоятельно или в составе названия заместителя, относится к линейной или разветвленной углеродной цепи, содержащей от 1 до 8 атомов углерода, либо любое число атомов углерода в пределах обозначенного диапазона. Используемый в настоящей заявке термин «алкокси» относится к заместителю типа -O-алкил, где «алкил» применяется в указанном выше смысле. Аналогичным образом, используемые в настоящей заявке термины «алкенил» и «алкинил» относятся к линейной или разветвленной углеродной цепи, содержащей от 2 до 8 атомов углерода или любое число атомов углерода в пределах обозначенного диапазона, при этом алкенильная цепь содержит по меньшей мере одну двойную связь в цепи, а алкинильная цепь содержит по меньшей мере одну тройную связь в цепи. Алкильная и алкоксильная цепи могут быть замещены по атому углерода. В заместителях, содержащих несколько алкильных групп, например (C1-6алкил)-2-амино-C1-6, алкильные группы диалкиламиногрупп могут быть одинаковыми или различаться.
Термин «галогензамещенный алкил» относится к насыщенному алкильному радикалу с разветвленной или линейной цепью, полученному путем отрыва одного атома водорода от материнской молекулы алкана. Материнская алкильная цепь содержит от 1 до 8 атомов углерода, при этом 1 или несколько атомов водорода замещены на атомы галогена, вплоть до и включая замену всех атомов водорода на атомы галогена. Предпочтительные галогензамещенные алкильные группы включают трифторметилзамещенные алкилы, дифторметилзамещенные алкилы и перфторалкилы, более предпочтительные фторированные алкилы включают трифторметил и дифторметил. Термин «галогензамещенный алкокси» относится к радикалу, полученному из галогензамещенного алкильного радикала путем его присоединения к атому кислорода, при этом атом кислорода имеет одну свободную валентность для присоединения к материнской структуре.
Используемый в настоящей заявке термин «циклоалкил» относится к насыщенному или частично ненасыщенному моноциклическому или полициклическому углеводороду, содержащему от 3 до 20 атомов углерода (предпочтительно от 3 до 14 атомов углерода). Примеры таких групп, помимо прочего, включают циклопропил, циклобутил, циклопентил, циклогексил, циклоцептил и адамантил. Термин «циклоалкил» также включает циклоалкильные кольца, конденсированные с бензольным кольцом (бензоконденсированный циклоалкил) или 5- или 6-членным гетероароматическим кольцом (содержащим один из атомов O, S или N и необязательно еще один атом азота) с образованием гетероарилконденсированного циклоалкила.
Термин «гетероциклил» относится к 5-10-членному неароматическому моноциклическому кольцу, в котором от 1 до 4 членов представляют собой атомы азота, либо к 5-10-членному неароматическому моноциклическому кольцу, в котором ни одного, один или два члена представляют собой атомы азота и до двух членов представляют собой атомы кислорода или серы, при этом кольцо необязательно содержит от нуля до двух ненасыщенных связей. Термин «гетероциклил» включает гетероциклическое кольцо, конденсированное с бензольным кольцом (бензоконденсированный гетероциклил), 5- или 6-членное гетероароматическое кольцо (содержащее один из O, S или N и необязательно еще один атом азота), 5-7-членное циклоалкильное или циклоалкенильное кольцо, 5-7-членное гетероциклильное кольцо (в определенном выше смысле, за исключением дополнительного конденсированного кольца) либо конденсированное по одному атому углерода циклоалкильного, циклоалкенильного или гетероциклильного кольца с образованием спирофрагмента. Для соединений, составляющих предмет настоящего изобретения, кольцевые атомы углерода, образующие гетероциклильное кольцо, являются полностью насыщенными. Другие соединения в соответствии с настоящим изобретением могут иметь частично насыщенное гетероциклильное кольцо. Кроме того, термин «гетероциклил» также включает гетероциклические кольца с мостиком, образующим бициклические кольца. Предпочтительные частично насыщенные гетероциклильные кольца могут иметь от одной до двух двойных связей. Такие соединения не считаются полностью ароматическими и не входят в понятие гетероароматического соединения. Примеры гетероциклильных групп, помимо прочего, включают пирролинил (в том числе 2H-пиррол, 2-пирролинил или 3-пирролинил), пирролидинил, 2-имидазолинил, имидазолидинил, 2-пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил и пиперазинил.
Используемый в настоящей заявке термин «арил» относится к ненасыщенному ароматическому моноциклическому кольцу из 6 атомов углерода или к ненасыщенному ароматическому полициклическому кольцу из 10-14 атомов углерода. Примеры таких арильных колец, помимо прочего, включают фенил, нафталенил и антраценил. Предпочтительными арильными группами для практического осуществления настоящего изобретения являются фенил и нафталенил.
Используемый в настоящей заявке термин «гетероарил» относится к 5- или 6-членному ароматическому кольцу, при этом указанное кольцо состоит из атомов углерода и содержит по меньшей мере один гетероатом. Соответствующие гетероатомы включают азот, кислород или серу. В случае 5-членных колец гетероарильное кольцо содержит один атом азота, кислорода или серы, а также может содержать до трех дополнительных атомов азота. В случае 6-членных колец указанное гетероарильное кольцо может содержать от одного до трех атомов азота. В том случае, когда указанное 6-членное кольцо содержит три атома азота, не более двух атомов азота находятся в соседних положениях. Термин «гетероарил» включает гетероарильное кольцо, конденсированное с бензольным кольцом (бензоконденсированный гетероарил), 5- или 6-членным гетероарильным кольцом (содержащим один из O, S или N и необязательно еще один атом азота), 5-7-членным циклоалкильным кольцом или 5-7-членным гетероциклильным кольцом (в определенном выше смысле, за исключением дополнительного конденсированного кольца). Примеры гетероарильных групп, помимо прочего, включают фурил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил или пиразинил, конденсированные гетероарильные группы включают индолил, изоиндолил, бензофурил, бензотиенил, индазолил, бензимидазолил, бензотиазолил, бензоксазолил, бензизоксазолил, бензотиадиазолил, бензотриазолил, хиноксалинил, хинолинил, изохинолинил или хиназолинил.
Термин «арилалкил» обозначает алкильную группу, замещенную арильной группой (например, бензил, фенэтил). Аналогичным образом, используемый в настоящей заявке термин «арилалкокси» обозначает алкоксильную группу, замещенную арильной группой (например, бензилокси).
Используемый в настоящей заявке термин «галоген» относится к фтору, хлору, брому и йоду. Заместители, замещенные галогенами по нескольким положениям, замещаются таким образом, чтобы получить в итоге устойчивые соединения.
Термин «оксо», используемый самостоятельно или в названии заместителя, относится к фрагменту O=, связанному с атомом углерода или серы. Например, фталимид и сахарин представляют собой примеры соединений с оксо-заместителями.
Если термин «алкил» или «арил» или любой из образованных от этих корней префиксов есть в названии заместителя (например, арилалкил, алкиламино), то предполагается, что все описанные выше ограничения для терминов «алкил» и «арил» применимы также и к производным названиям. Указание количества атомов углерода (например, C1-C6) относится независимо к количеству атомов углерода в алкильном фрагменте или алкильной части более крупного заместителя, в названии которого корень «алкил» используется в качестве префикса. Для алкильных и алкоксильных заместителей указанное количество атомов углерода включает все независимые члены приведенного диапазона по отдельности, а также любые сочетания диапазонов в указанных границах. Например, C1-6 алкил включает по отдельности метил, этил, пропил, бутил, пентил и гексил, а также их подкомбинации (например, C1-2, C1-3, C1-4, C1-5, C2-6, C3-6, C4-6, C5-6, C2-5 и т.д.).
Используемый в настоящей заявке термин «пациент» обозначает животное, предпочтительно млекопитающее, наиболее предпочтительно человека, являющееся объектом лечения, наблюдения или эксперимента.
Используемый в настоящей заявке термин «терапевтически эффективное количество» обозначает такое количество активного соединения или фармацевтического агента, которое вызывает биологически или медицински значимый ответ со стороны системы тканей, организма животного или человека, ожидаемый исследователем, ветеринаром, врачом или иным клиницистом, который включает облегчение симптоматики заболевания или патологического состояния, лечение которого проводится.
Используемый в настоящей заявке термин «препарат» относится к любому продукту, в состав которого входят указанные компоненты в указанных количествах, а также к любым продуктам, которые могут быть получены, прямо или косвенно, из сочетаний указанных компонентов в указанных количествах.
Используемый в настоящей заявке термин «ацил» относится к алкилкарбонильным заместителям.
В рамках настоящего документа первой указывают концевую часть описываемой боковой цепи, а затем перечисляют функциональные группы в направлении к точке присоединения заместителя. Например, заместитель «фенил(C1-6)алкиламинокарбонил(C1-6)алкил» обозначает группу следующей формулы:

Если не указано иное, предполагается, что определение какого-либо заместителя или переменной на определенной позиции в молекуле не зависит от соответствующих определений на других участках молекулы. Принимается, что заместители и схемы замещения соединений формулы (I) могут выбираться специалистом в данной области для обеспечения химически стабильных соединений, которые легко синтезировать по известным в данной области методикам, а также по методикам, изложенным в настоящем документе.
Для целей настоящего изобретения термин «модулируемый опиоидным рецептором» используется для обозначения состояния зависимости от модуляции опиоидного рецептора, включая, помимо прочего, опосредование опиоидным рецептором.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Варианты осуществления настоящего изобретения включают соединения формулы (I)

где
а) R1 выбран из группы, состоящей из
i) фенила;
ii) пиридинила, необязательно имеющего один заместитель, выбранный из группы, состоящей из C1-4алкокси, фтора, хлора и циано; и
iii) пиримидин-5-ила;
или R1 необязательно представляет собой метоксиметил, когда Y представляет собой этинил;
b) R1 выбран из группы, состоящей из
i) фенила;
ii) пиридинила, необязательно имеющего один заместитель, выбранный из группы, состоящей из C1-4алкокси и циано; и
iii) пиримидин-5-ила;
c) R1 выбран из группы, состоящей из
i) фенила;
ii) пиридинила, необязательно имеющего один заместитель, выбранный из группы, включающей метокси и циано; и
iii) пиримидин-5-ила;
d) Y представляет собой связь;
e) R2 представляет собой фенил, бензофуранил, 2,3-дигидробензофуранил, бензо[1,3]диоксол-5-ил, индолил или пиридинил, необязательно замещенный метилом, при этом фенил необязательно имеет от одного до двух заместителей, независимо выбранных из группы, состоящей из C1-4алкила, C1-4алкокси, фтора, хлора, циано, цианометила, дифторметокси, трифторметокси и гидрокси;
или R2 представляет собой фенил, имеющий один заместитель C1-4алкилкарбониламино;
f) R2 представляет собой фенил, необязательно имеющий от одного до двух заместителей, независимо выбранных из группы, состоящей из C1-4алкила, C1-4алкокси, фтора, хлора, циано, цианометила, дифторметокси, трифторметокси и гидрокси;
или R2 представляет собой фенил, имеющий один заместитель C1-4алкилкарбониламино;
g) R2 представляет собой фенил, необязательно имеющий один заместитель, выбранный из группы, состоящей из C1-4алкила, C1-4алкокси, фтора, хлора, циано, цианометила, дифторметокси, трифторметокси и гидрокси;
h) X представляет собой O;
i) L представляет собой метилен, а R3 выбран из группы, состоящей из
i) пирролидин-2-ила;
ii) 1-аминоэт-1-ила; и
iii) 1-аминоциклопент-1-ила;
или R3 объединен в один цикл с L и атомом азота, к которому присоединен L, с образованием пиперазинила;
а также любое сочетание вариантов из описанных выше вариантов осуществления а)-i) при условии, что предполагается, что те сочетания, в которых должны комбинироваться различные варианты осуществления одного и того же заместителя, должны быть исключены; а также их энантиомеры, диастереомеры, сольваты и фармацевтически приемлемые соли.
Дополнительный вариант осуществления настоящего изобретения включает соединения формулы (I)

где
R1 выбран из группы, состоящей из
i) фенила;
ii) пиридинила, необязательно имеющего один заместитель, выбранный из группы, состоящей из C1-4алкокси, фтора, хлора и циано; и
iii) пиримидин-5-ила;
или R1 необязательно представляет собой метоксиметил, когда Y представляет собой этинил;
Y представляет собой связь или этинил;
R2 представляет собой фенил, бензофуранил, 2,3-дигидробензофуранил, бензо[1,3]диоксол-5-ил, индолил или пиридинил, необязательно замещенный метилом, при этом фенил необязательно имеет от одного до двух заместителей, независимо выбранных из группы, состоящей из C1-4алкила, C1-4алкокси, фтора, хлора, циано, цианометила, дифторметокси, трифторметокси и гидрокси;
или R2 представляет собой фенил, имеющий один заместитель C1-4алкилкарбониламино;
X представляет собой O или CH2;
L отсутствует, а R3 представляет собой 4-аминоциклогексил, или L представляет собой метилен и R3 выбран из группы, состоящей из
i) пирролидин-2-ила;
ii) 1-аминоэт-1-ила; и
iii) 1-аминоциклопент-1-ила;
или R3 объединен в один цикл с L и атомом азота, к которому присоединен L, с образованием пиперазинила;
а также их энантиомеры, диастереомеры, сольваты и фармацевтически приемлемые соли.
Дополнительный вариант осуществления настоящего изобретения включает соединения формулы (I)

где
R1 выбран из группы, состоящей из
i) фенила;
ii) пиридинила, необязательно имеющего один заместитель, выбранный из группы, состоящей из C1-4алкокси и циано; и
iii) пиримидин-5-ила;
Y представляет собой связь;
R2 представляет собой фенил, необязательно имеющий от одного до двух заместителей, независимо выбранных из группы, состоящей из C1-4алкила, C1-4алкокси, фтора, хлора, циано, цианометила, дифторметокси, трифторметокси и гидрокси;
или R2 представляет собой фенил, имеющий один заместитель C1-4алкилкарбониламино;
X представляет собой O;
L представляет собой метилен и R3 выбран из группы, состоящей из
i) пирролидин-2-ила;
ii) 1-аминоэт-1-ила; и
iii) 1-аминоциклопент-1-ила;
или R3 объединен в один цикл с L и атомом азота, к которому присоединен L, с образованием пиперазинила;
а также их энантиомеры, диастереомеры, сольваты и фармацевтически приемлемые соли.
Дополнительный вариант осуществления настоящего изобретения включает соединения формулы (I)

где
R1 выбран из группы, состоящей из
i) фенила;
ii) пиридинила, необязательно имеющего один заместитель, выбранный из группы, включающей метокси и циано; и
iii) пиримидин-5-ила;
Y представляет собой связь;
R2 представляет собой фенил, необязательно имеющий один заместитель, выбранный из группы, состоящей из C1-4алкила, C1-4алкокси, фтора, хлора, циано, цианометила, дифторметокси, трифторметокси и гидрокси;
X представляет собой O;
L представляет собой метилен и R3 выбран из группы, состоящей из
i) пирролидин-2-ила;
ii) 1-аминоэт-1-ила; и
iii) 1-аминоциклопент-1-ила;
или R3 объединен в один цикл с L и атомом азота, к которому присоединен L, с образованием пиперазинила;
а также их энантиомеры, диастереомеры, сольваты и фармацевтически приемлемые соли.
Дополнительный вариант осуществления настоящего изобретения включает соединения формулы (I)

выбранные из группы, состоящей из:
соединения, в котором R1 представляет собой 6-метоксипиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиридин-3-ил, Y представляет собой этинил, R2 представляет собой 4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой метоксиметил, Y представляет собой этинил, R2 представляет собой 4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 4-этилфенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой бензо[1,3]диоксол-5-ил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 3-фтор-4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 2-фтор-4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 4-хлорфенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 3-хлорфенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 2-хлорфенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 3-метилкарбониламинофенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 4-(1H-имидазол-1-ил)фенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 3-гидроксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой CH2, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой CH2, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 4-цианофенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой 1-аминоэт-1-ил; (1S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой 1-аминоэт-1-ил; (1S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой 1-аминоциклопент-1-ил;
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой 1-аминоциклопент-1-ил;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой CH2, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 3-фтор-4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 2-фтор-4-метоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-цианометилфенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 6-метилпиридин-3-ил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-дифторметоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, а R3 объединен в один цикл с L и атомом азота, к которому присоединен L, с образованием пиперазин-1-ила;
соединения, в котором R1 представляет собой пиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, а R3 объединен в один цикл с L и атомом азота, к которому присоединен L, с образованием пиперазин-1-ила;
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой бензофуран-5-ил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой пиримидин-5-ил, Y представляет собой связь, R2 представляет собой 2,3-дигидробензофуран-5-ил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, L отсутствует, а R3 представляет собой транс-4-аминоциклогексил;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-метоксифенил, X представляет собой O, L отсутствует, а R3 представляет собой цис-4-аминоциклогексил;
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-трифторметоксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 4-этилфенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 3-гидроксифенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой бензофуран-5-ил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой индол-5-ил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 2-хлорфенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
соединения, в котором R1 представляет собой 5-цианопиридин-3-ил, Y представляет собой связь, R2 представляет собой 3-хлорфенил, X представляет собой O, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил; (2S)
и их фармацевтически приемлемые соли.
Для использования в медицинских целях соли соединений формулы (I) относятся к нетоксичным «фармацевтически приемлемым солям». Однако для получения соединений формулы (I) или их фармацевтически приемлемых солей могут использоваться и другие соли. Соответствующие целям настоящего изобретения фармацевтически приемлемые соли соединений формулы (I) включают соли присоединения кислоты, которые, например, могут быть получены при смешивании раствора одного из соединений, составляющих предмет настоящего изобретения, с раствором фармацевтически приемлемой кислоты, например соляной кислоты, серной кислоты, фумаровой кислоты, малеиновой кислоты, янтарной кислоты, уксусной кислоты, бензойной кислоты, лимонной кислоты, винной кислоты, углекислоты или фосфорной кислоты.
Кроме того, когда соединения формулы (I) имеют кислотный фрагмент, их допустимые фармацевтически приемлемые соли могут также включать соли щелочных металлов, например натриевые или калиевые соли, соли щелочноземельных металлов, например кальциевые или магниевые соли, а также соли с соответствующими органическими лигандами, например четвертичные аммонийные соли. Таким образом, типичные примеры фармацевтически приемлемых солей включают следующие соли: ацетаты, бензолсульфонаты, бензоаты, бикарбонаты, бисульфаты, битартраты, бораты, бромиды, кальция эдетаты, камсилаты, карбонаты, хлориды, клавуланаты, цитраты, дигидрохлориды, эдетаты, эдисилаты, эстолаты, эсилаты, фумараты, глуцептаты, глюконаты, глутаматы, гликоллиларсанилаты, гексилрезорцинаты, гидрабамины, гидробромиды, гидрохлориды, гидроксинафтоаты, йодиды, изотионаты, лактаты, лактобионаты, лаураты, малаты, малеаты, манделаты, мезилаты, метилбромиды, метилнитраты, метилсульфаты, мукаты, напсилаты, нитраты, N-метилглюкамина аммониевые соли, олеаты, памоаты (эмбонаты), пальмитаты, пантотенаты, фосфаты/дифосфаты, полигалактуронаты, салицилаты, стеараты, сульфаты, субацетаты, сукцинаты, таннаты, тартраты, теоклаты, тозилаты, триэтиодиды и валераты.
Типичные примеры кислот и оснований, которые могут применяться для получения фармацевтически приемлемых солей, включают следующие: кислоты, в том числе уксусную кислоту, 2,2-дихлоруксусную кислоту, ацилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, L-аспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, (+)-камфорную кислоту, камфорсульфокислоту, (+)-(1S)-камфор-10-сульфокислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту, цикламовую кислоту, додецилсерную кислоту, этан-1,2-дисульфокислоту, этансульфокислоту, 2-гидроксиэтансульфокислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту, гентизиновую кислоту, глюкогептоновую кислоту, D-глюконовую кислоту, D-глюкороновую кислоту, L-глютаминовую кислоту, α-оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромистоводородную кислоту, соляную кислоту, (+)-L-молочную кислоту, (±)-DL-молочную кислоту, лактобионовую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, (±)-DL-миндальную кислоту, метансульфокислоту, нафталин-2-сульфокислоту, нафталин-1,5-дисульфокислоту, 1-гидрокси-2-нафтойную кислоту, никотиновую кислоту, азотную кислоту, олеиновую кислоту, оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памовую кислоту, фосфорную кислоту, L-пироглютаминовую кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту, (+)-L-виннокаменную кислоту, тиоциановую кислоту, п-толуолсульфокислоту и ундециленовую кислоту;
и основания, в том числе аммиак, L-аргинин, бенетамин, бензатин, кальция гидроксид, холин, деанол, диэтаноламин, диэтиламин, 2-(диэтиламино)-этанол, этаноламин, этилендиамин, N-метилглюкамин, гидрабамин, 1H-имидазол, L-лизин, магния гидроксид, 4-(2-гидроксиэтил)-морфолин, пиперазин, калия гидроксид, 1-(2-гидроксиэтил)-пирролидин, натрия гидроксид, триэтаноламин, трометамин и цинка гидроксид.
Варианты осуществления настоящего изобретения включают пролекарства соединений формулы (I). Как правило, такие пролекарства представляют собой функциональные производные соединений, составляющих предмет настоящего изобретения, которые in vivo превращаются в требуемое соединение. Таким образом, в вариантах осуществления настоящего изобретения, относящихся к способам лечения, термин «введение» охватывает лечение различных заболеваний, указанных в описании соединения, являющегося предметом настоящего изобретения, или соединения, не указанного в настоящем описании, но преобразующегося в указанное соединение in vivo после его введения пациенту. Общепринятые процедуры отбора и приготовления соответствующих производных пролекарственных форм описаны, например, в работе Design of Prodrugs, Ed. H. Bundgaard, Elsevier, 1985.
Если соединения в соответствии с вариантами осуществления настоящего изобретения имеют по меньшей мере один хиральный центр, они могут соответственно существовать в форме энантиомеров. В тех случаях, когда соединения обладают двумя или более хиральными центрами, они дополнительно могут существовать в форме диастереомеров. Необходимо понимать, что все такие изомеры и их смеси попадают в рамки настоящего изобретения. Кроме того, некоторые из кристаллических форм соединений настоящего изобретения могут существовать в виде полиморфов, и в таком качестве они попадают под действие настоящего изобретения. Кроме того, некоторые из соединений могут образовывать сольваты с водой (то есть гидраты) или широко распространенными органическими растворителями, при этом такие сольваты также попадают в рамки настоящего изобретения. Специалисты в данной области понимают, что используемый в настоящей заявке термин «соединение» считается включающим сольватированные соединения формулы I.
В тех случаях, когда процессы получения соединений в соответствии с вариантами осуществления настоящего изобретения приводят к образованию смеси стереоизомеров, эти изомеры могут быть изолированы при помощи стандартных способов, таких как препаративная хроматография. Соединения могут быть получены в форме рацематов, либо индивидуальные энантиомеры могут быть получены в результате энантиоспецифического синтеза, либо посредством разделения. Соединения могут, например, быть разделены на составляющие энантиомеры с помощью стандартных способов, таких как формирование диастереометрических пар путем образования солей с оптически активными кислотами, например (-)-ди-п-толуоил-D-виннокаменная кислота и/или (+)-ди-п-толуоил-L-виннокаменная кислота, с последующей фракционной кристаллизацией и восстановлением свободного основания. Соединения могут также быть разделены с помощью образования диастереомерных эфиров или амидов с последующим хроматографическим разделением и удалением хирального партнера. В другом варианте осуществления настоящего изобретения такие соединения могут быть разделены при помощи хиральной колонки для ВЭЖХ.
Один вариант осуществления настоящего изобретения относится к композиции, содержащей (+)-энантиомер соединения формулы (I), при этом указанная композиция по существу не содержит (-)-изомера указанного соединения. В данном контексте фраза «по существу не содержит» обозначает содержание (-)-изомера менее 25%, предпочтительно менее 10%, более предпочтительно менее 5%, еще более предпочтительно менее 2% и еще более предпочтительно менее 1%, рассчитанное следующим образом:

Другой вариант осуществления настоящего изобретения представляет собой композицию, содержащую (-)-энантиомер соединения формулы (I), при этом указанная композиция по существу не содержит (+)-изомера указанного соединения. В данном контексте фраза «по существу не содержит» обозначает содержание (+)-изомера менее 25%, предпочтительно менее 10%, более предпочтительно менее 5%, еще более предпочтительно менее 2% и еще более предпочтительно менее 1%, рассчитанное следующим образом.
 .
.
Во время процессов получения соединений в соответствии с вариантами осуществления настоящего изобретения может возникнуть необходимость в защите чувствительных или реакционных групп на любой из рассматриваемых молекул. Для этих целей могут использоваться стандартные защитные группы, например, описанные в публикациях Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Presc, 1973; и T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 1991. Введенные защитные группы могут быть впоследствии удалены на любой удобной для этого стадии с применением известных специалистам способов.
Хотя составляющие предмет настоящего изобретения соединения (включая их фармацевтически приемлемые соли и фармацевтически приемлемые сольваты) могут вводиться пациенту отдельно, как правило, они будут вводиться в виде смеси с фармацевтически приемлемым носителем, вспомогательным веществом или разбавителем, выбираемым с учетом предполагаемого способа введения и стандартной фармацевтической практики. Таким образом, конкретные варианты осуществления настоящего изобретения относятся к фармацевтическим композициям, содержащим соединения формулы (I) и один или несколько фармацевтически приемлемых носителей, вспомогательных веществ или разбавителей.
В качестве примера в фармацевтических и ветеринарных композициях в соответствии с вариантами осуществления настоящего изобретения соединения формулы (I) могут присутствовать в виде смеси с любым(-и) соответствующим(-и) связующим(-и) веществом(-ами), смазывающим(-и) веществом(-ами), суспендирующим(-и) веществом(-ами), покрывающим(-и) веществом(-ами) и/или солюбилизирующим(-и) веществом(-ами).
Таблетки или капсулы с композициями могут вводиться по одной или по две и более за один прием, в зависимости от ситуации. Указанные соединения также можно применять в виде композиций с замедленным высвобождением.
В другом варианте осуществления настоящего изобретения соединения формулы (I) могут использоваться в виде ингаляций (интратрахеальных или интраназальных) либо в форме суппозиториев или пессариев, а также могут наноситься местно в виде лосьонов, растворов, кремов, мазей или присыпок. Например, описываемые соединения могут быть введены в состав крема, состоящего из водной эмульсии полиэтиленгликолей или жидкого парафина. Их также можно вводить в концентрации от 1 до 10 % вес. в состав мази, имеющей в качестве основы белый воск или белый мягкий парафин и содержащей также необходимые стабилизаторы и консерванты. Альтернативным способом трансдермального введения является использование пластыря.
Для ряда вариантов применения предпочтительно пероральное введение композиций в форме таблеток, содержащих такие вспомогательные вещества, как крахмал или лактоза, либо в форме капсул или драже, в чистом виде или в смеси со вспомогательными веществами, либо в форме эликсиров, растворов или суспензий, содержащих ароматизаторы или красители.
Композиции (а также соединения в отдельности) также можно вводить парентерально в виде инъекций, например, путем внутрикавернозного, внутривенного, внутримышечного, подкожного, внутрикожного или спинального введения. В этом случае композиции будут содержать соответствующий носитель или разбавитель.
Наилучшей формой композиций для парентерального введения является стерильный водный раствор, в состав которого могут также входить и другие компоненты, например достаточное количество солей или моносахаридов, для получения изотоничного крови раствора.
Для трансбуккального или сублингвального способа введения композицию можно вводить пациенту в виде таблеток или пастилок, изготавливаемых стандартными способами.
В качестве дополнительного примера фармацевтические и ветеринарные композиции, содержащие в качестве активного компонента одно или несколько соединений формулы (I), могут быть получены путем смешивания соединения или соединений с фармацевтическим носителем в соответствии со стандартными фармацевтическими методиками. Носитель может иметь разные формы в зависимости от предполагаемого способа введения (например, пероральный, парентеральный и т.д.). Таким образом, для жидких пероральных лекарственных форм, таких как суспензии, эликсиры и растворы, приемлемые носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, стабилизаторы, красители и т.д.; для твердых пероральных лекарственных форм, таких как порошки, капсулы и таблетки, приемлемые носители и добавки включают крахмалы, сахара, разбавители, гранулообразующие агенты, лубриканты, связующие вещества, добавки для улучшения распадаемости таблеток и т.д. Твердые пероральные лекарственные формы также могут быть покрыты оболочкой из таких веществ, как сахара, либо могут быть покрыты кишечнорастворимой оболочкой для изменения основного места всасывания и растворения лекарства. Для парентерального введения носитель, как правило, состоит из стерильной воды, при этом для улучшения растворимости или консервации могут быть добавлены другие ингредиенты. Инъекционно вводимые суспензии или растворы также могут быть изготовлены с использованием водных носителей с соответствующими добавками.
Терапевтически эффективное количество соединений формулы (I) или включающей их фармацевтической композиции составляет диапазон дозировок от приблизительно 0,1 до приблизительно 3000 мг, более конкретно от приблизительно 1 до приблизительно 1000 мг, более конкретно от приблизительно 10 до приблизительно 500 мг активного компонента при периодичности приема приблизительно от 1 до 4 раз в день для среднего (70 кг) человека, хотя специалисту в данной области будет понятно, что терапевтически эффективное количество для соединений, составляющих предмет настоящего изобретения, будет варьироваться в зависимости от того, лечение какого состояния проводится.
Для перорального введения фармацевтическая композиция предпочтительно используется в виде таблеток, содержащих 0,01, 10,0, 50,0, 100, 150, 200, 250 и 500 мг активного компонента для симптоматической коррекции дозировки у пациента, получающего лечение.
Соединения формулы (I) преимущественно могут назначаться в виде однократной дневной дозы или суммарная дневная доза может назначаться многократными дозами дважды, трижды или четырежды в день. Более того, соединения формулы (I) можно вводить интраназально при помощи местного использования соответствующих интраназальных средств доставки или с помощью трансдермальных кожных пластырей, хорошо известных специалистам в данной области.
Специалисту в этой области также очевидно, что терапевтически эффективная доза активных соединений формулы (I) или содержащих их фармацевтических композиций будет варьировать в зависимости от желаемого эффекта. Поэтому оптимальные назначаемые дозы могут быть легко определены специалистами и варьируются в зависимости от конкретно используемого соединения, способа введения, силы препарата и степени выраженности патологического состояния. Кроме того, факторы, связанные с индивидуальным проходящим курс лечения пациентом, такие как возраст, вес, диета, время введения, также должны учитываться при корректировке дозировки для достижения требуемого терапевтического уровня. Поэтому приведенные выше дозировки являются примерными для некоторого среднего случая. Разумеется, в некоторых отдельных случаях требуется использование более высокого или более низкого диапазона доз, и такие случаи входят в сферу действия настоящего изобретения.
Соединения формулы (I) можно вводить пациенту в форме любой из описанных выше композиций и при любом описанном выше режиме приема или с использованием любых общепринятых в данной области композиций и режимов приема в любых случаях, когда нуждающемуся в этом пациенту требуется введение соединения формулы (I).
Примеры болей, входящих в сферу действия настоящего изобретения, помимо прочего, включают воспалительные боли, боли, опосредуемые центральной нервной системой, боли, опосредуемые периферической системой, висцеральные боли, боли, вызванные структурными нарушениями или травмой мягких тканей, боли, связанные с прогрессирующим заболеванием, невропатические боли и острые боли, такие как боли, связанные с острым поражением, травмой или хирургическим вмешательством, а также хронические боли, такие как хронические головные боли и хронические боли, вызванные невропатическими состояниями, постинсультными состояниями, раком и мигренью.
Соединения, составляющие предмет настоящего изобретения, также могут применяться в качестве иммунодепрессантов, противовоспалительных агентов, агентов для лечения и предотвращения неврологических и психиатрических состояний, например депрессии и болезни Паркинсона, агентов для лечения урологических состояний и расстройств репродуктивной системы, например недержания мочи и преждевременного семяизвержения, препаратов для лечения алкогольной и наркотической зависимости, агентов для лечения гастрита и диареи, агентов для лечения сердечно-сосудистой системы и кардиозащитных агентов и агентов для лечения респираторных заболеваний.
Соединения, составляющие предмет настоящего изобретения, применимы при лечении боли, вызванной следующими причинами: остеоартрит, ревматоидный артрит, фибромиалгия, головная боль, зубная боль, ожог, солнечный ожог, укус змеи (в частности укус ядовитой змеи), укус паука, укус насекомого, нейрогенный мочевой пузырь, доброкачественная гипертрофия предстательной железы, интерстициальный цистит, ринит, контактный дерматит/гиперчувствительность, зуд, экзема, фарингит, мукозит, энтерит, целлюлит, каузалгия, неврит седалищного нерва, невралгия в височно-нижнечелюстном суставе, периферический неврит, полиневрит, культевая боль, фантомная боль, послеоперационная кишечная непроходимость, холецистит, болевой синдром после мастэктомии, нейропатическая боль в ротовой полости, синдром Шарко, рефлекторная симпатическая дистрофия, синдром Гийена-Барре, парестетическая мералгия, синдром жжения в полости рта, кластерная головная боль, двусторонняя периферическая нейропатия, диабетическая нейропатия, постгерпетическая невралгия, невралгия тройничного нерва, неврит зрительного нерва, постфебрильный неврит, мигрирующий неврит, сегментарный неврит, неврит Гомбо, нейронит, шейно-плечевая невралгия, черепная невралгия, невралгия коленчатого узла, невралгия языкоглоточного нерва, мигренозная невралгия, идиопатическая невралгия, межреберная невралгия, невралгия в области молочных желез, невралгия Мортона, синдром носоресничного нерва, затылочная невралгия, эритромелалгия, невралгия Слудера, невралгия крылонебного узла, невралгия надглазничного нерва, невралгия видиева нерва, воспалительные заболевания кишечника, синдром раздраженного кишечника, синусовая головная боль, тензионная головная боль, схватки, роды, менструальные боли и рак.
В отношении применения настоящих соединений в лечении заболеваний и патологических состояний, подобных указанным выше, терапевтически эффективные дозировки могут быть определены специалистами в данной области путем использования стандартных моделей для животных. Терапевтически эффективная дозировка для соединений формулы (I) при использовании в таком лечении находится в диапазоне от приблизительно 0,001 до приблизительно 300 мг/кг/день. Более конкретно, указанный диапазон составляет от приблизительно 0,5 до приблизительно 5,0 мг/кг веса тела в день, еще более конкретно от приблизительно 1,0 до приблизительно 3,0 мг/кг веса тела в день. Соединения могут назначаться с режимом приема от 1 до 4 раз в день.
ОБЩИЕ СПОСОБЫ СИНТЕЗА
Типичные примеры соединений настоящего изобретения могут быть синтезированы в соответствии с общими способами синтеза, описанными ниже и показанными на приведенных далее схемах и примерах. Поскольку схемы приведены в качестве иллюстрации, настоящее изобретение не следует интерпретировать как ограниченное химическими реакциями и условиями, описанными на схемах. Различные исходные вещества, указанные на схемах и используемые в примерах, имеются в продаже или могут быть получены способами, хорошо известными специалистам в данной области. Фрагменты соответствуют описанию, приведенному в настоящем документе.
В настоящем описании, в частности в схемах и примерах, используются следующие сокращения:
|
На схеме A показано получение соединений формулы (I)-A, в которых X представляет собой O, Y представляет собой связь, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил.

Соединение A1 доступно в продаже или может быть получено известными способами, описанными в научной литературе. Аминогруппа соединения A1 может быть алкилирована путем восстановительного аминирования с использованием альдегида формулы A2, где P представляет собой стандартную защитную группу для аминогруппы в присутствии источника гидрид-иона с образованием соединения формулы A3. Группа R1 соединения формулы (I) может быть введена путем катализируемой палладием реакции кросс-сочетания с использованием соответствующим образом замещенной борной кислоты или сложного эфира (A4) в присутствии соответствующего основания, такого как карбонат калия. Указанные реакции могут проводиться в присутствии или в отсутствии дополнительных лигандов для палладия, которые, в случае их использования, могут включать одно или несколько из следующих соединений: трифенилфосфин, три-о-толилфосфин, три(трет-бутил)фосфин, 1,1'-бис(дифенилфосфино)ферроцен, бис[2-(дифенилфосфино)фенил]эфир, 2-дициклогексилфосфино-2',6'-диметоксибифенил, гексафторфосфат 1-бутил-3-метилимидазолия и т.п. Возможные растворители включают этанол, THF, DMF, толуол, DME, диоксан и бензол. Соединения формулы A5 могут быть бромированы в присутствии соответствующего бромирующего агента, такого как NBS, с получением соединения формулы A6. Реакция с соответствующим образом замещенным спиртом формулы A7, необязательно в присутствии основания, позволяет получить соединение формулы A8. Снятие защитной группы с аминогруппы (P) с использованием известных специалистам способов дает соединение формулы (I)-A.
На схеме B представлен альтернативный способ получения соединений формулы (I)-A, в которых X представляет собой O, Y представляет собой связь, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил.

Соединение A1 доступно в продаже или может быть получено известными способами, описанными в научной литературе. Соединение B1 может быть введено в реакцию с соединением формулы A7, необязательно в присутствии основания, с получением соединения формулы B2. Восстановительное аминирование соединения формулы A2 в присутствии источника гидрид-иона, такого как триацетоксиборгидрид натрия, позволяет получить соединение формулы B3. Соединение формулы B3 может быть введено в реакцию кросс-сочетания с борной кислотой или эфиром формулы A4, как описано для схемы A, с получением соединения формулы B4. Снятие защитной группы с аминогруппы соединения формулы B4 дает соединение формулы (I)-A.
На схеме C показан способ получение соединений формулы (I)-C, в которых X представляет собой O, Y представляет собой связь, а R3 вместе с L и атомом азота, к которому присоединен L, объединены с образованием пиперазинильного кольца.

Соединение C1 доступно в продаже или может быть получено известными способами, описанными в научной литературе. Соединение C1 может быть введено в реакцию ароматического нуклеофильного замещения с соединением формулы A7, необязательно в присутствии основания, с получением соединения формулы C2. При нагревании соединения формулы C2 с амином формулы C3 можно получить соединение формулы C4. Соединение формулы C4 также можно получить обработкой соединения формулы C2 амином формулы C3 в присутствии палладиевого катализатора и соответствующих лигандов. Ароматическое бромирование с использованием бромирующего агента, такого как NBS, позволяет получить соединение формулы C5. Бромид формулы C5 может быть введен в реакцию катализируемого палладием кросс-сочетания, как описано в настоящей заявке, с получением соединения формулы C6. Снятие защитной группы с аминогруппы дает соединение формулы (I)-C.
На схеме D представлен способ получения соединений формулы (I)-D, в которых X представляет собой CH2, Y представляет собой связь, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил.

Соединение B1 может быть алкилировано с использованием соответствующим образом замещенного R2-метилмагнийгалида формулы D1 в апротонном растворителе, например THF, в присутствии хлорида цинка и палладиевого катализатора с получением соединения формулы D2. Восстановительное алкилирование соединения формулы A2 позволяет получить соединение формулы D3. R1 может быть введен с использованием катализируемой палладием реакции кросс-сочетания с соединением формулы A4, как описано в настоящей заявке, с получением соединения формулы D4. Снятие защитной группы с аминогруппы дает соединение формулы (I)-D.
На схеме E представлен способ получения соединений формулы (I)-E, в которых X представляет собой O, Y представляет собой этинил, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил.

Соединение формулы B3 может быть введено в реакцию кросс-сочетания с доступными в продаже R1-замещенным этином формулы E1 в присутствии палладиевого катализатора и йодида меди и органического основания, например TEA, с получением соединения формулы E2. Стандартное снятие защитной группы с аминогруппы позволяет получить соединение формулы (I)-E.
На схеме F представлен способ получения соединений формулы (I)-F, в которых X представляет собой O, Y представляет собой этинил, L представляет собой CH2, а R3 представляет собой пирролидин-2-ил.

Соединение формулы B3 может быть введено в реакцию кросс-сочетания с защищенным TMS алкином формулы F1 в присутствии палладиевого катализатора и йодида меди и органического основания, например TEA, с получением соединения формулы F2. Снятие TMS-группы с использованием источника фторид-иона, например TBAF, позволяет получить соединение формулы F3. Соединение формулы F3 может быть введено в реакцию кросс-сочетания с R1-бромидом или йодидом в присутствии палладиевого катализатора и йодида меди и органического основания, например TEA, с получением соединения формулы F4. Стандартное снятие защитной группы с аминогруппы позволяет получить соединение формулы (I)-E.
На схеме G представлен способ получения соединений формулы (I)-G, в которых X представляет собой O, Y представляет собой связь, L отсутствует, а R3 представляет собой 4-аминоциклогексил.

Соединение формулы C2 может быть обработано амином формулы G1, где P представляет собой защитную группу для аминогруппы, с получением промежуточного продукта G2. Последующее ароматическое бромирование с использованием бромирующего агента, например NBS, позволяет получить соединение формулы G3. Бромид формулы G3 может быть введен в реакцию катализируемого палладием кросс-сочетания, как описано в настоящей заявке, с получением соединения формулы G4. Стандартное снятие защитной группы с аминогруппы (P) позволяет получить соединение формулы (I)-G в соответствии с настоящим изобретением.
На схеме H представлен способ получения соединений формулы (I)-H, в которых X представляет собой O, Y представляет собой связь, L представляет собой метилен, а R3 представляет собой 1-аминоэт-1-ил или 1-аминоциклопент-1-ил.

RH представляет собой метил или спироконденсированный циклопентил
Соединение формулы B2 может быть введено в реакцию конденсации с альдегидом формулы H1 в присутствии источника гидрид-иона, где RH представляет собой метил или спироконденсированный циклопентил, с получением промежуточного продукта H2. Альдегиды формулы H1 доступны в продаже или могут быть получены путем восстановления соответствующих карбоновых кислот. Бромид формулы H2 может быть введен в реакцию катализируемого палладием кросс-сочетания, как описано в настоящей заявке, с борной кислотой или эфиром формулы A4, с получением соединения формулы H3. Стандартное снятие защитной группы с аминогруппы (P) позволяет получить соединение формулы (I)-H в соответствии с настоящим изобретением.
На схеме I представлен способ получения соединений формулы (I)-I, в которых X представляет собой CH2, Y представляет собой этинил, L представляет собой метилен, а R3 представляет собой пирролидин-2-ил.

Соединение формулы D3 может быть введено в реакцию кросс-сочетания с доступным в продаже R1-замещенным этином формулы E1 в присутствии палладиевого катализатора и йодида меди и органического основания, например TEA, с получением соединения формулы I1. Стандартное снятие защитной группы с аминогруппы позволяет получить соединение формулы (I)-I.
Конкретные примеры
Все реагенты были приобретены из доступных на рынке источников. Спектры ядерного магнитного резонанса (ЯМР) для атомов водорода были сняты в указанном растворителе с использованием тетраметилсилана (TMS) в качестве внутреннего стандарта на спектрометре Bruker Avance или Varian (300 или 400 МГц). Полученные величины приведены в миллионных долях в сторону низкого поля от сигнала TMS. Масс-спектры (МС) были получены на спектрометре Micromass Platform LC или Agilent 1100 LCMS в виде ЭРИ m/z (M+H+) с использованием электрораспылительной ионизации. Ускоряемые СВЧ-нагревом реакции проводили с использованием микроволновых приборов CEM Discover или Biotage, при этом, если не указано иное, реакционную смесь помещали в герметически закрытый сосуд. Стереоизомерные соединения можно охарактеризовать как рацемические смеси или как отдельные диастереомеры и энантиомеры с использованием рентгеновской кристаллографии и других известных специалистам способов. Если не указано иное, все использованные в приведенных ниже примерах материалы были получены от стандартных коммерческих поставщиков реагентов или были синтезированы стандартными способами, известными специалистам в области химического синтеза. Если не указано иное, заместители, которые варьируются между примерами, были атомами водорода.
Пример 1

A. 5-Бром-3-(4-метоксифенокси)-пиразин-2-иламин (1b). К суспензии NaH (60% в минеральном масле) (0,264 г, 6,6 ммоль) в DMF (13 мл) по каплям добавили раствор 4-метоксифенола (0,63 г, 5,08 ммоль) в DMF (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 30 минут в атмосфере аргона. Затем в реакционную смесь добавили раствор 3,5-дибромпиразин-2-иламина (соединение 1a, 1,285 г, 5,08 ммоль) в DMF (5 мл) и выдержали полученную смесь при температуре 70°C в течение 1 часа. Смесь остудили до комнатной температуры, затем погасили ледяной водой и перемешивали в течение 10 минут. Полученное твердое вещество собрали фильтрованием и получили темно-коричневый осадок. Полученный осадок растворили в EtOAc, затем перекристаллизовали из смеси Et2O-гексаны и получили соединение 1b (0,784 г, выход 52%) в виде твердого вещества оранжевого цвета. 1H ЯМР (400 МГц, CDCl3): δ 7,76 (с, 1H), 7,07-7,16 (м, 2H), 6,89-6,98 (м, 2H), 4,94 (уш. с., 2H), 3,84 (с, 3H).
B. Трет-бутиловый эфир 2-(S)-{[5-бром-3-(4-метоксифенокси)-пиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (1d). К раствору соединения 1b (0,487 г, 1,64 ммоль) в 1,2-дихлорэтане (7 мл) при комнатной температуре добавили Boc-L-пролиналь (соединение 1c) (0,557 г, 2,8 ммоль) и ледяную уксусную кислоту (0,35 мл), после чего полученный раствор перемешивали в течение 2 часов в атмосфере азота. Затем смесь обработали NaBH(OAc)3 (0,765 г, 3,61 ммоль) и непрерывно перемешивали при комнатной температуре в течение 20 часов. В реакционную смесь добавили дополнительное соединение 1c (0,186 г, 0,93 ммоль) и перемешивали ее в течение дополнительных 2 часов. Затем смесь обработали NaBH(OAc)3 (0,255 г, 1,20 ммоль) и непрерывно перемешивали при комнатной температуре в течение 20 часов. Полученную смесь разбавили CH2Cl2, промыли насыщенным водным раствором NaHCO3 и H2O. Органический слой последовательно промыли H2O и насыщенным солевым раствором, а затем высушили над Na2SO4. После этого смесь отфильтровали, фильтрат упарили при пониженном давлении и получили исходный материал. Полученный исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси EtOAc-гексаны, и получили соединение 1d (0,562 г, выход 72%). 1H ЯМР (400 МГц, CDCl3): δ 7,72 (уш. с., 1H), 7,12 (уш. с., 2H), 6,92 (уш. с., 2H), 4,20-4,51 (м, 1H), 3,83 (уш. с., 3H), 3,40-3,56 (м, 4H), 1,76-2,14 (м, 4H), 1,45 (уш. с., 9H).
C. Трет-бутиловый эфир 2-(S)-{[3-(4-метоксифенокси)-5-пиридин-3-илпиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (1f). В закрытую септой с тефлоновым покрытием колбу Шленка поместили смесь соединения 1d (160 мг, 0,334 ммоль), пиридин-3-илборной кислоты (соединение 1e) (61,5 мг, 0,501 ммоль), Na2CO3/H2O (70,8 мг, 0,668 ммоль в 0,5 мл H2O) и [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладия (II) (27,3 мг, 0,0334 ммоль) в диоксане (2 мл) и выдержали при температуре 85°C в течение 3 часов. Полученную смесь разбавили EtOAc и промыли насыщенным водным раствором NH4Cl и H2O. Органический слой промыли H2O, а затем высушили над Na2SO4. Смесь отфильтровали, фильтрат упарили при пониженном давлении и получили исходный материал. Полученный исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси EtOAc-гексаны, и получили соединение 1f (80 мг, выход 50%). 1H ЯМР (400 МГц, CDCl3): δ 8,95 (с, 1H), 8,46 (д, 1H), 8,16 (с, 1H), 7,93 (д, 1H), 7,09-7,26 (м, 4H), 6,94 (д, 2H), 4,19-4,42 (м, 1H), 3,86 (с, 3H), 3,37-3,69 (м, 4H), 1,77-2,16 (м, 4H), 1,47 (с, 9H), МС: m/z 478,2 (M + H)+.
D. [3-(4-Метоксифенокси)-5-пиридин-3-ил-пиразин-2-ил]-пирролидин-2-(S)-илметиламин (соединение 2). К раствору соединения 1f (80 мг, 0,157 ммоль) в CH2Cl2 (1 мл) при комнатной температуре добавили трифторуксусную кислоту (0,7 мл). Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем pH среды довели до pH~12, используя 1Н водного раствора NaOH. Полученную смесь разделили между CH2Cl2 и H2O. Органический слой промыли H2O и высушили над Na2SO4. После этого смесь отфильтровали, а фильтрат сконцентрировали при пониженном давлении. Полученный остаток растворили в CH2Cl2 (1 мл) и обработали 1,0 М раствором HCl в Et2O (0,16 мл, 0,16 ммоль) при комнатной температуре. Реакционную смесь перемешивали 3 часа при комнатной температуре. После этого реакционную смесь сконцентрировали при пониженном давлении и растерли остаток с Et2O. Твердое вещество собрали вакуумным фильтрованием и высушили, получив соединение 2 (61 мг, выход 94%) в виде гидрохлорида. Соль HCl: 1H ЯМР (400 МГц, DMSO-d6): δ 9,45 (уш. с., 1H), 8,97 (с, 1H), 8,97 (уш. с., 1H), 8,58 (д, 1H), 8,48 (с, 1H), 8,31 (д, 1H), 7,77 (т, 1H), 7,65 (дд, 1H), 7,26-7,33 (м, 2H), 7,01-7,07 (м, 2H), 3,82-3,89 (м, 1H), 3,80 (с, 3H), 3,72-3,78 (м, 2H), 3,12-3,29 (м, 2H), 2,03-2,13 (м, 1H), 1,82-2,02 (м, 2H), 1,69-1,81 (м, 1H); МС: m/z 378,2 (M + H)+.
Следуя процедуре, описанной выше для примера 1, но используя соответствующие реагенты, исходные вещества и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
|
Пример 2

A. Трет-бутиловый эфир 2-(S)-{[3-(4-метоксифенокси)-5-пиридин-3-илэтинилпиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (2a). В сухую колбу Шленка поместили смесь соединения 1d (100 мг, 0,21 ммоль), 3-этинилпиридина (54 мг, 0,52 ммоль), йодида меди (I) (4 мг, 0,02 ммоль), дихлорида бис(трифенилфосфин)палладия (II) (15 мг, 0,02 ммоль) и Et3N (0,25 мл). Колбы закрыли септой с тефлоновым покрытием, откачали и заполнили аргоном. Затем с помощью шприца в смесь добавили THF (1 мл). Полученную смесь выдержали при температуре 70°C в течение 3 часов. Полученную смесь разбавили EtOAc и промыли насыщенным водным раствором NH4Cl и H2O. Органический слой промыли H2O, а затем высушили над Na2SO4. Смесь отфильтровали, фильтрат упарили при пониженном давлении и получили исходный материал. Полученный исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси EtOAc-гексаны, и получили соединение 2a (57 мг, выход 54%). 1H ЯМР (400 МГц, CDCl3): δ 8,72 (с, 1H), 8,50 (д, 1H), 7,94 (с, 1H), 7,77 (дт, 1H), 7,24 (дд, 1H), 7,07-7,20 (м, 2H), 6,92 (д, 2H), 4,18-4,39 (м, 1H), 3,83 (с, 3H), 3,35-3,67 (м, 4H), 1,75-2,15 (м, 4H), 1,45 (с, 9H).
B. [3-(4-Метоксифенокси)-5-пиридин-3-илэтинил-пиразин-2-ил]-пирролидин-2-(S)-илметиламин (соединение 3). К раствору соединения 2a (50 мг, 0,10 ммоль) в CH2Cl2 (1 мл) добавили TFA (0,7 мл) при комнатной температуре. Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем pH среды довели до pH~12, используя 1Н водного раствора NaOH. Полученную смесь разделили между CH2Cl2 и H2O. Органический слой промыли H2O и высушили над Na2SO4. После этого смесь отфильтровали, а фильтрат сконцентрировали при пониженном давлении. Остаток растворили в CH2Cl2 (1 мл) и обработали 1,0 М раствором HCl в Et2O (0,2 мл, 0,2 ммоль) при комнатной температуре. Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем реакционную смесь сконцентрировали при пониженном давлении и растерли остаток с Et2O. Твердое вещество собрали вакуумным фильтрованием и высушили, получив соединение 3 (40 мг, выход 84%) в виде гидрохлорида. Соль HCl: 1H ЯМР (400 МГц, DMSO-d6): δ 9,39 (уш. с., 1H), 8,87 (уш. с., 1H), 8,78 (с, 1H), 8,62 (д, 1H), 8,07 (д, 1H), 8,03 (с, 1H), 7,92 (т, 1H), 7,53-7,58 (м, 1H), 7,17-7,22 (м, 2H), 6,99-7,05 (м, 2H), 3,80-3,85 (м, 1H), 3,78 (с, 3H), 3,71-3,76 (м, 2H), 3,11-3,28 (м, 2H), 2,02-2,12 (м, 1H), 1,83-2,01 (м, 2H), 1,67-1,79 (м, 1H); МС: m/z 402,2 (M+H)+.
Следуя процедуре, описанной выше для примера 2, но используя соответствующие реагенты, исходные материалы и способы очистки, известны специалистам в данной области, были получены следующие соединения настоящего изобретения:
|
Пример 3

A. Трет-бутиловый эфир 2-(S)-[(5-бромпиразин-2-иламино)-метил]-пирролидин-1-карбоновой кислоты (3b). К раствору соединения 3a (5,75 г, 33,05 ммоль) в 1,2-дихлорэтане (60 мл) при комнатной температуре добавили Boc-L-пролиналь (соединение 1c) (9,22 г, 46,3 ммоль) и ледяную уксусную кислоту (3 мл) и полученный раствор перемешивали в течение 2 часов в атмосфере азота. Затем смесь обработали NaBH(OAc)3 (12,6 г, 59,5 ммоль) и непрерывно перемешивали при комнатной температуре в течение 4 часов. Полученную смесь разбавили CH2Cl2 и промыли насыщенным водным раствором NaHCO3 и H2O. Органический слой последовательно промыли H2O и насыщенным солевым раствором, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси EtOAc-гексаны, и получили соединение 3b (8,97 г, выход 76%). 1H ЯМР (400 МГц, CDCl3): δ 8,03 (с, 1H), 7,68 (с, 1H), 6,68 (уш. с., 1H), 4,15-4,28 (м, 1H), 3,23-3,60 (м, 4H), 1,69-2,12 (м, 4H), 1,45-1,55 (м, 9H).
B. Трет-бутиловый эфир 2-(S)-[(5-пиримидин-5-илпиразин-2-иламино)-метил]-пирролидин-1-карбоновой кислоты (3d). В закрытую септой с тефлоновым покрытием колбу Шленка поместили смесь соединения 3b (1,742 г, 4,88 ммоль), пиримидин-5-борной кислоты (соединение 3c) (0,725 г, 5,85 ммоль), 1,5 М водного раствора Na2CO3 (6,5 мл, 9,76 ммоль) и [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладия (II) (0,32 г, 0,392 ммоль) в диоксане (26 мл) и выдерживали при температуре 85°C в течение 5 часов. Полученную смесь разбавили EtOAc и промыли насыщенным водным раствором NH4Cl и H2O. Органический слой промыли H2O, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 3d (0,8 г, выход 46%). 1H ЯМР (400 МГц, CDCl3): δ 9,20 (с, 2H), 9,17 (с, 1H), 8,43 (с, 1H), 8,02 (д, 1H), 6,99 (уш. с., 1H), 4,21-4,31 (м, 1H), 3,33-3,55 (м, 4H), 2,03-2,16 (м, 1H), 1,86-2,02 (м, 2H), 1,74-1,85 (м, 1H), 1,50 (с, 9H); МС: m/z 357,2 (M + H)+.
C. Трет-бутиловый эфир 2-(S)-[(3-бром-5-пиримидин-5-илпиразин-2-иламино)-метил]-пирролидин-1-карбоновой кислоты (3e). К охлажденному до 0°C раствору соединения 3d (0,255 г, 0,715 ммоль) в DMF (2 мл) в атмосфере азота по каплям добавили раствор N-бромсукцинимида (140 мг, 0,786 ммоль) в DMF (1 мл). Реакционную смесь перемешивали при температуре 0°C в течение 2 часов, а затем непрерывно перемешивали при комнатной температуре в течение 3 часов. Полученную смесь погасили водой и экстрагировали Et2O. Органический слой последовательно промыли H2O и насыщенным солевым раствором, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 3e (0,24 г, выход 77%). 1H ЯМР (400 МГц, CDCl3): δ 9,18 (с, 2H), 9,18 (с, 1H), 8,40 (с, 1H), 7,54 (уш. с., 1H), 4,30-4,39 (м, 1H), 3,34-3,60 (м, 4H), 2,04-2,16 (м, 1H), 1,88-2,02 (м, 2H), 1,72-1,84 (м, 1H), 1,51 (с, 9H); МС: m/z 435,0 (M + H)+, 437,0 (M+3)+.
D. Трет-бутиловый эфир 2-(S)-{[3-(2-хлорфенокси)-5-пиримидин-5-илпиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (3f). К суспензии NaH (60% в минеральном масле) (9,5 мг, 0,24 ммоль) в DMF (1 мл) в атмосфере аргона по каплям добавили 2-хлорфенол (0,03 мл, 0,26 ммоль). Смесь перемешивали 30 минут при комнатной температуре. Затем в реакционную смесь добавили раствор соединения 3e (80 мг, 0,184 ммоль) в DMF (2 мл) и выдерживали ее при температуре 90°C в течение 6 часов. Смесь охладили до комнатной температуры, затем погасили ледяной водой и экстрагировали EtOAc. Органический слой промыли H2O, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 3f (39 мг, выход 44%). МС: m/z 483,2 (M + H)+.
Е. [3-(2-Хлорфенокси)-5-пиримидин-5-илпиразин-2-ил]-пирролидин-2-(S)-илметиламин (соединение 12). К раствору соединения 3f (39 мг, 0,08 ммоль) в CH2Cl2 (1 мл) при комнатной температуре добавили трифторуксусную кислоту (0,7 мл). Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем pH среды довели до pH~12, используя 1Н водного раствора NaOH. Полученную смесь разделили между CH2Cl2 и H2O. Органический слой промыли H2O и высушили над Na2SO4. После этого смесь отфильтровали, а фильтрат сконцентрировали при пониженном давлении. Полученный остаток растворили в CH2Cl2 (1 мл) и обработали 1,0 М раствором HCl в Et2O (0,16 мл, 0,16 ммоль) при комнатной температуре. Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем реакционную смесь сконцентрировали при пониженном давлении и растерли остаток с Et2O. Твердое вещество собрали вакуумным фильтрованием и высушили, получив соединение 12 (32 мг, выход 87%) в виде гидрохлорида. Свободное основание: 1H ЯМР (400 МГц, CDCl3): δ 9,06 (с, 1H), 8,95 (с, 2H), 8,21 (с, 1H), 7,48-7,54 (м, 1H), 7,32-7,38 (м, 2H), 7,23-7,29 (м, 1H), 6,09 (т, 1H), 3,72-3,82 (м, 1H), 3,58-3,67 (м, 1H), 3,43-3,54 (м, 1H), 2,98-3,13 (м, 2H), 1,98-2,09 (м, 1H), 1,75-1,97 (м, 2H), 1,54-1,67 (м, 1H); МС: m/z 383,0 (M+H)+.
Следуя процедуре, описанной выше для примера 3, но используя соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
|
Соединение 8. Искомое соединение получили, следуя процедуре, описанной выше для примера 3, заменив в процедуре D 2-хлорфенол на 3-фтор-4-метоксифенол1. Свободное основание: 1H ЯМР (400 МГц, CDCl3): δ 9,08 (с, 1H), 9,00 (с, 2H), 8,20 (с, 1H), 6,98-7,06 (м, 3H), 5,97 (уш. с., 1H), 3,95 (с, 3H), 3,70 (ддд, 1H), 3,46-3,55 (м, 1H), 3,32-3,40 (м, 1H), 2,96-3,02 (м, 2H), 1,94-2,04 (м, 1H), 1,70-1,92 (м, 2H), 1,47-1,58 (м, 1H); МС: m/z 397,2 (M+H)+.
1 3-Фтор-4-метоксифенол получили следующим образом:

A. 3-Фтор-4-метоксифенол. Смесь 3-фтор-4-метоксиацетофенона (5,16 г, 30,68 ммоль) и mCPBA (8,65 г, 38,61 ммоль) в CH2Cl2 кипятили с обратным холодильником в течение 48 часов. Затем реакционную смесь охладили до комнатной температуры, разбавили CH2Cl2, промыли 5% водным раствором K2CO3, высушили над Na2SO4 и сконцентрировали при пониженном давлении. Остаток растворили в этаноле (20 мл), а затем медленно обработали раствором NaOH (5,2 г) в H2O (6 мл). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Затем смесь сконцентрировали и остаток разделили между водой и Et2O. Смесь подкислили разбавленным водным раствором HCl и экстрагировали Et2O. Органические слои объединили, промыли насыщенным солевым раствором, высушили над Na2SO4 и сконцентрировали при пониженном давлении, получив исходный материал. Исходный материал взболтали в гексанах и твердый осадок собрали вакуумным фильтрованием, получив искомое соединение. 1H ЯМР (400 МГц, CDCl3) δ: 6,85 (т, 1H), 6,66 (дд, 1H), 6,54 (ддд, 1H), 4,59 (уш. с., 1H), 3,85 (с, 3H).
Соединение 33. Искомое соединение получили, следуя процедуре, описанной выше для примера 3, заменив в процедуре D 2-хлорфенол на 2,3-дигидробензофуран-5-ол2. Свободное основание: 1H ЯМР (400 МГц, CDCl3): δ 9,07 (с, 1H), 9,00 (с, 2H), 8,17 (с, 1H), 7,05 (д, 1H), 6,94 (дд, 1H), 6,81 (д, 1H), 6,00 (т, 1H), 4,66 (т, 2H), 3,73 (ддд, 1H), 3,53-3,63 (м, 1H), 3,41 (ддд, 1H), 3,27 (т, 2H), 2,95-3,09 (м, 2H), 1,96-2,05 (м, 1H), 1,74-1,94 (м, 2H), 1,50-1,61 (м, 1H) МС: m/z 391,2 (M + H)+.
2 2,3-Дигидробензофуран-5-ол получили следующим образом, как показано на схеме:

А. Бензофуран-5-ол. К раствору BBr3-SMe2 (9,45 г, 30,22 ммоль) в дихлорэтане (50 мл) добавили 5-метоксибензофуран (1,28 г, 8,64 ммоль) и полученную смесь кипятили с обратным холодильником в атмосфере азота в течение 4 часов. Реакционную смесь охладили до комнатной температуры. К полученной смеси осторожно добавили воду и перемешивали ее в течение 20 минут. Полученную смесь разбавили CH2Cl2, промыли насыщенным солевым раствором, высушили над Na2SO4 и сконцентрировали при пониженном давлении, получив исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили искомое соединение. 1H ЯМР (400 МГц, CDCl3) δ: 7,60 (д, J=2,3 Гц, 1H), 7,37 (д, 1H), 7,02 (д, 1H), 6,82 (дд, 1H), 6,68 (дд, 1H), 4,59 (с, 1H).
B. 2,3-Дигидробензофуран-5-ол. К раствору бензофуран-5-ола (300 мг, 2,24 ммоль) в этаноле (10 мл) добавили 10% Pd-C (20 мг) и полученную смесь встряхивали в атмосфере водорода при давлении 0,34 МПа (50 psi) в гидрирующем аппарате Parr в течение 19 часов. Затем реакционную смесь отфильтровали и сконцентрировали, получив исходный материал. Исходный материал дважды перекристаллизовали из толуола. Твердый осадок собрали вакуумным фильтрованием и высушили, получив искомое соединение (155 мг, выход 51%). 1H ЯМР (400 МГц, CDCl3): δ 6,71-6,75 (м, 1H), 6,62-6,66 (м, 1H), 6,55-6,60 (м, 1H), 4,54 (т, 2H), 4,35 (с, 1H), 3,18 (т, 2H).
Пример 4

A. Трет-бутиловый эфир 2-(S)-{[3-(3-ацетоксифенокси)-5-пиримидин-5-ил-пиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (4a). К суспензии NaH (60% в минеральном масле) (18 мг, 0,45 ммоль) в DMF (1 мл) в атмосфере аргона по каплям добавили 3-гидроксифениловый эфир уксусной кислоты (0,06 мл, 0,488 ммоль). Смесь перемешивали 30 минут при комнатной температуре. Затем в реакционную смесь добавили раствор соединения 3e (163 мг, 0,375 ммоль) в DMF (2 мл) и выдержали ее при температуре 80°C в течение 6 часов. Смесь остудили до комнатной температуры, затем погасили ледяной водой и экстрагировали EtOAc. Органический слой промыли H2O, а затем высушили над Na2SO4. После этого смесь отфильтровали, фильтрат упарили при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 4a (69 мг, выход 36%). МС: m/z 507,2 (M+H)+.
B. Трет-бутиловый эфир 2-(S)-{[3-(3-гидроксифенокси)-5-пиримидин-5-ил-пиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (4b). В раствор соединения 4a (20 мг) в EtOH/ H2O (2/2 мл) добавили 1Н водного раствора NaOH (2 мл) и полученную смесь выдержали при температуре 80°C в течение 2 часов. Реакционной смеси дали остыть до комнатной температуры, а затем отогнали органический растворитель. pH водного остатка довели до pH~6 с помощью 2Н водного раствора HCl, затем экстрагировали его EtOAc и высушили над Na2SO4. Полученную смесь сконцентрировали и очистили с использованием препаративной ТСХ, получив соединение 4b. 1H ЯМР (400 МГц, CDCl3): δ 9,19 (с, 1H), 9,06 (с, 2H), 8,13 (с, 1H), 7,22 (т, 1H), 6,69-6,80 (м, 3H), 4,21-4,34 (м, 1H), 3,32-3,69 (м, 4H), 1,87-2,11 (м, 3H), 1,68-1,77 (м, 1H), 1,43-1,49 (м, 9H); МС: m/z 465,2 (M+H)+.
C. 3-{6-Пиримидин-5-ил-3-[(пирролидин-2-(S)-илметил)-амино]-пиразин-2-илокси}-фенол (соединение 15). К раствору соединения 4b в CH2Cl2 (1 мл) при комнатной температуре добавили трифторуксусную кислоту (0,7 мл). Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем pH среды довели до pH~12, используя 1Н водного раствора NaOH. Полученную смесь разделили между CH2Cl2 и H2O. Органический слой промыли H2O и высушили над Na2SO4. После этого смесь отфильтровали, а фильтрат сконцентрировали при пониженном давлении. Остаток растворили в CH2Cl2 (1 мл) и обработали 1,0 М раствором HCl в Et2O при комнатной температуре. Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем реакционную смесь сконцентрировали при пониженном давлении и растерли остаток с Et2O. Твердое вещество собрали вакуумным фильтрованием и высушили, получив соединение 15 в виде гидрохлорида. Свободное основание: 1H ЯМР (400 МГц, CDCl3): δ 9,02 (с, 1H), 8,94 (с, 2H), 8,04 (с, 1H), 7,11-7,19 (м, 1H), 6,66-6,76 (м, 3H), 6,21 (т, 1H), 3,95-4,03 (м, 1H), 3,64-3,75 (м, 2H), 3,26-3,36 (м, 2H), 1,95-2,27 (м, 3H), 1,76-1,89 (м, 1H); МС: m/z 365,3 (M + H)+.
Пример 5

A. Трет-бутиловый эфир 2-(S)-{[5-(5-цианопиридин-3-ил)-пиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (5b). В закрытую септой с тефлоновым покрытием колбу Шленка поместили смесь соединения 3b (2,0 г, 5,60 ммоль), 5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-никотинонитрила (соединение 5a) (1,55 г, 6,72 ммоль), K2CO3 (1,547 г, 11,2 ммоль) и [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладия (II) (274 мг, 0,336 ммоль) в смеси CH3CN (8 мл) и H2O (2 мл) и облучили ее в микроволновом реакторе при температуре 140°C в течение 20 минут. Полученную смесь разбавили EtOAc и затем промыли насыщенным водным раствором NH4Cl и H2O. Органический слой промыли H2O, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 5b (1,56 г, выход 73%) в виде порошка рыжеватого цвета. 1H ЯМР (400 МГц, CDCl3): δ 9,27 (д, 1H), 8,79 (с, 1H), 8,42-8,52 (м, 2H), 8,00 (д, 1H), 7,09 (уш. с., 1H), 4,05-4,34 (м, 1H), 3,30-3,59 (м, 4H), 2,03-2,17 (м, 1H), 1,86-2,01 (м, 2H), 1,73-1,84 (м, 1H), 1,50 (с, 9H); МС: m/z 381,2 (M + H)+.
B. Трет-бутиловый эфир 2-(S)-{[3-бром-5-(5-цианопиридин-3-ил)-пиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (5c). К охлажденному до 0°C раствору соединения 5b (1,53 г, 4,02 ммоль) в DMF (8 мл) в атмосфере азота по каплям добавили раствор N-бромсукцинимида (800 мг, 4,49 ммоль) в DMF (6 мл). Реакционную смесь перемешивали при температуре 0°C в течение 2 часов, а затем непрерывно перемешивали при комнатной температуре в течение 3 часов. Полученную смесь погасили водой и экстрагировали Et2O. Органический слой последовательно промыли H2O и насыщенным солевым раствором, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 5c (1,22 г, выход 66%). 1H ЯМР (400 МГц, CDCl3): δ 9,24 (д, 1H), 8,80 (д, 1H), 8,46 (т, 1H), 8,43 (с, 1H), 7,63 (уш. с., 1H), 4,10-4,41 (м, 1H), 3,32-3,62 (м, 4H), 2,04-2,20 (м, 1H), 1,85-2,03 (м, 2H), 1,71-1,85 (м, 1H), 1,44-1,54 (м, 9H); МС: m/z 459,0 (M + H)+, 461,0 (M + 3)+.
C. Трет-бутиловый эфир 2-(S)-{[5-(5-цианопиридин-3-ил)-3-(3-гидроксифенокси)-пиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (5d). В закрытую септой с тефлоновым покрытием колбу Шленка поместили смесь соединения 5c (100 мг, 0,218 ммоль), бензол-1,3-диола (150 мг, 1,362 ммоль) и K2CO3 (60 мг, 0,434 ммоль) в DMF (1 мл) и облучили ее в микроволновом реакторе при температуре 160°C в течение 15 минут. Полученную смесь разделили между Et2O и H2O. Органический слой последовательно промыли H2O и насыщенным солевым раствором, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 5d (86,2 мг, выход 81%). 1H ЯМР (400 МГц, CDCl3): δ 9,12 (д, 1H), 8,70 (с, 1H), 8,12-8,26 (м, 2H), 7,42 (уш. с., 1H), 7,23-7,29 (м, 1H), 6,67-6,86 (м, 3H), 5,85-6,10 (м, 1H), 4,19-4,39 (м, 1H), 3,36-3,68 (м, 4H), 1,71-2,17 (м, 4H), 1,47 (с, 9H); МС: m/z 489,2 (M + H)+.
D. 5-{6-(3-Гидроксифенокси)-5-[(пирролидин-2-(S)-илметил)-амино]-пиразин-2-ил}-никотинонитрил (соединение 38). К раствору соединения 5d (86,2 мг, 0,176 ммоль) в CH2Cl2 (3 мл) при комнатной температуре добавили трифторуксусную кислоту (0,4 мл). Реакционную смесь перемешивали 3 часа при комнатной температуре. После отгонки растворителя и очистки остатка с помощью обращенно-фазовой ВЭЖХ, используя в качестве элюента градиент смеси CH3CN-H2O, получили соединение 38 в виде трифторацетата (61,5 мг, выход 57%). 1H ЯМР (400 МГц, DMSO-d6): δ 9,79 (с, 1H), 9,14 (д, 1H), 9,03 (уш. с., 1H), 8,90 (д, 1H), 8,54 (т, 1H), 8,51 (с, 1H), 8,47 (уш. с., 1H), 7,75 (т, 1H), 7,24-7,32 (м, 1H), 6,68-6,79 (м, 3H), 3,77-3,89 (м, 1H), 3,68-3,77 (м, 2H), 3,12-3,32 (м, 2H), 2,04-2,16 (м, 1H), 1,83-2,03 (м, 2H), 1,68-1,81 (м, 1H); МС: m/z 389,3 (M + H)+.
Следуя процедуре, описанной выше для примера 5, но используя соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
|
Соединение 25. Искомое соединение получили, следуя процедуре, описанной выше для примера 5, заменив в процедуре C бензол-1,3-диол на 3-фтор-4-метоксифенол1. Соль HCl: 1H ЯМР (400 МГц, DMSO-d6): δ 9,33 (уш. с., 1H), 9,12 (уш. с., 1H), 8,91 (уш. с., 1H), 8,82 (уш. с., 1H), 8,56 (т, 1H), 8,52 (с, 1H), 7,81 (т, 1H), 7,39 (дд, 1H), 7,24-7,31 (м, 1H), 7,15-7,21 (м, 1H), 3,88 (с, 3H), 3,79-3,86 (м, 1H), 3,71-3,78 (м, 2H), 3,11-3,30 (м, 2H), 2,02-2,14 (м, 1H), 1,82-2,01 (м, 2H), 1,68-1,81 (м, 1H); МС: m/z 421,0 (M + H)+.
Пример 6

A. 5-Бром-3-(4-метоксибензил)-пиразин-2-иламин (6a). Раствор хлорида цинка (0,5 М раствор в THF) (26,3 мл, 13,23 ммоль) добавили к раствору хлорида 4-метоксибензилмагния (0,25 М раствор в THF) (50 мл, 12,5 ммоль) при комнатной температуре в атмосфере азота. Полученную мутную смесь перемешивали при комнатной температуре в течение 15 минут. К полученной смеси при комнатной температуре последовательно добавили дихлорид бис(трифенилфосфин)палладия (II) (0,185 г, 0,263 ммоль) и раствор 2-амино-3,5-дибромпиразина (соединение 1a) (1,33 г, 5,26 ммоль) в THF (4 мл). Полученную смесь оранжевого цвета перемешивали при комнатной температуре в течение 54 часов, а затем погасили водой (10 мл) при температуре 0°C. Полученную смесь разбавили этилацетатом (200 мл) и водой (60 мл). Органический слой отделили, и водный слой экстрагировали этилацетатом (2×100 мл). Объединенные органические слои высушили над безводным Na2SO4 и сконцентрировали при пониженном давлении. Остаток очистили колоночной флэш-хроматографией (SiO2, 30% этилацетата в гексанах) и получили соединение 6a (1,36 г, выход 88%). 1H ЯМР (400 МГц, CDCl3): δ 8,04 (с, 1H), 7,11-7,18 (м, 2H), 6,84-6,89 (м, 2H), 4,37 (уш. с., 2H), 4,03 (с, 2H), 3,80 (с, 3H).
B. Трет-бутиловый эфир 2-(S)-{[5-бром-3-(4-метоксибензил)-пиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (6b). К раствору соединения 6a (1,37 г, 4,66 ммоль) в 1,2-дихлорэтане (30 мл) при комнатной температуре добавили Boc-L-пролиналь (соединение 1c) (1,114 г, 5,59 ммоль) и ледяную уксусную кислоту (1,5 мл) и полученный раствор перемешивали в течение 2 часов в атмосфере азота. Затем смесь обработали NaBH(OAc)3 (1,38 г, 6,524 ммоль) и непрерывно перемешивали при комнатной температуре в течение 20 часов. В реакционную смесь добавили соединение 1c (0,56 г, 2,8 ммоль) и перемешивали ее в течение 2 часов. Затем смесь обработали NaBH(OAc)3 (0,69 г, 3,26 ммоль) и непрерывно перемешивали при комнатной температуре в течение 20 часов. Полученную смесь разбавили CH2Cl2, промыли насыщенным водным раствором NaHCO3 и H2O. Органический слой последовательно промыли H2O и насыщенным солевым раствором, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси EtOAc-гексаны, и получили соединение 6b (1,56 г, выход 70%). МС: m/z 477,1 (M + H)+, 479,1 (M + 3)+.
C. Трет-бутиловый эфир 2-(S)-{[3-(4-метоксибензил)-5-пиримидин-5-илпиразин-2-иламино]-метил}-пирролидин-1-карбоновой кислоты (6c). В закрытую септой с тефлоновым покрытием колбу Шленка поместили смесь соединения 6c (200 мг, 0,42 ммоль), пиримидин-5-борной кислоты (соединение 3c) (78 мг, 0,63 ммоль), Na2CO3/H2O (89 мг, 0,84 ммоль в 0,5 мл H2O) и [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладия (II) (34,3 мг, 0,042 ммоль) в диоксане (2 мл) и выдержали при температуре 100°C в течение 4 часов. Полученную смесь разбавили EtOAc, последовательно промыли насыщенным водным раствором NH4Cl и H2O, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 6c (88 мг, выход 44%). 1H ЯМР (400 МГц, CDCl3): δ 9,21 (с, 2H), 9,14 (с, 1H), 8,36 (с, 1H), 7,36 (д, 2H), 7,19-7,24 (м, 1H), 6,86 (д, 2H), 4,19-4,31 (м, 1H), 4,06 (с, 2H), 3,80 (с, 3H), 3,32-3,55 (м, 4H), 2,00-2,14 (м, 1H), 1,81-2,00 (м, 2H), 1,66-1,80 (м, 1H), 1,53 (с, 9H); МС: m/z 477,3 (M + H)+.
D. [3-(4-Метоксибензил)-5-пиримидин-5-ил-пиразин-2-ил]-пирролидин-2-(S)-илметиламин (соединение 17). К раствору соединения 6c (88 мг, 0,185 ммоль) в CH2Cl2 (1 мл) при комнатной температуре добавили трифторуксусную кислоту (0,7 мл). Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем pH среды довели до pH~12, используя 1Н водного раствора NaOH. Полученную смесь разделили между CH2Cl2 и H2O. Органический слой промыли H2O и высушили над Na2SO4. После этого смесь отфильтровали, а фильтрат сконцентрировали при пониженном давлении. Остаток растворили в CH2Cl2 (1 мл) и обработали 1,0 М раствором HCl в Et2O (0,39 мл, 0,39 ммоль) при комнатной температуре. Реакционную смесь перемешивали 3 часа при комнатной температуре. Затем реакционную смесь сконцентрировали при пониженном давлении и растерли остаток с Et2O. Твердое вещество собрали вакуумным фильтрованием и высушили, получив соединение 17 (71 мг, выход 86%) в виде гидрохлорида. Свободное основание: 1H ЯМР (400 МГц, CDCl3): δ 9,21-9,25 (м, 2H), 9,17-9,20 (м, 1H), 8,35 (с, 1H), 7,21-7,26 (м, 2H), 6,81-6,86 (м, 2H), 5,97-6,14 (м, 1H), 4,16 (с, 2H), 3,90-4,01 (м, 1H), 3,68-3,81 (м, H), 3,78 (с, 3H), 3,23-3,33 (м, 1H), 2,99-3,09 (м, 1H), 2,06-2,16 (м, 1H), 1,85-1,99 (м, 2H), 1,60-1,68 (м, 2H) МС: m/z 377,3 (M + H)+.
Следуя процедуре, описанной выше для примера 6, но используя соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
|
Пример 7

A. 2-Хлор-3-(4-метоксифенокси)-пиразин (7b). Смесь 2,3-дихлорпиразина (соединение 7a) (0,88 г, 5,91 ммоль), 4-метоксифенола (0,81 г, 6,5 ммоль) и карбоната калия (1,63 г, 11,82 ммоль) в этаноле (20 мл) перемешивали при комнатной температуре в течение 20 часов. Полученную смесь сконцентрировали при пониженном давлении и остаток разделили между EtOAc и водой. Органический слой последовательно промыли разбавленным водным раствором HCl и H2O, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 7b (0,755 г, выход 54%). 1H ЯМР (400 МГц, CDCl3): δ 8,04 (д, 1H), 7,99 (д, 1H), 7,07-7,15 (м, 2H), 6,93-7,00 (м, 2H), 3,84 (с, 3H).
B. Трет-бутиловый эфир 3'-(4-метоксифенокси)-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-карбоновой кислоты (7c). В закрытую септой с тефлоновым покрытием колбу Шленка поместили смесь соединения 7b (243 мг, 1,03 ммоль) и трет-бутилового эфира пиперазин-1-карбоновой кислоты (478 мг, 2,57 ммоль) в смеси i-PrOH/диоксан (4/0,5 мл) и выдержали ее при температуре 98°C в течение 48 часов. Полученную смесь разбавили EtOAc, последовательно промыли H2O и насыщенным солевым раствором и высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 7c (290 мг, выход 73%). 1H ЯМР (400 МГц, CDCl3): δ 7,82 (д, 1H), 7,54 (д, 1H), 7,05-7,09 (м, 2H), 6,93-6,98 (м, 2H), 3,83 (с, 3H), 3,60 (с, 8H), 1,50 (с, 9H).
C. Трет-бутиловый эфир 5'-бром-3'-(4-метоксифенокси)-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-карбоновой кислоты (7d). К охлажденному до 0°C раствору соединения 7c (196 мг, 0,51 ммоль) в DMF (2 мл) в атмосфере азота по каплям добавили раствор N-бромсукцинимида (110 мг, 0,61 ммоль) в DMF (1 мл). Реакционную смесь перемешивали при температуре 0°C в течение 2 часов, а затем непрерывно перемешивали при комнатной температуре в течение 3 часов. Полученную смесь погасили водой и экстрагировали Et2O. Органический слой последовательно промыли H2O и насыщенным солевым раствором, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 7d (166 мг, выход 70%). 1H ЯМР (400 МГц, CDCl3): δ 7,90 (с, 1H), 7,03-7,10 (м, 2H), 6,90-6,97 (м, 2H), 3,84 (с, 3H), 3,52-3,61 (м, 8H), 1,49 (с, 9H).
D. Трет-бутиловый эфир 5'-(5-цианопиридин-3-ил)-3'-(4-метоксифенокси)-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-карбоновой кислоты (7e). В закрытую септой с тефлоновым покрытием колбу Шленка поместили смесь соединения 7d (120 мг, 0,26 ммоль), соединения 5a (89 мг, 0,387 ммоль), Na2CO3/H2O (55 мг, 0,52 ммоль) в 0,4 мл H2O) и [1,1'-бис(дифенилфосфино)-ферроцен]дихлорпалладия (II) (21 мг, 0,026 ммоль) в диоксане (2 мл) и выдержали при температуре 90°C в течение 1 часа. Полученную смесь разбавили EtOAc и промыли насыщенным водным раствором NH4Cl и H2O. Органический слой промыли H2O, а затем высушили над Na2SO4. Затем смесь отфильтровали, фильтрат сконцентрировали при пониженном давлении и получили исходный материал. Исходный материал очистили колоночной флэш-хроматографией (SiO2), используя в качестве элюента градиент смеси гептан-EtOAc, и получили соединение 7e (100 мг, выход 79%). МС: m/z 489,2 (M + H)+.
E. 5-[3'-(4-Метоксифенокси)-3,4,5,6-тетрагидро-2H-[1,2']бипиразинил-5'-ил]-никотинонитрил (соединение 30). Используя адаптацию способа, описанного для процедуры D в примере 1, и заменив соединение 1f на соединение 7e, получили соединение 30 в виде гидрохлорида. Свободное основание: 1H ЯМР (400 МГц, CDCl3): δ 9,12 (д, 1H), 8,74 (д, 1H), 8,32 (с, 1H), 8,16 (т, 1H), 7,08-7,13 (м, 2H), 6,95-7,00 (м, 2H), 3,87 (с, 3H), 3,76-3,82 (м, 4H), 3,04-3,12 (м, 4H); МС: m/z 389,0 (M + H)+.
Следуя процедуре, описанной выше для примера 7, но используя соответствующие реагенты, исходные материалы и способы очистки, известные специалистам в данной области, были получены следующие соединения настоящего изобретения:
|
Используя описанные выше процедуры, были синтезированы приведенные в таблице ниже соединения 1-42 формулы (I).

|
Биологические исследования
Исследования in vitro
Пример 1
24-луночный анализ связывания с дельта-опиоидными рецепторами на клетках линии NG108-15
Способы: мембраны клеток линии NG108-15 были приобретены у компании Applied Cell Sciences (г. Роквилль, штат Мэриленд, США). Мембранный белок был суспендирован в концентрации 5 мг/мл в 10 мМ буферного раствора TRIS-HCl при pH 7,2 с добавлением 2 мМ EDTA, 10% сахарозы. Содержимое каждого флакона гомогенизировали в 5 мл 50 мМ буферного раствора Tris при pH 7,4 с использованием нескольких коротких импульсов на гомогенизаторе Polytron. Полученный гомогенат разбавили в 50 мМ буферного раствора Tris, содержащего 5 мМ MgCl2 до концентрации 330 мкг/мл в рабочем растворе с получением итоговой концентрации белка 133 мкг/лунку. Полученный препарат использовали для проведения 24-луночного анализа связывания с дельта-опиоидными рецепторами.
После инкубирования с дельта-селективным лигандом, ~0,2 нМ [3H]налтриндола, при температуре 25°C в течение 2,5 часов на 24-луночном планшете с суммарным объемом 1 мл содержимое планшета профильтровали через фильтр UniFilter24, GF/B. Данный планшет предварительно замочили в 0,3% PEI и профильтровали через 24-луночную систему сбора клеток. Указанный фильтр UniFilter24 трижды промыли 2 мл 10 мМ буферного раствора HEPES (pH 7,4) и высушили в печи при температуре 37°C в течение 1,5 часов. В каждую лунку добавили по 150 мкл Scint0 (компания PerkinElmer, № по каталогу 6013611). Затем планшеты анализировали на сканере TopCount.
Анализ: данные со сцинтилляционного счетчика использовали для расчета процентной степени ингибирования по сравнению с контрольным связыванием (когда определяли эффект только для одной концентрации тестируемого соединения) или значения Ki (когда тестировали диапазон концентраций). В качестве отрицательного контроля использовали неспецифическое связывание (н.с. - 1 мМ налоксона), в качестве положительного контроля использовали суммарное связывание (с.с. - только мембрана и лиганд). При анализе одной концентрации процентную степень ингибирования рассчитывали как (количество отсчетов в мин для суммарного связывания минус количество отсчетов в мин для тестируемого соединения), разделенное на (количество отсчетов в мин для суммарного связывания минус количество отсчетов в мин для неспецифичного связывания). Каждую приведенную процентную степень ингибирования получали усреднением результатов трех измерений. При работе с несколькими концентрациями полученные значения анализировали с помощью программы нелинейной регрессии для связывания по одному сайту из программного пакета Prism для получения значений Ki. Максимальные и минимальные величины использовали в качестве глобальных. Каждое приведенное значение Ki получали путем усреднения по результатам трех измерений.
Полученные данные приведены в таблице 2 ниже.
Пример 2
Анализ связывания с дельта-опиоидными рецепторами на мозге крысы
Процедура: самцов крыс линии Wistar (150-250 г, VAF, компания Charles River, г. Кингстон, штат Нью-Йорк) умерщвляли CO2, мозг извлекали и немедленно помещали в ледяной буферный раствор Tris HCl (50 мМ, pH 7,4). Передние отделы отделяли от остального мозга с использованием коронального сечения, начиная сверху у холмиков и проводя разрез вниз через соединение среднего мозга с мостом. После вскрытия передний мозг гомогенизировали в буферном растворе Tris в тефлон®-стеклянном гомогенизаторе. Полученный гомогенат разбавляли до концентрации 1 г ткани переднего мозга на 80 мл буферного раствора и центрифугировали на скорости 39000×g в течение 10 минут. Полученный осадок ресуспендировали в таком же объеме буферного раствора Tris с добавлением 5 мМ MgCl2 с помощью нескольких небольших импульсов на гомогенизаторе Polytron. Полученный препарат использовали для проведения анализа связывания с дельта-опиоидными рецепторами. После инкубирования с дельта-селективным пептидным лигандом, ~4 нМ [3H]DPDPE или 0,25 нМ [3H]налтриндола, при температуре 25°C в течение 2,5 часов на 96-луночном планшете с суммарным объемом 1 мл содержимое планшета профильтровали через фильтры Wallac filtermat B sheet на 96-луночной системе сбора клеток Tomtec. Указанные фильтры трижды промыли 2 мл 10 мМ буферного раствора HEPES (pH 7,4) и дважды просушили в микроволновой печи мощностью 650 Вт в течение 1,75 минут. На каждую зону с образцом поместили 2×50 мкл сцинтилляционной жидкости Betaplate Scint (компания LKB) и количественно определили радиоактивность с использованием жидкостного сцинтилляционного счетчика компании LKB (Wallac) 1205 BetaPlate.
Анализ: данные со сцинтилляционного счетчика использовали для расчета процентной степени ингибирования по сравнению с контрольным связыванием (когда определяли эффект только для одной концентрации тестируемого соединения) или значения Ki (когда тестировали диапазон концентраций). Процентную степень ингибирования рассчитывали как [(количество распадов в минуту для суммарного связывания - количество распадов в минуту для тестируемого соединения)/(количество распадов в минуту для суммарного связывания - количество распадов в минуту для неспецифического связывания)]*100. Значения Kd и Ki рассчитывали с помощью программы для анализа данных GraphPad PRISM. Полученные данные приведены в таблице 2 ниже.
Пример 3
Анализ связывания с мю-опиоидными рецепторами на мозге крысы
Процедура: самцов крыс линии Wistar (150-250 г, VAF, компания Charles River, г. Кингстон, штат Нью-Йорк) умерщвляли CO2, мозг извлекали и немедленно помещали в ледяной буферный раствор Tris HCl (50 мМ, pH 7,4). Передние отделы отделяли от остального мозга с использованием коронального сечения, начиная сверху у холмиков и проводя разрез вниз через соединение среднего мозга с мостом. После проведения сечения полученные передние отделы мозга гомогенизировали в буферном растворе Tris в тефлон®-стеклянном гомогенизаторе. Полученный гомогенат разбавляли до концентрации 1 г ткани переднего мозга на 80 мл буферного раствора и центрифугировали на скорости 39000×g в течение 10 минут. Полученный осадок ресуспендировали в таком же объеме буферного раствора Tris с добавлением 5 мМ MgCl2 с помощью нескольких небольших импульсов на гомогенизаторе Polytron. Полученный препарат использовали для проведения анализа связывания с мю-опиоидными рецепторами. После инкубирования с мю-селективным пептидным лигандом, ~0,8 нМ [3H]DAMGO, при температуре 25°C в течение 2,5 часов на 96-луночном планшете с суммарным объемом 1 мл содержимое планшета профильтровали через фильтры Wallac filtermat B sheet на 96-луночной системе сбора клеток Tomtec. Указанные фильтры трижды промыли 2 мл 10 мМ буферного раствора HEPES (pH 7,4) и дважды просушили в микроволновой печи мощностью 650 Вт в течение 1,75 минут. На каждую зону с образцом поместили 2×40 мкл сцинтилляционной жидкости Betaplate Scint (компания LKB) и количественно определили радиоактивность с помощью жидкостного сцинтилляционного счетчика компании LKB (Wallac) 1205 BetaPlate.
Анализ: данные со сцинтилляционного счетчика использовали для расчета процентной степени ингибирования по сравнению с контрольным связыванием (когда определяли эффект только для одной концентрации тестируемого соединения) или значения Ki (когда тестировали диапазон концентраций). Процентную степень ингибирования рассчитывали как [(количество распадов в минуту для суммарного связывания - количество распадов в минуту для тестируемого соединения)/(количество распадов в минуту для суммарного связывания - количество распадов в минуту для неспецифического связывания)]*100. Значения Kd и Ki рассчитывали с помощью программы для анализа данных GraphPad PRISM. Полученные данные приведены в таблице 2 ниже.
|
Пример 4
[35S]GTPγS анализ связывания на мембранах клеток линии NG108-15 (функциональный тест на дельта-опиоидные рецепторы) - скрининг при концентрации 200 нМ
Способ: клеточные мембраны NG108-15 приобрели в компании Applied Cell Sciences (г. Роквилль, штат Мэриленд). 5 мг/мл мембранных белков суспендировали в 10 мМ буферного раствора TRIS-HCl c pH 7,2, 2 мМ EDTA, 10% сахарозы. Мембраны хранили при температуре 4-8°C. 1 мл препарата мембран добавили в 10 мл холодного буферного раствора для проведения теста. Буферный раствор для проведения теста содержал 50 мМ буферного раствора Tris с pH 7,6, 5 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT и 1 мМ EGTA. Суспензию мембран дважды гомогенизировали на гомогенизаторе Polytron и центрифугировали на скорости 3 000 об/мин в течение 10 минут. Затем собранный супернатант центрифугировали на скорости 18 000 об/мин в течение 20 минут. В пробирку с осадком добавили 10 мл буферного раствора для проведения теста. Осадок и буфер перемешивали с использованием гомогенизатора Polytron.
Процедура инкубирования: осажденные мембраны (75 мкг/мл) предварительно инкубировали с частицами для сцинтилляционного анализа сближения (частицы SPA) (10 мг/мл) при температуре 25°C в течение 45 минут в буферном растворе для проведения теста. Затем связавшиеся с мембранами (37,5 мкг/мл) частицы SPA (5 мг/мл) инкубировали с 0,1 нМ [35S] GTPγS в том же буферном растворе Tris, содержащем 100 мкМ GDP, в суммарном объеме 200 мкл. Для стимулирования связывания [35S]-GTPγS добавляли 200 нМ агонистов рецептора. Базовый уровень связывания тестировали в отсутствии агонистов, а уровень неспецифического связывания тестировали в присутствии 10 мкМ немеченого GTPγS. Данные анализировали на счетчике Packard Top Count, результаты приведены в таблице 3 ниже.
ДАННЫЕ
% от базового=(стимулированный-неспецифичный)*100/(базовый-неспецифичный).
Относительная эффективность соединения при концентрации 200 нМ=(% от базового для тестируемого соединения при 200 нМ)/(рассчитанный максимум кривой зависимости эффекта от дозы для SNC80; кривая в пакете prism).
Пример 5
[35S]GTPγS анализ связывания на мембранах клеток линии CHO-hMOR (функциональный тест на мю-опиоидные рецепторы)
Способы: мембраны клеток линии CHO-hMOR были приобретены у компании Receptor Biology, Inc. (г. Балтимор, штат Мэриленд, США). Мембранный белок был суспендирован в концентрации приблизительно 10 мг/мл в 10 мМ буферного раствора TRIS-HCl при pH 7,2 с добавлением 2 мМ EDTA, 10% сахарозы, суспензия хранилась на льду. 1 мл препарата мембран добавили в 15 мл холодного буферного раствора для проведения теста, который содержал 50 мМ буферного раствора HEPES, pH 7,6, 5 мМ MgCl2, 100 мМ NaCl, 1 мМ DTT и 1 мМ EDTA. Суспензию мембран гомогенизировали на гомогенизаторе Polytron и центрифугировали на скорости 3 000 об/мин в течение 10 минут. Затем собранный супернатант центрифугировали на скорости 18 000 об/мин в течение 20 минут. Полученный осадок ресуспендировали в 10 мл буферного раствора для проведения теста в гомогенизаторе Polytron. Мембраны предварительно инкубировали с покрытыми агглютинином из проростков пшеницы частицами SPA (компания Amersham) при температуре 25°C в течение 45 минут в буферном растворе для проведения теста. Затем связавшиеся с мембранами частицы SPA (5 мг/мл) инкубировали с 0,5 нМ [35S]GTPγS в буферном растворе для проведения теста. Базовое связывание, которое осуществлялось в отсутствие добавленного тестируемого соединения, принимали за 100%, при этом стимулированное агонистом связывание достигало уровней, значительно превышающих данную величину. Для стимулирования связывания [35S]GTPγS использовали диапазон концентраций агонистов рецептора. Как базовое, так и неспецифическое связывание тестировали в отсутствие агониста, для определения уровня неспецифичного связывания использовали 10 мкМ немеченого GTPγS.
Соединения тестировали на активность как антагониста путем оценки их потенциала ингибирования стимулированного агонистом связывания GTPγS. Радиоактивность количественно определяли на счетчике Packard TopCount. Рассчитывали следующие параметры:


Значения EC50 рассчитаны в программе GraphPad Prism и приведены в таблице 3 ниже.
|
Исследование in vivo
Пример 6
Модель воспалительной боли на основе гиперчувствительности к излучаемому теплу у крыс, вызванной введением CFA
Введение полного адъюванта Фрейнда (CFA) в подошву лапки вызывает у грызуна сильную и продолжительную воспалительную реакцию, которая характеризуется хронической ярко выраженной гипералгезией как к тепловым, так и к механическим воздействиям. Эти эффекты достигают максимальной выраженности в период 24-72 часа после инъекции и могут продолжаться от нескольких дней до нескольких недель. Для оценки способности соединений к обращению тепловой гипералгезии в подошву левой задней лапки самцам крыс линии Sprague-Dawley (200-350 г) может быть введена инъекция CFA (1:1 CFA:солевой раствор, 100 мкл). По истечении 24-часового инкубационного периода определяли задержки реакции на излучающем тепло стимуляторе лапы (RH), которые сравнивали с фоновыми задержками до введения CFA. Стимулятор автоматически фиксировал поднятие лапки с поверхности стекла. Анализ продолжали только для крыс, у которых имело место по меньшей мере 25% сокращение латентного периода реакции (то есть имела место гипералгезия). После определения задержки после введения CFA крысам перорально вводили (2,5 мл/кг) тестируемое соединение или инертный носитель (гидроксипропилметилцеллюлоза, HPMC). Для каждого животного рассчитывали процентную степень обращения гипералгезии как (реакция после введения тестируемого соединения - реакция после введения CFA)/(реакция до введения CFA - реакция после введения CFA)×100. Таким образом, возвращение к нормальным порогам чувствительности до введения CFA определяли как 100% эффективность, тогда как отсутствие отличия от порогов чувствительности после введения CFA оценивали как 0% эффективность. Затем для каждой группы рассчитывали среднюю процентную степень обращения гипералгезии (n=6-8 крыс/группа).