Результат интеллектуальной деятельности: НАБОР ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕНЫХ ДНК-ЗОНДОВ ДЛЯ ИДЕНТИФИКАЦИИ РНК ЭНТЕРОВИРУСОВ, РИНОВИРУСОВ, ВИРУСОВ ГЕПАТИТА А И Е ИЗ ВОДНОЙ СРЕДЫ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПЦР
Вид РИД
Изобретение
Изобретение относится к наборам олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для идентификации генетического материала (РНК) энтеровирусов, риновирусов, вирусов гепатита А и Е в образцах воды из окружающей среды методом мультиплексной полимеразной цепной реакции и может быть использовано в вирусологии и эпидемиологии для обеспечения эпидемической безопасности населения при различных видах водопользования.
Проблема обеспечения эпидемической безопасности населения России при различных видах водопользования является приоритетной государственной задачей в системе предупредительного санитарно-эпидемиологического надзора. Будучи одним из ведущих в реализации кишечных вирусных инфекций, водный путь передачи в настоящее время является одним из основных в формировании спорадической и вспышечной заболеваемости.
Известно, что для индикации цитопатогенных вирусов, распространяющихся водным путем, в практической лабораторной службе используется метод их выделения на чувствительных культурах клеток. Однако данный метод имеет ряд недостатков, снижающих его практическую значимость: длительность процесса (3-4 недели), невозможность выделения нецитолитических и поврежденных вирусных агентов, не способных вызывать продуктивную цитолитическую инфекцию в системе in vitro, но, тем не менее, представляющих эпидемическую опасность для живого организма (Проблема лабораторной диагностики острых кишечных инфекций неустановленной этиологии у детей / Т.В. Амвросьева, Н.В. Поклонская, Е.П. Кишкурно, Н.Л. Клюйко, О.Н. Казинец, А.А. Безручко, О.И. Камяк // Перспективы сотрудничества государств-членов ШОС в противодействии угрозе инфекционных болезней: материалы междунар. науч.-практ. конф. / ФГУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора. - Новосибирск, 2009. - С. 52-55). Эти проблемы, возникающие при изучении вирусологического качества вод различных водных объектов, могут быть решены путем использования метода детекции, представляющего собой полимеразную цепную реакцию с этапом обратной транскрипции (ОТ-ПЦР), который позволяет в течение 3-6 часов обнаружить в исследуемом материале вирусную РНК.
Метод полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) является наиболее распространенным методом, используемым в лабораторной практике для дифференциальной диагностики инфекционных заболеваний. В основе метода лежат две реакции - обратная транскрипция и полимеразная цепная реакция. В реакции обратной транскрипции на матрице вирусной РНК строится комплиментарная ДНК (кДНК). В следующей за реакцией обратной транскрипции ПЦР происходит многократное избирательное удвоение целевого участка кДНК (амплификация). Амплифицируемый участок кДНК является маркерным, так как строго ограничен последовательностями ДНК-затравок (праймеров), без которых невозможно протекание ПЦР. Для детекции накопления продуктов амплификации в режиме реального времени помимо пары праймеров необходим также флуорисцентно-меченый ДНК-зонд. Сложность выбора праймеров и зонда обусловлена требованием их строгой видоспецифичности. В случае если выбранные олигонуклеотиды не обладают видовой специфичностью к целевому объекту либо не обладают достаточной гомологией к целевой нуклеотидной последовательности, возможны ложноотрицательные результаты исследования. В случае если выбранные праймеры и зонды демонстрируют сродство к нецелевым последовательностям ДНК, то возможны ложноположительные результаты исследования. Правильный выбор сочетания пары праймеров и флуоресцентно-меченого ДНК-зонда позволяет осуществить строго специфическую амплификацию целевого фрагмента кДНК и провести детекцию накопления продуктов ПЦР в режиме реального времени.
Для ПЦР диагностики энтеровирусов используются ПЦР-тест-системы с детекцией методом электрофореза таких компаний, как ЗАО «БиоХимМак» (http://www.biochemmack.ru/product/moleculardiagnostics/infectious/), ЗАО «Литех» (наборы реагентов для ПЦР производства "ИзоГен") (http://www.lytech.ru/ catalog_69.htm). Набор с гибридизационно-флуоресцентной детекцией производит компания «ИнтерЛабСервис» (http://www.interlabservice.ru/catalog/reagents/ index.php?sid=678).
Для диагностики вирусов гепатита А методом ПЦР используются набор реагентов для выявления РНК вируса гепатита A (HAV) в клиническом материале и объектах окружающей среды методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией "АмплиСенс® HAV-F (http://www.product_3056.html).
Для диагностики вируса гепатита Е методом ПЦР наборы на территории России не выпускаются.
Наиболее близким аналогом (прототипом) является набор для детекции кДНК риновируса человека методом ПЦР, включающий набор праймеров: "АмплиСенс®ОРВИ-скрин-FL" (ЦНИИ Эпидемиологии, г. Москва). Указанный набор реагентов позволяет выявлять возбудителей острых респираторных вирусных инфекций человека (ОРВИ) (РНК респираторно-синцитиального вируса, метапневмовируса, вирусов парагриппа 1-4 типов, коронавирусов, риновирусов, ДНК аденовирусов групп B, C и E и бокавируса в клиническом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией (http://www.pacxodka39.ru/product_3056.html)..
Таким образом, в настоящее время мультиплексные ПЦР тест-системы для одновременной диагностики энтеровирусов, риновирусов, вирусов гепатита А и Е на территории России и за рубежом не известны. Тем более нет специализированных тест-систем для выявления вирусов в образцах воды.
Техническим результатом заявляемого изобретения является создание набора реагентов: праймеры и флуоресцентно-меченые зонды, позволяющие идентифицировать энтеровирусы, риновирусы, вирусы гепатита А и Е, методом мультиплексной ПЦР в реальном времени.
Указанный технический результат достигается разработкой набора олиго-дезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для идентификации РНК энтеровирусов, риновирусов, вирусов гепатита А и Е из водной среды методом мультиплексной полимеразной цепной реакциии и имеющие представленную ниже (и в приложении к заявке) структуру нуклеотидных последовательностей:
для выявленя РНК риновирусов:
- прямые (F1 и F2) и обратные (R1 и R2) праймеры:
F1: 5`-TARACCTIGCAGATGRGGC-3`
F2: 5`-TTAACCGTYAICCGCCA-3`
R1: 5`-GAAACACGGACACCCAAAGTAG-3`
R2: 5`-ACCCAAAGTAGTCGGTCCC-3`
- флуоресцентно-меченые ДНК-зонды (Z1 и Z2):
Z1: FAM-CCYGCGTGGCIGCCTGC-BHQ1
Z2: FAM-YIAGCCTGCGTGGCGG-BHQ1
для выявления РНК всех энтеровирусов A, B, C, D и полиовирусов:
- прямой (F3) и обратный (R3) праймеры:
F3: 5`- CAAGIACTTCTGTTICCYCGGACIGA -3`
R3: 5`- ATITITCAATTGTCAICATAAGCAGCCA -3`
- флуоресцентно-меченый ДНК-зонд (Z3):
Z3: ROX- CCTIGGCNCCTGAIGCGGCTAATCC -BHQ2
для выявления РНК вируса гепатита А:
- прямой (F4) и обратный (R4) праймеры:
F4: 5`- GTAGGCTACGGGTGAAACCTCTT -3'
R4: 5`- CGGCGTTGAATGGTTTTTGT -3'
- флуоресцентно-меченый ДНК-зонд (Z4):
Z4: R6G- AGGGTAACAGCGGCGGATATTGGTGAGT -BHQ2
для выявления РНК вируса гепатита Е:
- прямой (F5) и обратный (R5) праймеры:
F5 5`- CGGCRGTGGTTTCTGGGGTGAC -3'
R5 5`- GGGGTTGGTTGGATGAATATAGGGG -3'
- флуоресцентно-меченый ДНК-зонд (Z5):
Z5 Cy5- TGATTCTCAGCCCTTCGCCCTCCCC -BHQ2
Перечень графических материалов
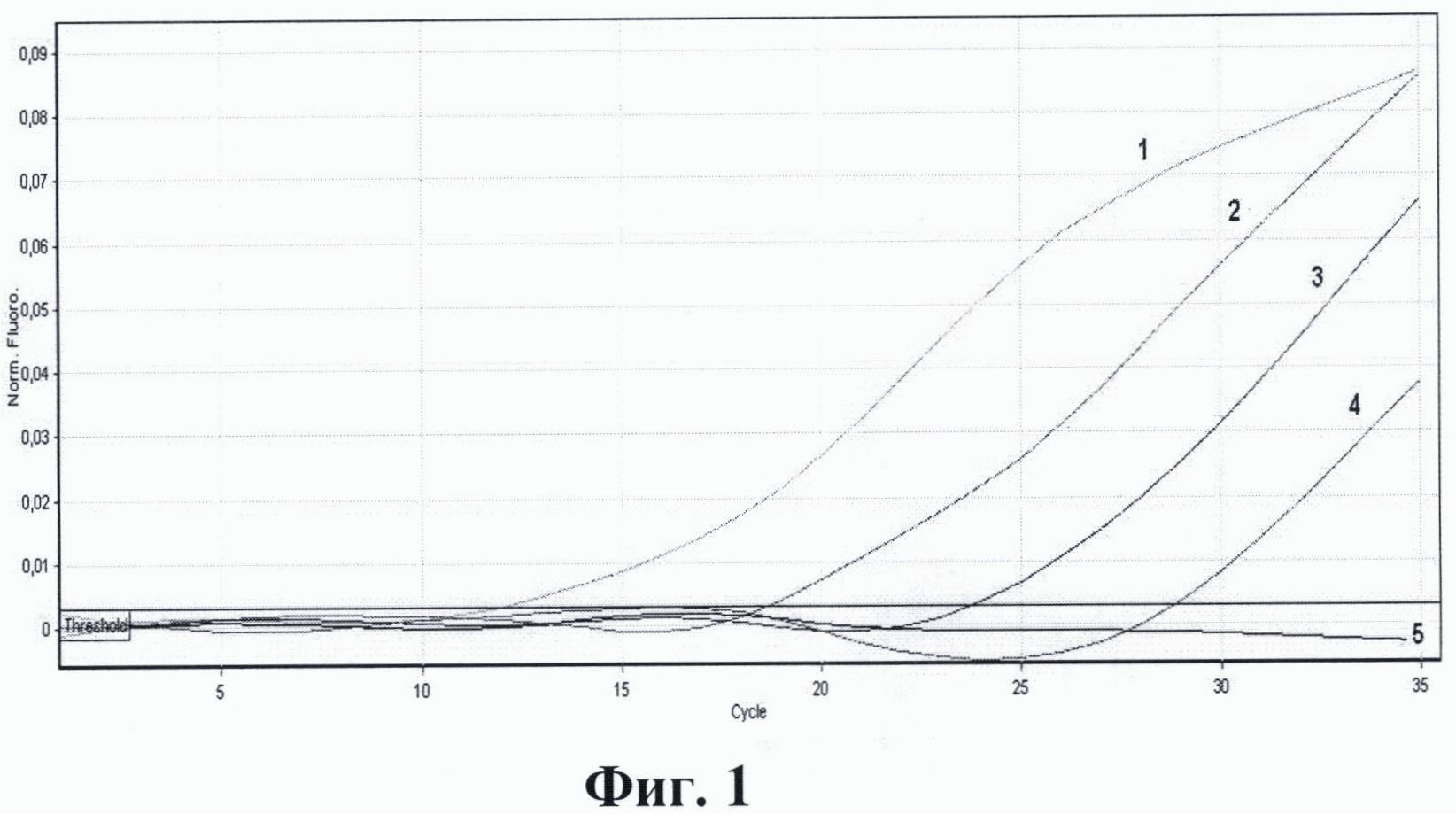
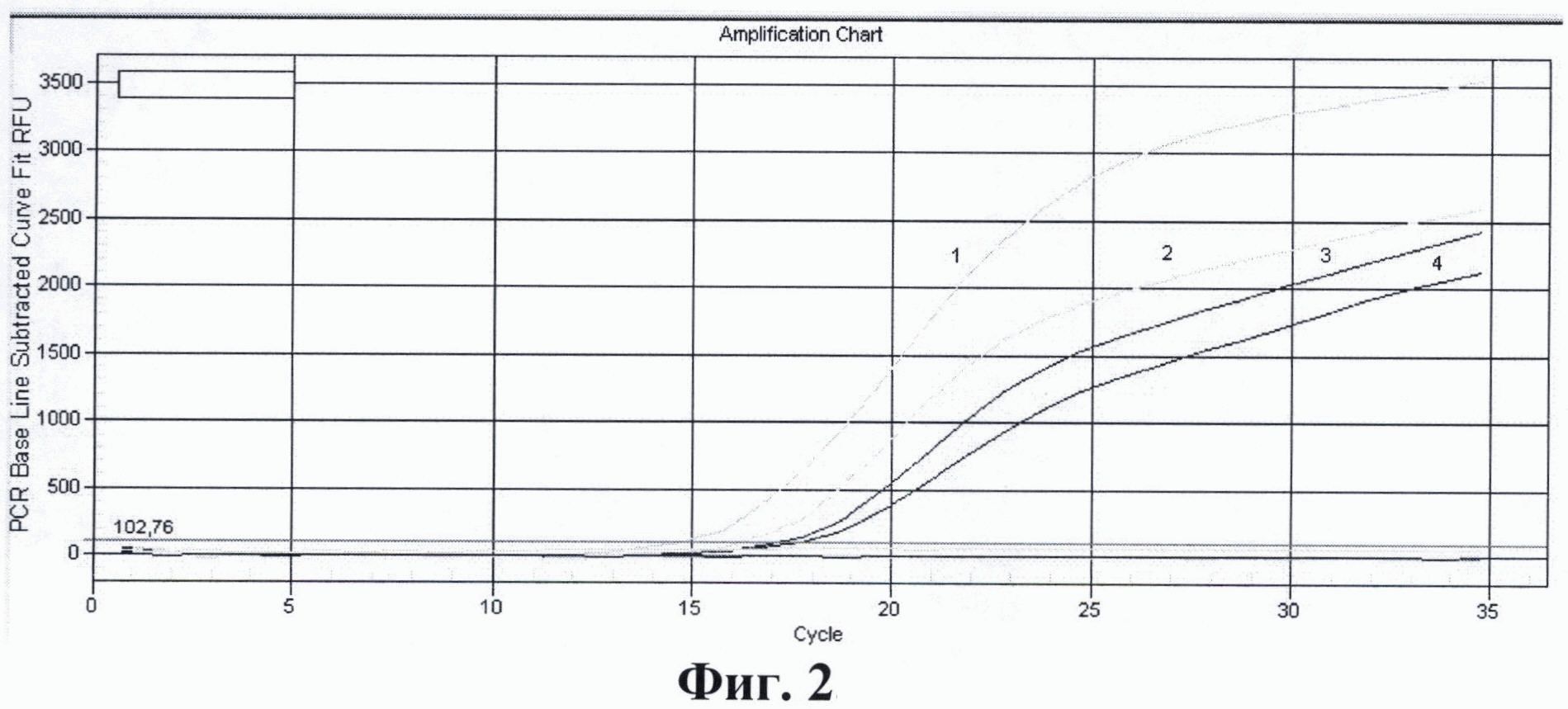
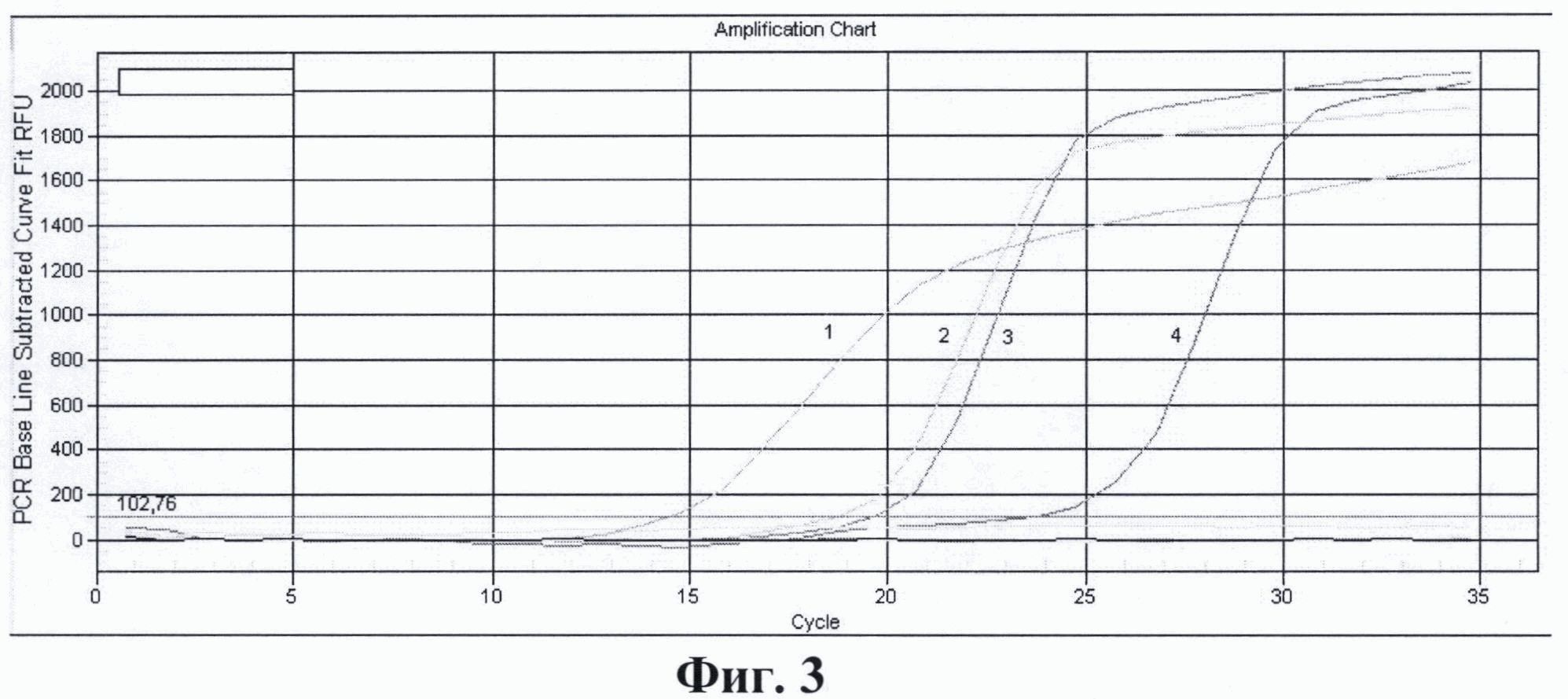
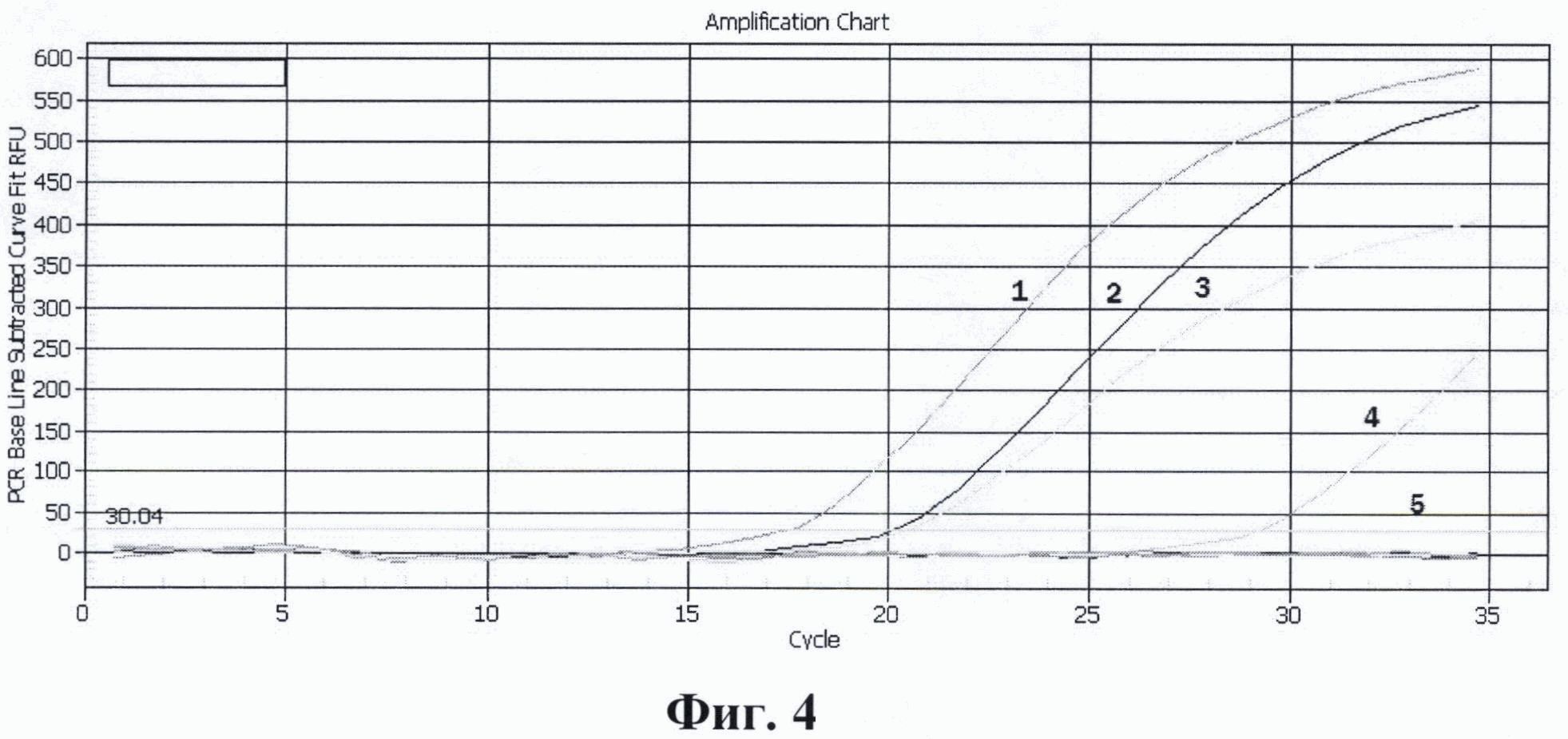
На фиг. 1. приведены графики анализа образцов на содержание риновирусов методом ПЦР в реальном времени. На фиг. 2. представлены графики анализа образцов на содержание энтеровирусов методом ПЦР в реальном времени. На фиг. 3. представлены графики анализа образцов на содержание вируса гепатита А методом ПЦР в реальном времени. На фиг. 4. приведены графики анализа образцов на содержание вируса гепатита Е методом ПЦР в реальном времени
Апробация олигонуклеотидов была осуществлена с использованием лабораторной вирусной коллекции изолятов энтеровирусов, риновирусов, вирусов гепатита А и Е (порядок проведения исследования одобрен этическим комитетом ФБУН ГНЦ ВБ «Вектор» (IRB 00001360)). Экспериментально было показано, что выбранные праймеры и ДНК-зонды обеспечивают надежный синтез целевых ДНК-фрагментов. Специфичность амплификации дополнительно подтверждали секвенированием.
Характеристика набора праймеров и участка амплифицируемой геномной РНК риновирусов. Предлагаемые к патентованию праймеры, фланкируют участок гена кодирующего вирусный гликопротеин 1 (VP1-ген). В ПЦР амплифицируется фрагмент генома с 28117 по 28630 нуклеотид (513 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной РНК энтеровирусов. Предлагаемые к патентованию праймеры комплементарны некодирующей части геномной РНК (5”-UTR). В ПЦР амплифицируется фрагмент генома с 72 по 521 нуклеотид (449 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной РНК вируса гепатита А. Предлагаемые к патентованию праймеры в ПЦР амплифицируют фрагмент генома с 311 по 421 нуклеотид (110 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Характеристика набора праймеров и участка амплифицируемой геномной РНК вируса гепатита Е. Предлагаемые к патентованию праймеры в ПЦР амплифицируют фрагмент генома с 5298 по 5370 нуклеотид (72 п.н.). Использование в комплекте с диагностическими праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продуктов амплификации в режиме реального времени.
Оптимизация условий проведения ПЦР осуществлялась с использованием коммерчески доступных наборов реагентов, приборов и ферментов, предназначенных для массового использования в лабораторной практике, что позволяет быстрое и надежное применение данного изобретения в медицинских и научно-исследовательских лабораториях.
Методика получения положительных контрольных образцов
Положительные контрольные образцы были получены методом клонирования. Компетентные клетки E. coli линии TOP 10 (Invitrogen, США) были трансформированы рекомбинантными плазмидами pCR2.1 (Invitrogen, США), несущими вирусспецифическую вставку искусственно синтезированных фрагментов кДНК. Наличие специфической к вирусному геному ДНК-вставки подтверждали секвенированием.
Определение концентрации плазмидной ДНК осуществляли при помощи флуориметра QUBIT (Invitrogen, США) и наборов реагентов Quant-iT DNA HS. Измерение флюоресценции проводили на приборах “Rotor Gene 6000” (Corbet), ABI Prizm 7000 и iQ5 «BioRad» (США). Специфичность каждого из полученных амплификационных фрагментов была подтверждена секвенированием на генетическом анализаторе 3130x/ Genetic Analyzer («Applied Biosystems», США).
Анализ эффективности проведенной трансформации осуществляли методом ПЦР в режиме реального времени в соответствии с протоколом, описанным ниже, где в реакционную смесь в качестве положительного образца добавляли 1×ТЕ-буфер, содержащий рекомбинантную плазмиду, со встройкой вирусспецифического синтезированного кДНК-дуплекса. В качестве отрицательного контрольного образца в реакционную смесь добавляли 1×ТЕ-буфер.
Конструирование внутреннего контрольного образца
В качестве внутреннего контрольного образца была использована защищенная двухцепочечная РНК фага MS-2. Псевдофаг получали клонированием под T5 фаговый промотор фрагмента 370 п.н. кДНК фага MS-2 в вектор pQE31. Синтез матричной РНК индуцировали IPTG. Фаговые частицы очищали центрифугированием.
Внутренний контрольный образец (ВКО), позволяет компенсировать ингибирование и контролировать процессы пробоподготовки и амплификации, что обеспечивает более точное определение РНК в каждом анализируемом образце. ВКО представляет собой неинфекционную защищенную РНК бактериофага MS2 (концентрация 105 копий РНК MS2/мл).
Выделение вируссодержащего материала из образцов воды.
Пробу воды готовили 1000-кратным разведением клинического образца, содержащего ротавирус в дистилированной и автоклавированнной воде. Пробы подвергались фильтрации через подобранную оптимальную фильтрационную систему. После чего производилась элюция с мембраны, выделение РНК, обратная транскрипция и ПЦР в режиме реального времени с использованием мультиплексного варианта тест-систем. Наиболее удобной в работе оказалась система вакуумной фильтрации с приставкой предварительной фильтрации (Sartorius, Германия), поскольку одновременно позволяла проводить отсечку бактериального компонента из образцов воды (на первый 0.22 мкм фильтр) и сорбцию вирусного материала на мембрану марки ММПА+-020-142 (ООО НПП «Технофильтр», Россия). Мембраны обладают повышенной сорбционной способностью по отношению к вирусам, колифагам и пирогенам. Мембраны микропористые полиамидные с положительным дзета-потенциалом, изготовленные на основе полиамида (Nylon-6 и Nylon-66). Мембраны ММПА+ имеют крупноячеистое строение с тонкими микропористыми перегородками, что предопределяет непрерывность структуры мембран и обеспечивает прочность и эластичность в сухом и смоченном виде. Благодаря высокой пористости и контролируемому размеру пор мембраны обладают высокой эффективностью удержания микрочастиц при большой скорости фильтрации.
Экстракция вирусной РНК
Вирусную РНК выделяли из 100 мкл вируссодержащей жидкости с использованием набора «ЛИТЕХ» (г. Москва) согласно инструкции производителя.
Реакция обратной транскрипции
Синтез комплементарной ДНК (кДНК) проводили на матрице суммарной РНК с использованием набора реагентов «Реверта-L» (ФБУН ЦНИИЭ, г. Москва) согласно инструкции производителя.
Проведение полимеразной цепной реакции
Условия проведения амплификации оптимизировали по концентрации ионов магния, концентрации праймеров и зондов в реакционной смеси, а также по температуре отжига праймеров.
Реакцию амплификации проводили в 30 мкл смеси для ПЦР (таб. 1), содержащей 1×Taq буфер для амплификации, 2.5 мМ MgCl2, 0.17 мМ каждого из нуклеозидтрифосфатов, 1.5 активных единиц Smart Taq ДНК-полимеразы (все компоненты ООО «Лаборатория МЕДИГЕН»), 20 пМ прямого и обратного праймеров и 8 пМ флуоресцентного ДНК-зонда.
|
ПЦР в режиме реального времени проводили согласно программе амплификации (таблица 2). Детекцию интенсивности флуоресценции проводили по каналам - по каналам Green (FAM, 470 nm /510 nm), Yellow (530 нм / 555 нм), Red (625 нм / 660 нм) и Orange ( ). Измерение флуоресценции проводили на приборах “Rotor Gene 6000” (Corbet Research, Австралия) и iQ5 (BioRad, США). Результаты оценивали по наличию флуоресценции до 30 цикла (фиг. 1-4).
|
В эксперименте методом ПЦР в реальном времени были проанализированы последовательные десятикратные разведения кДНК энтеровирусов, риновирусов, вирусов гепатита А и Е из образцов воды. На фиг. 1-4 представлены графики результатов анализа образцов методом ПЦР в реальном времени.
На фиг. 1. приведены результаты анализа образцов на содержание риновирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов, где:
1 - положительный контрольный образец (плазмидная конструкция, содержащая кДНК риновируса);
2 - кДНК риновируса, (разведение 1:100);
3 - кДНК риновируса, (разведение 1:1000);
4 - кДНК риновируса, (разведение 1:10000);
5 - отрицательный контрольный образец (однократный ТЕ-буфер).
На фиг. 2. Приведены результаты анализа образцов на содержание энтеровирусов методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов, где:
1 - положительный контрольный образец (плазмидная конструкция содержащая кДНК энтеровируса);
2 - кДНК энтеровируса, (разведение 1:100);
3 - кДНК энтеровируса, (разведение 1:1000);
4 - кДНК энтеровируса, (разведение 1:10000);
5 - отрицательный контрольный образец (однократный ТЕ-буфер).
На фиг. 3. представлены результаты анализа образцов на содержание вируса гепатита А методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов, где:
1 - положительный контрольный образец (плазмидная конструкция содержащая кДНК вируса гепатита А);
2 - кДНК вируса гепатита А, (разведение 1:100);
3 - кДНК вируса гепатита А, (разведение 1:1000);
4 - кДНК вируса гепатита А, (разведение 1:10000);
5 - отрицательный контрольный образец (однократный ТЕ-буфер).
На фиг. 4. приведены результаты анализа образцов на содержание вируса гепатита Е методом ПЦР в реальном времени с использованием патентуемых олигонуклеотидов, где:
1 - положительный контрольный образец (плазмидная конструкция содержащая кДНК вируса гепатита Е);
2 - кДНК вируса гепатита Е (разведение 1:100);
3 - кДНК вируса гепатита Е (разведение 1:1000);
4 - кДНК вируса гепатита Е (разведение 1:10000);
5 - отрицательный контрольный образец (однократный ТЕ-буфер).
Таким образом, из вышеизложенного следует, что достигнут заявляемый технический результат, а именно: разработан набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов, обеспечивающих надежную детекцию энтеровирусов, риновирусов, вирусов гепатита А и Е в образцах воды из окружающей среды методом мультиплексной полимеразной цепной реакции.
В рамках заявляемого технического решения разработанные праймеры и ДНК-зонды обладают высокой степенью гомологии ко всем известным нуклеотидным последовательностям геномов изолятов РНК энтеровирусов, риновирусов, вирусов гепатита А и Е человека, доступным в международной базе данных биотехнологической информации GenBank.
Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для идентификации РНК энтеровирусов, риновирусов, вирусов гепатита А и Е из водной среды методом мультиплексной полимеразной цепной реакциии и имеющие следующую структуру:Для выявления РНК риновирусов:прямые (F1 и F2) и обратные (R1 и R2) праймеры:F1: 5`-TA(A/G)ACCT(A/T/C/G)GCAGATG(A/G)GGC-3`F2: 5`-TTAACCGT(А/С)A(A/T/C/G)CCGCCA-3`R1: 5`-GAAACACGGACACCCAAAGTAG-3`R2: 5`-ACCCAAAGTAGTCGGTCCC-3`флуоресцентно-меченые ДНК-зонды (Z1 и Z2):Z1: FAM-CC(A/C)GCGTGGC(A/T/C/G)GCCTGC-BHQ1Z2: FAM-(A/C)(A/T/C/G)AGCCTGCGTGGCGG-BHQ1Для выявления РНК всех энтеровирусов А, В, С, D и полиовирусов:- прямой (F3) и обратный (R3) праймеры:F3: 5`-CAAG(A/T/C/G)ACTTCTGTT(A/T/C/G)CC(A/C)CGGAC(A/T/C/G)GA-3`R3: 5`-AT(A/T/C/G)T(A/T/C/G)TCAATTGTCA(A/T/C/G)CATAAGCAGCCA-3`- флуоресцентно-меченый ДНК-зонд (Z3):Z3: ROX-CCT(A/T/C/G)GGC(A/T/C/G)CCTGA(A/T/C/G)GCGGCTAATCC-BHQ2Для выявления РНК вируса гепатита А:- прямой (F4) и обратный (R4) праймеры:F4: 5`-GTAGGCTACGGGTGAAACCTCTT-3′R4: 5`-CGGCGTTGAATGGTTTTTGT-3′- флуоресцентно-меченый ДНК-зонд (Z4):Z4: R6G-AGGGTAACAGCGGCGGATATTGGTGAGT-BHQ2Для выявления РНК вируса гепатита Е:- прямой (F5) и обратный (R5) праймеры:F5: 5`-CGGC(A/G)GTGGTTTCTGGGGTGAC-3′R5: 5`-GGGGTTGGTTGGATGAATATAGGGG-3′- флуоресцентно-меченый ДНК-зонд (Z5):Z5 Су5-TGATTCTCAGCCCTTCGCCCTCCCC-BHQ2