Результат интеллектуальной деятельности: НАБОР РЕАГЕНТОВ И СПОСОБ ДЛЯ ВЫЯВЛЕНИЯ ДНК ВОЗБУДИТЕЛЕЙ ЧУМЫ, СИБИРСКОЙ ЯЗВЫ И ТУЛЯРЕМИИ МЕТОДОМ ПЦР С ГИБРИДИЗАЦИОННО-ФЛУОРЕСЦЕНТНЫМ УЧЕТОМ РЕЗУЛЬТАТОВ
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и может быть использовано для выявления возбудителей чумы, сибирской язвы и туляремии в биологическом материале и объектах окружающей среды в практическом здравоохранении.
Чума, сибирская язва и туляремия относятся к группе зоонозных, природно-очаговых, особо опасных инфекций. Так как летальность при легочной форме этих заболеваний чрезвычайно высока, данные виды рассматриваются в качестве потенциальных агентов биотерроризма. Эпидемиологическая обстановка по данным инфекциям остается достаточно сложной. Это обусловлено активностью природных очагов, и ростом возможностей заноса возбудителей с эндемичных территорий на эпидемически благополучные.
На территории Российской Федерации и ближнего зарубежья расположено 45 природных очагов чумы, в большинстве которых циркулируют штаммы основного высоковирулентного подвида. Род Yersinia входит в семейство Enterobacteriaceae и состоит из 17 видов, три из которых патогенны для человека - Y. pestis, Y. pseudotuberculosis и Y. enterocolitica. Вид Y. pestis произошел от вида Y. pseudotuberculosis и имеет до 99% нуклеотидной идентичности для большинства общих генов, однако радикально отличается от своего предка по тяжести вызываемого заболевания (Zhou D, Han Y, Song Y, Tong Z, Wang J, Guo Z, Pei D, Pang X, Zhai J, Li M, Cui B, Qi Z, Jin L, Dai R, Du Z, Bao J, Zhang X, Yu J, Wang J, Huang P, Yang R. DNA microarray analysis of genome dynamics in Yersinia pestis: insights into bacterial genome microevolution and niche adaptation. J Bacteriol 2004b; 186: 5138-5146. Huang Xiao-Zhe, Mikeljon P. Nikolich, Luther E. Lindler. (2006) Current Trends in Plague Research: From Genomics to Virulence. Clinical Medicine & Research Volume 4, Number 3: 189-199). Существуют две основных проблемы относительно идентификации чумного микроба: определение хромосомы Y. pestis обычно включает амплификацию геномных последовательностей, общих с Y. pseudotuberculosis или Y. enterocolitica, что не дает ясной индикации, который организм присутствует без комбинирования с анализом специфичных чумных плазмид. И второе - большое количество опубликованных данных оценивает очень ограниченное число изолятов Y. pestis, что недостаточно для адекватной эффективности анализа.
Возбудитель сибирской язвы Bacillus anthracis таксономически принадлежит к группе В. cereus, в которую входят шесть близкородственных видов, такие как В. cereus, В. anthracis, В. thuringiensis, В. mycoides, В. pseudomycoides и В. weihenstephanensis. Геномы В. anthracis, В. cereus и В. thuringiensis имеют очень небольшие различия и генетически не различаются при использовании целого ряда методов (Helgason, E., О.А. Okstad, D.A. Caugant, H.A. Johansen, A. Fouet, M. Mock, I. Hegna, and A. Kolsto. 2000. Bacillus anthracis, Bacillus cereus, and Bacillus thuringiensis: one species on the basis of genetic evidence. Appl. Environ. Microbiol. 66:2627-2630. Ash, C., J.A. Farrow, M. Dorsch, E. Stackebrandt, and M.D. Collins. 1991. Comparative analysis of Bacillus anthracis. Bacillus cereus, and related species on the basis of reverse transcriptase sequencing of 16S rRNA. Int. J. Syst. Bacteriol. 41:343-347. Ash, C., and M.D. Collins. 1992. Comparative analysis of 23S ribosomal RNA gene sequences of Bacillus anthracis and emetic Bacillus cereus determined by PCR-direct sequencing. FEMS Microbiol. Lett. 73:75-80). Большинство генетических и функциональных различий между видами связано с наличием плазмид, их количеством и размерами. Вирулентные штаммы B. anthracis содержат две высокомолекулярные плазмиды pX01 и pX02. Бесплазмидные штаммы B. anthracis утрачивают свою вирулентность, однако их идентификация может являться индикатором присутствия вирулентных штаммов в окружающей среде. Плазмиды pX01 и pX02 передаются в другие виды бацилл. Кроме того, некоторые плазмидные гены обнаружены в хромосомах и собственных плазмидах B. cereus и B. thuringiensis. (Coker, P.R., K.L. Smith, P.F. Fellows, G. Rybachuck, K.G. Kousoulas, and M.E. Hugh-Jones. 2003. Bacillus anthracis virulence in guinea pigs vaccinated with anthrax vaccine adsorbed is linked to plasmid quantities and clonality. J. Clin. Microbiol. 41:1212-1218. Rasko D.A., Jacques Ravel, Ole Andreas ⌀kstad, Erlendur Helgason, Regina Z. Cer, Lingxia Jiang, Kelly A. Shores, Derrick E. Fouts, Nicolas J. Tourasse, Samuel V. Angiuoli, James Kolonay, William C. Nelson, Anne-Brit KolstØ1,2, Claire M. Fraser and Timothy D. Read. The genome sequence of Bacillus cereus ATCC 10987 reveals metabolic adaptations and a large plasmid related to Bacillus anthracis pX01 Nucleic Acids Research, 2004, Vol.32, No.3977-988., Ruhfel, R.E., N.J. Robillar, and C.B. Thorne. 1984. Interspecies transduction of plasmids among Bacillus anthracis, B. cereus, and B. thuringiensis. J. Bacteriol. 157:708-711, Pannucci, J., R.T. Okinaka, R. Sabin, and C.R. Kuske. 2002. Bacillus anthracis pX01 plasmid sequence conservation among closely related bacterial species. J. Bacteriol. 184:134-141). Трудности при индикации возбудителя сибирской язвы в биологическом материале и объектах окружающей среды связаны с необходимостью обнаруживать бесплазмидные, ди- и моноплазмидные штаммы, а также дифференцировать вид В. anthracis от близкородственных сапрофитов рода Bacillus.
К роду Francisella относят в настоящее время 2 вида: F. tularensis и F. philomiragia. Однако в последнее время появились публикации, в которых изучены заболевания рыб, вызванные новыми видами франциселл: Francisella hispaniensis, Francsiella asiatica и Francsiella noatunensis (syn. Francisella piscicida) (Huber B, Escudero R, Busse H.J et al. // Int. J. Syst. Evol. Micr. - 2010. - №60. - P.1887-1896, Mikalsen, J. Colquhoun D.J. // Int. J. Syst. Evol. Microbiol. - 2009. doi:. doi: 10.1099/ijs.0.002139-0, Soto E., Hawke J., Fernandez D., Morales J.A. // J. Fish Dis. - 2009. - №32. P.713-722). Внутри вида F. tularensis различают 4 подвида: tularensis, holarctica, mediasiatica и novicida. Внутривидовые различия F. tularensis более значительные, чем внутри видов Bacillus anthracis и Yersinia pestis, что может говорить о значительно более раннем происхождении туляремийного микроба. Наиболее вирулентны штаммы, относящиеся к подвидам tularensis, holarctica и mediasiatica. Штаммы, относящиеся к виду F. philomiragia и подвиду F. tularensis subsp. novicida патогенны только для людей с ослабленным иммунитетом. При обнаружении туляремийного микроба в биологическом материале и объектах окружающей среды имеет большое значение определение эпидемиологической значимости выделенного штамма, то есть возможность отличать патогенные подвиды F. tularensis subsp. tularensis, F. tularensis subsp. holarctica и F. tularensis subsp. mediasiatica от непатогенных видов и подвида F. novicida.
Высокая контагиозность, летальность, достигающая 100%, при легочных формах заболеваний, а также общие клинические признаки острого респираторного заболевания на начальном этапе, вызывают необходимость различать заболевания, вызванные Y. pestis, В. anthracis и F. tularensis и как можно быстрее диагностировать патогены для применения эффективных методов лечения и предотвращения эпидемических вспышек.
Для диагностики каждой инфекции применяют бактериологические, культурально-морфологические, иммунологические и молекулярно-генетические методы исследования. Кроме ограниченной чувствительности, несмотря на применение высококачественных питательных сред, недостатком культурального метода является его продолжительность и высокая трудоемкость, связанная с опасными манипуляциями с биопробными животными и высокими концентрациями живых культур.
Метод ПЦР в реальном времени обладает более высокой чувствительностью и специфичностью, позволяет сократить время анализа, количественно оценивать содержание возбудителя в образцах и проводить анализ с микроколичеством образца в режиме закрытой пробирки, что значительно снижает риск контаминации. Отсутствие необходимости пост-амплификационных манипуляций с продуктами ПЦР позволяет также существенно сократить трудоемкость исследований. Все эти особенности обусловливают его преимущество относительно метода стандартной ПЦР. Несомненно, более существенные преимущества имеет ПЦР в реальном времени в мультилокусном варианте, в котором за счет одновременной амплификации нескольких ДНК-мишеней, можно одномоментно провести индикацию нескольких возбудителей, либо охарактеризовать возбудитель по ряду признаков (вирулентность, эпидемическая значимость, таксономическое положение).
Известен патент РФ №2473701 Куклев В.Е. и др. «Набор и способ для ускоренной идентификации чумного микроба с одновременной дифференциацией вирулентных и авирулентных штаммов Y. pestis, определением их плазмидного профиля. Набор используют для ускоренной идентификации штаммов чумного микроба с одновременной дифференциацией вирулентных и авирулентных штаммов Y. pestis и определением их плазмидного профиля. Набор включает праймеры и флуоресцентно меченные зонды к участкам генов 3a, cafl, pla, irp2, hmsH и lcrV в составе двух разных ПЦР-смесей. Гены 3a, irp2, hmsH локализованы на хромосоме. Использование генов irp2 и hmsH ограничено тем, что pgm-локус, в котором они находятся, нестабилен и при повторном культивировании Y. pestis, возможна его потеря.
Наиболее близким к предлагаемому изобретению по совокупности существенных признаков является способ и набор для одновременной детекции и идентификации Y. pestis, В. anthracis и F. tularensis методом ПЦР в режиме реального времени с использованием MGB-зондов (патент № US 7960106). В качестве мишеней для амплификации были выбраны фрагменты генов pagA и capB, локализованные на плазмидах вирулентности Bacillus anthracis pX01 и pX02, соответственно. Для выявления возбудителя чумы был также выбран pla ген, локализованный на мультикопийной и видоспецифичной плазмиде pPst. Для индикации туляремийного микроба авторы использовали фрагмент гена 23 kDa или iglC. Недостатком этого метода является невозможность обнаружения бесплазмидных штаммов возбудителей сибирской язвы и чумы. Невозможна также дифференциация сибиреязвенного микроба от близкородственных сапрофитов рода Bacillus, несущих плазмиды, подобные сибиреязвенным. Используемые в данной работе MGB-зонды компании «Applied biosystems» помимо метки и тушителя, несут также группу, связывающуюся с малой дорожкой ДНК (Minor Groove Binder). В результате повышается температура плавления зонда и стабильность его взаимодействия с ампликоном. Однако стоят такие зонды примерно в два раза дороже стандартных. Все четыре фрагмента генов были клонированы в вектор pUC19 E.coli, а полученную плазмиду авторы использовали в качестве позитивного контроля анализа.
Проведенный поиск по патентным базам и научно-техническим источникам информации показал отсутствие сведений об отечественных наборах, предназначенных для выявления Y. pestis, В. anthracis и F. tularensis методом ПЦР с гибридизационно-флюоресцентным учетом результатов, обеспечивающих детекцию возбудителей в биологическом материале и объектах окружающей среды, а также доступных для работы в лабораториях России. Таким образом, существует потребность в создании недорогого, чувствительного и специфичного набора, который нашел бы широкое применение в отечественном практическом здравоохранении.
Задачей предлагаемого изобретения является создание набора для детекции возбудителей чумы, сибирской язвы и туляремии в биологическом материале и объектах окружающей среды с возможностью использования его в ПЦР с гибридизационно-флуоресцентным учетом результатов.
Технический результат заявляемого изобретения заключается в повышении эффективности диагностических исследований за счет одновременного выявления хромосомной ДНК трех видов особо опасных бактерий, независимо от плазмидного профиля штаммов, а также дифференциацией штаммов Y. pestis, В. anthracis и F. tularensis от близкородственных видов. Технический результат достигается тем, что предложен набор для детекции возбудителей чумы, сибирской язвы и туляремии, включающем ПЦР-смесь, содержащую:
Праймеры:
SEQ ID N:4 (уро2088_up Y. pestis);
SEQ ID N:5 (уро2088_low Y. pestis);
SEQ ID N:7 (sspE_up B. anthracis);
SEQ ID N:8 (sspE_low B. anthracis);
SEQ ID N:10 (ISFtu5_up F. tularensis);
SEQ ID N:11 (ISFtu5_low F. tularensis);
Зонды:
SEQ ID N:6 (уро2088 Y. pestis с флуоресцентным красителем ROX и тушителем флуоресценции RTQ2);
SEQ ID N:9 (sspE B. anthracis с флуоресцентным красителем FAM) и тушителем флуоресценции BHQ1);
SEQ ID N:12 (ISFtu5 F. tularensis с флуоресцентным красителем R6G и тушителем флуоресценции RTQ2);
- эквимолярную смесь четырех дезоксинуклеозидтрифосфатов (дНТФ);
- хлорид калия;
- Трис-HCl, pH 8,8;
- хлорид магния;
- глицерол;
- Tween-20;
азид натрия.
Набор также содержит реагенты для проведения мультиплексной ПЦР: фермент Taq ДНК-полимеразу, положительный контрольный образец (смесь ДНК Y. pestis, F. tularensis и B. anthracis) и деионизованную воду.
Технический результат достигается также способом индикации чумного, сибиреязвенного и туляремийного микробов, при котором для постановки мультиплексной ПЦР используется набор, содержащий ПЦР-смесь, обеспечивающую амплификацию фрагментов размером 138 п.н., 102 п.н., 128 п.н., соответственно, амплифицирующиеся по следующим параметрам: 95°C - 5 мин, циклирование 62°C - 40 с, 95°C - 15 с, цикл повторить - 50 times/раз, с измерением флуоресценции при 62°C и учетом результатов по каналу FAM для флуоресцентной метки FAM, по каналу JOE для метки R6G, по каналу ROX для метки ROX; идентификацию возбудителя оценивают по нарастанию сигналов флуоресценции. Культуру оценивают как относящуюся к виду B. anthracis в реакции с ПЦР смесью по каналу FAM. Культуру оценивают как относящуюся к виду F. tularensis в реакции с ПЦР смесью по каналу JOE. Культуру оценивают как относящуюся к виду Y. pestis в реакции с ПЦР смесью по каналу ROX.
Обоснование выбора праймеров и зондов
Важным этапом при разработке ПЦР тест-систем является подбор мишеней для детекции возбудителя. Ген уро2088, был идентифицирован с помощью сравнительной геномной гибридизации, как хромосомный участок, специфический для вида Y. pestis, и не был найден ни в одном из исследованных в работах штаммах Y. pseudotuberculosis или Y. enterocolitica (Matero P, Pasanen Т, Laukkanen R, Tissari P, Tarkka E, Vaara M, Skurnik M. Real-time multiplex PCR assay for detection of Yersinia pestis and Yersinia pseudotuberculosis. APMIS 2009; 117:34-44. Zhou D, Han Y, Dai E, Pei D, Song Y, Zhai J, Du Z, Wang J, Guo Z, Yang R. Identification of signature genes for rapid and specific characterization of Yersinia pestis. Microbiol Immunol 2004a; 48:263-269).
Хромосомный ген ssp спор присутствует у всех бацилл, однако последовательность его имеет различия, достаточные для дифференциации сибиреязвенного микроба от близкородственных видов бацилл группы B. cereus (Kim K, Seo J, Wheeler K, Park C, Kim D, Park S, Kim W, Chung SI, Leighton T:Rapid genotypic detection of Bacillus anthracis and the Bacillus cereus group bymultiplex real-time PCR melting curve analysis. FEMS Immunology and Medical Microbiology 2005, 43(2):301-310, Ingmar Janse, Raditijo A Hamidjaja, Jasper M Bok, Bart J van Rotterdam: Reliable detection of Bacillus anthracis, Francisella tularensis and Yersinia pestis by using multiplex qPCR including internal controls for nucleic acid extraction and amplification. BMC Microbiology 2010, 10:314 doi:10.1186/1471-2180-10-314).
В геномах штаммов вида F. philomiragia и подвида F. tularensis subsp. novicida отсутствует последовательность элемента вставки ISFtu5, поэтому использование данного маркера позволяет обнаруживать только вирулентные подвиды вида F. tularensis (Champion MD, Zeng Q, Nix EB, Nano FE, Keim P, et al. (2009) Comparative Genomic Characterization of Francisella tularensis Strains Belonging to Low and High Virulence Subspecies. PLoS Pathog 5(5): e1000459. doi:10.1371/journal.ppat.1000459.
Предлагаемый способ включает амплификацию специфичных хромосомных последовательностей ДНК видов Y. pestis, B. anthracis и F. tularensis, что позволяет определять данные виды с любым набором плазмид и бесплазмидные штаммы, а также отличать возбудителей особо опасных инфекций от близкородственных видов.
В результате тщательной проверки качества определения нуклеотидных последовательностей были выведены следующие консенсусные последовательности фрагментов генов:
уро2088 Y. pestis SEQ ID №1 размером 138 п.н.
sspE B. anthracis SEQ ID №2 размером 102 п.н.
ISFtu5 F. tularensis SEQ ID №3 размером 128 п.н.
На основании последовательностей выбранных фрагментов генов уро2088 Y. pestis sspE B. anthracis ISFtu5 F. tularensis IPC с помощью программы Primer Premier-V5 (Premier Bio Soft International) и алгоритма BLAST подобраны олигонуклеотидные праймеры, обеспечивающие амплификацию фрагментов указанных локусов размером 138 п.н., 102 п.н., 128 п.н., соответственно. Выбор праймеров осуществляли с учетом возможности их использования в мультиплексной ПЦР с регистрацией результатов в режиме «реального времени», а гибридизационные зонды формата Taq Man подбирали в онлайн-режиме на интернет-сайте www.genscript.com.
К участку гена SEQ ID №1 подобраны праймеры SEQ ID №4; SEQ ID №5 и зонд SEQ ID №6, с флуоресцентной меткой ROX гасителем флуоресценции RTQ2;
К участку гена SEQ ID №2 подобраны праймеры SEQ ID №7; SEQ ID №8 и зонд SEQ ID №9, с флуоресцентной меткой FAM и гасителем флуоресценции BHQ1;
К участку гена SEQ ID №3 подобраны праймеры SEQ ID №10; SEQ ID №11 и зонд SEQ ID №12, с флуоресцентной меткой R6G и гасителем флуоресценции RTQ2;
Указанные последовательности представлены в таблице 1.
|
Экспериментально установлен оптимальный состав реакционной смеси для выполнения мультиплексной ПЦР. В ПЦР-смеси подобранные концентрации праймеров и зондов составили 5 пмоль: 3 пмоль, соответственно, количество фермента Taq-полимеразы в концентрации 2,5 ед. достаточно для обеспечения высокой специфичности и эффективности проведения реакции.
Экспериментально подобран режим отжига праймеров и эффективное число циклов амплификации (таблица 2).
|
Предварительная оценка аналитической специфичности используемых праймеров и зондов с помощью on-line алгоритма BLAST показала отсутствие гомологии выбранных последовательностей с другими микроорганизмами при уровне значимости E=10.
Для экспериментальной оценки чувствительности и специфичности мультиплексной ПЦР с гибридизационно-флуоресцентным учетом результатов в режиме реального времени использовали количественно охарактеризованные разведения ДНК Y. pestis F. tularensis и B. anthracis в концентрации 1×103-1×107 м.к./мл (таблица 3).
Для характеристики специфичности ПЦР применяли выборку штаммов из целевой коллекции различных микроорганизмов. Данные представлены в таблице 4.
В результате проведенной оценки установлено, что выбранные праймеры и зонды для детекции возбудителей чумы, сибирской язвы и туляремии методом мультиплексной полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов обладают высокой чувствительностью - 1×104 м.к./мл и специфичностью 100%.
На основе указанных праймеров и зондов сконструирован набор, который включает 4 пробирки с завинчивающимися крышками с компонентами: 1 микропробирку с ПЦР-смесью, 1 микропробирку с Taq- полимеразой, 1 микропробирку с положительным контрольным образцом (ПКО) (смесь ДНК Y. pestis, F. tularensis и B. anthracis) и 1 микропробирку с деионизованной водой.
ПЦР-смесь для проведения мультиплексной ПЦР включает:
Праймеры:
SEQ ID N:5 (уро2088_up Y. pestis);
SEQ ID N:6 (уро2088_low Y. pestis);
SEQ ID N:8 (sspE_up B. anthracis);
SEQ ID N:9 (sspE_low B. anthracis);
SEQ ID N:11 (ISFtu5_up F. tularensis);
SEQ ID N:12 (ISFtu5_low F. tularensis);
Зонды:
SEQ ID N:7 (уро2088 Y. pestis с флуоресцентным красителем ROX и тушителем флуоресценции RTQ2);
SEQ ID N:10 (sspE B. anthracis с флуоресцентным красителем FAM) и тушителем флуоресценции BHQ1);
SEQ ID N:13 (ISFtu5 F. tularensis с флуоресцентным красителем R6G и тушителем флуоресценции RTQ2);
- эквимолярную смесь четырех дезоксинуклеозидтрифосфатов (дНТФ);
- хлорид калия;
- Трис-HCl, pH 8,8;
- хлорид магния;
- глицерол;
- Tween-20;
- азид натрия.
Набор предназначен для одновременной детекции ДНК возбудителей чумы, сибирской язвы и туляремии в биологическом материале и объектах окружающей среды с возможностью использования его в ПЦР с гибридизационно-флуоресцентным учетом результатов. Набор рассчитан на проведение 100 определений, включая контрольные образцы. Набор прошел государственные испытания.
Заявляемый набор для одновременной детекции ДНК возбудителей чумы, сибирской язвы и туляремии после выделения ДНК по общепринятым методам включает следующие этапы:
а) проведение мультиплексной ПЦР;
б) оценка полученных результатов.
Реакционную смесь размораживают, перемешивают на встряхивателе и центрифугируют 3-5 секунд для сброса капель. Затем готовят рабочую реакционную смесь из расчета: 20 мкл реакционной смеси и 0,5 мкл фермента. Для проведения реакции отбирают количество пробирок вместимостью 0,2 мл, соответствующих числу исследуемых проб, ОКО-В, и по одной для положительного и отрицательного контролей амплификации. Маркируют ПЦР пробирки в соответствии с протоколом исследования. В отдельной микропробирке вместимостью 0,6 мл или 1,5 мл готовят реакционную смесь из расчета: Для N исследуемых образцов необходимо смешать 20* (N+3) мкл реакционной смеси и 0,5* (N+3) мкл фермента. Рабочую реакционную смесь перемешивают на встряхивателе и центрифугируют 3-5 секунд для сброса капель. Вносят по 20 мкл рабочей реакционной смеси в пробирки для ПЦР. ПКО размораживают, перемешивают на встряхивателе и центрифугируют 3-5 секунд для сброса капель, перемешивают и центрифугируют 5 секунд на микроцентрифуге-встряхивателе. Вносят в пробирки в соответствии с маркировкой по 5 мкл ОКО, ОКО-В, исследуемых образцов и ПКО, плотно закрывают крышки. Содержимое пробирок кратковременно перемешивают на микроцентрифуге-встряхивателе и центрифугируют 30 секунд на микроцентрифуге для микропробирок. Подготовленные микропробирки помещают в термоциклер типа «CFX96» BIO-RAD. Для работы с прибором «CFX96» BIO-RAD используют программу Bio-Rad CFX Manager.
Результаты учитывают на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, а цифровое значение порогового цикла «Ct» указано в соответствующей графе таблицы результатов на панели прибора. Пороговое значение Ct для положительных проб по каналам FAM, JOE, ROX составляет не более 50. При получении значения не более 50 результат считают положительным.
Оценка полученных результатов.
Учет и оценка результатов позволяет обнаруживать ДНК возбудителей чумы, сибирской язвы и туляремии в пробе.
Образец считается положительным на присутствие специфических фрагментов геномной ДНК B. anthracis, если зарегистрирован рост флуоресценции по каналу FAM (зонда, специфичного для гена B. anthracis), а значение порогового цикла меньше 50, и отрицательным, если автоматически значение порогового цикла не определено.
Образец считается положительным на присутствие специфических фрагментов геномной ДНК F. tularensis, если зарегистрирован рост флуоресценции по каналу HEX (зонда, специфичного для гена F. tularensis), а значение порогового цикла меньше 50, и отрицательным, если автоматически значение порогового цикла не определено. Образец считается положительным на присутствие специфических фрагментов геномной ДНК Y. pestis, если зарегистрирован рост флуоресценции по каналу ROX (зонда, специфичного для гена Y. pestis), а значение порогового цикла меньше 50, и отрицательным, если автоматически значение порогового цикла не определено.
Изобретение иллюстрируется следующими примерами (1 и 2) и графическими материалами (табл.1-5, фиг.1-3).
Таблица 1. Последовательности праймеров и зондов
Таблица 2. Условия амплификации
Таблица 3. Количественно охарактеризованные разведения ДНК Y. pestis F. tularensis и B. anthracis для экспериментальной оценки чувствительности и специфичности
Таблица 4. Штаммы микроорганизмов для характеристики специфичности набора.
Таблица 5. Результаты анализа зашифрованных проб
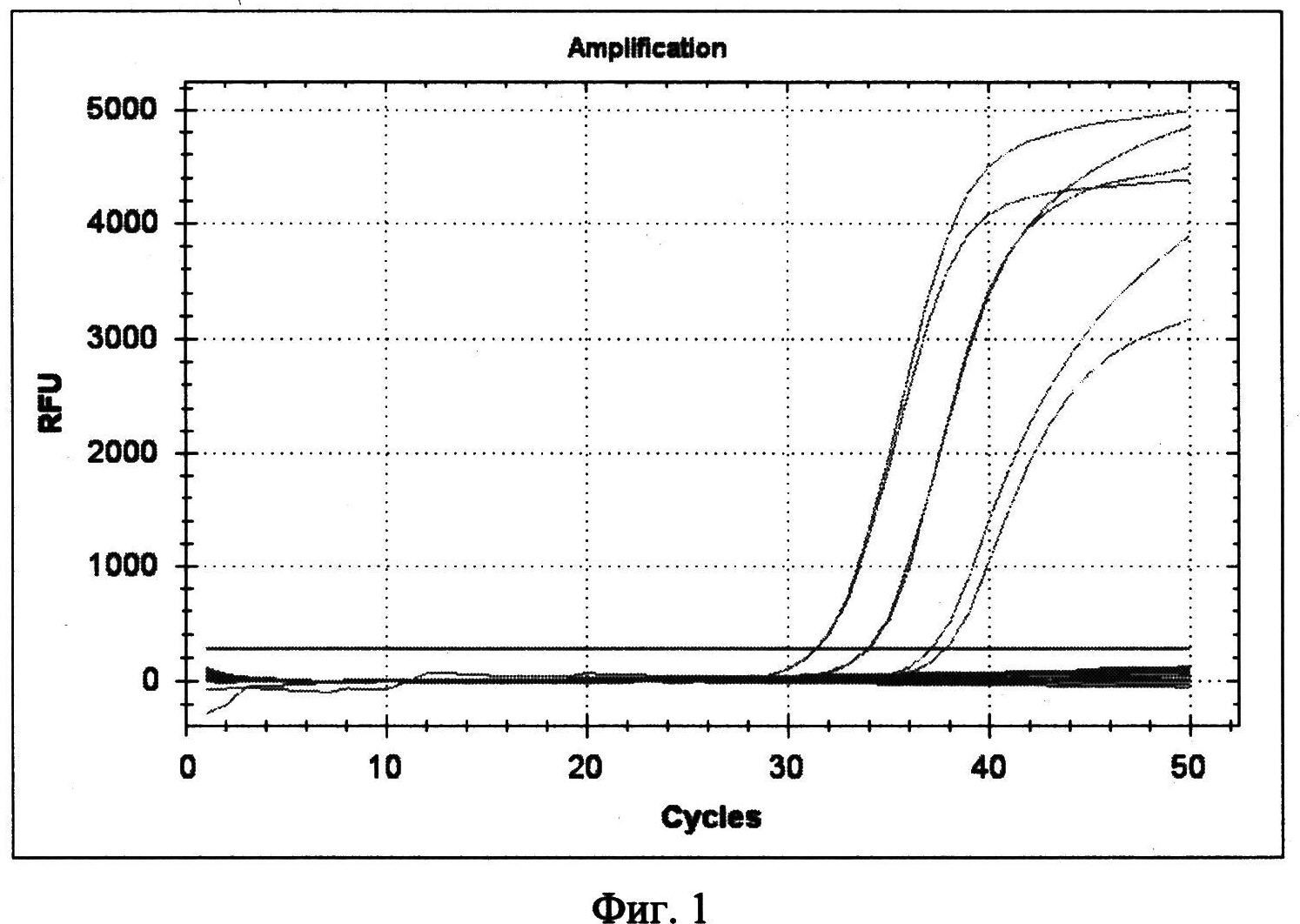
Фигура 1. Кинетические кривые ПЦР в режиме реального времени с использованием набора «MULTI-FLU» для образцов, содержащих ДНК, выделенные из 100 мкл бактериальных суспензий штамма Y. pestis EV с концентрациями 1×105 м.к./мл (Ct по каналу ROX - 31.4, 31.3), 1×104 м.к./мл (Ct по каналу ROX - 34.0, 33.9) и 1×103 м.к./мл (Ct по каналу ROX - 37.1, 37.8).
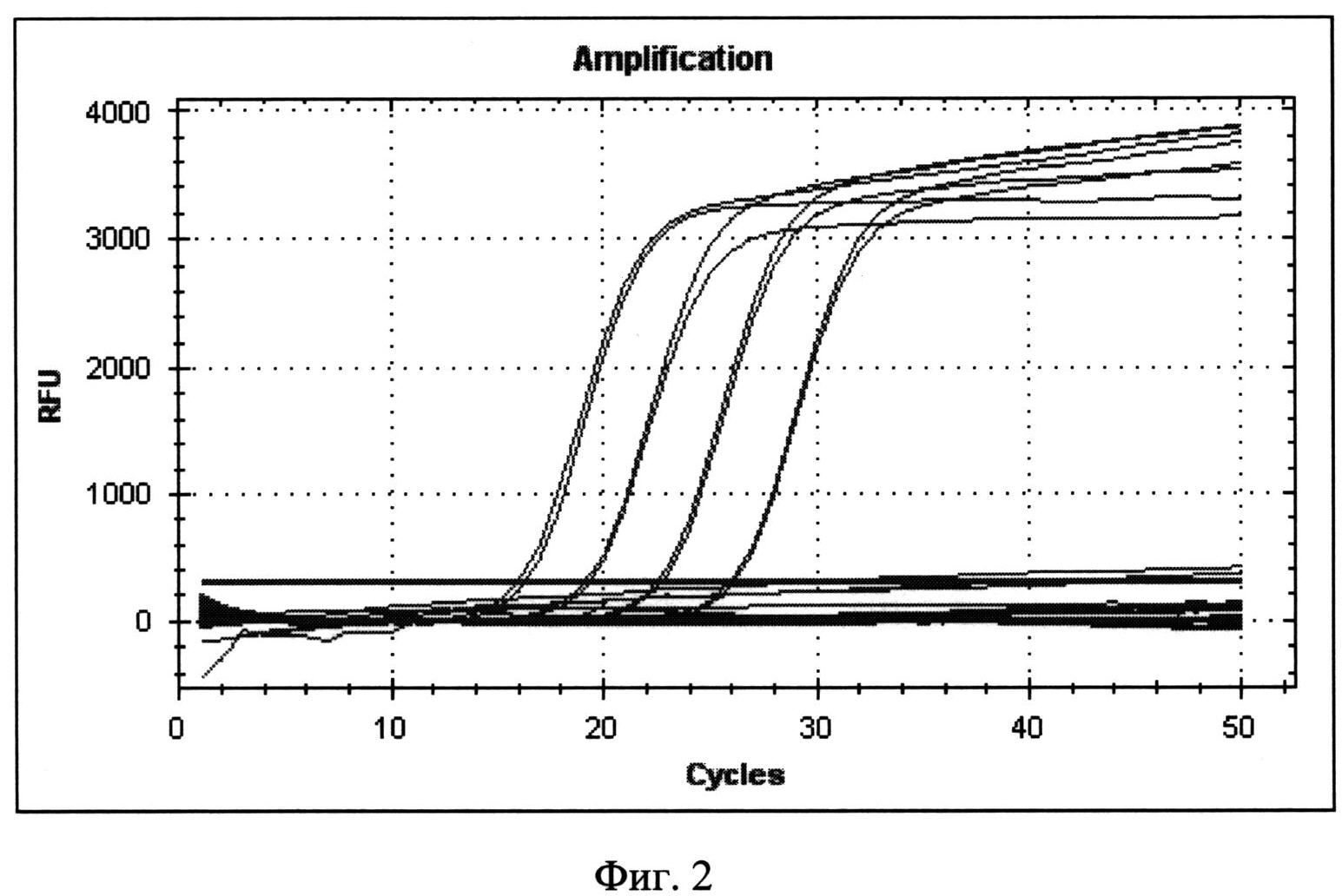
Фигура 2. Пример ПЦР в режиме реального времени с использованием набора «MULTI-FLU» для 10-кратных разведении ДНК, выделенной из 100 мкл бактериальной суспензии штамма B. anthracis 34 с концентрациями 1×108 м.к./мл (Ct по каналу РАМ исх - 16,3, 15,99; 1/10 - 19,34, 19,17; 1/100 - 22,72, 22,49; 1/1000 - 26,15, 26,0).
Фигура 3. Кинетические кривые ПЦР в режиме реального времени с использованием набора «MULTI-FLU» для образцов, содержащих ДНК, выделенные из бактериальных суспензий штамма F. tularensis 15 с концентрациями: 1×105 м.к./мл (Ct по каналу R6G (HEX) - 29,0, 28,9), 1×104 м.к./мл (Ct по каналу R6G - 32,1, 31,9) и 1×103 м.к./мл (Ct по каналу R6G(HEX) - 35.2, 34,9).
Пример 1
Материалом для исследования служили бактериальные взвеси клеток вакцинных штаммов Y. pestis EV76, B. anthracis СТИ-1 и F. tularensis subsp. holarctica 15/10, выросших на плотной питательной среде, приготовленные в 2 мл 0,9% стерильного раствора натрия хлорида, по отраслевому стандартному образцу мутности 10 единиц ГИСК им. Л.А. Тарасевича (ОСО 42-28-59-85П), что соответствует 5×109 м.к./мл для туляремийного микроба, 1×109 м.к./мл для Y. pestis и 1×108 м.к./мл B. anthracis. Штаммы получены из Государственной коллекции патогенных микроорганизмов и клеточных культур Роспотребнадзора «ГКПМ-Оболенск». Затем десятикратными разведениями в 0,9% стерильного раствора натрия хлорида доводили до концентрации 1×103 м.к./мл (Таблица 3). Далее к 100 мкл образцов, подготовленных как описано выше, добавляют лизирующий буфер на основе 6 М гуанидинизотиоцианата в объеме 450 мкл, указанном в инструкции к набору для выделения ДНК («РИБО-сорб» Кат. № К2-1-100), и инкубируют 15 минут при температуре (65±1)°C. После выполнения данного этапа материал считается обеззараженным. Далее проводят выделение ДНК в соответствии с инструкцией к набору, начиная с этапа добавления нуклеосорбента.
Мультиплексную ПЦР осуществляли в двух повторах для каждой исследуемой пробы или контрольного образца. Готовили рабочую реакционную смесь из расчета: 20 мкл реакционной смеси и 0,5 мкл фермента. Для проведения реакции 13 пробирок вместимостью 0,2 мл, соответствующих 10 пробам, ОКО-В, и по одной для положительного и отрицательного контролей амплификации. Маркировали ПЦР пробирки в соответствии с протоколом исследования. В отдельной микропробирке вместимостью 0,6 мл или 1,5 мл готовли реакционную смесь из расчета: Для 13 исследуемых образцов необходимо смешать 260 мкл реакционной смеси и 6,5 мкл фермента. Рабочую реакционную смесь перемешивали на встряхивателе и центрифугировали 3-5 секунд для сброса капель. Вносили по 20 мкл рабочей реакционной смеси в пробирки для ПЦР. ПКО размораживали, перемешивали на встряхивателе и центрифугировали 3-5 секунд для сброса капель, перемешивали и центрифугировали 5 секунд на микроцентрифуге-встряхивателе. Вносили в пробирки в соответствии с маркировкой по 5 мкл ОКО, ОКО-В, исследуемых образцов и ПКО, плотно закрывали крышки. Содержимое пробирок кратковременно перемешивали на микроцентрифуге-встряхивателе и центрифугировали 30 секунд на микроцентрифуге для микропробирок. Подготовленные микропробирки помещали в термоциклер типа «CFX96» BIO-RAD.
|
Для работы с прибором «CFX96» BIO-RAD использовали программу Bio-Rad CFX Manager.
Задавали следующую программу амплификации:
|
Cycle repeats/Цикл повторить - 50 times/раз.
В таблице результатов фиксировали значения порогового цикла (Ct) для каждой пробы. Определение видовой принадлежности исследуемых культур на основании регистрации сигналов по каналам FAM, HEX и ROX.
В пробах 1, 2 и 3 есть рост флуоресценции по каналу ROX, соответствующий наличию ДНК культуры Y. pestis EV76 и нет роста флуоресценции на каналах FAM и HEX (табл.3, фиг.1) Кинетические кривые ПЦР в режиме реального времени с использованием набора «MULTI-FLU» для образцов, содержащих ДНК, выделенные из 100 мкл бактериальных суспензий штамма Y. pestis EV с концентрациями 1×105 м.к./мл (Ct по каналу ROX - 31.4, 31.3), 1×104 м.к./мл (Ct по каналу ROX - 34.0, 33.9) и 1×103 м.к./мл (Ct по каналу ROX - 37.1, 37.8).
В пробах 4, 5, 6 и 7 есть рост флуоресценции по каналу FAM, соответствующий наличию ДНК культуры B. anthracis СТИ-1 и нет роста флуоресценции на каналах ROX и HEX (табл.3, фиг.2). Пример ПЦР в режиме реального времени с использованием набора «MULTI-FLU» для 10-кратных разведении ДНК, выделенной из 100 мкл бактериальной суспензии штамма B. anthracis 34 с концентрациями 1×108 м.к./мл (Ct по каналу FAM исх - 16,3, 15,99; 1/10 - 19,34, 19,17; 1/100 - 22,72, 22,49; 1/1000 - 26,15, 26,0).
В пробах 8, 9 и 10 есть рост флуоресценции по каналу HEX, соответствующий наличию ДНК культуры F. tularensis и нет роста флуоресценции на каналах FAM и ROX (табл.3, фиг.3). Кинетические кривые ПЦР в режиме реального времени с использованием набора «MULTI-FLU» для образцов, содержащих ДНК, выделенные из бактериальных суспензий штамма F. tularensis 15 с концентрациями: 1×105 м.к./мл (Ct по каналу R6G (HEX) - 29,0, 28,9), 1×104 м.к./мл (Ct по каналу R6G - 32,1, 31,9) и 1×103 м.к./мл (Ct по каналу R6G(HEX) - 35.2, 34,9).
Полученные результаты соответствуют заявленной специфичности и аналитической чувствительности набора для одновременной детекции ДНК возбудителей чумы, сибирской язвы и туляремии.
Пример 2
Материалом для исследования служили 9 зашифрованных проб, в которых присутствовали возбудитель чумы, сибирской язвы, туляремии и представители других родов и видов (Таблица 4).
|
Подготовку проб бактериальных суспензий выполняли в соответствии с требованиями СП 13.1285-03 «Безопасность работы с микроорганизмами 1-11 групп патогенности» (Москва, 2003 г.).
Обеззараживание исследуемых бактериальных суспензий проводили в соответствии с МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» (Москва, 2009 г.).
Материалом для исследования служили бактериальные взвеси клеток, выросших на плотной питательной среде, приготовленные в 2 мл 0,9% стерильного раствора натрия хлорида, по отраслевому стандартному образцу мутности 10 единиц ГИСК им. Л.А. Тарасевича (ОСО 42-28-59-85П), что соответствует 5×109 м.к./мл для туляремийного микроба, 1×109 м.к./мл для Y. pestis Y. pseudotuberculosis, E. coli и 10×108 м.к./мл для B. anthracis и В. cereus. Затем десятикратными разведениями в 0,9% стерильного раствора натрия хлорида доводили до различных концентраций (Таблица 2). Далее к 100 мкл образцов, подготовленных как описано выше, добавляли лизирующий буфер на основе 6 М гуанидинизотиоцианата в объеме 450 мкл, указанном в инструкции к набору для выделения ДНК («РИБО-сорб» Кат. № К2-1-100), и инкубируют 15 минут при температуре (65±1)°C. После выполнения данного этапа материал считается обеззараженным. Выделение ДНК выполняли по общепринятой схеме с использованием зарегистрированного коммерческого набора «Рибо-сорб», в соответствии с инструкцией к набору.
Мультиплексную ПЦР осуществляли в двух повторах для каждой исследуемой пробы или контрольного образца. Готовили рабочую реакционную смесь из расчета: 20 мкл реакционной смеси и 0,5 мкл фермента. Для проведения реакции 13 пробирок вместимостью 0,2 мл, соответствующих 10 пробам, ОКО-В, и по одной для положительного и отрицательного контролей амплификации. Маркировали ПЦР пробирки в соответствии с протоколом исследования. В отдельной микропробирке вместимостью 0,6 мл или 1,5 мл готовили реакционную смесь из расчета: Для 12 исследуемых образцов необходимо смешать 240 мкл реакционной смеси и 6,0 мкл фермента. Рабочую реакционную смесь перемешивали на встряхивателе и центрифугировали 3-5 секунд для сброса капель. Вносили по 20 мкл рабочей реакционной смеси в пробирки для ПЦР. ПКО размораживали, перемешивали на встряхивателе и центрифугировали 3-5 секунд для сброса капель, перемешивали и центрифугировали 5 секунд на микроцентрифуге-встряхивателе. Вносили в пробирки в соответствии с маркировкой по 5 мкл ОКО, ОКО-В, исследуемых образцов и ПКО, плотно закрывали крышки. Содержимое пробирок кратковременно перемешивали на микроцентрифуге-встряхивателе и центрифугировали 30 секунд на микроцентрифуге для микропробирок. Подготовленные микропробирки помещали в термоциклер типа «CFX96» BIO-RAD.
Для работы с прибором «CFX96» BIO-RAD использовали программу Bio-Rad CFX Manager. Задавали следующую программу амплификации (таб.2).
В таблице результатов фиксировали значения порогового цикла (Ct) для каждой пробы. Полученные результаты ПЦР представлены в таблице 5.
Определение видовой принадлежности исследуемых культур на основании регистрации сигналов по каналам FAM, HEX и ROX представлены в таблицах 4 и 5. После расшифровки проб, полученные результаты во всех случаях совпадали с характеристиками штаммов, использованных для приготовления шифрованных проб при изучении их в бактериологических, серологических и биологических методах. Штаммы получены из Государственная коллекция патогенных микроорганизмов и клеточных культур Роспотребнадзора «ГКПМ-Оболенск».
В пробе 1 есть рост флуоресценции по каналу ROX, соответствующий наличию ДНК культуры Y. pestis Y. pestis subsp. altaica И3446 и нет роста флуоресценции по каналам FAM и HEX.
В пробе 2 нет роста флуоресценции по каналам FAM, HEX и ROX, что означает отсутствие ДНК культур Y. pestis B. anthracis F. tularensis. Близкородственный к чумному вид Y. pseudotuberculosis данными праймерами не определяется.
В пробах 3, 4, есть рост флуоресценции по каналу FAM, соответствующий наличию ДНК культур B. anthracis ΔAmes и бесплазмидного штамма СТИ-1 Rif 4 и нет роста флуоресценции на каналах ROX и HEX, что означает - ДНК чумного и туляремийного микроба, данными праймерами не определяются.
В пробе 5 нет роста флуоресценции по каналам FAM, HEX и ROX, что означает отсутствие ДНК культур Y. pestis B. anthracis F. tularensis. Близкородственный к сибиреязвенному вид B. cereus (штамм B. cereus 504) данными праймерами не определяется.
|
В пробах 6, 7, есть рост флуоресценции по каналу HEX, соответствующий наличию ДНК культур F. tularensis subsp. tularensis Schu и F. tularensis subsp. mediasiatica 120 и нет роста флуоресценции на каналах ROX и FAM, что означает - ДНК чумного и сибиреязвенного микробов, данными праймерами не определяются.
В пробе 8 нет роста флуоресценции по каналам FAM, HEX и ROX, что означает отсутствие ДНК культур Y. pestis B. anthracis F. tularensis. Штаммы подвида F. tularensis subsp. novicida не являются эпидемически значимыми, не несут, определяемого данным набором, гена элемента вставки ISFtu5 и поэтому данными праймерами не определяются.
В пробе 9 нет роста флуоресценции по каналам FAM, HEX и ROX, что означает отсутствие ДНК культур Y. pestis B. anthracis F. tularensis. Вид Escherichia coli JM 83 данными праймерами не определяется.
Таким образом, заявляемое изобретение обладает новизной. Выбраны ДНК-мишени хромосомной локализации - последовательности фрагментов генов уро2088 Y. pestis, sspE B. anthracis и ISFtu5 F. tularensis. Подобраны праймеры и гибридизационные зонды, определен оптимальный состав реакционной смеси для выполнения мультиплексной ПЦР в режиме «реального времени» и оптимальные условия проведения реакции, особенности учета и оценки результатов, что позволяет выявлять возбудителей трех видов особо опасных инфекций, независимо от плазмидного состава штаммов, а также достигать высокого уровня чувствительности и специфичности, сокращать время анализа. Набор прошел предварительные, технические и медицинские испытания. В настоящее время проводится дополнительная экспертиза и регистрация в Росздравнадзоре.