Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ НАФТИФИНА
Вид РИД
Изобретение
Изобретение относится к области органической химии, в частности к способу получения нафтифина [(2E)-N-метил-N-(нафталин-1-илметил)-3-фенилпроп-2-ен-1-амина].
Нафтифин является противогрибковым лекарственным препаратом, применяющимся в медицине для лечения различных микозов [Berney D., Schuh K. Helv. Chim. Acta. 1978, 61, 1262-1273; Georgopoulos A., Petranyi G., Mieth H., Drews J. Antimicrob. Agents Chemother. 1981, 19, 386-389; Petranyi G., Georgopoulos A., Mieth H. Antimicrob. Agents Chemother. 1981, 19, 390-392; Petranyi G., Ryder N.S., Stutz A. Science. 1984, 224, 1239-1241].
Результаты изобретения могут быть использованы в химии, медицинской химии и фармации.
Известны способы получения нафтифина путем N-алкилирования N-метил-1-нафталин-1-илметиламина циннамилхлоридом или бромидом [Berney D. патент DE 2716943, 17.11.1977; Berney D. патент DE 2809211, 06.09.1979; Berney D. патент US 4282251, 04.08.1981; Baoguo L., Jianping D. патент CN 1324790, 05.12.2001]. Способы характеризуются недостаточно высоким выходом и изомерной чистотой целевого продукта.
Известен способ получения нафтифина на основе мультикомпонентного взаимодействия N-метил-1-нафталин-1-илметиламина, параформальдегида и (E)-стирилбороновой кислоты (реакция Петасиса). Недостатками способа являются недостаточно высокий выход нафтифина и малодоступность (Е)-стирилбороновой кислоты [Petasis N.A., Akritopoulou I. Tetrahedron Lett. 1993, 34, 583-586].
Известен способ получения нафтифина на основе однореакторного процесса окисления - иминирования - восстановления с участием 1-нафталинметанола и (2E)-N-метил-3-фенилпроп-2-ен-1-амина (или альтернативно циннамилового спирта и N-метил-1-нафталин-1-илметиламина) в присутствии 10-кратного избытка MnO2 и цианборгидрида на полимерной подложке [Kanno Н., Taylor R.J.K. Tetrahedron Lett. 2002, 43, 7337-7340]. Основными недостатками способа являются невысокий выход нафтифина, использование большого избытка MnO2, малодоступного и дорогостоящего цианборгидрида на полимерной подложке, а также проблемы, связанные с необходимостью очистки продукта от токсичных соединений марганца.
Известны способы получения нафтифина на основе аллилирования N-метил-1-нафталин-1-илметиламина циннамиловым спиртом, катализируемым Pt(cod)Cl2 в сочетании с лигандом DPEPhos [DPEPhos = оксиди (2,1-фенилен)бис(дифенилфосфин)] [Utsunomiya М., Miyamoto Y., Ipposhi J., Ohshima Т., Mashima K. Org. Lett. 2007, 9, 3371-3374; Ohshima Т., Miyamoto Y., Ipposhi J., Nakahara Y., Utsunomiya M., Mashima K.J. Am. Chem. Soc. 2009, 131, 14317-14328] и 1-фенилпроп-2-ен-1-олом, катализируемым Pd(allyl)Cl2 в сочетании с лигандом biphep [biphep = (2,2′-бис(дифенилфосфино)-1,1′-бифенил)] [Nishikata Т., Lipshutz В.Н. Org. Lett. 2009, 11, 2377-2379]. В связи с высокой стоимостью и малодоступностью платиновых и палладиевых катализаторов и особенно лигандов данные способы представляют лишь теоретический интерес.
Наиболее близким к предлагаемому изобретению по типу металлокатализируемой реакции сочетания и взятому нами за прототип является способ получения нафтифина, основанный на Pd-катализируемом сочетании метил(нафталин-1-илметил)проп-2-ен-1-илкарбамата и фенилдиазоний тетрафторбората (реакция Хека-Мацуда). Способ включает в себя следующие стадии: алкилирование аллиламина 1-(хлорметил)нафталином в присутствии K2CO3 с получением N-(нафталин-1-илметил)проп-2-ен-1-амина, взаимодействие N-(нафталин-1-илметил)проп-2-ен-1-амина с метилхлорформиатом в присутствии NaOH с получением метил(нафталин-1-илметил)проп-2-ен-1-илкарбамата, сочетание метил(нафталин-1-илметил)проп-2-ен-1-илкарбамата и фенилдиазоний тетрафторбората в присутствии Pd2(dba)3, NaOAc и PhCN с получением метил(нафталин-1-илметил)[(2E)-фенилпроп-2-ен-1-ил]карбамата, восстановление метил(нафталин-1-илметил)[(2E)-фенилпроп-2-ен-1-ил]карбамата литийалюминийгидридом с получением нафтифина [Prediger P., Barbosa L.F., Genisson Y., Correia C.R.D. J. Org. Chem. 2011, 76, 7737-7749].
Данный метод имеет следующие недостатки:
- недостаточно высокий выход на ключевой стадии Pd-катализируемого сочетания метил(нафталин-1-илметил)проп-2-ен-1-илкарбамата и фенилдиазоний тетрафторбората (85%) и общий выход нафтифина (68%);
- многостадийность процесса (4 стадии);
- высокая стоимость и токсичность Pd-катализатора.
Задачей изобретения является создание более эффективного, простого и практичного способа получения нафтифина с более высоким выходом.
Указанная задача решается тем, что нафтифин (1) получают согласно изобретению Fe-катализируемым сочетанием (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амина (2), полученного аллилированием N-метил-1-нафталин-1-илметиламина (3) (E)-1,3-дихлорпропеном (4), с фенилмагнийгалогенидом в апротонном растворителе в атмосфере инертного газа в присутствии соли железа (III). Исходный N-метил-1-нафталин-1-илметиламин (3) является промышленно доступным сырьем и его эффективно получают конденсацией 1-нафтальдегида с метиламином и восстановлением образующегося имина:
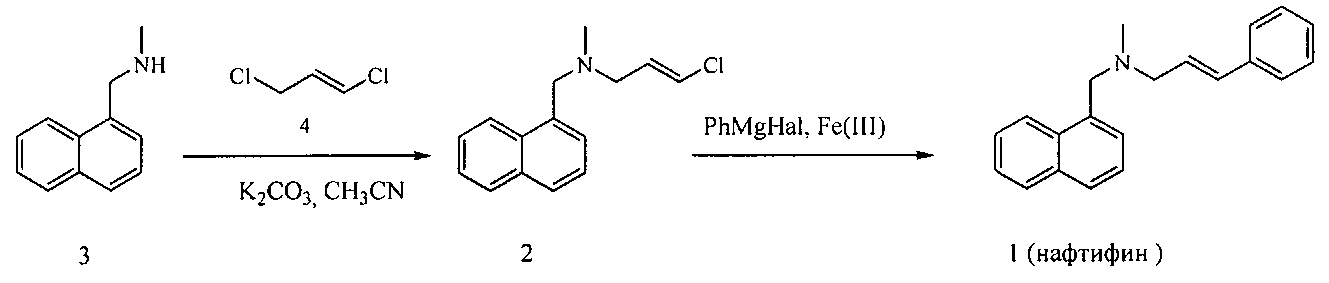
Способ осуществляют следующим образом.
Смесь (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амина (2), катализатора [соли железа (III)] в апротонном растворителе и 0.5-3 М раствора фенилмагнийгалогенида в органическом растворителе (предпочтительно 1М раствор PhMgBr в ТГФ) перемешивают при температуре от минус 40°C до плюс 30°C (предпочтительно при 0-25°C) в течение 0.1-8 ч (предпочтительно в течение 1-2 ч) в атмосфере инертного газа при следующем мольном соотношении реагентов [(2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амин] : [соль железа (III)] : [фенилмагнийгалогенид]=1:0.001-0.1:1-4(предпочтительно 1:0.01-0.03:1.6-1.8).
В качестве катализатора используют соли железа (III), в частности Fe(acac)3, FeCl3, Fe(acac)2Cl, Fe(acac)Cl2, Fe(Pv)3, FeCl3(PPh3) [предпочтительно Fe(acac)3] (асас = ацетилацетонат, Pv-пивалат).
В качестве апротонного растворителя используют простые эфиры [тетрагидрофуран (ТГФ), диметиловый эфир диэтиленгликоля (диглим), диэтиловый эфир диэтиленгликоля, диоксан], амидные растворители [N-метилпирролидон (NMP), N,N-диметилформамид (ДМФА), N,N-диметилацетамид (ДМА)], тетраметилэтилендиамин (ТМЭДА) или их смеси (предпочтительно смесь ТГФ и NMP в объемном соотношении 200:1-5:1).
Пример 1. Получение (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амина (2)
К суспензии 1.22 г (0.011 моль) (Е)-1,3-дихлорпропена (4) и 2.07 г (0.015 моль) K2CO3 в 20 мл абсолютного ацетонитрила прибавляют 1.71 г (0.01 моль) N-метил-1-нафталин-1-илметиламина (3). Перемешивают 1 ч при комнатной температуре, затем еще 4 ч при кипении до полной конверсии амина (3) (контроль методом ГЖХ). После охлаждения раствор фильтруют, осадок промывают этилацетатом и объединенные органические слои концентрируют. Продукт реакции выделяют методом колоночной хроматографии (SiO2, гексан-этилацетат, 9:1→3:1). Выход 1.97 г (80%), маслообразное вещество. ИК спектр, ν, см-1: 2838, 2790, 1635, 1495, 1452, 1366, 1018, 934, 791, 775. Спектр ЯМР 1H, δ, м. д.: 2.21 с (3Н, CH3N), 3.06 д (2Н, С1Н2, J 6.3 Гц), 3.86 с (2Н, CH2N), 6.04 д.т (1Н, С2Н, Jтранс 13.3, 6.3 Гц), 6.13 д (1Н, С3Н, Jтранс 13.3 Гц), 7.37-7.53 м (4Н, СНар), 7.73-7.84 м (2Н, СНар), 8.23 д (1Н, СНар, J 7.9 Гц). Спектр ЯМР 13С, δ, м.д.: 42.07 (CH3N), 57.23 (C1), 59.81 (CH2N), 120.14 (C3), 124.48 (СНар)5 125.05 (СНар), 125.62 (СНар), 125.86 (СНар), 127.33 (СНар), 128.05 (СНар.), 128.40 (СНар), 130.83 (С2), 132.36 (Сар.), 133.83 (Сар.), 134.40 (Сар). Масс-спектр, m/z (Iотн., %): 247 (1) и 245 (3.5) [М]+, 142 (32), 141 (98), 118 (26), 115 (69), 106 (30), 104 (100), 82 (27), 77 (24), 75 (61), 42 (79).
Пример 2. Способ получения (2E)-N-Метил-N-(нафталин-1-илметил)-3-фенилпроп-2-ен-1-амина (нафтифина) (1)
К раствору 1.23 г (5 ммоль) (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амина (2), 26.5 мг (1.5 мол %) Fe(acac)3 в смеси 8 мл ТГФ и 0.4 мл NMP медленно прибавляют при 0°C в атмосфере аргона 8.5 мл 1М раствора PhMgBr в ТГФ. Перемешивают при комнатной температуре в течение 1.5 ч. Затем приливают 5 мл воды и 20 мл этилацетата, органический слой отделяют, водный слой обрабатывают этилацетатом (2×10 мл). Объединенные органические слои промывают насыщенным раствором NaCl, сушат Na2SO4 и концентрируют. Продукт реакции выделяют методом колоночной хроматографии (SiO2, гексан - этилацетат, 9:1→3:1). Выход 1.32 г (92%), маслообразное вещество. ИК спектр, ν, см-1: 2786, 1495, 1450, 1363, 967, 798, 792, 775, 744, 692. Спектр ЯМР 1H, δ, м. д.: 2.27 с (3H, CH3N), 3.28 д (2Н, С1Н2, J 6.6 Гц), 3.94 с (2Н, CH2N), 6.36 д.т (1Н, С2Н, J 15.8, 6.6 Гц), 6.58 д (1H, С3Н, J 15.8 Гц), 7.21-7.55 м (9Н, СНар), 7.77 д (1Н, СНар., J 7.7 Гц), 7.84 д (1Н, СНар, J 7.7 Гц), 8.30 д (1Н, СНар, J 7.9 Гц). Спектр ЯМР 13С, δ, м.д.: 42.46 (CH3N), 60.05 (С1), 60.38 (CH2N), 124.60 (СНар), 125.11 (СНар), 125.55 (СНар), 125.88 (СНар.), 126.30 (2СНар.), 127.35 (С2), 127.44 (СНар.), 127.53 (СНар.), 127.92 (СНар), 128.43 (СНар), 128.52 (2СНар), 132.47 (Сар), 132.68 (С3), 133.88 (Сар), 134.81 (Сар), 137.12 (Сар). Масс-спектр, m/z (Iотн, %): 287 (18) [М]+, 196 (29), 182 (13), 146 (34), 142 (25), 141 (100), 117 (38), 116 (8), 115 (49), 91 (14), 42 (60). Найдено [М]+ 287.1686. C21H21N. Вычислено М 287.1674.
Пример 3. Способ получения (2E)-N-Метил-N-(нафталин-1-илметил)-3-фенилпроп-2-ен-1-амина (нафтифина) (1)
К раствору 0.319 г (1.3 ммоль) (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амина (2), 4.6 мг (1 мол %) Fe(acac)3 в смеси 2 мл ТГФ и 0.1 мл NMP медленно прибавляют при 0°C в атмосфере аргона 2.1 мл 1 М раствора PhMgBr в ТГФ. Перемешивают при комнатной температуре в течение 1.5 ч. Операции по выделению продукта и его спектральные характеристики аналогичны приведенным в примере 2. Выход 0.332 г (89%).
Пример 4. Способ получения (2E)-N-Метил-N-(нафталин-1-илметил)-3-фенилпроп-2-ен-1-амина (нафтифина) (1)
К раствору 1.23 г (5 ммоль) (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амина (2), 21.7 мг (1.5 мол %) Fe(acac)2Cl в смеси 8 мл ТГФ и 0.4 мл NMP медленно прибавляют при 0°C в атмосфере аргона 8.5 мл 1М раствора PhMgBr в ТГФ. Перемешивают при комнатной температуре в течение 1 ч. Операции по выделению продукта и его спектральные характеристики аналогичны приведенным в примере 2. Выход 1.29 г (90%).
Пример 5. Способ получения (2E)-N-Метил-N-(нафталин-1-илметил)-3-фенилпроп-2-ен-1-амина (нафтифина) (1)
К раствору 1.23 г (5 ммоль) (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амина (2), 16.2 мг (2 мол %) FeCl3 в смеси 8 мл ТГФ и 0.4 мл NMP медленно прибавляют при 0°C в атмосфере аргона 9 мл 1М раствора PhMgBr в ТГФ. Перемешивают при комнатной температуре в течение 2 ч. Операции по выделению продукта и его спектральные характеристики аналогичны приведенным в примере 2. Выход 1.25 г (87%).
Пример 6. Способ получения (2E)-N-Метил-N-(нафталин-1-илметил)-3-фенилпроп-2-ен-1-амина (нафтифина) (1).
К раствору 1.23 г (5 ммоль) (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амина (2), 26.5 мг (1.5 мол %) Fe(acac)3 в 8 мл ДМФА медленно прибавляют при 0°C в атмосфере аргона 8.5 мл 1М раствора PhMgBr в ТГФ. Перемешивают при комнатной температуре в течение 1.5 ч. Операции по выделению продукта и его спектральные характеристики аналогичны приведенным в примере 2. Выход 1.24 г (86%).
Пример 7. Способ получения (2E)-N-Метил-N-(нафталин-1-илметил)-3-фенилпроп-2-ен-1-амина (нафтифина) (1)
К раствору 1.23 г (5 ммоль) (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амина (2), 26.5 мг (1.5 мол %) Fe(acac)3 в смеси 8 мл диглима и 0.4 мл NMP медленно прибавляют при 0°C в атмосфере аргона 8.5 мл 1М раствора PhMgBr в ТГФ. Перемешивают при комнатной температуре в течение 2 ч. Операции по выделению продукта и его спектральные характеристики аналогичны приведенным в примере 2. Выход 1.28 г (89%).
Пример 8. Способ получения (2E)-N-Метил-N-(нафталин-1-илметил)-3-фенилпроп-2-ен-1-амина (нафтифина) (1)
К раствору 1.23 г (5 ммоль) (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1-амина (2), 26.5 мг (1.5 мол %) Fe(acac)3 в смеси 8 мл ТГФ и 0.4 мл NMP медленно прибавляют при 0°C в атмосфере аргона 8.5 мл 1М раствора PhMgCl в ТГФ. Перемешивают при комнатной температуре в течение 1.5 ч. Операции по выделению продукта и его спектральные характеристики аналогичны приведенным в примере 2. Выход 1.25 г (87%).
Пример 9. Способ получения нафтифина гидрохлорида
К раствору 1.23 г (5 ммоль) (2E)-3-хлор-N-метил-N-(нафталин-1-илметил)проп-2-ен-1 -амина (2), 26.5 мг (1.5 мол %) Fe(acac)3 в смеси 8 мл ТГФ и 0.4 мл NMP медленно прибавляют при 0°C в атмосфере аргона 8.5 мл 1М раствора PhMgBr в ТГФ. Перемешивают при комнатной температуре в течение 1.5 ч. Затем приливают 5 мл воды и 20 мл этилацетата, органический слой отделяют, водный слой обрабатывают этилацетатом (2×10 мл). Объединенные органические слои промывают насыщенным раствором NaCl, сушат Na2SO4 и концентрируют. Сырой продукт обрабатывают 7 мл 1М раствора HCl в этаноле, концентрируют, сухой остаток перекристаллизовывают из смеси этанола и диэтилового эфира. Выход 1.42 г (88%), белые кристаллы, т.пл. 174-176°C.
Предлагаемый способ имеет следующие преимущества:
- более высокий выход нафтифина на ключевой стадии сочетания и общий выход нафтифина;
- снижение количества стадий процесса;
- низкая стоимость и малотоксичность катализатора.

