Результат интеллектуальной деятельности: СПОСОБ МОДЕЛИРОВАНИЯ ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА В ТКАНЯХ РЕПРОДУКТИВНЫХ ОРГАНОВ ЖЕНЩИН
Вид РИД
Изобретение
Изобретение относится к экспериментальной биологии, медицине, к гинекологии и может быть использовано для изучения патологических механизмов хламидиоза тканей и органов репродуктивной системы женщин.
В последние годы в научном мире активно обсуждается проблема влияния хламидийной инфекции на гормональную функцию яичников (см. Keay S.D., Barlow R., Eley A., Masson G.M., Anthony F.W., Jenkins J.M. The relation between immunoglobulin Gantibodies to Chlamydia trachomatis and poorovarian respons to gonadotropin stimulation befor in vitro fertilization. // Fertil. Steril. - 1998. - v.70. - N. 2. - P. 214-218; Sharara F.I., Queenan J.T. Jr., Springer R.S., VT.L., Scoccia D., Scommegna A. Elevated serum Chlamydia trachomatis Ig G antibodies. What do they mean for IVF pregnancy rates and loss? // J. Reprod Med. 1997. - v.42. - N.5. - P.281-286).
Прослеживается связь между серологическими доказательствами первичной инфекции, вызванной Chlamydia trachomatis, и обструктивным бесплодием (см. Henry-Suchet J., Catalan F., Paris X., Loffredo V. Antibody titerto Chlamydia trachomatis to acutesalping it isand obstructive sterilities. // Chlamydial infections. Amstrdam, ′′Elsevier Biomedical Press′′. - 1982. - P. 183-87).
Исследования, направленные на определение дискриминационных значений титров антител к Chlamydia trachomatis у 2729 женщин с субфертильностью, показали значимость исследования титров антител к хламидиям в диагностике трубной окклюзии (см. Mol В.W, Dijkman В., Wertheim P., Lijmer J., Vander Veen F., Bossuyt P.M. The accuracy of serum Chlamydial antibodies in the diagnosis of tubal pathology: ameta-analysis. // FertilSteril. - 1997. - V.67. - N.6. - P. 1031-1037).
Антиген Chlamydia trachomatis идентифицирован в образцах эндометрия и фаллопиевых труб бесплодных женщин (см. Campbell L.A., Patton D.L., Moor D.E. etal. Detection of Chlamidial trachomatis deoxyribonucleic acid in Women with tubal infertility. Fertil. Steril. 1993. - V. 59. - P. 45-50).
При лапароскопии у женщин с острым сальпингитом Chlamydia trachomatis была выделена в аспиратах из труб и биоптатах фимбрий в 30% и 70% случаев соответственно (см. Mardh P. - A., Ripa К.Т., Svensson L., Westrom L. Chlamydia trachomatis in patients with acutes alpingitis // N. Engl. Med. - 1977. - v.296. - P. 1377-1380).
Тем не менее, имеющиеся данные не дают четкого представления о механизме повреждения репродуктивной системы женщин в процессе длительной персистенции в половых путях возбудителя хламидиоза, не установлены причины, приводящие к гормональным нарушениям.
Известна способность Chlamydia pneumonia и Chlamydia trachomatis типы Н и L2/434/BU инфицировать культивируемые клетки эндотелия вен (см. Fryer R.H. Schwobe E.P., Woods M.L., Rodgers G.M. Chlamydiaspecies infect human vascular endothelial cell and induce procoagulant activity. // J. Investig. Med. - 1997. - V.45. - N.4. - P. 168-174).
При этом обнаружено свойство инфицированных клеток экспрессировать прокоагулянтные тканевые факторы, отмечена адгезия тромбоцитов к инфицированным хламидиями клеткам разной степени выраженности. Оказалось, что указанные типы хламидий могут инфицировать человеческие эндотелиальные клетки вен и инициировать экспрессию тканевого фактора с пиком через 18 часов после инфицирования. Отмечено значительное повышение адгезии тромбоцитов при инфицировании эндотелиоцитов разными серотипами хламидий.
Однако представленный способ исследования, хотя и достаточно эффективен, но разработан для решения других задач.
Известно, что в системе in vitro фибробластоподобные синовиоциты способны поддерживать рост хламидий (см. Rodel J., Straube Е., Lungershausen W., Hartmann M., Groh A. Secretion of cytokines by humans ynoviocytes during in vitro infection with Chlamydia trachomatis. // J. Rheumatol. - 1998. - V.25. - N.11. - P.2161-2168), выбранный нами в качестве прототипа.
Штамм Е Chlamydia trachomatis стимулировал цитокиновый ответ инфицированных клеток, в частности, к продукции IL6, TGF-beta, GMCSF. Обработка интерфероном гамма способствовала высвобождению TNF-альфа в ответ на хламидийную инфекцию. В целом, индуцированный хламидиями цитокиновый ответ приводил к изменению синовиальной мембраны, вызывая воспаление.
Однако указанный способ предназначен для изучения причин воспаления в культуре фибробластов и не позволяет судить как о возможности культивирования клеток желтого тела, так и об адаптации штамма Е Chlamydia trachomatis к полученной культуре для изучения его патологического действия на ткани и органы репродуктивной системы женщин.
Полагаем, что доказательством взаимосвязи нарушений деятельности органов репродуктивной системы с инфицированием Chlamydia trachomatis могло бы явиться инфицирование культуры клеток желтых тел в эксперименте in vitro.
Предположение основано на способности хламидий расти и размножаться в различных клеточных культурах: McCoy, HeLa-229 и других (см. Kuo С.С, Wang S.P. Grayston J.T. Growt hof trachoma organisms in HeLa 229 cellculture. // Nongonococcal Uretrhritisand Relat. Infect. - Washington, DC-1977. - P. 328-336; Ripa K.T. and P. - A. Mardh. Cultivation of Chlamydia trachomatis incicloheximid - treated Mc Coy cells. // J. Clin. Microbiol. - 1977. - N. 6. - P. 328-331).
Техническим результатом изобретения является разработка модельной системы, содержащей желтые тела, выделенные из ткани яичников и Chlamydia trachomatis для выявления признаков инфицирования и воспаления.
Поставленная цель достигается тем, что ткань желтого тела, выделенного из биопсийного материала в пролиферативную фазу менструального цикла, гомогенизируют при комнатной температуре в культуральной среде RPMI-1640 «Seromed», затем полученную клеточную смесь центрифугируют в течение 10 минут при 1000 оборотов в минуту, супернатант удаляют, осадок клеток отмывают в среде RPMI, оценивают выделенные клетки в инвертированном микроскопе MicroStar «Reichert» и переносят в ростовую среду, содержащую RPMI-1640 с 15% эмбриональной телячьей сывороткой «Seromed», 2 ммоль/л глутамина и 150 γ/мл гентамицина, для выращивания клеток используют матрацы из нейтрального стекла объемом 100 мл, ростовую среду вносят в количестве 15 мл; на 3-и сутки заменяют 1/3 объема среды культивирования, на 6-й день образовавшийся монослой снимают со стекла 0,02% раствором Версена с хемотрипсином, центрифугируют в течение 10 минут при 1000 оборотов в минуту, удаляют надосадочную жидкость, клеточный осадок ресуспендируют в той же среде до дозы 2,0×105 клеток в 1 мл и переносят по 1 мл в пенициллиновые флаконы, на дно которых предварительно помещают покровные стекла размером 7×7 мм, через 36 часов ростовую среду удаляют из флаконов, сформировавшийся монослой клеток еще раз промывают той же средой, затем во флаконы вносят по 40 мл культуры Chlamydia trachomatis, центрифугируют с использованием центрифуги с горизонтальным ротором при 2500 оборотов в минуту в течение 1 часа, образцы инкубируют при 37°C в течение 72 часов, затем покровные стекла извлекают из флаконов, подсушивают на воздухе и фиксируют охлажденным ацетоном в течение 10 минут, окрашивают и при микроскопии выявляют обилие клеток эксплантата с выраженными признаками деструкции, с ретикулярными тельцами и переходными формами возбудителя, экзоцитоз хламидий, лизис инфицированных клеток на фоне клеточного детрита и голых ядер, присутствие клеток, весь объем которых заполняли зрелые бочонкообразные включения Chlamydia trachomatis с заметным уплотнением поверхностных структур, увеличением периплазматического пространства. Способ поясняется фотографиями.
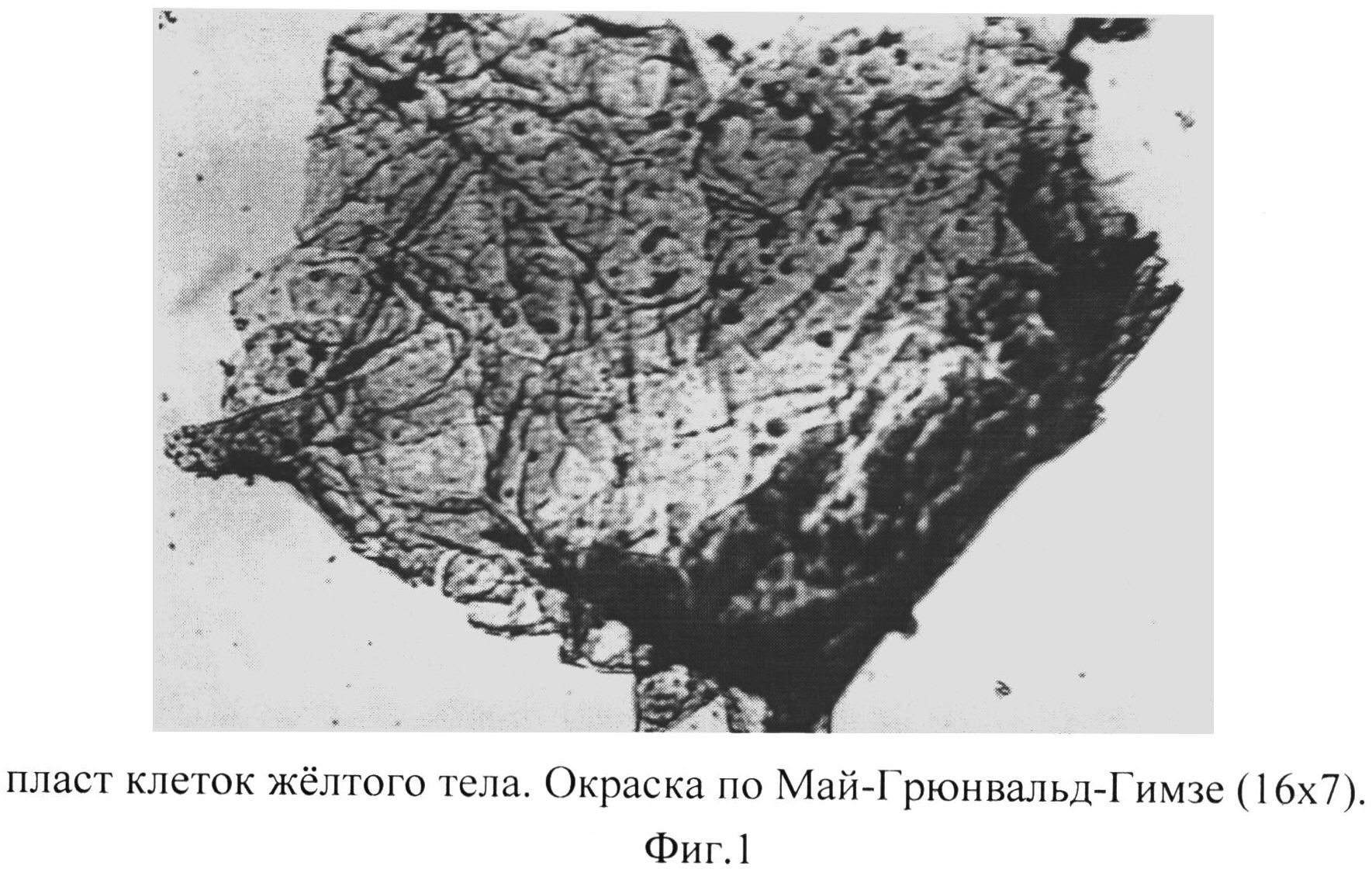
Фиг. 1 - пласт клеток желтого тела. Окраска по Май-Грюнвальд-Гимзе (16×7).
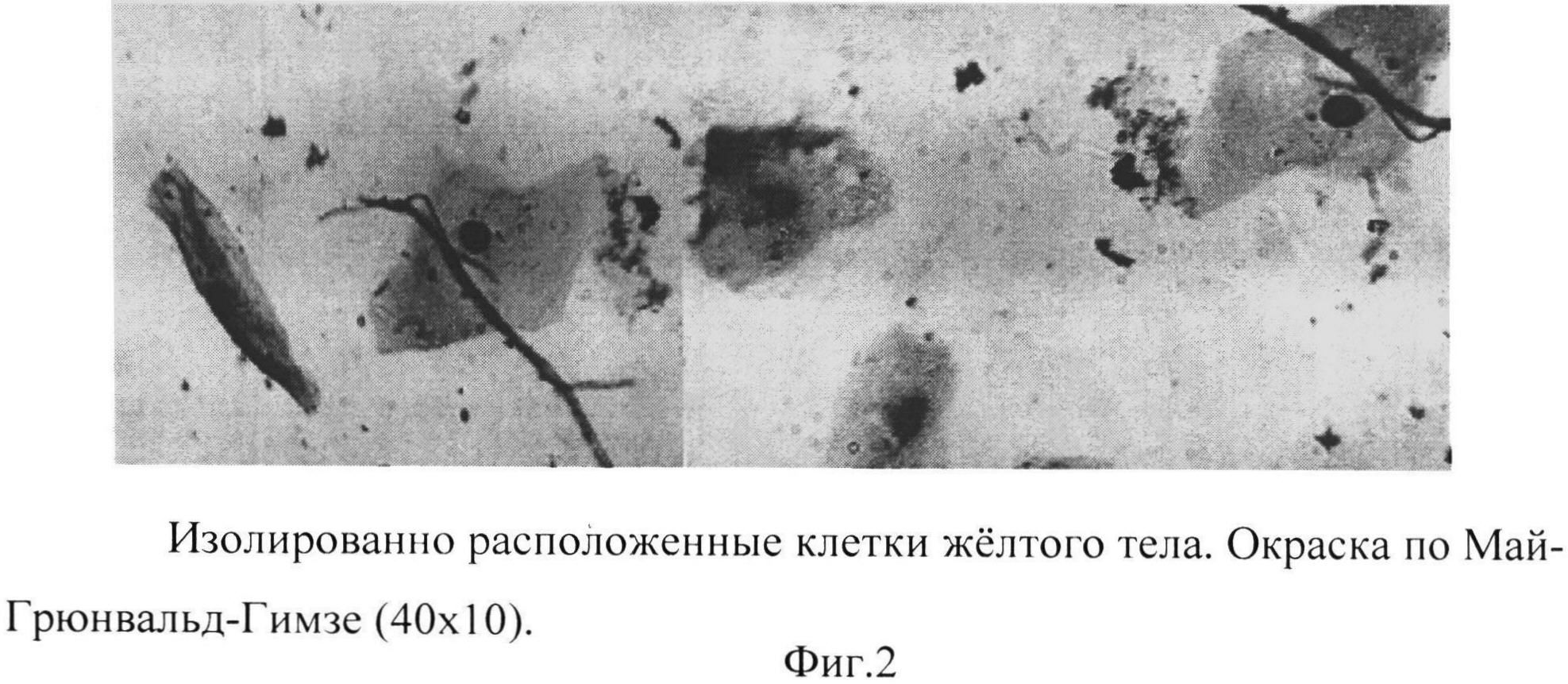
Фиг. 2 - изолированно расположенные клетки желтого тела. Окраска по Май-Грюнвальд-Гимзе (40×10).
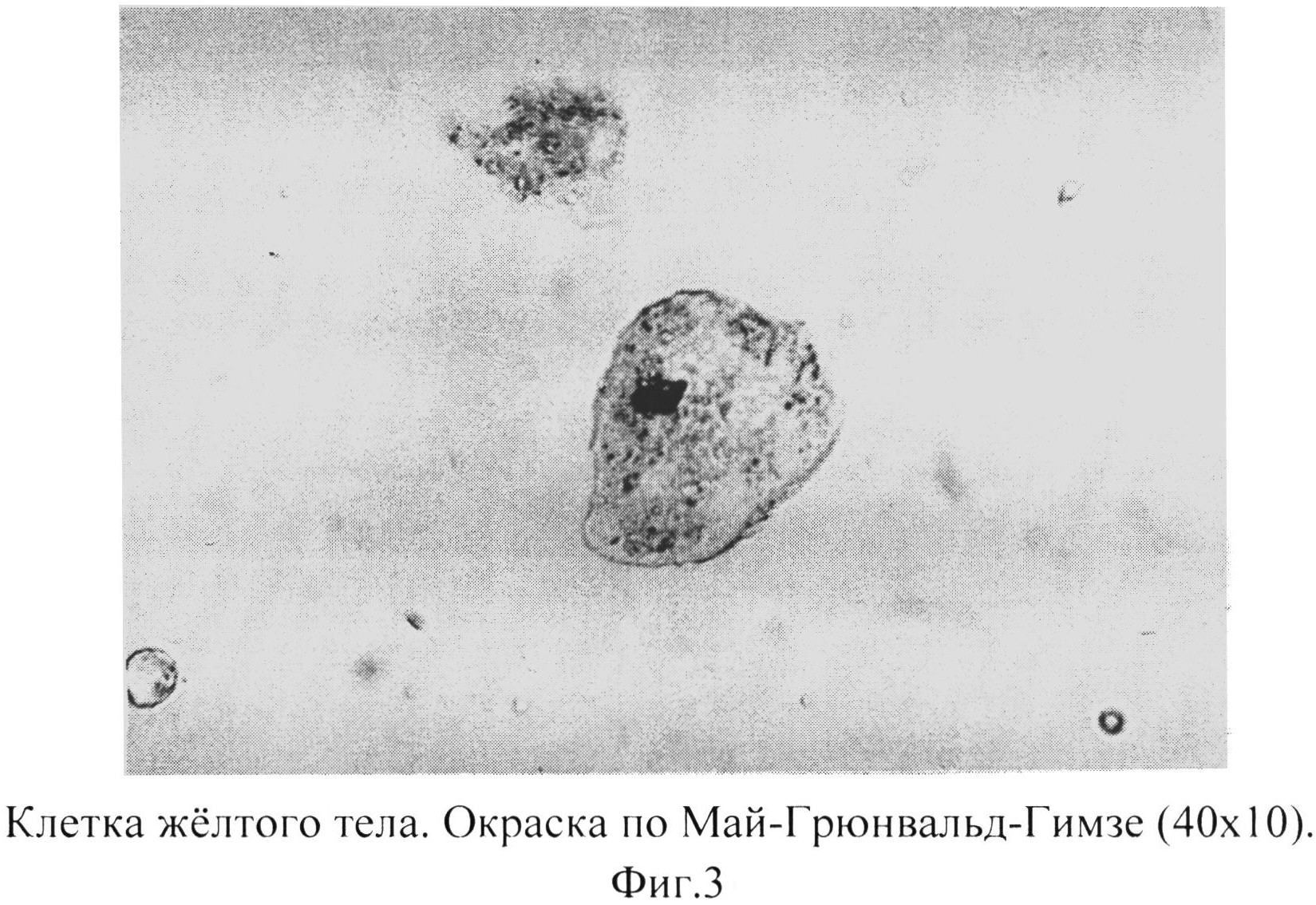
Фиг. 3 - клетка желтого тела. Окраска по Май-Грюнвальд-Гимзе (40×10).
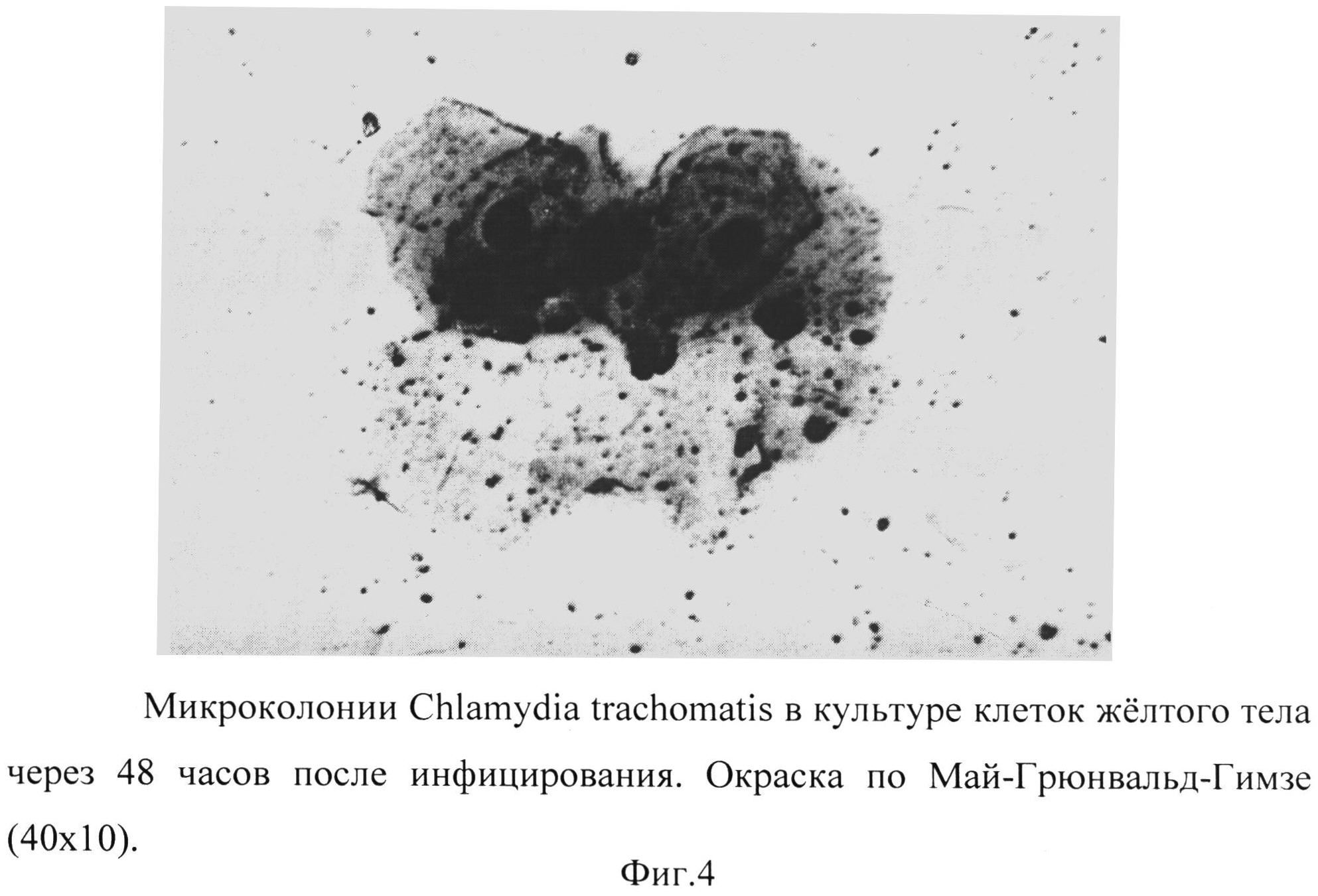
Фиг. 4 - микроколонии Chlamydia trachomatis в культуре клеток желтого тела через 48 часов после инфицирования. Окраска по Май-Грюнвальд-Гимзе (40×10).
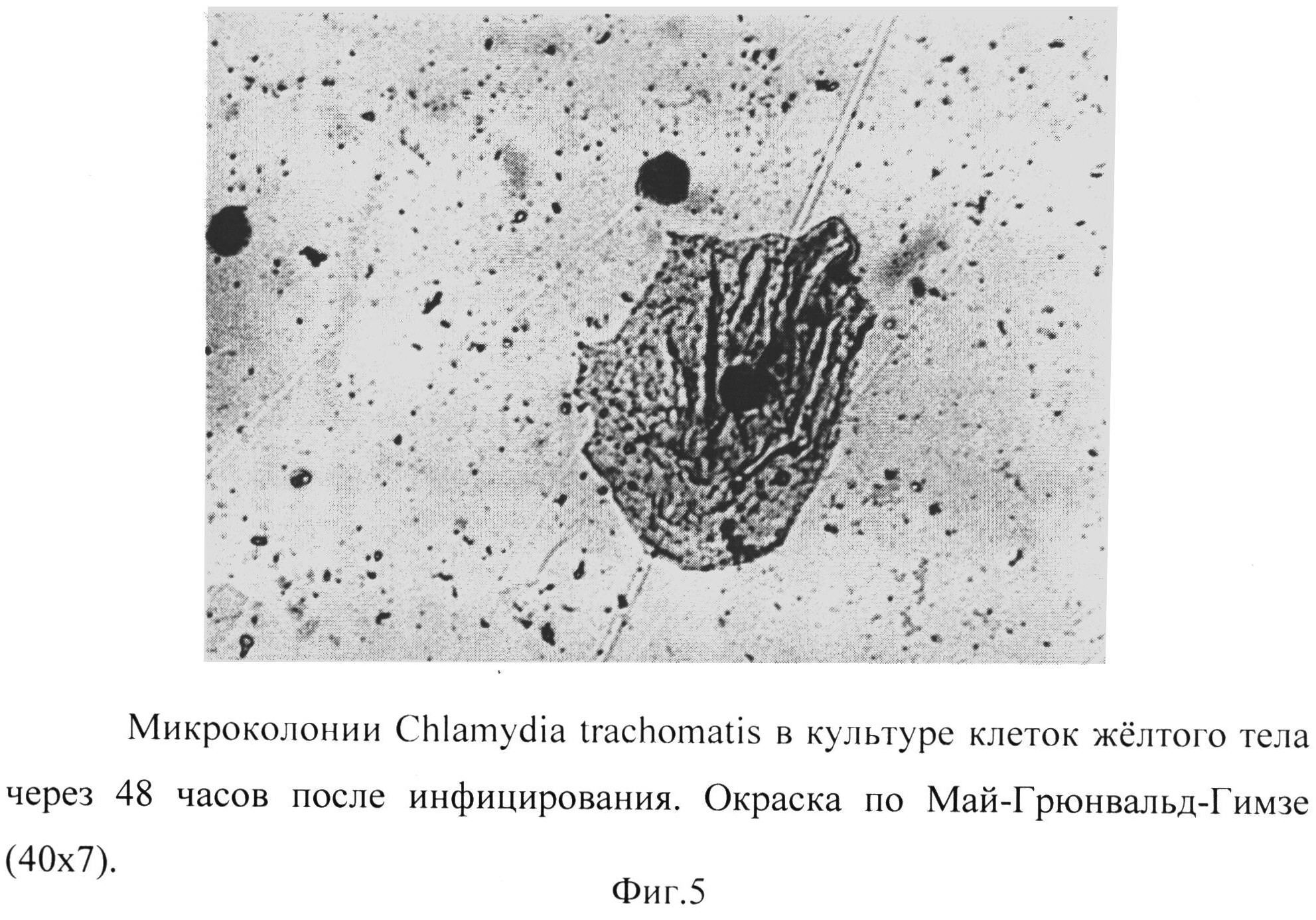
Фиг. 5 - микроколонии Chlamydia trachomatis в культуре клеток желтого тела через 48 часов после инфицирования. Окраска по Май-Грюнвальд-Гимзе (40×7).
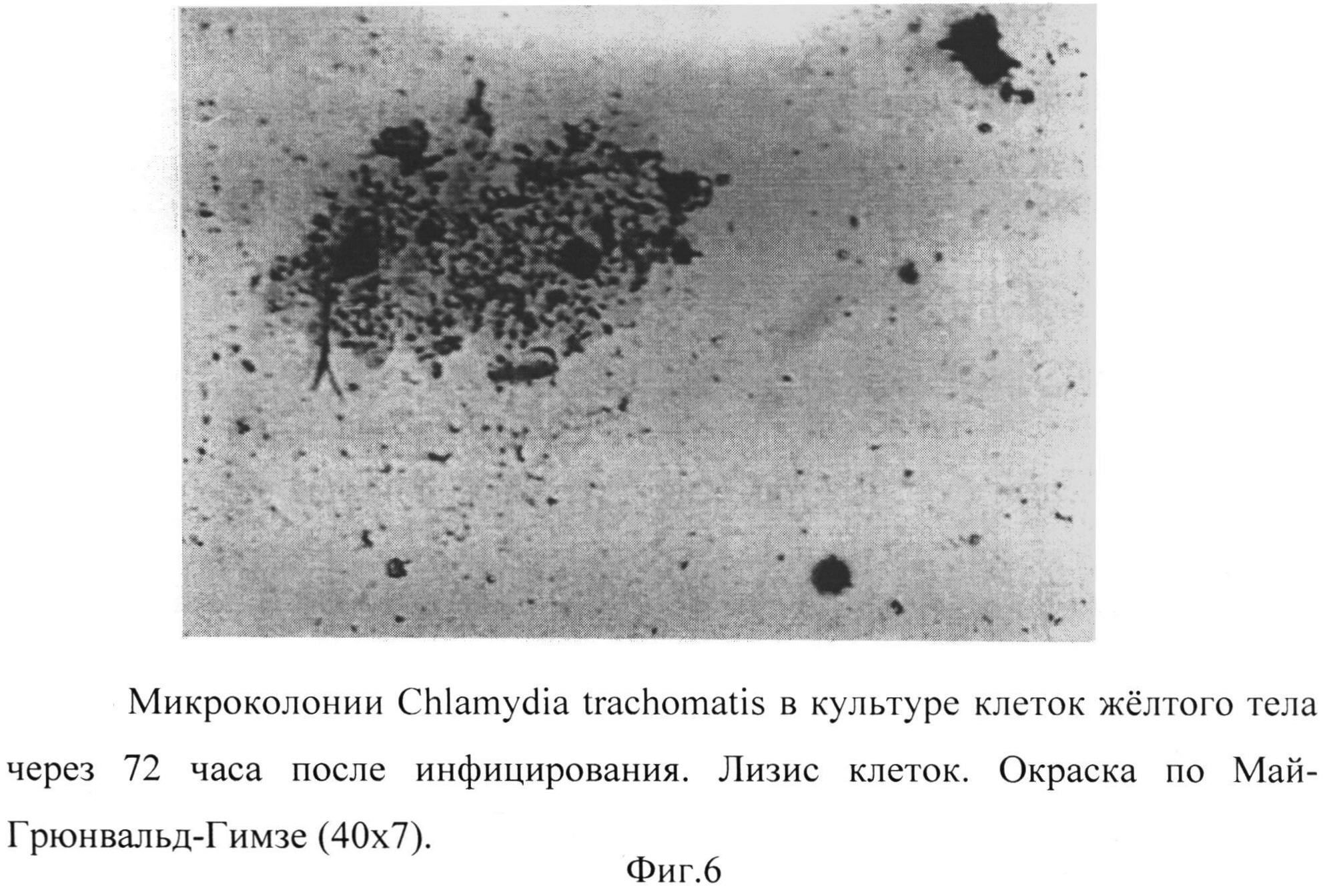
Фиг. 6 - микроколонии Chlamydia trachomatis в культуре клеток желтого тела через 72 часа после инфицирования. Лизис клеток. Окраска по Май-Грюнвальд-Гимзе (40×7).
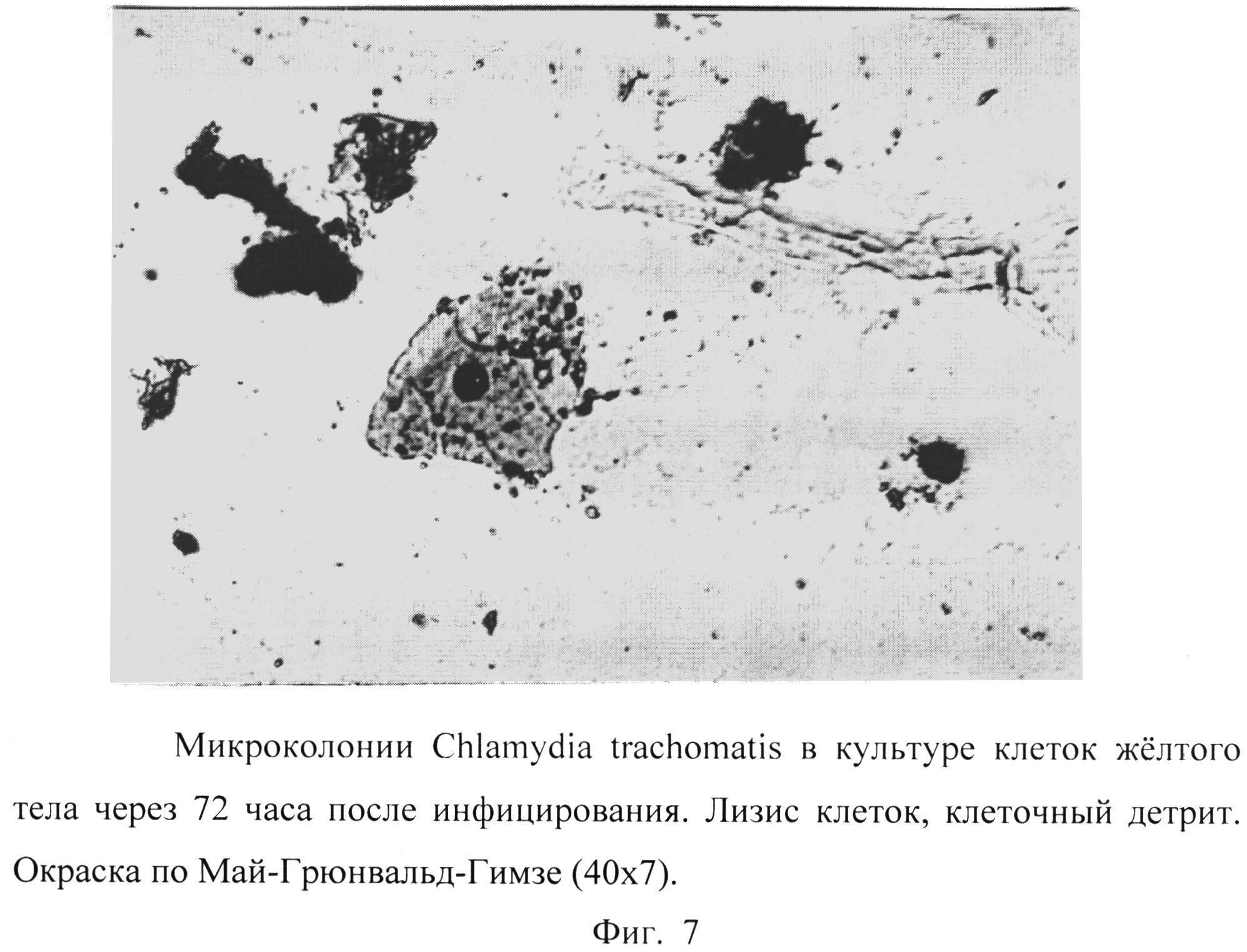
Фиг. 7 - микроколонии Chlamydia trachomatis в культуре клеток желтого тела через 72 часа после инфицирования. Лизис клеток, клеточный детрит. Окраска по Май-Грюнвальд-Гимзе (40×7).
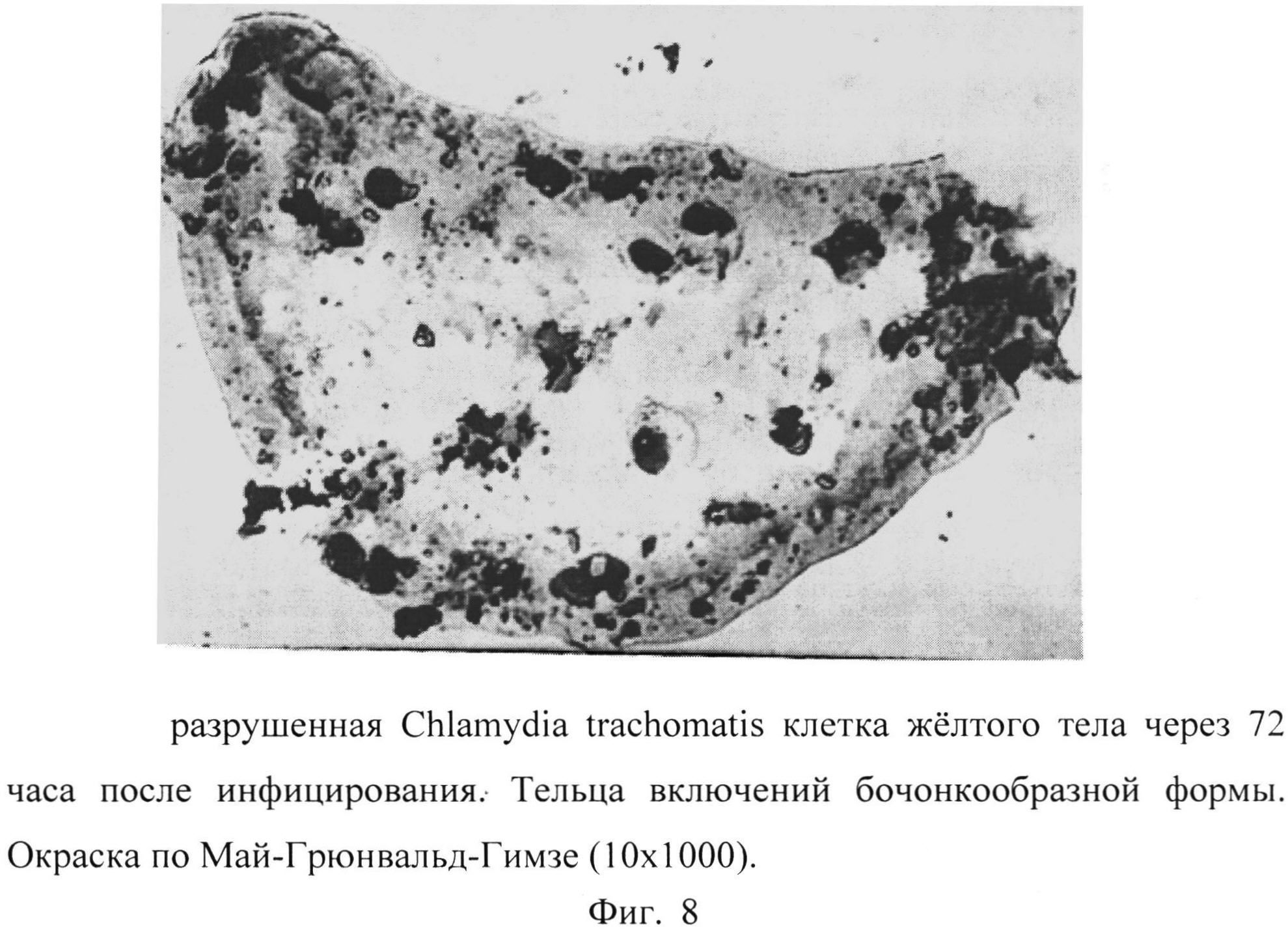
Фиг. 8 - разрушенная Chlamydia trachomatis клетка желтого тела через 72 часа после инфицирования. Тельца включений бочонкообразной формы. Окраска по Май-Грюнвальд-Гимзе (10×1000).
Способ осуществляется следующим образом.
В качестве агента инфицирования выбран штамм Е Chlamydia trachomatis с титром - 106IFU/мл, полученный роллерным культивированием в клеточных линиях McCoy (см. Бартеньева Н.С., Фуэнтос И., Деева Ф.В., Лефебр Ж.Ф. и др. Индукция тумор-некротического фактора хламидиями. // Актуальные микробиологические и клинические проблемы хламидийных инфекций. - М. - 1990. - С.30-32).
Инфицирование культурой Chlamydia trachomatis осуществляли с применением центробежной силы по стандартной методике (см. Dunlop Е.М.С., Vaughan-Jackson J.R., Darougar S. // Chlamydial infection improved methods of collection of material for coutuceion from the urogenital tract and rectum. // Brit. J. Vener. Dis. - 1972. - v.48. - K6. - P. 421-424).
Ткань желтого тела, выделенного из биопсийного материала в пролиферативную фазу менструального цикла, тщательно гомогенизируют при комнатной температуре в культуральной среде RPMI-1640 («Seromed»).
Полученную клеточную смесь центрифугируют в течение 10 мин при 1000 об/мин на Т-34. После центрифугирования супернатант удаляют, а осадок клеток отмывают в среде RPMI.
После оценки выделенных клеток в инвертированном микроскопе (MicroStar «Reichert») клеточную взвесь переносят в ростовую среду, содержащую RPMI-1640 с 15% эмбриональной телячьей сывороткой («Seromed»), 2 ммоль/л глутамина и 150 у/мл гентамицина.
Для выращивания клеток используют матрацы из нейтрального стекла объемом 100 мл. Ростовую среду вносят в количестве 15 мл.
На 3-и сутки проводят замену 1/3 объема среды культивирования.
На 6-й день образовавшийся монослой снимают со стекла 0,02% раствором Версена с хемотрипсином, центрифугируют в течение 10 мин при 1000 об/мин.
После удаления надосадочной жидкости клеточный осадок ресуспендируют в той же среде до дозы 2,0×105 клеток в 1 мл и переносят по 1 мл в пенициллиновые флаконы, на дно которых предварительно помещают покровные стекла размером 7×7 мм.
Монослой клеток формируется при вертикальном положении флаконов в атмосфере 5% CO2 при 37°C в CO2-инкубаторе («Sanyo»).
Процесс формирования монослоя клеток желтых тел состоит из 2-х этапов: начало образования монослоя - пласты клеток распадаются на отдельные клетки, последние свернуты в трубочки; завершение образования монослоя - клетки «разворачиваются», принимают свою обычную форму, располагаются отдельно или небольшими группами, морфологически идентифицируемы (Фиг.1, 2, 3).
Через 36 часов ростовую среду удаляют из флаконов, сформировавшийся монослой клеток еще раз промывают той же средой, после чего во флаконы вносят по 40 мл культуры Chlamydia trachomatis.
С целью повышения репродукции хламидий в культуре клеток и усиления адсорбции инокулята на монослой применяют центрифугирование с использованием центрифуги с горизонтальным ротором при 2500 об/мин в течение 1 часа.
После центрифугирования образцы инкубируют при 37°C в течение 72 часов.
Оценку результатов взаимодействия инфекционного агента с клеточной линией производят через 48 часов и по истечении 72 часов.
В указанные сроки покровные стекла извлекают из флаконов, подсушивают на воздухе и фиксируют охлажденным ацетоном в течение 10 мин.
Одно из стекол окрашивают по методу Май-Грюнвальда-Гимзы (см. Кост Е.А., Смирнова Л.Г. Руководство по клиническим лабораторным исследованиям. - М.: Медицина. - 1964. - 960 с), другое - методом прямой иммунофлюоресценции (см. Кутилин А.В., Дробышевская Э.И., Шаткин А.П. и др. Получение антихламидийных моноклональных антител // Актуальные микробиологические и клинические проблемы хламидийных инфекций. - Москва, 1990. - С.23-25).
При микроскопии препаратов, полученных через 48 часов после инфицирования, клетки желтого тела располагались разрозненно и небольшими группами.
Обращало внимание наличие значительного количества инфекционных частиц как внутри клеток (ретикулярные тельца), так и во внеклеточном пространстве (элементарные тельца), что объясняет обилие этих частиц в клеточной культуре. (Фиг.4, 5).
Через 72 часа в препаратах, полученных после более длительного контакта клеточной линии желтого тела с культурой Chlamydia trachomatis, значительная часть монослоя была разрушена.
Обращало внимание обилие клеток эксплантата с выраженными признаками деструкции, «нашпигованных» ретикулярными тельцами и переходными формами возбудителя. Наблюдалась картина экзоцитоза хламидий, лизиса инфицированных клеток (Фиг.6, 7) на фоне клеточного детрита и голых ядер. Особо привлекали внимание клетки, весь объем которых заполняли зрелые бочонкообразные включения Chlamydia trachomatis с заметным уплотнением поверхностных структур, увеличением периплазматического пространства (Рис.8).
Итак, уже через 72 часа после инфицирования определялись явные признаки лизиса инфицированных клеток желтого тела. Процесс сопровождался освобождением сотен инфекционных частиц хламидий, каждая из которых способна инициировать новый раунд инфекции.
При отсутствии доказательств о различиях между циклом развития инфекционного процесса in vivo от такового in vitro можно предположить, что при естественном инфицировании развитие хламидий происходит аналогичным образом, с продукцией инфекционного потомства.
С целью подтверждения вирулентности культуры клеток желтого тела, инфицированных штаммом Е Chlamydia trachomatis, было выполнено по описанной выше методике несколько повторных заражений монослоя клеток желтых тел. Получен аналогичный первому эксперименту результат.
Пример применения способа.
Ткань желтого тела, выделенного из биопсийного материала в пролиферативную фазу менструального цикла, тщательно гомогенизировали при комнатной температуре в культуральной среде RPMI-1640 («Seromed»).
Полученную клеточную смесь центрифугировали в течение 10 мин при 1000 об/мин на Т-34.
Супернатант удаляли, а осадок клеток отмывали в среде RPMI.
После оценки выделенных клеток в инвертированном микроскопе (MicroStar «Reichert») клеточную взвесь переносили в ростовую среду, содержащую RPMI-1640 с 15% эмбриональной телячьей сывороткой («Seromed»), 2 ммоль/л глутамина и 150 γ/мл гентамицина.
Для выращивания клеток использовали матрацы из нейтрального стекла объемом 100 мл. Ростовую среду вносили в количестве 15 мл.
На 3-и сутки заменяли 1/3 объема среды культивирования.
На 6-й день образовавшийся монослой снимали со стекла 0,02% раствором Версена с хемотрипсином, центрифугировали в течение 10 мин при 1000 об/мин.
После удаления надосадочной жидкости клеточный осадок ресуспендировали в той же среде до дозы 2,0×105 клеток в 1 мл и переносили по 1 мл в пенициллиновые флаконы, на дно которых предварительно помещают покровные стекла размером 7×7 мм.
Через 36 часов ростовую среду удаляли из флаконов, сформировавшийся монослой клеток еще раз промывали той же средой, после чего во флаконы вносили по 40 мл культуры Chlamydia trachomatis, центрифугировали с использованием центрифуги с горизонтальным ротором при 2500 об/мин в течение 1 часа.
После центрифугирования образцы инкубировали при 37°C в течение 72 часов.
Оценку результатов взаимодействия инфекционного агента с клеточной линией производили через 48 часов и по истечении 72 часов.
Для изучения патологического воздействия Chlamydia trachomatis на женские органы репродуктивной системы мы инъецировали суспензию инфицированных Chlamydia trachomatis клеток желтого тела интравагинально самкам белых беспородных крыс:1 группа - 14 крыс в лютеиновой фазе аналогично эксперименту с индукцией бесплодия у самок мышей С3Н (см. Pal S., Hui W., Peterson E.M., de 1a Maza L.M. Factors influencing the induction of infertility in amous model of Chlamydia trachomatis as cending genitaltract infection // J. Med. Microbiol. 1998. - v.47. - N. 7. - P. 599-605), 2 группа - 12 беременных крыс.
Через 6 дней в материале из половых путей всех крыс первой группы получены признаки диссеминации хламидий; у 7 крыс (58,3%) второй группы отмечены выкидыши, у остальных крыс второй группы в дальнейшем получено ослабленное потомство.
Таким образом, в эксперименте in vitro получены данные, подтверждающие способность клеток желтого тела, выделенного из биопсийного материала в пролиферативную фазу менструального цикла, к активному росту и размножению на поверхности покровных стекол.
Показана способность штамма Е Chlamydia trachomatis инфицировать и продуктивно размножаться в первично культивируемых клетках желтого тела, а также чувствительность культуры клеток желтого тела к Chlamydia trachomatis. Более того, инфицированные штаммом Е Chlamydia trachomatis клетки желтого тела способны поддерживать рост хламидий в системе in vitro и in vivo.
По нашему мнению, клетки желтого тела яичника могут служить своеобразной экологической нишей для хламидийной инфекции, являться реальными клетками-хозяевами для них, функционируя в организме как естественный резервуар инфекции. Сами Chlamydia trachomatis могут являться независимым фактором риска, ассоциированным с нарушением гормональной функции яичников.
Изобретение «Способ моделирования воспалительного процесса в тканях репродуктивных органов женщин» является новым, так как оно не известно из уровня техники в области экспериментальной биологии и медицины.
Новизна изобретения состоит в том, что наряду с получением культуры клеток желтого тела производится инфицирование монослоя этих клеток штаммом Е Chlamydia trachomatis, что, в свою очередь, позволяет выявить признаки инфицирования и воспаления.
Технико-экономическая эффективность способа моделирования воспалительного процесса в тканях репродуктивных органов женщин заключается в том, что полученная экспериментальная модель стабильной культуры клеток желтого тела, которую культивировали с Chlamydia trachomatis, представляет собой прямое доказательство взаимосвязи урогенитальной хламидийной инфекции и нарушений функции репродуктивной системы женщин.
Способ моделирования воспалительного процесса в тканях репродуктивных органов женщин, включающий получение клеточной культуры, инфицирование штаммом Е Chlamydia trachomatis, отличающийся тем, что ткань желтого тела, выделенного из биопсийного материала в пролиферативную фазу менструального цикла, гомогенизируют при комнатной температуре в культуральной среде RPMI-1640 «Seromed», затем полученную клеточную смесь центрифугируют в течение 10 минут при 1000 оборотов в минуту, супернатант удаляют, осадок клеток отмывают в среде RPMI, оценивают выделенные клетки в инвертированном микроскопе MicroStar «Reichert» и переносят в ростовую среду, содержащую RPMI-1640 с 15% эмбриональной телячьей сывороткой «Seromed», 2 ммоль/л глутамина и 150 γ/мл гентамицина, для выращивания клеток используют матрацы из нейтрального стекла объемом 100 мл, ростовую среду вносят в количестве 15 мл; на 3-и сутки заменяют 1/3 объема среды культивирования, на 6-й день образовавшийся монослой снимают со стекла 0,02% раствором Версена с хемотрипсином, центрифугируют в течение 10 минут при 1000 оборотов в минуту, удаляют надосадочную жидкость, клеточный осадок ресуспендируют в той же среде до дозы 2,0×10 клеток в 1 мл и переносят по 1 мл в пенициллиновые флаконы, на дно которых предварительно помещают покровные стекла размером 7×7 мм, через 36 часов ростовую среду удаляют из флаконов, сформировавшийся монослой клеток еще раз промывают той же средой, затем во флаконы вносят по 40 мл культуры Chlamydia trachomatis, центрифугируют с использованием центрифуги с горизонтальным ротором при 2500 оборотов в минуту в течение 1 часа, образцы инкубируют при 37°C в течение 72 часов, затем покровные стекла извлекают из флаконов, подсушивают на воздухе и фиксируют охлажденным ацетоном в течение 10 минут, окрашивают и при микроскопии выявляют обилие клеток эксплантата с выраженными признаками деструкции, с ретикулярными тельцами и переходными формами возбудителя, экзоцитоз хламидий, лизис инфицированных клеток на фоне клеточного детрита и голых ядер, присутствие клеток, весь объем которых заполняли зрелые бочонкообразные включения Chlamydia trachomatis с заметным уплотнением поверхностных структур, увеличением периплазматического пространства.