Результат интеллектуальной деятельности: МОДИФИЦИРОВАННЫЕ F ПРОТЕИНЫ SV И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Для данной заявки испрашивается приоритет предварительной заявки на патент США под регистрационным № 61/121126, поданной 9 декабря 2008 г., предварительной заявки под регистрационным № 61/169077, поданной 14 апреля 2009 г., и предварительной заявки под регистрационным № 61/224787, поданной 10 июля 2009 г., каждая из которых во всех аспектах полностью включена в настоящее описание путем ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в целом относится к модифицированным или мутированным слитым (F) протеинам респираторного синцитиального вируса и способам их получения и использования, включая иммуногенные композиции, такие как вакцины, для лечения и/или предотвращения инфекции RSV.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Респираторный синцитиальный вирус (RSV) является членом рода Pneumovirus семейства Paramyxoviridae. Человеческий RSV (HRSV) является ведущим возбудителем тяжелого заболевания нижних дыхательных путей у маленьких детей и ответственен за значительную заболеваемость и смертность у людей. RSV также признан важным возбудителем заболеваний у взрослых и пожилых людей с нарушениями иммунитета. Ввиду неполной устойчивости к RSV у инфицированного хозяина после естественной инфекции RSV может инфицировать множество раз в течение жизни в детском и взрослом возрасте.
Данный вирус имеет геном, состоящий из однонитевой негативно-смысловой РНК, которая тесно ассоциирована с вирусным протеином для образования нуклеокапсида. Вирусная оболочка состоит из липидной двухслойной структуры плазматической мембраны, которая содержит изменчиво кодированные структурные протеины. Вирусная полимераза упаковывается с вирионом и транскрибирует геномную РНК в мРНК. Геном RSV кодирует 3 трансмембранных структурных протеина, F, G и SH, 2 матричных протеина, M и M2, 3 нуклеокапсидных протеина N, P и L, и 2 неструктурных протеина, NSl и NS2.
Считается, что слияние HRSV и клеточных мембран происходит на клеточной поверхности и представляет собой необходимую стадию для передачи вирусного рибонуклеопротеина в клеточную цитоплазму во время ранних стадий инфекции. Данный процесс опосредуется слитым (F) протеином, который также способствует слиянию мембраны инфицированных клеток с мембраной соседних клеток для образования характерного синцития, что представляет собой и выраженный цитопатический эффект, и дополнительный механизм вирусного распространения. Соответственно, нейтрализация активности слияния важна для иммунитета хозяина. Действительно, было показано, что моноклональные антитела, вырабатываемые против F протеина, нейтрализуют инфекционность вируса и ингибируют слияние мембран (Calder et al., 2000, Virology 271: 122-131).
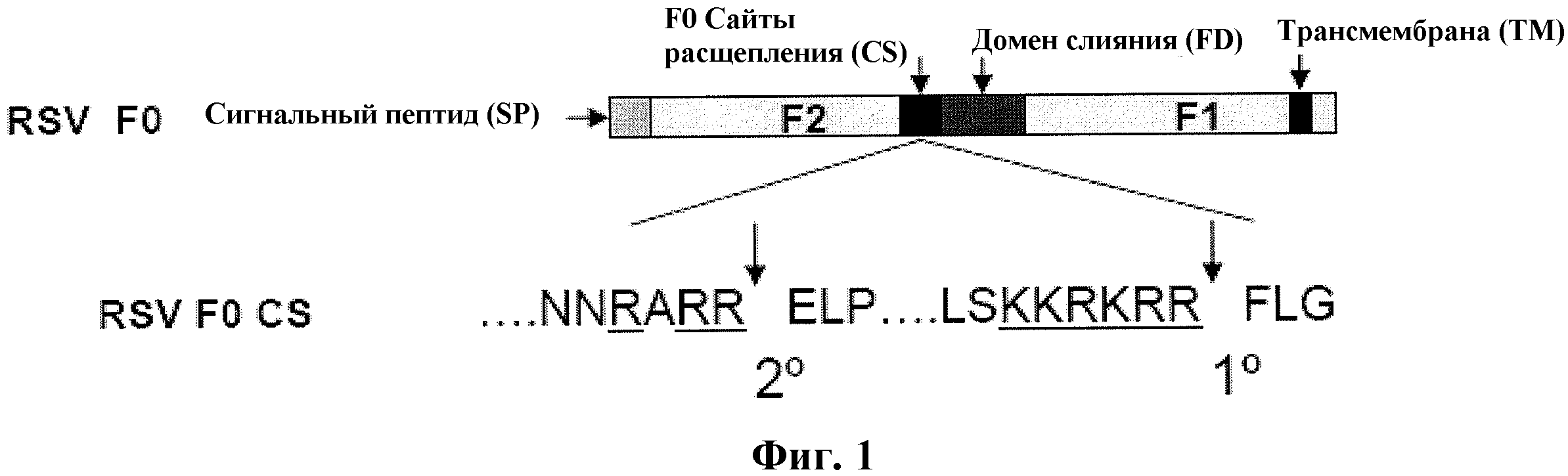
F протеин RSV разделяет структурные признаки и ограниченную, но значимую идентичность аминокислотных последовательностей с F гликопротеинами других парамиксовирусов. Он синтезируется в виде неактивного предшественника из 574 аминокислот (FO), который является котрансляционально гликозилированным на аспарагинах в эндоплазматической сети, где он собирается в гомоолигомеры. Перед достижением клеточной поверхности предшественник FO отщепляется протеазой на F2 от N-конца и Fl от C-конца. Цепи F2 и Fl остаются ковалентно связанными при помощи одной или более дисульфидных связей.
Было обнаружено, что подвергнутые иммуноаффинной очистке F протеины полной длины накапливаются в форме мицелл (также характеризуемых как розетки), подобных тем, которые наблюдаются с другими гликопротеинами вирусной мембраны полной длины (Wrigley et al., 1986, in Electron Microscopy of Proteins, Vol. 5, p. 103-163, Academic Press, London). Под электронным микроскопом молекулы в розетках представляются в виде структур, имеющих форму инвертированных конусообразных палочек (≈70%) или «леденцов на палочке» (≈30%), с их более широкими концами, выступающими из центров розеток. Конформационное состояние в форме палочки связано с F гликопротеином в неактивном состоянии перед слиянием, тогда как конформационное состояние в форме «леденца на палочке» связано с F гликопротеином в активном состоянии после слияния.
Электронная микроскопия может использоваться для дифференцировки между конформациями перед слиянием и после слияния (альтернативно обозначенными как префузогенная и фузогенная), как продемонстрировано Calder et al., 2000, Virology 271:122-131. Конформацию перед слиянием можно также отличить от фузогенной конформации (после слияния) анализами ассоциации липосом. Кроме того, конформацию перед слиянием можно отличить от фузогенной конформации с использованием антител (например, моноклональных антител), которые специфически распознают конформационные эпитопы, присутствующие на одной или другой из префузионной или фузогенной форм F протеина RSV, но не на другой форме. Такие конформационные эпитопы могут быть следствием предпочтительного воздействия антигенной детерминанты на поверхность молекулы. Альтернативно, конформационные эпитопы могут возникать в результате сближения аминокислот, которые являются несмежными в линейном полипептиде.
Ранее было показано, что F предшественник расщепляется в двух сайтах (сайте I, после остатка 109 и сайте II, после остатка 136), обоим из которых предшествуют мотивы, распознаваемые фурин-подобными протеазами. Сайт II смежен со слитым пептидом, и расщепление F протеина в обоих сайтах необходимо для слияния мембран (Gonzalez-Reyes et al., 2001, PNAS 98(17): 9859-9864). Когда расщепление завершается в обоих сайтах, то считается, что имеет переход от конусовидной палочки к палочке в форме «леденца на палочке».
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Как описано в настоящей заявке, заявители обнаружили, что удивительно высокие уровни экспрессии слитого (F) протеина могут быть достигнуты, когда вносятся определенные модификации в структуру F протеина RSV. Такие модификации также неожиданно снижают клеточную токсичность F протеина RSV в клетке-хозяине. Кроме того, модифицированные F протеины по настоящему изобретению демонстрируют улучшенную способность проявлять формирующуюся после слияния морфологию в форме «леденца на палочке» в отличие от наблюдающейся перед слиянием «палочковой» морфологии. Таким образом, в одном аспекте модифицированные F протеины по настоящему изобретению могут также проявлять улучшенную иммуногенность по сравнению с F протеинами дикого типа. Данные модификации могут найти значимое применение в разработке вакцин и способов применения указанных вакцин для лечения и/или предотвращения RSV. Настоящее изобретение относится к рекомбинантным F протеинам RSV, которые демонстрируют увеличенную экспрессию, сниженную клеточную токсичность и/или усиленные иммуногенные свойства по сравнению с F протеинами RSV дикого типа.
В одном аспекте изобретение относится к рекомбинантным F протеинам RSV, содержащим модифицированные или мутированные аминокислотные последовательности по сравнению с F протеинами RSV дикого типа. В целом, эти модификации или мутации увеличивают экспрессию, снижают клеточную токсичность и/или усиливают иммуногенные свойства F протеинов RSV по сравнению с F протеинами RSV дикого типа. В определенных иллюстративных вариантах осуществления F протеины RSV представляют собой человеческие F протеины RSV.
F протеин RSV предпочтительно содержит модифицированную или мутированную аминокислотную последовательность по сравнению с F протеином RSV дикого типа (например, как иллюстрируется в SEQ ID NO: 2). В одном варианте осуществления F протеин RSV содержит модификацию или мутацию в аминокислоте, соответствующей положению P 102 F протеина RSV дикого типа (SEQ ID NO: 2). В другом варианте осуществления F протеин RSV содержит модификацию или мутацию в аминокислоте, соответствующей положению 1379 F протеина RSV дикого типа (SEQ ID NO: 2). В другом варианте осуществления F протеин RSV содержит модификацию или мутацию в аминокислоте, соответствующей положению M447 протеина RSV дикого типа (SEQ ID NO: 2).
В одном варианте осуществления F протеин RSV содержит две или более модификации или мутации в аминокислотах, соответствующих положениям, описанным выше. В другом варианте осуществления F протеин RSV содержит три модификации или мутации в аминокислотах, соответствующих положениям, описанным выше.
В одном определенном варианте осуществления изобретение относится к F протеину RSV, где пролин в положении 102 замещен аланином. В другом варианте осуществления изобретение относится к F протеину RSV, где изолейцин в положении 379 замещен валином. В еще одном варианте осуществления изобретение относится к F протеину RSV, где метионин в положении 447 замещен валином. В определенных вариантах осуществления F протеин RSV содержит две или более модификации или мутации в аминокислотах, соответствующих положениям, описанным в указанных определенных вариантах осуществления. В определенных других вариантах осуществления F протеин RSV содержит три модификации или мутации в аминокислотах, соответствующих положениям, описанным в указанных определенных вариантах осуществления. В иллюстративном варианте осуществления F протеин RSV имеет аминокислотную последовательность, описанную в SEQ ID NO: 4.
В одном варианте осуществления кодирующая последовательность F протеина RSV, кроме того, оптимизирована для усиления его экспрессии в подходящей клетке-хозяине. В одном варианте осуществления клетка-хозяин представляет собой клетку насекомого. В иллюстративном варианте осуществления клетка насекомого представляет собой клетку Sf9.
В одном варианте осуществления кодирующая последовательность гена F RSV с оптимизированным кодоном представляет собой SEQ ID NO: 3. В другом варианте осуществления кодирующая последовательность гена F RSV с оптимизированным кодоном имеет аминокислотную последовательность, описанную в SEQ ID NO: 4.
В одном варианте осуществления F протеин RSV, кроме того, содержит, по меньшей мере, одну модификацию в криптическом поли(A) сайте F2. В другом варианте осуществления F протеин RSV, кроме того, содержит одну или более аминокислотных мутаций в сайте первичного расщепления (CS). В одном варианте осуществления F протеин RSV содержит модификацию или мутацию в аминокислоте, соответствующей положению Rl33 F протеина RSV дикого типа (SEQ ID NO: 2) или F протеина RSV с оптимизированным кодоном (SEQ ID NO: 4). В другом варианте осуществления F протеин RSV содержит модификацию или мутацию в аминокислоте, соответствующей положению Rl35 F протеина RSV дикого типа (SEQ ID NO: 2) или F протеина RSV с оптимизированным кодоном (SEQ ID NO: 4). В еще одном варианте осуществления F протеин RSV содержит модификацию или мутацию в аминокислоте, соответствующей положению Rl36 F протеина RSV дикого типа (SEQ ID NO: 2) или F протеина RSV с оптимизированным кодоном (SEQ ID NO: 4).
В одном определенном варианте осуществления изобретение относится к F протеину RSV, где аргинин в положении 133 замещен глутамином. В другом определенном варианте осуществления изобретение относится к F протеину RSV, где аргинин в положении 135 замещен глутамином. В еще одном определенном варианте осуществления изобретение относится к F протеину RSV, где аргинин в положении 136 замещен глутамином. В определенных вариантах осуществления F протеин RSV содержит две или более модификации или мутации в аминокислотах, соответствующих положениям, описанным в указанных определенных вариантах осуществления. В определенных других вариантах осуществления F протеин RSV содержит три модификации или мутации в аминокислотах, соответствующих положениям, описанным в указанных определенных вариантах осуществления. В иллюстративном варианте осуществления F протеин RSV имеет аминокислотную последовательность, описанную в SEQ ID NO: 6.
В другом варианте осуществления F протеин RSV, кроме того, содержит делецию в N-концевой половине домена слияния, соответствующего аминокислотам 137-146 SEQ ID NO: 2, SEQ ID NO: 4 и SEQ ID NO: 6. В иллюстративном варианте осуществления F протеин RSV имеет аминокислотную последовательность, описанную в SEQ ID NO: 8. В альтернативном варианте осуществления F протеин RSV имеет аминокислотную последовательность, описанную в SEQ ID NO: 10.
Кроме того, в объем изобретения включены F протеины RSV, отличные от человеческого F протеина RSV (SEQ ID NO: 2), которые содержат изменения, соответствующие изменениям, описанным выше. Такие F протеины RSV могут включать без ограничения F протеины RSV из штаммов A человеческого RSV, штаммов B человеческого RSV, штаммов коровьего RSV и штаммов птичьего RSV.
В некоторых вариантах осуществления изобретение относится к модифицированным или мутированным F протеинам RSV, которые демонстрируют увеличенную экспрессию в клетке-хозяине по сравнению с F протеинами RSV дикого типа, такими как F протеин RSV, показанный SEQ ID NO: 2. В других вариантах осуществления изобретение относится к модифицированным или мутированным F протеинам RSV, которые демонстрируют сниженную клеточную токсичность в клетке-хозяине по сравнению с F протеинами RSV дикого типа, такими как F протеин RSV, показанный SEQ ID NO: 2. В еще одних вариантах осуществления изобретение относится к модифицированным или мутированным F протеинам RSV, которые демонстрируют усиленные иммуногенные свойства по сравнению с F протеинами RSV дикого типа, такими как F протеин RSV, показанный SEQ ID NO: 2.
В дополнительных аспектах изобретение относится к иммуногенным композициям, содержащим один или более модифицированных или мутированных F протеинов, как описано в настоящей заявке. В одном варианте осуществления изобретение относится к мицелле, состоящей из одного или более модифицированных или мутированных F протеинов RSV (например, F мицелле RSV).
В другом варианте осуществления изобретение относится к вирусоподобной частице (VLP), содержащей модифицированный или мутированный F протеин RSV. В некоторых вариантах осуществления VLP, кроме того, содержит один или более дополнительных белков.
В одном варианте осуществления VLP, кроме того, содержит матричный (M) протеин. В одном варианте осуществления M протеин происходит из человеческого штамма RSV. В другом варианте осуществления M протеин происходит из коровьего штамма RSV. В других вариантах осуществления матричный протеин может представлять собой Ml протеин из штамма вируса гриппа. В одном варианте осуществления штамм вируса гриппа представляет собой штамм вируса птичьего гриппа. В других вариантах осуществления M протеин может быть получен из штамма вируса ньюкаслской болезни (NDV).
В дополнительных вариантах осуществления VLP, кроме того, содержит гликопротеин G RSV. В другом варианте осуществления VLP, кроме того, содержит гликопротеин SH RSV. В другом варианте осуществления VLP, кроме того, содержит N протеин нуклеокапсида RSV.
Модифицированные или мутированные F протеины RSV могут применяться для профилактики и/или лечения инфекции RSV. Таким образом, в другом аспекте изобретение относится к способу вызова иммунного ответа против RSV. Способ включает введение иммунологически эффективного количества композиции, содержащей модифицированный или мутированный F протеин RSV, индивиду, такому как человек или животное.
В другом аспекте настоящее изобретение относится к фармацевтически приемлемым вакцинным композициям, содержащим модифицированный или мутированный F протеин RSV, или VLP, содержащим модифицированный или мутированный F протеин RSV.
В одном варианте осуществления изобретение относится к иммуногенному составу, содержащему, по меньшей мере, одну эффективную дозу модифицированного или мутированного F протеина RSV. В другом варианте осуществления изобретение относится к иммуногенному составу, содержащему, по меньшей мере, одну эффективную дозу F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV. В еще одном варианте осуществления изобретение относится к иммуногенному составу, содержащему, по меньшей мере, одну эффективную дозу VLP, содержащей модифицированный или мутированный F протеин RSV.
В другом варианте осуществления изобретение относится к фармацевтической упаковке или набору, содержащему один или более контейнеров, заполненных одним или более ингредиентами вакцинных составов по изобретению.
В другом варианте осуществления изобретение относится к способу составления вакцинной или антигенной композиции, которая индуцирует иммунитет к инфекции или, по меньшей мере, к одному ее патологическому симптому у млекопитающего, причем способ включает добавление к составу эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV. В предпочтительном варианте осуществления инфекция представляет собой инфекцию RSV.
Модифицированные или мутированные F протеины RSV по изобретению могут использоваться для получения композиций, которые стимулируют иммунный ответ, который обеспечивает иммунитет или существенный иммунитет в отношении инфекционных агентов. Таким образом, в одном варианте осуществления изобретение относится к способу индукции иммунитета к инфекциям или, по меньшей мере, к одному ее патологическому симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV.
В еще одном варианте осуществления изобретение относится к способу индукции существенного иммунитета к инфекции вирусом RSV или, по меньшей мере, к одному ее патологическому симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV.
Композиции по изобретению могут вызывать существенный иммунитет у позвоночного (например, человека) при введении позвоночному. Таким образом, в одном варианте осуществления изобретение относится к способу индукции существенного иммунитета к инфекции вирусом RSV или, по меньшей мере, к одному ее патологическому симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV. В другом варианте осуществления изобретение относится к способу вакцинации млекопитающего против RSV, включающему введение млекопитающему вызывающего защиту количества модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV.
В другом варианте осуществления изобретение относится к способу индукции защитной реакции антител к инфекции вирусом RSV или, по меньшей мере, к одному ее симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV.
В другом варианте осуществления изобретение относится к способу индукции защитной клеточной реакции к инфекции вирусом RSV или, по меньшей мере, к одному ее патологическому симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV. В другом варианте осуществления изобретение относится к способу индукции защитной клеточной реакции к инфекции вирусом RSV или, по меньшей мере, к одному ее патологическому симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV. В другом варианте осуществления изобретение относится к способу индукции защитной клеточной реакции к инфекции вирусом RSV или, по меньшей мере, к одному ее патологическому симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы VLP, содержащей модифицированный или мутированный F протеин RSV.
В еще одном аспекте изобретение относится к изолированной нуклеиновой кислоте, кодирующей модифицированный или мутированный F протеин RSV по изобретению. В иллюстративном варианте осуществления изолированная нуклеиновая кислота, кодирующая модифицированный или мутированный F протеин RSV, выбрана из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7 или SEQ ID NO: 9.
В еще одном аспекте изобретение относится к изолированной клетке, содержащей нуклеиновую кислоту, кодирующую модифицированный или мутированный F протеин RSV по изобретению. В иллюстративном варианте осуществления изолированная нуклеиновая кислота, кодирующая модифицированный или мутированный F протеин RSV, выбрана из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7 или SEQ ID NO: 9.
В еще одном аспекте изобретение относится к вектору, содержащему нуклеиновую кислоту, кодирующую модифицированный или мутированный F протеин RSV по изобретению. В иллюстративном варианте осуществления изолированная нуклеиновая кислота, кодирующая модифицированный или мутированный F протеин RSV, выбрана из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7 или SEQ ID NO: 9. В одном варианте осуществления вектор представляет собой бакуловирусный вектор.
В еще одном аспекте изобретение относится к способу получения F протеина RSV, включающему (a) трансформацию клетки-хозяина для экспрессии нуклеиновой кислоты, кодирующей модифицированный или мутированный F протеин RSV по изобретению; и (b) культивирование указанной клетки-хозяина в условиях, содействующих продукции указанного F протеина RSV. В одном варианте осуществления нуклеиновая кислота, кодирующая модифицированный или мутированный F протеин RSV, выбрана из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7 или SEQ ID NO: 9. В другом варианте осуществления клетка-хозяин представляет собой клетку насекомого. В еще одном варианте осуществления клетка-хозяин представляет собой клетку насекомого, трансфицированную бакуловирусным вектором, содержащим модифицированный или мутированный F протеин RSV по изобретению.
В еще одном аспекте изобретение относится к способу получения мицеллы F протеина RSV, включающему (a) трансформацию клетки-хозяина для экспрессии нуклеиновой кислоты, кодирующей модифицированный или мутированный F протеин RSV по изобретению; и (b) культивирование указанной клетки-хозяина в условиях, содействующих продукции указанной мицеллы F протеина RSV. В одном варианте осуществления нуклеиновая кислота, кодирующая модифицированный или мутированный F протеин RSV, выбрана из группы, состоящей из SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7 или SEQ ID NO: 9. В одном варианте осуществления клетка-хозяин представляет собой клетку насекомого. В иллюстративном варианте осуществления клетка-хозяин представляет собой клетку насекомого, трансфицированную бакуловирусным вектором, содержащим модифицированный или мутированный F протеин RSV по изобретению.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 изображена структура F0 протеина HRSV дикого типа.
На фиг. 2 изображена структура модифицированного F0 протеина RSV с мутациями сайта расщепления, как описано в примере 3.
На фиг. 3 изображены консервативные замещения (R133Q, R135Q и R136Q) в сайте первичного расщепления модифицированного F протеина HRSV BV #541 (SEQ ID NO: 6).
На фиг. 4 изображена последовательность и структура модифицированного F протеина HRSV BV #541 (SEQ ID NO: 6).
На фиг. 5 изображена последовательность и структура модифицированного F протеина HRSV BV #622 (SEQ ID NO: 10).
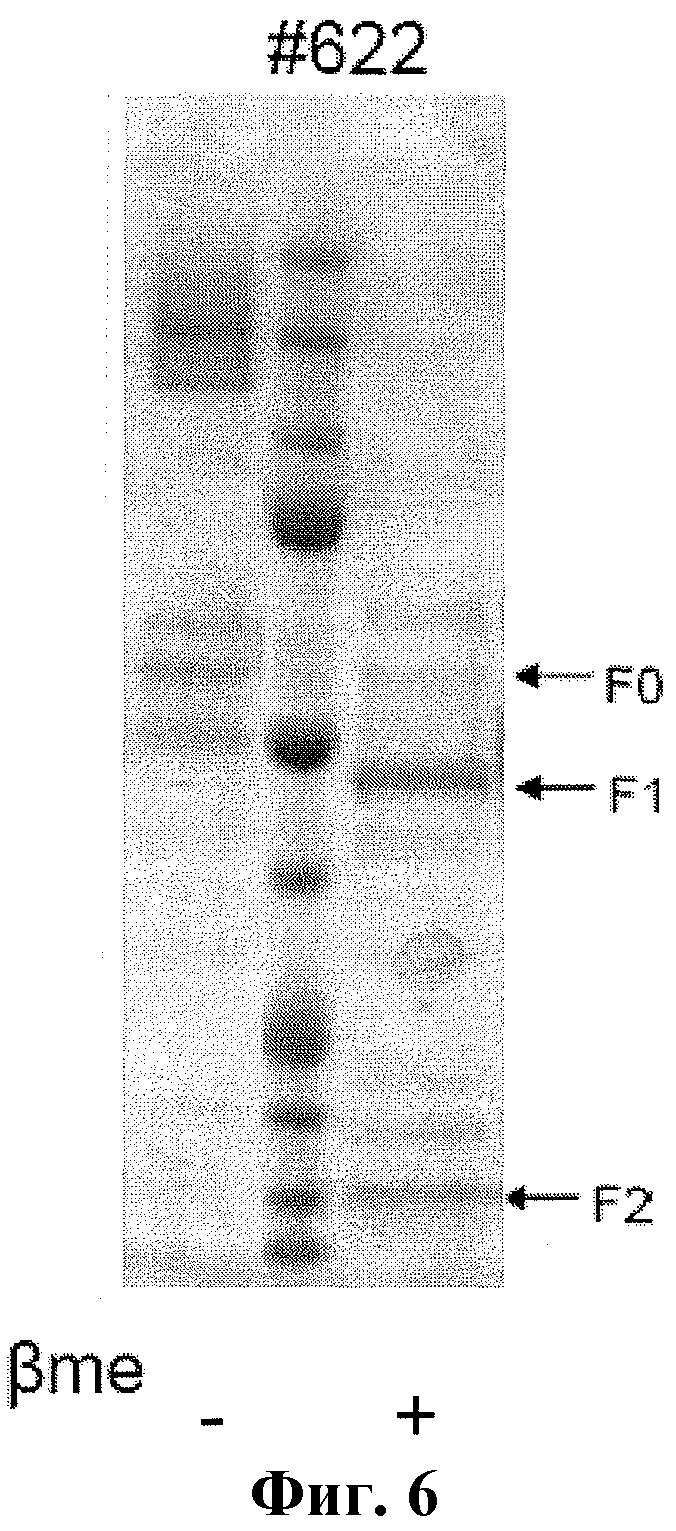
На фиг. 6 изображен окрашенный кумасси гель SDS-PAGE очищенного рекомбинантного F протеина HRSV BV #622 в присутствии βME или без него.
На фиг. 7 изображена структура модифицированного F протеина HRSV BV #683 (SEQ ID NO: 8).
На фиг. 8 изображен окрашенный кумасси гель SDS-PAGE очищенного рекомбинантного F протеина HRSV BV #622 и BV #683 в присутствии βME или без него (слева) и их структуры.
На фиг. 9 изображен окрашенный кумасси гель SDS-PAGE (слева) и вестерн-блот анализ (справа) очищенного рекомбинантного F протеина HRSV BV #683 в присутствии βME или без него.
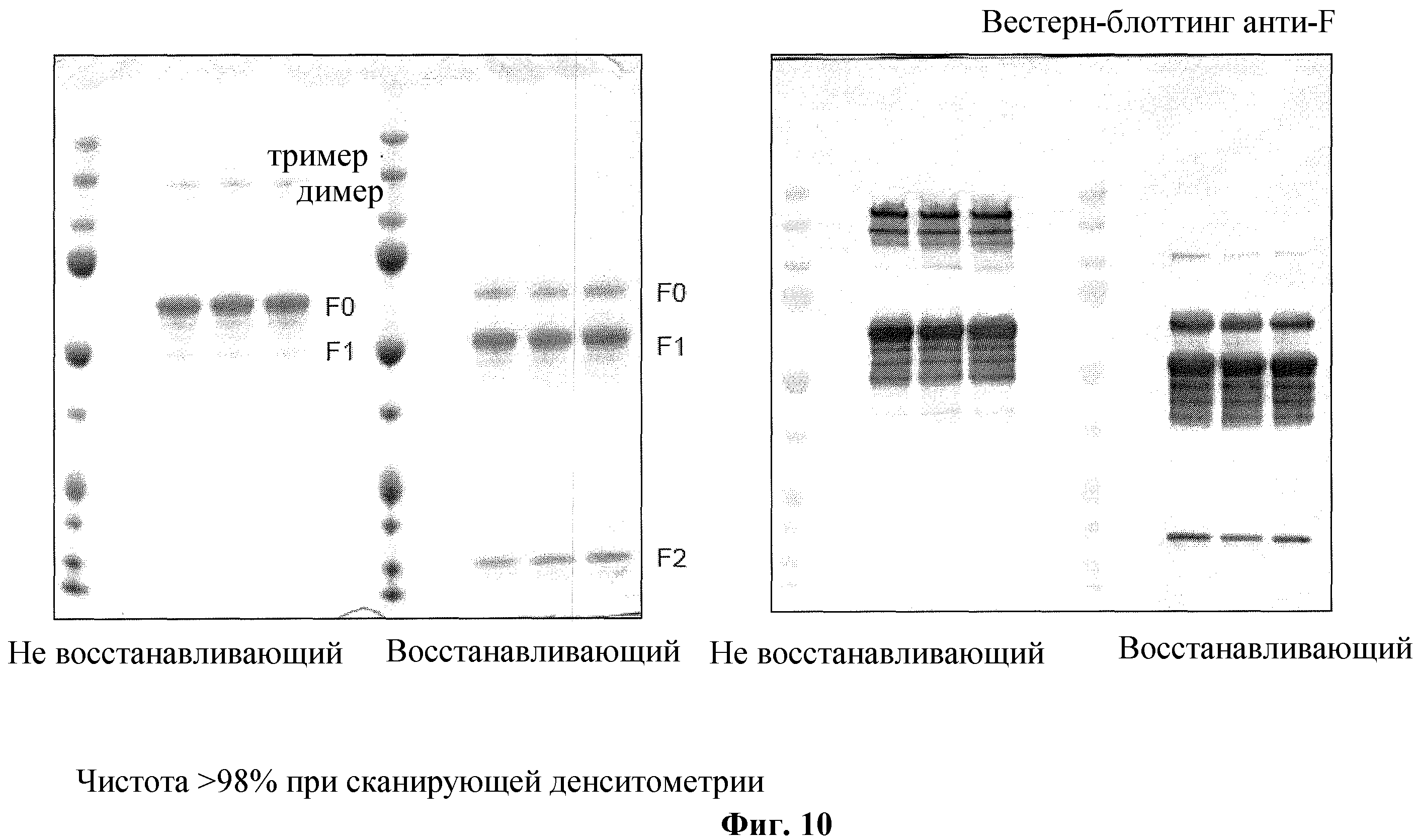
На фиг. 10 изображен окрашенный кумасси гель SDS-PAGE, используемый при анализе чистоты сканирующей денситометрией (слева) и вестерн-блоттингом (справа) очищенного рекомбинантного F протеина HRSV BV #683.
На фиг. 11 показаны изображения мицелл (розеток) очищенного рекомбинантного F протеина HRSV BV #683, полученные при электронной микроскопии с негативным окрашиванием.
На фиг. 12 изображен анализ размера частиц мицелл F протеина HRSV BV #683.
На фиг. 13 изображен окрашенный кумасси гель SDS-PAGE (слева) и вестерн-блот анализ (справа) модифицированного F протеина HRSV BV #622 и BV #623 (SEQ ID NO:21) с коэкспрессией с протеинами N HRSV и M BRSV и без нее в сборах (внутриклеточных) неочищенной клеточной культуры или образцах осадка клеток после центрифугирования разделением в 30% градиенте сахарозы и структуры BV #622 и BV #623.
На фиг. 14 изображен окрашенный кумасси гель SDS-PAGE (слева) и вестерн-блот анализ (справа) модифицированного F протеина HRSV BV #622, двойного тандемного химерного BV#636 (BV #541 + M BRSV), BV #683, BV #684 (BV #541 с L-доменом YIAL) и BV#685 (BV #541 с L-доменом YKKL) с коэкспрессией с протеинами N HRSV и M BRSV и без нее в сборах (внутриклеточных) неочищенной клеточной культуры или образцах осадка клеток после центрифугирования с коэкспрессией с протеинами N HRSV и M BRSV и без нее в сборах (внутриклеточных) и структура каждого анализированного модифицированного F протеина HRSV.
На фиг. 15 изображен окрашенный кумасси гель SDS-PAGE (слева) и вестерн-блот анализ (справа) модифицированного F протеина RSV BV #622 (SEQ ID NO: 10), двойного тандемного химерного BV#636 (BV #541 + M BRSV), BV #683 (SEQ ID NO: 8), BV #684 (BV #541 с L-доменом YIAL) и BV#685 (BV #541 с L-доменом YKKL) с коэкспрессией с протеинами N HRSV и M BRSV и без нее в образцах клеточного осадка после центрифугирования разделением в 30% градиенте сахарозы и структура каждого анализированного F протеина HRSV.
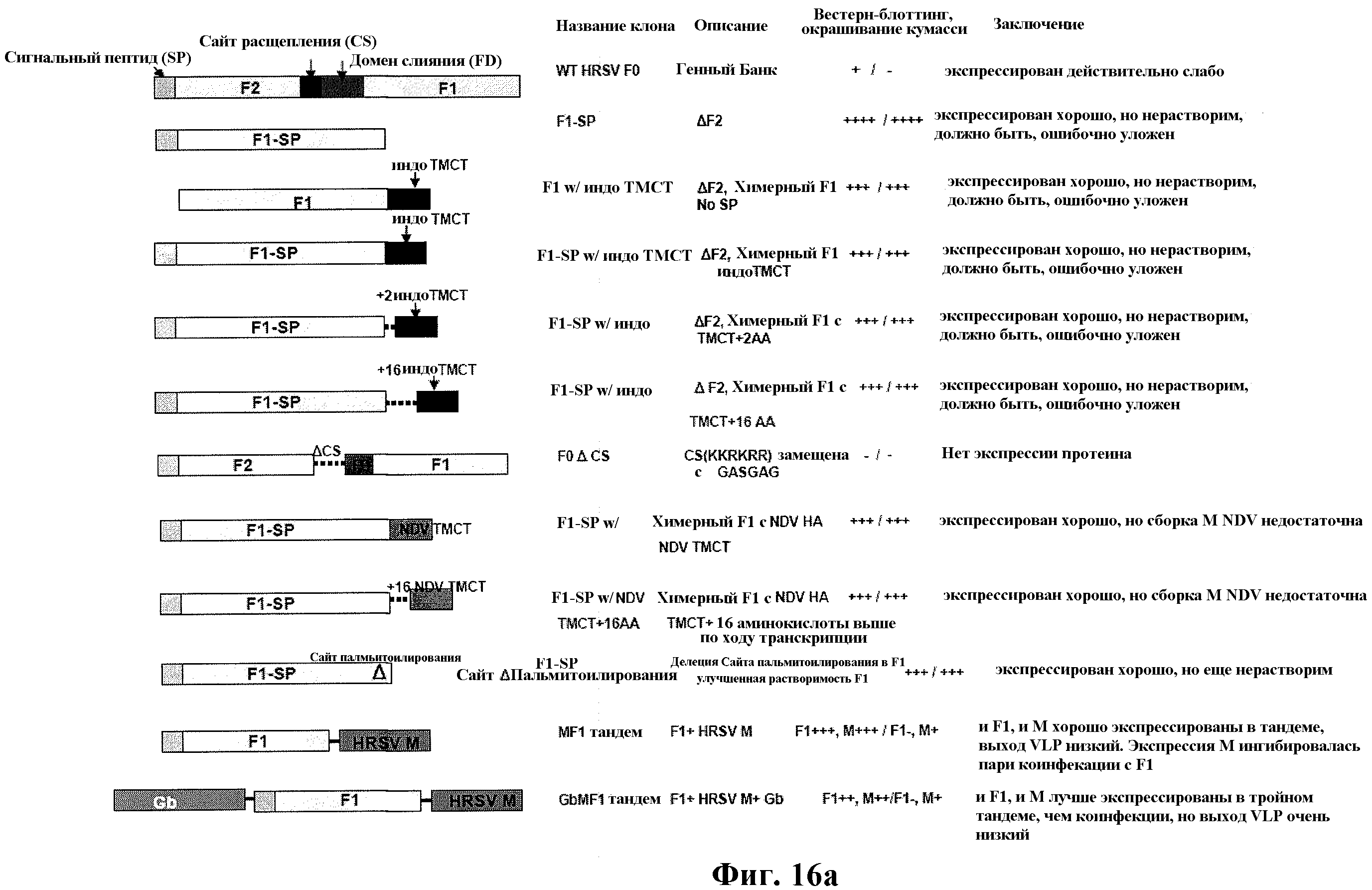
На фиг. 16 изображена структура, название клона. Описание, результаты вестерн-блоттинга и SDS-PAGE с окрашиванием кумасси и заключение для каждого модифицированного F протеина RSV, как описано в примере 9.
На фиг. 17 изображены экспериментальные процедуры исследования с контрольным заражением RSV, как описано в примере 10.
На фиг. 18 изображены результаты анализа нейтрализации RSV в 31-й и 46-й день у мышей, иммунизированных PBS, живым RSV, FI-RSV, 1 мг PFP, 1 мг PFP + квасцами, 10 мг PFP, 10 мг PFP + квасцами, 30 мг PFP, и положительный контроль (овечье анти-F антитело).
На фиг. 19 изображены титры RSV в легочных тканях мышей, иммунизированных PBS, живым RSV, FI-RSV, 1 мг PFP, 1 мг PFP + квасцами, 10 мг PFP, 10 мг PFP + квасцами, 30 мг PFP, через 4 дня после контрольного заражения инфекционным RSV.
На фиг. 20 изображен гель SDS-PAGE, окрашенный кумасси, очищенного рекомбинантного F протеина RSV BV #683, хранившегося при 2 - 8°C в течение 0, 1, 2, 4 и 5 недель.
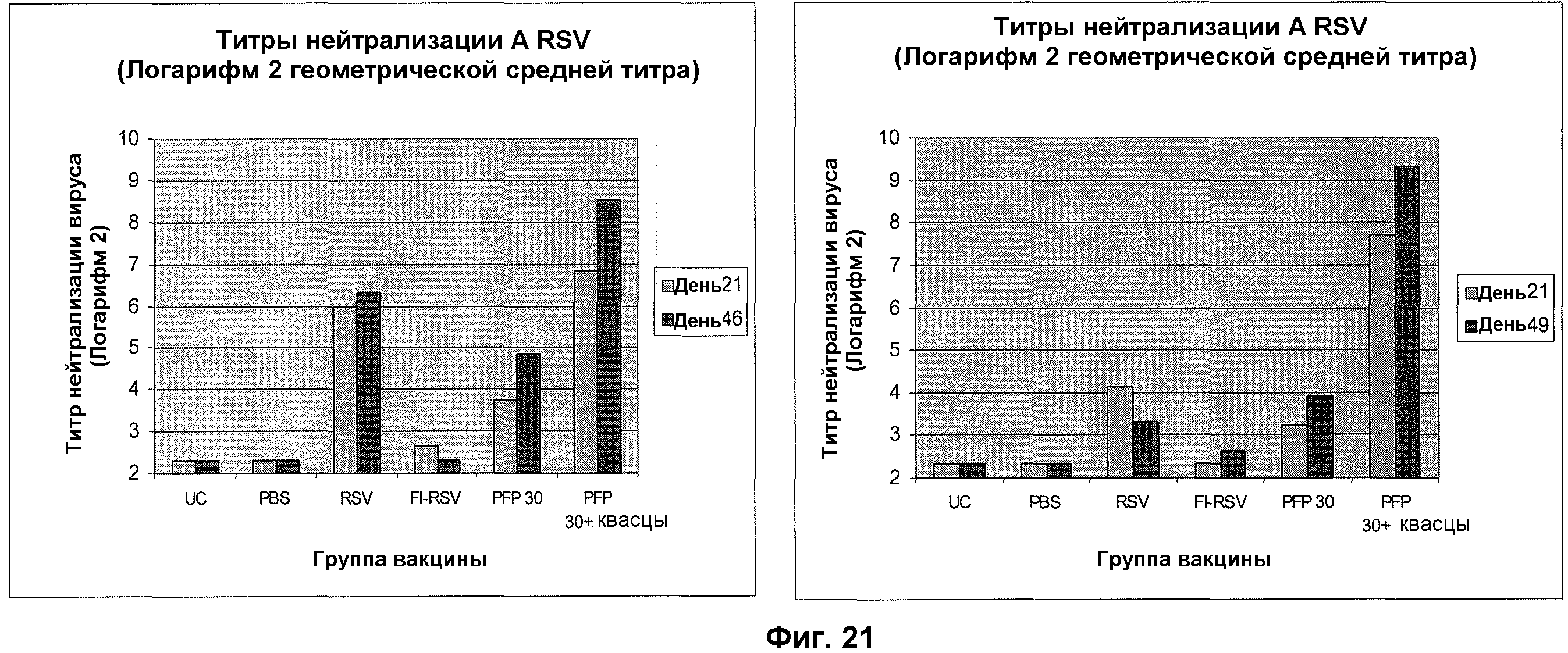
На фиг. 21 изображены реакции нейтрализующих антител RSV A и RSV B после иммунизации живым RSV (RSV), RSV, инактивированным формалином (FI-RSV), RSV-F протеином BV #683 с алюминием и без него (PFP и PFP + Алюминиевый адъювант) и контроли PBS.
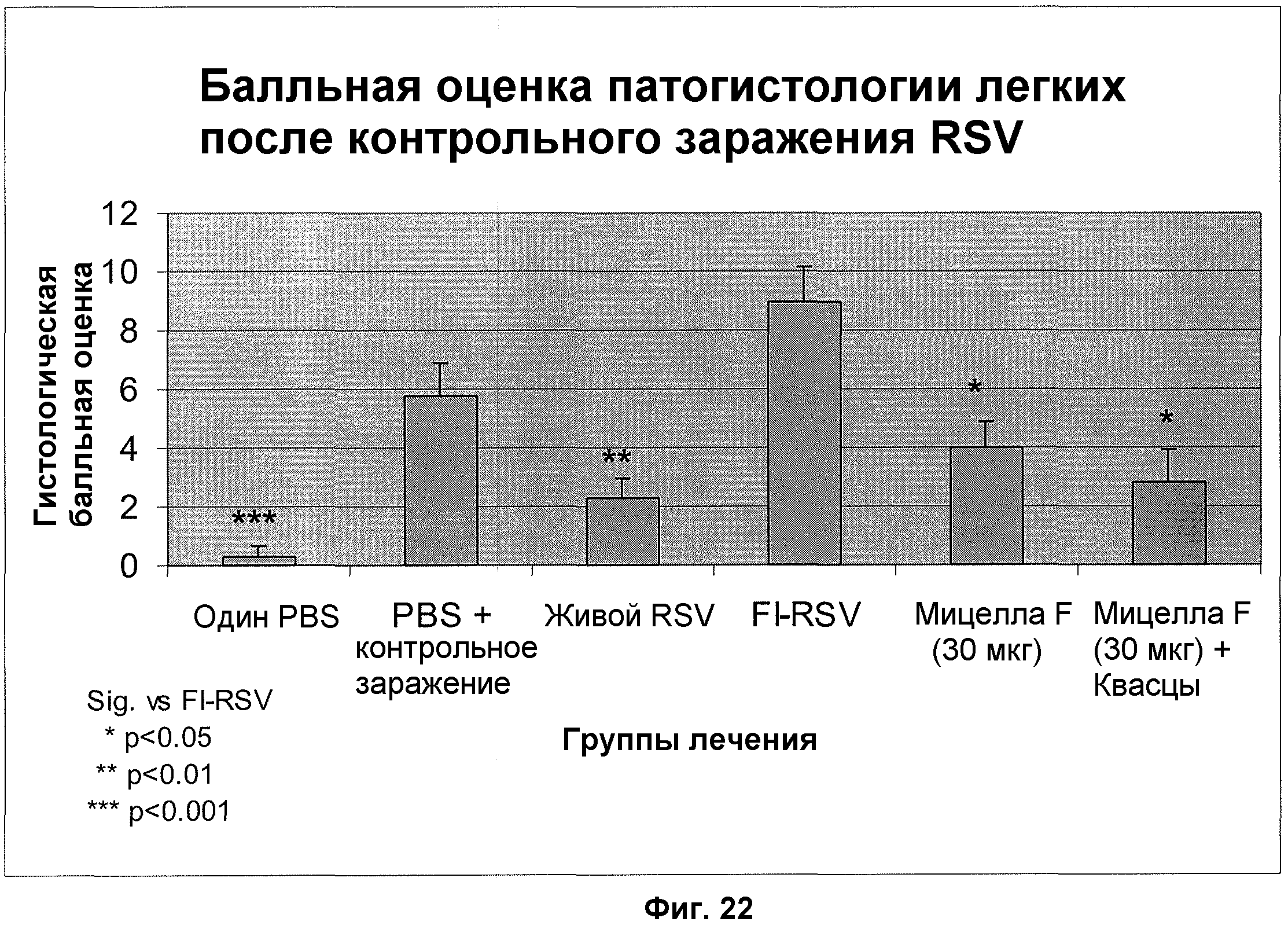
На фиг. 22 изображена легочная патология после контрольного заражения RSV у крыс, иммунизированных живым RSV, RSV, инактивированным формалином (FI-RSV), RSV-F протеином BV #683 с алюминием и без него (F-мицелла (30 мг) и F-мицелла (30 мг) + Алюминиевый адъювант), и контроли PBS.
ДЕТАЛЬНОЕ ОПИСАНИЕ
ОПРЕДЕЛЕНИЯ
Используемый в настоящем описании термин «адъювант» относится к соединению, которое при использовании в комбинации со специфическим иммуногеном (например, модифицированным или мутированным F протеином RSV, F мицеллой RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV) в составе усилит или иным образом изменит или модифицирует итоговый иммунный ответ. Модификация иммунного ответа включает интенсификацию или расширение специфичности каждой или обоих из реакции антител и клеточной иммунной реакции. Модификация иммунного ответа может также означать уменьшение или подавление определенных антиген-специфических иммунных реакций.
Используемый в настоящем описании термин «антигенный состав» или «антигенная композиция» относится к препарату, который при введении позвоночному, в частности птице или млекопитающему, вызывает иммунный ответ.
Используемый в настоящем описании термин «вирус птичьего гриппа» относится к вирусам гриппа, обнаруживаемым главным образом у птиц, но может также инфицировать людей или других животных. В некоторых случаях вирусы птичьего гриппа могут передаваться или распространяться от одного человека к другому. Вирус птичьего гриппа, который инфицирует людей, может вызвать пандемию гриппа, т.е. заболеваемость и/или смертность у людей. Пандемия возникает, когда появляется новый штамм вируса гриппа (вируса, к которому нет естественного иммунитета), распространяясь за пределы отдельных участков, возможно, по всему миру, и сразу инфицируя многих людей.
Используемый в настоящем описании термин «эффективная доза» в целом относится к количеству модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV по изобретению, достаточному для индукции иммунитета, для предотвращения и/или облегчения инфекции или для уменьшения, по меньшей мере, одного симптома инфекции или заболевания, и/или для усиления эффективности другой дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV. Эффективная доза может относиться к количеству модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV, достаточному для задержки или минимизации начала инфекции или заболевания. Эффективная доза может также относиться к количеству модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV, которое обеспечивает терапевтический эффект при лечении или борьбе с инфекцией или заболеванием. Кроме того, эффективная доза представляет собой количество в отношении модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV, по изобретению отдельно или в комбинации с другими способами лечения, которое обеспечивает терапевтический эффект при лечении или борьбе с инфекцией или заболеванием. Эффективная доза может также представлять собой количество, достаточное для усиления собственного иммунного ответа индивида (например, человека) против последующего воздействия инфекционного агента или заболевания. Уровни иммунитета можно контролировать, например, измерением количеств нейтрализующих секреторных и/или сывороточных антител, например нейтрализацией бляшек, фиксацией комплемента, ферментным иммуносорбентным анализом или анализом микронейтрализации, или измерением клеточных реакций, таких как без ограничения цитотоксические T-клетки, антигенпредставляющие клетки, хелперные T-клетки, дендритные клетки, и/или других клеточных реакций. T-клеточные реакции могут контролироваться, например, измерением, например, количества присутствующих клеток CD4+ и CD8+ с использованием специфических маркеров флуоресцентной проточной цитометрией или анализом T-клеток, таким как без ограничения анализ пролиферации T-клеток, цитотоксический анализ T-клеток, тетрамерный анализ (TETRAMER) и/или ферментный иммуносорбентный анализ пятна (ELISPOT-анализ). В случае вакцины «эффективная доза» представляет собой дозу, которая предотвращает заболевание и/или снижает тяжесть симптомов.
Используемый в настоящем описании термин «эффективная доза» в целом относится к количеству модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV, необходимому или достаточному для осуществления желательного биологического эффекта. Эффективное количество композиции представляет собой количество, которое обеспечивает достижение выбранного результата, и специалист в данной области может определить такое количество обычным экспериментированием. Например, эффективное количество для предотвращения, лечения и/или облегчения течения инфекции может представлять собой то количество, которое необходимо для вызова активации иммунной системы, приводя к развитию антиген-специфического иммунного ответа после воздействия модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV по изобретению. Термин также синономичен с «достаточным количеством».
Используемый в настоящем описании термин «экспрессия» относится к способу, посредством которого полинуклеиновые кислоты транскрибируются в мРНК и транслируются в пептиды, полипептиды или протеины. Если полинуклеиновая кислота происходит из геномной ДНК, то экспрессия, если выбрана соответствующая эукариотическая клетка-хозяин или организм, может включать сплайсинг мРНК. В контексте настоящего изобретения термин также охватывает выход мРНК гена F RSV и F протеинов RSV, достигаемый после их экспрессии.
Используемый в настоящем описании термин «F протеин», или «слитый протеин», или «полипептид слитого протеина» относится к полипептиду или протеину, имеющему всю или часть аминокислотной последовательности полипептида слитого белка RSV. Аналогичным образом, термин «G протеин» или «полипептид G протеина» относится к полипептиду или протеину, имеющему всю или часть аминокислотной последовательности полипептида протеина прикрепления. Были описаны и специалистам в данной области известны многочисленные слитые протеины и протеины прикрепления RSV. В документе WO/2008/114149, который полностью включен в настоящее описание путем ссылки, описаны иллюстративные варианты F и G протеинов (например, естественно встречающиеся варианты).
Используемый в настоящем описании термин «иммуногены» или «антигены» относится к веществам, таким как протеины, пептиды, нуклеиновые кислоты, которые способны вызывать иммунный ответ. Оба термина также включают эпитопы и используются взаимозаменяемо.
Используемый в настоящем описании термин «иммуностимулятор» относится к соединению, которое усиливает иммунный ответ через собственных химических посредников организма (цитокины). Данные молекулы содержат различные цитокины, лимфокины и хемокины с иммуностимулирующей, иммунопротективной и провоспалительной активностями, такие как интерфероны (IFN-γ), интерлейкины (например, IL-I, IL-2, IL-3, IL-4, IL-12, IL-13); факторы роста (например, фактор, стимулирующий колонии (CSF) гранулоцитов-макрофагов (GM) (GM-CSF)); и другие иммуностимулирующие молекулы, такие как макрофагальный воспалительный фактор, лиганд Flt3, B7.1; B7.2 и т.д. Иммуностимулирующие молекулы могут вводиться в том же составе, что и VLP по изобретению, или могут вводиться отдельно, или протеин, или вектор экспрессии, кодирующий протеин, может вводиться для обеспечения иммуностимулирующего эффекта.
Используемый в настоящем описании термин «иммуногенный состав» относится к препарату, который при введении позвоночному, например млекопитающему, вызывает иммунный ответ.
Используемый в настоящем описании термин «инфекционный агент» относится к микроорганизмам, которые вызывают инфекцию у позвоночного. Обычно организмы представляют собой вирусы, бактерии, паразиты, простейшие и/или грибы.
Используемые в настоящем описании термины «мутированный», «модифицированный» или «модификация» указывают на модификацию нуклеиновой кислоты и/или полипептида, которая приводит к получению измененной нуклеиновой кислоты или полипептида. Мутации включают, например, точечные мутации, делеции или вставки одного или множества остатков в полинуклеотиде, которые включают изменения, возникающие в пределах кодирующей протеин области гена, а также изменения в областях, находящихся вне кодирующей протеин последовательности, такой как без ограничения регуляторные или промотерные последовательности. Генетическое изменение может представлять собой мутацию любого типа. Например, мутация может составлять точечную мутацию, мутацию «сдвига рамки», вставку или делецию части или всего гена. В некоторых вариантах осуществления мутации являются результатами давления искусственной мутации. В еще одних вариантах осуществления мутации в F протеинах RSV являются результатом генетической инженерии.
Используемый в настоящем описании термин «мультивалентные» относится к композициям, которые имеют один или более антигенных протеинов/пептидов или иммуногенов против множественных типов или штаммов инфекционных агентов или заболеваний.
Используемый в настоящем описании термин «фармацевтически приемлемая вакцина» относится к препаративной форме, которая содержит модифицированный или мутированный F протеин RSV, F мицеллу RSV, содержащую модифицированный или мутированный F протеин RSV, или VLP, содержащую модифицированный или мутированный F протеин RSV по настоящему изобретению, которая представлена в форме, которая может вводиться позвоночному, и которая индуцирует защитный иммунный ответ, достаточный для вызова иммунитета для предотвращения и/или уменьшения, по меньшей мере, одного симптома инфекции или заболевания и/или усиления эффективности другой дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV. Обычно вакцина содержит среду в виде обычного солевого или забуференного водного раствора, в котором суспендируется или растворяется композиция по настоящему изобретению. В данной форме композиция по настоящему изобретению может подходящим образом применяться для предотвращения, облегчения или иного лечения инфекции. После введения хозяину вакцина способна спровоцировать иммунный ответ, включая без ограничения продукцию антител и/или цитокинов и/или активации цитотоксических T-клеток, антигенпредставляющих клеток, хелперных T-клеток, дендритных клеток и/или других клеточных реакций.
Используемая в настоящем описании фраза «защитный иммунный ответ» или «защитный ответ» относится к иммунному ответу, опосредованному антителами против инфекционного агента или заболевания, которое проявляется у позвоночного (например, человека), и который предотвращает или облегчает инфекцию или уменьшает, по меньшей мере, один ее симптом. Модифицированный или мутированный F протеин RSV, F мицелла RSV, содержащая модифицированный или мутированный F протеин RSV, или VLP, содержащая модифицированный или мутированный F протеин RSV по изобретению, может стимулировать продукцию антител, которые, например, нейтрализуют инфекционные агенты, блокируют поступление инфекционных агентов в клетки, блокируют репликацию инфекционных агентов и/или защищают клетки-хозяева от инфекции и разрушения. Данный термин может также относиться к иммунному ответу, который опосредуется T-лимфоцитами и/или другими лейкоцитами против инфекционного агента или заболевания, проявляемого у позвоночного (например, человека), который предотвращает или облегчает инфекцию или заболевание или уменьшает, по меньшей мере, один их симптом.
Используемый в настоящем описании термин «позвоночное», или «индивид», или «пациент» относится к любому члену подтипа хордовых, включая без ограничения людей и других приматов, включая нечеловекообразных приматов, таких как шимпанзе и другие виды обезьян. Неограничивающими примерами также являются сельскохозяйственные животные, такие как крупный рогатый скот, овцы, свиньи, козы и лошади; домашние животные, такие как собаки и кошки; лабораторные животные, включая грызунов, таких как мыши, крысы (включая хлопковых крыс) и морские свинки; птицы, включая домашних, диких и охотничье-промысловых птиц, таких как куры, индюшки и другие куриные птицы, утки, гуси и тому подобные. Термины «млекопитающие» и «животные» включены в данное определение. Предполагается включение и взрослых, и новорожденных индивидов. В частности, грудные и маленькие дети являются соответствующими индивидами или пациентами для вакцины RSV.
Используемый в настоящем описании термин «вирусоподобная частица» (VLP) относится к структуре, которая, по меньшей мере, в одном признаке напоминает вирус, но инфекционная способность которой не была продемонстрирована. Вирусоподобные частицы в соответствии с изобретением не несут генетическую информацию, кодирующую протеины вирусоподобных частиц. В целом, вирусные частицы лишены вирусного генома и поэтому являются неинфекционными. Кроме того, вирусоподобные частицы могут часто продуцироваться в больших количествах гетерологичной экспрессией и могут быть легко очищены.
Используемый в настоящем описании термин «химерная VLP» относится к VLP, которые содержат протеины или их части, по меньшей мере, из двух различных инфекционных агентов (гетерологичные протеины). Обычно один из протеинов происходит из вируса, который может запустить образование VLP из клеток-хозяев. Примерами в целях иллюстрации являются M протеин BRSV и/или G или F протеины HRSV. При целесообразности термины VLP RSV и химерные VLP могут использоваться взаимозаменяемо.
Используемый в настоящем описании термин «вакцина» относится к препарату из мертвых или ослабленных патогенов или из дериватизированных антигенных детерминант, который используется для индукции образования антител или иммунитета против патогена. Вакцина вводится для обеспечения иммунитета к заболеванию, например гриппу, который вызван вирусами гриппа. Кроме того, термин «вакцина» также относится к суспензии или раствору иммуногена (например, модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV), который вводится позвоночному для продукции защитного иммунитета, т.е. иммунитета, который предотвращает или снижает тяжесть заболевания, связанного с инфекцией. Настоящее изобретение относится к вакцинным композициям, которые являются иммуногенными и могут обеспечить защиту против заболевания, связанного с инфекцией.
F ПРОТЕИНЫ RSV
Два структурных мембранных протеина, F и G протеины, экспрессированы на поверхности RSV, и было показано, что они являются мишенями нейтрализующих антител (Sullender, W., 2000, Clinical Microbiology Review 13, 1-15). Эти два протеина также в первую очередь ответственны для распознавания вирусами и входа в клетки-мишени; G протеин связывается со специфическим клеточным рецептором, а F протеин способствует слиянию вируса с клеткой. F протеин также экспрессирован на поверхности инфицированных клеток и ответственен за последующее слияние с другими клетками, приводя к образованию синцития. Таким образом, антитела для F протеина могут нейтрализовать вирус или блокировать вход вируса в клетку или предотвратить образования синцития. Хотя антигенные и структурные различия между A и B подтипами были описаны и для G, и для F протеинов, более значимые антигенные различия присущи G протеину, где аминокислотные последовательности лишь на 53% гомологичны и антигенное родство составляет 5% (Walsh et al. (1987) J. Infect. Dis. 155, 1198-1204; and Johnson et al. (1987) Proc. Natl. Acad. Sci. USA 84, 5625-5629). Наоборот, антитела, выработанные против F протеина, проявляют высокую степень перекрестной реактивности среди вирусов подтипа A и B.
F протеин RSV направляет проникновение RSV слиянием между протеином оболочки вириона и плазматической мембраной клетки-хозяина. Позднее при инфекции F протеин, экспрессированный на клеточной поверхности, может опосредовать слияние с соседними клетками для образования синцития. F протеин представляет собой трансмембранный поверхностный протеин I типа, который имеет N-концевой расщепленный сигнальный пептид и мембранный якорь около C-конца. F RSV синтезируется в виде неактивного F0 предшественника, который собирается в гомотример и активируется расщеплением в транс-Гольджи комплексе клеточной эндопротеазой для выхода двух связанных дисульфидом субъединиц, субъединиц F1 и F2. N-конец субъединицы F1, которая создается расщеплением, содержит гидрофобный домен (слитый пептид), который вставляется непосредственно в мембрану-мишень для инициации слияния. Субъединица F1 также содержит гептадные повторы, которые соединяются во время слияния, запуская конформационный сдвиг, который тесно сближает вирусные и клеточные мембраны (Collins and Crowe, 2007, Fields Virology, 5th ed., D.M Kipe et al., Lipincott, Williams and Wilkons, p. 1604). SEQ ID NO: 2 (№ доступа в Генном Банке AAB59858) изображает репрезентативный F протеин RSV, который кодируется геном, показанным в SEQ ID NO: 1 (№ доступа в Генном Банке Ml1486).
В природе F протеин RSV экспрессирован в виде одного полипептидного предшественника длиной 574 аминокислоты, обозначенного как FO. In vivo FO олигомеризуется в эндоплазматическом ретикулуме и протеолитически обрабатывается фурин-протеазой в двух консервативных консенсусных последовательностях фурина (сайты расщепления фурина), RARR (SEQ ID NO: 23) (вторичная) и KKRKRR (SEQ ID NO: 24) (первичная), для генерирования олигомера, состоящего из двух связанных дисульфидом фрагментов. Меньший из этих фрагментов называется F2 и происходит из N-концевой части предшественника FO. Специалистам в данной области понятно, что в научной литературе аббревиатуры FO, Fl и F2 обычно обозначаются как F0, F1 и F2. Больший, C-концевой фрагмент Fl прикрепляет F протеин в мембране через последовательность гидрофобных аминокислот, которые примыкают к цитоплазматическому хвосту длиной 24 аминокислоты. Три F2-F1 димера соединяются для образования зрелого F протеина, который принимает метастабильную префузогенную («префузионную») конформацию, которая запускается для подвергания конформационному изменению после контакта с мембраной клетки-мишени. Конформационное изменение обнажает гидрофобную последовательность, известную как слитый пептид, который ассоциируется с мембраной клетки-мишени и содействует слиянию мембраны вируса или инфицированной клетки с мембраной клетки-мишени.
Фрагмент Fl содержит, по меньшей мере, два домена гептадных повторов, обозначенных как HRA и HRB, и расположен поблизости соответственно к слитому пептиду и якорным доменам. В перфузионной конформации димер F2-F1 образует глобулярную головку и стебельную структуру, в которой домены HRA находятся в сегментированной (растянутой) конформации в глобулярной головке. Напротив, домены HRB образуют трехнитевой скрученный спиральный стебель, простирающийся от области головки. Во время перехода от префузионной к постфузионной конформации домены HRA спадаются и сближаются с доменами HRB для образования антипараллельного шестиспирального пучка. В постфузионном состоянии слитый пептид и трансмембранные домены расположены в наложении для облегчения мембранного слияния.
Хотя представленное выше конформационное описание основывается на молекулярном моделировании кристаллографических данных, структурные различия между префузионной и постфузионной конформациями могут контролироваться без использования кристаллографии. Например, для дифференцировки префузионной и постфузионной (альтернативно обозначенных как префузогенная и фузогенная) конформаций может использоваться электронная микрография, как продемонстрировано в публикациях Calder et al., Virology, 271:122-131 (2000) и Morton et al., Virology, 311:275-288, которые включены в настоящее описание путем ссылки ввиду их технологических положений. Префузионную конформацию можно также отличить от фузогенной (постфузионной) конформации анализами ассоциации липосом, как описано в публикации Connolly et al., Proc. Natl. Acad. Sci. USA, 103:17903-17908 (2006), которая также включена в настоящее описание путем ссылки ввиду ее технологических положений. Кроме того, префузионная и фузогенная конформации могут дифференцироваться с использованием антител (например, моноклональных антител), которые специфически распознают конформационные эпитопы, присутствующие на одной или другой из префузионной или фузогенной формы F протеина RSV, но не на другой форме. Такие конформационные эпитопы могут быть вследствие преимущественного воздействия антигенной детерминанты на поверхность молекулы. Альтернативно, конформационные эпитопы могут возникнуть в результате наложения аминокислот, которые не являются смежными в линейном полипептиде.
МОДИФИЦИРОВАННЫЕ ИЛИ МУТИРОВАННЫЕ F ПРОТЕИНЫ RSV
Заявители обнаружили, что удивительно высокие уровни экспрессии слитого (F) белка могут быть достигнуты, когда специфические модификации вносятся в структуру F протеина RSV. Такие модификации также неожиданно снижают клеточную токсичность F протеина RSV в клетке-хозяине. Кроме того, модифицированные F протеины по настоящему изобретению демонстрируют улучшенную способность проявлять постфузионную морфологию «леденца на палочке» в отличие от префузионной «палочковой» морфологии. Таким образом, в одном аспекте модифицированные F протеины по настоящему изобретению могут также проявлять улучшенную (например, усиленную) иммуногенность по сравнению с F протеинами дикого типа (например, иллюстрируемый SEQ ID NO: 2, который соответствует № доступа в Генном Банке AAB59858). Данные модификации имеют значимое применение при разработке вакцин и способов применения указанных вакцин для лечения и/или предотвращения RSV.
В соответствии с изобретением и в предпочтительном аспекте в нативные или дикого типа F протеины RSV могут быть внесены множественные мутации с тем, чтобы в результате улучшить экспрессию и/или иммуногенные свойства по сравнению с нативными или дикого типа F протеинами RSV. Такие мутации включают точечные мутации, мутации «сдвига рамки», делеции и вставки, причем предпочтительны одна или более (например, 1, 2, 3 или 4 и т.д.) мутаций.
Полипептид нативного F протеина может быть выбран из любого F протеина штамма A RSV, штамма B RSV, штамма A HRSV, штамма B HRSV, штамма BRSV, или штамма птичьего RSV, или из их вариантов (как определено выше). В определенных иллюстративных вариантах осуществления полипептид нативного F протеина представляет собой F протеин, представленный SEQ ID NO: 2 (№ доступа в Генном Банке AAB59858). Для облегчения понимания настоящего описания положения аминокислотных остатков, независимо от штамма, даны в отношении (то есть положение аминокислотного остатка соответствует) положения аминокислоты иллюстративного F протеина. Средние специалисты в данной области могут легко определить сравнимые положения аминокислот F протеина из других штаммов RSV совмещением аминокислотных последовательностей выбранного штамма RSV с иллюстративной последовательностью с использованием общедоступных и хорошо известных алгоритмов совмещения (таких, как BLAST, например, с использованием параметров по умолчанию). Многочисленные дополнительные примеры полипептидов F протеина из различных штаммов RSV описаны в документе WO/2008/114149 (который полностью включен в настоящее описание путем ссылки). Дополнительные варианты могут возникнуть посредством генетического дрейфа или могут быть получены искусственно с использованием сайт-направленного или случайного мутагенеза или рекомбинацией двух или более ранее существовавших вариантов. Такие дополнительные варианты также подходят в контексте модифицированных или мутированных F протеинов RSV, описанных в настоящей заявке.
Мутации могут быть введены в F протеины RSV по настоящему изобретению с использованием любой методологии, известной специалистам в данной области. Мутации могут быть внесены случайно, например, проведением PCR (полимеразной цепной реакции, ПЦР) в присутствии марганца в качестве двухвалентного иона металла-кофактора. Альтернативно, олигонуклеотид направленный мутагенез может использоваться для создания мутантных или модифицированных F протеинов RSV, что обеспечивает возможность получения всех возможных классов изменений пар оснований в любом определенном сайте вдоль молекулы, кодирующей ДНК. В целом, данная методика включает отжиг олигонуклеотида, комплементарного (за исключением одного или более ошибочных спариваний оснований) однонитевой нуклеотидной последовательности, кодирующей представляющий интерес F протеин RSV. Ошибочно спаренный олигонуклеотид затем удлиняется ДНК-полимеразой, генерируя молекулу двухнитевой ДНК, которая содержит желательное изменение последовательности в одной нити. Изменения последовательности могут, например, привести к делеции, замещению или вставке аминокислоты. Затем двухнитевой полинуклеотид может быть вставлен в соответствующий вектор экспрессии, и, таким образом, может быть получен мутантный или модифицированный полипептид. Описанный выше олигонуклеотид направленный мутагенез может, например, проводиться посредством ПЦР.
ДОПОЛНИТЕЛЬНЫЕ ПРОТЕИНЫ RSV
Изобретение также относится к вирусоподобным частицам (VLP) RSV, содержащим модифицированный или мутированный F протеин RSV, который может включаться в состав вакцин или антигенных составов для защиты позвоночных (например, людей) против инфекции RSV или, по меньшей мере, ее одного патологического симптома. В некоторых вариантах осуществления VLP, содержащая модифицированный или мутированный F протеин RSV, кроме того, содержит дополнительные протеины RSV, такие как M, N, G и SH. В других вариантах осуществления VLP, содержащая модифицированный или мутированный F протеин RSV, кроме того, содержит протеины из гетерологичных штаммов вируса, такие как протеины вируса гриппа HA, NA и Ml. В одном варианте осуществления протеин Ml происходит из штамма вируса птичьего гриппа.
Протеин N RSV прочно связывается и с геномной РНК, и с репликативной промежуточной антигеномной РНК для образования устойчивого к РНазе нуклеокапсида. SEQ ID NOs: 16 (дикого типа) и 18 (с оптимизацией кодона) изображают репрезентативные аминокислотные последовательности N протеина RSV, и SEQ ID NOs: 15 (дикого типа) и 17 (с оптимизацией кодона) изображают репрезентативные последовательности нуклеиновых кислот, кодирующие N протеин RSV. В настоящее изобретение включены N протеины RSV, которые, по меньшей мере, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70% или примерно на 80%, примерно на 85%, примерно на 90%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98% или примерно на 99% идентичны SEQ ID NO: 18, и все их фрагменты и варианты (включая химерные протеины).
M протеин RSV представляет собой негликозилированный внутренний протеин вириона, который накапливается в плазматической мембране, которая взаимодействует с F протеином RSV и другими факторами в течение вирусного морфогенеза. В определенных предпочтительных вариантах осуществления M протеин RSV представляет собой M протеин коровьего RSV (BRSV). SEQ ID NOs: 12 (дикого типа) и 14 (с оптимизацией кодона) изображают репрезентативные аминокислотные последовательности M протеина BRSV, и SEQ ID NOs: 11 (дикого типа) и 13 (с оптимизацией кодона) изображают репрезентативные аминокислотные последовательности нуклеиновых кислот, кодирующих M протеин BRSV. В настоящее изобретение включены M протеины RSV (включая без ограничения BRSV), которые, по меньшей мере, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70% или примерно на 80%, примерно на 85%, примерно на 90%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98% или примерно на 99% идентичны SEQ ID NOs: 12 и 14, и все их фрагменты и варианты (включая химерные протеины).
G протеин RSV представляет собой трансмембранный гликопротеин II типа с одной гидрофобной областью около N-конца, который служит в качестве и как нерасщепленного сигнального пептида, и как мембранного якоря, оставляя C-концевые две трети молекулы, ориентированные наружу. G RSV также экспрессирован в виде секретируемого протеина, который возникает в результате трансляционной инициации во втором стартовом кодоне AUG в ORF (примерно у аминокислоты 48), который лежит в пределах сигнала/якоря. Большая часть эктодомена G RSV высоко изменчива между штаммами RSV (Id., p. 1607). SEQ ID NO: 26 изображает репрезентативный G протеин RSV, который кодируется генной последовательностью, показанной в SEQ ID NO: 25. В настоящее изобретение включены G протеины RSV, которые, по меньшей мере, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70% или примерно на 80%, примерно на 85%, примерно на 90%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98% или примерно на 99% идентичны SEQ ID NO: 26, и все их фрагменты и варианты (включая химерные протеины).
SH протеин RSV представляет собой трансмембранный протеин II типа, который содержит 64 (подгруппа A RSV) или 65 аминокислотных остатков (подгруппа B RSV). Некоторые исследования позволили предположить, что SH протеин RSV может играть роль в вирусном слиянии или в изменении проницаемости мембран. Однако RSV, лишенные гена SH, являются жизнеспособными, вызывают образование синцития и растут так же, как вирус дикого типа, указывая на то, что SH протеин не является необходимым для вхождения вируса в клетки-хозяина или образования синцития. SH протеин RSV проявил способность ингибирования передачи сигналов TNF-α (фактор некроза опухоли-альфа). SEQ ID NO: 27 изображает репрезентативную аминокислотную последовательность SH протеина RSV. В настоящее изобретение включены SH протеины RSV, которые, по меньшей мере, примерно на 20%, примерно на 30%, примерно на 40%, примерно на 50%, примерно на 60%, примерно на 70% или примерно на 80%, примерно на 85%, примерно на 90%, примерно на 95%, примерно на 96%, примерно на 97%, примерно на 98% или примерно на 99% идентичны SEQ ID NO: 27, и все их фрагменты и варианты (включая химерные протеины).
ВАКЦИНЫ RSV
В настоящее время единственным утвержденным подходом к профилактике заболевания, вызываемого RSV, является пассивная иммунизация. Первоначальное доказательство, свидетельствующее о защитной роли IgG, которое было получено в наблюдениях, включающих материнские антитела у хорьков (Prince, G. A., Ph.D. diss., University of California, Los Angeles, 1975) и людей (Lambrecht et al., (1976) J. Infect. Dis. 134, 211-217; и Glezen et al. (1981) J. Pediatr. 98,708-715). Hemming et al. (Morell et al, eds., 1986, Clinical Use of Intravenous Immunoglobulins, Academic Press, London at pages 285-294), установило возможность применения антитела против RSV при лечении или профилактике инфекции RSV во время исследований, включающих фармакокинетику внутривенно введенного иммуноглобулина (IVIG) у новорожденных с подозрением на наличие сепсиса новорожденных. Они отметили, что один грудной ребенок, в респираторных секрециях которого был выявлен RSV, быстро выздоровел после инфузии IVIG. Последующий анализ лота IVIG выявил необычно высокий титр антитела, нейтрализующего RSV. Та же группа исследователей затем изучала способность гипериммунной сыворотки или иммуноглобулина, обогащенного антителом, нейтрализующим RSV, защищать хлопковых крыс и приматов против инфекции RSV (Prince et al. (1985) Virus Res. 3, 193-206; Prince et al. (1990) J. Virol. 64, 3091-3092). Результаты данных исследований свидетельствовали о том, что нейтрализующее RSV антитело, вводимое профилактически, ингибировало репликацию RSV в дыхательных путях у хлопковых крыс. При введении с целью лечения антитело против RSV снижало вирусную репликацию в легких и у хлопковых крыс, и на модели у нечеловекообразных приматов. Кроме того, пассивная инфузия иммунной сыворотки или иммуноглобулина не вызывала усиленной легочной патологии у хлопковых крыс в последующих подвергнутых контрольному заражению RSV.
Поскольку инфекция RSV может быть предотвращена введением позвоночному нейтрализующих антител, то вакцина, содержащая модифицированный или мутированный F протеин RSV, может нейтрализующе индуцировать антитела при введении позвоночному in vivo. Модифицированные или мутированные F протеины RSV успешно применяются для профилактики и/или лечения инфекции RSV. Таким образом, другой аспект настоящего описания относится к способу вызова иммунного ответа против RSV. Способ включает введение иммунологически эффективного количества композиции, содержащей модифицированный или мутированный F протеин RSV, индивиду (такому, как человек или животное). Введение иммунологически эффективного количества композиции вызывает иммунный ответ, специфический для эпитопов, присутствующих на модифицированном или мутированном F протеине RSV. Такой иммунный ответ может включать B-клеточные реакции (например, продукцию нейтрализующих антител) и/или T-клеточные реакции (например, продукцию цитокинов). Предпочтительно иммунный ответ, вызванный модифицированным или мутированным F протеином RSV, включает элементы, которые специфичны, по меньшей мере, для одного конформационного эпитопа, присутствующего на модифицированном или мутированном F протеине RSV. В одном варианте осуществления иммунный ответ специфичен для эпитопа, присутствующего на модифицированном или мутированном F протеине RSV, обнаруживаемом в имеющем форму «леденца на палочке» постфузионном активном состоянии. F протеины RSV и композиции могут вводиться индивиду без усиления вирусного заболевания после контакта с RSV. Предпочтительно модифицированные или мутированные F протеины RSV, описанные в настоящей заявке, и подходящим образом составленные иммуногенные композиции вызывают смещенный к ThI иммунный ответ, который уменьшает или предотвращает инфекцию RSV и/или уменьшает или предотвращает патологическую реакцию после инфекции RSV.
В одном варианте осуществления F протеины RSV по настоящему изобретению обнаруживаются в форме мицелл (например, розеток). Мицеллы, получаемые в соответствии с изобретением, состоят из агрегатов иммуногенетически активных F спайковых протеинов, имеющих подобную розетке структуру. Розетки жизнеспособны при исследовании электронной микроскопией (Calder et al., 2000, Virology 271:122-131). Предпочтительно мицеллы по настоящему изобретению, содержащие модифицированные или мутированные F протеины RSV, проявляют морфологию «леденца на палочке», указывающую на постфузионное активное состояние. В одном варианте осуществления мицеллы очищаются после экспрессии в клетке-хозяине. При введении индивиду мицеллы по настоящему изобретению предпочтительно индуцируют нейтрализующие антитела. В некоторых вариантах осуществления мицеллы могут вводиться с адъювантом. В других вариантах осуществления мицеллы могут вводиться без адъюванта.
В другом варианте осуществления изобретение относится к вирусоподобным частицам (VLP) RSV, содержащим модифицированный или мутированный F протеин RSV, которые могут включаться в состав вакцин или антигенных составов для защиты позвоночных (например, людей) против инфекции RSV или, по меньшей мере, ее одного патологического симптома. Настоящее изобретение также относится к VLP RSV и векторам, содержащим гены RSV дикого типа и мутированных, или их комбинации, происходящих из различных штаммов вируса RSV, которые при трансфекции в клетки-хозяева, продуцируют вирусоподобные частицы (VLP), содержащие протеины RSV.
В некоторых вариантах осуществления вирусоподобные частицы RSV могут, кроме того, содержать, по меньшей мере, один вирусный матричный протеин (например, M протеин RSV). В одном варианте осуществления M протеин происходит из коровьего штамма RSV. В другом варианте осуществления матричный протеин может представлять собой Ml протеин из штамма вируса гриппа. В одном варианте осуществления штамм вируса гриппа представляет собой штамм птичьего гриппа. В предпочтительном варианте осуществления штамм птичьего гриппа представляет собой штамм H5N1 A/Indonesia/5/05. В другом варианте осуществления матричный протеин может быть из вируса ньюкаслской болезни (NDV).
В некоторых вариантах осуществления VLP могут, кроме того, содержать G протеин RSV. В одном варианте осуществления G протеин может быть из группы B HRSV. В еще одном варианте осуществления G RSV может происходить из группы A и/или группы B HRSV.
В некоторых вариантах осуществления VLP могут, кроме того, содержать SH протеин RSV. В одном варианте осуществления SH протеин может быть из группы A HRSV. В другом варианте осуществления SH протеин может быть из группы B HRSV. В еще одном варианте осуществления SH RSV может происходить из группы A и/или группы B HRSV.
В некоторых вариантах осуществления VLP могут, кроме того, содержать N протеин RSV. В одном варианте осуществления N протеин может быть из группы A HRSV. В другом варианте осуществления N протеин может быть из группы B HRSV. В еще одном варианте осуществления N RSV может происходить из группы A и/или группы B HRSV.
В других вариантах осуществления VLP по изобретению могут содержать один или более гетерологичных иммуногенов, таких как гриппозный гемагглютинин (HA) и/или нейраминидаза (NA).
В некоторых вариантах осуществления изобретение также относится к комбинациям различных M, F, N, SH и/или G протеинов RSV из одного и того же и/или различных штаммов в одной или более VLP. Кроме того, VLP могут включать одну или более дополнительных молекул для усиления иммунного ответа.
В другом варианте осуществления изобретения VLP RSV могут нести такие агенты, как нуклеиновые кислоты, siРНК (малые интерферирующие РНК), микроРНК, химиотерапевтические средства, визуализирующие агенты и/или другие агенты, которые необходимо ввести пациенту.
VLP по изобретению могут применяться для получения вакцин и иммуногенных композиций. Одним важным признаком VLP является способность экспрессировать представляющие интерес поверхностные протеины с тем, чтобы иммунная система позвоночного индуцировала иммунный ответ против представляющего интерес протеина. Однако не все протеины могут быть экспрессированы на поверхности VLP. Может быть много причин отсутствия или слабой экспрессии определенных протеинов на поверхности VLP. Одной причиной является то, что протеин не направляется к мембране клетки-хозяина или что протеин не имеет трансмембранного домена. В качестве примера последовательности около карбоксильного конца гриппозного гемагглютинина могут иметь значение для включения HA в липидный бислой зрелых гриппозных снабженных оболочкой нуклеокапсид и для сборки взаимодействия триммера HA с гриппозным матричным протеином Ml (Ali, et al., (2000) J. Virol. 74, 8709-19).
Таким образом, один вариант осуществления изобретения относится к химерным VLP, содержащим модифицированный или мутированный F протеин из RSV и, по меньшей мере, один иммуноген, который в норме эффективно не экспрессирован на клеточной поверхности или не представляет собой нормальный протеин RSV. В одном варианте осуществления модифицированный или мутированный F протеин RSV может быть слит с представляющим интерес иммуногеном. В другом варианте осуществления модифицированный или мутированный F протеин из RSV ассоциируется с иммуногеном через трансмембранный домен и цитоплазматический хвост гетерологичного вирусного поверхностного мембранного протеина, например оболочечного протеина MMTV.
Другие химерные VLP по изобретению содержат VLP, содержащие модифицированный или мутированный F протеин RSV, и, по меньшей мере, один протеин из гетерологичного инфекционного агента. Примеры гетерологичного инфекционного агента включают без ограничения вирус, бактерию, простейшее, гриб и/или паразит. В одном варианте осуществления иммуноген из другого инфекционного агента представляет собой гетерологичный вирусный белок. В другом варианте осуществления протеин из гетерологичного инфекционного агента представляет собой связанный с оболочкой протеин. В другом варианте осуществления протеин из гетерологичного инфекционного агента экспрессирован на поверхности VLP. В другом варианте осуществления протеин из инфекционного агента содержит эпитоп, который генерирует защитный иммунный ответ у позвоночного. В одном варианте осуществления протеин из другого инфекционного агента коэкспрессирован с модифицированным или мутированным F протеином RSV. В другом варианте осуществления протеин из другого инфекционного агента слит с модифицированным или мутированным F протеином RSV. В другом варианте осуществления лишь часть протеина из другого инфекционного агента слита с модифицированным или мутированным F протеином RSV. В другом варианте осуществления часть протеина из другого инфекционного агента, слитая с модифицированным или мутированным F протеином RSV, экспрессирована на поверхности VLP.
Изобретение также относится к вариантам протеинов, экспрессированным на или в VLP по изобретению. Варианты могут содержать изменения в аминокислотных последовательностях составляющих протеинов. Термин «вариант» в отношении к протеину относится к аминокислотной последовательности, которая изменена одной или более аминокислотами в отношении к эталонной последовательности. Вариант может иметь «консервативные» изменения, где замещенная аминокислота имеет аналогичные структурные или химические свойства, например замещение лейцина изолейцином. Альтернативно, вариант может иметь «неконсервативные» изменения, например замещение глицина триптофаном. Аналогичные небольшие изменения могут также включать делецию или вставку аминокислот или оба эти изменения. Руководство при определении, какой аминокислотный остаток может быть замещен или делетирован без устранения биологической или иммунологической активности, можно найти с использованием компьютерных программ, хорошо известных в данной области, например программного обеспечения DNASTAR.
Натуральные варианты могут возникать вследствие мутаций в протеинах. Указанные мутации могут привести к антигенной изменчивости в пределах отдельных групп инфекционных агентов, например гриппа. Таким образом, у лица, инфицированного, например, штаммом вируса гриппа, вырабатывается антитело против указанного вируса, поскольку появляются более новые вирусные штаммы, антитела против более старых штаммов больше не распознают более новый вирус, и может возникнуть реинфекция. Изобретение относится ко всей антигенной и генетической изменчивости протеинов из инфекционных агентов для получения VLP.
Общие ссылки, в которых описываются молекулярно-биологические методики, применимые в настоящем изобретении, такие как клонирование, мутация, клеточная культура и тому подобные, включают публикации Berger and Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology volume 152 Academic Press, Inc., San Diego, Calif. (Berger); Sambrook et al., Molecular Cloning A Laboratory Manual (3rd Ed.), Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N. Y., 2000 ("Sambrook") and Current Protocols in Molecular Biology, F. M. Ausubel et al., eds., Current Protocols, a joint venture between Greene Publishing Associates, Inc. and John Wiley & Sons, Inc., ("Ausubel"). В указанных ссылках описан мутагенез, использование векторов, промотеров и многие другие релевантные аспекты, относящиеся, например, к клонированию и мутации молекул F и/или G RSV, и т.д. Таким образом, изобретение также относится к использованию известных способов белковой инженерии и технологии рекомбинантной ДНК для улучшения или изменения характеристик протеинов, экспрессированных на или в VLP по изобретению. Различные типы мутагенеза могут использоваться для получения и/или выделения вариантных нуклеиновых кислот, которые кодируют белковые молекулы, и/или для дальнейшей модификации/мутации протеинов в VLP по изобретению или на них. Они включают без ограничения сайт-направленный, случайный точечный мутагенез, гомологичную рекомбинацию (перетасовку ДНК), мутагенез с использованием содержащих урацил матриц, олигонуклеотид-направленный мутагенез, модифицированный фосфортиоатом ДНК мутагенез, мутагенез с использованием имеющей гэпы дуплексной ДНК или тому подобные. Дополнительные подходящие способы включают репарацию точечного ошибочного спаривания оснований, мутагенез с использованием штаммов-хозяев с дефицитом репарации, рестрикцию-селекцию и рестрикцию-очистку, делеционный мутагенез, мутагенез полным генным синтезом, репарацию двухнитевого разрыва и тому подобные. Мутагенез, например, включающий химерные конструкты, также включен в настоящее изобретение. В одном варианте осуществления мутагенез может руководствоваться известными данными о естественно встречающейся молекуле или измененной или мутированной естественно встречающейся молекуле, например о последовательности, сравнениях последовательностей, физических свойствах, кристаллической структуре или тому подобных характеристиках.
Изобретение, кроме того, относится к вариантам протеинов, которые проявляют существенную биологическую активность, например способны вызывать эффективную реакцию антител при экспрессии на VLP по изобретению или в них. Такие варианты включают делеции, вставки, инверсии, повторы и замещения, выбранные в соответствии с общими правилами, известными в данной области, как оказывающие незначительное воздействие на активность.
Способы клонирования протеинов известны в данной области. Например, ген, кодирующий определенный протеин RSV, может быть выделен RT-PCR (обратной транскрипцией-ПЦР) из полиаденилированной мРНК, экстрагированной из клеток, которые были инфицированы вирусом RSV. Ген полученного продукта может клонироваться в качестве ДНК-вставки в вектор. Термин «вектор» относится к средству, посредством которого нуклеиновая кислота может распространяться и/или передаваться между организмами, клетками или клеточными компонентами. Векторы включают плазмиды, вирусы, бактериофаги, провирусы, фагемиды, транспозоны, искусственные хромосомы и тому подобные, которые автономно реплицируются или могут интегрироваться в хромосому клетки-хозяина. Вектор может также представлять собой полинуклеотид голой РНК, полинуклеотид, состоящий из и ДНК, и РНК внутри одной и той же нити, конъюгированной с полилизином ДНК или РНК, конъюгированной с пептидом ДНК или РНК, конъюгированной с липосомой ДНК, или тому подобные, который автономно не реплицируется. Во многих, но не во всех обычных вариантах осуществления векторы по настоящему изобретению представляют собой плазмиды или бакмиды.
Таким образом, изобретение относится к нуклеотидам, которые кодируют протеины, включая химерные молекулы, клонированные в вектор экспрессии, который может быть экспрессирован в клетке, индуцирующей образование VLP по изобретению. «Вектор экспрессии» представляет собой вектор, такой как плазмида, который способен стимулировать экспрессию, а также репликацию нуклеиновой кислоты, включенной в нее. Обычно нуклеиновая кислота, подлежащая экспрессии, «функционально связана» с промотером и/или энхансером и подвергается регуляторному контролю транскрипции промотером и/или энхансером. В одном варианте осуществления нуклеотиды кодируют модифицированный или мутированный F протеин RSV (как обсуждается выше). В другом варианте осуществления вектор, кроме того, содержит нуклеотиды, которые кодируют M и/или G протеины RSV. В другом варианте осуществления вектор, кроме того, содержит нуклеотиды, которые кодируют M и/или N протеины RSV. В другом варианте осуществления вектор, кроме того, содержит нуклеотиды, которые кодируют M, G и/или N протеины RSV. В другом варианте осуществления вектор, кроме того, содержит нуклеотиды, которые кодируют M протеин BRSV и/или N протеин RSV. В другом варианте осуществления вектор, кроме того, содержит нуклеотиды, которые кодируют M и/или G протеин BRSV или гриппозный HA и/или протеин NA (нейраминидазы). В другом варианте осуществления нуклеотиды кодируют модифицированный или мутированный F протеин RSV и/или G протеин RSV с гриппозным HA и/или протеином NA. В другом варианте осуществления вектор экспрессии представляет собой бакуловирусный вектор.
В некоторых вариантах осуществления изобретения протеин может включать мутации, содержащие изменения, которые продуцируют молчащие замещения, добавления или делеции, но не изменяют свойства или виды активности кодируемого протеина или того, как получают протеины. Нуклеотидные варианты могут быть получены по разнообразным причинам, например, для оптимизации экспрессии кодона для конкретного хозяина (замена кодонов в человеческой мРНК на кодоны, предпочитаемые клетками насекомых, такие как клетки Sf9). См. заявку на патент США 2005/0118191, полностью включенную в настоящую заявку во всех аспектах.
Кроме того, нуклеотиды могут секвенироваться для обеспечения того, что были клонированы правильные кодирующие области, и не содержат никаких нежелательных мутаций. Нуклеотиды могут быть субклонированы в вектор экспрессии (например, бакуловирус) для экспрессии в любой клетке. Выше приведен лишь один пример того, как могут быть клонированы вирусные протеины RSV. Специалисту в данной области понятно, что имеются и возможны дополнительные способы.
Изобретение также относится к конструктам и/или векторам, которые содержат нуклеотиды RSV, кодирующие структурные гены RSV, включая F, M, G, N, SH или их части и/или любые химерные молекулы, описанные выше. Вектор может представлять собой, например, фаг, плазмиду, вирусный или ретровирусный вектор. Конструкты и/или векторы, которые содержат структурные гены RSV, включая F, M, G, N, SH или их части и/или любые химерные молекулы, описанные выше, должны быть функционально связаны с соответствующим промотером, таким как промотер полигедрина AcMNPV (или другой бакуловирус), промотер PL фага лямбда, промотеры E. coli lac, phoA и tac, ранние и поздние промотеры S V40 и промотеры ретровирусных LTR, являющиеся неограничивающими примерами. Другие подходящие промотеры будут известны специалисту в данной области в зависимости от клетки-хозяина и/или желательной частоты экспрессии. Экспрессионные конструкты, кроме того, содержат сайты для инициации транскрипции, терминации и в транскрибированной области, связывающей рибосому сайта для трансляции. Кодирующая часть транскриптов, экспрессируемая конструктами, предпочтительно включает инициирующий трансляцию кодон в кодоне начала и окончания, соответствующим образом расположенном на конце подлежащего трансляции полипептида.
Векторы экспрессии предпочтительно включают, по меньшей мере, один выбираемый маркер. Такие маркеры включают дигидрофолат-редуктазу, G418 или гены устойчивости к неомицину для культуры эукаротических клеток и устойчивости к ампициллину для культивирования в E. coli и других бактериях. Среди предпочтительных векторов имеются вирусные векторы, такие как бакуловирус, поксвирус (например, вирус коровьей оспы, вирус птичьей оспы, вирус оспы канареек, вирус оспы домашней птицы, вирус оспы енотов, вирус свиной оспы и т.д.), аденовирус (например, собачий аденовирус), герпесвирус и ретровирус. Другие векторы, которые могут использоваться в изобретении, включают векторы для использования в бактериях, которые содержат векторы pQE70, pQE60 и pQE-9, pBluescript векторы, векторы Phagescript, pNH8A, pNHl6a, pNH18A, pNH46A, ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5. Среди предпочтительных эукариотических векторов имеются векторы pFastBacl, pWINEO, pSV2CAT, pOG44, pXTl and pSG, pSVK3, pBPV, pMSG и pSVL. Другие подходящие векторы вполне очевидны для специалиста в данной области. В одном варианте осуществления вектор, который содержит нуклеотиды, кодирующие гены RSV, включая модифицированные или мутированные F гены RSV, а также гены для M, G, N, SH или их частей и/или любой химерной молекулы, описанной выше, представляет собой pFastBac.
Рекомбинантные конструкты, указанные выше, могут использоваться для трансфекции, инфекции или трансформации и могут экспрессировать протеины RSV, включая модифицированный или мутированный F протеин RSV, и, по меньшей мере, один иммуноген. В одном варианте осуществления рекомбинантный конструкт содержит модифицированные или мутированные F, M, G, N, SH RSV или их части и/или любую молекулу, описанную выше, в эукариотических клетках и/или прокариотических клетках. Таким образом, изобретение относится к клеткам-хозяевам, которые включают вектор (или векторы), который содержит нуклеиновые кислоты, кодирующие структурные гены RSV, включая модифицированный или мутированный F протеин RSV; и, по меньшей мере, один иммуноген, такой как, без ограничения G, N и SH RSV, или их части, и/или любую молекулу, описанную выше, и обеспечивает возможность экспрессии генов, включая F, G, N, M, SH RSV или их части и/или любую молекулу, описанную выше, в клетке-хозяине, в условиях, которые обеспечивают возможность образования VLP.
Среди эукариотических клеток-хозяев имеются клетки-хозяева, относящиеся к клеткам дрожжей, насекомых, птиц, растений, C. elegans (или нематодам) и млекопитающим. Неограничивающими примерами клеток насекомых являются клетки Spodoptera frugiperda (Sf), например Sf9, Sf21, клетки Trichoplusia ni cells, например клетки High Five, и клетки Drosophila S2. Примерами грибных (включая дрожжевые) клеток-хозяев являются S. cerevisiae, Kluyveromyces lactis (K. lactis), виды Candida, включая C. albicans и C. glabrata, Aspergillus nidulans, Schizosaccharomyces pombe (S. pombe), Pichia pastoris и Yarrowia lipolytica. Примерами клеток млекопитающих являются клетки COS, почечные клетки детенышей хомячков, мышиные L клетки, клетки LNCaP, клетки яичников китайских хомячков (CHO), почечные клетки человеческих эмбрионов (HEK) и клетки африканских зеленых мартышек, клетки CVl, клетки HeLa, клетки MDCK, клетки Vero и Hep-2. Могут также использоваться ооциты Xenopus laevis или другие клетки, полученные у земноводных. Примеры прокариотических клеток-хозяев включают бактериальные клетки, например E. coli, B. subtilis, Salmonella typhi и микобактерии.
Векторы, например векторы, содержащие полинуклеотиды модифицированного или мутированного F протеина RSV; и, по меньшей мере, один иммуноген, включая без ограничения G, N или SH RSV или их части, и/или любая химерная молекула, описанная выше, может трансфицироваться в клетки-хозяева в соответствии со способами, хорошо известными в данной области. Например, введение нуклеиновых кислот в эукариотические клетки может осуществляться копреципитацией фосфатом кальция, электропорообразованием, микроинъекцией, липофекцией и трансфекцией с использованием реагентов трансфекции полиаминов. В одном варианте осуществления вектор представляет собой рекомбинантный бакуловирус. В другом варианте осуществления рекомбинантный бакуловирус трансфицируется в эукариотическую клетку. В предпочтительном варианте осуществления клетка представляет собой клетку насекомого. В другом варианте осуществления клетка насекомого представляет собой клетку Sf9.
Настоящее изобретение также относится к конструктам и способам, которые увеличивают эффективность продукции VLP. Например, добавление лидерных последовательностей к F, M, G, N, SH RSV или их частям и/или любым химерным или гетерологичным молекулам, описанным выше, может повысить эффективность транспортировки протеина внутри клетки. Например, гетерологичная сигнальная последовательность может быть слита с F, M, G, N, SH RSV или их частями и/или любой химерной или гетерологичной молекулой, описанной выше. В одном варианте осуществления сигнальная последовательность может происходить из гена клетки насекомого и слита с M, F, G, N, SH или их частями и/или любыми химерными или гетерологичными молекулами, описанными выше. В другом варианте осуществления сигнальный пептид представляет собой сигнальную последовательность хитиназы, которая эффективно работает в системах экспрессии бакуловируса.
Другой способ увеличения эффективности продукции VLP представляет собой кодоновую оптимизацию нуклеотидов, которые кодируют RSV, включая модифицированный или мутированный F протеин RSV, M, G, N, SH или их части и/или любые химерные или гетерологичные молекулы, описанные выше, для специфического типа клеток. Примерами оптимизирующих кодон нуклеиновых кислот для экспрессии в клетке Sf9 являются SEQ ID Nos: 3, 5, 7, 9, 13, 17, 19 и 25.
Изобретение также относится к способам получения VLP, причем способы включают экспрессирование генов RSV, включая модифицированный или мутированный F протеин RSV и, по меньшей мере, один дополнительный протеин, включая без ограничения M, G, N, SH RSV или их части и/или любую химерную или гетерологичную молекулу, описанную выше, в условиях, которые обеспечивают возможность образования VLP. В зависимости от системы экспрессии и выбранной клетки-хозяина VLP продуцируются выращиванием клеток-хозяев, трансформированных вектором экспрессии в условиях, посредством чего экспрессируются рекомбинантные протеины и образуются VLP. В одном варианте осуществления изобретение относится к способу получения VLP, включающему трансфекцию векторов, кодирующих, по меньшей мере, один модифицированный или мутированный F протеин RSV в подходящую клетку-хозяина, и экспрессирование модифицированного или мутированного F протеина RSV в условиях, которые обеспечивают возможность образования VLP. В другом варианте осуществления эукариотическая клетка выбрана из группы, состоящей из клеток дрожжей, насекомых, земноводных, птиц или млекопитающих. Выбор соответствующих условий роста находится в пределах компетенции среднего специалиста в данной области.
Способы выращивания клеток, подвергнутых воздействию методами генной инженерии для получения VLP по изобретению, включают без ограничения групповую технологию, технологию подачи партиями, непрерывную технологию и технологию перфузионной клеточной культуры. Клеточная культура означает рост и размножение клеток в биореакторе (ферментационной камере), где клетки размножаются и экспрессируют протеин (например, рекомбинантные протеины) для очистки и выделения. Обычно клеточная культура выращивается в стерильных, с регулируемой температурой и атмосферных условиях в биореакторе. Биореактор представляет собой камеру, используемую для культивирования клеток, в которой условия среды, такие как температура, атмосфера, перемешивание и/или pH, могут регулироваться. В одном варианте осуществления биореактор представляет собой камеру из нержавеющей стали. В другом варианте осуществления биореактор представляет собой предварительно стерилизованный пластиковый мешок (например, Cellbag®, Wave Biotech, Bridgewater, NJ). В другом варианте осуществления предварительно стерилизованные пластиковые мешки представляют собой мешки емкостью от 50 л до 1000 л.
Затем VLP выделяются с использованием способов, которые сохраняют их целостность, например градиентным центрифугированием, например, хлоридом цезия, сахарозой и йодиксанолом, а также стандартными методиками очистки, включая, например, обмен ионов и гель-фильтрационную хроматографию.
Ниже приводится пример того, как могут быть получены, изолированы и очищены VLP по изобретению. Обычно VLP получают из линий рекомбинантных клеток, подвергнутых методам инженерии для создания VLP, когда клетки выращиваются в клеточной культуре (см. выше). Специалисту в данной области было бы понятно, что существуют дополнительные способы, которые могут использоваться для получения и очистки VLP по изобретению, таким образом, изобретение не ограничивается описанным способом.
Получение VLP по изобретению может начинаться высеванием клеток Sf9 (неинфицированных) во флаконы шейкера, обеспечивающие возможность распространения и наращивания производства по мере роста и размножения клеток (например, из флакона объемом 125 мл в 50-литровый мешок Wave). Среда, используемая для выращивания клеток, составляется для соответствующей клеточной линии (предпочтительно бессывороточные среды, например среда для насекомых ExCell-420, JRH). Затем клетки инфицируются рекомбинантным бакуловирусом при наиболее эффективной множественности инфекции (например, от примерно 1 до примерно 3 бляшкообразующих единиц на клетку). После возникновения инфекции модифицированный или мутированный F протеин RSV, M, G, N, SH или их части и/или любые химерные или гетерологичные молекулы, описанные выше, экспрессируются из вирусного генома, самостоятельно собираются в VLP и секретируются из клеток приблизительно через 24-72 часа после инфекции. Обычно инфекция наиболее эффективна, когда клетки находятся в середине логарифмической фазы роста (4-8×106 клеток/мл) и, по меньшей мере, на 90% жизнеспособны.
VLP по изобретению можно собирать приблизительно через 48-96 часов после инфекции, когда уровни VLP в среде для клеточной культуры почти достигают максимума, но перед экстенсивным лизисом клеток. Плотность и жизнеспособность клеток Sf9 во время сбора может составлять от примерно 0,5×106 клеток/мл до примерно 1,5×106 клеток/мл при жизнеспособности, по меньшей мере, 20%, как показано анализом исключения красителя. Затем среда удаляется и просветляется. NaCl может добавляться к среде до концентрации от примерно 0,4 до примерно 1,0 M, предпочтительно до примерно 0,5 M, во избежание агрегации VLP. Удаление клеток и клеточных осколков из среды для клеточной культуры, содержащей VLP по изобретению, может осуществляться фильтрацией в тангенциальном потоке (TFF) одноразовым, предварительно стерилизованным фильтрующим картриджем с полыми волокнами от 0,5 до 1,0 мкм или аналогичным устройством.
Затем VLP в просветленной культуральной среде могут концентрироваться ультрафильтрацией с использованием одноразового, предварительно стерилизованного фильтрующего картриджа с полыми волокнами с отсечкой молекулярной массы 500000. Концентрированные VLP могут повергаться диафильтрации против 10 объемов солевого раствора с фосфатным буфером (PBS) при pH от 7,0 до 8,0, содержащим 0,5 M NaCl, для удаления остаточных компонентов среды.
Концентрированные, диафильтрованные VLP могут далее очищаться на прерывистом сахарозном градиенте от 20% до 60% в PBS при pH 7,2 0,5 M NaCl центрифугированием при 6500×g в течение 18 часов при от примерно 4°C до примерно 10°C. Обычно VLP образуют отчетливую видимую полосу от примерно 30% до примерно 40% сахарозы или на поверхности раздела (на пороге градиента от 20% до 60%), которые могут быть собраны из градиента и храниться. Данный продукт может разбавляться с включением 200 мМ NaCl при подготовке к следующей стадии способа очистки. Данный продукт содержит VLP и может содержать интактные частицы бакуловируса.
Дальнейшая очистка VLP может достигаться анионообменной хроматографией или изопикническим центрифугированием через 44% сахарозную подушку. При анионообменной хроматографии образец из градиента плотности сахарозы (см. выше) загружается в колонку, содержащую среду с анионом (например, Matrix Fractogel EMD TMAE), и элюируется через солевой градиент (от примерно 0,2 M до примерно 1,0 M NaCl), который может отделить VLP от других примесей (например, бакуловируса и ДНК/РНК). В способе с использованием сахарозной подушки образец, содержащий VLP, добавляется к 44% сахарозной подушке и центрифугируется в течение примерно 18 часов при 30000 g. VLP из полосы на верхней части 44% сахарозной подушки, тогда как бакуловирус осаждается на дно, а другие загрязняющие белки остаются в слое с 0% сахарозы в верхней части. Пик или полоса VLP собирается.
При желании интактный бакуловирус может быть инактивирован. Инактивация сможет осуществляться химическими способами, например формалином или β-пропиолактоном (BPL). Удаление и/или инактивация интактного бакуловируса может в значительной степени осуществляться использованием способов селективной преципитации и хроматографии, известных в данной области, как иллюстрируется выше. Способы инактивации включают инкубацию образца, содержащего VLP, в 0,2% BPL в течение 3 часов при температуре от примерно 25°C до примерно 27°C. Бакуловирус может также инактивироваться инкубацией образца, содержащего VLP, при 0,05% BPL при 4°C в течение 3 дней, затем при 37°C в течение одного часа.
После стадии инактивации/удаления продукт, содержащий VLP, может быть подвергнут еще одной стадии диафильтрации для удаления любого реагента со стадии инактивации и/или любой остаточной сахарозы и для помещения VLP в желательный буфер (например, PBS). Раствор, содержащий VLP, может стерилизоваться способами, известными в данной области (например, стерилизационной фильтрацией), и храниться в холодильнике или морозильнике.
Указанные выше методики могут использоваться в разнообразных масштабах. Например, T-колбы, встряхиваемые колбы, центрифужные флаконы до биореакторов промышленного размера. Биореакторы могут содержать или резервуар из нержавеющей стали, или предварительно стерилизованный пластиковый мешок (например, устройство, продаваемое компанией Wave Biotech, Bridgewater, NJ). Специалисту в данной области известно, что наиболее желательно для достижения конкретных целей.
Размножение и продукция бакуловирусных векторов экспрессии и инфекция клеток рекомбинантным бакуловирусом для получения рекомбинантных VLP RSV могут осуществляться в клетках насекомых, например клетках насекомых Sf9, как описано ранее. В одном варианте осуществления клетки представляют собой SF9, инфицированные рекомбинантным бакуловирусом, подвергнутым методам генной инженерии для получения VLP RSV.
ФАРМАЦЕВТИЧЕСКИЕ ИЛИ ВАКЦИННЫЕ СОСТАВЫ И ВВЕДЕНИЕ
Фармацевтические композиции, применяемые в настоящем изобретении, содержат фармакологически приемлемый носитель, включая любой подходящий разбавитель или эксципиент, который включает любое фармацевтическое средство, которое в сущности не вызывает продукцию иммунного ответа, вредного для позвоночного, получающего композицию, и которое может вводиться без ненужной токсичности, и модифицированный или мутированный F протеин RSV, F мицеллу RSV, содержащую модифицированный или мутированный F протеин RSV, или VLP, содержащую модифицированный или мутированный F протеин RSV по изобретению. Используемый в настоящем описании термин «фармацевтически приемлемое» значит утвержденное уполномоченным регулирующим агентством Федерального правительства или правительства штата или приведенное в списке Фармакопеи США, Европейской Фармакопеи или другой общепризнанной фармакопеи для применения у млекопитающих, а конкретнее у людей. Данные композиции могут применяться в качестве вакцины и/или антигенных композиций для индукции защитного иммунного ответа у позвоночного.
Изобретение относится к фармацевтически приемлемой вакцинной композиции, включающей VLP, содержащие, по меньшей мере, один модифицированный или мутированный F протеин RSV и, по меньшей мере, один дополнительный протеин, включая без ограничения M, G, N, SH RSV, или их части и/или любые химерные или гетерологичные молекулы, описанные выше. В одном варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, содержащие, по меньшей мере, один модифицированный или мутированный F протеин RSV и, по меньшей мере, один дополнительный иммуноген. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, содержащие, по меньшей мере, один модифицированный или мутированный F протеин RSV и, по меньшей мере, один M протеин RSV. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, содержащие, по меньшей мере, один модифицированный или мутированный F протеин RSV и, по меньшей мере, один M протеин BRSV. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, содержащие, по меньшей мере, один модифицированный или мутированный F протеин RS и, по меньшей мере, один гриппозный Ml протеин. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, содержащие, по меньшей мере, один модифицированный или мутированный F протеин RSV и, по меньшей мере, один Ml протеин вируса птичьего гриппа.
В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, кроме того, содержащие G протеин RSV, включая без ограничения HRSV, BRSV или G протеин птичьего RSV. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, кроме того, содержащие N протеин RSV, включая без ограничения HRSV, BRSV или N протеин птичьего RSV. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, кроме того, содержащие SH протеин RSV, включая без ограничения HRSV, BRSV или SH протеин птичьего RSV.
В другом варианте осуществления изобретение относится к фармацевтически приемлемой вакцинной композиции, включающей химерные VLP, такие как VLP, содержащие M BRSV, модифицированный или мутированный F протеин RSV и/или G, H или SH протеин из RSV и, возможно, HA или NA протеин, происходящий из вируса гриппа, где HA или NA протеин слит с трансмембранным доменом и цитоплазматическим хвостом F RSV и/или G протеином.
Изобретение также относится к фармацевтически приемлемой вакцинной композиции, содержащей модифицированный или мутированный F протеин RSV, F мицеллу RSV, содержащую модифицированный или мутированный F протеин RSV, или VLP, содержащую модифицированный или мутированный F протеин RSV, как описано выше.
В одном варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, содержащие, по меньшей мере, модифицированный или мутированный F протеин RSV, и, по меньшей мере, один дополнительный протеин. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, кроме того, содержащие M протеин RSV, такой как без ограничения M протеин BRSV. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, кроме того, содержащие G протеин RSV, включая без ограничения G протеин HRSV. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, кроме того, содержащие N протеин RSV, включая без ограничения N протеин HRSV, BRSV или птичьего RSV. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, кроме того, содержащие SH протеин RSV, включая без ограничения SH протеин HRSV, BRSV или птичьего RSV. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, содержащие M и F и/или G протеин BRSV из группы A HRSV. В другом варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, содержащие M и F и/или G протеин BRSV из группы B HRSV. В другом варианте осуществления изобретение относится к фармацевтически приемлемой вакцинной композиции, содержащей химерные VLP, такие как VLP, содержащие химерный M протеин из BRSV и, возможно, HA протеин, происходящий из вируса гриппа, где M протеин слит с HA протеином вируса гриппа. В другом варианте осуществления изобретение относится к фармацевтически приемлемой вакцинной композиции, содержащей химерные VLP, такие как VLP, содержащие M BRSV, и химерный F и/или G протеин из RSV и, возможно, HA протеин, происходящий из вируса гриппа, где химерный HA протеин вируса гриппа слит с трансмембранным доменом и цитоплазматическим хвостом F RSV и/или G протеина. В другом варианте осуществления изобретение относится к фармацевтически приемлемой вакцинной композиции, содержащей химерные VLP, такие как VLP, содержащие M BRSV, и химерный F и/или G протеин из RSV, и, возможно, HA или NA протеин, происходящий из вируса гриппа, где HA или NA протеин вируса гриппа слит с трансмембранным доменом и цитоплазматическим хвостом F RSV и/или G протеина.
Изобретение также относится к фармацевтически приемлемой вакцинной композиции, включающей химерную VLP, которая содержит, по меньшей мере, один протеин RSV. В одном варианте осуществления фармацевтически приемлемая вакцинная композиция включает VLP, содержащие модифицированный или мутированный F протеин RSV и, по меньшей мере, один иммуноген из гетерологичного инфекционного агента или пораженной клетки. В другом варианте осуществления иммуноген из гетерологичного инфекционного агента представляет собой вирусный протеин. В другом варианте осуществления вирусный протеин из гетерологичного инфекционного агента представляет собой протеин, связанный с оболочкой. В другом варианте осуществления вирусный протеин из гетерологичного инфекционного агента экспрессирован на поверхности VLP. В другом варианте осуществления вирусный протеин из инфекционного агента содержит эпитоп, который генерирует защитный иммунный ответ у позвоночного.
Изобретение также относится к набору для иммунизации позвоночного, такого как человек, включающему VLP, которые содержат, по меньшей мере, один протеин RSV. В одном варианте осуществления набор включает VLP, содержащие модифицированный или мутированный F протеин RSV. В одном варианте осуществления набор, кроме того, включает M протеин RSV, такой как M протеин BRSV. В другом варианте осуществления набор, кроме того, включает G протеин RSV. В другом варианте осуществления изобретение относится к набору, включающему VLP, который содержит химерный M протеин из BRSV и, возможно, HA протеин, происходящий из вируса гриппа, где M протеин слит с M BRSV. В другом варианте осуществления изобретение относится к набору, включающему VLP, который содержит химерный M протеин из BRSV, F и/или G протеин RSV и иммуноген из гетерологичного инфекционного агента. В другом варианте осуществления изобретение относится к набору, включающему VLP, который содержит химерный M протеин из BRSV, F и/или G протеин RSV и, возможно, HA протеин, происходящий из вируса гриппа, где HA протеин слит с трансмембранным доменом и цитоплазматическим хвостом F или G протеина RSV. В другом варианте осуществления изобретение относится к набору, включающему VLP, который содержит M протеин из BRSV, химерный F и/или G протеин RSV и, возможно, HA или NA протеин, происходящий из вируса гриппа, где HA протеин слит с трансмембранным доменом и цитоплазматическим хвостом F и/или G протеина RSV.
В одном варианте осуществления изобретение относится к иммуногенному составу, содержащему, по меньшей мере, одну эффективную дозу модифицированного или мутированного F протеина RSV. В другом варианте осуществления изобретение относится к иммуногенному составу, содержащему, по меньшей мере, одну эффективную дозу F мицеллы RSV, содержащую модифицированный или мутированный F протеин RSV. В другом варианте осуществления изобретение относится к иммуногенному составу, содержащему, по меньшей мере, одну эффективную дозу VLP, содержащую модифицированный или мутированный F протеин, как описано выше.
Иммуногенный состав по изобретению содержит модифицированный или мутированный F протеин RSV, F мицеллу RSV, содержащую модифицированный или мутированный F протеин RSV, или VLP, содержащую модифицированный или мутированный F протеин RSV, и фармацевтически приемлемый носитель или эксципиент. Фармацевтически приемлемые носители включают без ограничения солевой раствор, забуференный солевой раствор, декстрозу, воду, глицерол, стерильный изотонический водный буфер и их комбинации. Подробное обсуждение фармацевтически приемлемых носителей, разбавителей и других эксципиентов представлено в руководстве Remington's Pharmaceutical Sciences (Mack Pub. Co. NJ. current edition). Состав должен соответствовать способу введения. В предпочтительном варианте осуществления состав, подходящий для введения людям, предпочтительно является стерильным, не содержащим частиц и/или непирогенным.
При желании композиция может также содержать небольшие количества смачивающих или эмульгирующих агентов или агентов, забуферивающих pH. Композиция может представлять собой твердую лекарственную форму, такую как лиофилизированный порошок, подходящий для восстановления влагосодержания, жидкий раствор, суспензию, эмульсию, таблетку, пилюлю, капсулу, состав пролонгированного высвобождения или порошок. Пероральный состав может включать стандартные носители, такие как фармацевтические сорта маннита, лактозы, крахмала, стеарата магния, сахарина натрия, целлюлозы, карбоната магния и т.д.
Изобретение также относится к фармацевтической упаковке или набору, содержащему один или более контейнеров, заполненных одним или более ингредиентами вакцинных составов по изобретению. В предпочтительном варианте осуществления набор содержит два контейнера, причем один содержит модифицированный или мутированный F протеин RSV, F мицеллу RSV, содержащую модифицированный или мутированный F протеин RSV, или VLP, содержащую модифицированный или мутированный F протеин RSV, а другой содержит адъювант. В сочетании с таким контейнером (контейнерами) может находиться уведомление в форме, утвержденной правительственным агентством, регулирующим производство, применение или продажу фармацевтических или биологических продуктов, причем уведомление отражает утверждение агентством производства, применения или продажи для введения людям.
Изобретение также относится к составу, упакованному в герметически запаянный контейнер, такой как ампула или саше, с указанием количества композиции. В одном варианте осуществления композиция поставляется в виде жидкости, в другом варианте осуществления - в виде сухого стерилизованного лиофилизированного порошка или безводного концентрата в герметически запаянном контейнере и влагосодержание в нем может восстанавливаться, например, водой или солевым раствором до определенной концентрации для введения индивиду.
В альтернативном варианте осуществления композиция поставляется в жидкой форме в герметично запаянном контейнере с указанием количества и концентрации композиции. Предпочтительно жидкая форма композиции поставляется в герметично запаянном контейнере в концентрации, по меньшей мере, примерно 50 мкг/мл, предпочтительнее, по меньшей мере, примерно 100 мкг/мл, по меньшей мере, примерно 200 мкг/мл, по меньшей мере, примерно 500 мкг/мл или, по меньшей мере, примерно 1 мг/мл.
В качестве примера химерные VLP RSV, содержащие модифицированный или мутированный F протеин RSV по изобретению, вводятся в эффективном количестве (как определено выше), достаточном для стимуляции иммунного ответа, причем каждый ответ направлен против одного или более штаммов RSV. Введение модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP по изобретению вызывает иммунитет против RSV. Обычно доза может быть подобрана в пределах диапазона на основании, например, возраста, физического состояния, массы тела, пола, рациона, времени введения и других клинических факторов. Профилактический вакцинный состав вводится системно, например, подкожной или внутримышечной инъекцией с использованием иглы и шприца или безыгольного инъекционного устройства. Альтернативно, вакцинный состав вводится интраназально или в виде капель, крупных аэрозольных частиц (более чем примерно 10 мкм) или спрея в верхние дыхательные пути. Хотя любой из указанных выше путей доставки приводит к иммунному ответу, интраназальное введение обеспечивает дополнительный эффект вызова иммунитета слизистых оболочек в участке поступления многих вирусов, включая RSV и вирус гриппа.
Таким образом, изобретение также относится к способу составления вакцины или антигенной композиции, которая индуцирует иммунитет к инфекции или, по меньшей мере, к ее одному патологическому симптому у млекопитающего, включающему добавление к составу эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV. В одном варианте осуществления инфекция представляет собой инфекцию RSV.
Хотя возможна стимуляция иммунитета одной дозой, могут вводиться дополнительные дозировки тем же или другим путем для достижения желательного эффекта. Например, у новорожденных и маленьких детей множественные введения могут потребоваться для вызова достаточных уровней иммунитета. При необходимости введение может продолжаться с интервалами в течение всего детского возраста для поддержания достаточных уровней защиты против инфекций, например инфекции RSV. Аналогичным образом, взрослые, которые особенно восприимчивы к повторным или тяжелым инфекциям, такие как, например, работники здравоохранения, сотрудники дневных стационаров, члены семей маленьких детей, пожилые люди и лица с нарушенной сердечно-легочной функцией, могут требовать множественных иммунизаций для установления и/или поддержания защитных иммунных ответов. Уровни индуцированного иммунитета могут контролироваться, например, измерением количеств нейтрализующих и сывороточных антител, и дозировки могут подбираться или при необходимости вакцинации могут повторяться для вызова и поддержания желательных уровней защиты.
Способы введения композиции, содержащей модифицированный или мутированный F протеин RSV, F мицеллу RSV, содержащую модифицированный или мутированный F протеин RSV, или VLP, содержащую модифицированный или мутированный F протеин RSV (например, вакцинные и/или антигенные составы), включают без ограничения парентеральное введение (например, трансдермальное, внутримышечное, внутривенное и подкожное), эпидуральное и через слизистые оболочки (например, интраназальный и пероральный или легочный пути или введения суппозиториями). В определенном варианте осуществления композиции по настоящему изобретению вводятся внутримышечно, внутривенно, подкожно, трансдермально или интрадермально. Композиции могут вводиться любым удобным путем, например инфузией или болюсной инъекцией, путем всасывания через эпителиальные или слизисто-кожные выстилки (например, слизистую ротовой полости, толстой кишки, конъюнктивы, носоглотки, ротоглотки, влагалища, уретры, мочевого пузыря и кишечную слизистую оболочку и т.д.), и могут вводиться вместе с другими биологически активными агентами. В некоторых вариантах осуществления интраназальный или другие пути введения через слизистые оболочки композиции по изобретению могут индуцировать антитело или другой иммунный ответ, который существенно выше, чем при других путях введения. В другом варианте осуществления интраназальный или другой путь введения через слизистую оболочку композиции по изобретению может индуцировать антитело или другой иммунный ответ, который вызовет перекрестную защиту против других штаммов RSV. Введение может быть системным или местным.
В еще одном варианте осуществления вакцинный и/или иммуногенный состав вводится таким образом, чтобы нацеливаться на ткани слизистых оболочек для вызова иммунного ответа в участке иммунизации. Например, ткани слизистых оболочек, таких как связанная с кишечником лимфоидная ткань (GALT), могут служить мишенью для иммунизации путем использования перорального введения композиций, которые содержат адъюванты с определенными свойствами нацеливания на слизистые оболочки. Мишенями могут служить также дополнительные ткани слизистых оболочек, такие как носоглоточная лимфоидная ткань (NALT) и связанная с бронхиальной слизистой оболочкой лимфоидная ткань (BALT).
Вакцинные и/или иммуногенные составы по изобретению могут также вводиться по схеме, например, с первоначальным введением вакцинной композиции с последующими повторными иммунизациями. В определенных вариантах осуществления вторая доза композиции вводится в любое время от двух недель до одного года, предпочтительно от примерно 1, примерно 2, примерно 3, примерно 4, примерно 5 до примерно 6 месяцев после первоначального введения. Кроме того, третья доза может вводиться после второй дозы и от примерно трех месяцев до примерно двух лет или даже дольше, предпочтительно примерно 4, примерно 5 или примерно 6 месяцев или примерно 7 месяцев до примерно одного года после первоначального введения. Возможно введение третьей дозы, когда в сыворотке и/или моче или секретах слизистых индивида после второй дозы не выявляются или выявляются низкие уровни специфических иммуноглобулинов. В предпочтительном варианте осуществления вторая доза вводится примерно через один месяц после первого введения, а третья доза вводится примерно через 6 месяцев после первого введения. В другом варианте осуществления вторая доза вводится через 6 месяцев после первого введения. В другом варианте осуществления композиции по изобретению могут вводиться в качестве части комбинированной терапии. Например, композиции по изобретению могут составляться с другими иммуногенными композициями, противовирусными препаратами и/или антибиотиками.
Специалист в данной области может легко определить дозировку фармацевтической композиции, например, сначала идентификацией дозы, эффективной для вызова профилактического или терапевтического иммунного ответа, например, измерением сывороточного титра вирус-специфических иммуноглобулинов или измерением ингибирующего соотношения в образцах сыворотки, или образцах мочи, или в секретах слизистых оболочек. Дозировки могут определяться по исследованиям на животных. Неограничивающий перечень животных, используемых для исследования эффективности вакцин, включает морских свинок, хомячков, хорьков, шиншилл, мышей и хлопковых крыс. Большинство животных не являются естественными хозяевами для инфекционных агентов, но все же могут использоваться в исследованиях различных аспектов заболеваний. Например, любому из указанных выше животных можно ввести перспективную вакцину, например модифицированный или мутированный F протеин RSV, F мицеллу RSV, содержащую модифицированный или мутированный F протеин RSV, или VLP по изобретению для частичной характеристики вызванного иммунного ответа и/или для определения того, продуцировались ли какие-либо нейтрализующие антитела. Например, было проведено множество исследований на мышиной модели, потому что мыши имеют небольшой размер и их низкая стоимость позволяет исследователям проводить исследования в большом масштабе.
Кроме того, специалист в данной области может выполнять клинические исследования у людей для определения предпочтительной эффективной дозы для людей. Такие клинические исследования являются обычными и хорошо известны в данной области. Точная доза, подлежащая применению, также зависит от пути введения. Эффективные дозы могут быть экстраполированы по кривым зависимости реакции от дозы, полученной с использованием систем тестирования in vitro или на животных.
Как также хорошо известно в данной области, иммуногенность конкретной композиции может быть усилена использованием неспецифических стимуляторов иммунного ответа, известных как адъюванты. Адъюванты использовались экспериментально для содействия генерализованному увеличению иммунитета против неизвестных антигенов (например, патент США № 4877611). В протоколах иммунизации адъюванты использовались для стимуляции реакций в течение многих лет, и, в сущности, адъюванты хорошо известны среднему специалисту в данной области. Некоторые адъюванты воздействуют на путь, которым представляются антигены. Например, иммунный ответ увеличивается, когда белковые антигены осаждаются квасцами. Эмульгирование антигенов также увеличивает длительность представления антигена. Включение любого адъюванта, описанного в публикации Vogel et al., «A Compendium of Vaccine Adjuvants and Excipients (2nd Edition)», во всех аспектах полностью включенной в настоящее описание путем ссылки, предусматривается в пределах объема настоящего изобретения.
Иллюстративные адъюванты включают полный адъювант Фрейнда (неспецифический стимулятор иммунного ответа, содержащий убитую Mycobacterium tuberculosis), неполные адъюванты Фрейнда и адъювант в виде гидроксида алюминия. Другие адъюванты включают GMCSP, BCG (БЦЖ), гидроксид алюминия, соединения MDP, такие как thur-MDP и nor-MDP, CGP (MTP-PE), липид A, монофосфориллипид A (MPL). Также предусмотрен RIBI, который содержит 3 компонента, экстрагированных из бактерий, MPL, димиколат трегалозы (TDM) и скелет клеточной стенки (CWS) в 2% эмульсии сквалена/Твин 80. Могут также использоваться MF-59, Novasomes®, антигены MHC (главного комплекса гистосовместимости).
В одном варианте осуществления изобретения адъювант представляет собой малопластинчатый липидный пузырек, имеющий примерно от двух до десяти бислоев, расположенных в форме по существу сферических оболочек, разделенных водными слоями, окружающими большую аморфную центральную полость, лишенную липидных бислоев. Малопластинчатые липидные пузырьки могут действовать для стимуляции иммунного ответа несколькими путями в качестве неспецифических стимуляторов, в качестве носителей для антигена, в качестве носителей дополнительных адъювантов и их комбинаций. Малопластинчатые липидные пузырьки действуют в качестве неспецифических иммунных стимуляторов, когда, например, вакцина получается перемешиванием антигена с предварительно образованными пузырьками с тем, чтобы антиген оставался внеклеточным относительно пузырька. Путем инкапсуляции антигена внутри центральной полости пузырька пузырек действует и как иммунный стимулятор, и как носитель для антигена. В другом варианте осуществления пузырьки главным образом получены из нефосфолипидных пузырьков. В другом варианте осуществления пузырьки представляют собой Novasomes®. Novasomes® представляют собой малопластинчатые нефосфолипидные пузырьки в диапазоне от примерно 100 нм до примерно 500 нм. Они содержат Brij 72, холестерин, олеиновую кислоту и сквален. Было показано, что новасомы представляют собой эффективный адъювант для гриппозных антигенов (см. патенты США № 5629021, 6387373 и 4911928, во всех аспектах полностью включенные в настоящее описание путем ссылки).
Композиции по изобретению могут также составляться с «иммунными стимуляторами». Они представляют собой собственные химические посредники организма (цитокины) для увеличения ответа иммунной системы. Иммуностимуляторы включают без ограничения различные цитокины, лимфокины и хемокины с иммуностимулирующей, иммунопотенцирующей и провоспалительной активностью, такие как интерлейкины (например, IL-I, IL-2, IL-3, IL-4, IL-12, IL-13); факторы роста (например, фактор, стимулирующий колонии гранулоцитов-макрофагов (GM-CSF)); и другие иммуностимулирующие молекулы, такие как макрофагальный воспалительный фактор, лиганд Flt3, B7.1; B7.2, и т.д. Иммуностимулирующие молекулы могут вводиться в одном и том же составе в качестве композиций по изобретению или могут вводиться отдельно. Или протеин, или вектор экспрессии, кодирующий протеин, может вводиться для получения иммуностимулирующего эффекта. Таким образом, в одном варианте осуществления изобретение включает антигенные и вакцинные составы, содержащие адъювант и/или иммуностимулятор.
СПОСОБЫ СТИМУЛЯЦИИ ИММУННОГО ОТВЕТА
Модифицированные или мутированные F протеины RSV, F мицеллы RSV, содержащие модифицированный или мутированный F протеин RSV, или VLP по изобретению могут применяться для получения композиций, которые стимулируют иммунный ответ, что создает иммунитет или существенный иммунитет в отношении инфекционных агентов. И слизистый, и клеточный иммунитет может вносить вклад в иммунитет в отношении инфекционных агентов и заболеваний. Антитела, секретируемые местно в верхних отделах дыхательных путей, представляют собой основной фактор в устойчивости к естественной инфекции. Секреторный иммуноглобулин A (slgA) участвует в защите верхних дыхательных путей и сывороточный IgG в защите нижних дыхательных путей. Иммунный ответ, вызываемый инфекцией, защищает против инфекции тем же вирусом или антигенно аналогичным вирусным штаммом. Например, RSV подвергается частым и непрогнозируемым изменениям; поэтому после естественной инфекции эффективный период защиты, обеспечиваемый иммунитетом хозяина, может лишь быть эффективным в течение нескольких лет против новых штаммов вируса, циркулирующих в сообществе.
Таким образом, изобретение относится к способу индукции иммунитета к инфекциям или, по меньшей мере, к одному их симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV. В одном варианте осуществления способ включает введение VLP, содержащих модифицированный или мутированный F протеин RSV и, по меньшей мере, один дополнительный протеин. В другом варианте осуществления способ, кроме того, включает введение VLP, кроме того, содержащих M протеин RSV, например M протеин BRSV. В другом варианте осуществления способ, кроме того, включает введение VLP, кроме того, содержащих N протеин RSV. В другом варианте осуществления способ, кроме того, включает введение VLP, кроме того, содержащих G протеин RSV. В другом варианте осуществления способ, кроме того, включает введение VLP, кроме того, содержащих SH протеин RSV. В другом варианте осуществления способ, кроме того, включает введение VLP, кроме того, содержащих F и/или G протеин из группы A и/или группы B HRSV. В другом варианте осуществления способ включает введение VLP, содержащих M протеин из BRSV и химерный F и/или G протеин RSV или оболочечный протеин MMTV, например HA или NA протеин, происходящий из вируса гриппа, где HA и/или NA протеин слит с трансмембранным доменом и цитоплазматическим хвостом F RSV и/или G протеином или оболочечным протеином MMTV. В другом варианте осуществления индивид представляет собой млекопитающее. В другом варианте осуществления млекопитающее представляет собой человека. В другом варианте осуществления VLP RSV составляются с адъювантом или иммуностимулятором.
В одном варианте осуществления изобретение включает способ индукции иммунитета к инфекции RSV или, по меньшей мере, к одному ее патологическому симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV. В другом варианте осуществления изобретение включает способ индукции иммунитета к инфекции RSV или, по меньшей мере, к одному ее патологическому симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV. В еще одном варианте осуществления изобретение включает способ индукции иммунитета к инфекции RSV или, по меньшей мере, к одному ее патологическому симптому у индивида, включающему введение, по меньшей мере, одной эффективной дозы VLP RSV, где VLP содержат модифицированный или мутированный F протеин RSV, M, G, SH и/или N протеины. В еще одном варианте осуществления способ индукции иммунитета к инфекции RSV или, по меньшей мере, к одному ее патологическому симптому у индивида, включает введение, по меньшей мере, одной эффективной дозы VLP RSV, где VLP состоят по существу из M BRSV (включая химерный M) и протеинов F, G и/или N протеинов RSV. VLP могут содержать дополнительные протеины RSV и/или белковые примеси в концентрациях, которыми можно пренебречь. В другом варианте осуществления способ индукции иммунитета к инфекции RSV или, по меньшей мере, к одному ее патологическому симптому у индивида включает введение, по меньшей мере, одной эффективной дозы VLP RSV, где VLP состоят из M BRSV (включая химерный M), G и/или F протеинов RSV. В другом варианте осуществления способ индукции иммунитета к инфекции RSV или, по меньшей мере, к одному ее патологическому симптому у индивида включает введение, по меньшей мере, одной эффективной дозы VLP RSV, содержащих протеины RSV, где протеины RSV состоят из M BRSV (включая химерный M), F, G и/или N протеинов, включая химерные F, G и/или N протеины. Эти VLP содержат M BRSV (включая химерный M), RSV F, G и/или N протеины и могут содержать дополнительные клеточные ингредиенты, такие как клеточные протеины, бакуловирусные протеины, липиды, углеводороды и т.д., но не содержат дополнительные протеины RSV (отличные от фрагментов M BRSV (включая химерный M)), F, G и/или N протеины BRSV/RSV. В другом варианте осуществления позвоночное представляет собой млекопитающее. В другом варианте осуществления млекопитающее представляет собой человека. В другом варианте осуществления способ включает индукцию иммунитета к инфекции RSV или, по меньшей мере, к одному ее патологическому симптому у индивида введением состава в одной дозе. В другом варианте осуществления способ включает индукцию иммунитета к инфекции RSV или, по меньшей мере, к одному ее патологическому симптому у индивида введением состава в множественных дозах.
Изобретение также относится к индукции иммунитета у индивида к инфекции или, по меньшей мере, к одному ее симптому, вызванной инфекционным агентом, включающей введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV. В одном варианте осуществления способ включает введение VLP, содержащий модифицированный или мутированный F протеин RSV и, по меньшей мере, один протеин из гетерологичного инфекционного агента. В одном варианте осуществления способ включает введение VLP, содержащих модифицированный или мутированный F протеин RSV и, по меньшей мере, один протеин из одного и того же или гетерологичного инфекционного агента. В другом варианте осуществления протеин из гетерологичного инфекционного агента представляет собой вирусный протеин. В другом варианте осуществления протеин из инфекционного агента представляет собой протеин, связанный с оболочкой. В другом варианте осуществления протеин из инфекционного агента экспрессирован на поверхности VLP. В другом варианте осуществления протеин из инфекционного агента содержит эпитоп, который генерирует защитный иммунный ответ у позвоночного. В другом варианте осуществления протеин из инфекционного агента может связываться с M протеином RSV, таким как M протеин BRSV, F, G и/или N протеин RSV. В другом варианте осуществления протеин из инфекционного агента слит с протеином RSV, таким как M протеин BRSV, F, G и/или N протеин RSV. В другом варианте осуществления только часть протеина из инфекционного агента слита с протеином RSV, таким как M протеин BRSV, F, G и/или N протеин RSV. В другом варианте осуществления только часть протеина из инфекционного агента слита с частью протеина RSV, такого как M протеин BRSV, F, G и/или N протеин RSV. В другом варианте осуществления часть протеина из инфекционного агента, слитая с протеином RSV, экспрессирована на поверхности VLP. В другом варианте осуществления протеин RSV или его часть, слитая с протеином из инфекционного агента, связывается с M протеином RSV. В другом варианте осуществления протеин RSV или его часть происходит из F, G, N и/или P RSV. В другом варианте осуществления химерные VLP, кроме того, содержат N и/или P протеин из RSV. В другом варианте осуществления химерные VLP содержат более одного протеина из одного и того же и/или гетерологичного инфекционного агента. В другом варианте осуществления химерные VLP содержат более одного протеина инфекционного агента, таким образом, создавая мультивалентную VLP.
Композиции по изобретению могут индуцировать существенный иммунитет у позвоночного (например, человека) при введении позвоночному. Существенный иммунитет развивается в результате иммунного ответа против композиций по изобретению, который защищает или облегчает течение инфекции или, по меньшей мере, уменьшает симптом инфекции у позвоночного. В некоторых случаях, если позвоночное инфицировано, то инфекция будет бессимптомной. Ответ может не быть полностью защитным ответом. В таком случае, если позвоночное инфицировано инфекционным агентом, то у позвоночного будут отмечаться уменьшенные симптомы или более короткая длительность симптомов по сравнению с неиммунизированным позвоночным.
В одном варианте осуществления изобретение относится к способу индукции существенного иммунитета к инфекции вирусом RSV или, по меньшей мере, к одному симптому заболевания у индивида, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV. В другом варианте осуществления изобретение относится к способу вакцинации млекопитающего против RSV, включающему введение млекопитающему вызывающего защиту количества модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV. В одном варианте осуществления способ включает введение VLP, кроме того, содержащих M протеин RSV, такой как M протеин BRSV. В другом варианте осуществления способ, кроме того, включает введение VLP, содержащие G протеин RSV, например G протеин HRSV. В другом варианте осуществления способ, кроме того, включает введение VLP, содержащих N протеин из группы A HRSV. В другом варианте осуществления способ, кроме того, включает введение VLP, содержащих N протеин из группы B HRSV. В другом варианте осуществления способ, кроме того, включает введение VLP, содержащих химерный M протеин из BRSV и F и/или G протеин, происходящий из RSV, где F и/или G протеин слит с трансмембранным доменом и цитоплазматическим хвостом M протеина. В другом варианте осуществления способ включает введение VLP, содержащих M протеин из BRSV и химерный F RSV и/или G протеин, где F и/или G протеин слит с трансмембранным доменом и цитоплазматическим хвостом гриппозного HA и/или NA протеина. В другом варианте осуществления способ включает введение VLP, содержащих M протеин из BRSV, и химерный F протеин RSV и/или G протеин, и, возможно, гриппозный HA и/или NA протеин, где F и/или G протеин слит с трансмембранным доменом и цитоплазматическим хвостом HA и/или NA протеина. В другом варианте осуществления способ включает введение VLP, содержащих M протеин из BRSV, и химерный F протеин RSV и/или G протеин, и, возможно, гриппозный HA и/или NA протеин, где HA и/или NA протеин слит с трансмембранным доменом и цитоплазматическим хвостом F RSV и/или G протеина.
Изобретение также относится к способу индукции существенного иммунитета к инфекции или, по меньшей мере, к одному симптому заболевания у индивида, вызванного инфекционным агентом, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV. В одном варианте осуществления способ включает введение VLP, кроме того, содержащих M протеин RSV, такой как M протеин BRSV, и, по меньшей мере, один протеин из другого инфекционного агента. В одном варианте осуществления способ включает введение VLP, кроме того, содержащих M протеин BRSV и, по меньшей мере, один протеин из такого же или гетерологичного инфекционного агента. В другом варианте осуществления протеин из инфекционного агента представляет собой вирусный протеин. В другом варианте осуществления протеин из инфекционного агента представляет собой протеин, связанный с оболочкой. В другом варианте осуществления протеин из инфекционного агента экспрессирован на поверхности VLP. В другом варианте осуществления протеин из инфекционного агента содержит оболочку, которая генерирует защитный иммунный ответ у позвоночного. В другом варианте осуществления протеин из инфекционного агента может связываться с M протеином RSV. В другом варианте осуществления протеин из инфекционного агента может связываться с M протеином BRSV. В другом варианте осуществления протеин из инфекционного агента слит с протеином RSV. В другом варианте осуществления только часть протеина из инфекционного агента слита с протеином RSV. В другом варианте осуществления только часть протеина из инфекционного агента слита с частью протеина RSV. В другом варианте осуществления часть протеина из инфекционного агента, слитая с протеином RSV, экспрессирована на поверхности VLP. В другом варианте осуществления протеин RSV или его часть, слитая с протеином из инфекционного агента, связана с M протеином RSV. В другом варианте осуществления протеин RSV или его часть, слитая с протеином из инфекционного агента, связана с M протеином BRSV. В другом варианте осуществления протеин RSV или его часть происходит из F, G, N и/или P протеина RSV. В другом варианте осуществления VLP, кроме того, содержат N и/или P протеин RSV. В другом варианте осуществления VLP содержат более чем один протеин из инфекционного агента. В другом варианте осуществления VLP содержат более чем один протеин из инфекционного агента, таким образом, создавая мультивалентную VLP.
В другом варианте осуществления изобретение относится к способу индукции защитной реакции антител на инфекцию или, по меньшей мере, на один ее симптом у индивида, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV, F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV, или VLP, содержащей модифицированный или мутированный F протеин RSV, как описано выше.
Используемый в настоящем описании термин «антитело» обозначает протеин, содержащий один или более полипептидов, по существу или частично кодируемых генами иммуноглобулинов или фрагментами генов иммуноглобулинов. Признанными генами иммуноглобулинов являются гены константной области каппа-, лямбда-, альфа-, гамма-, дельта-, эпсилон- и мю-цепи иммуноглобулина, а также огромное количество генов вариабельной области иммуноглобулинов. Легкие цепи классифицируются либо как каппа, либо как лямбда. Тяжелые цепи классифицируются как гамма, мю, альфа, дельта или эпсилон, которые в свою очередь определяют классы иммуноглобулинов соответственно IgG, IgM, IgA, IgD и IgE. Типичная структурная единица иммуноглобулина (антитела) содержит тетрамер. Каждый тетрамер составлен из двух идентичных пар полипептидных цепей, причем каждая пара имеет одну «легкую» (примерно 25 кД) и одну «тяжелую» цепь (примерно 50-70 кД). N-конец каждой цепи ограничивает вариабельную область примерно из 100-110 аминокислот, главным образом, ответственных за распознавание антигена. Антитела существуют в виде интактных иммуноглобулинов или как ряд хорошо охарактеризованных фрагментов, полученных перевариванием различными пептидазами.
В одном варианте осуществления изобретение относится к способу индукции защитной клеточной реакции против инфекции RSV или, по меньшей мере, одного симптома заболевания у индивида, включающему введение, по меньшей мере, одной эффективной дозы модифицированного или мутированного F протеина RSV. В другом варианте осуществления изобретение относится к способу индукции защитной клеточной реакции против инфекции RSV или, по меньшей мере, одного симптома заболевания у индивида, включающему введение, по меньшей мере, одной эффективной дозы F мицеллы RSV, содержащей модифицированный или мутированный F протеин RSV. В еще одном варианте осуществления изобретение относится к способу индукции защитной клеточной реакции против инфекции RSV или, по меньшей мере, одного симптома заболевания у индивида, включающему введение, по меньшей мере, одной эффективной дозы VLP, где VLP содержит модифицированный или мутированный F протеин RSV, как описано выше. Клеточноопосредованный иммунитет также играет роль в излечении от инфекции RSV и может предотвратить осложнения, связанные с RSV. RSV-специфические клеточные лимфоциты были выявлены в крови и секретах из нижних дыхательных путей инфицированных индивидов. Цитолиз инфицированных RSV клеток опосредуется CTL (цитотоксическими Т-лимфоцитами) согласованно с RSV-специфическими антителами и комплементом. Первичная цитотоксическая реакция может выявляться в крови через 6-14 дней и исчезать к 21-му дню у инфицированных или вакцинированных индивидов (Ennis et al., 1981). Клеточноопосредованный иммунитет может также играть роль в выздоровлении при инфекции RSV и может предотвратить связанные с RSV осложнения. RSV-специфические клеточные лимфоциты были выявлены в крови и секретах нижних дыхательных путей инфицированных индивидов.
Как указано выше, иммуногенные композиции по настоящему изобретению предотвращают или уменьшают, по меньшей мере, один симптом инфекции RSV у индивида. Симптомы инфекции RSV хорошо известны в данной области. Они включают ринорею, боль в горле, головную боль, охриплость голоса, кашель, выделение мокроты, лихорадку, хрипы, стридор и одышку. Таким образом, способ по изобретению включает предотвращение или уменьшение, по меньшей мере, одного симптома, связанного с инфекцией RSV. Уменьшение симптома может определяться субъективно или объективно, например, самостоятельной оценкой индивидом, оценкой клиницистом или проведением соответствующего анализа или измерения (например, температуры тела), включая, например, оценку качества жизни, замедленное прогрессирование инфекции RSV или дополнительных симптомов, уменьшенную тяжесть симптомов инфекции RSV или подходящие анализы (например, титр антител и/или анализ активации T-клеток). Объективная оценка включает оценки и на животных, и на людях.
Данное изобретение далее иллюстрируется следующими примерами, которые не должны рассматриваться как ограничивающие. Содержания всех ссылок, патентов и опубликованных патентных заявок, приведенные по всей заявке, а также чертежи и список последовательностей во всех аспектах включены в настоящее описание путем ссылки.
ПРИМЕРЫ
Пример 1
Генерирование рекомбинантных бакмид, трансфекция клеток насекомых для получения штамма рекомбинантного вируса, очистка бляшек и инфекция клеток насекомых первичным штаммом вируса.
Для конструкции рекомбинантного вируса в представляющих интерес вирусных генах осуществляли оптимизацию кодона для экспрессии клетками Sf9 насекомых и клонировали в векторы pFastBac™ vectors.
После подтверждения и очистки желательных конструктов один флакон компетентных клеток MAX Efficiency® DHlOBac™ для каждого конструкта оттаивали на льду. Приблизительно 1 нг (5 мкл) ДНК плазмиды желательного конструкта pFastBac™ добавляли к клеткам и осторожно смешивали. Клетки инкубировали на льду в течение 30 минут. За этим следовали тепловой шок клеток в течение 45 секунд при 42°C без встряхивания. Затем пробирки переносили на лед и охлаждали в течение 2 минут. В последующем в каждую пробирку добавляли 900 мкл питательной среды S.O.C. комнатной температуры. Пробирки помещали на вибростенд при 37°C и 225 об/мин на 4 часа. Для каждой трансформации pFastBac™ 10-кратные серийные разведения клеток (10-1, 10-2 и 10-3) получали используя среду S.O.C. Затем 100 мкл каждого разведения высевали на чашку с агаром LB, содержащим 50 мкг/мл канамицина, 7 мкг/мл гентамицина, 10 мкг/мл тетрациклина, 100 мкг/мл Bluo-gal (галогенированного индолил-β-галактозида) и 40 мкг/мл IPTG (изопропил-бета-D-тиогалактопиранозида). Чашки инкубировали в течение 48 часов при 37°C. Белые колонии собирали для анализа.
Различные бакмидные ДНК из указанных выше получали для каждого конструкта и изолировали. Эти ДНК осаждали и добавляли к клеткам Sf9 на 5 часов.
Затем 30 мл клеток Sf9 насекомых (2×106 клеток/мл) инфицировали бакуловирусом, экспрессирующим представляющие интерес вирусные протеины, с 0,3 мл бляшечного элюата и инкубировали в течение 48-72 ч. Приблизительно 1 мл неочищенной культуры (клетки + среда) и осветленные сборы культуры сохраняли для анализа экспрессии, а остальные сохраняли в целях очистки.
Пример 2
Экспрессия, очистка и анализ модифицированных F протеинов HRSV
Гены, кодирующие представляющие интерес модифицированные F протеины HRSV, синтезировали in vitro в виде перекрывающихся олигонуклеотидов, клонированных и экспрессированных в клетках-хозяевах. Клонирование и экспрессия модифицированных F генов RSV достигались в соответствии со способами, известными в данной области.
Собирали и подтверждали рекомбинантные бляшки, содержащие представляющие интерес вирусные протеины. Затем рекомбинантный вирус амплифицировали инфекцией клеток Sf9 насекомых. В некоторых случаях клетки Sf9 насекомых коинфицировали рекомбинантным вирусом, экспрессирующим модифицированный F протеин, и другим рекомбинантным вирусом, экспрессирующим другие вирусные протеины (например, M протеин BRSV и/или N протеин HRSV). Культуру клеток насекомых инфицировали при ~3 MOI (Множественность инфекции = вирусных ffu (флуоресцентных фокусных единиц) или pfu (бляшкообразующих единиц)/клетку) бакуловирусом, несущим различные конструкты. Культуру и супернатант собирали через 48-72 после инфекции. Неочищенный сбор, приблизительно 30 мл, осветляли центрифугированием в течение 15 минут приблизительно при 800×g. Полученный неочищенный клеточный сбор, содержащий модифицированный F протеин HRSV, очищали, как описано ниже.
Представляющие интерес модифицированные F протеины HRSV очищали из сборов культуры инфицированных клеток Sf9 насекомых. Неионное поверхностно-активное вещество (ПАВ) Tergitol® NP-9 (Nonylphenol Ethoxylate) использовали в протоколе экстракции мембранных протеинов. Неочищенный экстракт далее очищали пропусканием через анионообменную хроматографию, аффинную хроматографию лентил-лектином/HIC (хроматографию гидрофобного взаимодействия) и катионообменную хроматографию.
Экспрессию протеинов анализировали SDS-PAGE (электрофорезом в полиакриламидном геле с додецилсульфатом натрия) и окрашивали для определения общего содержания протеинов красителем кумасси. Равные объемы клеточных образцов из неочищенного сбора и 2x буфера образца, содержащего βME (бета-меркаптоэтанол), загружали, приблизительно от 15 до 20 мкл (примерно до 7,5-10 мкл культуры)/полосу, на гель SDS Laemmli.
В некоторых случаях вместо хроматографии модифицированные F протеины HRSV в неочищенных клеточных сборах концентрировали способом разделения в 30% градиенте сахарозы и затем анализировали SDS-PAGE с окрашиванием кумасси или вестерн-блоттингом с использованием моноклонального антитела против F RSV.
Неочищенный клеточный сбор, содержащий модифицированные рекомбинантные F протеины, очищенные рекомбинантные F протеины или рекомбинантные F протеины, концентрированные градиентом сахарозы, могут, кроме того, анализироваться вестерн-блоттиногом с использованием моноклонального антитела против F RSV и/или поликлонального антитела против F RSV.
Пример 3
Модифицированный ген F HRSV, кодирующий F протеин BV # 541
Первоначальные попытки экспрессировать F протеин HRSV оказались неуспешными в достижении высоких уровней экспрессии. Последовательность F гена, использованная при экспрессии, представляла собой SEQ ID NO: 1 (F ген HRSV дикого типа, № доступа в Генном Банке Ml1486). Он кодирует неактивный предшественник (F0) 574 aa (аминокислота). Данный предшественник расщепляется дважды подобными фурину протеазами во время созревания для выхода двух связанных с дисульфидом полинуклеотидами субъединиц F2 из N конца и F1 из C конца (фиг. 1). Два сайта расщепления находятся у остатков 109 и 136, которым предшествуют мотивы распознавания фурина (RARR, aa 106-109 (SEQ ID NO: 23) и KKRKRR, aa 131-136 (SEQ ID NO: 24)). Последовательность F гена SEQ ID NO: 1 содержит субоптимальное использование кодона для экспрессии в клетках Sf9 насекомых и включает 3 ошибки, продуцируя протеин, который проявляет менее чем оптимальную укладку (SEQ ID NO: 2, № доступа в Генном Банке AAB59858). Кроме того, возможный сайт аденилирования поли(A) (ATAAAA) был идентифицирован в области, кодирующей субъединицу F2. Кроме того, последовательность F гена дикого типа обогащена AT приблизительно на 65%, хотя желательное отношение GC-AT последовательности F гена в системе экспрессии клеток насекомых Sf9 составляет 1:1.
С попыткой преодоления низких уровней экспрессии F протеина HRSV была сконструирована новая последовательность F гена с тем, чтобы:
(a) были исправлены три ошибки секвенирования Генного Банка;
(b) был модифицирован криптический поли(A) сайт в области, кодирующей субъединицу F2;
(c) были оптимизированы кодоны F гена; и
(d) F ген кодировал модифицированный F протеин с инактивированным сайтом первичного расщепления.
Указанные три исправленные аминокислотные ошибки представляли собой P102 A, 1379V и M447V. Криптический поли(A) сайт в F гене HRSV исправляли без изменения аминокислотной последовательности.
Схемы оптимизации кодона были основаны на следующих критериях: (1) обилии аминоацил-тРНаз для конкретного кодона у клеток насекомых вида Lepidopteran (бабочки) для данной аминокислоты, как описано Levin, D. B. et al. (Journal of General Virology, 2000, vol. 81, pp. 2313-2325), (2) поддержании отношения GC-AT ratio в генной последовательности приблизительно на уровне 1:1, (3) минимальной индукции палиндромных или стволо-петельных структур ДНК и (4) минимальном введении транскрипции и последовательностей посттранскрипционного рецепторного элемента. Пример оптимизированной последовательности F гена был показан как SEQ ID NO: 19 (RSV-F BV #368).
Для инактивации сайта первичного расщепления (1° CS, KKRKRR, aa 131-136) F протеина HRSV сайт распознавания фурина был мутипирован или в KKQKQQ (SEQ ID NO: 28), или в GRRQQR (SEQ ID NO: 29). Несколько модифицированных F протеинов с такими мутациями сайта расщепления оценивались для определения эффективности предотвращения расщепления. На фиг. 2 показаны несколько модифицированных F протеинов, которые оценивались. Результаты указывают на то, что сайт первичного расщепления F протеина HRSV может быть инактивирован тремя изменениями консервативных аминокислот R133Q, R135Q и R136Q. Указанные изменения консервативных аминокислот из Аргинина (R), который представляет собой полярно заряженную молекулу, в Глутамин (Q), который представляет собой нейтрально заряженную молекулу, изменяли состояние заряда в указанных сайтах и предотвращали расщепление подобными фурину протеазами (см. фиг. 3) при сохранении 3D структуры F протеина. Предотвращение расщепления в 1° CS привело к сниженной активности мембранного слияния F протеина.
Неограничивающая иллюстративная модифицированная последовательность F гена HRSV, сконструированная для включения всех указанных выше модификаций, показана на фиг. 4. Данный модифицированный F ген (SEQ ID NO: 5, RSV-F BV #541) кодирует модифицированный F протеин SEQ ID NO: 6. Данная генная последовательность была синтезирована in vitro в виде перекрывающихся олигонуклеотидов, клонированных и экспрессированных в клетках-хозяевах. Модифицированный F протеин BV #541 был очищен из сборов культур инфицированных клеток Sf9 насекомых и анализировался SDS-PAGE при окрашивании кумасси. Способ очистки и анализа SDS-PAGE описан в примере 2. Уровень экспрессии F протеина RSV-F BV #541 (например, F протеина 541) был улучшен по сравнению с F0 протеином дикого типа в клетках Sf9 насекомых.
Пример 4
Модифицированный протеин F HRSV с частичной делецией субъединицы F 1 домена слияния
Для дальнейшего улучшения экспрессии F протеина RSV были дополнительно сконструированы модифицированные F гены HRSV, которые включали следующие модификации:
(a) были исправлены указанные три ошибки секвенирования Генного Банка;
(b) был модифицирован криптический поли(A) сайт в области, кодирующей субъединицу F2;
(c) были оптимизированы кодоны F гена; и
(d) была частично делетирована нуклеотидная последовательность, кодирующая домен слияния субъединицы F1. В одном эксперименте нуклеотидная последовательность, кодирующая первые 10 аминокислот домена слияния субъединицы F1, была делетирована (соответствующая аминокислотам 137-146 SEQ ID NO: 2).
Неограничивающий иллюстративный модифицированный F ген RSV, содержащий указанные модификации, показан на фиг. 5, обозначенный как SEQ ID NO: 9 (RSV-F BV #622, например F протеин 622), кодирующий модифицированный F протеин SEQ ID NO: 10. Модифицированный F протеин HRSV BV #622 был очищен из сборов культуры клеток инфицированных клеток Sf9 насекомых и анализировался SDS-PAGE при окрашивании кумасси. Способ очистки и анализ SDS-PAGE описан в примере 2. Наблюдались высокие уровни экспрессии F протеина HRSV BV #622, как представлено на SDS-PAGE на фиг. 6.
Пример 5
Модифицированный F протеин HRSV с инактивированным сайтом первичного расщепления и частичной делецией домена слияния F1
Для определения того, может ли комбинация инактивированного сайта первичного расщепления и частичной делеции домена слияния F1 дополнительно стимулировать экспрессию F протеина RSV, в частности, в клетках Sf9 насекомых, был сконструирован другой модифицированный F ген RSV, содержащий следующие модификации:
(a) были исправлены указанные три ошибки секвенирования Генного Банка;
(b) был модифицирован криптический поли(A) сайт в области, кодирующей субъединицу F2;
(c) были оптимизированы кодоны F гена;
(d) сайт первичного расщепления был инактивирован; и
(e) была частично делетирована нуклеотидная последовательность, кодирующая субъединицу Fl домена слияния. В одном эксперименте была делетирована нуклеотидная последовательность, кодирующая первые 10 аминокислот субъединицы Fl домена слияния (соответствующая аминокислотам 137-146 SEQ ID NO: 2).
Неограничивающий иллюстративный модифицированный F ген RSV, содержащий указанные модификации, показан на фиг. 7, обозначенный как SEQ ID NO: 7 (RSV-F BV #683, например F протеин 683), кодирующий F протеин SEQ ID NO: 8. Модифицированный F протеин RSV BV #683 (например, F протеин 683) очищали из сборов инфицированной культуры клеток Sf9 насекомых и анализировали SDS-PAGE с окрашиванием кумасси. Способ очистки и анализ SDS-PAGE описан в примере 2. Были достигнуты другие усиления уровней экспрессии, как представлено при SDS-PAGE на фиг. 8.
Пример 6
Экспрессия и очистка модифицированного F протеина HRSV BV #683
Модифицированный F протеин HRSV BV #683 (например, F протеин 683, SEQ ID NO: 8) был экспрессирован в системе экспрессии бакуловируса, как описано в примере 1, и собирали и подтверждали рекомбинантные бляшки, экспрессирующие F протеин HRSV BV #683. Рекомбинантный вирус затем амплифицировали инфекцией клеток Sf9 насекомых. Культуру клеток насекомых инфицировали при ~3 MOI (Множественности инфекции = ffu вируса или pfu/клетки) бакуловирусом. Культуру и супернатант собирали через 48-72 ч после инфекции. Неочищенный сбор, приблизительно 30 мл, просветляли центрифугированием в течение 15 минут приблизительно при 800×g. Полученные неочищенные клеточные сборы, содержащие F протеин HRSV BV #683, очищали, как описано ниже.
F протеин HRSV BV #683 очищали из культуры инфицированных клеток Sf9 насекомых. Неионное ПАВ Tergitol® NP-9 (нонилфенол этоксилат) использовали в протоколе экстракции мембранного протеина. Неочищенный экстракт далее очищали пропусканием через анионообменную хроматографическую колонку при аффинной хроматографии лентил-лектином/HIC и катионообменной хроматографии.
Очищенный F протеин HRSV BV #683 анилизировали SDS-PAGE с окрашиванием кумасси и вестерн-блоттингом с использованием моноклонального антитела против F протеина RSV, как описано в примере 2. Результаты показаны на фиг. 9. Были достигнуты превосходные уровни экспрессии F протеина HRSV BV #683 (например, F протеина 683, SEQ ID NO: 8). По оценке в неочищенной клеточной культуре уровень экспрессии превышал 10 мг/л, и извлеченный F протеин BV #683 составлял примерно 3,5 мг/л клеточной культуры. В некоторых случаях были достигнуты уровни экспрессии выше 20 мг/л, и было извлечено примерно 5 мг/л модифицированного F протеина BV #683 (см. фиг. 10). Чистота извлеченного F протеина BV #683 достигала более 98% по данным определения сканирующей денситометрии (см. фиг. 10).
Пример 7
Очищенные мицеллы (розетки) F протеина HRSV BV #683
Очищенный F протеин HRSV BV #683 анализировали электронной микроскопией после негативного окрашивания (см. фиг. 11). F протеины агрегировались в форме мицелл (розеток), аналогичных тем, которые наблюдались для F протеина HRSV дикого типа (Calder et al., 2000, Virology 271, pp. 122-131), и других гликопротеинов вирусной мембраны полной длины (Wrigley et al., Academic Press, London, 1986, vol. 5, pp. 103-163). При электронной микроскопии F спайки проявляли палочковую морфологию в форме леденцов на палочках с их более широкими концами, выступающими от центров розеток. Длина одного триммера составляла примерно 20 нм, и диаметр мицеллярной частицы составлял примерно 40 нм (см. фиг. 12). Данные результаты указали на то, что F протеин HRSV BV #683 имеет правильную трехмерную 3D структуру для нативного, активного протеина.
В заключение был сконструирован, экспрессирован и очищен модифицированный, рекомбинантный F протеин HRSV (например, BV #683). Данный модифицированный F протеин полной длины гликозилировали. Модификации первичного сайта расщепления и домен слияния значительно повышали уровень экспрессии F протеина. Кроме того, данный модифицированный F протеин может расщепляться на субъединицы F1 и F2, которые связаны дисульфидом. Тримеры субъединиц Fl и F2 образуют спайки в форме «леденца на палочке» длиной 19,6 нм и частицами 40,2 нм. Кроме того, данный модифицированный F протеин высоко экспрессирован в клетках Sf9 насекомых. После очистки достигается чистота мицелл > 98%. Тот факт что спайки данного модифицированного протеина имеют морфологию «леденца на палочке», который может, кроме того, образовывать частицы мицелл размером 40 нм, указывает на то, что модифицированный F протеин BV #683 имеет правильную трехмерную структуру нативного протеина.
Пример 8
Коэкспрессия модифицированного F протеина HRSV с M BRSV и/или N протеинами HRSV при получении VLP
Настоящее изобретение также относится к VLP, содержащим модифицированный или мутированный F протеин RSV. Такие VLP могут использоваться для индукции антител к антигенам вирусных протеинов и, таким образом, могут вводиться для установления иммунитета против RSV. Например, такие VLP могут содержать модифицированный F протеин RSV и M BRSV и/или N протеины HRSV. Кодоны генов, кодирующих протеины M BRSV (SEQ ID NO: 14) или N HRSV (SEQ ID NO: 18), могут оптимизироваться для экспрессии в клетках насекомых. Например, оптимизированная последовательность M гена BRSV показана в SEQ ID NO: 13 и оптимизированная последовательность N гена RSV показана в SEQ ID NO: 17.
В одном эксперименте модифицированный F протеин BV #622 и другой модифицированный F протеин BV #623 (SEQ ID NO: 21, модифицированные так, что оба сайта расщепления инактивированы) были или экспрессированы отдельно, или коэкспрессированы с N протеином HRSV и M протеином BRSV. Оба неочищенных клеточных сбора, содержащие VLP (внутриклеточные) и осажденные VLP после центрифугирования, собранные в результате разделения в 30% градиенте сахарозы, анализировали SDS-PAGE с окрашиванием кумасси и вестерн-блоттингом с использованием моноклонального антитела против F RSV. На фиг. 13 показана структура модифицированных F протеинов BV #622 и BV #623 и результаты SDS-PAGE и анализа вестерн-блоттингом. BV #622 был высоко экспрессирован сам по себе или коэкспрессирован с N протеином HRSV и M протеином BRSV, тогда как BV #623 имел очень слабую экспрессию, указывая на то, что инактивация обоих сайтов расщепления ингибирует экспрессию F протеина.
В еще одном эксперименте модифицированный F протеин BV #622, ген BV #636 (BV #541 + BRSV M) с тандемной дупликацией, BV #683, BV #684 (BV #541 с L-доменом YIAL, введенным на C конце) и BV #685 (BV #541 с L-доменом YKKL, введенным на C конце) были экспрессированы или отдельно, или коэкспрессированы с N протеином HRSV и M протеином BRSV. L-домен (поздний домен) представляет собой консервативную последовательность в ретровирусах и присутствует внутри Gag, действуя в сочетании с клеточными протеинами для эффективного высвобождения вирионов из поверхности клетки (Ott et al., 2005, Journal of Virology 79: 9038-9045). Структура каждого модифицированного F протеина показана на фиг. 14. Оба неочищенных клеточных сбора, содержащие VLP (внутриклеточные) и VLP после осаждения центрифугированием, собранные разделением в 30% градиенте сахарозы, анализировали SDS-PAGE с окрашиванием кумасси и вестерн-блоттингом с использованием моноклонального антитела против F протеина RSV. На фиг. 14 показаны результаты SDS-PAGE и анализа вестерн-блоттингом неочищенных клеточных сборов, содержащих VLP (внутриклеточные), и на фиг. 15 показаны результаты SDS-PAGE и анализа вестерн-блоттингом VLP, осажденных центрифугированием, собранных разделением в 30% градиенте сахарозы. BV #622 и BV #683 были высоко экспрессированы сами по себе или коэкспрессированы с N протеином HRSV и M протеином BRSV, тогда как BV #636, BV #684 и BV #685 имели слабую экспрессию.
Пример 9
Скрининг F протеинов HRSV с высокой экспрессией
Были предприняты попытки скрининга для выявления дополнительных F протеинов RSV, которые могут быть высоко экспрессированы в подходящей форме в клетках насекомых и могут образовывать VLP с высоким выходом. Были сконструированы, экспрессированы и анализированы различные F гены. Для оценки экспрессии использовали и вестерн-блоттинг, и SDS-PAGE.
На фиг. 16a-16d суммированы: структура, название клона, описание, результаты анализа вестерн-блоттингом/окрашивание и заключение по каждому химерному F клону HRSV.
Как указано в результатах, F протеин полной длины дикого типа был слабо экспрессирован; химерные F протеины HRSV, которые содержат субъединицу F1, но не F2, могли быть хорошо экспрессированы, но продукты были или нерастворимыми, что могло быть следствием ошибочной укладки, или могли не осуществлять сборку с другими вирусными протеинами для образования VLP с хорошим выходом после коинфекций. Инактивация одного первичного сайта расщепления не привела к существенным увеличениям экспрессии, но лучшая экспрессия достигалась, когда инактивация первичного сайта расщепления комбинировалась с другой модификацией, такой как делеция криптического поли(A) сайта и исправление ошибок секвенирования аминокислот Генного Банка (например, BV #541). Введение L-домена YKKL в C-конец BV #541 усиливало секрецию VLP, содержащих модифицированный F протеин на протяжении примерно 2-3 складок (folds) в коэкспрессии с M BRSV и N протеинами HRSV. Результаты, кроме того, показали, что двойной тандемный химерный ген, состоящий из гена BV #541 и гена M BRSV, проявлял и улучшенную внутриклеточную экспрессию, и улучшенный выход VLP по сравнению с коинфекцией BV #541 и M протеинов BRSV, указывая на то, что M протеин BRSV может содействовать продукции VLP, содержащих модифицированный F протеин HRSV в клетках насекомых при тандемной экспрессии. Тройной тандемный химерный ген, состоящий из BV #541, M BRSV и N протеинов HRSV, имел даже более высокую внутриклеточную экспрессию и гораздо лучший выход VLP по сравнению с указанным выше двойным тандемным химерным геном или коинфекцией BV #541, M BRSV и N протеинами HRSV. Кроме того, данные результаты свидетельствовали о том, что химерный F протеин HRSV BV#683 (например, F протеин 683, SEQ ID NO: 8) имел наилучшую внутриклеточную экспрессию. Экспрессия тандемной дупликации гена, состоящего из генов BV#683 и M BRSV, или тройного тандемного химерного гена, состоящего из генов BV#683, M BRSV и N протеинов HRSV, также осуществлена в настоящем изобретении. Эти двойной и тройной тандемные химерные гены должны дополнительно улучшить продукцию VLP по сравнению с коинфекцией.
Пример 10
Анализ нейтрализации RSV и исследования контрольного заражения RSV у мышей
Для тестирования эффективности вакцины, содержащей модифицированный F протеин HRSV BV #683 в предотвращении инфекции RSV, проводили анализ нейтрализации RSV и исследования контрольного заражения RSV у мышей. Экспериментальные процедуры показаны на фиг. 17.
Группам мышей (n=10) внутримышечно инъецировали (за исключением живого RSV) плацебо (раствор PBS), живой RSV (вводимый внутримышечно), инактивированную формалином вакцину RSV (FI-RSV), 1 мкг частиц F (PFP, модифицированного F протеина BV #683), 1 мкг частиц очищенного F с квасцами (PFP + Alum), 10 мкг частиц очищенного F, 10 мкг частиц очищенного F с квасцами (PFP + Alum) или 30 мкг частиц очищенного F в 0-й и 21-й день. Каждую иммунизированную группу подвергали контрольному заражению живым RSV на 42-й день (21 день после второй иммунизации). Сыворотку у мышей каждой группы брали в 0-й и 31-й день (через 10 дней после второй иммунизации) и на 46-й день (через четыре дня после контрольного заражения живым RSV).
Сыворотку мышей из каждой группы лечения анализировали на присутствие нейтрализующих антител против RSV. Разведения сыворотки от иммунизированных мышей инкубировали с инфекционным RSV в 96-луночных микротитровальных планшетах. Сыворотку разбавляли от 1:20 до 1:2560. 50 мкл разбавленной сыворотки смешивали с 50 мкл живого вируса RSV (400 pfu) в каждой лунке. Смесь вируса/сыворотки сначала инкубировали в течение 60 мин при комнатной температуре, а затем смешивали со 100 мкл клеток HEp-2 и инкубировали в течение 4 дней. Затем подсчитывали число бляшек инфекционного вируса после окрашивания кристаллическим фиолетовым. Титр нейтрализации для каждого образца сыворотки определяли как обратную величину самого высокого разведения сыворотки, которая давала 100% нейтрализацию RSV (т.е. отсутствие бляшек), и ее определяли для каждого животного. Геометрическую среднюю величину титра нейтрализующих антител в сыворотке в 31-й день (через 10 дней после повторной иммунизации) и 46-й день (через 4 дня после контрольного заражения живым RSV) наносили на график для каждой группы, получавшей вакцину. На фиг. 18 показаны результаты анализов нейтрализации. Результаты указывают на то, что 10 мкг или 30 мкг очищенного F протеина дают гораздо более высокий титр нейтрализации по сравнению с живым RSV. Кроме того, титры нейтрализации PFP повышаются при совместном введении квасцового адъюванта.
Исследования контрольного заражения RSV проводили для определения того, может ли иммунизация предотвратить и/или ингибировать репликацию RSV в легких иммунизированных животных. Количество RSV в легких иммунизированных мышей определяли анализом бляшек, используя клетки HEp-2. Указанные выше иммунизированные группы мышей инфицировали 1×106 pfu инфекционного длинного штамма RSV интраназально на 42-й день (через 11 дней после второй иммунизации). На 46-й день (через 4 дня после инфекции RSV) легкие мышей удаляли, взвешивали и гомогенизировали. Гомогенизированную легочную ткань осветляли. Супернатант просветленного раствора разбавляли и подвергали анализу бляшек с использованием клеток HEp-2 для определения титра RSV в легочной ткани (рассчитанного в виде pfu/г легочной ткани). Результаты, показанные на фиг. 19, указывают на то, что у всех мышей, иммунизированных рекомбинантным F протеином RSV BV #683, имелся неопределяемый RSV в легких, и даже 1 мкг очищенного рекомбинантного F протеина HRSV BV #683 без адъюванта проявил превосходную эффективность в ингибировании репликации RSV (сниженной более чем в 1000 раз по сравнению с плацебо).
Для определения устойчивости вакцины PFP RSV, использованной выше, вакцину хранили при 2-8°C в течение 0, 1, 2, 4 и 5 недель, а затем анализировали SDS-PAGE с окраской кумасси (фиг. 20). Результаты показывают, что данная вакцина PFP RSV очень устойчива при 2-8°C и нет выявляемого ее разрушения.
Пример 11
Активность F мицеллы рекомбинантного RSV у хлопковых крыс
В данном примере группы животных включали иммунизацию в 0 и 21-й дни живым RSV (RSV), инактивированным формалином RSV (FI-RSV), F протеином RSV BV #683 с квасцами и без квасцов (PFP и PFP + Алюминиевый Адъювант), и контролировали PBS.
Как показано на фиг. 21, иммунизация 30 мкг F-мицеллярной вакциной (F протеином RSV BV #683, т.е. F протеином 683, SEQ ID NO: 8), с алюминием и без него, вызывала выраженные реакции антител после воздействия и RSV A, и RSV B. Кроме того, титры нейтрализующих антител были увеличены после повторной иммунизации в 46-й или 49-й день соответственно в группе RSV A и RSV B.
В то время как у крыс, иммунизированных инактивированным формалином RSV (FI-RSV), наблюдалась значительная легочная патология при использовании F-мицеллярной вакцины, не отмечено усиление заболевания (фиг. 22). Применение F-мицеллярной вакцины и F-мицеллярной вакцины с адъювантом давало более низкие балльные оценки воспаления (соответственно 4,0 и 2,8), чем в контрольной группе с первичной инфекцией RSV (PBS + контрольное заражение RSV) (5,8). Как отмечено выше, у группы, получавшей лечение FI-RSV, была более высокая балльная оценка воспаления, чем в контрольной группе с первичной инфекцией RSV (PBS + контрольное заражение RSV) (9,0 в сравнении с 5,8). Кроме того, у группы, леченной FI-RSV, была значительно более высокая средняя балльная оценка воспаления (9,0), чем у не подвергавшихся контрольному заражению плацебо у группы, получавшей живой RSV + контрольное заражение RSV, F-мицеллу + контрольное заражение RSV и F-мицеллу + квасцы + контрольное заражение RSV.
Представленное выше описание было дано только для ясности понимания, и из него не следует понимать ненужные ограничения, поскольку для специалистов в данной области будут очевидны возможные модификации. Оно не является допущением, что любая информация, содержащаяся в описании, представляет собой предшествующий уровень техники или релевантна к заявляемым в настоящее время изобретениям или что любая публикация, на которую имеется специальная или однозначная ссылка, является предшествующим уровнем техники.
Пока нет других определений, все технические и научные термины, использованные в настоящем описании, имеют такое же значение, которое общепонятно среднему специалисту в данной области, для которого предназначено настоящее изобретение.
Хотя описание было разбито на разделы для направления внимания читателя на определенные варианты осуществления, такие разделы не следует рассматривать как разделение между вариантами осуществления изобретения. Положения каждого раздела и вариантов осуществления, описанных в настоящей заявке, применимы к другим разделам.
Хотя изобретение было описано в связи с определенными вариантами его осуществления, следует понимать, что возможны другие модификации и настоящая заявка предназначена для включения любых вариантов, видов применения или адаптаций изобретения, следуя в целом принципам изобретения и включая такие отходы от настоящего описания, как входящие в пределы известной и обычной практики в данной области, к которой относится изобретение, и как может применяться к существенным признакам, изложенным выше в настоящей заявке, и как следует из объема прилагаемой формулы изобретения.