Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ
Вид РИД
Изобретение
Настоящее изобретение относится к производным 1Н-пиразоло[4,3-c]изохинолинов и применению их в терапии, в частности, в качестве противораковых агентов. Изобретение относится также к способу получения соединений согласно изобретению, а также к некоторым промежуточным реакционным продуктам, используемым в упомянутом способе.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Используемые обозначения
В рамках настоящего изобретения подразумевают под обозначением:
- атом галогена (Hal): атом фтора, хлора, брома или йода;
- алкильная группа: алифатическая насыщенная углеводородная группа, содержащая 1-6 атомов углерода (предпочтительно 1-4 атома углерода), линейная или разветвленная, образующаяся при удалении атома водорода из алкана. В качестве примера можно назвать группы: метил, этил, пропил, изопропил, бутил, изобутил или трет-бутил;
- алкоксигруппа: -О-алкильная группа, в которой алкильная группа такая, как описано выше;
- фторалкильная группа: алкильная группа, содержащая один или несколько атомов фтора вместо одного или нескольких атомов водорода;
- циклоалкильная группа: циклическая алкильная группа, содержащая 3-7 атомов углерода, при этом все атомы углерода включены в циклическую структуру. В качестве примеров можно назвать группы: циклопропил, циклобутил, циклопентил или циклогексил;
- защитная группа: группа, предназначенная для защиты химической функциональной группы от нежелательных химических реакций, которую вводят на стадии защиты и высвобождают на последующей стадии. Примеры защитных групп можно найти в документе T.W. Greene с сотр. «Protective Groups in Organic Chemistry», 3-е издание, 1999, Wiley-Interscience или в документе J.F.M. McOmie «Protective Groups in Organic Chemistry» Plenum Press, 1973. В качестве примеров защитных групп можно назвать трет-бутилкарбаматную (ВОС) или [2-(триметилсилил)этокси]метильную (SEM) группу.
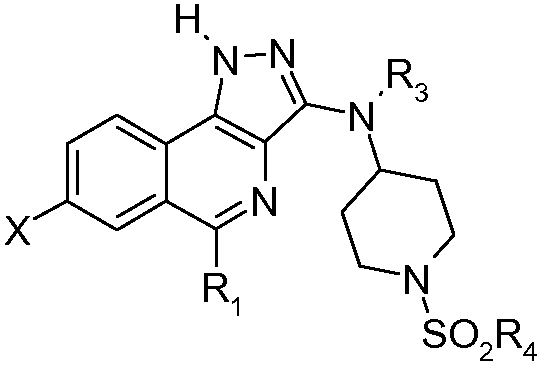
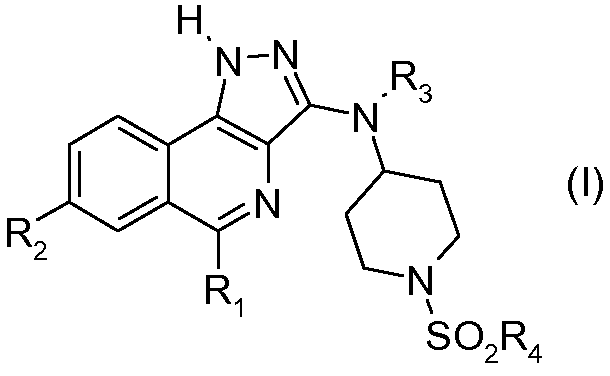
В соответствии с 1-м аспектом, настоящее изобретение относится к соединению формулы (I)
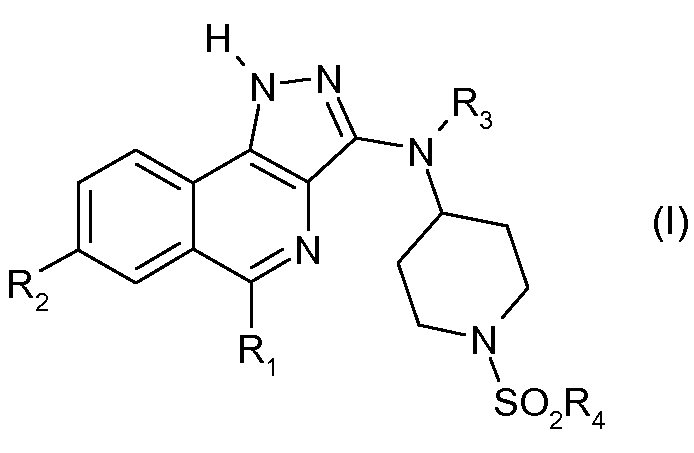
в которой:
R1 означает фенильную группу, необязательно замещенную одним или несколькими атомами галогена. Более конкретно, речь идет о 2,6-дифторфенильной группе.
R2 означает:
- атом водорода или галогена или цианогруппу;
- группу -C(=O)Y, в которой Y означает атом водорода или группу -NH2 или -ORa;
- группу -C(=S)NH2;
- группу -C(=NH)NH-OH;
- группу -CH2OH или -CH2F;
- группу -CH=N-OH;
- группу -CH=CH2 или -C≡C-Ra;
- группу  (4-пиразолил) или
(4-пиразолил) или  (3-триазол);
(3-триазол);
Ra означает атом водорода или (С1-С4)алкильную группу. Более конкретно, Ra означает атом водорода. R2 может быть выбран, более конкретно, из групп R2 согласно примерам, указанным в таблице I.
R3 означает атом водорода или (С1-С4)алкильную группу. Более конкретно, R3 означает атом водорода.
R4 означает -NH2, (С1-С4)алкильную, (С1-С4)фторалкильную или (С3-С7)циклоалкильную группу. Более конкретно, R4 может быть выбран из групп R4 согласно примерам, указанным в таблице I.
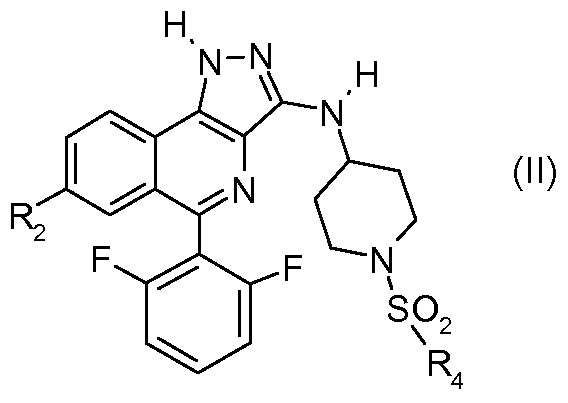
Среди соединений формулы (I) выделяют подгруппу соединений формулы (II)
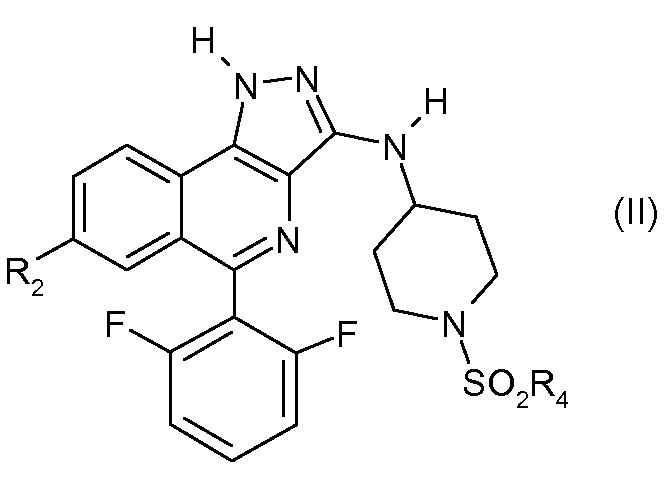
в которой R2 и R4 такие, как определено выше.
Среди соединений согласно изобретению можно назвать более конкретно соединения таблицы I.
Соединения согласно изобретению могут находиться в форме оснований или кислотно-аддитивных солей. Предпочтительно, эти соли получают с фармацевтически приемлемыми кислотами, но соли с другими кислотами, полезными для очистки или выделения соединений, также составляют часть изобретения. Соединения, также необязательно, могут содержать один или несколько асимметричных атомов углерода. Следовательно, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры и диастереоизомеры, а также их смеси составляют часть изобретения.
В соответствии со 2-м аспектом, изобретение относится к способу получения соединений согласно изобретению, а также к некоторым промежуточным реакционным продуктам, участвующим в упомянутом способе.
Получение соединений формулы (I)
Соединения формулы (I) получают в несколько стадий исходя из Р1 и Р2, следуя схеме 1:
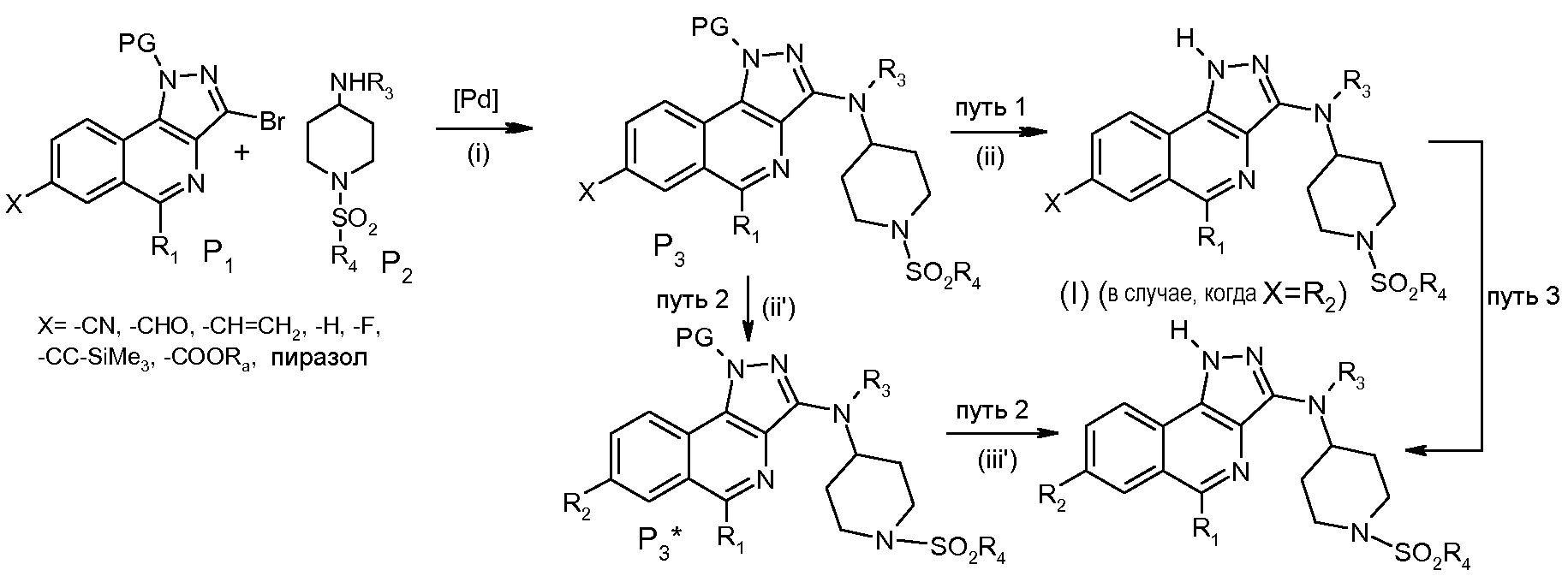
Схема 1
На стадии (I) осуществляют реакцию сочетания Бухвальда-Хартвига между Р1 и Р2 с получением Р3. PG обозначает защитную группу NH-функциональной группы пиразольного цикла и Х означает одну из следующих групп: -CN, -CHO, -CH=CH2, -H, -F, -C≡C-SiMe3, -COORa или 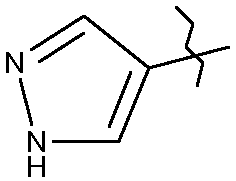 .
.
Этот метод сочетания осуществляют в присутствии комплекса палладия (в степени окисления (0) или (II), необязательно получаемого in situ). Можно использовать, например, Pd(PPh3)4, PdCl2(PPh3)2, Pd(OAc)2 или PdCl2(dppf), Pd2(dba)3, или смесь Pd(OAc)2 и 9,9-диметил-4,5-бис(дифенилфосфино)ксантена. Наиболее часто используемыми комплексами являются комплексы палладия (0). Сочетание протекает более благоприятно в присутствии основания, которым может быть, например, K2CO3, NaHCO3, Et3N, K2PO4, Ba(OH)2, NaOH, KF, CsF, Cs2CO3. Сочетание можно проводить в полярном растворителе, таком как, например, 1,4-диоксан. Примеры каталитических систем на основе палладия можно найти в документах: Guram A.; Rennels R.; Buchwald S. ACIEE 1995, 34, 1348; Louie J.; Hatwig J. Tel. Lett. 1995, 3609; Wolfe J.; Wagaw S.; Buchwald S.J. Am. Chem. Soc. 1996, 118, 7215; Driver M.; Hartwig J.J. Am. Chem. Soc. 1996, 118, 7217; Hamann B.; Hartwig J.J. Am. Chem. Soc. 1998, 120, 7369; Kawatsura M.; Hartwig J.J. Am. Chem. Soc. 1999, 121, 1473.
В случае, когда заместитель Х означает один из заместителей R2, определенных выше, соединение формулы (I) получают после снятия защитной группы PG на стадии (ii) пути 1. Условия для снятия защиты зависят от природы PG и являются известными для специалиста (смотрите, например, T.W. Greene с сотр. «Protective Groups in Organic Chemiistry», 3-е издание, 1999). Например, в случае группы SEM (β-(триметилсилил)этоксиметил), снятие защитной группы происходит в присутствии кислоты, такой как трифторуксусная кислота (ТФА) или хлористоводородная кислота.
В случае, когда заместитель Х не означает один из заместителей R2, то осуществляют одну или несколько химических реакций, известных специалисту, для превращения заместителя Х в заместитель R2. Согласно пути 2, Р3 превращают в Р3* на стадии (ii'), затем соединение формулы (I) получают после снятия защитной группы PG на стадии (iii'). Согласно альтернативному пути 3, превращение осуществляют непосредственно на самом соединении формулы (I).
Ниже находятся примеры превращений Х→R2:
- X=-CN→R2=-C(=O)NH2 (стадия 2 примера 4 и примера 14) или -С(=О)ОН: гидролиз нитрильной группы, например, с помощью гидроксида натрия;
- X=-CN→R2=-C(=S)NH2 (пример 9): эту реакцию можно осуществлять с помощью сульфида аммония в метаноле при микроволновом облучении (смотрите Synlett 2004, 14, 2615-2617);
- X=-CN→R2=-C(=O)H: эту реакцию можно осуществлять в присутствии диизобутилалюминийгидрида (стадия 1 примера 23);
- X=-C(=О)Н→R2=-CH=N-OH: превращение альдегидной группы в оксимную группу в присутствии NH2OH (пример 20);
- X=-C(=О)Н→R2=-CH2OH (пример 3): восстановление альдегидной группы с помощью восстановителя альдегидной группы, например, с помощью NaBH4;
- X=-C≡С-SiMe3→R2=-C≡CH (стадия 4 примера 7): реакцию можно осуществлять в присутствии тетрабутиламмонийфторида;
- Х=-С(=О)Н→-СН2ОН→R2=-CH2F (стадия 1 примера 17): фторирование осуществляют с помощью трифторида диэтиламиносульфида (DAST) (смотрите А.Н. Fauq, “N,N-Diethylaminosulfur Trifluoride” в Encyclopedia of Reagents for Organic Synthesis, изд.: L.Paquette 2004, J.Wiley & Sons, Нью-Йорк);
- Х=-C≡С-SiMe3→-C≡CH→R2=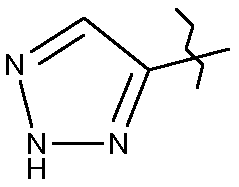 : реакция циклоприсоединения по Хьюзгену между алкиновой группой и триметилсилилазидом N3SiMe3 позволяет получить 1,2,3-триазольный цикл.
: реакция циклоприсоединения по Хьюзгену между алкиновой группой и триметилсилилазидом N3SiMe3 позволяет получить 1,2,3-триазольный цикл.
Получение соединений Р 1
Соединения Р1, у которых Х означает -Н, -Hal, -СООН или -CN, получают, следуя схеме 2, путем бромирования в основной среде соединения Р4 с последующей защитой защитной группой PG. Бромирование осуществляют, например, с помощью брома в присутствии КОН в полярном растворителе, таком как ДМФА. Примерами используемых защитных групп являются группа SEM, вводимая посредством SEM-Cl в присутствии основания, такого как, например, диизопропилэтиламин (DIPEA), или группа SO2NMe2 (смотрите пример 1), вводимая посредством Cl-SO2NMe2.
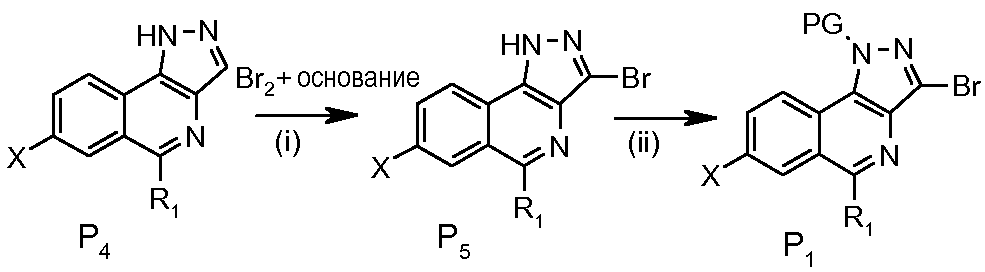
Схема 2
Соединения Р1, у которых Х означает -СНО, -СН=СН2, -С≡С-SiMe3, 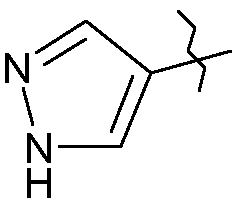 , получают на одной или нескольких стадиях из вышеупомянутого соединения Р5 или Р1, у которых Х означает -I, и А означает атом водорода (Р5) или PG (Р1) (схема 3):
, получают на одной или нескольких стадиях из вышеупомянутого соединения Р5 или Р1, у которых Х означает -I, и А означает атом водорода (Р5) или PG (Р1) (схема 3):
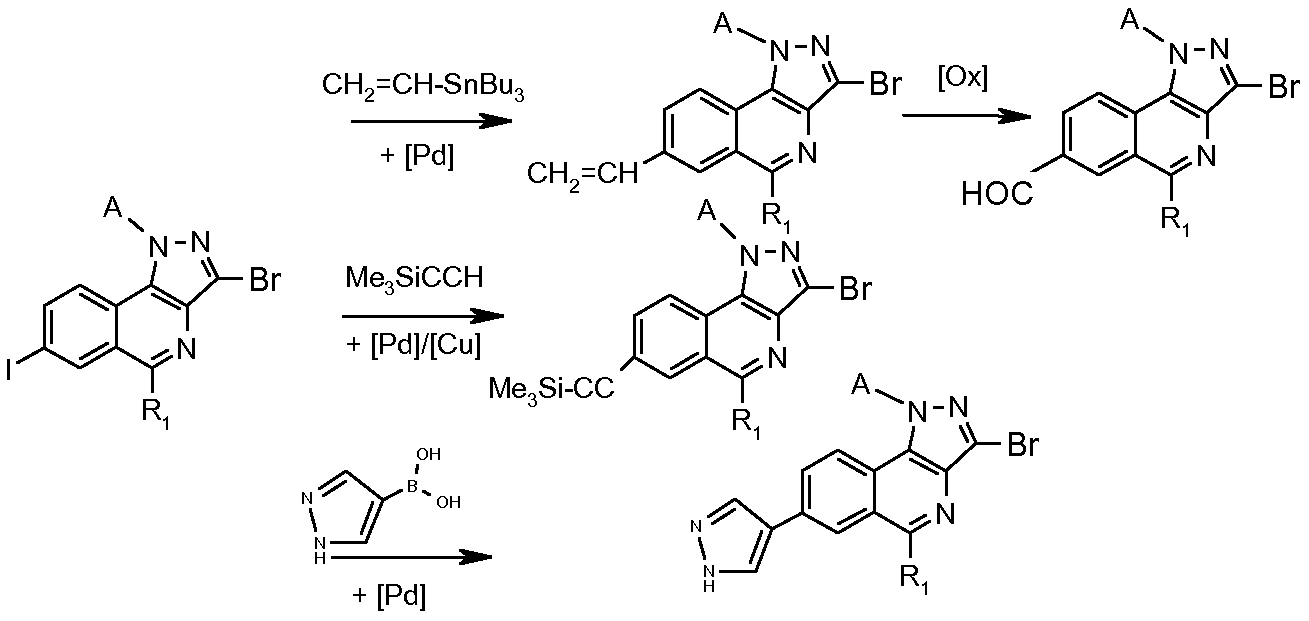
Схема 3
Конкретными реакциями, используемыми на схеме 3, являются:
- в случае Х=-СН=СН2: реакция Стилле с использованием -CH=CH-SnBu3 и комплекса палладия(0);
- в случае Х=-СНО: реакция окисления с использованием, например, тетраоксида осьмия;
- в случае Х=-С≡С-SiMe3: реакция Соногашира в присутствии НС≡С-SiMe3 и комплекса палладия(0) или (II) и соли меди (более подробно об этой реакции смотрите Chem. Rev. 2007, 107(3), 874-922; смотрите также стадию 2 примера 7);
- в случае Х=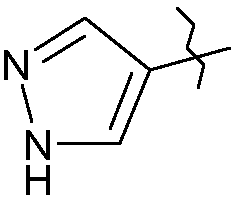 : сочетание по Сузуки с использованием 4-пиразолбороновой кислоты в присутствии комплекса палладия(0) или (II) и основания (возможно использование соответствующего пинаколинового эфира);
: сочетание по Сузуки с использованием 4-пиразолбороновой кислоты в присутствии комплекса палладия(0) или (II) и основания (возможно использование соответствующего пинаколинового эфира);
Соединения Р1, у которых Х означает -СОО(С1-С4)алкил, получают этерификацией соответствующих соединений Р1, у которых Х=-СООН.
Получение соединений Р 4
Соединения Р4, у которых Х означает -Н или -Hal, получают из соединения Р6 (схема 4), которое либо является рыночным продуктом (например, Х=I, CAS № 31827-94-8), либо его получают путем бромирования в кислотной среде соответствующего ацетофенона (смотрите стадию 1 примера 1):
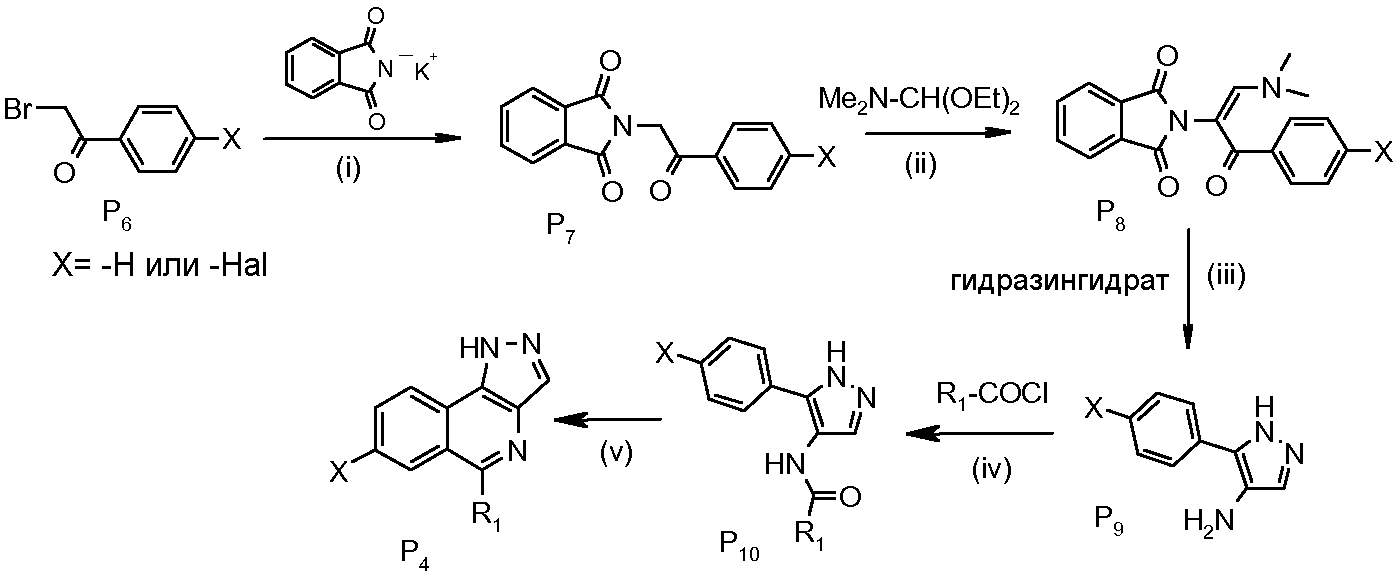
Схема 4
стадия (i): реакция между Р6 и фталимидом калия, которая приводит к Р7. Реакция может быть проведена в полярном растворителе, таком как ДМФА (смотрите стадию 2 примера 1 или стадию 1 примера 6);
стадия (ii): реакция Р7 с N,N-диметилформамиддиэтилацеталем, которая приводит к Р6. Реакция может быть проведена непосредственно с N,N-диметилформамиддиэтилацеталем при кипячении с обратным холодильником (смотрите стадию 1 примера 3);
стадия (iii): реакция Р8 с гидразингидратом, которая приводит к Р9. Реакция может быть проведена в полярном растворителе, таком как этанол (смотрите стадию 4 примера 1 или стадию 3 примера 6);
стадия (iv): реакция ацилирования Р9 с хлорангидридом кислоты R1COCl, которая приводит к Р10. Реакция может быть проведена в хлорированном растворителе, таком как ДХМ, в присутствии нуклеофильного катализатора, такого как пиридин;
стадия (v): реакция циклизации Р10 по Бишлеру-Наперальскому, которая приводит к Р4. Реакцию можно проводить в присутствии Р2О5 и дихлорида фенилфосфиновой кислоты при температуре >100°С (стадию 6 примера 1 или стадию 5 примера 6). Можно также использовать POCl3.
Соединения Р4, у которых Х означает -CN, получают циклизацией соответствующих защищенных соединений Р4, у которых Х означает -I. Используют, например, Zn(CN)2 и комплекс палладия(0) (реакция Розенмунда-Брауна: смотрите Chem. Rev. 1951, 49, 392).
Получение Р 2
Р2 можно получить, следуя схеме 5 (смотрите также WO 2003082871 стадии 1-4 примера 4, с.34-36), из аминопиперидина, защищенного по аминогруппе:
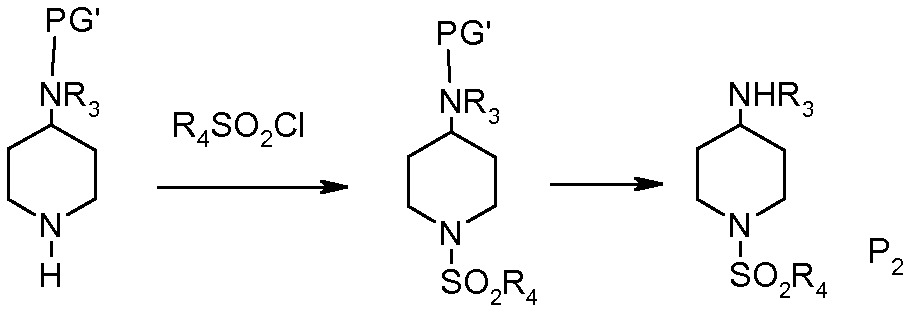
Схема 5
PG' означает защитную группу для аминофункции. Преимущественно, это может быть группа ВОС (трет-бутоксикарбонил).
Таким образом, изобретение относится также к способу получения соединения формулы
в которой R1, R3 и R4 такие, как определено выше, и Х означает атом водорода или фтора, цианогруппу, -С(=О)Н, -СН=СН2, -С≡С-SiMe3, -COORa, где Ra означает атом водорода или (С1-С4)алкильную группу или группу  , состоящему в том, что:
, состоящему в том, что:
(i) осуществляют реакцию сочетания соединений Р1 и Р2, описанных на схеме 1, в присутствии комплекса палладия и, необязательно, основания,
(ii) снимают защиту с продукта, полученного на предыдущей стадии (i).
Изобретение относится также к способу получения соединения формулы:
в которой R1, R3 и R4 такие, как определено выше, и R2 означает одну из следующих групп: -C(=O)NH2, -C(=S)NH2, -C(=O)H, -CH=N-OH, -CH2OH, -CH2F, -C≡CH или  ,
,
из соединения формулы: 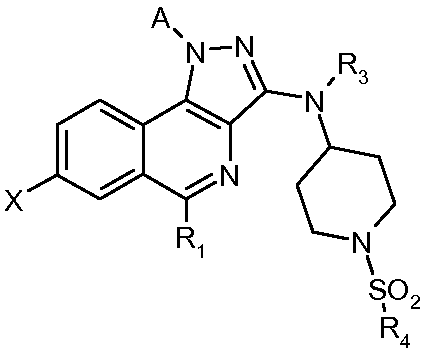 , в которой Х означает группу -CN, -CHO, -CH2OH, -C≡CH, -C≡C-SiMe3 и А означает атом водорода или защитную группу PG,
, в которой Х означает группу -CN, -CHO, -CH2OH, -C≡CH, -C≡C-SiMe3 и А означает атом водорода или защитную группу PG,
состоящему в том, что:
(i)
- гидролизуют группу Х=-CN до группы R2=-C(=O)NH2 или -С(=О)ОН;
- превращают группу Х=-CN в группу R2=-C(=S)NH2 в присутствии сульфида аммония при микроволновом облучении;
- восстанавливают группу Х=-CN до группы R2=-С(=О)Н;
- превращают группу Х=-С(=О)Н в группу R2=-СН=N-ОН в присутствии NH2OH;
- восстанавливают группу Х=-С(=О)Н до группы R2=-CH2OH;
- превращают группу Х=-С≡С-SiMe3 в группу R2=-С≡СН;
- фторируют группу Х=-СН2ОН до группы R2=-CH2F;
- превращают группу Х=-С≡СН в группу R2=  реакцией циклоприсоединения в присутствии триметилсилилазида N3SiMe3.
реакцией циклоприсоединения в присутствии триметилсилилазида N3SiMe3.
(ii) при желании удаляют защитную группу продукта, полученного на предыдущей стадии (i).
Соединения формулы (I) могут быть также получены из соединений Р1 и Р'2, следуя схеме 6:
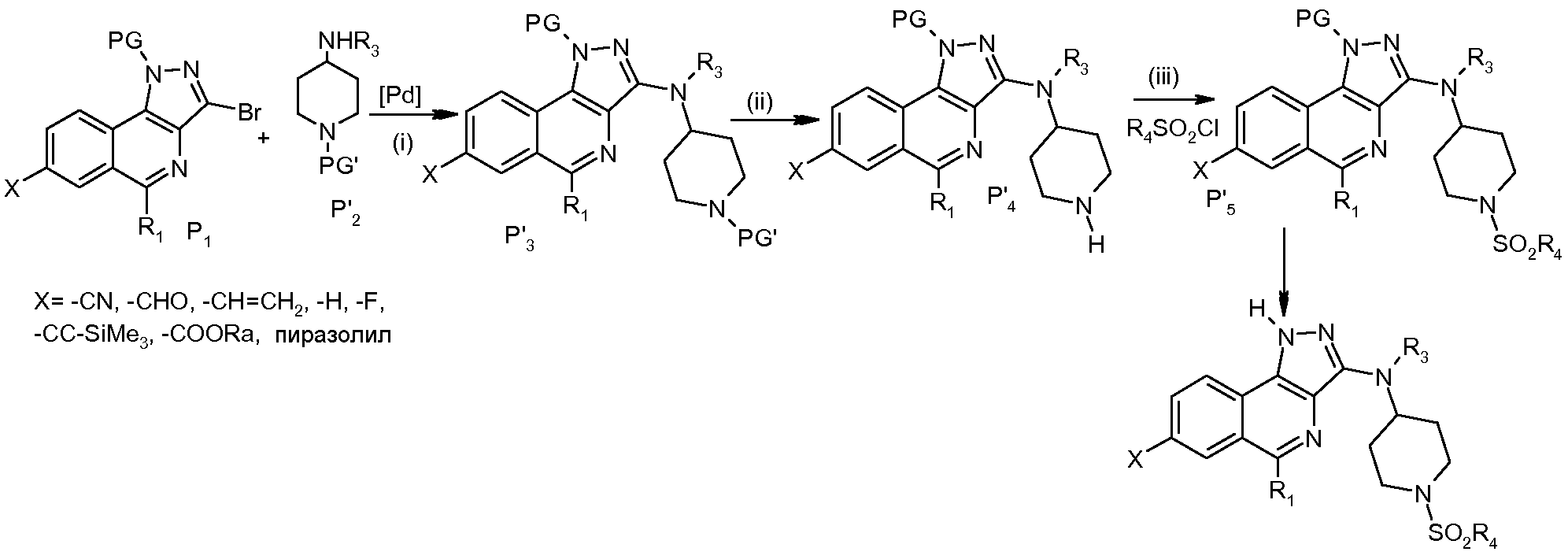
Схема 6
Стадию (i) осуществляют путем сочетания по Бухвальду-Хартвигу между Р1 и Р'2, что приводит к P'3. PG означает защитную группу для NH-функциональной группы пиразольного цикла, PG' означает защитную группу для аминофункции и Х означает одну из следующих групп: -CN, -CHO, -CH=CH2, -H, -F, -C≡C-SiMe3, -COORa или  .
.
На стадии (ii) снимают защитную группу с аминофункции, чтобы получить соединение Р′4, которое затем взаимодействует на стадии (iii) с соединением R4SO2Cl с получением P′5. Затем снимают защитную группу с NH-функциональной группы пиразольного цикла и получают соединение формулы (I).
Таким образом, изобретение относится также к способу получения соединения формулы
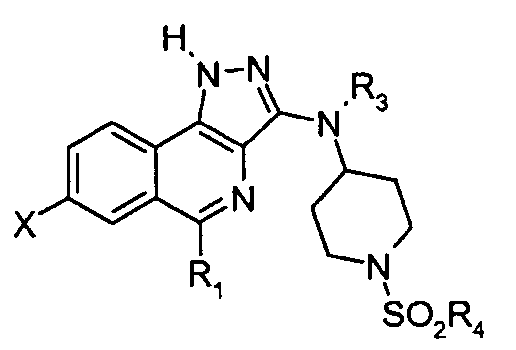
в которой R1, R3 и R4 такие, как определено выше, и X означает атом водорода или фтора, или цианогруппу, -C(=O)H,
CH=CH2, -C≡C-SiMe3, -COORa или группу  , где Ra означает
, где Ra означает
атом водорода или (C1-C4) алкильную группу
состоящему в том, что:
(i′) соединение Р′4 формулы
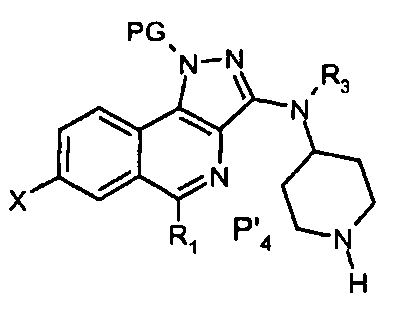
подвергают взаимодействию с соединением R4SO2Cl, (ii′) удаляют защитную группу продукта, полученного на предыдущей стадии (i).
Изобретение относится также к соединениям формулы
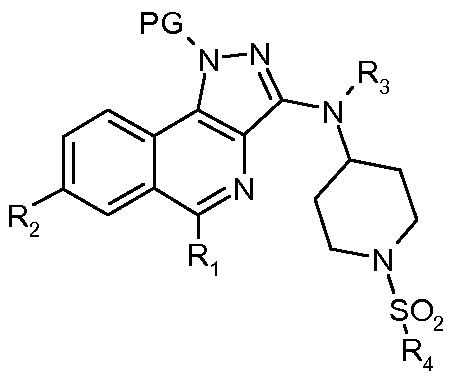 (схема 1) или формулы
(схема 1) или формулы 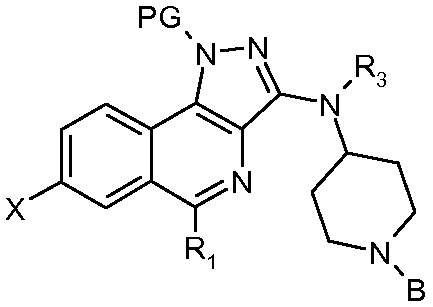 (схема 6), в которых:
(схема 6), в которых:
- R1, R2, R3 и R4 такие, как определено выше;
- Х означает атом водорода или фтора, цианогруппу, -С(=О)Н, -СН=СН2, -С≡С-SiMe3, -С≡СН, -COORa, где Ra означает атом водорода или (С1-С4)алкильную группу или группу  ;
;
- PG означает защитную группу для NH-функциональной группы пиразольной группы;
- В означает атом водорода или защитную группу PG' для аминофункции.
Более конкретно, PG означает SEM или SO2NMe2 и PG' означает BOC.
В соответствии с 3-м аспектом, изобретение относится к фармацевтической композиции, содержащей соединение такое, как описано выше, в комбинации с фармацевтически приемлемым вспомогательным веществом. Вспомогательное вещество выбирают, в зависимости от лекарственной формы и желаемого способа введения, из обычных вспомогательных веществ, которые известны специалисту.
В соответствии с 4-м аспектом, изобретение относится к лекарственному средству, содержащему соединение такое, как описано выше, а также к применению соединения такого, как описано выше, для получения лекарственного средства. Соединение может быть введено в сочетании с одним (или несколькими) другим противораковым агентом. Такой способ лечения может быть осуществлен при одновременном, раздельном или последовательном введении соединений. Способ лечения выбирается врачом в зависимости от заболевания и типа опухоли, на которую направлено лечение.
В соответствии с 5-м аспектом, изобретение относится также к способу лечения патологий, указанных выше, который включает введение пациенту эффективной дозы соединения согласно изобретению или одной из его фармацевтически приемлемых солей, или одного из его гидратов или сольватов.
ПРИМЕРЫ
Следующие примеры иллюстрируют получение некоторых соединений согласно изобретению.
Анализы LC-MS-DAD-ELSD
Колонка: Atlantis T3; 3,0Ч50 мм; размер гранул 3 мкм; по каталогу номер Waters 186003721; расход элюента=0,8 мл/мин; блок нагревания: LC=35°C; DAD: длина волны 200-400 нм; градиент за 7 мин с использованием смеси А (вода/муравьиная кислота 0,1%) и ацетонитрила В: 0 мин (95% А; 5% В); 5 мин (5% А; 95% В); 5,5 мин (5% А; 95% В); 6,5 мин (95% А; 5% В); 7 мин (95% А; 5% В).
Анализ 1 Н-ЯМР
Спектры 1Н-ЯМР записывали на приборе Brьker 400 МГц в ДМСО-d6. Химические смещения приведены в м.д.
Получение соединений, указанных в таблице I
Пример 1: 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1H-пиразоло[4,3-c]изохинолин-7-карбоксамид
Стадия 1: В трехгорлую колбу емкостью 1 л вводят 50 г 4-йодацетофенона в 500 мл ледяной уксусной кислоты. Затем приливают по каплям при комнатной температуре (КТ) 10,4 мл брома. Реакционную среду перемешивают в течение 2 часов при комнатной температуре, затем выпаривают при пониженном давлении (ПД). Неочищенный продукт обрабатывают толуолом 3 раза примерно по 200 мл, затем один раз 200 мл метиленхлорида (ДХМ) и каждый раз концентрируют при пониженном давлении (ПД) для удаления всех следов уксусной кислоты и брома. Полученный твердый продукт оранжевого цвета сушат в вакууме в эксикаторе при комнатной температуре. Таким путем получают 66 г 2-бром-1-(4-йодфенил)этанона в виде твердого вещества оранжевого цвета, используемого на следующей стадии без дополнительной очистки.
Масс-спектр (MS) (E/I): m/z=404 (M+).
1Н-ЯМР: 4,90 (с, 2Н), 7,74 (д, J=8,5 Гц, 2Н), 7,96 (д, J=8,5 Гц, 2Н).
Стадия 2: В колбу емкостью 500 мл вводят 66 г 2-бром-1-(4-йодфенил)этанона в 140 мл ДМФА и 38 г фталимида калия. Смесь перемешивают при комнатной температуре в течение 4 часов и образовавшийся осадок отфильтровывают через фриттированное стекло, промывают 3 раза по 50 мл изопропиловым эфиром. Таким путем, после сушки при пониженном давлении получают 80 г 2-[2-(4-йодфенил)-2-оксоэтил]изоиндол-1,3-диона в виде твердого вещества белого цвета, используемого на следующей стадии без дополнительной очистки.
SM (E/I): m/z=391 (M+).
1Н-ЯМР: 5,21 (с, 2Н), 7,84 (д, J=8,5 Гц, 2Н), 7,88-7,98 (м, 4Н), 8,00 (д, J=8,5 Гц, 2Н).
Тпл. (по Кофлеру): 230°C.
Стадия 3: В колбу емкостью 500 мл вводят 81,6 г 2-[2-(4-йодфенил)-2-оксоэтил]изоиндол-1,3-диона в 134 мл N,N-диметилформамиддиэтилацеталя. Реакционную среду нагревают с обратным холодильником в течение 5 часов, затем охлаждают на ледяной бане примерно до 0°С. Образовавшийся осадок центрифугируют на фриттированном стекле, промывают изопропиловым эфиром два раза по 50 мл, затем осуществляют 2 промывки с осветлением (промывка лепешки без перемешивания) с помощью 50 мл изопропилового эфира. После сушки при пониженном давлении, получают 79 г смеси изомеров Е и Z 2-[2-диметиламино-1-(4-йодбензоил)винил]изоиндол-1,3-диона в виде твердого вещества желто-оранжевого цвета.
SM (E/I): m/z=446 (M+).
1Н-ЯМР: 2,92 (м шир., 6Н), 7,22 (д, J=8,5 Гц, 2Н), 7,49 (с шир., 1Н), 7,80 (д, J=8,5 Гц, 2Н), 7,92 (м, 4Н).
Т.пл. (по Кофлеру): 226°C.
Стадии 4: В колбу емкостью 1 л вводят при комнатной температуре 78,3 г смеси изомеров E и Z 2-[2-диметиламино-1-(4-йодбензоил)винил]изоиндол-1,3-диона в 535 мл этанола. Получают суспензию коричневого цвета, к которой добавляют 21 мл гидразингидрата. Суспензию нагревают с обратным холодильником. Через 30 минут нагревания наблюдается загустевание смеси, которая приобретает желто-лимонный цвет. Эту суспензию перемешивают при кипячении с обратным холодильником в течение 4 часов 30 минут, затем смесь доводят до комнатной температуры. Суспензию центрифугируют на фриттированном стекле и осадок промывают этанолом 2 раза по 100 мл. Получают фильтрат, который после выпаривания образует 46 г твердого вещества 1 желтого цвета и остаток 2 первоначального осадка, который сушат при пониженном давлении при 40°С и получают таким путем 39 г порошка кремового цвета. Твердое вещество 1 перемешивают в течение 15 минут в 300 мл EtOAc. Отфильтровывают и повторяют эту операцию 13 раз, используя каждый раз 150 мл EtOAc. Различные фильтраты объединяют и концентрируют при пониженном давлении. Таким путем получают 24,3 г твердого вещества золотисто-желтого цвета. Осадок 2 обрабатывают 300 мл EtOAc. Отфильтровывают и повторяют эту операцию 7 раз, используя каждый раз 150 мл EtOAc. Различные фильтраты объединяют и концентрируют при пониженном давлении. Получают 7,3 г твердого вещества желто-лимонного цвета. Обе партии объединяют, получая 31,6 г 3-(4-йодфенил)-1Н-пиразол-4-иламина (твердое вещество оранжевого цвета).
SM (E/I): m/z=285 (M+).
1Н-ЯМР: 4,04 (с шир., 2Н), 7,15 (с, 1Н), 7,57 (д шир., J=8,5 Гц, 2Н), 7,72 (д, J=8,5 Гц, 2Н), 12,35 (м уш., 1Н).
Стадия 5: В колбу емкостью 2 л вводят 31,5 г 3-(4-йодфенил)-1Н-пиразол-4-иламина в 425 мл ДХМ и 278 мг пиридина. Смесь охлаждают до 0°С на ледяной бане и добавляют 13,9 мл хлорангидрида 2,6-дифторбензойной кислоты. Температуре в течение 3 часов дают постепенно подняться до комнатной температуры. После выпаривания растворителя при пониженном давлении в неочищенную реакционную среду добавляют воду, затем водный слой экстрагируют с помощью EtOAc. Органические экстракты объединяют, промывают насыщенным раствором NaCl, сушат над MgSO4. Затем выпаривают EtOAc в вакууме и получают таким путем 49,2 г смеси 2,6-дифтор-N-[5-(4-йодфенил)-1Н-пиразол-4-ил]бензамида и N-[1-(2,6-дифторбензоил)-5-(4-йодфенил)-1H-пиразол-4-ил]-2,6-дифторбензамида в виде воздушной массы оранжевого оттенка, которую используют далее без дополнительной очистки. Неочищенную реакционную среду обрабатывают таким образом, чтобы получить только целевой продукт: в 3-литровой колбе при комнатной температуре в атмосфере аргона растворяют 49,2 г смеси 2,6-дифтор-N-[5-(4-йодфенил)-1Н-пиразол-4-ил]бензамида и N-[1-(2,6-дифторбензоил)-5-(4-йодфенил)-1H-пиразол-4-ил]-2,6-дифторбензамида в 950 мл этанола и 470 мл ТГФ, затем добавляют 385 мл 5 н. водного раствора едкого натра. Через 1 час перемешивания при комнатной температуре выливают смесь в 1025 мл 2 н. хлористоводородной кислоты. Экстрагируют с помощью EtOAc, промывают органические слои насыщенным раствором NaCl, сушат над MgSO4, затем концентрируют при пониженном давлении. Получают неочищенный продукт, который суспендируют в 570 мл ДХМ и перемешивают при кипячении с обратным холодильником в ДХМ в течение 15 минут. После охлаждения с помощью ледяной бани, осадок центрифугируют промывают 2 раза с помощью 30 мл ледяного ДХМ. Получают 25,8 г 2,6-дифтор-N-[5-(4-йодфенил)-1Н-пиразол-4-ил]бензамида (твердое вещество кремового цвета).
SM (E/I): m/z=425 (M+).
1Н-ЯМР: 7,15-7,25 (м, 2Н), 7,51 (д, J=8,5 Гц, 2Н), 7,57 (м, 1Н), 7,79 (д, J=8,5 Гц, 2Н), 7,93 (м уш., 1Н), 10,2 (с, 1Н), 13,3 (м уш., 1Н).
Тпл. (по Кофлеру): 204°С.
Стадия 6: В колбу емкостью 500 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, вводят 9,2 г 2,6-дифтор-N-[5-(4-йодфенил)-1Н-пиразол-4-ил]бензамида, 168 мл дихлорида фенилфосфиновой кислоты и 46,3 г пентоксида фосфора. После выдерживания в течение 23 часов при 165°С смесь охлаждают до комнатной температуры, затем выливают в смесь 260 мл воды и 400 г льда. Температура повышается до 40°С. Нейтрализуют путем медленного добавления 930 мл 3 М раствора карбоната натрия, затем 110 мл 28%-ного водного раствора гидроксида аммония. Экстрагируют 1 раз 1150 мл и 2 раза по 550 мл EtOAc. Органические экстракты объединяют, промывают насыщенным раствором NaCl и сушат над MgSO4, затем концентрируют при пониженном давлении. Полученное твердое вещество перемешивают в течение 15 минут при кипячении с обратным холодильником в 220 мл ДХМ, охлаждают на ледяной бане, затем фильтруют и промывают 2 раза по 28 мл ледяным ДХМ. После сушки в вакууме при 40°С получают 7,4 г 5-(2,6-дифторфенил)-7-йод-1Н-пиразоло[4,3-c]изохинолина (твердое вещество кремового цвета).
SM (E/I): m/z=407 (M+).
1Н-ЯМР: 7,39 (т, J=8,0 Гц, 2Н), 7,71 (м, 1Н), 7,99 (с шир., 1Н), 8,33 (м, 2Н), 8,45 (с шир., 1Н), 14,35 (с шир., 1Н).
Тпл. (по Кофлеру): 260°С.
Стадия 7: В колбу емкостью 1000 мл в атмосфере аргона вводят 7,4 г 5-(2,6-дифторфенил)-7-йод-1Н-пиразоло[4,3-c]изохинолина в 190 мл тетрагидрофурана и 20 мл диметилформамида (ДМФА), после охлаждения до 0°С на ледяной бане добавляют 1 г NaH (50%-ная суспензия в вазелиновом масле) и перемешивают в течение 30 минут при 0°С, затем добавляют при этой же температуре 2,7 мл диметилсульфамоилхлорида. После выдерживания в течение 1 часа при комнатной температуре неочищенную среду выливают в насыщенный раствор NH4Cl. Водный слой экстрагируют 3 раза по 300 мл EtOAc. Органические экстракты объединяют, сушат над MgSO4, концентрируют при пониженном давлении. После очистки флеш-хроматографией на силикагеле (40-63 мкм) с элюированием смесью ДХМ/метанол (98/02 об.) получают 9 г смеси региоизомеров положения: диметиламида 5-(2,6-дифторфенил)-7-йодпиразоло[4,3-c]изохинолин-1-сульфоновой кислоты и диметиламида 5-(2,6-дифторфенил)-7-йодпиразоло[4,3-c]изохинолин-2-сульфоновой кислоты, в виде твердого вещества.
SM (E/I): m/z=514 (M+).
1Н-ЯМР: 3,02 (с, 6Н), 7,40 (т, J=8,0 Гц, 2Н), 7,74 (м, 1Н), 7,92 (с шир., 1Н), 8,32 (дд, J=1,5 и 8,5 Гц, 1Н), 8,39 (д, J=8,5 Гц, 1Н), 9,31 (с, 1Н).
Т.пл.: 224°С.
Стадия 8: В колбу емкостью 500 мл, снабженную магнитной мешалкой и обратным холодильником с вводом для аргона, помещают 5,4 г твердого вещества, полученного на стадии 7, в 100 мл ДМФА. После барботирования аргона в течение 10 минут к реакционной среде добавляют 1,6 г цианида цинка, 0,28 г Pd(PPh3)4 и нагревают смесь при 130°С при перемешивании в течение 1 часа 30 минут. Неочищенную реакционную смесь вливают в 100 объемов воды, водный слой экстрагируют 3 раза по 400 мл EtOAc, затем органические экстракты объединяют, сушат над MgSO4 и концентрируют при пониженном давлении. Полученный остаток загущают в диизопропилоксиде, фильтруют и сушат в эксикаторе при 35°С. Таким путем получают 3,3 г смеси региоизомеров диметиламида 7-циано-5-(2,6-дифторфенил)пиразоло[4,3-c]изохинолин-1-сульфоновой кислоты (твердое вещество кремового цвета).
SM (E/I): m/z=413 (M+).
1Н-ЯМР: 3,03 (с, 6Н), 7,39 (т, J=8,0 Гц, 2Н), 7,75 (м, 1Н), 8,24 (с шир., 1Н), 8,38 (дд, J=1,5 и 8,5 Гц, 1Н), 8,76 (д, J=8,5 Гц, 1Н), 9,41 (с, 1Н).
Тпл.: 231°С (по Кофлеру).
Стадия 9: В колбу емкостью 250 мл вводят 4 г смеси региоизомеров диметиламида 7-циано-5-(2,6-дифторфенил)пиразоло[4,3-c]изохинолин-1-сульфоновой кислоты в 160 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 108 мл ТФА и перемешивают при комнатной температуре в течение 6 часов. Смесь концентрируют при пониженном давлении, полученное твердое вещество обрабатывают 600 мл воды и добавляют 50 мл 0,75 М раствора гидроксида аммония. Водный слой экстрагируют 3 раза по 150 мл EtOAc. Органические экстракты объединяют, промывают насыщенным раствором NaCl, затем сушат над MgSO4. После концентрирования EtOAc при пониженном давлении получают 2,6 г 5-(2,6-дифторфенил)-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество бежевого цвета).
SM (E/I): m/z=306 (M+).
1Н-ЯМР: 7,38 (т, J=8,0 Гц, 2Н), 7,72 (м, 1Н), 8,24 (с шир., 1Н), 8,34 (дд, J=1,5 и 8,5 Гц, 1Н), 8,59 (с, 1Н), 8,70 (д, J=8,5 Гц, 1Н), 14,5 (м очень уш., 1Н).
Стадия 10: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 2,6 г 5-(2,6-дифторфенил)-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 85 мл ДМФА, 0,87 мл брома и 1,5 г КОН. После перемешивания в течение 1 часа при комнатной температуре смесь выливают в ледяную воду. Водный слой экстрагируют 3 раза по 150 мл EtOAc. Органические экстракты объединяют, промывают насыщенным раствором NaCl, затем сушат над MgSO4 и выпаривают при пониженном давлении. Таким путем получают 3,3 г 3-бром-5-(2,6-дифторфенил)-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, используемого на следующей стадии без дополнительной очистки (твердое вещество светло-желтого цвета).
SM (E/I): m/z=385 (M+).
1Н-ЯМР: 7,39 (т, J=8,0 Гц, 2Н), 7,75 (м, 1Н), 8,34 (с шир., 1Н), 8,41 (дд, J=1,5 и 8,5 Гц, 1Н), 8,68 (д, J=8,5 Гц, 1Н), 14,5 (м уш., 1Н).
Стадия 11: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 3,3 г 3-бром-5-(2,6-дифторфенил)-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 85 мл ДМФА, 10,6 мл N,N-диизопропилэтиламина и 3,2 мл 2-(триметилсилил)этоксиметилхлорида. После выдерживания в течение 5 часов при комнатной температуре смесь выливают в 8 объемов ледяной воды. Водный слой экстрагируют 3 раза по 200 мл EtOAc, органические экстракты объединяют, промывают насыщенным раствором NaCl, затем сушат над MgSO4 и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ и метанола (99,5/0,5 об.), и получают, с одной стороны, 2,1 г 3-бром-5-(2,6-дифтофенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в виде твердого вещества белого цвета.
SM (E/I): m/z=515 (M+).
1Н-ЯМР: -0,12 (с, 9Н), 0,87 (т, J=8,0 Гц, 2Н), 3,65 (т, J=8,0 Гц, 2Н), 6,17 (с, 2Н), 7,40 (т, J=8,0 Гц, 2Н), 7,77 (м, 1Н), 8,41 (с шир., 1Н), 8,47 (дд, J=1,5 и 8,5 Гц, 1Н), 8,77 (д, J=8,5 Гц, 1Н).
И, с другой стороны, 1,2 г 3-бром-5-(2,6-дифтофенил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество белого цвета).
SM (E/I): m/z=515 (M+).
1Н-ЯМР: -0,05 (с, 9Н), 0,90 (т, J=8,0 Гц, 2Н), 3,73 (т, J=8,0 Гц, 2Н), 5,92 (с, 2Н), 7,38 (т, J=8,0 Гц, 2Н), 7,76 (м, 1Н), 8,24 (с шир., 1Н), 8,34 (дд, J=1,5 и 8,5 Гц, 1Н), 8,69 (д, J=8,5 Гц, 1Н).
Стадия 12: В колбу емкостью 150 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 1 г 3-бром-5-(2,6-дифтофенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 27 мл 1,4-диоксана. После барботирования аргона через реакционную среду в течение 10 минут добавляют 692 мг 1-метансульфонилпиперидин-4-иламина, 4 г карбоната цезия, 135 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 43 мг ацетата палладия(II). Реакционную смесь нагревают с обратным холодильником в течение 4 часов. После охлаждения смесь выливают в воду, экстрагируют EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ и EtOAc (85/15 об.), и получают таким путем 1 г 5-(2,6-дифтофенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество желтого цвета).
SM (E/I): m/z=596 (M+).
1Н-ЯМР: -0,05 (с, 9Н), 0,89 (т, J=8,0 Гц, 2Н), 1,61 (м, 2Н), 2,11 (м, 2Н), 2,74 (м, 2Н), 2,85 (с, 3Н), 3,59 (м, 2Н), 3,68 (т, J=8,0 Гц, 2Н), 4,46 (м, 1Н), 5,69 (с, 2Н), 6,70 (д, J=8,0 Гц, 1Н), 7,34 (т, J=8,0 Гц, 2Н), 7,68 (м, 1Н), 7,97 (с шир., 1Н), 8,14 (дд, J=1,5 и 8,5 Гц, 1Н), 8,48 (д, J=8,5 Гц, 1Н).
Стадия 13: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 1 г 5-(2,6-дифтофенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 96 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 10,7 мл ТФА и перемешивают при комнатной температуре в течение 20 часов. Реакционную смесь концентрируют при пониженном давлении и полученное твердое вещество обрабатывают 100 мл воды и экстрагируют три раза по 100 мл EtOAc, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Таким путем получают 992 мг трифторацетата 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, используемого на следующей стадии без дополнительной очистки.
SM (E/I): m/z=482 (M+).
Стадия 14: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 992 мг трифторацетата 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, 63 мл этанола, 30 мл ТГФ и 10 мл 9,3 н. гидроксида натрия. После кипячения с обратным холодильником в течение 3 часов смесь охлаждают и выливают в 250 мл 1 М водного раствора дигидрофосфата калия. Экстрагируют с помощью EtOAc, промывают насыщенным водным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Неочищенный твердый продукт растворяют в 20 мл ДМФА, затем добавляют 1 г гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР), 323 мг 1-гидроксибензотриазола (НОВТ), 170 мг хлорида аммония и 1 мл N,N-диизопропилэтиламина (DIPEA). Через 2 часа перемешивания при комнатной температуре реакционную смесь выливают в воду, экстрагируют с помощью EtOAc, промывают 1 М водным раствором дигидрофосфата калия, затем насыщенным водным раствором NaCl. После сушки над MgSO4 фильтрации и концентрирования при пониженном давлении, очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ, метанола и 4 н. метанольного раствора аммиака (90/10/1 об.), получают 321 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксамида (твердое вещество желто-лимонного цвета).
SM (E/I): m/z=500 (M+).
1Н-ЯМР: 1,68 (м, 2Н), 2,11 (м, 2Н), 2,88 (с, 3Н), 2,90 (м, 2Н), 3,56 (м, 2Н), 3,80 (м, 1Н), 6,09 (д, J=8,0 Гц, 1Н), 7,33 (т, J=8,0 Гц, 2Н), 7,57 (с шир., 1Н), 7,69 (м, 1Н), 8,17 (с шир., 1Н), 8,23 (с шир., 1Н), 8,36 (д шир., J=8,5 Гц, 1Н), 8,45 (д, J=8,5 Гц, 1Н), 12,85 (с, 1Н).
Пример 2: 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегидоксим
Стадия 1: В колбу емкостью 250 мл, снабженную приспособлением для ввода аргона, помещают 2,4 г 5-(2,6-дифторфенил)-7-йод-1Н-пиразоло[4,3-c]изохинолина, полученного на стадии 6 примера 1, в 80 мл ДМФА, 0,80 мл брома и 1,4 г KOH. Через 1 час выдерживания при комнатной температуре смесь выливают в ледяную воду. Органический слой экстрагируют 3 раза по 150 мл EtOAc. Органические слои объединяют, промывают насыщенным раствором NaCl, сушат над MgSO4 и выпаривают при пониженном давлении. Получают 2,23 г 3-бром-5-(2,6-дифторфенил)-7-йод-1Н-пиразоло[4,3-c]изохинолина (твердое вещество кремового цвета), используемого на следующей стадии без дополнительной очистки.
SM (E/I): m/z=486 (M+).
Стадия 2: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, загружают 2,22 г 3-бром-5-(2,6-дифторфенил)-7-йод-1Н-пиразоло[4,3-c]изохинолина в 11 мл ДМФА. После барботирования аргона через среду в течение 10 минут добавляют 1,47 мл трибутилвинилстаннана и 481 мг дихлорида бис(трифенилфосфин)палладия(II). Нагревают смесь в течение 1 часа при 100°С, затем после охлаждения выпаривают досуха в вакууме. Получают масло, которое обрабатывают 350 мл EtOAc и 300 мл 20% водного раствора KF. Перемешивают при комнатной температуре в течение 30 минут, затем фильтруют суспензию на фриттированном стекле, покрытом слоем Clarcel Flo. Органический слой экстрагируют при помощи EtOAc, затем промывают насыщенным водным раствором NaCl, сушат над MgSO4 и выпаривают досуха при пониженном давлении. Получают 3,1 г неочищенного вещества, которое очищают хроматографией на силикагеле (20-45 мкм), элюируя смесью ДХМ и метанола (95/5 об.), и получают 1,44 г 3-бром-5-(2,6-дифторфенил)-7-винил-1Н-пиразоло[4,3-c]изохинолина (твердое вещество светло-желтого цвета).
SM (E/I): m/z=386 (M+).
1Н-ЯМР: 5,43 (д, J=11,2 Гц, 1Н), 6,00 (д, J=17,6 Гц, 1Н), 6,92 (дд, J=17,6; 11,2 Гц, 1Н), 7,37 (т, J=7,9 Гц, 2Н), 7,65 (с шир., 1Н), 7,73 (м, 1Н), 8,33 (дд, J=8,8; 1,5 Гц, 1Н), 8,51 (д, J=8,8 Гц, 1Н), 14,59 (м уш., 1Н).
Стадия 3: В колбу емкостью 150 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 1 г 3-бром-5-(2,6-дифторфенил)-7-винил-1Н-пиразоло[4,3-c]изохинолина в 13 мл ТГФ, затем добавляют 7 мл воды, 13 мл трет-бутанола, 0,79 мл 2,5% раствора тетраоксида осьмия в 2-метил-2-пропаноле и 1,7 г перйодата натрия. Перемешивают в течение 3 часов при комнатной температуре, затем смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Получают 1,047 г неочищенного продукта, который очищают хроматографией на силикагеле (20-45 мкм), элюируя смесью ДХМ и метанола (95/5 об.), и получают 686 мг 3-бром-5-(2,6-дифторфенил)-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида (твердое вещество кремового цвета).
SM (E/I): m/z=388 (M+).
1Н-ЯМР: 7,41 (д, J=7,9 Гц, 2Н), 7,77 (м, 1Н), 8,34 (с шир., 1Н), 8,47 (дд, J=8,5; 1,2 Гц, 1Н), 8,69 (д, J=8,5 Гц, 1Н), 10,15 (с, 1Н), 14,89 (м уш., 1Н).
Стадия 4: В колбу емкостью 150 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 780 мг 3-бром-5-(2,6-дифторфенил)-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида в 20 мл ДМФА, 2,5 мл диизопропилэтиламина и 0,75 мл 2-(триметилсилил)этоксиметилхлорида. Перемешивают смесь в течение 24 часов при комнатной температуре, затем выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Получают 1,18 г неочищенного продукта, который очищают хроматографией на силикагеле (20-45 мкм), элюируя смесью ДХМ и метанола (99,5/0,5 об.), и получают, с одной стороны, 545 мг 3-бром-5-(2,6-дифторфенил)-1-(2-триметилсиланилэтоксиметил)-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида в виде твердого вещества кремового цвета.
SM (E/I): m/z=388 (M+).
1Н-ЯМР: -0,13 (с, 9Н), 0,86 (т, J=7,8 Гц, 2Н), 3,66 (т, J=7,8 Гц, 2Н), 6,18 (с, 2Н), 7,43 (т, J=7,9 Гц, 2Н), 7,79 (м, 1Н), 8,39 (с шир., 1Н), 8,48 (дд, J=8,5; 1,5 Гц, 1Н), 8,80 (д, J=8,3 Гц, 1Н), 10,17 (с, 1Н).
И, с другой стороны, 354 мг 3-бром-5-(2,6-дифторфенил)-2-(2-триметилсиланилэтоксиметил)-2Н-пиразоло[4,3-c]изохинолин-7-карбальдегида (твердое вещество кремового цвета).
SM (E/I): m/z=388 (M+).
1Н-ЯМР: -0,08 (с, 9Н), 0,90 (т, J=8,0 Гц, 2Н), 3,73 (т, J=8,0 Гц, 2Н), 5,91 (с, 2Н), 7,41 (т, J=7,8 Гц, 2Н), 7,77 (м, 1Н), 8,22 (с шир., 1Н), 8,42 (дд, J=8,3; 1,5 Гц, 1Н), 8,72 (д, J=8,3 Гц, 1Н), 10,13 (с, 1Н).
Стадия 5: В колбу емкостью 50 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 348,4 мг 3-бром-5-(2,6-дифторфенил)-2-(2-триметилсиланилэтоксиметил)-2Н-пиразоло[4,3-c]изохинолин-7-карбальдегида в 12,5 мл 1,4-диоксана. После барботирования аргона в течение 10 минут добавляют 320 мг 1-метансульфонилпиперидин-4-иламина, 1,1 г карбоната цезия, 62 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 20 мг ацетата палладия(II). Смесь нагревают с обратным холодильником в течение 4 часов. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (20-45 мкм), элюируя смесью ДХМ и EtOAc (85/15 об.), и получают таким путем 217 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида (твердое вещество желтого цвета).
SM (E/I): m/z=615 (M+).
1Н-ЯМР: 0,05 (с, 9Н), 0,89 (т, J=8,1 Гц, 2Н), 1,62 (м, 2Н), 2,12 (м, 2Н), 2,75 (м, 2Н), 2,85 (с, 3Н), 3,59 (м, 2Н), 3,67 (т, J=8,1 Гц, 2Н), 4,46 (м, 1Н), 5,68 (с, 2Н), 6,63 (д, J=8,3 Гц, 1Н), 7,37 (т шир., J=7,8 Гц, 2Н), 7,68 (м, 1Н), 8,06 (с шир., 1Н), 8,25 (дд, J=8,4; 1,7 Гц, 1Н), 8,52 (д, J=8,4 Гц, 1Н), 10,08 (с, 1Н).
Стадия 6: В колбу емкостью 100 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 211 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида в 8,5 мл пиридина, добавляют 36 мг гидроксиламинхлоргидрата и перемешивают в течение 64 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают EtOAc, промывают 1 М водным раствором фосфата калия, затем насыщенным водным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (20-45 мкм), элюируя смесью ДХМ и EtOAc (75/25 об.), и получают таким путем 184 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегидоксима (твердое вещество желтого цвета).
SM (E/I): m/z=630 (M+).
1Н-ЯМР: 0,04 (с, 9Н), 0,89 (м, 2Н), 1,61 (м, 2Н), 2,11 (м, 2Н), 2,74 (м, 2Н), 2,85 (с, 3Н), 3,58 (м, 2Н), 3,67 (м, 2Н), 4,46 (м, 1Н), 5,65 (с, 2Н), 6,50 (д, J=8,3 Гц, 1Н), 7,33 (т шир., J=8,1 Гц, 2Н), 7,65 (м, 1Н), 7,72 (с шир., 1Н), 8,01 (дд, J=8,4; 1,7 Гц, 1Н), 8,27 (с, 1Н), 8,35 (д, J=8,4 Гц, 1Н), 11,39 (с, 1Н).
Стадия 7: В колбу емкостью 50 мл, снабженную приспособлением для ввода аргона, помещают 180 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегидоксима в 15 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 1,8 мл ТФА и перемешивают в течение 6 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 50 мл воды и 2 мл 0,75 М водного раствора гидроксида аммония. Экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. После хроматографии на силикагеле (20-45 мкм) с элюированием смесью ДХМ и метанола (92,5/7,5 об.), получают 63 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегидоксима (твердое вещество желто-лимонного цвета).
SM (E/I): m/z=500 (M+).
1Н-ЯМР: 1,67 (м, 2Н), 2,11 (м, 2Н), 2,87 (с, 3Н), 2,89 (м, 2Н), 3,56 (м, 2Н), 3,79 (м, 1Н), 6,06 (д, J=7,8 Гц, 1Н), 7,32 (т шир., J=7,6 Гц, 2Н), 7,67 (м, 1Н), 7,84 (с шир., 1Н), 8,14 (д шир., J=8,5 Гц, 1Н), 8,30 (с, 1Н), 8,41 (д, J=8,5 Гц, 1Н), 11,43 (с, 1Н), 12,81 (с, 1Н).
Пример 3: [5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-ил]метанол
Стадия 1: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 45 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида, полученного на стадии 5 примера 2, в 1,5 мг ТГФ и 1,5 мл метанола. После охлаждения до 0°С на ледяной бане добавляют 5,5 мг NaBH4 и перемешивают в течение 30 минут. После этого добавляют 1,5 мл ацетона, затем выливают смесь в водный насыщенный раствор бикарбоната натрия. Экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Получают 46 мг [5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}1Н-пиразоло[4,3-c]изохинолин-7-ил]метанола, используемого на следующей стадии без дополнительной очистки.
SM (E/I): m/z=617 (M+).
Стадия 2: В колбу емкостью 30 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 46 мг [5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}1Н-пиразоло[4,3-c]изохинолин-7-ил]метанола в 4 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 0,45 мл ТФА и перемешивают в течение 2 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 25 мл воды и 0,75 мл 0,75 М водного раствора гидроксида аммония. Экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. После хроматографии на силикагеле (20-45 мкм) с элюированием смесью ДХМ и метанола (92,5/7,5 об.) получают 13 мг [5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-ил]метанола (твердое вещество желтого цвета).
SM (E/I): m/z=487 (M+).
1Н-ЯМР: 1,67 (м, 2Н), 2,11 (м, 2Н), 2,87 (с, 3Н), 2,90 (м, 2Н), 3,56 (м, 2Н), 3,79 (м, 1Н), 4,63 (д, J=5,7 Гц, 2Н), 5,34 (т, J=5,7 Гц, 1Н), 5,98 (д, J=7,8 Гц, 1Н), 7,31 (м, 2Н), 7,59 (с шир., 1Н), 7,66 (м, 1Н), 7,83 (д шир., J=8,3 Гц, 1Н), 8,35 (д, J=8,3 Гц, 1Н), 12,68 (с, 1Н).
Пример 4: 5-(2,6-дифторфенил)-3-{[1-(трифторметансульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксамид
Стадия 1: Работают как описано в примере 1, стадия 12. В колбу емкостью 50 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 200 мг 3-бром-5-(2,6-дифторфенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 4 мл 1,4-диоксана. После барботирования аргона в течение 10 минут добавляют 269 мг трифторацетата 1-трифторметансульфонилпиперидин-4-иламина, 543 мг карбоната цезия, 22 мг 9,9-диметил-4,5-бис(дифенилфосфин)ксантена и 8,7 мг ацетата палладия(II). Смесь нагревают с обратным холодильником в течение 2 часов. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью EtOAc и гептана (40/60 об.), и получают 272 мг 5-(2,6-дифторфенил)-3-{[1-(трифторметансульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество бледно-желтого цвета).
SM (E/I): m/z=666 (M+).
Синтез 1,1-диметилэтил-(1-трифторметансульфонилпиперидин-4-ил)карбамата
В колбу емкостью 150 мл, снабженную магнитной мешалкой, вводят в атмосфере аргона 2 г 4-N-boc-аминопиперидина в 35 мл ДХМ, 82 мг 4-диметиламинопиридина (DMAP) и 1,86 мл триэтиламина. После охлаждения до 0°С на ледяной бане добавляют по каплям 1,6 мл трифторметансульфонилхлорида. Перемешивают в течение 30 минут при 0°С, затем в течение 1 часа при комнатной температуре. Смесь выливают в 100 мл насыщенного водного раствора бикарбоната натрия. Экстрагируют при помощи EtOAc, промывают насыщенным водным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют досуха при пониженном давлении. После хроматографии на силикагеле (15-40 мкм) с элюированием смесью ДХМ и метанола (98/02 об.) получают 1,5 г 1,1-диметилэтил-(1-трифторметансульфонилпиперидин-4-ил)карбамата (твердое вещество кремового цвета).
SM (E/I): m/z=232 (M+).
В колбу емкостью 150 мл вводят 1,37 г 1,1-диметилэтил-(1-трифторметансульфонилпиперидин-4-ил)карбамата в 30 мл ДХМ. Добавляют 3 мл ТФА и перемешивают при комнатной температуре в течение 1 часа. Смесь концентрируют при пониженном давлении и полученное твердое вещество обрабатывают 30 мл воды и 2 мл 0,75 М водного раствора гидроксида аммония. Экстрагируют при помощи EtOAc, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Получают 1,2 г трифторацетата 1-трифторметансульфонилпиперидин-4-иламина (твердое вещество беловатого цвета).
SM (E/I): m/z=346 (M+).
Стадия 2: В колбу емкостью 30 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 272 мг 5-(2,6-дифторфенил)-3-{[1-(трифторметансульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, 10 мл этанола, 5 мл ТГФ и 0,611 мл 9,3 н. NaOH. Через 2 часа кипячения с обратным холодильником смесь охлаждают и вливают 50 мл 1 М водного раствора дигидрофосфата калия. Экстрагируют при помощи EtOAc, промывают насыщенным водным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Полученный неочищенный твердый продукт растворяют в 4 мл ДМФА, затем добавляют 275 мг гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР), 84 мг 1-гидроксибензотриазола (НОВТ), 44 мг хлорида аммония и 2 мл N,N-диизопропилэтиламина (DIPEA). После выдерживания в течение 3 часов при комнатной температуре смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным водным раствором NaCl. После сушки над MgSO4 фильтрования и концентрирования при пониженном давлении, получают 300 мг 5-(2,6-дифторфенил)-3-{[1-(трифторметансульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксамида.
SM (E/I): m/z=684 (M+).
Стадия 3: В колбу емкостью 50 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 300 мг 5-(2,6-дифторфенил)-3-{[1-(трифторметансульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксамида в 8 мл ДХМ. Добавляют 3 мл ТФА и перемешивают в течение 2 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 30 мл воды и 2 мл 0,75 М водного раствора гидроксида аммония. Экстрагируют при помощи EtOAc, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. После хроматографии на силикагеле (15-40 мкм) с элюированием при помощи EtOAc получают 30 мг 5-(2,6-дифторфенил)-3-{[1-(трифторметансульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксамида (твердое вещество бледно-желтого цвета).
SM (E/I): m/z=554 (M+).
1Н-ЯМР: 1,69 (м, 2Н), 2,17 (м, 2Н), 3,38 (м, 2Н), 3,83 (м, 2Н), 3,93 (м, 1Н), 6,24 (м, 1Н), 7,33 (т, J=8,0 Гц, 2Н), 7,58 (с шир., 1Н), 7,69 (м, 1Н), 8,17 (с шир., 1Н), 8,23 (с шир., 1Н), 8,36 (д шир., J=8,5 Гц, 1Н), 8,44 (д, J=8,5 Гц, 1Н), 12,9 (с шир., 1Н).
Пример 5: 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-7-винил-1Н-пиразоло[4,3-c]изохинолин
Стадия 1: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 380 мг 3-бром-5-(2,6-дифторфенил)-7-винил-1Н-пиразоло[4,3-c]изохинолина, полученного на стадии 2 примера 2, в 10 мл ДМФА, 1,2 мл диизопропилэтиламина и 0,37 мл 2-(триметилсилил)этоксиметилхлорида. Смесь перемешивают в течение 24 часов при комнатной температуре, затем выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Получают 548 мг неочищенного продукта, который очищают хроматографией на силикагеле (20-45 мкм), элюируя смесью ДХМ и метанола (99,5/0,5 об.); получают, с одной стороны, 198 мг 3-бром-5-(2,6-дифторфенил)-1-(2-триметилсиланилэтоксиметил)-7-винил-1Н-пиразоло[4,3-c]изохинолина в виде твердого вещества кремового цвета и, с другой стороны, 194 мг 3-бром-5-(2,6-дифторфенил)-2-(2-триметилсиланилэтоксиметил)-7-винил-2Н-пиразоло[4,3-c]изохинолина (твердое вещество кремового цвета).
SM (E/I): m/z=516 (M+).
1Н-ЯМР: 0,05 (с, 9Н), 0,92 (т, J=7,8 Гц, 2Н), 3,73 (т, J=7,8 Гц, 2Н), 5,39 (д, J=11,1 Гц, 1Н), 5,87 (с, 2Н), 5,94 ((д, J=17,7 Гц, 1Н), 6,90 (дд, J=17,7; 11,1 Гц, 1Н), 7,39 (т, J=7,8 Гц, 2Н), 7,57 (с шир., 1Н), 7,73 (м, 1Н), 8,21 (дд, J=8,5; 1,5 Гц, 1Н), 8,51 (д, J=8,5 Гц, 1Н).
Стадия 2: В колбу емкостью 30 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 189 мг 3-бром-5-(2,6-дифторфенил)-2-(2-триметилсиланилэтоксиметил)-7-винил-2Н-пиразоло[4,3-c]изохинолина в 5 мл 1,4-диоксана. После барботирования аргона в течение 10 минут добавляют 130 мг 1-метансульфонилпиперидин-4-иламина, 453 мг карбоната цезия, 25 мг 9,9-диметил-4,5-бис(дифенилфосфин)ксантена и 8 мг ацетата палладия(II). Смесь нагревают с обратным холодильником в течение 4 часов. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ и EtOAc (85/15 об.), и получают таким путем 96 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-2-{[2-(триметилсилил)этокси]метил}-7-винил-2Н-пиразоло[4,3-c]изохинолина (твердое вещество желтого цвета).
SM (E/I): m/z=613 (M+).
1Н-ЯМР: 0,04 (с, 9Н), 0,89 (т, J=8,3 Гц, 2Н), 1,60 (м, 2Н), 2,10 (м, 2Н), 2,74 (м, 2Н), 2,84 (с, 3Н), 3,58 (м, 2Н), 3,66 (т, J=8,3 Гц, 2Н), 4,44 (м, 1Н), 5,33 (д, J=11,0 Гц, 1Н), 5,64 (с, 2Н), 5,87 (д, J=17,7 Гц, 1Н), 6,47 (д, J=7,8 Гц, 1Н), 6,83 (дд, J=17,7; 11,0 Гц, 1Н), 7,33 (т, J=7,8 Гц, 2Н), 7,42 (с шир., 1Н), 7,64 (м, 1Н), 8,02 (дд, J=8,3; 1,5 Гц, 1Н), 8,31 (д, J=8,3 Гц, 1Н).
Стадия 3: В колбу емкостью 30 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 92 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-2-{[2-(триметилсилил)этокси]метил}-7-винил-2Н-пиразоло[4,3-c]изохинолина в 8 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 0,9 мл ТФА и перемешивают в течение 2 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 30 мл воды и 1,5 мл 0,75 М водного раствора гидроксида аммония. Экстрагируют при помощи EtOAc, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол (95/05 об.). Получают 14 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-7-винил-2Н-пиразоло[4,3-c]изохинолина (твердое вещество желтого цвета).
SM (E/I): m/z=483 (M+).
1Н-ЯМР: 1,67 (м, 2Н), 2,11 (м, 2Н), 2,87 (с, 3Н), 2,90 (м, 2Н), 3,56 (м, 2Н), 3,79 (м, 1Н), 5,37 (д, J=11,2 Гц, 1Н), 5,94 (д, J=17,6 Гц, 1Н), 6,01 (д шир., J=8,3 Гц, 1Н), 6,87 (дд, J=17,6; 11,2 Гц, 1Н), 7,32 (т, J=7,8 Гц, 2Н), 7,53 (с шир., 1Н), 7,67 (м, 1Н), 8,17 (д шир., J=8,8 Гц, 1Н), 8,39 (д, J=8,8 Гц, 1Н), 12,73 (с, 1Н).
Пример 6: 5-(2,6-дифторфенил)-7-фтор-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин
Стадия 1: В колбу емкостью 50 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 4,2 г 2-бром-1-(4-фторфенил)этанона в 10 мл ДМФА и 3,6 г фталимида калия. Среду перемешивают в течение 4 часов при комнатной температуре и образовавшийся осадок отфильтровывают через фриттированное стекло, промывают изопропиловым эфиром 3 раза по 50 мл. Таким путем, после сушки при пониженном давлении, получают 5 г 2-[2-(4-фторфенил)-2-оксоэтил]изоиндол-1,3-диона (твердое вещество белого цвета), используемого на следующей стадии без дополнительной очистки.
Температура плавления (по Кофлеру): 140°С.
SM (E/I): m/z=283 (M+).
1Н-ЯМР: 5,25 (с, 2Н), 7,44 (т, J=9,0 Гц, 2Н), 7,85-8,00 (м, 4Н), 8,19 (дд, J=9,8; 5,4 Гц, 2Н).
Стадия 2: В колбу емкостью 100 мл, снабженную приспособлением для ввода аргона и магнитной мешалкой, вводят 5 г 2-[2-(4-фторфенил)-2-оксоэтил]изоиндол-1,3-диона в 25 мл N,N-диметилформамиддиэтилацеталя. Смесь кипятят с обратным холодильником в течение 15 часов, затем охлаждают на ледяной бане до 0°С. Образовавшийся осадок центрифугируют через фриттированное стекло, промывают два раза по 50 мл изопропиловым эфиром, затем проводят две промывки с осветлением (промывка лепешки без перемешивания) с 50 мл изопропилового эфира. После сушки при пониженном давлении получают 4,5 г смеси изомеров E и Z 2-[2-диметиламино-1-(4-фторбензоил)винил]изоиндол-1,3-диона (твердое вещество желто-оранжевого цвета).
Тпл. (по Кофлеру): 228°С.
SM (E/I): m/z=338 (M+).
1Н-ЯМР: 2,94 (м уш., 6Н), 7,25 (т, J=9,0 Гц, 2Н), 7,46-7,57 (м, 3Н), 7,86-8,00 (м, 4Н).
Стадия 3: В колбу емкостью один литр, снабженную мощной магнитной мешалкой и обратным холодильником для ввода аргона, при комнатной температуре помещают 4,5 г 2-[2-диметиламино-1-(4-фторбензоил)винил]изоиндол-1,3-диона в 30 мл этанола. Получают суспензию коричневого цвета, к которой добавляют 1,62 мл гидразингидрата в 20 мл этанола. Суспензию нагревают с обратным холодильником. После нагревания в течение 30 минут наблюдается загустевание смеси, которая приобретает желто-лимонный цвет. Эту суспензию перемешивают при нагревании с обратным холодильником в течение 3 часов, затем смесь доводят до комнатной температуры. Нерастворившуюся часть отфильтровывают через фриттированное стекло и промывают 2×20 мл изопропиловым эфиром. Фильтрат концентрируют досуха и получают 6 г твердого продукта бежевого цвета. К неочищенной смеси добавляют 50 мл воды и 20 мл 2 М хлористоводородной кислоты. Добавляют 50 мл EtOAc и отфильтровывают нерастворившуюся часть. Отделяют водный слой и обрабатывают его 3×15 мл EtOAc. Подщелачивают водный слой добавлением 2 М раствора едкого натра до достижения рН=11, затем экстрагируют 3×20 мл этилацетатом. Промывают органический слой водой до достижения нейтрального рН. Экстрагируют при помощи EtOAc, сушат над MgSO4, фильтруют и концентрируют досуха. Получают 1,93 г 3-(4-фторфенил)-1Н-пиразол-4-иламина (масло с фиолетовым оттенком).
SM (E/I): m/z=177 (M+).
1Н-ЯМР: в этой партии наблюдается смесь таутомеров, все абсорбционные полосы широкие при сигналах: 3,69-4,15 (м, 2Н), 7,09-7,34 (м, 3Н), 7,51-8,08 (м, 2Н), 12,10-12,50 (м, 1Н).
Стадия 4: В колбу, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 1,93 г 3-(4-фторфенил)-1Н-пиразол-4-иламина в 20 мл ДХМ и 15 мл пиридина. Смесь охлаждают до 0°С на ледяной бане и добавляют 1,7 мл хлорангидрида 2,6-дифторбензойной кислоты. Температуре дают постепенно подняться до комнатной температуры в течение 3 часов. После испарения растворителя при пониженном давлении добавляют воду к неочищенной реакционной среде, затем водный слой экстрагируют при помощи EtOAc. Органические экстракты объединяют, промывают насыщенным раствором NaCl, сушат над MgSO4. Затем испаряют в вакууме EtOAc и получают 3 г смеси 2,6-дифтор-N-[5-(4-фторфенил)-1H-пиразол-4-ил]бензамида и N-[1-(2,6-дифторбензоил)-5-(4-фторфенил)-1H-пиразол-4-ил]-2,6-дифторбензамида в виде бежевого твердого вещества, используемого в дальнейшем без дополнительной очистки. Неочищенный реакционный продукт обрабатывают таким образом, чтобы получить только целевой продукт: при комнатной температуре в атмосфере аргона в колбе растворяют 3 г смеси 2,6-дифтор-N-[5-(4-фторфенил)-1Н-пиразол-4-ил]бензамида и N-[1-(2,6-дифторбензоил)-5-(4-фторфенил)-1H-пиразол-4-ил]-2,6-дифторбензамида в 20 мл метанола и 12 мл тетрагидрофурана, затем добавляют 6 мл 5 н. водного раствора едкого натра. Через 1 час выдерживания при комнатной температуре смесь выливают в 6 мл 5 н. хлористоводородной кислоты. Экстрагируют с помощью EtOAc, органические слои промывают насыщенным раствором NaCl, сушат над MgSO4, затем концентрируют при пониженном давлении. Получают 2,6 г 2,6-дифтор-N-[5-(4-фторфенил)-1Н-пиразол-4-ил]бензамида (твердое вещество кремового цвета).
SM (E/I): m/z=317 (M+).
1Н-ЯМР: 7,21 (т, J=7,8 Гц, 2Н), 7,26 (м шир., 2Н), 7,56 (м, 1Н), 7,73 (м шир., 2Н), 8,02 (м шир., 1Н), 10,21 (с, 1Н), 12,95-13,29 (м уш., 1Н).
Тпл.=112°С.
Стадия 5: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 2,6 г 2,6-дифтор-N-[5-(4-фторфенил)-1Н-пиразол-4-ил]бензамида, 60 мл дихлорида фенилфосфина и 17,5 г пентоксида фосфора. Через 23 часа нагревания при 165°С смесь охлаждают до комнатной температуры, затем выливают в смесь 260 мл воды и 400 г льда. Температура повышается до 40°С. Нейтрализуют среду путем медленного добавления 120 мл 28%-ного водного раствора гидроксида аммония. Экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl и сушат над MgSO4, затем концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ и метанола (99/1 об.), и получают 680 мг 5-(2,6-дифторфенил)-7-фтор-1Н-пиразоло[4,3-c]изохинолина (твердое вещество кремового цвета).
SM (E/I): m/z=299 (M+).
1Н-ЯМР: 7,34 (т, J=7,8 Гц, 2Н), 7,38 (м шир., 1Н), 7,70 (м, 1Н), 7,96 (т шир., J=9,1 Гц, 1Н), 8,48 (с шир., 1Н), 8,63 (дд, J=9,1; 5,6 Гц, 1Н), 14,29 (с шир., 1Н).
Стадия 6: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 680 мг 5-(2,6-дифторфенил)-7-фтор-1Н-пиразоло[4,3-c]изохинолина в 10 мл ДМФА, 0,21 мл брома и 344 мг KOH. После выдерживания в течение 5 часов при комнатной температуре смесь выливают в ледяную воду. Водный слой экстрагируют 3Ч150 мл EtOAc. Органические экстракты объединяют, промывают насыщенным раствором NaCl, сушат над MgSO4 и выпаривают при пониженном давлении. Таким путем получают 770 мг 3-бром-5-(2,6-дифторфенил)-7-фтор-1Н-пиразоло[4,3-c]изохинолина (твердое вещество желтого цвета), используемого на следующей стадии без дополнительной очистки.
SM (E/I): m/z=378 (M+).
1Н-ЯМР: 7,38 (т, J=8,1 Гц, 2Н), 7,45 (д шир., J=9,2 Гц, 1Н), 7,74 (м, 1Н), 8,03 (тд шир., J=9,2; 2,9 Гц, 1Н), 8,63 (дд, J=9,2; 5,4 Гц, 1Н), 14,69 (м уш., 1Н).
Стадия 7: В колбу емкостью 50 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 770 мг 3-бром-5-(2,6-дифторфенил)-7-фтор-1Н-пиразоло[4,3-c]изохинолина в 15 мл ДМФА, 2,5 мл N,N-диизопропилэтиламина и 0,76 мл 2-(триметилсилил)этоксиметилхлорида. После выдерживания в течение 5 часов при комнатной температуре смесь выливают в 8 объемов ледяной воды. Водный слой экстрагируют 3 раза по 200 мл EtOAc, органические экстракты объединяют, промывают насыщенным раствором NaCl, сушат над MgSO4 и концентрируют при пониженном давлении. Получают 520 мг 3-бром-5-(2,6-дифторфенил)-7-фтор-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолина (твердое вещество оранжевого цвета).
SM (E/I): m/z=508 (M+).
1Н-ЯМР: 0,12 (c, 9Н), 0,85 (т, J=7,9 Гц, 2Н), 3,64 (т, J=7,9 Гц, 2Н), 6,13 (с, 2Н), 7,39 (т, J=7,8 Гц, 2Н), 7,51 (дд, J=9,2; 2,7 Гц, 1Н), 7,75 (м, 1Н), 8,06 (тд, J=9,2; 2,7 Гц, 1Н), 8,71 (дд, J=9,2; 5,4 Гц, 1Н).
Стадия 8: В колбу емкостью 50 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 520 мг 3-бром-5-(2,6-дифторфенил)-7-фтор-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолина в 14 мл 1,4-диоксана. После барботирования аргона в течение 10 минут добавляют 225 мг 1-метансульфонилпиперидин-4-иламина, 780 мг карбоната цезия, 92 мг 9,9-диметил-4,5-бис(дифенилфосфин)ксантена и 40 мг ацетата палладия(II). Смесь нагревают с обратным холодильником в течение 5 часов. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ и EtOAc (95/05 об.), и таким путем получают 94 мг 5-(2,6-дифторфенил)-7-фтор-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолина (твердое вещество желтого цвета).
SM (E/I): m/z=605 (M+).
1Н-ЯМР: -0,13 (с, 9Н), 0,84 (м, 2Н), 1,69 (м, 2Н), 2,10 (м, 2Н), 2,88 (с, 3Н), 2,90 (м частично экранирован, 2Н), 3,57 (м, 2Н), 3,62 (м, 2Н), 3,77 (м, 1Н), 5,89 (с, 2Н), 6,28 (д, J=8,3 Гц, 1Н), 7,28-7,40 (м, 3Н), 7,69 (м, 1Н), 7,91 (тд, J=9,0; 2,9 Гц, 1Н), 8,60 (дд, J=9,0; 5,4 Гц, 1Н).
Стадия 9: В колбу, снабженную приспособлением для ввода аргона, помещают 95 мг 5-(2,6-дифторфенил)-7-фтор-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолина в 10 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 0,173 мл ТФА и перемешивают в течение 20 часов при комнатной температуре. Смесь концентрируют при пониженном давлении, и полученный твердый продукт обрабатывают 30 мл воды и 2 мл 0,75 М водного раствора гидроксида аммония. Экстрагируют при помощи EtOAc, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ и метанола (95/05 об.). Получают 6 мг 5-(2,6-дифторфенил)-7-фтор-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолина (твердое вещество желтого цвета).
SM (E/I): m/z=475 (M+).
1Н-ЯМР: 1,67 (м, 2Н), 2,10 (м, 2Н), 2,87 (с, 3Н), 2,90 (м, 2Н), 3,56 (м, 2Н), 3,79 (м, 1Н), 6,08 (д, J=8,3 Гц, 1Н), 7,29 (м, 1Н), 7,33 (т, J=7,8 Гц, 2Н), 7,68 (м, 1Н), 7,88 (т шир., J=9,3 Гц, 1Н), 8,50 (дд, J=9,3; 5,4 Гц, 1Н), 12,80 (с, 1Н)*.
Пример 7: 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-7-этинил-1Н-пиразоло[4,3-c]изохинолин
Стадия 1: В колбу емкостью 150 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 1,2 г 3-бром-5-(2,6-дифторфенил)-7-йод-1Н-пиразоло[4,3-c]изохинолина, полученного на стадии 1 примера 2, в 24 мл ДМФА, 3 мл диизопропилэтиламина и 0,92 мл 2-(триметилсилил)этоксиметилхлорида. Смесь перемешивают в течение 24 часов при комнатной температуре, затем выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Получают 1,52 г неочищенного продукта, который очищают хроматографией на силикагеле (20-45 мкм), элюируя смесью ДХМ/метанол (99,5/0,5 об.), и получают, с одной стороны, 832 мг 3-бром-5-(2,6-дифторфенил)-1-(2-триметилсиланилэтоксиметил)-7-йод-1Н-пиразоло[4,3-c]изохинолина в виде твердого вещества белого цвета.
SM (E/I): m/z=616 (M+).
С другой стороны, 526 мг 3-бром-5-(2,6-дифторфенил)-2-(2-триметилсиланилэтоксиметил)-7-йод-2Н-пиразоло[4,3-c]изохинолина (масло цвета охры), используемого на следующей стадии без дополнительной очистки.
SM (E/I): m/z=616 (M+).
Стадия 2: В колбу емкостью 10 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 263 мг 3-бром-5-(2,6-дифторфенил)-2-(2-триметилсиланилэтоксиметил)-7-йод-2Н-пиразоло[4,3-c]изохинолина в 1,5 мл ДМФА, затем 1,5 мл триэтиламина. После барботирования аргона через смесь в течение 10 минут добавляют 30 мг дихлорида бис(трифенилфосфин)палладия(II), 8,7 мг йодида меди(I) и 118 мкл этинилтриметилсилана. Перемешивают в течение 2 часов при комнатной температуре выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ и метанола (99,5/0,5 об.), и получают 140 мг 3-бром-5-(2,6-дифторфенил)-2-(2-триметилсиланилэтоксиметил)-7-триметилсиланилэтинил-2Н-пиразоло[4,3-c]изохинолина (твердое вещество кремового цвета).
SM (E/I): m/z=586 (M+).
1Н-ЯМР: -0,05 (с, 9Н), 0,23 (с, 9Н), 0,89 (м, 2Н), 3,72 (м, 2Н), 5,88 (с, 2Н), 7,4 (т, J=8,1 Гц, 2Н), 7,6 (с шир., 1Н), 7,75 (м, 1Н), 8,01 (дд, J=8,3; 1,5 Гц, 1Н), 8,52 (д, J=8,3 Гц, 1Н).
Стадия 3: В колбу емкостью 30 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 79 мг 3-бром-5-(2,6-дифторфенил)-2-(2-триметилсиланилэтоксиметил)-7-триметилсиланилэтинил-2Н-пиразоло[4,3-c]изохинолина в 5 мл 1,4-диоксана. После барботирования аргона через реакционную среду в течение 10 минут добавляют 81 мг 1-метансульфонилпиперидин-4-иламина, 282 мг карбоната цезия, 16 мг 9,9-диметил-4,5-бис(дифенилфосфин)ксантена и 5 мг ацетата палладия(II). Смесь нагревают с обратным холодильником в течение 5 часов. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ/метанол (95/05 об.), и получают 54 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-2-{[2-(триметилсилил)этокси]метил}-7-триметилсиланилэтинил-2Н-пиразоло[4,3-c]изохинолина в виде твердого вещества желтого цвета.
SM (E/I): m/z=683 (M+).
Стадия 4: В колбу емкостью 30 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 74 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-2-{[2-(триметилсилил)этокси]метил}-7-триметилсиланилэтинил-2Н-пиразоло[4,3-c]изохинолина в 5 мл ТГФ, добавляют 0,22 см3 тетрабутиламмоний фторида и перемешивают в течение 30 минут при комнатной температуре. Смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ и EtOAc (85/15 об.), и получают 47 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-2-{[2-(триметилсилил)этокси]метил}-7-этинил-2Н-пиразоло[4,3-c]изохинолина (твердое вещество желто-лимонного цвета).
SM (E/I): m/z=611 (M+).
Стадия 5: В колбу емкостью 30 мл, снабженную приспособлением для ввода аргона, помещают 47 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-2-{[2-(триметилсилил)этокси]метил}-7-этинил-2Н-пиразоло[4,3-c]изохинолина в 4 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 0,47 мл ТФА и перемешивают в течение 3 часов при комнатной температуре. Смесь концентрируют при пониженном давлении, и полученный твердый продукт обрабатывают 25 мл воды и 0,75 мл 0,75 М водного раствора гидроксида аммония. Экстрагируют при помощи EtOAc, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ и метанола (92,5/7,5 об.). Получают 6 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-7-этинил-2Н-пиразоло[4,3-c]изохинолина (твердое вещество желтого цвета).
SM (E/I): m/z=481 (M+).
1Н-ЯМР: 1,66 (м, 2Н), 2,11 (м, 2Н), 2,87 (с, 3Н), 2,91 (м, 2Н), 3,56 (м, 2Н), 3,79 (м, 1Н), 4,37 (с, 1Н), 6,10 (д, J=8,3 Гц, 1Н), 7,34 (т, J=7,9 Гц, 2Н), 7,65 (с шир., 1Н), 7,69 (м, 1Н), 7,97 (д шир., J=8,3, 1Н), 8,42 (д, J=8,3 Гц, 1Н), 12,88 (с шир., 1Н).
Пример 8: метил-5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксилат
Стадия 1: В трехгорлую колбу емкостью 250 мл, снабженную магнитной мешалкой и вводом для аргона, помещают 4 г 5-(2,6-дифторфенил)-7-йод-1Н-пиразоло[4,3-c]изохинолина, полученного на стадии 6 примера 1, в 120 мл ТГФ и 3 мл ДМФА. Среду охлаждают до 0°С на ледяной бане, затем добавляют 952 мг гидрида натрия (60%). После выдерживания среды в течение 15 минут при 0°С добавляют 1,3 мл диметилсульфамоилхлорида. После выдерживания в течение 16 часов при комнатной температуре смесь выливают в 300 мл воды и экстрагируют этилацетатом. Органический слой сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Полученное твердое вещество растирают в диизопропиловом эфире. Нерастворившуюся часть отфильтровывают при пониженном давлении, сушат в вакууме и получают 2,94 г 5-(2,6-дифторфенил)-7-йод-N,N-диметил-1Н-пиразоло[4,3-c]изохинолин-1-сульфонамида (твердое вещество бежевого цвета).
LC-MS-DAD-ELSD: 515(+)=(М+Н)(+).
Стадия 2: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 2,94 г 5-(2,6-дифторфенил)-7-йод-N,N-диметил-1Н-пиразоло[4,3-c]изохинолин-1-сульфонамида в 90 мл ДМФА. После барботирования аргона в течение 10 минут добавляют 1,81 г трибутилвинилстаннана и 331 мг трифенилфосфинпалладия(0). Смесь нагревают с обратным холодильником в течение 3 часов, затем после охлаждения выливают смесь в воду и экстрагируют этилацетатом. Органический слой сушат над MgSO4 и выпаривают досуха при пониженном давлении. Получают 2,36 г 5-(2,6-дифторфенил)-7-этинил-N,N-диметил-1Н-пиразоло[4,3-c]изохинолин-1-сульфонамида (твердое вещество каштанового цвета). Продукт используют без дополнительной очистки.
LC-MS-DAD-ELSD: 415(+)=(М+Н)(+).
Стадия 3: В колбу емкостью 250 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 2,36 г 5-(2,6-дифторфенил)-7-этинил-N,N-диметил-1Н-пиразоло[4,3-c]изохинолин-1-сульфонамида в 30 мл ТГФ, затем добавляют 23 мл воды, 30 мл трет-бутанола, 2,14 мл 2,5%-го раствора тетраоксида осьмия в 2-метил-2-пропаноле и 5,04 г перйодата натрия. Перемешивают в течение 4 часов при комнатной температуре, затем смесь выливают в 100 мл воды, экстрагируют при помощи EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Неочищенный продукт очищают хроматографией на силикагеле (15-40 мкм), элюируя ДХМ, и получают 1,92 г 5-(2,6-дифторфенил)-7-формил-N,N-диметил-1Н-пиразоло[4,3-c]изохинолин-1-сульфонамида (твердое вещество бежевого цвета).
LC-MS-DAD-ELSD: 417(+)=(М+Н)(+).
Стадия 4: В колбу емкостью 250 мл вводят 1,41 г 5-(2,6-дифторфенил)-7-формил-N,N-диметил-1Н-пиразоло[4,3-c]изохинолин-1-сульфонамида в 124 мл ацетона. Добавляют 1,07 г перманганата калия, растворенного в 62 мл воды. После выдерживания в течение 1 часа при комнатной температуре ацетон испаряется, затем смесь подкисляют до рН 1 добавлением 5 н. хлористоводородной кислоты. Смесь экстрагируют этилацетатом, органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении, и получают 1,46 г 5-(2,6-дифторфенил)-1-(диметилсульфамоил)-1Н-пиразоло[4,3-c]изохинолин-7-карбоновой кислоты (твердое вещество желтого цвета).
LC-MS-DAD-ELSD: 433(+)=(М+Н)(+).
Стадия 5: В колбу емкостью 250 мл вводят 1,46 г 5-(2,6-дифторфенил)-1-(диметилсульфамоил)-1Н-пиразоло[4,3-c]изохинолин-7-карбоновой кислоты в 100 мл ДХМ, затем добавляют 20 мл ТФА. Перемешивают в течение 16 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 30 мл насыщенного водного раствора NaHCO3 и экстрагируют три раза по 30 мл EtOAc. Водный слой подкисляют до рН 1 добавлением 37% HCl и экстрагируют при помощи EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении, и получают 927 мг 5-(2,6-дифторфенил)-2Н-пиразоло[4,3-c]изохинолин-7-карбоновой кислоты (твердое вещество бежевого цвета).
LC-MS-DAD-ELSD: 326(+)=(М+Н)(+).
Стадия 6: В колбу емкостью 100 мл вводят 605 мг 5-(2,6-дифторфенил)-2Н-пиразоло[4,3-c]изохинолин-7-карбоновой кислоты в 20 мл ДМФА. Добавляют 334 мг гидроксида калия, затем 595 мг брома и перемешивают в течение 1 часа при комнатной температуре. Смесь выливают в 100 мл воды и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении с получением 1,2 г масла оранжевого цвета, которое очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол (80/20 об.), и получают 562 мг 3-бром-5-(2,6-дифторфенил)-2Н-пиразоло[4,3-c]изохинолин-7-карбоновой кислоты (твердое вещество белого цвета).
LC-MS-DAD-ELSD: 406(+)=(М+Н)(+).
Стадия 7: В трехгорлую колбу емкостью 25 мл, снабженную магнитной мешалкой и вводом для аргона, помещают 562 мг 3-бром-5-(2,6-дифторфенил)-2Н-пиразоло[4,3-c]изохинолин-7-карбоновой кислоты в 11 мл ДМФА, 1,38 мл диизопропилэтиламина и 740 мкл 2-(триметилсилил)этоксиметилхлорида. После выдерживания в течение 2 часов при комнатной температуре, реакционную среду выливают в 100 мл воды. Водный слой экстрагируют 3 раза по 100 мл EtOAc, органические экстракты объединяют, промывают насыщенным раствором NaCl, сушат над MgSO4 и концентрируют при пониженном давлении. Неочищенный продукт очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью циклогексан/ДХМ (50/50 об.), затем ДХМ, и получают 502 мг смеси 3-бром-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-7-карбоновой кислоты и 3-бром-5-(2,6-дифторфенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбоновой кислоты (масло бледно-желтого цвета).
LC-MS-DAD-ELSD: 665(+)=(М+Н)(+).
Стадия 8: В колбу емкостью 25 мл, снабженную магнитной мешалкой, вводят 500 мг смеси 3-бром-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-7-карбоновой кислоты и 3-бром-5-(2,6-дифторфенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбоновой кислоты, полученной на стадии 7, в 10 мл метанола и 1 мл 2 н. раствора гидроксида натрия. После выдерживания в течение 5 минут при комнатной температуре смесь выливают в 10 мл EtOAc и 5 мл воды. Органический слой промывают насыщенным водным раствором NaCl, сушат над MgSO4, концентрируют при пониженном давлении и получают 336 мг смеси метил-3-бром-5-(2,6-дифторфенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксилата и метил-3-бром-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-7-карбоксилата (твердое вещество бежевого цвета).
LC-MS-DAD-ELSD: 549(+)=(М+Н)(+).
Стадия 9: В трехгорлую колбу емкостью 25 мл, снабженную магнитной мешалкой и вводом для аргона, помещают 113 мг смеси метил-3-бром-5-(2,6-дифторфенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксилата и метил-3-бром-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-7-карбоксилата, полученной на стадии 8, в 3 мл 1,4-диоксана. После барботирования аргона через смесь в течение 10 минут добавляют 37 мг 1-метансульфонилпиперидин-4-иламина, 255 мг карбоната цезия, 18 мг 9,9-диметил-4,5-бис(дифенилфосфин)ксантена и 5 мг ацетата палладия(II). Смесь нагревают при 110°С в течение 4 часов. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя ДХМ, затем смесью ДХМ и EtOAc (80/20 об.), и получают 46 мг смеси метил-5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1H-пиразоло[4,3-c]изохинолин-7-карбоксилата и метил-5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-2-{[2-(триметилсилил)этокси]метил}-2H-пиразоло[4,3-c]изохинолин-7-карбоксилата (твердое вещество желтого цвета).
LC-MS-DAD-ELSD: 646(+)=(М+Н)(+).
Стадия 10: В колбу емкостью 25 мл, снабженную магнитной мешалкой, вводят 46 мг смеси метил-5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1H-пиразоло[4,3-c]изохинолин-7-карбоксилата и метил-5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-2-{[2-(триметилсилил)этокси]метил}-2H-пиразоло[4,3-c]изохинолин-7-карбоксилата, полученной на стадии 9, в 5 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 0,5 мл ТФА и перемешивают в течение 18 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 20 мл воды и экстрагируют три раза по 20 мл EtOAc. Органический слой сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя ДХМ, затем смесью ДХМ/EtOAc (50/50 об.), и получают 12 мг метил-5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино-1H-пиразоло[4,3-c]изохинолин-7-карбоксилата (твердое вещество желтого цвета).
1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,67 (м, 2Н), 2,11 (м, 2Н), 2,88 (с, 3Н), 2,92 (м, 2Н), 3,56 (м, 2Н), 3,80 (м, 1Н), 3,87 (с, 3Н), 6,16 (д, J=7,7 Гц, 1Н), 7,37 (м, 2Н), 7,71 (м, 1Н), 8,23 (с шир., 1Н), 8,42 (д шир., J=8,5 Гц, 1Н), 8,54 (д, J=8,5 Гц, 1Н), 13,01 (с, 1Н).
LC-MS-DAD-ELSD: 516(+)=(М+Н)(+).
Пример 9: 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карботиоамид
В пробирку емкостью 5 мл для микроволнового облучения, вводят 45 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, полученного в примере 12, и 0,2 мл 20%-ного водного раствора сульфида аммония в 2 мл метанола. Смесь нагревают в микроволновой печи при 100°С в течение 20 минут (мощность печи установлена на 100 Ватт), затем выливают в 50 мл воды, экстрагируют EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Полученное твердое вещество растирают в диизопропиловом эфире. Нерастворившуюся часть отфильтровывают при пониженном давлении, сушат в вакууме и получают 36 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карботиоамида (твердое вещество желтого цвета).
1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,66 (м, 2Н), 2,11 (м, 2Н), 2,88 (с, 3Н), 2,90 (м, 2Н), 3,56 (м, 2Н), 3,79 (м, 1Н), 6,10 (д, J=8,3 Гц, 1Н), 7,33 (т, J=7,8 Гц, 2Н), 7,68 (м, 1Н), 8,18 (с шир., 1Н), 8,34 (дд, J=8,3; 1,5 Гц, 1Н), 8,40 (д, J=8,3 Гц, 1Н), 9,74 (с шир., 1Н), 10,01 (с шир., 1Н), 12,87 (м уш., 1Н).
LC-MS-DAD-ELSD: 517(+)=(М+Н)(+).
Пример 10: 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин
Стадия 1: В колбу емкостью 250 мл, снабженную магнитной мешалкой, вводят 30 г 2-хлорацетофенона и 36,3 г фталимида калия в 120 мл ДМФА. После выдерживания в течение 4 часов при комнатной температуре, среду концентрируют в вакууме. Полученный твердый продукт обрабатывают 120 мл ДХМ и 100 мл 1 раствором гидроксида натрия. Органический слой промывают насыщенным водным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют в вакууме. Полученный твердый продукт растирают в диизопропиловом эфире. Нерастворившуюся часть отфильтровывают и сушат в вакууме с получением 42,6 г 2-(2-оксо-2-фенилэтил)-1Н-изоиндол-1,3(2Н)-диона в виде твердого вещества бежевого цвета, используемого на следующей стадии без дополнительной очистки.
Стадия 2: В колбу емкостью 100 мл, снабженную магнитной мешалкой, вводят 42,4 г 2-(2-оксо-2-фенилэтил)-1Н-изоиндол-1,3(2Н)-диона в 105 мл N,N-диметилформамиддиэтилацеталя. Среду нагревают с обратным холодильником в течение 3 часов, затем концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя ДХМ, затем смесью ДХМ и метанола (90/10 об.) с получением 40,69 г смеси изомеров E и Z 2-[1-(диметиламино)-3-оксо-3-фенилпроп-1-ен-2-ил]-1Н-изоиндол-1,3(2Н)-диона в виде твердого вещества кремового цвета.
LC-MS-DAD-ELSD: 321(+)=(М+Н)(+).
Стадия 3: В колбу емкостью 250 мл вводят при комнатной температуре 20,5 г смеси изомеров E и Z 2-[1-(диметиламино)-3-оксо-3-фенилпроп-1-ен-2-ил]-1Н-изоиндол-1,3(2Н)-диона в 75 мл этанола. Добавляют 7,8 мл гидразингидрата. Суспензию перемешивают в течение 1 часа 30 минут при комнатной температуре, затем нагревают с обратным холодильником. После нагревания в течение 1 часа 30 минут можно наблюдать загустевание смеси, которая приобретает желтый цвет. Суспензию центрифугируют в горячем состоянии на фриттированном стекле и осадок промывают этанолом. Фильтрат концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя ДХМ, затем смесью ДХМ/метанол (95/5 об.), и получают 9,45 г 5-фенил-1Н-пиразол-4-амина (твердое вещество каштанового цвета).
LC-MS-DAD-ELSD: 163(+)=(М+Н)(+).
Стадия 4: В колбу емкостью 250 мл, снабженную магнитной мешалкой, вводят 10 г 5-фенил-1Н-пиразол-4-иламина в 45 мл ДХМ и 45 мл пиридина. Реакционную среду охлаждают до 0°С на ледяной бане и добавляют 17,4 мл хлорангидрида 2,6-дифторбензойной кислоты. Смесь перемешивают в течение 3 часов при комнатной температуре. После испарения растворителя при пониженном давлении к неочищенному реакционному продукту добавляют 50 мл воды, затем экстрагируют водный слой два раза по 50 мл EtOAc. Органические экстракты объединяют, промывают насыщенным раствором NaCl, сушат над MgSO4. Затем выпаривают в вакууме EtOAc и получают смесь 2,6-дифтор-N-[5-фенил-1Н-пиразол-4-ил]бензамида и N-[1-(2,6-дифторбензоил)-5-фенил-1Н-пиразол-4-ил]-2,6-дифторбензамида в виде масла каштанового цвета. Неочищенный реакционный продукт обрабатывают таким образом, чтобы получить только целевой продукт: в колбе емкостью 250 мл растворяют при комнатной температуре в атмосфере аргона смесь 2,6-дифтор-N-[5-фенил-1Н-пиразол-4-ил]бензамида и N-[1-(2,6-дифторбензоил)-5-фенил-1Н-пиразол-4-ил]-2,6-дифторбензамида в 20 мл метанола и 20 мл 5 н. водного раствора едкого натра. После выдерживания в течение 30 минут при комнатной температуре смесь выливают в 50 мл воды и экстрагируют при помощи EtOAc, промывают органические слои насыщенным раствором NaCl, сушат над MgSO4, затем концентрируют при пониженном давлении. Получают неочищенный продукт, который суспендируют в ДХМ и перемешивают в течение 15 минут при нагревании с обратным холодильником в ДХМ. После охлаждения на ледяной бане центрифугируют на фриттированном стекле, промывают два раза ледяным ДХМ. Получают 7,7 г 2,6-дифтор-N-(5-фенил-1Н-пиразол-4-ил)бензамида (твердое вещество цвета охры).
LC-MS-DAD-ELSD: 300(+)=(М+Н)(+).
Стадия 5: В трехгорлую колбу емкостью 500 мл, снабженную магнитной мешалкой и вводом для аргона, помещают 12,5 г 2,6-дифтор-N-(5-фенил-1Н-пиразол-4-ил)бензамида, 218 мл оксихлорида фосфора и 68,2 г Р2О5. После нагревания смеси с обратным холодильником в течение 30 минут, среда загустевает, и добавляют 20 мл оксихлорида фосфора. После нагревания с обратным холодильником в течение 5 часов реакционную смесь охлаждают до комнатной температуры, затем медленно выливают в 2 л ледяной воды, поддерживая температуру ниже 40°С. Нейтрализуют среду медленным добавлением карбоната калия и экстрагируют 3 раза по 500 мл EtOAc. Органические экстракты объединяют, промывают насыщенным раствором NaCl, сушат над MgSO4, затем концентрируют при пониженном давлении. Полученный твердый продукт очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя ДХМ, затем смесью ДХМ/EtOAc (80/20 об.). Получают 6,4 г 5-(2,6-дифторфенил)-1Н-пиразоло[4,3-c]изохинолина (воздушная масса желтого цвета).
LC-MS-DAD-ELSD: 282(+)=(М+Н)(+).
Стадия 6: В колбу емкостью 50 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 700 мг 5-(2,6-дифторфенил)-1Н-пиразоло[4,3-c]изохинолина в 25 мл ДМФА. Добавляют 0,26 мл брома и 447 мг KOH. После 1 часа выдерживания при комнатной температуре смесь выливают в 100 мл ледяной воды. Водный слой экстрагируют 3 раза по 100 мл EtOAc. Органические слои объединяют, промывают насыщенным раствором NaCl, сушат над MgSO4 и выпаривают при пониженном давлении. Получают 950 мг 3-бром-5-(2,6-дифторфенил)-1Н-пиразоло[4,3-c]изохинолина (твердое вещество оранжевого цвета). Полученный продукт используют на следующей стадии без дополнительной очистки.
LC-MS-DAD-ELSD: 362(+)=(М+Н)(+).
Стадия 7: В колбу емкостью 50 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 890 мг 3-бром-5-(2,6-дифторфенил)-1Н-пиразоло[4,3-c]изохинолина в 20 мл ДМФА, 2,46 мл N,N-диизопропилэтиламина и 658 мкл 2-(триметилсилил)этоксиметилхлорида. После выдерживания в течение 16 часов при комнатной температуре смесь выливают в 50 мл ледяной воды. Водный слой экстрагируют 3 раза по 50 мл EtOAc, органические экстракты объединяют, промывают насыщенным раствором NaCl, сушат над MgSO4 и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью циклогексана и ДХМ (80/20 об.), и получают, с одной стороны, 498 мг 3-бром-5-(2,6-дифторфенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолина в виде смолы белого цвета.
LC-MS-DAD-ELSD: 492(+)=(М+Н)(+).
И, с другой стороны, 200 мг 3-бром-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолина (смола белого цвета).
LC-MS-DAD-ELSD: 492(+)=(М+Н)(+).
Стадия 8: В трехгорлую колбу емкостью 25 мл, снабженную магнитной мешалкой и вводом для аргона, вводят 200 мг 3-бром-5-(2,6-дифторфенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолина в 6 мл 1,4-диоксана. После барботирования аргона через реакционную среду в течение 10 минут добавляют 73 мг 1-метилсульфонилпиперидин-4-иламина, 505 мг карбоната цезия, 36 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 10 мг ацетата палладия(II). Смесь нагревают в течение 2 часов при 120°С. После охлаждения смесь выливают в воду, экстрагируют EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью циклогексана и EtOAc (50/50 об.), и таким путем получают 71 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолина (смола желтого цвета).
LC-MS-DAD-ELSD: 588(+)=(М+Н)(+).
Стадия 9: В колбу емкостью 10 мл вводят 71 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолина в 3 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 0,3 мл ТФА и перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 20 мл воды и экстрагируют 3 раза по 20 мл EtOAc. Органический слой сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя ДХМ, затем смесью ДХМ и метанола (95/5 об.), и получают 9 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолина (твердое вещество бежевого цвета).
1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,67 (м, 2Н), 2,11 (м, 2Н), 2,88 (с, 3Н), 2,90 (м, 2Н), 3,56 (м, 2Н), 3,79 (с шир., 1Н), 6,04 (м уш., 1Н), 7,32 (м, 2Н), 7,52-7,74 (м, 3Н), 7,92 (м, 1Н), 8,40 (д, 1Н), 12,76 (с шир., 1Н).
LC-MS-DAD-ELSD: 458(+)=(М+Н)(+).
Пример 11: 5-(2,6-дифторфенил)-3-{[1-(циклопропилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрил
Стадия 1: В колбу емкостью 25 мл, снабженную магнитной мешалкой и вводом для аргона, ввводят 150 мг 3-бром-5-(2,6-дифтофенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, полученного на стадии 11 примера 1, в 4 мл 1,4-диоксана. После барботирования аргона через смесь в течение 10 минут добавляют 60 мг 1-циклопропилсульфонилпиперидин-4-иламина, 361 мг карбоната цезия, 25 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 7 мг ацетата палладия(II). Смесь нагревают в течение 2 часов при 120°С. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью циклогексана и EtOAc (50/50 об.), и получают 57 мг 5-(2,6-дифторфенил)-3-{[1-(циклопропилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество желтого цвета).
LC-MS-DAD-ELSD: 639(+)=(М+Н)(+).
Стадия 2: В колбу емкостью 10 мл, снабженную магнитной мешалкой, вводят 57 мг 5-(2,6-дифторфенил)-3-{[1-(циклопропилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 5 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 0,3 мл ТФА и перемешивают при комнатной температуре в течение 3 часов. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 20 мл воды и экстрагируют 3 раза по 20 мл EtOAc, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), смесью циклогексана и EtOAc (80/20 об.), и получают 16 мг 5-(2,6-дифторфенил)-3-{[1-(циклопропилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество желтого цвета).
1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д.: 0,89-1,04 (м, 4Н), 1,67 (м, 2Н), 2,10 (м, 2Н), 2,58 (м, 1Н), 3,00 (м, 2Н), 3,62 (м, 2Н), 3,82 (м, 1Н), 6,21 (д, J=7,8 Гц, 1Н), 7,34 (т, J=7,8 Гц, 2Н), 7,70 (м, 1Н), 8,19 (с шир., 1Н), 8,27 (дд, J=8,5; 1,5 Гц, 1Н), 8,56 (д, J=8,5 Гц, 1Н), 13,07 (с, 1Н).
LC-MS-DAD-ELSD: 509(+)=(М+Н)(+).
Пример 12: 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрил
Стадия 1: В трехгорлую колбу емкостью 25 мл, снабженную магнитной мешалкой и вводом для аргона, помещают 525 мг 3-бром-5-(2,6-дифтофенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, полученного на стадии 11 примера 1, в 12 мл 1,4-диоксана. После барботирования аргона через реакционную среду в течение 10 минут добавляют 294 мг 1-метилсульфонилпиперидин-4-иламина, 1,26 г карбоната цезия, 89 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 23 мг ацетата палладия(II). Смесь нагревают в течение 2 часов при 120°С. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью циклогексан/EtOAc (80/20 об.), затем (50/50 об.), и получают 470 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество желтого цвета).
LC-MS-DAD-ELSD: 613(+)=(М+Н)(+).
Стадия 2: В пробирку для микроволнового облучения с максимальной емкостью 20 мл, снабженную магнитной мешалкой, вводят 300 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 12 мл 5 н. хлористоводородной кислоты. Реакционную смесь нагревают в течение 5 минут при 100°С в микроволновой печи, затем выливают в 20 мл воды, доводят среду до рН 7 добавлением 9,3 н. раствора гидроксида натрия и экстрагируют три раза по 20 мл EtOAc. Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ и EtOAc (50/50 об.), и получают 180 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество желтого цвета).
1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,67 (м, 2Н), 2,11 (м, 2Н), 2,87 (с, 3Н), 2,90 (м, 2Н), 3,56 (м, 2Н), 3,80 (м, 1Н), 6,20 (д шир., J=7,7 Гц, 1Н), 7,34 (м, 2Н), 7,70 (м, 1Н), 8,18 (с шир., 1Н), 8,28 (д шир., J=8,6 Гц, 1Н), 8,56 (д, J=8,6 Гц, 1Н), 13,07 (с, 1Н).
LC-MS-DAD-ELSD: 483(+)=(М+Н)(+).
Пример 13: 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрил
Стадия 1: В трехгорлую колбу емкостью 25 мл, снабженную магнитной мешалкой и вводом для аргона, помещают 150 мг 3-бром-5-(2,6-дифтофенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, полученного на стадии 11 примера 1, в 4 мл 1,4-диоксана. После барботирования аргона через реакционную среду в течение 10 минут добавляют 56 мг 1-этилсульфонилпиперидин-4-иламина, 361 мг карбоната цезия, 25 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 7 мг ацетата палладия(II). Смесь нагревают в течение 2 часов при 120°С. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью циклогексан/EtOAc (80/20 об.), затем (50/50 об.), и получают 60 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество желтого цвета).
LC-MS-DAD-ELSD: 627(+)=(М+Н)(+).
Стадия 2: В колбу емкостью 10 мл, снабженную магнитной мешалкой, вводят 50 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 5 мл ДХМ. После охлаждения смеси до 0°С на ледяной бане добавляют 0,1 мл ТФА и перемешивают в течение 3 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 20 мл воды, и экстрагируют три раза по 20 мл EtOAc. Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя ДХМ, затем смесью ДХМ и метанола (90/10 об.), и получают 27 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество желтого цвета).
1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,23 (т, J=7,3 Гц, 3Н), 1,63 (м, 2Н), 2,09 (м, 2Н), 2,97 (м, 2Н), 3,05 (к, J=7,3 Гц, 2Н), 3,61 (м, 2Н), 3,81 (м, 1Н), 6,23 (м уш., 1Н), 7,34 (т, J=7,8 Гц, 2Н), 7,70 (м, 1Н), 8,18 (с шир., 1Н), 8,27 (д шир., J=8,5 Гц, 1Н), 8,56 (д, J=8,5 Гц, 1Н), 13,07 (с шир, 1Н).
LC-MS-DAD-ELSD: 497(+)=(М+Н)(+).
Пример 14: 5-(2,6-дифторфенил)-3-{[1-(циклопропилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксамид
В колбу емкостью 10 мл вводят 29,7 мг 5-(2,6-дифторфенил)-3-{[1-(циклопропилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, полученного в примере 11, 1,3 мл этанола и 125 мкл 9,3 н. гидроксида натрия. После кипячения с обратным холодильником в течение 30 минут смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 10 мл воды, и экстрагируют три раза по 10 мл EtOAc. Объединенные органические слои сушат над MgSO4, фильтруют и концентрируют при пониженном давлении с получением 17 мг 5-(2,6-дифторфенил)-3-{[1-(циклопропилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбксамида (твердое вещество желтого цвета).
1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д.: 0,89-1,02 (м, 4Н), 1,67 (м, 2Н), 2,11 (м, 2Н), 2,58 (м, 1Н), 3,00 (м, 2Н), 3,63 (м, 2Н), 3,80 (м, 1Н), 6,09 (д, J=7,3 Гц, 1Н), 7,35 (д, J=7,8 Гц, 2Н), 7,56 (с шир., 1Н), 7,68 (м, 1Н), 8,17 (с шир., 1Н), 8,23 (с шир., 1Н), 8,35 (д шир., J=8,5 Гц, 1Н), 8,45 (д, J=8,5 Гц, 1Н), 12,87 (с, 1Н).
LC-MS-DAD-ELSD: 527(+)=(М+Н)(+).
Пример 15: 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегид
В колбу емкостью 10 мл вводят 54 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида, полученного на стадии 5 примера 2, в 5 мл ДХМ. После охлаждения смеси до 0°С на ледяной бане добавляют 0,3 мл ТФА и перемешивают в течение 16 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 5 мл насыщенного водного раствора NaHCO3. Экстрагируют при помощи EtOAc, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/EtOAc (50/50 об.). Таким путем получают 9 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида (твердое вещество желтого цвета).
1Н-ЯМР (400 МГц, ДМСО-d6) δ м.д.: 1,68 (м, 2Н), 2,11 (м, 2Н), 2,88 (с, 3Н), 2,90 (м, 2Н), 3,57(м, 2Н), 3,81 (м, 1Н), 6,16 (м шир., 1Н), 7,36 (т, J=7,8 Гц, 2Н), 7,71 (м, 1Н), 8,23 (с шир., 1Н), 8,34 (д шир., J=8,5 Гц, 1Н), 8,57 (д, J=8,2 Гц, 1Н), 10,10 (с, 1Н), 13,02 (с шир, 1Н).
LC-MS-DAD-ELSD: 486(+)=(М+Н)(+).
Пример 16: 5-(2,6-дифторфенил)-N-гидрокси-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксимидамид
В колбу емкостью 10 мл вводят 30 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, полученного в примере 12, 1,3 мл метанола, 0,8 мл ТФА и 62 мг триэтиламина. Добавляют 44 мг гидроксиамина в форме хлоргидрата. Смесь нагревают в течение 3 часов при 65°С, затем выпаривают при пониженном давлении. Полученный твердый продукт обрабатывают 10 мл воды и экстрагируют при помощи EtOAc. Органический слой сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя ДХМ, затем смесью ДХМ/метанол (80/20 об.), и получают 9,7 мг 5-(2,6-дифторфенил)-N-гидрокси-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксимидамида в виде твердого вещества желтого цвета.
1Н-ЯМР (300 МГц, ДМСО-d6) δ м.д.: 1,67 (м, 2Н), 2,11 (м, 2Н), 2,91 (м, 2Н), 2,87 (с, 3Н), 3,56 (м, 2Н), 3,79 (м, 1Н), 5,95 (с шир., 2Н), 6,03 (д, J=7,9 Гц, 1Н), 7,31 (м, 2Н), 7,66 (м, 1Н), 7,95 (с шир., 1Н), 8,18 (дд, J=8,5; 1,6 Гц, 1Н), 8,39 (д, J=8,5 Гц, 1Н), 9,82 (с, 1Н), 12,76 (с, 1Н).
LC-MS-DAD-ELSD: 516(+)=(М+Н)(+).
Пример 17: 5-(2,6-дифторфенил)-7-(фторметил)-N-[1-(метилсульфонил)пиперидин-4-ил]-1Н-пиразоло[4,3-c]изохинолин-3-амин
Стадия 1: Исходя из 377 мг [5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-ил]-метанола, полученного на стадии 1 примера 3, и 7 мл ДХМ. Охлаждают до -70°С на бане с сухим льдом и добавляют 88 мкл трифторида диэтиламиносульфида (DAST). После выдерживания в течение 30 минут смесь выливают в насыщенный водный раствор бикарбоната натрия, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ/EtOAc (85/15 об.), и получают 90 мг 5-(2,6-дифторфенил)-7-(фторметил)-N-[1-(метилсульфонил)пиперидин-4-ил]-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-амина (твердое вещество желтого цвета).
SM (E/I): m/z=619(M+).
1Н-ЯМР: -0,05 (с, 9Н), 0,88 (м, 2Н), 1,60 (м, 2Н), 2,10 (м, 2Н), 2,74 (м, 2Н), 2,84 (с, 3Н), 3,58 (м, 2Н), 3,66 (м, 2Н), 4,44 (м шир., 1Н), 5,58 (д, J=47,4 Гц, 2Н), 5,65 (с, 2Н), 6,48 (д, J=7,6 Гц, 1Н), 7,33 (т, J=7,5 Гц, 2Н), 7,52 (с шир., 1Н), 7,64 (м, 1Н), 7,82 (д шир., J=8,1 Гц, 1Н), 8,38 (д, J=8,1 Гц, 1Н).
Стадия 2: В колбу емкостью 30 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 87 мг 5-(2,6-дифторфенил)-7-(фторметил)-N-[1-(метилсульфонил)пиперидин-4-ил]-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-амина в 7 мл ДХМ. После охлаждения смеси до 0°С на ледяной бане добавляют 0,85 мл ТФА и перемешивают в течение 3 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 24 мл воды и 1,1 мл 0,75 М водного раствора гидроксида аммония. Экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/МеОН (95/05 об.). Получают 27 мг 5-(2,6-дифторфенил)-7-(фторметил)-N-[1-(метилсульфонил)пиперидин-4-ил]-1Н-пиразоло[4,3-c]изохинолин-3-амина (твердое вещество желтого цвета).
1Н-ЯМР: 1,67 (м, 2Н), 2,11 (м, 2Н), 2,87 (с, 3Н), 2,90 (м, 2Н), 3,56 (м, 2Н), 3,80 (м шир., 1Н), 5,58 (д, J=47,2 Гц, 2Н), 6,05 (д шир., J=8,0 Гц, 1Н), 7,33 (т, J=7,7 Гц, 2Н), 7,57-7,73 (м, 2Н), 7,95 (д шир., J=8,3 Гц, 1Н), 8,45 (д, J=8,3 Гц, 1Н), 12,81 (с, 1Н).
Пример 18: 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксамид
Стадия 1: В колбу емкостью 100 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 600 мг 3-бром-5-(2,6-дифтофенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 15 мл 1,4-диоксана. После барботирования аргона через реакционную среду в течение 10 минут добавляют 448 мг 1-этансульфонилпиперидин-4-иламина, 1,4 г карбоната цезия, 80 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 26 мг ацетата палладия(II). Смесь нагревают с обратным холодильником в течение 4 часов. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ и EtOAc (95/05 об.), и получают 436 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (твердое вещество желтого цвета).
SM (E/I): m/z=626 (M+).
1Н-ЯМР: -0,06 (с, 9Н), 0,88 (м, 2Н), 1,18 (т, J=7,3 Гц, 3Н), 1,58 (м, 2Н), 2,07 (м, 2Н), 2,82 (м, 2Н), 3,03 (к, J=7,3 Гц, 2Н), 3,56-3,70 (м, 4Н), 4,47 (м, 1Н), 5,67 (с, 2Н), 6,69 (д, J=8,1 Гц, 1Н), 7,33 (т, J=7,8 Гц, 2Н), 7,66 (м, 1Н), 7,96 (д, J=1,7 Гц, 1Н), 8,13 (дд, J=8,3 и 1,7 Гц, 1Н), 8,47 (д, J=8,3 Гц, 1Н).
Стадия 2: В колбу емкостью 100 мл, снабженную магнитной мешалкой и приспособлением для ввода аргона, помещают 396 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 4 мл толуола. После охлаждения смеси до 0°С на ледяной бане добавляют 0,64 мл 95%-ной хлористоводородной кислоты и перемешивают в течение 15 часов при комнатной температуре. Смесь охлаждают до 0°С и нейтрализуют посредством 9 мл 7,5 М водного раствора NH3. Экстрагируют при помощи EtOAc, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ и МеОН (95/05 об.). Получают 174 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбоксамида (твердое вещество желтого цвета).
SM (E/I): m/z=514 (M+).
1Н-ЯМР: 1,23 (т, J=7,4 Гц, 3Н), 1,65 (м, 2Н), 2,09 (м, 2Н), 2,98 (м, 2Н), 3,05 (к, J=7,4 Гц, 2Н), 3,62 (м, 2Н), 3,81 (м, 1Н), 6,09 (д, J=8,3 Гц, 1Н), 7,33 (м, 2Н), 7,55 (с шир., 1Н), 7,68 (м, 1Н), 8,17 (с шир., 1Н), 8,23 (с шир., 1Н), 8,35 (д шир., J=8,8 Гц, 1Н), 8,45 (д, J=8,8 Гц, 1Н), 12,85 (с, 1Н).
Пример 19: 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегид
Стадия 1: В трехгорлую колбу емкостью 50 мл, снабженную магнитной мешалкой и вводом для аргона, помещают 350 мг 3-бром-5-(2,6-дифторфенил)-2-(2-триметилсиланилэтоксиметил)-2Н-пиразоло[4,3-c]изохинолин-7-карбальдегида, полученного на стадии 4 примера 2, в 7,8 мл 1,4-диоксана. Добавляют 195 мг 1-этилсульфонилпиперидин-4-иламина, 880 мг карбоната цезия, 59 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 15 мг ацетата палладия(II). Смесь нагревают с обратным холодильником в течение 2 часов. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью циклогексана и EtOAc (75/25 об.), и получают 195 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида (воздушная масса желтого цвета).
LC-MS-DAD-ELSD: 628(+)=(М+Н)(+).
Стадия 2: В пробирку для микроволнового облучения с максимальной емкостью 20 мл вводят 195 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида, 10 мл 5 н. водного раствора HCl. Смесь нагревают в течение 20 минут в микроволновой печи при 100°С, затем выливают в воду, экстрагируют при помощи EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ и МеОН (95/5 об.). Получают 90 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида в виде воздушной массы желтого цвета.
1Н-ЯМР (500 МГц, ДМСО-d6) δ м.д.: 1,23 (т, J=7,4 Гц, 3Н), 1,64 (м, 2Н), 2,10 (м, 2Н), 2,98 (м, 2Н), 3,05 (к, J=7,4 Гц, 2Н), 3,62 (м, 2Н), 3,83 (м, 1Н), 6,18 (д, J=7,7 Гц, 1Н), 7,36 (т, J=7,8 Гц, 2Н), 7,71 (м, 1Н), 8,24 (с шир., 1Н), 8,34 (д шир., J=8,4 Гц, 1Н), 8,57 (д, J=8,4 Гц, 1Н), 10,11 (с, 1Н), 13,02 (с, 1Н).
[M+H]+ m/z=500.
Пример 20: 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегидоксим
В колбу емкостью 25 мл вводят 30 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида, полученного в примере 19, в 2 мл пиридина. Добавляют 7 мг гидроксиамина в форме хлоргидрата. После выдерживания в течение 1 часа при комнатной температуре смесь выпаривают при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол (95/5 об.), и получают 22 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегидоксима (твердое вещество желтого цвета).
1Н-ЯМР (500 МГц, ДМСО-d6) δ м.д. со смесью изомеров E или Z: 1,23 (т, J=7,4 Гц, 3Н), 1,63 (м, 2Н), 2,09 (м, 2Н), 2,97 (м, 2Н), 3,05 (к, J=7,4 Гц, 2Н), 3,61 (м, 2Н), 3,80 (м, 1Н), 6,08 (м шир., 1Н), 7,33 (м, 2Н), 7,66 (м, 1Н), 7,86 (с шир., 1Н), 8,14 (д шир., J=8,3 Гц, 1Н), 8,30 (с, 1Н), 8,41 (д, J=8,3 Гц, 1Н), 11,45 (м шир., 1Н), 12,82 (м шир., 1Н).
[M+H]+ m/z=515.
Пример 21: [5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-ил]метанол
В колбу емкостью 25 мл вводят 30 мг 5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-карбальдегида, полученного в примере 19, в 2 мл метанола. Среду охлаждают до 5°С. Добавляют 12 мг боргидрида натрия. После выдерживания в течение 30 минут при 5°С смесь выпаривают при пониженном давлении. Полученный твердый продукт обрабатывают 10 мл 0,5 М водного раствора HCl. Экстрагируют при помощи EtOAc, сушат органический слой над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол (95/5 об.), и получают 12 мг [5-(2,6-дифторфенил)-3-{[1-(этилсульфонил)пиперидин-4-ил]амино}-1Н-пиразоло[4,3-c]изохинолин-7-ил]метанола (твердое вещество желтого цвета).
1Н-ЯМР (500 МГц, ДМСО-d6) δ м.д.: 1,23 (т, J=7,3 Гц, 3Н), 1,62 (м, 2Н), 2,09 (м, 2Н), 2,97 (м, 2Н), 3,05 (к, J=7,3 Гц, 2Н), 3,61 (м, 2Н), 3,79 (м, 1Н), 4,63 (д, J=5,5 Гц, 2Н), 5,36 (т, J=5,5 Гц, 1Н), 6,01 (д, J=7,8 Гц, 1Н), 7,32 (м, 2Н), 7,59 (с шир., 1Н), 7,66 (м, 1Н), 7,83 (д шир., J=8,3 Гц, 1Н), 8,35 (д, J=8,3 Гц, 1Н), 12,68 (с, 1Н).
[M+H]+ m/z=502.
Пример 22: 5-(2,6-дифторфенил)-3-[(1-сульфамоилпиперидин-4-ил)амино]-2Н-пиразоло[4,3-c]изохинолин-7-карбоксамид
Стадия 1: Вводят 707 мг 3-бром-5-(2,6-дифторфенил)-1-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолин-7-карбонитрила в 17 мл 1,4-диоксана. После барботирования аргона через смесь в течение 10 минут добавляют 846 мг 4-аминопиперидин-1-сульфонамида, 2,15 г карбоната цезия, 95 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 30 мг ацетата палладия(II). Смесь нагревают с обратным холодильником в течение 20 часов. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ/EtOH/NH3 (7 н. раствор в МеОН) (90/10/1 об.), и получают 407 мг 5-(2,6-дифторфенил)-3-(пиперидин-4-иламино)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-7-карбонитрила (масло желтого цвета).
1Н-ЯМР: -0,05 (с шир., 9Н), 0,88 (т, J=7,9 Гц, 2Н), 1,39 (м, 2Н), 1,93 (м, 2Н), 2,08 (м уш., 1Н), 2,39 (м, 2Н), 2,93 (м, 2Н), 3,71 (т, J=7,9 Гц, 2Н), 4,42 (м, 1Н), 5,66 (с, 2Н), 6,58 (д, J=8,1 Гц, 1Н), 7,33 (т, J=7,9 Гц, 2Н), 7,66 (м, 1Н), 7,95 (с шир., 1Н), 8,12 (д шир., J=8,3 Гц, 1Н), 8,46 (д, J=8,3 Гц, 1Н).
Стадия 2: Смешивают 375 мг 5-(2,6-дифторфенил)-3-(пиперидин-4-иламино)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-7-карбонитрила, 2 мл ДМЭ и 84 мг сульфамида и нагревают в микроволновой печи в течение 1 часа при 150°С. После испарения растворителя осаждают избыток сульфамида добавлением этилового эфира, затем центрифугируют на фриттированном стекле и концентрируют фильтрат при пониженном давлении. Получают 439 мг 4-{[7-циано-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-2H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида (твердое вещество желтого цвета).
1Н-ЯМР: -0,05 (м, 9Н), 0,88 (т, J=7,9 Гц, 2Н), 1,61 (м, 2Н), 2,09 (м, 2Н), 2,53 (м частично экранирован, 2Н), 3,49 (м, 2Н), 3,67 (т, J=7,9 Гц, 2Н), 4,40 (м, 1Н), 5,67 (с, 2Н), 6,67 (д, J=8,1 Гц, 1Н), 6,73 (с, 2Н), 7,34 (т, J=7,9 Гц, 2Н), 7,68 (м, 1Н), 7,95 (д, J=1,5 Гц, 1Н), 8,13 (дд, J=8,3; 1,5 Гц, 1Н), 8,47 (д, J=8,3 Гц, 1Н).
Стадия 3: Вводят 54 мг 4-{[7-циано-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-2H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида в 0,5 мл толуола. После охлаждения до 0°С на ледяной бане добавляют 90 мкл 95%-ной серной кислоты и перемешивают при комнатной температуре в течение 24 часов. Остаток смеси охлаждают до 0°С и нейтрализуют добавлением 9 мл 7,5 М водного раствора гидроксида аммония. Экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол (95/05 об.). Получают 7 мг 5-(2,6-дифторфенил)-3-[(1-сульфамоилпиперидин-4-ил)амино]-2Н-пиразоло[4,3-c]изохинолин-7-карбоксамида (твердое вещество желтого цвета).
1Н-ЯМР: 1,67 (м, 2Н), 2,11 (м, 2Н), 2,67 (м, 2Н), 3,47 (м, 2Н), 3,71 (м, 1Н), 6,01 (д, J=8,2 Гц, 1Н), 6,70 (с шир., 2Н), 7,33 (т, J=7,7 Гц, 2Н), 7,55 (с шир., 1Н), 7,68 (м, 1Н), 8,17 (с шир., 1Н), 8,22 (с шир., 1Н), 8,35 (д шир., J=8,5 Гц, 1Н), 8,45 (д, J=8,5 Гц, 1Н), 12,84 (с, 1Н).
Пример 23: 4-({5-(2,6-дифторфенил)-7-[(E/Z)-(гидроксиимино)метил]-1H-пиразоло[4,3-c]изохинолин-3-ил}амино)пиперидин-1-сульфонамид
Стадия 1: К исходным 406 мг 4-{[7-циано-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-2H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида, полученного на стадии 2 примера 22, и 4 мл толуола добавляют 3 мл ДХМ и охлаждают до 0°С на ледяной бане. Добавляют по каплям 970 мкл диизобутилалюминийгидрида и перемешивают в течение 2 часов при 0°С. Смесь выливают в 0,1 М раствор едкого натра, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ/метанол (90/10 об.). Получают 251 мг 4-{[5-(2,6-дифторфенил)-7-формил-2-{[2-(триметилсилил)этокси]метил}-2H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида (масло желтого цвета), используемого на следующей стадии без дополнительной очистки.
Стадия 2: Вводят 250 мг 4-{[5-(2,6-дифторфенил)-7-формил-2-{[2-(триметилсилил)этокси]метил}-2H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида в 5 мл толуола. После охлаждения до 0°С на ледяной бане добавляют 206 мкл 95%-ной серной кислоты и продолжают перемешивание в течение 1 часа при 0°С. Смесь нейтрализуют 10 мл 7,5 М раствора гидроксида аммония. Экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/этанол (90/10 об.). Получают 38 мг 4-{[5-(2,6-дифторфенил)-7-формил-1H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида (твердое вещество желтого цвета).
1Н-ЯМР: 1,62-1,72 (м, 2Н), 2,11 (м, 2Н), 2,62-2,71 (м, 2Н), 3,47 (м, 2Н), 3,67-3,76 (м, 1Н), 6,14 (м уш., 1Н), 6,73 (с, 2Н), 7,36 (т, J=7,8 Гц, 2Н), 7,67-7,75 (м, 1Н), 8,23 (с шир., 1Н), 8,34 (д шир., J=8,3 Гц, 1Н), 8,57 (д, J=8,3 Гц, 1Н), 10,09 (с, 1Н), 13,04 (с шир., 1Н).
Стадия 3: Вводят 38 мг 4-{[5-(2,6-дифторфенил)-7-формил-1H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида в 2 мл пиридина, затем добавляют 9 мг хлоргидрата гидроксиамина и перемешивают в течение 48 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают EtOAc, промывают 1 М водным раствором фосфата калия, затем насыщенным водным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (20-45 мкм), элюируя смесью ДХМ/EtOH (80/20 об.), и получают 19 мг 4-({5-(2,6-дифторфенил)-7-[(E/Z)-(гидроксиимино)метил]-1H-пиразоло[4,3-c]изохинолин-3-ил}амино)пиперидин-1-сульфонамида (твердое вещество желтого цвета).
1Н-ЯМР: 1,60-1,73 (м, 2Н), 2,10 (м, 2Н), 2,68 (м, 2Н), 3,44-3,53 (м, 2Н), 3,70 (м, 1Н), 5,97 (д шир., J=6,4 Гц, 1Н), 6,70 (с, 2Н), 7,32 (т, J=7,9 Гц, 2Н), 7,68 (м, 1Н), 7,84 (с шир., 1Н), 8,14 (д шир., J=8,7 Гц, 1Н), 8,29 (с, 1Н), 8,41 (д, J=8,7 Гц, 1Н), 11,42 (с шир., 1Н), 12,79 (с шир., 1Н).
Пример 24: 5-(2,6-дифторфенил)-N-[1-(метилсульфонил)пиперидин-4-ил]-7-(1Н-пиразол-4-ил)-1Н-пиразоло[4,3-c]изохинолин-3-амин
Стадия 1: Вводят 342 мг 3-бром-5-(2,6-дифторфенил)-2-(2-триметилсиланилэтоксиметил)-7-йод-2Н-пиразоло[4,3-c]изохинолина в 13 мл 1,4-диоксана. Добавляют 74 мг 4-пиразолбороновой кислоты, 77 мг Pd(PPh3)4 и 165 мг карбоната натрия. Смесь нагревают с обратным холодильником в течение 4 часов 30 минут. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол (95/05 об.), и получают 136 мг 3-бром-5-(2,6-дифторфенил)-7-(1Н-пиразол-4-ил)-2-([2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолина (воздушная масса белого цвета), используемая на следующей стадии без дополнительной очистки.
Стадия 2: Вводят 115 мг 3-бром-5-(2,6-дифторфенил)-7-(1Н-пиразол-4-ил)-2-([2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолина в 2 мл ДМФА, 0,26 мл диизопропилэтиламина и 77 мкл 2-(триметилсилил)этоксиметилхлорида. Перемешивают реакционную среду при комнатной температуре в течение 18 часов, затем выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают хроматографией на силикагеле (20-45 мкм), элюируя смесью ДХМ и метанола (98/02 об.), и получают 116 мг 3-бром-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-7-(1-{[2-(триметилсилил)этокси]метил}-1Н-пиразол-4-ил)-2Н-пиразоло[4,3-c]изохинолина (порошок желтого цвета).
1Н-ЯМР: -0,01 (д, J=5,9 Гц, 4Н), 0,82-1,00 (м, 1Н), 3,60 (т, J=7,8 Гц, 1Н), 3,77 (т, 1Н), 5,46 (с, 1Н), 5,92 (с, 1Н), 7,42 (т, 1Н), 7,71-7,83 (м, 1Н), 8,03 (с, 1Н), 8,28 (дд, 1Н), 8,43 (с, 1Н), 8,58 (д, J=8,3 Гц, 1Н).
Стадия 3: Вводят 110 мг 3-бром-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-7-(1-{[2-(триметилсилил)этокси]метил}-1Н-пиразол-4-ил)-2Н-пиразоло[4,3-c]изохинолина в 5 мл 1,4-диоксана. После барботирования аргона через среду в течение 10 минут добавляют 57 мг 1-метансульфонилпиперидин-4-иламина, 199 мг карбоната цезия, 16 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 5 мг ацетата палладия(II). Смесь нагревают с обратным холодильником в течение 2 часов. После охлаждения смесь выливают в воду, экстрагируют EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ/метанол (97,5/2,5 об.), и получают 77 мг 5-(2,6-дифторфенил)-N-[1-(метилсульфонил)пиперидин-4-ил]-2-{[2-(триметилсилил)этокси]метил}-7-(1-{[2-(триметилсилил)этокси]метил}-1Н-пиразол-4-ил)-2Н-пиразоло[4,3-c]изохинолин-3-амина (воздушная масса желтого цвета).
1Н-ЯМР: -0,07 (с, 9Н), -0,02 (с, 9Н), 0,84 (т, J=8,3 Гц, 2Н), 0,90 (т, J=8,3 Гц, 2Н), 1,56-1,68 (м, 2Н), 2,11 (м, 2Н), 2,76 (м, 2Н), 2,86 (с, 3Н), 3,56 (т, J=8,3 Гц, 2Н), 3,61 (м, 2Н), 3,68 (т, J=8,3 Гц, 2Н), 4,47-4,57 (м, 1Н), 5,42 (с, 2Н), 5,65 (с, 2Н), 6,46 (д, J=8,0 Гц, 1Н), 7,34 (т, J=7,9 Гц, 2Н), 7,59 (с шир., 1Н), 7,66 (м, 1Н), 7,92 (с, 1Н), 8,05 (дд, J=8,3; 1,7 Гц, 1Н), 8,31 (с, 1Н), 8,34 (д, J=8,3 Гц, 1Н).
Стадия 4: Вводят 73 мг 5-(2,6-дифторфенил)-N-[1-(метилсульфонил)пиперидин-4-ил]-2-{[2-(триметилсилил)этокси]метил}-7-(1-{[2-(триметилсилил)этокси]метил}-1Н-пиразол-4-ил)-2Н-пиразоло[4,3-c]изохинолин-3-амина в 5 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 0,58 мл ТФА и перемешивают в течение 5 часов при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 23 мл воды, нейтрализуют 7,5 М водным раствором гидроксида аммония. Экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя ДХМ, затем смесью ДХМ/метанол (90/10 об.), и получают 5 мг 5-(2,6-дифторфенил)-N-[1-(метилсульфонил)пиперидин-4-ил]-7-(1Н-пиразол-4-ил)-1Н-пиразоло[4,3-c]изохинолин-3-амина (твердое вещество желтого цвета).
1Н-ЯМР: 1,61-1,74 (м, 2Н), 2,06-2,16 (м, 2Н), 2,87 (с, 3Н), 2,89-2,95 (м, 2Н), 3,52-3,60 (м, 2Н), 3,75-3,84 (м, 1Н), 5,98 (д, J=8,2 Гц, 1Н), 7,31 (т, J=8,0 Гц, 2Н), 7,65-7,71 (м, 2Н), 7,82-7,88 (м уш., 1Н), 8,15-8,24 (м уш., 1Н), 8,18 (д шир., J=8,3 Гц, 1Н), 8,40 (д, J=8,3 Гц, 1Н), 12,66 (с, 1Н), 13,05 (с шир. 1Н).
Пример 25: 5-(2,6-дифторфенил)-N-[1-(метилсульфонил)пиперидин-4-ил]-7-(2Н-1,2,3-триазол-4-ил)-1Н-пиразоло[4,3-c]изохинолин-3-амин
Стадия 1: Вводят 239 мг 5-(2,6-дифторфенил)-3-{[1-(метилсульфонил)пиперидин-4-ил]амино}-2-{[2-(триметилсилил)этокси]метил}-7-этинил-2Н-пиразоло[4,3-c]изохинолина, полученного на стадии 4 примера 7, в 4 мл метанола и 4 мл ДМФА, добавляют 208 мкл триметилсилилазида и 15 мг йодида меди(I). После нагревания смеси при 100°С в течение 2 часов, добавляют 104 мкл триметилсилилазида и 7 мг йодида меди(I) и продолжают нагревание в течение 2 часов при 100°С. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (40-63 мкм), элюируя смесью ДХМ/метанол (95/05 об.), и получают 121 мг 5-(2,6-дифторфенил)-N-[1-(метилсульфонил)пиперидин-4-ил]-7-(2Н-1,2,3-триазол-4-ил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-амина (воздушная масса желтого цвета).
1Н-ЯМР: -0,04 (с, 9Н), 0,90 (м, 2Н), 1,61 (м, 2Н), 2,12 (м, 2Н), 2,75 (м, 2Н), 2,85 (с, 3Н), 3,57 (м, 2Н), 3,68 (м, 2Н), 4,47 (м, 1Н), 5,66 (с, 2Н), 6,49 (д, J=8,4 Гц, 1Н), 7,36 (т, J=8,0 Гц, 2Н), 7,67 (м, 1Н), 8,01 (с шир., 1Н), 8,25 (д шир., J=8,5 Гц, 1Н), 8,41 (д, J=8,5 Гц, 1Н), 8,43 (м уш., частично экранирован, 1Н), 15,28 (м уш., 1Н).
Стадия 2: Вводят 116 мг 5-(2,6-дифторфенил)-N-[1-(метилсульфонил)пиперидин-4-ил]-7-(2Н-1,2,3-триазол-4-ил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-амина в 10 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 1,1 мл ТФА и перемешивают в течение 5 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 60 мл воды, нейтрализуют 7,5 М водным раствором гидроксида аммония. Экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол (92,5/7,5 об.), и получают 10 мг 5-(2,6-дифторфенил)-N-[1-(метилсульфонил)пиперидин-4-ил]-7-(2Н-1,2,3-триазол-4-ил)-1Н-пиразоло[4,3-c]изохинолин-3-амина (твердое вещество желтого цвета).
1Н-ЯМР: 1,62-1,75 (м, 2Н), 2,10 (м, 2Н), 2,82-2,97 (м, 5Н), 3,57 (м, 2Н), 3,74-3,86 (м, 1Н), 6,04 (д, J=8,0 Гц, 1Н), 7,35 (т, J=8,0 Гц, 2Н), 7,63-7,75 (м, 1Н), 8,13 (с шир., 1Н), 8,39 (д шир., J=8,6 Гц, 1Н), 8,45 (м уш., 1Н), 8,49 (д, J=8,6 Гц, 1Н), 12,77 (с, 1Н), 15,23 (м уш., 1Н).
Пример 26: 4-{[7-циано-5-(2,6-дифторфенил)-1H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамид
Вводят 306 мг 4-{[7-циано-5-(2,6-дифторфенил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида в 20 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 1,5 мл ТФА и перемешивают в течение 16 часов при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 30 мл воды, нейтрализуют 2 мл 7,5 М водного раствора гидроксида аммония. Экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол/NH4OH (92,5/7,5/0,75 об.). Получают 8 мг 4-{[7-циано-5-(2,6-дифторфенил)-1H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида.
1Н-ЯМР: 1,61-1,73 (м, 2Н), 2,09 (м, 2Н), 2,63-2,72 (м, 2Н), 3,47 (м, 2Н), 3,67-3,76 (м, 1Н), 6,13 (д, J=7,0 Гц, 1Н), 6,70 (с, 2Н), 7,34 (т, J=7,8 Гц, 2Н), 7,65-7,74 (м, 1Н), 8,18 (с шир., 1Н), 8,28 (д шир., J=8,6 Гц, 1Н), 8,56 (д, J=8,6 Гц, 1Н), 13,05 (с, 1Н).
Пример 27: 4-{[5-(2,6-дифторфенил)-7-(гидроксиметил)-1H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамид
Стадия 1: Вводят 449 мг 4-{[5-(2,6-дифторфенил)-7-формил-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида, полученного на стадии 1 примера 23, в 20 мл метанола. После охлаждения до 0°С на ледяной бане добавляют 34 мг NaBH4 и перемешивают в течение 1 часа. Добавляют 3 мл ацетона, затем смесь выливают в насыщенный водный раствор бикарбоната натрия. Экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол/NH4OH (95/5/0,5 об.). Получают 197 мг 4-{[5-(2,6-дифторфенил)-7-(гидроксиметил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида (воздушная масса желтого цвета).
1Н-ЯМР: -0,05 (с, 9Н), 0,88 (т, J=8,3 Гц, 2Н), 1,58 (м, 2Н), 2,09 (м, 2Н), 2,52 (м частично экранирован, 2Н), 3,48 (м, 2Н), 3,66 (т, J=8,3 Гц, 2Н), 4,34-4,43 (м, 1Н), 4,58 (д, J=5,7 Гц, 2Н), 5,38 (т, J=5,7 Гц, 1Н), 5,62 (с, 2Н), 6,39 (д, J=8,3 Гц, 1Н), 6,70 (с, 2Н), 7,30 (т, J=7,8 Гц, 2Н), 7,43 (с шир., 1Н), 7,58-7,67 (м, 1Н), 7,70 (дд, J=8,3; 1,5 Гц, 1Н), 8,33 (д, J=8,3 Гц, 1Н).
Стадия 2: Вводят 194 мг 4-{[5-(2,6-дифторфенил)-7-(гидроксиметил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида в 25 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 1,9 мл ТФА и перемешивают в течение 2 часов 30 минут при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 50 мл воды, нейтрализуют 2,5 мл 7,5 М водного раствора гидроксида аммония. Экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол/NH4OH (90/10/1 об.). Получают 28 мг 4-{[5-(2,6-дифторфенил)-7-(гидроксиметил)-1H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида.
1Н-ЯМР: 1,60-1,73 (м, 2Н), 2,05-2,16 (м, 2Н), 2,62-2,73 (м, 2Н), 3,46 (д, J=11,2 Гц, 2Н), 3,64-3,76 (м, 1Н), 4,63 (д, J=5,4 Гц, 2Н), 5,34 (т, J=5,9 Гц, 1Н), 5,75 (с, 1Н), 5,91 (д, 1Н), 6,70 (с, 2Н), 7,32 (т, 2Н), 7,59 (с, 1Н), 7,61-7,71 (м, 1Н), 7,84 (дд, 1Н), 8,35 (д, J=8,3 Гц, 1Н), 12,66 (с, 1Н).
Пример 28: 4-{[5-(2,6-дифторфенил)-7-фтор-1H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамид
Стадия 1: Работают как описано на стадии 3 примера 24, но вводят 310 мг 3-бром-5-(2,6-дифторфенил)-7-фтор-2-{[2-(триметилсилил)этокси]метил}-1Н-пиразоло[4,3-c]изохинолина в 8 мл 1,4-диоксана. После барботирования аргона через смесь в течение 10 минут добавляют 244 мг 2-метилпропан-2-ил-4-аминопиперидин-1-карбоксилата, 755 мг карбоната цезия, 63 мг 9,9-диметил-4,5-бис(дифенилфосфино)ксантена и 20 мг ацетата палладия(II). Смесь нагревают с обратным холодильником в течение 3 часов. После охлаждения смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол (90/10 об.), и получают 340 мг 2-метилпропан-2-ил-4-{[5-(2,6-дифторфенил)-7-фтор-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-карбоксилата (твердое вещество желтого цвета).
LC-MS-DAD-ELSD: 628=(M+H).
Стадия 2: Вводят 340 мг 2-метилпропан-2-ил-4-{[5-(2,6-дифторфенил)-7-фтор-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-карбоксилата в 16 мл метанола и 1,5 мл ТГФ. После охлаждения до 0°С на ледяной бане добавляют 2,7 мл 4 н. раствора хлористоводородной кислоты в диоксане и перемешивают в течение 5 часов при комнатной температуре. Смесь выливают в 200 мл насыщенного раствора бикарбоната натрия, затем экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол/гидроксид аммония (90/10/1 об.), и получают 180 мг 5-(2,6-дифторфенил)-7-фтор-N-(пиперидин-4-ил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-амина (твердое вещество желтого цвета).
LC-MS-DAD-ELSD: 528=(M+H).
Стадия 3: Смешивают 180 мг 5-(2,6-дифторфенил)-7-фтор-N-(пиперидин-4-ил)-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-амина, 2 мл ДМЭ и 41 мг сульфамида и нагревают в микроволновой печи в течение 1 часа при 150°С. Смесь выливают в воду, экстрагируют при помощи EtOAc, промывают насыщенным раствором NaCl, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол/гидроксид аммония (95/0,5/0,5 об.), и получают 183 мг 4-{[5-(2,6-дифторфенил)-7-фтор-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида (твердое вещество желтого цвета).
LC-MS-DAD-ELSD: 607=(M+H).
Стадия 4: Вводят 183 мг 4-{[5-(2,6-дифторфенил)-7-фтор-2-{[2-(триметилсилил)этокси]метил}-2Н-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида в 24 мл ДХМ. После охлаждения до 0°С на ледяной бане добавляют 1,9 мл ТФА и перемешивают в течение 2 часов 30 минут при комнатной температуре. Смесь концентрируют при пониженном давлении и полученный твердый продукт обрабатывают 50 мл воды, нейтрализуют 2,5 мл 7,5 М водного раствора гидроксида аммония. Экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Очищают флеш-хроматографией на силикагеле (15-40 мкм), элюируя смесью ДХМ/метанол/гидроксид аммония (90/10/1 об.). Получают 28 мг 4-{[5-(2,6-дифторфенил)-7-фтор-1H-пиразоло[4,3-c]изохинолин-3-ил]амино}пиперидин-1-сульфонамида (твердое вещество бледно-желтого цвета).
LC-MS-DAD-ELSD: 477=(M+H).
1Н-ЯМР: 1,66 (м, 2Н), 2,11 (м, 2Н), 2,67 (м, 2Н), 3,46 (м, 2Н), 3,70 (м, 1Н), 6,03 (д, J=7,7 Гц, 1Н), 6,72 (с, 2Н), 7,26-7,40 (м, 3Н), 7,68 (м, 1Н), 7,88 (тд, J=9,0; 2,5 Гц, 1Н), 8,50 (дд, J=9,0; 5,5 Гц, 1Н), 12,79 (с, 1Н).
Определение ИК 50 на клетках HeLa (ATCC CCL-2)
Для осуществления этого теста использовали опухолевые адгезионные клеточные линии. Пролиферацию этих клеток определяли посредством измерения количества 14С-тимидина, включенного в клетки. Клетки наносили на 96-луночные планшеты Cytostar вместе с культуральной средой и инкубировали в течение 4 часов при 37°С - 5% СО2. Затем вводили тестируемые соединения и планшеты повторно помещали в инкубатор. Через 72 часа после обработки к реакционной среде добавляли 14С-тимидин и клетки повторно инкубировали в течение 24 часов. Количество включенного 14С-тимидина измеряли с помощью считывающего устройства MicroBeta (Perkin Elmer) после 24-часовой инкубации в присутствии метки. Общая продолжительность обработки клеток тестируемыми соединениями составляла 96 часов.
В каждом опыте на планшеты наносили клетки в установленных концентрациях. Соединения тестировали в 10 концентрациях, осуществляя две параллельные пробы. Наиболее широко используемой начальной концентрацией является 10 мкМ, но она может варьироваться, также как и необходимость разведения, которая зависит от уровня активности соединений. Серийные разведения производились с использованием чистого ДМСО, затем каждую концентрацию разводили культуральной средой. Все соединения тестировали в двух независимых опытах.
Используемый материал
Среда Дульбекко (Gibco 11960-044)
Инактивированная фетальная телячья сыворотка (SVF) (Gibco 10500-056)
Пенициллин-стрептомицин-глутамин (PSG) (Gibco 10378-016)
96-луночный планшет Cytostar (Amersham RPNQ0162)
ДМСО (Sigma D2650)
14C-тимидин (NEN NEC-568)
|
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/044d77ee6887305473355695fbaaad95.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/d14482f2600246344e3748ac149c9720.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/efe8b114509786aa6cc088846128902a.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/ede84d5fc7ff78fc7887a19f7512fabf.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/4516e947601be9f057cfdcf65af43fd2.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/cc98ffaaf582b906ff333cc5e12b994a.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/8e449014f64f1afa034a8b231363e5bd.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/4a1897e8bbb0d99a1a79daf5a7ec7a60.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/0792e4a67e1f5e340c01d38d21cf310c.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/e5cd4d68c86d12d3be7fb631f29ae71c.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/75259111c8868a47612b245077500421.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/2d1e891d02a63e4ce09213745915b08b.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/4eb17dbd102687a3bd7d25c896b9c8ea.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/34b876c91f1fbfb0a1ea537bce8b5071.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/119bde9e0e129890f0f1c2afc28a0f86.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/ce69a66e3086d6cd29c271101f22f730.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/94689ff1609ada077ff470b292727226.png)
![ПРОИЗВОДНЫЕ 1Н-ПИРАЗОЛО[4,3-c]ИЗОХИНОЛИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В ТЕРАПИИ](https://fips.edrid.ru/images/rid/2c/f6/51/5f60c8f031ddb9ded62aa8bfffd94fa7.jpg)