Результат интеллектуальной деятельности: СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕЙ
Вид РИД
Изобретение
Предлагаемое изобретение относится к биологии и медицине, а именно к способам подавления опухолевого роста с использованием рекомбинантного белка, связывающегося с рецепторами (DR4 и DR5) цитокина TRAIL/Apo2L, и запускающего апоптотическую гибель опухолевых клеток, не повреждая при этом нормальные клетки.
Рекомбинантные белки человека, разработанные на основе цитокина TRAIL/Apo2L как и моноклональные антитела к рецепторам DR4 и DR5 этого цитокина, избирательно вызывают гибель опухолевых клеток, не повреждая нормальные клетки здоровых тканей. Это дает уникальную возможность создания на основе таких белков противоопухолевых препаратов, избирательно повреждающих опухолевые клетки и не оказывающих токсического действия на организм больного (см. Srivastava R.K., Neoplasia 2001, 3 (6), 535-546; Wang S., Oncogene, 2008, 27, 6207-6215).
Известен способ подавления роста опухолей путем применения рекомбинантных пептидов, связывающихся с рецепторами (DR4 и DR5) цитокина TRAIL/Apo2L и запускающих апоптотическую гибель опухолевых клеток (Патент США №6046048, 04-04-2000).
Недостатком известного способа является то, что клетки некоторых опухолей обладают слабой чувствительностью к действию TRAIL/Apo2L. Кроме того, опухолевые клетки различного происхождения могут приобретать резистентность к белкам TRAIL/Apo2L в результате адаптивного ответа на ухудшение условий околоклеточного микроокружения.
Известен способ подавления опухолевого роста путем применения рекомбинантных пептидов, связывающихся с рецепторами (DR4 и DR5) цитокина TRAIL/Apo2L и запускающих апоптотическую гибель опухолевых клеток, в котором для преодоления резистентности опухолевых клеток к TRAIL-опосредованному апоптозу выполняется мутация в рекомбинантном белке TRAIL, в результате которой снижается эффективность связывания белка с рецепторами-ловушками DcR1 и DcR2 для цитокина TRAIL/Apo2L, понижающих чувствительность клеток к этому цитокину. В результате такой мутации повышается эффективность связывания рекомбинантного белка с рецепторами гибели DR4 и DR5, что может способствовать повышению эффективности повреждающего действия белка на опухолевые клетки (Патент РФ 24005038, 29-07-2009).
Недостатком известного способа является то, что резистентность опухолевых клеток к TRAIL индуцированному апоптозу обусловлена различными механизмами, и повышенное количество рецепторов является только одним из таких механизмов, который не является основным для большинства опухолевых клеток. Это снижает возможности применения мутантного рекомбинантного белка TRAIL, имеющего низкую афинность к рецепторам-ловушкам DcR1 и DcR2, для подавления роста опухолей.
Наиболее близким, принятым за прототип, является способ повышения эффективности применения рекомбинантных белков TRAIL за счет их сочетания с веществами, понижающими резистентность опухолевых клеток посредством воздействия на молекулярные мишени клеток, ответственные за их выживаемость, в частности с препаратом нексавар, который является ингибитором RAF киназы и тирозиновых рецепторных киназ (Clin Cancer Res., 2010, 16(21); 5189-99).
Недостатком способа, принятого за прототип, является ограниченное проникновение рекомбинантного белка TRAIL в опухолевую ткань, что снижает противоопухолевый эффект сочетания белков TRAIL с сенситизирующими к нему веществами in vivo. Недостаточно эффективное проникновение веществ к опухолевым клеткам является одной из основных проблем онкологии, которая обусловлена бурным размножением опухолевых клеток, опережающим рост сосудов, повышенным интерстициальным давлением в паренхиме опухолевой ткани. Особенно значительна проблема ограничения скорости переноса к опухолевым клеткам для белковых субстанций, имеющих низкий коэффициент диффузии и быстрое время удаления их из кровотока.
Задачей предлагаемого изобретения была разработка способа повышения эффективности противоопухолевого эффекта сочетаний рекомбинантных белков TRAIL с веществами, подавляющими резистентность опухолевых клеток к повреждающим воздействиям, за счет их применения с субстанциями, обеспечивающими повышение эффективности их проникновения в опухолевую ткань.
Для решения этой задачи предложен способ подавления опухолевого роста с применением рекомбинантных белков TRAIL в комбинации с веществами, подавляющими резистентность опухолевых клеток к апоптогенному действию белков TRAIL, в котором дополнительно к указанному сочетанию веществ применяют циклический пептид Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys. Применение этого пептида обеспечивает повышение эффективности подавления роста опухолей указанными сочетаниями рекомбинантного белка TRAIL с веществами, повыщающими чувствительность к нему опухолевых клеток.
Проблема повышения эффективности проникновения противоопухолевых препаратов в паренхиму опухолевой ткани является одной из наиболее актуальных в онкологии. Утверждения о том, что сосуды в опухолевой ткани значительно фенестрированы, то есть имеются зазоры между эндотелиальными клетками, и поэтому высокопроницаемы для препаратов согласно многочисленным экспериментальным исследованиям не соответствуют действительности. Ранее было предложено использование специфических пептидов для повышения эффективности проникновения препаратов в опухолевую ткань (US Patent Application 20090246133). Способ основан на использовании пептида Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys, имеющего в своем составе мотив Arg-Gly-Asp (последовательность аминокислот аргинин-глицин-аспарагиновая кислота), обеспечивающего его преимущественное связывание с эндотелиальными клетками сосудов в опухолевой ткани, и мотив Cys-Arg-Gly-Asp-Lys-Gly, который после протеолиза пептида освобождается и, связываясь с рецептором нейропилином 1 на поверхности эндотелиальных клеток, повышает эффективность проникновения веществ из сосудов к опухолевым клеткам. Используя модельные опухоли человека в иммунодефицитных мышах, было показано, что введение в кровоток пептида Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys в дополнении к доксорубицину усиливало проникновение цитостатика в опухолевую ткань. Также при этом было показано подавление роста экспериментальных опухолей в животных, однако эффект был небольшой. Более значительный эффект авторы получили при введении пептида Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys с препаратом Bortuzomab, который является антителами против рецептора Нег2 new. Однако механизм повышения эффективности проникновения препаратов через сосуды в опухолевую ткань при использовании пептида Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys остается неизвестными, как об этом пишут авторы. Более того, остается неизвестно, в сочетании с какими противоопухолевыми препаратами указанный пептид способен повышать эффективность их проникновения в опухоль и соответственно противоопухолевую активность. Соответственно этому неизвестно, будет ли эффективным применение пептидов Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys в дополнение к рекомбинантным белкам TRAIL. Ниже представлены примеры реализации предложенного способа на моделях человеческих опухолей в иммунодефицитных мышах.
Материалы и методика испытаний.
Испытание предложенного способа проводили на моделях человеческих опухолей в иммунодефицитных мышах BALB/c nude. Для этого использовали мышей возрастом 7-8 недель весом 20-22 г, взятых из питомника лабораторных животных «Пущино» (ФИБХ РАН, г.Пущино). Для индукции опухолей клетки фибросаркомы (линия НТ-1080) или карциномы легкого человека (линия A 549) выращивали in vitro и вводили под кожу мышам в объеме 0.3 мл питательной среды ДМЕМ по 1×106 клеток НТ-1080 на мышь либо по 3×106 клеток А 549 на мышь. Протокол испытаний был одобрен этическими комитетами Московского научно-исследовательского института онкологии им. П.А.Герцена и Института теоретической и экспериментальной биофизики РАН.
Рекомбинантный человеческий белок izTRAIL, модифицированный изолейциновым зиппером для увеличения активности, получали в ИТЭБ РАН. Белок izTRAIL вызывал апоптотическую гибель клеток А 549, НТ-1080 и многих других опухолевых клеток in vitro, начиная с концентрации 0.1-5 нг/мл, и не вызывал гибель нормальных мезенхимальных стволовых клеток костного мозга человека in vitro при концентрациях 20 мкг/мл.
Для подавления резистентности опухолевых клеток применяли химиотерапевтический препарат доксорубицин и таргетный противоопухолевый препарат «Нексавар». Действующая субстанция препарата «Нексавар» - сорафениб является ингибитором внутриклеточных киназ (Raf, тирозинкиназных рецепторов) и согласно нашим данным, подавляет резистентность опухолевых клеток А 549, НТ-1080 к рекомбинантным белкам TRAIL in vitro
Циклический пептид Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys получали в ФИБХ РАН. Пептид в концентрации 4 мкг/мл был нетоксичен для используемых опухолевых клеток in vitro.
Противоопухолевый эффект оценивали по торможению роста опухоли. Показатель торможения роста опухоли (ТРО) вычисляли по формуле:
ТРО(%)=[(Vконтроль-Vопыт)/Vконтроль]×100, где V - объем опухоли в мм3
Минимально значимые критерии активности по ТРО считали при превышении 50% (Методические указания по изучению противоопухолевой активности фармакологических веществ. / Трещалина Е.М., Жукова О.С., Герасимова Г.К. и др // Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: ИИА Ремедиум, 2000, с.319) Статистическую обработку полученных результатов проводили, используя критерий Уитни - Манна (p<0.05).
Пример 1
Испытание предложенного способа проводили на модели человеческой опухоли, инициированной введением под кожу мышам клеток фибросаркомы человека, линия НТ-1080. Через 7 суток после инъекции опухолевых клеток животных случайным образом делили на следующие группы:
1 - контрольная группа, в которой, начиная с 7 дня роста опухоли, вводили внутриорбитально (внутривенно) физиологический раствор (0,3 мл) в те же сроки, что белок izTRAIL и пептид Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys.
2 - мышам этой группы вводили препарат «Нексавар» перорально в разовой дозе по 50 мг сорафениба (действующее вещество препарата «Нексавар») на 1 кг веса животных ежедневно в течение 24 дней.
3 - мышам этой группы рекомбинантный белок izTRAIL вводили внутриорбитально (внутривенно) в разовой дозе 15 мг/кг в те же сроки, что и «Нексавар».
4 - в этой группе рекомбинантный белок izTRAIL вводили внутриорбитально (внутривенно) в разовой дозе 15 мг/кг через 3 часа после введения препарата «Нексавар».
5 - мышам этой группы пептид Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys вводили внутриорбитально (внутривенно) в разовой дозе 4 мг/кг через 3 часа после введения препарата «Нексавар».
6 - мышам этой группы вводили пептид Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys внутриорбитально (внутривенно) в разовой дозе 4 мг/кг вместе с белком izTRAIL (15 мг/кг) через 3 часа после введения препарата «Нексавар».
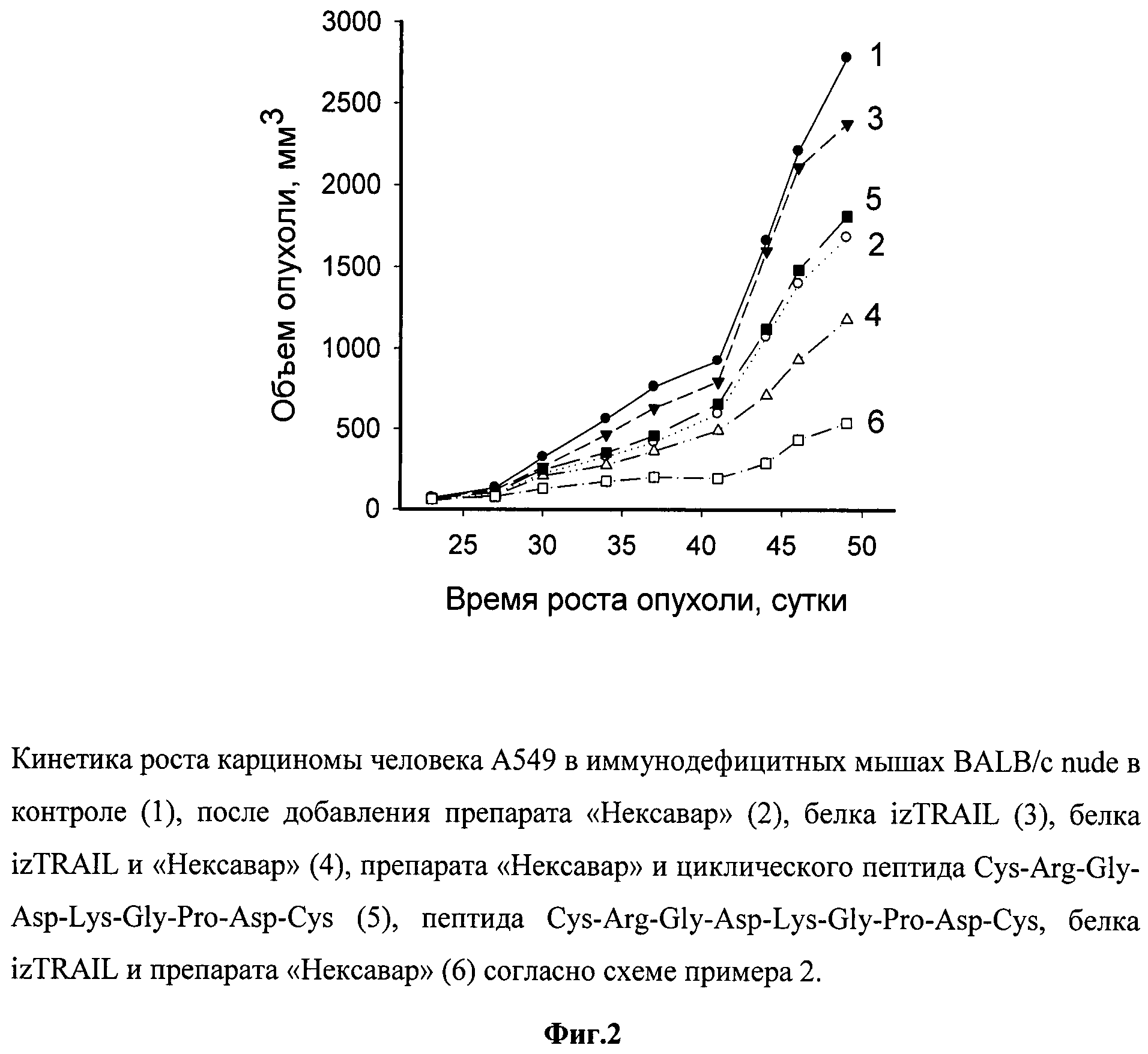
Данные, характеризующие противоопухолевую эффективность комплексного лечения мышей BALB/c nude с человеческой саркомой НТ-1080 с применением рекомбинантного белка izTRAIL, таргетного препарата «Нексавар», а также пептида Cys-Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys представлены на фиг.1.
Как видно из фиг.1, представляющей рост опухолей в указанных группах, рекомбинантный противоопухолевый белок в дозе 15 мг/кг, в 15000 раз превышающей эффективные концентрации этого белка на клетки НТ-1080 in vitro, в моноварианте был неэффективен и ТРО составлял около 10%. Препарат «Нексавар» в концентрациях, токсичных для этих клеток in vitro, был слабоэффективен (ТРО около 35%) и пептид в нетоксичной концентрации не усиливал его действие. Рекомбинантный белок izTRAIL в сочетании с препаратом «Нексавар» неаддитивным образом тормозил рост опухоли до 55%, а дополнительное применение с ними пептида Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys усиливало торможение роста опухоли до 80%. Повышение коэффициента торможения роста опухоли за счет добавления циклического пептида Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys к сочетанию рекомбинантного белка izTRAIL и препарата «Нексавар» было достоверным согласно критерию Уитни-Манна (p<0.05).
Пример 2
Испытание предложенного способа проводили на модели человеческой опухоли, инициированной введением под кожу клеток карциномы A 549. Через 21 сутки после инъекции опухолевых клеток, когда появлялась возможность выявить опухоли и определить их размер (около 4 мм в диаметре), животных случайным образом делили на следующие группы:
1 - контрольная группа, в которой, начиная с 21 дня роста опухоли, вводили внутривенно (хвостовая вена) физиологический раствор (0,3 мл) в те же сроки, что и белок izTRAIL.
2 - препарат «Нексавар» вводили мышам перорально в разовой дозе по 50 мг сорафениба (действующее вещество препарата «Нексавар») на 1 кг веса животных ежедневно.
3 - мышам этой группы рекомбинантный белок izTRAIL вводили внутривенно (хвостовая вена) в разовой дозе 10 мг/кг в те же сроки, что и «Нексавар».
4 - рекомбинантный белок izTRAIL вводили внутриорбитально (внутривенно) в разовой дозе 15 мг/кг через 2 часа после введения препарата «Нексавар».
5 - пептид Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys вводили внутривенно в разовой дозе 4 мг/кг через 2 часа после введения препарата «Нексавар».
6 - в этой группе пептид Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys вводили мышам внутривенно в разовой дозе 4 мг/кг вместе с белком izTRAIL (10 мг/кг) через 2 часа после введения препарата «Нексавар».
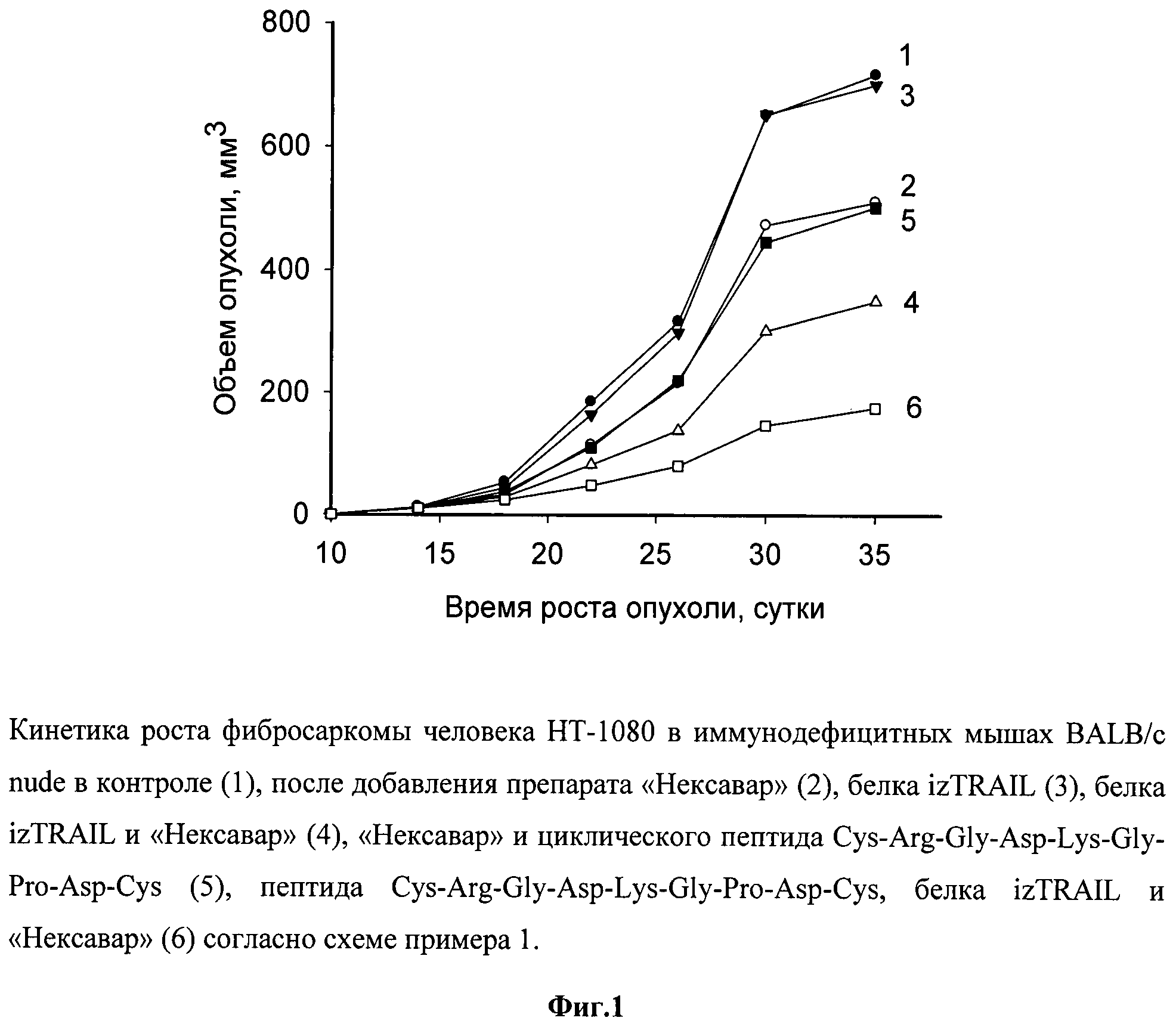
Как видно из фиг.2, представляющей рост опухолей в указанных группах, рекомбинантный противоопухолевый белок в дозе 10 мг/кг, в 1500 раз превышающей эффективные концентрации этого белка на клетки А549 in vitro, в моноварианте был неэффективен для подавления роста опухолей (ТРО - 15-20%). Препарат «Нексавар» в концентрации 10 мкг/мл был токсичен для этих клеток in vitro, но оказывал слабый противоопухолевый эффект (ТРО составлял около 35%). Пептид в нетоксичной концентрации не усиливал его действие. Рекомбинантный белок izTRAIL в сочетании с препаратом «Нексавар» неаддитивным образом тормозил рост опухоли до 50%, а дополнительное применение с ними пептида Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys усиливало торможение роста опухоли до 75%. Повышение коэффициента торможения роста опухоли за счет добавления циклического пептида Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys к сочетанию рекомбинантного белка izTRAIL и препарата «Нексавар» было достоверным согласно статистике Уитни-Манна (p<0.05).
Пример 3
Испытание предложенного способа проводили на модели человеческой опухоли, инициированной введением под кожу клеток карциномы А 549. Через 21 сутки после инъекции опухолевых клеток, когда появлялась возможность выявить опухоли и определить их размер (около 4 мм в диаметре), животных случайным образом делили на следующие группы:
1 - контрольная группа, в которой, начиная с 21 дня роста опухоли, вводили внутривенно (хвостовая вена) физиологический раствор (0,3 мл) в те же сроки, что и белок izTRAIL.
2 - группа, в которой препарат доксорубицин вводили, начиная с 21 дня роста опухолей, внутривенно (хвостовая вена) в разовой дозе по 2 мг на 1 кг веса животных с интервалом 7 дней.
3 - рекомбинантный белок izTRAIL вводили в разовой дозе 10 мг/кг через 2 часа (внутрибрюшинно), 24 и 48 часов (внутривенно) после введения препарата доксорубицин по схеме группы 2.
4 - рекомбинантный белок izTRAIL вводили в разовой дозе 10 мг/кг в те же сроки и таким же образом, как в группе 3, но без введения препарата доксорубицин.
5 - циклический пептид Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys вводили в разовой дозе 4 мг/кг вместе с белком izTRAIL (10 мг/кг) по схеме группы 3 после введения препарата доксорубицин.
6 - циклический пептид Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys вводили по той же схеме, что и в группе 5, после введения препарата «Нексавар», но без izTRAIL.
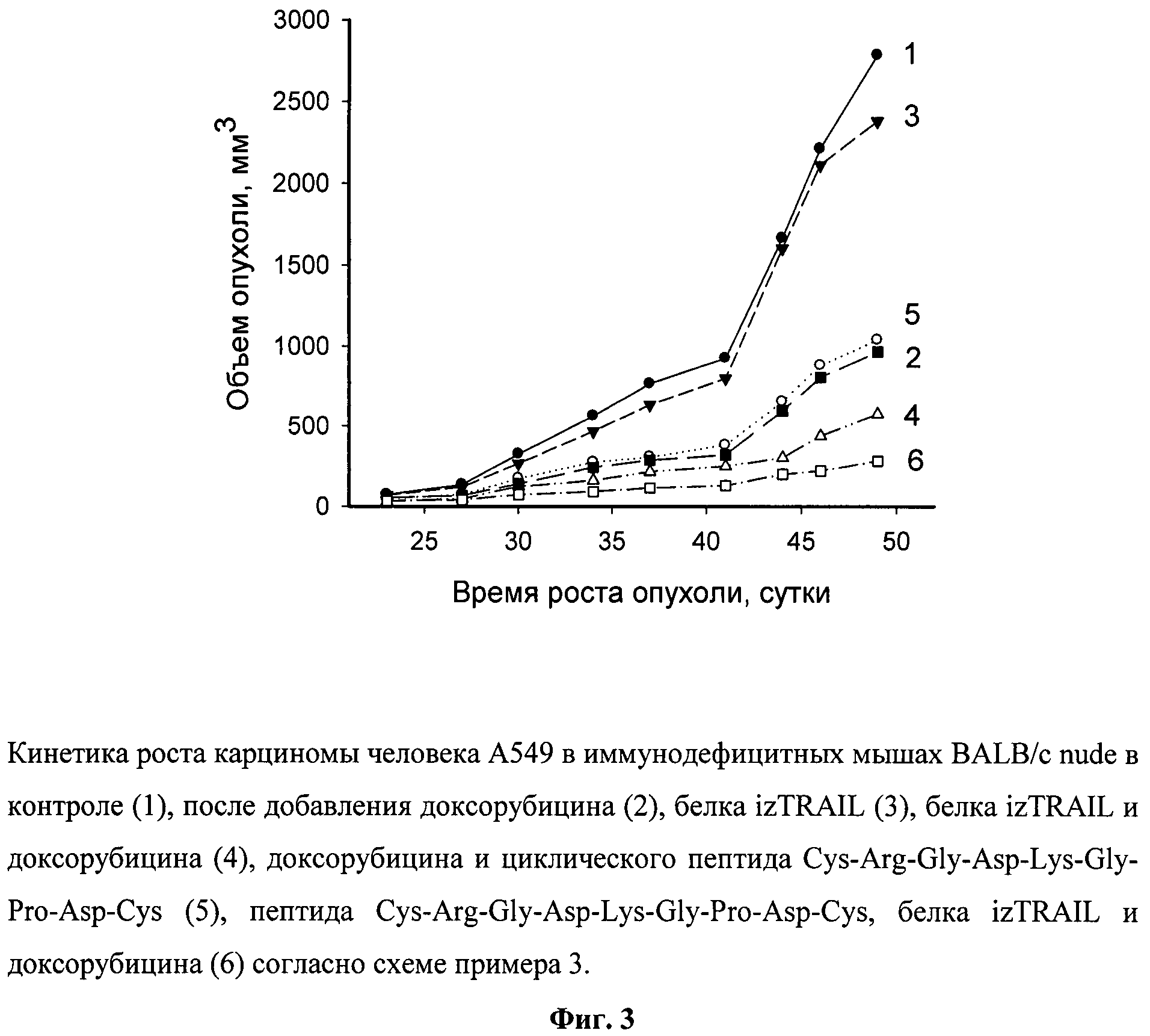
Из фиг.3, представляющей рост опухолей, видно, что рекомбинантный противоопухолевый белок в дозе 10 мг/кг, в 1500 раз превышающей эффективные концентрации этого белка на клетки А549 in vitro, в моноварианте был неэффективен (ТРО - 5-10%). Доксорубицин в терапевтической дозе вызывал значительное торможение роста опухоли (ТРО достигало 60%). Пептид в нетоксичной концентрации не усиливал противоопухолевый эффект доксорубицина. Рекомбинантный белок izTRAIL в сочетании с доксорубицином неаддитивным образом подавлял рост опухоли (увеличение ТРО до 75%). Дополнительное применение пептида Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys в сочетании с izTRAIL и доксорубициномом усиливало торможение роста опухоли до 90%. Повышение коэффициента торможения роста опухоли за счет добавления циклического пептида Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys к сочетанию рекомбинантного белка izTRAIL и доксорубицина было достоверным согласно статистике Уитни-Манна (p<0.05)
Таким образом, предлагаемый способ подавления роста опухолей, в котором применение рекомбинантного белка TRAIL в сочетании с противоопухолевыми препаратами и таргетными субстанциями дополняют циклическим пептидом Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys, позволяет повысить эффективность торможения роста опухолей.
Способ подавления роста опухолей с применением рекомбинантных белков, связывающихся с рецепторами цитокина TRAIL/Apo2L и обладающих избирательной токсичностью против опухолевых клеток, в комбинации с веществами, подавляющими резистентность опухолевых клеток к повреждающему действию этих белков, отличающийся тем, что дополнительно используют циклический пептид Cys-Arg-Gly-Asp-Lys-Gly-Pro-Asp-Cys.