Результат интеллектуальной деятельности: СОДЕЖАЩИЙ ОКТРЕОТИД СОСТАВ С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ СО СТАБИЛЬНО ВЫСОКИМ УРОВНЕМ ВОЗДЕЙСТВИЯ
Вид РИД
Изобретение
Настоящее изобретение относится к составам с замедленным высвобождением, содержащим в качестве активного ингредиента октреотид или его фармацевтически приемлемую соль и некоторые линейные сополимеры полилактида и гликолида (СМГК).
Фармацевтические композиции по настоящему изобретению предназначены в том числе для продолжительного поддерживающего лечения пациентов с акромегалией и для лечения тяжелых форм диареи и гиперемии, связанных со злокачественными карциноидными опухолями и опухолями (випомами), клетки которых вырабатывают вазоактивный интестинальный пептид (ВИП).
Пептидные препараты обычно вводят системным способом, например, парентерально. Однако парентеральное введение может сопровождаться болезненными ощущениями и вызывать дискомфорт, прежде всего при многократном ежедневном введении. Чтобы свести к минимуму количество назначенных пациенту инъекций, лекарственное вещество предпочтительно вводят в виде состава с замедленным высвобождением. Общим недостатком при введении инъекционных составов с замедленным высвобождением является изменение содержания активного вещества в плазме крови от максимальных уровней до уровней, близких к нулю, в течение всего периода высвобождения.
В настоящем изобретении предлагается улучшенный состав с замедленным высвобождением, который обеспечивает стабильно высокий уровень воздействия активного вещества. Кроме того, состав с замедленным высвобождением по настоящему изобретению обеспечивает быстрое достижение необходимого уровня воздействия активного вещества, т.е. характеризуется только короткой лаг-фазой или ее отсутствием. Состав с замедленным высвобождением по настоящему изобретению содержит в качестве активного ингредиента (лекарственного вещества) октреотид или его фармацевтически приемлемую соль. Октреотид является аналогом соматостатина и характеризуется следующей формулой:
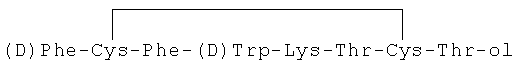
Активный ингредиент применяют в форме фармацевтически приемлемой соли октреотида, такой как кислотно-аддитивная соль, например соль неорганической кислоты, поликислоты или органической кислоты, например, соляной кислоты, уксусной кислоты, молочной кислоты, лимонной кислоты, фумаровой кислоты, малоновой кислоты, малеиновой кислоты, винной кислоты, аспарагиновой кислоты, бензойной кислоты, янтарной кислоты или памовой (эмбоновой) кислоты. Кислотно-аддитивные соли присутствуют в виде одно- или двухвалентных солей, например, в зависимости от содержания в молекуле одного или двух кислотных остатков. Предпочтительным является монопамоат октреотида.
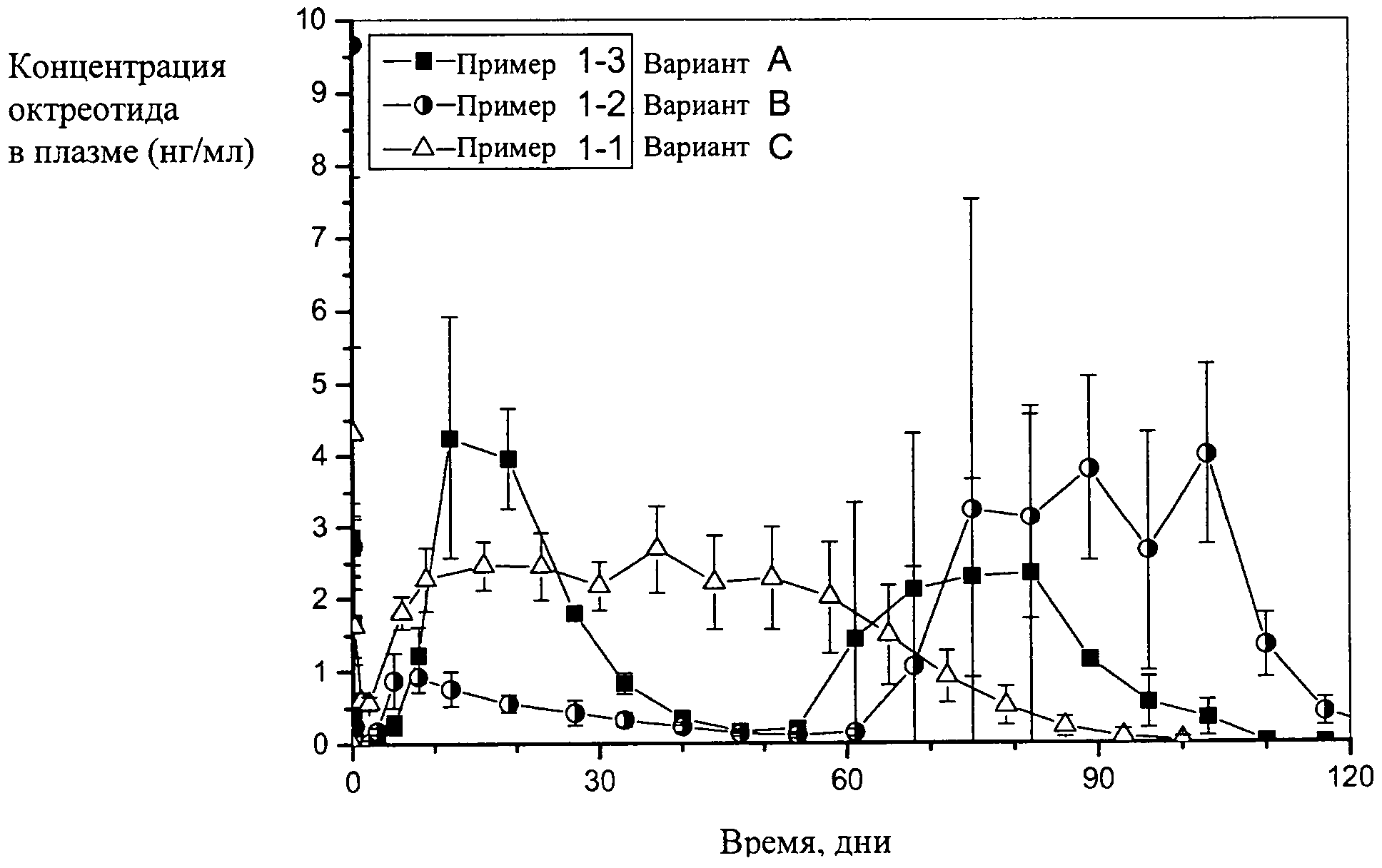
Для поддержания приемлемого уровня ГРч (гормон роста человека) и ИФР-1 (инсулиноподобный фактор роста) в крови пациентов с акромегалией необходимо поддерживать стабильный уровень октреотида в плазме крови по крайней мере на уровне 1,5 нг/мл, 1,8 нг/мл или 2 нг/мл, что является достаточным для контроля заболевания (терапевтическая конечная концентрация активного вещества в плазме крови). Разработка состава с замедленным высвобождением на основе СМГК, который обеспечивает указанные стабильно высокие уровни действия активного вещества в плазме крови в течение длительного периода времени, является сложной задачей. До настоящего времени ни один из описанных содержащих октреотид составов с замедленным высвобождением не в состоянии обеспечить необходимый уровень действия активного вещества в плазме крови при его введении кроликам в дозе 12 мг/кг массы тела (самцы новозеландских белых кроликов (HsdIf:NZW), ~3 кг±20%, Харлан, Нидерланды) в течение длительного времени в течение более 50 дней. Составы с пролонгированным высвобождением, содержащие в качестве активного ингредиента октреотид или его фармацевтически приемлемую соль и СМГК, описаны, например, в патенте GB2265311 или заявке WO 2007/071395. Однако известные составы характеризуются длительной фазой низкого уровня ("лаг-фазой") для партии 1-2, как показано на фиг.1 и/или "впадиной" на кривых для препарата с диффузионным контролируемым высвобождением и для препарата с эрозионным контролируемым высвобождением, партии 1-2 и 1-3, как показано на фиг.1.
В настоящем изобретении неожиданно было установлено, что составы, содержащие два различных линейных сополимера СМГК, характеризующиеся одинаковым соотношением мономеров лактид/гликолид (Л/Г) 75:25, но различными значениями вязкости, обеспечивают улучшенный профиль высвобождения, прежде всего в отношении лаг-фазы или "впадины" на кривой. Было установлено, что составы по настоящему изобретению обеспечивают стабильно высокий уровень октреотида в плазме крови по крайней мере 1,5 нг/мл, 1,8 нг/мл или 2 нг/мл в течение длительного периода времени, такого как, например, по крайней мере 50 дней. Указанный улучшенный профиль высвобождения в течение продолжительного периода времени, следовательно, прежде всего можно использовать для состава с замедленным высвобождением, который можно применять в течение более длительного периода времени, по сравнению с коммерческим содержащим октреотид составом с замедленным высвобождением, так называемым Sandostatin®LAR®, который вводят каждые 28 дней.
В одном объекте настоящего изобретения предлагается содержащий октреотид состав с замедленным высвобождением, состоящий из смеси двух различных сополимеров СМГК, характеризующихся одинаковым соотношением мономеров М/Г, равным 75:25, но различными значениями вязкости. Предпочтительно указанные два сополимера отличаются концевыми группами, например сложноэфирной и карбоксильной концевыми группами. Состав характеризуется стабильно высоким уровнем действия активного вещества в организме кроликов после внутримышечной инъекции в течение по крайней мере 50 дней, предпочтительно по крайней мере приблизительно 2 месяца. Кроме того, составы с замедленным высвобождением по настоящему изобретению характеризуются короткой лаг-фазой до достижения уровня конечной терапевтической концентрации. При однократной инъекции состава по настоящему изобретению типичная лаг-фаза между начальным повышением концентрации и достижением конечной терапевтической концентрации в плазме крови составляет период менее 12 дней, например от 4 до 12 дней или от 6 до 10 дней.
Распределение частиц лекарственного вещества по размерам влияет на профиль высвобождения лекарственного препарата из формы пролонгированного действия. Лекарственное вещество, которое используют для получения состава с замедленным высвобождением, представляет собой кристаллическую структуру или аморфный порошок. Предпочтительным является аморфный порошок с размером частиц от приблизительно 0,1 мкм до приблизительно 15 мкм (99%>0,1 мкм, 99%<15 мкм), предпочтительно от 1 мкм до приблизительно менее 10 мкм (90%>1 мкм, 90%<10 мкм). Для обеспечения требуемого распределения частиц по размеру лекарственное вещество предпочтительно подвергают процессу микронизации.
Настоящее изобретение также относится к фармацевтической композиции с замедленным высвобождением, содержащей в качестве активного ингредиента октреотид или его фармацевтически приемлемую соль, включенные в матрицу СМГК, например, в виде микрочастиц, имплантатов или полутвердых составов.
Фармацевтическая композиция по настоящему изобретению обеспечивает замедленное высвобождение активного ингредиента у пациента (предпочтительно человека), нуждающегося в таком лечении, в период по крайней мере 45 дней, по крайней мере 50 дней, по крайней мере 60 дней, по крайней мере 75 дней или по крайней мере 90 дней. Фармацевтическая композиция по настоящему изобретению обеспечивает замедленное высвобождение активного вещества в период от 60 до 120 дней. Во время высвобождения активного ингредиента уровень октреотида в плазме крови находится в пределах терапевтического диапазона. Следует понимать, что точная доза октреотида зависит от множества факторов, в том числе от состояния, подлежащего лечению, тяжести состояния, подлежащего лечению, массы тела пациента и продолжительности лечения. Благоприятный профиль высвобождения по настоящему изобретению позволяет увеличить интервалы между введением фармацевтической композиции по настоящему изобретению по сравнению с известными составами. До настоящего времени ни один содержащий октреотид состав замедленного высвобождения с более длительным интервалом введения более 28 дней не был утвержден для лечения. Из-за благоприятного профиля высвобождения состав с замедленным высвобождением по настоящему изобретению можно использовать для введения от одного раза в 2 месяца (например, каждые 8 недель или каждые 60 дней) до одного раза каждые 4 месяца (например, каждые 16 недель или каждые 120 дней). В одном предпочтительном варианте осуществления настоящего изобретения состав с замедленным высвобождением по настоящему изобретению вводят один раз каждые 3 месяца (например, каждые 12 недель или каждые 90 дней).
Неожиданно было установлено, что можно значительно снизить изменения концентрации активного вещества в плазме крови за счет использования пригодной комбинации двух различных линейных СМГК в фармацевтической композиции по настоящему изобретению.
Лекарственное вещество включают в биодеградабельную полимерную матрицу, состоящую из двух различных линейных СМГК, в которых соотношение мономеров М/Г составляет 75:25.
СМГК по настоящему изобретению характеризуются молекулярной массой (ММ) от 1000 до 500000 Да, предпочтительно от 5000 до 100000 Да и линейной структурой.
Характеристическая вязкость (ХВ) растворов СМГК по настоящему изобретению в СНСl3 составляет менее 0,9 дл/г, предпочтительно менее 0,8 дл/г, предпочтительно менее 0,6 дл/г, более предпочтительно от 0,1 дл/г до 0,5 дл/г. Характеристическую вязкость определяют стандартными методами по времени истечения, как описано, например, в Европейской фармакопее, стр.17-18 (капиллярный метод) (1997). Если не указано иное, указанные значения вязкости измеряли при температуре 25°С и 0,1% концентрации сополимеров в СНСl3.
Концевые группы СМГК по настоящему изобретению включают, но не ограничиваясь только ими, гидроксигруппу, карбоксигруппу, сложноэфирную группу и т.п.
Содержание лекарственного вещества в составе с замедленным высвобождением находится в интервале от 1% до 30%, предпочтительно от 10% до 25%, более предпочтительно от 15% до 20%. Содержание определяют в виде массового соотношения лекарственного вещества в виде свободного основания и общей массы состава СМГК.
Пригодные известные коммерческие полимеры включают, но не ограничиваясь только ими, продукты: RESOMER ®, Boehringer Ingelheim Pharma GmbH & KG, Ингельхайм, Германия, LACTEL ®, Durect Corp, Pelham, Алабама, США, MEDISORB ®, Lakeshore, Inc Кембридж, Массачусетс, США, PURASORB ®, PURAC biochem BV, Gorinchem, Нидерланды. Предпочтительными полимерами по настоящему изобретению, прежде всего, являются продукты Resomer ® RG 752 Н и Resomer ® RG 753 С.
Фармацевтическую композицию по настоящему изобретению можно получать в стерильных или нестерильных условиях с последующей стерилизацией гамма-облучением. Предпочтительной является конечная стерилизация гамма-облучением, в результате получают продукт с наивысшей стерильностью.
Фармацевтическая композиция по настоящему изобретению также содержит один или более фармацевтических эксципиентов, модулирующих параметры высвобождения, в количестве от 0,1% до 50%. Примеры таких агентов включают: поливиниловый спирт, поливинилпирролидон, натриевую соль карбоксиметилцеллюлозы (КМЦ-Na), декстрин, полиэтиленгликоль, пригодные ПАВ, такие как коммерческие продукты полоксамеры, так называемые блок-сополимеры оксиэтилена и оксипропилена, оксиэтилена и эфиров жирных кислот и сорбита под торговым названием твин ® (например, твин 20, твин 40, твин 60, твин 80, твин 65, твин 85, твин 21, твин 61, твин 81), коммерческие эфиры сорбита и жирных кислот, например, известные под торговым названием SPAN, лецитины, неорганические соли, такие как карбонат цинка, гидроксид магния, карбонат магния или протамин, например протамин человека или протамин лосося, или природные или синтетические полимеры, содержащие аминогруппы, такие как полилизин.
Фармацевтическая композиция по настоящему изобретению представляет собой смесь пролонгированного действия или смесь различных полимеров, отличающихся составом, молекулярной массой и/или полимерной структурой. Термин "полимерная смесь", использованный в данном контексте, обозначает твердый раствор или суспензию двух различных линейных полимеров в одном имплантате или микрочастице. В отличие от него термин "смесь пролонгированного действия", использованный в данном контексте, обозначает смесь двух составов с замедленным высвобождением, таких как имплантатов, или микрочастиц, или полутвердых составов (различного состава), содержащих один или более СМГК в каждом составе. Предпочтительной является фармацевтическая композиция, в которой два СМГК присутствуют в виде полимерной смеси.
Фармацевтическую композицию по настоящему изобретению получают в виде имплантатов, полутвердых составов (гелей), жидких растворов или суспензий, которые затвердевают in situ сразу после введения, или микрочастиц. Предпочтительными являются микрочастицы. Способ получения микрочастиц, включающих октреотид или его фармацевтически приемлемую соль, известен и, например, описан в патентах US5445832 или US5538739.
В следующем разделе настоящего описания представлены полимерные микрочастицы, хотя то же самое относится и к имплантатам, полутвердым составам (гелям) и растворам.
В настоящем изобретении можно использовать частицы от субмикронного до миллиметрового размера, например, их диаметр составляет от приблизительно 0,01 мкм до приблизительно 2 мм, например, приблизительно от 0,1 мкм до приблизительно 500 мкм. В фармацевтике используют частицы диаметром не более приблизительно 250 мкм, например от 10 до 200 мкм, предпочтительно от 10 до 130 мкм, более предпочтительно от 10 до 90 мкм.
Микрочастицы по настоящему изобретению предварительно смешивают с антиагломерационным агентом или на частицы наносят покрытие из антиагломерационного агента или слой антиагломерацинного агента, например, в предварительно заполненном шприце или флаконе. Пригодные антиагломерационные агенты включают, например, маннит, глюкозу, декстрозу, сахарозу, хлорид натрия или водорастворимые полимеры, такие как поливиниловый спирт, поливинилпирролидон или полиэтиленгликоль, например, с описанными выше свойствами.
Способ получения состава с замедленным высвобождением по настоящему изобретению подробно описан для микрочастиц.
Микрочастицы можно получить несколькими способами, известными в данной области техники, например методом коацервации или разделения фаз, сушки с распылением, эмульгирования/суспендирования типа "вода-в-масле" (В/М), или типа "вода-в-масле-в-воде" (В/М/В), или типа "твердое вещество-в-масле-в-воде" (Т/М/В) с последующей экстракцией растворителя или испарением растворителя. Метод эмульгирования/суспендирования является предпочтительным способом, который включает следующие стадии:
(1) получение внутренней органической фазы, включающее
(1а) растворение полимера или полимеров в пригодном органическом растворителе или смеси растворителей, необязательно растворение/диспергирование пригодных добавок,
(1б) растворение/суспендирование/эмульгирование лекарственного вещества в растворе полимера, полученного на стадии (1а),
(2) получение внешней водной фазы, содержащей стабилизаторы и необязательно, но предпочтительно буферные соли,
(3) смешивание внутренней органической фазы с внешней водной фазой, например, в аппарате с высоким сдвигом, например в роторно-статорном смесителе (турбинного типа) или статическом смесителе, при этом получают эмульсию, и
(4) отверждение микрочастиц при испарении растворителя или экстракции растворителя, промывка микрочастиц, например, водой, сбор и сушка микрочастиц, например лиофильная сушка или сушка в вакууме, и просеивание микрочастиц через сито с размером ячеек 140 мкм. Пригодные органические растворители для растворения полимеров включают, например, этилацетат, ацетон, тетрагидрофуран (ТГФ), ацетонитрил или галогенизированные углеводороды, например хлористый метилен, хлороформ или гексафторизопропанол.
Пригодные примеры стабилизатора, применяемого на стадии (2б), включают поливиниловый спирт (ПВС) в количестве от 0,1% до 5%, гидроксиэтилцеллюлозу (ГЭЦ) и/или гидроксипропилцеллюлозу (ГПЦ) в общем количестве от 0,01% до 5%, поливинилпирролидон, желатин, предпочтительно желатин из свиньи или рыбы.
Сухую композицию микрочастиц на заключительной стадии стерилизуют гамма-облучением (избыточная стерилизация), при этом обеспечивается максимальная стерильность необязательно частиц в объеме или расфасованных после заполнения ими конечного контейнера. В другом варианте стерилизованные в объеме микрочастицы можно ресуспендировать в пригодном носителе и в виде суспензии заполнять ими пригодное устройство, такое как двухкамерный шприц, с последующей лиофилизацией.
Фармацевтическая композиция по настоящему изобретению, включающая микрочастицы, может также содержать носитель для ускорения повторного суспендирования.
До введения микрочастицы суспендируют в пригодном носителе для инъекций. Предпочтительно указанный наполнитель содержит водную основу, включающую фармацевтические эксципиенты, такие как маннит, хлорид натрия, глюкоза, декстроза, сахароза или глицерины, неионогенные ПАВ, например, полоксамеры, сополимер оксиэтилена с эфирами сорбита и жирных кислот, натриевая соль карбоксиметилцеллюлозы (КМЦ-Na), сорбит, поливинилпирролидон или моностеарат алюминия, для обеспечения изотоничности и для улучшения параметров смачиваемости и седиментации микрочастиц. Агенты для повышения смачивания и вязкости можно добавлять в количестве от 0,01% до 1% для обеспечения изотоничности суспензии для инъекции.
Настоящее изобретение также относится к применению фармацевтической композиции по настоящему изобретению для продолжительного поддерживающего лечения пациентов с акромегалией и для лечения тяжелых форм диареи и гиперемии, связанных со злокачественными карциноидными опухолями и опухолями (випомами), в клетках которых вырабатывается вазоактивный интестинальный пептид (ВИП).
Эффективность фармацевтических композиций по настоящему изобретению можно оценивать при проведении стандартных клинических испытаний или испытаний на моделях животных.
В настоящем изобретении также предлагается набор, включающий состав с замедленным высвобождением во флаконе, необязательно оснащенном клапаном для переливания, вместе с наполнителем на водной основе в ампуле, флаконе или предварительно заполненном шприце или в виде микрочастиц и наполнителя, разделенных в двухкамерном шприце.
Краткое описание фигур
На фиг.1 показана зависимость концентрации октреотида в сыворотке крови от времени после введения образцов, полученных в примерах 1-1, 1-2 и 1-3 (варианты составов С, В, А) в дозе 12 мг/кг внутримышечно кроликам (среднее значение и СО определяли при испытаниях на 4-х животных).
Экспериментальная часть
Следующие примеры представлены для иллюстрации настоящего изобретения и не ограничивают его объем. Примеры предназначены только для описания способа применения настоящего изобретения на практике.
Пример 1
Получение микрочастиц
Определенное количество полимеров СМГК растворяли в соответствующем количестве дихлорметана, при этом получали растворы полимера с соответствующей концентрацией, как указано в таблице 2, столбец "Конц. СМГК". Соответствующее количество лекарственного вещества взвешивали в стеклянном лабораторном стакане и раствор полимера выливали в лекарственное вещество, при этом получали микрочастицы с соответствующим содержанием лекарственного вещества, как указано в столбце "Содержание лекарственного вещества".
Например, для получения микрочастиц с содержанием лекарственного вещества 20% и концентрацией полимера 20% 3,547 г полимеров СМГК растворяли в 17,7 мл дихлорметана и получали 20 мас./об.%-ный раствор полимера. 1,453 г памоата октреотида, содержащего 68,8% свободного основания пептида (1,00 г соответствует 20% свободного основания октреотида), взвешивали в стеклянном лабораторном стакане и полимерный раствор выливали на лекарственное вещество.
Суспензию гомогенизировали в роторно-статорном смесителе фирмы Ultra-Turrax при скорости 20000 об/мин в течение 1 мин при охлаждении смесью лед/вода. Указанная суспензия относится к суспензии типа Т/М ("твердое вещество-в-масле").
10,00 г поливинилового спирта ПВС 18-88, 3,62 г KН2РО4 и 15,14 г Na2HPO4 растворяли в 2,00 л деионизированной воды, при этом получали буферный раствор 0,5% ПВС 18-88, рН 7,4.
Суспензию типа Т/М смешивали с раствором 0,5% ПВС 18-88 следующим образом: в один и тот же турбинный смеситель подавали суспензию Т/М с помощью перистальтического насоса (Реrрех, шланг Viton) со скоростью 10 мл/мин в турбину и водный раствор с помощью шестеренчатого насоса (Ismatec MV-Z/B, напорная насадка Р140) со скоростью 200 мл/мин. Два раствора смешивали в турбинном смесителе, как указано в таблице 2. Гомогенизированную эмульсию типа Т/М/В собирали в стеклянный лабораторный стакан объемом 2 л, который предварительно заполняли 200 мл буферного раствора ПВС.
Эмульсию типа Т/М/В затем нагревали до температуры 45°С в течение 5 ч. Температуру 45°С поддерживали в течение еще 2 ч, затем партию продукта снова охлаждали до комнатной температуры. На этой стадии выделяющийся дихлорметан удаляли в вакууме и партию перемешивали 4-х лопастной пропеллерной мешалкой со скоростью 250 об/мин.
В результате из эмульсии типа Т/М/В формировались микрочастицы. Указанные микрочастицы отделяли фильтрованием (5 мкм). Микрочастицы промывали 5 раз по 200 мл воды и сушили в течение 36 ч при температуре 20°С и давлении 0,030 мбар. Высушенные микрочастицы просеивали через сито с размером ячеек 140 мкм и высыпали в стеклянные флаконы в атмосфере азота. Полученные указанным способом микрочастицы стерилизовали гамма-облучением в дозе 30 кГр.
Размер микрочастиц определяли методом дифракции лазерного излучения. Микрочастицы ресуспендировали в уайт-спирите с использованием ультразвука. В таблице 2 в столбце Х90 указан диаметр частиц после обработки ультразвуком в течение 120 с (90% всех частиц меньше указанной величины).
Анализ микрочастиц проводили методом ЖХВР после растворения микрочастиц в смеси ацетонитрила и метанола 3:2 с использованием ультразвука и дальнейшего разбавления 1:1 Na-ацетатным буферным раствором (рН 4). Раствор отделяли от остаточных твердых частиц с помощью центрифугирования.
|
А: СМГК 65:35 эфир, 0,6 дл/г (%)
В: СМГК 75:25 кислота, 0,2 дл/г (%)
С: СМГК 75:25 эфир, 0,4 дл/г (%)
D: СМГК 85:15 эфир, 0,6 дл/г (%)
Пример 2
Композиции носителей А-G
КМЦ-Na, маннит и плюроник F68 в количестве, указанном в таблице 3, растворяли в 15 мл горячей деионизованной воды при температуре приблизительно 90°С при интенсивном перемешивании на магнитной мешалке. Полученный прозрачный раствор охлаждали до температуры 20°С и разбавляли деионизированной водой до объема 20,0 мл.
|
Пример 3
Получение суспензии микрочастиц
180 мг микрочастиц, полученных в примерах 1-1, 1-2 или 1-3, суспендировали в 1,0 мл композиции носителя D (таблица 3) в 6 флаконах типа R. Суспензии гомогенизировали при встряхивании вручную в течение приблизительно 30 с. Ресуспендированную суспензию можно вводить без затруднений с использованием иглы 20 калибра.
Пример 4
Лиофилизация микрочастиц
180 мг микрочастиц, полученных в примерах 1-1, 1-2 или 1-3, ресуспендировали в 1 мл композиции носителя F (таблица 3), гомогенизировали при перемешивании в течение от 1 до 12 ч и затем высушивали в установке для лиофилизации. После ресуспендирования лиофилизированных микрочастиц в 1 мл чистой воды (вода для инъекций) происходит быстрое и эффективное смачивание микрочастиц, которые можно вводить без затруднений с использованием иглы 20 калибра.
Пример 5
Профиль высвобождения in vivo (кролики)
Микрочастицы, содержащие октреотид, суспендировали в 1 мл пригодного водного носителя и полученную суспензию вводили внутримышечно (в/м) самцам новозеландских белых кроликов в дозе 12 мг/кг. Для каждой лекарственной формы (исследуемая группа) использовали 4 животных. Через определенные интервалы времени (указаны в таблице 4) отбирали образцы плазмы и определяли концентрацию октреотида методом радиоиммунного анализа (РИА).
|