Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 6-АРИЛ-4-АМИНОПИКОЛИНАТОВ
Вид РИД
Изобретение
Данная заявка заявляет приоритет предварительной заявки на патент Соединенных Штатов с регистрационным номером 61/184874, зарегистрированной 8 июня 2009 г. Настоящее изобретение относится к способу получения 6-(арил)-4-аминопиколинатов. Более конкретно, настоящее изобретение относится к способу получения 6-(арил)-4-аминопиколинатов из соответствующих 3-галоген-6-(арил)-4-иминотетрагидропиколинатов.
В патентах США 6784137(В2) и 7314849((В2) описаны некоторые 6-(арил)-4-аминопиколинатные соединения и их применение в качестве гербицидов. В обоих этих патентах описано получение 6-(арил)-4-аминопиколинатов из пиколинов, имеющих либо легко удаляемую группу, либо металлсодержащую группу в 6-положении кольца пиколина. Может быть благоприятным получение 6-(арил)-4-аминопиколинатов эффективно и с высоким выходом из непиридинового источника.
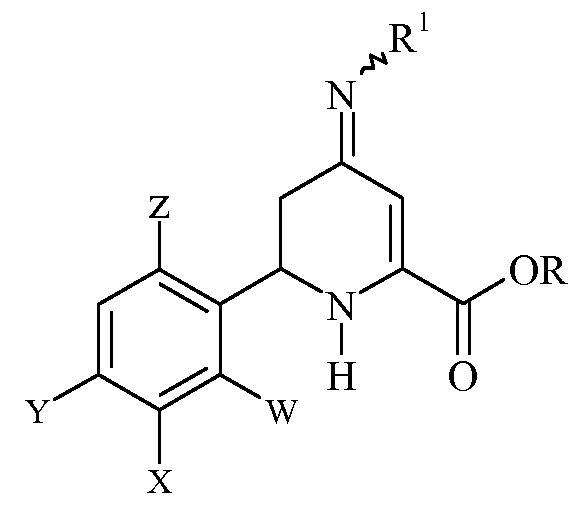
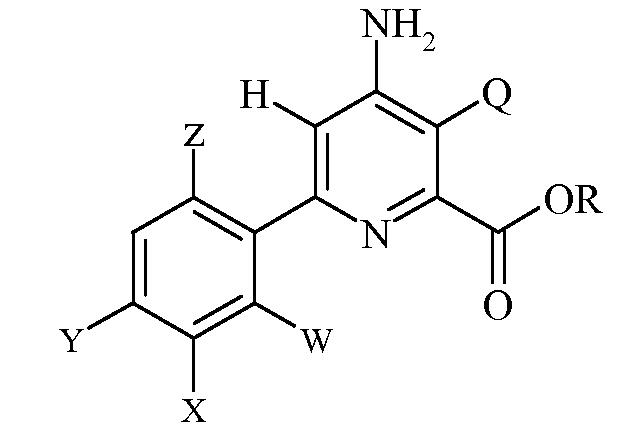
Настоящее изобретение относится к способу получения 6-(арил)-4-аминопиколинатов из соответствующих 3-галоген-6-(арил)-4-иминотетрагидропиколинатов. Более конкретно, настоящее изобретение относится к способу получения 6-(арил)-4-аминопиколината формулы
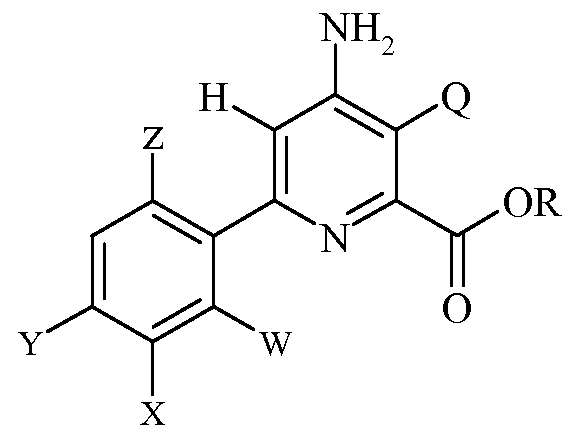
где
Q представляет собой Cl или Br;
R представляет собой С1-С4алкил;
W представляет собой H, F или Cl;
X представляет собой H, F, Cl или С1-С4алкокси;
Y представляет собой галоген;
Z представляет собой H или F;
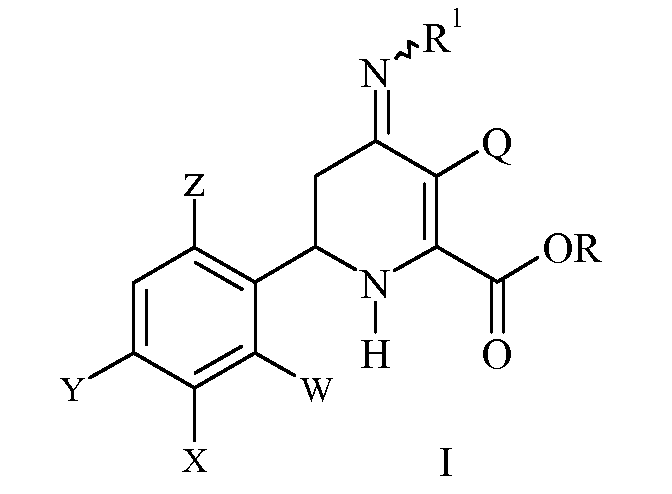
включающему нагревание эфира 3-галоген-6-(арил)-4-иминотетрагидропиколиновой кислоты формулы (I)
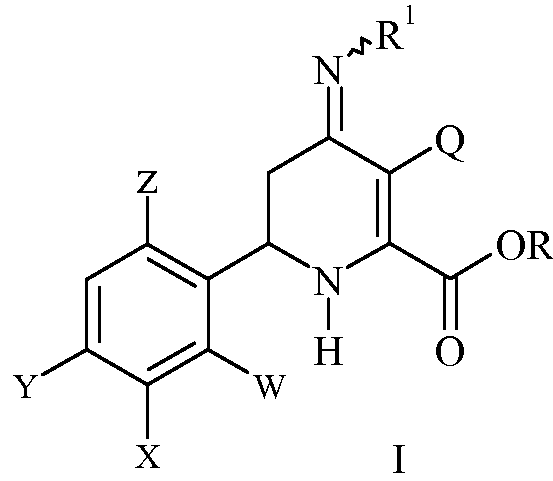
где
R представляет собой С1-С4алкил;
R1 представляет собой OS(O)2R2, -OC(O)R2 или -OC(O)OR2;
R2 представляет собой С1-С4алкил или незамещенный или замещенный фенил;
Q представляет собой Cl или Br;
W представляет собой H, F или Cl;
X представляет собой H, F, Cl или С1-С4алкокси;
Y представляет собой галоген;
Z представляет собой H или F;
при температуре от 25°С до 150°С в присутствии полярного растворителя и выделение продукта.
Термин “алкил”, а также термины его производных, такие как “алкановый”, применяемые в контексте, включают в свой диапазон части с неразветвленной цепью, части с разветвленной цепью и циклические части.
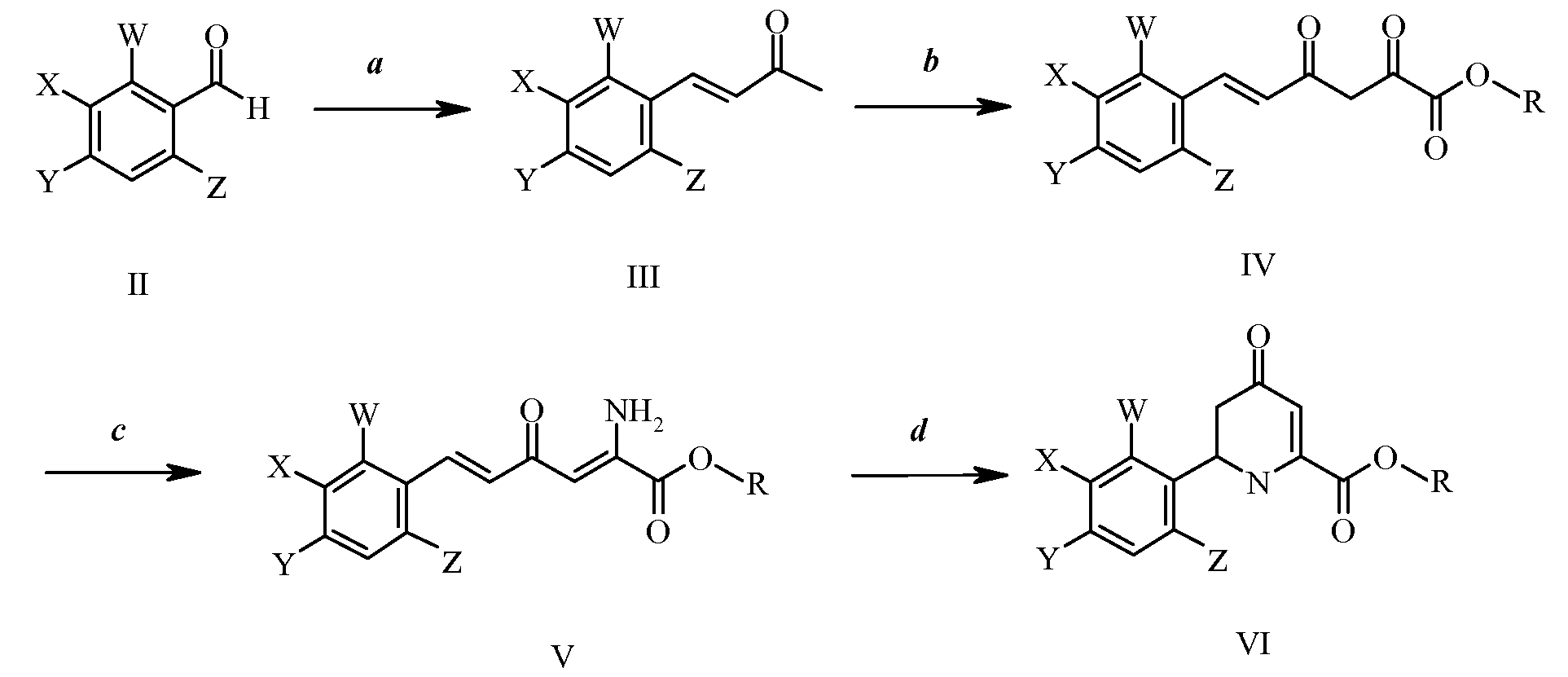
Исходные соединения, 3-галоген-6-(арил)-4-иминотетрагидропиколинаты, можно получить рядом способов. На стадии а схемы I ароматический альдегид формулы II, в которой W, X, Y и Z имеют значения, указанные ранее, можно конденсировать с кетоном, таким как ацетон, в присутствии основания, такого как гидроксид натрия, получая при этом α,β-ненасыщенный кетон формулы III. Эти соединения можно затем подвергнуть реакции с основанием, таким как этоксид натрия, в присутствии диалкилоксалата для получения сложного β-дикетоэфира формулы IV, как в стадии b, в которой R представляет собой С1-С4алкил, как, например, в патенте США 4304728. На стадии с схемы I реакция источника амина, такого как ацетат аммония, с соединениями формулы IV приводит к образованию енамина формулы V. Для реакции требуется отношение сложного β-дикетоэфира формулы IV к источнику амина приблизительно 1:2. Реакцию проводят при температурах от 25°С до 80°С. Обычно предпочтительными являются температуры от 60°С до 80°С. Реакцию предпочтительно проводят в полярном протонном растворителе. Предпочтительные растворители включают в себя спирты. Наиболее предпочтительным растворителем являются либо метиловый спирт, либо этиловый спирт. Наконец, на стадии d схемы I 4-оксотетрагидропиколинаты формулы VI получают посредством нагревания соединений формулы V при высоких температурах в автоклаве. Реакцию проводят при температурах от 125°С до 200°С. Обычно предпочтительными являются температуры от 150°С до 200°С. Реакцию предпочтительно проводят в полярном апротонном растворителе. Предпочтительные растворители включают в себя простые эфиры, такие как 1,4-диоксан.
Схема I
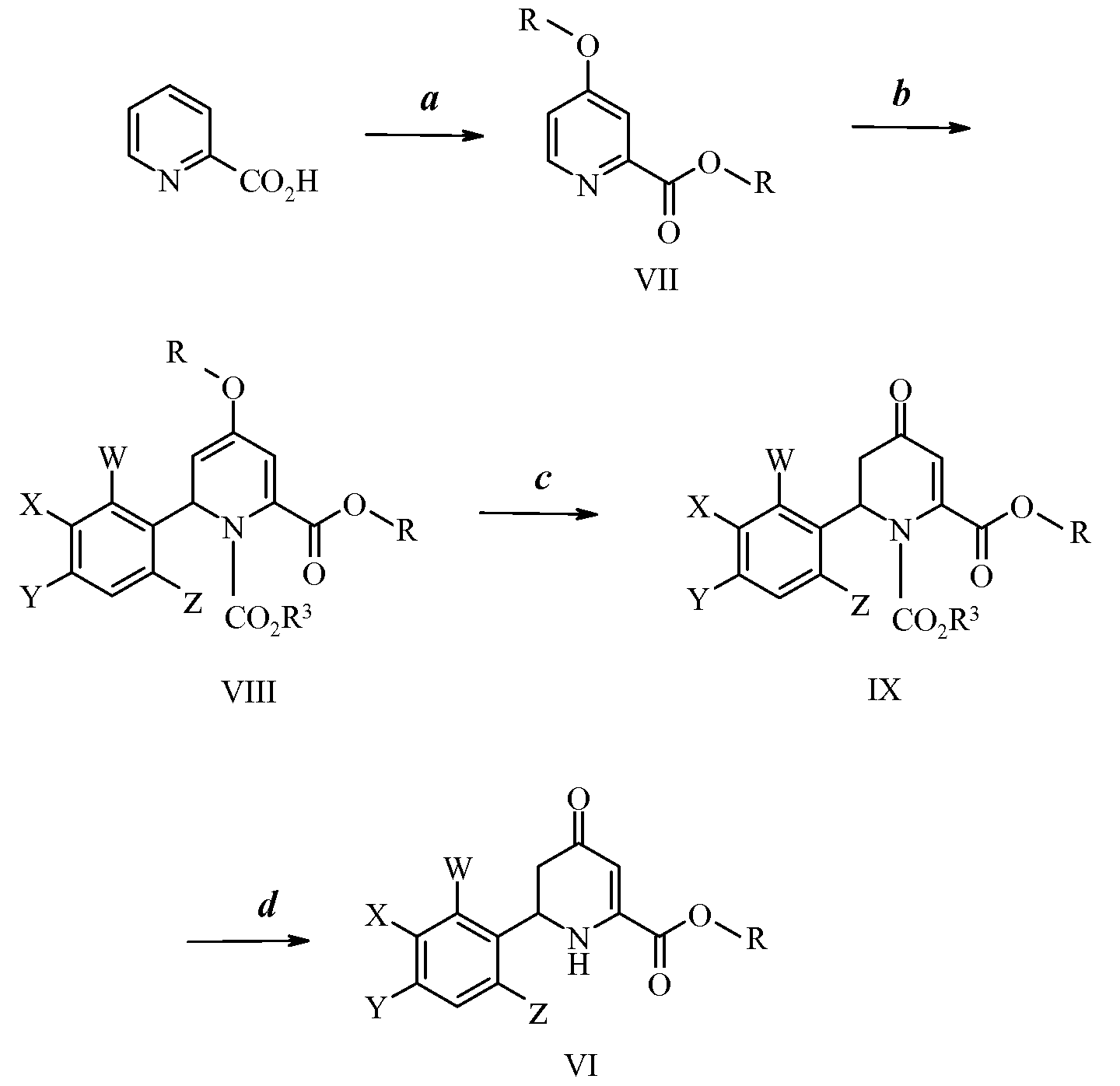
Другой путь получения 4-оксотетрагидропиколинатов формулы VI можно увидеть на схеме II. На стадии а схемы II 2-пиколиновую кислоту обрабатывают тионилхлоридом и спиртом, таким как метиловый спирт, получая при этом эфир 4-алкокси-2-пиколиновой кислоты формулы VII, в которой R имеет значение, указанное выше. Обработка соединений формулы VII хлорформиатом с последующим добавлением in situ галогенида арилцинка, где W, X, Y и Z имеют значения, указанные ранее, к образовавшейся смеси дает дигидропиколинат формулы VIII, как показано на стадии b, в которой R3 представляет собой фенил. В первой части этого протокола проводимых в одном реакторе двух стадий требуется небольшой избыток хлорформиата относительно соединения формулы VII. Реакцию проводят при температуре от -5°С до 20°С. Обычно предпочтительными являются температуры от -5°С до 10°С. Реакцию предпочтительно проводят в полярном апротонном растворителе. Предпочтительные растворители включают в себя простые эфиры. Наиболее предпочтительным растворителем является либо тетрагидрофуран (ТГФ), либо диэтиловый простой эфир. Во второй части этой стадии требуется небольшой избыток галогенида арилцинка относительно соединения формулы VII, и реакцию проводят при температуре от -5°С до 30°С. Обычно предпочтительными являются температуры от 20°С до 30°С. На стадии с схемы II кислотный гидролиз соединений формулы VIII в полярном апротонном растворителе, таком как ТГФ, дает 4-оксотетрагидропиколинат формулы IX, защищенный в виде карбамата. В реакции требуется избыток кислоты относительно соединения формулы VIII. Реакцию проводят при температурах от -5°С до 30°С. Особенно предпочтительными являются температуры от 20°С до 30°С. Реакцию предпочтительно проводят в полярных смесях растворителей. Предпочтительные растворители включают в себя смеси простой эфир-вода, такие как ТГФ-вода. И, наконец, на стадии d схемы II обработка соединений формулы IX основанием, таким как метоксид натрия, с последующей водной обработкой дает 4-оксотетрагидропиколинат формулы VI. В реакции требуется небольшой избыток основания относительно соединения формулы IX. Реакцию проводят при температурах от -5°С до 20°С. Обычно предпочтительными являются температуры от -5°С до 10°С. Реакцию предпочтительно проводят в полярном протонном растворителе. Предпочтительные растворители включают в себя спирты, такие как метиловый спирт.
Схема II
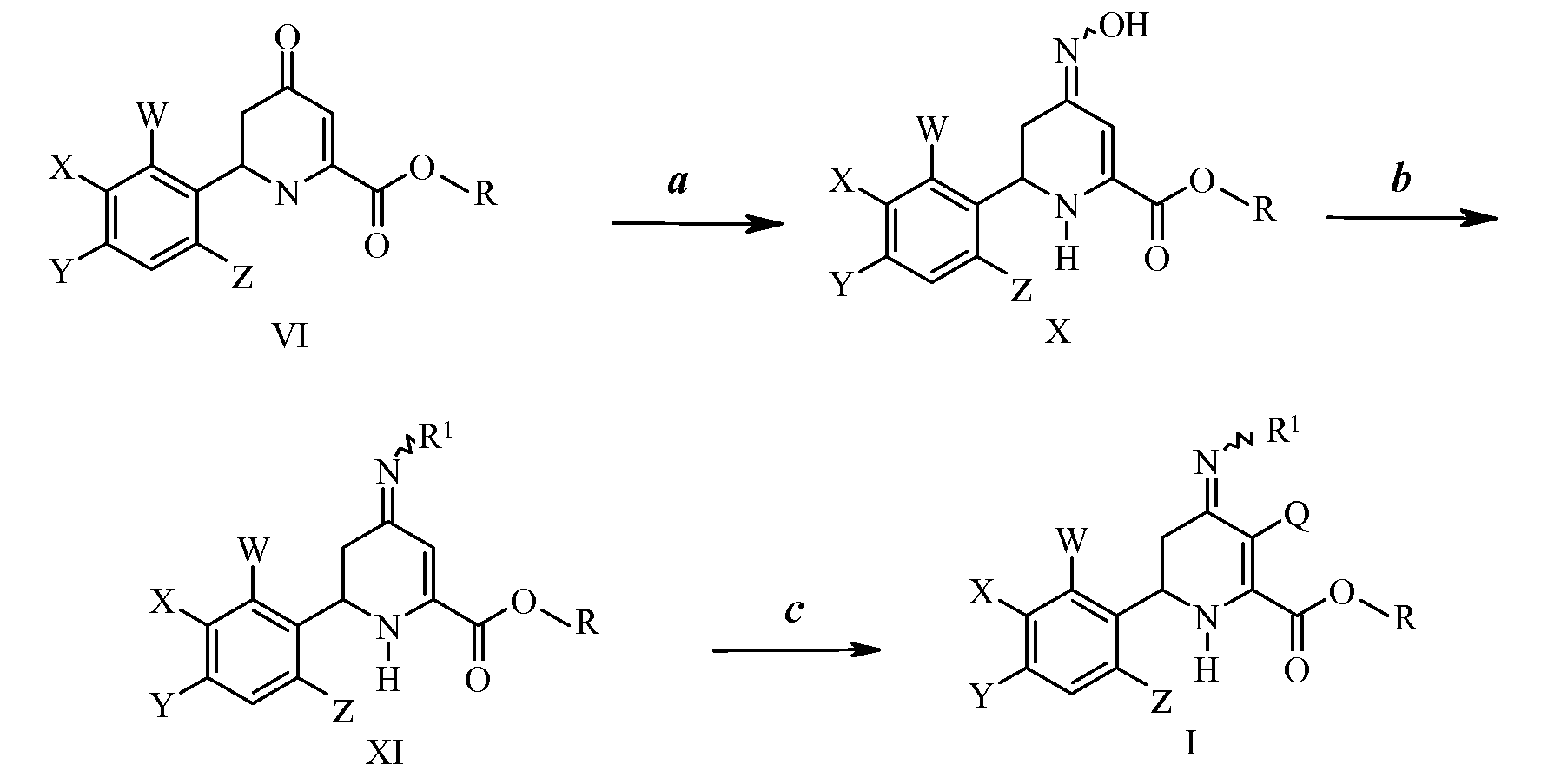
Соединения формулы VI, у которых W, X, Y, Z и R имеют значения, указанные ранее, можно превратить в соответствующие оксимы формулы Х реакцией с гидроксиламином или гидрохлоридом гидроксиламина в присутствии основания, такого как пиридин, и в растворителе, таком как толуол или метанол, как на стадии а схемы III. Для реакции требуется избыток гидроксиламина относительно соединения формулы VI. Реакцию проводят при температурах от 25°С до 80°С. Обычно предпочтительными являются температуры от 60°С до 80°С. Реакцию предпочтительно проводят в полярном протонном растворителе. Предпочтительные растворители включают в себя спирты. Наиболее предпочтительным растворителем является либо метиловый спирт, либо этиловый спирт. На стадии b схемы III оксимы формулы Х можно обработать сульфонилхлоридом, ацилхлоридом, алкилхлорформиатом или арилхлорформиатом в присутствии основания, с получением при этом соответствующих сульфонилированных, ацилированных или карбонатсодержащих оксимов формулы XI, в которой R1 представляет собой -OS(O)2R2, -OC(O)R2 и -OC(O)OR2, R2 представляет собой С1-С4алкил или незамещенный или замещенный фенил, R имеет значения, указанные ранее. Для реакции требуется отношение сульфонилирующего, ацилирующего или карбонилирующего реагента к соединению формулы Х почти 2:1. Требуется по меньшей мере один эквивалент третичного аминового основания, причем предпочтительными являются количества между 1 и 2 эквивалентами. Реакцию проводят при температурах от -5°С до 30°С. Обычно предпочтительными являются температуры от -5°С до 20°С. Предпочтительные растворители включают в себя инертные растворители, такие как хлорированные углеводороды. Реакция замещенных оксимов формулы XI с хлорирующим агентом, таким как сульфурилхлорид, или бромирующим агентом, таким как бром или N-бромсукцинимид, дает 3-галоген-6-(арил)-4-иминотетрагидропиколинаты формулы I, в которой Q имеет значения, указанные ранее, как показано на стадии с схемы III. Для реакции требуется приблизительно эквимолярные количества хлорирующего или бромирующего агента и соединения формулы XI. Реакцию проводят при температурах от -5°С до 30°С. Обычно предпочтительными являются температуры от -5°С до 20°С. Предпочтительные растворители включают в себя инертные растворители, такие как дихлорметан. Альтернативно получение соединений формулы I можно выполнить обработкой соединений формулы VI в другом порядке - стадии с, а и затем b.
Схема III
Исходные соединения, 3-галоген-6-(арил)-4-иминотетрагидропиколинаты, полученные любым из этих способов, можно выделить общепринятым способом.
6-(Арил)-4-аминопиколинатные гербициды формулы
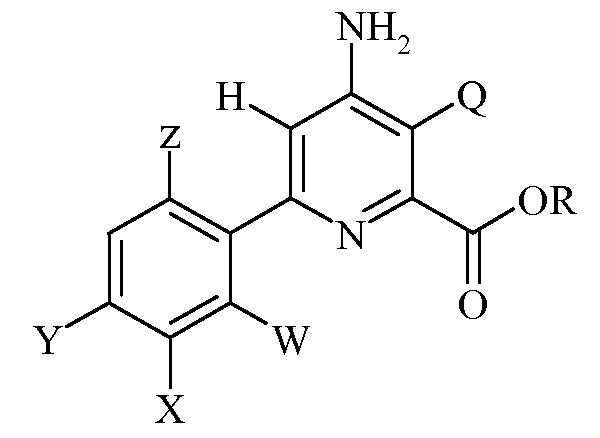
преимущественно получают нагреванием 3-галоген-6-(арил)-4-иминотетрагидропиколинатов формулы
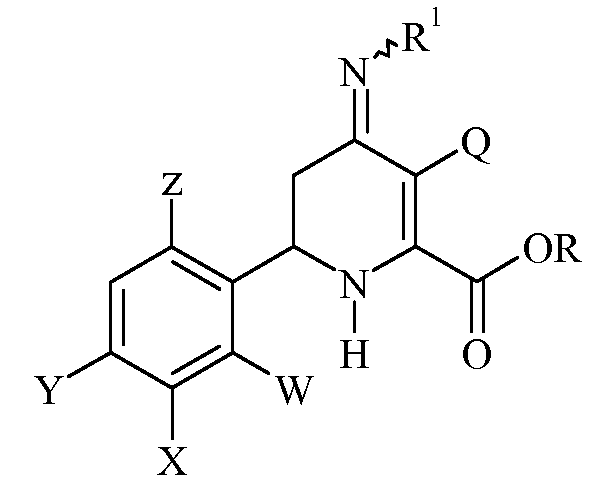
в присутствии полярного растворителя. Полярный растворитель предпочтительно применяют в большом молярном избытке. Полярным растворителем может быть либо полярный протонный растворитель, либо полярный апротонный растворитель. Полярные протонные растворители включают в себя алкановые кислоты, причем С1-С4алкановая кислота является предпочтительной и ледяная уксусная кислота является наиболее предпочтительной. Полярные апротонные растворители включают в себя амиды, подобные N,N-диметилформамиду, N,N-диметилацетамиду или N-метил-2-пирролидинону, и сульфоксиды, подобные диметилсульфоксиду. С полярным растворителем можно необязательно применять сорастворитель. Сорастворитель должен быть смешиваемым с полярным растворителем и исходным соединением, 3-галоген-6-(арил)-4-иминотетрагидропиколинатом.
Превращение 3-галоген-6-(арил)-4-иминотетрагидропиколината в 6-(арил)-4-аминопиколинат проводят при температуре от 25°С до 150°С. Предпочтительный температурный диапазон составляет от 25°С до 90°С.
Часто подходящим является получение эфира 3-галоген-6-(арил)-4-иминотетрагидропиколиновой кислоты хлорированием или бромированием сульфонилированного, ацилированного или карбонатсодержащего оксима формулы
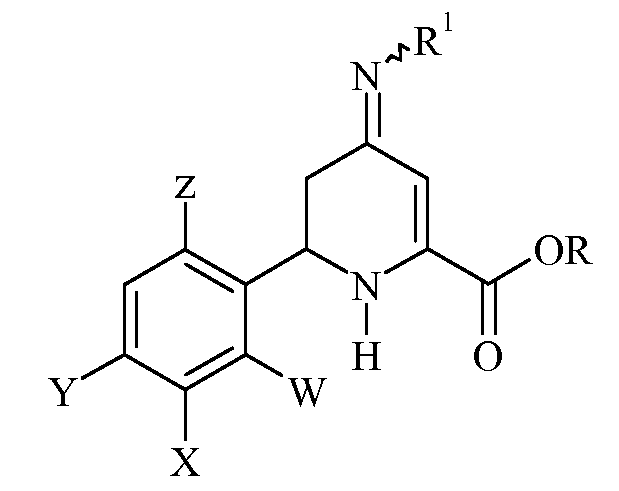
в которой W, X, Y, Z, R, R1 и R2 имеют значения, указанные выше, хлорирующим или бромирующим агентом. Типичные хлорирующие и бромирующие агенты включают в себя хлор, сульфурилхлорид, N-хлорсукцинимид, бром, сульфурилбромид и N-бромсукцинимид. Для реакции требуются приблизительно эквимолярные количества хлорирующего или бромирующего агента. Реакцию обычно проводят при температуре от -5°С до 30°С. Обычно предпочтительными являются температуры от -5°С до 20°С. Предпочтительные растворители включают в себя инертные растворители, такие как дихлорметан.
Продукты, полученные любым из этих способов, можно выделить общепринятым способом, таким как выпаривание или экстракция, и можно очистить стандартными процедурами, такими как перекристаллизация или хроматография.
Следующие примеры представлены для иллюстрации изобретения.
ПРИМЕРЫ
Пример 1
Получение (Е)-4-(4-хлор-2-фторфенил)-бут-3-ен-2-она (1)
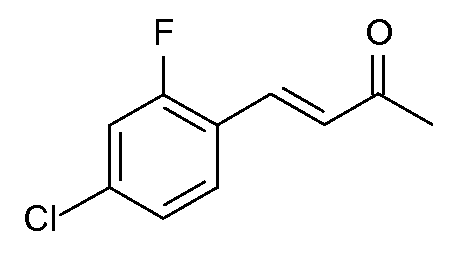
К перемешиваемому механической мешалкой раствору 4-хлор-2-фторбензальдегида (23,8 граммов (г), 0,15 моля (моль)) в ацетоне (100 миллилитров (мл)) при комнатной температуре добавляли на протяжении 20 минут (мин) раствор гидроксида натрия (NaOH, 6,6 г, 0,165 моль) в воде (Н2О, 400 мл). После перемешивания реакционной смеси на протяжении ночи добавляли дихлорметан (CH2Cl2, 100 мл). Водный слой отделяли и экстрагировали CH2Cl2 (100 мл) и объединенные органические экстракты промывали насыщенным раствором соли и сушили над сульфатом магния (MgSO4). Удаление растворителя с последующей дистилляцией Kugelrohr давало 4-(4-хлор-2-фторфенил)-3-бутен-2-он (1; 22,5 г, 76%) в виде бесцветной жидкости, которая отверждалась при стоянии: т.кип. 70-80°С, 0,1 мм Hg (13,33 Паскаля (Па)); 1Н ЯМР (400 МГц, CDCl3) δ 7,59 (д, J=16,5 Гц, 1H), 7,50 (т, J=8,1 Гц, 1H), 7,22-7,12 (м, 2H), 6,76 (д, J=16,5 Гц, 1H), 2,39 (c, 3H); HRMS (масс-спектр высокого разрешения)-ESI (m/z): вычисл. для C10H8ClFO 198,024; найдено 198,025.
(Е)-4-(4-Хлор-2-фтор-3-метоксифенил)-бут-3-ен-2-он (2)
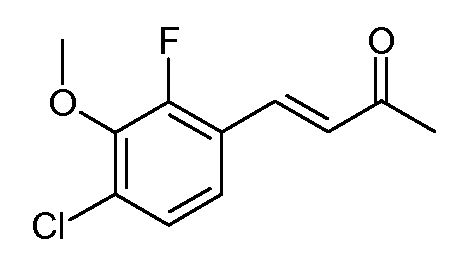
С применением процедуры примера 1 подвергали реакции смесь 4-хлор-2-фтор-3-метоксибензальдегида (200 г, 1,6 моль), NaOH (46,6 г, 1,16 моль) и ацетона (1 л), получая при этом (Е)-4-(4-хлор-2-фтор-3-метоксифенил)-3-бутен-2-он (2; 180 г, 74%, чистота 93% по данным ВЭЖХ) в виде бледно-коричневого твердого вещества; 1H ЯМР (400 МГц, CDCl3) δ 7,59 (д, J=16,5 Гц, 1H), 7,50 (т, J=8,1 Гц, 1H), 7,26-7,07 (м, 2H), 6,76 (д, J=16,5 Гц, 1H), 2,39 (c, 3H); HRMS-ESI (m/z): вычисл. для C11H10ClFO2 228,035; найдено 228,036.
Пример 2
Получение этилового эфира (Е)-6-(4-хлор-2-фторфенил)-2,4-диоксогекс-5-еновой кислоты (3)
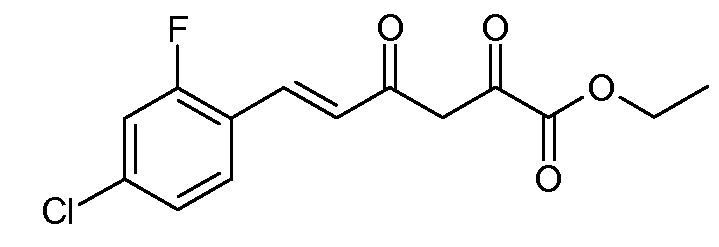
Гранулы натрия (2,88 г, 0,125 моль) медленно добавляли к абсолютному этиловому спирту (EtOH, 125 мл). После того как натрий прореагировал, растворитель удаляли при пониженном давлении и добавляли безводный простой эфир (200 мл). Реакционную смесь охлаждали до -5°С и на протяжении 30 мин добавляли раствор (Е)-4-(4-хлор-2-фторфенил)-бут-3-ен-2-она (1; 24,75 г, 0,125 моль) и диэтилоксалата (21,9 г, 0,15 моль) в безводном простом эфире (25 мл). После перемешивания в течение 2 дней (д) при комнатной температуре твердое вещество желтого цвета отделяли фильтрованием и промывали простым эфиром. После одного часа (ч) сушки при комнатной температуре твердое вещество распределяли между CH2Cl2 (200 мл) и 1н серной кислотой (H2SO4, 150 мл). Органический слой сушили (MgSO4) и растворитель удаляли, получая при этом этиловый эфир (Е)-6-(4-хлор-2-фторфенил)-2,4-диоксогекс-5-еновой кислоты (3; 32,3 г, 86%) в виде твердого вещества желтого цвета. Небольшое количество образца перекристаллизовывали из EtOH, получая при этом кристаллы желтого цвета: т.пл. 84-85°С; 1H ЯМР (400 МГц, CDCl3) δ 14,72 (c, 1H), 7,76 (д, J=16,1 Гц, 1H), 7,49 (д, J=8,3 Гц, 1H), 7,24-7,12 (м, 2H), 6,73 (д, J=16,1 Гц, 1H), 6,53 (c, 1H), 4,38 (кв, J=7,1 Гц, 2H), 1,40 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C14H12ClFO4 298,041; найдено 298,041.
Этиловый эфир (Е)-6-(4-хлорфенил)-2,4-диоксогекс-5-еновой кислоты (4)
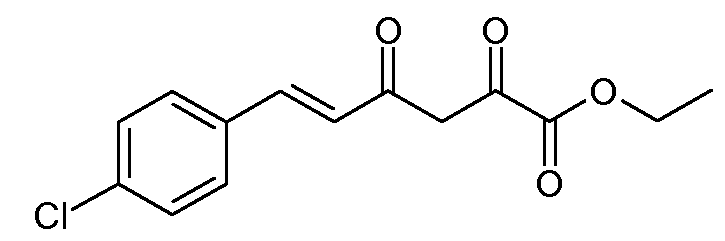
С применением процедуры примера 2 подвергают реакции смесь гранул натрия (6,33 г, 0,275 моль), (Е)-4-(4-хлорфенил)-бут-3-ен-2-она (45,16 г, 0,25 моль) и диэтилоксалата (43,8 г, 0,30 моль), получая при этом этиловый эфир (Е)-6-(4-хлорфенил)-2,4-диоксогекс-5-еновой кислоты (4; 61,1 г, 87%) в виде кристаллов желтого цвета: т.пл. 117-118°С; 1H ЯМР (400 МГц, CDCl3) δ 14,80 (c, 1H), 7,68 (д, J=15,9 Гц, 1H), 7,53-7,35 (м, 4H), 6,62 (д, J=15,9 Гц, 1H), 6,53 (c, 1H), 4,38 (кв, J=7,2 Гц, 2H), 1,40 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C14H13ClO4 280,050; найдено 280,050.
Этиловый эфир (E)-6-(4-хлор-2-фтор-3-метоксифенил)-2,4-диоксогекс-5-еновой кислоты (5)
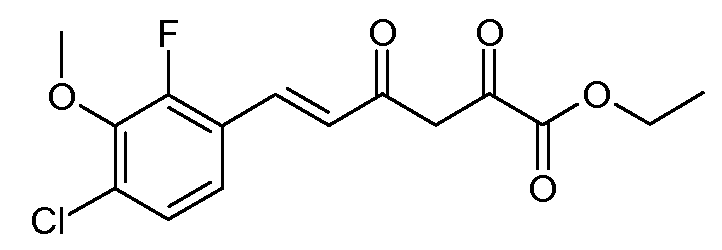
С применением процедуры примера 2 подвергают реакции смесь гранул натрия (5,52 г, 0,24 моль), (Е)-4-(4-хлор-2-фтор-3-метоксифенил)-бут-3-ен-2-она (2; 45,73 г, 0,20 моль) и диэтилоксалата (36,54 г, 0,25 моль), получая при этом этиловый эфир (Е)-6-(4-хлор-2-фтор-3-метоксифенил)-2,4-диоксогекс-5-еновой кислоты (5; 61,1 г, 93%) в виде кристаллов желтого цвета: т.пл. 67,5-69°С; 1H ЯМР (400 МГц, CDCl3) δ 14,71 (c, 1H), 7,78 (д, J=16,1 Гц, 1H), 7,27-7,18 (м, 2H), 6,73 (д, J=16,1 Гц, 1H), 6,54 (c, 1H), 4,38 (кв,J=7,1 Гц, 2H), 3,99 (д, J=1,2 Гц, 3H), 1,41 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C15H14ClFNO5 328,051; найдено 328,051.
Пример 3
Получение метилового эфира (Е)-6-(4-хлорфенил)-2,4-диоксогекс-5-еновой кислоты (6)
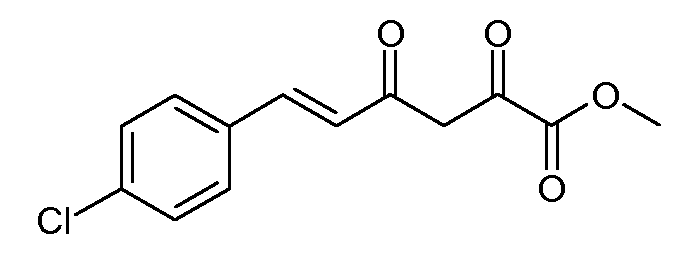
Раствор этилового эфира (Е)-6-(4-хлорфенил)-2,4-диоксогекс-5-еновой кислоты (4; 33,39 г, 0,12 моль) и концентрированной H2SO4 (0,5 мл) перемешивали при кипячении с обратным холодильником в течение 6 час в метиловом спирте (МеОН, 400 мл). После охлаждения и концентрирования раствора метиловый эфир (Е)-6-(4-хлорфенил)-2,4-диоксогекс-5-еновой кислоты (6; 22,7 г, 71%) собирали в виде желтых кристаллов: т.пл. 135-136°С; 1H ЯМР (400 МГц, CDCl3) δ 14,74 (c, 1H), 7,67 (д, J=15,9 Гц, 1H), 7,49 (д, J=8,5 Гц, 2H), 7,38 (д, J=8,5 Гц, 2H), 6,61 (д, J=15,9 Гц, 1H), 6,53 (c, 1H), 3,92 (c, 3H); HRMS-ESI (m/z): вычисл. для C13H11ClO4 266,034; найдено 266,034.
Пример 4
Получение этилового эфира (2Z,5Е)-2-амино-6-(4-хлор-2-фторфенил)-4-оксогекса-2,5-диеновой кислоты (7)
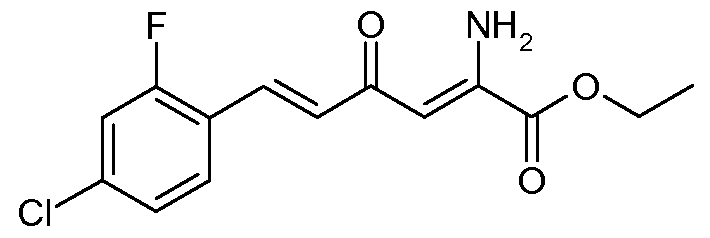
Смесь этилового эфира (Е)-6-(4-хлор-2-фторфенил)-2,4-диоксогекс-5-еновой кислоты (3; 15,0 г, 0,05 моль) и ацетата аммония (7,7 г, 0,1 моль) в EtOH (100 мл) перемешивали и нагревали для кипячения с обратным холодильником в течение 1 час. Растворитель удаляли при пониженном давлении и остаток растворяли в CH2Cl2 (200 мл) и промывали насыщенным водным карбонатом натрия (Na2CO3, 100 мл). После сушки над MgSO4 добавляли силикагель (50 г) и растворитель удаляли. Остаток промывали 20% раствором этилацетат (EtOAc)/гексаны (300 мл), получая при этом после удаления растворителя этиловый эфир (2Z,5Е)-2-амино-6-(4-хлор-2-фторфенил)-4-оксогекса-2,5-диеновой кислоты (7; 6,1 г, 41%) в виде бледно-оранжевого твердого вещества: т.пл. 102-103°С; 1H ЯМР (400 МГц, CDCl3) δ 9,4 (ушир.с, 1H), 7,62 (д, J=15,9 Гц, 1H), 7,52 (т, J=8,5 Гц, 1H), 7,49 (д, J=8,3 Гц, 1H), 7,19-7,08 (м, 2H), 6,87 (д, J=15,9 Гц, 1H), 6,14 (c, 1H), 6,05 (ушир.с, 1H), 4,37 (кв, J=7,1 Гц, 2H), 1,39 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C14H13ClFNO3 297,056; найдено 297,056. Дальнейшее промывание силикагеля 40% раствором EtOAc/гексаны (400 мл) давало дополнительный этиловый эфир (2Z,5Е)-2-амино-6-(4-хлор-2-фторфенил)-4-оксогекса-2,5-диеновой кислоты (7; 8,8 г с чистотой 70% по данным 1Н ЯМР) с общим выходом 12,2 г (82%).
Этиловый эфир (2Z,5E)-2-амино-6-(4-хлорфенил)-4-оксогекса-2,5-диеновой кислоты (8)
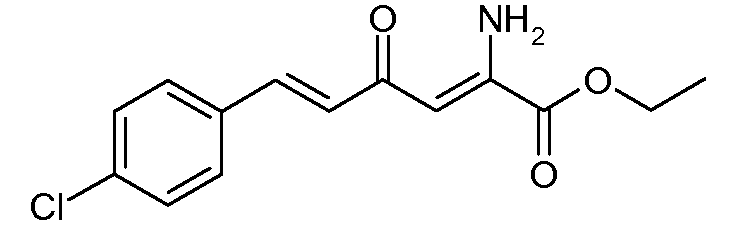
С применением процедуры примера 4 этиловый эфир (Е)-6-(4-хлорфенил)-2,4-диоксогекс-5-еновой кислоты (4; 79,5 г, 0,284 моль) и ацетат аммония (43,78 г, 0,568 моль) подвергали реакции в EtOH (795 мл), получая при этом этиловый эфир (2Z,5E)-2-амино-6-(4-хлорфенил)-4-оксогекса-2,5-диеновой кислоты (8; 47 г, 86%) в виде твердого вещества желтого цвета: т.пл. 105-107°С; 1H ЯМР (400 МГц, CDCl3) δ 9,40 (ушир.с, 1H), 7,52 (д, J=15,9 Гц, 1H), 7,50-7,47 (м, 2H), 7,38-7,32 (м, 2H), 6,78 (д, J=15,9 Гц, 1H), 6,14 (c, 1H), 6,01 (c, 1H), 4,37 (кв, J=7,1 Гц, 2H), 1,39 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C14H14ClNO3 279,067; найдено 279,066.
Метиловый эфир (2Z,5E)-2-амино-6-(4-хлорфенил)-4-оксогекса-2,5-диеновой кислоты (9)
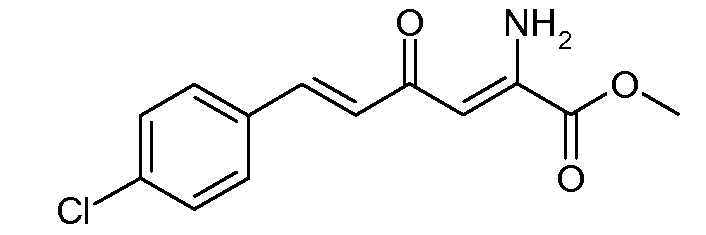
С применением процедуры примера 4 метиловый эфир (Е)-6-(4-хлорфенил)-2,4-диоксогекс-5-еновой кислоты (6; 21,3 г, 0,008 моль) и ацетат аммония (12,33 г, 0,16 моль) подвергали реакции в MeOH (150 мл), получая при этом метиловый эфир (2Z,5Е)-2-амино-6-(4-хлорфенил)-4-оксогекса-2,5-диеновой кислоты (9; 15,7 г, 74%) в виде твердого вещества желтого цвета: т.пл. 112-113°С; 1H ЯМР (400 МГц, CDCl3) δ 9,37 (ушир.с, 1H), 7,64-7,42 (м, 3H), 7,38-7,32 (м, 2H), 6,75 (д, J=15,9 Гц, 1H), 6,14 (c, 1H), 5,99 (ушир.с, 1H), 3,91 (c, 3H); HRMS-ESI (m/z): вычисл. для C13H12ClNO3 265,050; найдено 265,050.
Этиловый эфир (2Z,5E)-2-амино-6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-гекса-2,5-диеновой кислоты (10)
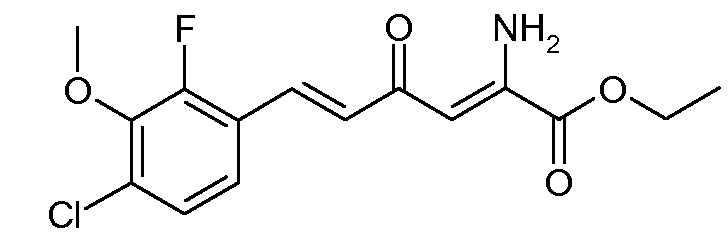
С применением процедуры примера 4 этиловый эфир (Е)-6-(4-хлор-2-фтор-3-метоксифенил)-2,4-диоксогекс-5-еновой кислоты (5; 37,8 г, 0,115 моль) и ацетат аммония (15,4 г, 0,2 моль) подвергали реакции в EtOH (200 мл), получая при этом этиловый эфир (2Z,5Е)-2-амино-6-(4-хлор-2-фтор-3-метоксифенил)-4-оксогекса-2,5-диеновой кислоты (10; 38,5 г, 92%, чистота по 1H ЯМР-спектроскопии 90%) в виде твердого вещества темно-оранжевого цвета. Обработка силикагелем (50 г) с последующим элюированием 40% раствором EtOAc/гексаны (400 мл) давала твердое вещество желтого цвета (25,3 г, 67%): т.пл. 103-104°С; 1H ЯМР (400 МГц, CDCl3) δ 9,44 (ушир.с, 1H), 7,63 (д, J =16,1 Гц, 1H), 7,23 (дд, J=8,6, 7,0 Гц, 1H), 7,16 (дд, J=8,6, 1,6 Гц, 1H), 6,87 (д, J=16,1 Гц, 1H), 6,15 (c, 1H), 6,04 (ушир.с, 1H), 4,37 (кв, J=7,1 Гц, 2H), 3,98 (д, J=1,2 Гц, 3H), 1,40 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C15H15ClFNO4 327,067; найдено 327,068.
Пример 5
Получение этилового эфира 6-(4-хлор-2-фторфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (11)
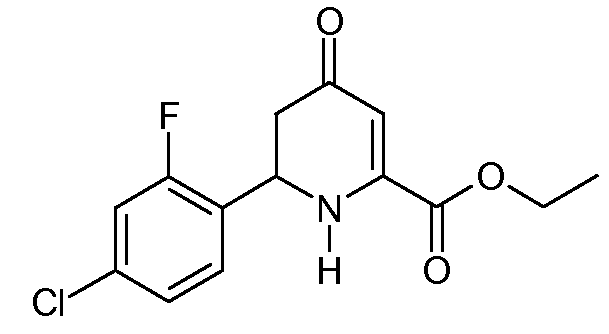
Раствор этилового эфира (2Z,5Е)-2-амино-6-(4-хлор-2-фторфенил)-4-оксогекса-2,5-диеновой кислоты (7; 5,26 г, 0,0177 моль) в безводном 1,4-диоксане (100 мл) нагревали до 185°С в 200 мл реакторе Парра под положительным давлением азота (N2). Спустя 9 час реактор охлаждали и растворитель удаляли при пониженном давлении, получая при этом темно-оранжевое масло (5,85 г). По данным 1H ЯМР-спектроскопии вещество содержало 75% требуемого этилового эфира 6-(4-хлор-2-фторфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (11) вместе с 25% нециклизованного соединения 7. Очистка на основном оксиде алюминия с применением 40% раствора EtOAc/гексаны давала твердое вещество не совсем белого цвета (1,4 г, 26%): т.пл. 107-109°С; 1H ЯМР (400 МГц, CDCl3) δ 7,40 (т, J=8,1 Гц, 1H), 7,22-7,06 (м, 2H), 5,84 (c, 1H), 5,73 (c, 1H), 5,09 (т, J=8,9 Гц, 1H), 4,35 (кв, J=7,1 Гц, 2H), 2,69 (д, J=8,9 Гц, 2H), 1,36 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C14H13ClFNO3 297,057; найдено 297,057.
С применением процедуры примера 5 реакция этилового эфира (2Z,5E)-2-амино-6-(4-хлор-2-фторфенил)-4-оксогекса-2,5-диеновой кислоты (7; 88 г, 0,296 моль) в 1,4-диоксане (880 мл) в реакторе Парра на 2 л с последующей очисткой хроматографией на силикагеле с элюированием 40% раствором EtOAc/гексаны давала этиловый эфир 6-(4-хлор-2-фторфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (11; 43 г, 49%, чистота по ВЭЖХ 96%) в виде твердого вещества рыжевато-коричневого цвета.
Этиловый эфир 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (12)
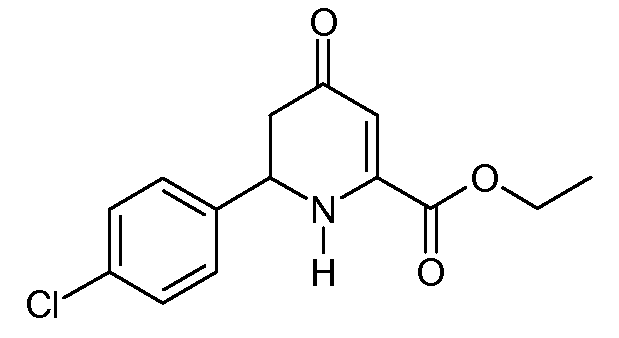
С применением процедуры примера 5 реакция этилового эфира (2Z,5Е)-2-амино-6-(4-хлорфенил)-4-оксогекса-2,5-диеновой кислоты (8; 47 г, 0,168 моль) в 1,4-диоксане (470 мл) в реакторе Парра на 2 л с последующей очисткой хроматографией на силикагеле с элюированием 40% раствором EtOAc/гексаны давала этиловый эфир 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (12; 25 г, 49%, чистота по ВЭЖХ 99%) в виде твердого вещества не совсем белого цвета: т.пл. 93-94°С; 1H ЯМР (400 МГц, CDCl3) δ 7,36 (кв, J=8,6 Гц, 4H), 5,82 (c, 1H), 5,72 (ушир.с, 1H), 4,74 (дд, J=14,2, 5,0 Гц, 1H), 4,35 (кв, J=7,1 Гц, 2H), 2,68 (дд, J=16,3, 14,2 Гц, 1H), 2,58 (дд, J=16,4, 5,0 Гц, 1H), 1,36 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C14H14ClNO3 279,067; найдено 279,066.
Метиловый эфир 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (13)
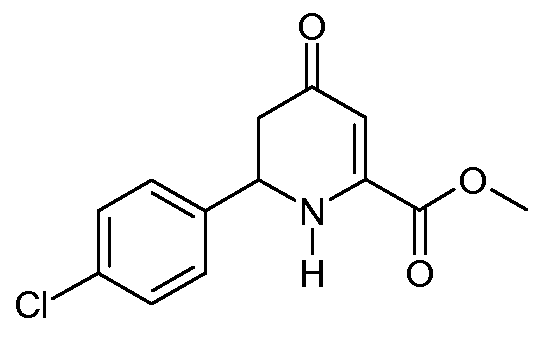
С применением процедуры примера 5 реакция метилового эфира (2Z,5Е)-2-амино-6-(4-хлорфенил)-4-оксогекса-2,5-диеновой кислоты (9; 6,64 г, 0,025 моль) в 1,4-диоксане (100 мл) в реакторе Парра на 200 мл давала после растирания со смесью простой эфир/пентан метиловый эфир 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (13; 6,12 г, 91%, чистота по ГХ 98%) в виде твердого вещества не совсем белого цвета: т.пл. 113-114°С; 1H ЯМР (400 МГц, CDCl3) δ 7,36 (кв, J=8,6 Гц, 4H), 5,82 (c, 1H), 5,72 (ушир.с, 1H), 4,74 (дд, J=14,2, 5,0 Гц, 1H), 4,74 (дд, J=14,2, 5,0 Гц, 1H), 3,90 (c, 3H), 2,68 (дд, J=16,3, 14,2 Гц, 1H), 2,58 (дд, J=16,4, 5,0 Гц, 1H); HRMS-ESI (m/z): вычисл. для C13H12ClNO3 265,050; найдено 265,051.
Этиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (14)

С применением процедуры примера 5 реакция этилового эфира (2Z,5E)-2-амино-6-(4-хлор-2-фтор-3-метоксифенил)-4-оксогекса-2,5-диеновой кислоты (10; 6,55 г, 0,02 моль) в 1,4-диоксане (100 мл) в реакторе Парра на 200 мл давала после растирания со смесью простой эфир/пентан этиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (14; 5,9 г, 90%, чистота по ГХ 98%) в виде твердого вещества не совсем белого цвета: т.пл. 116-118°С; 1H ЯМР (400 МГц, CDCl3) δ 7,22 (дд, J=8,5, 1,8 Гц, 1H), 7,09 (дд, J=8,4, 7,1 Гц, 1H), 5,93 (c, 1H), 5,90 (c, 1H), 5,21-5,08 (м, 1H), 4,37 (кв, J=7,1 Гц, 2H), 3,99 (д, J=1,3 Гц, 3H), 2,87-2,73 (м, 2H), 1,38 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C15H15ClFNO4 327,067; найдено 327,067.
Пример 6
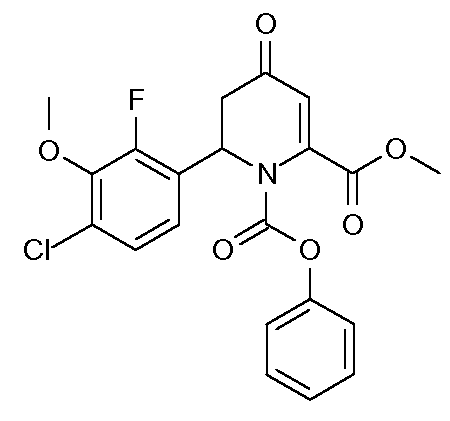
Получение 2-метилового эфира-1-фенилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-5,6-дигидро-4H-пиридин-1,2-дикарбоновой кислоты (15)
2-Хлор-6-фторанизол (24,5 г, 0,153 моль) растворяли в безводном ТГФ (150 мл) в атмосфере азота. Раствор охлаждали до -60°С и по каплям на протяжении 30 мин добавляли n-BuLi (67 мл 2,5 M раствора в гексане, 0,168 моль). Во время добавления реакционная смесь нагревалась до -48°С. Реакционную смесь перемешивали в течение 30 мин при -50°С и затем охлаждали до -60°С. К реакционной смеси добавляли безводный ZnCl2 (25 г, 0,183 моль) сначала добавлением твердого ZnCl2 и затем добавлением его раствора в безводном ТГФ. Реакционную смесь перемешивали при -45°С в течение 2,5 час до тех пор, пока не был растворен почти весь ZnCl2. Реакционному раствору давали возможность нагреться до комнатной температуры и растворитель выпаривали продуванием азота. Остаток снова растворяли в ТГФ с получением исходного раствора.
Метил-4-метоксипиколинат (11,92 г, 0,0713 моль) растворяли в безводном ТГФ (300 мл) в атмосфере N2. Раствор охлаждали на ледяной бане. Добавляли неразбавленный фенилхлорформиат (10,5 мл, 0,0837 моль). Спустя 45 мин по каплям на протяжении 1 час добавляли исходный раствор (4-хлор-2-фтор-3-метоксифенил)цинк(II)хлорида (1,19 M в ТГФ, 76,0 мл, 0,0904 моль). Раствор перемешивали при комнатной температуре в течение 3 дней (д) и затем гасили добавлением насыщенного водного раствора хлорида аммония (NH4Cl) (200 мл). Органический слой отделяли и водный слой экстрагировали простым эфиром (2×100 мл). Объединенные органические экстракты промывали Н2О и насыщенным раствором соли. Раствор сушили (MgSO4) и упаривали до получения ярко-желтой жидкости, которую растворяли в ТГФ (250 мл) и 1M HCl (250 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 дней и затем нейтрализовали насыщенным раствором NaHCO3. Реакционную смесь экстрагировали простым эфиром. Эфирные экстракты промывали Н2О с последующим промыванием насыщенным раствором соли, затем сушили (MgSO4) и упаривали до получения желтого масла. Сырой продукт очищали хроматографией на силикагеле (градиент смеси гексан-EtOAc), получая при этом желтое масло. Масло кристаллизовали из МеОН, получая при этом 2-метиловый эфир-1-фениловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-5,6-дигидро-4H-пиридин-1,2-дикарбоновой кислоты (15; 17,67 г, 57%) в виде твердого вещества белого цвета: т.пл. 112-114°С; 1H ЯМР (300 МГц, CDCl3) δ 7,40 (м, 2H), 7,27 (м, 1H), 7,14 (м, 4H), 6,22 (д, J=6,6 Гц, 1H, H6), 5,90 (д, J=1,2 Гц, 1H, H3), 3,97 (д, JF-H=0,9 Гц, 3H, OMe), 3,87 (c, 3H, CO2Me), 3,30 (дд, J=6,6, 17,4 Гц, 1H, H5a), 3,05 (д, J=18 Гц, 1H, H5b); 13C {1H} ЯМР (75,4 МГц, CDCl3) δ 191,7 (C4), 163,8 (CO2Me), 153,9 (д, JF-С=250 Гц, C2'), 151,0, 150,3, 145,0, 144,8, 129,6 (мета-Ph), 128,8 (д, JF-С=3 Гц, C4'), 126,5 (пара-Ph), 125,2 (д, JF-С=3 Гц, C5'), 124,5 (д, JF-С=12 Гц, Cl'), 121,0 (д, JF-С=4 Гц, C6'), 120,9 (орто-Ph), 114,5 (C3), 61,6 (д, JF-С=5 Гц, OMe), 53,8, 53,4, 41,6; Анал. вычисл. для C21H17ClFNO6: С, 58,14; Н, 3,95; N, 3,23. Найдено: С, 57,82; Н, 3,90; N, 3,18.
Пример 7
Получение метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (16)
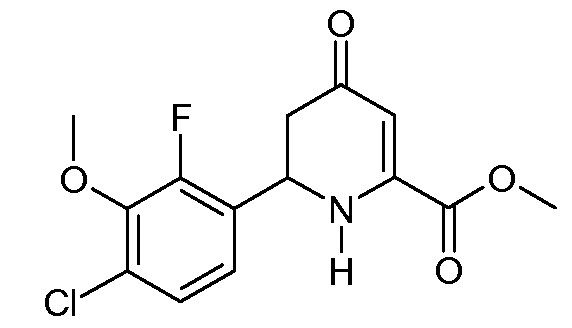
2-Метиловый эфир-1-фениловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-5,6-дигидро-4H-пиридин-1,2-дикарбоновой кислоты (15; 7,213 г, 0,0166 моль) суспендировали в MeOH (80 мл). Суспензию охлаждали на ледяной бане и добавляли твердый метоксид натрия (NaOMe; 1,08 г, 0,02 моль). Спустя 1 час реакцию гасили насыщенным водным раствором NH4Cl (80 мл) и H2O (50 мл) и затем охлаждали на льду. Осадок отделяли фильтрованием, промывали Н2О с последующим промыванием холодным MeOH и сушили на воздухе, получая при этом метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (16; 4,93 г, 94%) в виде порошка белого цвета: т.пл. 164,9-166,2°С; 1H ЯМР (300 МГц, CDCl3) δ 7,20 (дд, JF-H=1,8 Гц, JH-H=8,7 Гц, 1H, ароматический), 7,10 (дд, JF-H=6,9 Гц, JH-H=8,7 Гц, 1H, ароматический), 5,84 (д, J=0,9 Гц, 1H, H3), 5,68 (ушир.с, 1H, NH), 5,10 (т, J=9,3 Гц, 1H, H6), 3,98 (д, JF-H=1,5 Гц, 3H, OMe), 3,91 (c, 3H, CO2Me), 2,71 (д, J=9 Гц, 2H, H5); 13C{1H} ЯМР (75,4 МГц, CDCl3) δ 193,0 (C4), 163,6 (CO2Me), 153,8 (д, JF-С=251 Гц, C2'), 147,9 (C2), 144,6 (д, JF-С=13 Гц, C3'), 128,6 (д, JF-С=3 Гц, Cl'/C4'), 126,8 (д, JF-С=11 Гц, Cl'/C4'), 125,5 (д, JF-С=3 Гц, C5'), 121,5 (д, JF-С=4 Гц, C6'), 102,0 (C3), 61,6 (д, JF-С=5 Гц, OMe), 53,4, 50,8, 42,0; HRMS-ESI (m/z): вычисл. для C14H13ClFNO4 313,0512; найдено 313,0511. Анал. вычисл. для C14H13ClFNO4: С, 53,60; Н, 4,18; N, 4,46. Найдено: С, 53,30; Н, 4,14; N, 4,35.
Пример 8
Получение этилового эфира 6-(4-хлор-2-фторфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (17)
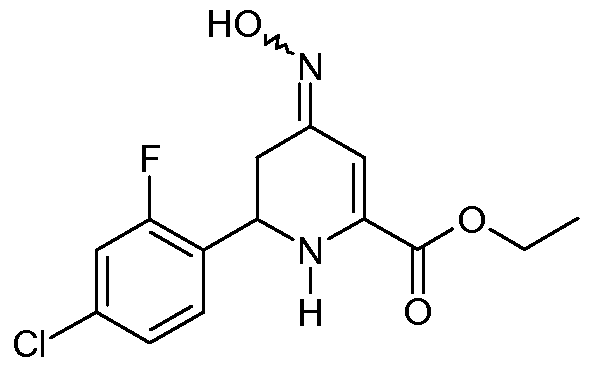
Смесь этилового эфира 6-(4-хлор-2-фторфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (11, 41 г, 0,138 моль), гидрохлорида гидроксиламина (38,3 г, 0,552 моль) и пиридина (82 мл) в EtOH (400 мл) нагревали для кипячения с обратным холодильником в течение 1 час. Реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали. Остаток растирали со смесью лед-холодная Н2О, получая при этом смесь 3:2 син- и анти-изомеров этилового эфира 6-(4-хлор-2-фторфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (17; 24 г, 56%, чистота по ВЭЖХ 98%) в виде твердого вещества рыжевато-коричневого цвета: т.пл. 124-126°С; 1H ЯМР (400 МГц, ДМСО-d6) основной изомер δ 9,3 (ушир.с, 1H), 7,40 (м, 1H), 7,27 (м, 2H), 6,76 (ушир.с, 1H), 6,21 (c, 1H), 4,80 (ушир.с, 1H), 4,42-4,13 (м, 2H), 2,69 (дд, J=14,9, 4,9 Гц, 1H), 2,62-2,45 (м, 1H), 1,30 (т, J=6,8 Гц, 3H); 1H ЯМР (400 МГц, ДМСО-d6) минорный изомер δ 9,3 (ушир.с, 1H), 7,40 (м, 1H), 7,27 (м, 2H), 6,12 (ушир.с, 1H), 5,95 (c, 1H), 4,64 (дд, J=8,4, 5,1 Гц, 1H), 4,42-4,13 (м, 2H), 2,91 (дд, J=16,5, 4,9 Гц, 1H), 2,52 (м, 1H), 1,27 (т, J=6,5 Гц, 3H); HRMS-ESI (m/z): вычисл. для C14H14ClFN2O3 312,068; найдено 312,067.
Метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18)
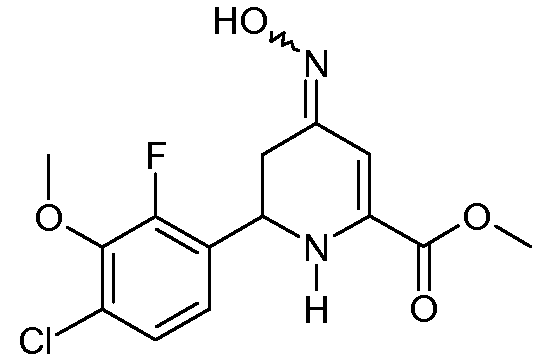
Метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (16, 5,19 г, 16,5 ммоль) перемешивали в метаноле (160 мл). Добавляли гидрохлорид гидроксиламина (3,35 г, 48,3 ммоль) с последующим добавлением пиридина (10,0 мл, 123 ммоль). Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 120 мин. Метанол выпаривали в вакууме. Добавляли H2O (200 мл) и остаток экстрагировали простым эфиром (4×150 мл). Объединенные экстракты промывали насыщенным раствором соли, сушили (MgSO4) и упаривали в вакууме, получая при этом метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18; 4,54 г, 80%) в виде твердого вещества белого цвета: т.пл. 136-138°С. Смесь 1:1 син- и анти-изомеров обнаруживали ЯМР-спектроскопией и ВЭЖХ. 1H ЯМР (400 МГц, C6D6) δ 8,34 (ушир., 1H, NOH), 8,25 (ушир. 1H, NOH), 7,00 (c, 1H, H3), 6,71 (дд, JF-H=1,5 Гц, JH-H=9 Гц, 1H, ароматический), 6,69 (дд, JF-H=1,8 Гц, JH-H=9 Гц, 1H, ароматический), 6,57 (дд, JF-H=JH-H=7,5 Гц, 1H, ароматический), 6,53 (c, 1H, H3), 6,50 (дд, JF-H=JH-H=7,5 Гц, 1H, ароматический), 4,72 (c, 1H, NH), 4,52 (c, 1H, NH), 4,38 (дд, JH-H=3,6, 10,2 Гц, 1H, H6, изомер A), 4,23 (дд, JH-H=3,9, 11,4 Гц, 1H, H6, изомер B), 3,53 (c, 6H, CO2Me), 3,24 (c, 3H, OMe), 3,23 (c, 3H, OMe), 3,30 (дд, JH-H=4,2, 16,8 Гц, 1H, H5, изомер B), 2,63 (дд, JH-H=4,2, 15,3 Гц, 1H, H5, изомер A), 2,44 (дд, JH-H=10,5, 15,3 Гц, 1H, H5, изомер A), 2,33 (дд, JH-H=11,1, 16,8 Гц, 1H, H5, изомер B); 13C{1H} ЯМР (CDCl3) δ 164,2 (CO2Me), 163,9 (CO2Me), 153,7 (д, JF-C=250 Гц, C2'), 153,6 (д, JF-C=251 Гц, C2'), 152,6 (C4), 149,6 (C4), 144,3 (д, JF-C=3 Гц, C3'), 144,1 (д, JF-C=3 Гц, C3'), 139,2, 138,3, 128,6 (д, JF-C=12 Гц), 127,9 (д, JF-C=11 Гц), 127,8 (д, JF-C=3 Гц), 127,7 (д, JF-C=3 Гц), 125,3, 121,7, 101,7 (C3), 92,6 (C3), 61,42, 61,38, 52,7, 52,6, 49,3, 48,3, 33,6 (C5), 28,7 (C5). HRMS-ESI (m/z): вычисл. для C14H14ClFN2O4 328,0621; найдено 328,0620. Анал. вычисл. для C14H14ClFN2O4: С, 51,15; Н, 4,29; N, 8,52. Найдено: С, 51,31; Н, 4,34; N, 8,40.
Пример 9
Получение этилового эфира 6-(4-хлорфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (19)
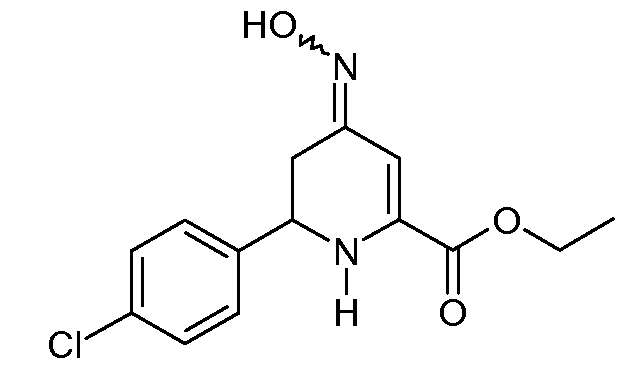
Смесь этилового эфира 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (12; 5,6 г, 0,02 моль) и 50% водного гидроксиламина (3 мл, 0,045 моль) в толуоле (100 мл) перемешивали при кипячении с обратным холодильником в течение 2 час. После удаления растворителя остаток добавляли к CH2Cl2 (100 мл), промывали насыщенным водным раствором NaCl, сушили (MgSO4) и растворитель удаляли, получая при этом оранжевое твердое вещество (5,8 г). Растирание со смесью простой эфир/пентан давало смесь 3:2 син- и анти-изомеров этилового эфира 6-(4-хлорфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (19; 4,85 г, 85%) в виде твердого вещества не совсем белого цвета: т.пл. 159-160°С; 1H ЯМР (400 МГц, CDCl3) основной изомер δ 9,3 (ушир., 1H), 7,35-7,25 (м, 4H), 6,19 (c, 1H), 4,88 (c, 1H), 4,36-4,25 (м, 3H), 3,35-3,23 (м, 1H), 2,35 (дд, J=16,8, 12,8 Гц, 1H), 1,34 (т, J=7,1 Гц, 3H); 1H ЯМР (400 МГц, CDCl3) минорный изомер δ 9,3 (ушир.с, 1H), 7,35-7,25 (м, 4H), 6,57 (c, 1H), 5,19 (c, 1H), 4,57-4,38 (м, 1H), 4,36-4,25 (м, 2H), 2,72-2,54 (м, 2H), 1,34-1,31 (м, 3H); HRMS-ESI (m/z): вычисл. для C14H15ClN2O3 294,077; найдено 294,077.
Пример 10
Получение этилового эфира 6-(4-хлор-2-фторфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (20)
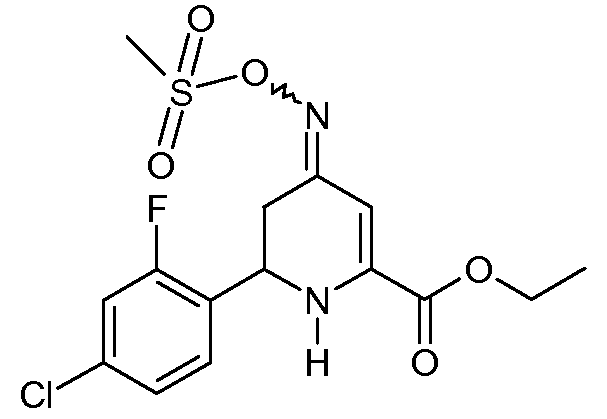
К перемешиваемому магнитной мешалкой раствору этилового эфира 6-(4-хлор-2-фторфенил)-4-гидроксимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (17; 22,0 г, 0,0705 моль) в CH2Cl2 (220 мл) добавляли триэтиламин (19,6 мл, 0,141 моль). Реакционную смесь охлаждали на ледяной бане и на протяжении 30 мин добавляли по каплям метансульфонилхлорид (8,8 мл, 0,113 моль). После нагревания до комнатной температуры на протяжении ночи реакционную смесь разбавляли CH2Cl2 (200 мл), промывали насыщенными водными растворами NaHCO3 и NaCl и сушили (Na2SO4). Удаление растворителя с последующим растиранием со смесью простой эфир/пентан давало смесь 8:1 изомеров этилового эфира 6-(4-хлор-2-фторфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (20; 10,5 г, 39%, чистота по 1Н ЯМР 95%) в виде твердого вещества не совсем белого цвета: т.пл. 114-116°С; 1H ЯМР (400 МГц, CDCl3) основной изомер δ 7,36 (т, J=8,1 Гц, 1H), 7,19 (дд, J=8,3, 1,6 Гц, 1H), 7,15 (дд, J=10,1, 1,9 Гц, 1H), 6,37 (c, 1H), 5,59 (c, 1H), 4,93 (дд, J=10,9, 4,4 Гц, 1H), 4,35 (кв, J=7,1 Гц, 2H), 3,15 (c, 3H), 2,92-2,68 (м, 2H), 1,38 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C15H16ClFN2O5S 390,0447; найдено 390,0444.
Метиловый эфир 6-(4-хлорфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (21)
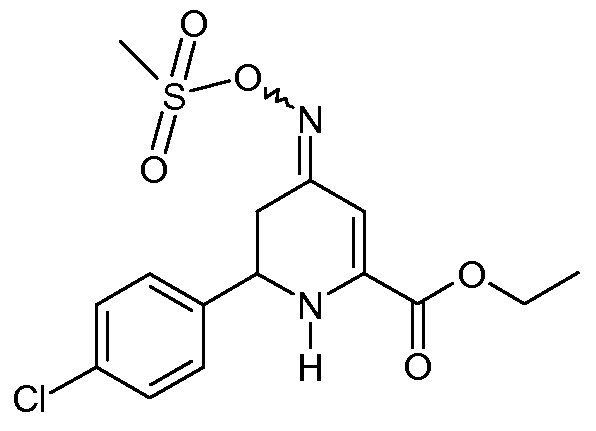
С применением процедуры примера 10 реакция смеси этилового эфира 6-(4-хлорфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (19; 13,0 г, 0,0442 моль), метансульфонилхлорида (5,5 мл, 0,0707 моль) и триэтиламина (12,3 мл, 0,0884 моль) давала смесь 8:1 изомеров этилового эфира 6-(4-хлорфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (21; 10,5 г, 86%, чистота по ВЭЖХ 97%) в виде твердого вещества не совсем белого цвета: т.пл. 113-115°С; 1H ЯМР (400 МГц, CDCl3) основной изомер δ 7,45-7,29 (м, 4H), 6,36 (c, 1H), 5,59 (c, 1H), 4,56 (дд, J=11,7, 5,3 Гц, 1H), 4,35 (кв,J=7,1, 1,3 Гц, 2H), 3,15 (c, 3H), 2,82-2,67 (м, 2H), 1,38 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C15H17ClN2O5S 372,055; найдено 372,055.
Пример 11
Получение метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-п-толуолсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (22)
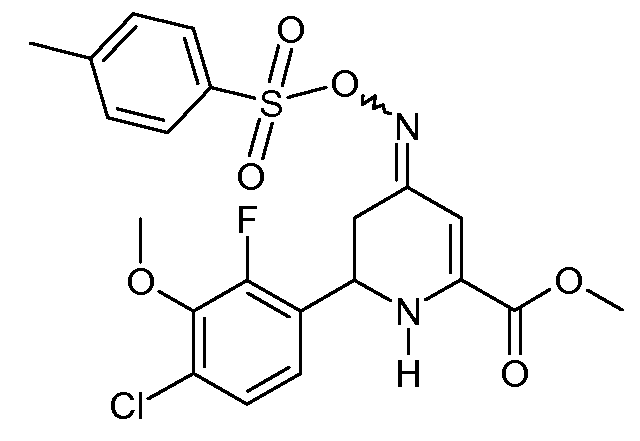
К перемешиваемому магнитной мешалкой раствору метилового эфира-6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18; 0,657 г, 0,002 моль) в пиридине (5 мл), охлажденному на ледяной бане, добавляли п-толуолсульфонилхлорид (0,572 г, 0,003 моль) на протяжении 5 мин. После предоставления реакционной смеси возможности нагреться до комнатной температуры в течение 2 дней растворитель удаляли при пониженном давлении. Остаток растворяли в CH2Cl2 (50 мл), промывали насыщенными водными растворами NaHCO3 и NaCl и сушили (MgSO4). Удаление растворителя давало вязкое оранжевое масло (1,12 г). Растирание со смесью простой эфир/пентан давало смесь 4:1 изомеров метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е,Z)-п-толуолсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (22; 0,818 г, 85%) в виде твердого вещества не совсем белого цвета: т.пл. 147-148°С; 1H ЯМР (400 МГц, CDCl3) δ 7,85 (д, J=8,3 Гц, 2H), 7,32 (д, J=8,0 Гц, 2H), 7,11 (дд, J=8,5, 1,7 Гц, 1H), 6,95 (дд, J=8,3, 7,2 Гц, 1H), 6,39 (c, 1H), 5,47 (c, 1H), 4,84 (дд, J=10,6, 4,5 Гц, 1H), 3,95 (д, J=1,1 Гц, 3H), 3,89 (c, 3H), 2,71 (ддд, J=26,3, 15,5, 7,7 Гц, 2H), 2,45 (c, 3H); HRMS-ESI (m/z): вычисл. для C21H20ClFN2O6S 482,0709; найдено 482,0701.
Пример 12
Получение метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (23)
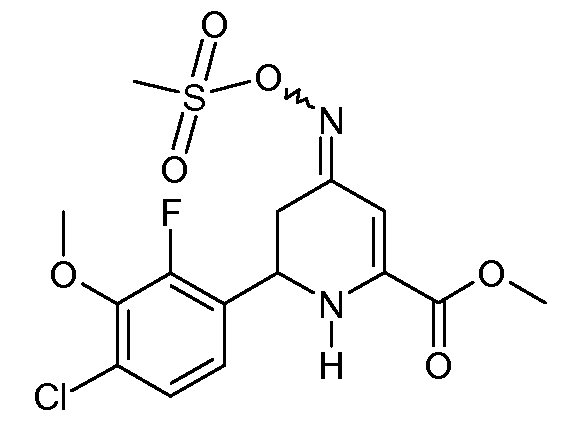
Стадия A. К перемешиваемому магнитной мешалкой раствору метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (16; 4,70 г, 0,015 моль) в MeOH (100 мл) при комнатной температуре добавляли гидрохлорид гидроксиламина (2,08 г, 0,03 моль) с последующим добавлением пиридина (8 мл). После кипячения с обратным холодильником в течение 1 часа растворитель удаляли при пониженном давлении. Остаток растворяли в CH2Cl2 (100 мл) и промывали насыщенными водными растворами NaHCO3 и NaCl. После сушки (MgSO4) удаление растворителя давало смесь 1:1 изомеров метилового эфира 6-(4-хлор-2-фторфенил-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18; 4,95 г, выход сырого продукта 100%) в виде твердого вещества желтого цвета.
Стадия B. К перемешиваемому магнитной мешалкой раствору метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18; 4,95 г, 0,015 моль) в пиридине (30 мл), охлажденному на ледяной бане, добавляли метансульфонилхлорид (3,43 г, 0,03 моль) на протяжении 5 мин. После предоставления реакционной смеси возможности нагреться до комнатной температуры в течение 2 дней растворитель удаляли при пониженном давлении. Остаток растворяли в CH2Cl2 (100 мл), промывали насыщенными водными растворами NaHCO3 и NaCl и сушили (MgSO4). Удаление растворителя давало липкое твердое вещество бледно-оранжевого цвета (5,5 г). Растирание со смесью простой эфир/пентан давало смесь 8:1 изомеров метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (23; 4,14 г, 68%) в виде твердого вещества белого цвета: т.пл. 134-135°С; 1H ЯМР (400 МГц, CDCl3) основной изомер δ 7,20 (дд, J=8,8, 1,3 Гц, 1H), 7,06 (дд, J=8,5, 6,7 Гц, 1H), 6,4 (c, 1H), 5,59 (ушир.с, 1H), 4,93 (дд, J=10,8, 4,7 Гц, 1H), 3,96 (c, 3H), 3,90 (c, 3H), 3,15 (c, 3H), 2,81 (м, 2H); HRMS-ESI (m/z): вычисл. для C15H16ClFN2O6S 406,040; найдено 406,040.
Метиловый эфир 6-(4-хлорфенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (24)
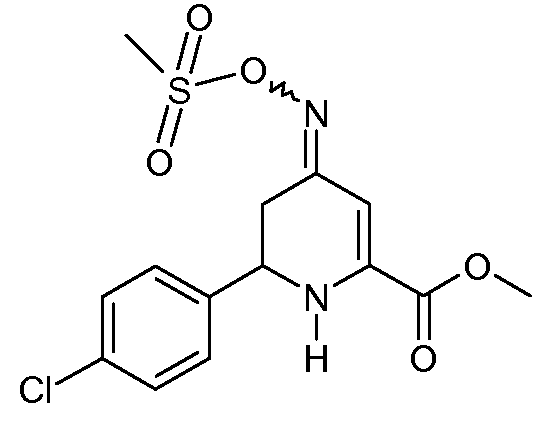
С применением процедуры примера 12 реакцией метилового эфира 6-(4-хлорфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (13; 6,64 г, 0,025 моль), гидрохлорида гидроксиламина (3,47 г, 0,05 моль) и пиридина (10 мл) получали после обработки оранжевое масло (9,1 г). Это вещество снова растворяли в пиридине (40 мл) и обрабатывали метансульфонилхлоридом (5,72 г, 0,05 моль), получая при этом смесь 4:1 изомеров метилового эфира 6-(4-хлорфенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (24; 3,5 г, 39%, чистота по 1Н ЯМР 95%) в виде твердого вещества не совсем белого цвета: т.пл. 62-64°С; 1H ЯМР (400 МГц, CDCl3) основной изомер δ 7,42-7,28 (м, 4H), 6,39 (c, 1H), 5,55 (c, 1H), 4,57 (дд, J=11,6, 5,1 Гц, 1H), 3,90 (c, 3H), 3,14 (c, 3H), 2,93-2,65 (м, 2H); минорный изомер δ 7,45-7,28 (м, 4H), 6,15 (c, 1H), 5,23 (c, 1H), 4,41 (дд, J=13,4, 4,3 Гц, 1H), 3,90 (c, 3H), 3,30 (дд, J=17,2, 4,3 Гц, 1H), 3,15 (c, 3H), 2,56 (дд, J=17,1, 13,5 Гц, 1H); HRMS-ESI (m/z): вычисл. для C14H15ClN2O5S 358,0384; найдено 358,0385.
Этиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (25)
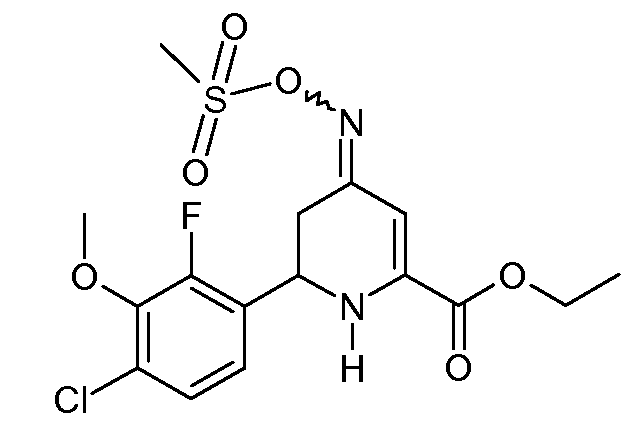
С применением процедуры примера 12 реакцией этилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (14; 3,93 г, 0,012 моль), гидрохлорида гидроксиламина (2,08 г, 0,03 моль) и пиридина (8 мл) получали после обработки липкое твердое вещество оранжевого цвета (5,1 г). Это вещество снова растворяли в пиридине (30 мл) и обрабатывали метансульфонилхлоридом (2,75 г, 0,024 моль), получая при этом смесь 4:1 изомеров этилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (25; 2,6 г, 52%, чистота по 1Н ЯМР 95%) в виде твердого вещества белого цвета: т.пл. 130-132°С; 1H ЯМР (400 МГц, CDCl3) δ 7,20 (дд, J=8,5, 1,5 Гц, 1H), 7,10-7,05 (м, 1H), 6,37 (c, 1H), 5,60 (c, 1H), 4,93 (дд, J=11,1, 4,4 Гц, 1H), 4,45-4,34 (м, 2H), 3,98 (д, J=1,1 Гц, 3H), 3,16 (c, 3H), 2,95-2,74 (м, 2H), 1,40 (д, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C16H18ClFN2O6S 420,056; найдено 420,056.
Пример 13
Получение метилового эфира 3-хлор-6-(4-хлор-2-фторфенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (26)
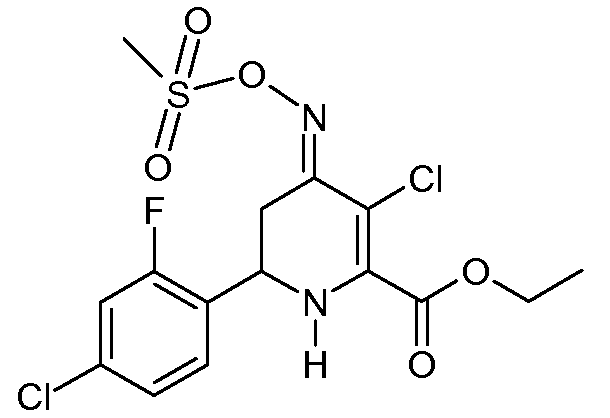
К перемешиваемому магнитной мешалкой раствору этилового эфира 6-(4-хлор-2-фторфенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (20; 2,74 г, 0,007 моль) в CH2Cl2 (20 мл), охлажденному на ледяной бане, добавляли раствор сульфурилхлорида (SO2Cl2, 0,94 г, 0,007 моль) в CH2Cl2 на протяжении 5 мин. После предоставления возможности реакционной смеси нагреться до комнатной температуры в течение 1 час добавляли CH2Cl2 (50 мл). После промывания реакционной смеси насыщенным водным раствором NaCl и сушки (MgSO4) удаляли растворитель, получая при этом этиловый эфир 3-хлор-6-(4-хлор-2-фторфенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (26; 2,91 г, 98%, чистота по 1Н ЯМР 95%) в виде пушистого бледно-желтого твердого вещества: т.пл. 63-64°С; 1H ЯМР (400 МГц, CDCl3) δ 7,37 (т, J=8,1 Гц, 1H), 7,20 (дд, J=8,4, 1,7 Гц, 1H), 7,16 (дд, J=10,1, 2,0 Гц, 1H), 5,31 (c, 1H), 4,78 (дд, J=12,6, 4,5 Гц, 1H), 4,41 (кв, J=7,1 Гц, 2H), 3,39 (дд, J=16,9, 4,4 Гц, 1H), 3,22 (c, 3H), 2,91-2,76 (м, 1H), 1,40 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C15H15Cl2FN2O5S 425,240; найдено 425,240.
Метиловый эфир 3-хлор-6-(4-хлорфенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (27)
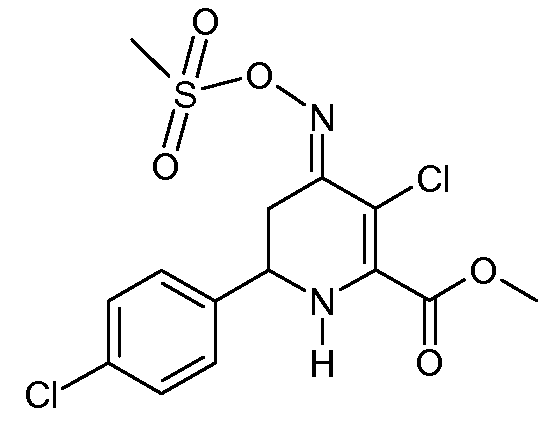
С применением процедуры примера 13 реакцией метилового эфира 6-(4-хлорфенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (24; 2,78 г, 0,008 моль) и SO2Cl2 (1,08 г, 0,005 моль) в CH2Cl2 (25 мл) получали метиловый эфир 3-хлор-6-(4-хлорфенил)-4-[(E)-метансульфонилоксимино]-3-хлор-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (27; 3,20 г, 99%, чистота по 1Н ЯМР 95%) в виде пушистого твердого вещества бледно-желтого цвета: т.пл. 60-62°С; 1H ЯМР (400 МГц, CDCl3) δ 7,41-7,29 (м, 4H), 5,33 (c, 1H), 4,44 (дд, J=13,8, 4,1 Гц, 1H), 3,94 (c, 3H), 3,40 (ддд, J=16,9, 4,2, 1,8 Гц, 1H), 3,21 (c, 3H), 2,88-2,57 (м, 1H); HRMS-ESI (m/z): вычисл. для C15H14Cl2N2O5S 391,9995; найдено 391,9997.
Этиловый эфир 3-хлор-6-(4-хлорфенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (28)
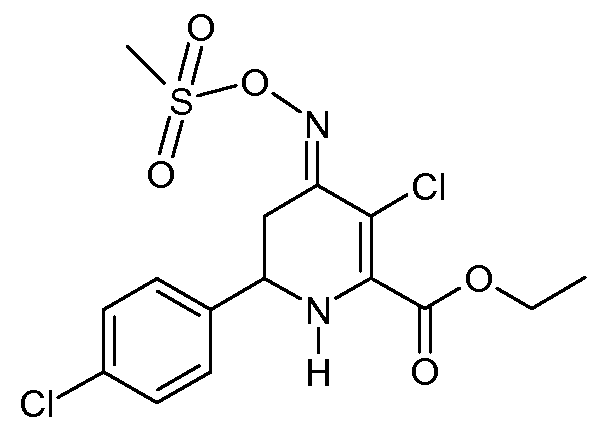
С применением процедуры примера 13 реакцией этилового эфира 6-(4-хлорфенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (21; 5,97 г, 0,016 моль) и SO2Cl2 (2,16 г, 0,016 моль) в CH2Cl2 (50 мл) получали этиловый эфир 3-хлор-6-(4-хлорфенил)-4-[(Е)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (28; 6,43 г, 99%, чистота по 1Н ЯМР 92%) в виде пушистого твердого вещества бледно-желтого цвета: т.пл. 57-59°С; 1H ЯМР (400 МГц, CDCl3) δ 7,35 (м, 4H), 5,35 (c, 1H), 4,44 (дд, J=13,0, 3,2 Гц, 1H), 4,39 (т, J=7,1 Гц, 2H), 3,39 (ддд, J=16,9, 4,2, 1,8 Гц, 1H), 3,22 (c, 3H), 2,65 (дд, J=16,9, 13,9 Гц, 1H), 1,40 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C15H16Cl2N2O5S 406,015; найдено 406,016.
Метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (29)
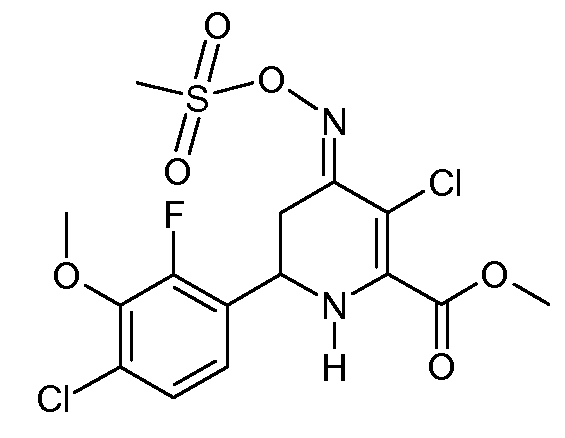
С применением процедуры примера 13 реакцией метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (23; 2,04 г, 0,005 моль) и SO2Cl2 (0,68 г, 0,005 моль) в CH2Cl2 (10 мл) получали метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (29; 2,18 г, 99%, чистота по 1Н ЯМР 95%) в виде пушистого твердого вещества бледно-желтого цвета: т.пл. 64-66°С; 1H ЯМР (400 МГц, CDCl3) δ 7,24 (дд, J=8,8, 1,3 Гц, 1H), 7,09 (дд, J=8,5, 6,7 Гц, 1H), 5,38 (c, 1H), 4,78 (дд, J=12,7, 4,5 Гц, 1H), 3,98 (c, 3H), 3,93 (c, 3H), 3,42 (дд, J=16,7, 4,5 Гц, 1H), 3,24 (c, 3H), 2,77 (дд, J=16,9, 12,8 Гц, 1H); HRMS-ESI (m/z): вычисл. для C15H15ClFN2O5S 441,001; найдено 441,002.
Этиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (30)
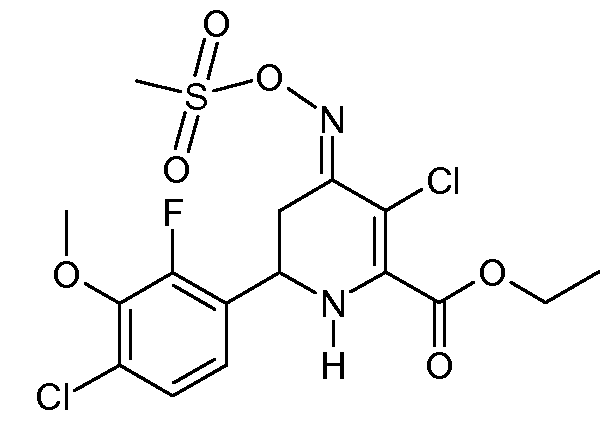
С применением процедуры примера 13 реакцией метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (25; 2,11 г, 0,005 моль) и SO2Cl2 (0,68 г, 0,005 моль) в CH2Cl2 (10 мл) получали этиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (30; 2,21 г, 97%, чистота по 1Н ЯМР 95%) в виде пушистого твердого вещества бледно-желтого цвета: т.пл. 60-62°С; 1H ЯМР (400 МГц, CDCl3) δ 7,21 (дд, J=8,5, 1,8 Гц, 1H), 7,08 (дд, J=8,6, 6,9 Гц, 1H), 5,32 (c, 1H), 4,78 (дд, J=12,8, 4,5 Гц, 1H), 4,41 (кв, J=7,1 Гц, 2H), 3,99 (д, J=1,3 Гц, 3H), 3,41 (дд, J=16,9, 4,5 Гц, 1H), 3,23 (c, 3H), 2,76 (дд, J=11,7, 5,2 Гц, 1H), 1,40 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C16H17Cl2FNO6S 454,016; найдено 454,017.
Метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-п-толуолсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (31)
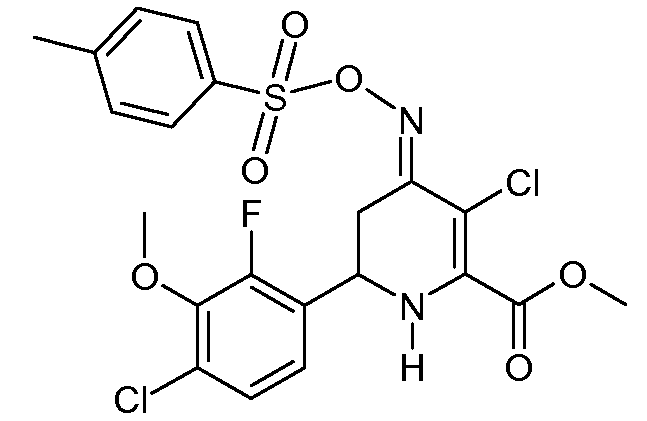
С применением процедуры примера 13 реакцией метилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е,Z)-п-толуолсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (22; 0,628 г, 0,0013 моль) и SO2Cl2 (0,175 г, 0,0013 моль) в CH2Cl2 (5 мл) получали метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-п-толуолсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (31; 0,616 г, 98%, чистота по 1Н ЯМР 95%) в виде пушистого твердого вещества бледно-желтого цвета: т.пл. 62-64°С; 1H ЯМР (400 МГц, CDCl3) δ 7,91 (д, J=8,3 Гц, 2H), 7,34 (д, J=8,0 Гц, 2H), 7,16 (дд, J=8,5, 1,7 Гц, 1H), 7,01 (дд, J=8,4, 7,1 Гц, 1H), 5,25 (c, 1H), 4,70 (дд, J=12,6, 4,3 Гц, 1H), 3,97 (д, J=1,2 Гц, 3H), 3,91 (c, 3H), 3,33 (ддд, J=16,8, 4,4, 1,6 Гц, 1H), 2,88-2,64 (м, 1H), 2,45 (c, 3H); HRMS-ESI (m/z): вычисл. для C21H19Cl2FN2O5S 516,0322; найдено 516,0319.
Пример 14
Получение метилового эфира 3-бром-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (32)
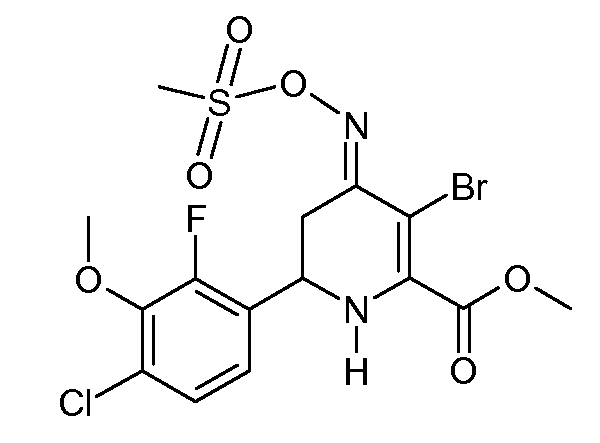
N-Бромсукцинимид (0,512 г, 2,88 ммоль) добавляли к раствору метилового эфира (6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (23; 1,17 г, 2,88 ммоль) в CH2Cl2 (10 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа и затем разбавляли CH2Cl2 и промывали Н2О. Органический слой отделяли и сушили посредством Biotage Phase Separator SPE. Растворитель удаляли в вакууме, получая при этом коричневое масло (1,4 г). Очистка хроматографией на силикагеле (40% EtOAc/10% CH2Cl2/50% пентана) давала метиловый эфир 3-бром-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (32; 1,17 г, 84%) в виде стекловидного вещества желтого цвета: 1Н ЯМР (300 МГц, CDCl3) δ 7,21 (дд, J=8,6, 1,8 Гц, 1H), 7,07 (дд, J=8,4, 6,7 Гц, 1H), 5,39 (c, 1H), 4,81 (д, J=12,2 Гц, 1H), 4,01-3,97 (м, 4H), 3,94 (д, J=2,0 Гц, 3H), 3,43 (дд, J=16,8, 2,8 Гц, 1H), 3,23 (д, J=1,9 Гц, 3H), 2,79 (дд, J=16,8, 12,7 Гц, 1H); HRMS-ESI (m/z): вычисл. для C15H17BrClFN2O6S 485,9663; найдено 485,9663.
Пример 15
Получение метилового эфира 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (33)
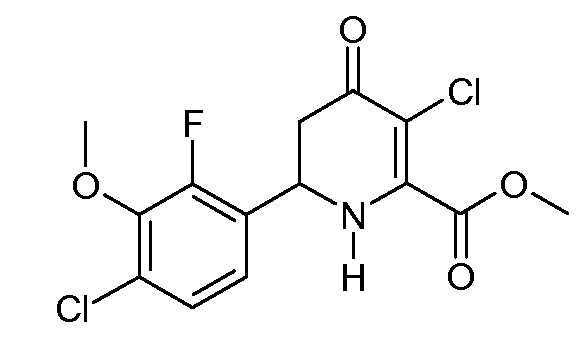
Метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (16; 483 мг, 1,54 ммоль) перемешивали в CH2Cl2 (10 мл) и охлаждали на ледяной бане. По каплям добавляли раствор SO2Cl2 (209 мг, 1,55 ммоль) в CH2Cl2 (5 мл). Спустя 30 мин реакционный раствор гасили 10% водным раствором бисульфита натрия. Органический слой отделяли, промывали насыщенным водным раствором NaHCO3, Н2О и насыщенным раствором соли и затем сушили (MgSO4). Раствор упаривали до получения желтого масла, которое кристаллизовали из холодного метанола, получая при этом метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (33; 0,437 г, 81%) в виде твердого вещества бледно-желтого цвета: т.пл. 127-129°С; 1H ЯМР (300 МГц, CDCl3) δ 7,20 (дд, JF-H=1,5 Гц, JH-H=8,1 Гц, 1H, ароматический), 7,10 (дд, JF-H=6,9 Гц, JH-H=8,1 Гц, 1H, ароматический), 5,82 (ушир.с, 1H, NH), 5,10 (т, J=9,3 Гц, 1H, H6), 3,98 (д, JF-H=1,5 Гц, 3H, OCH3), 3,97 (c, 3H, CO2CH3), 2,88 (д, J=9 Гц, 2H, H5); ESI-МС m/z 347,9 ([M+H]+).
Пример 16
Получение метилового эфира 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (34)
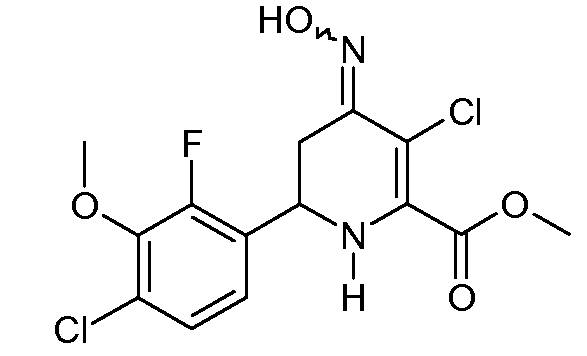
Метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-3-хлор-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (33; 1,612 г, 4,63 ммоль) суспендировали в MeOH (20 мл). Добавляли гидрохлорид гидроксиламина (966 мг, 13,9 ммоль) с последующим добавлением пиридина (3 мл). Реакционную смесь перемешивали в течение 18 час при комнатной температуре и затем в течение 4 час при 40°С. Растворитель удаляли роторным испарением. Добавляли Н2О (100 мл) и образовавшееся твердое вещество отделяли фильтрованием, промывали Н2О с последующим промыванием MeOH, получая при этом метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (34; 1,353 г, 81%) в виде порошка белого цвета: т.пл. 174-176°С; 1H ЯМР (300 МГц, ДМСО-d6) δ 11,23 (c, 1H, NOH), 7,35 (дд, JF-H=1,5 Гц, JH-H=8,7 Гц, 1H, ароматический), 7,17 (дд, JF-H=JH-H=8,7 Гц, 1H, ароматический), 6,93 (ушир.с, 1H, NH), 4,69 (м, 1H, H6), 3,88 (c, 3H), 3,79 (c, 3H), 3,03 (дд, J=4,5, 16 Гц, 1H, H5a), 2,74 (дд, J=9,0, 16 Гц, 1H, H5b); Анал. вычисл. для C14H13Cl2FN2O4: С, 46,30; Н, 3,61; N, 7,71. Найдено: С, 46,77; Н, 3,64; N, 7,42.
Пример 17
Получение метилового эфира 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(E)-ацетоксиоксимино]-3-хлор-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (35)
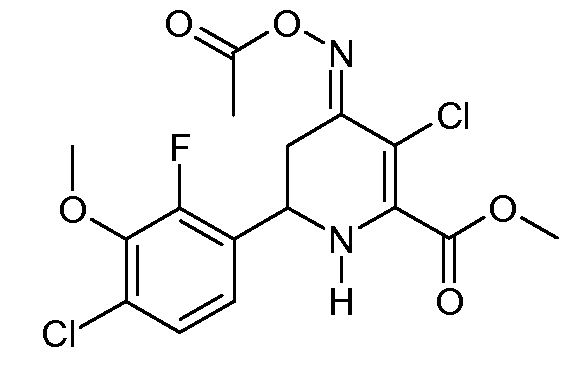
Метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-3-хлор-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (34, 756 мг, 2,08 ммоль) суспендировали в ледяной уксусной кислоте (10 мл). При комнатной температуре по каплям добавляли уксусный ангидрид (241 мг, 2,36 ммоль). Реакционную смесь нагревали при 80°С в течение 2 час. Раствор концентрировали в вакууме и остаток растворяли в CH2Cl2 (50 мл) и промывали насыщенным водным раствором NaHCO3. Экстракты промывали насыщенным раствором соли, сушили (MgSO4) и выпаривали, получая при этом метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е)-ацетоксиоксимино]-3-хлор-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (35; 842 мг, 99%) в виде твердого вещества бледно-оранжевого цвета: 1H ЯМР (400 МГц, CDCl3) δ 7,21 (дд, JF-H=1,5 Гц, JH-H=8,4 Гц, 1H, ароматический), 7,11 (дд, JF-H=6,9 Гц, JH-H=8,4 Гц, 1H, ароматический), 5,24 (ушир.с, 1H, NH), 4,76 (дд, J=4,2, 12,3 Гц, 1H, H5a), 3,98 (д, JF-H=1,5 Гц, 3H, OMe), 3,94 (c, 3H, CO2Me), 3,40 (ддд, JF-H=1,8 Гц, JF-H=4,2, 16,5 Гц, 1H, H6), 2,72 (дд, J=12,3, 16,5 Гц, 1H, H5b), 2,23 (c, 3H, NOAc). HRMS: вычисл. для C16H15Cl2FN2O5 404,034; найдено 404,034.
Пример 18
Получение этилового эфира 4-амино-3-хлор-6-(4-хлор-2-фторфенил)пиридин-2-карбоновой кислоты (36)
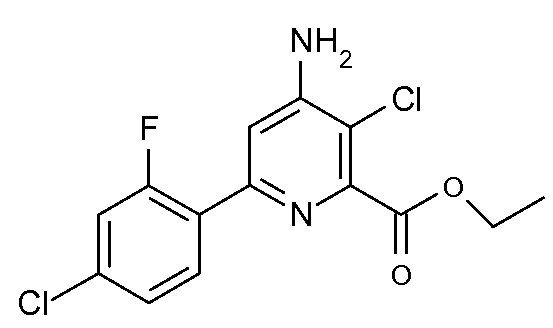
Стадия 1. Раствор этилового эфира (2Z,5E)-2-амино-6-(4-хлор-2-фторфенил)-4-оксогекса-2,5-диеновой кислоты (7; 6,0 г, 0,02 моль) в безводном 1,4-диоксане (100 мл) нагревали до 185°С в реакторе Парра на 200 мл при избыточном давлении N2. Спустя 14 час реактор охлаждали и растворитель удаляли при пониженном давлении, получая при этом темно-оранжевое масло (7,1 г). По данным 1Н ЯМР-спектроскопии вещество содержало 90% требуемого этилового эфира 6-(4-хлор-2-фторфенил)-4-оксо-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (11).
Стадия 2. Смесь указанного выше вещества и 50% водного гидроксиламина (4,0 г) в толуоле (150 мл) нагревали для кипячения с обратным холодильником в течение 4 час. Реакционную смесь охлаждали до комнатной температуры и добавляли CH2Cl2 (150 мл). Органический слой промывали насыщенным раствором NaCl и сушили (MgSO4). Растворитель удаляли, получая при этом смесь изомеров этилового эфира 6-(4-хлор-2-фторфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (17, 4,3 г) в виде твердого вещества коричневого цвета.
Стадия 3. Указанное выше вещество растворяли в ледяной уксусной кислоте (30 мл), смесь охлаждали до 5°С и на протяжении 10 мин добавляли раствор SO2Cl2 (4,05 г, 0,03 моль) в ледяной уксусной кислоте (5 мл). После выдерживания смеси 5 дней при комнатной температуре растворитель удаляли на роторном испарителе и остаток растворяли в CH2Cl2 (100 мл). После промывания раствора насыщенным раствором NaHCO3 и высушивания (MgSO4) растворитель удаляли, получая при этом оранжевое масло (4,6 г), которое содержало по данным 1Н ЯМР 65% этилового эфира 4-амино-3-хлор-6-(4-хлор-2-фторфенил)пиридин-2-карбоновой кислоты. Колоночная хроматография на силикагеле (20% раствор EtOAc/гексаны) давала соединение 36 (2,2 г, 33% после 3 стадий) в виде твердого вещества не совсем белого цвета: т.пл. 109-110°С; 1H ЯМР (400 МГц, CDCl3) δ 7,96 (т, J=8,5 Гц, 1H), 7,20 (дд, J=8,4, 1,7 Гц, 1H), 7,16 (д, J=1,4 Гц, 1H), 7,13 (дд, J=11,1, 2,0 Гц, 1H), 4,91 (c, 2H), 4,47 (кв, J=7,1 Гц, 2H), 1,43 (т, J=7,1 Гц, 3H); Анал. вычисл. для C14H11Cl2FN2O2: С, 51,09; Н, 3,37; N, 8,51. Найдено: С, 50,90; Н, 3,31; N, 8,47.
Пример 19
Получение этилового эфира 4-амино-3-хлор-6-(4-хлорфенил)пиридин-2-карбоновой кислоты (37)
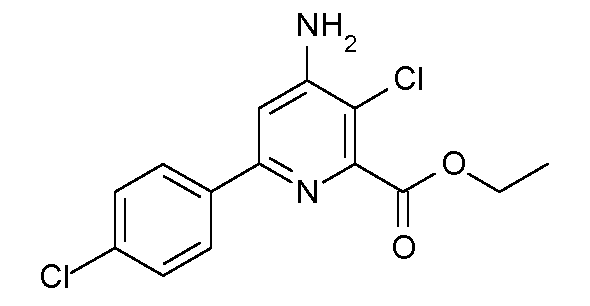
К перемешиваемому магнитной мешалкой раствору этилового эфира 6-(4-хлорфенил)-4-гидроксиимино-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (19; 0,589 г, 0,002 моль) в ледяной уксусной кислоте (5 мл), охлажденному до 5°С, добавляли SO2Cl2 (0,16 мл, 0,002 моль). После нагревания до комнатной температуры в течение 2 час добавляли дополнительный SO2Cl2 (0,225 мл, 0,0028 моль). После выдерживания смеси 2 дня при комнатной температуре растворитель удаляли на роторном испарителе и остаток растворяли в CH2Cl2 (50 мл). После промывания раствора насыщенным раствором NaHCO3 и сушки (MgSO4) растворитель удаляли, получая при этом твердое вещество бледно-желтого цвета (0,65 г). Препаративная тонкослойная хроматография на силикагеле (20% раствор EtOAc/гексаны) давала этиловый эфир 4-амино-3-хлор-6-(4-хлорфенил)пиридин-2-карбоновой кислоты (37; 0,325 г, 52%, чистота по 1Н ЯМР 93%) в виде твердого вещества белого цвета: т.пл. 128-130°С; 1H ЯМР (400 МГц, CDCl3) δ 7,90-7,82 (м, 2H), 7,46-7,36 (м, 2H), 7,07 (c, 1H), 4,81 (c, 2H), 4,48 (кв, J=7,1 Гц, 2H), 1,44 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C14H12Cl2N2O2 310,027; найдено 310,028. Собирали также этиловый эфир 4-амино-3,5-дихлор-6-(4-хлорфенил)пиридин-2-карбоновой кислоты (38; 0,092 г, выход 13%) в виде твердого вещества белого цвета: т.пл. 143-145°С; 1H ЯМР (400 МГц, CDCl3) δ 7,73-7,58 (м, 2H), 7,49-7,36 (м, 2H), 5,31 (c, 2H), 4,45 (кв, J=7,1 Гц, 2H), 1,41 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C14H11Cl3N2O2 344,013; найдено 344,013.
Пример 20
Получение метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (39)
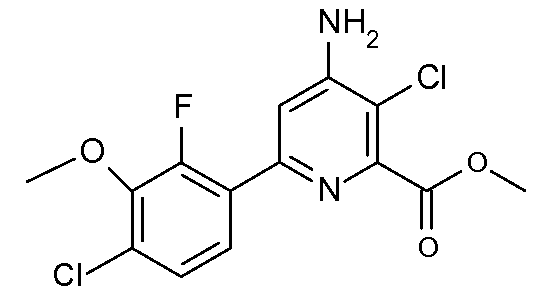
Метиловый эфир 3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Z)-гидроксиимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (18, 756 мг, 2,08 ммоль) перемешивали в ледяной уксусной кислоте (10 мл). При комнатной температуре по каплям добавляли уксусный ангидрид (241 мг, 2,36 ммоль). Реакционную смесь перемешивали при кипячении с обратным холодильником в атмосфере азота в течение 6 час. Раствор концентрировали в вакууме. Остаток растворяли с CH2Cl2 (50 мл) и промывали насыщенным водным раствором NaHCO3. Экстракты промывали насыщенным раствором соли, сушили (MgSO4) и упаривали до получения твердого вещества коричневого цвета. Очистка с применением хроматографии на силикагеле и градиента смеси гексан-EtOAc давала метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (39; 0,204 г, 28%) в виде твердого вещества рыжевато-коричневого цвета: 1H ЯМР (400 МГц, CDCl3) δ 7,65 (дд, J=8,6, 7,8 Гц, 1H), 7,23 (дд, J=8,7, 1,8 Гц, 1H), 7,18 (д, J=1,7 Гц, 1H), 4,85 (c, 2H), 4,00 (c, 3H), 3,97 (д, J=0,9 Гц, 3H),); HRMS-ESI (m/z): вычисл. для C14H11Cl2FN2O3 344,013; найдено 344,013.
Пример 21
Получение метилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (39)
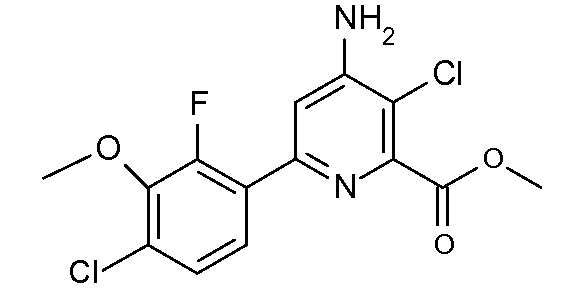
Перемешиваемый магнитной мешалкой метиловый эфир 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е)-метансульфонилоксимино]-3-хлор-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (29, 0,441 г, 0,001 моль) в ледяной уксусной кислоте (2 мл) нагревали до 90°С в течение 4 час. После удаления растворителя на роторном испарителе остаток растворяли в CH2Cl2 (25 мл) и промывали насыщенными растворами NaHCO3 и NaCl. После сушки (MgSO4) растворитель удаляли, получая при этом метиловый эфир 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (39; 0,332 г, 96%; чистота по ГХ и 1Н ЯМР-спектроскопии 93%) в виде твердого вещества белого цвета: т.пл. 141-143°С. 1Н ЯМР (400 МГц, CDCl3) δ 7,65 (дд, J=8,6, 7,8 Гц, 1H), 7,23 (дд, J=8,7, 1,8 Гц, 1H), 7,18 (д, J=1,7 Гц, 1H), 4,85 (c, 2H), 4,00 (c, 3H), 3,97 (д, J=0,9 Гц, 3H). HRMS-ESI (m/z): вычисл. для C14H11Cl2FN2O3 344,013; найдено 344,013.
Пример 22
Получение этилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (40)
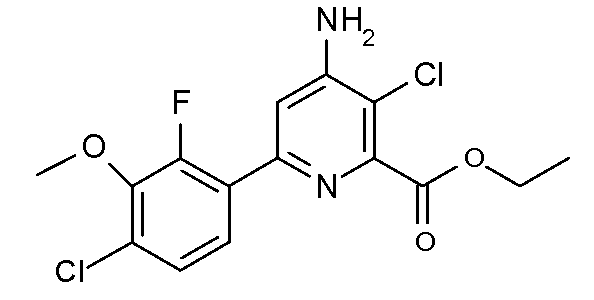
К перемешиваемому магнитной мешалкой раствору этилового эфира 6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е,Z)-метансульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (25, 4,20 г, 0,01 моль) в ледяной уксусной кислоте (100 мл), охлажденному до 5°С, добавляли раствор SO2Cl2 (1,35 г, 0,01 моль) в ледяной уксусной кислоте (3 мл) на протяжении 5 мин. Реакционную смесь нагревали до комнатной температуры в течение 1 часа, затем до 90°С на протяжении 4 час. После удаления растворителя на роторном испарителе остаток растворяли в CH2Cl2 (100 мл) и промывали насыщенными растворами NaHCO3 и NaCl. После сушки (MgSO4) растворитель удаляли, получая при этом твердое вещество желтого цвета (3,55 г), которое содержало 81% этилового эфира 4-амино-3-хлор-6-(4-хлор-2-фтор-3-метоксифенил)пиридин-2-карбоновой кислоты (40) по данным 1Н ЯМР-спектроскопии. Колоночная хроматография на силикагеле (20% раствор EtOAc/гексаны) давала продукт в виде твердого вещества не совсем белого цвета (2,75 г, 78%, чистота по ГХ и 1Н ЯМР-спектроскопии 93%): т.пл. 73-74°С; 1H ЯМР (400 МГц, CDCl3) δ 7,67 (дд, J=8,6, 7,8 Гц, 1H), 7,23 (дд, J=8,7, 1,7 Гц, 1H), 7,18 (д, J=1,7 Гц, 1H), 4,83 (c, 2H), 4,48 (кв, J=7,1 Гц, 2H), 3,97 (д, J=0,8 Гц, 3H), 1,43 (т, J=7,1 Гц, 3H); HRMS-ESI (m/z): вычисл. для C15H13Cl2FN2O3 358,028; найдено 358,059.
Пример 23
Получение метилового эфира 4-амино-3-бром-6-(4-хлор-2-фторфенил)пиридин-2-карбоновой кислоты (41)
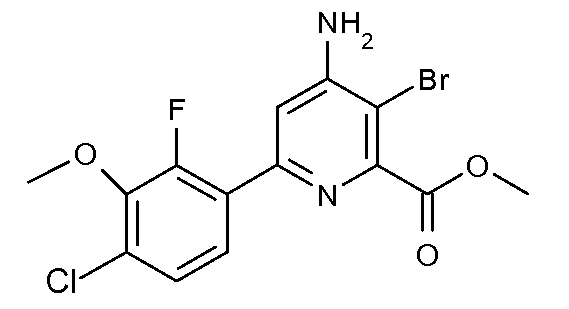
Раствор метилового эфира 3-бром-6-(4-хлор-2-фтор-3-метоксифенил)-4-[(Е)-метилсульфонилоксимино]-1,4,5,6-тетрагидропиридин-2-карбоновой кислоты (23, 900 мг, 1,856 ммоль) в ледяной уксусной кислоте (4,6 мл) нагревали при 150°С в течение 5 мин в микроволновой печи Biotage. После охлаждения до температуры окружающей среды реакционную смесь разбавляли Н2О и значение pH делали нейтральным насыщенным раствором Na2CO3. Образовавшуюся смесь экстрагировали 3 раза этилацетатом. Объединенные органические экстракты промывали насыщенным раствором соли, сушили Na2SO4, фильтровали и концентрировали в вакууме. Колоночная хроматография на силикагеле (20% раствор EtOAc/пентан) давала метиловый эфир 4-амино-3-бром-6-(4-хлор-2-фторфенил)пиридин-2-карбоновой кислоты (41; 0,60 г, 83%) в виде твердого вещества бледно-коричневого цвета: т.пл. 148-149°С; 1H ЯМР (300 МГц, CDCl3) δ 7,65 (дд, J=8,6, 7,7 Гц, 1H), 7,26-7,20 (м, 1H), 7,14 (д, J=1,8 Гц, 1H), 4,91 (c, 2H), 3,99 (c, 3H), 3,97 (д, J=0,9 Гц, 3H); HRMS-ESI (m/z): вычисл. для C14H11BrClFN2O3 387,962; найдено 387,963.