Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ НЕСПЕЦИФИЧЕСКОЙ УСТОЙЧИВОСТИ ПАТОГЕННЫХ МИКРООГРАНИЗМОВ К АНТИБИОТИКАМ НА ОСНОВАНИИ ИЗМЕРЕНИЯ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФОСФОДИЭСТЕРАЗ, РАСЩЕПЛЯЮЩИХ ЦИКЛИЧЕСКИЙ ДИГУАНОЗИНМОНОФОСФАТ
Вид РИД
Изобретение
Изобретение относится к биотехнологии, конкретно - к областям биомедицины, биоскрининга и разработки способов диагностики и мониторинга бактериальных инфекций на основе репортерных биомолекул, специфичных для организма-мишени, и касается нового способа определения наличия неспецифической устойчивости к антибиотикам, вызванной формированием биологических пленок. Данные биопленки изменяют проницаемость отдельных клеток и клеточных колоний, затрудняя проникновение антибиотиков внутрь клетки. В ряде случаев компоненты биопленок напрямую связывают антибиотики, предотвращая их доступ к мишеням. Колонии бактерий, сформировавших биопленки, обладают высокой степенью адгезивности как к различным поверхностям, включая медицинские инструменты, например системы гемодиализа, катетеры и другое оборудование, так и к тканям живого организма, например различным слизистым оболочкам. Многочисленные исследования показали, что одна из главных проблем терапии хронических воспалительных инфекций заключается в высокой устойчивости биопленок, формируемых патогенами-возбудителями к антибиотикам и другим неблагоприятным факторам среды, а также высокая степень адгезии бактерий к слизистым оболочкам организма-хозяина. Устойчивость биопленок псевдомонад является одной из важнейших причин неблагоприятного прогноза у больных муковисцидозом. Изменение баланса биопленочного и планктонного состояния патогена является основным способом передачи возбудителя чумы от блох к млекопитающим. Существует целый ряд процессов в бактериях, как частично изученных, так и до сих пор мало исследованных, связанных с формированием или диссоциацией биопленок, а также другими переключениями бактериального фенотипа, которые так или иначе связаны с вирулентностью этих патогенов и со способами их защиты от антибиотиков и других неблагоприятных факторов среды. Центральную роль в управлении этими процессами играет динуклеотид, циклический дигуанозинмонофосфат (c-di-GMP), найденный исключительно в бактериальных клетках. Синтез и гидролиз c-di-GMP, происходящий под действием внешних и внутренних сигналов, приводит к изменению концентрации этого вторичного переносчика в клетке. Это вызывает как глобальные переключения фенотипа (например, от планктонной формы к антибиотикоустойчивой биопленке и обратно), так и модуляцию различных локальных процессов, таких как включение и выключение экспрессии различных генов, реакцию на свет и химические вещества и т.п.
Основной областью применения технологии детекции каталитической активности фосфодиэстеаз c-di-GMP являются клинические и биологические исследования, биомедицина и разработка лекарств.
Изменение концентрации c-di-GMP управляется двумя типами ферментов. Синтез c-di-GMP происходит из GTP и катализируется различными дигуанилатциклазами, которые имеют, как правило, один или несколько регуляторных доменов и регулируются также ингибированием продуктом реакции. Гидролиз c-di-GMP происходит под действием семейства специфических фосфодиэстераз, также как и дигуанилатциклазы состоящих из различных регуляторных доменов и высокогомологичного каталитического домена (EAL домен, названный так по наиболее консервативной аминокислотной последовательности). В настоящее время известен целый ряд процессов, зависящих от изменения активности фосфодиэстераз c-di-GMP и непосредственно связанных с вирулентностью. В частности, увеличение активности фосфодиэстеразы приводит к увеличению антибиотикоустойчивости штаммов Pseudomonas aeruginosa, вызывающих инфекцию при муковисцидозе (Hoffman LR, D'Argenio DA, MacCoss MJ, Zhang Z, Jones RA, Miller SI (2005) Nature, 436, 1171-1175). Активность фосфодиэстеразы непосредственно связана с вирулентностью возбудителя чумы (Bobrov AG, Kirillina О, Ryjenkov DA, Waters CM, Price PA, Fetherston JD, Mack D, Goldman WE, Gomelsky M, Perry RD (2011) Mol Microbiol, 79, 533-551). У возбудителя боррелиоза продукция c-di-GMP критична для поддержания жизни возбудителя в организме клещей-переносчиков. Возбудитель холеры использует c-di-GMP и соответствующую фосфодиэстеразу для переключения фенотипа и включения механизмов вирулентности. Очевидно, что в будущем список фосфодиэстераз c-di-GMP будет пополняться. Определение активности той или иной фосфодиэстеразы будет иметь важнейшее значение для определения присутствия патогена, анализа его фенотипа и ответа на воздействие антибиотиков. Это может быть весьма эффективно использовано при терапии как хронических, так и особо опасных инфекций, при быстром определении генотипов и фенотипов патогенов, составляющих бактериальную пленку, при селекции ингибиторов фосфодиэстераз c-di-GMP.
Известны способ морфологического анализа фенотипа бактерий, формирующих биопленки, в частности биопленки, образуемые патогенными псевдомонадами, выделенными от пациентов с муковисцидозом (Mathur Т, Singhal S, Khan S, Upadhyay DJ, Fatma T, Rattan A. (2006) Indian J Med Microbiol, 24, 25-29). Существуют также микроскопические методы определения формирования биопленок как у псевдомонад, так и у других патогенов (Hassan A, Usman J, Kaleem F, Omair M, Khalid A, Iqbal M. Braz J (2011) Infect Dis, 15, 305-311). Эти методы служат для оценки фенотипа микроорганизма и его потенциальной вирулентности и устойчивости к антибиотикам, дезинфицирующим агентам и другим факторам. Вместе с тем, данными методами невозможно решить задачу количественного определения продукции белков, обуславливающих те или иные детерминанты вирулентности, определить динамику изменения уровня неспецифической устойчивости к антибиотикам или оценить эффект терапевтической интервенции. Микроскопические и морфологические методы требуют длительного времени (несколько суток), которое необходимо для роста колоний микроорганизмов и развития диагностического фенотипа, как правило, обуславливаемого синтезом полисахаридного экстраклеточного матрикса. Кроме того, фенотипические изменения могут происходить по нескольким сценариям и необязательно выражаются в изменении устойчивости к антибиотикам.
Известны методы дифференциального окрашивания бактерий, формирующих биопленки, с помощью красителей кристаллического фиолетового на бактериях, прикрепленных к высокоадгезивному пластику (O'Toole GA (2011) J Vis Exp, 47, pii: 2437), и конго красного, внесенного в агаризованную среду (Harrison-Balestra С, Cazzaniga AL, Davis SC, Mertz PM (2003) Dermatol Surg, 29, 631-635).
Известны прямые методы определения резистентности микроорганизмов к антибиотикам, в частности метод посева на селективную среду с различными концентрациями антибиотика (Kronvall G, Kahlmeter G, Myhre E, Galas MF (2003) Clin Microbiol Infect, 9, 120-132), метод капиллярных дисков, насыщенных определенными концентрациями раствора антибиотика и молекулярно-генетические методы, выявляющие наличие генов устойчивости к тому или иному антибиотику (Woodford N, Sundsfjord AJ (2005) Antimicrob Chemother, 56, 259-261). Эти методы эффективны для определения специфической устойчивости к антибиотикам, обусловленной продукцией специфического белка, инактивирующего антибиотик или обеспечивающего его выведение из клетки. Однако такие методы неспособны оценить развитие неспецифической устойчивости к антибиотику, вызванной внешней блокировкой проницаемости клеток в связи с формированием биопленок. Клетки, в потенциале обладающие такой устойчивостью, при искусственной культивации будут находиться в планктонной фазе и до перехода в фазу биопленки будут гибнуть от значительно меньших концентраций антибиотика, снижая достоверность анализа. Количественная детекция активности фосфодиэстеразы c-di-GMP, ответственной за переключение фенотипа, является существенно более адекватным параметром, описывающим степень развития неспецифической устойчивости к антибиотику, чем вышеописанные методы. Она позволяет напрямую осуществлять мониторинг активности ключевого компонента регуляции формирования антибиотикоустойчивых биопленок в ответ на повышение концентрации антибиотика в среде.
Известен способ детекции c-di-GMP in vivo, основанный на продукции флуоресцентного внутриклеточного сенсорного белка (Rybtke MT, Borlee BR, Murakami К, Irie Y, Hentzer M, Nielsen ТЕ, Givskov M, Parsek MR, Tolker-Nielsen Т (2012) Appl Environ Microbiol, 78, 5060-5069). Этот способ может использоваться для мониторинга общей концентрации c-di-GMP и баланса концентрации фосфодиэстераз - дигуанилатциклаз, однако, он неэффективен для определения концентрации каталитической активности конкретной фосфодиэстеразы, ответственной за формирование устойчивости к антибиотику, или за определенное переключение фенотипа, работающее как фактор вирулентности.
Известен также наиболее близкий способ детекции, который заключается в определении количества c-di-GMP in vitro с использованием флуоресцентного белкового сенсора (Но CL, Koh SL, Chuah ML, Luo Z, Tan WJ, Low DK, Liang ZX (2011) Chembiochem, 12, 2753-2758). Однако этот способ также не может быть напрямую использован для определения переключения фенотипа или развития неспецифической антибиотикоустойчивости, поскольку не направлен на определение каталитической активности фосфодиэстеразы-мишени, ответственной за тот или иной процесс в патогене. Кроме того, если рассматривать использование данного способа в качестве только детекционого модуля для определения активности фосфодиэстераз, его недостатком является использование рекомбинантного белкового конструкта, что усложняет и удорожает детекцию, особенно в условиях, когда, при низких концентрациях детектируемой фосфодиэстеразы, требуется использование избытка субстрата.
Изобретение решает задачу разработки высокочувствительного способа определения присутствия каталитически активной фосфодиэстеразы c-di-GMP заранее определенного типа, ответственной за процесс эстеролиза c-di-GMP в клетках инфекционного бактериального агента, ведущий к развитию неспецифической устойчивости к антибиотику, переключению вирулентного фенотипа и другим изменениям, способным повлиять на ход заболевания или служить индикаторами эффективности терапии, и применимого для детекции фосфодиэстеразы c-di-GMP, полученной из клинических образцов, в результате культивирования патогена in vitro, или выделенной из патогена, обнаруженного в окружающей среде.
Поставленная задача решается за счет создания способа детекции активности c-di-GMP фософдиэстеразы-мишени с помощью сформированного комплекса G-квадруплексов c-di-GMP и флуоресцентного красителя, способного интеркалировать в структуру G-квадруплексов c-di-GMP, увеличивая при интеркаляции интенсивность собственной флуоресценции и уменьшая интенсивность собственной флуоресценции при разрушении G-квадруплексов за счет гидролиза c-di-GMP фосфодиэстеразой-мишенью.
Также задача решается за счет применения аффинных зондов в форме моноклональных или поликлональных антител, либо нуклеиновых или пептидных аптамеров, специфичных к одному из некаталитических модулей c-di-GMP фосфодиэстеразы таким образом, что связывание с этим модулем не влияет или незначительно влияет на способность мишени гидролизовать c-di-GMP.
Также задача решается за счет применения смеси детергентов и нуклеаз, обеспечивающих мягкий лизис бактериальных клеток и разрушение высокомолекулярных нуклеиновых кислот, обеспечивающее высвобождение в раствор фосфодиэстераз-мишеней для обеспечения доступа к ним аффинных зондов.
Также задача решается за счет гетерофазного принципа выделения фосфодиэстеразы-мишени, в рамках которого комплекс мишени с аффинными зондами, специфически адсорбируется на твердой фазе, в то время как остальные компоненты смеси удаляются с раствором.
Также задача решается за счет создания контрольных ферментов, представляющих из себя рекомбинантный аналог анализируемой мишени с заранее рассчитанной удельной ферментативной активностью.
А также задача решается за счет эффективного количественного определения ферментативной активности фосфодиэстеразы-мишени, иммобилизованной на твердой фазе при помощи аффинных зондов, на основе измерения падения флуоресценции G-квадруплексов в сравнении с падением флуоресценции в контрольных реакциях, осуществляемых рекомбинантным ферментом-мишенью.
Техническим результатом изобретения является создание быстрого и высокочувствительного способа определения концентрации и динамики изменения концентрации под действием терапии и других стимулов или антагонистов, ключевых c-di-GMP зависимых регуляторов, обладающих активностью c-di-GMP фосфодиэстеразы. Чувствительность разработанной методики зависит от каталитической эффективности анализируемой фосфодиэстеразы-мишени, и в среднем составляет 50 пг/мл фермента.
В предлагаемом техническом решении, в качестве субстрата для определения активности c-di-GMP фосфодиэстеразы применяют комплекс флуоресцентного интеркалирующего красителя, который способен в определенных условиях (повышенная концентрация солей щелочных металлов, концентрация c-di-GMP, достаточная для формирования G-квадруплексов (Nakayama S, Kelsey I, Wang J, Sintim HO (2011) Chem Commun, 47, 4766-4768). G-квадруплексы - особые структуры, которые образуют, главным образом, рибо- и дезоксирибонуклеинове гуаниновые нуклеотиды. G-квадруплексы являются одними из наиболее распространенных структур, в которые происходит интеркаляция флуоресцентных красителей (таких как, в частности, SYBR Green), связывающихся с ДНК при проведении количественного анализа продуктов, наработанных ПЦР в режиме реального времени. При интеркаляции красителя в ДНК или РНК происходит разгорание флуоресценции, при уменьшении количества структур, способных образовывать G-квадруплексы, происходит падение интенсивности флуоресценции. Разрушение G-квадруплексов, сформированных c-di-GMP, может происходить, например, вследствие уменьшения концентрации этого динуклеотида род действием специфической фосфодиэстеразы. Важно, что другие нуклеазы или фосфодиэстеразы неспособны расщеплять c-di-GMP, что обеспечивает высокую специфичность данного метода по отношению к фосфодиэстеразам c-di-GMP. Предпочтительными красителями являются интеркалирующие азоловые красители типа SYBR Green и его аналогов. Наиболее предпочтительным интеркалирующим в G-квадруплексы красителем для детекции и количественного определения активности фосфодиэстеразы является краситель тиазоловый оранжевый (Nakayama S, Kelsey I, Wang J, Roelofs K, Stefane B, Luo Y, Lee VT, Sintim HO (2011) J Am Chem Soc, 133, 4856-4864), обладающий одним из самых больших значений изменения интенсивности флуоресценции при изменении концентрации G-квадруплексов c-di-GMP. Принципиальным преимуществом использования тиазолового оранжевого и других интеркалирующих красителей по сравнению с флуоресцентными аналогами c-di-GMP и флуоресцентыми белковыми сенсорами c-di-GMP является дешевизна и высокая стабильность интеркаляторов c-di-GMP при сравнимых с другими перечисленными типами зондов значениях изменения сигнала при анализе активности фосфодиэстеразы.
Важным условием успешного технического решения поставленной задачи определения активности фосфодиэстеразы-мишени в биологических образцах является использование антител, специфичных к доменам фосфодиэстераз c-di-GMP, иным, чем каталитический, связывание с которыми не вызывает существенного изменения каталитической эффективности фермента - мишени. Применение таких антител позволяет специфически выделить фосфодиэстеразу-мишень из клеточного лизата без потери каталитической активности, и проводить анализ активности аффинно выделенной мишени.
Существенным достоинством метода является применение гетерофазной детекции, обеспечивающей возможность автоматизации метода анализа активности фосфодиэстераз c-di-GMP. Одновременно с этим, применение гетерофазной селекции обеспечивает простое и эффективное выделение индивидуальных фосфодиэстераз-мишеней в процессе анализа. Предпочтительными матрицами для проведения гетерофазного анализа являются парамагнитные микрочастицы, покрытые аффинными лигандами, обеспечивающими специфическое выделение комплексов антитело-фосфодиэстераза из раствора. Предпочтительными лигандами являются белки, связывающие иммуноглобулины, например белок A, белок G и их аналоги. Наиболее предпочтительной системой для аффинной адсорбции фосфодиэстераз-мишеней являются специфические к мишеням антитела, модифицированные биотином, в паре с парамагнитыми микрочастицами, покрытыми биотин-связывающим белком. Наиболее предпочтительным белком для покрытия парамагнитных микрочастиц является нейтравидин, обеспечивающий наименьшую неспецифическую адсорбцию белков из раствора.
Автоматизация метода обеспечивает его применимость для высокопроизводительного скрининга библиотек малых органических молекул с целью получения ингибиторов активности фософодиэстераз c-di-GMP, блокирующих образование биопленок, переключение фенотипа патогенов и экспрессию детерминант вирулентности. Автоматизация также повышает воспроизводимость результатов клинико-диагностических исследований активности фосфодиэстераз c-di-GMP.
К преимуществам заявленного способа определения неспецифической устойчивости к антибиотикам и выявления формирования биопленок относятся:
1) высокая чувствительность и специфичность метода, основанная на определении активности базовых детерминант этих процессов - регуляторных фосфодиэстераз c-di-GMP, а не косвенных признаков, таких как фенотип колоний, или окрашивание определенными красителями; 2) совместимость метода с технологиями ПЦР в реальном времени и иммуноферментного анализа, широко применяемыми в клинической диагностике; 3) устойчивость к ложноположительным результатам, обеспечиваемая специфичностью гидролиза c-di-GMP и специфичностью аффинной адсорбции заданных фосфодиэстераз-мишеней препаратами моно- или поликлональных антител; 4) относительная дешевизна компонентов диагностического набора по сравнению с рекомбинантными флуоресцентными белками и флуоресцентными и флуорогенными производными c-di-GMP, синтез которых дорог и остается сложной химической задачей.
Изобретение осуществляется следующим образом
Осуществляют подготовку G-квадруплексов c-di-GMP с интеркалированным тиазоловым оранжевым в растворе с концентрацей солей щелочных металлов 0.3 М.
Целевую фосфодиэстразу выделяют из лизированных бактериальных клеток методом аффинной адсорбции на парамагнитных частицах, покрытых нейтравидином, используя в качестве промежуточного аффинного лиганда биотинилированные антитела или иные аффинные молекулы (например, аптамеры), специфичные к некаталитическим доменам фосфодиэстеразы. Полученные иммобилизованные иммунные комплексы фосфодиэстеразы-мишени с антителами отмывают от несвязавшихся и низкоаффинных примесей и проводят аффинную очистку комплексов, сформированных мишенью и биотинилированными антителами методом магнитной сепарации за счет связывания биотинилированных антител с парамагнитными частицами, покрытыми нейтравидином или его аналогами, связывающими биотин.
Микрочастицы с иммобилизованной фосфодиэстеразой помещают в раствор, содержащий избыток c-di-GMP в форме G-квадруплексов, несущих флуоресцентный интеркалирующий краситель. Оценивают активность фермента на основе взаимодействия комплексов фосфодиэстераза/биотинилированное антитело, иммобилизованными на парамагнитных частицах, с комплексами, содержащими c-di-GMP в форме G-квадруплексов с интеркалированным красителем, по измерению падения флуоресценции при гидролизе c-di-GMP и разрушении флуоресцентных комплексов c-di-GMP с интеркалирующим красителем под действием фосфодиэстеразы. Концентрацию флуоресцентных комплексов рассчитывают заранее на основе кинетических параметров гидролиза c-di-GMP для фермента-мишени, полученного в рекомбинантной форме при оверпродукции в Е. coli. Качественную и количественную оценку активности фермента-мишени производят на основании сравнения полученных кривых значений падения флуоресценции комплексов c-di-GMP/интеркалирующий краситель с калибровочными кривыми значений падения флуоресценции, полученными для известных количеств идентичной исследуемой мишени рекомбинантной фосфодиэстеразы с известной удельной активностью. Уровень фосфодиэстеразной активности, обнаруживаемый тестируемыми бактериальными штаммами, используют в качестве критерия высокой неспецифической антибиотикоустойчивости и эффективности формирования биопленок в сравнении с уровнями фосфодиэстеразной активности, выявленными для контрольных штаммов бактерий того же вида, не обладающих антибиотикоустойчивостью и способностью к формированию биопленок.
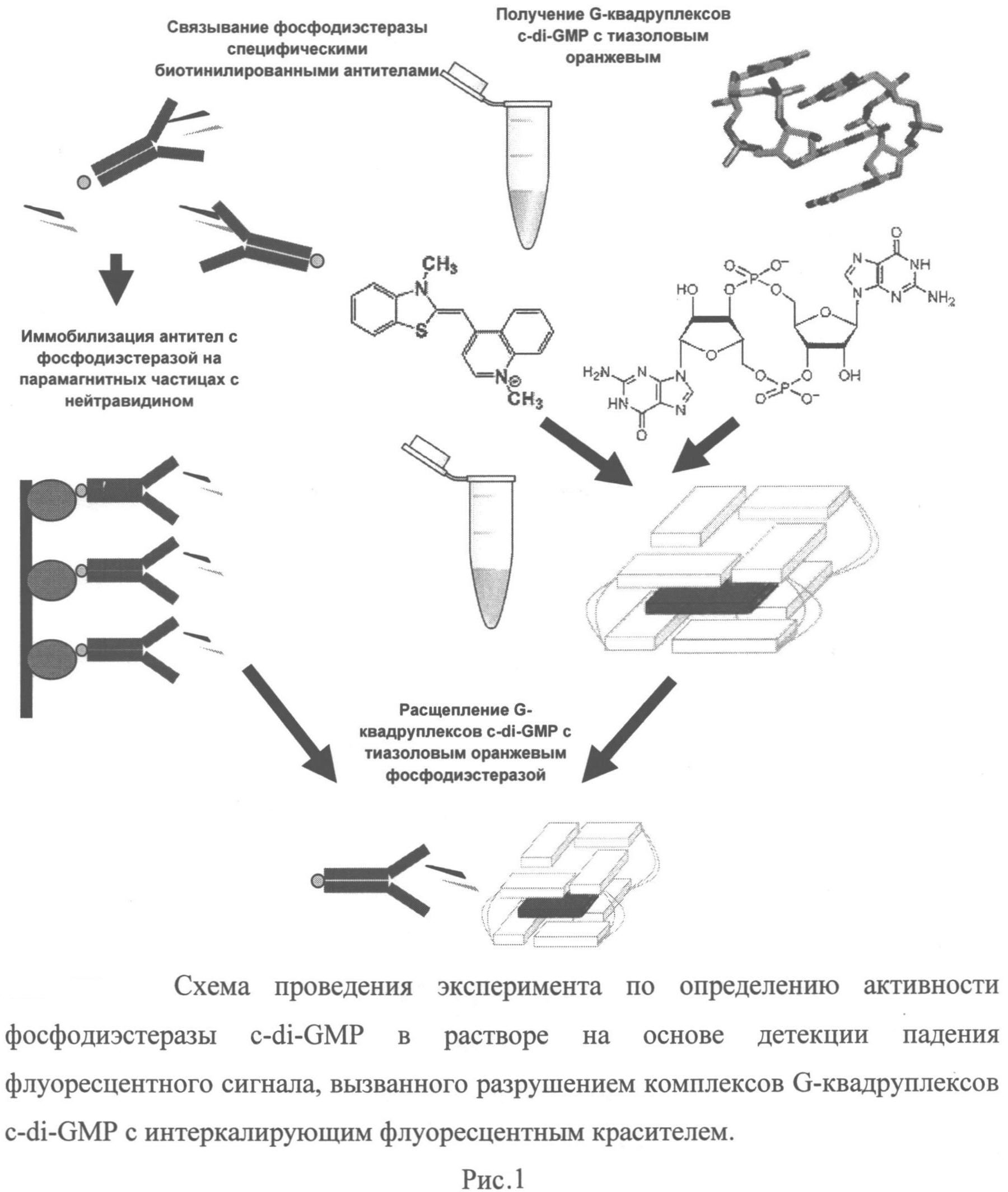
Принципиальная схема осуществления изобретения приведена на Рис.1. Изобретение иллюстрируют следующие графические материалы:
Рисунок 1. Схема проведения эксперимента по определению активности фосфодиэстеразы c-di-GMP в растворе на основе детекции падения флуоресцентного сигнала, вызванного разрушением комплексов G-квадруплексов c-di-GMP с интеркалирующим флуоресцентным красителем.
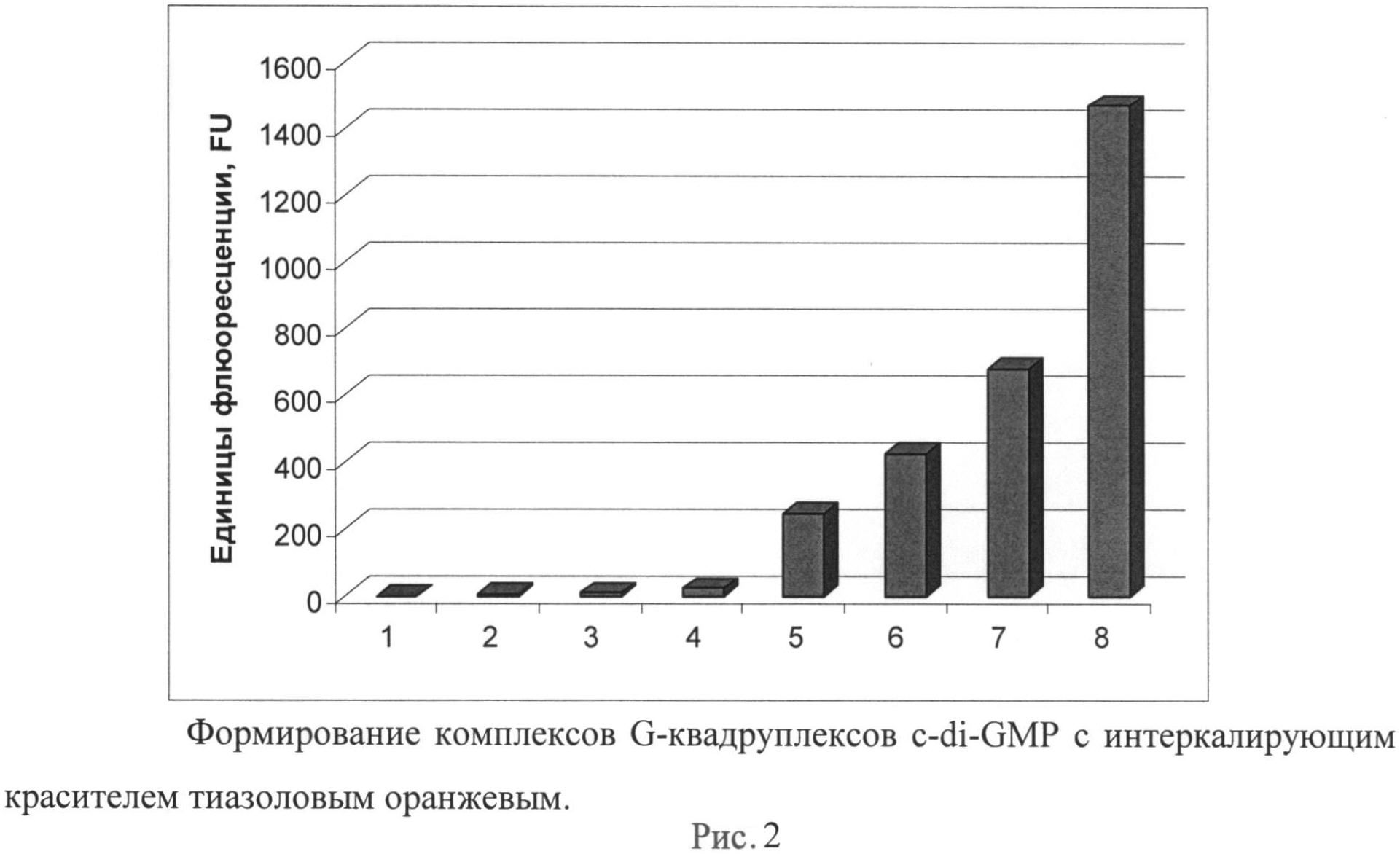
Рисунок 2. Формирование комплексов G-квадруплексов c-di-GMP с интеркалирующим красителем тиазоловым оранжевым.
На рисунке представлено увеличение интенсивности флуоресценции при добавлении различных концентраций c-di-GMP к тиазоловому оранжевому (30 мкм) в буфере, содержащем 1 М хлорида натрия и 20 мМ трис-HCl pH 7,5. Измерения проводились на приборе Varioskan Flash (Thermo, США) при соотношении длин волн возбуждения/детекции 507/535 нм. По оси X представлена концентрация c-di-GMP: 1-0 мкМ, 2-1 мкМ, 3-2 мкМ, 4-5 мкМ, 5-10 мкМ, 6-15 мкМ, 7-20 мкМ, 8-30 мкМ.
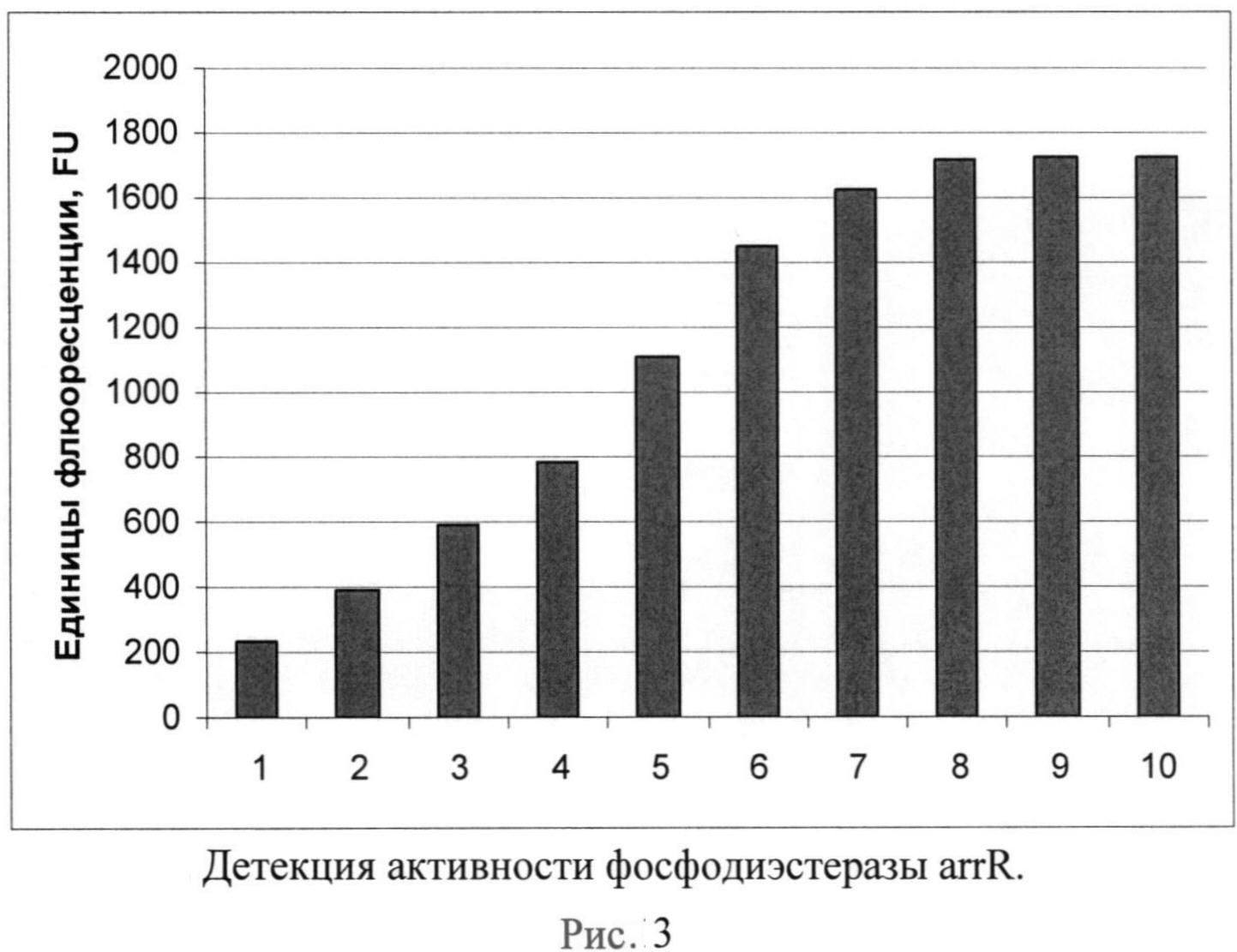
Рисунок 3. Детекция активности фосфодиэстеразы arrR. Детекция активности фосфодиэстеразы arrR проводилась в растворе, содержащем 20 мМ трис-HCl, 300 мМ хлорида калия, 3 мМ хлорида магния, 30 мкМ комплексов тиазолового оранжевого с c-di-GMP. По оси X приведены различные концентрации фосфодиэстеразы arrR (нг/мл): 1-10, 2-4, 3-2, 4-1,5-0,4, 6-0,2, 7-0,1, 8-0,04, 9-0,02, 10-0.
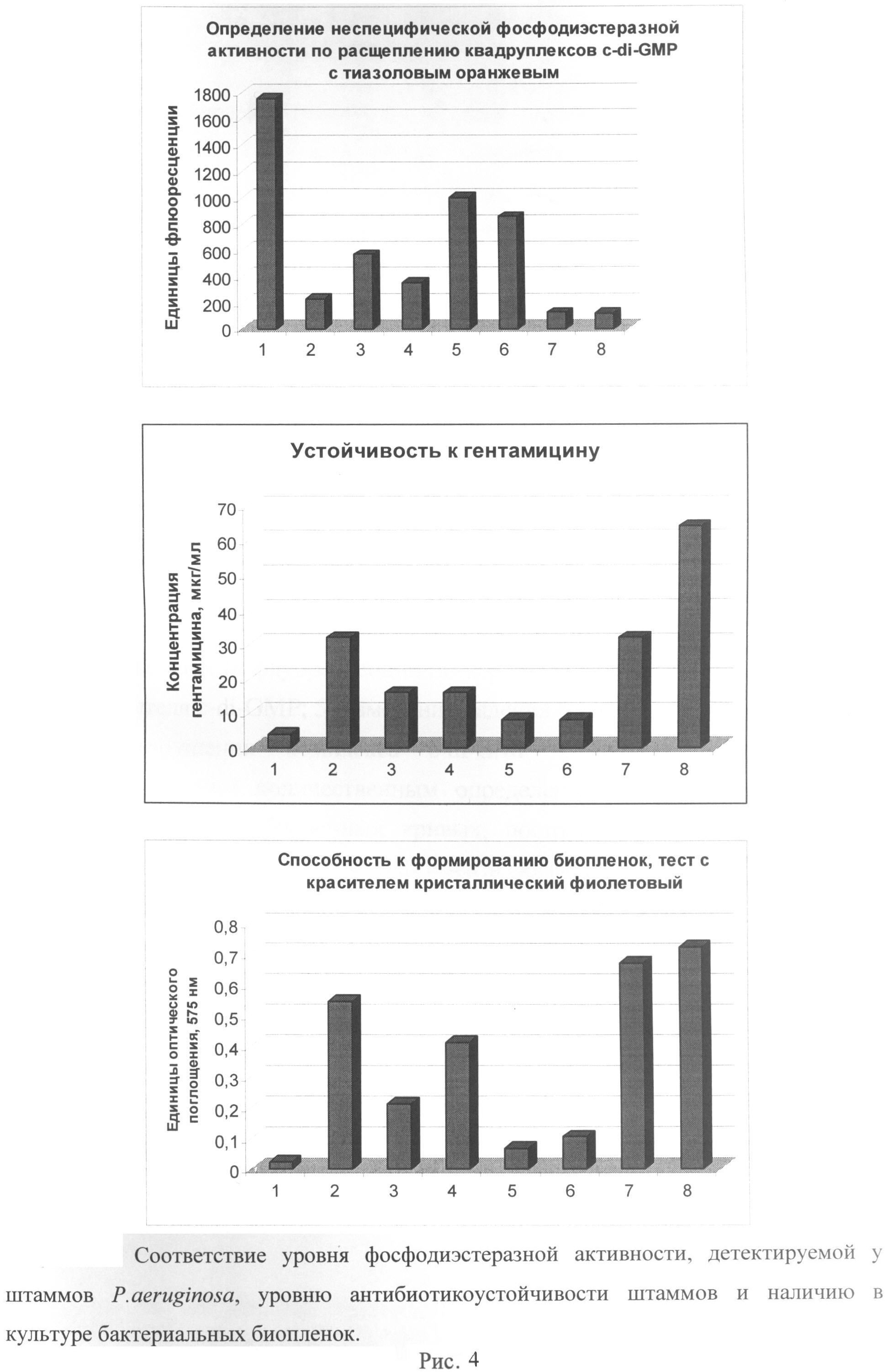
Рисунок 4. Сравнение уровня фосфодиэстеразной активности, детектируемой у штаммов P.aeruginosa, уровня антибиотикоустойчивости штаммов и наличия в культуре бактериальных биопленок. Все бактериальные культуры выращивались в жидкой среде в стандартных условиях в течение 12 часов.
По оси Х на рисунках представлены: 1 - бактерии P. aeruginosa штамма АТСС 27853, выращенные без добавления антибиотиков; 2 - бактерии P. aeruginosa штамма АТСС 27853, выращенные в присутствии 8 мкг/мл гентамицина; 3 - бактерии P. aeruginosa, полученные от лабораторных животных, инфицированных различными клиническими изолятами патогена.
Изобретение иллюстрируют примеры.
Пример 1. Подготовка тестируемых образцов фосфодиэстеразы arrR патогенного микроорганизма Р. aeruginosa.
Клетки патогена, полученные от модельных животных, хронически инфицированных Р. aeruginosa (Anderson GG, Moreau-Marquis S, Stanton BA, O'Toole GA (2008) Infect Immun, 76, 1423-1433) и клетки P. aeruginosa (штамм АТСС 27853) выращивают в течении 12 часов при 37°C в жидкой культуре на триптиказо-соевом бульоне без добавления антибиотиков и в присутствии 8 мкг/мл антибиотика гентамицина и определяют концентрацию жизнеспособных бактерий высевом на твердую среду.
Выращенные бактерии отмывают двукратным центрифугированием в фосфатно-солевом буфере pH 7,3. Отмытые клетки лизируют составом B-PER (Thermo Pierce, США), используя инструкции производителя с добавлением ДНКазного коктейля (Roche, США) для снижения вязкости раствора. Лизат осветляют центрифугированием, и либо используют непосредственно для анализа, либо замораживают при -80°C, добавляя до 1% трегалозу и до 10% глицерина в качестве криопротекторов.
Пример 2. Формирование и аффинная очистка иммунных комплексов фосфодиэстеразы arrR с биотинилированными антителами на парамагнитных частицах с нейтравидином для измерения гидролитической активности по отношению к c-di-GMP.
К солюбилизированному белковому препарату, полученному из клеток Р. aeruginosa PAO1 добавляют 100 мкг/мл биотинилированного поликлонального кроличьего антитела к экстрамембранному домену arrR (Gotoh H, Zhang Y, Dallo SF, Hong S, Kasaraneni N, Weitao. T (2008) Res Microbiol, 159, 294-302). После инкубации в течение 2 часов к лизату добавляют 100 мкл суспензии парамагнитных частиц, нагруженных нейтравидином (Thermo Pierce, США), и инкубируют в течение 30 мин при встряхивании. По окончании инкубации смесь 10 раз отмывают фосфатно-солевым буфером pH 7,3 (2 мл), содержащим 20 мкг/мл ацетилированного бычьего сывороточного альбумина, не содержащего протеазной или нуклеазной активности, и 0,05% Тритон X-100, необходимого для поддержания трансмембранного домена arrR в солюбилизированном состоянии.
Отмытые микросферы, содержащие иммунный комплекс arrR, смешивают с раствором.
Пример 3. Получение комплексов G-квадруплексов c-di-GMP с интеркалирующим красителем для измерения активности фосфодиэстеразы.
Циклический динуклеотид в концентрации 50 мкм (2-кратное превышение минимального избытка субстрата, рассчитанного для arrR) смешивают с буфером, содержащим 300 мМ хлорида калия, 10 мМ фосфата калия pH 7,5. Смесь нагревают до 95°C в течение 10 минут и медленно охлаждают до комнатной температуры (30 минут, принудительное охлаждение в программируемом термостате), затем добавляют тиазоловый оранжевый до концентрации 300 мкм. Полученную смесь инкубируют при температуре +4°C в течение ночи. Полноту формирования комплексов определяют флуориметрически на основании стандартных калибровочных кривых. Значения молярной экстинкции для c-di-GMP и красителя принимают равными 21600 и 63000 М-1 см-1, соответственно.
Пример 4. Определение фосфодиэстеразной активности arrR по расщеплению комплексов G-квадруплексов c-di-GMP с интеркалирующим красителем.
Для определения фосфодиэстеразной активности arrR парамагнитные микрочастицы, покрытые нейтравидином с иммобилизованными комплексами фосфодиэстераза arrR/биотинилированное антитело, титруют в микропланшете для флуоресцентных измерений в разведениях 1:2, 1:5, 1:10, 1:50, 1:100, 1:500, 1:1000. Оттитрованные микрочастицы отделяют от буфера при помощи магнита и к микрочастицам с иммобилизованной фосфодиэстеразой добавляют комплексы G-квадруплексов c-di-GMP с интеркалирующим красителем. Микропланшет инкубируют в камере сканирующего флуориметра 2 часа при 37°C, проводя измерение флуоресценции. Длина волны возбуждения при измерении составляет 508 нм, измерение флуоресценции - интегральное в диапазоне 518-700 нм. Полученные данные сравнивают со значениями падения флуоресценции, измеренными за то же время с известными количествами рекомбинантной фосфодиэстеразы arrR, взятой в серии концентраций, соответствующих разведениям раствора с концентрацией 20 нг/мл 1:2, 1:5, 1:10, 1:20, 1:50, 1:100, 1:200, 1:500, 1:1000. Чувствительность метода определения фосфодиэстеразной активности на основании контрольных измерений составляет 50 пг/мл. Активность фосфодиэстеразы в положительном контрольном образце, полученном на основе лизата бактерий P. aeruginosa штамма АТСС 27853, выращенного без антибиотиков, соответствует активности рекомбинантного фермента arrR, взятом в концентрации 200 пг/мл, а выращенного в присутствии гентамицина - 2 нг/мл. Активность фосфодиэстеразы в образцах, полученных от модельных животных, хронически инфицированных Р. aeruginosa, соответствует активности фермента arrR в концентрации 100 пг - 4 нг/мл.
Пример 5. Определение антибиотикоустойчивости тестируемых бактерий и факта присутствия бактериальных биопленок в бактериальных культурах
Используя выращенные 12-часовые культуры, определяют антибиотикоустойчивость бактерий P. aeruginosa (штамм АТСС 27853 и бактерии, полученные от модельных животных) высевом на триптиказо-соевый агар, содержащий различные концентрации аминогликозидного антибиотика гентамицина (4, 8, 16, 32 и 64 мкг/мл антибиотика). Для культуры штамма P. aeruginosa АТСС 27853, выращенной в отсутствие гентамицина, устойчивость к антибиотику составляет 4 мкг/мл, а для культуры того же штамма, выращенного с добавлением гентамицина, устойчивость к антибиотику составляет 32 мкг/мл. Бактериальные культуры, полученные от инфицированных животных, обладают устойчивостью к гентамицину в концентрации 4-64 мг/мл в соответствии с детектированным уровнем активности фосфодиэстеразы arrR.
Формирование биопленок в 12-часовых культурах P. aeruginosa детектируют микроскопически и оценивают по результатам спектрофотометрических измерений бактериальной суспензии (λ=575 нм), окрашенной в течение 15 минут 1% раствором кристаллического фиолетового с последующей промывкой и солюбилизацией красителя в 96% этаноле, и по количеству жизнеспособных клеток, выявленных методом титрования на чашках. Культура штамма P. aeruginosa АТСС 27853, выращенная в течение 12 часов в отсутствие гентамицина, характеризуется более низкими показателями жизнеспособности, чем культура того же штамма, выращенного с добавлением гентамицина, что говорит об эффективном формировании биопленки бактериями в присутствии антибиотика. Бактериальные культуры, полученные от инфицированных животных, обнаруживают эффективность формирования биопленок, повышающуюся в соответствии с детектированным уровнем активности фосфодиэстеразы arrR.
Способ определения неспецифической устойчивости патогенных микроорганизмов к антибиотикам и факта присутствия бактериальных биопленок на основании измерения каталитической активности фосфодиэстераз, расщепляющих циклический дигуанозинмонофосфат, с пороговой чувствительностью 50 пг/мл, включающий:1) выделение фосфодиэстеразы-мишени из лизированных бактериальных клеток;2) связывание фосфодиэстеразы биотинилированными антителами, специфичными к некаталитическим доменам фосфодиэстеразы;3) аффинную очистку комплексов, сформированных фосфодиэстеразой-мишенью и биотинилированным антителом при помощи парамагнитных частиц, содержащих нейтравидин или его аналоги, связывающие биотин;4) взаимодействие комплексов фосфодиэстераза/биотинилированное антитело, иммобилизованных на парамагнитных частицах, с комплексами, содержащими с-di-GMP в форме G-квадруплексов с интеркалированным красителем, сопровождающееся падением интенсивности флуоресценции по мере разрушения комплексов интеркалирующего красителя c-di-GMP;5) измерение падения флуоресценции при гидролизе c-di-GMP и разрушении комплекса c-di-GMP с интеркалирующим красителем с последующим количественным определением активности фосфодиэстеразы на основании калибровочных кривых, построенных с использованием известных количеств рекомбинантного фермента фосфодиэстеразы, идентичного исследуемой мишени;6) выявление повышенного уровня фосфодиэстеразной активности, обнаруживаемого тестируемыми антибиотикоустойчивыми бактериальными штаммами, способными к формированию биопленок, по сравнению с уровнем фосфодиэстеразной активности, обнаруживаемым для контрольных штаммов бактерий того же вида, не обладающих антибиотикоустойчивостью и способностью к формированию биопленок.