Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ ОПТИМАЛЬНЫХ ПАРАМЕТРОВ РАСТВОРЕНИЯ ОКСИДОВ ПЕРЕХОДНЫХ МЕТАЛЛОВ В РАСТВОРАХ, СОДЕРЖАЩИХ КОМПЛЕКСООБРАЗУЮЩИЙ АГЕНТ
Вид РИД
Изобретение
Изобретение относится к атомной энергетике и может быть использовано для определения оптимальных параметров растворения оксидов переходных металлов в растворах комплексообразующих агентов, применяемых при химических отмывках и дезактивациях контуров ядерных энергетических установок (ЯЭУ).
Эксплуатация ЯЭУ сопровождается накоплением на внутренних поверхностях первых контуров радиоактивных отложений (РО) смешанных оксидов переходных металлов (ПМ), включающих незначительные количества радиоактивных изотопов катионов ПМ - радионуклидов: 51Cr3+, 54Mn2+, 59Fe2+, 59Fe3+, 58Co2+, 60Co2+, 63Ni2+ и др. Катионы металлов, количественно определяющие состав оксидов (Fe, Ni, Cr), являются основными элементами конструкционных материалов (КМ). Другие элементы являются легирующими добавками в сталях. Накопление РО приводит к снижению тепло-гидравлических параметров установок, коррозионным нарушениям элементов оборудования, ухудшению радиационной обстановки.
Для удаления РО применяют химические технологии отмывки и дезактивации с использованием растворов, включающих реагенты, которые эффективно переводят в растворенное состояние оксиды ПМ, образуют устойчивые растворимые соединения с катионами металлов, радионуклидов и не оказывают значительных коррозионных воздействий на КМ/М. Пик, М. Сегал. Химическая дезактивация водо-водяных реакторов в Великобритании. - Атомная техника за рубежом.: 1984, №12, стр.26-36/.
Основное количество РО из контуров ЯЭУ удаляется при воздействии на оксиды растворов кислотных агентов (минеральных, органических, комплексообразующих кислот). Известны преимущества комплексообразующих агентов (комплексонов) перед минеральными и органическими кислотами. Если для последних характерна более высокая скорость растворения оксидов, то комплексоны образуют с катионами ПМ значительно более устойчивые растворимые соединения (комплексонаты), что снижает вероятность обратного осаждения металлов и радионуклидов из растворов на поверхности КМ. Показателями, характеризующими устойчивость соединений катионов металлов (Me) с анионами или лигандами (L) кислот в растворах, являются величины констант нестойкости (pK), определяемые отрицательными десятичными логарифмами отношения произведения концентраций ионов металлов [Me] и лигандов [L] в растворах к концентрации образующихся в растворах соединений [MeL].
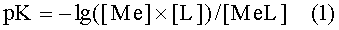
Чем больше величина pK, тем устойчивее в растворах соединения MeL /Н.И. Ампелогова, Ю.М. Симановский, А.А. Трапезников. Дезактивация в ядерной энергетике. - М.: Энергоиздат, 1982 г., стр.123-130, табл.9.5 стр.126/. Устойчивость («прочность») соединений лигандов комплексообразующих агентов с катионами ПМ зависит от значений pH растворов, состава растворов, наличия в них кроме комплексонов других реагентов, например, восстановителей, органических кислот и т.д.
Также к отличительным показателям растворов комплексонов относят их «емкость» по катионам ПМ или максимальные концентрации катионов металлов, достигаемые и удерживаемые в растворах при растворении оксидов ПМ. Установлена общая закономерность - чем больше величины pK комплексонатов, а значит соединения [MeL] наиболее устойчивы, тем выше достигаемые концентрации катионов ПМ в растворах /Т.Х. Маргулова. Химические очистки теплоэнергетического оборудования. - М.: «Энергия», 1969 г., стр.38-40/, /Н.М. Дятлова, В.Я. Темкина, К.И. Попов. Комплексоны и комплексонаты металлов. - М.: «Химия», 1988 г., стр.99-105, 456-458/. Для монорастворов комплексонов, применяемых с целью растворения оксидов ПМ, например, наиболее известных этилендиаминтетрауксусной кислоты (ЭДТА) и ее двух-замещенной натриевой соли - Трилона Б, определены зависимости изменения величин рК комплексонатов катионов переходных металлов от величин pH растворов. Наиболее устойчивые соединения ЭДТА с катионом Fe3+ образуются в области pH растворов ~1.5÷2.0. Для катиона Fe2+ максимальным значениям констант нестойкости комплексных соединений в монорастворах ЭДТА отвечает значение pH ~5.0. При соблюдении отмеченных областей pH, оптимальных для растворения оксидов железа в монорастворах ЭДТА и Трилона Б, в растворах достигаются наиболее высокие концентрации катионов Fe3+, Fe2+. Данные катионы ПМ количественно определяют элементный состав гематита (Fe2O3) и магнетита (Fe3O4) - оксидов железа, которые образуются в контурах ЯЭУ с водным теплоносителем. В случае отклонений величин pH монорастворов комплексонов от оптимальных значений устойчивость соединений [MeL] снижается, что приводит к уменьшению концентраций ПМ. Растворение оксидов железа в монорастворах ЭДТА и Трилона Б сопровождается смещением величин pH растворов из кислых областей в щелочные, в которых прочность комплексонатов катионов железа ниже. При некотором значении pH комплексование вообще прекращается, величина pH и концентрация комплексона, железа в растворах стабилизируется. Такой раствор приходится сбрасывать, хотя в нем еще достаточно свободного комплексона /Т.Х. Маргулова. Химические очистки теплоэнергетического оборудования. - М.: «Энергия», 1969 г., стр.38-40/. Таким образом, определение аутентичных оптимальных параметров растворения оксидов ПМ, а именно, диапазонов pH растворов, содержащих комплексообразующие агенты, при которых комплексоны образуют наиболее устойчивые соединения с катионами переходных металлов, а «емкость» растворов комплексонов по ПМ используется в наибольшей мере, оказывает существенное влияние на конечные результаты работ по отмывке и дезактивации контуров ЯЭУ и их экономическую эффективность.
Показано, что введение в растворы комплексонов дополнительных агентов, например, восстановителей или органических кислот, приводит к улучшению показателей растворов. При вводе восстановителей, например, гидразина (N2H4), структуры оксидов железа «расшатываются» за счет протекания реакций восстановления катионов Fe3+ в Fe2+ /В.М. Седов, А.Ф. Нечаев, В.А. Доильницын, П.Г. Крутиков. Химическая технология теплоносителей ядерных энергетических установок, - М.: Энергоатомиздат, 1985 г., стр.252 табл.5, 1, стр.258/. Введение органических кислот (щавелевой - H2C2O4, лимонной - H3Cit и др.) способствует поддержанию pH растворов в оптимальных диапазонах. Это объясняют тем, что органические кислоты, обладающие более высокой скоростью растворения оксидов, после перевода элементов оксидов в раствор «передают» катионы ПМ комплексообразующим агентам, соединения которых с металлами прочнее. Освобожденная (регенерированная) органическая кислота поддерживает pH растворов в оптимальной кислотной области и вновь вступает в реакцию растворения оксидов /Т.Х. Маргулова. Применение комплексонов в теплоэнергетике. - М.: Энергоатомиздат, 1986 г., стр.147/, /Н.М. Дятлова, В.Я. Темкина, К.И. Попов. Комплексоны и комплексонаты металлов. - М.: Химия, 1988 г., стр.461/. Дополнительно ввод органических кислот обеспечивает «синергетические» эффекты, проявляющиеся в нестехиометрическом увеличении концентраций ПМ в растворах. Установлено, что для образующихся в этих растворах сложных молекул - ассоциатов - с участием катионов металлов и лигандов комплексообразующих и органических кислот стехиометрические соотношения не могут определяться по правилу аддитивности /Т.Х. Маргулова. Применение комплексонов в теплоэнергетике, - М.: Энергоатоиздат, 1986 г., стр.147-148/. Эффекты связывают с изменениями устойчивости комплексонатов металлов в растворах в присутствии других реагентов /Н.М. Дятлова, В.Я. Темкина, К.И. Попов. Комплексоны и комплексонаты металлов. - М.: «Химия», 1988 г., стр.100-101, 104/.
Определение констант нестойкости комплексонатов ПМ, взаимосвязи строения комплексных соединений с реакционной способностью комплексообразующих агентов с катионами ПМ является одной из важнейших задач химии координационных соединений. Рассчитать и определить константы нестойкости в растворах комплексонов, содержащих дополнительные реагенты, сложно. Величины pK соединений в присутствии конкурирующих лигандов могут, как уменьшаться, так и увеличиваться /М.И. Булатов. Расчеты равновесий в аналитической химии. - Ленинград.: «Химия», 1984 г., стр.100-105/. Несмотря на резко возросшую за период с середины 40-х годов прошлого столетия до настоящего времени точность измерительной аппаратуры, на совершенствование методов обработки экспериментальных результатов, величины pK, полученные группами исследователей для одних и тех же комплексонов и катионов ПМ при одинаковых условиях эксперимента, часто значительно отличаются. Примером могут служить значения констант нестойкости, полученные для этилендиаминтетраацетата Cr3+, a именно, 23,0 и 12,8, разница между которыми составляет 10 порядков (1010). Причина, как правило, заключается в систематических ошибках, выявить источник которых далеко не всегда возможно. Актуальность проблем определения pK, связанных с систематическими погрешностями, сохраняется и в настоящее время /Н.М. Дятлова, В.Я. Темкина, К.И. Попов. Комплексоны и комплексонаты металлов. - М.: «Химия», 1988 г., стр.99-105/.
Накоплен значительный опыт отмывки и дезактивации контуров ЯЭУ, разработано большое количество составов (рецептур) растворов для растворения оксидов переходных металлов, но их совершенствование продолжается. Концентрации ПМ, достигаемые в растворах комплексообразующих агентов, также как и устойчивость комплексных соединений с катионами металлов, в значительной степени зависят от величин pH и химического состава растворов, концентрационных соотношений реагентов. Оценка их влияния, особенно для растворов сложного химического состава, включающих наряду с комплексонами другие агенты, невозможна без постановки опытов по растворению оксидов в лабораторных условиях. До сих пор преимущества тех или иных рецептур подтверждают результатами экспериментальных исследований по растворению оксидов ПМ, включающих измерения физико-химических показателей растворов. Известны работы по определению оптимальных параметров растворения оксидов железа в растворах, содержащих Трилон Б и другие реагенты, а именно, органические кислоты. Определяли соотношения Трилона Б и лимонной кислоты, Трилона Б и малеинового ангидрида, при которых в растворах достигаются наиболее высокие концентрации переходного металла - железа. Растворяли навески оксидов в ряде растворов с заданными концентрациями и соотношениями реагентов. Измеряли конечные концентрации железа (CFe). По результатам измерений строили графические зависимости CFe от соотношения реагентов в растворах. Определили, что максимальная концентрация Fe3+ в растворах достигается при соотношении реагентов (комплексона и органической кислоты) 1:1. В тоже время отметили, что для решения вопроса о необходимости введения в данные рецептуры восстановителей необходимо проведение дальнейших исследований, так как результаты работ, полученные по приведенной методике установления оптимальных параметров растворения оксидов ПМ, не однозначны /Т.Х. Маргулова. Химические очистки теплоэнергетического оборудования, М., Энергия, 1969 г., стр.174-175).
Неоднозначность трактовки результатов экспериментальных измерений указанных выше физико-химических показателей растворов для определения оптимальных условий растворения оксидов ПМ подтверждается литературными данными, из которых следует различие и противоречивость рекомендуемых параметров использования растворов, содержащих один и тот же комплексен, для одних и тех же целей. Например, для растворения оксидов железа в мировой практике применяют следующие рецептуры, основными действующими агентами которых являются ЭДТА и Трилон Б:
- с содержанием реагентов в % от их общей концентрации в растворах:
- 5 ЭДТА + 95 сульфаминовой кислоты (Великобритания);
- 20 ЭДТА + 60 H3Cit + 20 моноэтаноламина (Франция);
- 40 ЭДТА + 30 H3Cit + 30 H2C2O4 при pH=2.5÷3.0, ∑Сагентов=1÷2.5 г/л (Канада);
- с содержанием реагентов в растворах в % весовых:
- 0.3 Трилона Б + 0.15 H3Cit + 0.05 NH2OH (гидроксиламин) (Россия);
- 0.3 ЭДТА + 0.1 H3Cit при pHнач.=3.0 (Россия);
- 0.23 Трилона Б + 0.11 H3Cit при pH=3.6÷4.7 (Россия);
- 0.72 ЭДТА + 0.52 H3Cit + 0.002 N2H4 при pH=3.5 (Германия);
- 10 ЭДТА + NH4OH (аммиак) до pH=6.0+1 N2H4 (США)
/Т.Х. Маргулова. Химические очистки теплоэнергетического оборудования, М., Энергия, 1969 г., стр.165/, /Т.Х. Маргулова. Применение комплексонов в теплоэнергетике, М., Энергоатомиздат, 1986 г., стр.209/, /А.Ф. Седов, А.Ф. Нечаев, В.А. Доильницын и др. Химическая технология теплоносителей ядерных энергетических установок, М.: Энергоатомиздат, 1985 г., стр.262-263, табл.5.2/, /Т.Х. Маргулова, О.И. Мартынова. Водные режимы тепловых и атомных электростанций, - М.: «Высшая школа», 1987 г., стр.297/, /Н.И. Ампелогова, Ю.М. Симановский, А.А. Трапезников. Дезактивация в ядерной энергетике, - М.: Энергоиздат, 1982 г., стр.185, табл.11.1/, /М. Йовчев. Коррозия теплоэнергетического и ядерно-энергетического оборудования, М.: Энергоатомиздат, 1988, стр.159/.
Известны исследования по определению оптимальных параметров растворения оксидов железа в растворах, одновременно содержащих оксиэтилидендифосфоновую кислоту (ОЭДФ) и Трилон Б, включающие экспериментальные измерения физико-химических показателей растворов при разных заданных концентрациях реагентов. В качестве показателей использовали концентрации железа (CFe), максимально достигаемые при растворении оксидов, начальные и конечные величины pH растворов (pHнач., pHкон., соответственно). Строили графические зависимости показателей. На основании графических зависимостей CFe от pHнач. и pHкон. растворов установили, что максимальная железо - емкость в растворах 2.5 г/л ОЭДФ + 2.5 г/л Трилона Б достигается в области начальных значений pH растворов от 2.0 до 2.5 и конечных в диапазоне от 3.0 до 3.5 /Т.Х. Маргулова. Применение комплексонов в теплоэнергетике, М., Энергоатомиздат, 1986 г., стр.255/.
Данный способ определения оптимальных параметров растворения оксидов переходных металлов в растворах, содержащих комплексообразующий агент, является наиболее близким к заявляемому и принят за прототип.
Недостатки способа-прототипа заключаются в следующем.
1. Достоверность определения оптимальных параметров процессов растворения оксидов ПМ в растворах, содержащих комплексообразующий агент, на основании измерения таких показателей растворов, как CMe, pHнач. и pHкон., не достаточна, так как данные параметры не позволяют определять аутентичные величины pH растворов, при которых комплексные соединения с катионами переходных металлов в растворах наиболее устойчивы, соблюдение которых позволяет достигать максимальных концентраций катионов металлов в растворах и которые, соответственно, необходимо поддерживать непосредственно в процессе растворения оксидов.
2. При использовании способа-прототипа необходимо проведение большого количества химических анализов по определению весовых концентраций катионов переходных металлов в растворах, содержащих комплексообразующий агент.
Определение концентраций ПМ в растворах комплексообразующих агентов является отдельной задачей аналитической химии. Устойчивость комплексных соединений приводит к «маскировке» катионов металлов в растворах, осложняет использование традиционных методик. Это вызывает необходимость разработки оригинальных способов анализа, адаптированных к конкретным рецептурам, либо использования других методов, например, метода атомно-абсорбционного анализа /И. Хавезов, Д. Цалев. Атомно-абсорбционный анализ, - Л.: «Химия», 1983 г., стр.86-105/ или оптической эмиссионной спектроскопии с индуктивно-связанной плазмой /М. Томпсон, Д.Н. Уолш. Руководство по спектрометрическому анализу с индуктивно-связанной плазмой, - М.: «Недра», 1988 г., стр.9-11/, что требует применения дорогостоящего оборудования и привлечения высококвалифицированных специалистов.
Задачей настоящего изобретения является создание способа определения оптимальных параметров растворения оксидов переходных металлов в растворах, содержащих комплексообразующий агент, позволяющего:
- повысить достоверность определения оптимальных параметров растворения оксидов переходных металлов, а именно, величин pH растворов, при которых комплексные соединения с катионами переходных металлов, количественно определяющими элементный состав оксидов, наиболее устойчивы, в растворах достигаются максимальные концентрации катионов металлов, и которые (параметры) необходимо поддерживать непосредственно в процессе растворения оксидов ПМ;
- полностью исключить или свести к минимуму химические анализы растворов, содержащих комплексообразующие агенты, по определению весовых концентраций катионов переходных металлов.
Для решения поставленной задачи и достижения указанных технических результатов в способе определения оптимальных параметров растворения оксидов переходных металлов в растворах, содержащих комплексообразующий агент, включающем экспериментальные измерения физико-химических показателей растворов, в том числе величин pH растворов, построение графических зависимостей показателей от величин pH растворов, согласно изобретению, предлагается:
- в качестве показателей использовать объемные коэффициенты распределения радиоактивных изотопов переходных металлов, определяющих состав оксидов, между сильноосновным анионитом в форме комплексообразующего агента и растворами этого комплексообразующего агента и равновесные величины pH растворов, для чего в исследуемые растворы вносить радиоактивные изотопы переходных металлов, затем в фиксированные объемы растворов с заданными концентрациями реагентов, активностями изотопов переходных металлов и начальными величинами pH растворов вносить фиксированные объемы анионита в форме комплексообразующего агента, измерять величины радиоактивности изотопов переходных металлов в растворах до и после установления ионообменного равновесия между растворами и анионитом в форме комплексообразующего агента и равновесные величины pH растворов, по результатам измерений активности растворов рассчитывать величины объемных коэффициентов распределения радиоактивных изотопов переходных металлов между растворами и анионитом в форме комплексообразующего агента, а выбор оптимальных параметров растворения оксидов переходных металлов производить из графической зависимости изменения величин объемных коэффициентов распределения радиоактивных изотопов переходных металлов от равновесных величин pH растворов, для чего определять диапазоны равновесных величин pH, отвечающие максимальным величинам объемных коэффициентов распределения радиоактивных изотопов переходных металлов;
- время установления ионообменного равновесия радиоактивных изотопов переходных металлов между анионитом в форме комплексообразующего агента и растворами этого комплексообразующего агента определять по стабилизации активности растворов по изотопам переходных металлов.
Известно использование объемных коэффициентов распределения (Кр) катионов металлов между растворами и различными сорбентами, ионитами в качестве показателей, характеризующих селективность (сродство) сорбционных материалов к катионам металлов в растворах разного состава. Величины коэффициентов распределения катионов металлов между растворами и сорбентами, зависимости Кр от параметров растворов, а именно, концентраций и соотношений реагентов в растворах, величин pH, применяют при обосновании и прогнозировании возможностей осуществления сорбционных процессов, включающих разделение и концентрирование металлов, например, при разделениях катионов металлов из растворов в аналитической химии, в радиохимии, при очистке водных теплоносителей ЯЭУ, жидких радиоактивных отходов и т.д. /И.К. Цитович. Курс аналитической химии. - М.: Высшая школа, 1994 г., стр.424-428/, /О. Самуэльсон. Ионообменные разделения в аналитической химии. - М.: «Химия», 1966 г., стр.288-299/, /А.С. Никифоров, В.В. Куличенко, М.И. Жихарев. Обезвреживание жидких радиоактивных отходов. - М.: Энергоатомиздат, 1985 г., стр.26-33/.
Предлагаемое использование объемных коэффициентов распределения (Кр) радиоактивных изотопов металлов, определяющих элементный состав оксидов ПМ, между растворами комплексона и анионитами в форме этого комплексона в качестве показателей для определения оптимальных параметров растворения оксидов в растворах комплексонов, а именно, оптимальных величин pH, при которых комплексные соединения с катионами металлов наиболее устойчивы, в растворах достигаются максимальные концентрации катионов металлов, и которые необходимо поддерживать непосредственно в процессе растворения оксидов, ранее не рассматривалось и не применялось.
При проведении экспериментальных исследований по определению оптимальных параметров растворения оксидов железа в растворах, содержащих в качестве комплексообразующего агента оксиэтилидендифосфоновую кислоту, авторы заявляемого способа столкнулись с явлением выпадения на поверхностях сталей перлитного класса желеобразных осадков соединений катионов Fe3+ с комплексоном в монорастворах ОЭДФ. Также было установлено, что образование осадков устраняется при введении в растворы добавок восстановителей, например, гидразина. Концентрация N2H4, с которой осадкообразование прекращается, была экспериментально определена величиной ~160 мг/л при концентрации ОЭДФ в растворе 1 г/л, что соответствует соотношению мольных концентраций реагентов 1:1. Оптимальные концентрация N2H4 и начальные величины pH растворов ОЭДФ, полученные путем измерения CMe, pHнач. растворов при растворении навесок оксидов магнетита, были определены диапазонами 0.25÷0.30 г/л и 3.5÷5.0, соответственно.
В результате проведенных работ авторами было установлено:
- в качестве показателей для определения оптимальных параметров растворения оксидов переходных металлов в растворах, содержащих комплексообразующий агент, а именно, величин pH растворов, при которых в них достигаются максимальные концентрации катионов металлов, а комплексные соединения наиболее устойчивы, могут быть использованы объемные коэффициенты распределения катионов радиоактивных изотопов ПМ, определяющих элементный состав оксидов, между растворами и сильноосновными анионитами в форме этого комплексообразующего агента и равновесные величины pH растворов;
- искомые оптимальные величины pH растворов, которые необходимо поддерживать непосредственно в процессе растворения оксидов ПМ, могут быть определены из зависимостей объемных коэффициентов распределения (Кр) радиоактивных изотопов ПМ между растворами комплексона и сильноосновными анионитами в форме этого комплексона от равновесных величин pH растворов;
- оптимальными величинами pH растворов являются равновесные величины pH, соответствующие максимальным величинам объемных Кр радиоактивных изотопов переходных металлов.
В отличие от способа-прототипа, включающего растворение навесок оксидов ПМ, экспериментальное измерение весовых концентраций катионов металлов, начальных и конечных величин pH исследуемых растворов, определение диапазонов pH, при которых концентрации ПМ максимальны, предлагаемое техническое решение не требует растворения оксидов и проведения химических анализов.
Заявляемый способ определения оптимальных параметров растворения оксидов ПМ в растворах, содержащих комплексообразующий агент, осуществляется следующим образом.
Готовят исследуемые растворы с разными начальными величинами pH (pHнач.) и заданными концентрациями комплексообразующего агента и других реагентов. В случае необходимости корректировку pHнач. от кислой области до щелочной проводят путем внесения в растворы добавок щелочей, например, аммиака. Вносят в фиксированные объемы растворов (Vраствора) радиоактивный изотоп переходного металла, количественно определяющего элементный состав оксида, например, радионуклид 59Fe в случае растворения оксидов железа, и измеряют исходную радиоактивность (Nисх) растворов.
Переводят сильноосновный анионит в форму комплексообразующего агента, определяющего состав раствора. В качестве ионитов могут быть использованы, например, гелиевый анионит марки АВ-17-8чС или «АМБЕРЛАЙТ - IRN78» в ОН--форме. Подготовку ионитов проводят известными способами в динамических или статических условиях /ГОСТ 20255.2-89. Иониты. Методы определения динамической обменной емкости/, /ГОСТ 20255.1-89. Иониты. Методы определения статической обменной емкости/. В результате получают анионит в форме комплексона - комплексит.
Вносят фиксированные объемы комплексита (Vсмолы) в фиксированные объемы исследуемых растворов (Vраствора). Выдерживают растворы и комплексит до наступления между ними ионообменного равновесия, которое определяют по стабилизации результатов измерений активности изотопов в растворах, после чего измеряют равновесные активности растворов (Nравн.) и равновесные величины pH растворов (pHравн.).
Рассчитывают объемные коэффициенты распределения (Кр) радиоактивного изотопа металла между растворами и комплекситом по формуле:
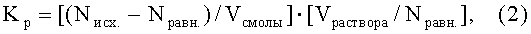
где Nисх., Nравн. - исходная и равновесная радиоактивность раствора по соответствующему изотопу, имп./мин·мл;
Vсмолы, Vраствора - объем смолы и раствора, мл.
Берут логарифмы величин объемных коэффициентов распределения (lgKp).
Строят графические зависимости величин lgKp от pHравн. растворов.
Определяют диапазоны pHравн., в которых значения lgKp максимальны.
Данные диапазоны соответствуют оптимальным параметрам растворения оксида ПМ, оптимальным величинам pH, которые необходимо поддерживать непосредственно в процессе растворения оксида и при которых достигаются максимальные концентрации металлов в растворах, а значит, соединения ПМ с комплексоном наиболее устойчивы.
Пример осуществления заявляемого способа.
Результаты эксперимента приведены в таблице 1 и иллюстрируются прилагаемыми фигурами, где:
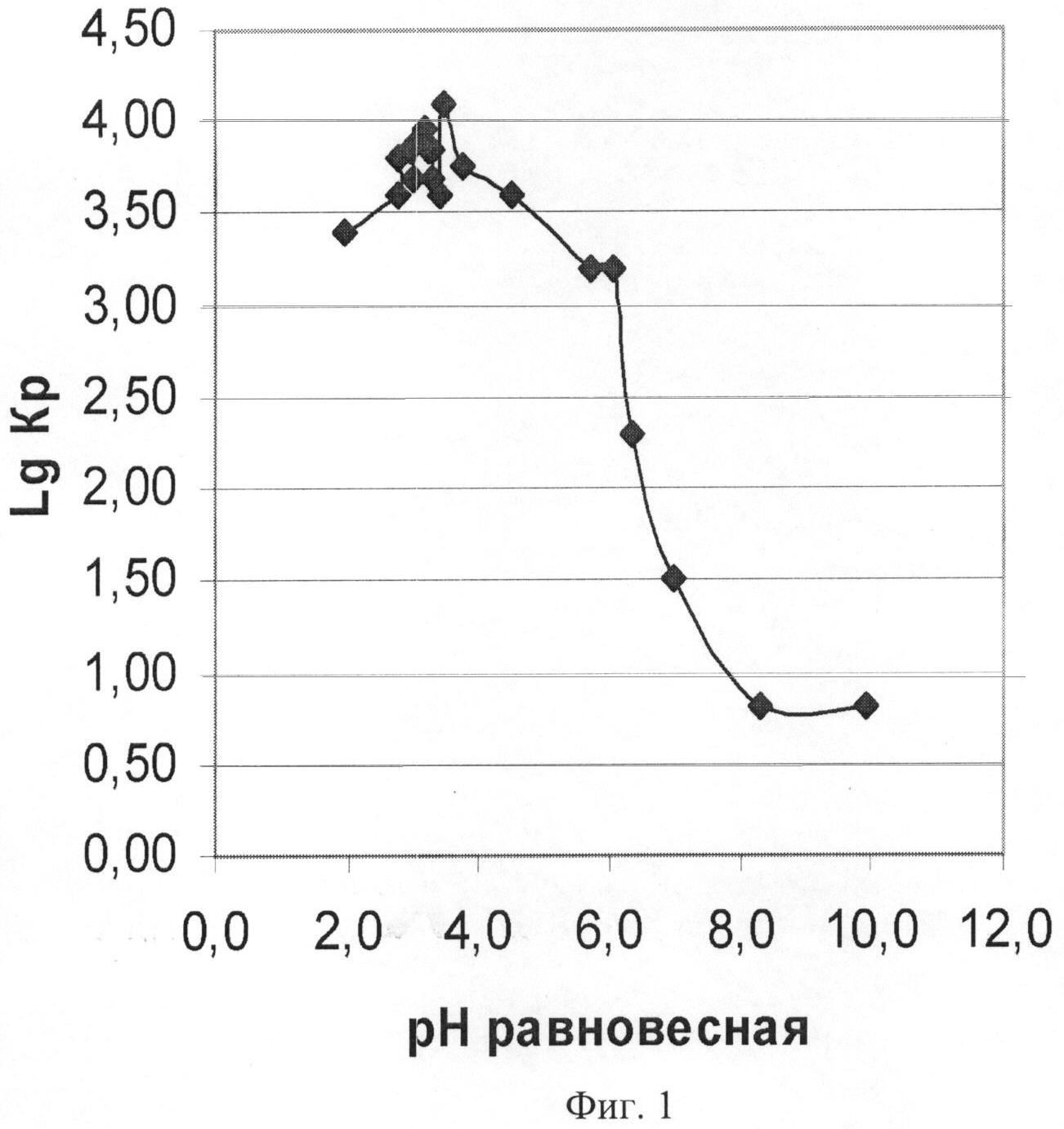
Фиг.1 - Зависимость логарифма объемного коэффициента распределения (LgKp) катиона радиоактивного изотопа 59Fe2+ на анионите АВ-17-8 чС в ОЭДФ-форме от равновесной величины pH растворов состава, г/л: 1÷5 ОЭДФ + 0.25÷1.5 N2H4 + NH4OH. Условия опытов: статика, Т=70±2°C, Vраствора=100 мл, Vсмолы=2 мл.
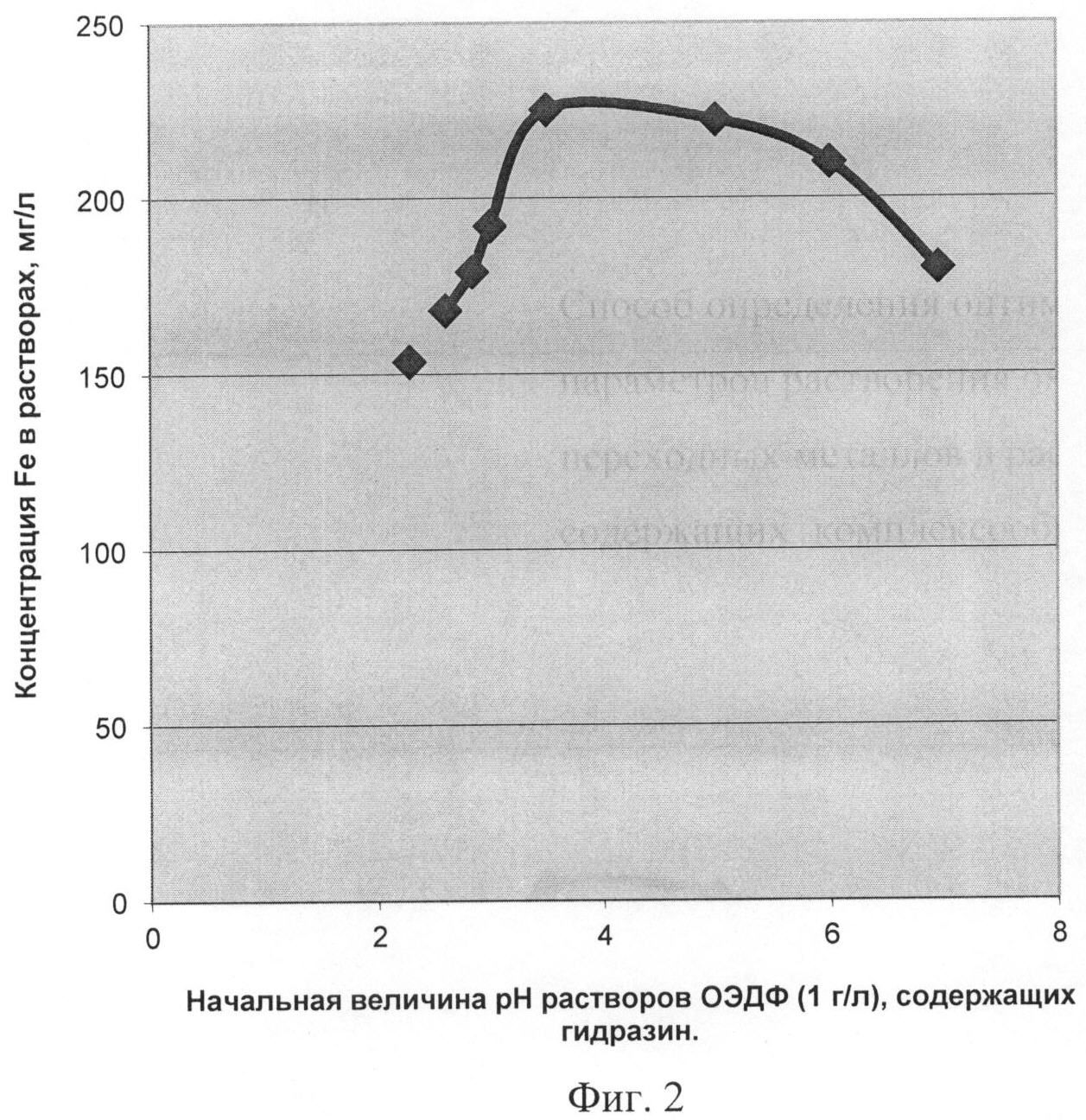
Фиг.2 - Изменение содержания железа в растворах, содержащих ОЭДФ с концентрацией 1 г/л и гидразин, при растворении магнетита (Fe3O4) в зависимости от величин pHнач. растворов, соответствующих заданным концентрациям ОЭДФ и N2H4.
Концентрация N2H4 (Сгидр.), мг/л→pHнач. растворов: Cгидр.=0→pHнач.=28; Cгидр.=50→pHнач.=2.40; Cгидр.=100→pHнач.=2.60; Cгидр.=150→pHнач.=2.85; Cгидр.=200→pHнач.=3.00; Cгидр.=250→pHнач.=3.50; Cгидр.=300→pHнач.=6.00; Cгидр.=350→pHнач.=6.95.
Условия опытов: растворение Fe2O3 при продувке растворов аргоном; отношение объема раствора к массе навески - 2:1 (на 2 см3 - 1 мг Fe3O4); температура - 70±2°C; время - 2 часа. Содержание железа в растворах определяли атомно-абсорбционным методом на спектрофотометре «Сатурн» /Спектрофотометр «Сатурн». Техническое описание и инструкция по эксплуатации. 5 Г I.550.082.ТО/.
Пример определения оптимальных параметров растворения магнетита в растворах, содержащих оксиэтилидендифосфоновую кислоту (ОЭДФ) и гидразин (N2H4).
Готовят растворы, содержащие ОЭДФ и N2H4, с заданными концентрациями реагентов и начальными величинами pH растворов. Корректировку pH проводят внесением в растворы аммиака. Замеряют начальные величины pH растворов (pHнач.).
Переводят сильноосновный анионит марки АВ-17-8 чС в ОЭДФ-форму, для чего, помещают анионит в ОН--форме в стеклянную колонку и пропускают через ионит монораствор комплексона. В фильтрате измеряют pH. Подготовку анионита завершают, когда величина pH фильтрата сравняется с величиной pH пропускаемого раствора.
Помещают фиксированные объемы (100 мл) растворов ОЭДФ + N2H4 с известными концентрациями агентов и разными величинами pHнач. в колбы.
Вносят в объемы растворов радиоактивный изотоп переходного металла, количественно определяющего элементный состав Fe3O4, а именно, радионуклид 59Fe.
Отбирают из колб аликвоты растворов (1 мл) и измеряют исходную активность растворов (Nисх.) с использованием радиометрической аппаратуры, например, бета - радиометра. Отмечают дату и время измерения.
Вносят фиксированные объемы анионита в ОЭДФ-форме (2 мл) в объемы растворов (100 мл) с разными величинами pHнач. и отмечают время приведения растворов в контакт с комплекситом.
Выдерживают растворы с комплекситом до установления ионообменного равновесия радионуклида 59Fe между ними. Для сокращения времени установления равновесия колбы с растворами помещают в термостат с температурой 70°C. Авторами было установлено, что ионообменное равновесие при ~20°C в статических условиях наступает через ~200 часов. При температуре 70°C, допускаемой для АВ-17-8чС по термостойкости, время наступления равновесия сокращается до ~10 часов.
Выдерживают комплексит в растворах не менее 10 часов.
Отбирают пробы растворов. Объем проб увеличивают с учетом ожидаемого снижения активности радионуклида в растворах в процессе их выдержки в контакте с комплекситом и оставляют объемы, достаточные для измерения pH растворов.
Измеряют равновесные (конечные) активности растворов и проводят перерасчет результатов измерений на дату и время определения исходных активностей растворов с учетом периода полураспада радионуклида, а именно, 59Fe (Nравн.).
Измеряют равновесные величины pH растворов (pHравн.).
Рассчитывают объемные коэффициенты распределения (Кр) катиона изотопа (59Fe2+) между комплекситом и растворами по формуле 2.
Берут логарифмы величин объемных коэффициентов распределения (lg Kp).
Строят график зависимости величин lg Кр от величин pHравн. растворов.
Из графика определяют область pHравн. растворов, которой отвечает область максимальных значений величин lg Кр.
Найденная область pHравн. является оптимальной для проведения растворения оксида переходного металла - магнетита в данных растворах, содержащих заданные концентрации ОЭДФ и гидразина.
В таблице 1 приведены физико-химические показатели (Кр, pHравн.) растворов, содержащих ОЭДФ и гидразин, после наступления ионообменного равновесия по распределению радионуклида 59Fe между растворами и анионитом АВ-17-8чС в ОЭДФ-форме, полученные из результатов экспериментальных измерений активности растворов и равновесных величин pH растворов.
На основании данных таблицы 1 (pHравн., lg Кр) построена графическая зависимость логарифмов величин объемных коэффициентов распределения катиона радиоактивного изотопа 59Fe2+ от равновесных величин pH растворов (фиг.1).
Из графика (фиг.1) диапазон равновесных величин pH растворов, который отвечает диапазону максимальных величин Кр, соответствует области значений pH от 2.5 до 4.8. Наиболее высоким значениям Кр соответствует диапазон pH растворов от 3.0 до 3.5. Поддержание pH растворов в данном диапазоне непосредственно в процессе растворения оксидов железа в растворах ОЭДФ + N2H4 является наиболее оптимальным, обеспечивает достижение максимальных концентраций катионов железа и соответствует образованию в растворах наиболее устойчивых комплексных соединений с катионом Fe2+.
Правомерность данного заключения подтверждена результатами определения весовых концентраций катионов железа в растворах ОЭДФ + N2H4 с заданными концентрациями реагентов и разными начальными величинами pH при растворении навесок магнетита. Результаты экспериментально получены авторами традиционным способом, аналогичным способу-прототипу. Из графика (фиг.2), на котором представлена зависимость достигнутых концентраций железа в растворах от pHнач. растворов, следует, что максимальной концентрации ионов железа в растворах соответствует диапазон начальных величин pH от 3.5 до 5.0, после чего железо-емкость растворов падает.
Авторами экспериментально установлено:
1. Существует прямо пропорциональная зависимость между величинами объемных коэффициентов распределения изотопов переходных металлов между растворами, содержащими комплексообразующий агент, и сильноосновными анионитами в форме этого комплексообразующего агента и устойчивостью комплексонатов ПМ, образующихся в этих растворах.
2. В качестве физико-химических показателей растворов, содержащих комплексообразующий агент, для более достоверного определения оптимальных параметров растворения оксидов ПМ, а именно, величин pH растворов, которые необходимо поддерживать непосредственно в процессе растворения оксидов, могут быть использованы объемные коэффициенты распределения радиоактивных изотопов металлов между исследуемыми растворами комплексона и сильноосновными анионитами в форме этого комплексона (комплекситами) и равновесные величины pH растворов;
3. Зависимость величин объемных коэффициентов распределения изотопов металлов, количественно определяющих элементный состав оксидов, например, изотопа 59Fe в случае исследования параметров растворения Fe3O4, от равновесных величин pH растворов, позволяет определять оптимальные параметры растворения оксидов и характеризует показатели растворов;
4. Оптимальным параметрам растворения отложений оксидов ПМ, а именно, оптимальным величинам pH, соответствуют диапазоны равновесных величин pH растворов, которые отвечают максимальным значениям объемных коэффициентов распределения катионов металлов;
5. В данных оптимальных диапазонах pH при заданных концентрациях реагентов в растворах достигаются максимальные концентрации металлов, определяющих состав оксидов ПМ, а образующиеся сложные комплексные соединения - ассоциаты - с участием катионов металлов и лигандов комплексообразующих агентов наиболее устойчивы.
Установленные закономерности относятся не только к примеру конкретного выполнения заявляемого способа, но применимы и для определения оптимальных параметров растворения оксидов ПМ в растворах, содержащих другие комплексоны, и в растворах, содержащих наряду с лигандами комплексообразующих агентов лиганды органических и минеральных кислот и другие агенты. Это было экспериментально подтверждено авторами при проверке оптимальных параметров растворения оксидов железа в растворах ЭДТА + H3Cit + H2C2O4, а именно, рекомендуемых начальных pH растворов, равных величине 2.5, при соотношении агентов в растворах 4:3:3 и суммарной концентрации реагентов 1÷2.5 г/л. Рецептуру применяют при дезактивации первых контуров промышленных ЯЭУ с тяжеловодным теплоносителем по «низкоконцентрационной» химической технологии, которую в мировой практике обозначают аббревиатурой «CAN-DECON» /Decontamination of Nuclear Facilities to Permit Operation, Inspection, Maintenance, Modification or Plant Decommissioning. International Atomic Energy Agency, Vienna, 1985. Technical Reports Series, No. 249, page 12-13, 47-51/. Полученные при использовании заявляемого способа оптимальные величины pH растворов ЭДТА + H3Cit + H2C2O4, которые необходимо поддерживать непосредственно в процессе растворения оксидов железа, совпали с областью, рекомендуемой разработчиками рецептуры. Одновременно, на основании зависимости Кр радиоактивных изотопов 59Fe между растворами ЭДТА + H3Cit + H2C2O4 и анионитом АВ-17-8 чС в ЭДТА-форме от pHравн. растворов показано, что даже незначительные отклонения величин pH от оптимальных значений при растворении оксидов железа, например, от 2.5 до 3.5, критичны для процессов дезактивации первых контуров ЯЭУ с применением рецептуры. Обнаружено, что указанные отклонения приводят к существенному, как минимум на порядок, снижению устойчивости комплексных соединений с катионами Fe3+, что определяет для растворов, содержащих ЭДТА, значительную актуальность сохранения и поддержания оптимальных величин pH непосредственно в процессе дезактивации контуров ЯЭУ.
Элементный состав оксидов зависит от КМ контуров, но в любом случае определяется переходными металлами, которые выделяют среди других элементов на основании незавершенности внутренних электронных оболочек их атомов или ионов. Незавершенность оболочек предопределяет способность ПМ к образованию координационных (комплексных) соединений, что является их общим свойством. Это позволяет утверждать, что способ применим для определения оптимальных параметров растворения не только оксидов железа, но и оксидов других ПМ, например, оксидов хрома, марганца, кобальта, никеля, цинка, циркония.
Наличие гамма-спектрометрической аппаратуры, позволяющей идентифицировать и измерять активности нескольких гамма-излучающих радиоактивных изотопов ПМ в растворах одновременно, предоставляет исследователям дополнительные возможности. Так как концентрации радиоактивных изотопов ПМ, вносимые в растворы, ничтожно малы, и их взаимовлиянием на величины коэффициентов распределения изотопов между растворами и комплекситами можно пренебречь, то можно проводить одномоментное определение оптимальных параметров растворения различных оксидов переходных металлов в растворах, содержащих тот или иной комплексообразующий агент. Для этого в исследуемые растворы с заданными концентрациями и соотношениями реагентов, начальными величинами pH необходимо одновременно вносить гамма-излучающие изотопы сразу нескольких переходных металлов, количественно определяющих элементный состав тех или иных оксидов, например, изотопы 59Fe, 95Zr, 95Nb, 54Mn, 51Cr, 60Co, 58Co.
Заявляемый способ легко осуществим. Для его реализации требуются радиоактивные изотопы переходных металлов, входящих в состав конкретных оксидов ПМ, и радиометрическая аппаратура, позволяющая измерять активность растворов по внесенным радионуклидам.
|