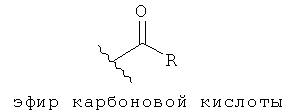Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ ЦИКЛОПЕНТАНЫ, ОБЛАДАЮЩИЕ ПРОСТАГЛАНДИНОВОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Данные по родственным заявкам
Это заявка испрашивает приоритет по предварительной заявке на патент США №61/026 179, поданной 05 февраля 2008 г., и. безусловной заявке на патент США №12/363 996, поданной 02 февраля 2009, которые тем самым включены посредством ссылки в полном объеме.
Описание изобретения
[1] Глазные гипотензивные средства эффективны при лечении многих различных глазных гипертензивных состояний, таких как повышение глазного давления после хирургической или лазерной трабекулотомии, глаукома, и как предоперационная подготовка.
[2] Глаукома представляет собой глазную болезнь, характеризующаяся повышенным внутриглазным давлением. На основе ее этиологии глаукома была классифицирована как первичная или вторичная. Например, первичная глаукома у взрослых (врожденная глаукома) может быть как открытоугольной, так и закрытоугольной, острой или хронической. Вторичная глаукома является результатом предшествующих глазных болезней, таких как увеит, внутриглазная опухоль или набухающая катаракта. Глаукома встречается приблизительно у 2% всех людей в возрасте старше 40 лет и может быть бессимптомной в течение многих лет прежде, чем начать прогрессировать, приводя к быстрой потере зрения.
[3] Основные причины первичной глаукомы до сих пор не известны. Увеличенное внутриглазное давление обусловлено затруднением оттока водянистой влаги (внутриглазной жидкости). При хронической открытоугольной глаукоме передняя камера глаза и ее анатомические структуры выглядят нормальными, но отток внутриглазной жидкости затруднен. При острой или хронической закрытоугольной глаукоме передняя камера глаза является мелкой, угол фильтрации сужен, и радужная оболочка может затруднять проходимость трабекулярной сети у входа Шлеммова канала. Расширение зрачка может сместить корень радужной оболочки вперед относительно угла, что может послужить причиной зрачкового блока и таким образом вызвать острый приступ. Глаза с узкими углами передней камеры имеют предрасположенность к острому приступу закрытоугольной глаукомы различных степеней серьезности.
[4] Причиной вторичной глаукомы является любое нарушение оттока водянистой тканевой жидкости из задней камеры в переднюю камеру и затем в Шлеммов канал. Воспалительная болезнь переднего сегмента может препятствовать протеканию жидкости из-за полной задней синехии в бомбированной радужной оболочке, и может привести к закупориванию дренажного канала с экссудатом. Другие частые причины - внутриглазные опухоли, набухающая катаракта, окклюзия центральной вены сетчатки, травма глаза, операционные вмешательства и внутриглазное кровоизлияние.
[5] В случаях, когда хирургическая операция не назначается, простагландины и простамиды с недавнего времени стали ведущим направлением в лечении глаукомы. В настоящее время определенные эйкозаноиды и их производные доступны в продаже для применения в терапии глаукомы. Эйкозаноиды и производные включают многочисленные биологически важные соединения, такие как простагландины и их производные. Простагландины могут быть описаны как производные простановой кислоты, обладающей следующей структурной формулой:
[6] Известны различные типы простагландинов, в зависимости от строения и заместителей алициклического кольца скелета простановой кислоты. Дальнейшая классификация основана на числе ненасыщенных связей в боковой цепи, обозначенном числовыми индексами после названия данного типа простагландина [например, простагландин Е1 (PGE1), простагландин Е2 (PGE2)] и на ориентации заместителей в эпициклическом кольце, обозначенной α или β [например, простагландин F2α (PGF2β)].
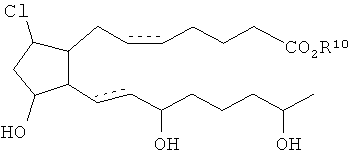
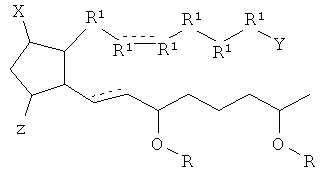
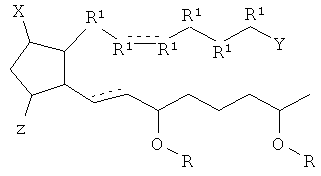
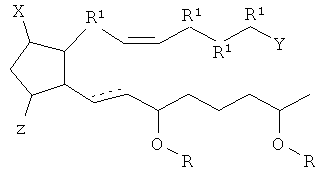
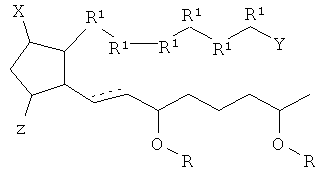
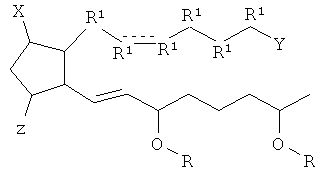
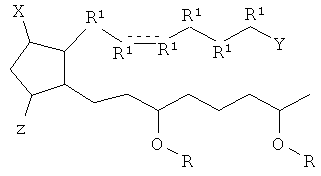
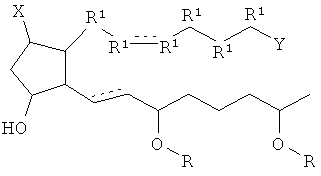
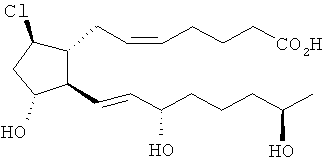
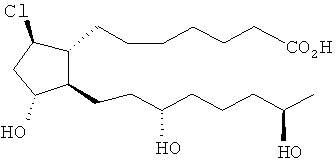
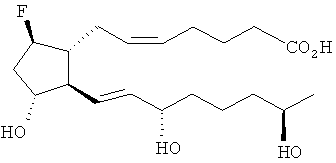
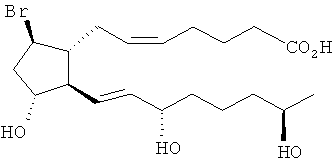
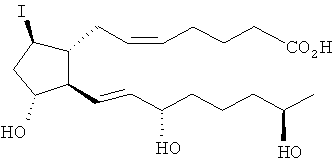
[7] Здесь раскрыты соединения, представленные формулой:

где пунктирная линия означает наличие или отсутствие связи;
Y имеет от 1 до 14 атомов углерода и является: функциональной группой карбоновой кислоты или ее сложным эфиром;
X представляет собой галоген;
Z представляет собой -OH;
каждый R1 независимо является CH2, или, если R1 образует двойную связь с другим R1, то оба являются СН, и
каждый R независимо является -H.
[8] Эти соединения эффективны для снижения внутриглазного давления. Снижение внутриглазного давления, как было показано, задерживало или предотвращало приступ первичной открытоугольной глаукомы, и задерживало или предотвращало дальнейшую потерю зрения у пациентов с первичной открытоугольной глаукомой. Таким образом, эти соединения также эффективны при лечении глаукомы. Эти соединения также эффективны для роста волос, включая что-либо одно или более из следующего: увеличение количества отдельных волос, увеличение длины отдельных волос и увеличение силы или толщины отдельных волос. Эти соединения также эффективны для улучшения внешнего вида волос, включая увеличение их блеска, сияния, или других свойств, связанных с отражением или дисперсией света, а также изменение цвета волос, включая изменение волос от седых или белых к цвету, бывшему у волос прежде, чем они поседели или побелели, например, к рыжему, каштановому или черному.
[9] В уровне техники хорошо известны различные типы подходящих для дозировки форм и лекарственных препаратов, которые могут быть легко приспособлены для доставки соединений, раскрытых здесь. Например, соединение может быть растворено или суспендировано в водном растворе или эмульсии, приведенным к соответствующему pH с помощью буферного раствора, и введено местно в глаз млекопитающего (US 7091231).
[10] В настоящем описании "подвергать обработке", "обработка", или "лечение" относятся к применению соединения, композиции, терапевтически активного агента или препарата в диагностике, терапии, облегчении страданий, лечении или профилактики болезни или другого нежелательного состояния.
[11] Если не указано иначе, ссылка на какое-либо соединение должна толковаться широко, включая соединения, фармацевтически приемлемые соли, пролекарства, таутомеры, альтернативные твердые формы, нековалентные комплексы, и их комбинации, имеющие химическую суть изображенной структуры или химического наименования.
[12] Фармацевтически приемлемой солью является любая соль родоначального соединения, которая подходит для введения животному или человеку. Фармацевтически приемлемая соль также относится к любой соли, которая может сформироваться in vivo в результате введения кислоты, другой соли, или пролекарства, которое преобразуется в кислоту или соль. Соль включает одну или более ионных форм соединения, таких как сопряженная кислота или основание, связанных с одним или более соответствующих противоионов. Соли могут образоваться из или включать одну или более депротонированных кислых групп (например, карбоновых кислот), одну или более протонированных основных групп (например, аминов), или то и другое (например, цвиттерионы).
[13] Пролекарство представляет собой соединение, которое после введения переходит в терапевтически активное соединение. Например, преобразование может произойти при гидролизе сложноэфирной группы или некоторой другой биологически неустойчивой группы. Изготовление пролекарств хорошо известно в практике. Например, глава "Prodrugs and Drug Delivery Systems" в книге Richard В. Silverman, Organic Chemistry of Drug Design and Drug Action, 2d Ed., Elsevier Academic Press: Amsterdam, 2004, pp.496-557, раскрывает дополнительные детали по данной теме. В частности, рассмотрены сложные эфиры, такие как метиловый, этиловый, изпропиловый и т.п. Также рассмотрены пролекарства, содержащие полярную группу, такую как гидроксил или морфолин. Примеры таких пролекарств включают соединения, содержащие группы -CO2(СН2)2OH, 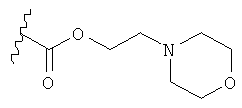 , и т.п.
, и т.п.
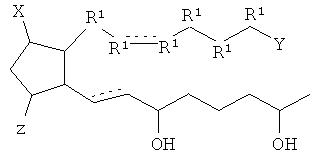
[14] Таутомеры представляют собой изомеры, которые находятся в быстром равновесии друг с другом. Например, таутомеры могут быть связаны с переносом протона, водородного атома или гидрид-иона.
[15] Если стереохимия не изображена явно и однозначно, подразумевается, что структура включает каждый возможный стереоизомер, как чистый, так и в любой возможной смеси.
[16] Альтернативными твердыми формами являются твердые формы, отличающиеся от тех, которые могут получаться из осуществления способов, описанных здесь. Например, альтернативные твердые формы могут быть полиморфными, различными видами аморфных твердых форм, стеклами и т.п.
[17] Нековалентными комплексами являются комплексы, которые могут образовываться между соединением и дополнительным химическим веществом, одним или более, которые не содержат ковалентное связывающее взаимодействие между соединением и дополнительным химическим веществом. Они могут иметь или не иметь определенное соотношение между соединением и дополнительным химическим веществом. Примеры могли бы включать сольваты, гидраты, комплексы с переносом заряда и т.п.
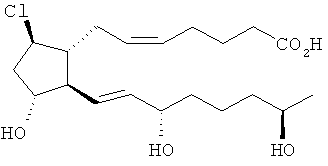
[18] Пунктирная линия означает присутствие или отсутствие связи. Таким образом, ниже рассмотрены соединения согласно структурным формулам.
|
[19] Y является функциональной группой карбоновой кислоты или ее сложным эфиром.
[20] Сложные эфиры функциональных групп карбоновой кислоты содержат атом кислорода, непосредственно присоединенный к центральному атому кислотной группы, причем атом кислорода не является частью -OH группы. Центральным атомом кислотной группы является атом, связанный с -OH в органической кислотной функциональной группе. В качестве примера ниже изображены сложные эфиры функциональных групп карбоновой кислоты.
|
[21] R является углеводородным радикалом с ограничением, что Y не может иметь более 14 атомов углерода.
[22] Углеводородный радикал представляет собой функциональную группу, состоящую из углерода и водорода, включая следующее, но не ограничиваясь им:
а. алкил, который является углеводородным радикалом, не содержащим двойных или тройных связей, например:
- линейный алкил, т.е. метил, этил, н-пропил, н-бутил, н-пентил, н-гексил и т.д.,
- разветвленный алкил, т.е. t/зо-пропил, mpem-бутил и другие изомеры бутила, разветвленные изомеры пентила и т.д.,
- циклоалкил, т.е. циклопропил, циклобутил, циклопентил, циклогексил и т.д.,
- комбинация линейных, разветвленных и/или циклоалкилов;
б. алкенил, который является углеводородным радикалом, содержащим 1 или более двойную связь, включая линейный, разветвленный или циклоалкенил;
в. алкинил, который является углеводородным радикалом, содержащим 1 или более тройную связь, включая линейный, разветвленный или циклоалкинил;
г.незамещенный или углеводородный радикал, замещенный фенилом; и
д. комбинации алкилов, алкенилов и/или алкинилов.
[23] C1-6 углеводород является углеводородным радикалом, содержащим 1, 2, 3, 4, 5 или 6 атомов углерода.
[24] C1-6 алкил является алкилом, содержащим 1, 2, 3, 4, 5 или 6 атомов углерода, таким как изомеры метила, этила, пропила, бутила, пентила и гексила, и т.д.
[25] В одном воплощении Y является -CO2R4, где R4 является независимо H, алкилом C1-C6.
[26] Z является -OH. Таким образом, рассмотрены соединения согласно структурным формулам, приведенным ниже.
[27] Ниже приведены структурные изображения пригодных воплощений.
[28] В одном примере осуществления X является Cl.
[29] Другим воплощением является соединение, представленное формулой Cl
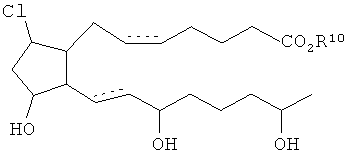
где R10 является H или C1-6алкилом.
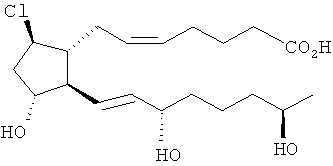
[30] Другим воплощением является соединение, представленное формулой
[31] Другим воплощением является соединение, представленное формулой
[32] Другим воплощением является способ понижения внутриглазного давления, при котором млекопитающему, нуждающемуся в вышеупомянутом, вводят соединение, раскрытое здесь.
[33] Другим воплощением является способ лечения глаукомы или повышенного внитриглазного давления, при котором млекопитающему, нуждающемуся в вышеупомянутом, вводят соединение, раскрытое здесь.
[34] Другим воплощением является способ улучшения роста волос или улучшения внешнего вида волос, при котором млекопитающему, нуждающемуся в вышеупомянутом, вводят соединение, раскрытое здесь.
[35] Другим воплощением является применение соединения, раскрытого здесь, в изготовлении препарата для лечения глаукомы или повышенного внитриглазного давления.
[36] Другим воплощением является применение соединения, раскрытого здесь, в изготовлении препарата для улучшения роста волос или улучшения внешнего вида волос.
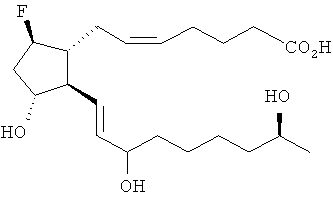
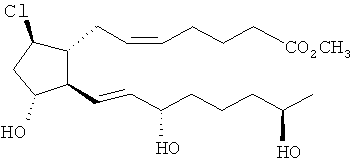
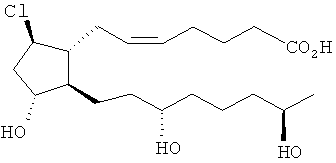
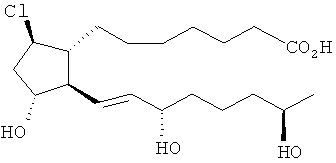
[37] Другие гипотетические примеры пригодных соединений изображены ниже.
Способы синтеза
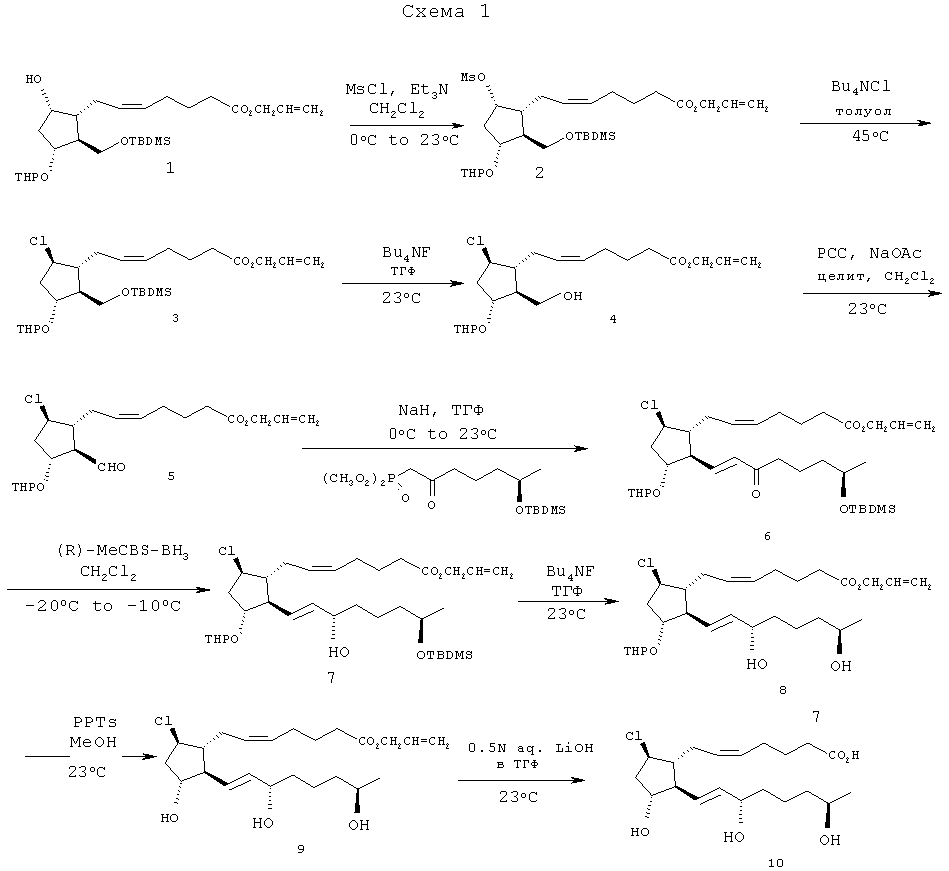
[38] (Z)-аллил-7-((1R,2S,3R,5S)-2-((трет-бутилдиметилсилилокси)метил)-5-(метилсульфонилокси)-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гепт-5-еноат (2).
[39] К раствору сил илового эфира 1 (5 г, 10 ммоль) и триэтиламина (5 г, 49,5 ммоль) в 40 мл дихлорметана при 0°С по каплям добавляли при быстром перемешивании 2 мл (25,8 ммоль) хлористого мезила. После завершения добавления удаляли ледяную баню и перемешивали реакционную смесь при комнатной температуре более 1 ч. Анализ способом ТСХ (тонкослойной хроматографии) показал отсутствие исходного вещества (Rf=0,5 в 20% смеси EtOAc/гексан). Смесь фильтровали через 50 г силикагеля и промывали 250 мл смеси гексан/EtOAc (1:1). Фильтрат концентрировали in vacuo для получения 6,2 г неочищенного мезилата 2 (107%-ый выход), содержащего в небольшом количестве растворитель и триэтиламин гидрохлорид. 1Н ЯМР (CDCl3): 0,04 (s, 6Н), 0,87 (s, 9Н), 1,25 (m, 1Н), 1,44-1,84 (m, 9Н), 1,85-2,38 (m, 10Н), 2,99 (s, 1,3Н), 3,03 (s, 1,3Н), 3,14 (s, 1,7Н), 3,48 (m, 1Н), 3,68(m, 2Н), 3,85 (m, 1,5Н), 4,10(m, 0,6Н), 4,20 (m, 0,6Н), 4,58 (m, 3Н), 5,06 (m, 1Н), 5,26 (m, 2Н), 5,42 (m, 2Н), 5,91 (m, 1Н).
[40] (2)-аллил-7-((1R,2S,3R,5R)-2-((трет-бутилдиметилсилилокси)метил)-5-хлор-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гепт-5-еноат (3).
[41] Раствор 10 ммоль мезилата 2 и 11,15 г (40 ммоль) хлорида тетрал-бутиламмония в 200 мл толуола перемешивали при 45°C в течение 20 ч, затем при 23°C в течение 40 ч. Реакционную смесь затем разбавляли этилацетатом (250 мл) и переносили в делительную воронку емкостью 1 л. Органический слой промывали водой (2x500 мл), солевым раствором (200 мл), высушивали над безводным сульфатом натрия (100 г) и фильтровали. Концентрирование фильтрата in vacuo давало 4,7 г неочищенных продуктов. Очистка неочищенной смеси методом ФХ (флэш-хроматографии) на 120-граммовом картридже из силикагеля, при использовании в качестве элюента смеси 5% EtOAc/95% гексан (1,5 л), смеси 10% EtOAc/90% гексан (500 мл), затем чистого этилацетата, привела к 1,48 г (29%) хлорида 3; 1Н NMR (CDCl3): 0,04 (s, 6Н), 0,89 (s, 9Н), 3,4-3,77 (m, 3Н), 3,78-4,2 (m, 3Н), 4,3-4,7 (m, 3Н), 5,2-5,58 (m, 4Н), 5,93 (m, 1Н). Также получили 2,2 г более полярного побочного продукта. Этот побочный продукт очищали методом флэш-хроматографии на 120 г силикагеля, при использовании в качестве элюента смеси 20% EtOAc/80% гексан, затем 1 л смеси 40% EtOAc/гексан для получения 690 мг десилированного хлорида 3; 1Н ЯМР (CDCl3): 1,42-1,98 (m, 12Н), 2,0-2,48 (m, 8Н), 3,45-4,44 (m, 6Н), 4,54-4,76 (m, 3Н), 5,20-5,55 (m, 4Н), 5,91 (m, 1Н).
[42] (Z)-аллил-7-((1R,2S,3R,5R)-5-хлор-2-(гидроксиметил)-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гепт-5-еноат (4).
[43] Раствор 1,46 г (2,8 ммоль) силилового эфира 3 в 10 мл 1,0М ТБАФЯГФ (тетрабутиламмоний фторид/тетрагидрофуран) перемешивали при 25°С в течение 3 ч. Растворитель ТГФ затем удаляли in vacuo, и оставшееся масло помещали в этилацетат (100 мл), промывали насыщенным водным хлоридом аммония (2×75 мл), солевым раствором, и высушивали над безводным сульфатом натрия (50 г). Смесь фильтровали, и фильтрат концентрировали in vacuo для получения 1,18 г (количественный выход) спирта 4, используемого на следующей стадии без очистки; 1Н ЯМР (CDCI3): 1,42-1,98 (m, 12Н), 2,0-2,48 (m, 8Н), 3,45-4,44 (m, 6Н), 4,54-4,76 (m, 3Н), 5,20-5,55 (m, 4Н), 5,91 (m, 1Н).
[44] (Z)-аллил-7-((1R,2R,3R,5R)-5-хлор-2-формил-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гепт-5-еноат (5).
[45] Раствор 690 мг (1,72 ммоль) спирта 4 в 4 мл дихлорметана добавляли из пипетки к смеси РСС (пиридиний-хлорохромата) (650 мг, 3,0 ммоль), ацетата натрия (325 мг, 3,96 ммоль) и целита (1,23 г) в 7 мл дихлорметана. Пипетку ополаскивали дополнительными 3 мл дихлорметана для полного перенесения. Закрытую смесь перемешивали при 25°C в течение 3 ч. Смесь фильтровали через 25 г силикагеля и промывали 200 мл смеси этилацетат/гексан (1:4). Фильтрат концентрировали in vacuo для получения 500 мг неочищенного альдегида 5 в виде масла (выход 72%). 1Н ЯМР (CDCl3): 1,45-1,85 (m, 10Н), 2,04-3,00 (m, 10Н), 3,51 (m, 1Н), 3,81 (m, 1Н), 4,07 (m, 1Н), 4,59 (m, 4Н), 5,26 (m, 1Н), 5,45 (m, 1Н), 5,92 (m, 1Н), 9,75 (dd, J=2,1, 9 Гц, 1Н).
[46] (Z)-аллил-7-((1R,2R,3R,5R)-2-((R,E)-8-(трет-бутилдиметилсилилокси)-7-метил-3-оксоокт-1-енил)-5-хлор-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гепт-5-еноат (6).
[47] К суспензии 56 мг (1,35 ммоль) гидрида натрия (60%-ая масляная суспензия) в 1 мл ТГФ при 0°С добавляли раствор диметил (6R)-6-{[трет-бутил(диметил)силил]окси}-2-оксогептилфосфоната (550 мг, 1,57 ммоль) в 1 мл ТГФ. Смесь перемешивали при 0°С в течение 30 минут прежде, чем по каплям добавить раствор альдегида 5 (500 мг, 1,25 ммоль) в 1 мл ТГФ. Шприц, содержащий альдегид 5, ополаскивали 2 мл ТГФ для полного прибавления и перемешивали смесь при 25°C в течение 3 ч. Реакционную смесь обрабатывали насыщенным водным хлоридом аммония (50 мл), и водный слой экстрагировали этилацетатом (2×75 мл). Этилцетатные слои объединяли и промывали солевым раствором, высушивали над 30 г безводного сульфата натрия, фильтровали и концентрировали in vacuo для получения 920 мг неочищенных продуктов. Очистка методом флэш-хроматографии на 40-граммовом картридже из силикагеля, при использовании в качестве элюента смеси 10% EtOAc/90% гексан, привела к 490 мг (63%) очищенного енона 6; 1H ЯМР (CDCl3): 0,04 (s, 6Н), 0,88 (s, 9Н), 1,12 (d, J=6 Гц, ЗН), 1,36-1,80 (m, 13Н), 1,98-2,42 (m, 9Н), 2,54 (t, Гц J=7,2, 2Н), 3,44 (m, 1Н), 3,78 (m, 2Н), 3,90-4,30 (m, 2Н), 4,57 (m, 3Н), 5,20-5,52 (m, 4Н), 5,91 (m, 1Н), 6,14 (m, 1Н), 6,74 (m, 1Н). ЖХ-МС 625,48 [М++CH3CN].
[48] (Z)-аллил-7-((1R,2R,3R,5R)-2-((3S,7R,E)-7-(трет-бутилдиметилсилилокси)-3-гидроксиокт-1-енил)-5-хлор-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гепт-5-еноат (7).
[49] Раствор енона 6 (398 мг, 0,64 ммоль) в 7 мл дихлорметана охлаждали до -20°C и при быстром перемешивании добавляли одной порцией твердый комплекс (R)-метил-CBS-боргидрид [CBS, Corey-Bakshi-Shibata - Кори-Бакши-Шибата] (290 мг, 1,0 ммоль). Образующийся раствор перемешивали в течение 1 ч. при температуре от -20° до -10°C. Анализ методом TCX на этом этапе не показал оставшегося исходного вещества, и реакционную смесь разбавляли 2 мл метанола, удаляли охлаждающую ванну и перемешивали при 20°C в течение 60 мин. Смесь концентрировали in vacuo для удаления растворителей и остаточные продукты очищали методом флэш-хроматографии на силикагеле (40-граммовый картридж фирмы SiliCycle) для получения 270 мг (15S)-спитра 7; 1Н ЯМР (CDCl3): 0,03 (s, 6Н), 0,87 (s, 9Н), 1,10 (d, J=6 Гц, 3Н), 1,20-1,97 (m, 18Н), 2,0-2,4 (m, 8Н), 3,45 (m, 1Н), 3,80 (m, 2Н), 3,90-4,15 (m, 3H), 4,59 (m, 3Н), 5,20-5,70 (m, 6Н), 5,92 (m, 1H).
[50] (Z)-аллил 7-((1R,2R,3R,5R)-5-хлоро-2-((3S,7R,E)-3,7-дигидроксиокт-1-енил)-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гепт-5-еноат (8).
[51] Раствор силилового эфира 7 (270 мг, 0,43 ммоль) перемешивали при 30°С с 2 мл (2 ммоль) 1,0М ТБАФ/ТГФ во флаконе в течение 20 ч. Метод ТСХ показал, что исходный материал в основном десилировали, и реакционную смесь концентрировали in vacuo. Остаточные неочищенные продукты растворяли в 50 мл этилацетата и промывали последовательно насыщенным хлоридом аммония (50 мл), рассолом (50 мл) и высушивали над 10 г безводного сульфата натрия. Смесь фильтровали и концентрировали in vacuo. Остаточные продукты очищали методом флэш-хроматографии на 20 г силикагеля, при использовании в качестве элюента смеси EtOAc/гексан (1:1), а затем чистого EtOAc. Комбинация соответствующих фракций и удаление растворителей привели к 175 мг (79%) чистого диола 8 в виде масла; 1Н ЯМР (CDCl3): 1,18 (d, J=6 Гц, 3H), 1,38-1,84 (m, 13Н), 1,91 (m, 1Н), 2,00-2,40 (m, 11Н), 3,47 (m, 1H), 3,81 (m, 2H), 3,99 (m, 1H), 4,09 (m, 2H), 4,54-4,72 (m, 3H), 5,21-5,66 (m, 6H), 5,92 (m, 1H).
[52] (Z)-аллил-7-((1R,2R,3R,5R)-5-хлор-2-((3S,7R,E)-3,7-дигидроксиокт-1-енил)-3-гидроксициклопентил)гепт-5-еноат (9).
[53] Во флакон емкостью 20 мл, снабженный магнитной мешалкой, загружали 175 мг (0,34 ммоль) ТГП- (тетрагидропиранил-) эфира 8, растворенного в 5 мл метанола. Затем туда же добавляли 300 мг (1,20 ммоль) PPTs (пиридиний p-толуолсульфоната) и перемешивали смесь при 22°C более 7,5 ч. Реакцию анализировали методом ТСХ (Rf продукта составлял 0,6 в EtOAc), и концентрировали in vacuo для удаления метанола. Остаточные продукты растворяли в этилацетате и фильтровали через 22-граммовый картридж из силикагеля, отделяя полярный продукт от солей с помощью элюирования этилацетатом (350 мл). Концентрирование фильтрата приводило к 125 мг продукта, триола 9, в виде масла; 1H ЯМР (CDCl3): 1,18 (d, J=6,3 Гц, 3H), 1,34-1,62 (m, 5Н), 1,69 (m, 2Н), 1,84-2,38 (m, 11Н), 2,47 (br s, 1H), 3,53 (br s, 1H), 3,70 (br s, 1H), 3,79 (br m, 1H), 3,99 (m, 1H), 4,08 (m, 2H), 4,57 (m, 2H), 5,18-5,60 (m, 6H), 5,91 (m, 1H).
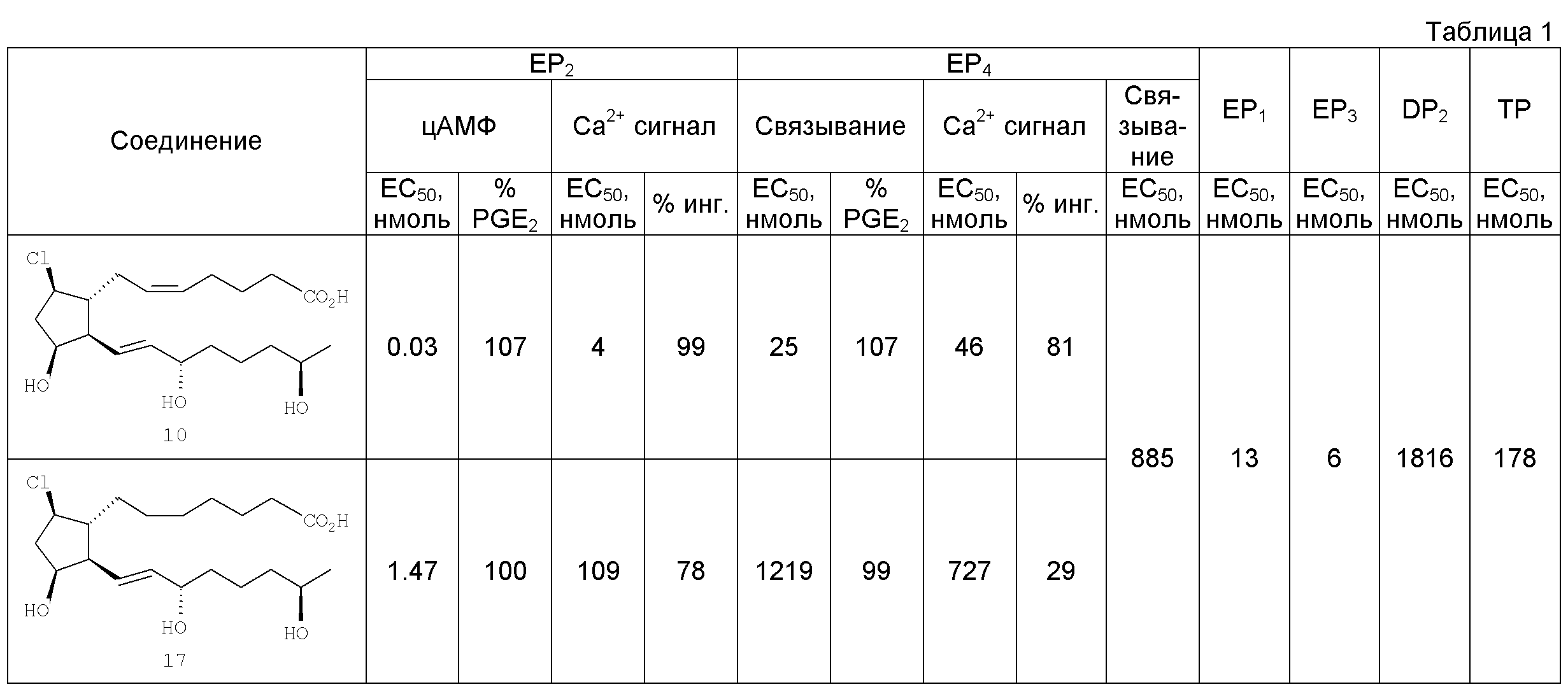
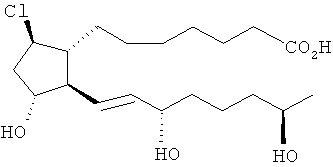
[54] (Z)-аллил 7-((1R,2R,3R,5R)-5-xnop-2-((3S,7R,Е)-3,7-дигидроксиокт-1-енил)-3-гидроксициклопентил)гепт-5-еновая кислота (10).
[55] Раствор 77 мг (0,18 ммоль) сложного эфира 9 в 1,4 мл ТГФ гидролизовали 400 мкл (0,18 ммоль) водной гидроокиси лития (0,5М) и 0,4 мл метанола при 25°C в течение 5 ч. Смесь подкисляли добавлением 200 мкл 1,0М соляной кислоты и остаточную воду удаляли in vacuo. Остаточные продукты очищали методом флэш-хроматографии на 10 г силикагеля при элюировании 100% EtOAc, смесью 5% метанол/95% EtOAc, затем смесью 10% метанол/90% этилацетат. Из выделенных фракций отделили 49 мг свободной кислоты 10 в виде масла (выход 70%); 1Н ЯМР (ацетон-d6): 1,11 (d, J=6,3 Гц, 3H), 1,45 (m, 6Н), 1,67 (m, 2Н), 1,91 (m, 1Н), 2,09-2,37 (m, 8Н), 2,86 (br s, 4Н), 3,71 (m, 1Н), 4,12 (m, 3H), 5,54 (m, 4Н).
Схема 2
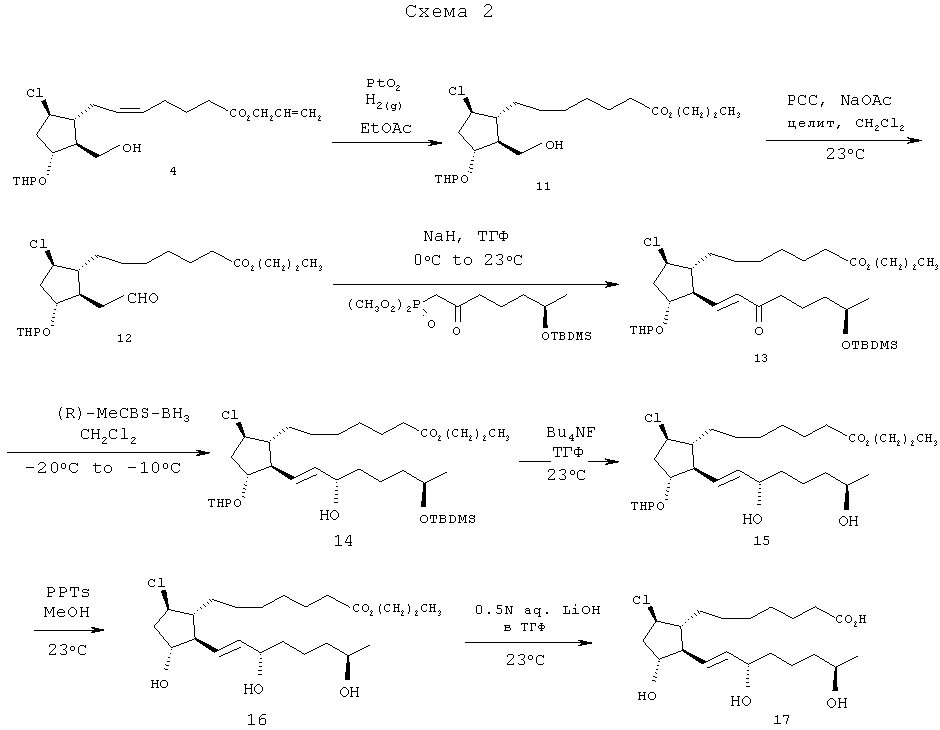
[56] Пропил-7-((1R,2S,3R,5R)-5-хлор-2-(гидроксиметил)-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гептаноат (11)
[57] Раствор 1 г (2,49 ммоль) спирта 4 в 13 мл EtOAc и катализатора Адамса (22 мг) перемешивали под давлением газообразного водорода 30 фунтов/дюйм2 в аппарате Парра более 21 ч. Затем смесь фильтровали через картридж из силикагеля для удаления катализатора, используя EtOAc в качестве растворителя. Фильтрат затем концентрировали in vacuo для получения 990 мг пропилового эфира 11 в виде масла; 1Н ЯМР (CDCl3): 0,94 (t, J=7,3 Гц, 3Н), 1,20-1,94 (m, 31Н), 2,17 (m, 2Н), 2,32 (m, 4Н), 3,46-4,12 (m, 8Н), 4,03 (t, J=6,6 Гц, 2H), 4,13-4,38 (m, 2Н), 4,59 (m, 1Н), 4,73 (m, 1Н).
[58] Пропил-7-((1R,2S,3R,5R)-5-хлор-2-формил-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гептаноат (12).
[59] Раствор 700 мг (1,73 ммоль) спирта 11 в 4 мл дихлорметана добавляли из пипетки к смеси РСС (пиридиний-хлорохромата) (700 мг, 3,23 ммоль), ацетата натрия (350 мг, 4,26 ммоль) и целита (1,3 г) в 7 мл дихлорметана. Пипетку ополаскивали дополнительными 3 мл дихлорметана для полного перенесения. Запечатанную смесь перемешивали при 30°C в течение 1,5 ч. Смесь фильтровали через 20 г силикагеля и промывали 200 мл смеси этилацетат/гексан (1:4). Фильтрат концентрировали in vacuo для получения 500 мг сырого альдегида 12. Дальнейшая очистка методом флэш-хроматографии на 10 г силикагеля привела к 380 мг очищенного альдегида 12 (выход 54%) в виде масла; 1Н ЯМР (CDCl3): 0,93 (t, J=7,2 Гц, 3Н), 1,31 (m, 10Н), 1,42-1,90 (m, 17Н), 1,94-2,44 (m, 4Н), 2,28 (t, J=7,5 Гц, 2Н), 2,52 (m, 1Н), 2,68 (m, 1Н), 3,48 (m, 2Н), 3,81 (m, 2Н), 4,01 (t, J=6,6 Гц, 3Н), 4,06 (m, 1Н), 4,5-4,64 (m, 2Н), 9,75 (m, J=2,1, 9 Гц, 1Н).
[60] Пропил-7-((1R,2R,3R,5R)-2-((R,E)-7-(трет-бутилдиметилсилилокси)-3-оксоокт-1-енил)-5-хлор-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гептаноат (13).
[61] К суспензии 56 мг (1,35 ммоль) гидрида натрия (60%-ая масляная суспензия) в 1 мл ТГФ при 0°C добавляли раствор диметил (6R)-6-{[трет-бутил(диметил)силил]
[62] окси}-2-оксогептилфосфоната (550 мг, 1,57 ммоль) в 1 мл ТГФ. Смесь перемешивали при 0°C в течение 30 минут прежде, чем по каплям добавить раствор альдегида 12 (380 мг, 0,94 ммоль) в 1 мл ТГФ. Шприц, содержащий альдегид 12, ополаскивали 2 мл ТГФ для полного добавления и перемешивали смесь при 25°C в течение 3 ч. Реакционную смесь обрабатывали насыщенным водным хлоридом аммония (50 мл), и водный слой экстрагировали этилацетатом (2×75 мл). Этилцетатные слои объединяли и промывали солевым раствором, высушивали над 30 г безводного сульфата натрия, фильтровали и концентрировали in vacuo для получения 880 мг сырых продуктов. Очистка методом флэш-хроматографии на 30-граммовом картридже из силикагеля, при использовании в качестве элюента смеси 10% ЕЮАс/гексан, приводила к 425 мг (71%) очищенного енона 13; 1Н ЯМР (CDCl3): 0,04 (s, 6Н), 0,88 (s, 9Н), 0,93 (t, J=7,5 Гц, 3Н), 1,12 (d, J=6,3 Гц, 3Н), 1,22-1,84 (m, 24Н), 1,97 (m, 1Н), 2,19 (t, J=6,3 Гц, 1H), 2,24-2,58 (m, 6Н), 3,45 (m, 1Н), 3,79 (m, 2Н), 4,02 (m, 3Н), 4,19 (m, 1Н), 4,57 (m, 1Н), 6,14 (m, 1Н), 6,75 (m, 1Н).
[63] Пропил-7-((1R,2R,3R,5R)-2-((3S,7R,E)-7-(трет-бутилдиметилсилилокси)-3-гидроксиокт-1-енил)-5-хлор-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил)гептаноат (14).
[64] Раствор енона 13 (425 мг, 0,67 ммоль) в 7 мл дихлорметана охлаждали до -30°C и при быстром перемешивании добавляли одной порцией твердый комплекс (R)-метил-CBS-боргидрида (350 мг, 1,20 ммоль). Образующийся раствор перемешивали в течение 1 ч. при температуре от -30° до -20°C. Анализ методом TCX на этом этапе не показал оставшегося исходного материала, и реакционную смесь разбавляли 2 мл метанола, удаляли охлаждающую ванну и перемешивали при 25°C в течение 60 мин. Смесь концентрировали in vacuo для удаления растворителей, и остаточные продукты очищали методом флэш-хроматографии на силикагеле (40-граммовый картридж фирмы SiliCycle, 500 мл смеси 10%) этилацетат/гексан, затем 500 мл смеси 20% этилацетат/гексан) для получения 316 мг (15S)-спирта 14 (выход 74%); 1Н ЯМР (CDCl3): 0,04 (s, 6Н), 0,87 (s, 9Н), 0,93 (t, J=6 Гц, 3Н), 1,10 (d, J=4,8 Гц, 3Н), 1,24-1,88 (m, 24Н), 2,10-2,32 (m, 4Н), 3,45 (m, 1Н), 3,80 (m, 2Н), 4,03 (m, 4Н), 4,61 (dt, J=2,4, 14,4 Гц, 1Н), 5,56 (m, 2Н).
[65] Пропил-7-((1R,2R,3R,5R)-5-хлор-2-((3S,7R,E)-3,7-дигидроксиокт-1-енил)-3-(тетрагидро-2Н-пиран-2-илокси)циклопентил) гептаноат (15).
[66] Раствор сил илового эфира 14 (316 мг, 0,50 ммоль) перемешивали при 35°C с 2 мл (2 ммоль) 1,0М ТБАФ/ТГФ во флаконе в течение 9,5 ч. Метод ТСХ показал, что исходный материал в основном десилировал, и реакционную смесь концентрировали in vacuo. Остаточные сырые продукты растворяли в 50 мл этилацетата и промывали последовательно насыщенным хлоридом аммония (50 мл), солевым раствором (50 мл) и высушивали над 10 г безводного сульфата натрия. Смесь фильтровали и концентрировали in vacuo. Остаточные продукты очищали методом флэш-хроматографии на 40 г силикагеля, при использовании в качестве элюента смеси EtOAc/гексан (1:1), а затем чистого EtOAc. Объединение соответствующих фракций и удаление растворителей приводило к 218 мг (84%) диола 15 в виде масла; 1Н ЯМР (CDCI3): 0,94 (t, J=7,5 Гц, 3Н), 1,18 (d, J=6,3 Гц, 3Н), 1,31 (m, 6Н), 1,42-1,90 (m, 19Н), 2,10-2,50 (m, 7Н), 3,48 (m, 1Н), 3,72-4,16 (m, 7Н), 4,64 (dt, 1Н), 5,57 (m, 2Н).
[67] Пропил-7-((1R,2R,3R,5R)-5-хлор-2-((3S,7R(E)-3,7-дигидроксиокт-1-енил)-3-гидроксициклопентил)гептаноат (16).
[68] Во флакон емкостью 20 мл, снабженный магнитной мешалкой, загружали 218 мг (0,42 ммоль) ТГП-(тетрагидропиранил-) эфира 15, растворенного в 5 мл метанола. Затем туда же добавляли 350 мг (1,39 ммоль) PPTs (пиридиний p-толуолсульфоната) и перемешивали смесь при 25°C более 8 ч. Реакцию анализировали методом TCX (Rf продукта составлял 0,5 в EtOc), и концентрировали in vacuo для удаления метанола. Остаточные продукты растворяли в этилацетате и фильтровали через 20 г силикагеля, при использовании в качестве элюента 300 мл этилацетата. Фильтрат концентрировали для получения 156 мг продуктов, которые далее очищали методом флэш-хроматографии через 25 г силикагеля, при элюировании смесью этилацетат/гексан (1:1), затем 100%-ым этилацетатом для получения 140 мг триола 16 в виде масла; 1Н ЯМР (CDCl3): 0,94 (t, J=7,2 Гц, 3Н), 1,17 (d, J=6 Гц, 3Н), 1,22-1,72 (m, 18Н), 1,91 (m, 2Н), 2,05-2,36 (m, 4Н), 3,30 (br s, 1H), 3,78 (m, 1H), 4,02 (m, 5H), 4,5 (m, 2H), 5,50 (m, 2H), 13C ЯМР: 10,53, 21,52, 22,09, 23,74, 25,03, 26,83, 29,08, 29,49, 32,90, 34,42, 36,75, 38,52, 43,59, 53,53, 57,75, 60,98, 66,06, 67,50, 72,56, 74,98, 133,27, 135,79, 174,24.
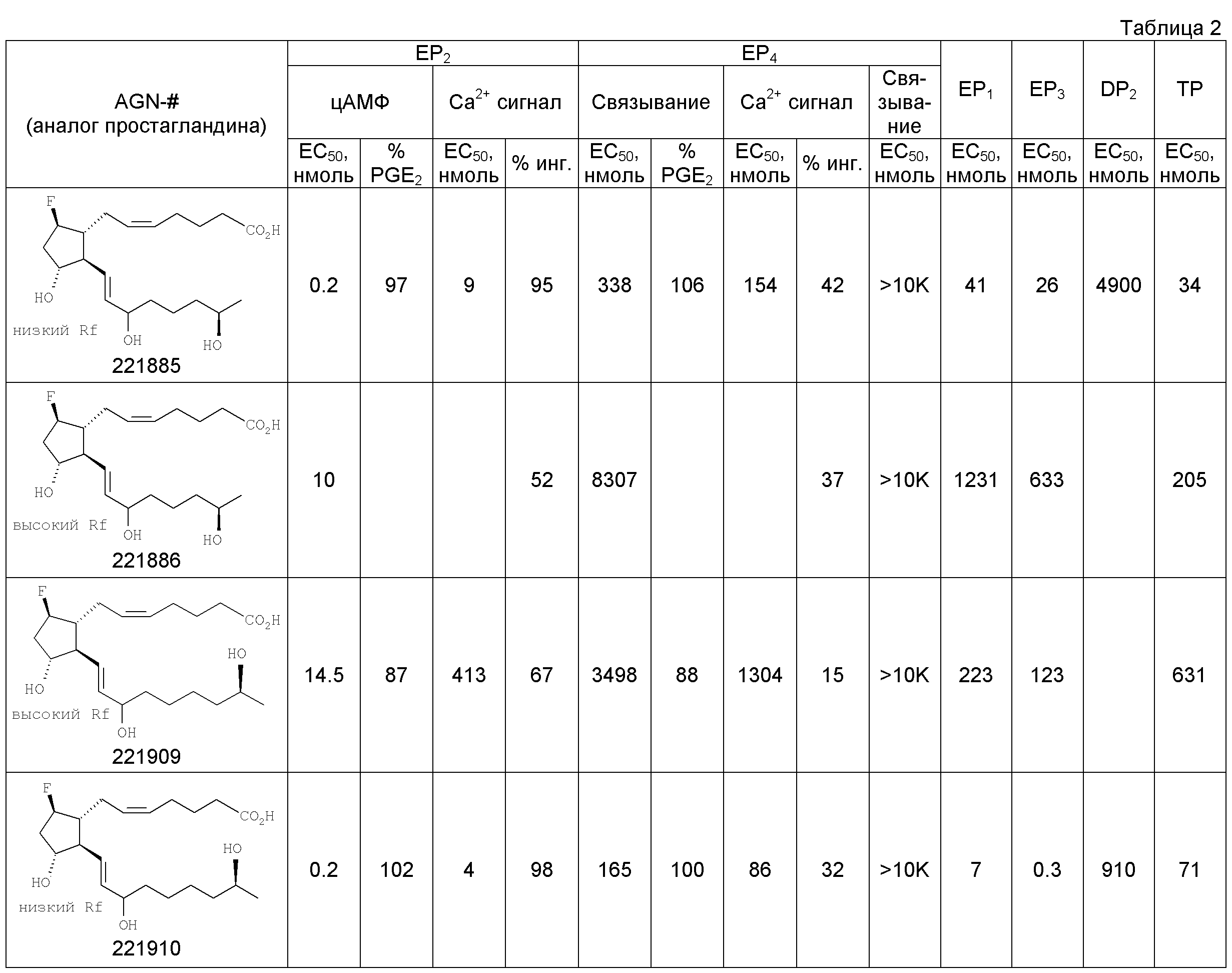
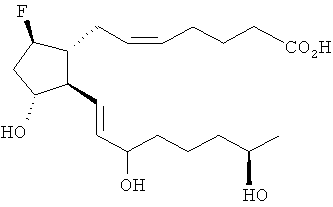
[69] 7-((1R,2R,3R,5R)-5-хлор-2-((3S,7R,E)-3,7-дигидроксиокт-1-енил)-3-гидрокси-циклопентил)гептановая кислота (17).
[70] Раствор 137 мг (0,31 ммоль) сложного эфира 16 в 2 мл ТГФ гидролизовали 800 мкл (0,40 ммоль) водной гидроокиси лития (0,5М) и 1 мл метанола при 25°С в течение 6 ч. Смесь подкисляли добавлением 400 мкл 1,0М соляной кислоты и удаляли in vacuo остаточную воду. Остаточные продукты очищали методом флэш-хроматографии на 10 г силикагеля, при элюировании смесью 8% метанол/92% EtOAc, затем смесью 10% метанол/90% этилацетат. Из выделенных фракций отделяли 110 мг свободной кислоты 17 в виде масла (выход 88%); 1Н ЯМР (ацетон-d6): 1,13 (d, J=6,3 Гц, 3Н), 1,16-1,68 (m, 13Н), 1,86 (m, 1Н), 2,0-2,24 (m, 3Н), 2,29 (t, J=7,5 Гц, 2Н), 3,73 (m, 1Н), 4,09 (m, 3Н), 5,56 (m, 2Н). ЖХ-МС 373,3 [М++1-Н20].
Тестирование in vitro [71] Способы, использованные для получения in vitro данных, приведенных ниже в Таблицах 1 и 2, описаны в US 11/553143 от 26 октября 2006, который включен сюда посредством ссылки.