Результат интеллектуальной деятельности: КОМПЛЕКСНОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ГРИППА РАЗЛИЧНЫХ ТИПОВ
Вид РИД
Изобретение
Изобретение относится к области медицины и может быть использовано для лечения гриппа, в том числе гриппа A и гриппа B.
Из уровня техники известно лекарственное средство для лечения инфекционных заболеваний, в том числе вирусной этиологии, на основе активированной формы сверхмалых доз антител к интерферону (RU 2192888 C1, A61K 39/395, 20.11.2002).
Изобретение направлено на повышение эффективности лечения гриппа, в том числе гриппа A и гриппа B.
Решение поставленной задачи обеспечивается тем, что комплексное лекарственное средство для лечения гриппа различных типов, содержащее активированную-потенцированную форму антител к гамма-интерферону человека, согласно изобретению, содержит в качестве дополнительных действующих компонентов активированную-потенцированную форму антител к CD4 и активированную-потенцированную форму антител к гистамину.
При этом активированную-потенцированную форму антител к гамма-интерферону человека (ИФН-γ), активированную-потенцированную форму антител к CD4 рецептору и активированную-потенцированную форму антител к гистамину используют в виде активированного-потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного исходного-раствора антител в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - вертикальным встряхиванием каждого разведения, при этом конечные разведения содержат сверхмалые дозы (СМД) антител.
При этом комплексное лекарственное средство может быть выполнено в твердой лекарственной форме в виде фармацевтической композиции и содержать технологически необходимое (эффективное) количество нейтрального носителя, насыщенного смесью активированной-потенцированной формы антител к гамма-интерферону человека, активированной-потенцированной формы антител к CD4 рецептору и активированной-потенцированной формы антител к гистамину, и фармацевтически приемлемые добавки, которые включают, например, лактозу, целлюлозу микрокристаллическую и магния стеарат.
При этом водные или водно-спиртовые растворы активированных - потенцированных форм антител к гамма-интерферону человека, к CD4 рецептору и к гистамину получены путем многократного последовательного разведения матричного-исходного-раствора антител к гамма- интерферону человека, к CD4 рецептору и к гистамину в сочетании с внешним воздействием - вертикальным встряхиванием каждого разведения, при этом концентрация матричных растворов составляет 0,5÷5,0 мг/мл.
Предпочтительно каждый из компонентов заявленного лекарственного средства используют в виде смеси различных, преимущественно сотенных, разведений, приготовленных по гомеопатической технологии.
Решение поставленной задачи обеспечивается также тем, что в способе лечения гриппа различных типов путем введения в организм активированной - потенцированной формы антител к гамма- интерферону человека, согласно изобретению, дополнительно (одновременно и сочетано) вводят активированную-потенцированную форму антител к CD4 рецептору и активированную-потенцированную форму антител к гистамину.
Предпочтительно активированную - потенцированную форму антител к гамма-интерферону человека, активированную потенцированную форму антител к CD4 рецептору и активированную
- потенцированную форму антител к гистамину используют в виде активированного-потенцированного водного или водно-спиртового раствора каждого компонента, активность которого обусловлена процессом последовательного многократного разведения матричного-исходного-раствора антител в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - вертикальным встряхиванием каждого разведения.
При этом указанным вирусом гриппа может быть, например, грипп A, в том числе, сезонный грипп, H5N1 и H1N1, и грипп B.
При этом могут использовать приготовленные в виде единого лекарственного препарата - одной лекарственной формы смесь различных разведений антител к гамма-интерферону человека в сочетании (в комплексе) со смесью различных разведений антител к CD4 рецептору и к гистамину, приготовленных по гомеопатической технологии.
При этом каждый из действующих компонентов представляет собой смесь различных сотенных разведений, приготовленных по гомеопатической технологии.
Кроме того, заявленное лекарственное средство, как комплексное, содержит действующие компоненты в объемном соотношении 1:1:1, при этом каждый компонент используют в виде смеси трех соответствующих матричных растворов, разведенных в 10012, 10030, и 10050 раз, что эквивалентно сотенным разведениям С12, С30, С50, приготовленным по гомеопатической технологии.
Заявленное лекарственное средство рекомендуется принимать, предпочтительно, по 1-2 таблетке 2-4 раза в день.
При лечении гриппа различного типа, включая грипп A, в том числе, сезонный грипп, H5N1 и H1N1, и грипп B, возможно раздельное применение в виде трех отдельно приготовленных препаратов как в виде растворов, так и в твердых лекарственных формах (таблетках), каждый из которых содержит активированную-потенцированную форму антител к гамма-интерферону человека, активированную-потенцированную форму антител к CD4 рецептору и, соответственно, активированную-потенцированную форму антител к гистамину.
Согласно изобретению, активированная-потенцированная форма антител представляет собой форму антител, например, к гамма-интерферону человека, к CD4 рецептору или к гистамину, приготовленную по гомеопатической технологии потенцирования путем многократного последовательного разведения матричного-исходного-раствора антител в сочетании с внешним воздействием - вертикальным встряхиванием каждого разведения, которая обладает активностью в фармакологических моделях и/или клинических методах лечения гриппа различного типа, включая высокопатогенный грипп, грипп A, в том числе, сезонный грипп, H5N1 и H1N1, и грипп B.
Предложенное сочетание активированных-потенцированных форм антител к гамма-интерферону человека, к CD4 рецептору и к гистамину обеспечивает получение неожиданного синергетического терапевтического эффекта, экспериментально подтвержденного на адекватной модели, который заключается в повышении эффективности лечения гриппа различного типа, включая высокопатогенный грипп, грипп A, в том числе, сезонный грипп, H5N1 и H1N1, и грипп B, что обусловлено усилением противовирусной активности и усилением иммунотропного действия за счет повышения функциональной активности CD4 рецептора, рецепторов к гамма - интерферону и гистамину. Кроме того, применение заявленного препарата в пре- и поствакцинальном периоде увеличивает эффективность вакцинации, обеспечивает неспецифическую профилактику ОРВИ и гриппа в момент становления поствакцинального иммунитета, предупреждает развитие интеркуррентных заболеваний в поствакцинальном периоде.
При этом возможно применение заявленного комплексного лекарственного средства в сочетании с другими противовирусными препаратами и симптоматическими средствами.
Лекарственный препарат готовят, преимущественно, следующим образом.
Для приготовления активированной-потенцированной формы действующих компонентов используют моноклональные или, преимущественно, поликлональные антитела, которые могут быть получены по известным технологиям-методикам, описанным, например, в книге: Иммунологические методы, под ред. Г. Фримеля, М., «Медицина», 1987, с.9-33; или, например, в статье Laffly Е., Sodoyer R. Hum. Antibodies. Monoclonal and recombinant antibodies, 30 years after. - 2005 - Vol.14. - N 1-2. P.33-55.
Для проведения экспериментальных исследований могут быть использованы антитела, приготовленные по заказу специализированной биотехнологической фирмой.
Моноклональные антитела получают, например, с помощью гибридомной технологии. Причем начальная стадия процесса включает иммунизацию, основанную на принципах, уже разработанных при приготовлении поликлональных антисывороток. Дальнейшие этапы работы предусматривают получение гибридомных клеток, продуцирующих клоны одинаковых по специфичности антител. Их выделение в индивидуальном виде проводится теми же методами, что и в случае поликлональных антисывороток.
Поликлональные антитела могут быть получены активной иммунизацией животных. Для этого по специально разработанной схеме животным делают серию инъекций требуемым в соответствии с изобретением веществом-антигеном или конъюгированным антигеном: гамма-интерфероном человека, CD4 рецептором и гистамином. В результате проведения такой процедуры получают моноспецифическую антисыворотку с высоким содержанием антител, которую и используют для получения активированной потенцированной формы. При необходимости проводят очистку антител, присутствующих в антисыворотке, например, методом аффинной хроматографии, путем применения фракционирования солевым осаждением или ионообменной хроматографии.
Пример 1.
Для получения поликлональных антител к гамма-интерферону человека в качестве иммуногена (антигена) для иммунизации кроликов используют адъювант и, например, цельную молекулу гамма-интерферона человека следующей последовательности:
1 MKYTSYILAF QLCIVLGSLG CYCQDPYVKE AENLKKYFNA GHSDVADNGT LFLGILKNWK
61 EESDRKIMQS QIVSFYFKLF KNFKDDQSIQ KSVETIKEDM
NVKFFNSNKK KRDDFEKLTN
121 YSVTDLNVQR KAIHELIQVM AELSPAAKTG KRKRSQMLFR
GRRASQ
Возможно для получения поликлональных антител к гамма-интерферону человека в качестве иммуногена (антигена) для иммунизации кроликов использование адъюванта и, например, одного полипептидного фрагмента гамма-интерферона человека, выбранного из следующих последовательностей:
7-55:
ILAF QLCIVLGSLG CYCQDPYVKE AENLKKYFNA GHSDV
24-166:
QDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE
SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV
KFFNSNKKKR DDFEKLTNYS VTDLNVQRKAIHELIQVMAE
LSPAAKTGKR KRSQMLFRGR RASQ
24-166:
QDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE
SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV
KFFNSNKKKR DDFEKLTNYS VTDLNVQRKA IHELIQVMAE
LSPAAKTGKR KRSQMLFQGR RASQ
69-123:
QS QIVSFYFKLF KNFKDDQSIQ KSVETIKEDM NVKFFNSNKK
KRDDFEKLTN YSV
100-145:
M NVKFFNSNKK KRDDFEKLTN YSVTDLNVQR KAIHELIQVM
AELSP
92-130:
SVETIKEDM NVKFFNSNKK KRDDFEKLTN YSVTDLNVQR
123-147:
VTDLNVQR KAIHELIQVM AELSPAA
24-166:
MQDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE
SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV
KFFNSNKKKR DDFEKXTNYS VTDLNVQRKAIHELIQVMAE
LSPAAKTGKR KRSQMLFQGR RASQ
5-45:
SYILAF QLCIVLGSLG CYCQDPYVKE AENLK
94-114:
ETIKEDM NVKFFNSNKK KRDD,
24-166:
MQDPYVKEAE NLKKYFNAGH SDVADNGTLF LGILKNWKEE
SDRKIMQSQI VSFYFKLFKN FKDDQSIQKS VETIKEDMNV
KFFNSNKKKR DDFEKXTNYS VTDLNVQRKA IHELIQVMAE
LSPAAKTGKR KRSQMLFRGR RASQ
Перед отбором крови за 7-9 дней проводят 1-3 внутривенных инъекций для повышения уровня антител. В процессе иммунизации у кроликов отбирают небольшие пробы крови для оценки количества антител. Максимальный уровень иммунного ответа на введение большинства антигенов достигается через 40-60 дней после первой инъекции. После окончания первого цикла иммунизации кроликов в течение 30 дней дают восстановить здоровье и проводят реиммунизацию, включающую 1-3 внутривенные инъекции. Для получения антисыворотки из иммунизированных кроликов собирают кровь в центрифужную пробирку объемом 50 мл. С помощью деревянного шпателя удаляют со стенок пробирки образовавшиеся сгустки и помещают палочку в сгусток, образовавшийся в центре пробирки. Кровь помещают в холодильник (температура 4°C) на ночь. На следующий день удаляют сгусток, прикрепившийся к шпателю, и центрифугируют оставшуюся жидкость при 13000 g в течение 10 мин. Супернатант (надосадочная жидкость) является антисывороткой. Полученная антисыворотка должна быть желтого цвета. Можно добавлять к антисыворотке 20% NaN3 до конечной концентрации 0,02% и хранить до использования в замороженном состоянии при температуре -20°C (или без добавления NaN3 - при температуре -70°). Ввыделение из антисыворотки антител к гамма-интерферону возможно следующим образом:
1. 10 мл антисыворотки кролика разбавляют в 2 раза 0,15 М NaCl добавляют 6,26 г Na2SO4, перемешивают и инкубируют 12-16 ч при 4°C;
2. выпавший осадок удаляют центрифугированием, растворяют в 10 мл фосфатного буфера и затем диализуют против того же буфера в течение ночи при комнатной температуре;
3. после удаления осадка центрифугированием раствор наносят на колонку с ДЭАЭ-целлюлозой, уравновешенную фосфатным буфером;
4. фракцию антител определяют, измеряя оптическую плотность элюата при 280 нм.
Очистку антител производят методом аффинной хроматографии на колонке с антигеном, путем связывания антител к гамма-интерферону с антигеном (гамма-интерферон), прикрепленным к нерастворимому матриксу колонки, с последующим элюированием антител концентрированными растворами соли.
Полученный, таким образом, буферный раствор поликлональных кроличьих антитела к гамма-интерферону, очищенных на антигене, с концентрацией 0,5÷5,0 мг/мл, предпочтительно 2,0÷3,0 мг/мл, используют в качестве матричного (исходного) раствора для последующего приготовления активированной-потенцированной формы.
Поликлональные антитела к CD4 рецептору получают по вышеуказанному способу, используя в качестве иммуногена (антигена) для иммунизации кроликов адъювант и цельную молекулу или один полипептидный фрагмент CD4 рецептора, выбранный, например, из следующих аминокислотных последовательностей:
412-458:
IGLGIFFCV RCRHRRRQAE RMSQIKRLLS EKKTCQCPHR
FQKTCSPI
26-60:
MNRGVPFRHL LLVLQLALLP AATQGKKVVL GKKGD
105-119:
A DSRRSLWDQG NFPL
115-139:
G NFPLIIKNLKIEDSDTYICE VEDQ
|
Получение поликлональных антител к гистамину может быть произведено по вышеуказанному методу получения поликлональных антител к гамма-интерферону человека с использованием в качестве иммуногена (антигена) для иммунизации кроликов адъювант и гистамин (4-(2-Аминоэтил)-имидазол, или бета-имидазолил-этиламин с химической формулой C5H9N3.
Предпочтительным для приготовления заявленного лекарственного препарата является использование поликлональных антител к гамма-интерферону человека, к CD4 (например, к CD4 рецептору Т-лимфоцитов) и к гистамину, которые в качестве матричного (исходного) раствора с концентрацией 0,5÷5,0 мг/мл используют для последующего приготовления активированной-потенцированной формы.
Активированную - потенцированную форму каждого компонента готовят путем равномерного уменьшения концентрации в результате последовательного разведения 1 части каждого подвергаемого разведению раствора, начиная с упомянутого матричного раствора, в 9 частях (для десятичного разведения D) или в 99 частях (для сотенного разведения C) или в 999 частях (для тысячного разведения M) нейтрального растворителя в сочетании с многократным вертикальным встряхиванием (потенцированием, или "динамизацией") каждого полученного разведения и использованием отдельных емкостей для каждого последующего разведения до получения требуемой потенции - кратности разведения по гомеопатическому методу (см., например, В.Швабе "Гомеопатические лекарственные средства", М., 1967 г., с.14-29).
Внешнюю обработку в процессе уменьшения концентрации также можно осуществлять ультразвуком, электромагнитным или иным физическим воздействием.
Например, для приготовления 12-го сотенного разведения С12 одну часть матричного (исходного) раствора антител, например, к гамма-интерферону человека, с концентрацией 2,5 мг/мл разводят в 99 частях нейтрального водного или водно-спиртового растворителя и многократно (10 и более раз) вертикально встряхивают-потенцируют, получая 1-е сотенное С1 разведение. Из 1-го сотенного С1 разведения приготовляют 2-ое сотенное разведение С2. Данную операцию повторяют 11 раз, получая 12-е сотенное разведение С 12. Таким образом, 12-е сотенное разведение С 12 представляет собой раствор, полученный разбавлением последовательно 12 раз в разных емкостях 1-ой части исходного матричного раствора антител к гамма- интерферону человека с концентрацией 2,5 мг/мл в 99-ти частях нейтрального растворителя, т.е. раствор, полученный разведением матричного раствора в 10012 раз. Аналогичные операции с соответствующей кратностью разведения проводят для получения разведений С30 и С50.
При использовании, например, активированной-потенцированной формы антител к гамма-интерферону человека в виде смеси различных, преимущественно сотенных, разведений каждое разведение (например, С12, С30, С50) приготовляют раздельно по описанной выше технологии до разведения на 3 разведения меньше, чем конечное (соответственно, до получения С9, С27, С47), и затем вносят в соответствии с составом смеси в одну емкость по одной части каждого компонента и смешивают с требуемым количеством растворителя (соответственно, с 97 частями для сотенного разведения). Далее полученную смесь последовательно дважды разводят в соотношении 1 к 100, потенцируя полученный раствор после каждого разведения. При этом получают активированную - потенцированную форму антител, например, к гамма-интерферону человека в сверхмалой дозе, полученной разведением матричного раствора в 10012, 10030, 10050 раз, эквивалентной смеси сотенных разведений С12, С30, С50.
Возможно использование каждого компонента в виде смеси других различных, разведений, например, десятичных и или сотенных, (D20, С30, С100 или С12, С30, С200 и т.д.), приготовленных по гомеопатической технологии, эффективность которых определяют экспериментально.
Для получения заявленного лекарственного средства водные или водно-спиртовые растворы действующих компонентов смешивают, преимущественно, в объемном соотношении 1:1:1 и используют в жидкой лекарственной форме.
Заявленное лекарственное средство может быть выполнено и в твердой лекарственной форме в виде фармацевтической композиции, которая содержит технологически необходимое (эффективное) количество нейтрального носителя - например, лактозы - насыщенного путем пропитывания до насыщения смесью водных или водно-спиртовых растворов активированной-потенцированной формы антител к гамма-интерферону человека, активированной-потенцированной формы антител к CD4 рецептору и активированной-потенцированной формы антител к гистамину, и фармацевтически приемлемые добавки, включающие, преимущественно, лактозу, целлюлозу микрокристаллическую и магния стеарат.
Для получения твердой оральной формы заявленного лекарственного средства производят в установке кипящего слоя (например, типа «Huttlin Pilotlab» производства компании Htittlin GmbH) орошение до насыщения вводимых в псевдоожиженный - кипящий слой гранул нейтрального вещества - лактозы (молочного сахара) с размером частиц 50÷500 мкм, предварительно полученным водным или водно-спиртовым раствором активированной потенцированной формы антител к CD4 рецептору, преимущественно, в соотношении 1 кг раствора антител на 5 или 10 кг лактозы (1:5-1:10) с одновременной сушкой в потоке подаваемого под решетку нагретого воздуха при температуре не выше 40°C. Расчетное количество лактозы (10÷91% от таблеточной массы), насыщенной активированной-потенцированной формой антител по вышеуказанной методике, загружают в смеситель и смешивают с лактозой, увлажненной активированной-потенцированной формой антител, в количестве 3÷10% таблеточной массы и с чистой лактозой в количестве не более 84% от таблеточной массы (для снижения стоимости и некоторого упрощения и ускорения технологического процесса без снижения эффективности лечебного воздействия). Затем в эту смесь добавляют микрокристаллическую целлюлозу в количестве 5÷10% от таблеточной массы и стеарат магния в количестве 1% от таблеточной массы. Полученную таблеточную массу равномерно перемешивают и таблетируют прямым сухим прессованием (например, в таблет - прессе Korsch - XL 400) с формированием круглых таблеток массой 150÷500 мг. После таблетирования получают таблетки массой 300 мг, пропитанные водно-спиртовым раствором активированной-потенцированной формой антител к гамма-интерферону человека, к CD4 рецептору Т-лимфоцитов и к гистамину в сверхмалой дозе каждого компонента, приготовленной из матричного раствора, разведенного в 10012, в 10030 в 10050, что эквивалентно смеси сотенных разведений С12, С30 и С50, приготовленных по гомеопатической технологии.
Предпочтительно заявленную фармацевтическую композицию рекомендуется принимать по 1-2 таблетке 2-4 раза в день.
Пример 2
Для исследования свойств заявленных лекарственных средств для лечения пациентов группы активного препарата №1 были использованы таблетки массой 300 мг, пропитанные фармацевтической композицией, содержащей водно-спиртовые растворы (6 мг/табл.) активированных - потенцированных форм поликлональных аффинно очищенных кроличьих антител к гамма интерферону человека (анти-IFN-γ) и CD4 рецептора (анти-CD4) в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора в 10012, 10030, 100200 раз, эквивалентных смеси сотенных гомеопатических разведений С12, С300, С200 (СМД анти-IFN-γ+ анти-CD4); для лечения пациентов группы активного препарата №2 были использованы таблетки массой 300 мг, пропитанные фармацевтической композицией, содержащей водно-спиртовые растворы (6 мг/табл.) активированных - потенцированных форм поликлональных аффинно очищенных кроличьих антител к гамма интерферону человека (анти-IFN-γ), к CD4 рецептору (анти-СD4) и гистамину (анти-Н) в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора в 10012, 10030, 100200 раз, эквивалентных смеси сотенных гомеопатических разведений С12, С30, С200 (СМД анти-IFN-γ+анти-CD4+анти-H). Для лечения пациентов группы сравнения были использованы таблетки массой 300 мг, пропитанные водно-спиртовым раствором (3 мг/табл.) активированной - потенцированной формы поликлональных кроличьих антител к гамма интерферону человека, очищенных на антигене, в сверхмалой дозе, полученной сверхразведением исходного матричного раствора в 10012, 10030, 10050 раз, эквивалентной смеси сотенных гомеопатических разведений С12, С30, С50 (СМД анти-IFN-γ).
Антиретровирусную активность композиций СМД анти-IFN-γ+анти-CD4 и СМД анти-IFN-γ+анти-СD4+анти-Н оценивали в ходе открытого сравнительного клинического исследования с участием пациентов, инфицированных вирусом иммунодефицита человека (ВИЧ), которые наблюдались в Территориальном центре по профилактике и борьбе со СПИД'ом и инфекционными заболеваниями. В исследование были включены 65 мужчин и 32 женщины (всего 97 пациентов) в возрасте от 18 до 48 лет с вирусной нагрузкой ≥150 копий РНК ВИЧ-1 в 1 мл плазмы и уровнем CD4-лимфоцитов не ниже 250 клеток/мкл (или ≥0,25×109/л). 34 из 97 участников исследования наблюдались по поводу бессимптомного инфекционного статуса и ранее не получали лечения по поводу ВИЧ-инфекции (наивные пациенты). 63 из 97 пациентов находились на антиретровирусной терапии (APT) в течение 1-2 лет. В исследование не включались пациенты с циррозом печени, вирусным гепатитом С, тяжелыми сопутствующими заболеваниями в стадии обострения, беременные женщины, а также лица, принимающие внутривенно наркотические средства. Исследование проводили в осенне-зимний период, когда отмечался сезонный подъем заболеваемости гриппом и острыми респираторными инфекциями (ОРВИ).
75 пациента были рандомизированы в три группы, им была назначена терапия препаратами группы 1 и 2 или препаратом сравнения группы 3 в профилактической (в отношении гриппа/ОРВИ) дозировке - по 1 таблетке 1 раз в день в течение 6 недель, в том числе: пациентам группы 1 (n=25) была назначена композиция СМД анти-IFN-γ+анти-CD4 в виде монотерапии (подгруппа 1А: наивные пациенты, n=12) или в сочетании с APT (подгруппа 1Б, n=13); пациентам группы 2 (n=23) была назначена композициям СМД анти-IFN-γ+анти-CD4+анти-H, в том числе, в виде монотерапии (подгруппа 2А: наивные пациенты, n=11) или в сочетании с APT (подгруппа 2Б, n=12); пациентам группы 3 (n=27) был назначен препарат СМД анти-IFN-γ, в том числе, в виде монотерапии (подгруппа 3А: наивные пациенты, n=11) или в сочетании с APT (подгруппа 3Б, n=16). Контрольную (четвертую) группу (n=22) составили пациенты, которые продолжали получать APT по прежней схеме без добавления какого-либо изучаемого препарата (группа APT).
Исходно и через 6 недель у всех пациентов оценивали вирусную нагрузку, уровень CD4 и CD8 лимфоцитов, иммунорегуляторный индекс CD4/CD8. Для определения копий РНК ВИЧ-1 в плазме крови использовали наборы COBAS AMPLICOR HTV-1 MONITOR Kit, version 1,5 для автоматического ПНР-анализатора СОВAS AMPLICOR (Roche, Швейцария). Фенотипирование циркулирующих лимфоцитов периферической крови выполняли на проточном цитофлюориметре FACSCount (Becton Dickinson, США) с использованием стандартных тест-систем FACSCount Reagent Kit, содержащих антитела к CD3, CD4, CD8, меченные флюорохромами FITC, РЕ.
В таблице 1 представлены данные по вирусной нагрузке (числу копий РНК ВИЧ) в виде значений медианы (Me), первого и третьего квартилей (Q1, Q3) у пациентов исследуемых групп в динамике наблюдения. В результате исследования установлено, что 6-недельный прием композиции СМД анти-IFN-γ+анти-CD4 приводил к снижению количества копий РНК ВИЧ-1 у 58% наивных пациентов (у 7 из 12 человек подгруппы 1А), при этом среднее снижение вирусной нагрузки составило 16,9%. Сочетанное применение композиции СМД анти-IFN-γ+анти-CD4 и APT было не менее эффективным, поскольку уменьшение количества копий РНК ВИЧ-1 отмечено у 62% участников исследования (у 8 из 13 человек подгруппы 1Б), а снижение вирусной нагрузки в среднем было 18,2% от исходного уровня. Примерно сходные показатели получены при использовании композиции СМД анти-IFN-γ+анти-СD4+анти-Н: противовирусная активность регистрировалась у 55% ВИЧ-инфицированных наивных пациентов (у 6 из 11 человек подгруппы 2А) и у 67% лиц, получавших комбинацию СМД анти-IFN-γ+анти-CD4+анти-H и APT (у 8 из 12 человек подгруппы 2Б); среднее снижение вирусной нагрузки составило 17,3%) и 18,9% соответственно. Антиретровирусная активность, отмеченная в первых двух группах, была несколько выше результатов лечения, полученных у пациентов группы сравнения. Монотерапия СМД анти-IFN-γ через 6 недель снижала количество копий РНК ВИЧ-1 у 36% наивных пациентов (у 4 из 11 человек подгруппы 3А), при этом уменьшение вирусной нагрузки в среднем составило 9,5%. Сочетанное применение монокомпонентного препарата СМД анти-IFN-γ и APT повышало эффективность терапии, способствуя снижению вирусной нагрузки у 50% участников исследования (у 8 из 16 человек подгруппы 3Б) в среднем на 14,2%. Аналогичные показатели лечения у лиц, получавших только APT (контрольная группа 4), составили 32% (у 7 из 22 человек группы 4) и 13,3% соответственно.
Анализ показателей субпопуляций циркулирующих лимфоцитов в динамике наблюдения (Таблица 2) показал более выраженное, чем в контрольной группе, увеличение числа CD4 лимфоцитов через 6 недель терапии при использовании СМД анти-IFN-γ+анти-CD4, СМД анти-IFN-γ+анти-CD4+анти-H и СМД анти-IFN-γ в виде монотерапии у наивных пациентов (подгруппы 1А, 2А и 3А) или при сочетании с APT (подгруппы 1Б, 2Б и 3Б). При этом число CD8 через 6 недель приема препаратов (моно- либо сочетанная терапия) не менялось ни в одной из изучаемых групп. Позитивная динамика со стороны СБ4-лимфоцитов в ходе лечения приводила к повышению иммунорегуляторного индекса CD4/CD8, наиболее значимому в подгруппах пациентов, принимавших композиции СМД анти-IFN-γ+анти-CD4 и анти-IFN-γ+анти-СD4+анти-Н (моно- или сочетанная терапия - группы I и 2) и СМД анти-IFN-γ в сочетании с APT (подгруппа 3Б).
|
|
Отсутствие у пациентов в ходе лечения нежелательных явлений, связанных с приемом исследуемых лекарственных средств, свидетельствовало о хорошей переносимости препаратов. Повторный контроль лабораторных показателей, в том числе, анализов крови и мочи, биохимических маркеров, подтверждало безопасность лечения.
Таким образом, проведенное исследование продемонстрировало антиретровирусную эффективность препарата СМД анти-IFN-γ+анти-CD4 и препарата СМД анти-IFN-γ+анти-CD4+анти-H, обусловленную, очевидно, изменением функциональной активности CD4 рецепторов, что препятствует проникновению ВИЧ в клетки, а также подавлением репликации ВИЧ внутри клетки за счет активации процессов транскрипции мРНК противовирусных белков. Установлено, что снижение вирусной нагрузки, отмеченное в результате 6-недельного приема препарата СМД анти-IFN-γ+анти-CD4 и препарата СМД анти-IFN-γ+анти-CD4+анти-H в дозе 1 таблетка в день, превышает противовирусный эффект, который регистрируется через 6 недель приема монокомпонентного препарата СМД анти-IFN-γ в той же дозе либо продолжающейся по прежней схеме APT. Сочетание какого-либо препарата СМД aHTH-IFN-γ+aHTH-CD4, СМД анти-IFN-γ+анти-СD4+анти-Н или СМД анти-IFN с APT несколько усиливает противовирусную активность последней, что проявляется в уменьшении среднего значения вирусной нагрузки через 6 недель у большего процента участников исследования.
Показано влияние препаратов СМД анти-IFN-γ+анти-CD4 и анти-IFN-γ+анти-CD4+анти-H на соотношение CD4/CD8 лимфоцитов у ВИЧ-инфицированных пациентов (за счет некоторого увеличения абсолютного количества СD4-клеток), наиболее выраженное при совместном использовании с APT. Учитывая одновременное снижение вирусной нагрузки у пациентов, принимающих препараты СМД анти-IFN-γ+анти-CD4 и СМД анти-IFN-γ+анти-CD4+анти-H, можно полагать, что увеличение количества CD4-клеток связано с пополнением популяции этих клеток за счет здоровых (неинфицированных) клеток. Сочетание APT с препаратами СМД анти-IFN-γ+анти-CD4, СМД анти-IFN-γ+анти-CD4+анти-H или СМД анти-IFN более эффективно в отношении восстановления иммунорегуляторного индекса CD4/CD8, чем продолжающаяся APT по прежней схеме.
Антиретровирусная активность препаратов СМД анти-IFN-γ+анти-CD4 и СМД анти-IFN-γ+анти-СD4+анти-Н позволяет использовать их с профилактической и лечебной целью как у наивных ВИЧ-инфицированных пациентов, так и у лиц, получающих APT.
Примера 3.
Для экспериментального изучения заявленного технического решения были использованы таблетки массой 300 мг, пропитанные фармацевтической композицией, содержащей водно-спиртовые растворы (6 мг/табл.) активированных - потенцированных форм поликлональных аффинно очищенных кроличьих антител к гамма интерферону человека (AT ГИ), к CD4 рецептору молекуле Т-лимфоцитов (AT CD4), к гистамину (AT Г), в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора в 10012, 10030, 100200 раз каждого компонента, эквивалентных смеси сотенных гомеопатических разведений С12, С30, С200 (AT ГИ +AT CD4+AT Г). В качестве препарата сравнения используют препарат, содержащий активированные - потенцированные формы поликлональных аффинно очищенных кроличьих антител к гамма интерферону человека (AT ГИ) в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора в 10012, 10030, 100200 раз, эквивалентных смеси сотенных гомеопатических разведений С12, С30, С200 (СМД AT ГИ). Группа плацебо получала таблетки массой 300 мг, содержащие лактозу моногидрат, целлюлозу микрокристаллическую, магния стеарат.
В продолжающемся двойном слепом плацебоконтролируемое исследовании эффективности и безопасности препарата AT ГИ+AT CD4+AT Г при ОРВИ и в продолжающемся открытом сравнительном контролируемом исследовании эффективности и безопасности препарата AT ГИ+AT CD4+AT Г при гриппе дополнительно оценивали число развившихся на фоне острого инфекционного процесса осложнений, в том числе бактериальных (бактериальная пневмония, трахеит, отит, гломерулонефрит и др.).
В тех случаях, когда система защиты совершенна, - инфекционный процесс может прерваться или, оставаясь локализованным, не сопровождаться развитием выраженных клинических симптомов, т.е. адекватность защитных реакций приводит к быстрой инактивации возбудителя, восстановлению нарушенных функций организма и выздоровлению. Иная картина возникает в организме, высоковосприимчивом к инфекционному возбудителю и не располагающим совершенным механизмом специфической и неспецифической защиты (иммунокомпрометированные пациенты). В таких случаях репродуцировавшиеся во все возрастающем количестве возбудители и продукты их взаимодействия с эпителиальными и иммунными клетками, а также сами разрушенные клетки попадают в кровь, обусловливая развитие тяжелых форм течения болезни, формирование осложнений и возможный неблагоприятный исход.
Применение препарата AT ГИ+AT CD4+AT Г как при гриппе, так и при ОРВИ способствует значительному снижению частоты бактериальных осложнений по сравнению с плацебо (Таблица 3), и, как следствие, снижению потребности в антибактериальной терапии. Препарат AT ГИ+AT CD4+AT Г препятствует развитию вторичного иммунодефицита на этапе реконвалесценции, оказывая иммуномодулирующий эффект и повышая естественные защитные силы организма. Способность AT ГИ+AT CD4+AT Г снижать частоту развития бактериальных осложнений превышала по сравнению с препаратом СМД AT ГИ.
|
Пример 4.
Для экспериментального изучения заявленного технического решения были использованы таблетки массой 300 мг, пропитанные фармацевтической композицией, содержащей водно-спиртовые растворы (6 мг/табл.) активированных - потенцированных форм поликлональных аффинно очищенных кроличьих антител к гамма интерферону человека (AT ГИ), к CD4 рецептору молекуле Т-лимфоцитов (AT CD4), к гистамину (AT Г), в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора в 10012, 10030, 100200 раз каждого компонента, эквивалентных смеси сотенных гомеопатических разведений С12, СЗО, С200 (AT ГИ+AT CD4+AT Г). В качестве препарата сравнения использовали препарат Тамифлю® (действующее вещество - озельтамивир, Ф. Хоффманн-Ля Рош Лтд. - Швейцария) (Осельтамивир).
В продолжающееся открытое сравнительное контролируемое клиническое исследование препарата AT ГИ+AT CD4+AT Г и препарата Тамифлю® включаются пациенты в возрасте 18-60 лет обоего пола, с гриппом А или В с признаками интоксикации и катаральным синдромом. В исследование включаются пациенты с температурой тела 37,8°C и более (при условии регистрации такой температуры с момента начала заболевания), длительностью заболевания не более 48 часов до начала лечения, без тяжелых сопутствующих заболеваний. Пациентам проводится экспресс-тест на наличие антигенов вируса гриппа. Пациенты с отрицательными результатами теста не включаются в исследование. Все пациенты дают письменное добровольное согласие на участие в исследовании перед началом всех процедур исследования. Пациенты заполняют дневники, в которых регистрируют температуру тела дважды в день, сопутствующую терапию и пр. Пациенты получают препарат AT ГИ+AT CD4+AT Г по 8 таблеток в первый день и по три таблетки в день со второго по пятый дни, или Тамифлю® по 75 мг дважды в день, согласно инструкции производителя. Пациенты могут принимать жаропонижающие препараты при необходимости. Не допускается применение противовирусных, иммуномодулирующих, антигистаминных препаратов и антибиотиков. Перед первым приемом препарата и на последнем визите пациенты сдают образцы крови и мочи для проведения лабораторных исследований с целью мониторинга безопасности проводимой терапии. Лечение продолжается 5 суток, последующее наблюдение - 2 суток. Таким образом, в среднем, каждый пациент принимает участие в исследовании в течение 7 дней.
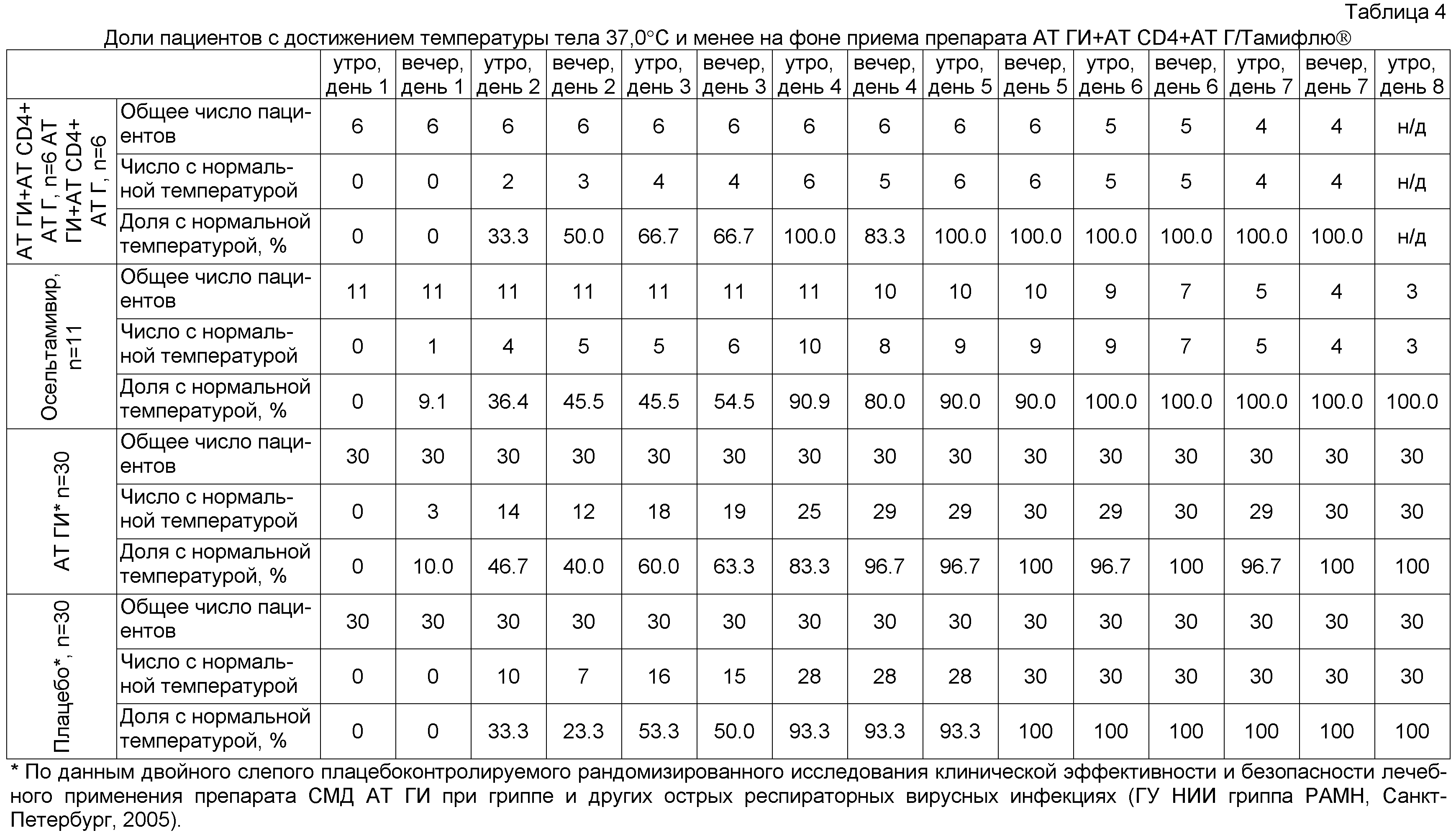
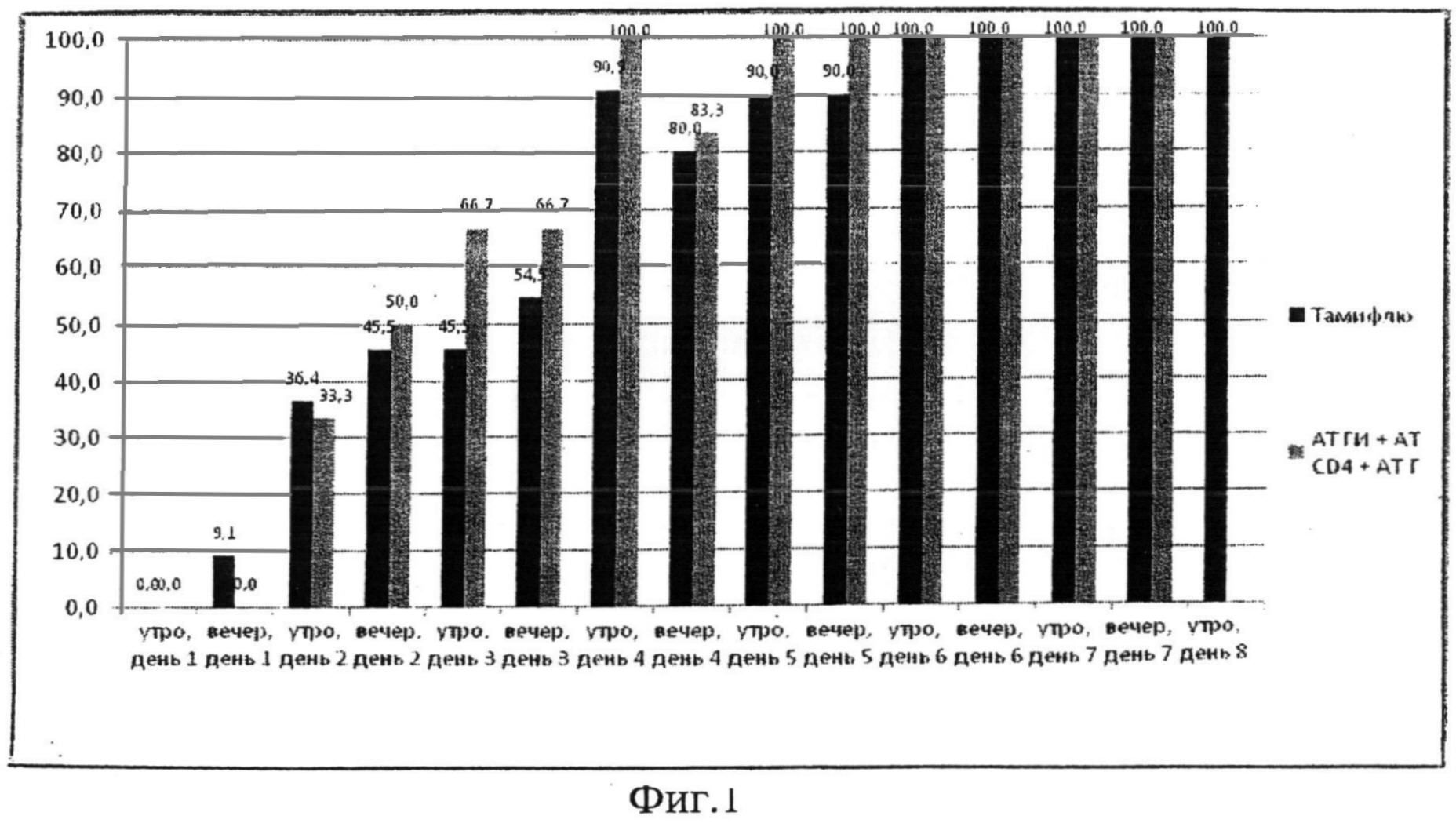
Эффективность терапии оценивалась по срокам достижения температуры тела 37,0°C и менее, также сравнивалось число приемов антипиретиков.
На момент проведения анализа исследование завершило 17 пациентов (6 пациентов группы препарата AT ГИ+AT CD4+AT Г и 11 пациентов группы приема Тамифлю®).
Доли пациентов с достижением температуры тела 37,0°C и менее в группах статистически не различались между собой на протяжении всего периода лечения. Уже к началу 4-х суток лечения в обеих группах было достигнуто почти полное выздоровление пациентов (Фиг.2). Уже к началу вторых суток лечения в обеих группах у трети пациентов была зарегистрирована нормализация температуры тела. Среднее число приемов жаропонижающих в группах также не имело статистически значимых различий и на начало 4-х суток терапии составило 7,6±0,84 в группе приема препарата AT ГИ+AT CD4+AT Г и 7,4±0,90 в группе приема препарата Тамифлю® соответственно.
В анализ безопасности были включены данные всех 17 пациентов, участвовавших в исследовании и завершивших лечение в установленные протоколом сроки, досрочно выбывших пациентов не было. В течение всего периода наблюдения отмечалась хорошая переносимость препарата, нежелательные явления не отмечались. Исследование анализа крови в начале и конце периода лечения не выявило патологических отклонений. Общий анализ мочи в первый и заключительный день исследования также не выявил патологии ни у одного пациента.
При сравнении полученных данных с результатами проведенного в 2005 году двойного слепого плацебоконтролируемого рандомизированного исследования клинической эффективности и безопасности лечебного применения препарата, содержащего активированные - потенцированные формы поликлональных аффинно очищенных кроличьих антител к гамма интерферону человека (AT ГИ) в сверхмалых дозах (СМД), полученных сверхразведением исходного матричного раствора в 10012, 10030, 100200 раз, эквивалентных смеси сотенных гомеопатических разведений С12, С30, С200 (СМД AT ГИ) при гриппе и других острых респираторных вирусных инфекциях (ГУ НИИ гриппа РАМН, Санкт-Петербург, 2005) было выявлено, что препарат AT ГИ+AT CD4+AT Г более эффективно по сравнению с СМД AT ГИ снижает температуру (см. Фиг.1, Таблица 4 и Таблица 5).