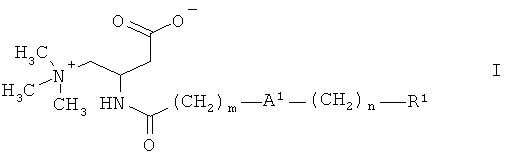Результат интеллектуальной деятельности: 4-ТРИМЕТИЛАММОНИОБУТИРАТЫ В КАЧЕСТВЕ ИНГИБИТОРОВ СРТ2
Вид РИД
Изобретение
Настоящее изобретение относится к новым 4-триметиламмониобутирата» качестве ингибиторов СРТ2, способу получения этих соединений, фармацевтическим препаратам, которые содержат такие соединения, а также к применению этих соединений для изготовления лекарственных средств.
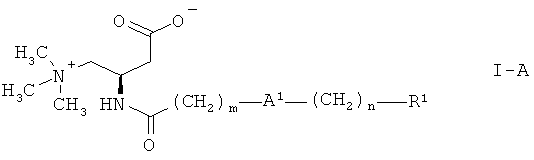
Более конкретно, изобретение относится к соединениям формулы:
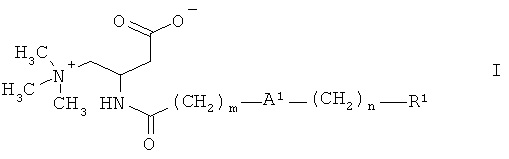 ,
,
где
А1 представляет собой О или связь,
m выбран из 3, 4, 5, 6, 7, 8, 9 и 10,
n выбран из 1, 2, 3, 4 и 5,
R1 представляет собой арил, выбранный из фенила и нафтила, причем указанный арил является незамещенным или замещен одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, состоящей из низшего алкила, галогена, низшего галогеналкила, низшей алкоксигруппы и фенила, или
гетероарил, выбранный из группы, состоящей из пиридила, тиенила и тиазолила, причем указанный гетероарил является незамещенным или замещен одной, двумя или тремя группами, выбранными из низшего алкила, галогена, низшего галогеналкила, низшей алкоксигруппы и фенила,
и их фармацевтически приемлемым солям.
Повышенные плазменные уровни свободных жирных кислот (FFA) вызывают острую и длительную периферийную и печеночную инсулиновую резистентность. Повышенные плазменные уровни FFA и повышенное окисление FFA связаны с диабетом 2 типа. Гипергликемия после голодания в течение ночи является основным признаком и важным диагностическим критерием диабета, и избыточный глюконеогенез главным образом является ответственным за послеабсорбционную гипергликемию у пациентов с диабетом. Высокие уровни свободных жирных кислот (FFA) приводит к повышению митохондриального β-окисления в печени, которое приводит к повышенным концентрациям ацетил СоА. Это обеспечивает повышенную энергию (АТФ) и пониженную силу (NADH) для глюконеогенеза. Повышенные уровни ацетил СоА также стимулируют глюконеогенез аллостерической активацией пируваткарбоксилазы. Таким образом, снижение избыточного β-окисления в печени, которое является критическим для управления эффективности глюконеогенеза, должно приводить к снижению гипергликемии натощак у пациентов с диабетом. Митохондриальное окисление длинных цепей FFA требует участия двух мембраносвязанных карнитин-зависимых пальмитоилтрансфераз (СРТ). СРТ1, внешний митохондриальный мембранный фермент, катализирует образование длинноцепочечных ацилкарнитинов. Изоформы СРТ1 печени (L-CPT1) и мышц (М-СРТ1) кодируются двумя различными генами, и ингибируются малонил-СоА. N-терминальный домен L-CPT1 придает ему меньшую чувствительность к малонил СоА. СРТ2, внутренний митохондриальный мембранный фермент, восстанавливает длинноцепочечные ацилкарнитины в длинноцепочечные сложные эфиры ацил-СоА. Длинноцепочечные ацил-СоА затем β-окисляются до ацетил-СоА, которые активируют пируваткарбоксилазу и глюконеогенез. В соответствии с описанным выше механизмом действия, фармацевтически активные вещества, которые ингибируют транспорт длинных цепей FFA путем ингибирования СРТ, снижают β-окисление в печени, тем самым ингибируют глюконеогенез, и следовательно, препятствуют гипергликемии.
Настоящее изобретение относится к новым соединениям, которые ингибируют активность карнитинпальмитоилтрансферазы (СРТ), в частности/предпочтительно активность СРТ2. Соединения настоящего изобретения могут использоваться в качестве фармацевтически активных агентов, которые полезны для профилактики и/или лечения заболеваний, которые модулируются ингибиторами СРТ, в частности/предпочтительно ингибиторами СРТ2, особенно заболеваний, которые связаны с гипергликемией и/или нарушениями толерантности к глюкозе. Такие заболевания включают, например, диабет и связанные с ним патологии, инсулиннезависимый сахарный диабет (также известный как диабет II типа), ожирение, гипертензию, синдром инсулиновой резистентности, метаболический синдром, гиперлипидемию, гиперхолестеринемию, жировой гепатоз, атеросклероз, острую сердечную недостаточность и почечную недостаточность.
Новые соединения настоящего изобретения превосходят соединения, известные из предшествующего уровня техники, поскольку они ингибируют в частности или предпочтительно активность СРТ2. Следовательно, предполагается, что они обладают повышенным терапевтическим потенциалом по сравнению с соединениями, уже известными из предшествующего уровня техники.
Если не указано иное, следующие определения приведены для иллюстрации и определения значения и объема различных терминов, использующихся для описания изобретения.
В данном описании термин «низший» используется для обозначения группы, содержащей от одного до семи, предпочтительно от одного до четырех атомов углерода.
Термин «галоген» обозначает фтор, хлор, бром и йод, где фтор, хлор и бром являются предпочтительными.
Термин «алкил», отдельно или в комбинации с другими группами, обозначает разветвленный или линейный моновалентный насыщенный алифатический углеводородный радикал, содержащий от одного до двадцати атомов углерода, предпочтительно от одного до шестнадцати атомов углерода, более предпочтительно от одного до десяти атомов углерода. Термин «C1-10-алкил» обозначает разветвленный или линейный моновалентный насыщенный алифатический углеводородный радикал, содержащий от одного до десяти атомов углерода, такой как, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил, 1,1,3,3-тетраметилбутил и им подобные. Низшие алкильные группы как описано далее также являются предпочтительными алкильными группами.
Термин «низший алкил» или «С1-С7-алкил», отдельно или в комбинации с другими группами, обозначает разветвленный или линейный моновалентный алкильный радикал, содержащий от одного до семи атомов углерода, предпочтительно от одного до четырех атомов углерода. Этот термин далее представлен такими радикалами, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и им подобные.
Термин «низший галогеналкил» или «галоген-С1-С7-алкил» обозначает низшие алкильные группы как определено выше, где по крайней мере один из атомов водорода низшей алкильной группы замещен атомом галогена, предпочтительно фтором или хлором, наиболее предпочтительно фтором. Предпочтительными низшими галогеналкильными группами являются трифторметил, дифторметил, трифторэтил, 2,2-дифторэтил, фторметил и хлорметил, где трифторметил является особенно предпочтительным.
Термин «алкоксигруппа» или «низшая алкоксигруппа» обозначает группу R'-O-, где R' представляет собой низший алкил, и термин «низший алкил» имеет приведенное выше значение. Примерами низших алкоксигрупп являются, например, метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа и трет-бутоксигруппа, предпочтительно метоксигруппа и этоксигруппа, и наиболее предпочтительно метоксигруппа.
Соединения формулы (I) могут образовывать фармацевтически приемлемые соли. Соединения формулы (I) могут образовывать соли с основаниями. Примерами таких солей являются соли с щелочным металлом, щелочноземельным металлом и соли аммония, такие как, например, соли Na-, К-, Са- и триметиламмония. Соединения формулы I также могут образовывать фармацевтически приемлемые кислотные аддитивные соли. Примерами таких фармацевтически приемлемых солей являются соли соединений формулы (I) с физиологически совместимыми минеральными кислотами, такими как хлористоводородная кислота, серная кислота или фосфорная кислота; или с органическими кислотами, такими как метансульфоновая кислота, п-толуолсульфоновая кислота, уксусная кислота, молочная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, янтарная кислота или салициловая кислота. Термин «фармацевтически приемлемые соли» обозначает все эти соли.
Более подробно, настоящее изобретение относится к соединениям формулы:
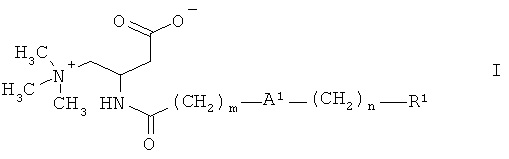 ,
,
где
А1 представляет собой О или связь,
m выбран из 3, 4, 5, 6, 7, 8, 9 и 10,
n выбран из 1, 2, 3, 4 и 5,
R1 представляет собой арил, выбранный из фенила и нафтила, причем указанный арил является незамещенным или замещен одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, состоящей из низшего алкила, галогена, низшего галогеналкила, низшей алкоксигруппы и фенила, или
гетероарил, выбранный из группы, состоящей из пиридила, тиенила и тиазолила, причем указанный гетероарил является незамещенным или замещен одной, двумя или тремя группами, выбранными из низшего алкила, галогена, низшего галогеналкила, низшей алкоксигруппы и фенила,
и их фармацевтически приемлемым солям.
Соединения формулы I являются отдельно предпочтительными, и их фармацевтически приемлемые соли являются отдельно предпочтительными, причем соединения формулы I являются особенно предпочтительными.
Предпочтительными являются также соединения формулы I в соответствии с изобретением, где А1 представляет собой О (кислород).
Предпочтительными также являются соединения формулы I в соответствии с настоящим изобретением, где m выбран из 6, 7, 8, 9 и 10. Особенно предпочтительными являются соединения формулы I, где m равен 7.
Также предпочтительными являются соединения формулы I в соответствии с изобретением, где n выбран из 1, 2, 3 и 4, причем более предпочтительными являются соединения, где n равен 1 или 2, и особенно предпочтительными являются соединения, где n равен 1.
Особенно предпочтительными являются соединения формулы I, где сумма тип выбрана из 8, 9, 10 и 11.
Группой предпочтительных соединений формулы (I) в соответствии с изобретением являются соединения, где R1 представляет собой арил, выбранный из фенила и нафтила, причем указанный арил является незамещенным или замещен одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, состоящей из низшего алкила, галогена, низшего галогеналкила, низшей алкоксигруппы и фенила.
Особенно предпочтительными являются соединения формулы I в соответствии с изобретением, где R1 представляет собой фенил, замещенный одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, состоящей из низшего алкила, галогена, низшего галогеналкила, низшей алкоксигруппы и фенила. Более предпочтительными являются соединения формулы I, где R1 представляет собой фенил, замещенный одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, состоящей из низшего алкила, галогена, низшего галогеналкила, низшей алкоксигруппы и фенила, при условии, что по крайней мере один из заместителей представляет собой галоген или низший галогеналкил. Особенно предпочтительный R1 представляет собой фенил, замещенный одной, двумя, тремя, четырьмя или пятью группами, выбранными из галогена и низшего галогеналкила.
Другой группой предпочтительных соединений формулы I в соответствии с настоящим изобретением являются соединения, где R1 представляет собой гетероарил, выбранный из группы, состоящей из пиридила, тиенила и тиазолила, причем указанный гетероарил является незамещенным или замещен одной, двумя или тремя группами, выбранными из низшего алкила, галогена, низшего галогеналкила, низшей алкоксигруппы и фенила.
Особенно предпочтительными являются соединения формулы I по изобретению, где R1 представляет собой тиенил.
Кроме того, соединения формулы I с (R)-конфигурацией являются особенно предпочтительными, то есть соединения формулы:
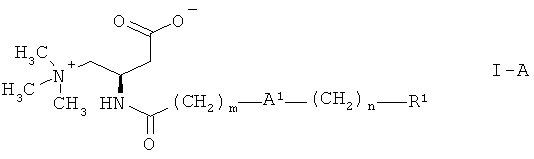 .
.
Предпочтительными соединениями формулы I являются соединения, выбранные из группы, состоящей из следующих соединений:
(R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(2,5-дифторбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(2,4-дифторбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(2,3,4-трифторбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(пентафторфенилметокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(4-трифторметилбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(3-фтор-4-трифторметилбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(4-метоксибензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(бифенил-4-илметокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(2-фтор-4-трифторметилбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(нафтален-1-илметокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-(8-бензилоксиоктаноиламино)-4-триметиламмониобутират,
(R)-3-[8-(2-фторбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(3-фторбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(4-фторбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(2,3-дифторбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-(10-фенилдеканоиламино)-4-триметиламмониобутират,
(S)-3-(10-фенилдеканоиламино)-4-триметиламмониобутират,
(R)-3-[10-(2-фторфенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-[10-(2,5-диметилфенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-[10-(2,6-диметилфенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-[10-(4-метоксифенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-(10-нафтален-1-илдеканоиламино)-4-триметиламмониобутират,
(R)-4-триметиламмонио-3-[10-(4-трифторметилфенил)деканоиламино]бутират,
(R)-3-[10-(3-фторфенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-[10-(2,3-дифторфенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-(10-тиофен-3-илдеканоиламино)-4-триметиламмониобутират,
(R)-3-(6-фенилгексаноиламино)-4-триметиламмониобутират,
(R)-3-(7-фенилгептаноиламино)-4-триметиламмониобутират,
(R)-3-(8-фенилоктаноиламино)-4-триметиламмониобутират,
(R)-3-(9-фенилнонаноиламино)-4-триметиламмониобутират,
(R)-3-(11-фенилундеканоиламино)-4-триметиламмониобутират,
(R)-3-(12-фенилдодеканоиламино)-4-триметиламмониобутират,
и их фармацевтически приемлемые соли.
Особенно предпочтительными соединениями формулы I является соединения, выбранные из группы, состоящей из следующих соединений:
(R)-3-[8-(4-трифторметилбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(3-фтор-4-трифторметилбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(бифенил-4-илметокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(нафтален-1-илметокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-[8-(3-фторбензилокси)октаноиламино]-4-триметиламмониобутират,
(R)-3-(10-фенилдеканоиламино)-4-триметиламмониобутират,
(S)-3-(10-фенилдеканоиламино)-4-триметиламмониобутират,
(R)-3-[10-(2-фторфенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-[10-(2,5-диметилфенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-[10-(2,6-диметилфенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-[10-(4-метоксифенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-(10-нафтален-1-илдеканоиламино)-4-триметиламмониобутират,
(R)-3-[10-(3-фторфенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-[10-(2,3-дифторфенил)деканоиламино]-4-триметиламмониобутират,
(R)-3-(10-тиофен-3-илдеканоиламино)-4-триметиламмониобутират,
(R)-3-(12-фенилдодеканоиламино)-4-триметиламмониобутират,
и их фармацевтически приемлемые соли.
Ясно, что из соединений общей формулы I настоящего изобретения могут быть получены производные по функциональным группам с получением производных, которые способны превращаться обратно в исходное соединение in vivo.
Настоящее изобретение также относится к способу получения соединений формулы I как определено выше, который включает:
реакцию третичного амина формулы:
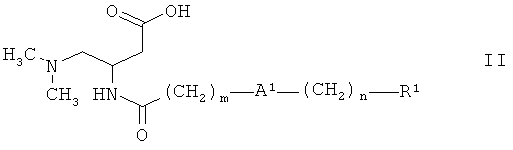 ,
,
где А1, m, n и R1 являются такими, как определено выше,
с метилирующим агентом в присутствии основания в полярном растворителе с получением соединения формулы:
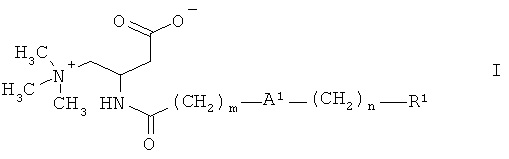 ,
,
Метилирующие агент предпочтительно выбран из йодметана или метилового эфира трифторметансульфоновой кислоты. «В присутствии основания» обозначает предпочтительно в присутствии гидрокарбоната натрия или гидрокарбоната калия. Полярный растворитель предпочтительно выбран из метанола или ацетонитрила. Предпочтительно, реакцию осуществляют при температуре от 0°С до 60°С.
Поскольку соединений формулы I с (R)-конфигурацией являются предпочтительными, третичные амины формулы:
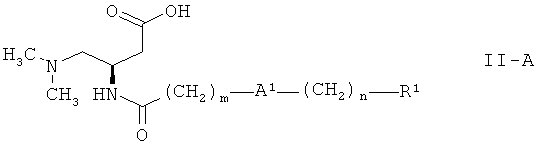 ,
,
предпочтительно используются в способе настоящего изобретения. Настоящее изобретение также относится к соединениям формулы I как определено выше, полученным описанным выше способом.
Более подробно, соединения формулы I настоящего изобретения получают из соответствующих третичных аминов II. Превращение соединения II в соединение I осуществляют с помощью метилирующего реагента, такого как йодметан или метиловый эфир трифторметансульфоновой кислоты, в присутствии основания, например, гидрокарбоната натрия или гидрокарбоната калия, в растворителе, таком как метанол или ацетонитрил, при температуре от 0°С до 60°С.
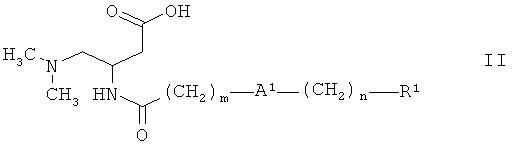
Соединения формулы II получают из соответствующих сложных эфиров 1 (Rp = метил, этил, бензил), используя способы, известные из предшествующего уровня техники. Особенно предпочтительными являются соединения 1, где Rp = бензил, которые могут быть превращены в соединение II гидрированием под давлением от 1 до 10 бар, используя подходящий катализатор, например, палладий на активированном угле, в растворителе, таком как метанол или этанол, при температуре от 0°С до 50°С. Альтернативно, сложные эфиры 1 могут быть превращены в соединение II основным гидролизом, используя реагенты, такие как гидроксид лития, гидроксид натрия, гидроксид калия, в растворителях, таких как вода, метанол, этанол, тетрагидрофуран, или их смеси, при температуре от 0°С до 100°С.
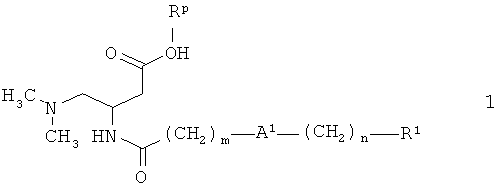
Альтернативно, соединения формулы II, где А1 представляет собой связь и n обозначает 2, также могут быть получены из сложного эфира 2 (когда Rp представляет собой бензил) гидрированием, как описано выше, поскольку двойная связь, соседняя с R1, в результате используемой методики синтеза (см. ниже) также восстанавливается. Когда Rp представляет собой метил, этил или бензил, превращение соединения 2 в соединение (II) также может осуществляться в две стадии следующим образом: На первой стадии описанная выше двойная связь восстанавливается триэтилсиланом и трифторуксусной кислотой в инертном растворителе, таком как толуол или дихлорметан. На второй стадии сложноэфирная группа гидролизуется, используя реагенты, такие как гидроксид лития, гидроксид натрия, гидроксид калия, в растворителях, таких как вода, метанол, этанол, тетрагидрофуран или их смеси, при температуре от 0°С до 100°С.
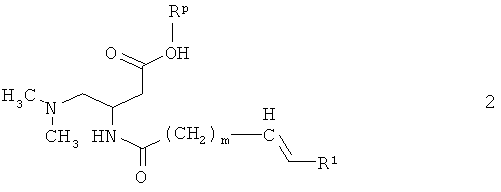
Соединения формулы 1 получают из 3-амино-4-диметиламинобутирата 3:
и карбоновой кислоты 4:
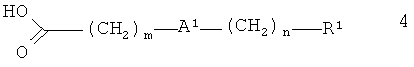 .
.
Это может осуществляться в условиях, хорошо известных специалисту в данной области техники. Например, реакция обычно может осуществляться смешением карбоновой кислоты 4 с амином 3 в апротонных растворителях, такие как дихлорметан, тетрагидрофуран, N,N-диметилформамид, N-метилпирролидинон и их смеси, при температуре от 0°С до 60°С, в присутствии или отсутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, и конденсирующего агента. Подходящие конденсирующие агенты выбраны, например, из тетрафторбората O-(7-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (TBTU), гексафторфосфата O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), N,N'-дициклогексилкарбодиимида, гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида, гексафторфосфата O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, гексафторфосфата бром-трис-пирролидинофосфония или других агентов, хорошо известных специалисту в данной области техники.
Альтернативно, такие реакции могут осуществляться в две стадии, включая сначала превращение ацилгалогенидного производного 4 и последующую реакцию конденсации с амином 3 в присутствии основания. Обычно используемыми реагентами для получения ацилхлорида являются тионилхлорид, пентахлорид фосфора, оксалилхлорид или хлорид циануровой кислоты, и реакцию обычно проводят в отсутствии растворителя или в присутствии апротонного растворителя, такого как дихлорметан, толуол или ацетон. Необязательно может добавляться основание, такое как для промежуточного пиридина, триэтиламина, диизопропилэтиламина или 4-метилморфолина. Полученный ацилхлорид может быть выделен или подвергаться реакции как таковой с амином 3 в апротонном растворителе, таком как дихлорметан, тетрагидрофуран или ацетон, в присутствии основания. Обычными основаниями являются триэтиламин, 4-метилморфолин, пиридин, диизопропилэтиламин или диметиламинопиридин или их смеси.
Альтернативно, такие реакции могут осуществляться в две стадии, включая сначала образование смешанного ангидридного производного 4 реакцией с реагентом, таким как этилхлорформиат, изобутилхлорформиат или ангидрид уксусной кислоты, и последующую реакцию с амином 3 как описано выше.
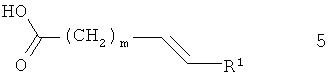
Соединения формулы 2 получают из 3-амино-4-диметиламинобутирата 3 и карбоновой кислоты 5, аналогично соединению 1.
Синтез 3-амино-4-диметиламинобутират а3 приведен на схеме 1 и начинается с коммерчески доступного N-защищенного моноэфира аспарагиновой кислоты 7. Rp представляет собой метил, этил или бензил, причем бензил является особенно предпочтительным.
Схема 1
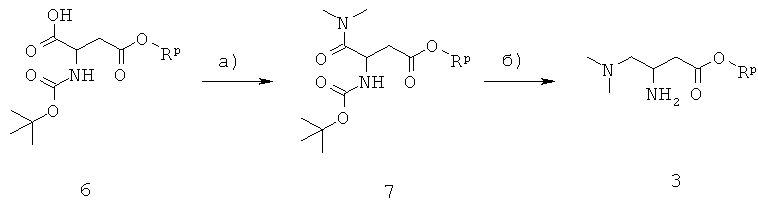
На стадии а, схема 1, карбоновую кислоту 6 подвергают реакции с диметиламином до N,N-диметиламидного производного 7, используя реагенты и способы, описанные для реакции карбоновой кислоты 4 с амином 3.
На стадии 6, схема 1, N,N-диметиламид 7 превращают в диметиламинопроизводное 3 восстановлением и последующим удалением трет-бутоксикарбонильной защитной группы. Предпочтительными реагентами для восстановления являются комплекс боран-тетрагидрофуран или комплекс боран-диметилсульфид, в апротонном растворителе, таком как тетрагидрофуран, при температуре от -20°С до 80°С. Удаление трет-бутоксикарбонильной группы осуществляется в кислотных условиях, используя хлористоводородную кислоту или серную кислоту, в растворителях, таких как этанол, метанол, вода или их смеси, при температуре от 0°С до 20°С.
Карбоновые кислоты 4 являются либо коммерчески доступными, либо могут быть получены, как показано на схемах 2-7.
Когда R1 является таким, как определено выше, и А2 представляет собой кислород, карбоновые кислоты 5 могут быть получены, как показано на схеме 2, где Х представляет собой уходящую группу, такую как бром, йод или метансульфонилоксигруппу, и PG представляет собой необязательную защитную группу, например, тетрагидропиран-2-ил.
Схема 2
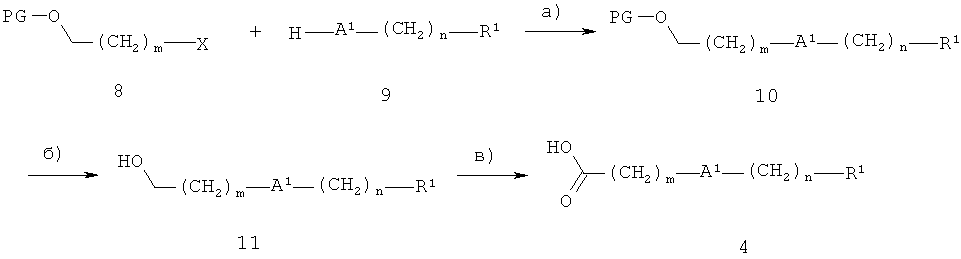
На стадии а, схема 2, соединение 9 алкилируют необязательно защищенным ω-галоген- или ω-сульфонилоксиспиртом 8, получая соединение 10. Реакцию осуществляют в растворителе, таком как этанол, ацетонитрил или N,N-диметилформамид, в присутствии основания, например, карбоната калия, гидроксида натрия, трет-бутилата калия или гидрида натрия, при температуре от 0°С до 100°С.
На необязательной стадии 6 (то есть когда PG≠H), защитную группу соединения 10 удаляют, получая спирт 11. Когда PG = тетрагидропиран-2-ил, эту реакцию осуществляют, используя кислотный катализатор, такой как хлористоводородная кислота, толуол-4-сульфоновая кислота или толуол-4-сульфонат пиридиния, в растворителе, таком как вода, метанол или этанол, при температуре от 0°С до 100°С.
На стадии в, схема 2, спирт 11 окисляют до карбоновой кислоты 4. Обычно используемыми реагентами и условиями для окисления спирта 11 включают дихромат пиридиния, оксид хрома(VI) или перманганат калия. Это окисление соединения 11 в соединение 4 также возможно для спиртов 11, в которых А1 представляет собой связь.
Альтернативно, спирт 11 может быть получен, как показано на схеме 3. А2 представляет собой кислород и R1, m и n являются такими, как определено выше. В этом способе диол 12 и соединение 13 подвергают реакции в условиях Мицунобу используя фосфин, например, трифенилфосфин, и диэфир азодикарбоновой кислоты, например, диэтилазодикарбоксилат или диизопропилазодикарбоксилат, в растворителе, таком как тетрагидрофуран, дихлорметан или толуол, при температуре от 0°С до 50°С, получая соединение 11.
Схема 3
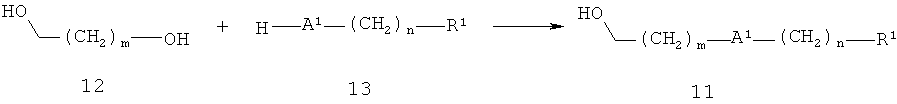
Альтернативно, спирт 11 может быть получен, как показано на схеме 4. А1 представляет собой кислород и R1, m и n являются такими, как определено выше, Х представляет собой уходящую группу, такую как бром, йод или метансульфонилоксигруппу. Так, соединение 14 алкилируют галогенидом или сульфонатом 15. Реакцию осуществляют в растворителе, таком как этанол, ацетонитрил или N,N-диметилформамид, в присутствии основания, например, карбоната калия, гидроксида натрия, трет-бутилата калия или гидрида натрия, при температуре от 0°С до 100°С.
Схема 4
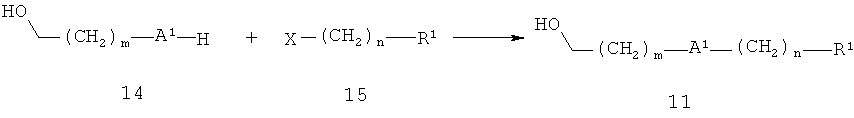
Кислота 4 также может быть поучена, как показано на схеме 5. А1 представляет собой кислород и R1, m и n являются такими, как определено выше, Х представляет собой уходящую группу, такую как бром, йод или метансульфонилокси. Алкилирование карбоновой кислоты 16 галогенидом или 20 сульфонатом 15 осуществляют аналогично соединению 14 с помощью соединения 15 (схема 4).
Схема 5
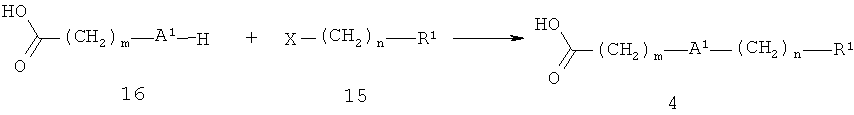
Ненасыщенные кислоты общей формулы 5 могут быть получены, как показано на схеме 6. R1 и m являются такими, как определено выше, к представляет собой низший алкил, например, метил или этил.
Схема 6
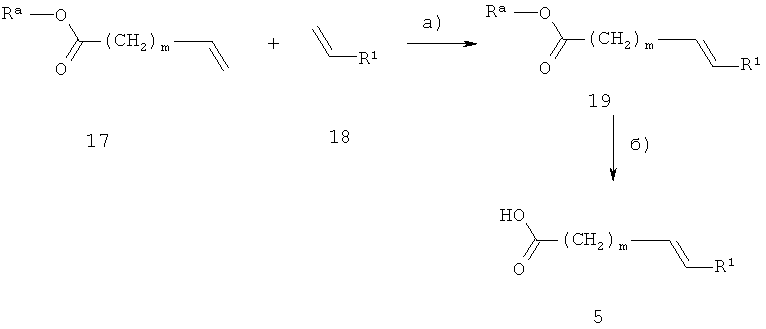
На стадии а, схема 6, ненасыщенный сложный эфир 17 подвергают реакции с производным стирола 18 в реакции алкенового перекрестного-метатезиса, получая соединение 19. Эту реакцию осуществляют в инертном растворителе, таком как дихлорметан или толуол, и необходим подходящий катализатор, например, дихлор(1,3-димезитил-4,5-дигидроимидазол-2-илиден)(фенилметилен)(трициклогексилфосфин)рутений, при температуре от 20°С до 100°С.
На стадии 6, схема 6, сложный эфир 19 превращают в кислоту 5 основным гидролизом, используя реагенты, такие как гидроксид лития, гидроксид натрия, гидроксид калия, в растворителях, таких как вода, метанол, этанол, тетрагидрофуран или их смеси, при температуре от 0°С до 100°С.
Альтернативно, ненасыщенные кислоты формулы 5 могут быть получены, как показано на схеме 7. R1 и m являются такими, как определено выше.
Схема 7
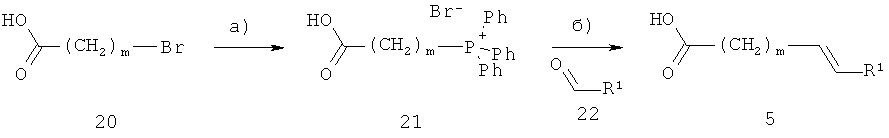
На стадии а, схема 7, ω-бромкислоту 20 подвергают реакции с трифенилфосфином, получая соль фосфония 21. Эту реакцию осуществляют в инертном растворителе, таком как толуол, при температуре от 20°С до 110°С.
На стадии 6, схема 7, соль фосфония 21 подвергают реакции с альдегидом 22, получая соединение 5. Эту реакцию осуществляют в присутствии основания, например, гидрида натрия, n-бутиллития или трет-бутилата калия, в растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре от -20°С до 50°С.
Как описано выше, новые соединения формулы I настоящего изобретения, как было обнаружено, ингибируют активность карнитинпальмитоилтрансферазы 2 (СРТ2). Соединения настоящего изобретения, следовательно, могут использоваться для лечения и/или профилактики заболеваний, которые модулируются ингибиторами СРТ2, особенно заболеваний, которые связаны с гипергликемией и/или нарушениями толерантности к глюкозе. Такие заболевания включают, например, диабет и связанные патологии, инсулиннезависимый сахарный диабет (также известный как диабет II типа), ожирение, гипертензию, синдром инсулиновой резистентности, метаболический синдром, гиперлипидемию, гиперхолестеринемию, ожирение печени, атеросклероз, острую сердечную недостаточность и почечную недостаточность.
Настоящее изобретение, следовательно, также относится к фармацевтическим композициям, включающим соединение формулы I как определено выше и фармацевтически приемлемый носитель и/или адъювант.
Настоящее изобретение также включает соединения формулы I как определено выше для применения в качестве терапевтически активных веществ, особенно в качестве терапевтически активных веществ для лечения и/или профилактики заболеваний, которые модулируются ингибиторами СРТ2, особенно для применения в качестве терапевтически активных веществ для лечения и/или профилактики гипергликемии, нарушений толерантности к глюкозе, диабета и связанных с ним патологий, инсулиннезависимого сахарного диабета, ожирения, гипертензии, синдрома инсулиновой резистентности, метаболического синдрома, гиперлипидемии, гиперхолестеринемии, жирового гепатоза, атеросклероза, острой сердечной недостаточности и почечной недостаточности.
В другом предпочтительном варианте осуществления, изобретение относится к способу терапевтического и/или профилактического лечения заболеваний, которые модулируются ингибиторами СРТ2, особенно терапевтического и/или профилактического лечения гипергликемии, нарушений толерантности к глюкозе, диабета и связанных с ним патологий, инсулиннезависимого сахарного диабета, ожирения, гипертензии, синдрома инсулиновой резистентности, метаболического синдрома, гиперлипидемии, гиперхолестеринемии, жирового гепатоза, атеросклероза, острой сердечной недостаточности и почечной недостаточности, который включает введение соединения формулы I как определено выше человеку или животному.
Настоящее изобретение также относится к применению соединений формулы I как определено выше для изготовления лекарственных средств терапевтического и/или профилактического лечения заболеваний, которые модулируются ингибиторами СРТ2, особенно терапевтического и/или профилактического лечения гипергликемии, нарушений толерантности к глюкозе, диабета и связанных патологий, инсулиннезависимого сахарного диабета, ожирения, гипертензии, синдрома инсулиновой резистентности, метаболического синдрома, гиперлипидемии, гиперхолестеринемии, жирового гепатоза, атеросклероза, острой сердечной недостаточности и почечной недостаточности. Такие лекарственные средства включают соединение формулы I как определено выше.
Профилактика и/или лечение гипергликемии и инсулиннезависимого сахарного диабета являются предпочтительным применением.
Следующие тесты проводили для определения активности соединений настоящего изобретения. Уровень техники для осуществления анализов описан в статьях: Jackson и др., Biochem. J., 1999, 341, сс.483-489 и Jackson и др., J. Biol. Chem., 2000, 275, сс.19560-19566.
кДНК человека и крысы СРТ2 и СРТ1 печени и кДНК СРТ1 мышц человека субклонировали в pGAPZB или pGAPZA, соответственно. Эти плазмиды использовали для трансформации Р. pastoris штамма Х-33 электропорацией после получения электрокомпетентных клеток. Отбирали большое количество копий клонов, при необходимости используя 0,5 или 1 мг/мл зеоцина. Культуры для экспериментов на активность индуцировали в течение 16 ч в среде YPD (1% дрожжевой экстракт, 2% пептона, 2% глюкозы). Сырые клеточные экстракты получали разрушением клеток с помощью стеклянных шариков или французского пресса, в зависимости от размеров ферментера. После центрифугирования бесклеточные экстракты повторно суспендировали в разрушающем клетки буфере (50 мМ Tris, pH7,4, 100 мМ KCl, 1 мМ EDTA) в присутствии смеси ингибитора протеазы, затем делили на аликвоты и замораживали при -20°С.
Активность в отношении СРТ измеряли, используя спектрофотометрический анализ, используя 5,5'-дитио-бис-(2-нитробензойную кислоту) (DTNB), также называемую реагент Эллмана. HS-CoA высвобождался при образовании ацилкарнитина из карнитина (500 мкМ) и пальмитоил-СоА (80 мкМ), восстанавливая DTNB (300 мкМ), получая 5-меркапто-2-нитробензойную кислоту, которая поглощает при 410 нм с молярным коэффициентом поглощения 13600 М-1·см-1. Буфер для анализа содержат 120 мМ KCl, 25 мМ Tris, рН 7,4, 1 мМ EDTA. Этот анализ использовали для идентификации ингибиторов СРТ, особенно/предпочтительно СРТ2-селективных ингибиторов, по сравнению с изоформами СРТ1 печени и мышц.
Соединения в соответствии с формулой I предпочтительно имеют значение IC50 (CPT2) ниже 10 мкМ, предпочтительно от 1 нМ до 10 мкМ, более предпочтительно от 1 нМ до 1 мкМ. В следующей таблице приведены данные для некоторых примеров.
|
Соединения формулы I и их фармацевтически приемлемые соли могут использоваться в качестве лекарственных средств, например в форме фармацевтических препаратов для энтерального, парентерального или местного введения. Они могут вводиться, например перорально, например в форме таблеток, покрытых оболочкой таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например в форме суппозиториев, парентерально, например в форме инъекционных растворов или суспензий, или инфузионных растворов, или местно, например в форме мазей, кремов или масел. Пероральное введение является предпочтительным.
Получение фармацевтических препаратов может осуществляться способом, известным любому специалисту в данной области техники, путем введения описанных соединений формулы I и их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически активными веществами, в форму для галенового введения вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими материалами носителя и при необходимости, обычными фармацевтическими адъювантами.
Подходящими материалами носителя являются не только неорганические материалы носителя, но также органические материалы носителя. Так, например, лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли могут использоваться в качестве материалов носителя для таблеток, покрытых оболочкой таблеток, драже и твердых желатиновых капсул. Подходящими материалами носителя для мягких желатиновых капсул являются, например, растительные масла, воски, жиры и полутвердые и жидкие полиолы (в зависимости от природы активного ингредиента носители могут не использоваться, однако, для мягких желатиновых капсул). Подходящими материалами носителя для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар и им подобные. Подходящими материалами носителя для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Подходящими материалами носителя для суппозиториев являются, например, природные или отвержденные масла, воски, жиры и полужидкие или жидкие полиолы. Подходящими материалами носителя для местных составов являются глицериды, полусинтетические и синтетические глицериды, гидрированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стеролы, полиэтиленгликоли и производные целлюлозы.
Обычные стабилизаторы, консерванты, увлажняющие и эмульгирующие агенты, улучшающие консистенцию агенты, отдушки, соли для регулирования осмотического давления, буферные вещества, солюбилизаторы, красители и маскирующие агенты и антиоксиданты рассматриваются в качестве фармацевтических адъювантов.
Дозировка соединений формулы I может варьироваться в широких пределах в зависимости от контролируемого заболевания, возраста и индивидуального состояния пациента и способа введения, и конечно, определяется для конкретных целей в каждом конкретном случае. Для взрослых пациентов рассматривается суточная дозировка от около 1 до 2000 мг, особенно от около 1 до 500 мг. В зависимости от степени тяжести заболевания и точного фармакокинетического профиля соединение может вводиться в одной или нескольких суточных дозированных единицах, например, в 1-3 дозированных единицах.
Фармацевтические препараты обычно содержат около 1-500 мг, предпочтительно 1-200 мг соединения формулы I.
Следующие примеры служат для более подробной иллюстрации настоящего изобретения. Они, однако, никоим образом не должны ограничивать его объем.
Примеры
Сокращения:
ВЭЖХ = высокоэффективная жидкостная хроматография, m/е = масса изменения соотношения, измеренная масс-спектрометрией (MS).
Промежуточное соединение 1
(R)-3-[8-(3.4-Дифторбензилокси)октаноиламино1-4-диметиламинобутановая кислота
Стадия 1: Раствор 1,8-октандиола (300 мг, 2,05 ммоля) в смеси тетрагидрофуран/N,N-диметилформамид 2:1 (3 мл) добавляли по каплям при 0°С к суспензии гидрида натрия (60% дисперсия в минеральном масле, 90 мг, 2,3 ммоля) в N,N-диметилформамиде (1,5 мл), затем через 2 ч добавляли 3,4-дифторбензилбромид (445 мг, 2,15 ммоля). Через 4 ч реакционную смесь разделяли между водой и этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили сульфатом натрия, отфильтровывали и упаривали. Хроматография (SiO2, градиент гептан-этилацетат) приводила к получению 8-(3,4-дифторбензилокси)октан-1-ола (258 мг, 46%). Бесцветное масло, m/е=273,3 ([М+Н]+).
Стадия 2: Дихромат пиридиния (1,23 г, 3,27 ммоля) добавляли при 0°С к раствору 8-(3,4-дифторбензилокси)октан-1-ола (254 мг, 0,93 ммоля) в N,N-диметилформамиде (2 мл). Реакционную смесь оставляли достигать комнатной температуры в течение 16 ч, затем разделяли между водой и этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили сульфатом натрия, отфильтровывали и упаривали. Хроматография (SiO2, градиент гептан-[этилацетат/муравьиная кислота 100:1]) приводила к получению 8-(3,4-дифторбензилокси)октановой кислоты (162 мг, 61%). Бесцветное масло, m/e=285,1 ([М-Н]-),
Стадия 3: Раствор 8-(3,4-дифторбензилокси)октановой кислоты (153 мг, 0,53 ммоля), N,N-диизопропилэтиламина (414 мг, 3,21 ммоля) и гексафторфосфата O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (244 мг, 0,64 ммоля) в N,N-диметилформамиде перемешивали в течение 1 ч при комнатной температуре, затем добавляли раствор дигидрохлорида бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты (198 мг, 0,64 ммоля) в N,N-диметилформамиде (1 мл). Реакционную смесь перемешивали в течение 16 ч при комнатной температуре, затем упаривали. Хроматография (SiO2, градиент дихлорметан-[дихлорметан/метанол/25% водн. раствор аммиака 110:10:1]) приводила к получению бензилового эфира (R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты (136 мг, 50%). Светло-желтое масло, m/e=505,4 ([М+Н]+).
Стадия 4: Раствор бензилового эфира (R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты (125 мг, 0,25 ммоля) гидрировали при атмосферном давлении в присутствии палладия (10% на активированном угле, 30 мг). Через 30 мин катализатор отфильтровывали, и фильтрат концентрировали и сушили с получением (R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты (96 мг, 89%). Светло-желтое масло, m/e=413,2 ([М-Н]-).
Получение дигидрохлорида бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты
а) Триэтиламин (2,8 мл, 20,0 ммолей) добавляли при 0°С к раствору 4-бензилового эфира Boc-D-аспарагиновой кислоты (5,00 г, 15,0 ммолей) в дихлорметане, затем по каплям добавляли этилхлорформиат (1,91 мл, 20,0 ммолей). Реакционную смесь перемешивали в течение 1 ч при 0°С, затем по каплям добавляли раствор гидрохлорида диметиламина (2,65 г, 32,0 ммоля) и триэтиламина (4,53 мл, 32,0 ммоля) в дихлорметане (100 мл). Реакционную смесь оставляли при комнатной температуре в течение 16 ч, затем промывали насыщенным раствором хлорида натрия и концентрировали. Хроматография (SiO2; градиент гептан-этилацетат) приводила к получению бензилового эфира (R)-3-трет-бутоксикарбониламино-N,N-диметилсукцинаминовой кислоты (3,77 г, 70%). Бесцветное масло, m/e=351,4 ([М+Н]+).
б) Комплекс боран-диметилсульфид (1,57 мл, 3,14 ммоля) добавляли по каплям при 0°С к раствору бензидового эфира (R)-3-трет-бутоксикарбониламино-N,N-диметилсукцинаминовой кислоты (500 мг, 1,43 ммоля). Реакционную смесь нагревали до комнатной температуры и кипятили с обратным холодильником в течение 3 часов, затем охлаждали до 0°С и по каплям обрабатывали 6 М водн. раствором хлористоводородной кислоты (0,68 мл, 4,1 ммоля). Реакционную смесь оставляли нагреваться до комнатной температуры и концентрировали в вакууме. Полученную воду азеотропно отгоняли с толуолом и концентрировали в высоком вакууме с получением дигидрохлорида бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты (384 мг, 87%). Белое твердое вещество, m/e=237,4 ([М+Н]+).
Промежуточное соединение 2
(R)-3-[8-(2,5-Дифторбензилокси)октаноиламино]-4-диметиламинобутановая кислота
Указанное в заголовке соединение, m/e=413,3 ([М-Н]-), получали
аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 2,5-дифторбензилбромидом, получая 8-(2,5-дифторбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(2,5-дифторбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(2,5-дифторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 3 (R)-3-[8-(2,4-дифторбензилокси)октаноиламино]-4-диметиламинобутановая кислота
Указанное в заголовке соединение, m/e=413,1 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 2,4-дифторбензилбромидом, получая 8-(2,4-дифторбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(2,4-дифторбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(2,4-дифторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 4
(R)-4-Диметиламино-3-[8-(2,3,4-трифторбензилокси)октаноиламино]бутановая кислота
Указанное в заголовке соединение, m/e=432,5 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 2,3,4-трифторбензилбромидом, получая 8-(2,3,4-трифторбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(2,3,4-трифторбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(2,3,4-трифторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 5
(R)-4-Диметиламино-3-(8-пентафторфенилметоксиоктаноиламино)бутановая кислота
Указанное в заголовке соединение, m/e=467,5 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 пентафторбензилбромидом, получая 8-(пентафторбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(пентафторбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(пентафторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 6
(R)-4-Диметиламино-3-[8-(4-трифторметилбензилокси)октаноиламино]бутановая кислота
Указанное в заголовке соединение, m/e=445,6 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 4-трифторметилбензилбромидом, получая 8-(4-трифторметилбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(4-трифторметилбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(4-трифторметилбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 7
(R)-4-Диметиламино-3-[8-(3-фтор-4-трифторметилбензилокси)октаноиламино]бутановая кислота
Указанное в заголовке соединение, m/e=463,5 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 3-фтор-4-трифторметилбензилбромидом, получая 8-(3-фтор-4-трифторметилбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(3-фтор-4-трифторметилбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(3-фтор-4-трифторметилбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 8
(R)-4-Диметиламино-3-[8-(4-метоксибензилокси)октаноиламино]бутановая кислота
Указанное в заголовке соединение, m/e=407,6 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 4-метоксибензилбромидом, получая 8-(4-метоксибензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(4-метоксибензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(4-метоксибензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 9
(R)-3-[8-(Бифенил-4-илметокси)октаноиламино]-4-диметиламинобутановая кислота
Указанное в заголовке соединение, m/e=455,3 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 4-(бромметил)бифенилом, получая 8-(бифенил-4-илметокси)октан-1-ол, который окисляли на стадии 2 до 8-(бифенил-4-илметокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(бифенил-4-илметокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 10
(R)-4-Диметиламино-3-[8-(2-фтор-4-трифторметилбензилокси)октаноиламино]бутановая кислота
Указанное в заголовке соединение, m/e=463,1 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 2-фтор-4-трифторметилбензилбромидом, получая 8-(2-фтор-4-трифторметилбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(2-фтор-4-трифторметилбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(2-фтор-4-трифторметилбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 11
(R)-4-Диметиламино-3-[8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октаноиламино]бутановая кислота
Указанное в заголовке соединение, m/e=479,4 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 2,3,5,6-тетрафтор-4-метоксибензилбромидом, получая 8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 12
(R)-4-Диметиламино-3-[8-(нафтален-1-илметокси)октаноиламино]бутановая кислота
Указанное в заголовке соединение, m/e=427,1 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 1-бромметилнафталеном, получая 8-(нафтален-1-илметокси)октан-1-ол, который окисляли на стадии 2 до 8-(нафтален-1-илметокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(нафтален-1-илметокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 13
(R)-3-(8-Бензилоксиоктаноиламино)-4-диметиламинобутановая кислота
Указанное в заголовке соединение, m/e=377,6 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 бензилбромидом, получая 8-бензилоксиоктан-1-ол, который окисляли на стадии 2 до 8-бензилоксиоктановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-бензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 14
(R)-4-Диметиламино-3-[8-(2-фторбензилокси)октаноиламино]бутановая кислота
Указанное в заголовке соединение, m/e=397,4 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 2-фторбензилбромидом, получая 8-(2-фторбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(2-фторбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(2-фторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 15
(R)-4-Диметиламино-3-[8-(3-фторбензилокси)октаноиламино]бутановая кислота
Указанное в заголовке соединение, m/e=397,4 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 3-фторбензилбромидом, получая 8-(3-фторбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(3-фторбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(3-фторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 16
(R)-4-Диметиламино-3-[8-(4-фторбензилокси)октаноиламино]бутановая кислота
Указанное в заголовке соединение, m/e=397,4 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 4-фторбензилбромидом, получая 8-(4-фторбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(4-фторбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(4-фторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 17
(R)-3-[8-(2,3-Дифторбензилокси)октаноиламино]-4-диметиламинобутановая кислота
Указанное в заголовке соединение, m/e=415,5 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 1-4. Так, 1,8-октандиол алкилировали на стадии 1 2,3-дифторбензилбромидом, получая 8-(2,3-дифторбензилокси)октан-1-ол, который окисляли на стадии 2 до 8-(2,3-дифторбензилокси)октановой кислоты. Ее конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-3-[8-(2,3-дифторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 18
(R)-4-Диметиламино-3-(10-фенилдеканоиламино)бутановая кислота
Указанное в заголовке соединение, m/e=377,3 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 3 и 4. Так, коммерчески доступную 10-фенилдекановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-4-диметиламино-3-(10-фенилдеканоиламино)бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 19 (8)-4-Диметиламино-3-(10-фенилдеканоиламино)бутановая кислота
Указанное в заголовке соединение, m/e=377,5 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 3 и 4. Так, коммерчески доступную 10-фенилдекановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (8)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (8)-4-диметиламино-3-(10-фенилдеканоиламино)бутановой кислоты, который гидрировали на стадии 4.
Дигидрохлорид бензилового эфира (8)-3-амино-4-диметиламинобутановой кислоты получали аналогично дигидрохлориду бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты (промежуточное соединение 1), исходя из 4-бензилового эфира Boc-L-аспарагиновой кислоты.
Промежуточное соединение 20
(R)-4-Диметиламино-3-[10-(2-фторфенил)деканоиламино]бутановая кислота
Стадия 1: К раствору этилового эфира 9-деценовой кислоты (статья Tetrahedron, 2003, 59, с.7973; 500 мг, 2,53 ммоля) и 2-фторстирола (617 мг, 5,05 ммоля) в дихлорметане (12,5 мл) добавляли дихлор(1,3-димезитил-4,5-дигидроимидазол-2-илиден)(фенилметилен)(трициклогексилфосфин)рутений (107 мг, 0,13 ммоля). Смесь насыщали азотом и закрывали в колбе под давлением, затем нагревали при 40°С в течение 18 ч. После охлаждения и упаривания растворителя продукт очищали хроматографией (SiO2, гептан-дихлорметан 3:1) с получением этилового эфира 10-(2-фторфенил)дец-9-еновой кислоты (420 мг, 57%).
Стадия 2: К раствору этилового эфира 10-(2-фторфенил)дец-9-еновой кислоты (420 мг, 1,44 ммоля) в тетрагидрофуране (2 мл) добавляли 2 М водн. раствор гидроксида лития (2 мл, 4 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем разделяли между 1 М водн. раствором хлористоводородной кислоты и этилацетатом. Органический слой сушили сульфатом магния, отфильтровывали и упаривали, с получением 10-(2-фторфенил)дец-9-еновой кислоты (250 мг, 66%).
Стадия 3: Аналогично промежуточному соединению 22, стадия 3, 10-(2-фторфенил)дец-9-еновую кислоту превращали в 10-(2-фторфенил)дец-9-еноилхлорид, затем подвергали реакции с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты, получая бензиловый эфир (R)-4-диметиламино-3-[10-(2-фторфенил)дец-9-еноиламино]бутановой кислоты.
Стадия 4: Гидрирование бензилового эфира (R)-4-диметиламино-3-[10-(2-фторфенил)дец-9-еноиламино]бутановой кислоты аналогично промежуточному соединению 1, стадия 4, приводило к получению (R)-4-диметиламино-3-[10-(2-фторфенил)деканоиламино]бутановой кислоты, m/e=395,2 ([М+Н]+).
Промежуточное соединение 21
(R)-4-Диметиламино-3-[10-(2,5-диметилфенил)деканоиламино]бутановая кислота
Указанное в заголовке соединение, m/e=405,4 ([М+Н]+), получали аналогично промежуточному соединению 20, стадии 1-4. Так, этиловый эфир 9-деценовой кислоты подвергали реакции на стадии 1 с 2,5-диметилстиролом, получая этиловый эфир 10-(2,5-диметилфенил)дец-9-еновой кислоты, который гидролизовали на стадии 2 до 10-(2,5-диметилфенил)дец-9-еновой кислоты. На стадии 3 ее превращали в 10-(2,5-диметилфенил)дец-9-еноилхлорид, затем подвергали реакции с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты, получая бензиловый эфир (R)-4-диметиламино-3-[10-(2,5-диметилфенил)дец-9-еноиламино]бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 22
(R)-4-Диметиламино-3-[10-(2,6-диметилфенил)деканоиламино]бутановая кислота
Стадия 1: К раствору 9-бромнонановой кислоты (7,00 г, 29,5 ммоля) в толуоле (10 мл) добавляли трифенилфосфин (7,74 г, 29,5 ммоля). Раствор закрывали под давлением азота в колбе для повышенного давления, и нагревали при 110°С в течение 18 часов. После окончания реакции наблюдали две фазы. Толуольный верхний слой декантировали с сырого продукта, который промывали толуолом. Получали бромид (8-карбоксиоктил)трифенилфосфония (14,9 г), который непосредственно использовали на следующей стадии. Белое полутвердое вещество, m/e=419,3 ([М+Н]+).
Стадия 2: Гидрид натрия (60% дисперсия в минеральном масле; 0,65 г, 16 ммолей) добавляли порциями при комнатной температуре к перемешиваемому раствору бромида (8-карбоксиоктил)трифенилфосфония (2,8 г, 5,6 ммоля) в тетрагидрофуране (30 мл) при комнатной температуре, затем через 1 час к реакционной смеси порциями добавляли 2,6-диметилбензальдегид (757 мг, 5,64 ммоля), и раствор перемешивали в течение 2 суток при комнатной температуре. После окончания реакции добавляли воду (10 мл), и раствор подкисляли до значения рН 3 концентрированной хлористоводородной кислотой. Продукт экстрагировали этилацетатом, органический слой сушили сульфатом магния, отфильтровывали и упаривали, Хроматография (SiO2, гептан-этилацетат 4:1) приводила к получению 10-(2,6-диметилфенил)дец-9-еновой кислоты в виде бесцветного масла.
Стадия 3: Раствор 10-(2,6-диметилфенил)дец-9-еновой кислоты (239 мг, 0,87 ммоля), оксалилхлорида (0,11 мл, 1,3 ммоля) и N,N-диметилформамида (одна капля) в дихлорметане (3 мл) перемешивали при комнатной температуре в течение 2 часов, затем летучий материал удаляли дистилляцией с получением 10-(2,6-диметилфенил)дец-9-еноилхлорида Его повторно растворяли в дихлорметане, затем по каплям добавляли N,N-Диизопропилэтиламин (140 мг, 1,04 ммоля), затем дигидрохлорид бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем промывали водой. Органический слой упаривали, и остаток очищали препаративной ВЭЖХ с получением бензилового эфира (R)-4-диметиламино-3-[10-(2,6-диметилфенил)дец-9-еноиламино]бутановой кислоты.
Стадия 4: Гидрирование бензилового эфира (R)-4-диметиламино-3-[10-(2,5-диметилфенил)дец-9-еноиламино]бутановой кислоты аналогично промежуточному соединению 1, стадия 4, приводило к получению (R)-4-диметиламино-3-[10-(2,6-диметилфенил)деканоиламино]бутановой кислоты, m/e=405,3 ([M+H]+).
Промежуточное соединение 21
(R)-4-Диметиламино-3-[10-(4-метоксифенил)деканоиламино]бутановая кислота
Указанное в заголовке соединение, m/e=407,3 ([М+Н]+), получали аналогично промежуточному соединению 20, стадии 1-4. Так, этиловый эфир 9-деценовой кислоты подвергали реакции на стадии 1 с 4-метоксистиролом, получая этиловый эфир 10-(4-метоксифенил)дец-9-еновой кислоты, который подвергали гидролизу на стадии 2 до 10-(4-метоксифенил)дец-9-еновой кислоты. На стадии 3 ее превращали в 10-(4-метоксифенил)дец-9-еноилхлорид, затем подвергали реакции с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты, получая бензиловый эфир (R)-4-диметиламино-3-[10-(4-метоксифенил)дец-9-еноиламино]бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 24
(R)-4-Диметиламино-3-(10-нафтален-1-илдеканоиламино)бутановая кислота
Указанное в заголовке соединение, m/e=427,4 ([М+Н]+), получали аналогично промежуточному соединению 20, стадии 1-4. Так, этиловый эфир 9-деценовой кислоты подвергали реакции на стадии 1 с 1-винилнафталеном, получая этиловый эфир 10-(нафтален-1-ил)дец-9-еновой кислоты, который подвергали гидролизу на стадии 2 до 10-(нафтален-1-ил)дец-9-еновой кислоты. На стадии 3 ее превращали в 10-(нафтален-1-ил)дец-9-еноилхлорид, затем подвергали реакции с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты, получая бензиловый эфир (R)-4-диметиламино-3-[10-(нафтален-1-ил)дец-9-еноиламино]бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 25
(R)-4-Диметиламино-3-[10-(4-трифторметилфенил)деканоиламино]бутановая кислота
Указанное в заголовке соединение, m/e=445,1 ([М+Н]+), получали аналогично промежуточному соединению 20, стадии 1-4. Так, этиловый эфир 9-деценовой кислоты подвергали реакции на стадии 1 с 4-трифторметилстиролом, получая этиловый эфир 10-(4-трифторметилфенил)дец-9-еновой кислоты, который подвергали гидролизу на стадии 2 до 10-(4-трифторметилфенил)дец-9-еновой кислоты. На стадии 3 ее превращали в 10-(4-трифторметилфенил)дец-9-еноилхлорид, затем подвергали реакции с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты, получая бензиловый эфир (R)-4-диметиламино-3-[10-(4-трифторметилфенил)дец-9-еноиламино]бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 26
(R)-4-Диметиламино-3-[10-(3-фторфенил)деканоиламино]бутановая кислота
Указанное в заголовке соединение, m/e=395,3 ([М+Н]+), получали аналогично промежуточному соединению 20, стадии 1-4. Так, этиловый эфир 9-деценовой кислоты подвергали реакции на стадии 1 с 3-фторстиролом, получая этиловый эфир 10-(3-фторфенил)дец-9-еновой кислоты, который подвергали гидролизу на стадии 2 до 10-(3-фторфенил)дец-9-еновой кислоты. На стадии 3 ее превращали в 10-(3-фторфенил)дец-9-еноилхлорид, затем подвергали реакции с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты, получая бензиловый эфир (R)-4-диметиламино-3-[10-(3-фторфенил)дец-9-еноиламино]бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 27
(R)-3-[10-(2,3-Дифторфенил)деканоиламино]-4-диметиламинобутановая кислота
Указанное в заголовке соединение, m/e=413,3 ([М+Н]+), получали аналогично промежуточному соединению 22, стадии 2-4. Так, 2,3-дифторбензальдегид подвергали реакции на стадии 2 с бромидом (8-карбоксиоктил)трифенилфосфония, получая 10-(2,3-дифторфенил)дец-9-еновую кислоту. На стадии 3 ее превращали в 10-(2,3-дифторфенил)дец-9-еноилхлорид, затем подвергали реакции с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты, получая бензиловый эфир (R)-4-диметиламино-3-[10-(2,3-дифторфенил)дец-9-еноиламино]бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 28
(R)-4-Диметиламино-3-(10-тиофен-3-илдеканоиламино)бутановая кислота
Стадия 1: Реакция 3-тиофенекарбоксальдегида с бромидом (8-карбоксиоктил)трифенилфосфония, аналогично промежуточному соединению 22, стадия 2, приводила к получению 10-(тиофен-3-ил)дец-9-еновой кислоты.
Стадия 2: Аналогично промежуточному соединению 22, стадия 3, 10-(тиофен-3-ил)дец-9-еновую кислоту превращали в 10-(тиофен-3-ил)дец-9-еноилхлорид, затем подвергали реакции с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты, получая бензиловый эфир (R)-4-диметиламино-3-[10-(тиофен-3-ил)дец-9-еноиламино]бутановой кислоты.
Стадия 3: Триэтилсилан (0,23 мл, 1,43 ммоля) и трифторуксусную кислоту (0,21 мл, 2,9 ммоля) добавляли к раствору бензилового эфира 4-диметиламино-3-(10-тиофен-3-илдец-9-еноиламино)бутановой кислоты (67 мг, 0,14 ммоля) в толуоле (8 мл). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, после чего раствор добавляли в холодный насыщенный водн. раствор бикарбоната натрия. Водную фазу отделяли и экстрагировали дважды дихлорметаном. Объединенные органические слои сушили сульфатом магния, отфильтровывали и концентрировали в вакууме с получением бензилового эфира 4-диметиламино-3-(10-тиофен-3-илдеканоиламино)бутановой кислоты (74 мг), m/e=473,3 ([М+Н]+).
Стадия 4: Гидролиз бензилового эфира 4-диметиламино-3-(10-тиофен-3-илдеканоиламино)бутановой кислоты, аналогично промежуточному соединению 20, стадия 2, приводил к получению (R)-4-диметиламино-3-(10-тиофен-3-илдеканоиламино)бутановой кислоты, m/e=383,1 ([М+Н]+).
Промежуточное соединение 29
(R)-4-Диметиламино-3-(6-фенилгексаноиламино)бутановая кислота
Указанное в заголовке соединение, m/e=321,3 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 3 и 4. Так, коммерчески доступную 6-фенилгексановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-4-диметиламино-3-(6-фенилгексаноиламино)бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 30
(R)-4-Диметиламино-3-(7-фенилгептаноиламино)бутановая кислота
Указанное в заголовке соединение, m/e=335,4 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 3 и 4. Так, коммерчески доступную 7-фенилгептановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-4-диметиламино-3-(7-фенилгептаноиламино)бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 31
(R)-4-Диметиламино-3-(8-фенил-октаноиламино)бутановая кислота
Указанное в заголовке соединение, m/e=347,4 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 3 и 4. Так, коммерчески доступную 8-фенилоктановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-4-диметиламино-3-(8-фенилоктаноиламино)бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 32
(R)-4-Диметиламино-3-(9-фенилнонаноиламино)бутановая кислота
Указанное в заголовке соединение, m/e=361,5 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 3 и 4. Так, коммерчески доступную 9-фенилнонановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-4-диметиламино-3-(9-фенилнонаноиламино)бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 33
(R)-4-Диметиламино-3-(11-фенилундеканоиламино)бутановая кислота
Указанное в заголовке соединение, m/e=391,5 ([М+Н]+), получали аналогично промежуточному соединению 1, стадии 3 и 4. Так, коммерчески доступную 11-фенилундекановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-4-диметиламино-3-(11-фенилундеканоиламино)бутановой кислоты, который гидрировали на стадии 4.
Промежуточное соединение 34
(R)-4-Диметиламино-3-(12-фенилдодеканоиламино)бутановая кислота
Указанное в заголовке соединение, m/e=403,6 ([М-Н]-), получали аналогично промежуточному соединению 1, стадии 3 и 4. Так, коммерчески доступную 12-фенилдодекановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламинобутановой кислоты с получением бензилового эфира (R)-4-диметиламино-3-(12-фенилдодеканоиламино)бутановой кислоты, который гидрировали на стадии 4.
Пример 1
(R)-3-[8-(3,4-Дифторбензилокси)октаноиламино]-4-триметиламмониобутират
Гидрокарбонат калия (24 мг, 0,24 ммоля) и йодметан (106 мг, 0,74 ммоля) добавляли к раствору (R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-диметиламинобутановой кислоты (77 мг, 0,19 ммоля) в метаноле (2,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем разбавляли хлороформом (5 мл). Нерастворенный материал удаляли фильтрацией с получением (R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-триметиламмониобутирата в виде светло-желтого твердого вещества, m/e=429,3 ([M+H]+).
Следующие примеры осуществляли аналогично примеру 1:
|
Пример А
Покрытые пленкой таблетки, содержащие следующие ингредиенты, могут быть получены обычным образом:
Ингредиенты
|
Активный ингредиент просеивали и смешивали с микрокристаллической целлюлозой, и смесь гранулировали с раствором поливинилпирролидона в воде. Гранулят смешивали с натрийгликолированным крахмалом и стеаратом магния, и спрессовывали с получением ядер 120 или 350 мг соответственно. Ядра покрывали водным раствором/суспензией указанного выше пленочного покрытия.
Пример Б
Капсулы, содержащие следующие ингредиенты, могут быть получены обычным образом:
|
Компоненты просеивали, смешивали и наполняли в капсулы размера 2.
Пример В
Инъекционные растворы могут иметь следующий состав:
|
Активный ингредиент растворяли в смеси полиэтиленгликоля 400 и воды для инъекций (часть). Значение рН доводили до 5,0 уксусной кислотой. Объем доводили до 1,0 мл добавлением оставшегося количества воды. Раствор отфильтровывали, наполняли в сосуды с помощью специального оборудования и стерилизовали.
Пример Г
Мягкие желатиновые капсулы, содержащие следующие ингредиенты, могут быть получены обычным образом:
Содержимое капсулы
|
Желатиновая капсула
|
Активный ингредиент растворяли в теплом расплаве других ингредиентов, и смесь наполняли в мягкие желатиновые капсулы подходящего размера. Наполненные мягкие желатиновые капсулы обрабатывали в соответствии с обычными методиками.
Пример Д
Саше, содержащие следующие ингредиенты, могут быть получены обычным образом:
|
Микрокристаллическая целлюлоза (AVICEL РН
|
Активный ингредиент смешивали с лактозой, микрокристаллической целлюлозой и натрийкарбоксиметилцеллюлозой, и гранулировали со смесью поливинилпирролидона в воде. Гранулят смешивали со стеаратом магния и отдушками, и наполняли в саше.