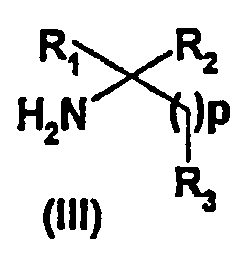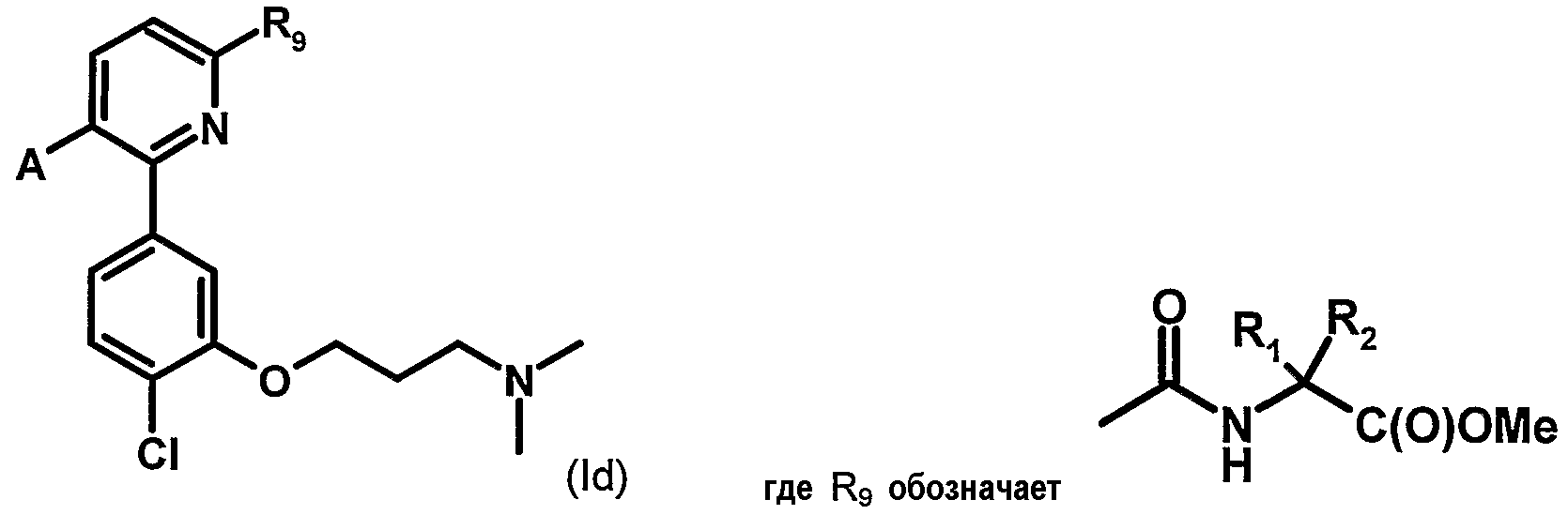Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ 5,6-БИСАРИЛ-2-ПИРИДИНКАРБОКСАМИДОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ УРОТЕНЗИНА II
Вид РИД
Изобретение
Настоящее изобретение относится к 5,6-бисарил-2-пиридинкарбоксамидам, к способу их получения и к применению в терапии в качестве антагонистов рецепторов уротензина II.
Уротензин II является циклическим пептидом, состоящим из 11 аминокислот, и признан одним из наиболее сильных на сегодняшний день сосудосуживающих агентов (Ames et al., 1999, Nature 401, 282-286). Его биологическая активность опосредуется через активность рецептора с 7 трансмембранными доменами, связанного с G белком, GPR14-рецептора и переименованного в рецептор UT (Urotensin II Receptor) Международным сообществом фундаментальной и клинической фармакологии (International Union of Basic and Clinical Pharmacology (IUPHAR)). Активация рецептора уротензина II вызывает мобилизацию межклеточного кальция. Уротензин II и его рецептор сильно экспрессируются на уровне сердечно-сосудистой системы, а также в ткани почек, головного мозга и в эндокринной системе (Richards and Charls, 2004, Peptides 25, 1795-1802). На изолированных сосудах уротензин II человека вызывает сужение, интенсивность которого меняется в зависимости от данного участка и видовой принадлежности (Douglas et al., 2000, Br. J. Pharmacol. 131, 1262-1274). Введение уротензина II анестезированным приматам увеличивает сопротивление периферических сосудов и деградацию сократимости сердца и сердечного выброса, которое может привести при большой дозе к коллапсу сердечно-сосудистой системы и, в, конце концов, к смерти животного (Armes et al., 1999, Nature 401, 282-286). Кроме того, уротензин II стимулирует пролиферацию гладкомышечных клеток сосудов и оказывает синергетический эффект вместе с митогенной активностью серотонина и окисленных ЛНП (липиды низкой плотности) (Watanabe et al., 2001, Circulatuion 104; 16-18). На культуре кардиомитоцитов уротензин II индуцирует гипертрофию клеток и увеличивает синтез внеклеточного матрикса (Tzanidis A. Et al., 2003, Cire. Res. 93, 246-253).
При некоторых сердечно-сосудистых, почечных и метаболических патологиях человека увеличивается содержание уротенизина II в крови и моче. В числе этих патологий можно назвать артериальную гипертонию, сердечную недостаточность, почечную недостаточность, диабет и цирроз печени (Richards and Charles, 2004, Peptides 25, 1795-1802; Doggrell, 2004, Expert Opin Investig Drugs 13, 479-487).
Основные эффекты уротензина II также описаны в литературе (Matsumoto Y. Et al., Neurosci. Lett, 2004, 358, 99).
Наконец, было показано, что некоторые линии опухолевых клеток суперэкспрессируют рецептор уротензина II (Takahashi R. Et al., Peptides, 2003, 24, 301).
Антагонисты рецепторов уротензина II могут быть полезны для лечения застойной сердечной недостаточности, ишемии сердца, инфаркта миокарда, гипертрофии миокарда и кардиофиброза, коронарных заболеваний и атеросклероза, системной артериальной гипертонии и легочной гипертонии, портальной гипертонии и фиброза печени, пост-ангиопластического рестеноза, острой и хронической почечной недостаточности на фоне диабета и/или гипертонии, диабета, сосудистого воспаления и аневризм.
Кроме того, антагонисты рецепторов уротензина II могут быть полезны для лечения расстройств центральной нервной системы, включая нейродегенеративные заболевания, нарушения мозгового кровообращения, стресс, тревожное состояние, агрессивность, депрессия, шизофрения, а также рвоту и расстройства сна. Наконец, антагонисты рецепторов уротензина II могут быть также полезны для лечения некоторых видов рака.
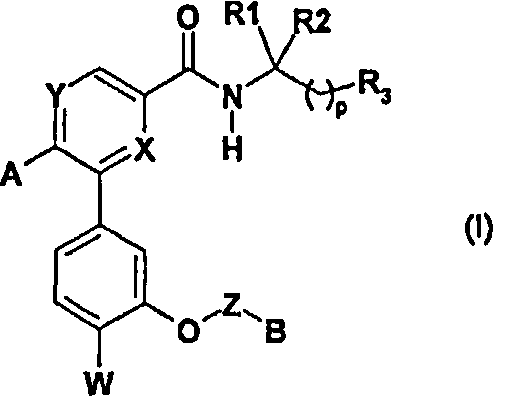
Соединения согласно изобретению отвечают формуле (I):
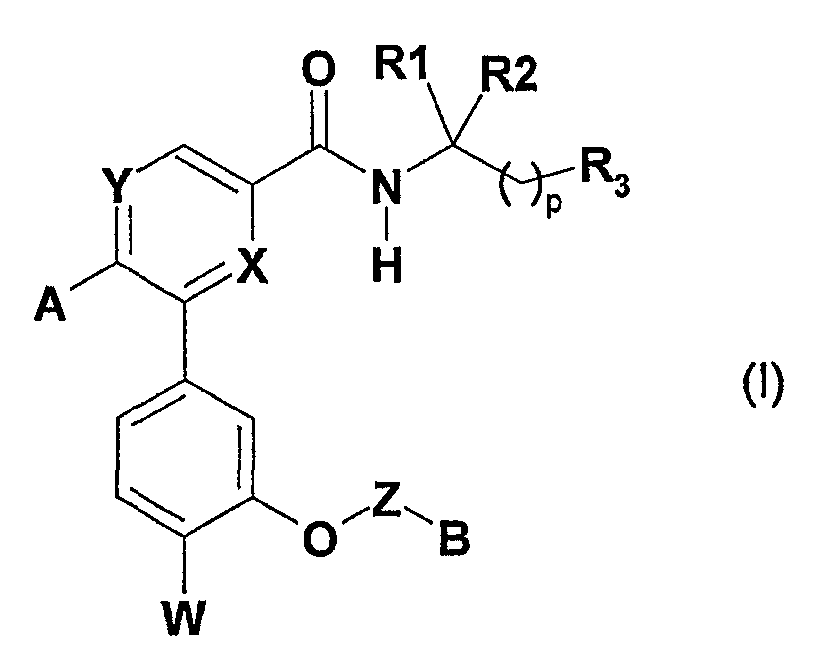
в которой:
X и Y обозначают независимо один от другого атом азота или звено -CR4-, в котором R4 обозначает атом водорода или (С1-С4)алкильную группу или алкоксигруппу;
А обозначает арильную или гетероарильную группу, причем указанные арильная и гетероарильная группы необязательно замещены одной или несколькими группами, выбранными из атома галогена, гидроксильной группы, (С1-С4)алкильной группы, (С3-С5)циклоалкильной группы, (С1-С4)алкоксигруппы, необязательно замещенной (С1-С4)алкоксигруппой, галогеналкильной группой, галогеналкоксигруппой, нитрильной группой;
W обозначает атом галогена или галогеналкильную группу;
Z обозначает (С1-С4)алкиленовую группу, необязательно замещенную одной или несколькими группами, выбранными из атома галогена и (С1-С4)алкильной группы, гидроксильной группы и (С1-С4)алкоксигруппы;
В обозначает группу -NR4R5, где R4 и R5 обозначают независимо один от другого (С1-С4)алкильную группу;
R1 и R2 обозначают:
- либо R1 обозначает атом водорода и R2 обозначает (С1-С4)алкильную группу,
- либо R1 и R2 образуют вместе с атомом углерода, с которым они соединены, моно- или полициклическую систему, выбранную из: (С3-С8)циклоалкильной группы, бициклической мостиковой группы или тетрациклической мостиковой группы, причем указанная система может быть замещена одной или несколькими гидроксильными группами;
R3 обозначает:
- либо группу С(O)R5, в которой R5 обозначает (С1-С4)алкоксигруппу, необязательно замещенную (С1-С4)алкоксигруппой, или группу NR6R7, в которой R6 и R7 независимо один от другого обозначают атом водорода, (С1-С4)алкильную группу, (С3-С5)циклоалкильную группу, (С1-С4)алкилсульфонильную группу, галогеналкильную группу,
- либо группу CH2XR8, в которой:
- Х обозначает атом кислорода и R8 обозначает атом водорода или (С1-С4)алкильную группу,
- или Х обозначает группу NH и R8 обозначает (С1-С4)алкилкарбонильную группу, (С1-С4)алкилкарбоксильную группу или (С1-С4)алкилсульфонильную группу,
- либо нитрильную группу (CN);
p обозначает целое число, равное 0 или 1.
Соединения формулы (I) могут содержать один или несколько атомов асимметрического углерода. Следовательно, они могут находиться в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, в том числе рацемические смеси, составляют часть изобретения.
Соединения формулы (I) могут находиться в форме оснований или могут быть переведены в соли с помощью кислот или оснований, в частности, фармацевтически приемлемых кислот или оснований. Такие аддитивные соли составляют часть изобретения.
Эти соли преимущественно получают с фармацевтически приемлемыми кислотами, однако соли других полезных кислот, например, кислот, пригодных для очистки или выделения соединений формулы (I), также составляют часть изобретения.
Соединения формулы (I) могут находиться также в форме гидратов или сольватов, а именно, в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или растворителя. Такие гидраты и сольваты также составляют часть изобретения.
Среди соединений, описанных в настоящем изобретении, можно назвать первую группу соединений, соответствующих формуле (I), в которой:
Х и Y обозначают независимо один от другого атом азота или звено -CR4-, в котором R4 обозначает атом водорода;
А обозначает арильную или гетероарильную группу, причем указанные арильная или гетероарильная группы необязательно замещены одной или несколькими группами, выбранными из атома галогена, гидроксильной группы, (С1-С4)алкильной группы, (С3-С5)циклоалкильной группы, (С1-С4)алкоксигруппы, необязательно замещенной (С1-С4)алкоксигруппой, галогеналкильной группой, галогеналкоксигруппой;
W обозначает атом галогена;
Z обозначает (С1-С4)алкиленовую группу;
В обозначает группу -NR4R5, в которой R4 и R5 обозначают независимо один от другого (С1-С4)алкильную группу,
R1 и R2 обозначают:
- либо R1 обозначает атом водорода и R2 обозначает (С1-С4)алкильную группу,
- либо R1 и R2 образуют вместе с атомом углерода, с которым они соединены, моно- или полициклическую систему, выбранную из: (С3-С8)циклоалкильной группы и тетрациклической мостиковой группы, причем указанная система может быть замещена одной или несколькими гидроксильными группами;
R3 обозначает:
- либо группу С(О)R5, в которой R5 обозначает (С1-С4)алкоксигруппу, необязательно замещенную (С1-С4)алкоксигруппой, или группу NR6R7, в которой R6 и R7 независимо один от другого обозначают атом водорода, (С1-С4)алкильную группу, (С3-С5)циклоалкильную группу, (С1-С4)алкилсульфонильную группу, галогеналкильную группу,
- либо группу CH2XR8, в которой Х обозначает атом кислорода и R8 обозначает атом водорода или (С1-С4)алкильную группу,
- либо нитрильную группу (CN);
р обозначает целое число, равное 0 или 1.
Среди соединений формулы (I) согласно изобретению можно назвать вторую группу соединений, которая определяется следующим образом:
X и Y обозначают независимо один от другого атом азота или звено -CR4-, в котором R4 обозначает атом водорода:
и/или
А обозначает арильную или гетероарильную группу, причем указанные арильная или гетероарильная группы необязательно замещены одной или несколькими группами, выбранными из атома галогена, гидроксильной группы, (С1-С4)алкильной группы, (С3-С5)циклоалкильной группы, (С1-С4)алкоксигруппы, необязательно замещенной (С1-С4)алкоксигруппой, галогеналкильной группой, галогеналкоксигруппой,
и/или
W обозначает атом галогена;
и/или
Z обозначает (С1-С4)алкиленовую группу;
и/или
В обозначает группу -NR4R5, в которой R4 и R5 обозначают независимо один от другого (С1-С4)алкильную группу,
и/или
R1 и R2 обозначают:
- либо R1 обозначает атом водорода и R2 обозначает (С1-С4)алкильную группу,
- либо R1 и R2 образуют вместе с атомом углерода, с которым они соединены, моно- или полициклическую систему, выбранную из (С3-С8)циклоалкильной группы или тетрациклической мостиковой группы, причем указанная система может быть замещена одной или несколькими гидроксильными группами;
и/или
R3 обозначает:
- либо группу С(О)R5, в которой R5 обозначает (С1-С4)алкоксигруппу, необязательно замещенную (С1-С4)алкоксигруппой, или группу NR6R7, в которой R6 и R7 независимо один от другого обозначают атом водорода, (С1-С4)алкильную группу, (С3-С5)циклоалкильную группу, (С1-С4)алкилсульфонильную группу, галогеналкильную группу,
- либо группу CH2XR8, в которой Х обозначает атом кислорода и R8 обозначает атом водорода или (С1-С4)алкильную группу,
и/или
р обозначает целое число, равное 0 или 1.
Среди соединений формулы (I) согласно изобретению можно назвать третью группу соединений, которая определена следующим образом:
X и Y обозначают независимо один от другого атом азота или звено -CR4-, в котором R4 обозначает атом водорода:
и/или
А обозначает арильную или гетероарильную группу, причем указанные арильная или гетероарильная группы необязательно замещены одной или несколькими группами, выбранными из атома галогена, гидроксильной группы, (С1-С4)алкильной группы, (С3-С5)циклоалкильной группы, (С1-С4)алкоксигруппы, необязательно замещенной (С1-С4)алкоксигруппой, галогеналкильной группой, галогеналкоксигруппой,
и/или
W обозначает атом галогена;
и/или
Z обозначает (С1-С4)алкиленовую группу;
и/или
В обозначает группу -NR4R5, в которой R4 и R5 обозначают независимо один от другого (С1-С4)алкильную группу,
и/или
R1 и R2 обозначают:
- либо R1 обозначает атом водорода и R2 обозначает (С1-С4)алкильную группу,
- либо R1 и R2 образуют вместе с атомом углерода, с которым они соединены, моно- или полициклическую систему, выбранную из (С3-С8)циклоалкильной группы или тетрациклической мостиковой группы, причем указанная система может быть замещена одной или несколькими гидроксильными группами;
и/или
R3 обозначает:
- либо группу С(О)R5, в которой R5 обозначает (С1-С4)алкоксигруппу, необязательно замещенную (С1-С4)алкоксигруппой, или группу NR6R7, в которой R6 и R7 независимо один от другого обозначают атом водорода, (С1-С4)алкильную группу, (С3-С5)циклоалкильную группу, (С1-С4)алкилсульфонильную группу, галогеналкильную группу,
- либо группу CH2XR8, в которой Х обозначает атом кислорода и R8 обозначает атом водорода или (С1-С4)алкильную группу,
- либо нитрильную группу (CN);
и/или
р обозначает целое число, равное 0 или 1.
Среди соединений формулы (I) согласно изобретению можно назвать четвертую группу соединений, в которых X и Y обозначают независимо один от другого атом азота или звено -CR4-, в котором R4 обозначает атом водорода.
Среди соединений формулы (I) согласно изобретению можно назвать пятую группу соединений, в которых А обозначает арильную или гетероарильную группу, причем указанные арильная или гетероарильная группы необязательно замещены одной или несколькими группами, выбранными из атома галогена, гидроксильной группы, (С1-С4)алкильной группы, (С3-С5)циклоалкильной группы, (С1-С4)алкоксигруппы, необязательно замещенной (С1-С4)алкоксигруппой, галогеналкильной группой, галогеналкоксигруппой.
Арильные и гетероарильные группы пятой группы соединений могут быть выбраны из фенильной, пиперонильной, пиридинильной или пиразолильной группы, необязательно соединенной с центральным кольцом, содержащим X и Y, посредством атома азота.
Среди соединений формулы (I) согласно изобретению можно назвать шестую группу соединений, в которых W обозначает атом галогена.
Среди соединений формулы (I) согласно изобретению можно назвать седьмую группу соединений, в которых Z обозначает (С1-С4)алкиленовую группу.
Среди соединений формулы (I) согласно изобретению можно назвать восьмую группу соединений, в которых В обозначает группу -NR4R5, в которой R4 и R5 обозначают независимо один от другого (С1-С4)алкильную группу.
Среди соединений формулы (I) согласно изобретению можно назвать девятую группу соединений, в которых R1 обозначает атом водорода и R2 обозначают (С1-С4)алкильную группу.
Среди соединений формулы (I) согласно изобретению можно назвать десятую группу соединений, в которых R1 и R2 образуют вместе с атомом углерода, с которым они соединены, моно- или полициклическую систему, выбранную из (С3-С8)циклоалкильной группы или тетрациклической мостиковой группы, причем указанная система может быть замещена одной или несколькими гидроксильными группами.
Указанная тетрациклическая мостиковая группа может быть адамантильной группой.
Среди соединений формулы (I) согласно изобретению можно назвать одиннадцатую группу соединений, в которых R3 обозначает группу С(О)R5, в которой R5 обозначает (С1-С4)алкоксигруппу, необязательно замещенную (С1-С4)алкоксигруппой, или группу NR6R7, в которой R6 и R7 независимо один от другого обозначают атом водорода, (С1-С4)алкильную группу, (С3-С5)циклоалкильную группу, (С1-С4)алкилсульфонильную группу, галогеналкильную группу.
Среди соединений формулы (I) согласно изобретению можно назвать двенадцатую группу соединений, в которых R3 обозначает группу -CH2XR8, в которой Х обозначает атом кислорода и R8 обозначает атом водорода или (С1-С4)алкильную группу.
Среди соединений формулы (I) согласно изобретению можно назвать тринадцатую группу соединений, в которых р означает целое число, равное 0.
Среди соединений формулы (I) согласно изобретению можно назвать четырнадцатую группу соединений, в которых р означает целое число, равное 1.
Все группы или подгруппы могут быть использованы независимо одни от других в разных комбинациях для получения соединений согласно изобретению.
Среди комбинаций групп, соответствующих соединениям согласно изобретению, можно назвать первую комбинацию, соответствующую соединениям, в которых:
Х обозначает атом азота и Y обозначает атом азота или звено -CR4-, в котором R4 обозначает атом водорода;
А обозначает арильную группу, необязательно замещенную одной или несколькими группами, выбранными из атома галогена, (С1-С4)алкильной группы, (С3-С5)циклоалкильной группы, (С1-С4)алкоксигруппы, галогеналкоксигруппы, или обозначает гетероарильную группу, необязательно замещенную одной или несколькими группами, выбранными из атома галогена, (С1-С4)алкильной группы;
W обозначает атом галогена,
Z обозначает (С1-С4)алкиленовую группу;
В обозначает группу -NR4R5, в которой R4 и R5 обозначают независимо один от другого (С1-С4)алкильную группу,
R1 и R2 обозначают:
- либо R1 обозначает атом водорода и R2 обозначает (С1-С4)алкильную группу,
- либо R1 и R2 образуют вместе с атомом углерода, с которым они соединены, (С3-С8)циклоалкильную группу, необязательно замещенную одной или несколькими гидроксильными группами или адамантильной группой;
R3 обозначает:
- либо группу С(О)R5, в которой R5 обозначает (С1-С4)алкоксигруппу, необязательно замещенную (С1-С4)алкоксигруппой, или группу NR6R7, в которой R6 обозначает атом водорода и R7 обозначает, (С1-С4)алкильную группу, (С3-С5)циклоалкильную группу, (С1-С4)алкилсульфонильную группу, галогеналкильную группу,
- либо группу CH2XR8, в которой Х обозначает атом кислорода и R8 обозначает атом водорода или (С1-С4)алкильную группу,
р обозначает целое число, равное 0 или 1.
Среди комбинаций групп, соответствующих соединениям согласно изобретению, можно назвать вторую комбинацию, соответствующую соединениям, в которых:
Х обозначает атом азота и Y обозначает атом азота или звено -CR4-, в которой R4 обозначает атом водорода;
А обозначает арильную группу, необязательно замещенную одной или несколькими группами, выбранными из атома галогена, (С1-С4)алкильной группы или (С1-С4)алкоксигруппы, или обозначает гетероарильную группу, необязательно замещенную одной или несколькими атомами галогена или одной или несколькими (С1-С4)алкильными группами;
W обозначает атом галогена,
Z обозначает (С1-С4)алкиленовую группу;
В обозначает группу -NR4R5, в которой R4 и R5 обозначают независимо один от другого (С1-С4)алкильную группу,
R1 и R2 обозначают:
- либо R1 обозначает атом водорода и R2 обозначает (С1-С4)алкильную группу,
- либо R1 и R2 образуют вместе с атомом углерода, с которым они соединены, (С3-С8)циклоалкильную группу или адамантильную группу;
R3 обозначает:
- либо группу С(О)R5, в которой R5 обозначает (С1-С4)алкоксигруппу, необязательно замещенную (С1-С4)алкоксигруппой, или группу NR6R7, в которой R6 обозначает атом водорода и R7 обозначает атом водорода или (С1-С4)алкильную группу, (С3-С5)циклоалкильную группу, (С1-С4)алкилсульфонильную группу,
- либо группу CH2XR8, в которой Х обозначает атом кислорода и R8 обозначает атом водорода,
р обозначает целое число, равное 0 или 1.
Среди комбинаций групп, соответствующих соединениям согласно изобретению, можно назвать третью комбинацию, соответствующую соединениям, в которых:
Х обозначает атом азота и Y обозначает атом азота или звено -CR4-, в котором R4 обозначает атом водорода;
А обозначает арильную группу, необязательно замещенную одной или несколькими группами, выбранными из атома галогена, (С1-С4)алкильной группы или (С1-С4)алкоксигруппы, или обозначает гетероарильную группу, необязательно замещенную одной или несколькими атомами галогена;
W обозначает атом галогена,
Z обозначает (С1-С4)алкиленовую группу;
В обозначает группу -NR4R5, в которой R4 и R5 обозначают независимо один от другого (С1-С4)алкильную группу,
R1 и R2 обозначают:
- либо R1 обозначает атом водорода и R2 обозначает (С1-С4)алкильную группу, при этом атом углерода, который несет R1 и R2, имеет абсолютную (S) конфигурацию,
- либо R1 и R2 образуют вместе с атомом углерода, с которым они соединены, (С3-С8)циклоалкильную группу;
R3 обозначает:
- либо группу С(О)R5, в которой R5 обозначает (С1-С4)алкоксигруппу, необязательно замещенную (С1-С4)алкоксигруппой, или группу NR6R7, в которой R6 обозначает атом водорода и R7 обозначает атом водорода, (С1-С4)алкильную группу, (С3-С5)циклоалкильную группу, (С1-С4)алкилсульфонильную группу, галогеналкильную группу,
- либо группу CH2XR8, в которой Х обозначает атом кислорода и R8 обозначает атом водорода или (С1-С4)алкильную группу,
р обозначает целое число, равное 1.
В рамках настоящего изобретения, если не оговорено иначе, подразумевают под:
- атомом галогена: атом фтора, брома или иода:
- алкильной группой: насыщенную линейную алифатическую группу, содержащую 1-5 атомов углерода, или, если алкильная цепь содержит не менее трех атомов углерода, может представлять собой линейную, разветвленную или частично циклизованную группу. В качестве примера можно привести метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную, пентильную, метилен-циклопропильную группы;
- алкиленовой группой: алкильную группу, которая определена выше, являющуюся двухвалентной группой. В качестве примера можно привести метиленовую, пропиленовую, бутиленовую, этиленовую (-СН2-СН2-) или 2-метилпропиленовую группы;
- циклоалкильной группой: насыщенную циклическую группу, которая содержит 3-8 атомов углерода, являющуюся циклической группой. В качестве примера можно привести циклопропильную, циклопентильную, циклогексильную группы;
- полициклической мостиковой группой: полициклическую систему, содержащую от двух до четырех насыщенных цикла с 7-10 атомами углерода, в которых смежные атомы углерода соединены друг с другом и принадлежат, по меньшей мере, двум циклам одновременно, например, мостиковая бициклическая группа или мостиковая тетрациклическая группа, такая как адамантильная группа;
- арильной группой: ароматическую моноциклическую группу, содержащую 5 или 6 атомов углерода, например, фенильную группу, причем этот цикл может быть слит с гетероциклической, частично насыщенной группой, содержащей 5 или 6 атомов, из которых один или два являются гетероатомами, такими как атом кислорода, например, диоксолильная группа, образующая пиперонильную группу;
- гетероарильной группой: ароматическую циклическую группу, содержащую 5 или 6 атомов, из которых один или несколько являются гетероатомами, такими как атом азота. В качестве примеров гетероарильных групп можно назвать пиридинильную, пиразолильную группу;
- циклоалкиленовой группой: циклоалкильную группу, которая определена выше, и являющуюся двухвалентной группой;
- галогеналкильной группой: алкильную группу, которая определена выше, в которой один или несколько атомов водорода замещены атомом галогена. В качестве примера можно назвать трифторметильную группу, дифторметильную группу;
- галогеналкоксигруппой: группу формулы -О-галогеналкил, в которой галогеналкильная группа определена выше. В качестве примера можно назвать группу -U-CHF2;
- алкоксигруппой: группу формулы -О-алкил, в которой алкильная группа определена выше.
Из числа соединений согласно изобретению можно назвать, в частности, следующие соединения:
1. Метил-1-{[(3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоксилат;
2. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(4-гидрокси-2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
3. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(5-гидрокси-2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
4. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
5. Метил-1-{[(3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-метил-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоксилат
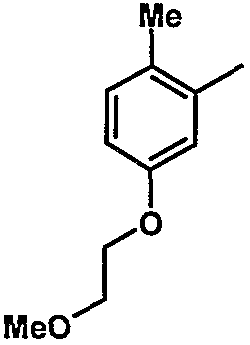
6. Метил-1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[5-(2-метоксиэтокси)-2-метилфенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоксилат;
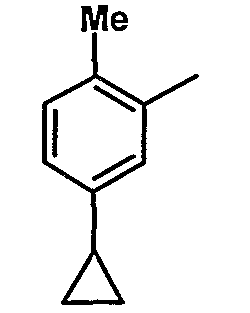
7. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(5-циклопропил-2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
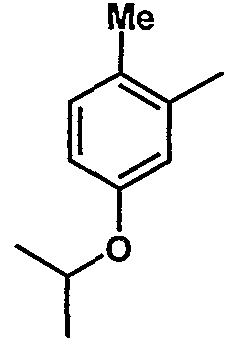
8. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(5-изопропокси-2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
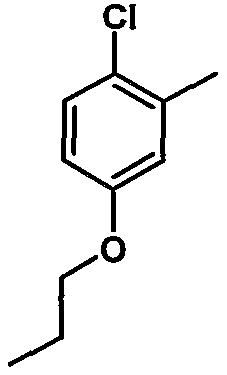
9. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-пропоксифенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
10. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(5-этокси-2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
11. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(6-метил-1,3-бензодиоксол-5-ил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
12. Метил-1-{[(3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-фтор-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоксилат;
13. Метил-1-{[(2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-3,5-диметил-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоксилат;
14. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(3-гидрокси-2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
15. Метил-1-{[(2-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2'-метил-3,3'-бипиридин-6-ил)карбонил]амино}циклогексанкарбоксилат;
16. Метил-1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[5-(дифторметокси)-2-метилфенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоксилат;
17. Метил-1-{[(6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-[2-(дифторметил)-5-метилфенил]пиридин-2-ил)карбонил]амино}циклогексанкарбоксилат;
18. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(3,5-диметил-1Н-пиразол-1-ил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
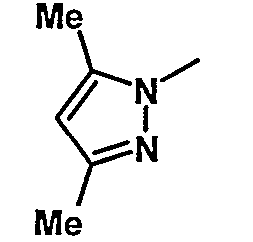
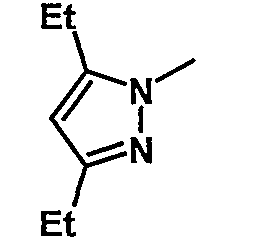
19. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(3,5-диэтил-1Н-пиразол-1-ил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилат;
20. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,4-диметилфенил)пиразин-2-ил]карбонил}амино)циклогексанкарбоксилат;
21. Метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-этоксифенил)пиразин-2-ил]карбонил}амино)циклогексанкарбоксилат;
22. Метил-(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-метилфенил)пиридин-2-ил]карбонил}амино)-4-метилпентаноат;
23. Метил-(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,4-диметилфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентаноат;
24. Метил-(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлор-5-этоксифенил)пиразин-2-ил]карбонил}амино)-4,4-диметилпентаноат;
25. Метил-(3S)-3-{[(3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-фтор-2,3'-бипиридин-6'-ил)карбонил]амино}-4,4-диметилпентаноат;
26. Метил-2-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)адамантан-2-карбоксилат;
27. 2-метоксиэтил-(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентаноат;
28. Метил-(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентаноат;
29. Этил-(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентаноат;
30. Изопропил-(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентаноат;
31. Метил-(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентаноат;
32. N-[(1S)-1-(2-амино-2-оксоэтил)-2,2-диметилпропил]-6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-карбоксамид;
33. 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-2,2-диметил-1-[2-(метиламино)-2-оксоэтил]пропил}-5-(2-метилфенил)пиридин-2-карбоксамид;
34. 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-2,2-диметил-1-{2-[(метилсульфонил)амино]-2-оксоэтил}пропил]-5-(2-метилфенил)пиридин-2-карбоксамид;
35. 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-1-{2-[(1,1,1-трифторэтил)амино]-2-оксоэтил}-2,2-диметилпропил]-5-(2-метилфенил)пиридин-2-карбоксамид;
36. 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-1-{2-[циклопропил(метил)амино]-2-оксоэтил}-2,2-диметилпропил]-5-(2-метилфенил)пиридин-2-карбоксамид;
37. 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-1-(2-гидроксиэтил)-2,2-диметилпропил]-5-(2-метилфенил)пиридин-2-карбоксамид;
38. 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-1-(2-метоксиэтил)-2,2-диметилпропил]-5-(2-метилфенил)пиридин-2-карбоксамид;
39. 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(2S)-1-циано-3,3-диметилбутан-2-ил]-5-(2-метилфенил)пиридин-2-карбоксамид;
40. Метил-цис-1-{[(3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}-4-гидроксициклогексанкарбоксилат;
41. Метил-цис-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,4-диметилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоксилат;
42. Метил-цис-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоксилат;
43. Метил-цис-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(5-этокси-2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоксилат;
44. Метил-цис-1-{[(3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-метил-2,3'-бипиридин-6'-ил)карбонил]амино}-4-гидроксициклогексанкарбоксилат;
Соединения, перечисленные выше, названы согласно номенклатуре IUPAC с помощью программного обеспечения ACD/Name, версия θ.0. Advanced Chemistry Development, Inc.: Toronto ON, Canada, www.acdlabs.com. 2006.
В дальнейшем тексте под защитной группой (GP) понимают группу, которая, с одной стороны, может защитить реакционноспособную группу, такую как гидрокси или аминогруппу, в процессе синтеза и, с другой стороны, регенерировать сохранившуюся реакционноспособную группу в конце синтеза. Примеры защитных групп, а также способы защиты и снятия защиты приведены в документе «Protective Groups in Organic Synthesis», Green et al., 3-e издание (John Wiley & Sons, Inc., New York).
Под уходящей группой (Т) в дальнейшем тексте понимают группу, которая легко отщепляется от молекулы в результате гидролитического разрыва связи с одновременным уходом электронной пары. Таким образом, эта группа может быть легко заменена другой группой во время реакции нуклеофильного замещения или во время реакции сочетания, например, с металлоорганическим соединением. Такими уходящими группами являются, например, атомы галогена или активированная гидрокси группа, такая как мезильная, тозильная, трифлатная, ацетильная и т.д. группы. Примеры уходящих групп, а также ссылки на способы их получения приведены в документе «Advances in Organic Chemistry», J.March, 3-е издание, Wiley Interscience, стр.310-316.
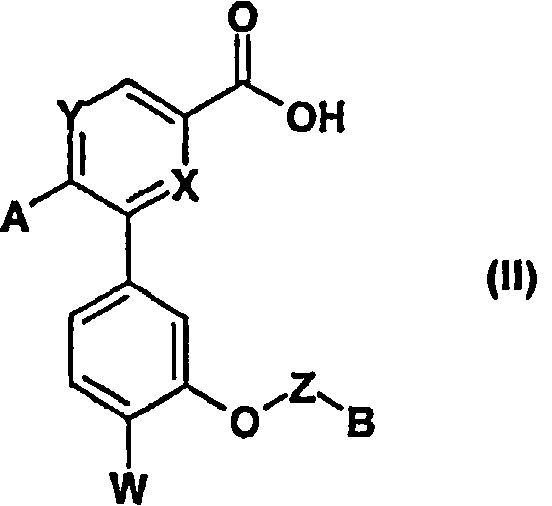
В соответствии с изобретением соединения формулы (I) можно получать согласно способу, описанному ниже, иллюстрированному схемой синтеза №1.
Реакция пептидного сочетания, осуществляемая между кислотой (II) и аминосоединениями формулы (III) в присутствии агента сочетания, такого как тетрафторборат N-{(1H-бензотриазол-1-илокси)(диметиламино)метилиден}-N-метилметанаминия (TBTU) или гидрохлорид N-[3-(диметиламино)пропил-N'-этил]карбодиимида (EDC.HCl) с или без N-гидроксисукцинимида (HONSu), и органического основания, такого как N,N-диизопропилэтиламин (DIEA), в полярном апротонном растворителе, таком как ацетонитрил или ДМФА, позволяет получать соединения формулы (I) соответствующие изобретению (стадия i). Аминосоединения формулы (III) получают согласно способам, известным специалисту.
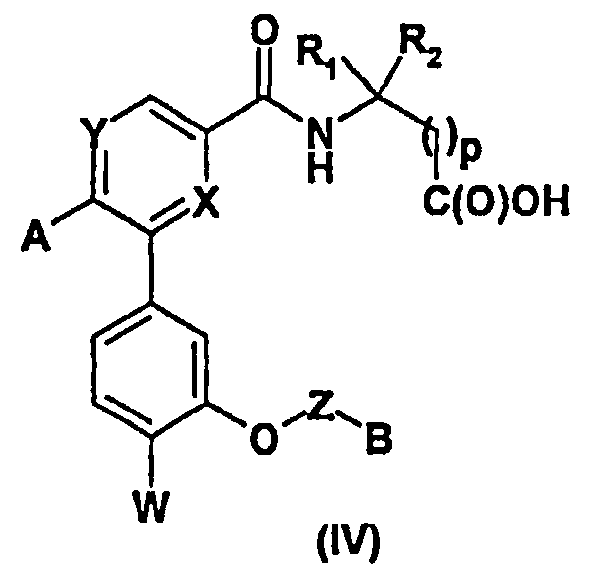
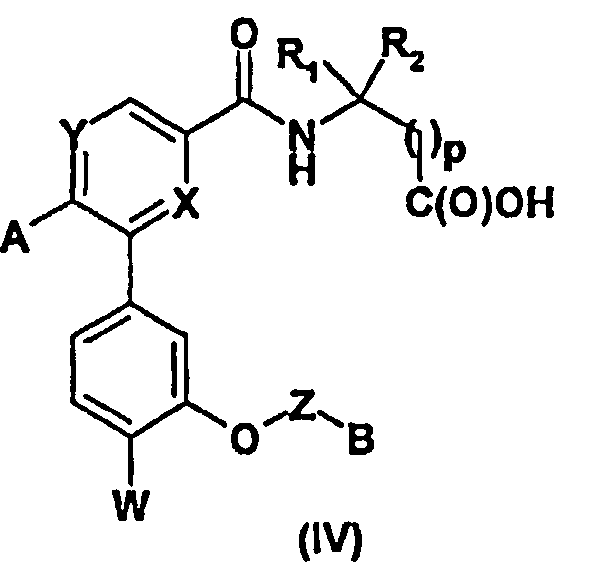
В случае, когда R3=C(O)R5, где R5 обозначает (С1-С4)алкоксигруппу, можно также осуществить омыление соединений формулы (I) с помощью сильного минерального основания, такого как гидроксид натрия, в бинарной смеси, такой как вода/метанол, при комнатной температуре (Т.А.) или при нагревании с обратным холодильником, что приводит, после подкисления, к кислотам формулы (IV) (стадия ii).
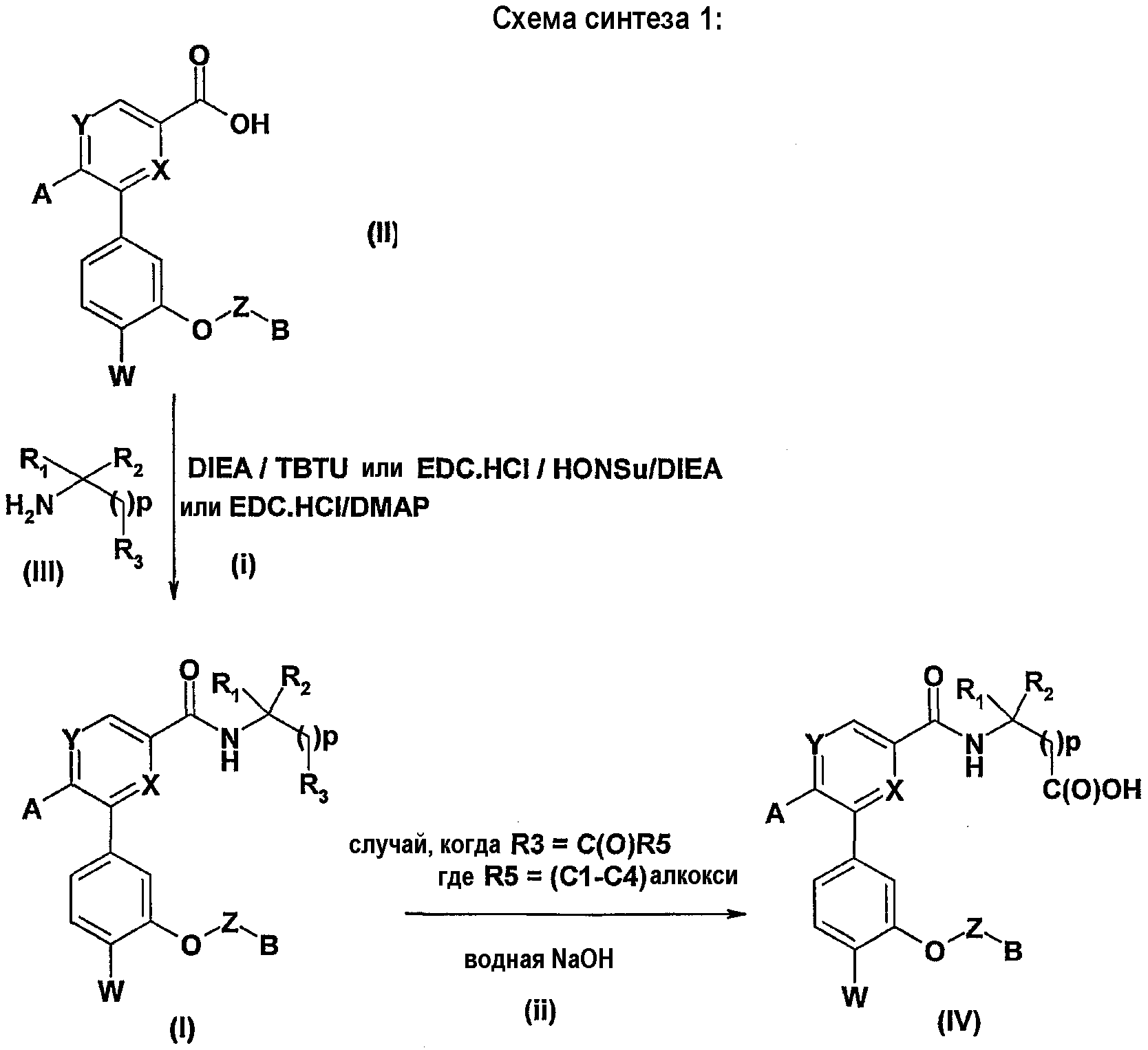
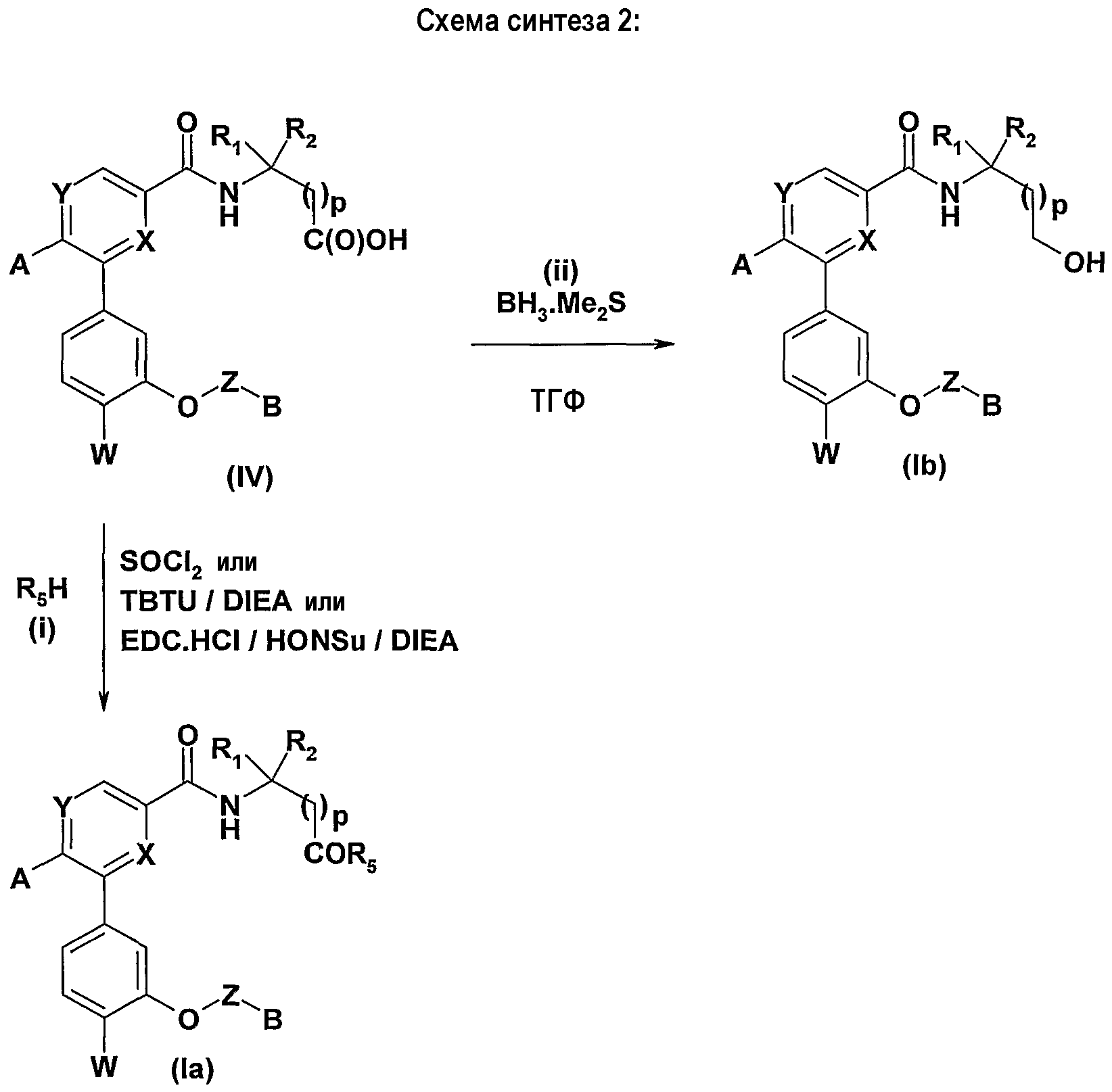
С другой стороны, можно получать соединения формулы (Ia), которые соответствуют соединениям формулы (I), в которых R3=C(O)R5, согласно способу, который иллюстрирован ниже схемой синтеза №2:
Осуществляют реакцию между кислотой (IV) и спиртом или амином R5H в присутствии тионилхлорида (SOCl2) или агента пептидного сочетания, такого как TBTU или система EDC.HCl/HONSu, органического основания, такого как DIEA, в полярном апротонном растворителе, таком как ацетонитрил или ДМФА, и получают соединения формулы (Ia) согласно изобретению (стадия i).
Более конкретно, соединения формулы (Ib), соответствующие соединениям формулы (I), в которых R3=-CH2XR8, где X является атомом кислорода, а R8 - атомом водорода, могут быть получены восстановлением кислоты (IV) с помощью восстановительного агента, такого как борандиметилсульфидный комплекс, в апротонном растворителе, таком как ТГФ (стадия ii).
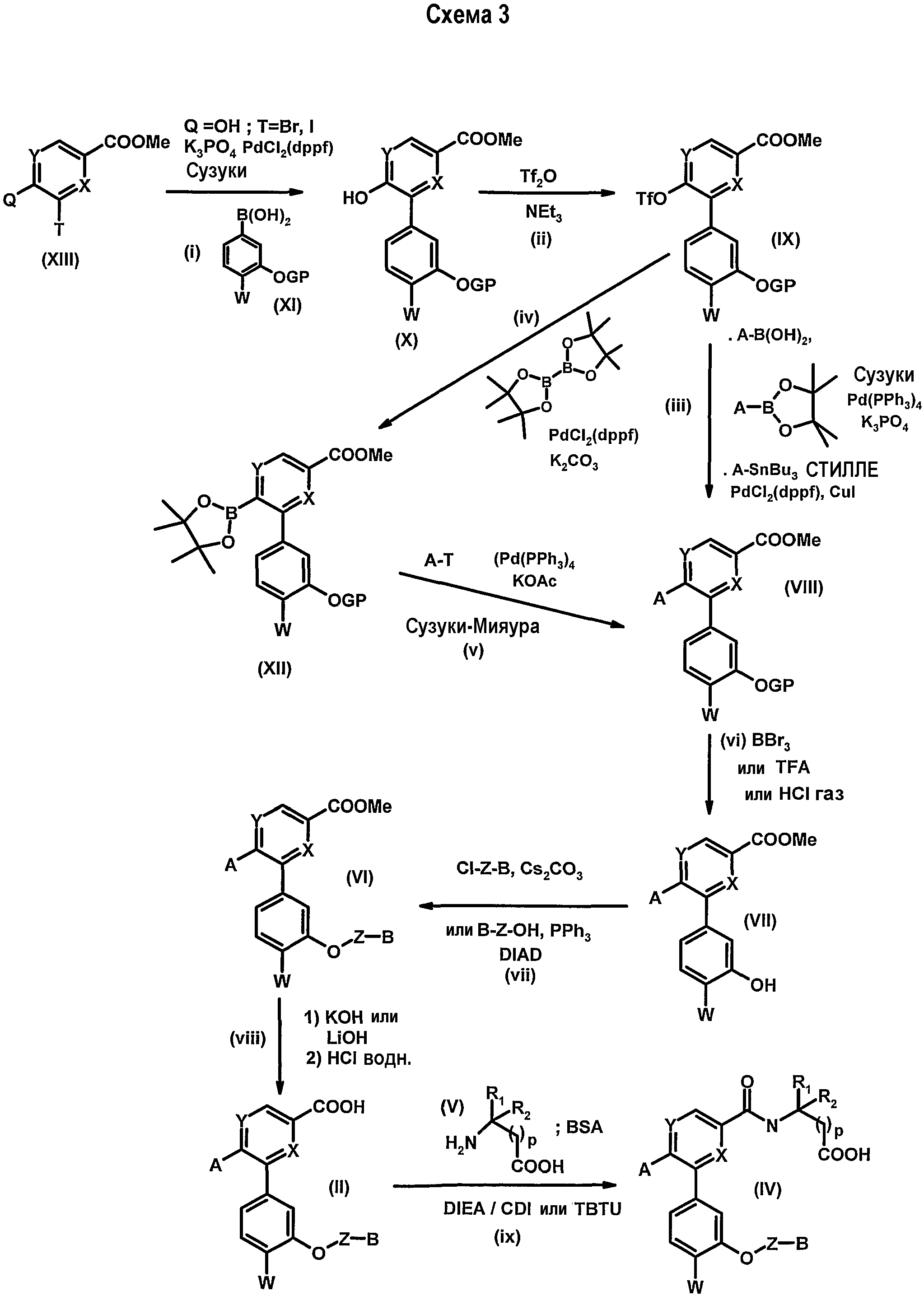
Соединения формулы (II) и (IV) могут быть получены согласно способу, который иллюстрирован ниже схемой 3.
Когда в исходном соединении формулы (XIII) X обозначает атом азота, а Y обозначает атом углерода (т.е. группу формулы -CR4-, которая определена со ссылкой на соединения формулы (I) согласно изобретению), или Х обозначает атом углерода, а Y обозначает атом азота, или же Х и Y обозначают атом азота, то можно осуществить на стадии (i) реакцию сочетания типа сочетания Сузуки, катализируемую производным палладия (О), таким как тетракис(трифенилфосфин)палладий)(О) [Pd(PPh3)4] или палладия (II), такого как дихлорид [1,1'-бис(циклопентадиенилфосфино)ферроцен]палладия(II) [PdCl2(dppf)] между соединением формулы (XIII) (где Q=OH или Br и T=атом галогена, такой как атом брома или иода) и бороновой кислотой формулы (XI), в которой GP означает бензильную группу, необязательно замещенную одной или несколькими группами алкокси, в присутствии слабого минерального основания, такого как фосфат калия или К2СО3, в полярном апротонном растворителе, таком как N,N-диметилформамид (ДМФА) или 1,4-диоксан, при температуре около 95°С. Эта реакция позволяет произвести региоселективное замещение функциональной группы Т на феноксицикл (XI) и получить соединение (Х).
Функциональную ОН-группу соединения (Х) затем превращают на стадии (ii) в уходящую группу, такую как трифторметансульфонатная группа (TfO), с помощью трифторметансульфонового ангидрида в присутствии основания, такого как триэтиламин (ТЕА), в растворителе, таком как дихлорметан (DCM) с получением соединения формулы (IX).
Полученная таким образом трифторметансульфонатная группа, благодаря своей реакционной способности, способна ввести на стадии (iii) кольцо А в процессе палладийорганического сочетания по типу:
- либо сочетания Сузуки между соединением (IX) и бороновой кислотой или ее сложным эфиром соответственно формул А-В(ОН)2 или
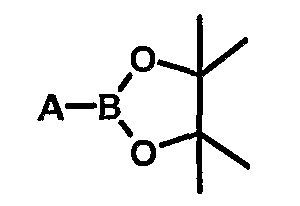
в присутствии каталитического количества палладиевого производного, такого как Pd(PPh3)4, в присутствии слабого минерального основания, такого как фосфат калия, и полярного апротонного растворителя, такого как ДМФА, при температуре 90°С.
- либо сочетания СТИЛЛЕ между соединением формулы (IX) и производным арилтрибутилстаннана или гетероарилстаннана ASnBu3 в присутствии каталитического количества иодида меди (CuI) и производного палладия (II), такого как PdCl2(dppf), и полярного апротонного растворителя, такого как 1,4-диоксан, при температуре 90°С.
Получают таким образом соединение (VII).
В качестве варианта, можно использовать реакционную способность группы в обратном порядке, осуществляя последовательно две реакции: реакцию образования борсодержащего производного/реакцию СУЗУКИ-МИЯУРА (соответственно стадии iv и v), исходя из производного (IX) и арил- или гетероарилгалогенида А-Т (Т обозначает атом галогена, такой как атом брома или иода). Реакцию СУЗУКИ-МИЯУРА осуществляют с использованием промежуточного соединения (XII) в присутствии каталитического количества производного палладия(0), такого как Pd(PPh3)4, слабого минерального основания, такого как карбонат калия, в бинарной смеси растворителей, такой как DME/вода, при температуре около 80°С. При этом, диоксобороланильную функциональную группу производного (XII) получают из трифторметансульфонильной группы производного (IX) путем взаимодействия с 4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2-диоксабороланом в присутствии каталитического количества производного палладия (II), такого как PdCl2(dppf), слабого основания, такого как ацетат калия, в аполярном растворителе, таком как толуол, при температуре около 110°С.
Таким образом получают соединение (VIII).
Снятие защиты с фенольной группы соединения формулы (VIII) c помощью трибромида бора при -78°C, трифторуксусной кислоты (TFA) при комнатной температуре (К.Т.) или хлористого водорода при 0° в DCM (стадия (vi)) приводит к получению соединения формулы (VII).
Введение группы Z-B на стадии (vii) может быть осуществлено:
- либо путем алкилирования соединения (VII) с помощью хлорпроизводного Cl-Z-B в присутствии слабого минерального основания, такого как карбонат цезия, в полярном апротонном растворителе, таком как ДМФА, при температуре между 80 и 100°С, такой как 90°С,
- либо путем реакции Мицунобу между соединением (VII) и спиртом формулы НО-Z-В в присутствии трифенилфосфина, диизопропилазодикарбоксилата (DIAD) и каталитического количества слабого органического основания, такого как ТЕА, при 0°С в апротонном растворителе, таком как тетрагидрофуран (ТГФ).
Соединение формулы (VI) подвергают затем омылению на стадии (viii) с помощью сильного минерального основания, такого как гидроксид калия, в смеси вода/метанол, при к.т. или при нагревании с обратным холодильником, и получают, после подкисления сильной кислотой, такой как 1 н. соляная кислота (HCl), соединение (II).
В рамках настоящего описания под к.т. понимают температуру между 20 и 25°С.
Осуществляя реакцию пептидного сочетания (стадия (ix)) между соединением (II) и аминосоединениями формулы (V) в присутствии агента сочетания, такого как карбонилдиимидазол (CDI), тетрафторборат N-[(1H-бензотриазол-1-илокси)(диметиламино)метилиден]-N-метилметанаминия (TBTU) или система EDC.HCl/HONSu, и органического основания, такого как DIEA, в полярном апротонном растворителе, таком как ДМФА или N-метилпирролидинон (NMP) или ацетонитрил, при к.т., получают соединения формулы (IV).
Исходные соединения или реагенты на схемах 1, 2 и 3, если не указаны способы их получения, имеются в продаже или описаны в литературе, или могут быть получены согласно способам, которые там описаны или известны специалисту.
Согласно другому из своих аспектов, настоящее изобретение относится также к соединениям формулы (II). Эти соединения пригодны в качестве промежуточных соединений синтеза соединений формулы (I).
Следующие примеры описывают получение некоторых соединений согласно изобретению. Эти примеры не ограничивают изобретение, а только иллюстрирует его. Номера соединений, полученных в примерах, соответствуют тем же номерам, указанным в таблицах, представленных ниже, которые иллюстрируют химическую структуру и физические свойства некоторых соединений согласно изобретению.
Используемая аббревиатура и формулы:
AcOEt - этилацетат
AcOH - уксусная кислота
BSA - N,O-бис(триметилсилил)ацетамид
CDI - карбонилдиимидазол
CuI - иодид меди
DCM - дихлорметан
DIBAL-H - гидрид диизобутилалюминия
DIAD - диизопропилазодикарбоксилат
DIEA - N,N-диизопропилэтиламин
DMAP - 4-диметиламинопиридин
DME - диметоксиэтан
ДМФА - диметилформамид
ДМСО - диметилсульфоксид
EDC.HCl - гидрохлорид N-[3-(диметиламино)пропил-N'-этил]карбодиимид
EtOH - этанол
Час - час(ы)
Мин - минута(ы)
HCl - соляная кислота
К2СО3 - карбонат калия
КОАс - ацетат калия
КОН - гидроксид калия
К3РО4 - фосфат калия или трехкалиевый тетраоксофосфат
Na2CO3 - карбонат натрия
NH4Cl - хлорид аммония
NaHCO3 - гидрокарбонат натрия
Na2SO4 - сульфат натрия
NMP - N-метилпирролидинон
PdCl2(dppf) - дихлорид [1,1'-бис(циклопентадиенилдифенилфосфино)ферроцен]палладия(II)
Pd(PPh3)4 - тетракис(трифенилфосфин)палладий(0)
Pd2(dba)3 - трис(дибензилиденацетон)дипалладий(0)
TBTU - тетрафторборат N-{(1H-бензотриазол-1-илокси)(диметиламино)метилиден}-N-метилметанаммония
TEA - триэтиламин
TFA - трифторуксусная кислота
ТГФ - тетрагидрофуран
к.т. - комнатная температура
Масс-спектры получены в следующих условиях при сочетании ЖХ/МС:
Колонка: Kromasil 50×2,1 мм, 6,5 мкм
Элюенты: А=CH2CN/TFA (1000/0,5)
В=Н2О/CH2CN/TFA (1000/30/0,5)
|
Время удержания обозначено Tr.
Спектры магнитного резонанса протона (1Н-ЯМР), которые представлены ниже, зарегистрированы при 400 МГц в ДМСО-d6, используя пик ДМСО-d5 в качестве эталона. Химические сдвиги δ выражены в частях на млн (м.д.). Наблюдаемые сигналы выражены следующим образом: с=синглет, д=дублет, т=триплет, м=массив или синглет широкий, Н=протон.
Пример 1
Гидрохлорид метил-1-{[(3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'бипиридин-6-ил)карбонил]амино}циклогексанкарбоксилата (соединение №1)
Получение метил-6-бром-5-гидрокси-2-пиридинкарбоксилата осуществлено способом, описанным в литературе (J. Org. Chem. 1996, 4623-4633).
1.1 2-[(4-метоксибензил)окси]-1-хлор-4-иодбензол
Суспензию из 300 г (1179 ммоль) 2-хлор-5-иодфенола, 184 г (1179 ммоль) 4-метоксибензилхлорида и 195,5 г (1415 ммоль) безводного К2СО3 в 1,2 л безводного ДМФА перемешивали 5 часов при 70°С, затем охлаждали до к.т. Реакционную среду затем распределяли в 3 л смеси эфир/вода 2:1. Органический слой промывали 2×1 л воды, высушивали над Na2SO4 и концентрировали при пониженном давлении, полученный остаток загущали в пентане. Получали 406 г 2-[(4-метоксибензил)окси]-1-хлор-4-иодбензола в виде бежевого порошка.
Выход=92%
Т.пл.(°С)=72.
1.2 [3-[(4-метоксибензил)окси]-4-хлорфенил]бороновая кислота
К раствору 145 г (387 ммоль) 2-[(4-метоксибензил)окси]-1-хлор-4-иодбензола в 1,2 л безводного ТГФ, находящемуся в атмосфере аргона и перемешиваемому при -50°С, прибавляли по каплям 220 мл (440 ммоль) 2 н. раствора iPrMgCl в ТГФ, поддерживая температуру между -40 и -50°С. Доводили температуру реакционной смеси до -10°С и перемешивание продолжали 1 час. Затем прибавляли 94 мл (406 ммоль) триизопропилбората и поднимали медленно температуру реакционной смеси до 0°С. После 2 часов перемешивания смесь разбавляли 500 мл 5 н. водного раствора HCl, затем экстрагировали эфиром (2×600 мл). Органический слой промывали 2×1 л воды, высушивали над Na2SO4, затем концентрировали при пониженном давлении. Полученный остаток загущали 300 мл пентана, фильтровали на фриттированном стекле и промывали 200 мл пентана. Получали 96 г [3-[(4-метоксибензил)окси]-4-хлорфенил]бороновой кислоты в виде твердого вещества белого цвета.
Выход=84%
Т.пл.(°С)=148 (с разложением).
1.3 Метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-гидроксипиридин-2-карбоксилат
Раствор 80 г (345 ммоль) метил-6-бром-5-гидрокси-2-пиридинкарбоксилата и 146 г (499 ммоль) [3-[(4-метоксибензил)окси]-4-хлорфенил]бороновой кислоты в 1600 мл безводного диоксана перемешивали 15 минут при барботировании аргоном, затем прибавляли 143 г (1034 ммоль) безводного К2СО3 и 14 г (17,2 ммоль) PdCl2(dppf). Реакционную среду перемешивали 10 часов при 95°С в атмосфере аргона, охлаждали до к.т., затем распределяли при к.т. между 2 л AcOEt и 350 мл 1 н. водного раствора HCl. Органический слой промывали 300 мл 1 н. водного раствора HCl и 600 мл воды. После высушивания над Na2SO4 и концентрирования при пониженном давлении, осадок извлекали 500 мл смеси пентан/DCM 7:3, отфильтровывали и промывали 200 мл пентана. Получали 105 г метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-гидроксипиридин-2-карбоксилата в виде порошка коричневого цвета, используемого на следующей стадии.
Выход=76%.
Т.пл.(°С)=202.
1.4 Метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-{[(трифторметил)сульфонил]окси}пиридин-2-карбоксилат
К смеси 115 г (287 ммоль) метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-гидроксипиридин-2-карбоксилата в 1200 мл DCM прибавляли 121,3 мл (863 ммоль) ТЕА. Смесь, постепенно растворяясь, охлаждали до -20°С в атмосфере аргона. По каплям прибавляли 54,5 мл (331 ммоль) трифторметансульфонового ангидрида, поддерживая температуру на уровне -20°С. Спустя 3 часа выдерживания при -10°С реакционную среду обрабатывали 1 л DCM и промывали 2×1 л воды, высушивали над Na2SO4, затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле, элюируя смесью пентан/AcOEt в градиенте AcOEt от 0 до 30%. После концентрирования при пониженном давлении, получали 138 г метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-{[(трифторметил)сульфонил]окси}пиридин-2-карбоксилата в виде белых кристаллов.
Выход=90%.
Т.пл.(°С)=89.
1.5 Метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-карбоксилат
Раствор 30 г (56 ммоль) метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-{[(трифторметил)сульфонил]окси}пиридин-2-карбоксилата и 28,6 г (113 ммоль) 4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2-диоксаборолана в 500 мл безводного толуола перемешивали 15 мин при барботировании аргоном, затем прибавляли 16,6 г (169 ммоль) безводного КОАс и 2,3 г (2,82 ммоль) PdCl2(dppf) и нагревали реакционную смесь 26 часов при 110°С. Затем реакционную смесь распределяли в 800 мл смеси AcOEt/солевой раствор 1:1. Органический слой высушивали над Na2SO4, фильтровали, затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле, элюируя смесью DCM/AcOEt в градиенте от 0 до 30% AcOEt. После концентрирования при пониженном давлении, получали 22,4 г метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-карбоксилата в виде воска.
Выход=78%.
1.6 Метил-2'-[3-[(4-метоксибензил)окси]-4-хлорфенил]-3,5-дихлор-2,3'-бипиридин-6'-карбоксилат
Через суспензию 1 г (1,96 ммоль) метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-карбоксилата и 0,58 г (2,55 ммоль) 2-бром-3,5-дихлорпиридина в 10 мл смеси DME/вода 2:1 пропускали путем барботирования аргон в течение 10 мин, затем добавляли последовательно 0,81 г (5,88 ммоль) К2СО3 и 0,159 г (0,14 ммоль) Pd(PPh3)4. Реакционную смесь нагревали 4 часа при 80°С, затем охлаждали и разбавляли в 50 мл AcOEt. Органический слой промывали 2×20 мл воды, высушивали над Na2SO4, затем концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью циклогексан/AcOEt в градиенте от 0 до 40% AcOEt и получали 0,4 г метил-2'-[3-[(4-метоксибензил)окси]-4-хлорфенил]-3,5-дихлор-2,3'-бипиридин-6'-карбоксилата в виде масла.
Выход=38%.
1.7 Метил-3,5-дихлор-2'-(4-хлор-3-гидроксифенил)-2,3'-бипиридин-6'-карбоксилат
К раствору 0,4 г (0,75 ммоль) метил-2'-[3-[(4-метоксибензил)окси]-4-хлорфенил]-3,5-дихлор-2,3'-бипиридин-6'-карбоксилата в 8 мл безводного DCM, охлажденному в атмосфере аргона до 0°С, прибавляли 0,6 мл TFA. После 2 часов перемешивания при к.т. реакционную среду концентрировали при пониженном давлении. Полученный остаток поглощали 10 мл AcOEt и 10 мл насыщенного водного раствора NaHCO3. После экстрагирования водный слой повторно экстрагировали 10 мл AcOEt. Органические слои объединяли, промывали 10 мл воды, высушивали над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя смесью гертан/AcOEt в градиенте от 0 до 30% AcOEt. После концентрирования при пониженном давлении, получали 0,27 г метил-3,5-дихлор-2'-(4-хлор-3-гидроксифенил)-2,3'-бипиридин-6'-карбоксилата в виде масла.
Выход=89%.
1.8 Метил-3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-карбоксилат
К раствору 2 г (4,88 ммоль) метил-3,5-дихлор-2'-(4-хлор-3-гидроксифенил)-2,3'-бипиридин-6'-карбоксилата в 20 мл безводного ДМФА, находящемуся в атмосфере аргона, прибавляли 1,15 г (7,32 ммоль) гидрохлорида 3-хлор-N,N-диметилпропан-1-амина и 4,77 г (14,64 ммоль) карбоната цезия. Реакционную среду перемешивали 18 часов при 90°С, охлаждали до к.т., затем концентрировали при пониженном давлении. Остаток поглощали 250 мл AcOEt и промывали 250 мл 5% водного раствора Na2CO3, затем 100 мл воды. После высушивания над Na2SO4 и концентрирования при пониженном давлении остаток очищали колоночной хроматографией на силикагеле, элюируя смесью DCM/метанол в градиенте от 0 до 15% метанола. После концентрирования при пониженном давлении получали 1,82 г метил-3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-карбоксилата в виде смолы.
Выход=80%.
1.9 3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-карбоновая кислота
К раствору 1,82 г (3,9 ммоль) метил-3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-карбоксилата в 50 мл EtOH и 10 мл воды прибавляли 0,34 г (6,06 ммоль) КОН. Реакционную среду перемешивали 18 часов при к.т., затем концентрировали при пониженном давлении. Полученный остаток поглощали 6,1 мл 1 н. водного раствора HCl (6,1 ммоль) и 100 мл смеси DCM/MeOH 9:1. Органический слой высушивали над Na2SO4 и концентрировали при пониженном давлении, в результате получали 1,8 г 3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-карбоновую кислоту в виде смолы.
Выход=95%.
1.10 Гидрохлорид 1-{[(3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоновой кислоты
К раствору 1,49 г (3,1 ммоль) 3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-карбоновой кислоты в 15 мл безводного NMP прибавляли в атмосфере аргона 1,62 мл (9,3 ммоль) DIEA и 2,83 г (8,82 ммоль) TBTU. Одновременно с этим доводили до 90°С при перемешивании в атмосфере аргона смесь 421 мг (2,94 ммоль) 1-аминоциклогексанкарбоновой кислоты и 1,51 мл (6,19 ммоль) BSA в 15 мл безводного ацетонитрила. Спустя 2 часа, смесь полностью растворилась и полученный раствор, доведенный до к.т., прибавляли к раствору 3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-карбоновой кислоты, активированной TBTU. После перемешивания в течение 2 часов при к.т., прибавляли 10 мл 0,5 н. водного раствора HCl и перемешивание продолжали 18 часов. Реакционную среду распределяли между 100 мл смеси DCM/MeOH 9:1 и 10 мл воды. После экстрагирования водный слой снова экстрагировали 10 мл смеси DCM/MeOH 9:1. Органические слои объединяли, высушивали над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали ВЭЖХ на обращенной фазе (RP18), элюируя смесью 10-2 н. водная HCl/ацетонитрил в градиенте от 5% до 100% ацетонитрила. После концентрирования при пониженном давлении и лиофилизации получали 1 г гидрохлорида 1-{[(3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоновой кислоты в виде белого порошка.
Выход=50%.
Т.пл.(°С)=165.
1.11 Гидрохлорид метил-1-{[(3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоксилата
К раствору 300 мг (0,47 ммоль) гидрохлорида 1-{[(3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоновой кислоты в 10 мл метанола, охлажденному до 0°С, прибавляли 0,07 мл (0,93 ммоль) тионилхлорида. Реакционную смесь доводили до к.т. и перемешивали в течение 20 часов, затем концентрировали при пониженном давлении. Полученный остаток поглощали 20 мл эфира и загущали. После высушивания при пониженном давлении, получали 268 мг гидрохлорида метил-1-{[(3,5-дихлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоксилата в виде белого порошка.
Выход=87%.
Т.пл.(°С)=168.
М=C30H33Cl3N4O4=618; М+Н=619; Tr=1,14 мин.
1Н-ЯМР (м.д., ДМСО-d6, 400 МГц): 9,90 (с, 1Н); 8,80 (с, 1Н); 8,65 (с, 1Н); 8,35 (с, 1Н); 8,20 (д, 1Н); 8,15 (д, 1Н); 7,40 (д, 2Н); 6,80 (д, 1Н); 4,05 (м, 2Н); 3,65 (с, 3Н); 3,20 (м, 2Н); 2,80 (с, 6Н); 2,20 (м, 4Н); 1,85 (т, 2Н); 1,7-1,3 (м, 6Н).
Пример 2
Гидрохлорид метил (3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентаноата (соединение №31)
2.1 Метил-6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-карбоксилат
Осуществляя последовательность стадий дебензилирование/О-алкилирование/омыление, описанных соответственно в примерах 1.7, 1.8 и 1.9, и исходя из 665 мг (1,35 ммоль) метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-(2-хлорфенил)пиридин-2-карбоксилата получали 181 мг гидрохлорида 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-карбоновой кислоты в виде смолы.
Выход=28%.
2.2 Гидрохлорид (3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты
К смеси 674 мг (1,4 ммоль) гидрохлорида 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-карбоновой кислоты в 7 мл безводного ДМФА последовательно прибавляли в атмосфере аргона при к.т. 240 мг (2,1 ммоль) N-гидроксисукцинимида и 401 мг (2,1 ммоль) EDC.HCl. После перемешивания в течение 18 часов к реакционной среде последовательно прибавляли 1,31 мл (7,7 ммоль) DIEA и 304 мг (1,51 ммоль) трет-бутил-(3S)-3-амино-4,4-диметилпентаноата (J. Org. Chem. 1999, 64, 6411-6417). Перемешивание продолжали 18 часов при к.т., затем реакционную смесь концентрировали при пониженном давлении. Полученный остаток обрабатывали 18 часов при к.т. 0,25 мл (3 ммоль) 12 н. водного раствора HCl в 30 мл муравьиной кислоты, затем концентрировали при пониженном давлении. После очистки ВЭЖХ на обращенной фазе (RP18) при элюировании смесью 10-2 н. водная HCl/ацетонитрил в градиенте ацетонитрила 5-100%, получали после лиофилизации 500 мг гидрохлорида (3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты в виде порошка белого цвета.
Выход=59%.
Т.пл.(°С)=170.
2.3 Гидрохлорид метил-(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентаноата
В соответствии с процедурой, описанной в примере 1.11, этерифицировали 217 мг (0,356 ммоль) гидрохлорида (3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты с помощью 0,05 мл (0,71 ммоль) тионилхлорида в 4 мл метанола и, после загущения 20 мл эфира и лиофилизации, получали 196 мг гидрохлорида метил-(3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-хлорфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентаноата в виде белого порошка.
Выход=94%.
Т.пл.(°С)=126.
[α]D 20=-17° (c=0,1, МеОН).
М=C31H37Cl2N3O4=585; M+H=586; Tr=1,14 мин.
1Н-ЯМР (м.д., ДМСО-d6, 400 МГц): 10,15 (с, 1Н); 8,45 (дд, 1Н); 8,10 (дд, 1Н); 8,05 (д, 1Н); 7,55 (м, 1Н); 7,45 (м, 3Н); 7,40 (д, 1Н); 7,20 (д, 1Н); 6,95 (дд, 1Н); 4,35 (тд, 1Н); 3,95 (м, 2Н); 3,55 (д, 3Н); 3,20 (м, 2Н); 2,80 (д, 6Н); 2,70 (м, 2Н); 2,15 (м, 2Н); 0,95 (д, 9Н).
Пример 3
Гидрохлорид метил-1-{[(3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-метил-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоксилата (соединение №5)
3.1 Метил-3-хлор-2'-{4-хлор-3-[(4-метоксибензил)окси]фенил}-5-метил-2,3'-бипиридин-6'-карбоксилат
Осуществляя реакцию сочетания Сузуки-Мияура между 1 г (1,96 ммоль) метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-карбоксилата и 526 мг (2,55 ммоль) 2-бром-3-хлор-5-метилпиридина согласно примеру 1.6, получали 637 мг метил-3-хлор-2'-{4-хлор-3-[(4-метоксибензил)окси]фенил}-5-метил-2,3'-бипиридин-6'-карбоксилата в виде масла.
Выход=64%.
3.2 3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-метил-2,3'-бипиридин-6'-карбоновая кислота
Осуществляя последовательность стадий дебензилирование/О-алкилирование/омыление, описанных соответственно в примерах 1.7, 1.8 и 1.9, и исходя из 338 мг (0,66 ммоль) метил-3-хлор-2'-{4-хлор-3-[(4-метоксибензил)окси]фенил}-5-метил-2,3'-бипиридин-6'-карбоксилата, получали 134 мг 3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-метил-2,3'-бипиридин-6'-карбоновой кислоты в виде смолы коричневого цвета.
Выход=45%.
3.3 Гидрохлорид метил-1-аминоциклогексанкарбоксилата
Через суспензию 2 г (14 ммоль) 1-аминоциклогексанкарбоновой кислоты в 20 мл метанола барботировали хлористый водород в течение 2 минут. К полученному раствору прибавляли 1,2 мл (16,8 ммоль) тионилхлорида и реакционную среду нагревали в течение 6 часов с обратным холодильником. После охлаждения смесь концентрировали при пониженном давлении и полученный остаток поглощали 5 мл метанола. Добавляли 50 мл эфира для осаждения 2,3 г гидрохлорида метил-1-аминоциклогексанкарбоксилата в виде белого порошка.
Выход=85%.
Т.пл.(°С)=240.
3.4 Гидрохлорид метил-1-{[(3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-метил-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоксилата
К суспензии 134 мг (0,29 ммоль) 3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-метил-2,3'-бипиридин-6'-карбоновой кислоты в 5 мл безводного ацетонитрила последовательно прибавляли 0,18 мл (1,02 ммоль) DIEA и 56 мг (0,29 ммоль) гидрохлорида метил-1-аминоциклогексанкарбоксилата. Смесь охлаждали до 0°С и добавляли 112 мг (0,35 ммоль) TBTU. После перемешивания в течение 18 часов при температуре между 0 и 10°С, реакционную среду концентрировали при пониженном давлении, затем поглощали 20 мл смеси AcOEt/эфир 1:1. После промывки 10 мл воды и 10 мл насыщенного водного раствора NaHCO3, органический слой высушивали над Na2SO4 и концентрировали при пониженном давлении. К остатку, поглощенному 5 мл DCM, прибавляли 0,2 мл (0,1 ммоль) 2 н. раствора HCl в эфире, затем 20 мл безводного эфира, что привело к осаждению 139 мг гидрохлорида метил-1-{[(3-хлор-2'-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-метил-2,3'-бипиридин-6'-ил)карбонил]амино}циклогексанкарбоксилата в виде порошка белого цвета.
Выход=80%.
Т.пл.(°С)=152.
М=C31H36Cl2N4O4=598; M+H=599; Tr=1,11 мин.
1Н-ЯМР (м.д., ДМСО-d6, 400 МГц): 10,25 (с, 1Н); 8,60 (с, 1Н); 8,52 (с, 1Н); 8,10 (т, 2Н); 7,85 (с, 1Н); 7,40 (д, 1Н); 7,35 (д, 1Н); 6,90 (дд, 1Н); 4,00 (м, 2Н); 3,65 (с, 3Н); 3,20 (м, 2Н); 2,80 (д, 6Н); 2,40 (с, 3Н); 2,20 (м, 4Н); 1,90 (т, 2Н); 1,70-1,30 (м, 6Н).
Пример 4
Гидрохлорид метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилата (соединение №4)
4.1 Метил-6-[3-[(4-метоксибензил)окси-4-хлорфенил]-5-(2-метилфенил)пиридин-2-карбоксилат
Раствор 2,6 г (4,88 ммоль) метил-6-[3-[(4-метоксибензил)окси]-4-хлорфенил]-5-{[(трифторметил)сульфонил]окси}пиридин-2-карбоксилата (пример 1.4) и 880 мг (6,48 ммоль) 2-метилфенилбороновой кислоты в 20 мл безводного ДМФА перемешивали 15 минут при барботировании аргоном, затем добавляли 1,27 г (6 ммоль) безводного К3РО4 и 0,58 г (0,5 ммоль) Pd(PPh3)4, и реакционную смесь перемешивали 18 часов при 90°С в атмосфере аргона. Реакционную среду затем распределяли при к.т. в 120 мл смеси эфир/AcOEt/вода 1:1:2. После экстрагирования водный слой повторно экстрагировали 10 мл AcOEt, органические слои объединяли и промывали 4×30 мл воды, высушивали над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле при элюировании смесью гептан/AcOEt в градиенте от 0 до 20% AcOEt. После концентрирования при пониженном давлении получали 1,8 г метил-6-[3-[(4-метоксибензил)окси-4-хлорфенил]-5-(2-метилфенил)пиридин-2-карбоксилата в виде масла.
4.2 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-карбоновая кислота
Осуществляя последовательность стадий дебензилирование/О-алкилирование/омыление, описанных соответственно в примерах 1.7, 1.8 и 1.9, и исходя из 5,3 г (11 ммоль) метил-6-[3-[(4-метоксибензил)]окси-4-хлорфенил]-5-(2-метилфенил)пиридин-2-карбоксилата и 1,4 г (8,9 ммоль) гидрохлорида 3-хлор-N,N-диметилпропан-1-амина получали 3,9 г 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-карбоновой кислоты в виде смолы.
Выход=81%.
Т.пл.(°С)=146-150.
4.3 Гидрохлорид метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилата
В соответствии с процедурой, описанной в примере 3.5, осуществляли пептидное сочетание между 300 мг (0,71 ммоль) 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-карбоновой кислоты и 137 мг (0,71 ммоль) гидрохлорида метил-1-аминоциклогексанкарбоксилата и получали, после загущения, 190 мг гидрохлорида метил-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)циклогексанкарбоксилата в виде белого порошка.
Выход=48%.
Т.пл.(°С)=115.
М=C32H38ClN3O4=563; M+H=564; Tr=1,18 мин.
1Н-ЯМР (м.д., ДМСО-d6, 400 МГц): 10,2 (с, 1Н); 8,55 (с, 1Н); 8,10 (д, 1Н); 7,95 (д, 1Н); 7,40-7,20 (м, 6Н); 7,05 (дд, 1Н); 3,85 (м, 2Н); 3,65 (с, 3Н); 3,20 (м, 2Н); 2,80 (д, 6Н); 2,20 (д, 2Н); 2,10 (м, 2Н); 1,90 (с, 3Н); 1,85 (т, 2Н); 1,70-1,30 (м, 6Н).
Пример 5
Гидрохлорид метил-цис-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоксилата (соединение №42)
5.1 Гидрохлорид метил-цис-1-амино-4-гидроксициклогексанкарбоксилата
В соответствии с процедурой, описанной в примере 3.4, осуществляли этерификацию 1,41 г (7,21 ммоль) цис-1-амино-4-гидроксициклогексанкарбоновой кислоты (J. Chem. Soc. Perkin Trans. 1 (1999) рр.3375-3379) с помощью 0,62 мл (8,65 ммоль) тионилхлорида в 30 мл метанола и получали 1,5 г гидрохлорида метил-цис-1-амино-4-гидроксициклогексанкарбоксилата в виде белого порошка.
Выход=100%.
Т.пл.(°С)=160.
5.2 Гидрохлорид метил-цис-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоксилата
К суспензии 467 мг (1,1 ммоль) 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-карбоновой кислоты (пример 4.2) в 11 мл безводного ДМФА последовательно прибавляли в атмосфере аргона при к.т. 139 мг (1,21 ммоль) N-гидроксисукцинимида и 232 мг (1,21 ммоль) EDC.HCl. Реакционную смесь перемешивали 24 часа при к.т., затем прибавляли к прозрачному желтому раствору 253 мг (1,21 ммоль) гидрохлорида метил-цис-1-амино-4-гидроксициклогексанкарбоксилата и 1 мл (5,94 ммоль) DIEA. Снова перемешивали в течение 16 часов при к.т., затем реакционную смесь разбавляли в 30 мл AcOEt и органический слой промывали 3×20 мл воды. После высушивания над Na2SO4 и концентрирования при пониженном давлении, полученный остаток поглощали смесью 5 мл метанола и 1,5 мл 1 н. водного раствора HCl (1,5 ммоль), затем очищали ВЭЖХ на обращенной фазе (RP18), элюируя смесью 10-2 н. водная HCl/ацетонитрил в градиенте от 5% до 100% ацетонитрила за 90 минут. После концентрирования при пониженном давлении и лиофилизации получали 252 мг гидрохлорида метил-цис-1-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4-гидроксициклогексанкарбоксилата в виде белого порошка.
Выход=37%.
Т.пл.(°С)=244.
М=C32H38ClN3O5=579; M+H=580; Tr=7,2 мин (градиент 20 мин).
1Н-ЯМР (м.д., ДМСО-d6, 400 МГц): 9,80 (с, 1Н); 8,60 (с, 1Н); 8,05 (д, 1Н); 7,95 (д, 1Н); 7,35 (д, 1Н); 7,30-7,10 (м, 5Н); 6,95 (дд, 1Н); 4,75 (м, 1Н); 3,95 (м, 2Н); 3,65 (с, 3Н); 3,55 (м, 1Н); 3,20 (м, 2Н); 2,85 (с, 6Н); 2,30 (м, 2Н); 2,15 (м, 2Н); 1,90 (с, 3Н); 1,80 (м, 4Н); 1,40 (м, 2Н).
Пример 6
Гидрохлорид 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-2,2-диметил-1-{2-[(метилсульфонил)амино]-2-оксоэтил}пропил]-5-(2-метилфенил)пиридин-2-карбоксамида (соединение №34)
6.1 Гидрохлорид (3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2,4-диметилфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты
В соответствии со способом, описанным в примере 2.2, осуществляли пептидное сочетание между 425 мг (1 ммоль) 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-карбоновой кислоты (пример 4.2) и 206 мг (2,05 ммоль) трет-бутил-(3S)-3-амино-4,4-диметилпентаноата (J. Org. Chem., 1999, 64, 6411-6417) и получали 390 мг гидрохлорида (3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты в виде порошка белого цвета.
Выход=66%.
Т.пл.(°С)=130.
[α]D 22=-5°; (c=0,1; MeOH).
6.2 Гидрохлорид 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-2,2-диметил-1-{2-[(метилсульфонил)амино]-2-оксоэтил}пропил]-5-(2-метилфенил)пиридин-2-карбоксамида
К раствору 250 мг (0,42 ммоль) гидрохлорида (3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты и 49 мг (0,51 ммоль)метансульфонамида в 2 мл DCM последовательно прибавляли 52 мг (0,42 ммоль) DMAP и 89 мг (0,47 ммоль) EDC.HCl. Реакционную среду перемешивали 16 часов при к.т. Снова прибавляли 0,42 ммоль EDC.HCl и 0,42 ммоль метансульфонамида, и реакционную смесь перемешивали еще 3 суток, затем концентрировали при пониженном давлении. Остаток поглощали 100 мл AcOEt, и органический слой промывали 30 мл воды, затем 30 мл 4 М водного раствора NaHCO3. После высушивания над Na2SO4 и концентрирования при пониженном давлении, остаток очищали колоночной хроматографией на силикагеле, элюируя смесью DCM/метанол в градиенте метанола от 0% до 10%. После концентрирования при пониженном давлении остаток поглощали 2 мл метанола и 0,5 мл 1 н. водного раствора HCl, затем очищали ВЭЖХ на обращенной фазе (RP18), элюируя смесью 10-2 н. водная HCl/ацетонитрил в градиенте ацетонитрила от 5% до 100% в течение 90 минут. После концентрирования при пониженном давлении и лиофилизации, получали 130 мг гидрохлорида 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-2,2-диметил-1-{2-[(метилсульфонил)амино]-2-оксоэтил}пропил]-5-(2-метилфенил)пиридин-2-карбоксамида в виде порошка белого цвета.
Выход=46%.
Т.пл. °С=138.
[α]D 22=-45°; (c=0,5; MeOH).
М=C32H41ClN4O5S=628; M+H=629; Tr=1,06 мин.
1Н-ЯМР (м.д., ДМСО-d6, 400 МГц): 11,80 (д, 1Н); 10,30 (с, 1Н); 8,40 (т, 1Н); 8,05 (д, 1Н); 7,95 (д, 1Н); 7,30 (м, 5Н); 7,15 (д, 1Н); 7,05 (дд, 1Н); 4,35 (т, 1Н); 3,80 (м, 2Н); 3,15 (м, 2Н); 3,05 (с, 3Н); 2,80 (с, 6Н); 2,65 (м, 2Н); 2,10 (м, 2Н); 1,90 (с, 3Н); 1,00 (д, 9Н).
Пример 7
Гидрохлорид 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-1-(2-гидроксиэтил)-2,2-диметилпропил]-5-(2-метилфенил)пиридин-2-карбоксамида (соединение №37)
К раствору 250 мг (0,42 ммоль) гидрохлорида (3S)-3-({[6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-5-(2-метилфенил)пиридин-2-ил]карбонил}амино)-4,4-диметилпентановой кислоты (пример 6.1) в 2 мл ТГФ по каплям прибавляли в атмосфере аргона 1,06 мл (2,12 ммоль) 2 н. раствора борандиметилсульфидного комплекса в ТГФ. Реакционную среду перемешивали 16 часов при к.т., затем разбавляли в 10 мл безводного метанола. Полученный раствор концентрировали при пониженном давлении, и остаток поглощали 20 мл метанола, затем снова концентрировали при пониженном давлении. Полученный остаток растворяли в 20 мл смеси ТГФ/1 н. водный раствор HCl 1:1, и раствор нагревали 4 часа с обратным холодильником. После охлаждения и концентрирования при пониженном давлении, остаток очищали ВЭЖХ на обращенной фазе (RP18), элюируя смесью 10-2 н. водная HCl/ацетонитрил в градиенте ацетонитрила от 0% до 100% за период 120 минут. После концентрирования при пониженном давлении и лиофилизации, получали 50 г гидрохлорида 6-{4-хлор-3-[3-(диметиламино)пропокси]фенил}-N-[(1S)-1-(2-гидроксиэтил)-2,2-диметилпропил]-5-(2-метилфенил)пиридин-2-карбоксамида в виде порошка белого цвета.
Выход=20%.
Т.пл. °С=93.
[α]D 22=-20°; (c=0,4; MeOH).
М=C31H40ClN3O3=537; M+H=538; Tr=1,06 мин.
1Н-ЯМР (м.д., ДМСО-d6, 400 МГц): 10,10 (с, 1Н); 8,15 (д, 1Н); 8,10 (дд, 1Н); 7,95 (д, 1Н); 7,30 (м, 5Н); 7,10 (м, 1Н); 7,05 (дд, 1Н); 3,95 (т, 1Н); 3,80 (м, 2Н); 3,45 (м, 2Н); 3,15 (м, 2Н); 2,80 (д, 6Н); 2,10 (м, 2Н); 1,90 (д, 3Н); 1,85 (м, 1Н); 1,65 (м, 1Н); 0,95 (д, 9Н).
Следующие таблицы иллюстрируют химическую структуру и физические свойства некоторых соединений согласно изобретению.
Все соединения, указанные в таблицах, находятся в форме гидрохлорида.
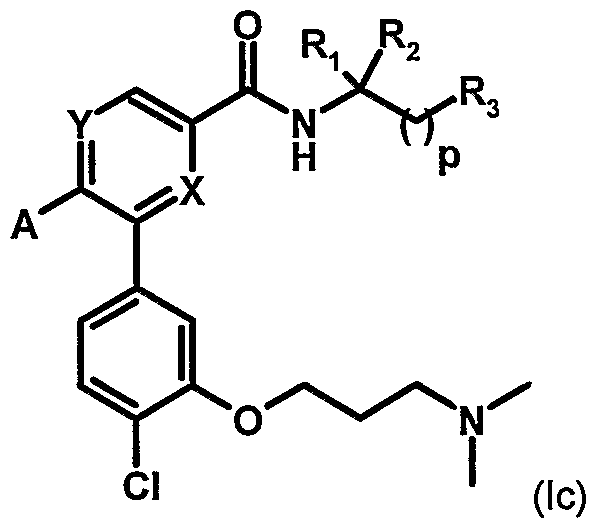
Таблица 1 иллюстрирует соединения формулы (Ic), соответствующие соединениям формулы (I), в которых W обозначает атом хлора, Z обозначает группу -(СН2)3- и В обозначает группу -N(CH3)2.
Таблица 2 иллюстрирует соединения формулы (Id), соответствующие соединениям формулы (I), в которых W обозначает атом хлора, Z обозначает группу -(СН2)3- и В обозначает группу -N(CH3)2, p равно 0 и R3 обозначает С(О)ОМе.
В этих таблицах:
- Ме, Et и iPr обозначают, соответственно, метильную, этильную и изопропильную группу,
- С(О)Оалкил обозначает сложноэфирную группу, например, С(О)ОМе обозначает группу сложного метилового эфира, C(O)OiPr обозначает группу сложного изопропилового эфира, и т.д.
- С(О)NH2 обозначает амидную группу и т.д.
- символ «Т.пл.» в колонке обозначает точку плавления соединения в градусах Цельсия.
ТАБЛИЦА СОЕДИНЕНИЙ
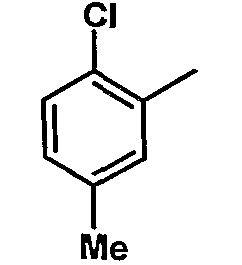
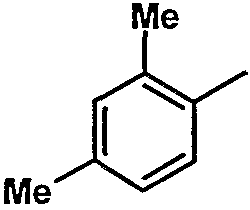
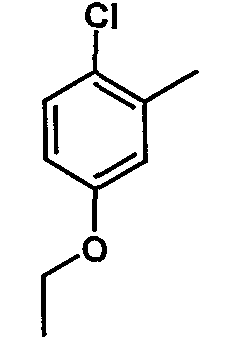
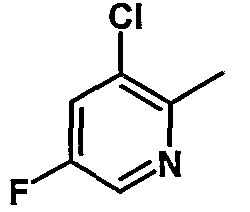
|
|
|
Соединения согласно изобретению были объектом фармакологических исследований для определения свойств этих соединений, в частности, с помощью теста in vitro на мобилизацию межклеточного кальция (тест FlipR) с использованием антагонистов (соединений согласно настоящему изобретению) рецептора GPR14 человека уротензина II.
Этот тест описан ниже:
1. Протокол FlipR (планшет-ридер для флуорометрической визуализации (Fluorometric Imaging Plate Reader))
1.1 Цель
Цель заключается в измерении активации рецептора GPR14 уротензином II человека.
1.2 Принцип испытания
GPR14 является Gq-связанным рецептором с 7 трансмембранными доменами. Его активация специфическим лигандом вызывает увеличение Са2+ в клетке через сигнальный путь PLC (фосфолипаза С), IP3 (инозитол-1,4,5-трифосфат), DAG (диацилглицерол). Увеличение Са2+ в клетке измеряли с помощью проницаемого зонда Fluo4AM (зонд с узким диапазоном возбуждения и с узким диапазоном эмиссии), который связывается со свободным Са2+ и осуществляет эмиссию на длине волны 520 нм. Свободный зонд не флуоресцирует в отсутствие Са2+.
1.3 Протокол
План эксперимента
1) засев клетками в Д-1 (День-1) или Д-2
2) введение/загрузка (Д0) зонда (1 час)
3) добавление продуктов в FlipR и измерение
4) добавление лиганда в FlipR и измерение в присутствии продуктов
5) обработка и отправка данных
Клетки CHOGPR14
Клетки культивировали в полной среде Flask T225. Для проведения экспериментов клетки пересевали в объеме 200 мкл культуральной среды с плотностью 60000 клеток/лунка в 96- луночные черные планшеты с прозрачным дном для использования в день Д+1 или с плотностью 40000 клеток/лунка для использования в Д+2.
Введение Fluo 4 M
Fluo 4 AM готовили в концентрации 20 мМ, затем отбирали аликвоту (50 мкл) и хранили при -20°С в защищенном от света месте. Готовили также раствор плюрониевой кислоты в ДМСО в концентрации 200 мг/мл (который хранили одну неделю при комнатной температуре в защищенном от света месте).
В лунки с клетками вносили смесь Fluo 4 AM + плюрониевая кислота (аликвота 50 мкл + 50 мкл плюрониевой кислоты), разведенную до 1/100 буфером для анализа.
После промывки лунок с использованием 150 мкл буфера для анализа (см. приложение) лунки с клетками загружали следующим образом:
- распределяли по 100 мкл буфера для анализа в лунку
- добавляли по 10 мкл смеси Fluo-4AM + плюрониевая кислота, разведенной до 1/100.
Клетки инкубировали 1 час при 37°С в защищенном от света инкубаторе в присутствии 5% СО2.
Затем клетки промывали 3 раза по 150 мкл буфера для анализа для удаления избытка зонда. В конце промывки добавляли в каждую лунку буфер объемом 150 мкл.
После инкубации планшетов в течение 20 минут при к.т. в защищенном от света месте, эти планшеты переносили в FlipR для измерения флуоресценции.
Базовый уровень введения Fluo-4 определяли для каждого планшета (стандартное отклонение (sd) <10%) перед первым введением.
После стабилизации базового сигнала, соединения, являющиеся ингибиторами GPR14, вводили посредством FlipR в объеме 50 мкл из планшета для разведения, осуществленного на Biomek 2000 буфером для анализа. Уротензин II (конечная концентрация 3 нМ, равная СЕ50) добавляли в объеме 50 мкл посредством FlipR к клеткам из сток-планшета в концентрации 15 нМ, разведенного буфером для анализа.
Регистрация данных осуществлялась непрерывно в течение всего эксперимента.
1.4 Анализ данных
Для каждого планшета базовое значение флуоресценции перед введением соединений нормализовали с помощью функции “пространственная равномерная коррекция (spatial uniformity correction)” FlipR. Значения флуоресценции, измеренные непосредственно перед введением уротензина II (минимальные), а также значения флуоресценции, измеренные при пике активности уротензина II (максимальные), направляли на обработку в Excel. Для каждого планшета ряд лунок обрабатывали только уротензином при отсутствии соединения-ингибитора. Минимальные и максимальные значения флуоресценции для этих лунок усредняли и на основании этих данных определяли 100%-ый эффект уротензина II.
Процент ингибирования, подсчитанный для каждой ингибирующей концентрации, рассчитывался следующим образом:
- для каждой лунки, содержащей УроII (уротензин II) + ингибитор, определяли интервал значений (дельта)продукта = макс. - мин.
- для лунок, содержащих только УроII, определяли интервал значений (дельта)УроII = (среднее макс. - среднее мин.)
Процент ингибирования для каждой концентрации продукта рассчитывали следующим образом:
Ингибирование (%)=100×(дельта УроII - дельта продукта)/дельта УроII
1.5 Приложение
Композиция буфера для анализа (деминерализованная вода вводится непосредственно перед употреблением)
|
Различные солевые растворы могут храниться на складе 2 месяца при температуре 4°С.
Разводили водой до заданного объема и добавляли пробенецид, растворенный в 1 н. гидроксиде натрия.
|
Устанавливают рН 7,4
1.6 Материал
Уротензин II (Bachem H-4768)
Fluo-4AM (Molecular Probes (F14202 5×1 мг))
Пробенецид (Sigma P8761 100 г)
Плюрониевая кислота (Molecular Probes Р6867)
HBSS 10x (Gibco 14185-045)
HEPES (кислота) (Sigma H3375)
Карбонат натрия (Sigma S7795) Na2CO3
Сульфат магния (Sigma M7774) MgSO4
Хлорид кальция (Sigma C5080) CaCl2
V-образное черное дно (Molecular Devices 9000-0549)
Черный 96-луночный планшет (Beckton Dickinson 356640)
ДМСО (Sigma D 5879)
1.7 Результаты
Исследованные соединения имеют показатель IC50 в тесте FlipR ниже 10000 нМ. Некоторые из этих соединений имеют IC50 в тесте FlipR ниже 1000 нМ, и даже ниже 200 нМ. Например, соединения №1, 2, 4, 5, 7, 9, 11, 13, 18, 20, 24, 26, 29, 33, 36, 42, 44 таблицы имеют показатель CI50, соответственно, 1600, 1700, 630, 540, 330, 1400, 566, 846, 1080, 116, 102, 170, 253, 450, 450, 95, 660 нМ.
Следовательно, соединения согласно изобретению могут быть использованы для получения лекарственных средств, в частности, лекарственных средств, являющихся ингибиторами рецепторов уротензина II. Таким образом, согласно другому из своих аспектов изобретение относится к лекарственным средствам, которые содержат соединение формулы (I) или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, или же энантиомер, диастереоизомер или рацемическую смесь этого соединения.
Эти лекарственные средства находят свое применение в терапии, в частности, для лечения и/или профилактики застойной сердечной недостаточности, ишемии сердца, инфаркта миокарда, гипертрофии миокарда и кардиофиброза, коронарных заболеваний и атеросклероза, системной артериальной гипертонии, легочной гипертонии, портальной гипертонии, фиброза печени, пост-ангиопластического рестеноза, почечной недостаточности, в частности, острой и хронической почечной недостаточности на фоне диабета и/или гипертонии, диабета, воспаления общего характера, фиброза общего характера и аневризм.
Эти лекарственные средства находят также применение в терапии для лечения и/или профилактики заболеваний центральной нервной системы, в том числе нейродегенеративных заболеваний, нарушений мозгового кровообращения, стресса, тревоги, агрессивности, депрессии, шизофрении или расстройств сна.
Лекарственные средства, содержащие соединения-антагонисты уротензина II, такие как соединения согласно изобретению, находят свое применение в терапии для лечения и/или профилактики рвоты.
Эти лекарственные средства находят применение также в терапии для лечения некоторых видов рака.
Эти лекарственные средства находят применение также в терапии для лечения и/или профилактики астмы и легочных заболеваний.
Следует отметить, что соединения согласно изобретению, которые содержат группу R3, соответствующую сложноэфирной группе, после приема внутрь могут подвергаться ферментативному гидролизу с высвобождением соответствующей кислоты, и поэтому могут быть полезны в качестве пролекарств.
В соответствии с другим аспектом, изобретение относится к фармацевтическим композициям, содержащим в качестве действующего начала соединение согласно изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения согласно изобретению, или фармацевтически приемлемой соли указанного соединения, энантиомера, диастереоизомера или рацемической смеси этого соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
Указанные эксципиенты выбирают, в зависимости от фармацевтической формы и от желаемого пути введения, из обычных эксципиентов, которые известны специалисту.
В фармацевтических композициях согласно изобретению, предназначенных для введения пероральным, подъязычным, подкожным, трансдермальным, внутривенным, топическим, локальным, внутритрахеальным, внутриносовым, чрескожным или ректальным путем, активное начало формулы (I) или его соль, указанной выше, может вводиться в стандартной лекарственной форме в смеси с классическими вспомогательными веществами животным и людям для профилактики или лечения нарушений или заболеваний, указанных выше.
Соответствующие стандартные лекарственные формы включают формы для перорального введения, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и растворы или суспензии для приема внутрь, формы для подъязычного, защечного, внутритрахеального, внутриглазного, внутриносового введения, формы для ингаляций, формы для топического, чрескожного, подкожного, внутримышечного и внутривенного введения, формы для ректального введения или имплантаты. Для топического нанесения можно использовать соединения согласно изобретению в составе кремов, гелей, мазей или лосьонов.
В качестве примера стандартная лекарственная форма соединения согласно изобретению в виде таблетки может включать следующие компоненты:
|
Согласно другому аспекту, изобретение относится также к способу лечения указанных выше патологий, который включает введение пациенту эффективной дозы соединения согласно изобретению или одной из его фармацевтически приемлемых солей, или энантиомера, диастереоизомера или рацемической смеси этого соединения.