Результат интеллектуальной деятельности: КАРБОКСИЛ- ИЛИ ГИДРОКСИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА
Вид РИД
Изобретение
Настоящее изобретение относится к новым карбоксил- или гидроксилзамещенным производным бензимидазола, способу получения этих соединений, фармацевтическим составам, которые содержат такие соединения, а также к применению этих соединений для изготовления фармацевтических составов.
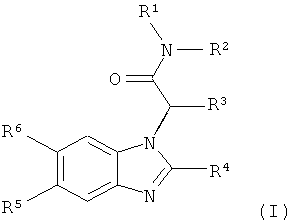
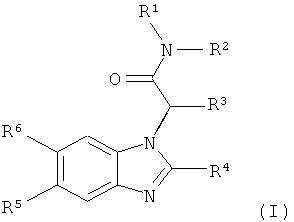
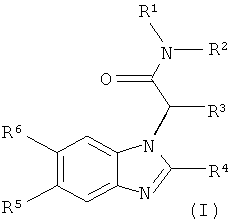
Более конкретно, настоящее изобретение относится к новым производным бензимидазола формулы (I): 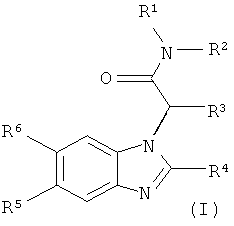
где
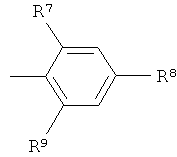
R1 выбран из
 ,
,  и
и 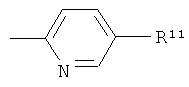
R2 представляет собой водород или низший алкил;
R3 представляет собой циклогексил или бицикло[2.2.1]гептил;
R4 представляет собой фенил, который замещен в 4-положении галогеном,
цианогруппой или фтор-низшим алкилом, или пиридил, который замещен 1 или 2 заместителями, независимо выбранными из галогена, аминогруппы, цианогруппы и низшей алкоксигруппы;
R5 и R6 независимо друг от друга представляют собой водород или фтор;
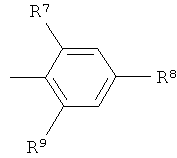
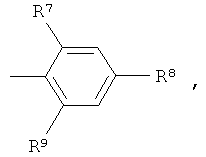
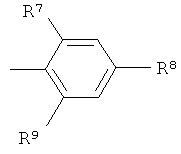
R7 и R9 независимо друг от друга выбраны из группы, состоящей из водорода, низшего алкила, галогена, низшей алкоксигруппы, фтор-низшего алкила, фтор-низшей алкоксигруппы и цианогруппы;
R8 представляет собой -(CR12R13)n-СООН, где n обозначает 0, 1 или 2, и R12 и R13 независимо друг от друга представляют собой водород или низший алкил, или R12 и R13 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо,
или -O-(CR14R15)p-COOH, где р обозначает 1 или 2, и R14 и R15 независимо друг от друга представляют собой водород или низший алкил, или R14 и R15 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо,
или R8 представляет собой тетразол;
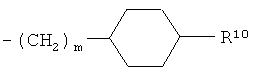
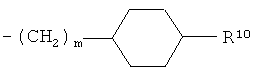
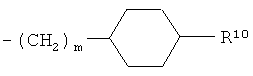
R10 представляет собой гидроксигруппу или -(СН2)р-СООН, где р обозначает 0, 1 или 2;
m обозначает 0 или 1;
R11 представляет собой -СООН;
и их фармацевтически приемлемым солям.
Соединения являются селективными модуляторами фарнезоидного-Х-рецептора.
Фарнезоидный-Х-рецептор (FXR) является членом семейства ядерного гормонального рецептора факторов транскрипции. FXR изначально идентифицирован как рецептор, активируемый фарнезолом, и последующие исследования выявили основную роль FXR в качестве рецептора желчной кислоты [статья Makishima, М., Okamoto, A.Y., Repa, J.J., Tu, H., Learned, R.M., Luk, A., Hull, M.V., Lustig, K. D., Mangelsdorf, D.J. и Shan, В., Science, 1999, 284, cc. 1362-5, Identification of a nuclear receptor for bile acids]. FXR экспрессируется в печени, кишечнике, почках и надпочечниках. Четыре срощенных изоформы были клонированы в человеке.
Среди основных желчных кислот ченодезоксихолиевая кислота является наиболее мощным агонистом FXR. Связывание желчных кислот или синтетических лигандов с FXR вызывает транскрипциональную экспрессию небольшого гетеродимерного партнера (SHP), члена семейства атипичного ядерного рецептора, который связывается с некоторыми другими рецепторами ядерного гормона, включая LRH-1 и LXR альфа и блоки их транскрипционных функций [статья Lu, Т.Т., Makishima, М., Repa, J.J., Schoonjans, К., Kerr, Т.A., Auwerx, J. и Mangelsdorf, D.J., Mol Cell, 2000, 6, cc. 507-15, Molecular basis for feedback regulation of bile acid synthesis by nuclear receptors.]. CYP7A1 и CYP8B являются ферментами, участвующими в синтезе желчной кислоты в печени. FXR подавляет их экспрессию активацией пути SHP. FXR непосредственно вызывает экспрессию переносчиков-экспортеров желчной кислоты для семейства ABC в гепатоцитах, включая экспортный насос соли желчной кислоты (ABCB11) и резистентность ко многим лекарственным препаратам, связывающим белок 2 (АВСС2) [статьи Kast, Н.R., Goodwin, В., Tarr, Р.Т., Jones, S.A., Anisfeld, А.М., Stoltz, С.М., Tontonoz, P., Kliewer, S., Willson, Т.М. и Edwards, P. A., J Biol Chem, 2002, 277, cc. 2908-15, Regulation of multidrug resistance-associated protein 2 (ABCC2) by the nuclear receptors pregnane X receptor, farnesoid X-activated receptor, and constitutive androstane receptor.; Ananthanarayanan, M., Balasubramanian, N., Makishima, M, Mangelsdorf, D.J. и Suchy, F.J., J Biol Chem, 2001, 276, cc. 28857-65, Human bile salt export pump promoter is transactivated by the farnesoid X receptor/bile acid receptor.]. Мыши с блокированным FXR имеют ослабленную резистентность к вызванной желчной кислотой гепатотоксичности, и синтетические агонисты FXR, как было показано, являются гепатопротекторными на животных моделях холестаза [статьи Liu, Y., Binz, J., Numerick, M.J., Dennis, S., Luo, G., Desai, В., MacKenzie, К.I., Mansfield, T.A., Kliewer, S.A., Goodwin, В. и Jones, S.A., J Clin Invest, 2003, 112, cc. 1678-87, Hepatoprotection by the farnesoid X receptor agonist GW4064 in rat models of intra-and extrahepatic cholestasis; Sinal, C.J., Tohkin, M., Miyata, M., Ward, J.M., Lambert, G. и Gonzalez, F.J., Cell, 2000, 102, cc. 731-44, Targeted disruption of the nuclear receptor FXR/BAR impairs bile acid and lipid homeostasis.]. Эти данные показывают, что FXR защищает гепатоциты от токсичности желчной кислоты подавлением как клеточного синтеза, так и импорта желчных кислот, и стимулируя их выведение печенью.
Процесс энтерогепатического циркулирования желчных кислот также является основным регулятором гомеостаза холестерина в сыворотке. После биосинтеза из холестерина в печени, желчные кислоты секретируются желчью в желчь в просвете малого кишечника с целью пищеварения и абсорбции жиров и жирорастворимых витаминов. Соотношение различных желчных кислот определяет гидрофильность общей желчной кислоты и ее способность растворять холестерин. Активация FXR повышает гидрофильность общей массы, понижая кишечную растворимость холестерина, эффективно блокируя его абсорбцию. Пониженная абсорбция, как ожидается, приводит к понижению уровней холестерина в плазме. Действительно, прямые ингибиторы абсорбции холестерина, такие как эзетимиб, снижают холестерин в плазме, обеспечивая некоторое доказательство в поддержку этой гипотезы. Однако, эзетимиб ограничен эффективностью, которая приводит к обратному сверхрегулированию синтеза холестерина в клетках, пытаясь компенсировать расщепление холестерина. Последние данные показали, что FXR останавливает это действие частично непосредственным подавлением экспрессии редуктазы HMGCoA путем с участием SHP и LRH1 [статья Datta, S., Wang, L., Moore, D.D. и Osborne, T.F., J Biol Chem, 2006, 281, cc. 807-12, Regulation of 3-hydroxy-3-methylglutaryl coenzyme A reductase promoter by nuclear receptors liver receptor homologue-1 and small heterodimer partner: a mechanism for differential regulation of cholesterol synthesis and uptake]. FXR также снижает синтез в печени триглицеридов путем подавления экспрессии SREBP1-c альтернативным путем, включающим SHP и LXRaльфa. Эти соединения, которые модулируют активность FXR, могут показывать превышающую терапевтическую активность в отношении понижения уровня холестерина и триглицеридов в плазме по сравнению с использующимися терапиями.
Большинство пациентов с заболеванием коронарной артерии имеют высокие уровни атерогенного ЛПНП в плазме. Ингибиторы HMGCoA редуктазы (статины) являются эффективными при нормализации уровней ЛПНП-С, но снижают риск сердечно-сосудистых заболеваний, таких как инсульт и инфаркт миокарда, только на 30%. Необходимы дополнительные терапии, нацеленные на другое снижение атерогенного ЛПНП, а также другие липидные факторы риска, такие как высокие уровни триглицерида в плазме и низкие уровни ЛПВП-С.
Высокая доля пациентов с диабетом 2 типа в США имеет нарушенные концентрации липопротеинов в плазме. Преобладание общего холестерина > 240 мг/дл присутствует у 37% мужчин с диабетом и у 44% у женщин с диабетом, и преобладание ЛПНП-С > 160 мг/дл составляет 31% и 44% соответственно для этих групп. Диабет представляет собой заболевание, при котором способность пациента контролировать уровни глюкозы в крови снижается из-за частичного ослабления отклика на инсулин. Диабет II типа (T2D), также называемый инсулиннезависимым сахарным диабетом (NIDDM), составляет 80-90% всех случаев диабета в развитых странах. При T2D панкреатические островки Лангерганса продуцируют инсулин, но первичные целевые ткани (мышцы, печень и жировая ткань) развивают сильную резистентность к его действиям. Организм компенсирует продуцированием еще большего количества инсулина, в конце концов приводя к неспособности продуцировать панкреатический инсулин. Так, T2D представляет собой сердечно-сосудистый-метаболический синдром, связанный с множеством сопутствующих заболеваний, включая дислипидемию и резистентность к инсулину, а также гипертензию, эндотелиальную дисфункцию и воспалительный атеросклероз.
Первая линия лечения дислипидемии и диабета заключается в низкожировой диете и диете с низким содержанием глюкозы, физические упражнения и снижение веса тела. Результаты могут быть умеренными, и становится необходимым лечение различных развивающихся метаболических дефицитов, например, липид-модулирующими агентами, такими как статины и фибраты, гликогликемическими лекарственными препаратами, такими как сульфонилмочевины и метформин, или веществами, усиливающими чувствительность к инсулину, класса тиазолидиндиона (TZD) PPARгамма-агонистов. Последние исследования обеспечивают доказательства того, что модуляторы FXR могут иметь повышенный терапевтический потенциал, обеспечивая отличную нормализацию уровней ЛПНП-С и триглицеридов, в настоящее время достигаемую только с помощью комбинаций существующих лекарственных препаратов, и, кроме того, могут устранять обратные действия при клеточном гомеостазе холестерина.
Новые соединения настоящего изобретения превосходят соединения, известные из предшествующего уровня техники, поскольку они связываются и селективно модулируют FXR очень эффективно. Следовательно, снижается абсорбция холестерина, понижаются уровни холестерина ЛПНП и триглицеридов, и снижается воспалительный атеросклероз. Поскольку множественные аспекты совместной дислипидемии и гомеостаза холестерина связаны с модуляторами FXR, они, как ожидается, имеют повышенный терапевтический потенциал по сравнению с соединениями, известными из предшествующего уровня техники.
Если не указано иное, следующие определения приведены для иллюстрации и определения значения и объема различных терминов, используемых для описания настоящего изобретения.
В этом описании термин "низший" используется для обозначения группы, состоящей из одного-семи, предпочтительно одного четырех атомов углерода.
Термин "галоген" обозначает фтор, хлор, бром и йод, где фтор, хлор и бром являются предпочтительными.
Термин "алкил", отдельно или в комбинации с другими группами обозначает разветвленный или линейный моновалентный насыщенный алифатический углеводородный радикал, содержащий от одного до двадцати атомов углерода, предпочтительно от одного до шестнадцати атомов углерода, более предпочтительно от одного до десяти атомов углерода. Термин "C1-10-алкил" обозначает разветвленный или линейный моновалентный насыщенный алифатический углеводородный радикал, содержащий от одного до десяти атомов углерода, такой как, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил, 1,1,3,3-тетраметилбутил и им подобные. Низшие алкильные группы, описанные далее, также являются предпочтительными алкильными группами.
Термин "низший алкил" или "С1-С7-алкил", отдельно или в комбинации с другими группами, обозначает разветвленный или линейный моновалентный алкильный радикал, содержащий от одного до семи атомов углерода, предпочтительно от одного до четырех атомов углерода. Этот термин представлен такими радикалами, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и им подобные. Низшие алкильные группы необязательно могут быть замещены, например, гидроксигруппой. Такие замещенные низшие алкильные группы обозначаются как "гидрокси-низший-алкил".
Термин "фтор-низший алкил" обозначает низшие алкильные группы, которые моно- или несколько раз замещены фтором. Примерами фтор-низших алкильных групп являются, например, -CFH2, -CF2H, -CF3, -CH2CF3, -(CH2)2CF3, -CH(CF3)2 и -CF2-CF2H.
Термин "амино", отдельно или в комбинации, обозначает первичную, вторичную или третичную аминогруппу, присоединенную через атом азота, где вторичная аминогруппа имеет алкильный или циклоалкильный заместитель, и третичная аминогруппа имеет два аналогичных или различных алкильных или циклоалкильных заместителя, или два заместителя азота вместе образуют кольцо, такое как, например, -NH2 метиламино, этиламино, диметиламино, диэтиламино, метилэтиламино, пирролидин-1-ил или пиперидино и т.д., предпочтительно первичная аминогруппа, диметиламиногруппа и диэтиламиногруппа, и особенно диметиламиногруппа.
Термин "циклоалкил" обозначает моновалентный углеводородный радикал, содержащий от 3 до 10 атомов углерода, предпочтительно от 3 до 7 атомов углерода, такой как циклопропил, циклобутил, циклопентил или циклогексил. Циклоалкиьная группа необязательно может быть замещена как описано в описании и формуле изобретения.
Термин "алкокси" обозначает группу -O-R', где R' представляет собой алкил. Термин "низшая алкоксигруппа" обозначает группу -O-R', где R' представляет собой низший алкил. Предпочтительным примером является метоксигруппа.
Термин "фтор-низшая алкоксигруппа" обозначает группу R"-O-, где R" представляет собой фтор-низший алкил. Примерами фтор-низших алкоксигрупп являются, например, -O-CFH2, -O-CF2H, -O-CF3, -O-CH2CF3, -O-(CH2)2CF3, -O-CH(CF3)2 и -O-CF2-CF2H.
Термин "защитная группа" обозначает группы, которые используются для защиты функциональных групп, особенно гидроксигрупп, временно. Примерами защитных групп являются бензил, п-метоксибензил, трет-бутилдиметилсилил, трет-бутилдифенилсилил и (для защиты аминогрупп) Вос и бензилоксикарбонил.
Соединения формулы (I) могут образовывать фармацевтически приемлемые кислотные аддитивные соли. Примерами таких фармацевтически приемлемых солей являются соли соединения формулы (I) с физиологически совместимыми минеральными кислотами, такими как хлористоводородная кислота, серная кислота, сернистая кислота или фосфорная кислота; или с органическими кислотами, такими как метансульфоновая кислота, п-толуолсульфоновая кислота, уксусная кислота, молочная кислота, трифторуксусная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, янтарная кислота или салициловая кислота. Термин "фармацевтически приемлемые соли" обозначает такие соли. Соединения формулы (I), в которых присутствует группа COOH, могут далее образовывать соли с основанием. Примерами таких солей являются соли с щелочным, щелочноземельным металлом и аммонием, такие как, например, соль Na-, K-, Ca- и триметиламмония. Термин "фармацевтически приемлемые соли" также относится к таким солям.
Более конкретно, настоящее изобретение относится к соединениям формулы (I):
где
R1 выбран из
 ,
,  и
и 
R2 представляет собой водород или низший алкил;
R3 представляет собой циклогексил или бицикло[2.2.1]гептил;
R4 представляет собой фенил, который замещен в 4-положении галогеном, цианогруппой или фтор-низшим алкилом, или пиридил, который замещен 1 или 2 заместителями, независимо выбранными из галогена, аминогруппы, цианогруппы и низшей алкоксигруппы;
R5 и R6 независимо друг от друга представляют собой водород или фтор;
R7 и R9 независимо друг от друга выбраны из группы, состоящей из водорода, низшего алкила, галогена, низшей алкоксигруппы, фтор-низшего алкила, фтор-низшей алкоксигруппы и цианогруппы;
R8 представляет собой -(CR12R13)n-COOH, где n обозначает 0, 1 или 2, и R12 и R13 независимо друг от друга представляют собой водород или низший алкил, или R12 и R13 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо, или -O-(CR14R15)p-COOH, где p обозначает 1 или 2, и R14 и R15 независимо друг от друга представляют собой водород или низший алкил, или R14 и R15 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо;
R10 представляет собой гидроксигруппу или -(СН2)р-СООН, где p обозначает 0, 1 или 2;
m обозначает 0 или 1;
R11 представляет собой -СООН;
и их фармацевтически приемлемым солям.
Соединения формулы (I) являются индивидуально предпочтительными, и их физиологически приемлемые соли являются индивидуально предпочтительными, где соединения формулы (I) являются особенно предпочтительными.
Соединения формулы (I) могут содержать один или несколько асимметричных С атомов, и, следовательно, могут существовать в виде энантиомерной смеси, диастереомерной смеси или в виде оптически чистых соединений.
В частности, предпочтительными соединениями являются соединения формулы (I), описанные в примерах как индивидуальные соединения, а также их фармацевтически приемлемые соли, а также оптически чистые соединения.
Предпочтительными являются соединения формулы (I), где
R8 представляет собой -(CR12 R13)n-СООН, где n обозначает 0, 1 или 2, и R12 и R13 независимо друг от друга представляют собой водород или низший алкил, или R12 и R13 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо,
или -O-(CR14 R15)p-COOH, где р обозначает 1 или 2, и R14 и R15 независимо друг от друга представляют собой водород или низший алкил, или R14 и R15 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо.
Предпочтительными далее являются соединения формулы (I) в соответствии с изобретением, где R2 представляет собой водород.
Особенно предпочтительными являются также соединения формулы (I) в соответствии с настоящим изобретением, где R3 представляет собой циклогексил.
Группой предпочтительных соединений формулы (I) является группа, где R4 представляет собой фенил, который замещен в 4-положении галогеном, цианогруппой или фтор-низшим алкилом, с более предпочтительными соединениями формулы (I), где R4 представляет собой 4-галогенфенил. Наиболее предпочтительно, R4 представляет собой 4-хлорфенил.
Другой группой предпочтительных соединений формулы (I) являются соединения, где R4 представляет собой пиридил, который замещен 1 или 2 заместителями, независимо выбранными из галогена, аминогруппы, цианогруппы и низшей алкоксигруппы. Наиболее предпочтительно, R4 представляет собой пиридин-3-ил, который замещен 1 или 2 заместителями, независимо выбранными из галогена, аминогруппы, цианогруппы и низшей алкоксигруппы. Наиболее предпочтительно, R4 представляет собой 6-хлорпиридин-3-ил или 2,6-диметоксипиридин-3-ил.
Предпочтительными далее являются соединения формулы (I) в соответствии с настоящим изобретением, где R5 и R6 представляют собой фтор.
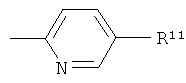
Группой предпочтительных соединений формулы (I) в соответствии с настоящим изобретением являются соединения, где R1 представляет собой
 ,
,
и где R7 и R9 независимо друг от друга выбраны из группы, состоящей из водорода, низшего алкила, галогена, низшей алкоксигруппы, фтор-низшего алкила, фтор-низшей алкоксигруппы и цианогруппы; и
R8 представляет собой -(CR12R13)n-COOH, где n обозначает 0, 1 или 2, и
R12 и R13 независимо друг от друга представляют собой водород или низший алкил, или R12 и R13 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо, или -O-(CR14R15)p-COOH, где р обозначает 1 или 2, и R14 и R15 независимо друг от друга представляют собой водород или низший алкил, или R14 и R15 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо.
Это обозначает, что эти соединения формулы (I) имеют формулу:
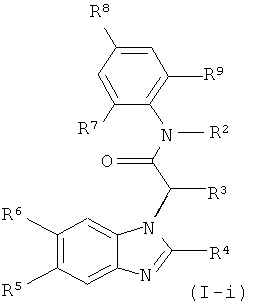
где R1-R9 являются такими, как определено выше.
Соединения формулы (I-i) являются особенно предпочтительными, где R8 представляет собой -(CR12R13)n-COOH, n обозначает 0, 1 или 2, и R12 и R13 независимо друг от друга представляют собой водород или низший алкил, или
R12 и R13 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо. Более предпочтительно, R8 представляет собой -СООН.
Также предпочтительными являются соединения формулы (I-i), где R8 представляет собой -O-(CR14R15)p-COOH, где р обозначает 1 или 2, и R14 и R15 независимо друг от друга представляют собой водород или низший алкил, или R14 и R15 вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо. Особенно предпочтительными являются соединения, где р обозначает 1. Особенно предпочтительными являются соединения, где R14 и R15 представляют собой метил, или где R14 и R15 вместе с атомом углерода, к которому они присоединены, образуют циклопропильное кольцо.
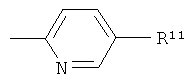
Другой группой предпочтительных соединений формулы (I) в соответствии с настоящим изобретением являются соединения, где R1 представляет собой группу:
 ,
,
и где R10 представляет собой гидрокси или -(СН2)р-СООН, где р обозначает 0, 1 или 2,
и m обозначает 0 или 1.
Это обозначает, что эти соединения формулы (I) имеют формулу:
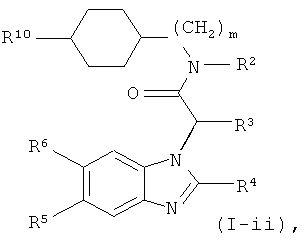
где R1-R6, R10 и m являются такими, как определено выше.
Предпочтительными являются соединения формулы (I-ii), где m обозначает 0.
Другими предпочтительными соединениями формулы (I-ii) в соответствии с настоящим изобретением являются соединения, где R10 представляет собой гидроксигруппу или -СООН. Особенно предпочтительными являются соединения, где R10 представляет собой гидроксигруппу.
Кроме того, соединения формулы (I) в соответствии с настоящим изобретением являются предпочтительными, где R1 представляет собой группу:
 .
.
Это обозначает, что эти соединения формулы (I) имеют формулу:
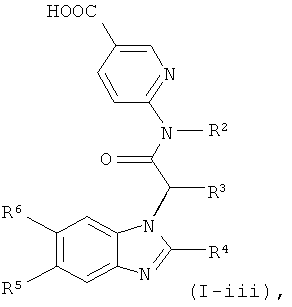
где R1-R6 являются такими, как определено выше.
Предпочтительные соединения формулы (I) выбраны из группы, состоящей из следующих соединений:
6-{2-[2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}никотиновая кислота,
3-хлор-4-{2-[2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
4-{2-[2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота,
4-{2-[2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойная кислота,
(-)-3-хлор-4-{2-[2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
(+)-3-хлор-4-{2-[2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
транс-4-{2-[2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексанкарбоновая кислота,
2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-N-(4-гидроксициклогексил)ацетамид,
(+)-2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-N-(транс-4-гидроксициклогексил)ацетамид,
транс-4-({циклогексил[2-(2,6-диметоксипиридин-3-ил)-5,6-дифтор-1Н-бензимидазол-1-ил]ацетил}амино)циклогексанкарбоновая кислота,
(+)-4-{2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота,
4-{2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}-3-метилбензойная кислота,
4-{2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}-3-фторбензойная кислота,
4-{2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5-фторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота,
(-)-4-{2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5-фторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота,
(-)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексанкарбоновая кислота,
(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексил)уксусная кислота,
(+)-[транс-4-({2-[2-(4-хлорфенил)-5,6-дифтор-1Н-бензимидазол-1-ил]-2-циклогексилацетил}амино)циклогексил]уксусная кислота,
4-{2-бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}бензойная кислота,
(-)-транс-4-[({-2-[2-(4-хлорфенил)-5-фтор-1Н-бензимидазол-1-ил]-2-циклогексилацетил}амино)метил]циклогексанкарбоновая кислота,
3-хлор-4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
(+)-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
(-)-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойная кислота,
(+)-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойная кислота,
(-)-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойная кислота,
3-хлор-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
(+)-3-хлор-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
(-)-3-хлор-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота,
(+)-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота,
(-)-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота,
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3,5-дифторбензойная кислота,
(+)-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3,5-дифторбензойная кислота,
(-)-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3,5-дифторбензойная кислота,
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-цианобензойная кислота,
3-хлор-4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
(+)-3-хлор-4-{-2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
(-)-3-хлор-4-{-2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метоксибензойная кислота,
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота,
4-{2-циклогексил-2-[5,6-дифтор-2-(4-трифторметилфенил)бензоимидазол-1-ил]ацетиламино}бензойная кислота,
4-{2-циклогексил-2-[5-фтор-2-(4-трифторметилфенил)бензоимидазол-1-ил]ацетиламино}бензойная кислота,
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметоксибензойная кислота,
4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино} бензойная кислота,
4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота,
(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}фенил)уксусная кислота,
2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовая кислота,
2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)-2-метилпропионовая кислота,
3-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}фенил)пропионовая кислота,
3-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовая кислота,
(-)-3-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовая кислота,
(+)-3-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовая кислота,
(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)уксусная кислота,
2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)пропионовая кислота,
2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовая кислота,
(+)-2-(4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовая кислота,
(-)-2-(4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовая кислота,
1-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота,
(+)-1-(4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота,
(-)-1-(4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота,
2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-транс-(4-гидроксициклогексил)ацетамид,
(-)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-(4-гидроксициклогексил)ацетамид,
(+)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-(4-гидроксициклогексил)ацетамид,
6-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино} никотиновая кислота
и их фармацевтически приемлемые соли.
Также предпочтительными являются соединения формулы (I), выбранные из следующих соединений:
(+)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-цианобензойная кислота,
(-)4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-цианобензойная кислота,
(+)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метоксибензойная кислота,
(-)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метоксибензойная кислота,
(+)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота,
(-)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота,
(+)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметоксибензойная кислота,
(-)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметоксибензойная кислота,
(-)-4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота,
(+)-4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота,
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-циано-5-фторбензойная кислота,
(+)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-циано-5-фторбензойная кислота,
(-)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-циано-5-фторбензойная кислота,
1-(4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота,
(+)-1-(4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота,
(-)-1-(4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота,
4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота,
(+)-4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота,
(-)-4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота,
4-{2-циклогексил-2-[5,6-дифтор-2-(6-метоксипиридин-3-ил)бензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота,
(-)-4-{2-[2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексанкарбоновая кислота,
(4-{2-[2-(6-хлор-2-метоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексил)уксусная кислота,
4-{2-[2-(6-хлор-2-метоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексанкарбоновая кислота,
4-{2-[2-(6-хлор-2-метоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
(+)-4-{2-циклогексил-2-[5,6-дифтор-2-(6-метоксипиридин-3-ил)бензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота,
(-)-4-{2-[2-(6-хлор-2-метоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексанкарбоновая кислота,
(-)-(4-{2-[2-(6-хлор-2-метоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексил)уксусная кислота,
(+)-4-{(S)-2-[2-(6-хлор-2-метоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
4-{2-бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}бензойная кислота,
(4-{2-циклогексил-2-[5,6-дифтор-2-(2-метоксипиридин-3-ил)бензоимидазол-1-ил]ацетиламино}циклогексил)уксусная кислота,
4-[2-циклогексил-2-(5,6-дифтор-2-п-толилбензоимидазол-1 -ил)ацетиламино]бензойная кислота,
4-[2-циклогексил-2-(5,6-дифтор-2-п-толилбензоимидазол-1-ил)ацетиламино]циклогексанкарбоновая кислота,
(-)-4-[2-циклогексил-2-(5,6-дифтор-2-п-толилбензоимидазол-1-ил)ацетиламино]бензойная кислота,
(+)-[2-циклогексил-2-(5,6-дифтор-2-п-толилбензоимидазол-1 -ил)ацетиламино]циклогексанкарбоновая кислота,
4-{2-бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота,
4-{2-циклогексил-2-[5,6-дифтор-2-(4-метоксифенил)бензоимидазол-1-ил]ацетиламино}бензойная кислота,
(-)-4-{2-бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота,
4-{2-циклогексил-2-[5,6-дифтор-2-(4-метоксифенил)бензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота,
(-)-4-{2-циклогексил-2-[5,6-дифтор-2-(4-метоксифенил)бензоимидазол-1-ил]ацетиламино}бензойная кислота,
(4-{2-бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексил)уксусная кислота,
(-)-4-{2-бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}бензойная кислота,
(-)-(4-{2-бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексил)уксусная кислота,
2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)фенил]ацетамид,
2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-N-[2-хлор-4-(1Н-тетразол-5-ил)фенил]-2-циклогексилацетамид,
2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[2-фтор-4-(1Н-тетразол-5-ил)фенил]ацетамид,
(+ или -)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[2-фтор-4-(1Н-тетразол-5-ил)фенил]ацетамид,
(+ или -)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[2-фтор-4-(1Н-тетразол-5-ил)фенил]ацетамид,
2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид,
(+)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид,
(-)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид,
2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид,
(+)-2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид,
(-)-2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид,
2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-N-[2-фтор-4-(1Н-тетразол-5-ил)фенил]ацетамид,
2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид
и их фармацевтически приемлемые соли.
Особенно предпочтительными соединениями формулы (I) являются соединения, выбранные из группы, состоящей из следующих соединений:
2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-N-(4-гидроксициклогексил)ацетамид,
(+)-2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-N-(транс-4-гидроксициклогексил)ацетамид,
(-)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-(4-гидроксициклогексил)ацетамид,
и их фармацевтически приемлемые соли.
Другими особенно предпочтительными соединениями формулы (I) являются соединения, выбранные из группы, состоящей из следующих соединений:
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота,
(-)-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино} бензойная кислота,
4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота,
(-)-4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота,
и их фармацевтически приемлемые соли.
Другими особенно предпочтительными соединениями формулы (I) являются соединения, выбранные из группы, состоящей из следующих соединений:
2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовая кислота,
(-)-2-(4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовая кислота,
1-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота,
(-)-1-(4-{-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота,
и их фармацевтически приемлемые соли.
Другими особенно предпочтительными соединениями формулы (I) являются соединения, выбранные из группы, состоящей из следующих соединений:
(-)4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-цианобензойная кислота,
(-)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота,
(-)-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-циано-5-фторбензойная кислота,
(-)-4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота,
и их фармацевтически приемлемые соли.
Другими особенно предпочтительными соединениями формулы (I) являются соединения, выбранные из группы, состоящей из следующих соединений:
(+или -)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-]-N-[2-фтор-4-(1Н-тетразол-5-ил)фенил]ацетамид,
(-)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид,
(-)-2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид,
и их фармацевтически приемлемые соли.
Следует понимать, что из соединений общей формулы (I) настоящего изобретения могут быть получены производные по функциональным группам с получением производных, которые способны превращаться в исходное соединение in vivo.
Настоящее изобретение также относится к способу получения соединений формулы (I) как описано выше, который включает циклизацию соединения формулы (II):

где R1, R2, R3, R4, R5 и R6 являются такими, как определено выше.
Циклизация соединения формулы (II) может осуществляться в реакционных условиях, хорошо известных из предшествующего уровня техники. Такие циклизации обычно могут осуществляться, например, в подходящем растворителе, таком как, например, дихлорметан, при подходящей температуре в присутствии подходящего реагента, такого как свободный PPh3 или PPh3 на смоле.
Настоящее изобретение также относится к альтернативному способу получения соединений формулы (I) как описано выше, который включает амидную конденсацию кислоты формулы (III):
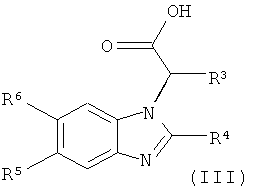
где R3, R4, R5 и R6 являются такими, как определено выше, с амином формулы (IV):
R1-NH2 (IV)
где R1 является таким, как определено выше.
Амидная конденсация соединения формулы (III) может осуществляться в реакционных условиях, хорошо известных специалисту в данной области техники. Такая конденсация обычно может осуществляться, например, в подходящем растворителе, таком как N,N-диметилформамид (ДМФА) или диоксан, при подходящей температуре в присутствии подходящего конденсирующего реагента, такого как N,N'-карбонилдиимидазол (CDI), N,N'-дициклогексилкарбодиимид (ДЦК), гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI), гексафторфосфат 1-[бис(диметиламино)метилен]-1Н-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (HATU), 1-гидрокси-1,2,3-бензотриазол (НОВТ) или тетрафторборат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (TBTU).
Настоящее изобретение также относится к соединениям формулы (I), как определено выше, полученным описанным выше способом.
Соединения формулы (I) могут быть получены способами, известными из предшествующего уровня техники, или как описано далее. Если не указано иное, заместители R1-R8 являются такими, как определено выше.
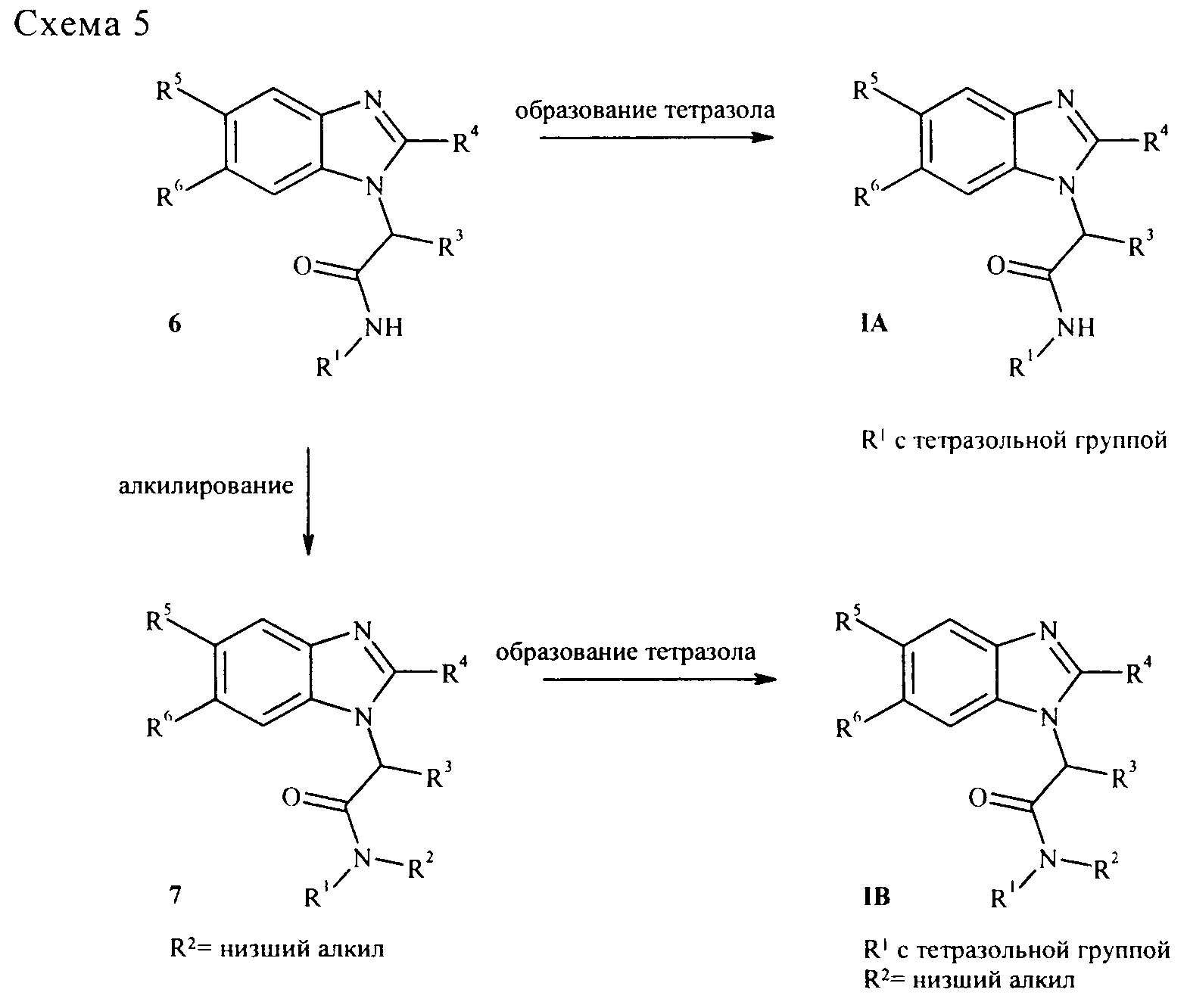
Соединения формулы (I) в соответствии с настоящим изобретением могут быть получены, например, способами и методиками, приведенными далее. Типичная методика получения соединений формулы (I) показана ниже на схеме 1.
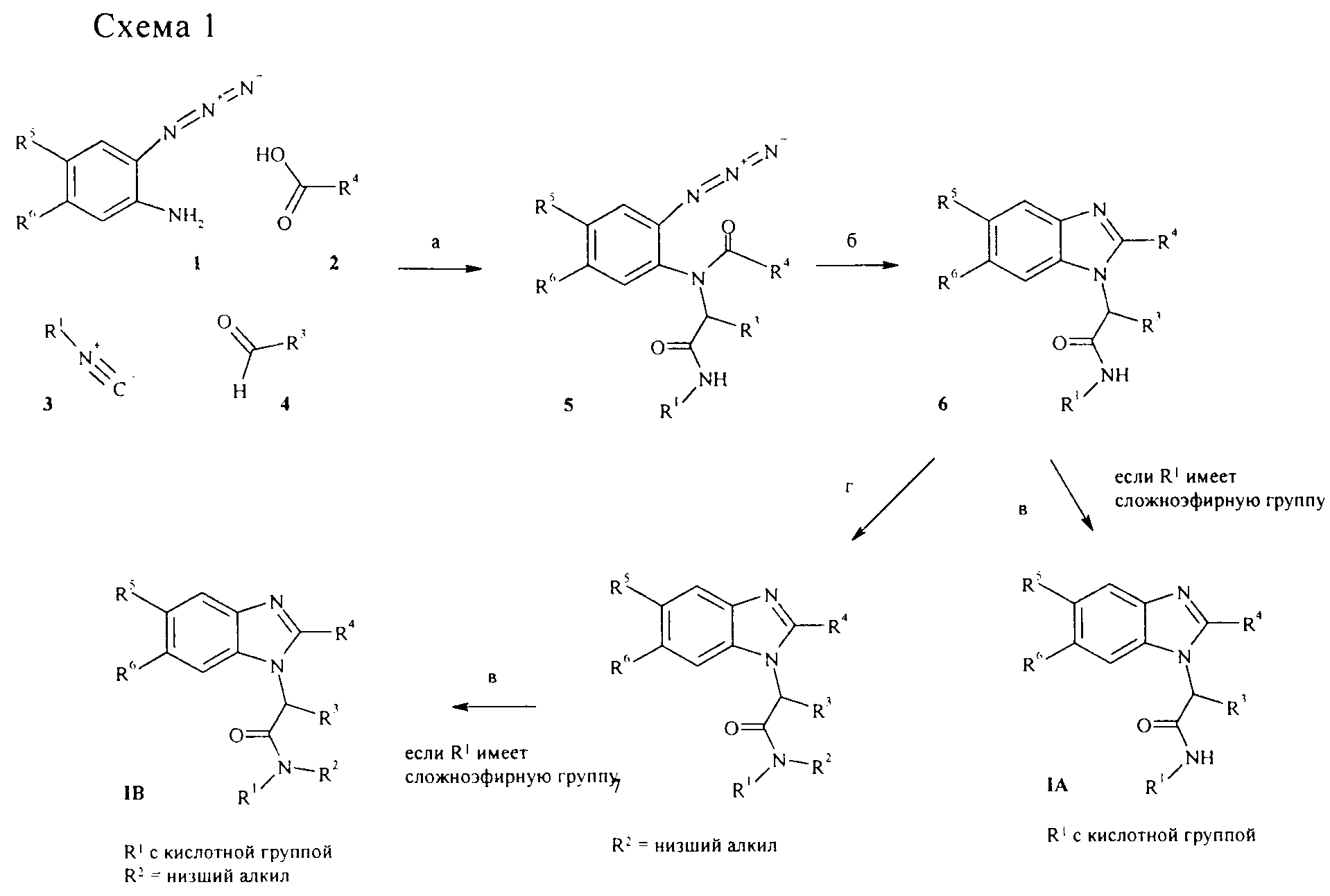
В подходящем органическом растворителе, таком как, например, МеОН, 2-азидоариламин 1, карбоновую кислоту 2, изонитрил 3 и альдегид 4 конденсируют с получением соединения 5 так называемой реакцией Ugi-типа (стадия а, стандартная методика может быть обнаружена, например, в книге "The Peptides" by Gross & Meienhofer, T. 2, Academic Press, N.Y., 1980, cc. 365-381). В последующей внутримолекулярной реакции типа Штаудингера с подходящим реагентом, таким как, например, PPh3, азидобисамид 5 превращают в бензимидазол 6. В тех случаях, когда заместитель R1 имеет сложноэфирную группу, сложноэфирная группа может отщепляться в основных (например, метиловый или этиловый эфиры гидроксидом лития в полярных растворителях, таким как, например, метанол, вода или ТГФ, или смесях указанных растворителей) или в кислых условиях (например, трет-бутиловый эфир, используя концентрированную хлористоводородную кислоту в ТГФ или муравьиную кислоту в метаноле) с получением конечных соединений IA (стадия в). Необязательно бензимидазол 6 может быть N-алкилирован депротонированием с помощью сильного основания (например, NaH или LiHMDA) и последующей обработкой алкилирующим агентом R2-X, где X является стандартной уходящей группой, такой как, например, Cl, Br, I, SO2алкил, SO2фторалкил, SО2арил (стадия г). В полученном соединении 7, как и для производных 6, сложноэфирная группа может отщепляться, как описано выше на стадии в. Многие из строительных блоков 2-4, в частности карбоновая кислота 2, являются коммерчески доступными. Если нет, они могут быть получены из коммерчески доступных исходных материалов методиками, описанными в уровне техники, и обычно известными специалисту в данной области техники. Изонитрил 3, например, может быть получен дегидратацией соответствующего формамида R1-N-CHO с помощью подходящего реагента, такого как, например, фосген, POCl3 или Me2N=CH+ClCl-. Альдегид 4, например, может быть получен из соответствующего спирта окислением подходящим окислителем, таким как, например, тетрапропиламмонийперрутенат (VII). 2-Азидоариламин 1 обычно получают в три стадии из соответствующей 2-аминоарилкарбоновой кислоты, которую превращают в 2-азидоарилкарбоновую кислоту окислением NaNO2 в подходящем растворителе (например, метаноле) и последующей обработкой подходящей азидной солью, такой как NaN3. Полученную 2-азидоарилкарбоновую кислоту затем превращают в соединение 1 перегруппировкой Курциуса 2-азидоарилкарбонового азида, полученного из 2-азидоарилкарбоновой кислоты ее активацией подходящим реагентом (например, хлорэтилформиатом в присутствии основания, такого как триэтиламин) и последующей обработкой подходящим источником азидных анионов (например, азид натрия). 2-Азидоариламин 1 альтернативно может быть получен через 2-азидоарилкарбоксамид, полученный активацией 2-азидоарилкарбоновой кислоты подходящим реагентом (например, хлорэтилформиатом в присутствии основания, такого как триэтиламин) и последующей обработкой аммиаком. Этот амид превращают в соединение 1 так называемой перегруппировкой Хофмана обработкой подходящим реагентом, таким как NaOBr.
Если один из исходных материалов или соединений формулы (I) содержит одну или несколько функциональных групп, которые не являются стабильными или являются реакционноспособными в условиях реакции одной или нескольких реакционных стадий, подходящие защитные группы (как описано, например, в книге "Protective Groups in Organic Chemistry", T.W. Greene и P.G.M. Wutts, 2-oe издание, 1991, Wiley N.Y.) могут быть введены перед необходимой стадией, используя методы, хорошо известные из предшествующего уровня техники. Такие защитные группы могут быть удалены на последующей стадии синтеза, используя стандартные методы, описанные в уровне техники.
Если соединения (1), (2), (3) или (4) содержат стереогенные центры, соединения (I) могут быть получены в виде смесей диастереомеров или энантиомеров, которые могут быть разделены методами, хорошо известными из предшествующего уровня техники, например, (хиральная) ВЭЖХ или кристаллизация. Рацемические соединения, например, могут быть разделены на их антиподы через диастереомерные соли кристаллизацией с оптически чистыми кислотами, или разделением антиподов специфическими хроматографическими методами, используя хиральные адсорбенты или хиральный элюент.
Альтернативный подход для получения соединений формулы I показан ниже на схеме.
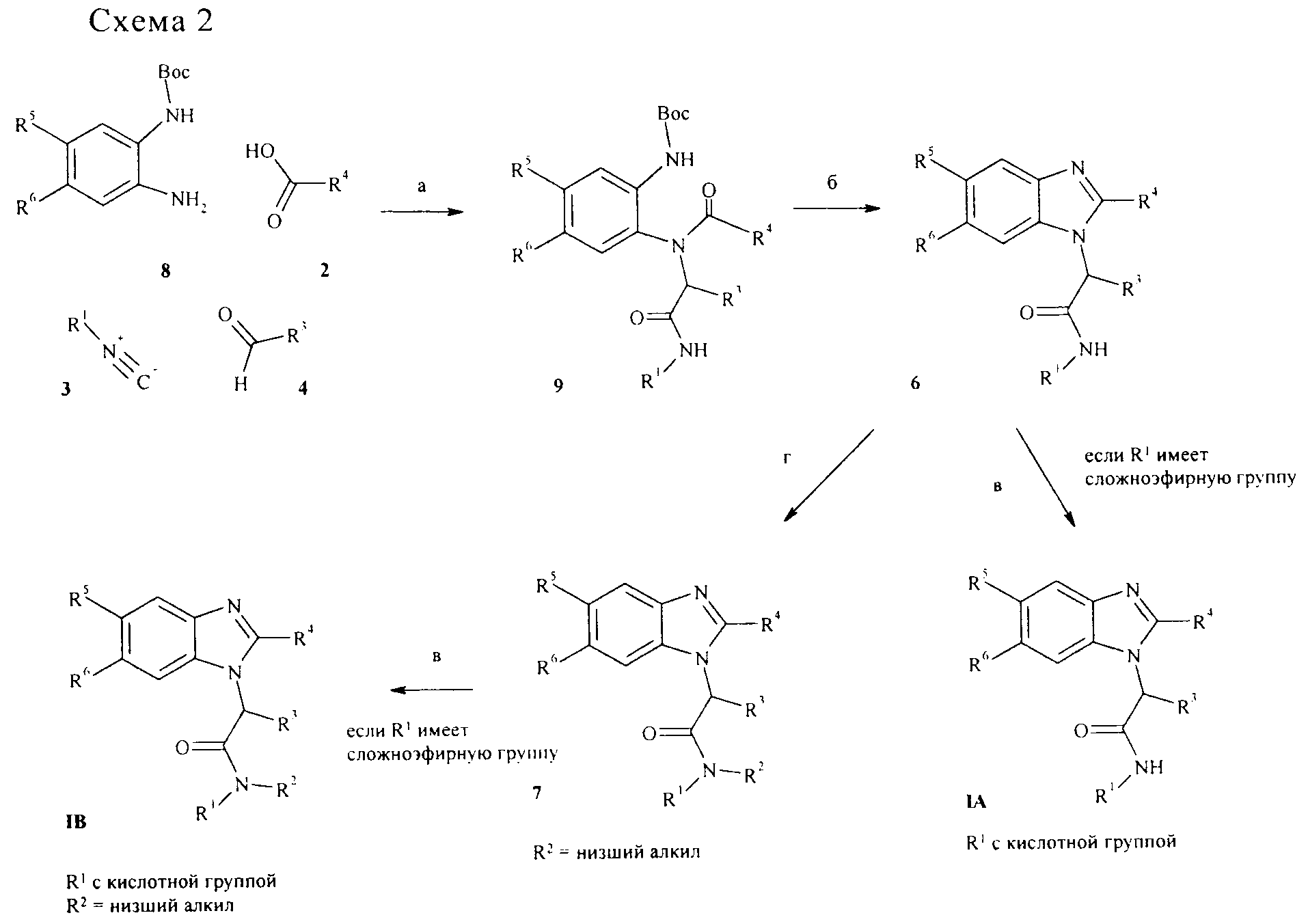
Соединения общей формулы I также могут быть получены, как описано на схеме 2. В этом подходе моно-boc-защищенный орто-арилендиамин 8, карбоновую кислоту 2, изонитрил 3 и альдегид 4 конденсируют в органическом растворителе, таком как, например, метанол в присутствии кислоты (такой как, например, HCl) до бисамида 9 снова конденсацией типа Ugi (стадия а). С бисамида 9 снимают защитные группы с помощью ТФУК и циклизуют до целевого бензимидазола 6 (стадия б). Когда промежуточное соединение 9 имеет сложноэфирную группу, она может отщепляться, как описано на схеме 1, с получением соединений формулы IA. Необязательно, промежуточное соединение 9 может быть N-алкилировано как описано выше (стадия в) с получением промежуточных соединений 7, которые, в свою очередь, могут быть превращены в соединения формулы IB в условиях, описанных на схеме 1. Стандартные методики, подходящие для этого подхода, описаны, например, в статьях Tempest и др., Tet. Lett., 2001, 42, cc. 4959 - 4962 и cc. 4963-4968, или Zhang и др., Tet. Lett., 2004, 45, cc. 6757-6760. Моно-boc-защищенные орто-арилендиамины 1 являются коммерчески доступными или могут быть получены из соответствующего незащищенного диамина обработкой ди-трет-бутилдикарбонатом в органическом растворителе, таком как, например, ТГФ в присутствии основания, такого как, например, диизопропилэтиламин.
Если нужные или необходимые функциональные группы, присутствующие в соединении I (такие как -СO2алкил, аминогруппы, цианогруппы и другие), могут образовывать производные с другими функциональными группами, используя обычные стандартные методики, известные специалисту в данной области техники (например, восстановление -СO2алкила до -СН2ОН с помощью LiAlH4, гидролиз -СO2алкила до CO2H и последующее необязательное превращение в амид, ацилирование аминогрупп).
Если один из исходных материалов или соединений формулы (I) содержит одну или несколько функциональных групп, которые не являются стабильными или являются реакционноспособными в условиях реакции одной или нескольких реакционных стадий, подходящие защитные группы (как описано, например, в книге "Protective Groups in Organic Chemistry", T.W. Greene и P.G.M. Wutts, 2-oe издание, 1991, Wiley N.Y.) могут быть введены перед необходимой стадией, используя методы, хорошо известные из предшествующего уровня техники. Такие защитные группы могут быть удалены на последующей стадии синтеза, используя стандартные методы, описанные в уровне техники.
Если соединения (2), (3), (4), (6), (7) или (9) содержат стереогенные центры, соединения (I) могут быть получены в виде смесей диастереомеров или энантиомеров, которые могут быть разделены методами, хорошо известными из предшествующего уровня техники, например, (хиральная) ВЭЖХ или кристаллизация. Рацемические соединения, например, могут быть разделены на их антиподы через диастереомерные соли кристаллизацией с оптически чистыми кислотами, или разделением антиподов специфическими хроматографическими методами, используя хиральные адсорбенты или хиральный элюент.
R1, присутствующий в соединении (I), после стадий а и 6 или стадий а, 6 и в в описанных выше схемах может быть превращен или замещен другим R1, используя одну стадию или последовательность реакционных стадий. Два возможных примера приведены далее:
a) R1=CH2Ph, например, может быть удален, используя условия дебензилирования (например, гидролиз в растворителе, таком как метанол, в присутствии катализатора, такого как Pd(0) на угле), и новый R1 может быть введен, например депротонированием полученного CONHR2 с помощью сильного основания (например, LiHMDA) и обработкой алкилирующим агентом R1-X (X представляет собой обычную уходящую группу, такую как, например, Cl, Br, I, SO2aлкил, SO2фторалкил, SO2арил, и R1 представляет собой С1-10-алкил, низкий-алкокси-низший-алкил, низший-алкокси-карбонил-низший-алкил, циклоалкил, циклоалкил-низший-алкил, арил-низший-алкил, диарил-низший-алкил, гетероарил-низший-алкил или гетероциклил-низший-алкил), или альтернативно Pd(II)-промотируемой конденсацией с помощью R1-X(R1 представляет собой арил или гетероарил, и X представляет собой Cl, Br, I или OSO2CF3).
б) Амидолиз -CR3CON R1 R2 - группы соединения (I) в -CR3COOH может осуществляться, используя подходящие условия, такие как нагревание в изопропаноле в присутствии NaOH или LiOH. Новая амидная связь затем может быть образована, используя амин HNR1R2 и обычный пептидконденсирующий реагент, такой как, например, EDCI, ДЦК или TPTU.
Функциональные группы, присутствующие в (I) или любых промежуточных соединениях, которые не являются стабильными или являются реакционноспособными в реакционных условиях одной или нескольких реакционных стадий, могут быть защищены подходящими защитными группами (как описано, например, в книге "Protective Groups in Organic Chemistry", T.W.Greene и P.G.M. Wutts, 2-oe издание, 1991, Wiley N.Y.), перед необходимой стадией, используя методы, хорошо известные из предшествующего уровня техники. Такие защитные группы могут быть удалены на последующей стадии синтеза, используя стандартные методы, описанные в уровне техники.
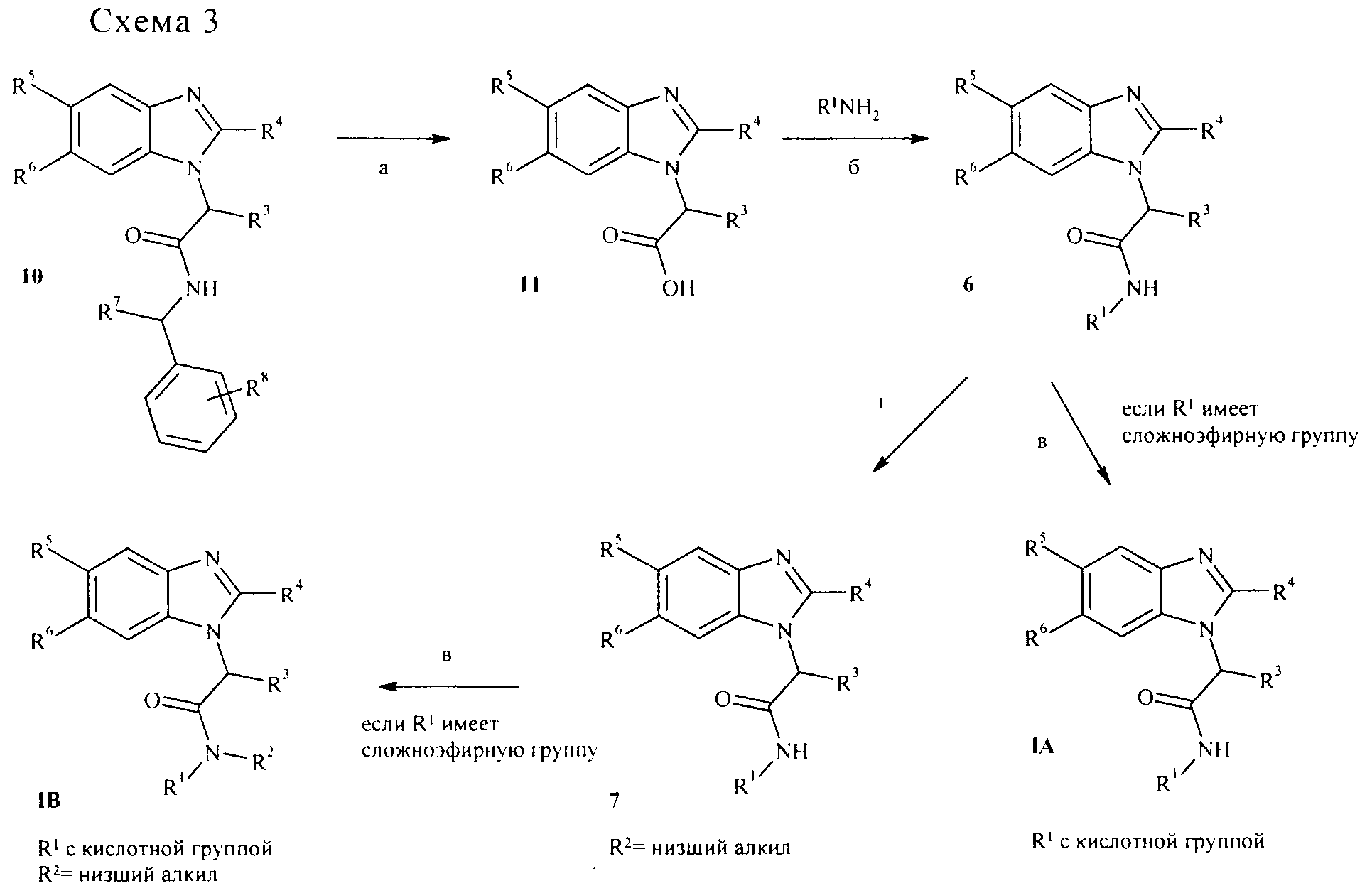
Альтернативным способом амидолиза Ugi реакционных продуктов является обработка бензимидазолов, таких как соединение 10, нитритом натрия в смеси уксусной кислоты и ангидрида уксусной кислоты с получением промежуточного соединения продукта реакции диазотирования, который после перегруппировки может быть расщеплен в реакции смесью гидроксидов щелочного металла (например, LiOH, NaOH, КОН) и перекиси водорода в соответствующие свободные карбоновые кислоты 11 (схема 3, стадия а; см. статьи: Е.Н.White, J.Am.Chem. Soc, 1955, 77, cc. 6011-6014, D.A: Evans, P.H.Carter, C.J.Dinsmore, J.C.Barrow, J.L.Katz, D.W.Kung, Tetrahedron Lett., 1997, 38, cc. 4535-4538). Реакция амидного расщепления является более широкой в отношении природы амида, который может использоваться, и не ограничена только бензиламидами. Использование хиральных кислот в стадии реакции Ugi приводит к образованию диастереоизомеров, которые могут быть разделены стандартной хроматографией на обычном кремниевом эфире на стадии амида 10 или свободной кислоты 11. Альтернативно, хиральные кислоты 11 могут быть разделены стандартными методами, известными специалисту в данной области техники, такими как кристаллизация с хиральными аминами или хиральная хроматография.
Другой подход получения соединений формулы I приведен ниже на схеме 4.
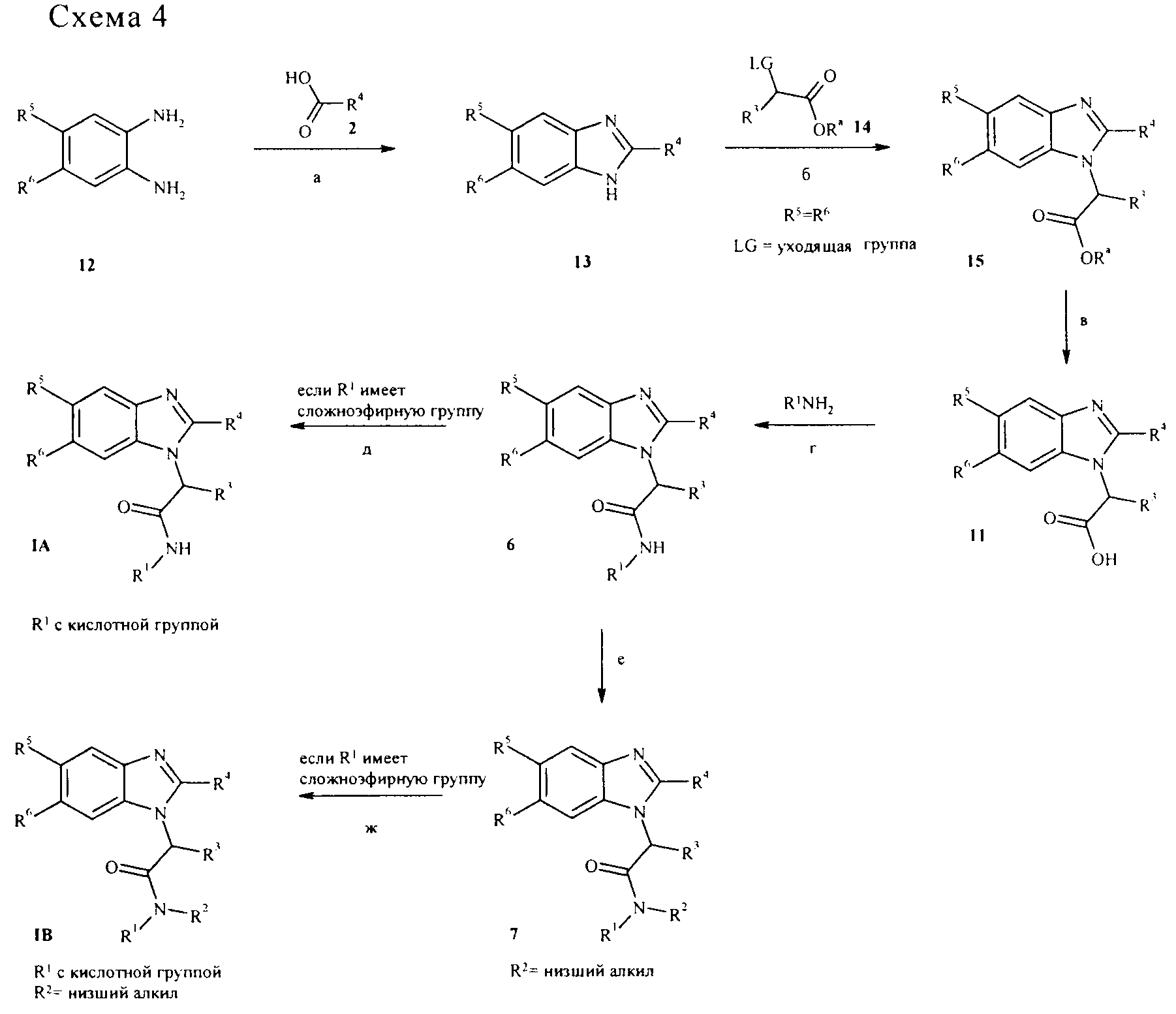
Соединения общей формулы IA и IB также могут быть получены в соответствии со схемой 4. Бензимидазолы общей структуры 13 (коммерчески доступные или полученные, например, реакцией подходящим образом замещенного фенилендиамина 12 с арилкарбоновой кислотой 2, стадия а) могут быть алкилированы, например, с помощью сложного эфира 2-бром (или другая уходящая группа, такая как, например, ОSO2алкил, ОSO2фторалкил, ОSO2арил)алкилуксусной кислоты 14 в подходящем растворителе, таком как, например, N,N'-диметилформамид и подходящем основании, таком как, например, карбонат цезия, с получением промежуточного соединения 12 (R9 представляет собой алкильную группу, такую как, например, метил, этил или трет-бутил). Отщепление сложноэфирной группы, используя условия, описанные в схеме 1, приводит к получению кислотных промежуточных соединений 15. Амидная конденсация промежуточных соединений 11c необязательно замещенными циклоалкил/ариламинами (коммерчески доступные или полученные способами, описанными в ссылках, или способами, известными из предшествующего уровня техники) приводит к получению соединений 6 (стадия г). Амидные конденсации этого типа широко описаны в предшествующем уровне техники (например, книга Comprehensive Organic Transformations: А Guide to Functional Groups Preparations, 2-ое издание, Richard C. Larock. John Wiley & Sons, New York, NY., 1999) и могут осуществляться с помощью конденсирующих реагентов, таких как, например, N,N-карбонилдиимидазол (CDI), 1-гидрокси-1,2,3-бензотриазол (НОВТ) или тетрафторборат О-бензотриазол-1-ил-N,N,N,N-тетраметилурония (TBTU) в подходящем растворителе, таком как, например, N,N-диметилформамид (ДМФА) или диоксан, необязательно в присутствии основания (например, триэтиламин, диизопропилэтиламин или 4-(диметиламино)пиридин). Альтернативно, промежуточные соединения 6 могут быть получены превращением промежуточных соединений 11 в их хлорангидриды кислот обработкой, например, тионилхлоридом, необязательно в растворителе, таком как, например, дихлорметан, и реакцией хлорангидрида кислоты с необязательно замещенными циклоалкил/ариламинами в подходящем растворителе, таком как, например, дихлорметан и в присутствии основания, такого как, например, триэтиламин, пиридин, диизопропилэтиламин или 4-(диметиламино)пиридин. Превращение промежуточных соединений 6 в соединения общей формулы IA и IB может осуществляться, как описано на приведенных выше схемах.
Специалисту в данной области техники известно, что тетразолы могут быть получены различными стандартными методиками. Например, органические нитрилы могут реагировать с азидом натрия и хлоридом аммония или хлоридом триалкил- или тетраалкил-аммония в подходящем растворителе, таком как, например, ДМФА, ДМСО, N-метилпирролидин или толуол, с получением тетразолов. Альтернативно, органические азиды, такие как азиды оловоорганических соединений, кремнийорганических соединений, борорганических соединений и алюмоорганических соединений, такие как, например, триалкилолово- или триметилсилазиды, в подходящем растворителе, таком как, например, толуол, могут подвергаться реакции с нитрилами с образованием тетразолов. Для некоторых из этих реакций могут потребоваться повышенные температуры, такие как, например, температура кипения растворителя. Другой способ получения тетразолов включает реакцию алкил или арилнитрила с азидом натрия в присутствии кислоты Льюиса, такой как, например, трифторид бора или бромид цинка, в растворителях, таких как дихлорметан, N,N-диметилформамид или вода, при температуре от 0°C до температуры кипения растворителя.
Предпочтительный способ получения тетразолов включает реакцию производного с нитрильной группы формулы 6 и 7 (полученного, как описано на схемах 1-4) с азидом натрия и солью триалкиламмония, такой как, например, гидрохлорид триэтиламмония, в подходящем растворителе, таком как, например, ксилол, при повышенных температурах, предпочтительно при температуре кипения растворителя. (Didier: я не знаю, нужен ли специфический предпочтительный способ (это способ, который мы используем до сих пор). Если нет, я предлагаю опустить его, поскольку другой способ может быть лучшим/более подходящим, особенно в отношении технического процесса и производства).
Если соединения формулы 6 или 7 содержат стереогенные центры, соединения (I) могут быть получены в виде смесей диастереомеров или энантиомеров, которые могут быть разделены методами, хорошо известными из предшествующего уровня техники, например, (хиральная) ВЭЖХ или кристаллизация. Рацемические соединения, например, могут быть разделены на их антиподы через диастереомерные соли кристаллизацией с оптически чистыми кислотами, или разделением антиподов специфическими хроматографическими методами, используя хиральные адсорбенты или хиральный элюент. Стадия образования тетразола может осуществляться на хиральных или ахиральных бензимидазолах типа 6 или 7.
Функциональные группы, присутствующие в соединении (I) или любых промежуточных соединениях, которые не являются стабильными или являются реакционноспособными в реакционных условиях одной или нескольких реакционных стадий, могут быть защищены подходящими защитными группами (как описано, например, в книге "Protective Groups in Organic Chemistry", T.W. Greene и P.G.M. Wutts, 2-oe издание, 1991, Wiley N.Y.), перед необходимой стадией, используя методы, хорошо известные из предшествующего уровня техники. Такие защитные группы могут быть удалены на последующей стадии синтеза, используя стандартные методы, описанные в уровне техники.
Несмотря на то, что их получение не описано в примерах, соединения формулы (I), а также все промежуточные продукты могут быть получены в соответствии с аналогичными методами или в соответствии с методами, описанными выше. Исходные материалы являются коммерчески доступными или являются известными из предшествующего уровня техники.
Как описано выше, было обнаружено, что новые соединения настоящего изобретения связываются и селективно активируют FXR. Следовательно, они могут использоваться для лечения или профилактики заболеваний и состояний, которые модулируются агонистами FXR. "Заболевания (и состояния), которые модулируются агонистами FXR", включают повышенные уровни липидов и холестерина, особенно высокий уровень ЛПНП-холестерина, высокий уровень триглицеридов, низкий уровень ЛПВП-холестерина, дислипидемию, атеросклероз, диабет, особенно инсулиннезависимый сахарный диабет, метаболический синдром, заболевание холестеринового желчного камня, холестаз/фиброз печени, заболевания, связанные с абсорбцией холестерина, рак, особенно желудочно-кишечный рак, остеопороз, периферийное окклюзионное заболевание, ишемический инсульт, болезнь Паркинсона и болезнь Альцгеймера. Предпочтительными заболеваниями (и состояниями), которые модулируются агонистами FXR, являются профилактика или лечения высоких уровней ЛПНП-холестерина, высокого уровня триглицеридов, дислипидемии, заболевание холестеринового желчного камня, рака, инсулиннезависимого сахарного диабета и метаболического синдрома. Особенно предпочтительными заболеваниями, которые модулируются агонистами FXR, являются высокий уровень ЛПНП-холестерина, высокий уровень триглицеридов и дислипидемия.
Настоящее изобретение, следовательно, также относится к фармацевтическим композициям, включающим соединение как определено выше и фармацевтически приемлемый носитель и/или адъювант
Настоящее изобретение также включает соединения как описано выше для применения в качестве терапевтически активных веществ, особенно в качестве терапевтически активных веществ, предназначенных для лечения или профилактики заболеваний, которые модулируются агонистами FXR, особенно в качестве терапевтически активных веществ для лечения или профилактики повышенных уровней липидов и холестерина, высокого уровня ЛПНП-холестерина, высокого уровня триглицеридов, низкого уровня ЛПВП-холестерина, дислипидемии, атеросклероза, диабета, особенно инсулиннезависимого сахарного диабета, метаболического синдрома, заболевания холестеринового желчного камня, холестаза/фиброза печени, заболеваний, связанных с абсорбцией холестерина, рака, желудочно-кишечного рака, остеопороза, периферийного окклюзионного заболевания, ишемического инсульта, болезни Паркинсона и/или болезни Альцгеймера.
В другом предпочтительном варианте осуществления настоящее изобретение относится к способу терапевтического или профилактического лечения заболеваний, которые модулируются агонистами FXR, особенно терапевтического или профилактического лечения повышенных уровней липидов и холестерина, высокого уровня ЛПНП-холестерина, высокого уровня триглицеридов, низкого уровня ЛПВП-холестерина, дислипидемии, атеросклероза, диабета, особенно инсулиннезависимого сахарного диабета, метаболического синдрома, заболевания холестеринового желчного камня, холестаза/фиброза печени, заболеваний, связанных с абсорбцией холестерина, рака, желудочно-кишечного рака, остеопороза, периферийного окклюзионного заболевания, ишемического инсульта, болезни Паркинсона и болезни Альцгеймера, который включает введение соединения как определено выше человеку или животному.
Настоящее изобретение также включает применение соединений, как определено выше для терапевтического или профилактического лечения заболеваний, которые модулируются агонистами FXR, особенно для терапевтического или профилактического лечения повышенных уровней липидов и холестерина, высокого уровня ЛПНП-холестерина, высокого уровня триглицеридов, низкого уровня ЛПВП-холестерина, дислипидемии, атеросклероза, диабета, особенно инсулиннезависимого сахарного диабета, метаболического синдрома, заболевания холестеринового желчного камня, холестаза/фиброза печени, заболеваний, связанных с абсорбцией холестерина, рака, желудочно-кишечного рака, остеопороза, периферийного окклюзионного заболевания, ишемического инсульта, болезни Паркинсона и болезни Альцгеймера.
Настоящее изобретение также относится к применению соединений, как описано выше для приготовления лекарственных средств, предназначенных для терапевтического или профилактического лечения заболеваний, которые модулируются агонистами FXR, особенно для терапевтического или профилактического лечения повышенных уровней липидов и холестерина, высокого уровня ЛПНП-холестерина, высокого уровня триглицеридов, низкого уровня ЛПВП-холестерина, дислипидемии, атеросклероза, диабета, особенно инсулиннезависимого сахарного диабета, метаболического синдрома, заболевания холестеринового желчного камня, холестаза/фиброза печени, заболеваний, связанных с абсорбцией холестерина, рака, желудочно-кишечного рака, остеопороза, периферийного окклюзионного заболевания, ишемического инсульта, болезни Паркинсона и болезни Альцгеймера. Такие лекарственные средства включают соединение, как описано выше.
Следующие тесты осуществляли для определения активности соединений формулы (I). Уровень техники по анализам связывания может быть обнаружен в статье: Nichols JS и др., Anal. Biochem, 1998, 257, cc. 112-119, "Development of а scintillation proximity assay for peroxisome proliferator-activated receptor gamma ligand binding domain".
Векторы экспрессии бактерий и млекопитающих конструировали для получения глутатион-s-трансферазы (GST) и белков ДНК-связывающего домена Gal4 (GAL), слитых с лиганд-связывающим доменом (LBD) человека FXR (аминокислоты 193-473). Для этого часть последовательностей, кодирующих FXR LBD, амплифицировали полимеразной цепной реакцией (PCR) из полноцепочечного клона с помощью PCR, и затем субклонировали в плазмидные векторы. Финальный клон верифицировали анализом последовательности ДНК.
Индуцирование, экспрессию и последующую очистку слитого белка GST-LBD осуществляли в клетках штамма Е. coli BL21(pLysS) стандартными методами (книга Current Protocols in Molecular Biology, Wiley Press, под ред. Ausubel и др.).
Анализ связывания с радиолигандом
Связывание тестируемых веществ с лиганд-связывающим доменом FXR оценивали в радиолигандном анализе замещения. Анализ осуществляли в буфере, состоящем из 50 мМ Hepes, pH 7,4, 10 мМ NaCl, 5 мМ MgCl2. Для каждой реакционной лунки в 96-луночной планшете 40 нМ GST-FXR слитого белка LBD связывали с 10 мкг гранул глутатион-силикат иттрия SPA (PharmaciaAmersham) в конечном объеме 50 мкл при перемешивании. Добавляли радиолиганд (например, 40 нМ) 2,N-дициклогексил-2-[2-(2,4-диметоксифенил)бензоимидазол-1-ил]ацетамид), и реакционную смесь инкубировали при КТ в течение 30 минут в присутствии тестируемых соединений с последующей обработкой сцинтилляционным счетчиком. Все анализы на связывание осуществляли в 96-луночных планшетах, и количество связанного лиганда измеряли на Packard TopCount с помощью OptiPlates (Packard). Кривые зависимости от дозы строили в диапазоне концентраций от 6×10-9 М до 2,5×10-5 М.
Анализы с лициферазным транскрипционным репортерным геном
Клетки почек молодых хомячков (ВНК21 АТСС CCL10) выращивали в среде DMEM, содержащей 10% FBS, при 37°C в атмосфере 95% O2:5% CO2. Клетки высаживали в 6-луночные планшеты с плотностью 105 клеток/лунка, и затем трансфецировали с помощью pFA-FXR-LBD или экспрессионной плазмиды плюс репортерная плазмида. Трансфекцию осуществляли с помощью реагента Fugene 6 (Roche Molecular Biochemicals) в соответствии с предлагаемой инструкцией. Через шесть часов после трансфекции, клетки собирали трипсинизацией и помещали в 96-луночные планшеты с плотностью 104 клеток/лунка. Через 24 часа слияния клеток среду удаляли и замещали 100 мкл среды, не содержащей фенола красного, содержащей тестируемые вещества или контрольные лиганды (конечная концентрация ДМСО: 0,1%). После инкубирования клеток в течение 24 часов с веществами, 50 мкл супернатанта отделяли, и затем добавляли 50 мкл реагента Luciferase Constant-Light (Roche Molecular Biochemicals) для лизиса клеток и инициирования люциферазной реакции. Люминесценцию, как меру люциферазной активности, определяли на Packard TopCount. Транскрипционную активацию в присутствии тестируемого вещества выражали как кратное изменение люминесценции по сравнению с люминесценцией клеток, инкубированных в отсутствии вещества. Значения ЕС50 рассчитывали, используя программу XLfit (ID Business Solutions Ltd. UK).
Соединения в соответствии с формулой (I) имеют активность по крайней мере в одном из описанных выше анализов (ЕС50 или IC50), предпочтительно в диапазоне от 0,5 нМ до 10 мкМ, более предпочтительно от 0,5 нМ до 100 нМ.
Например, следующие соединения показывают следующие значения IC50 в описанном выше анализе связывания:
|
|
|
|
|
Соединения формулы (I) и их фармацевтически приемлемые соли могут использоваться в качестве лекарственных средств, например, в форме фармацевтических препаратов для энтерального, парентерального или местного введения. Они могут вводиться, например, перорально, например, в форме таблеток, покрытых оболочкой таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например, в форме суппозиториев, парентерально, например, в форме инъекционных растворов или суспензий, или инфузионных растворов, или местно, например, в форме мазей, кремов или масел. Пероральное введение является предпочтительным.
Получение фармацевтических препаратов может осуществляться способом, известным любому специалисту в данной области техники, путем введения описанных соединений формулы (I) и их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически активными веществами, в форму для галенового введения вместе с подходящими, нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими материалами носителя и при необходимости, обычными фармацевтическими адъювантами.
Подходящими материалами носителя являются не только неорганические материалы носителя, но также органические материалы носителя. Так, например, лактоза, кукурузный крахмал или их производные, тальк, стеариновая кислота или ее соли могут использоваться в качестве материалов носителя для таблеток, покрытых оболочкой таблеток, драже и твердых желатиновых капсул. Подходящими материалами носителя для мягких желатиновых капсул являются, например, растительные масла, воски, жиры и полутвердые и жидкие полиолы (в зависимости от природы активного ингредиента носители могут не использоваться, однако, для мягких желатиновых капсул). Подходящими материалами носителя для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар и им подобные. Подходящими материалами носителя для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Подходящими материалами носителя для суппозиториев являются, например, природные или отвержденные масла, воски, жиры и полужидкие или жидкие полиолы. Подходящими материалами носителя для местных составов являются глицериды, полусинтетические и синтетические глицериды, гидрированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стеролы, полиэтиленгликоли и производные целлюлозы.
Обычные стабилизаторы, консерванты, увлажняющие и эмульгирующие агенты, улучшающие консистенцию агенты, отдушки, соли для регулирования осмотического давления, буферные вещества, солюбилизаторы, красители и маскирующие агенты и антиоксиданты рассматриваются в качестве фармацевтических адъювантов.
Дозировка соединений формулы (I) может варьироваться в широких пределах в зависимости от контролируемого заболевания, возраста и индивидуального состояния пациента и способа введения, и конечно, определяется для конкретных целей в каждом конкретном случае. Для взрослых пациентов рассматривается суточная дозировка от около 1 до 1000 мг, особенно от 1 до 300 мг. В зависимости от степени тяжести заболевания и точного фармакокинетического профиля соединение может вводиться в одной или нескольких суточных дозированных единицах, например, в 1-3 дозированных единицах.
Фармацевтические препараты обычно содержат около 1-500 мг, предпочтительно 1-100 мг соединения формулы (I).
Следующие примеры служат для более подробной иллюстрации настоящего изобретения. Они, однако, никоим образом не должны ограничивать его объем.
Примеры
Сокращения:
ДХМ = дихлорметан, DIPEA=N,N'-диизопропилэтиламин, ДМФА = диметилформамид, HATU = гексафторфосфат 2-(7-аза-1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония, HCl = хлорид водорода, ВЭЖХ=высокоэффективная жидкостная хроматография, LiOH = гидроксид лития, MPLC = жидкостная хроматография среднего давления, NaHCO3 = гидрокарбонат натрия, КТ=комнатная температура, SiO2 = силикагель.
Общие замечания
Реакции осуществляли в атмосфере азота или аргона, как подходит.
Пример 1
3-Хлор-4-{2-[2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Указанное в заголовке соединение получали нагреванием [2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (200 мг, 0,46 ммоля) в 5 мл тионилхлорида до 80°C в течение 4 ч. Растворитель упаривали, и остаток переносили в дихлорметан. Добавляли метиловый эфир 4-амино-3-хлорбензойной кислоты (85 мг, 0,46 ммоля), и реакционную смесь перемешивали при КТ в течение ночи. Сырой продукт обрабатывали добавлением раствора 1М NaHCO3 и экстракцией водного слоя дихлорметаном. Органические слои объединяли, сушили MgSO4 и упаривали досуха. Остаток переносили в метанол (3 мл) и добавляли 1N NaOH (1 мл). Смесь перемешивали при КТ в течение ночи, растворитель упаривали, и продукт выделяли препаративной ВЭЖХ. MS (ES+): 560 (М+Н).
Промежуточные соединения
а) [2-(6-Хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусная кислота
К раствору трет-бутилового эфира (2-амино-4,5-дифторфенил)карбаминовой кислоты (1,0 г, 4,1 ммоля) в метаноле (15 мл) добавляли циклогексанкарбальдегид (0,82 мл, 6,14 ммоля, 1,5 эквив.), 6-хлорникотиновую кислоту (0,665 г, 4,1 ммоля, 1,0 эквив.) и изоцианометилбензол (0,48 мл, 10,24 ммоля, 1,0 эквив.) и перемешивали при КТ в течение 16 ч. Добавляли раствор 4М HCl в диоксане (10 мл), и реакционную смесь перемешивали при КТ в течение 3 ч. Раствор концентрировали упариванием при пониженном давлении, значение рН доводили до 9 добавлением раствора 1М NaHCO3, и водный слой экстрагировали этилацетатом. Объединенные органические фазы сушили MgSO4 и концентрировали упариванием при пониженном давлении. Сырой материал растворяли в смеси уксусного ангидрида (40 мл) и уксусной кислоты (20 мл), и охлаждали до 0°C. Порциями добавляли нитрит натрия (7,4 г, 107 ммолей). После добавления реакционную смесь нагревали до КТ и перемешивали в течение 3 ч. Раствор концентрировали упариванием при пониженном давлении, значение рН доводили до 9 добавлением раствора 1М NaHCO3, и водный слой экстрагировали этилацетатом. Полученное коричневое масло переносили в смесь ТГФ: вода (3:1, 20 мл), и по каплям добавляли предварительно полученный раствор LiOH (2,1 г, 48,7 ммоля) в перекиси водорода (10 мл, 30% раствор в воде). Смесь перемешивали при КТ в течение 30 мин. Раствор концентрировали упариванием при пониженном давлении, значение рН доводили до 4 добавлением уксусной кислоты, и водный слой экстрагировали этилацетатом. Промежуточное соединение далее не очищали, а использовали как сырой материал для дальнейшей модификации. MS (ES"): 404 (М-Н).
б) трет-Бутиловый эфир (2-амино-4,5-дифторфенил)карбаминовой кислоты
4,5-Дифтор-2-нитрофениламин (6,0 г, 34 ммоля, 1 эквив.) добавляли к раствору ди-трет-бутилдикарбоната (14,8 г, 68 ммолей, 2 эквив.) и ДМАП (211 мг, 0,2 ммоля, 0,05 в ТГФ (100 мл), и смесь перемешивали при комнатной температуре в течение 72 часов. Растворитель упаривали, и сырой продукт экстрагировали из этилацетата и водн. NaHCO3. Остаток переносили в ДХМ и охлаждали до 0°C. Медленно добавляли трифторуксусную кислоту (7,75 г, 68 ммолей, 2 эквив.), и смесь перемешивали в течение 48 ч при 0°C. Добавляли 2N NaOH для доведения значения pH до 7. Органический слой отделяли и упаривали. Остаток переносили в этилацетат, и продукт экстрагировали из водн. раствора NaHCO3. Промежуточное соединение выделяли хроматографией на кизельгеле. 4,28 г (16 ммолей, 1 эквив.) растворяли в ДМФА (50 мл) и добавляли 13 мл насыщенного раствора NH4Cl. Добавляли порошок цинка (5,1 г, 78 ммолей, 5 эквив.), и суспензию перемешивали в течение 30 минут при 80°C и еще 2 часа при комнатной температуре. Оставшееся твердое вещество отфильтровывали, и органический слой упаривали. Продукт экстрагировали из этилацетата и водн. раствора NaHCO3, и затем очищали хроматографией на кизельгеле.
Пример 2
6-{2-[2-(6-Хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино)никотиновая кислота
Указанное в заголовке соединение получали аналогично примеру 1, заменяя метиловый эфир 4-амино-3-метилбензойной кислоты на метиловый эфир 6-аминоникотиновой кислоты. MS (ES+): 527 (М+Н).
Пример 3
4-{2-[2-(6-Хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}3-фторбензойная кислота
Указанное в заголовке соединение получали аналогично примеру 1, заменяя метиловый эфир 4-амино-3-хлорбензойной кислоты на метиловый эфир 4-амино-3-фторбензойной кислоты. MS (ES):544 (М+Н).
Пример 4
4-{2-[2-(6-Хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойная кислота
Указанное в заголовке соединение получали аналогично примеру 1, заменяя метиловый эфир 4-амино-3-фторбензойной кислоты на метиловый эфир 4-амино-3-метилбензойной кислоты. MS (ES+):540 (М+Н).
Пример 5
(-)-3-Хлор-4-{2-[2-(6-хлорпиридин-3-ил]-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Указанное в заголовке соединение получали аналогично примеру 1, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ. MS (ES+):560 (М+Н).
Пример 6
(+)-3-Хлор-4-{(2-[2-(6-хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Указанное в заголовке соединение получали аналогично примеру 1, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ. MS (ES):560 (М+Н).
Промежуточное соединение
Метиловый эфир транс-4-изоцианоциклогексанкарбоновой кислоты
Гидрохлорид метилового эфира транс-4-аминоциклогексанкарбоновой кислоты (2 г, 10,3 ммоля) растворяли в смеси ДМФА (10 мл) и DIPEA (2 мл). Добавляли этилформиат (5 мл, 62 ммоля), и смесь нагревали при 75°C в течение ночи. Растворитель упаривали, и сырой продукт экстрагировали этилацетатом. Получали коричневое масло. MS (ES+):186 (М+Н). Сырой материал растворяли в дихлорметане (15 мл). Добавляли триэтиламин (1,5 мл), и реакционную смесь охлаждали до 0°C. Трифосген (470 мг, 1,6 ммоля) растворяли в дихлорметане (4 мл), и добавляли по каплям к реакционной смеси. Смесь нагревали до КТ и перемешивали в течение 1 ч. Продукт выделяли непосредственно хроматографией на кизельгеле, используя этилацетат в качестве элюента. Промежуточное соединение использовали без дополнительной характеризации.
Пример 7
транс-4-{2-[2-(6-Хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексанкарбоновая кислота
К раствору трет-бутилового эфира (2-амино-4,5-дифторфенил)карбаминовой кислоты (0,2 г, 0,82 ммоля) в метаноле (4 мл) добавляли циклогексанкарбальдегид (0,16 мл, 1,22 ммоля, 1,5 эквив.), 6-хлорникотиновую кислоту (0,13 г, 0,82 ммоля, 1,0 эквив.) и метиловый эфир транс-4-изоцианоциклогексанкарбоновой кислоты (0,137 мг, 0,82 ммоля, 1,0 эквив.), и перемешивали при КТ в течение 16 ч. Добавляли раствор 4М HCl в диоксане (4 мл), и реакционную смесь перемешивали при КТ в течение 3 ч. Раствор концентрировали упариванием при пониженном давлении, значение рН доводили до 9 добавлением 1М раствора NaHCO3, и водный слой экстрагировали этилацетатом. Объединенные органические фазы сушили MgSO4 и концентрировали упариванием при пониженном давлении. Сырой материал растворяли в метаноле (15 мл), и добавляли NaOH (5 мл) и ДМФА (1 мл), и смесь нагревали при 50°C в течение ночи. Значение рН доводили до 4. Появлялось светло-коричневое твердое вещество, которое затем очищали препаративной ВЭЖХ. MS (ES+):532 (М+Н).
Пример 8
2-Циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-N-(транс-4-гидроксициклогексил)ацетамид
К раствору циклогексил-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]уксусной кислоты (300 мг, 0,70 ммоля, 1,0 эквив.) в ДХМ (5 мл) добавляли триэтиламин (142,1 мг, 194,7 мкл, 1,39 ммоля, 2,0 эквив.) и HATU (341,6 мг, 0,90 ммоля, 1,3 эквив.), и смесь перемешивали при 40°C. Через 15 мин добавляли гидрохлорид транс-4-аминоциклогексанола (137,04 мг, 0,90 ммоля, 1,3 эквив.; [CAS RN 50910-54-8]), и перемешивание продолжали при 50°C в течение 2 ч. Удаление смеси растворителей при пониженном давлении и очистка хроматографией на колонке с силикагелем с помощью системы MPLC (CombiFlash Companion, Isco Inc.), элюируя градиентом гептан/этилацетат, приводили к получению 0,33 г (90%) указанного в заголовке соединения. MS (ES+):529 (М+Н).
Промежуточные соединения
а) N-Бензил-2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетамид
К раствору трет-бутилового эфира (2-амино-4,5-дифторфенил)карбаминовой кислоты (2,50 г, 10,24 ммоля, 1,0 эквив.; пример 1, промежуточное соединение б) в метаноле (30 мл) добавляли циклогексанкарбальдегид (1,15 г, 1,23 мл, 10,24 ммоля, 1,0 эквив.; [2043-61-0]), и смесь перемешивали при КТ. Через 30 мин добавляли 2,6-диметоксиникотиновую кислоту (1,88 г, 10,24 ммоля, 1,0 эквив.; [CAS RN 16727-43-8]) и изоцианометилбензол (1,20 г, 1,25 мл, 10,24 ммоля, 1,0 эквив.; [931-53-3]), и перемешивание продолжали при КТ в течение 2 ч. Добавляли раствор 4М HCl в диоксане (20 мл), и реакционную смесь перемешивали при КТ в течение ночи. Раствор концентрировали упариванием при пониженном давлении, значение рН доводили до 9 добавлением 1М раствора NaHCO3, и водный слой экстрагировали дихлорметаном. Объединенные органические фазы сушили MgSO4 и концентрировали упариванием при пониженном давлении. Сырой материал очищали колоночной хроматографией на силикагеле, используя систему MPLC (CombiFlash Companion, Isco Inc.), элюируя градиентом гептан/этилацетат с получением 3,57 г (60%) указанного в заголовке соединения. MS (ES+):522 (М+Н).
б) Циклогексил-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]уксусная кислота
К раствору N-бензил-2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетамида (3,50 г, 6,72 ммоля, 1,0 эквив.) в смеси уксусной кислоты (25 мл) и ангидрида уксусной кислоты (50 мл) добавляли при 0°C несколькими небольшими порциями нитрит натрия (10,20 г, 147,91 ммоля, 22,0 эквив.) в течение 1 ч. Реакционную смесь перемешивали в течение ночи, оставляя нагреваться до КТ. Раствор концентрировали упариванием при пониженном давлении, значение рН доводили до 9 добавлением 1М раствора NaHCO3, и водный слой экстрагировали диэтиловым эфиром. Объединенные органические фазы сушили MgSO4 и концентрировали упариванием при пониженном давлении. Сырой материал переносили в смесь ТГФ: вода (3:1, 40 мл), и добавляли предварительно полученный раствор LiOH (1,61 г, 67,23 ммоля, 10,0 эквив.) в перекиси водорода (15,24 г, 13,73 мл, 134,46 ммоля, 20,0 эквив.; 30% раствор в воде), и перемешивали при КТ в течение 30 мин. Раствор концентрировали упариванием при пониженном давлении, значение рН доводили до 4 добавлением 1М раствора HCl, и водный слой экстрагировали диэтиловым эфиром. Объединенные органические фазы сушили MgSO4 и концентрировали упариванием при пониженном давлении. Очистка колоночной хроматографией на силикагеле, используя систему MPLC (CombiFlash Companion, Isco Inc.), элюируя градиентом дихлорметан/метанол, приводила к получению 1,67 г (57%) указанного в заголовке соединения. MS (ES+):432 (М+Н).
Пример 9
(+)-2-Циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-N-(транс-4-гидроксициклогексил)ацетамид
Указанное в заголовке соединение получали в соответствии с примером 8, проводя разделение стереоизомеров с помощью хиральной препаративной ВЭЖХ (Chiralpak-AD колонка), элюируя градиентом этанол/гептан. MS (ES+):530 (М+Н).
Пример 10
транс-4-{2-Циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота
К раствору этилового эфира 4-{2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновой кислоты (350 мг, 0,60 ммоля, 1,0 эквив.) в смеси ацетонитрил/вода (2:1,5 мл) добавляли 6М водный раствор NaOH (0,3 мл, 1,80 ммоля, 3,0 эквив.), и реакционную смесь нагревали при микроволновом излучении до 100°C в течение 30 мин. Растворитель удаляли при пониженном давлении, и сырую реакционную смесь доводили до рН=3 добавлением раствора 1М HCl, и водный слой экстрагировали смесью дихлорметан/изопропанол (4:1). Объединенные органические фазы сушили MgSO4, концентрировали упариванием при пониженном давлении, и сырой материал очищали короткой колонкой с силикагелем, элюируя градиентом дихлорметан/метанол, получая 0,31 г (93%) указанного в заголовке соединения. MS (ES+):558 (М+Н).
Промежуточное соединение
Этиловый эфир 4-{2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5.6-дифторбензоимидазол-1-ил]ацетиламино)циклогексанкарбоновой кислоты
Указанное в заголовке соединение получали аналогично примеру 8, заменяя гидрохлорид транс-4-аминоциклогексанола на этиловый эфир транс-4-аминоциклогексанкарбоновой кислоты ([CAS RN 1678-68-8]). MS (ES+):585 (М+Н).
Пример 11
(+)-транс-4-{2-Циклогексил-2-[2-(2.6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали в соответствии с примером 10, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Chiralpak-AD колонка), элюируя градиентом этанол (+0,5% муравьиная кислота)/гептан. MS (ES+):557 (М+Н).
Пример 12
4-{2-Циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}-3-метилбензойная кислота
Указанное в заголовке соединение получали аналогично примеру 10 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):566 (М+Н).
Промежуточное соединение
Метиловый эфир 4-{2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}-3-метилбензойной кислоты
Указанное в заголовке соединение получали аналогично примеру 8, заменяя гидрохлорид транс-4-аминоциклогексанола на метиловый эфир 4-амино-3-метилбензойной кислоты ([CAS RN 18595-14-7]). MS (ES+):579 (М+Н).
Пример 13
4-{2-Циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}-3-фторбензойная кислота
Указанное в заголовке соединение получали аналогично примеру 10 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):569 (М+Н).
Промежуточное соединение
Этиловый эфир 4-{2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5.6-дифторбензоимидазол-1-ил]ацетиламино}-3-фторбензойной кислоты
Указанное в заголовке соединение получали аналогично примеру 8, заменяя гидрохлорид транс-4-аминоциклогексанола на этиловый эфир 4-амино-3-фторбензойной кислоты ([CAS RN 73792-12-8]). MS (ES+):597 (М+Н).
Пример 14
транс-4-{2-Циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5-фторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали аналогично примеру 10 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):540 (М+Н).
Промежуточное соединения
а) N-Бензил-2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5-фторбензоимидазол-1-ил]ацетамид
Указанное в заголовке соединение получали аналогично примеру 8, промежуточное соединение а, заменяя трет-бутиловый эфир (2-амино-4,5-дифторфенил)карбаминовой кислоты (пример 1, промежуточное соединение б) на трет-бутиловый эфир (2-амино-5-фторфенил)карбаминовой кислоты (полученный, как описано в статье М.J. Bamford, М.J. Alberti, N. Bailey, S. Davies, D.К. Dean, A. Gaiba, S. Garland, J.D. Hading, D.K. Jung, T.A. Panchal, C.A. Parr, J.G. Steadman, A.K. Takle, J.T. Townsend, D.M. Wilson, J. Witherington, Bioorg. Med. Chem. Lett., 2005, 15, cc.3402-3406). MS (ES+):504 (M+H).
б) Циклогексил-[2-(2,6-диметоксипиридин-3-ил)-5-фторбензоимидазол-1-ил]уксусная кислота
Указанное в заголовке соединение получали аналогично примеру 8, промежуточное соединение б. MS (ES+):415 (М+Н).
в) Этиламид 4-{2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5-фторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновой кислоты
Указанное в заголовке соединение получали аналогично примеру 8, заменяя гидрохлорид транс-4-аминоциклогексанола на этиловый эфир транс-4-аминоциклогексанкарбоновой кислоты ([CAS RN 1678-68-8]). MS (ES+):568 (М+Н).
Пример 15
(-)-транс-4-{2-Циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5-фторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали аналогично примеру 14, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Chiralpak-AD колонка), элюируя градиентом изопропанол (+0,5% муравьиной кислоты)/гептан. MS (ES+):540 (М+Н).
Пример 16
(-)-транс-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали аналогично примеру 8, заменяя циклогексил-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]уксусную кислоту на [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусную кислоту (пример 22, промежуточное соединение в), и гидрохлорид транс-4-аминоциклогексанола на этиловый эфир транс-А- аминоциклогексанкарбоновой кислоты ([CAS RN 1678-68-8]), после эфирного гидролиза аналогично примеру 10. Очистку проводили хиральной препаративной ВЭЖХ (Chiralpak-AD колонка), элюируя градиентом этанол (+0,5% муравьиной кислоты)/гептан. MS (ES+):530 (М+Н).
Пример 17
(транс-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексил)уксусная кислота
Указанное в заголовке соединение получали аналогично примеру 10 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):544 (М+Н).
Промежуточное соединение
Этиловый эфир (4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино} циклогексил)уксусной кислоты
Указанное в заголовке соединение получали аналогично примеру 8, заменяя циклогексил-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]уксусную кислоту на [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусную кислоту (пример 22, промежуточное соединение в), и гидрохлорид транс-4-аминоциклогексанола на гидрохлорид этилового эфира транс-(4-аминоциклогексил)уксусной кислоты ([CAS RN 76308-26-4]). MS (ES+): 572 (М+Н).
Пример 18
(+)-транс-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексил)уксусная кислота
Указанное в заголовке соединение получали в соответствии с примером 17, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Chiralcel-ODH колонка), элюируя градиентом изопропанола (+0,5% трифторуксусной кислоты)/гептан. MS (ES+):544 (М+Н).
Пример 19
4-{2-Бицикло[2,2.1[гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}бензойная кислота
Указанное в заголовке соединение получали аналогично примеру 10 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):536 (М+Н).
Промежуточное соединение
Метиловый эфир 4-{2-бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}бензойной кислоты
Указанное в заголовке соединение получали аналогично примеру 8, промежуточное соединение а, заменяя циклогексанкарбальдегид на бицикло[2.2.1]гептан-7-карбальдегид ([CAS RN 53291-20-6]), 2,6-диметоксиникотиновую кислоту на 4-хлорбензойную кислоту ([CAS RN 74-11-3]), и изоцианометилбензол на метиловый эфир 4-изоцианобензойной кислоты ([CAS RN 198476-21-0]) после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):550 (М+Н).
Пример 20
(-)-транс-4-({2-[2-(4-Хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}метил)циклогексанкарбоновая кислота
Указанное в заголовке соединение получали аналогично примеру 10 после очистки хиральной препаративной ВЭЖХ (Chiralpak-AD колонка), элюируя градиентом изопропанола (+0,5% муравьиной кислоты)/гептан. MS (ES+):527 (М+Н).
Промежуточное соединение
Метиловый эфир 4-({2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}метил)циклогексанкарбоновой кислоты
Указанное в заголовке соединение получали аналогично примеру 8, промежуточное соединение а, заменяя трет-бутиловый эфир (2-амино-4,5-дифторфенил)карбаминовой кислоты на трет-бутиловый эфир (2-амино-5-фторфенил)карбаминовой кислоты (полученный, как описано в статье М.J. Bamford, М.J. Alberti, N.Bailey, S.Davies, D.К.Dean, A. Gaiba, S. Garland, J.D. Harling, D.K. Jung, T.A. Panchal, C.A. Parr, J.G. Steadman, A.K. Takle, J.T. Townsend, D.M. Wilson, J. Witherington, Bioorg. Med. Chem. Lett., 2005, 15, cc. 3402-3406), 2,6-диметоксиникотиновую кислоту на 4-хлорбензойную кислоту ([CAS RN 74-11-3]), и изоцианометилбензол на метиловый эфир 4-изоцианометилциклогексанкарбоновой кислоты ([CAS RN 730964-84-8]) после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):540 (М+Н).
Пример 21
3-Хлор-4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Указанное в заголовке соединение получали аналогично примеру 10 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):542 (М+Н).
Промежуточное соединение
Метиловый эфир 3-хлор-4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты
Указанное в заголовке соединение получали аналогично примеру 8, промежуточное соединение а, заменяя трет-бутиловый эфир (2-амино-4,5-дифторфенил)карбаминовой кислоты на трет-бутиловый эфир (2-амино-5-фторфенил)карбаминовой кислоты (полученный, как описано в статье М.J. Bamford, М.J. Alberti, N. Bailey, S. Davies, D.К. Dean, A. Gaiba, S. Garland, J.D. Harling, D.K. Jung, T.A. Panchal, C.A. Parr, J.G. Steadman, A.K. Takle, J.T. Townsend, D.M.Wilson, J. Witherington, Bioorg. Med. Chem. Lett., 2005, 15, cc. 3402-3406), 2,6-диметоксиникотиновую кислоту на 4-хлорбензойную кислоту ([CAS RN 74-11-3]), и изоцианометилбензол на метиловый эфир 3-хлор-4-изоцианобензойной кислоты (полученный аналогично метиловому эфиру 4-изоцианобензойной кислоты ([CAS RN 198476-21-0]) из метилового эфира 4-амино-3-хлорбензойной кислоты ([CAS RN 84228-44-4]) как описано в статье S.Kamijo, Т.Jin, Y.Yamamoto, J.Am.Chem. Soc, 2001, 123, cc. 9453-9454) после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):554 (М+Н).
Пример 22
4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
К раствору этилового эфира 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты (промежуточное соединение г) в 25 мл диоксана добавляли 25 мл воды и 0,57 г (13,6 ммоля) моногидрата гидроксида лития. Раствор перемешивали в течение 2 ч при 100°C. После охлаждения до комнатной температуры добавляли 16 мл 1М водного раствора хлористоводородной кислоты при перемешивании. Суспензию отфильтровывали, остаток на фильтре промывали водой и сушили в высоком вакууме с получением 2,46 г (99%) целевого соединения в виде бесцветного твердого вещества.
MS (ES+):524 (М-Н)
Промежуточные соединения
а) 2-(4-Хлорфенил)-5,6-дифтор-1Н-бензоимидазол
Смесь 50,7 г (0,35 моля) 1,2-диамино-4,5-дифторбензола, 55,1 г (0,35 моля) 4-хлорбензойной кислоты и 507 г полифосфорной кислоты нагревали до 160°C и перемешивали при этой температуре в течение 90 мин. После охлаждения до 55°C добавляли 1000 мл воды и 500 мл этилацетата. При охлаждении льдом добавляли около 1000 мл 32% водного раствора гидроксида натрия (рН около 9). Суспензию отфильтровывали на дикалите, и остаток на фильтре промывали 1,5 л этилацетата. Фазы разделяли, и водную фазу промывали 0,5 л этилацетата. Органическую фазу промывали 1М водным раствором гидроксида натрия и насыщенным раствором хлорида натрия, сушили сульфатом магния и отфильтровывали. К раствору добавляли силикагель, и растворитель упаривали. Сырой адсорбированный продукт очищали колоночной хроматографией на силикагеле, используя градиент н-гептан: этилацетат (об/об, от 4:1 до 1:1) в качестве элюента. Фракции, содержащие продукт в чистой форме, объединяли и упаривали. Оставшиеся фракции растворяли в этилацетате, промывали дважды 1М водным раствором гидроксида натрия и насыщенным раствором хлорида натрия, объединенные водные слои экстрагировали один раз этилацетатом, и объединенные органические слои сушили сульфатом магния и отфильтровывали. Хроматография на силикагеле приводила к получению второй партии соединения. Общий выход: 75 г (80%) светло-желтого твердого вещества. MS (ES+):265 (М+Н).
б) Этиловый эфир [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты
К раствору 75 г (0,28 моля) 2-(4-хлорфенил)-5,6-дифтор-1H-бензоимидазола в 750 мл N,N-диметилформамида добавляли 116 г (0,33 моля) карбоната цезия и 88 г (0,35 моля) этилового эфира бромциклогексилуксусной кислоты (коммерчески доступный). Смесь нагревали до 100°C, и после перемешивания в течение 90 мин добавляли еще 116 г карбоната цезия и 88 г этилового эфира бромциклогексилуксусной кислоты. Через 6 ч добавляли еще 116 г карбоната цезия и 88 г этилового эфира бромциклогексилуксусной кислоты. Через 22 ч (общее время реакции) реакционную смесь охлаждали до 30°C и выливали в 1 л ледяной воды и 2 л этилацетата. Фазы разделяли, и водную фазу экстрагировали 500 мл этилацетата. Объединенные органические фазы промывали три раза 500 мл ледяной воды и один раз насыщенным раствором хлорида натрия, сушили сульфатом магния и отфильтровывали. К раствору добавляли силикагель, и растворитель упаривали. Сырой адсорбированный продукт очищали колоночной хроматографией на силикагеле, используя смесь н-гептан: этилацетат (9:1 об/об) в качестве элюента. Фракции, содержащие продукт, объединяли, и растворитель упаривали до получения суспензии. Суспензию охлаждали в ледяной бане и отфильтровывали с получением 92 г (75%) целевого продукта в виде бесцветного твердого вещества. MS (ES+):433 (М+Н).
в) [2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусная кислота
К раствору 24 г (0,055 моля) этилового эфира [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты в 240 мл диоксана, добавляли 240 мл воды и 7,0 г (0,166 моля) моногидрата гидроксида лития.
Раствор перемешивали в течение 2 ч при 100°C. После охлаждения до комнатной температуры органический растворитель упаривали. После перемешивания добавляли 162 мл 1М хлористоводородной кислоты. Полученную суспензию отфильтровывали, остаток на фильтре промывали водой и сушили в высоком вакууме с получением 21,7 г (95%) целевого соединения в виде белого твердого вещества. MS (ES-):403 (М-Н).
г) Этиловый эфир 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты
Раствор 3,0 г (7,4 ммоля) [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты в 5,4 мл тионилхлорида перемешивали при кипении с обратным холодильником. Через 1 ч летучие компоненты удаляли на роторном испарителе, остаток переносили в толуол и упаривали (три раза). Полученное масло растворяли в 30 мл дихлорметана, охлаждали до 0°C и добавляли по каплям к раствору этил 4-аминобензоата (1,35 г, 8,1 ммоля) и 2,72 г (22,2 ммоля) 4-диметиламинопиридина, растворенных в 30 мл дихлорметана. Охлаждающую баню удаляли, и перемешивание продолжали в течение 4 ч. Реакционную смесь выливали в 25% водный раствор хлористоводородной кислоты, фазы отделяли, и водную фазу экстрагировали дихлорметаном. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили сульфатом магния, отфильтровывали и упаривали. Остаток очищали колоночной хроматографией на силикагеле, используя смесь гептан: этил ацетат (от 1:0 до 1:1 об/об) в качестве элюента с получением указанного в заголовке соединения в виде бесцветного твердого вещества (2,6 г, 62%). MS (ES+):552 (М+Н).
Примеры 23 и 24
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)+:522,2.
(-)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н):522,2. Промежуточные соединения
а) 2-(4-Хлорфенил)-5,6-дифтор-1Н-бензоимидазол
Смесь 50,7 г (0,35 моля) 1,2-диамино-4,5-дифторбензола, 55,1 г (0,35 моля) 4-хлорбензойной кислоты и 507 г полифосфорной кислоты нагревали до 160°C и перемешивали при этой температуре в течение 90 мин. После охлаждения до 55°C добавляли 1000 мл воды и 500 мл этилацетата. При охлаждении добавляли около 1000 мл 32% водного раствора гидроксида натрия (рН около 9). Суспензию отфильтровывали через декалит, и остаток на фильтре промывали 1,5 л этилацетата. Фазы разделяли, и водную фазу промывали 0,5 л этилацетата. Органические фазы промывали 1М водным раствором гидроксида натрия и насыщенным раствором хлорида натрия, сушили сульфатом магния и отфильтровывали. К раствору добавляли силикагель, и растворитель упаривали. Сырой адсорбированный продукт очищали колоночной хроматографией на силикагеле, используя градиент н-гептан: этилацетат (об/об, от 4:1 до 1:1) в качестве элюента. Фракции, содержащие продукт в чистой форме, объединяли и упаривали. Оставшиеся фракции растворяли в этилацетате, промывали дважды 1М водным раствором гидроксида натрия и насыщенным раствором хлорида натрия, объединенные водные слои экстрагировали один раз этилацетатом, и объединенные органические слои сушили сульфатом магния и отфильтровывали. Хроматография на силикагеле приводила к получению второй партии соединения. Общий выход: 75 г (80%) светло-желтого твердого вещества.
MS (TS) m/e (М+Н)+:264,9.
б) Этиловый эфир [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты
К раствору 75 г (0,28 моля) 2-(4-хлорфенил)-5,6-дифтор-1Н-бензоимидазола в 750 мл N,N-диметилформамида добавляли 116 г (0,33 моля) карбоната цезия и 88 г (0,35 моля) этилового эфира бромциклогексилуксусной кислоты (коммерчески доступный). Смесь нагревали до 100°C и после перемешивания в течение 90 мин добавляли еще 116 г карбоната цезия и 88 г этилового эфира бромциклогексилуксусной кислоты. Через 6 ч добавляли еще 116 г карбоната цезия и 88 г этилового эфира бромциклогексилуксусной кислоты. Через 22 ч (общее время реакции) реакционную смесь охлаждали до 30°C и выливали в 1 л ледяной воды и 2 л этилацетата. Фазы разделяли и водную фазу экстрагировали 500 мл этилацетата. Объединенные органические фазы промывали три раза 500 мл ледяной воды и один раз насыщенным раствором хлорида натрия, сушили сульфатом магния и отфильтровывали. К раствору добавляли силикагель и растворитель упаривали. Сырой адсорбированный продукт очищали колоночной хроматографией на силикагеле, используя смесь н-гептан: этилацетат (9:1 об/об) в качестве элюента. Фракции, содержащие продукт, объединяли, и растворитель упаривали до получения суспензии. Суспензию охлаждали в ледяной бане, и отфильтровывали с получением 92 г (75%) целевого продукта в виде бесцветного твердого вещества.
MS (TS) m/e (М+Н)+:433,1.
в) [2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусная кислота
К раствору 24 г (0,055 моля) этилового эфира [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты в 240 мл диоксана добавляли 240 мл воды и 7,0 г (0,166 моля) моногидрата гидроксида лития. Раствор перемешивали в течение 2 ч при 100°C. После охлаждения до комнатной температуры органический растворитель упаривали. При перемешивании добавляли 162 мл 1М хлористоводородной кислоты. Полученную суспензию отфильтровывали, остаток на фильтре промывали водой и сушили в высоком вакууме с получением 21,7 г (95%) целевого соединения в виде белого твердого вещества.
MS (TS) m/e (М-Н)-:403,2.
г) Этиловый эфир 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты
Раствор 3,0 г (7,4 ммоля) [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты в 5,4 мл тионилхлорида перемешивали при кипении с обратным холодильником. Через 1 ч летучие компоненты удаляли на роторном испарителе, остаток переносили в толуол и упаривали (три раза). Полученное масло растворяли в 30 мл дихлорметана, охлаждали до 0°C и добавляли по каплям к раствору этил 4-аминобензоата (1,35 г, 8,1 ммоля) и 2,72 г (22,2 ммоля) 4-диметиламинопиридина, растворенных в 30 мл дихлорметана. Охлаждающую баню удаляли, и перемешивание продолжали в течение 4 ч. Реакционную смесь выливали в 25% водный раствор хлористоводородной кислоты, фазы разделяли, и водную фазу экстрагировали дихлорметаном. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили сульфатом магния, отфильтровывали и упаривали. Остаток очищали колоночной хроматографией на силикагеле, используя смесь гептан: эти л ацетат (от 1:0 до 1:1 об/об) в качестве элюента с получением указанного в заголовке соединения в виде бесцветного твердого вещества (2,6 г, 62%).
MS (TS) m/e (М+Н)+:552,1
Пример 25
4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойная кислота
Соединение получали аналогично примеру 22 из метилового эфира 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойной кислоты.
Бесцветное твердое вещество (97%), MS (TS) m/e (М-Н)+:536,3.
Примеры 26 и 27
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойной кислоты хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойная кислота
Беловатое твердое вещество (45%). MS (TS) m/e (М-Н)+:536,2.
(-)-4-{2-[2-(4-Хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойная кислота
Беловатое твердое вещество (42%). MS (TS) m/e (М-Н)+:536,2.
Промежуточное соединение
Метиловый эфир 4-{2-[2-(4-хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метилбензойной кислоты
Это соединение получали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты и метил 4-амино-3-метилбензоата.
Бесцветное твердое вещество (97%). MS (TS) m/e (М+Н)+:552,3.
Пример 28
3-Хлор-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Это соединение получали аналогично примеру 22 из метилового эфира 3-хлор-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты.
Светло-желтое твердое вещество (91%). MS (TS) m/e (М-Н)-:556,1.
Примеры 29 и 30
Указанные в заголовке соединения получали разделением стереоизомеров 3-хлор-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-3-Хлор-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Бесцветное твердое вещество (24%). MS (TS) m/e (М-Н)-:556,0.
(-)-3-Хлор-4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Бесцветное твердое вещество (24%). MS (TS) m/e (М-Н)-:556,1.
Промежуточное соединение
Метиловый эфир 3-хлор-4-{2-[2-(4-хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты
Это соединение получали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты и метил 4-амино-3-хлорбензоата.
Бесцветное твердое вещество (62%). MS (TS) m/e (М+Н)+:572,2.
Пример 31
4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота
Это соединение получали аналогично примеру 22 из метилового эфира 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойной кислоты.
Бесцветное твердое вещество (91%). MS (TS) m/e (M-H)': 540,2.
Примеры 32 и 33
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойной кислоты хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино} -3-фторбензойная кислота 15
Бесцветное твердое вещество (41%). MS(TS) m/e (M-H)- 540,2
(-)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота.
Бесцветное твердое вещество (35%). MS (TS) m/e (M-H)- 540,2
Промежуточное соединение
Метиловый эфир 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойной кислоты
Это соединение получали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты, метил 4-амино-3-фторбензоата, и используя 4-(диметиламино)пиридин в качестве основания.
Бесцветная пена (70%). MS (TS) m/e (M+H)+ 556,1.
Пример 34
4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3,5-дифторбензойная кислота
Это соединение получали аналогично примеру 22 из метилового эфира 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3,5-дифторбензойной кислоты.
Бесцветное твердое вещество (92%). MS (TS) m/e (M-H)-: 558,1.
Примеры 35 и 36
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3,5-дифторбензойной кислоты хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3,5-дифторбензойная кислота
Бесцветное твердое вещество (10%). MS (TS) m/e (M-H)-: 558,1.
(-)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3,5-дифторбензойная кислота
Бесцветное твердое вещество (19%). MS (TS) m/e (M-H)-: 558,1.
Промежуточное соединение
Метиловый эфир 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3,5-дифторбензойной кислоты
Это соединение получали аналогично примеру 20, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты, метилового эфира 4-амино-3,5-дифторбензойной кислоты, и используя пиридин в качестве основания.
Светло-желтая пена (73%). MS (TS) m/e (M+H)+ 574,3.
Пример 37
4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-цианобензойная кислота
Это соединение получали аналогично примеру 22 из метилового эфира 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-цианобензойной кислоты с получением целевого соединения в виде бесцветного твердого вещества (27%).
MS (TS) m/e (M-H)-: 547,2.
Промежуточное соединение
Метиловый эфир 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-цианобензойной кислоты
Это соединение получали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты, метилового эфира 4-амино-3-цианобензойной кислоты и N,N-диизопропилэтиламина в качестве основания.
Бесцветная пена (20%). MS (TS) m/e (M+H)+ 563,3.
Пример 38
3-Хлор-4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Это соединение получали аналогично примеру 22 из метилового эфира 3-хлор-4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты с получением указанного в 10 заголовке соединения в виде бесцветного твердого вещества (60%).
MS (TS) m/e (M-H)-: 522,1.
Примеры 39 и 40
Указанные в заголовке соединения получали разделением стереоизомеров метилового эфира 3-хлор-4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
Метиловый эфир (+)-3-хлор-4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты
Бесцветное твердое вещество (21%). MS (TS) m/e (M-H)-: 520,2.
Метиловый эфир (-)-3-хлор-4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты
Бесцветное твердое вещество (29%). MS (TS) m/e (M-H)-: 520,2.
Промежуточные соединения
а) Этиловый эфир [2-(4-хлорфенил)бензоимидазол-1-ил]циклогексилуксусной кислоты
Это соединение синтезировали аналогично примеру 22, промежуточное соединение б, из 2-(4-хлорфенил)-1Н-бензоимидазола (коммерчески доступный), этилового эфира бромциклогексилуксусной кислоты (коммерчески доступный) и карбоната цезия с получением конечного соединения в виде бесцветного твердого вещества (58%).
MS (TS) m/e (M+H)+ 397,2.
б) [2-(4-Хлорфенил)бензоимидазол-1-ил]циклогексилуксусная кислота
Это соединение синтезировали аналогично примеру 22, промежуточное соединение в, из этилового эфира [2-(4-хлорфенил)бензоимидазол-1-ил]циклогексилуксусной кислоты с получением целевого соединения в виде бесцветного твердого вещества (99%).
MS (TS) m/e (М-Н)-:367,0.
в) Метиловый эфир 3-хлор-4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино} бензойной кислоты
Указанное в заголовке соединение синтезировали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)бензоимидазол-1-ил]циклогексилуксусной кислоты, 4-амино-3-хлорбензойной кислоты, и используя пиридин в качестве основания.
MS (TS) m/e (М+Н)+:537,4.
Пример 41
4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метоксибензойная кислота
Это соединение синтезировали аналогично примеру 22 из метилового эфира 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метоксибензойной кислоты с получением указанного в заголовке соединения в виде бесцветного твердого вещества (84%).
MS (TS) m/e (М-Н)-:552,0.
Промежуточное соединение
Метиловый эфир 4-{2-[2-(4-хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метоксибензойной кислоты
Это соединение синтезировали аналогично примеру 20, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 22, промежуточное соединение в), метилового эфира 4-амино-3-метоксибензойной кислоты, и используя пиридин в качестве основания с получением указанного в заголовке соединения в виде бесцветного твердого вещества (74%).
MS m/e (М+Н)+: 568,1.
Пример 42
4-{2-[2-(4-Хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота
Это соединение синтезировали аналогично примеру 22 из метилового эфира 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойной кислоты с получением указанного в заголовке соединения в виде бесцветного твердого вещества (79%).
MS m/e (М+Н)+:590,0.
Промежуточное соединение
Метиловый эфир 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойной кислоты
Это соединение синтезировали аналогично примеру 20, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 20, промежуточное соединение в), метилового эфира 4-амино-3-трифторметилбензойной кислоты, и используя пиридин в качестве основания с получением указанного в заголовке соединения в виде бесцветного твердого вещества (74%).
MS m/e (М+Н)+: 606,1.
Пример 43
4-{2-Циклогексил-2-[5,6-дифтор-2-(4-трифторметилфенил)бензоимидазол-1-ил]ацетиламино}бензойная кислота
Это соединение получали аналогично примеру 22 из этилового эфира 4-{2-циклогексил-2-[5,6-дифтор-2-(4-трифторметилфенил)бензоимидазол-1-ил]ацетиламино}бензойной кислоты.
Бесцветное твердое вещество (95%). MS (TS) m/e (М-Н)-:555,9.
Промежуточное соединение
Этиловый эфир 4-{2-циклогексил-2-[5.6-дифтор-2-(4-трифторметилфенил)бензоимидазол-1-ил]ацетиламино}бензойной кислоты
Раствор 0,30 г (1,23 ммоля) трет-бутилового эфира (2-амино-4,5-дифторфенил)карбаминовой кислоты и 0,15 мл (0,14 г, 1,23 ммоля) циклогексанкарбоксальдегида перемешивали в течение 10 мин. Затем добавляли 0,23 г (1,23 ммоля) 4-(трифторметил)бензойной кислоты, и через 5 мин 0,22 г (1,23 ммоля) этилового эфира 4-изоцианобензойной кислоты. Через 21 ч добавляли 3 мл 4М водного раствора хлористоводородной кислоты, и перемешивание продолжали в течение 16 ч. Растворитель упаривали, остаток растворяли в смеси ацетонитрила, воды и N,N-диметилформамида, и очищали препаративной ВЭЖХ с получением целевого соединения в виде бесцветного твердого вещества (7%).
MS m/e (М+Н)+:586,1.
Пример 44
4-{2-Циклогексил-2-[5-фтор-2-(4-трифторметилфенил)бензоимидазол-1-ил]ацетиламино}бензойная кислота
Это соединение получали аналогично примеру 22 из этилового эфира 4-{2-циклогексил-2-[5-фтор-2-(4-трифторметилфенил)бензоимидазол-1-ил]ацетиламино}бензойной кислоты.
Бесцветное твердое вещество (64%). MS m/e 538,1 (М-Н)-.
Промежуточное соединение
Этиловый эфир 4-{2-циклогексил-2-[5-фтор-2-(4-трифторметилфенил)бензоимидазол-1-ил]ацетиламино}бензойной кислоты
Это соединение получали аналогично примеру 43, промежуточное соединение, из трет-бутилового эфира (2-амино-5-фторфенил)карбаминовой кислоты, циклогексанкарбоксальдегида, 4-(трифторметил)бензойной кислоты и этилового эфира 4-изоцианобензойной кислоты.
Светло-коричневая пена (21%). MS m/e (М+Н)+:568,2.
Пример 45
4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметоксибензойная кислота
Указанное в заголовке соединение синтезировали аналогично примеру 22 из метилового эфира 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметоксибензойной кислоты с получением целевого соединения в виде бесцветного твердого вещества (84%).
MS (TS) m/e (М-Н)-:608,0.
Промежуточное соединение
Метиловый эфир 4-{2-[2-(4-хлорфенил)5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметоксибензойной кислоты
Это соединение синтезировали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 22, промежуточное соединение в), метилового эфира 4-амино-3-трифторметоксибензойной кислоты, и используя пиридин в качестве основания, с получением указанного в заголовке соединения в виде бесцветного твердого вещества (85%).
MS (TS) m/e (М+Н)+:622,0.
Пример 46
4-{2-[2-(4-Хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Это соединение синтезировали аналогично примеру 22 из этилового эфира 4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты. Бесцветное твердое вещество (86%).
MS (TS) m/e (М-Н)-:504,1.
Промежуточное соединение
Этиловый эфир 4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойной кислоты
Это соединение синтезировали аналогично примеру пример 43, промежуточное соединение, из трет-бутилового эфира (2-амино-5-фторфенил)карбаминовой кислоты, циклогексанкарбоксальдегида, 4-хлорбензойной кислоты и этилового эфира 4-изоцианобензойной кислоты.
MS m/e (М+Н)+:534,1.
Пример 47
4-{2-[2-(4-Хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота
Это соединение синтезировали аналогично примеру 22 из метилового эфира
4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойной кислоты. Белое твердое вещество (89%).
MS (TS) m/e (М-Н)-:522,2.
Промежуточное соединение
Метиловый эфир 4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойной кислоты
Это соединение синтезировали аналогично примеру пример 43, промежуточное соединение, из трет-бутилового эфира (2-амино-5-фторфенил)карбаминовой кислоты, циклогексанкарбоксальдегида, 4-хлорбензойной кислоты и метилового эфира 3-фтор-4-изоцианобензойной кислоты.
Light brown foam (15%). MS m/e (M+H)+:538,2.
Пример 48
(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}фенил)уксусная кислота
Указанное в заголовке соединение синтезировали аналогично примеру 22 из этилового эфира (4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}фенил)уксусной кислоты с получением целевого соединения в виде бесцветного твердого вещества (95%).
MS (TS) m/e (М-Н)-:536,3.
Промежуточное соединение
Этиловый эфир (4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}фенил)уксусной кислоты
Это соединение синтезировали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 20, промежуточное соединение в), этилового эфира (4-аминофенил)уксусной кислоты и гексафторфосфата O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония с получением целевого соединения в виде желтой пены (82%).
MS m/e (М+Н)+:566,3.
Пример 49
2-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовая кислота
Указанное в заголовке соединение синтезировали аналогично примеру 22 из этилового эфира 2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовой кислоты.
Бесцветное твердое вещество (93%). MS (TS) m/e (М-Н)-:568,0.
Промежуточное соединение
Этиловый эфир 2-(4-{2-[2-(4-хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовой кислоты
Указанное в заголовке соединение синтезировали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 20, промежуточное соединение в), 2-(4-амино-3-фторфенил)пропионовой кислоты, и используя 4-(диметиламино)пиридин в качестве основания.
Бесцветная пена (74%). MS m/e (М+Н)+:598,1.
Пример 50
2-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)-2-метилпропионовая кислота
Указанное в заголовке соединение синтезировали аналогично примеру 22 из метилового эфира 2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)-2-метилпропионовой кислоты.
Бесцветное твердое вещество (88%). MS (TS) m/e (М-Н)-:582,0.
Промежуточное соединение
Метиловый эфир 2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)-2-метилпропионовой кислоты
Указанное в заголовке соединение синтезировали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 22, промежуточное соединение в), метилового эфира 2-(4-амино-3-фторфенил)-2-метилпропионовой кислоты, и используя 4-(диметиламино)пиридин в качестве основания.
Бесцветная пена (54%). MS m/e (М+Н)+:598,2.
Пример 51
3-(4-{2-[2-(4-Хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}фенил)пропионовая кислота
Указанное в заголовке соединение синтезировали аналогично примеру 22 из этилового эфира 3-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}фенил)пропионовой кислоты.
Бесцветное твердое вещество (78%). MS (TS) m/e (М+Н)+:552,1.
Промежуточное соединение
Этиловый эфир 3-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}фенил)пропионовой кислоты
Указанное в заголовке соединение синтезировали аналогично примеру 20, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 20, промежуточное соединение в), этилового эфира 3-(4-аминофенил)пропионовой кислоты, гексафторфосфата O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония и N-этилдиизопропиламина.
Бесцветное твердое вещество (48%). MS (TS) m/e (М+Н)+:580,2.
Пример 52
3-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовая кислота
Указанное в заголовке соединение синтезировали аналогично примеру 22 из метилового эфира 3-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовой кислоты (промежуточное соединение а).
Бесцветное твердое вещество (80%). MS (TS) m/e (М-Н)-:568,1.
Промежуточное соединение
Метиловый эфир 3-(4-{2-[2-(4-хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовой кислоты
Указанное в заголовке соединение синтезировали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 22, промежуточное соединение в), метилового эфира 3-(4-амино-3-фторфенил)пропионовой кислоты, гексафторфосфата O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония и N-этилдиизопропиламина.
Светло-коричневая пена (38%). MS m/e (М+Н)+:584,1.
Примеры 53 и 54
Стереоизомеры примера 52 синтезировали кислотным отщеплением (муравьиная кислота/изопропанол (1/1 об/об), кипение, 17 ч) хирального трет-бутилового эфира промежуточных соединений б1 и б2, как описано ниже.
(-)-3-(4-{2-[2-(4-Хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовая кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:568,1.
(+)-3-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовая кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:568,1.
Промежуточные соединения
а) трет-Бутиловый эфир 3-(4-{2-{2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовой кислоты
Указанное в заголовке соединение синтезировали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 20, промежуточное соединение в), трет-бутилового эфира 3-(4-амино-3-фторфенил)пропионовой кислоты, и используя 4-(диметиламино)пиридин в качестве основания. Светло-коричневая пена (78%).
MS m/e (М+Н)+:626,3.
Стереоизомеры описанного выше промежуточного соединения получали хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
б1) трет-Бутиловый эфир (-)-3-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовой кислоты
Бесцветная пена (30%). MS m/e (М+Н)+:626,2.
б2) трет-Бутиловый эфир (+)-3-(4-{2-[2-(4-хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенил)пропионовой кислоты
Бесцветная пена (35%). MS m/e (М+Н)+:626,3.
Пример 55
(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилапетиламино}-3-фторфенокси)уксусная кислота
К раствору трет-бутилового эфира (4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)уксусной кислоты (120 мг, 0,19 ммоля) в дихлорметане (5 мл) добавляли трифторуксусную кислоту (1,5 мл). Через 2 ч растворитель удаляли при пониженном давлении. Полученное масло (78 мг, 71%) затвердевало при хранении в холодильнике.
Светло-коричневое твердое вещество. MS m/e (М-Н)-:570,2.
Промежуточные соединения
а) трет-Бутиловый эфир (3-фтор-4-нитрофенокси)уксусной кислоты
К раствору 3-фтор-4-нитрофенола (1,57 г, 10 ммолей) в N,N-диметилформамиде (10 мл) добавляли трет-бутилбромацетат (1,95 г, 10 ммолей) и карбонат калия (1,38 г, 10 ммолей). Смесь перемешивали в течение ночи при комнатной температуре. Растворитель упаривали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (50 г, дихлорметан в качестве элюента) с получением продукта в виде бледно-желтого твердого вещества (2,22 г, 84%).
MS m/e (M+NH4)+:289,0.
б) трет-Бутиловый эфир (4-амино-3-фторфенокси)уксусной кислоты
Раствор трет-бутилового эфира (3-фтор-4-нитрофенокси)уксусной кислоты (2,14 г, 8 ммолей) в этаноле (3 мл) гидрировали в течение 5 ч при комнатной температуре и атмосферном давлении над 10% палладием на угле. Катализатор удаляли фильтрацией, растворитель упаривали при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (от 1:0 до 1:1 гептан/этилацетат элюент) с получением продукта в виде коричневого масла (960 мг, 50%).
MS m/e (М+Н)+:242,2.
в) трет-Бутиловый эфир (4-{2-[2-(4-хлорфенил)-5.6-диФторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)уксусной кислоты
К суспензии [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 22, промежуточное соединение а), 150 мг, 0,37 ммоля) в дихлорметане (5 мл) добавляли пиридин (2,5 эквив., 70 мкл) и тионилхлорид (1,2 эквив., 30 мкл). Смесь перемешивали в течение 30 мин при комнатной температуре. Добавляли пиридин (1,2 эквив., 30 мкл) и трет-бутиловый эфир 4-амино-3-фторфенокси)уксусной кислоты (0,95 эквив., 85 мг). Смесь разбавляли дихлорметаном, и органическую фазу промывали 10% водным раствором бикарбоната натрия, водой и насыщенным раствором хлорида натрия, сушили сульфатом магния, и остаток после упаривания очищали колоночной хроматографией на силикагеле (от 1:0 до 3:2 гептан/этилацетат в качестве элюента) с получением указанного в заголовке соединения в виде светло-коричневой пены (137 мг, 58%).
MS m/e (М+Н)+:628,4.
Пример 56
2-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)пропионовая кислота
Это соединение получали аналогично примеру 22 из метилового эфира 2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)пропионовой кислоты с получением указанного в заголовке соединения в виде бесцветного твердого вещества (76%).
MS (TS) m/e (М-Н)-:584,1.
Промежуточное соединение
Метиловый эфир 2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)пропионовой кислоты
Это соединение получали аналогично примеру 57, промежуточное соединение, из метилового эфира [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты и 2-(4-амино-3-фторфенокси)пропионовой кислоты.
Светло-желтая пена (48%). MS (TS) m/e (М+Н)+:600,2.
Пример 57
2-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовая кислота
Это соединение получали аналогично примеру 22 из этилового эфира 2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовой кислоты.
Бесцветное твердое вещество (78%). MS (TS) m/e (М-Н)-:598,1.
Примеры 58 и 59
Указанные в заголовке соединения получали разделением стереоизомеров 2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовой кислоты хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-2-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовая кислота
Бесцветное твердое вещество (45%). MS (TS) m/e (М-Н)-:598,1.
(-)-2-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовая кислота
Бесцветное твердое вещество (31%). MS (TS) m/e (М-Н)-:598,1.
Промежуточное соединение
Этиловый эфир 2-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)-2-метилпропионовой кислоты
К раствору 0,2 г (0,49 ммоля) [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 22, промежуточное соединение в)) в 3 мл N,N-диметилформамида добавляли 0,21 г (0,55 ммоля) гексафторфосфата 0-(7-азабензотриазол-1-ил)-N,N,N,N'-тетраметилурония, 0,42 мл (0,32 г, 2,5 ммоля) N-этилдиизопропиламина и 0,13 г (0,54 ммоля) этилового эфира 2-(4-амино-3-фторфенокси)-2-метилпропионовой кислоты. Через 18 ч реакционную смесь выливали в воду и этилацетат, фазы разделяли, органический слой промывали дважды водой, затем насыщенным раствором хлорида натрия, и сушили сульфатом магния. После фильтрации остаток очищали колоночной хроматографией на силикагеле с получением 0,12 г (40%) целевого соединения в виде светло-желтой пены.
MS (TS) m/e (М+Н)+:628,3.
Пример 60
1-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота
Это соединение получали аналогично примеру 22 из метилового эфира 1-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновой кислоты.
Бесцветное твердое вещество (97%). MS (TS) m/e (М-Н)-:596,1.
Примеры 61 и 62
Указанные в заголовке соединения получали разделением стереоизомеров 1-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновой кислоты хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-1-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота
Бесцветное твердое вещество (45%). MS (TS) m/e (М-Н)-:596,2.
(+)-1-(4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота
Бесцветное твердое вещество (39%). MS (TS) m/e (М-Н)-:596,3.
Промежуточное соединение
Метиловый эфир 1-(4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновой кислоты
Это соединение получали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты, метилового эфира 1-(4-амино-3-фторфенокси)циклопропанкарбоновой кислоты, и используя 4-(диметиламино)пиридин в качестве основания.
Бесцветная пена (57%). MS(TS) m/e (М+Н)+:612,2.
Пример 63
2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-транс-(4-гидроксициклогексил)ацетамид
Это соединение получали аналогично примеру 22, промежуточное соединение г, из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты, транс-4-аминоциклогексанола, и используя диизопропилэтиламин в качестве основания.
Светло-коричневая пена (66%). MS(TS) m/e (М+Н)+:502,2.
Примеры 64 и 65
Указанные в заголовке соединения получали разделением стереоизомеров 2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-транс-(4-гидроксициклогексил)ацетамида хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(-)-2-[2-(4-Хлорфенил)-5,6-диФторбензоимидазол-1-ил]-2-циклогексил-N-транс-(4-гидроксициклогексил)ацетамид
Бесцветная пена (37%). MS (TS) m/e (М+Н)+:502,2.
(+)-2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-транс-(4-гидроксициклогексил)ацетамид
Бесцветная пена (39%). MS (TS) m/e (М+Н)+:502,2.
Пример 66
6-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино} никотиновая кислота
Метиловый эфир 6-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}никотиновой кислоты (24 мг, 0,04 ммоля) растворяли в воде (0,5 мл) и диоксане (0,5 мл). Добавляли моногидрат гидроксида лития (9 эквив., 17 мг), и смесь перемешивали в течение 3 ч при комнатной температуре. Диоксан удаляли при пониженном давлении, и остаток подкисляли до значения pH2 3М водным раствором хлористоводородной кислоты. Осадок отфильтровывали с получением указанного в заголовке соединения в виде белого твердого вещества (20 мг, 84%).
MS m/e (М+Н)+:525,1.
Промежуточное соединение
Метиловый эфир 6-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино} никотиновой кислоты
Указанное в заголовке соединение получали в соответствии с примером 22, промежуточное соединение в), из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты и метил 6-аминоникотината.
Бесцветное твердое вещество (49%). MS m/e (М+Н)+:539,2.
Примеры 67 и 68
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-цианобензойной кислоты (пример 37) хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-цианобензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:547,1.
(-)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-цианобензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:547,1.
Примеры 69 и 70
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метоксибензойной кислоты (пример 41) хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метоксибензойная кислота
Светло-желтое твердое вещество. MS (TS) m/e (М+Н)+:554,2.
(-)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-метоксибензойная кислота
Светло-желтое твердое вещество. MS (TS) m/e (М+Н)+:554,2.
Примеры 71 и 72
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойной кислоты (пример 42) хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М+Н)+:590,4.
(-)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:590,3.
Примеры 73 и 74
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметоксибензойной кислоты (пример 45) хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилапетиламино}-3-трифторметоксибензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:606,2.
(-)-4-{2-[2-(4-Хлорфенил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметоксибензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:606,3.
Примеры 75 и 76
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойной кислоты (пример 47) хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(-)-4-{2-[2-(4-Хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:522,2.
(+)-4-{2-[2-(4-Хлорфенил)-5-фторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторбензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:522,2.
Пример 77
4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-циано-5-фторбензойная кислота
Это соединение получали аналогично примеру 22 из метилового эфира 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-циано-5-фторбензойной кислоты с получением указанного в заголовке соединения в виде бесцветного твердого вещества (96%).
MS (TS) m/e (М-Н)-:565,2.
Промежуточное соединение
Метиловый эфир 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-циано-5-фторбензойной кислоты
Указанное в заголовке соединение получали аналогично примеру 22, промежуточное соединение г), из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты и метилового эфира 4-амино-3-циано-5-фторбензойной кислоты (Arzneimittel Forschung, 34(11), Nr. 11а, 1984; cc. 1612-1624) с получением продукта в виде светло-коричневого твердого вещества (20%).
MS (TS) m/e (М+Н)+:581,1.
Примеры 78 и 79
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-циано-5-фторбензойной кислоты хиральной препаративной ВЭЖХ (Reprosil Chiral-NR колонка).
(+)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-циано-5-фторбензойная кислота
Светло-коричневая пена. MS (TS) m/e (М-Н)-:565,2.
(-)-4-{2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}-3-циано-5-фторбензойная кислота
Светло-коричневая пена. MS (TS) m/e (М-Н)-:565,2.
Пример 80
1-(4-{2-[2-(4-Хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота
Это соединение получали аналогично примеру 22 из метилового эфира 1-(4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновой кислоты с получением указанного в заголовке соединения в виде светло-желтого твердого вещества (91%).
MS (TS) m/e (М-Н)-:560,1.
Промежуточные соединения
а) Метиловый эфир 1-(4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновой кислоты
Указанное в заголовке соединение получали аналогично примеру 22, промежуточное соединение г), из [2-(4-хлорфенил)бензоимидазол-1-ил]циклогексилуксусной кислоты (пример 39/40, промежуточное соединение б) и метилового эфира 1-(4-амино-3-фторфенокси)циклопропанкарбоновой кислоты с получением продукта в виде светло-желтой пены (21%).
MS (TS) m/e (М+Н)+:576,2.
б) Метиловый эфир 1-(4-амино-3-фторфенокси)циклопропанкарбоновой кислоты
К раствору 4,49 г (17,6 ммоля) метилового эфира 1-(3-фтор-4-нитрофенокси)циклопропанкарбоновой кислоты в 50 мл этанола добавляли 0,5 г 10% палладия на угле, и суспензию перемешивали в течение 8 ч при комнатной температуре в атмосфере водорода (1,7 бар). После добавления 100 мл этилацетата катализатор отфильтровывали, фильтрат упаривали и сушили в высоком вакууме с получением указанного в заголовке соединения в виде коричневого масла (98%), которое использовали на следующей стадии без дополнительной очистки.
MS (TS) m/e (М+Н)+: 226,1.
в) Метиловый эфир 1-(3-фтор-4-нитрофенокси)циклопропанкарбоновой кислоты
Раствор 7,5 г (22,3 ммоля) метилового эфира 4-бром-2-(3-фтор-4-нитрофенокси)бутановой кислоты в 100 мл тетрагидрофурана охлаждали до - 15°C и добавляли 2,63 г (23,4 ммоля) трет-бутоксида калия. Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 5 ч при комнатной температуре. Темный раствор выливали в 200 мл этилацетата и 200 мл водного раствора хлористоводородной кислоты, экстрагировали, и фазы разделяли. Органический слой промывали насыщенным раствором хлорида натрия, и водные слои экстрагировали этилацетатом. Объединенные органические слои сушили сульфатом магния, отфильтровывали и упаривали. Остаток очищали колоночной хроматографией на силикагеле, используя систему MPLC (CombiFlash Companion, Isco Inc.), элюируя градиентом гептан: этилацетат (от 100:30 до 70:30 об/об) с получением указанного в заголовке соединения в виде светло-желтого масла (79%).
MS (TS) m/e (М):255,0.
г) Метиловый эфир 4-бром-2-(3-фтор-4-нитрофенокси)бутановой кислоты
К раствору 5,5 г (35,0 ммоля) 3-фтор-4-нитрофенола в 55 мл N,N-диметилформамида добавляли 11,8 г (45,5 ммоля) метил 2,4-дибромбутирата и 6,3 г (45,5 ммоля) карбоната калия. После перемешивания в течение 3 ч реакционную смесь выливали в этилацетат и 1 М водный раствор хлористоводородной кислоты и экстрагировали. Органические фазы промывали насыщенным раствором хлорида натрия, сушили сульфатом магния, отфильтровывали и упаривали. Остаток очищали колоночной хроматографией на силикагеле, используя систему MPLC (CombiFlash Companion, Isco Inc.), элюируя градиентом гептан: этилацетат (от 1:0 до 1:1 об/об) с получением указанного в заголовке соединения в виде светло-желтого масла (64%), которое было достаточно чистым для использования на следующей стадии.
Примеры 81 и 82
Указанные в заголовке соединения получали разделением стереоизомеров 1-(4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновой кислоты хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-1-(4-{2-[2-(4-Хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота
Бесцветное твердое вещество. MS (TS) m/e (М+Н)+:562,4.
(-)-1-(4-{2-[2-(4-Хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-фторфенокси)циклопропанкарбоновая кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:560,2.
Пример 83
4-{2-[2-(4-Хлорфенил)бензоимидазол-1-ил1-2-циклогексилацетиламино}-3-трифторметилбензойная кислота
Это соединение получали аналогично примеру 22 из метилового эфира 4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойной кислоты с получением указанного в заголовке соединения в виде бесцветного твердого вещества (79%).
MS (TS) m/e (М+Н)+:556,2.
Промежуточные соединения
а) Метиловый эфир 4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойной кислоты
Указанное в заголовке соединение получали аналогично примеру 22, промежуточное соединение г), из [2-(4-хлорфенил)бензоимидазол-1-ил]циклогексилуксусной кислоты (пример 39/40, промежуточное соединение б) и метилового эфира 4-амино-3-трифторметилбензойной кислоты с получением продукта в виде светло-желтого твердого вещества (57%).
MS (TS) m/e (М+Н)+: 570,3.
б) Метиловый эфир 4-амино-3-трифторметилбензойной кислоты
К раствору 4,0 г (16,1 ммоля) метилового эфира 4-нитро-3-трифторметилбензойной кислоты в 50 мл метанола добавляли 0,4 г 10% палладия на угле, и суспензию перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода (1,7 бар). После добавления 100 мл этилацетата катализатор отфильтровывали, фильтрат упаривали и сушили в высоком вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (98%), которое использовали на следующей стадии без дополнительной очистки.
в) Метиловый эфир 4-нитро-3-трифторметилбензойной кислоты
Раствор 4,2 г (17,9 ммоля) 4-нитро-3-(трифторметил)бензойной кислоты (коммерчески доступная) в 5,1 мл 1,25 М хлористоводородной кислоты в метаноле кипятили с обратным холодильником в течение 5 ч. После охлаждения до комнатной температуры раствор выливали в насыщенный водный раствор бикарбоната натрия, и фазы разделяли. Водный слой экстрагировали три раза этилацетатом, объединенные органические слои промывали насыщенным раствором хлорида натрия, сушили сульфатом магния и упаривали. После фильтрации растворитель упаривали, и остаток очищали колоночной хроматографией на силикагеле, используя систему MPLC (CombiFlash Companion, Isco Inc.), элюируя градиентом гептан: этил ацетат (от 100:0 до 60:40 об/об) с получением указанного в заголовке соединения в виде светло-желтого твердого вещества (90%), которое было достаточно чистым для использования на следующей стадии без дополнительной очистки.
Примеры 84 и 85
Указанные в заголовке соединения получали разделением стереоизомеров 4-{2-[2-(4-хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойной кислоты хиральной препаративной ВЭЖХ (Chiralpak-AD колонка).
(+)-4-{2-[2-(4-Хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М-Н)-:554,0.
(-)-4-{2-[2-(4-Хлорфенил)бензоимидазол-1-ил]-2-циклогексилацетиламино}-3-трифторметилбензойная кислота
Бесцветное твердое вещество. MS (TS) m/e (М+Н)+:554,0.
Пример 86
транс-4-{2-Циклогексил-2-[5,6-дифтор-2-(6-метоксипиридин-3-ил)бензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали аналогично примеру 7 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):527 (М+Н)+.
Пример 87
(-)-транс-4-{2-[2-(6-Хлорпиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Chiralpak AD колонка), элюируя градиентом этанола (+0,5% уксусной кислоты)/гептан. MS (ES+):531 (М+Н)+.
Промежуточное соединение
Этиловый эфир (транс-4-изоцианоциклогексил)уксусной кислоты
5 г (22,8 ммоля) гидрохлорида этилового эфира транс-(4-аминоциклогексил)уксусной кислоты суспендировали в смеси 40 мл (731 ммоль) этилформиата и 10 мл ДМФА. Добавляли 5,6 мл (25 ммолей) DIPEA, и смесь нагревали при 80°C в течение 72 ч. Смесь растворителей упаривали досуха, и сырой продукт экстрагировали из смеси этилацетат/вода. Получали 4,2 г желтого твердого вещества, которое растворяли в 40 мл ДХМ. Добавляли 6,6 мл (47 ммолей) триэтиламина, и смесь охлаждали до 0-5°С. 2,3 мл (7,9 ммоля) трифосгена растворяли в 10 мл ДХМ и добавляли по каплям. Реакционную смесь нагревали до комнатной температуры, и продукт выделяли непосредственно хроматографией на силикагеле, используя смесь этилацетат/гексан в качестве элюента. Промежуточное соединение использовали без дополнительной характеризации.
Пример 88
(транс-4-{2-[2-(6-Хлор-2-метоксипиридин-3-ил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексил)уксусная кислота
Указанное в заголовке соединение получали аналогично примеру 7, используя этиловый эфир (транс-4-изоцианоциклогексил)уксусной кислоты в качестве изонитрильного компонента, после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):575 (М+Н)+.
Пример 89
транс-4-{2-[2-(6-Хлор-2-метоксипиридин-3-ил)-5.6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали аналогично примеру 7 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):561 (М+Н)+.
Пример 90
4-{2-[2-(6-Хлор-2-метоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Указанное в заголовке соединение получали аналогично примеру 7 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):555 (М+Н)+.
Пример 91
(+)-транс-4-{2-Циклогексил-2-[5,6-дифтор-2-(6-метоксипиридин-3-ил)бензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Chiralpak-AD колонка), элюируя градиентом этанола (+0,5% уксусной кислоты)/гептан. MS (ES+):528 (М+Н)+.
Пример 92
(-)-транс-4-{2-[2-(6-Хлор-2-метоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}пиклогексанкарбоновая кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Chiralpak AD колонка), элюируя градиентом этанола (+0,5% уксусной кислоты)/гептан. MS (ES+):561 (М+Н)+.
Пример 93
(-)-(транс-4-{2-[2-(6-Хлор-2-метоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}циклогексил)уксусная кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Chiralpak AD колонка), элюируя градиентом этанола (+0,5% уксусной кислоты)/гептан. MS (ES+):575 (М+Н)+.
Пример 94
(+)-4-{(S)-2-[2-(6-Хлор-2-метоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетиламино}бензойная кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Chiralcel-OD колонка), элюируя градиентом этанола (+0,5% уксусной кислоты)/гептан. MS (ES+):555 (М+Н)+.
Промежуточное соединение
Бицикло[2.2.1]гептан-7-карбальдегид
15,9 г (81 ммоль) 7-бромбицикло[2.2.1]гептана добавляли по каплям к 2 г магния (81 ммоль) в 25 мл диэтилового эфира, и кипятили с обратным холодильником в течение 2,5 ч. Смесь охлаждали до 0-5°С, и по каплям добавляли 6,3 мл (81 ммоль) ДМФА. Смесь затем кипятили с обратным холодильником в течение 2 ч, охлаждали до комнатной температуры, и белого твердое вещество отфильтровывали и промывали диэтиловым эфиром. Фильтрат упаривали, и получали 4,87 г белого твердого вещества. Промежуточное соединение использовали без дополнительной характеризации.
Пример 95
4-{2-Бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5.6-дифторбензоимидазол-1-ил]ацетиламино}бензойная кислота
Указанное в заголовке соединение получали аналогично примеру 7 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):536 (М+Н)+.
Пример 96
(транс-4-{2-Циклогексил-2-[5,6-дифтор-2-(2-метоксипиридин-3-ил)бензоимидазол-1-ил]ацетиламино}циклогексил)уксусная кислота
Указанное в заголовке соединение получали аналогично примеру 7 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):541 (М+Н)+.
Пример 97
4-[2-Циклогексил-2-(5,6-дифтор-2-п-толилбензоимидазол-1-ил)ацетиламино]бензойная кислота
Указанное в заголовке соединение получали аналогично примеру 7 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):504 (М+Н)+.
Пример 98
транс-4-[2-Циклогексил-2-(5,6-дифтор-2-п-толилбензоимидазол-1-ил)ацетиламино]циклогексанкарбоновая кислота
Указанное в заголовке соединение получали аналогично примеру 7 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):510 (М+Н)+.
Пример 99
(-)-4-[2-Циклогексил-2-(5,6-дифтор-2-п-толилбензоимидазол-1-ил)ацетиламино]бензойная кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Reprosil Chiral NR колонка), элюируя градиентом этанола (+0,5% уксусной кислоты)/гептан. MS (ES+):504 (М+Н)+.
Пример 100
(+)-транс-[2-Циклогексил-2-(5,6-дифтор-2-р-толилбензоимидазол-1-ил)ацетиламино]циклогексанкарбоновая кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Reprosil Chiral NR колонка), элюируя градиентом этанола (+0,5% уксусной кислоты)/гептан. MS (ES+):510 (М+Н)+.
Пример 101
транс-4-{2-Бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали аналогично примеру 7 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):542 (М+Н)+.
Пример 102
4-{2-Циклогексил-2-[5,6-дифтор-2-(4-метоксифенил)бензоимидазол-1-ил]ацетиламино}бензойная кислота
Указанное в заголовке соединение получали аналогично примеру 7 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):520 (М+Н)+.
Пример 103
(-)-транс-4-{2-Бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Reprosil Chiral NR колонка), элюируя градиентом этанол (+0,5% трифторуксусной кислоты)/гептан. MS (ES+):542 (М+Н)+.
Пример 104
транс-4-{2-Циклогексил-2-[5,6-дифтор-2-(4-метоксифенил)бензоимидазол-1-ил]ацетиламино}циклогексанкарбоновая кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Reprosil Chiral NR колонка), элюируя градиентом этанол (+0,5% трифторуксусной кислоты)/гептан. MS (ES+):526 (М+Н)+.
Пример 105
(-)-4-{2-Циклогексил-2-[5.6-дифтор-2-(4-метоксифенил)бензоимидазол-1-ил]ацетиламино}бензойная кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Chiralpak-AD колонка), элюируя градиентом этанол (+0,5% уксусной кислоты)/гептан. MS (ES-):518 (М-Н)-.
Пример 106
(транс-4-{2-Бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорФенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексил)уксусная кислота
Указанное в заголовке соединение получали аналогично примеру 7 после очистки препаративной ВЭЖХ с обратной фазой, элюируя градиентом ацетонитрил/вода. MS (ES+):556 (М+Н)+.
Пример 107
(-)-4-{2-Бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}бензойная кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Reprosil Chiral NR колонка), элюируя градиентом этанол (+0,5% уксусной кислоты)/гептан. MS (ES+):536 (М+Н)+.
Пример 108
(-)-(транс-4-{2-Бицикло[2.2.1]гепт-7-ил-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]ацетиламино}циклогексил)уксусная кислота
Указанное в заголовке соединение получали в соответствии с примером 7, проводя разделение стереоизомеров хиральной препаративной ВЭЖХ (Chiralpak AD колонка), элюируя градиентом этанол (+0,5% уксусной кислоты)/гептан. MS (ES+):556 (М+Н)+.
Пример 109
2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)фенил]ацетамид
Суспензию 0,13 г (0,25 ммоля) 2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-N-(4-цианофенил)-2-циклогексилацетамида, 0,17 г (1,26 ммоля) гидрохлорида триэтиламмония и 82 мг (1,26 ммоля) азида натрия в 3 мл орто-ксилола перемешивали при 145°C в течение 2,5 ч. Коричневую суспензию выливали в 1М водный раствор хлористоводородной кислоты и экстрагировали три раза этилацетатом. Объединенные органические слои сушили сульфатом магния, отфильтровывали и упаривали досуха. Остаток растворяли в ацетонитриле, и добавляли несколько капель воды, после чего осаждался осадок. Полученную суспензию отфильтровывали, и твердое вещество промывали ацетонитрилом, содержащим несколько капель воды с получением целевого соединения в виде белого твердого вещества (68%). MS (ES+):548,3 (М+Н).
Промежуточное соединение
2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-N-(4-цианофенил)-2-циклогексилацетамид
К суспензии 0,5 г (1,24 ммоля) [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты (пример 22, промежуточное соединение в) в 3 мл дихлорметана по каплям добавляли 0,01 мл (0,12 ммоля) N,N-диметилформамида, 0,13 мл (1,54 ммоля) оксалилхлорида при выделении газа. Полученный прозрачный светло-желтый раствор перемешивали в течение 1 ч при комнатной температуре, затем упаривали досуха, обрабатывали дважды 5 мл дихлорметана и снова упаривали досуха. Светло-желтое твердое вещество растворяли в 8 мл дихлорметана и добавляли по каплям к перемешиваемой смеси 0,13 г (1,24 ммоля) 4-аминобензонитрила и 0,46 мл (3,31 ммоля) триэтиламина в дихлорметане. После перемешивания в течение 3,75 ч прозрачный желтый раствор выливали в воду и экстрагировали дважды дихлорметаном. Органические слои промывали водой и насыщенным раствором хлорида натрия, сушили сульфатом магния, отфильтровывали, и после добавления силикагеля упаривали досуха. Очистка колоночной хроматографией на силикагеле, используя систему MPLC (CombiFlash Companion, Isco Inc.), элюируя градиентом от гептана до гептан/этилацетат (от 1:0 до 1:1 об/об) приводила к получению 0,45 г (81%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. MS (ES-):(М-Н):571,2.
Пример 110
2-[2-(4-Хлорфенил)-5.6-дифторбензоимидазол-1-ил]-N-[2-хлор-4-(1Н-тетразол-5-ил)фенил]-2-циклогексилацетамид
Указанное в заголовке соединение получали аналогично примеру 109 из N-(2-хлор-4-цианофенил)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетамида без использования воды для осаждения с получением целевого соединения в виде белого твердого вещества (85%). MS (ES-):580,1 (М-Н).
Промежуточное соединение
N-(2-Хлор-4-цианофенил)-2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексилацетамид
Указанное в заголовке соединение получали аналогично примеру 22, промежуточное соединение г), из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты и 4-амино-3-хлорбензонитрила с получением целевого соединения в виде белого твердого вещества (62%). MS (ES+):М-Н:539,2.
Пример 111
2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[2-фтор-4-(1H-тетразол-5-ил)фенил]ацетамид
Указанное в заголовке соединение получали аналогично примеру 109 из 2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-N-(4-циано-2-фторфенил)-2-циклогексилацетамида без использования воды для осаждения. Остаток суспендировали в ацетонитриле и кипятили с обратным холодильником, после чего образовывался раствор. После охлаждения до комнатной температуры вновь полученный осадок собирали фильтрацией, и ту же методику использовали второй раз с получением целевого соединения в виде беловатого твердого вещества (29%). MS (ES+):566,4 (М+Н).
Промежуточное соединение
2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-N-[-(4-циано-2-фторфенил)-2-циклогексилацетамид
Указанное в заголовке соединение получали аналогично примеру 22, промежуточное соединение г), из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты и 4-амино-3-фторбензонитрила, и используя градиент гептан:этилацетат (от 1:1 до 4:1) в качестве элюента. Указанный в заголовке продукт перекристаллизовывали из трет-бутилметилового эфира с получением 0,79 г (61%) белого твердого вещества (29%). MS (ES+):М+Н:523,2.
Примеры 112 и 113
Указанные в заголовке соединения получали разделением стереоизомеров 2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[2-фтор-4-(1Н-тетразол-5-ил)фенил]ацетамида хиральной препаративной ВЭЖХ (Reprosil Chiral-NR колонка).
(+ или -)-2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[2-фтор-4-(1Н-тетразол-5-ил)фенил]ацетамид
Бесцветное твердое вещество. MS (TS) m/e (М+Н)+: 566,4
(+или -)-2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[2-фтор-4-(ТН-тетразол-5-ил)фенил]ацетамид
Бесцветное твердое вещество. MS (TS) m/e (М+Н)+:566,4
Пример 114
2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид
Указанное в заголовке соединение получали аналогично примеру 109 из 2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-N-(4-циано-2-трифторметилфенил)-2-циклогексилацетамида без использования воды для осаждения. Бесцветное твердое вещество (87%). MS (TS) m/e (М+Н)+: 616,3.
Промежуточное соединение
2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-N-(4-циано-2-трифторметилфенил)-2-циклогексилацетамид
Указанное в заголовке соединение получали аналогично примеру 22, промежуточное соединение г), из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты и 4-амино-3-трифторметилбензонитрила. Соединение очищали с помощью системы MPLC (CombiFlash Companion, Isco Inc.), элюируя градиентом от гептана до н-гептан/этилацетат (от 1:0 до 4:1 об/об) и последующей очисткой препаративной ВЭЖХ, используя колонку Gemini и градиент ацетонитрил: вода (содержащий 0,5% муравьиной кислоты). Бесцветная пена (47%). MS (ES+): М+Н:573,2.
Примеры 115 и 116
Указанные в заголовке соединения получали разделением стереоизомеров 2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1H-тетразол-5-ил)-2-трифторметилфенил]ацетамида хиральной препаративной ВЭЖХ (Reprosil Chiral-NR колонка), используя смесь этанол (содержащего 0,01 М ацетата аммония):н-гептан (30:70 об/об).
(+)-2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1H-тетразол-5-ил)-2-трифторметилфенил]ацетамид
Бесцветное твердое вещество. MS (TS) m/e (М+Н)+:616,4
(-)-2-[2-(4-Хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид
Бесцветное твердое вещество. MS (TS) m/e (М+Н)+:616,4
Пример 117
2-[2-(4-Хлорфенил)бензоимидазол-1-ил]-2-циклогексил-N-[4-(1H-тетразол-5-ил)-2-трифторметилфенил]ацетамид
Указанное в заголовке соединение получали аналогично примеру 109 из 2-[2-(4-хлорфенил)бензоимидазол-1-ил]-N-(4-циано-2-трифторметилфенил)-2-циклогексилацетамида без использования воды для осаждения. Бесцветное твердое вещество (89%). MS (TS) m/e (М+Н)+:580,2.
Промежуточное соединение
2-[2-(4-Хлорфенил)бензоимидазол-1-ил]-N-(4-циано-2-трифторметилфенил)-2-циклогексилацетамид
Указанное в заголовке соединение получали аналогично примеру 22, промежуточное соединение г), из [2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]циклогексилуксусной кислоты и 4-амино-3-трифторметилбензонитрила. Соединение очищали препаративной ВЭЖХ, используя колонку Gemini и градиент ацетонитрил: вода (содержащий 0,5% муравьиной кислоты). Светло-коричневая пена (42%). MS (ES+):М+Н:537,3.
Примеры 118 и 119
Указанные в заголовке соединения получали разделением стереоизомеров 2-[2-(4-хлорфенил)-5,6-дифторбензоимидазол-1-ил]-2-циклогексил-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамида хиральной препаративной ВЭЖХ (Reprosil Chiral-NR колонка), используя смесь этанол (содержащего 0,01 М ацетата аммония):н-гептан (40:60 об/об).
(+)-2-[2-(4-Хлорфенил)бензоимидазол-1-ил]-2-циклогексил-N-[4-(1H-тетразол-5-ил)-2-трифторметилфенил]ацетамид
Бесцветное твердое вещество. MS (TS) m/e (М+Н)+:580,3
(-)-2-[2-(4-Хлорфенил)бензоимидазол-1-ил]-2-циклогексил-N-[4-(1H-тетразол-5-ил)-2-трифторметилфенил]ацетамид
Беловатое твердое вещество. MS (TS) m/e (М+Н)+:580,2
Пример 120
2-Циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-N-[2-фтор-4-(1Н-тетразол-5-ил)фенил]ацетамид
Указанное в заголовке соединение получали аналогично примеру 109 из N-(4-циано-2-фторфенил)-2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетамида. Сырой продукт очищали препаративной системой ВЭЖХ (Phenomenex Gemini колонка), используя градиент ацетонитрила и воды (содержащей 0,5% муравьиной кислоты). Беловатое твердое вещество (44%). MS (TS) m/e (М-Н)-:591,4.
Пример 121
2-Циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]-N-[4-(1Н-тетразол-5-ил)-2-трифторметилфенил]ацетамид
Указанное в заголовке соединение получали аналогично примеру 109 из N-(4-циано-2-трифторметилфенил)-2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетамида. Сырой продукт очищали системой препаративной ВЭЖХ (Phenomenex Gemini колонка), используя градиент ацетонитрила и воды (содержащей 0,5% муравьиной кислоты). Беловатое твердое вещество (36%). MS (TS) m/e (М-Н)-:641,2.
Промежуточное соединение
N-(4-Циано-2-трифторметилфенил)-2-циклогексил-2-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]ацетамид
Указанное в заголовке соединение получали аналогично примеру 22, промежуточное соединение г), из циклогексил-[2-(2,6-диметоксипиридин-3-ил)-5,6-дифторбензоимидазол-1-ил]уксусной кислоты и 4-амино-3-трифторметилбензонитрила. Сырой продукт очищали системой препаративной ВЭЖХ (Phenomenex Gemini колонка), используя градиент ацетонитрила и воды (содержащей 0,5% муравьиной кислоты). Светло-коричневая пена (19%). MS (TS) (М+Н+)+:600,3.
Пример А
Покрытые пленкой таблетки, содержащие следующие ингредиенты, могут быть получены обычным образом:
|
Активный ингредиент просеивали и смешивали с микрокристаллической целлюлозой, и смесь гранулировали с раствором поливинилпирролидона в воде. Гранулят смешивали с натрийгликолированным крахмалом и стеаратом магния, и спрессовывали с получением ядер 120 или 350 мг соответственно. Ядра покрывали водным раствором/суспензией указанного выше пленочного покрытия.
Пример Б
Капсулы, содержащие следующие ингредиенты, могут быть получены обычным образом:
|
Компоненты просеивали и смешивали, и наполняли в капсулы размера 2.
Пример В
Инъекционные растворы могут иметь следующий состав:
|
Активный ингредиент растворяли в смеси полиэтиленгликоля 400 и воды для инъекций (часть). Значение pH доводили до 5,0 уксусной кислотой. Объем доводили до 1,0 мл добавлением оставшегося количества воды. Раствор отфильтровывали, наполняли в сосуды с помощью специального оборудования и стерилизовали.
Пример Г
Мягкие желатиновые капсулы, содержащие следующие ингредиенты, могут быть получены обычным образом:
|
Активный ингредиент растворяли в теплом расплаве других ингредиентов, и смесь наполняли в мягкие желатиновые капсулы подходящего размера. Наполненные мягкие желатиновые капсулы обрабатывали в соответствии с обычными методиками.
Пример Д
Саше, содержащие следующие ингредиенты, могут быть получены обычным образом:
|
Активный ингредиент смешивали с лактозой, микрокристаллической целлюлозой и натрийкарбоксиметилцеллюлозой, и гранулировали со смесью поливинилпирролидона в воде. Гранулят смешивали со стеаратом магния и отдушками и наполняли в саше.