Результат интеллектуальной деятельности: ПРОИЗВОДНОЕ ХИНОЛОНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
Вид РИД
Изобретение
Настоящее изобретение относится к производному хинолона и фармацевтической композиции.
Уровень техники
Болезнь Паркинсона представляет собой хроническое, прогрессирующее нейродегенеративное заболевание, которое обычно развивается после среднего возраста. Первичные симптомы включают односторонний тремор в состоянии покоя, акинезию и ригидность. Тремор, акинезию и ригидность называют тремя основными признаками болезни Паркинсона, и причиной каждого из них является селективная гибель дофаминергических нейронов, проецирующихся из черной субстанции в стриатум. Этиология данной болезни до сих пор неизвестна, однако, собранные данные позволяют предположить, что нейродегенеративное расстройство запускается ослабленной энергогенерирующей системой вкупе с аномальной митохондриальной функцией нигростриарных дофаминергических нейронов. Предполагается, что митохондриальная дисфункция впоследствии вызывает окислительный стресс и недостаточность кальциевого гомеостаза, приводя, таким образом, к нейродегенерации (Ann. N. Y. Acad. Sci. 991:111-119(2003)).
Способы лечения болезни Паркинсона приблизительно подразделяют на лечебную тактику (лекарственная терапия) и хирургическую тактику (стереотаксическая операция). Из их числа лекарственная терапия является установившейся терапией и считается основным видом лечения. В лекарственной терапии для компенсирования нигростриарной дофаминергической нейрональной функции, измененной болезнью Паркинсона, используется симптоматический терапевтический агент. Наиболее превосходные терапевтические свойства проявляет леводопа. Говорят, что ни один агент не превосходит леводопу по эффективности. В настоящее время леводопа используется совместно с ингибитором дофадекарбоксилазы для предотвращения ее метаболизма на периферии, и были получены желаемые клинические эффекты.
Однако одним из недостатков лечения леводопой является то, что после нескольких лет лечения снижение продолжительности и стабильности эффективности данного лекарственного средства приводит к рецидиву двигательных нарушений, таких как дискинезия и суточные флуктуации. Кроме того, причиной беспокойства были побочные эффекты со стороны пищеварительной системы, такие как тошнота и рвота, вызванные избыточным высвобождением дофамина, проблемы с кровоснабжением органов, такие как ортостатическая гипотензия, тахикардия и аритмия, и неврологические проявления, такие как галлюцинации, бред и отвлекаемость.
Таким образом, с целью снижения дозировок препарата леводопа и, за счет этого, уменьшения его побочного действия, применяют комбинированную лекарственную терапию, в которой используется сочетание агонистов дофаминовых рецепторов, ингибиторов фермента метаболизма дофамина, релизера дофамина, антихолинергических агентов центрального действия и так далее. Подобные терапевтические достижения поразительно улучшают прогнозы, однако, даже в настоящее время отсутствуют фундаментальные способы лечения болезни Паркинсона и других нейродегенеративных заболеваний. Лекарственные препараты необходимо принимать в течение всей оставшейся жизни пациента, а упомянутые выше недостатки - пониженная эффективность в течение долговременного введения, побочные действия и неконтролируемое прогрессирование болезни - могут происходить по причине монотерапии леводопой. Кроме того, даже при использовании комбинированной лекарственной терапии трудно ожидать впечатляющих результатов.
Описание изобретения
Цель настоящего изобретения состоит в предоставлении нового соединения, которое обладает функциональным улучшающим эффектом и подавляет неврологическую дисфункцию за счет ингибирования хронического прогрессирования болезни Паркинсона или защиты дофаминовых нейронов от болезни этой этиологии, увеличивая, таким образом, продолжительность промежутка времени перед началом первого введения леводопы.
Авторами настоящего изобретения было проведено тщательное исследование для достижения вышеупомянутой цели и, в результате, им удалось получить соединение, представленное следующей общей формулой (1), которое включает защиту и улучшение митохондриальной функциональной активности, и защиту и восстановление активности нейронов. Настоящее изобретение было завершено на основании упомянутых вышеполученных данных.
В настоящем изобретении предоставлено производное хинолона, фармацевтическая композиция, содержащее указанное соединение, использование указанного соединения, способ лечения или предупреждения расстройства, и способ получения указанного соединения, описанные в приведенных ниже пунктах с 1 по 11.
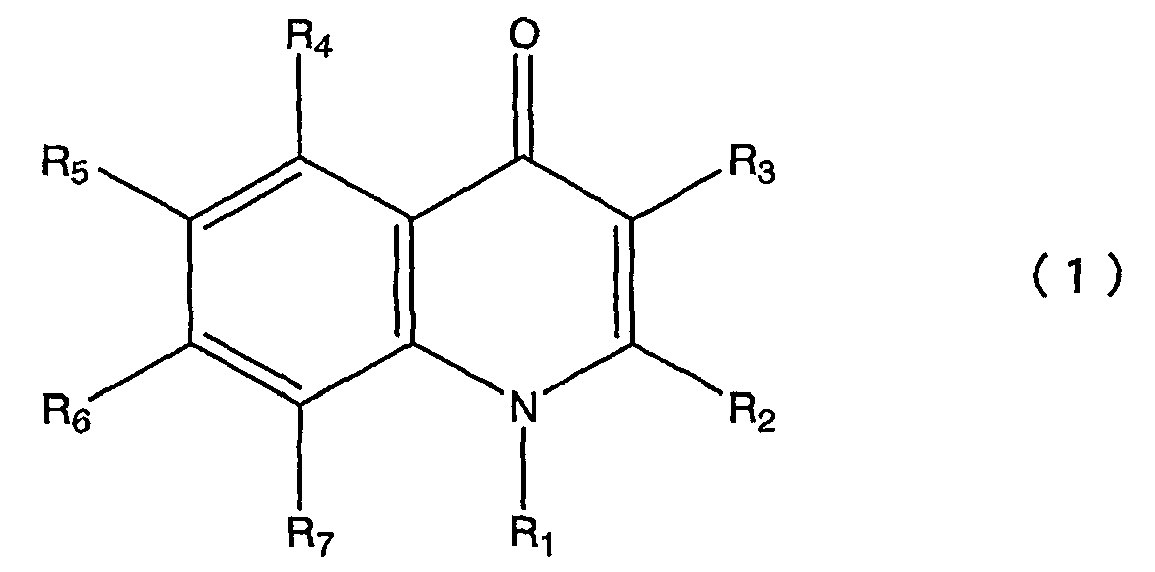
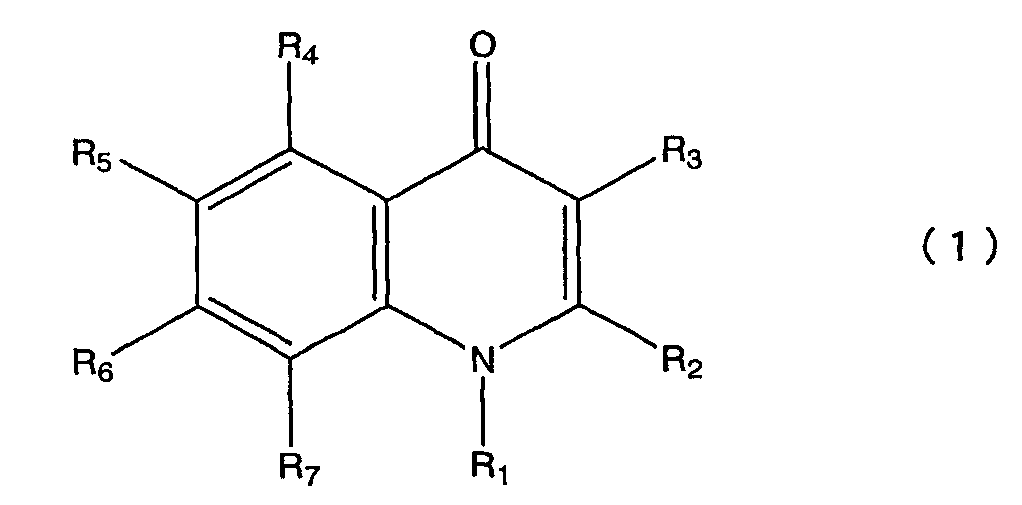
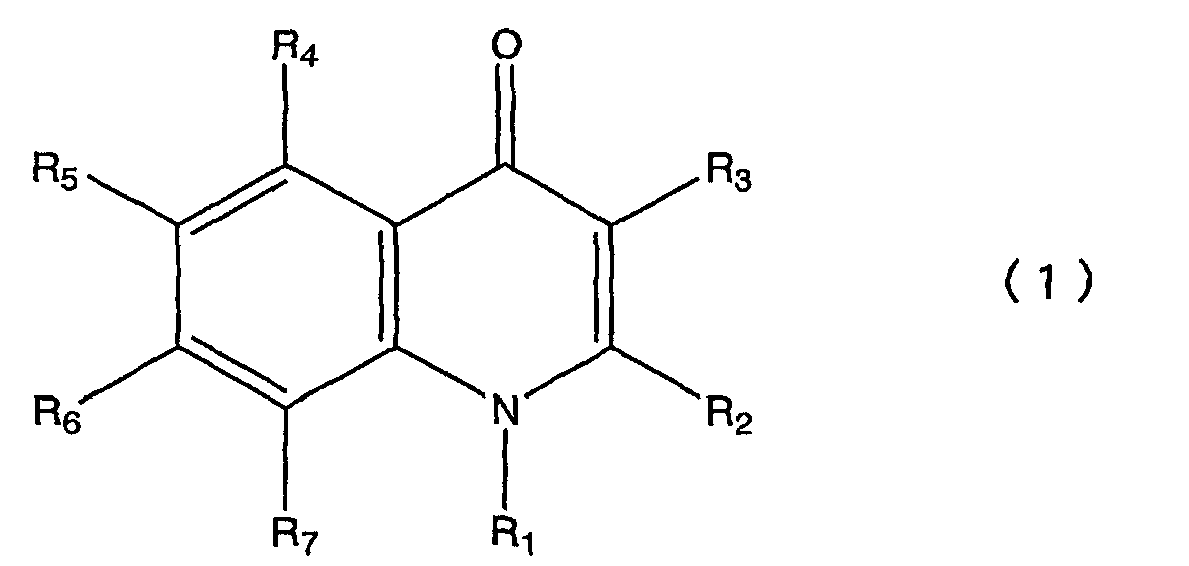
Пункт 1. Производное хинолона, представленное общей формулой (1)
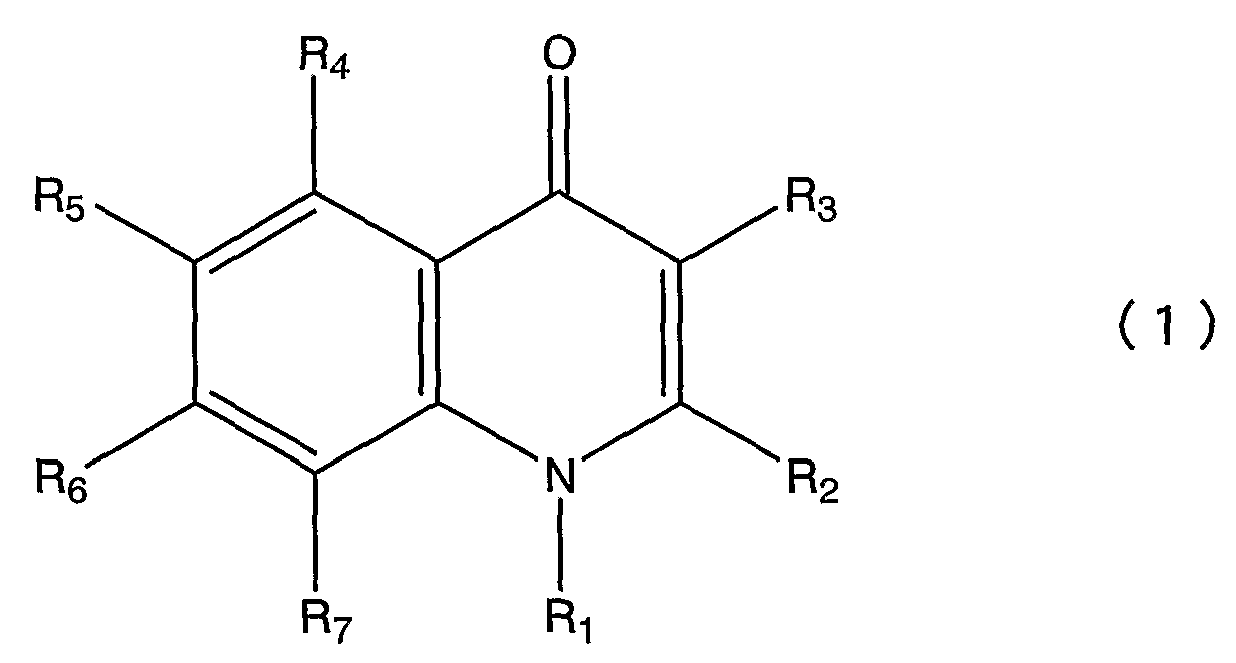
или его соль,
в которой R1 представляет атом водорода, низшую алкильную группу, цикло С3-8 алкил низшую алкильную группу или низшую алкокси низшую алкильную группу;
R2 представляет атом водорода, низшую алкильную группу или галогензамещенную низшую алкильную группу;
R3 представляет фенильную группу, фурильную группу, тиенильную группу или пиридильную группу, при этом каждая из этих групп необязательно замещена одной или более группами, выбранными из группы, состоящей из следующих с (1) по (16) в ароматическом или гетероциклическом кольце, представленном вышеуказанным R3;
(1) низшие алкильные группы,
(2) низшие алкокси-группы,
(3) галогензамещенные низшие алкокси-группы;
(4) фенокси-группа,
(5) низшие алкилтио-группы,
(6) гидрокси-группа,
(7) гидрокси низшие алкильные группы,
(8) атомы галогена,
(9) низшие алканоильные группы,
(10) низшие алкоксикарбонильные группы,
(11) амино-группы, необязательно замещенные одной или более низшими алкильными группами,
(12) карбамоильные группы, необязательно замещенные одной или более низшими алкильными группами,
(13) цикло С3-8 алкил низшие алкокси-группы,
(14) пирролидинилкарбонильные группы,
(15) морфолинилкарбонильные группы и
(16) карбоксильная группа;
R4 представляет атом галогена;
R5 представляет атом водорода или атом галогена;
R6 представляет атом водорода; и
R7 представляет любую из приведенных ниже групп с (1) по (15):
(1) гидрокси-группа,
(2) атом галогена,
(3) низшая алкокси-группа,
(4) галогензамещенная низшая алкокси-группа,
(5) гидрокси низшая алкокси-группа,
(6) низшая алкокси низшая алкокси-группа,
(7) амино-группа, необязательно замещенная одним или более членами, выбранными из группы, состоящей из низших алкильных групп, низших алкокси низших алкильных групп и цикло С3-8 алкильных групп,
(8) амино низшая алкокси-группа, необязательно замещенная по амино-группе одним или более членами, выбранными из группы, состоящей из низших алкильных групп, низших алканоильных групп, низших алкилсульфонильных групп и карбамоильных групп, необязательно замещенных одной или более низшими алкильными группами,
(9) цикло С3-8 алкокси-группа,
(10) цикло С3-8 алкил низшая алкокси-группа,
(11) тетрагидрофурил низшая алкокси-группа,
(12) низшая алкилтио-группа,
(13) гетероциклическая группа, выбранная из группы, состоящей из морфолинильных групп, пирролидинильных групп, фурильных групп, тиенильных групп и бензотиенильных групп,
(14) фенил низшая алкокси низшая алкокси-группа и
(15) пирролидинилкарбонильная группа.
Пункт 2. Производное хинолона общей формулы (1) или его соль по п.1,
в котором R1 представляет атом водорода или низшую алкильную группу;
R2 представляет атом водорода или низшую алкильную группу;
R3 представляет фенильную группу или пиридильную группу, при этом каждая из данных групп необязательно замещена одной или двумя группами, выбранными из группы, состоящей из следующих из (1), (2), (6) и (8) в ароматическом или гетероциклическом кольце, представленном вышеуказанным R3:
(1) низшие алкильные группы,
(2) низшие алкокси-группы,
(6) гидрокси-группа, и
(8) атомы галогена,
R4 представляет атом галогена;
R5 представляет атом водорода;
R6 представляет атом водорода; и
R7 представляет любую из приведенных ниже групп (3), (4) и (7):
(3) низшая алкокси-группа,
(4) галогензамещенная низшая алкокси-группа, и
(7) амино-группа, необязательно замещенная одной или двумя низшими алкильными группами.
Пункт 3. Производное хинолона общей формулы (1) или его соль по п.2, выбранное из группы, состоящей из:
5-фтор-3-(4-метоксифенил)-2-метил-8-пропокси-1Н-хинолин-4-он,
5-фтор-3-(4-метоксифенил)-1-метил-8-пропокси-1Н-хинолин-4-он,
3-(2,4-диметоксифенил)-5-фтор-8-пропокси-1Н-хинолин-4-он,
5-фтор-8-изопропокси-3-(4-метоксифенил)-1Н-хинолин-4-он,
3-(2,4-дихлорфенил)-5-фтор-8-пропокси-1Н-хинолин-4-он,
8-этокси-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он,
5-фтор-3-(4-метокси-2-метилфенил)-8-пропокси-1Н-хинолин-4-он,
5-фтор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-он,
5-фтор-3-(2-фтор-4-метоксифенил)-8-пропокси-1Н-хинолин-4-он,
5-фтор-3-(4-гидроксифенил)-8-пропокси-1Н-хинолин-4-он,
8-циклопропилметокси-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он,
5-фтор-8-пропокси-3-пиридин-4-ил-1Н-хинолин-4-он,
5-фтор-3-(4-метоксифенил)-8-(N-метил-N-пропиламино)-1Н-хинолин-4-он и
5-фтор-3-(4-метоксифенил)-8-(4,4,4-трифторбутокси)-1Н-хинолин-4-он.
Пункт 4. Фармацевтическая композиция, включающая производное хинолона общей формулы (1) или его соль по п.1, в качестве активного ингредиента, и фармацевтически приемлемый носитель.
Пункт 5. Профилактическое и/или терапевтическое средство для нейродегенеративных заболеваний, заболеваний, вызванных неврологической дисфункцией, или заболеваний, вызванных ухудшением функции митохондрии, включающий в качестве активного ингредиента производное хинолона общей формулы (1) или его соль по п.1.
Пункт 6. Профилактическое и/или терапевтическое средство по п.5, где нейродегенеративное заболевание выбирают из группы, состоящей из болезни Паркинсона, синдрома Паркинсона, юношеского паркинсонизма, стриатонигральной дегенерации, прогрессирующего супрануклеарного паралича, истинной акинезии, болезни Альцгеймера, болезни Пика, прионной болезни, кортикобазальной дегенерации, болезни диффузных телец Леви, болезни Хантингтона, хореи-акантоцитоза, доброкачественной наследственной хореи, пароксизмального хореоатетоза, эссенциального тремора, эссенциального миоклонуса, синдрома Туретта, синдрома Ретта, дегенеративного дрожания, лордотической дисбазии, атетоза, спастической кривошеи, синдрома Мейжа, церебрального паралича, болезни Вильсона, синдрома Сегавы, синдрома Халлервордена-Шпатца, нейроаксональной дистрофии, паллидумальной атрофии, спиноцеребеллярной дегенерации сетчатки, атрофии коры головного мозга, церебеллярной атрофии Холмса, оливопонтоцеребеллярной атрофии, наследственной оливопонтоцеребеллярной атрофии, болезни Джозефа, дентаторубро-паллидолюисовой атрофии, болезни Герстманна-Штраусслера-Шейнкера, атаксии Фридрейха, синдрома Русси-Леви, синдрома Мэя-Уайта, врожденной церебеллярной атаксии, наследственной эпизодической атаксии, атаксии-телеангиэктазии, бокового амиотрофического склероза, прогрессирующего бульбарного паралича, спинальной прогрессирующей мышечной атрофии, спинобульбарной мышечной атрофии, болезни Верднига-Хоффмана, болезни Кугельберга-Веландер, наследственного спастического парапареза, сирингомиелии, сирингобульбии, синдрома Арнольда-Киари, синдрома мышечной скованности, синдрома Клиппель-Фейля, синдрома Фацио-Лонде, низшей миелопатии, синдрома Дэнди-Уолкера, расщепление позвоночника, синдрома Съегрена-Ларссона, радиационной миелопатии, возрастной дегенерации желтого пятна и апоплексии мозга, выбранной из группы, состоящей из ишемического инсульта и кровоизлияния в мозг.
Пункт 7. Профилактическое и/или терапевтическое средство по п.5, где заболевание, вызванное неврологической дисфункцией, выбирают из группы, состоящей из травмы спинного мозга, вызванной химиотерапией невропатии, диабетической невропатии, радиационного поражения и демиелинизирующих заболеваний, выбранных из группы, состоящей из рассеянного склероза, острого диссеминированного энцефаломиелита, поперечного миелита, прогрессирующей многофокальной лейкоэнцефалопатии, подострого склерозирующего панэнцефалита, хронической воспалительной демиелинизирующей полиневропатии и синдрома Гиллена-Барре.
Пункт 8. Профилактическое и/или терапевтическое средство по п.5, где заболевание, вызванное ухудшением функции митохондрия, выбирают из группы, состоящей из синдрома Пирсона, диабета, глухоты, мигрени злокачественного течения, болезни Лебера, MELAS, MERRF, синдрома перехлеста MERRF/MELAS, NARP, истинной миопатии, митохондриальной кардиомиопатии, миопатии, слабоумия, желудочно-кишечной атаксии, сидеробластной приобретенной анемии, вызванной аминогликозидами потери слуха, недостаточности комплекса III вследствие наследственных вариантов цитохрома b, множественного симметричного липоматоза, атаксии, миоклонуса, ретинопатии, MNGIE, болезни ANT1, болезни Твинкла, болезни POLG, рецидивирующей миоглобинурии, SANDO, ARCO, недостаточности комплекса I, недостаточности комплекса II, атрофии зрительного нерва, фатальной детской недостаточности комплекса IV, недостаточности митохондриальной ДНК, синдрома недостаточности митохондриальной ДНК, энцефаломиелопатии Ли, синдрома хронической прогрессирующей наружной офтальмоплегии (CPEO), синдрома Керна-Сайра, энцефалопатии, лактацидемии, миоглобинурии, вызванных лекарственными препаратами митохондриальных заболеваний, шизофрении, большого депрессивного расстройства, I биполярного расстройства, II биполярного расстройства, смешанного приступа, дистимических расстройств, атипичной депрессии, сезонных аффективных расстройств, послеродовой депрессии, малой депрессии, рецидивирующего краткого депрессивного расстройства, стойкой депрессии/хронической депрессии, двойной депрессии и острой почечной недостаточности.
Пункт 9. Применение производного хинолона общей формулы (1) или его соли по п.1 в качестве лекарственного средства.
Пункт 10. Способ лечения или предупреждения нейродегенеративных заболеваний, заболеваний, вызванных неврологической дисфункцией, или заболеваний, вызванных ухудшением функции митохондрия, включающий введение человеку или животному производного хинолона общей формулы (1) или его соли по п.1.
Пункт 11. Способ получения производного хинолона общей формулы (1)

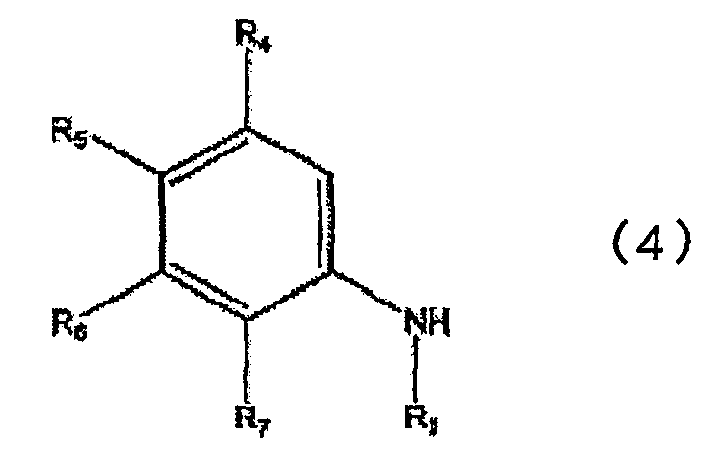
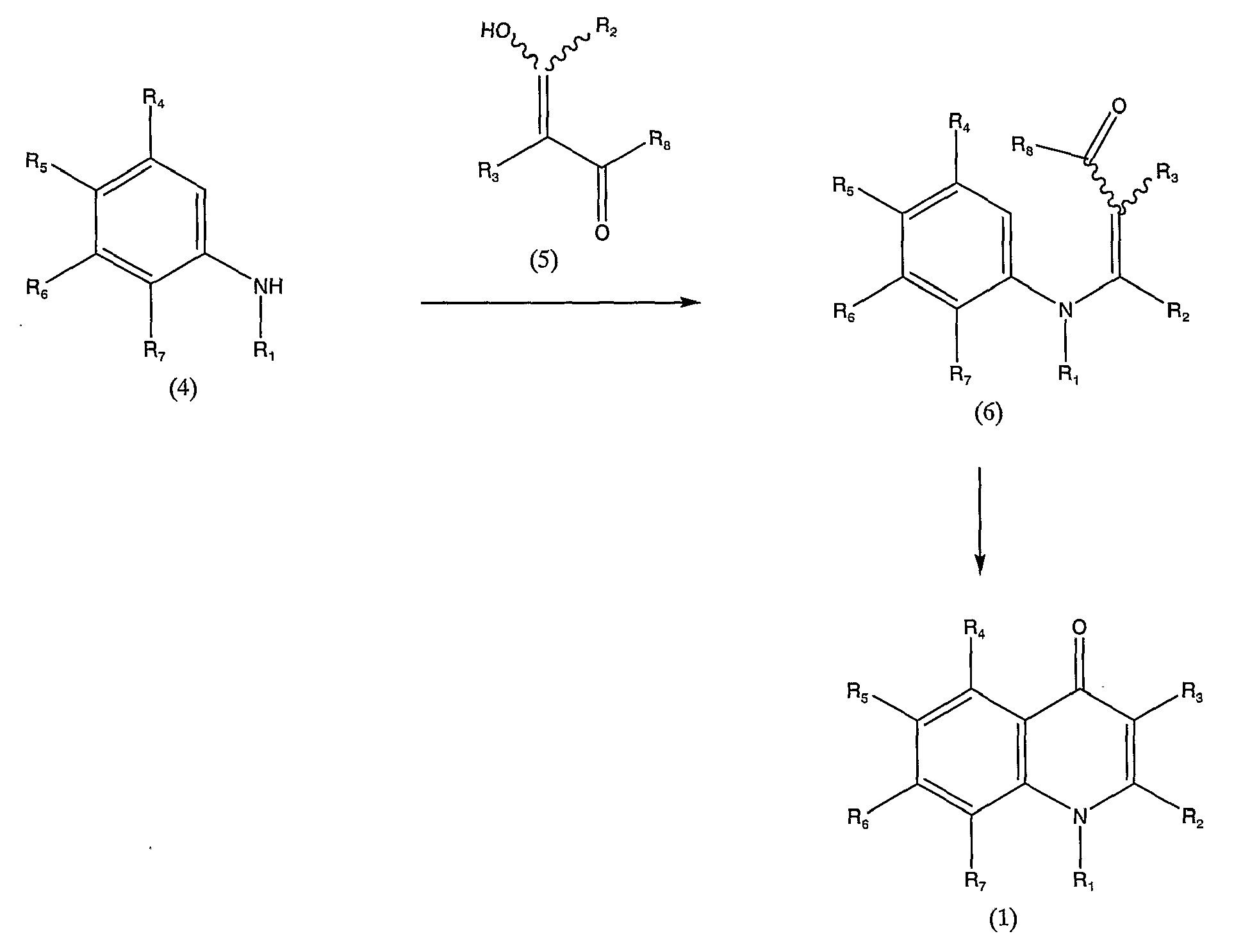
или его соли, в которой каждый из R1, R2, R3, R4, R5, R6 и R7 определен выше в п.1, включающий взаимодействие соединения, представленного общей формулой (4)
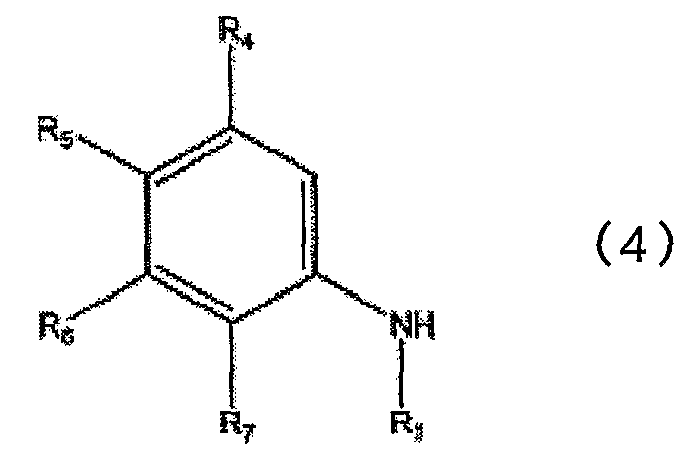
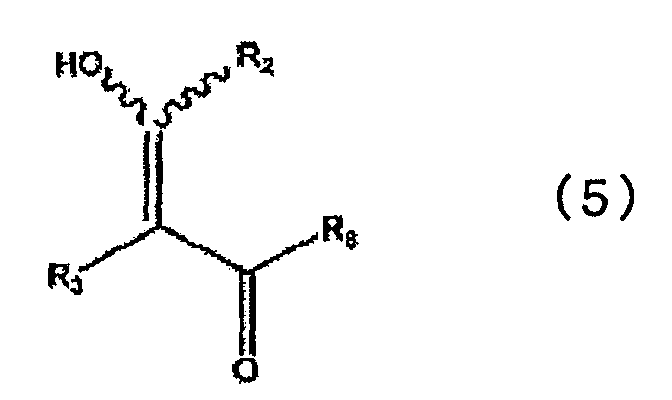
в которой каждый из R1, R4, R5, R6 и R7 определен выше в п.1, с соединением, представленным общей формулой (5)
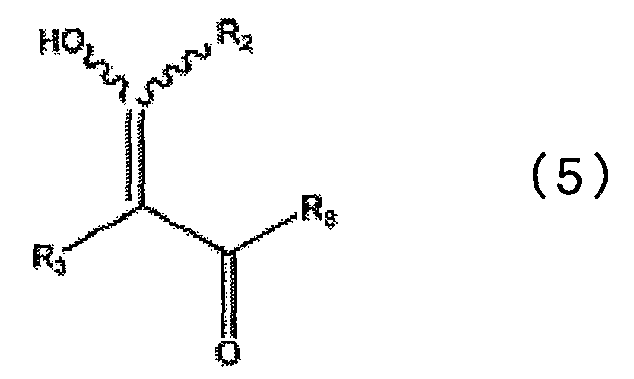
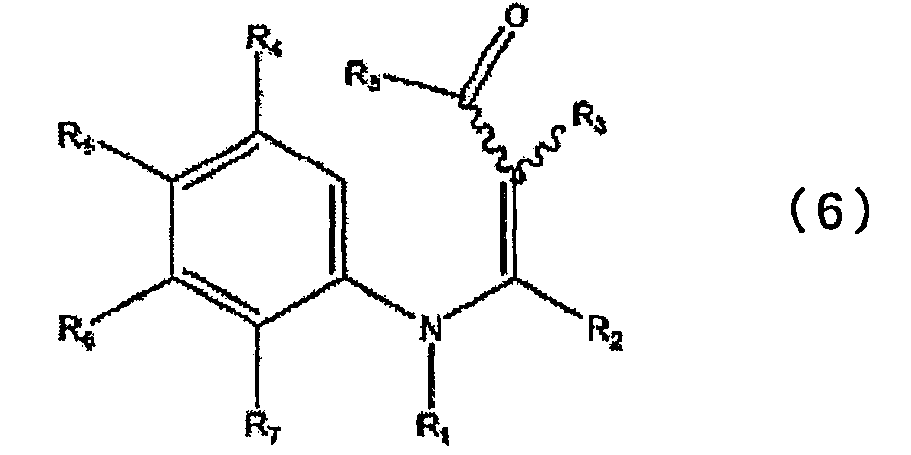
в которой каждый из R2 и R3 определен выше в п.1, и R8 представляет низшую алкокси-группу, с получением при этом промежуточного соединения, представленного общей формулой (6)
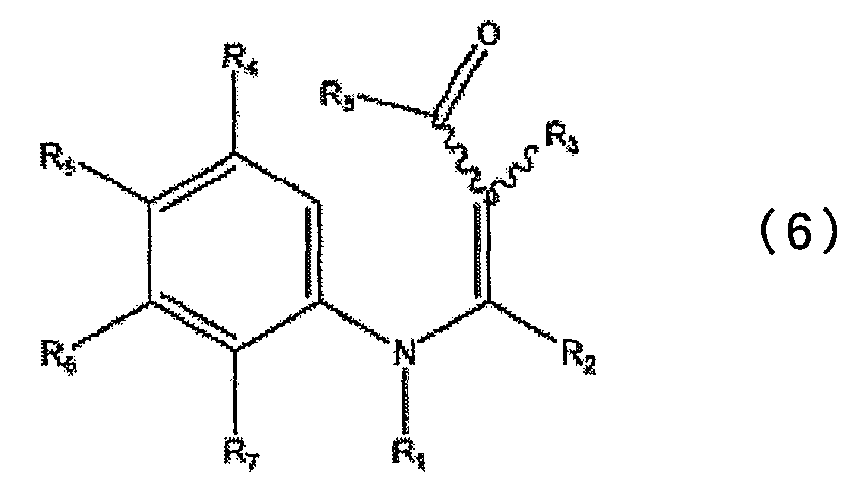
в которой каждый из R1, R2, R3, R4, R5, R6, R7 и R8 определен выше; и подвергая полученное соединение реакции циклизации.
Конкретные примеры групп в общей формуле (1) являются следующими.
Примеры низших алкильных групп включают линейные или разветвленные С1-6 (предпочтительно С1-4) алкильные группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, вторбутил, н-пентил, 1-этилпропил, изопентил, неопентил, н-гексил, 1,2,2-триметилпропил, 3,3-диметилбутил, 2-этилбутил, изогексил, 3-метилпентил и так далее.
Примеры С3-8 циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и так далее.
Примеры цикло С3-8 алкил низших алкильных групп включают низшие алкильные группы, замещенные одной-тремя (предпочтительно, одной) описанной выше цикло С3-8 алкильной группой(группами).
Примеры низших алкокси-групп включают линейные или разветвленные С1-6 (предпочтительно С1-4) алкокси-группы, такие как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси, вторбутокси, н-пентокси, изопентокси, неопентокси, н-гексилокси, изогексилокси, 3-метилпентокси и так далее.
Примеры низших алкокси низших алкильных групп включают низшие алкильные группы, замещенные одной-тремя (предпочтительно, одной) описанной выше низшей алкокси-группой(группами).
Примеры атомов галогена включают фтор, хлор, бром и йод.
Примеры галогензамещенных низших алкильных групп включают низшие алкильные группы, замещенные одним-семью атомом(атомами) галогена, предпочтительно одним-тремя атомом(атомами) галогена. Их примеры включают фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, бромметил, дибромметил, дихлорфторметил, 2,2-дифторэтил, 2,2,2-трифторэтил, пентафторэтил, 2-фторэтил, 2-хлорэтил, 3,3,3-трифторпропил, гептафторпропил, 2,2,3,3,3-пентафторпропил, гептафторизопропил, 3-хлорпропил, 2-хлорпропил, 3-трибромпропил, 4,4,4-трифторбутил, 4,4,4,3,3-пентафторбутил, 4-хлорбутил, 4-бромбутил, 2-хлорбутил, 5,5,5-трифторпентил, 5-хлорпентил, 6,6,6-трифторгексил, 6-хлоргексил, перфторгексил и так далее.
Примеры галогензамещенных низших алкокси-групп включают низшие алкокси-группы, замещенные одним-семью атомом(атомами) галогена, предпочтительно одним-тремя атомом(атомами) галогена. Их примеры включают фторметокси, дифторметокси, трифторметокси, хлорметокси, дихлорметокси, трихлорметокси, бромметокси, дибромметокси, дихлорфторметокси, 2,2,2-трифторэтокси, пентафторэтокси, 2-хлорэтокси, 3,3,3-трифторпропокси, гептафторпропокси, гептафторизопропокси, 3-хлорпропокси, 2-хлорпропокси, 3-бромпропокси, 4,4,4-трифторбутокси, 4,4,4,3,3-пентафторбутокси, 4-хлорбутокси, 4-бромбутокси, 2-хлорбутокси, 5,5,5-трифторпентокси, 5-хлорпентокси, 6,6,6-трифторгексилокси, 6-хлоргексилокси и так далее.
Примеры низших алкилтио-групп включают алкилтио-группы, в которых алкильный фрагмент представляет упомянутую выше низшую алкильную группу.
Примеры гидрокси низших алкильных групп включают упомянутые выше низшие алкильные группы, замещенные одной-тремя (предпочтительно одной) гидроксильной группой(группами).
Примеры низших алканоильных групп включают линейные или разветвленные С1-6 (предпочтительно С1-4) алканоильные группы, такие как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, трет-бутилкарбонил, гексаноил и так далее.
Примеры низших алкоксикарбонильных групп включают алкоксикарбонильные группы, в которых алкоксильный фрагмент представляет упомянутую выше низшую алкокси-группу.
Примеры амино-групп, необязательно замещенных одной или более низшими алкильными группами, включают амино-группы, необязательно замещенные одной или двумя низшей алкильной группой(группами), описанными выше.
Примеры карбамоильных групп, необязательно замещенных одной или более низшими алкильными группами, включают карбамоильные группы, необязательно замещенные одной или двумя низшей алкильной группой(группами), описанными выше.
Примеры цикло С3-8 алкил низших алкильных групп включают упомянутые выше низшие алкильные группы, замещенные одной-тремя (предпочтительно одной) цикло С3-8 алкильной группой(группами), описанными выше.
Примеры гидрокси низших алкокси-групп включают упомянутые выше низшие алкокси-группы, замещенные одной-тремя (предпочтительно, одной) гидроксильной группой(группами).
Примеры низших алкокси низших алкокси-групп включают упомянутые выше низшие алкокси-группы, замещенные одной-тремя (предпочтительно, одной) низшей алкокси-группой(группами), описанными выше.
Примеры амино-групп, необязательно замещенных одним или более членами, выбранными из группы, состоящей из низших алкильных групп, низших алкокси низших алкильных группыи цикло С3-8 алкильных групп, включают амино-группы, необязательно замещенные одним или двумя членами, выбранными из группы, состоящей из упомянутых выше низших алкильных групп, упомянутых выше низших алкокси низших алкильных групп и упомянутых выше цикло С3-8 алкильных групп.
Примеры низших алкилсульфонильных групп включают алкилсульфонильные группы, в которых алкильный фрагмент представляет упомянутую выше низшую алкильную группу.
Примеры амино низших алкокси-групп, необязательно замещенных по амино-группе одним или более членами, выбранными из группы, состоящей из низших алкильных групп, низших алканоильных групп, низших алкилсульфонильных групп и карбамоильных групп, необязательно замещенных одной или более низшими алкильными группами, включают низшие алкокси-группы, замещенные одной-тремя (предпочтительно одной) амино-группой(группами). В настоящем описании амино низшая алкокси-группа необязательно замещена по амино-группе одним или двумя членами, выбранными из группы, состоящей из упомянутых выше низших алкильных групп, упомянутых выше низших алканоильных групп, упомянутых выше низших алкилсульфонильных групп, карбамоильных групп, необязательно замещенных одной или более низшими алкильными группами, упомянутыми выше.
Примеры цикло С3-8 алкокси-групп включают группы, в которых цикло С3-8 алкильная группа и атом кислорода связаны между собой.
Примеры тетрагидрофурильных низших алкокси-групп включают упомянутые выше низшие алкокси-группы, замещенные одной-тремя (предпочтительно одной) тетрагидрофурильной группой(группами).
Примеры низших алкилтио-групп включают алкилтио-группы, в которых алкильный фрагмент представляет упомянутую выше низшую алкильную группу.
Примеры фенильных низших алкокси-групп включают упомянутые выше низшие алкокси-группы, замещенные одной-тремя (предпочтительно одной) фенильной группой(группами).
Примеры фенильных низших алкокси низших алкокси-групп включают упомянутые выше низшие алкокси-группы, замещенные одной-тремя (предпочтительно одной) фенильной низшей алкокси-группой(группами).
Способ получения соединения данного изобретения подробно описан ниже.
Производное хинолона, представленное общей формулой (1) (в дальнейшем называемое также соединением (1)), можно получить различными способами; например, способом по следующей схеме реакции 1 или 2.
Схема реакции 1
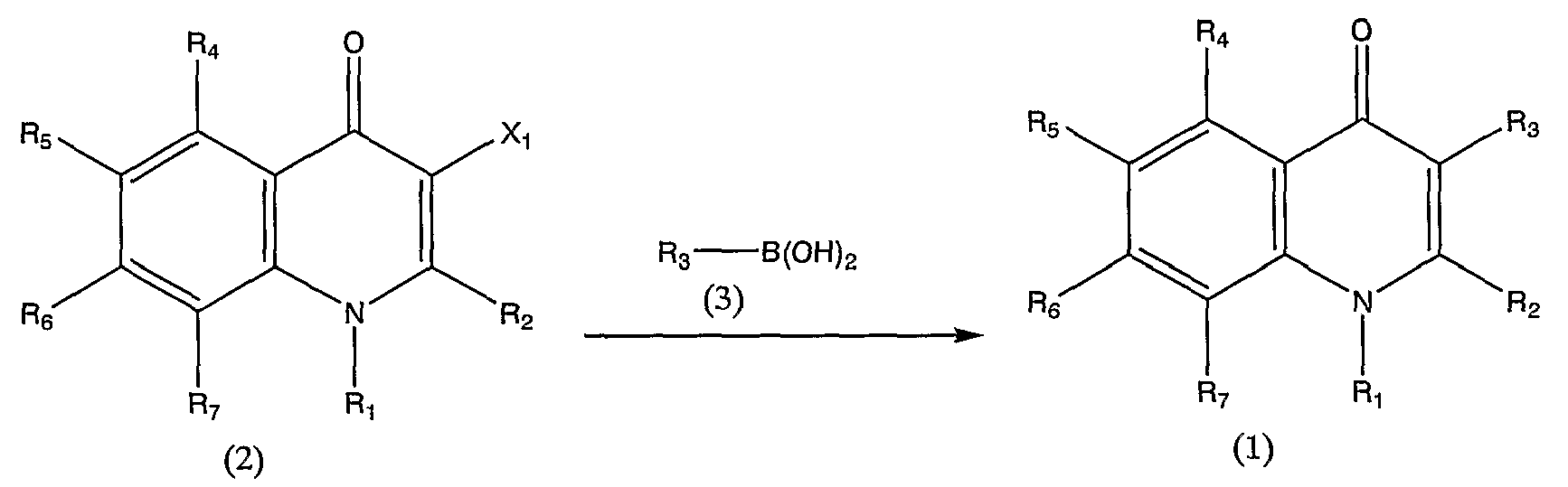
в которой R1, R2, R3, R4, R5, R6 и R7 аналогичны определенным выше, и Х1 представляет атом галогена.
Примеры атомов галогена, представленных Х1, включают фтор, хлор, бром и йод.
Предпочтительно, уходящие группы в данной реакции включают галоген. Из их числа особенно предпочтителен йод.
Соединение (1) можно получить вводя во взаимодействие соединение общей формулы (2) и соединение общей формулы (3) в инертном растворителе или без использования каких-либо растворителей, в присутствии или в отсутствие основного соединения, в присутствии палладиевого катализатора.
Примеры инертных растворителей включают воду, растворители на основе простых эфиров, такие как диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, диметиловый эфир диэтиленгликоля и диметиловый эфир этиленгликоля; растворители на основе ароматических углеводородов, такие как бензол, толуол и ксилол; растворители на основе низших спиртов, такие как метанол, этанол и изопропанол; растворители на основе кетонов, такие как ацетон и метилэтилкетон; и полярные растворители, такие как N,N-диметилформамид (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамид и ацетонитрил. Данные инертные растворители можно использовать по отдельности или в виде сочетания двух или более из них.
Используемые в данной реакции соединения палладия особенно не ограничены, но включают, например, катализаторы на основе четырехвалентного палладия, такие как тетрагидрат гексахлорпалладата(IV) натрия и гексахлорпалладат(IV) калия, катализаторы на основе двухвалентного палладия, такие как хлорид палладия(II), бромид палладия(II), ацетат палладия(II), ацетилацетонат палладия(II), дихлорбис(бензонитрил)палладий(II), дихлорбис(ацетонитрил)палладий(II), дихлорбис(трифенилфосфин)палладий(II), дихлортетраамин палладия(II), дихлорбис(циклоокта-1,5-диен)палладий(II), трифторацетат палладия(II) и комплекс 1,1'-бис(дифенилфосфино)ферроцен дихлорпалладия(II) с дихлорметаном, катализаторы на основе нульвалентного палладия, такие как трис(дибензилиденацетон)2палладий(0), комплекс трис(дибензилиденацетон)2палладия(0) с хлороформом и тетракис(трифенилфосфин)палладий(0) и так далее. Данные палладиевые катализаторы можно использовать по отдельности или в виде сочетания двух или более из них.
В данной реакции количество палладиевого катализатора особенно не ограничено, но обычно оно находится в интервале от 0,000001 до 20 моль из расчета на палладий относительно 1 моль соединения (2). Количество палладиевого катализатора предпочтительно находится в интервале от 0,0001 до 5 моль из расчета на палладий относительно 1 моль соединения (2).
Данная реакция протекает преимущественно в присутствии подходящего лиганда. Примеры лигандов палладиевого катализатора включают, например, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINAP), три-о-толилфосфин, бис(дифенилфосфино)ферроцен, трифенилфосфин, три-трет-бутилфосфин и 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (XANTPHOS). Данные лиганды используют по отдельности или в виде сочетания двух или более из них.
Соотношение палладиевого катализатора и лиганда особенно не ограничено. Количество лиганда составляет от около 0,1 до около 100 моль на моль палладиевого катализатора, и предпочтительно от около 0,5 до около 15 моль на моль палладиевого катализатора.
В качестве основных соединений можно использовать различные известные неорганические и органические основания.
Неорганические основания включают, например, гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия, гидроксид цезия и гидроксид лития, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия и карбонат лития; гидрокарбонаты щелочных металлов, такие как гидрокарбонат лития, гидрокарбонат натрия и гидрокарбонат калия; щелочные металлы, такие как натрий и калий; фосфаты, такие как фосфат натрия и фосфат калия; амиды, такие как амид натрия, и гидриды щелочных металлов, такие как гидрид натрия и гидрид калия.
Органические основания включают, например, низшие алкоголяты щелочных металлов, такие как метилат натрия, этилат натрия, трет-бутилат натрия, метилат калия, этилат калия и трет-бутилат калия, и амины, такие как триэтиламин, трипропиламин, пиридин, хинолин, пиперидин, имидазол, N-этилдиизопропиламин, диметиламинопиридин, триметиламин, диметиланилин, N-метилморфолин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0]ундец-5-ен (DBU), 1,4-диазабицикло[2.2.2]октан (DABCO) и так далее.
Подобные основные соединения можно использовать по отдельности или в виде сочетания двух или более из них. Более предпочтительные основные соединения, используемые в данной реакции, включают карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия и карбонат лития.
Основное соединение обычно используют в количестве от 0,5 до 10 моль на моль соединения (2) и предпочтительно от 0,5 до 6 моль на моль соединения (2).
Соединение (3) обычно используют в количестве, по меньшей мере, около 1 моль на моль соединения (2), и предпочтительно от около 1 до около 5 моль на моль соединения (2).
Данную реакцию можно проводить при нормальном давлении в атмосфере инертного газа, включая азот, аргон и так далее, или при повышенном давлении.
Реакция обычно протекает при температуре от комнатной до 200°С, и предпочтительно при температуре от комнатной до 150°С, и обычно завершается в течение от около 1 до около 30 часов. Реакцию также доводят до конца нагреванием при температуре от 100 до 200°С в течение от 5 минут до 1 часа с использованием реактора с микроволновым излучением.
Соединение, представленное общей формулой (3), используемое в качестве исходного соединения в схеме реакции 1, представляет легкодоступное описанное соединение. Соединение, представленное общей формулой (2), включает новое соединение, и данное соединение получают по представленной ниже схеме реакции 6.
Схема реакции 2
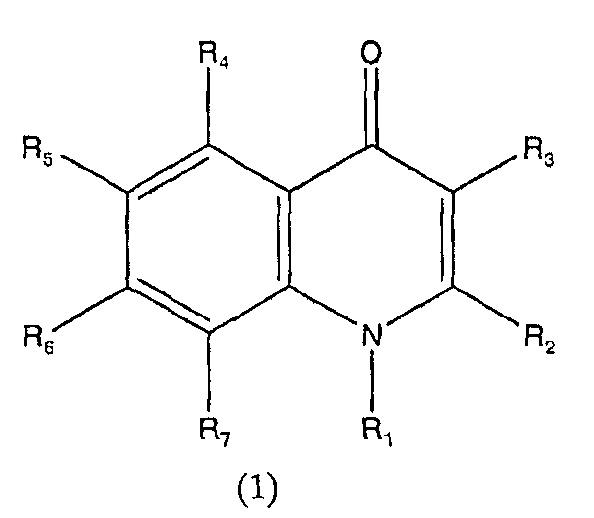
в которой R1, R2, R3, R4, R5, R6 и R7 аналогичны определенным выше, и R8 представляет низшую алкокси-группу.
Низшая алкокси-группа, представленная R8 в общей формуле (5), имеет определение, аналогичное описанному выше.
Соединения, представленные общими формулами (4) и (5), вводят во взаимодействие в инертном растворителе или без использования каких-либо растворителей, в присутствии или в отсутствие кислого катализатора, получая в результате промежуточное соединение, представленное общей формулой (6). После этого полученное соединение циклизуют, получая соединение, представленное общей формулой (1).
Примеры инертных растворителей включают воду; растворители на основе простых эфиров, такие как диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, диметиловый эфир диэтиленгликоля и диметиловый эфир этиленгликоля; растворители на основе ароматических углеводородов, такие как бензол, толуол и ксилол; растворители на основе низших спиртов, такие как метанол, этанол и изопропанол; и полярные растворители, такие как N,N-диметилформамид (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамид и ацетонитрил. Данные инертные растворители можно использовать по отдельности или в виде сочетания двух или более из них.
Можно использовать любые типы известных кислых катализаторов, включая толуолсульфокислоту, метансульфокислоту, ксилолсульфокислоту, серную кислоту, ледяную уксусную кислоту, трехфтористый бор, кислотные ионообменные смолы и так далее. Данные кислые катализаторы можно использовать по отдельности или в виде сочетания двух или более из них.
Из числа подобных кислот предпочтительно используют кислотные ионообменные смолы. Примеры кислотных ионообменных смол включают имеющиеся в продаже полимерные катионообменные смолы, такие как Lewatit S100, Zeo-karb 225, Dowex 50, Amberlit IR120 или Amberlyst 15 и подобные полимеры стиролсульфокислот; Lewatit PN, Zeo-karb 215 или 315 и подобные конденсаты полисульфокислот; Lewatit CNO, Duolit CS100 и подобные смолы на основе м-фенолкарбоновых кислот; или Permutit C, Zeo-karb 226 или Amberlite IRC 50 и подобные полиакрилаты. Из их числа особенно предпочтителен Amberlyst 15.
Оксидный катализатор обычно используют в количестве от 0,0001 до 100 моль на моль соединения (4), и предпочтительно от 0,5 до 6 моль на моль соединения (4).
В схеме реакции 2 соединение (5) обычно используют в количестве, по меньшей мере, около 1 моль на соединения (4), и предпочтительно от около 1 до около 5 моль на моль соединения (4).
Данную реакцию можно проводить при нормальном давлении в атмосфере инертного газа, включая азот, аргон и так далее, или при повышенном давлении.
Реакция обычно протекает при температуре от комнатной до 200°С, и предпочтительно при температуре от комнатной до 150°С. В ходе реакции проводят азеотропную отгонку воды до тех пор, пока выделение воды в ходе реакции не прекратится. Реакция обычно завершается в течение от около 1 до около 30 часов.
Способ получения соединения общей формулы (1) реакцией циклизации промежуточного соединения, представленного общей формулой (6), можно применять, нагревая данное соединение в растворителе, таком как дифениловый эфир, или нагревая данное соединение в отсутствие растворителя. Реакцию проводят при температуре от 150 до 300°С в течение от 5 минут до 2 часов.
Соединение, представленное общей формулой (4), используемое в качестве исходного вещества в описанной выше схеме реакции 2, представляет известное соединение или может быть легко получено из известного соединения. Соединение, представленное общей формулой (5), включает новое соединение, и данное соединение получают, например, в соответствии со способами, представленными на описанных выше схеме реакции 4 и схеме реакции 5.
Схема реакции 3
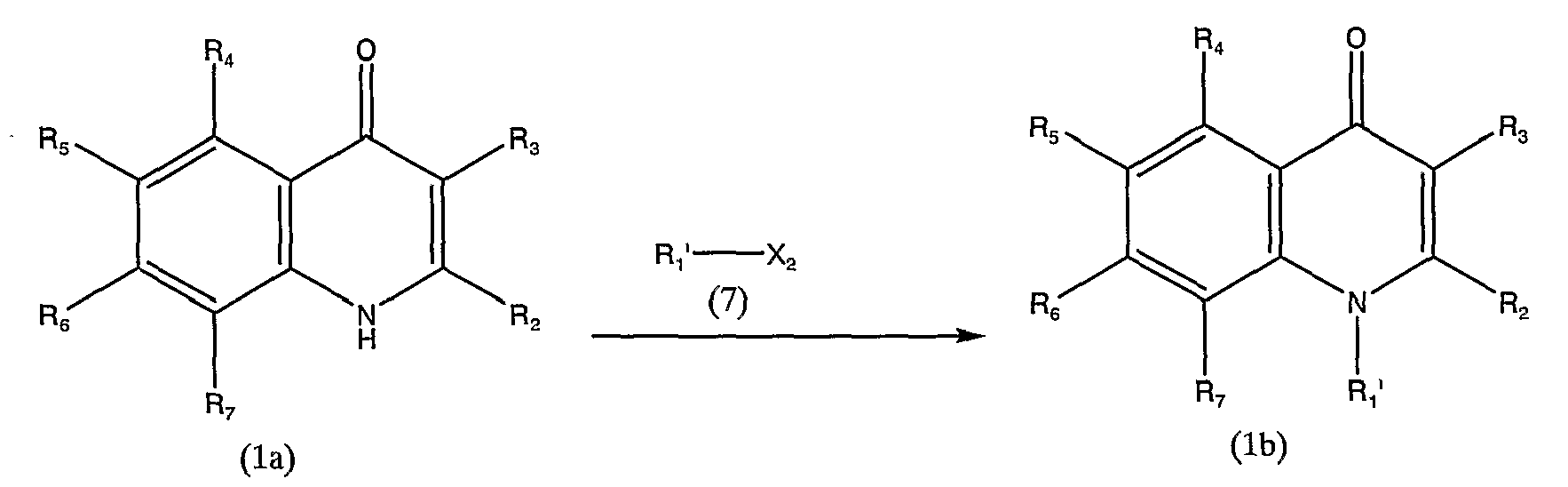
в которой R2, R3, R4, R5, R6 и R7 аналогичны определенным выше, и R1' представляет группу, представленную R1, отличающуюся от водорода, и Х2 представляет группу, которая подвергается той же реакции замещения, что и реакция замещения галогена, или атома галогена.
Галогены, представленные Х2 в общей формулы (1а), включают описанный выше атом галогена. Группы, которые подвергаются той же реакции замещения, что и реакция замещения атомов галогена, представленных Х2, включают низшие алкилсульфонилокси-группы, арилсульфонилокси-группы, аралкилсульфонилокси-группы и так далее.
Примеры низших алкилсульфонилокси-групп включают линейные или разветвленные С1-6 алкилсульфонилокси-группы, такие как метансульфонилокси, этансульфонилокси, н-пропансульфонилокси, изопропансульфонилокси, н-бутансульфонилокси, трет-бутансульфонилокси, н-пентансульфонилокси и н-гексансульфонилокси.
Примеры арилсульфонилокси-групп включают нафтилсульфонилокси и фенилсульфонилокси, необязательно содержащие в фенильном кольце в качестве заместителя от одной до трех группы(групп), выбранных из группы, состоящей из линейных или разветвленных С1-6 алкильных групп, линейных или разветвленных С1-6 алкокси-групп, нитро-групп и атомов галогена. Примеры фенилсульфонилокси-групп, необязательно замещенных упомянутым выше заместителем(ями), включают фенилсульфонилокси, 4-метилфенилсульфонилокси, 2-метилфенилсульфонилокси, 4-нитрофенилсульфонилокси, 4-метоксифенилсульфонилокси, 2-нитрофенилсульфонилокси, 3-хлорфенилсульфонилокси и так далее. Примеры нафтилсульфонилокси-групп включают α-нафтилсульфонилокси, β-нафтилсульфонилокси и так далее.
Примеры аралкилсульфонилокси-групп включают фенилзамещенные линейные или разветвленные С1-6 алкилсульфонилокси-группы, которые могут содержать в фенильном кольце в качестве заместителя от одного до трех заместителя(заместителей), выбранных из группы, включающей линейные или разветвленные С1-6 алкильные группы, линейные или разветвленные С1-6 алкокси-группы, нитро-группу и атомы галогена, или нафтилзамещенные линейные или разветвленные С1-6 алкилсульфонилокси-группы. Примеры алкилсульфонилокси-групп, замещенных упомянутой выше фенильной группой(группами), включают бензилсульфонилокси, 2-фенилэтилсульфонилокси, 4-фенилбутилсульфонилокси, 4-метилбензилсульфонилокси, 2-метилбензилсульфонилокси, 4-нитробензилсульфонилокси, 4-метоксибензилсульфонилокси, 3-хлорбензилсульфонилокси и так далее. Примеры алкилсульфонилокси-групп, замещенных упомянутой выше нафтильной группой(группами), включают α-нафтилметилсульфонилокси, β-нафтилметилсульфонилокси и так далее.
Соединение, представленное общей формулой (1b), можно получить взаимодействием соединения, представленного общей формулой (1а), с соединением, представленным общей формулой (7), в инертном растворителе или без использования каких-либо растворителей, в присутствии или в отсутствие основного соединения.
Примеры инертных растворителей включают воду; растворители на основе простых эфиров, такие как диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, диметиловый эфир диэтиленгликоля и диметиловый эфир этиленгликоля; растворители на основе ароматических углеводородов, такие как бензол, толуол и ксилол; растворители на основе низших спиртов, такие как метанол, этанол и изопропанол; растворители на основе кетонов, такие как ацетон и метилэтилкетон; и полярные растворители, такие как N,N-диметилформамид (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамид и ацетонитрил. Данные инертные растворители можно использовать по отдельности или в виде сочетания двух или более из них.
В качестве основных соединений можно использовать различные известные неорганические основания и органические основания.
Неорганические основания включают, например, гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия, гидроксид цезия и гидроксид лития, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия и карбонат лития; гидрокарбонаты щелочных металлов, такие как гидрокарбонат лития, гидрокарбонат натрия и гидрокарбонат калия; щелочные металлы, такие как натрий и калий; амиды, такие как амид натрия, и гидриды щелочных металлов, такие как гидрид натрия и гидрид калия.
Органические основания включают, например, низшие алкоголяты щелочных металлов, такие как метилат натрия, этилат натрия, трет-бутилат натрия, метилат калия, этилат калия и трет-бутилат калия, и амины, такие как триэтиламин, трипропиламин, пиридин, хинолин, пиперидин, имидазол, N-этилдиизопропиламин, диметиламинопиридин, триметиламин, диметиланилин, N-метилморфолин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0]ундец-5-ен (DBU), 1,4-диазабицикло[2.2.2]октан (DABCO) и так далее.
Подобные основные соединения можно использовать по отдельности или в виде сочетания двух или более из них. Более предпочтительные основные соединения, используемые в данной реакции, включают неорганические основания, такие как гидрид натрия и гидрид калия.
Основное соединение обычно используют в количестве от 0,5 до 10 моль на моль соединения (1а), и предпочтительно от 0,5 до 6 моль на моль соединения (1а).
В схеме реакции 1 соединение (7) обычно используют в количестве, по меньшей мере, около 1 моль на соединения (1а), и предпочтительно от около 1 до около 5 моль на моль соединения (1а).
Данную реакцию можно проводить при нормальном давлении в атмосфере инертного газа, включая азот, аргон и так далее, или при повышенном давлении.
Реакция обычно протекает при температуре от 0°С до 200°С, и предпочтительно при температуре от комнатной до 150°С, и обычно завершается в течение от около 1 до около 30 часов.
Соединение, представленное общей формулой (7), которое используют в качестве исходного вещества в описанной выше схеме реакции 3, представляет легкодоступное известное соединение.
Соединение (5) и соединение (2), являющиеся исходными веществами для соединения изобретения, включают новые соединения и могут быть получены различными способами, например, способами в соответствии со следующими схемами реакций с 4 по 6.
Схема реакции 4
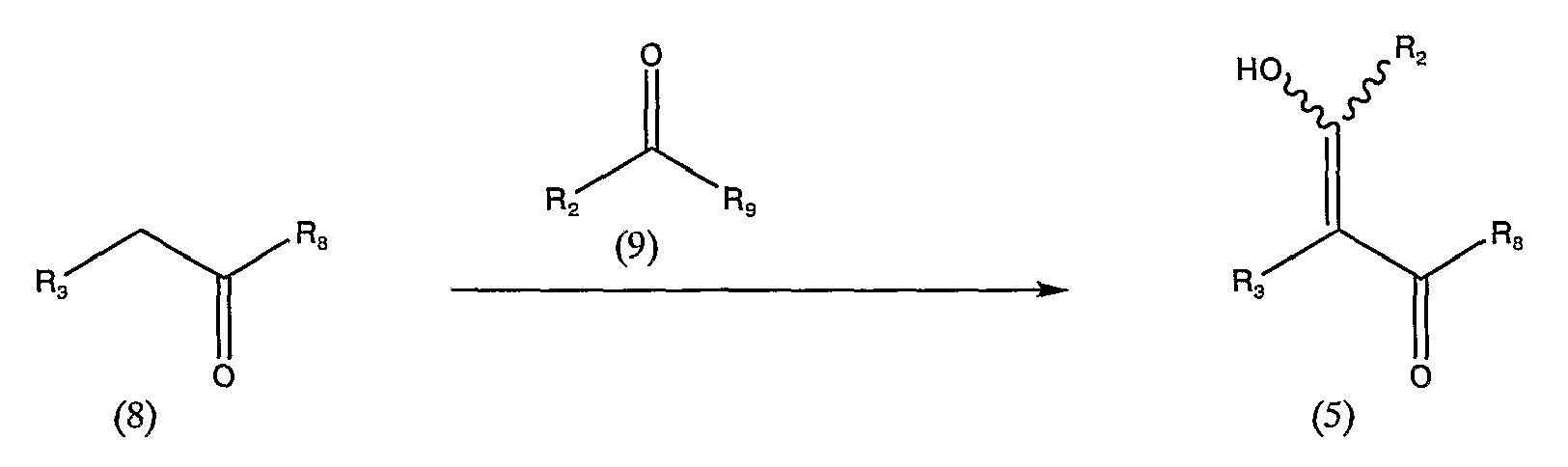
в которой R2, R3 и R8 аналогичны определенным выше, а R9 представляет низшую алкокси-группу.
Низшая алкокси-группа, представленная R9 в общей формуле (9), имеет определение, аналогичное описанному выше.
Соединение, представленное общей формулой (5), можно получить взаимодействием соединения, представленного общей формулой (8), с соединением, представленным общей формулой (9), в инертном растворителе или без использования каких-либо растворителей, в присутствии или в отсутствие основного соединения.
Примеры инертных растворителей включают воду; растворители на основе простых эфиров, такие как диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, диметиловый эфир диэтиленгликоля и диметиловый эфир этиленгликоля; растворители на основе ароматических углеводородов, такие как бензол, толуол и ксилол; растворители на основе низших спиртов, такие как метанол, этанол и изопропанол; растворители на основе кетонов, такие как ацетон и метилэтилкетон; и полярные растворители, такие как N,N-диметилформамид (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамид и ацетонитрил. Данные инертные растворители можно использовать по отдельности или в виде сочетания двух или более из них.
В качестве основного соединения можно использовать различные известные неорганические основания и органические основания.
Неорганические основания включают, например, гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия, гидроксид цезия и гидроксид лития, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия и карбонат лития, гидрокарбонаты щелочных металлов, такие как гидрокарбонат лития, гидрокарбонат натрия и гидрокарбонат калия; щелочные металлы, такие как натрий и калий, амиды, такие как амид натрия, и неорганические основания на основе гидридов щелочных металлов, таких как гидрид натрия и гидрид калия.
Органические основания включают, например, низшие алкоголяты щелочных металлов, такие как метилат натрия, этилат натрия, трет-бутилат натрия, метилат калия, этилат калия и трет-бутилат калия, и амины, такие как триэтиламин, трипропиламин, пиридин, хинолин, пиперидин, имидазол, N-этилдиизопропиламин, диметиламинопиридин, триметиламин, диметиланилин, N-метилморфолин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0]ундец-5-ен (DBU), 1,4-диазабицикло[2.2.2]октан (DABCO) и так далее.
Подобные основные соединения можно использовать по отдельности или в виде сочетания двух или более из них. Более предпочтительные основные соединения, используемые в данной реакции, включают неорганические основания, такие как гидрид натрия и гидрид калия.
Основное соединение обычно используют в количестве от около 1 до около 10 моль на моль соединения (8), и предпочтительно от около 1 до около 6 моль на моль соединения (8).
В схеме реакции 4 соединение (9) обычно используют в количестве, по меньшей мере, около 1 моль на соединения (8), и предпочтительно от около 1 до около 5 моль на моль соединения (8).
Данную реакцию можно проводить при нормальном давлении в атмосфере инертного газа, включая азот, аргон и так далее, или при повышенном давлении.
Реакция обычно протекает при температуре от комнатной до 200°С, и предпочтительно при температуре от комнатной до 150°С и обычно завершается в течение от около 1 до около 30 часов.
Соединения, представленные общими формулами (8) и (9), которые используют в качестве исходных веществ в схеме реакции 4, представляют легкодоступные известные соединения.
Схема реакции 5
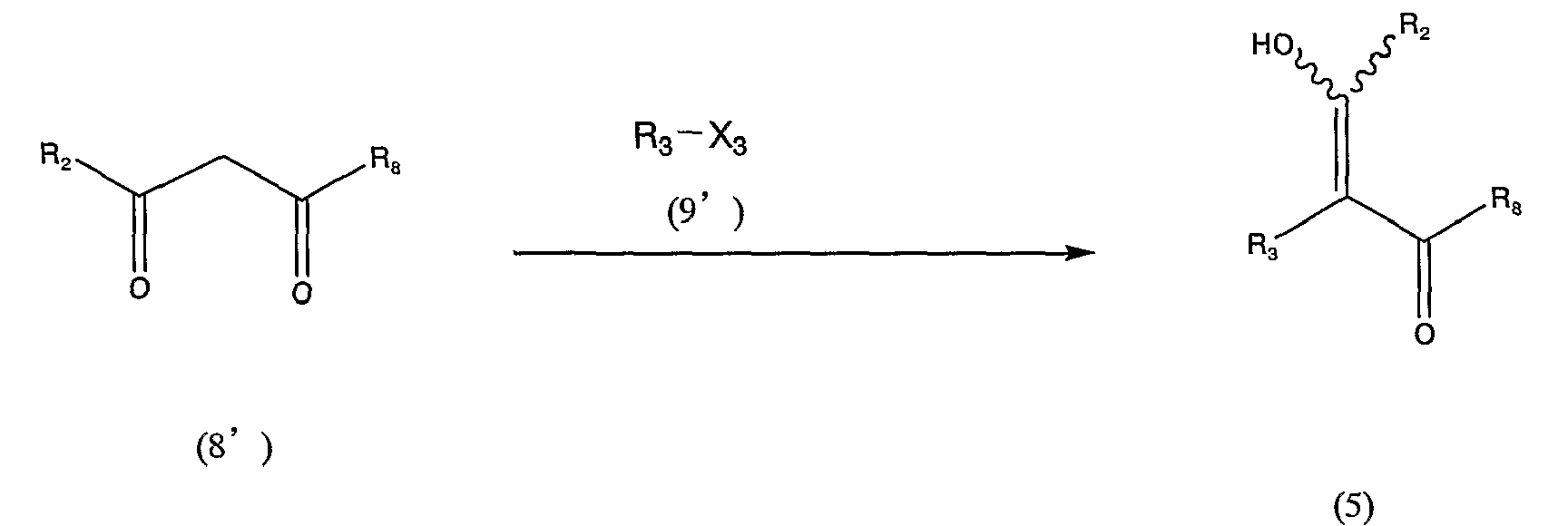
в которой R2, R3 и R8 аналогичны определенным выше, и Х3 представляет атом галогена.
Атом галогена, представленный Х3 в общей формуле (9'), имеет определение, аналогичное описанному выше.
Соединение, представленное общей формулой (5), можно получить взаимодействием соединения, представленного общей формулой (8'), с соединением, представленным общей формулой (9'), в инертном растворителе или без использования каких-либо растворителей, в присутствии основного соединения, такого как карбонат цезия, и медного катализатора, такого как йодид меди.
Примеры инертных растворителей включают полярные растворители, такие как N,N-диметилформамид (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамид и ацетонитрил. Данные инертные растворители можно использовать по отдельности или в виде сочетания двух или более из них.
Данную реакцию можно проводить в присутствии аминокислот, таких как L-пролин.
Данную реакцию можно проводить при нормальном давлении в атмосфере инертного газа, включая азот, аргон и так далее, или при повышенном давлении.
Реакция обычно протекает при температуре от комнатной до 200°С, и предпочтительно при температуре от комнатной до 150°С, и обычно завершается в течение от около 1 до около 30 часов.
Указанная выше реакция специально приведена в представленном ниже стандартном примере 58.
Соединения, представленные общими формулами (8') и (9'), которые используют в качестве исходных веществ в описанной выше схеме реакции 5, представляют известные соединения или легко могут быть получены из известных соединений.
Схема реакции 6
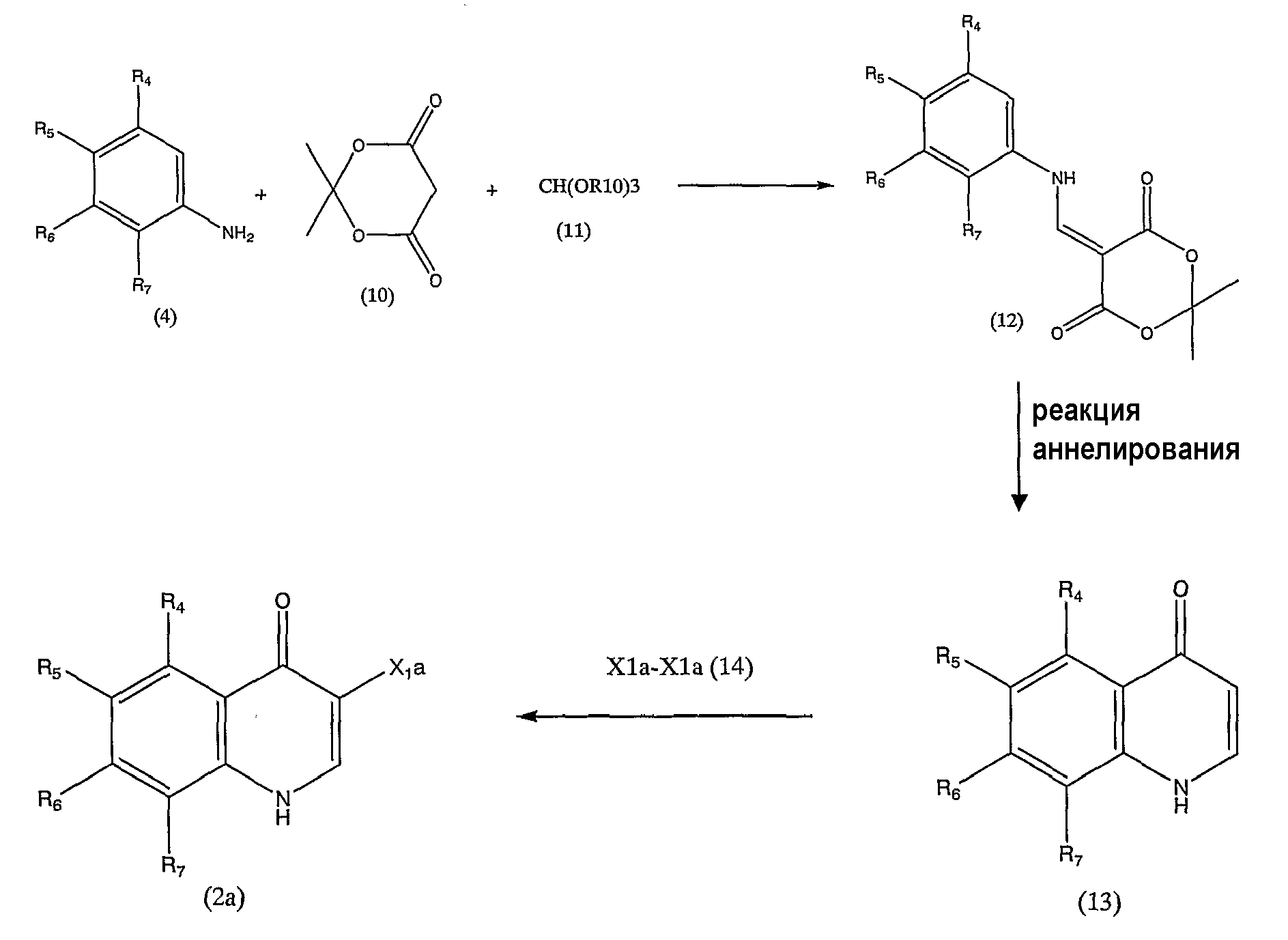
в которой R4, R5, R6 и R7 аналогичны определенным выше, и Х1а представляет атом галогена. R10 представляет низшую алкильную группу.
Низшая алкильная группа, представленная R10, и атом галогена, представленный Х1а, имеют определения, аналогичные описанным выше.
Соединение, представленное общей формулой (12), можно получить реакцией конденсации соединений, представленных общими формулами (4), (10) и (11), в инертном растворителе или без использования каких-либо растворителей.
Примеры инертных растворителей включают воду; растворители на основе простых эфиров, такие как диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, диметиловый эфир диэтиленгликоля и диметиловый эфир этиленгликоля; растворители на основе галогензамещенных углеводородов, такие как дихлорметан, хлороформ, 1,2-дихлорэтан и четыреххлористый углерод; растворители на основе ароматических углеводородов, такие как бензол, толуол и ксилол; растворители на основе низших спиртов, такие как метанол, этанол и изопропанол; и полярные растворители, такие как N,N-диметилформамид (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамид и ацетонитрил. Вместо упомянутых выше растворителей в качестве растворителя можно использовать соединение, представленное общей формулой (11). Данные инертные растворители можно использовать по отдельности или в виде сочетания двух или более из них.
В схеме реакции 6 соединение (10) обычно используют в количестве, по меньшей мере, около 1 моль на соединения (4), и предпочтительно от около 1 до около 5 моль на моль соединения (4).
По отношению к соединению (10) используют избыток соединения (11).
Данную реакцию можно проводить при нормальном давлении в атмосфере инертного газа, включая азот, аргон и так далее, или при повышенном давлении.
Реакция обычно протекает при температуре от комнатной до 200°С, и предпочтительно при температуре от комнатной до 150°С, и обычно завершается в течение от около 1 до около 30 часов.
Соединение, представленное общей формулой (13), можно получить реакцией аннелирования соединения, представленного общей формулой (12), в инертном растворителе или без использования каких-либо растворителей.
Примеры инертных растворителей включают растворители на основе простых эфиров, такие как дифениловый эфир.
Данную реакцию можно проводить при нормальном давлении в атмосфере инертного газа, включая азот, аргон и так далее, или при повышенном давлении.
Реакция обычно протекает при температуре от комнатной до 300°С, и предпочтительно при температуре от 150°С до 300°С, и обычно завершается в течение от около 1 до около 30 часов.
Соединение, представленное общей формулой (2а), можно получить реакцией соединения, представленного общей формулой (13), с соединением, представленным общей формулой (14), в инертном растворителе или без использования каких-либо растворителей, в присутствии или в отсутствие основного соединения.
Примеры инертных растворителей включают воду; растворители на основе простых эфиров, такие как диоксан, тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан, диметиловый эфир диэтиленгликоля и диметиловый эфир этиленгликоля; растворители на основе ароматических углеводородов, такие как бензол, толуол и ксилол; растворители на основе низших спиртов, такие как метанол, этанол и изопропанол; растворители на основе кетонов, такие как ацетон и метилэтилкетон; полярные растворители, такие как N,N-диметилформамид (ДМФА), диметилсульфоксид (ДМСО), гексаметилфосфортриамид и ацетонитрил. Данные инертные растворители можно использовать по отдельности или в виде сочетания двух или более из них.
В качестве основного соединения можно использовать различные известные неорганические основания и органические основания.
Неорганические основания включают, например, гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия, гидроксид цезия и гидроксид лития, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия и карбонат лития, гидрокарбонаты щелочных металлов, такие как гидрокарбонат лития, гидрокарбонат натрия и гидрокарбонат калия; щелочные металлы, такие как натрий и калий; амиды, такие как амид натрия, и неорганические основания на основе гидридов щелочных металлов, таких как гидрид натрия и гидрид калия.
Органические основания включают, например, растворители на основе низших алкоголятов щелочных металлов, такие как метилат натрия, этилат натрия, трет-бутилат натрия, метилат калия, этилат калия и трет-бутилат калия, и амины, такие как триэтиламин, трипропиламин, пиридин, хинолин, пиперидин, имидазол, N-этилдиизопропиламин, диметиламинопиридин, триметиламин, диметиланилин, N-метилморфолин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0]ундец-5-ен (DBU), 1,4-диазабицикло[2.2.2]октан (DABCO) и так далее.
Подобные основные соединения можно использовать по отдельности или в виде сочетания двух или более из них. Более предпочтительные основные соединения, используемые в данной реакции, включают карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия и карбонат лития и так далее.
Основное соединение обычно используют в количестве от около 0,5 до около 10 моль на моль соединения (13), и предпочтительно от около 0,5 до около 6 моль на моль соединения (13).
В схеме реакции 6 соединение (14) обычно используют в количестве, по меньшей мере, 0,5 моль на соединения (13), и предпочтительно от около 0,5 до около 5 моль на моль соединения (13).
Данную реакцию можно проводить при нормальном давлении в атмосфере инертного газа, включая азот, аргон и так далее, или при повышенном давлении.
Реакция обычно протекает при температуре от комнатной до 200°С, и предпочтительно при температуре от комнатной до 150°С, и обычно завершается в течение от около 1 до около 30 часов.
Соединения, представленные общими формулами (10), (11) и (14), которые используют в качестве исходных веществ в схеме реакции 6, представляют легко доступные известные соединения.
Сырые исходные соединения, используемые в каждой из описанных выше схем реакций, могут включать подходящие соли, и целевые соединения, полученные в результате каждой из данных реакций, могут образовывать подходящие соли. Такие предпочтительные соли включают следующие предпочтительные соли соединения (1).
Подходящие соли соединения (1) представляют фармакологически допустимые соли, включая соли металлов, такие как соли щелочных металлов (например, соли натрия, соли калия и так далее), соли щелочноземельных металлов (например, соли кальция, соли магния и так далее), соли аммония, соли неорганических оснований, таких как карбонаты щелочных металлов (например, карбонат лития, карбонат калия, карбонат натрия, карбонат цезия и так далее), гидрокарбонаты щелочных металлов (например, гидрокарбонат лития, гидрокарбонат натрия, гидрокарбонат калия и так далее), гидроксиды щелочных металлов (например, гидроксид лития, гидроксид натрия, гидроксид калия, гидроксид цезия и так далее), соли органических оснований, таких как три(низший)алкиламин (например, триметиламин, триэтиламин, N-этилдиизопропиламин и так далее), пиридин, хинолин, пиперидин, имидазол, пиколин, диметиламинопиридин, диметиланилин, N-(низший)алкилморфолин (например, N-метилморфолин и так далее), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0]ундец-5-ен (DBU) и 1,4-диазабицикло[2.2.2]октан (DABCO); соли неорганических кислот, такие как гидрохлорид, гидробромид, гидройодид, сульфат, нитрат и фосфат; и соли органических кислот, такие как формиат, ацетат, пропионат, оксалат, малонат, сукцинат, фумарат, малеат, лактат, малат, цитрат, тартрат, карбонат, пикрат, метансульфонат, этансульфонат, п-толуолсульфонат и глутамат.
Кроме того, в каждую из общих формул включены соединения в форме, в которую добавляли сольват (например, гидрат, этанолят и так далее) в исходные соединения и целевое соединение, представленные на каждой из схем реакций. Предпочтительные сольваты включают гидрат.
Каждое из целевых соединений, полученных согласно приведенным выше схемам реакций, можно выделить и очистить из реакционной смеси, например, после охлаждения реакционной смеси, осуществления процедуры выделения, такой как фильтрование, концентрирование, экстракция и так далее, для выделения сырого продукта реакции, а затем подвергая данный сырой продукт реакции обычному способу очистки, такому как колоночная хроматография, перекристаллизация и так далее.
Соединение формулы (1) согласно настоящему изобретению, естественно, включает геометрические изомеры, стереоизомеры, оптические изомеры и тому подобные изомеры.
В отношении приведенного выше соединения общей формулы (1) следует отметить следующие моменты. В том случае, когда R1 в общей формуле (1) представляет атом водорода, соединение включает таутомер хинолонового цикла. То есть, когда R1 в представляет атом водорода (1') в соединении хинолона общей формулы (1)
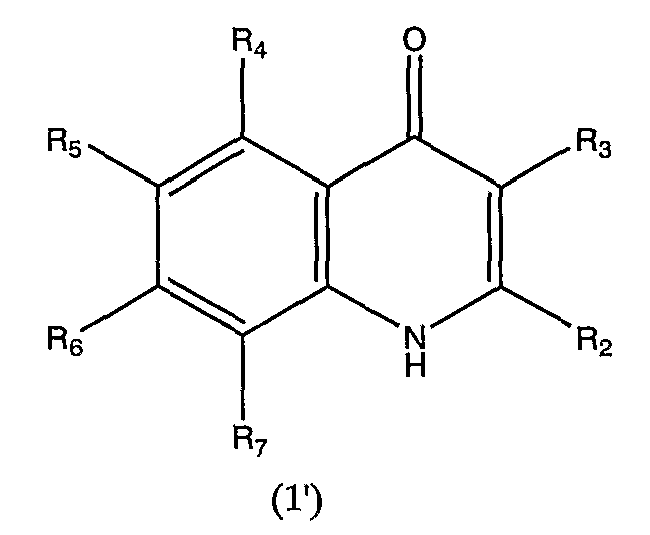
в которой R2, R3, R4, R5, R6 и R7 аналогичны определенным выше,
соединение данного таутомера можно представить формулой (1'')
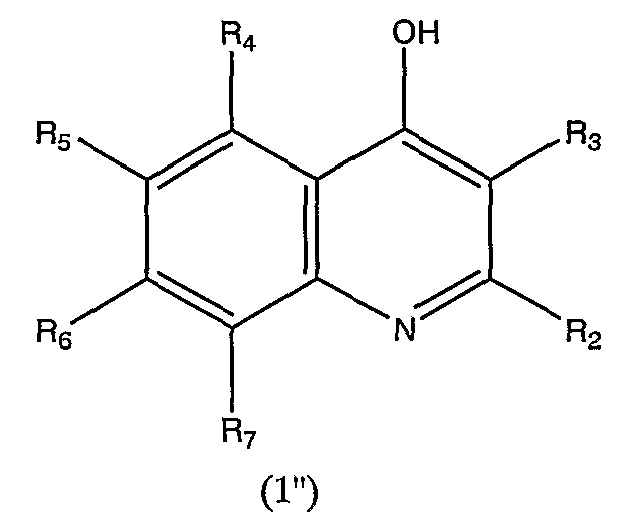
в которой R2, R3, R4, R5, R6 и R7 аналогичны определенным выше.
То есть оба соединения, представленных формулами (1') и (1''), находятся в состоянии таутомерного равновесия, представленного следующей формулой равновесия.
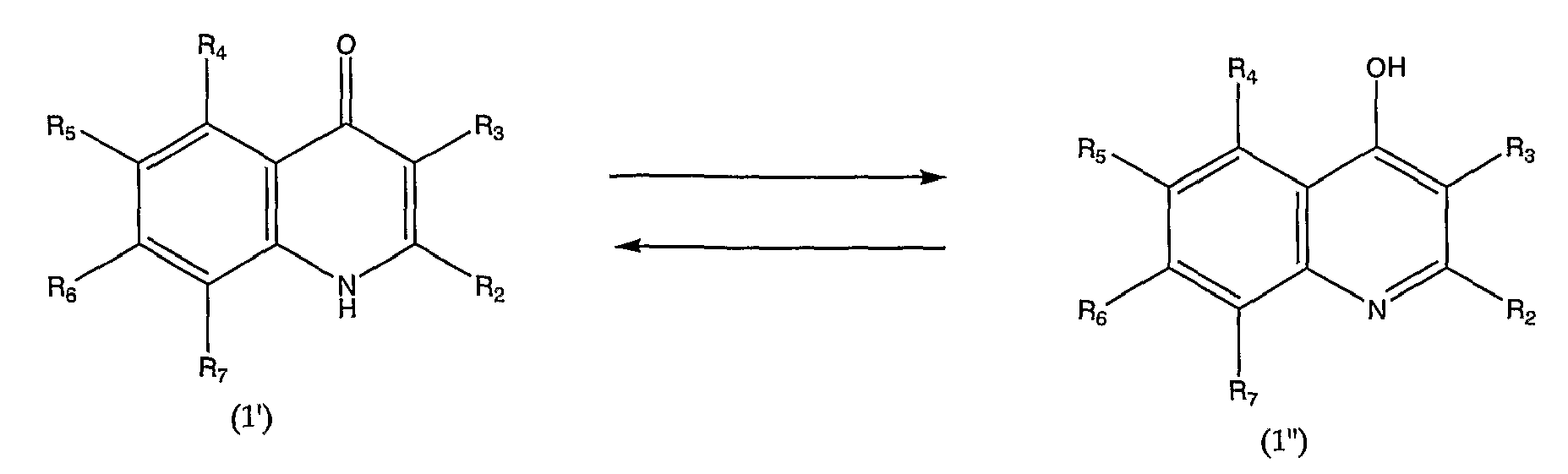
в которой R2, R3, R4, R5, R6 и R7 аналогичны определенным выше.
Подобная таутомерия между соединением 4-хинолона и соединением 4-гидроксихинолина технически известна, и для специалиста в данной области очевидно, что оба описанных выше таутомера находятся в состоянии равновесия и взаимного превращения.
Таким образом, соединение (1), естественно, включает упомянутые выше таутомеры.
В описании структурная формула соединения 4-хинолона подходящим образом используется в качестве структурной формулы целевого или исходного вещества, включая соединения подобных таутомеров.
Соединение общей формулы (1) и его соль используют в виде общих фармацевтических препаратов. Данные препараты получают с использованием обычно применяемых разбавителей или эксципиентов, таких как наполнители, сухие разбавители, связующие вещества, смачивающие вещества, разрыхлители, поверхностно-активные вещества, смазывающие вещества и так далее. Форму подобных фармацевтических препаратов можно выбрать в соответствии с целью терапии. Типичные примеры включают таблетки, пилюли, порошки, растворы, суспензии, эмульсии, гранулы, капсулы, суппозитории, инъекции (растворы, суспензии и так далее) и тому подобное.
Для получения таблеток можно использовать любой из различных носителей, общеизвестных в данной области. Их примеры включают лактозу, белый сахар, хлорид натрия, глюкозу, мочевину, крахмал, карбонат кальция, каолин, кристаллическую целлюлозу, кремниевую кислоту и другие эксципиенты; воду, этанол, пропанол, сахарный сироп, растворы глюкозы, растворы крахмала, растворы желатина, карбоксиметилцеллюлозу, шеллак, метилцеллюлозу, фосфат калия, поливинилпирролидон и другие связующие вещества; сухой крахмал, альгинат натрия, порошок агар-агара, ламинариновый порошок, гидрокарбонат натрия, карбонат кальция, полиоксиэтиленовый эфир сорбита и жирной кислоты, лаурилсульфат натрия, моноглицериды стеариновой кислоты, крахмал, лактозу и другие разрыхлители; белый сахар, стеарин, масло какао, гидрированные масла и другие ингибиторы разрыхления; четвертичные аммониевые основания, лаурилсульфат натрия и другие промоторы абсорбции; глицерин, крахмал и другие смачивающие вещества; крахмал, лактозу, каолин, бентонит, коллоидную кремниевую кислоту и другие адсорбенты; очищенный тальк, стеараты, порошкообразную борную кислоту, полиэтиленгликоль и другие смазывающие вещества и так далее. Кроме того, при необходимости на подобные таблетки может быть нанесено покрытие из обычных покрывающих веществ, например, для получения таблеток с сахарным покрытием, таблеток с желатиновым покрытием, таблеток с кишечно-растворимым покрытием, таблеток с пленочным покрытием, таблеток с двойным или многослойным покрытием и так далее.
Для получения пилюль можно использовать любой из различных носителей, общеизвестных в данной области. Их примеры включают глюкозу, лактозу, крахмал, масло какао, гидрированные растительные масла, каолин, тальк и другие эксципиенты; порошкообразный гуммиарабик, порошкообразную трагакантовую камедь, желатин, этанол и другие связующие вещества; ламинарин, агар-агар и другие разрыхлители и так далее.
Для получения суппозиториев можно использовать любые различные носители, общеизвестные в данной области. Их примеры включают полиэтиленгликоль, масло какао, высшие спирты, сложные эфиры высших спиртов, желатин, полусинтетические глицериды и так далее.
Капсулы можно получить, смешивая активное основное соединение с упомянутыми выше носителями для заключения первого в твердую желатиновую капсулу, мягкую желатиновую капсулу, или тому подобное.
Для получения препарата для инъекций раствор, эмульсию или суспензию стерилизуют и, предпочтительно, делают ее изотоничной к крови. Для получения препарата для инъекций можно применять любые разбавители, широко используемые для подобных форм в данной области. Примеры таких разбавителей включают воду, этиловый спирт, макрогол, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксилированный изостеариловый спирт, полиоксиэтиленовые эфиры сорбита и жирной кислоты и так далее.
В этом случае фармацевтический препарат может содержать хлорид натрия, глюкозу или глицерин в количестве, достаточном для приготовления изотонического раствора, и может содержать обычные солюбилизаторы, буферные агенты, анальгезирующие средства и так далее. Кроме того, при необходимости фармацевтический препарат может содержать красители, консерванты, вкусовые добавки, подсластители и так далее, и/или другие лекарственные средства.
Количество соединения, представленного общей формулы (1) и его соли, входящих в фармацевтическую композицию настоящего изобретения, не ограничено и может быть подходящим образом выбрано из широкого интервала. Эта доля обычно составляет от около 0,1 до около 70 масс.%, предпочтительно от около 0,1 до около 30 масс.% фармацевтического препарата.
Способ введения фармацевтического препарата настоящего изобретения особенно не ограничен, и препарат вводят способом, который подходит для формы препарата, возраста пациента, пола и прочих условий, и состояния болезни. Например, таблетки, пилюли, растворы, суспензии, эмульсии, гранулы и капсулы вводят перорально. Препараты для инъекций вводят внутривенно отдельно или в смеси с обычными инъекционными вливаниям, такими как растворы глюкозы, растворы аминокислот, или тому подобное, или отдельно вводят внутримышечно, внутрикожно, подкожно или внутрибрюшинно, при необходимости. Суппозитории вводят внутриректально.
Дозировку фармацевтического препарата данного изобретения выбирают подходящим образом в соответствии со способом применения, возрастом пациента, полом и прочими условиями, и тяжестью заболевания. Количество активного основного соединения обычно составляет от около 0,1 до около 10 мг/кг массы тела/день. Кроме того, желательно, чтобы фармацевтический препарат в каждой дозе формы введения содержался в количестве от около 1 до около 200 мг.
При применении соединения настоящего изобретения в комбинации с препаратами леводопа, агонистами дофаминовых рецепторов, ингибиторами фермента метаболизма дофамина, препаратами, повышающими скорость высвобождения дофамина, антихолинергическими агентами центрального действия и тому подобным можно достигнуть таких эффектов, как снижение дозы, улучшение побочных эффектов, повышение терапевтической эффективности и так далее, которые не достигаются в результате обычных видов терапии.
Результат изобретения
Соединение настоящего изобретения обладает защитной и улучшающей активностью в отношении митохондриальной функции и защитной и восстанавливающей нейронной активностью, и так далее, и, таким образом, эффективно для лечения и предупреждения нейродегенеративных заболеваний, заболеваний, относящихся к нейродегенеративному расстройству, и заболеваний, относящихся к митохондриальной дисфункции.
Нейродегенеративные заболевания включают болезнь Паркинсона, синдром Паркинсона, юношеский паркинсонизм, стриатонигральную дегенерацию, прогрессирующий супрануклеарный паралич, истинную акинезию, болезнь Альцгеймера, болезнь Пика, прионную болезнь, кортикобазальную дегенерацию, болезнь диффузных телец Леви, болезнь Хантингтона, хорею-акантоцитоз, доброкачественную наследственную хорею, пароксизмальный хореоатетоз, эссенциальный тремор, эссенциальный миоклонус, синдром Туретта, синдром Ретта, дегенеративное дрожание, лордотическую дисбазию, атетоз, спастическую кривошею, синдром Мейжа, церебральный паралич, болезнь Вильсона, синдром Сегавы, синдром Халлервордена-Шпатца, нейроаксональную дистрофию, паллидумальную атрофию, спиноцеребеллярную дегенерацию сетчатки, атрофию коры головного мозга, церебеллярную атрофию Холмса, оливопонтоцеребеллярную атрофию, наследственную оливопонтоцеребеллярную атрофию, болезнь Джозефа, дентаторубро-паллидолюисову атрофию, болезнь Герстманна-Штраусслера-Шейнкера, атаксию Фридрейха, синдром Русси-Леви, синдром Мэя-Уайта, врожденную церебеллярную атаксию, наследственную эпизодическую атаксию, атаксию-телеангиэктазию, боковой амиотрофический склероз, прогрессирующий бульбарный паралич, спинальную прогрессирующую мышечную атрофию, спинобульбарную мышечную атрофию, болезнь Верднига-Хоффмана, болезнь Кугельберга-Веландер, наследственный спастический парапарез, сирингомиелию, сирингобульбию, синдром Арнольда-Киари, синдром мышечной скованности, синдром Клиппель-Фейля, синдром Фацио-Лонде, низшую миелопатию, синдром Дэнди-Уолкера, расщепление позвоночника, синдром Съегрена-Ларссона, радиационную миелопатию, возрастную дегенерацию желтого пятна и апоплексию мозга (например, ишемический инсульт, кровоизлияние в мозг и так далее).
Заболевания, вызванные неврологической дисфункцией, включают травму спинного мозга, вызванную химиотерапией невропатию, диабетическую невропатию, радиационное поражение и демиелинизирующие заболевания (например, рассеянный склероз, острый диссеминированный энцефаломиелит, поперечный миелит, прогрессирующую многофокальную лейкоэнцефалопатию, подострый склерозирующий панэнцефалит, хроническую воспалительную демиелинизирующую полиневропатию, синдром Гиллена-Барре и так далее).
Заболевания, вызванные ухудшением функции митохондрия, включают синдром Пирсона, диабет, глухоту, мигрень злокачественного течения, болезнь Лебера, MELAS, MERRF, синдром перехлеста MERRF/MELAS, NARP, истинную миопатию, митохондриальную кардиомиопатию, миопатию, слабоумие, желудочно-кишечную атаксию, сидеробластную приобретенную анемию, вызванную аминогликозидами потерю слуха, недостаточность комплекса III вследствие наследственных вариантов цитохрома b, множественный симметричный липоматоз, атаксию, миоклонус, ретинопатию, MNGIE, болезнь ANT1, болезнь Твинкла, болезнь POLG, рецидивирующую миоглобинурию, SANDO, ARCO, недостаточность комплекса I, недостаточность комплекса II, атрофию зрительного нерва, фатальную детскую недостаточность комплекса IV, недостаточность митохондриальной ДНК, синдром недостаточности митохондриальной ДНК, энцефаломиелопатию Ли, синдром хронической прогрессирующей наружной офтальмоплегии (CPEO), синдром Керна-Сайра, энцефалопатию, лактацидемию, миоглобинурию, вызванные лекарственными препаратами митохондриальные заболевания, шизофрению, большое депрессивное расстройство, I биполярное расстройство, II биполярное расстройство, смешанный приступ, дистимические расстройства, атипичную депрессию, сезонные аффективные расстройства, послеродовую депрессию, малую депрессию, рецидивирующее краткое депрессивное расстройство, стойкую депрессию/хроническую депрессию, двойную депрессию и острую почечную недостаточность.
Наилучший способ осуществления изобретения
В дальнейшем настоящее изобретение описано более подробно со ссылкой на справочные примеры, примеры и фармакологические тестовые примеры.
Справочный пример 1
N-Циклогексил-4-фтор-2-нитро-N-метиланилин
К раствору 2,5-дифторнитробензола (5,0 г, 31,4 ммоль) в N-метилпирролидоне (NMP) (20 мл) добавляли карбонат калия (6,0 г, 43,5 ммоль) и N-метилциклогексиламин (4,6 г, 40,6 ммоль), и перемешивали при 100°С в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли воду и экстрагировали полученную смесь этилацетатом. Органический слой промывали водой, и затем сушили над безводным сульфатом магния. Полученный сухой продукт концентрировали при пониженном давлении, получая при этом 7,0 г маслообразного N-циклогексил-4-фтор-2-нитро-N-метиланилина желтого цвета (выход: 89%).
1Н ЯМР (CDCl3) dppm: 1,12-1,80 (10H, м), 2,67 (3H, c), 3,00-3,09 (1H, м), 7,07-7,20 (2H, м), 7,42-7,47 (1H, м).
Соединения следующих справочных примеров с 2-5 получали способом, аналогичным приведенному выше справочному примеру 1, с использованием соответствующих исходных веществ.
Справочный пример 2
4-Фтор-N-(2-метоксиэтил)-N-метил-2-нитроанилин
1Н ЯМР (CDCl3) dppm: 2,85 (3H, c), 3,25-3,31 (5H, м), 3,52 (2H, т, J=5,6 Гц), 7,16-7,20 (2H, м), 7,43-7,47 (1H, м).
Справочный пример 3
4-Фтор-N-изобутил-N-метил-2-нитроанилин
1Н ЯМР (CDCl3) dppm: 0,89 (3H, c), 0,91 (3H, c), 1,89-1,98 (1H, м), 2,81(3H,c), 2,92 (2H, д, J=7,5 Гц), 7,15-7,20 (2H, м), 7,42-7,46 (1H, м).
Справочный пример 4
4-Фтор-N-изопропил-N-метил-2-нитроанилин
1Н ЯМР (CDCl3) dppm: 1,16 (3H, c), 1,19 (3H, c), 2,67 (3H, c), 3,50-3,61 (1H, м), 7,15-7,20 (2H, м), 7,43-7,46 (1H, м).
Справочный пример 5
4-Фтор-N-метил-2-нитро-N-пропиланилин
1Н ЯМР (CDCl3) dppm: 0,84 (3H, т, J=7,5 Гц), 1,51-1,66 (2H, м), 2,77 (3H, c), 3,00 (2H, т, J=7,5 Гц), 7,05-7,20 (2H, м), 7,44 (1H, дд, J=2,75 Гц, J=8,0 Гц).
Справочный пример 6
4-Фтор-2-нитро-1-пропилсульфанилбензол
К раствору 2,5-дифторнитробензола (5,0 г, 31,4 ммоль) в N-метилпирролидоне (NMP) (15 мл) добавляли карбонат калия (5,0 г, 36,2 ммоль) и 1-пропантиол (2,7 г, 35,5 ммоль) и перемешивали полученную смесь при 90°С в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры добавляли воду (50 мл) и экстрагировали продукт реакции этилацетатом (100 мл). Органический слой промывали водой и затем сушили над безводным сульфатом магния. Полученный сухой продукт концентрировали при пониженном давлении, получая при этом 6,7 г порошкообразного 4-фтор-2-нитро-1-пропилсульфанилбензола желтого цвета (выход: 99%).
1Н ЯМР (CDCl3) dppm: 1,06 (3Н, т, J=7,5 Гц), 1,68-1,83 (2H, м), 2,89 (2H, т, 7,5 Гц), 7,27-7,42 (2H, м), 7,89 (2H, дд, J=2,75 Гц, J=8,5 Гц).
Справочный пример 7
1-трет-Бутокси-4-фтор-2-нитробензол
Раствор трет-бутилата калия (3,55 г, 31,6 ммоль) в тетрагидрофуране (ТГФ) (20 мл) охлаждали на метанольно-ледяной бане и затем добавляли 4,2 г 2,5-дифторнитробензола (26,4 ммоль). Смесь нагревали до комнатной температуры, перемешивали в течение 96 часов и перемешивали еще при 60°С в течение 1 часа. К реакционной смеси добавляли воду (2 мл) и 2н. хлористоводородную кислоту (2 мл) при охлаждении на бане с ледяной водой и затем добавляли воду. Полученную смесь экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении, и остаток затем очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=19:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 4,5 г маслообразного 1-трет-бутокси-4-фтор-2-нитробензола оранжевого цвета (выход: 80%).
1Н ЯМР (CDCl3) dppm: 1,38 (9H, c), 7,18-7,20 (2H, м), 7,47 (1H, д, J=1,1 Гц).
Справочный пример 8
4-Фтор-2-нитро-1-пропоксибензол
Раствор карбоната калия (3,48 г, 25,2 ммоль) и 1-йодпропана (3,95 г, 23,2 ммоль) в N,N-диметилформамиде (ДМФА) (3 мл) добавляли к раствору 4-фтор-2-нитрофенола (3,3 г, 21,0 ммоль) в ДМФА (7 мл). Смесь перемешивали при комнатной температуре в течение 48 часов. К реакционной смеси добавляли воду и экстрагировали полученную смесь этилацетатом. Органический слой дважды промывали насыщенным раствором хлорида натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=9:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 4,03 г маслообразного 4-фтор-2-нитро-1-пропоксибензола желтого цвета (выход: 96%).
1Н ЯМР (CDCl3) dppm: 1,06 (3H, т, J=7,4 Гц), 1,78-1,92 (2H, м), 4,04 (2H, т, J=6,4 Гц), 7,04 (1H, дд, J=4,3 Гц, J=9,2 Гц), 7,21-7,29 (1H, м), 7,58 (1H, дд, J=3,1 Гц, J=7,8 Гц).
Соединения следующих справочных примеров с 9 по 16 получали способом, аналогичным приведенным выше справочным примерам с 7 по 8, с использованием соответствующих исходных веществ.
Справочный пример 9
4-Фтор-1-изопропокси-2-нитробензол
1Н ЯМР (CDCl3) dppm: 1,36 (3H, c), 4,54-4,63 (1H, м), 7,02-7,05 (1H, м), 7,18-7,26 (1H, м), 7,49 (1H, дд, J=3,0 Гц, J=7,5 Гц).
Справочный пример 10
1-Этокси-4-фтор-2-нитробензол
1Н ЯМР (CDCl3) dppm: 1,44 (3H, т, J=7,0 Гц), 4,08 (2H, кв, J=7,0 Гц), 7,02 (1H, дд, J=4,25 Гц, J=9,25 Гц), 7,22-7,30 (1H, м), 7,56 (1H, дд, J=3,25 Гц, J=7,75 Гц).
Справочный пример 11
1-Циклопропилметокси-4-фтор-2-нитробензол
1Н ЯМР (CDCl3) dppm: 0,36-0,41 (2H, м), 0,61-0,69 (2H, м), 1,22-1,28 (1H, м), 3,95 (2H, д, J=6,8 Гц), 7,04 (1H, дд, J=4,4 Гц, J=9,2 Гц), 7,20-7,27 (1H, м), 7,57 (1H, дд, J=3,1 Гц, J=7,8 Гц).
Справочный пример 12
4-Фтор-2-нитро-1-(4,4,4-трифторбутокси)бензол
1Н ЯМР (CDCl3) dppm: 2,04-2,16 (2H, м), 2,31-2,44 (2H, м), 4,14 (2H, т, J=5,9 Гц), 7,04 (1H, дд, J=4,3 Гц, J=9,2 Гц), 7,24-7,32 (1H, м), 7,61 (1H, дд, J=3,2 Гц, J=7,8 Гц).
Справочный пример 13
4-Фтор-1-(2-метоксиэтокси)-2-нитробензол
1Н ЯМР (CDCl3) dppm: 3,45 (3H, c), 3,78 (2H, т, J=4,8 Гц), 4,24 (2H, т, J=4,8 Гц), 7,12 (1H, дд, J=4,4 Гц, J=9,2 Гц), 7,23-7,30 (1H, м), 7,59 (1H, дд, J=3,1 Гц, J=7,8 Гц).
Справочный пример 14
1-Циклопентокси-4-фтор-2-нитробензол
1Н ЯМР (CDCl3) dppm: 1,62-1,66 (2H, м), 1,83-1,94 (6H, м), 4,82-4,86 (1H, м), 7,04 (1H, дд, J=4,4 Гц, J=9,3 Гц), 7,19-7,27 (1H, м), 7,54 (1H, дд, J=3,2 Гц, J=7,8 Гц).
Справочный пример 15
1-Циклобутилметокси-4-фтор-2-нитробензол
1Н ЯМР (CDCl3) dppm: 1,90-2,02 (4H, м), 2,08-2,15 (2H, м), 2,77-2,81 (1H, м), 4,03 (2H, д, J=6,2 Гц), 7,04 (1H, дд, J=4,3 Гц, J=9,2 Гц), 7,21-7,28 (1H, м), 7,58 (1H, дд, J=3,1 Гц, J=7,8 Гц).
Справочный пример 16
2-(4-Фтор-2-нитрофеноксиметил)тетрагидрофуран
1Н ЯМР (CDCl3) dppm: 1,88-2,12 (4H, м), 3,80-3,94 (2H, м), 4,11 (2H, д, J=4,0 Гц), 4,27-4,32 (1H, м), 7,10 (1H, дд, J=4,4 Гц, J=9,3 Гц), 7,22-7,30 (1H, м), 7,59 (1H, дд, J=3,1 Гц, J=7,8 Гц).
Справочный пример 17
2-[3-(4-Фтор-2-нитрофенокси)пропил]изоиндол-1,3-дион
Карбонат калия (10,8 г, 78,1 ммоль) и N-(3-бромпропил)фталимид (12,1 г, 45,1 ммоль) добавляли к раствору 4-фтор-2-нитрофенола (6,0 г, 38,2 ммоль) в N,N-диметилформамиде (ДМФА) (80 мл) и перемешивали смесь при 60°С в течение 4 часов. После охлаждения реакционной смеси до комнатной температуры добавляли воду (200 мл) и затем охлаждали реакционную смесь льдом. Выпавшее нерастворимое вещество выделяли фильтрованием. После промывания водой (50 мл × 3) оставшееся на фильтре вещество сушили на воздухе, получая 13,2 г порошкообразного 2-[3-(4-фтор-2-нитрофенокси)пропил]изоиндол-1,3-диона бледно-желтого цвета (выход: 100%).
1Н ЯМР (CDCl3) dppm: 2,18-2,28 (2H, м), 3,93 (2H, т, J=6,5 Гц), 4,15 (2H, т, J=6,0 Гц), 7,04 (1H, дд, J=4,3 Гц, J=9,2 Гц), 7,23-7,28 (1H, м), 7,58 (1H, дд, J=3,1 Гц, J=7,8 Гц), 7,69-7,74 (2H, м), 7,81-7,85 (2H, м).
Справочный пример 18
3-(4-Фтор-2-нитрофенокси)пропиламин
6,5 г 2-[3-(4-фтор-2-нитрофенокси)пропил]изоиндол-1,3-диона суспендировали в этаноле (140 мл) и добавляли к полученной суспензии гидразингидрат (3,0 мл). Смесь перемешивали в течение 3,5 часов при кипячении с обратным холодильником. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли 13 мл 5 н. водного раствора гидроксида натрия и экстрагировали полученную смесь дихлорметаном. Органический слой промывали насыщенным раствором хлорида натрия и затем сушили над безводным сульфатом магния. Полученный сухой продукт концентрировали при пониженном давлении, получая при этом 4,03 г маслообразного 3-(4-фтор-2-нитрофенокси)пропиламина красно-оранжевого цвета (выход: 100%).
1Н ЯМР (CDCl3) dppm: 1,92-2,02 (2H, м), 2,94 (2H, т, J=6,5 Гц), 4,19 (2H, т, J=5,9 Гц), 7,07 (1H, дд, J=4,3 Гц, J=9,2 Гц), 7,22-7,30 (1H, м), 7,59 (1H, дд, J=3,1 Гц, J=7,8 Гц).
Справочный пример 19
N-[3-(4-фтор-2-нитрофенокси)пропил]ацетамид
К раствору 3-(4-фтор-2-нитрофенокси)пропиламина (2,0 г, 9,33 ммоль) в дихлорметане добавляли пиридин (1,5 мл, 18,6 ммоль) и уксусный ангидрид (0,97 г, 10,3 ммоль) при охлаждении льдом и затем добавляли еще дихлорметан (4 мл). Полученную смесь перемешивали при комнатной температуре в течение 15 часов. К реакционной смеси добавляли 2 н. хлористоводородную кислоту (9,5 мл) и перемешивали данную смесь. К смеси добавляли воду и экстрагировали полученную смесь дихлорметаном. После промывания насыщенным водным раствором хлорида натрия органический слой концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=30:1→20:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 2,13 г маслообразного N-[3-(4-фтор-2-нитрофенокси)пропил]ацетамида желтого цвета (выход: 89%).
1Н ЯМР (CDCl3) dppm: 2,04 (3H, c), 2,03-2,12 (2H, м), 3,48-3,55 (2H, м), 4,20 (2H, т, J=5,5 Гц), 6,56 (1H, ушир.с), 7,08 (1H, дд, J=4,3 Гц, J=9,3 Гц), 7,26-7,36 (1H, м), 7,70 (1H, дд, J=3,2 Гц, J=7,8 Гц).
Справочный пример 20
N-[3-(4-Фтор-2-нитрофенокси)пропил]метансульфонамид
К раствору 3-(4-фтор-2-нитрофенокси)пропиламина (2,0 г, 9,33 ммоль) в дихлорметане добавляли, при охлаждении льдом, пиридин (1,5 мл, 18,6 ммоль) и метансульфонилхлорид (0,8 мл, 10,3 ммоль) и добавляли еще метилхлорид (4 мл). Полученную смесь перемешивали при комнатной температуре в течение 24 часов и дополнительно добавляли к ней метансульфонилхлорид (0,12 мл, 1,5 ммоль) и затем смесь перемешивали при комнатной температуре в течение 15 часов. К реакционной смеси добавляли 2 н. хлористоводородную кислоту (9,5 мл) и экстрагировали смесь дихлорметаном. После промывания насыщенным водным раствором хлорида натрия органический слой концентрировали при пониженном давлении и остаток затем очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=4:1→1:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 1,2 г маслообразного N-[3-(4-фтор-2-нитрофенокси)пропил]метансульфонамида желто-оранжевого цвета (выход: 44%).
1Н ЯМР (CDCl3) dppm: 2,09-2,18 (2H, м), 3,00 (3H, c), 3,39-3,46 (2H, м), 4,23 (2H, т, J=5,6 Гц), 5,00 (1H, ушир.c), 7,09 (1H, дд, J=4,3 Гц, J=9,2 Гц), 7,26-7,35 (1H, м), 7,66 (1H, дд, J=3,1 Гц, J=7,8 Гц).
Справочный пример 21
Фенил[3-(4-фтор-2-нитрофенокси)пропил]карбамат
К раствору 3-(4-фтор-2-нитрофенокси)пропиламина (4,03 г, 18,8 ммоль) в диоксане (43 мл) добавляли триэтиламин (2,90 мл, 21,4 ммоль) и фенилхлоркарбонат (2,52 мл, 20,0 мл) при охлаждении льдом и перемешивали смесь при комнатной температуре в течение 0,5 часа. Реакционную смесь концентрировали при пониженном давлении и остаток затем очищали колоночной хроматографией на силикагеле (дихлорметан:этилацетат=30:1). Очищенный продукт концентрировали досуха при пониженном давлении, получая при этом 5,92 г порошкообразного фенил[3-(4-фтор-2-нитрофенокси)пропил]карбамата желтого цвета (выход: 94%).
1Н ЯМР (CDCl3) dppm: 2,09-2,18 (2H, м), 3,48-3,56 (2H, м), 4,21 (2H, т, J=5,7 Гц), 5,69 (1H, ушир.c), 7,05-7,20 (4H, м), 7,26-7,37 (3H, м), 7,65 (1H, дд, J=3,1 Гц, J=7,8 Гц).
Справочный пример 22
3-[3-(4-Фтор-2-нитрофенокси)пропил]-1,1-диметилмочевина
К раствору фенил[3-(4-фтор-2-нитрофенокси)пропил]карбамата (5,89 г, 17,6 ммоль) в ДМФА (25 мл) добавляли 50%-ный водный раствор диметиламина (2,5 мл) и перемешивали смесь при комнатной температуре в течение 24 часов. К реакционной смеси добавляли воду и экстрагировали полученную смесь этилацетатом. Органический слой дважды промывали насыщенным водным раствором хлорида натрия и концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (дихлорметан:этилацетат=19:1→4:1→2:1). Очищенный продукт концентрировали досуха при пониженном давлении, получая при этом 4,10 г маслообразной 3-[3-(4-фтор-2-нитрофенокси)пропил]-1,1-диметилмочевины бледно-желтого цвета (выход: 82%).
1Н ЯМР (CDCl3) dppm: 2,03-2,12 (2H, м), 2,89 (6H, c), 3,42-3,49 (2H, м), 4,17 (2H, т, J=5,8 Гц), 4,85 (1H, ушир.c), 7,09 (1H, дд, J=4,3 Гц, J=9,3 Гц), 7,24-7,32 (1H, м), 7,61 (1H, дд, J=3,2 Гц, J=7,8 Гц).
Справочный пример 23
1-[3-(4-Фтор-2-нитрофенокси)пропил]-1,3,3-триметилмочевина
К раствору 2,0 г 3-[3-(4-фтор-2-нитрофенокси)пропил]-1,1-диметилмочевины (7,0 ммоль) в ДМФА (9 мл) добавляли гидрид натрия (55% в масле) (396 мг, 9,1 ммоль), при охлаждении льдом и перемешивали смесь при комнатной температуре в течение 5 минут. К смеси добавляли йодистый метил (0,735 мл, 11,8 ммоль) и перемешивали полученную смесь при комнатной температуре в течение 48 часов. К реакционной смеси добавляли воду и проводили экстракцию этилацетатом. После промывания насыщенным водным раствором хлорида натрия органический слой концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (дихлорметан:этилацетат=9:1→6:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 0,83 г маслообразной 1-[3-(4-фтор-2-нитрофенокси)пропил]-1,3,3-триметилмочевины бледно-желтого цвета (выход: 40%).
1Н ЯМР (CDCl3) dppm: 2,04-2,14 (2H, м), 2,76 (6H, c), 2,83 (3H, c), 3,38 (2H, т, J=6,9 Гц), 4,09 (2H, т, J=5,9 Гц), 7,04 (1H, дд, J=4,3 Гц, J=9,3 Гц), 7,22-7,30 (1H, м), 7,60 (1H, дд, J=3,1 Гц, J=7,7 Гц).
Справочный пример 24
5-Фтор-2-пропоксианилин
4-Фтор-2-нитро-1-пропоксибензол (2,0 г, 10,0 ммоль) и 5% палладия на угле (750 мг) добавляли к этанолу (30 мл). Каталитическую реакцию проводили при комнатной температуре и атмосферном давлении (нормальном давлении). Катализатор удаляли фильтрованием через целит, а фильтрат концентрировали при пониженном давлении. Остаток растворяли в дихлорметане и сушили над безводным сульфатом магния. Полученный сухой продукт концентрировали при пониженном давлении, получая при этом 1,45 г маслообразного 5-фтор-2-пропоксианилина красно-оранжевого цвета (выход: 86%).
1Н ЯМР (CDCl3) dppm: 1,04 (3H, т, J=7,4 Гц), 1,74-1,88 (2H, м), 3,89 (2H, ушир.с), 3,90 (2H, т, J=6,5 Гц), 6,31-6,46 (2H, м), 6,66 (1H, дд, J=5,1 Гц, J=8,7 Гц).
Соединения следующих справочных примеров с 25 по 42 получали способом, аналогичным описанному выше способу справочного примера 24, при использовании соответствующих исходных соединений.
Справочный пример 25
5-Фтор-2-изопропоксианилин
1Н ЯМР (CDCl3) dppm: 1,32 (3H, c), 1,35 (3H, c), 3,88 (2H, ушир.с), 4,38-4,48 (1H, м), 6,31-6,46 (2H, м), 6,68-6,73 (1H, м).
Справочный пример 26
2-Этокси-5-фторанилин
1Н ЯМР (CDCl3) dppm: 1,39 (3H, т, J=7,0 Гц), 3,90 (2H, ушир.с), 3,97 (2H, кв, J=7,0 Гц), 6,31-6,46 (2H, м), 6,63-6,68 (1H, м).
Справочный пример 27
5-Фтор-2-морфолин-4-иланилин
1Н ЯМР (CDCl3) dppm: 2,83 (4H, т, J=4,6 Гц), 3,81 (4H, т, J=4,6 Гц), 4,13 (2H, ушир.с), 6,38-6,45 (2H, м), 6,93-6,97 (1H, м).
Справочный пример 28
5-Фтор-2-пирролидин-1-иланилин
1Н ЯМР (CDCl3) dppm: 1,88-1,94 (4H, м), 2,94-3,00 (4H, м), 4,03 (2H, ушир.с), 6,35-6,46 (2H, м), 6,90-6,95 (1H, м).
Справочный пример 29
2-Циклопропилметокси-5-фторанилин
1Н ЯМР (CDCl3) dppm: 0,29-0,35 (2H, м), 0,58-0,65 (2H, м), 1,22-1,29 (1H, м), 3,77 (2H, д, J=6,9 Гц), 3,94 (2H, ушир.с), 6,29-6,46 (2H, м), 6,64 (1H, дд, J=5,1 Гц, J=8,8 Гц).
Справочный пример 30
N1-Циклогексил-4-фтор-N1-метилбензол-1,2-диамин
1Н ЯМР (CDCl3) dppm: 1,11-1,31 (4H, м), 1,55-1,82 (6H, м), 2,57-2,68 (4H, м), 4,18 (2H, ушир.с), 6,33-6,44 (2H, м), 6,92-6,98 (1H, м).
Справочный пример 31
4-Фтор-N1-(2-метоксиэтил)-N1-метилбензол-1,2-диамин
1Н ЯМР (CDCl3) dppm: 2,70 (3H, c), 2,96 (2H, т, J=5,4 Гц), 3,39 (3H, c), 3,45 (2H, т, J=5,4 Гц), 4,38 (2H, ушир.с), 6,33-6,43 (2H, м), 6,93-6,99 (1H, м).
Справочный пример 32
4-Фтор-N1-изобутил-N1-метилбензол-1,2-диамин
1Н ЯМР (CDCl3) dppm: 0,92 (3H, c), 0,94 (3H, c), 1,62-1,83 (1H, м), 2,54-2,60 (5H, м), 6,30-6,49 (2H, м), 6,82-6,93 (1H, м).
Справочный пример 33
4-Фтор-N1-изопропил-N1-метилбензол-1,2-диамин
1Н ЯМР (CDCl3) dppm: 1,05 (3H, c), 1,07 (3H, c), 2,55 (3H, c), 3,06-3,17 (1H, м), 4,16 (2H, ушир.с), 6,34-6,45 (2H, м), 6,91-6,97 (1H, м).
Справочный пример 34
4-Фтор-N1-метил-N1-пропилбензол-1,2-диамин
1Н ЯМР (CDCl3) dppm: 0,86 (3H, т, J=7,4 Гц), 1,41-1,56 (2H, м), 2,57 (3H, c), 2,72 (2H, т, J=7,25 Гц), 4,18 (2H, ушир.с), 6,35-6,44 (2H, м), 6,91-6,97 (1H, м).
Справочный пример 35
N-[3-(2-Амино-4-фторфенокси)пропил]ацетамид
1Н ЯМР (CDCl3) dppm: 1,95-2,05 (2H, м), 1,97 (3H, c), 3,42-3,50 (2H, м), 3,92 (2H, ушир.с), 4,02 (2H, т, J=5,9 Гц), 5,83 (1H, ушир.с), 6,32-6,47 (2H, м), 6,68 (1H, дд, J=5,0 Гц, J=8,8 Гц).
Справочный пример 36
N-[3-(2-Амино-4-фторфенокси)пропил]метансульфонамид
1Н ЯМР (CDCl3) dppm: 2,02-2,11 (2H, м), 2,94 (3H, c), 3,33-3,40 (2H, м), 3,91 (2H, ушир.с), 4,07 (2H, т, J=5,7 Гц), 4,76 (1H, ушир.с), 6,32-6,46 (2H, м), 6,68 (1H, дд, J=5,0 Гц, J=8,8 Гц).
Справочный пример 37
5-Фтор-2-(4,4,4-трифторбутокси)анилин
1Н ЯМР (CDCl3) dppm: 2,01-2,12 (2H, м), 2,22-2,41 (2H, м), 3,87 (2H, ушир.с), 4,01 (2H, т, J=6,0 Гц), 6,32-6,47 (2H, м), 6,65 (1H, дд, J=5,0 Гц, J=8,8 Гц).
Справочный пример 38
1-[3-(2-Амино-4-фторфенокси)пропил]-1,3,3-триметилмочевина
1Н ЯМР (CDCl3) dppm: 1,99-2,10 (2H, м), 2,78 (6H, c), 2,84 (3H, c), 3,37 (2H, т, J=6,9 Гц), 3,94 (2H, ушир.с), 3,97 (2H, т, J=6,1 Гц), 6,30-6,45 (2H, м), 6,65 (1H, дд, J=5,1 Гц, J=8,8 Гц).
Справочный пример 39
5-Фтор-2-(2-метоксиэтокси)анилин
1Н ЯМР (CDCl3) dppm: 3,43 (3H, c), 3,70-3,73 (2H, м), 3,99 (2H, ушир.с), 4,07-4,10 (2H, м), 6,30-6,45 (2H, м), 6,72 (1H, дд, J=5,1 Гц, J=8,7 Гц).
Справочный пример 40
2-Циклопентокси-5-фторанилин
1Н ЯМР (CDCl3) dppm: 1,56-1,66 (2H, м), 1,75-1,87 (6H, м), 3,85 (2H, ушир.с), 4,69-4,72 (1H, м), 6,30-6,45 (2H, м), 6,66 (1H, дд, J=5,1 Гц, J=8,8 Гц).
Справочный пример 41
2-Циклобутилметокси-5-фторанилин
1Н ЯМР (CDCl3) dppm: 1,86-1,96 (4H, м), 2,08-2,16 (2H, м), 2,74-2,80 (1H, м), 3,90 (2H, ушир.с), 3,91 (2H, д, J=6,7 Гц), 6,31-6,45 (2H, м), 6,66 (1H, дд, J=5,1 Гц, J=8,8 Гц).
Справочный пример 42
2-Третбутокси-5-фторанилин
1Н ЯМР (CDCl3) dppm: 1,37 (9H, c), 3,87 (2H, ушир.с), 6,27-6,45 (2H, м), 6,85 (1H, дд, J=5,6 Гц, J=8,8 Гц).
Справочный пример 43
5-Фтор-2-пропилсульфаниланилин
4-Фтор-2-нитро-1-пропилсульфанилбензол (6,7 г, 31,1 ммоль) растворяли в смеси растворителей этанола (40 мл) и воды (4 мл). К полученной смеси добавляли хлорид аммония (17 г, 0,32 моль) и понемногу добавляли порошкообразный цинк (20 г, 0,31 моль). После этого полученную смесь перемешивали при комнатной температуре в течение 1 часа. Нерастворимое вещество удаляли фильтрованием и фильтрат концентрировали при пониженном давлении, получая при этом 5,8 г маслообразного 5-фтор-2-пропилсульфаниланилина коричневого цвета (выход: 93%).
1Н ЯМР (CDCl3) dppm: 0,96 (3H, т, J=7,3 Гц), 1,49-1,64 (2H, м), 2,62 (2H, т, J=7,4 Гц), 4,51 (2H, ушир.с), 6,35-6,47 (2H, м), 7,32-7,38 (1H, м).
Справочный пример 44
4,5-Дифтор-2-пропоксианилин
К раствору 1-бром-4,5-дифтор-2-пропоксибензола (3,0 г, 11,9 ммоль) в толуоле (60 мл) добавляли раствор бензофенонимина (2,38 г, 13,1 ммоль), трис(дибензилиденацетон)дипалладия (275 мг, 0,3 ммоль), 9,9-диметил-4,5-бис(дифенилфосфино)ксантена (XANTPHOS) (347 мг, 0,6 ммоль) и карбоната цезия (5,83 г, 17,9 ммоль) в толуоле (20 мл). Смесь перемешивали в атмосфере азота при 100°С в течение 23 часов. После охлаждения реакционной смеси до комнатной температуры добавляли воду и насыщенный водный раствор хлорида аммония. Полученную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток растворяли в диэтиловом эфире (60 мл) и добавляли концентрированную хлористоводородную кислоту (10 мл) к полученному раствору, который после этого перемешивали в течение 2 часов. К реакционной смеси добавляли 5 н. водный раствор гидроксида натрия (24 мл) для получения рН 11 и концентрировали при пониженном давлении. Остаток растворяли в дихлорметане и промывали насыщенным водным раствором хлорида натрия. Органический слой концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=9:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 850 мг маслообразного 4,5-дифтор-2-пропоксианилина темно-коричневого цвета (выход: 38%).
1Н ЯМР (CDCl3) dppm: 1,04 (3H, т, J=7,4 Гц), 1,75-1,86 (2H, м), 3,71 (2H, ушир.с), 3,88 (2H, т, J=6,5 Гц), 6,51 (1H, дд, J=8,0 Гц, 11,5 Гц), 6,60 (1H, дд, J=7,3 Гц, J=11,8 Гц).
Справочный пример 45
1-(2-Амино-4-фторбензоил)пирролидин
К раствору 4-фторантраниловой кислоты (2,0 г, 12,8 ммоль) в ДМФА (4 мл) добавляли раствор пирролидина (1,93 г, 27,1 ммоль) в ДМФА (4 мл), раствор триэтиламина (3,79 г, 37,5 ммоль) в ДМФА (4 мл), 1-гидроксибензотриазол (HOBt) (3,11 г, 23,0 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (WSC) (3,91 г, 20,4 ммоль) в данном порядке. Смесь перемешивали при комнатной температуре в течение 14 часов. К реакционной смеси добавляли воду и экстрагировали полученную смесь этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=30:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 1,65 г маслообразного 1-(2-амино-4-фторбензоил)пирролидина оранжевого цвета (выход: 62%).
1Н ЯМР (CDCl3) dppm: 1,75-2,00 (4H, м), 3,40-3,75 (4H, м), 4,85 (2H, ушир.с), 6,33-6,40 (2H, м), 7,14-7,21 (1H, м).
Справочный пример 46
Этил α-(гидроксиметилен)-4-метоксифенилацетат
К раствору этил 4-метоксифенилацетата (2,0 г, 10,3 ммоль) в бензоле (10 мл) добавляли гидрид натрия (60% в масле) (467 мг, 11,7 ммоль) при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение 5 минут. Перемешиваемую смесь вновь охлаждали льдом; добавляли к ней этилформиат (1,02 мл, 12,6 ммоль) и перемешивали при комнатной температуре в течение 3 часов. При охлаждении льдом добавляли к реакционной смеси воду и этилацетат и затем добавляли 2 н. хлористоводородную кислоту (6 мл) для разделения реакционной смеси на два слоя. Органический слой концентрировали при пониженном давлении, и остаток затем очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=4:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 1,97 г маслообразного этил α-(гидроксиметилен)-4-метоксифенилацетата слегка красновато-коричневого цвета (выход: 86%). Полученное соединение подвергается замещению азота и хранилось в морозилке.
1Н ЯМР (CDCl3) dppm: 1,28 (3H, т, J=7,1 Гц), 3,81 (3H, c), 4,28 (2H, кв, J=7,1 Гц), 6,87 (2H, д, J=8,8 Гц), 7,16-7,26 (3H, м), 12,02 (1H, д, J=12,5 Гц).
Соединения следующих справочных примеров с 47 по 57 получали способом, аналогичным описанному выше способу справочного примера 46, при использовании соответствующих исходных соединений.
Справочный пример 47
Этил 2,4-диметокси-α-(гидроксиметилен)фенилацетат
1Н ЯМР (CDCl3) dppm: 1,21 (3H, т, J=7,1 Гц), 3,76 (3H, c), 3,81 (3H, c), 4,22 (2H, кв, J=7,1 Гц), 6,43-6,49 (2H, м), 7,00 (1H, д, J=8,9 Гц), 7,12 (1H, д, J=12,6 Гц), 11,89 (1H, д, J=12,6 Гц).
Справочный пример 48
Этил 2,4-дихлор-α-(гидроксиметилен)фенилацетат
1Н ЯМР (CDCl3) dppm: 1,15 (3H, т, J=7,2 Гц), 4,22 (2H, кв, J=7,2 Гц), 7,11-7,26 (3H, м), 7,40-7,43 (1H, м), 12,00 (1H, д, J=12,2 Гц).
Справочный пример 49
Этил α-(гидроксиметилен)-2-метоксифенилацетат
1Н ЯМР (CDCl3) dppm: 1,19 (3H, т, J=7,1 Гц), 3,79 (3H, c), 4,21 (2H, кв, J=7,1 Гц), 6,86-7,68 (5H, м), 11,91 (1H, д, J=12,3 Гц).
Справочный пример 50
Этил α-(гидроксиметилен)-2-изопропокси-4-метоксифенилацетат
1Н ЯМР (CDCl3) dppm: 1,20-1,31 (9H, м), 3,80 (3H, c), 4,17 (2H, кв, J=7,1 Гц), 4,43-4,47 (1H, м), 6,42-6,46 (2H, м), 6,90-7,12 (2H, м), 11,85 (1H, д, J=12,6 Гц).
Справочный пример 51
Этил α-(гидроксиметилен)-4-метокси-2-метилфенилацетат
1Н ЯМР (CDCl3) dppm: 1,20 (3H, т, J=7,2 Гц), 2,19 (3H, c), 3,80 (3H, c), 4,22 (2H, кв, J=1,2 Гц), 6,54-6,75 (2H, м), 7,02-7,26 (2H, м), 11,94 (1H, д, J=12,7 Гц).
Справочный пример 52
Этил 2-фтор-α-(гидроксиметилен)-4-метоксифенилацетат
1Н ЯМР (CDCl3) dppm: 1,22 (3H, т, J=7,1 Гц), 3,80 (3H, c), 4,21 (2H, кв, J=7,1 Гц), 6,61-6,69 (2H, м), 7,03-7,26 (2H, м), 12,05 (1H, д, J=12,3 Гц).
Справочный пример 53
Этил 4-этокси-α-(гидроксиметилен)-2-метоксифенилацетат
1Н ЯМР (CDCl3) dppm: 1,19-1,45 (6H, м), 3,75 (3H, c), 4,00-4,26 (4H, м), 6,42-6,48 (2H, м), 6,97-7,26 (2H, м), 11,86 (1H, д, J=12,3 Гц).
Справочный пример 54
Этил α-(гидроксиметилен)-4-изопропокси-2-метоксифенилацетат
1Н ЯМР (CDCl3) dppm: 1,20-1,31 (9H, м), 3,75 (3H, c), 4,16 (2H, кв, J=7,2 Гц), 4,43-4,47 (1H, м), 6,43-6,48 (2H, м), 6,99-7,22 (2H, м), 11,87 (1H, д, J=12,3 Гц).
Справочный пример 55
Этил 4-циклопропилметокси-α-(гидроксиметилен)фенилацетат
1Н ЯМР (CDCl3) dppm: 0,35-0,37 (4H, м), 1,24 (3H, т, J=7,1 Гц), 3,81-3,83 (2H, м), 4,25 (2H, кв, J=1,1 Гц), 6,85-6,91 (2H, м), 7,16-7,27 (3H, м), 12,02 (1H, д, J=12,5 Гц).
Справочный пример 56
Этил α-(гидроксиметилен)-4-метилсульфанилфенилацетат
1Н ЯМР (CDCl3) dppm: 1,22 (3H, т, J=7,1 Гц), 2,47 (3H, c), 4,09 (2H, кв, J=7,1 Гц), 6,85-6,94 (2H, м), 7,16-7,26 (3H, м), 11,99 (1H, д, J=12,3 Гц).
Справочный пример 57
Этил 4-этокси-α-(гидроксиметилен)фенилацетат
1Н ЯМР (CDCl3) dppm: 1,23-1,47 (6H, м), 4,00-4,32 (4H, м), 6,85-6,88 (2H, м), 7,15-7,27 (3H, м), 12,00 (1H, д, J=12,5 Гц).
Справочный пример 58
Этил 4-метокси-α-пропионилфенилацетат
К раствору этилпропионилацетата (3,8 г, 26,3 ммоль) и 4-йоданизола (5,0 г, 21,3 ммоль) в диметилсульфоксиде (ДМСО) (40 мл) добавляли L-пролин (980 мг, 8,52 ммоль), йодид меди(I) (810 мг, 4,26 ммоль) и карбонат цезия (27,7 г, 85,2 ммоль) в данном порядке. Смесь перемешивали в атмосфере азота при температуре от 40 до 45°С в течение 27 часов. Реакционную смесь охлаждали до комнатной температуры и затем добавляли воду и водный раствор хлорида аммония. Полученную смесь экстрагировали этилацетатом. Органический слой дважды промывали насыщенным водным раствором хлорида натрия и концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=19:1→8:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 2,97 г маслообразного этил 4-метокси-α-пропионилфенилацетата желтого цвета (выход: 56%).
1Н ЯМР (CDCl3) dppm: 1,01-1,11 (3H, м), 1,18-1,31 (3H, м), 2,52-2,61 (2H, м), 3,80 и 3,82 (3H, c), 4,15-4,24 (2H, м), 4,65 (0,6H, c), 6,84-7,28 (4H, м), 13,13 (0,4H, c).
Соединение следующего справочного примера 59 получали способом, аналогичным описанному выше способу справочного примера 58, при использовании соответствующих исходных соединений.
Справочный пример 59
Этил α-ацетил-4-метоксифенилацетат
1Н ЯМР (CDCl3) dppm: 1,16-1,29 (3H, м), 1,85 (1,4H, c), 2,17 (1,6H, c), 3,80 и 3,82 (1,4 и 1,6H, c), 4,13-4,25 (2H, м), 4,62 (0,6H, c), 6,85-7,28 (4H, м), 13,09 (0,4H, c).
Справочный пример 60
5-[(5-Фтор-2-пропоксифениламино)метилен]-2,2-диметил[1,3]диоксан-4,6-дион
К метилортоформиату (31 мл) добавляли кислоту Мелдрума (5,29 г, 36,7 ммоль) и перемешивали смесь в течение 2 часов при кипячении с обратным холодильником. Полученную смесь охлаждали до 50°С и добавляли к ней 5-фтор-2-пропоксианилин (4,28 г, 25,3 ммоль) и метилортоформиат (3 мл). Полученную смесь перемешивали в течение 6 часов при кипячении с обратным холодильником. После этого полученную реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток перекристаллизовывали из метанола, получая при этом 7,61 г порошкообразного 5-[(5-фтор-2-пропоксифениламино)метилен]-2,2-диметил[1,3]диоксан-4,6-диона бледно-коричневого цвета (выход: 93%).
1Н ЯМР (CDCl3) dppm: 1,12 (3H, т, J=7,4 Гц), 1,75 (6H, c), 1,85-1,98 (2H, м), 4,02 (2H, т, J=6,3 Гц), 6,86-6,91 (2H, м), 7,06-7,10 (1H, м), 8,60 (1H, д, J=14,6 Гц), 11,68 (1H, д, J=14,8 Гц).
Соединение следующего справочного примера 61 получали способом, аналогичным описанному выше способу справочного примера 60, при использовании соответствующих исходных соединений.
Справочный пример 61
5-[(2-Циклопропилметокси-5-фторфениламино)метилен]-2,2-диметил[1,3]диоксан-4,6-дион
1Н ЯМР (CDCl3) dppm: 0,39-0,43 (2H, м), 0,65-0,73 (2H, м), 1,31-1,37 (1H, м), 1,75 (6H, c), 3,92 (2H, д, J=6,9 Гц), 6,86-6,91 (2H, м), 7,07-7,11 (1H, м), 8,60 (1H, д, J=14,5 Гц), 11,69 (1H, д, J=14,3 Гц).
Справочный пример 62
5-Фтор-8-пропокси-1Н-хинолин-4-он
5-[(5-Фтор-2-пропоксифениламино)метилен]-2,2-диметил-[1,3]-диоксан-4,6-дион (7,6 г, 23,5 ммоль) добавляли к дифениловому эфиру (15 мл) и нагревали смесь при помощи колбонагревателя, и затем оставляли при кипении с обратным холодильником на 2 часа. После охлаждения реакционной смеси до комнатной температуры добавляли этилацетат (5 мл) и н-гексан (10 мл). Полученную смесь перемешивали и выделяли полученное нерастворимое вещество фильтрованием. Фильтрат перекристаллизовывали из смеси растворителей этилацетат-н-гексан, получая при этом 3,15 г порошкообразного 5-фтор-8-пропокси-1Н-хинолин-4-она темно-коричневого цвета (выход: 61%).
1Н ЯМР (ДМСО-d6) dppm: 1,03 (3H, т, J=7,3 Гц), 1,74-1,88 (2H, м), 4,07 (2H, т, J=6,4 Гц), 5,97 (1H, д, J=7,4 Гц), 6,87 (1H, дд, J=8,8 Гц, 11,9 Гц), 7,13 (1H, дд, J=4,0 Гц, J=8,8 Гц), 7,70 (1H, т, J=1,2 Гц), 11,07 (1H, ушир.с).
Соединение следующего справочного примера 63 получали способом, аналогичным описанному выше способу справочного примера 62, при использовании соответствующих исходных соединений.
Справочный пример 63
8-Циклопропилметокси-5-фтор-1Н-хинолин-4-он
1Н ЯМР (ДМСО-d6) dppm: 0,34-0,40 (2H, м), 0,55-0,61 (2H, м), 1,27-1,33 (1H, м), 3,98 (2H, д, J=7,0 Гц), 5,97 (1H, д, J=7,4 Гц), 6,86 (1H, дд, J=8,8 Гц, J=11,9 Гц), 7,13 (1H, дд, J=4,0 Гц, J=8,8 Гц), 7,71 (1H, т, J=7,4 Гц), 11,10 (1H, ушир.с).
Справочный пример 64
5-Фтор-2-метил-8-пропокси-1Н-хинолин-4-он
К раствору 5-фтор-2-пропоксианилина (10 г, 59 ммоль) и этилацетоацетата (7,7 г, 59 ммоль) в бензоле (200 мл) добавляли Amberlyst 15 (1,0 г, продукт Sigma Aldrich Corp.). Смесь перемешивали при кипячении с обратным холодильником в течение 6 часов и использовании насадки Дина-Старка. Реакционную смесь охлаждали до комнатной температуры, смолу удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. К остатку добавляли дифениловый эфир (20 мл). Смесь нагревали при помощи колбонагревателя и перемешивали при кипении с обратным холодильником в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры нерастворимое вещество, полученное в результате добавления смеси н-гексан-этилацетат (2:1), выделяли фильтрованием. Оставшееся на фильтре вещество промывали смесью н-гексан-этилацетат (2:1) и сушили, получая при этом 6,0 г порошкообразного 5-фтор-2-метил-8-пропокси-1Н-хинолин-4-она бледно-желтого цвета (выход: 43%).
1Н ЯМР (ДМСО-d6) dppm: 0,97 (3H, т, J=7,3 Гц), 1,77-1,87 (2H, м), 2,34 (3H, c), 4,08 (2H, т, J=6,4 Гц), 5,84 (1H, c), 6,79-6,88 (1H, м), 7,10-7,14 (1H, м), 10,58 (1H, ушир.с).
Справочный пример 65
5-Фтор-3-йод-8-пропокси-1Н-хинолин-4-он
5-Фтор-8-пропокси-1Н-хинолин-4-он (1,0 г, 4,52 ммоль) суспендировали в ДМФА (11 мл) и добавляли к суспензии карбонат калия (0,7 г, 5,06 ммоль) и йод (1,27 г, 5,00 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в водный раствор тиосульфата натрия (3,94 г, 25 ммоль) (45 мл). Смесь перемешивали в течение 5 минут. К полученной реакционной смеси добавляли этилацетат и перемешивали, выделяя при этом нерастворимое вещество фильтрованием. Фильтрат отделяли и промывали органический слой насыщенным водным раствором хлорида натрия и затем концентрировали при пониженном давлении. Остаток и выделенное нерастворимое вещество объединяли, и затем очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=50:1→40:1). Очищенный продукт концентрировали досуха при пониженном давлении, получая при этом 1,25 г порошкообразного 5-фтор-3-йод-8-пропокси-1Н-хинолин-4-она бледного темно-коричневого цвета (выход: 80%).
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,4 Гц), 1,78-1,86 (2H, м), 4,09 (2H, т, J=6,5 Гц), 6,97 (1H, дд, J=8,8 Гц, J=11,9 Гц), 7,19 (1H, дд, J=4,0 Гц, J=8,8 Гц), 8,19 (1H, c), 11,44 (1H, ушир.с).
Соединения следующих справочных примеров 66 и 67 получали способом, аналогичным описанному выше способу справочного примера 65, при использовании соответствующих исходных соединений.
Справочный пример 66
5-Фтор-3-йод-2-метил-8-пропокси-1Н-хинолин-4-он
1Н ЯМР (CDCl3) dppm: 0,97 (3H, т, J=7,4 Гц), 1,78-1,88 (2H, м), 2,70 (3H, c), 6,92-7,00 (1H, м), 7,17-7,22 (1H, м).
Справочный пример 67
8-Циклопропилметокси-5-фтор-3-йод-1Н-хинолин-4-он
1Н ЯМР (ДМСО-d6) dppm: 0,36-0,40 (2H, м), 0,56-0,63 (2H, м), 1,28-1,31 (1H, м), 3,99 (2H, д, J=7,0 Гц), 6,97 (1H, дд, J=8,8 Гц, J=11,9 Гц), 7,19 (1H, дд, J=4,0 Гц, J=8,8 Гц), 8,19 (1H, c), 11,48 (1H, ушир.с).
Справочный пример 68
8-Циклопропилметокси-1-этил-5-фтор-3-йод-1Н-хинолин-4-он
К раствору 8-циклопропилметокси-5-фтор-3-йод-1Н-хинолин-4-она (910 мг, 2,53 ммоль) в ДМФА (5 мл) добавляли карбонат калия (450 мг, 3,26 ммоль). Смесь перемешивали в течение 15 минут при комнатной температуре. Добавляли к ней йодистый этил (0,31 мл, 3,87 ммоль) и перемешивали полученную смесь при 60°С в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры добавляли воду и экстрагировали полученную смесь этилацетатом. Органический слой концентрировали при пониженном давлении, а остаток затем очищали колоночной хроматографией на силикагеле (дихлорметан:этилацетат=40:1→15:1). Очищенный продукт концентрировали досуха при пониженном давлении, получая при этом 750 мг порошкообразного 8-циклопропилметокси-1-этил-5-фтор-3-йод-1Н-хинолин-4-она бледно-темно-коричневого цвета (выход: 77%).
1Н ЯМР (ДМСО-d6) dppm: 0,34-0,38 (2H, м), 0,57-0,64 (2H, м), 1,26-1,36 (4H, м), 3,93 (2H, д, J=7,3 Гц), 4,56 (2H, кв, J=7,0 Гц), 7,05 (1H, дд, J=8,9 Гц, J=11,4 Гц), 7,24 (1H, дд, J=4,6 Гц, J=9,0 Гц), 8,45 (1H, c).
Справочный пример 69
2,2,2-Трифтор-N-(5-фтор-2-пропоксифенил)ацетамид
Раствор 5-фтор-2-пропоксианилина (10,0 г, 59,1 ммоль) в дихлорметане (60 мл) охлаждали льдом и добавляли к нему триэтиламин (16,5 мл). Затем добавляли ангидрид трифторуксусной кислоты (14,8 г, 70,5 ммоль) и перемешивали полученную смесь при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и экстрагировали полученную смесь дихлорметаном. Органический слой промывали водой и сушили над безводным сульфатом натрия. Полученный сухой продукт концентрировали при пониженном давлении и остаток затем очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=10:1). Очищенный продукт концентрировали досуха при пониженном давлении, получая при этом 15,83 г порошкообразного 2,2,2-трифтор-N-(5-фтор-2-пропоксифенил)ацетамида белого цвета (выход: 99%).
1Н ЯМР (CDCl3) dppm: 1,03 (3H, т, J=7,5 Гц), 1,79-1,93 (2H, м), 3,98 (2H, т, J=6,5 Гц), 6,80-6,86 (2H, м), 8,10-8,12 (1H, м), 8,64 (1H, ушир.с).
Справочный пример 70
Этиловый эфир 4,4,4-трифтор-3-(5-фтор-2-пропоксифениламино)бута-2-еновой кислоты
К раствору 2,2,2-трифтор-N-(5-фтор-2-пропоксифенил)ацетамида (15,83 г, 59,1 ммоль) в толуоле (100 мл) добавляли карбоэтоксиметилентрифенилфосфоран (41,52 г, 119,2 ммоль). Смесь перемешивали в атмосфере азота при кипячении с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, концентрировали при пониженном давлении и остаток затем очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=10:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 19,7 г маслообразного этилового эфира 4,4,4-трифтор-3-(5-фтор-2-пропоксифениламино)бута-2-еновой кислоты желтого цвета (выход: 99%).
1Н ЯМР (CDCl3) dppm: 1,02 (3H, т, J=7,5 Гц), 1,28 (3H, т, 7,0 Гц), 1,74-1,88 (2H, м), 3,85 (2H, т, J=6,5 Гц), 4,17 (2H, кв, J=7,0 Гц), 5,41 (1H, c), 6,77-6,97 (3H, м), 9,77 (1H, ушир.с).
Справочный пример 71
5-Фтор-8-пропокси-2-трифторметил-1Н-хинолин-4-он
К этиловому эфиру 4,4,4-трифтор-3-(5-фтор-2-пропоксифениламино)бута-2-еновой кислоты (19,7 г, 59,0 ммоль) добавляли дифениловый эфир (15 мл) и перемешивали смесь в течение 1,5 часов при кипячении с обратным холодильником. Реакционную смесь охлаждали до комнатной температуры, добавляли н-гексан и выделяли выпавший осадок фильтрованием. Оставшиеся на фильтре вещество промывали н-гексаном и сушили, получая при этом 16,2 г порошкообразного 5-фтор-8-пропокси-2-трифторметил-1Н-хинолин-4-она белого цвета (выход: 94%).
1Н ЯМР (ДМСО-d6) dppm: 1,00 (3H, т, J=7,5 Гц), 1,76-1,90 (2H, м), 4,07 (2H, т, J=6,5 Гц), 7,18-7,32 (3H, м), 12,26 (1H, ушир.с).
Справочный пример 72
5-Фтор-3-йод-8-пропокси-2-трифторметил-1Н-хинолин-4-он
К раствору 5-фтор-8-пропокси-2-трифторметил-1Н-хинолин-4-она (6,0 г, 20,7 ммоль) в ДМФА (20 мл) добавляли карбонат калия (3,73 г, 27 ммоль) и йод (6,85 г, 27 ммоль) в данном порядке и перемешивали смесь при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли насыщенный водный раствор сульфита натрия (20 мл) и этилацетат и выделяли выпавший осадок фильтрованием. Фильтрат промывали водой и затем сушили над безводным сульфатом натрия. Высушенный фильтрат концентрировали при пониженном давлении. Остаток и вещество, выделенное предварительным фильтрованием, объединяли и растворяли в этаноле, и затем концентрировали. Остаток перекристаллизовывали из смеси растворителей этилацетат-н-гексан, получая при этом 4,7 г порошкообразного 5-фтор-3-йод-8-пропокси-2-трифторметил-1Н-хинолин-4-она белого цвета (выход: 55%).
1Н ЯМР (ДМСО-d6) dppm: 0,96 (3H, т, J=7,5 Гц), 1,70-1,80 (2H, м), 3,95 (2H, т, J=6,5 Гц), 6,64-6,85 (2H, м), 12,02 (1H, ушир.с).
Справочный пример 73
1-(5-Бром-2-циклопентилоксифенил)этанон
К раствору 5'-бром-2'-гидроксиацетофенона (8,5 г, 39,5 ммоль) в ДМФА (10 мл) добавляли карбонат калия (6,55 г, 47,4 ммоль), циклопентилбромид (8,25 г, 55,3 ммоль) и ДМФА (5 мл), и перемешивали полученную смесь при 60°С в течение 4,5 часов. К полученной смеси добавляли карбонат калия (3,0 г, 21,7 ммоль) и циклопентилбромид (2,0 г, 13,4 ммоль) и перемешивали при 60°С в течение 9 часов. После охлаждения реакционной смеси до комнатной температуры добавляли воду и экстрагировали полученную смесь этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и затем концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=9:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 11,3 г маслообразного 1-(5-бром-2-циклопентилоксифенил)этанона бледно-желтого цвета (выход: 100%).
1Н ЯМР (CDCl3) dppm: 1,68-1,95 (8H, м), 2,58 (3H, c), 4,83-4,87 (1H, м), 6,83 (1H, д, J=8,9 Гц), 7,49 (1H, дд, J=2,6 Гц, 8,9 Гц), 7,82 (1H, д, J=2,6 Гц).
Справочный пример 74
Оксим 1-(5-бром-2-циклопентилоксифенил)этанона
1-(5-Бром-2-циклопентилоксифенил)этанон (5,0 г, 17,65 ммоль) растворяли в смеси растворителей хлороформа (18 мл) и метанола (70 мл). К полученному раствору добавляли гидрохлорид гидроксиламина (1,88 г, 27,0 ммоль) и пиридин (4,36 мл, 54,1 ммоль) и перемешивали смесь в течение 6 часов при кипении с обратным холодильником. Реакционную смесь охлаждали до комнатной температуры, и затем концентрировали при пониженном давлении. К остатку добавляли 2 н. хлористоводородную кислоту (13,9 мл) и экстрагировали полученную смесь дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом магния и концентрировали досуха при пониженном давлении. Остаток промывали н-гексаном и сушили, получая при этом 4,6 г порошкообразного оксима 1-(5-бром-2-циклопентилоксифенил)этанона белого цвета (выход: 87%).
1Н ЯМР (CDCl3) dppm: 1,65-1,90 (8H, м), 2,17 (3H, c), 4,72-4,76 (1H, м), 6,76 (1H, д, J=8,4 Гц), 7,35-7,41 (2H, м), 7,99 (1H, ушир.с).
Справочный пример 75
N-(5-Бром-2-циклопентилоксифенил)ацетамид
Оксим 1-(5-бром-2-циклопентилоксифенил)этанона (4,56 г, 15,3 ммоль) суспендировали в ацетонитриле (100 мл). Добавляли к нему хлорид индия(III) (507 мг, 2,29 ммоль) и нагревали полученную смесь при кипении с обратным холодильником в течение 2 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Остаток экстрагировали дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия и затем концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=8:1→4:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 3,41 г маслообразного N-(5-бром-2-циклопентилоксифенил)ацетамида бледно-желтого цвета (выход: 75%).
1Н ЯМР (CDCl3) dppm: 1,67-1,94 (8H, м), 2,18 (3H, c), 4,75-4,81 (1H, м), 6,72 (1H, д, J=8,7 Гц), 7,10 (1H, дд, J=2,3 Гц, 8,7 Гц), 7,67 (1H, ушир.с), 8,55 (1H, д, J=2,3 Гц).
Справочный пример 76
5-Бром-2-циклопентилоксианилин
К раствору N-(5-бром-2-циклопентилоксифенил)ацетамида (3,4 г, 11,4 ммоль) в этаноле (100 мл) добавляли концентрированную хлористоводородную кислоту (5,8 мл) и перемешивали полученную смесь в течение 3 часов при кипении с обратным холодильником. После охлаждения реакционной смеси до комнатной температуры добавляли 5 н. раствор гидроксида натрия (14,2 мл) для получения рН 11. После этого экстрагировали полученную смесь дихлорметаном. Органический слой промывали насыщенным водным раствором хлорида натрия и затем концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=4:1). Очищенный продукт концентрировали при пониженном давлении, получая при этом 2,97 г маслообразного 5-бром-2-циклопентилоксианилина бледно-желтого цвета (выход: 100%).
1Н ЯМР (CDCl3) dppm: 1,62-1,89 (8H, м), 3,80 (2H, ушир.с), 4,71-4,75 (1H, м), 6,61 (1H, д, J=8,4 Гц), 6,75-6,81 (2H, м).
Пример 1
5-Фтор-3-фуран-3-ил-8-пропокси-1Н-хинолин-4-он
5-Фтор-3-йод-8-пропокси-1Н-хинолин-4-он (780 мг, 2,24 ммоль) суспендировали в смеси растворителей толуола (10 мл) и метанола (1,6 мл) и добавляли туда фуран-3-бороновую кислоту (752 мг), тетракис(трифенилфосфин)палладий (130 мг, 0,11 ммоль) и 2 н. водный раствор карбоната натрия (2,25 мл) в данном порядке. Смесь перемешивали в атмосфере азота при 110°С в течение 20 часов. После охлаждения реакционной смеси до комнатной температуры добавляли воду и экстрагировали полученную смесь дихлорметаном. Органический слой концентрировали при пониженном давлении, после этого остаток очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=60:1→50:1). Очищенный продукт концентрировали при пониженном давлении и перекристаллизовывали из этанола, получая при этом 180 мг порошкообразного 5-фтор-3-фуран-3-ил-8-пропокси-1Н-хинолин-4-она бледно-желтого цвета (выход: 58%).
Температура плавления 214-215°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, J=7,3 Гц), 1,78-1,87 (2H, м), 4,09 (2H, т, J=6,4 Гц), 6,87-6,95 (2H, м), 7,13 (1H, дд, J=3,8 Гц, J=8,8 Гц), 7,67 (1H, c), 8,11 (1H, c), 8,51 (1H, c), 11,50 (1H, ушир.с).
Соединения следующих примеров со 2 по 5 получали способом, аналогичным способу описанного выше примера 1, с использованием соответствующих исходных соединений.
Пример 2
5-Фтор-3-(3-фтор-4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Серый порошок (этанол).
Температура плавления 194-195°С.
1Н ЯМР (ДМСО-d6) dppm: 1,03 (3H, т, J=7,3 Гц), 1,79-1,87 (2H, м), 3,84 (3H, c), 4,09 (2H, т, J=6,4 Гц), 6,90 (1H, дд, J=8,7 Гц, J=12,1 Гц), 7,12-7,19 (2H, м), 7,35-7,39 (1H, м), 7,56 (1H, дд, J=2,0 Гц, J=13,5 Гц), 7,87 (1H, c), 11,40 (1H, ушир.с).
Пример 3
5-Фтор-8-пропокси-3-тиофен-3-ил-1Н-хинолин-4-он
Бледно-коричневый порошок (этанол).
Температура плавления 208-210°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,4 Гц), 1,75-1,89 (2H, м), 4,08 (2H, т, J=6,4 Гц), 6,90 (1H, дд, J=8,7 Гц, J=12,1 Гц), 7,13 (1H, дд, J=3,9 Гц, J=8,8 Гц), 7,50-7,57 (2H, м), 8,14 (1H, c), 8,19-8,21 (1H, м), 11,42 (1H, ушир.с).
Пример 4
3-(3-Хлор-4-метоксифенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Бледно-желтый порошок (этанол).
Температура плавления 217-218°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,3 Гц), 1,78-1,86 (2H, м), 3,85 (3H, с), 4,08 (2H, т, J=6,4 Гц), 6,90 (1Н, дд, J=8,8 Гц, J=12,0 Гц), 7,10-7,15 (2H, м), 7,51 (1Н, дд, J=2,1 Гц, J=8,5 Гц), 7,74 (1H, д, J=2,1 Гц), 7,87 (1Н, с), 11,45 (1H, ушир.с).
Пример 5
5-Фтор-8-пропокси-3-(4-трифторметоксифенил)-1Н-хинолин-4-он
Бледно-серый порошок (этанол).
Температура плавления 212-214°С.
1Н ЯМР (ДМСО-d6) dppm: 1,03 (3H, т, J=7,3 Гц), 1,79-1,87 (2H, м), 4,09 (2H, т, J=6,4 Гц), 6,92 (1H, дд, J=8,8 Гц, J=12,0 Гц), 7,16 (1H, дд, J=3,9 Гц, J=8,8 Гц), 7,35 (2H, д, J=8,5 Гц), 7,73 (2H, д, J=8,7 Гц), 7,91 (1H, c), 11,45 (1H, ушир.с).
Пример 6
5-Фтор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
К раствору 5-фтор-2-пропоксианилина (16,25 г, 96,0 ммоль) и этил α-(гидроксиметилен)-4-метоксифенилацетата (21,34 г, 96,0 ммоль) в бензоле (150 мл) добавляли Amberlyst 15 (1,0 г, продукт Sigma Aldrich Corp.). Смесь нагревали при кипении с обратным холодильником в течение 14 часов при использовании насадки Дина-Старка и перемешивании. Реакционную смесь охлаждали до комнатной температуры, смолу удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. К остатку добавляли дифениловый эфир (40 мл) и нагревали смесь при помощи колбонагревателя, и перемешивали при кипении с обратным холодильником в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и непосредственно очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=100:0→30:1→20:1). Очищенный продукт концентрировали при пониженном давлении и остаток перекристаллизовывали из этанола, получая при этом 5,28 г порошкообразного 5-фтор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-она бледно-желтого цвета (выход: 17%).
Температура плавления 196-197°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,3 Гц), 1,78-1,86 (2H, м), 3,75 (3H, c), 4,07 (2H, т, J=6,4 Гц), 6,83-6,96 (3H, м), 7,11 (1H, дд, J=3,9 Гц, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц), 7,81 (1H, c), 11,50 (1H, ушир.с).
Соединения следующих примеров с 7 по 46 получали способом, аналогичным способу описанного выше примера 6, с использованием соответствующих исходных соединений.
Пример 7
5-Фтор-3-(2-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 193-195°С.
1Н ЯМР (CDCl3) dppm: 1,05 (3H, т, J=7,5 Гц), 1,82-1,97 (2H, м), 3,77 (3H, c), 4,05 (2H, т, J=6,3 Гц), 6,77-7,02 (4H, м), 7,26-7,29 (1H, м), 7,42-7,45 (1H, м), 7,72-7,74 (1H, м), 8,83 (1H, ушир.с).
Пример 8
3-(2,4-Диметоксифенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 116-118°С.
1Н ЯМР (CDCl3) dppm: 1,07 (3H, т, J=7,5 Гц), 1,84-1,98 (2H, м), 3,76 (3H, c), 3,84 (3H, c), 4,06 (2H, т, J=7,5 Гц), 6,54-6,58 (2H, м), 6,77-6,92 (2H, м), 7,38-7,42 (1H, м), 7,72-7,75 (1H, м), 8,79 (1H, ушир.с).
Пример 9
5-Фтор-8-изопропокси-3-(4-метоксифенил)-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 193-194°С.
1Н ЯМР (CDCl3) dppm: 1,39 (6H, д, J=5,0 Гц), 3,79 (3H, c), 4,58 (1H, кв, J=5,0 Гц), 6,79-6,92 (4H, м), 7,54-7,57 (2H, м), 7,68-7,71 (1H, м), 8,80 (1H, ушир.с).
Пример 10
3-(2,4-Дихлорфенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 256-259°С.
1Н ЯМР (ДМСО-d6) dppm: 1,01 (3H, т, J=7,5 Гц), 1,79-1,87 (2H, м), 4,08 (2H, т, J=6,3 Гц), 6,88-6,98 (1H, м), 6,96-7,72 (1H, м), 7,37-7,47 (2H, м), 7,65-7,67 (1H, м), 7,75-7,77 (1H, м), 11,42 (1H, ушир.с).
Пример 11
8-Этокси-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 155-156°С.
1Н ЯМР (CDCl3) dppm: 1,46 (3H, т, J=7,5 Гц), 3,81 (3H, c), 4,14 (2H, кв, J=7,5 Гц), 6,77-6,94 (4H, м), 7,54-7,60 (2H, м), 7,71-7,73 (1H, м), 9,02 (1H, ушир.с).
Пример 12
3-(2,4-Диметоксифенил)-8-этокси-5-фтор-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 154-155°С.
1Н ЯМР (CDCl3) dppm: 1,44 (3H, т, J=7,5 Гц), 3,73 (3H, c), 3,81 (3H, c), 4,12 (2H, кв, J=7,5 Гц), 6,50-6,53 (2H, м), 6,54-6,89 (2H, м), 7,35-7,39 (1H, м), 7,69-7,72 (1H, м), 8,97 (1H, ушир.с).
Пример 13
3-(2,4-Дихлорфенил)-8-этокси-5-фтор-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 236-237°С.
1Н ЯМР (ДМСО-d6) dppm: 1,40 (3H, т, J=1,5 Гц), 4,17 (2H, кв, J=7,5 Гц), 6,88-7,00 (1H, м), 7,22-7,32 (1H, м), 7,38-7,45 (2H, м), 7,64-7,65 (1H, м), 7,74-7,75 (1H, м), 11,40 (1H, ушир.с).
Пример 14
5-Фтор-3-(4-метоксифенил)-8-морфолин-4-ил-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 249-251°С.
1Н ЯМР (CDCl3) dppm: 2,75-3,22 (4H, м), 3,65-4,15 (4H, м), 6,85-6,93 (3H, м), 7,34-7,40 (1H, м), 7,54-7,58 (2H, м), 7,74-7,77 (1H, м), 10,02 (1H, ушир.с).
Пример 15
5-Фтор-3-(2-изопропокси-4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 204-206°С.
1Н ЯМР (CDCl3) dppm: 1,09 (3H, т, J=6,3 Гц), 1,23 (3H, c), 1,26 (3H, c), 1,87-2,01 (2H, м), 3,83 (3H, c), 4,08 (2H, т, J=6,3 Гц), 4,34-4,50 (1H, м), 6,55-6,60 (2H, м), 6,78-6,93 (2H, м), 7,50 (1H, д, J=7,5 Гц), 7,80 (1H, д, J=7,5 Гц), 8,73 (1H, ушир.с).
Пример 16
5-Фтор-3-(4-метокси-2-метилфенил)-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 197-199°С.
1Н ЯМР (CDCl3) dppm: 1,06 (3H, т, J=6,3 Гц), 1,80-2,00 (2H, м), 2,24 (3H, c), 3,80 (3H, c), 4,07 (2H, т, J=6,3 Гц), 6,70-6,94 (4H, м), 7,07 (1H, д, J=7,5 Гц), 7,54 (1H, д, J=7,5 Гц), 8,80 (1H, ушир.с).
Пример 17
5-Фтор-3-(2-фтор-4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат-этанол).
Температура плавления 230-232°С.
1Н ЯМР (CDCl3) dppm: 1,05 (3H, т, J=7,5 Гц), 1,80-2,00 (2H, м), 3,80 (3H, c), 4,06 (2H, т, J=7,5 Гц), 6,64-6,93 (4H, м), 7,53-7,60 (1H, м), 7,74-7,78 (1H, м), 8,86 (1H, ушир.с).
Пример 18
5-Фтор-3-(4-метоксифенил)-8-пирролидин-1-ил-1Н-хинолин-4-он
Бледно-коричневый порошок (этилацетат-н-гексан).
Температура плавления 100-105°С.
1Н ЯМР (CDCl3) dppm: 1,90-2,08 (4H, м), 3,01-3,20 (4H, м), 3,81 (3H, c), 6,81-6,94 (3H, м), 7,29-7,34 (1H, м), 7,55-7,60 (2H, м), 7,74-7,76 (1H, м), 9,41 (1H, ушир.с).
Пример 19
3-(4-Этокси-2-метоксифенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Бледно-коричневый порошок (этилацетат).
Температура плавления 118-120°С.
1Н ЯМР (CDCl3) dppm: 1,06 (3H, т, J=7,5 Гц), 1,39 (3H, т, J=7,5 Гц), 1,83-1,98 (2H, м), 3,75 (3H, c), 4,00-4,14 (4H, м), 6,51-6,55 (2H, м), 6,76-6,91 (2H, м), 7,38 (1H, д, J=6,2 Гц), 7,72 (1H, д, J=6,2 Гц), 8,65 (1H, ушир.с).
Пример 20
5-Фтор-3-(4-изопропокси-2-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат-н-гексан).
Температура плавления 113-115°С.
1Н ЯМР (CDCl3) dppm: 1,04 (3H, т, J=7,5 Гц), 1,33 (3H, c), 1,36 (3H, c), 1,80-1,95 (2H, м), 3,72 (3H, c), 4,03 (2H, т, J=7,5 Гц), 4,50-4,71 (1H, м), 6,49-6,53 (2H, м), 6,78-6,86 (2H, м), 7,34-7,38 (1H, м), 7,42-7,74 (1H, м), 8,82 (1H, ушир.с).
Пример 21
5,6-Дифтор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Бледно-коричневый порошок (этилацетат-н-гексан).
Температура плавления 198-200°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,3 Гц), 1,78-1,86 (2H, м), 3,75 (3H, c), 4,11 (2H, т, J=6,4 Гц), 6,93 (2H, д, J=8,8 Гц), 7,38 (1H, дд, J=6,5 Гц, J=12,3 Гц), 7,54 (2H, д, J=8,8 Гц), 7,81 (1H, c), 11,50 (1H, ушир.с).
Пример 22
8-Бром-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 134-135°С.
1Н ЯМР (ДМСО-d6) dppm: 3,78 (3H, c), 6,94-7,02 (3H, м), 7,52 (2H, д, J=6,3 Гц), 7,84 (1H, c), 7,89-8,00 (1H, м), 11,20 (1H, ушир.с).
Пример 23
5-Фтор-3-(4-метоксифенил)-8-(пирролидин-1-карбонил)-1Н-хинолин-4-он
Оранжевый порошок (этилацетат).
Температура плавления 236-237°С.
1Н ЯМР (ДМСО-d6) dppm: 1,77-1,91 (4H, м), 3,29-3,34 (2H, м), 3,54-3,59 (2H, м), 3,76 (3H, c), 6,94 (2H, д, J=8,7 Гц), 7,02 (1H, дд, J=8,3 Гц, J=11,8 Гц), 7,53 (2H, д, J=8,7 Гц), 7,71 (1H, дд, J=5,1 Гц, J=8,3 Гц), 7,88 (1H, c), 11,26 (1H, c).
Пример 24
8-Циклопропилметокси-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат-этанол).
Температура плавления 190-191°С.
1Н ЯМР (ДМСО-d6) dppm: 0,33-0,39 (2H, м), 0,55-0,62 (2H, м), 1,26-1,34 (1H, м), 3,75 (3H, c), 3,99 (2H, д, J=7,0 Гц), 6,83-6,95 (3H, м), 7,12 (1H, дд, J=3,8 Гц, J=8,8 Гц), 7,53 (2H, д, J=8,6 Гц), 7,82 (1H, c), 11,34 (1H, ушир.с).
Пример 25
8-(N-циклогексил-N-метиламино)-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 224-225°С.
1Н ЯМР (ДМСО-d6) dppm: 1,00-1,24 (5H, м), 1,53-1,99 (5H, м), 2,65 (3H, c), 3,78 (3H, c), 6,92-6,99 (3H, м), 7,50-7,57 (3H, c), 7,87 (1H, c), 10,93 (1H, ушир.с).
Пример 26
N-{3-[5-фтор-3-(4-метоксифенил)-4-оксо-1,4-дигидрохинолин-8-илокси]пропил}ацетамид
Бледно-коричневый порошок (этанол).
Температура плавления 229-231°С.
1Н ЯМР (ДМСО-d6) dppm: 1,80 (3H, c), 1,91-1,96 (2H, м), 3,24-3,31 (2H, м), 3,74 (3H, c), 4,12 (2H, т, J=5,6 Гц), 6,84-7,13 (4H, м), 7,53 (2H, д, J=8,6 Гц), 7,83 (1H, c), 8,01 (1H, ушир.с), 11,40 (1H, ушир.с).
Пример 27
N-{3-[5-фтор-3-(4-метоксифенил)-4-оксо-1,4-дигидрохинолин-8-илокси]пропил}метансульфонамид
Бледно-коричневый порошок (этанол).
Температура плавления 120-121°С.
1Н ЯМР (ДМСО-d6) dppm: 1,96-2,06 (2H, м), 2,88 (3H, c), 3,10-3,30 (2H, м), 3,75 (3H, c), 4,18 (2H, т, J=5,9 Гц), 6,85-6,95 (3H, м), 7,00-7,16 (2H, м), 7,54 (2H, д, J=8,7 Гц), 7,82 (1H, c), 11,34 (1H, ушир.с).
Пример 28
5-Фтор-8-(N-изобутил-N-метиламино)-3-(4-метоксифенил)-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 144-145°С.
1Н ЯМР (ДМСО-d6) dppm: 0,86 (3H, c), 0,91 (3H, c), 1,61-1,67 (1H, м), 2,61 (3H, c), 2,80 (2H, д, J=6,75 Гц), 3,79 (3H, c), 6,91-6,99 (3H, м), 7,46-7,57 (3H, м), 7,88 (1H, c), 11,02 (1H, ушир.с).
Пример 29
5-Фтор-8-(N-изопропил-N-метиламино)-3-(4-метоксифенил)-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 267-269°С.
1Н ЯМР (ДМСО-d6) dppm: 1,04 (3H, c), 1,06 (3H, c), 2,62 (3H, c), 3,10-3,18 (1H, м), 3,76 (3H, c), 6,90-6,98 (3H, м), 7,47-7,55 (3H, м), 7,85 (1H, c), 10,94 (1H, ушир.с).
Пример 30
5-Фтор-3-(4-метоксифенил)-8-(N-метил-N-пропиламино)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 145-146°С.
1Н ЯМР (ДМСО-d6) dppm: 0,79 (3H, т, J=7,5 Гц), 1,31-1,45 (2H, м), 2,63 (3H, c), 2,85 (2H, т, J=7,5 Гц), 3,76 (3H, c), 6,89-6,97 (3H, м), 7,43-7,54 (3H, м), 7,82 (1H, c), 11,07 (1H, ушир.с).
Пример 31
5-Фтор-3-(4-метоксифенил)-8-(4,4,4-трифторбутокси)-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 171-172°С.
1Н ЯМР (ДМСО-d6) dppm: 1,99-2,08 (2H, м), 2,48-2,61 (2H, м), 3,74 (3H, c), 4,17 (2H, т, J=5,9 Гц), 6,84-6,94 (3H, м), 7,11 (1H, дд, J=3,8 Гц, J=8,8 Гц), 7,53 (2H, д, J=8,7 Гц), 7,82 (1H, c), 11,40 (1H, ушир.с).
Пример 32
1-{3-[5-Фтор-3-(4-метоксифенил)-4-оксо-1,4-дигидрохинолин-8-илокси]пропил}-1,3,3-триметилмочевина
Коричневое аморфное твердое вещество (диэтиловый эфир).
1Н ЯМР (ДМСО-d6) dppm: 2,00-2,05 (2H, м), 2,63 (6H, c), 2,74 (3H, c), 3,20-3,40 (2H, м), 3,76 (3H, c), 4,12 (2H, т, J=6,0 Гц), 6,85-6,96 (3H, м), 7,14 (1H, дд, J=3,9 Гц, J=8,8 Гц), 7,55 (2H, д, J=8,7 Гц), 7,81 (1H, c), 11,40 (1H, ушир.с).
Пример 33
3-(4-Этоксифенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 203-205°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,3 Гц), 1,13 (3H, т, J=7,0 Гц), 1,76-1,91 (2H, м), 3,99-4,13 (4H, м), 6,84-6,94 (3H, м), 7,12-7,17 (1H, м), 7,50 (2H, д, J=7,5 Гц), 7,79 (1H, c), 11,25 (1H, ушир.c).
Пример 34
Гидрохлорид 5-фтор-8-[N-(2-метоксиэтил)-N-метиламино]-3-(4-метоксифенил)-1Н-хинолин-4-она
Бледно-желтый порошок (этилацетат).
Температура плавления 100-101°С.
1Н ЯМР (ДМСО-d6) dppm: 2,78 (3H, c), 3,08 (2H, т, J=5,3 Гц), 3,33 (3H, c), 3,49 (2H, т, J=5,3 Гц), 3,81 (3H, c), 6,94-7,02 (3H, м), 7,50-7,62 (3H, м), 8,00 (1H, c), 11,16 (1H, ушир.с).
Пример 35
3-(4-Циклопропилметоксифенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 162-163°С.
1Н ЯМР (ДМСО-d6) dppm: 0,30-0,35 (2H, м), 0,54-0,58 (2H, м), 1,01 (3H, т, J=7,5 Гц), 1,10-1,30 (1H, м), 1,72-1,91 (2H, м), 3,80 (2H, д, J=7,0 Гц), 4,07 (2H, т, J=6,4 Гц), 6,84-6,93 (3H, м), 7,11-7,16 (1H, м), 7,50 (2H, д, J=8,8 Гц), 7,79 (1H, c), 11,25 (1H, ушир.с).
Пример 36
5-Фтор-8-(2-метоксиэтокси)-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 142-144°С.
1Н ЯМР (ДМСО-d6) dppm: 3,31 (3H, c), 3,70-3,80 (2H, м), 3,75 (3H, c), 4,20-4,30 (2H, м), 6,84-6,94 (3H, м), 7,16 (1H, дд, J=3,6 Гц, J=8,7 Гц), 7,53 (2H, д, J=8,4 Гц), 7,82 (1H, c), 11,10 (1H, ушир.с).
Пример 37
8-Циклопентокси-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 213-215°С.
1Н ЯМР (ДМСО-d6) dppm: 1,50-1,70 (2H, м), 1,71-2,00 (6H, м), 3,75 (3H, c), 4,92-4,95 (1H, м), 6,83-6,95 (3H, м), 7,09 (1H, дд, J=3,9 Гц, J=8,8 Гц), 7,53 (2H, д, J=8,6 Гц), 7,80 (1H, c), 11,20 (1H, ушир.с).
Пример 38
5-Фтор-3-(4-метилсульфанилфенил)-8-пропокси-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 198-199°С.
1Н ЯМР (CDCl3) dppm: 1,07 (3H, т, J=7,4 Гц), 1,85-2,04 (2H, м), 2,50 (3H, c), 4,07 (2H, т, J=6,6 Гц), 6,80-6,94 (2H, м), 7,27-7,31 (2H, м), 7,56 (2H, д, J=8,4 Гц), 7,74 (1H, д, J=8,2 Гц), 8,81 (1H, ушир.с).
Пример 39
5-Фтор-3-(4-метоксифенил)-8-(тетрагидрофуран-2-илметокси)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 108-110°С.
1Н ЯМР (ДМСО-d6) dppm: 1,67-1,75 (1H, м), 1,81-1,90 (2H, м), 2,02-2,09 (1H, м), 3,65-3,83 (2H, м), 3,75 (3H, c), 4,10 (2H, д, J=4,6 Гц), 4,25-4,29 (1H, м), 6,84-6,95 (3H, м), 7,17 (1H, дд, J=3,8 Гц, J=8,8 Гц), 7,53 (2H, д, J=8,7 Гц), 7,82 (1H, c), 11,20 (1H, ушир.с).
Пример 40
5-Фтор-3-(4-метоксифенил)-8-пропилсульфанил-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 173-174°С.
1Н ЯМР (ДМСО-d6) dppm: 0,90 (3H, т, J=7,3 Гц), 1,40-1,52 (2H, м), 2,79 (2H, т, J=7,2 Гц), 3,77 (3H, c), 6,93-7,04 (3H, м), 7,51-7,55 (2H, м), 7,79-7,87 (2H, м), 11,24 (1H, ушир.с).
Пример 41
8-Циклобутилметокси-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 193-194°С.
1Н ЯМР (ДМСО-d6) dppm: 1,79-1,93 (4H, м), 2,04-2,09 (2H, м), 2,76-2,81 (1H, м), 3,74 (3H, c), 4,08 (2H, д, J=6,8 Гц), 6,83-6,93 (3H, м), 7,11 (1H, дд, J=3,8 Гц, J=8,8 Гц), 7,52 (2H, д, J=8,6 Гц), 7,82 (1H, c), 11,20 (1H, ушир.с).
Пример 42
8-трет-Бутокси-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-коричневый порошок (этилацетат-диэтиловый эфир).
Температура плавления 206-208°С.
1Н ЯМР (ДМСО-d6) dppm: 1,40 (9H, c), 3,76 (3H, c), 6,84-6,96 (3H, м), 7,31 (1H, дд, J=4,3 Гц, J=8,8 Гц), 7,54 (2H, д, J=8,8 Гц), 7,82 (1H, c), 10,95 (1H, ушир.с).
Пример 43
5-Фтор-8-метокси-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-темно-коричневый порошок (этилацетат).
1Н ЯМР (ДМСО-d6) dppm: 3,76 (3H, c), 3,95 (3H, c), 6,87-6,95 (3H, м), 7,15 (1H, дд, J=3,8 Гц, J=8,8 Гц), 7,54 (2H, д, J=8,7 Гц), 7,76 (1H, c), 11,50 (1H, ушир.с).
Пример 44
5-Фтор-8-метоксиметокси-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-темно-коричневый порошок (дихлорметан-метанол).
1Н ЯМР (CDCl3) dppm: 3,44 (3H, c), 3,76 (3H, c), 5,20 (2H, c), 6,76-6,87 (3H, м), 7,18-7,23 (1H, м), 7,52 (2H, д, J=7,8 Гц), 7,69 (1H, c), 9,68 (1H, ушир.с).
Пример 45
8-(3-Бензилоксипропокси)-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Темно-коричневое аморфное твердое вещество.
1Н ЯМР (ДМСО-d6) dppm: 2,08-2,13 (2H, м), 3,68 (2H, т, J=6,2 Гц), 3,77 (3H, c), 4,22 (2H, т, J=6,0 Гц), 4,48 (2H, c), 6,84-6,97 (3H, м), 7,13-7,18 (1H, м), 7,21-7,29 (5H, м), 7,55 (2H, д, J=8,7 Гц), 7,76 (1H, c), 11,25 (1H, ушир.с).
Пример 46
8-(2-Бензилоксипропокси)-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Темно-коричневое аморфное твердое вещество.
1Н ЯМР (ДМСО-d6) dppm: 1,32 (3H, д, J=6,2 Гц), 3,76 (3H, c), 3,98-4,24 (3H, м), 4,54-4,69 (2H, м), 6,84-6,96 (3H, м), 7,16-7,30 (6H, м), 7,54 (2H, д, J=8,7 Гц), 7,78 (1H, c), 11,19 (1H, ушир.с).
Пример 47
8-Циклопропилметокси-5-фтор-3-(4-метоксифенил)-2-метил-1Н-хинолин-4-он
К раствору 2-циклопропилметокси-5-фторанилина (760 мг, 4,2 ммоль) и этил α-ацетил-4-метоксифенилацетата (1,0 г, 4,2 ммоль) в бензоле (40 мл) добавляли Amberlyst 15 (350 мг, продукт Sigma Aldrich Corp.) и нагревали смесь при кипении с обратным холодильником в течение 19 часов с использованием насадки Дина-Старка и при перемешивании. Реакционную смесь охлаждали до комнатной температуры, смолу удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. К остатку добавляли дифениловый эфир (2,2 мл) и нагревали смесь при помощи колбонагревателя и затем перемешивали 1 час при кипении с обратным холодильником. Реакционную смесь охлаждали до комнатной температуры и непосредственно очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=80:1→60:1). Очищенный продукт концентрировали при пониженном давлении, а остаток перекристаллизовывали из этилацетата, получая при этом 120 мг порошкообразного 8-циклопропилметокси-5-фтор-3-(4-метоксифенил)-2-метил-1Н-хинолин-4-она бледно-желтого цвета (выход: 8%).
Температура плавления 167-169°С.
1Н ЯМР (ДМСО-d6) dppm: 0,35-0,39 (2H, м), 0,54-0,61 (2H, м), 1,31-1,37 (1H, м), 2,23 (3H, c), 3,76 (3H, c), 4,02 (2H, д, J=7,0 Гц), 6,80-6,94 (3H, м), 7,08-7,18 (3H, м), 10,62 (1H, ушир.с).
Соединение следующего примера 48 получали способом, аналогичным способу описанного выше примера 47, с использованием соответствующих исходных соединений.
Пример 48
2-Этил-5-фтор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Бледно-коричневый порошок (этилацетат-н-гексан).
Температура плавления 169-171°С.
1Н ЯМР (ДМСО-d6) dppm: 0,98-1,05 (6H, м), 1,80-1,89 (2H, м), 2,56 (2H, т, J=7,5 Гц), 3,77 (3H, c), 4,13 (2H, т, J=6,6 Гц), 6,81-6,95 (3H, м), 7,05-7,17 (3H, м), 10,40 (1H, ушир.с).
Пример 49
5-Фтор-8-пропокси-3-пиридин-3-ил-1Н-хинолин-4-он
5-Фтор-3-йод-8-пропокси-1Н-хинолин-4-он (600 мг, 1,73 ммоль) суспендировали в 1,2-диметоксиэтане (12 мл). К полученной суспензии добавляли 3-пиридинбороновую кислоту (752 мг), комплекс 1,1'-бис(дифенилфосфино)ферроцендихлорпалладий(II)-дихлорметан (PdCl2(DPPF)) (76 мг, 0,093 ммоль) и 2 н. водный раствор карбоната натрия (2,54 мл) в данном порядке. Смесь перемешивали при 90°С в течение 2 часов в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры добавляли воду и экстрагировали полученную смесь этилацетатом. Органический слой концентрировали при пониженном давлении и остаток затем очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=15:1). Очищенный продукт концентрировали при пониженном давлении и затем перекристаллизовывали из этанола, получая при этом 185 мг порошкообразного 5-фтор-8-пропокси-3-пиридин-3-ил-1Н-хинолин-4-она бледно-коричневого цвета (выход: 36%).
Температура плавления 234-236°С.
1Н ЯМР (ДМСО-d6) dppm: 1,01 (3H, т, J=7,3 Гц), 1,77-1,86 (2H, м), 4,08 (2H, т, J=6,4 Гц), 6,93 (1H, дд, J=8,8 Гц, J=12,0 Гц), 7,13-7,18 (1H, м), 7,37-7,42 (1H, м), 7,97 (1H, c), 8,01-8,05 (1H, м), 8,44-8,46 (1H, м), 8,77 (1H, д, J=2,1 Гц), 11,55 (1H, ушир.с).
Соединения следующих примеров с 50 по 66 получали способом, аналогичным способу описанного выше примера 49, с использованием соответствующих исходных соединений.
Пример 50
3-(4-Этокси-3-фторфенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Бледно-желтый порошок (этанол).
Температура плавления 176-177°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,3 Гц), 1,33 (3H, т, J=6,9 Гц), 1,75-1,89 (2H, м), 4,05-4,14 (4H, м), 6,90 (1H, дд, J=8,7 Гц, J=12,1 Гц), 7,09-7,16 (2H, м), 7,32-7,36 (1H, м), 7,52-7,58 (1H, м), 7,87 (1H, c), 11,45 (1H, c).
Пример 51
5-Фтор-8-пропокси-3-пиридин-4-ил-1Н-хинолин-4-он
Бледно-коричневый порошок (этанол).
Температура плавления 259-261°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,3 Гц), 1,78-1,86 (2H, м), 4,09 (2H, т, J=6,4 Гц), 6,96 (1H, дд, J=8,8 Гц, J=12,0 Гц), 7,19 (1H, дд, J=3,8 Гц, J=8,8 Гц), 7,71 (2H, д, J=6,1 Гц), 8,06 (1H, c), 8,52 (2H, д, J=6,1 Гц), 11,50 (1H, ушир.с).
Пример 52
5-Фтор-3-(4-феноксифенил)-8-пропокси-1Н-хинолин-4-он
Бледно-коричневый порошок (этанол).
Температура плавления 228-230°С.
1Н ЯМР (ДМСО-d6) dppm: 1,01 (3H, т, J=7,3 Гц), 1,77-1,85 (2H, м), 4,07 (2H, т, J=6,2 Гц), 6,90 (1H, дд, J=8,8 Гц, J=12,1 Гц), 6,97-7,02 (4H, м), 7,10-7,15 (2H, м), 7,34-7,63 (4H, м), 7,88 (1H, c), 11,40 (1H, ушир.с).
Пример 53
3-(4-Этилфенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 153-154°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,3 Гц), 1,17 (3H, т, J=7,5 Гц), 1,78-1,86 (2H, м), 2,59 (2H, кв, J=7,5 Гц), 4,08 (2H, т, J=6,4 Гц), 6,89 (1H, дд, J=8,8 Гц, J=12,1 Гц), 7,10-7,21 (3H, м), 7,50 (2H, д, J=8,0 Гц), 7,83 (1H, c), 11,40 (1H, ушир.с).
Пример 54
3-(4-Ацетилфенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Бледно-красный порошок (этилацетат).
Температура плавления 180-181°С.
1Н ЯМР (ДМСО-d6) dppm: 0,95 (3H, т, J=7,5 Гц), 1,71-1,83 (2H, м), 2,51 (3H, м), 4,02 (2H, т, J=6,6 Гц), 6,84-6,91 (1H, м), 7,10-7,14 (1H, м), 7,72 (2H, д, J=8,4 Гц), 7,87-7,90 (3H, м), 11,40 (1H, ушир.с).
Пример 55
Метил 4-(5-фтор-4-оксо-8-пропокси-1,4-дигидрохинолин-3-ил)бензоат
Белый порошок (этилацетат).
Температура плавления 201-202°С.
1Н ЯМР (ДМСО-d6) dppm: 1,01 (3H, т, J=7,3 Гц), 1,77-1,91 (2H, м), 3,86 (3H, c), 4,09 (2H, т, J=6,5 Гц), 6,90-6,99 (1H, м), 7,17-7,22 (1H, м), 7,80 (2H, д, J=8,5 Гц), 7,94-7,98 (3H, м), 11,48 (1H, ушир.с).
Пример 56
5-Фтор-8-пропокси-3-[4-(пирролидин-1-карбонил)фенил]-1Н-хинолин-4-он
Бледно-красный порошок (этилацетат).
Температура плавления 236-237°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,4 Гц), 1,79-1,89 (6H, м), 3,43-3,49 (4H, м), 4,08 (2H, т, J=6,5 Гц), 6,89-6,97 (1H, м), 7,15-7,20 (1H, м), 7,51 (2H, д, J=8,6 Гц), 7,67 (2H, д, J=8,6 Гц), 7,90 (1H, c), 11,40 (1H, ушир.с).
Пример 57
4-(5-Фтор-4-оксо-8-пропокси-1,4-дигидрохинолин-3-ил)-N,N-диметилбензамид
Бледно-коричневый порошок (этилацетат).
Температура плавления 235-237°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,4 Гц), 1,80-1,89 (2H, м), 2,97 (6H, c), 4,08 (2H, т, J=6,4 Гц), 6,89-6,93 (1H, м), 7,15-7,20 (1H, м), 7,39 (2H, д, J=8,0 Гц), 7,67 (2H, д, J=8,0 Гц), 7,90 (1H, c), 11,41 (1H, ушир.с).
Пример 58
5-Фтор-3-фуран-2-ил-8-пропокси-1Н-хинолин-4-он
Бледно-коричневый порошок (этилацетат).
Температура плавления 210-212°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=1,4 Гц), 1,78-1,90 (2H, м), 4,10 (2H, т, J=6,6 Гц), 6,54-6,56 (1H, м), 6,90-6,99 (1H, м), 7,15-7,21 (2H, м), 7,64-7,65 (1H, м), 8,20 (1H, c), 11,47 (1H, ушир.с).
Пример 59
5-Фтор-8-пропокси-3-тиофен-2-ил-1Н-хинолин-4-он
Бледно-красный порошок (этилацетат).
Температура плавления 211-213°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,5 Гц), 1,78-1,90 (2H, м), 4,10 (2H, т, J=6,5 Гц), 6,92-7,20 (3H, м), 7,41-7,59 (2H, м), 8,34 (1H, c), 11,63 (1H, ушир.с).
Пример 60
3-(5-Фтор-4-оксо-8-пропокси-1,4-дигидрохинолин-3-ил)тиофен-2-карбальдегид
Белый порошок (этилацетат).
Температура плавления 190-191°С.
1Н ЯМР (ДМСО-d6) dppm: 1,01 (3H, т, J=7,4 Гц), 1,79-1,88 (2H, м), 4,08 (3H, т, J=6,5 Гц), 6,92-7,00 (1H, м), 7,18-7,23 (1H, м), 7,32 (1H, д, J=5,0 Гц), 7,98 (1H, c), 8,04-8,06 (1H, м), 9,73 (1H, c), 11,40 (1H, ушир.с).
Пример 61
3-(4-Диметиламинофенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 206-207°С.
1Н ЯМР (ДМСО-d6) dppm: 1,01 (3H, т, J=7,4 Гц), 1,79-1,88 (2H, м), 2,90 (6H, c), 4,07 (2H, т, J=6,4 Гц), 6,71 (2H, д, J=9,0 Гц), 6,82-6,90 (1H, м), 7,09-7,14 (1H, м), 7,45 (2H, д, J=9,0 Гц), 7,76 (1H, c), 11,18 (1H, ушир.с).
Пример 62
3-(3,4-Диметоксифенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Бледно-красный порошок (этилацетат).
Температура плавления 217-218°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,5 Гц), 1,78-1,88 (2H, м), 3,76 (6H, c), 4,07 (2H, т, J=6,4 Гц), 6,85-6,97 (2H, м), 7,08-7,16 (2H, м), 7,30 (1H, c), 7,82 (1H, c), 11,28 (1H, ушир.с).
Пример 63
5-Фтор-3-(6-метоксипиридин-3-ил)-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 215-216°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,5 Гц), 1,77-1,91 (2H, м), 3,86 (3H, c), 4,08 (2H, т, J=6,3 Гц), 6,81-6,96 (2H, м), 7,14-7,19 (1H, м), 7,77-7,99 (2H, м), 8,35 (1H, c), 11,39 (1H, ушир.с).
Пример 64
3-(2,6-Диметоксипиридин-3-ил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Бледно-красный порошок (этилацетат).
Температура плавления 198-199°С.
1Н ЯМР (ДМСО-d6) dppm: 1,01 (3H, т, J=7,3 Гц), 1,76-1,90 (2H, c), 3,83 (3H, c), 3,89 (3H, c), 4,07 (2H, т, J=6,3 Гц), 6,39 (1H, д, J=7,1 Гц), 6,86-6,94 (1H, м), 7,13-7,17 (1H, м), 7,68 (1H, д, J=7,1 Гц), 7,81 (1H, c), 11,23 (1H, ушир.с).
Пример 65
3-(2,5-Диметоксифенил)-5-фтор-8-пропокси-1Н-хинолин-4-он
Бледно-красный порошок (этилацетат).
Температура плавления 156-157°С.
1Н ЯМР (ДМСО-d6) dppm: 1,03 (3H, т, J=7,3 Гц), 1,80-1,90 (2H, м), 3,65 (3H, c), 3,71 (3H, c), 4,09 (2H, т, J=6,3 Гц), 6,87-6,91 (4H, м), 6,94-6,95 (1H, м), 7,73 (1H, c), 11,18 (1H, ушир.с).
Пример 66
8-Циклопропилметокси-1-этил-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Коричневый порошок (этилацетат-н-гексан).
Температура плавления 150-152°С.
1Н ЯМР (ДМСО-d6) dppm: 0,34-0,38 (2H, м), 0,57-0,64 (2H, м), 1,27-1,39 (4H, м), 3,75 (3H, c), 3,92 (2H, д, J=7,2 ц), 4,60 (2H, кв, J=6,8 Гц), 6,91-6,99 (3H, м), 7,17 (1H, дд, J=4,5 Гц, J=8,9 Гц), 7,60 (2H, д, J=8,7 Гц), 7,98 (1H, c).
Пример 67
5-Фтор-3-(4-метоксифенил)-2-метил-8-пропокси-1Н-хинолин-4-он
5-Фтор-3-йод-2-метил-8-пропокси-1Н-хинолин-4-он (400 мг, 1,11 ммоль), 4-метоксифенилбороновую кислоту (504 мг, 3,3 ммоль), комплекс 1,1'-бис(дифенилфосфино)ферроцендихлорпалладий(II)-дихлорметан (PdCl2(DPPF)) (100 мг, 0,12 ммоль) и 2 н. водный раствор карбоната натрия (1 мл) добавляли к 1,2-диметоксиэтану (3 мл) и нагревали смесь при 170°С в течение 10 минут (реактор с микроволновым облучением). Реакционную смесь охлаждали до комнатной температуры и фильтровали через целит. Фильтрат экстрагировали дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=100:0→40:1). Очищенный продукт концентрировали при пониженном давлении и остаток перекристаллизовывали из этилацетата, получая при этом 230 мг порошкообразного 5-фтор-3-(4-метоксифенил)-2-метил-8-пропокси-1Н-хинолин-4-она белого цвета (выход: 61%).
Температура плавления 211-212°С.
1Н ЯМР (ДМСО-d6) dppm: 0,98 (3H, т, J=7,3 Гц), 1,79-1,90 (2H, м), 2,23 (3H, c), 3,76 (3H, c), 4,10 (2H, т, J=6,5 Гц), 6,93-6,95 (2H, м), 7,07-7,09 (2H, м), 7,72-7,73 (1H, м), 7,83 (1H, c), 10,50 (1H, ушир.с).
Соединения следующих примеров с 68 по 85 получали способом, аналогичным способу описанного выше примера 67, с использованием соответствующих исходных соединений.
Пример 68
5-Фтор-2-метил-8-пропокси-3-пиридин-3-ил-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 190-192°С.
1Н ЯМР (ДМСО-d6) dppm: 0,99 (3H, т, J=7,5 Гц), 1,77-1,89 (2H, м), 2,27 (3H, c), 4,12 (2H, т, J=6,1 Гц), 6,85-6,93 (1H, м), 7,16-7,21 (1H, м), 7,38-7,43 (1H, м), 7,63-7,67 (1H, м), 8,40-8,50 (2H, м), 10,70 (1H, ушир.с).
Пример 69
5-Фтор-2-метил-8-пропокси-3-пиридин-4-ил-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 265-266°С.
1Н ЯМР (ДМСО-d6) dppm: 0,99 (3H, т, J=7,5 Гц), 1,78-1,92 (2H, м), 2,28 (3H, c), 4,12 (2H, т, J=6,8 Гц), 6,86-6,94 (1H, м), 7,17-7,21 (1H, м), 7,25 (2H, д, J=6,0 Гц), 8,55 (2H, д, J=6,0 Гц), 10,72 (1H, ушир.с).
Пример 70
5-Фтор-2-метил-8-пропокси-3-(4-трифторметоксифенил)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 167-168°С.
1Н ЯМР (ДМСО-d6) dppm: 0,99 (3H, т, J=7,3 Гц), 1,78-1,92 (2H, м), 2,25 (3H, c), 4,10 (2H, т, J=6,6 Гц), 6,83-6,92 (1H, м), 7,15-7,20 (1H, м), 7,31-7,38 (4H, м), 10,64 (1H, ушир.с).
Пример 71
3-(4-Этилфенил)-5-фтор-2-метил-8-пропокси-1Н-хинолин-4-он
Бледно-красный порошок (этилацетат).
Температура плавления 221-222°С.
1Н ЯМР (ДМСО-d6) dppm: 0,99 (3H, т, J=7,3 Гц), 1,18 (3H, т, J=7,5 Гц), 1,80-1,89 (2H, м), 2,23 (3H, c), 2,58 (2H, кв, J=7,5 Гц), 4,10 (2H, т, J=6,6 Гц), 6,82-6,89 (1H, м), 7,08-7,22 (5H, м), 10,53 (1H, ушир.с).
Пример 72
5-Фтор-2-метил-8-пропокси-3-тиофен-2-ил-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 233-234°С.
1Н ЯМР (ДМСО-d6) dppm: 0,98 (3H, т, J=7,3 Гц), 1,77-1,89 (2H, м), 2,46 (3H, c), 4,11 (2H, т, J=6,8 Гц), 6,86-7,20 (4H, м), 7,52-7,55 (1H, м), 10,70 (1H, ушир.с).
Пример 73
3-(4-Диметиламинофенил)-5-фтор-2-метил-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 255-257°С.
1Н ЯМР (ДМСО-d6) dppm: 1,00 (3H, т, J=7,5 Гц), 1,80-1,90 (2H, м), 2,26 (3H, c), 2,91 (6H, c), 4,11 (2H, т, J=6,6 Гц), 6,72 (2H, д, J=8,7 Гц), 6,80-6,89 (1H, м), 7,00 (2H, д, J=8,7 Гц), 7,11-7,17 (1H, м), 10,45 (1H, ушир.с).
Пример 74
5-Фтор-3-(4-фторфенил)-2-метил-8-пропокси-1Н-хинолин-4-он
Бледно-коричневый порошок (этилацетат).
Температура плавления 196-197°С.
1Н ЯМР (ДМСО-d6) dppm: 1,00 (3H, т, J=7,3 Гц), 1,80-1,91 (2H, м), 2,25 (3H, c), 4,12 (2H, т, 6,8 Гц), 6,84-6,92 (1H, м), 7,15-7,29 (5H, м), 10,06 (1H, ушир.с).
Пример 75
3-(2,4-Диметоксифенил)-5-фтор-2-метил-8-пропокси-1Н-хинолин-4-он
Бледно-коричневый порошок (этилацетат).
Температура плавления 100-101°С.
1Н ЯМР (ДМСО-d6) dppm: 0,99 (3H, т, J=7,5 Гц), 1,80-1,86 (2H, м), 2,11 (3H, c), 3,65 (3H, c), 3,78 (3H, c), 4,10 (2H, т, J=6,8 Гц), 6,51-6,59 (2H, м), 6,80-6,94 (2H, м), 7,11-7,17 (1H, м), 10,47 (1H, ушир.с).
Пример 76
5-Фтор-3-фуран-2-ил-2-метил-8-пропокси-1Н-хинолин-4-он
Бледно-коричневый порошок (этилацетат).
Температура плавления 203-204°С.
1Н ЯМР (ДМСО-d6) dppm: 0,99 (3H, т, J=7,5 Гц), 1,78-1,89 (2H, м), 2,47 (3H, c), 4,10 (2H, т, J=6,8 Гц), 6,52-6,54 (1H, м), 6,67-6,69 (1H, м), 6,86-6,95 (1H, м), 7,15-7,20 (1H, м), 7,67-7,68 (1H, м), 10,66 (1H, м).
Пример 77
5-Фтор-3-(4-метоксифенил)-8-пропокси-2-трифторметил-1Н-хинолин-4-он
Белый порошок (н-гексан-этилацетат).
Температура плавления 170-171°С.
1Н ЯМР (ДМСО-d6) dppm: 1,00 (3H, т, J=7,3 Гц), 1,76-1,90 (2H, м), 3,80 (3H, c), 4,11 (2H, т, J=6,5 Гц), 6,98 (2H, д, J=8,7 Гц), 7,15-7,25 (4H, м), 10,11 (1H, ушир.с).
Пример 78
5-Фтор-3-фуран-2-ил-8-пропокси-2-трифторметил-1Н-хинолин-4-он
Бледно-желтый порошок (н-гексан-этилацетат).
Температура плавления 134-136°С.
1Н ЯМР (ДМСО-d6) dppm: 0,99 (3H, т, J=7,5 Гц), 1,76-1,90 (2H, м), 4,11 (2H, т, J=6,6 Гц), 6,59-6,65 (2H, м), 7,21-7,33 (2H, м), 7,81 (1H, м), 10,08 (1H, ушир.с).
Пример 79
3-(4-Диметиламинофенил)-5-фтор-8-пропокси-2-трифторметил-1Н-хинолин-4-он
Бледно-желтый порошок (н-гексан-этилацетат).
Температура плавления 176-177°С.
1Н ЯМР (ДМСО-d6) dppm: 1,00 (3H, т, J=7,4 Гц), 1,76-1,91 (2H, м), 2,94 (6H, c), 4,11 (2H, т, J=6,6 Гц), 6,75 (2H, д, J=8,8 Гц), 7,03 (2H, д, J=8,8 Гц), 7,21-7,24 (2H, м), 10,00 (1H, ушир.с).
Пример 80
3-(4-Этилфенил)-5-фтор-8-пропокси-2-трифторметил-1Н-хинолин-4-он
Белый порошок (н-гексан-этилацетат).
Температура плавления 187-188°С.
1Н ЯМР (ДМСО-d6) dppm: 1,00 (3H, т, J=7,3 Гц), 1,20 (3H, т, J=7,5 Гц), 1,77-1,91 (2H, м), 2,62-2,71 (2H, кв, J=7,5 Гц), 4,12 (2H, т, J=6,6 Гц), 7,13-7,29 (6H, м), 10,23 (1H, ушир.с).
Пример 81
5-Фтор-3-(4-фторфенил)-8-пропокси-2-трифторметил-1Н-хинолин-4-он
Коричневый порошок (н-гексан-этилацетат).
Температура плавления 154-155°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,3 Гц), 1,81-1,89 (2H, м), 4,13 (2H, т, J=6,5 Гц), 7,10-7,31 (4H, м), 7,80-7,86 (1H, м), 8,08 (1H, c), 10,24 (1H, ушир.с).
Пример 82
5-Фтор-8-пропокси-3-(4-трифторметоксифенил)-2-трифторметил-1Н-хинолин-4-он
Бледно-красный порошок (н-гексан-этилацетат).
Температура плавления 143-144°С.
1Н ЯМР (ДМСО-d6) dppm: 1,00 (3H, т, J=7,3 Гц), 1,77-1,91 (2H, м), 4,12 (2H, т, J=6,6 Гц), 7,19-7,54 (6H, м), 10,44 (1H, ушир.с).
Пример 83
5-Фтор-2-изопропил-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат-н-гексан).
Температура плавления 195-197°С.
1Н ЯМР (ДМСО-d6) dppm: 1,00 (3H, т, J=7,3 Гц), 1,16 (6H, д, J=7,0 Гц), 1,78-1,92 (2H, м), 2,86-2,97 (1H, м), 3,77 (3H, c), 4,13 (2H, т, J=6,4 Гц), 6,84-7,22 (6H, м), 8,98 (1H, ушир.с).
Пример 84
5-Фтор-3-фуран-2-ил-2-изопропил-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат-н-гексан).
Температура плавления 113-114°С.
1Н ЯМР (ДМСО-d6) dppm: 0,99 (3H, т, J=7,5 Гц), 1,21 (6H, д, J=7,0 Гц), 1,80-1,89 (2H, м), 3,11-3,16 (1H, м), 4,12 (2H, т, J=6,4 Гц), 6,48-6,54 (2H, м), 6,90-6,98 (1H, м), 7,20-7,25 (1H, м), 7,69-7,70 (1H, м), 9,29 (1H, ушир.с).
Пример 85
5-Фтор-8-пропокси-3-тиофен-2-ил-2-трифторметил-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат-н-гексан).
Температура плавления 149-150°С.
1Н ЯМР (ДМСО-d6) dppm: 1,00 (3H, т, J=7,4 Гц), 1,76-1,90 (2H, м), 4,11 (2H, т, 6,4 Гц), 7,10-7,30 (4H, м), 7,72-7,75 (1H, м), 10,52 (1H, ушир.с).
Пример 86
5-Фтор-8-фуран-2-ил-3-(4-метоксифенил)-1Н-хинолин-4-он
8-Бром-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он (150 мг, 0,43 ммоль), 2-фуранбороновую кислоту (145 мг, 1,3 ммоль), комплекс 1,1'-бис(дифенилфосфино)ферроцендихлорпалладий(II)-дихлорметан (PdCl2(DPPF)) (35 мг, 0,04 ммоль) и 2 н. водный раствор карбоната натрия (1 мл) добавляли к 1,2-диметоксиэтану (3 мл) и нагревали смесь при 180°С в течение 10 минут (реактор с микроволновым облучением). После охлаждения реакционной смеси до комнатной температуры добавляли дихлорметан и затем фильтровали через целит. Фильтрат экстрагировали дихлорметаном и промывали водой. Органический слой сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (дихлорметан). Очищенный продукт концентрировали при пониженном давлении и остаток перекристаллизовывали из смеси н-гексан-этилацетат, получая при этом 100 мг порошкообразного 5-фтор-8-фуран-2-ил-3-(4-метоксифенил)-1Н-хинолин-4-она слегка оранжевого цвета (выход: 70%).
Температура плавления 209-211°С.
1Н ЯМР (ДМСО-d6) dppm: 3,79 (3H, c), 6,74-6,77 (1H, м), 6,96-7,00 (3H, м), 7,07-7,15 (1H, м), 7,55-7,59 (2H, м), 7,81-7,93 (3H, м), 11,00 (1H, ушир.с).
Соединения следующих примеров 87 и 88 получали способом, аналогичным способу описанного выше примера 86, с использованием соответствующих исходных соединений.
Пример 87
5-Фтор-3-(4-метоксифенил)-8-тиофен-3-ил-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 183-184°С.
1Н ЯМР (ДМСО-d6) dppm: 3,76 (3H, c), 6,93-7,09 (3H, м), 7,30-7,32 (1H, м), 7,49-7,54 (3H, м), 7,76-7,80 (3H, м), 10,64 (1H, ушир.с).
Пример 88
8-Бензо[b]тиофен-2-ил-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-желтый порошок (этилацетат).
Температура плавления 276-277°С.
1Н ЯМР (ДМСО-d6) dppm: 3,76 (3H, c), 6,84-6,92 (3H, м), 7,30-7,40 (2H, м), 7,62-7,66 (2H, м), 7,84-7,99 (5H, м), 11,03 (1H, ушир.с).
Пример 89
4-(5-Фтор-4-оксо-8-пропокси-1,4-дигидрохинолин-3-ил)бензойная кислота
Метил 4-(5-фтор-4-оксо-8-пропокси-1,4-дигидрохинолин-3-ил)бензоат (330 мг, 0,93 ммоль) суспендировали в смеси растворителей этанола (3 мл) и ТГФ (3 мл). Добавляли 1,24 н. водный раствор гидроксида лития (2 мл) и перемешивали смесь при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду, и затем полученную смесь экстрагировали дихлорметаном. Органический слой промывали водой, сушили над безводным сульфатом магния и концентрировали досуха при пониженном давлении, получая при этом 300 мг порошкообразной 4-(5-фтор-4-оксо-8-пропокси-1,4-дигидрохинолин-3-ил)бензойной кислоты белого цвета (выход: 95%).
1Н ЯМР (ДМСО-d6) dppm: 1,01-1,07 (3H, т, J=7,3 Гц), 1,80-1,91 (2H, м), 4,09-4,14 (2H, т, J=6,4 Гц), 6,85-7,24 (3H, м), 7,75-7,78 (2H, м), 7,92-7,95 (2H, м), 11,51 (1H, ушир.с), 12,84 (1H, ушир.с).
Пример 90
5-Фтор-3-[4-(морфолин-4-карбонил)фенил]-8-пропокси-1Н-хинолин-4-он
4-(5-Фтор-4-оксо-8-пропокси-1,4-дигидрохинолин-3-ил)бензойную кислоту (260 мг, 0,76 ммоль), морфолин (99,5 мг, 1,14 ммоль), WSC (189 мг, 0,99 ммоль) и HOBT (151 мг, 0,99 ммоль) добавляли к ДМФА (10 мл) и перемешивали смесь при комнатной температуре в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении и остаток затем очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=30:1). Очищенный продукт концентрировали при пониженном давлении и остаток перекристаллизовывали из этилацетата, получая при этом 80 мг порошкообразного 5-фтор-3-[4-(морфолин-4-карбонил)фенил]-8-пропокси-1Н-хинолин-4-она белого цвета (выход: 26%).
Температура плавления 234-236°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,4 Гц), 1,80-1,89 (2H, м), 3,40-3,60 (8H, м), 4,09 (2H, т, J=6,5 Гц), 6,89-6,98 (1H, м), 7,16-7,21 (1H, м), 7,41 (2H, д, J=8,3 Гц), 7,69 (2H, д, J=8,3 Гц), 7,91 (1H, c), 11,41 (1H, ушир.с).
Пример 91
5-Фтор-3-(4-метоксифенил)-1-метил-8-пропокси-1Н-хинолин-4-он
К раствору 5-фтор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-она (400 мг, 1,22 ммоль) в ДМФА (10 мл) добавляли гидрид натрия (60% в масле, 76 мг, 1,9 ммоль). Смесь перемешивали при комнатной температуре в течение 15 минут. Добавляли к ней йодистый метил (225 мг, 1,6 ммоль) и затем перемешивали полученную смесь при комнатной температуре в течение 19 часов. К реакционной смеси добавляли воду и этилацетат для разделения смеси на два слоя. Органический слой промывали водой, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=1:1). Очищенный продукт концентрировали при пониженном давлении, и остаток перекристаллизовывали из этилацетата, получая при этом 365 мг порошкообразного 5-фтор-3-(4-метоксифенил)-1-метил-8-пропокси-1Н-хинолин-4-она бледно-желтого цвета (выход: 72%).
Температура плавления 147-148°С.
1Н ЯМР (ДМСО-d6) dppm: 0,98 (3H, т, J=7,5 Гц), 1,77 (2H, м), 3,76 (3H, c), 3,98 (2H, т, J=6,4 Гц), 4,08 (3H, c), 6,91-7,01 (3H, м), 7,19-7,24 (1H, м), 7,57-7,61 (2H, м), 7,96 (1H, c).
Соединения следующих примеров с 92 по 94 получали способом, аналогичным способу описанного выше примера 91, с использованием соответствующих исходных соединений.
Пример 92
1-Этил-5-фтор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 123-125°С.
1Н ЯМР (ДМСО-d6) dppm: 1,00 (3H, т, J=7,3 Гц), 1,29 (3H, т, J=6,8 Гц), 1,79-1,88 (2H, м), 3,76 (3H, c), 4,03 (2H, т, J=6,5 Гц), 4,52 (2H, кв, J=6,8 Гц), 6,91-7,02 (3H, м), 7,22-7,27 (1H, м), 7,60 (2H, д, J=8,7 Гц), 8,00 (1H, c).
Пример 93
1-(2-Этоксиэтил)-5-фтор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 108-109°С.
1Н ЯМР (ДМСО-d6) dppm: 0,96-1,09 (6H, м), 1,77-1,89 (2H, м), 3,65 (2H, т, J=5,0 Гц), 3,78 (3H, с), 4,02 (2H, т, J=6,8 Гц), 4,72 (2H, т, J=5,0 Гц), 6,94-7,04 (3H, м), 7,23-7,29 (1H, м), 7,57 (2H, д, J=8,7 Гц), 7,93 (1H, c).
Пример 94
1-Циклопропилметил-5-фтор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Бледно-желтый порошок (н-гексан).
Температура плавления 60-62°С.
1Н ЯМР (ДМСО-d6) dppm: 0,36-0,51 (4H, м), 1,07 (3H, т, J=7,4 Гц), 1,26-1,30 (1H, м), 1,86-1,94 (2H, м), 4,09 (2H, т, J=6,5 Гц), 6,96-7,08 (3H, м), 7,28-7,33 (1H, м), 7,61-7,66 (2H, м), 8,05 (1H, c).
Пример 95
5-Фтор-3-(4-гидроксифенил)-8-пропокси-1Н-хинолин-4-он
Раствор 5-фтор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-она (249 мг, 0,76 ммоль) в дихлорметане (5 мл) охлаждали до -10°С на бане метанола со льдом. Добавляли туда 1 н. трехбромистый бор (4,08 мл) и перемешивали смесь при комнатной температуре в течение 6 часов. К реакционной смеси добавляли ледяную воду и дихлорметан и выделяли полученное нерастворимое вещество фильтрованием. Фильтрат отделяли и концентрировали органический слой при пониженном давлении. Остаток и оставшееся на фильтре вещество смешивали, и очищали данную смесь колоночной хроматографией на силикагеле (дихлорметан:метанол=60:1→25:1). Очищенный продукт концентрировали при пониженном давлении. Для кристаллизации остатка добавляли этилацетат. Кристаллы выделяли фильтрованием, промывали этилацетатом и затем сушили, получая при этом 220 мг порошкообразного 5-фтор-3-(4-гидроксифенил)-8-пропокси-1Н-хинолин-4-она бледно-желтого цвета (выход: 92%).
Температура плавления 271-272°С.
1Н ЯМР (ДМСО-d6) dppm: 1,03 (3H, т, J=7,3 Гц), 1,78-1,87 (2H, м), 4,08 (2H, т, J=6,4 Гц), 6,77 (2H, д, J=8,6 Гц), 6,87 (1H, д, J=8,8 Гц, J=12,1 Гц), 7,12 (1H, дд, J=3,9 Гц, J=8,8 Гц), 7,41 (2H, д, J=8,6 Гц), 7,77 (1H, c), 9,43 (1H, ушир.с), 11,20 (1H, ушир.с).
Пример 96
5-Фтор-8-гидрокси-3-(4-гидроксифенил)-1Н-хинолин-4-он
5-Фтор-8-метокси-3-(4-метоксифенил)-1Н-хинолин-4-он (1,0 г, 3,34 ммоль) суспендировали в дихлорметане (40 мл), и охлаждали суспензию до -10°С на бане метанола со льдом. Добавляли туда 1 н. трехбромистый бор (17 мл) и перемешивали полученную смесь при комнатной температуре в течение 15 часов. К реакционной смеси добавляли ледяную воду и дихлорметан и выделяли полученное нерастворимое вещество фильтрованием. Оставшееся на фильтре вещество промывали водой, сушили и очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=20:1→8:1→этилацетат:метанол=4:1). Очищенный продукт концентрировали при пониженном давлении и затем добавляли этилацетат для кристаллизации остатка. Кристаллы выделяли фильтрованием, промывали этилацетатом и сушили, получая при этом 360 мг порошкообразного 5-фтор-8-гидрокси-3-(4-гидроксифенил)-1Н-хинолин-4-она бледно-серого цвета (выход: 40%).
Температура плавления 303-305°С (разложение).
1Н ЯМР (ДМСО-d6) dppm: 6,74-6,82 (3H, м), 6,94 (1H, дд, J=4,1 Гц, J=8,5 Гц), 7,41 (2H, д, J=8,3 Гц), 7,74 (1H, c), 9,46 (1H, ушир.с), 10,70 (1H, ушир.с), 11,32 (1H, ушир.с).
Пример 97
5-Фтор-3-(4-гидрокси-2-метоксифенил)-8-пропокси-1Н-хинолин-4-он
К раствору 5-фтор-3-(4-изопропокси-2-метоксифенил)-8-пропокси-1Н-хинолин-4-она (120 мг, 0,31 ммоль) в дихлорметане (5 мл) добавляли хлористый алюминий (108 мг, 0,81 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и дихлорметан и разделяли. После этого органический слой промывали водой. Промытый органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток затем очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=10:1). Очищенный продукт концентрировали при пониженном давлении, и остаток перекристаллизовывали из этилацетата, получая при этом 100 мг порошкообразного 5-фтор-3-(4-гидрокси-2-метоксифенил)-8-пропокси-1Н-хинолин-4-она белого цвета (выход: 90%).
Температура плавления 251-253°С.
1Н ЯМР (ДМСО-d6) dppm: 1,01-1,07 (3H, т, J=7,4 Гц), 1,77-1,88 (2H, м), 3,63 (3H, c), 4,07-4,12 (2H, т, J=6,6 Гц), 6,33-6,43 (2H, м), 6,84-6,90 (1H, м), 7,02-7,11 (2H, м), 7,61-7,64 (1H, м), 9,39 (1H, c), 11,07 (1H, ушир.с).
Соединение следующего примера 98 получали способом, аналогичным способу описанного выше примера 97, с использованием соответствующих исходных соединений.
Пример 98
5-Фтор-3-(2-гидрокси-4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 208-209°С.
1Н ЯМР (ДМСО-d6) dppm: 1,02 (3H, т, J=7,5 Гц), 1,81-1,90 (2H, м), 3,73 (3H, c), 4,11 (2H, т, J=6,5 Гц), 6,43-6,51 (2H, м), 6,98-7,06 (1H, м), 7,16-7,25 (2H, м), 7,95 (1H, c), 10,23 (1H, c), 11,93 (1H, ушир.с).
Пример 99
5-Фтор-8-гидрокси-3-(4-метоксифенил)-1Н-хинолин-4-он
К раствору 5-фтор-8-метоксиметокси-3-(4-метоксифенил)-1Н-хинолин-4-она (350 мг, 1,06 ммоль) в этаноле (18 мл) добавляли 2 н. хлористоводородную кислоту (6,0 мл). Смесь перемешивали при 55°С в течение 1 часа. Перемешиваемую смесь охлаждали до комнатной температуры и добавляли к ней 1 н. гидроксид натрия (11,6 мл) для получения рН от 3 до 4. Смесь с доведенным рН концентрировали при пониженном давлении, а остаток затем очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=50:1→20:1). Очищенный продукт концентрировали при пониженном давлении, а остаток кристаллизовали из этанола, выделяли фильтрованием, промывали этанолом и сушили, получая при этом 165 мг порошкообразного 5-фтор-8-гидрокси-3-(4-метоксифенил)-1Н-хинолин-4-она бледно-темно-коричневого цвета (выход: 54%).
Температура плавления 270-272°С.
1Н ЯМР (ДМСО-d6) dppm: 3,75 (3H, c), 6,79 (1H, дд, J=8,5 Гц, J=2,1 Гц), 6,90-6,97 (3H, м), 7,53 (2H, д, J=8,6 Гц), 7,77 (1H, c), 10,60 (1H, ушир.с), 11,40 (1H, ушир.с).
Пример 100
5-Фтор-3-(2-гидроксиметилтиофен-3-ил)-8-пропокси-1Н-хинолин-4-он
3-(5-Фтор-4-оксо-8-пропокси-1,4-дигидрохинолин-3-ил)тиофен-2-карбальдегид (120 мг, 0,39 ммоль) суспендировали в этаноле (5 мл) и добавляли к суспензии боргидрид натрия (19,24 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли дихлорметан к реакционной смеси, которую промывали водой. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=30:1). Очищенный продукт концентрировали при пониженном давлении и остаток перекристаллизовывали из этилацетата, получая при этом 110 мг порошкообразного 5-фтор-3-(2-гидроксиметилтиофен-3-ил)-8-пропокси-1Н-хинолин-4-она белого цвета (выход: 82%).
Температура плавления 181-184°С.
1Н ЯМР (ДМСО-d6) dppm: 1,01 (3H, т, J=7,3 Гц), 1,79-1,88 (2H, м), 4,07 (2H, т, J=6,4 Гц), 4,47 (2H, д, J=5,4 Гц), 5,48 (1H, т, J=5,4 Гц), 6,87-6,96 (1H, м), 7,11-7,19 (2H, м), 7,39-7,40 (1H, м), 7,88 (1H, c), 11,36 (1H, ушир.с).
Пример 101
5-Фтор-8-(3-гидроксипропокси)-3-(4-метоксифенил)-1Н-хинолин-4-он
8-(3-Бензилоксипропокси)-5-фтор-3-(4-метоксифенил)-1Н-хинолин-4-он (1,95 г, 4,49 ммоль) и 10%-ный палладий на угле (720 мг) добавляли к этанолу (50 мл). Смесь перемешивали при 55°С в течение 7,5 часов в атмосфере водорода (1 атмосфера) и подвергали каталитическому восстановлению. Реакционную смесь охлаждали до комнатной температуры и фильтровали через целит, чтобы удалить растворитель. Фильтрат концентрировали при пониженном давлении. После этого остаток очищали колоночной хроматографией на силикагеле (дихлорметан:метанол=80:1→20:1). Очищенный продукт концентрировали при пониженном давлении и остаток концентрировали досуха, получая при этом 820 мг аморфного твердого 5-фтор-8-(3-гидроксипропокси)-3-(4-метоксифенил)-1Н-хинолин-4-она бледно-темно-коричневого цвета (выход: 53%).
1Н ЯМР (ДМСО-d6) dppm: 1,92-2,02 (2H, м), 3,65 (2H, т, J=5,9 Гц), 4,20 (2H, т, J=6,2 Гц), 4,59 (1H, ушир.с), 6,84-6,95 (3H, м), 7,14 (1H, дд, J=3,9 Гц, J=8,8 Гц), 7,55 (2H, д, J=8,7 Гц), 7,80 (1H, c), 11,27 (1H, ушир.с).
Соединение следующего примера 102 получали способом, аналогичным способу описанного выше примера 101, с использованием соответствующих исходных соединений.
Пример 102
5-Фтор-8-(2-гидроксипропокси)-3-(4-метоксифенил)-1Н-хинолин-4-он
Белый порошок (этилацетат).
Температура плавления 216-218°С.
1Н ЯМР (ДМСО-d6) dppm: 1,19 (3H, д, J=6,2 Гц), 3,76 (3H, c), 3,82-4,12 (3H, м), 5,25 (1H, ушир.с), 6,84-6,96 (3H, м), 7,12 (1H, дд, J=3,9 Гц, J=8,8 Гц), 7,56 (2H, д, J=8,8 Гц), 7,86 (1H, c), 11,20 (1H, ушир.с).
Соединения следующих примеров 103 и 104 получали способом, аналогичным способу описанного выше примера 1, с использованием соответствующих исходных соединений.
Пример 103
5-Хлор-3-(4-метоксифенил)-8-пропокси-1Н-хинолин-4-он
Бледно-коричневый порошок (этилацетат).
Температура плавления 194-196°С.
1Н ЯМР (ДМСО-d6) dppm: 1,03 (3H, т, J=7,3 Гц), 1,80-1,87 (2H, м), 3,76 (3H, c), 4,11 (2H, т, J=6,4 Гц), 6,93 (2H, д, J=8,6 Гц), 7,12 (1H, д, J=8,5 Гц), 7,17 (1H, д, J=8,5 Гц), 7,54 (2H, д, J=8,6 Гц), 7,80 (1H, c), 11,23 (1H, ушир.с).
Пример 104
5-Бром-8-циклопентокси-3-(4-метоксифенил)-1Н-хинолин-4-он
Бледно-коричневый порошок (этанол).
Температура плавления 213-215°С.
1Н ЯМР (ДМСО-d6) dppm: 1,59-1,70 (2H, м), 1,71-2,00 (6H, м), 3,75 (3H, c), 4,97-5,00 (1H, м), 6,94 (2H, д, J=8,7 Гц), 7,04 (1H, д, J=8,5 Гц), 7,40 (1H, д, J=8,4 Гц), 7,53 (2H, д, J=8,7 Гц), 7,81 (1H, c), 11,20 (1H, ушир.с).
Фармакологический тест 1
Оценка улучшения митохондриальной дисфункции при использовании клеточных линий нейробластомы человека SH-SY5Y, обработанных 1-метил-4-фенилпиридинием (МРР+).
В клеточных линиях нейробластомы человека SH-SY5Y, в которых митохондриальная активность была нарушена обработкой МРР+ (Bollimuntha S. et al., J Biol. Chem, 280, 2132-2140 (2005) и Shang T. et al., J Biol. Chem, 280, 34644-34653 (2005)), улучшение митохондриальной дисфункции оценивали на основании измерения величины митохондриальной окислительно-восстановительной активности при помощи флуоресцентного красителя Alamar Blue после добавления соединения (Nakai M. et al., Exp. Neurol, 179, 103-110 (2003)).
Клеточные линии нейробластомы человека SH-SY5Y выращивали в модифицированной по способу Дульбекко среде Игла, содержащей 10% эмбриональной телячьей сыворотки (DMEM, содержащей 50 единиц/мл пенициллина и 50 мкг/мл стрептомицина в качестве антибиотиков) при 37°С в присутствии 5% двуокиси углерода. Клетки размещали на покрытом поли-D-лизином 96-луночном черном планшете при концентрации 3-6×104 клеток/см2 (количество среды: 100 мкл/лунку) и выращивали в указанной выше среде в течение двух дней. После этого среду заменяли на DMEM, содержащую 1% саплимент N2 (N2-DMEM), или на среду (100 мкл/лунку), в которой растворяли 1,5 мМ МРР+. Клетки выращивали в ней в течение 39-48 часов и затем подвергали системе измерения митохондриальной окислительно-восстановительной активности. Тестируемое соединение, которое предварительно растворяли в диметилфульфоксиде (ДМСО), разбавляли N2-DMEM и добавляли в объеме 10 мкл/лунку за 24 часа до измерения активности (конечная концентрация соединения: от 0,01 до 1 мкл/лунку).
После удаления среды отсасыванием добавляли сбалансированный солевой раствор, содержащий 10% Alamar Blue (154 мМ хлорида натрия, 5,6 мМ хлорида калия, 2,3 мМ хлорида кальция, 1,0 мМ хлорида магния, 3,6 мМ гидрокарбоната натрия, 5 мМ глюкозы, 5 мМ HEPES, рН 7,2) в объеме 100 мкл/лунку, и вводили во взаимодействие в инкубаторе при 37°С в течение 1 часа. Интенсивность флуоресценции определяли при помощи детектора флуоресценции (продукт Hamamatsu Photonics K.K., длина волны возбуждения 530 нм, длина волны измерения 580 нм), для измерения, таким образом, митохондриальной окислительно-восстановительной активности.
Сравнительную оценку интенсивности флуоресценции лунки клеток, выращенных в среде, содержащей МРР+, и каждого из тестируемых соединений, проводили на основании 100% интенсивности флуоресценции лунки клеток, выращенных в среде, содержащей только ДМСО (конечная концентрация: 0,1%). Когда группы МРР+-индуцированных клеток проявляли большую интенсивность флуоресценции, чем группы клеток, выращенных только в ДМСО, тестируемое соединение оценивали как обладающее улучшенной активностью в отношении митохондриальной дисфункции.
|
Фармакологический тест 2
Оценка дофаминергической нейрональной протективной активности с использованием C57BL/6 мышей, обработанных 1-метил-4-фенил-1,2,3,6-тетрагидропиридином (МРТР)
При использовании мыши с МРТР-поврежденными дофаминергическими нейронами (Chan Р. et al., J Neurochem, 57, 348-351 (1991)), оценку дофаминергической нейропротективной активности проводили на основании содержания дофамина и уровня белка тирозингидроксилазы (ТН) и переносчика дофамина (DAT) (то есть дофаминергических нейрональных маркерных белков) в области полосатого тела мозга после введения соединения (Mori А. et al., Neurosci Res, 51, 265-274 (2005)).
В качестве подопытного животного использовали самца мыши C57BL/6 (предоставленного Japan Charles River Inc., от 10 до 12 недель). МРТР растворяли в физиологическом раствор соли до получения концентрации 4 мг/мл и затем вводили мыши подкожно в объеме 10 мл/кг. Тестируемое соединение суспендировали в 5%-ном растворе гуммиарабика/физиологического солевого раствора (масс./об.) таким образом, чтобы можно было получить концентрацию соединения 1 мг/мл. Каждое из тестируемых соединений или его растворителей вводили мыши перорально через 30 минут, 24 часа и 48 часов после введения МРТР. Мышь декапитировали через 72 часа после введения МРТР, извлекали мозг и препарировали каждую сторону стриатума.
Левый стриатум использовали в качестве образца для определения уровня белка методом вестерн-блоттинга. Каждую ткань гомогенизировали в HEPES буферном растворе сахарозы (0,32 М сахарозы, 4 мкг/мл пепстатина, 5 мкг/мл апротинина, 20 мкг/мл ингибитора трипсина, 4 мкг/мл лейпептина, 0,2 мМ фенилметансульфонилфторида, 2 мМ этилендиаминтетрауксусной кислоты (EDTA), 2 мМ этиленгликоль бис(β-аминоэтиловый эфир)тетрауксусной кислоты, 20 мМ HEPES, рН 7,2) и проводили анализ на содержание белка при помощи набора реактивов с бицинхониновой кислотой для анализа белка (предоставленного Pierce Corporation). Каждый гомогенизированный образец, содержащий равное количество белка, растворенного в буферном растворе Лемли, подвергали электрофорезу через полиакриламидные гели в присутствии додецилсульфата натрия. Разделенный электрофорезом белок электрически переносили на поливинилиденфторидные мембраны. Данные мембраны вводили во взаимодействие со специфическим первичным антителом на ТН, DAT и белками «домашнего хозяйства», то есть α1 подгруппой Na+/K+-АТФазы и актина (Na+/K+-АТФаза, продукт UpState Biotechnology Inc.: прочие являются продуктами Chemi-Con Corporation). Затем фиксировали вторичное антитело, меченное пероксидазой хрена (продукт Amersham K.K.) для каждого первичного антитела, и определяли хемилюминесценцию, связанную с ферментной активностью пероксидазы, с использованием рентгеновской пленки. Плотность белкового слоя на пленке анализировали при помощи денситометра (продукт Bio-rad Laboratories Inc.), получая значение ТН относительно Na+/K+-АТФазы и значение DAT относительно актина.
Правый стриатум, массу ткани которого определяли непосредственно после препарирования, использовали в качестве образца для анализа для определения содержания дофамина. Каждую ткань гомогенизировали в 0,1 н. растворе хлорной кислоты, содержащем изопротеренол в качестве соединения внутреннего стандарта измерения, при помощи ультразвукового гомогенизатора, при охлаждении льдом. Надосадочную жидкость, полученную при 20000×g гомогената, который центрифугировали при 4°С в течение 15 минут, подвергали высокоэффективной жидкостной хроматографии на колонке с обращенной фазой (продукт Eicom Corporation). Подвижная фаза 15% метанол 0,1 М лимонная кислота/0,1 М буферный раствор ацетата натрия (содержащий 190 мг/л 1-октансульфоната натрия, 5 мг/л EDTA, рН 3,5) подавали со скоростью 0,5 мл/мин, и детектировали пик дофамина для каждого образца с использованием электрохимического детектора (приложенное напряжение +750 мВ vs. Ag/AgCl, продукт Eicom Corporation). Что касается идентифицированного пика дофамина, содержание дофамина на массу ткани в каждом образце рассчитывали при помощи аналитического программного обеспечения (продукт Gilson Inc.).
В обоих анализах значение образца, взятого у МРТР-индуцированных мышей, которым вводили только тестируемое соединение или растворитель, выражали относительно значения образца, взятого у мышей без обработки МРТР (100%). Статистический анализ значений проводили с использованием системы неклинического статистического анализа. Значения с уровнем значимости <0,05 определяли как статистически значимые. В случае МРТР-индуцированных мышей, когда в группе, получавшей тестируемое лекарственное средство, проявлялось повышение уровня белка по сравнению с группой, получавшей растворитель, и в t-тесте наблюдалась значительная разница между данными группами, тестируемое лекарственное средство оценивали как обладающее дофаминовой нейропротективной активностью.