Результат интеллектуальной деятельности: СРЕДСТВО И СПОСОБ ИНДУКЦИИ АПОПТОЗА ОПУХОЛЕВЫХ КЛЕТОК
Вид РИД
Изобретение
Группа изобретений относится к области медицины, онкологии и может быть использована для индукции апоптоза опухолевых клеток линии Jurkat.
Заболеваемость и смертность от злокачественных новообразований является одной из наиболее актуальных проблем в современной медицине. В патогенезе опухолевого роста выделяют 3 стадии: стадию трансформации нормальной клетки в опухолевую (стадия инициации); стадию размножения опухолевых клеток (стадия промоции); стадию опухолевой прогрессии. Изучение механизмов опухолевого перерождения привело исследователей к выводу о том, что канцерогенез зависит не только от пролиферативной активности опухолевого клона, но и от его возможностей избегать регулируемую клеточную гибель (Антонеева И.И. Петров С.Б. Маркеры апоптоза и пролиферации опухолевых клеток по мере прогрессирования рака яичников // Онкология. - 2008. - Т.10. №2. - С.234-237). В результате генетических мутаций снижается способность трансформированных клеток активировать программу апоптоза, что, с одной стороны, способствует прогрессированию опухолевого процесса, а с другой - может стать причиной множественной лекарственной устойчивости (Абраменко И.В., Фильченков А.А., Оценка параметров апоптоза в диагностике онкологических заболеваний, их прогнозе и оптимизации схем терапии // Вопросы онкологии. - 2003. - Т.49. - С.21-30).
В настоящее время предложено множество средств, направленных на активацию апоптоза опухолевых клеток. Для стимулирования апоптоза предлагается обрабатывать опухолевые клетки водно-спиртовым экстрактом болиголова (Патент РФ№ 2340349, A61K 36/18, A61K 47/10, А61Р 35/00, 10.12.2008). Проапоптотический эффект данного токсического вещества показан на культуре опухолевых клеток и лимфоцитов, необходимы дальнейшие исследования влияния болиголова на жизнедеятельность нормальных клеток организма.
Авторы патента SG№174455 (A1) (C12N 15/113, 28.10.2011) предлагают использовать микро РНК 128, участвующую в регуляции генасупрессора опухолей р53. Однако известно, что р53 является наиболее часто инактивированным регулятором апоптоза в опухолевых клетках. Таким образом, недостатком данного подхода в контексте опухолевой трансформации клеток является отсутствие адекватного ответа со стороны мутировавшего р53.
В изобретении AU №2009322269 (A1) (A61K 31/496; А61Р 35/00; C07D 403/12, 30.06.2011) описано применение веществ, вызывающих ингибирование антиапоптотической функции протеина Bcl-2. Действительно, многие типы опухолей характеризуются повышенной экспрессией данного белка. При этом он является также обязательным компонентам баланса про- и антиапоптотических факторов в нетрансформированных клетках, что существенно ограничивает применение данного подхода. Использование данного подхода ограничено опухолями, характеризующимися повышенной экспрессией Bcl-2.
В качестве средства, стимулирующего апоптоз, описано применение тритерпеновых гликозидов из голотурий (Патент РФ№ 2340349, A61K 36/18, A61K 47/10, А61Р 35/00, 10.12.2008), производных апогоссипола (патент US №2011111057 (A1), A61K 31/02; A61K 31/05; A61K 31/075; A61K 31/11; A61K 31/122; A61K 31/225; A61K 31/337; A61K 31/353; A61K 31/357; A61K 31/453; A61K 31/65; A61K 33/24; А61Р 35/00; G01N 33/68, 12.05.2011), дексанабиола и его производных (Патент WO №2011030106 (A1), A61K 31/352; А61Р 35/00, 17.03.2011), антипрогестина Патент YU №Р29903 (А), A61K 31/57; А61Р 35/00; А61Р 43/00; C07J 7/00, 17.08.2006), ингибитора FAK киназы PND-1186 (WO №2011019943 (A1) МПК А61Р 35/00; C07D 413/02; C07D 413/04, 17.02.2011). Все указанные вещества не являются компонентами нормальной внутриклеточной сигнализации и могут быть токсичны для окружающих тканей. Однако на данный момент времени ассртимент средств для управления апоптозом недостаточен, а область их применения ограничена
В настоящее время предложены различные способы активации апоптоза опухолевых клеток. Так, в качестве индуктора программированной гибели клеток было предложено использование специфических антисмысловых олигонуклеотидов специфичных к мРНК определенных генов, экспрессируемых опухолевыми клетками (Патент РФ №2240125, A61K 31/7088, 20.11.2004). Показано, что модифицированные антитела-агонисты к DR-5 в сочетании с апоптоз-индуцирующими агентами синергетически индуцируют апоптоз раковых клеток (Патент РФ№ 2379056, A61K 39/395, C07K 16/28, А61Р 35/00, 20.01.2010). Данный способ предлагает использование апоптоз-индуцирующих агентов, которые могут приводить к гибели нормальных клеток. Другими исследователями был запатентован способ, позволяющий специфически индуцировать апоптоз клеток, экспрессирующих TLR3-рецептор. Для этого используется агонист TLR3 в сочетании с интерфероном типа I в низкой дозе (Патент РФ№ 2401661, A61K 31/713, A61K 38/21, А61Р 35/00, 20.10.2010). К недостаткам данного метода можно отнести ограничение его применения клетками несущими TLR3-рецептор, клоны клеток с другими дифференцировочными признаками будут не чувствительны к описанному воздействию.
Известно использование магнитного поля для селективной индукции апоптоза опухолевых клеток без воздействия на окружающие ткани и без индукции некроза (Патент РФ№ 2200596, A61N 2/00, 20.03.2003). Описанный метод может быть использован в случае солидных опухолей с четкой локализацией, существенным минусом данного подхода является технические трудности его применения при опухолях клеток крови.
Заявленный в патенте US №2011059189 (A1) (A61K 33/00; А61Р 31/12; А61Р 35/00, 10.03.2011) способ усиления апоптоза опухолей за счет воздействия на клетки модифицированного производного силиката натрия Na8.2Si4.4H9.7O17.6 включает, в том числе, увеличение продукции оксида азота, как проапоптотического агента. D.Bayer предложил воздействовать на уровень внутриклеточного оксида азота путем ингибирования ферментов, ответственных за утилизацию NO (Патент US №2009264398 (A1), A61K 31/337; A61K 31/397; А61Р 35/00; C12Q 1/18, 22.10.2009).
Наиболее близким к предлагаемому является способ индукции апоптоза опухолевых клеток за счет повышения уровня оксида азота ("METHOD FOR INDUCING TUMOR POPTOSIS BY INCREASING NITRIC OXIDE LEVELS" патент US №2009264398). Автор данного метода предлагает использовать ингибитор фермента NO-диоксигеназы, ответственного за утилизацию NO для увеличению уровня указанного газотрансмиттера в опухолевых клетках. Существенным недостатком данного способа является высокая способность оксида азота к окислению внутриклеточных молекул. Так, известно, что митохондрии содержат большое количество гемсодержащих, а также железо- и серосодержащих белков, с которыми NO (или ONOO-) активно соединяется (Реутов В.П. 2002. Цикл оксида азота в организме млекопитающих и принцип цикличности. Биохимия. 67 (3): 353-376). Воздействие оксида азота приводит к разобщению окислительного фосфорилирования на уровне цитохром оксидазы, увеличению количества супероксид аниона и к синтезу пероксинитрита при взаимодействии NO с супероксидом. Пероксинитрит ингибирует практически все компоненты электронной транспортной цепи, включая комплекс I (NADH дегидрогеназу), комплекс II (сукцинат дегидрогеназу), комплекс III (цитохром с редуктазу) и комплекс V (АТФ синтазу) путем окисления цистеина, нитрозилирования тирозина и повреждения Fe-S центров белков (Pacher P., Beckman J. S., Liaudet L. 2007. Nitric Oxide and Peroxynitrite in Health and Disease. Physiol. Rev. 87:315-424). Также, показано, что пероксинитрит приводит к открытию пор индуктором апопотоза было выявлено в результате проведения экспериментальных исследований. В настоящее время известно, что внутриклеточные газы необходимы для функционирования практически всех органов и тканей. Монооксид углерода вовлечен в регуляцию тонуса сосудов и ангиогенеза, передачу импульсов в мозге, а также метаболизм ксенобиотиков в печеночной ткани. СО ингибирует про-воспалительные сигнальные пути и способствует индукции анти-инфламаторных и анти-пролиферативных механизмов [20]. В экспериментах с использованием нетрансформированных клеток показано, что СО ингибирует апоптоз. Антиапоптотический потенциал СО был впервые продемонстрирован в экспериментальных условиях при исследовании влияния данного газа на эндотелиальные клетки и β-клетки поджелудочной железы. Так, добавление в клеточные культуры экзогенного СО препятствовало TNF-индуцированному апоптозу мышиных фибробластов и эндотелиальных клеток. Подобный антиапоптотический эффект наблюдался в условиях in vitro при гиперэкспрессии гемоксигеназы-1 [21]. Показано, что СО защищает эндотелиальные клетки от TNF-опосредованного апоптоза за счет активации NF-κВ-зависимых антиапоптотических генов [22]. Однако монооксид углерода имеет проапоптотичексий эффект в отношении опухолевотрансформированных клеток. В экспериментах с использованием Jurkat клеток было показано, что СО усиливает клеточную смерть, активированную Fas/FasL или TRAIL лигандами [23]. На примере эндотелиальных клеток показано, что СО повышает продукцию оксида азота за счет Akt-опосредованного фосфорилирования eNOS, что может приводить к усилению апоптоза [24]. На сегодняшний день существует несколько потенциальных доноров моноксида углерода. CO-RM (СО-высвобождающие молекулы), группа соединений, являющихся донорами моноксида углерода и диссоциирующие с выделением СО в клетках (CORM-1 ([Mn2(СО)10]) и CORM-2 (Ru(CO)3Cl2 димер), CORM-3 и CORM-4). В своей работе мы использовали CORM-2, обладающий не только липофильностью, но и способностью быстро диссоциировать в растворе с образованием моноксида углерода [25].
Способ осуществляют следующим образом
0,5 мкл стокового 20 мМ раствора CORM-2 добавляют к 200 мкл клеточной суспензии опухолевых клеток линии Jurkat плотностью 1*106 клеток/мл для получения конечной концентрации 50 мкМ, и далее образцы культивируют в течение 24 ч в 5% СО2 атмосфере при 37°C.
Пример на выполнение способа
Т-лимфобластные клетки человека линии Jurkat (Всероссийский банк клеточных культур. Институт цитологии РАН, С.-Петербург) были культивированы в RPMI-1640 («Invitrogen», США) дополненной в соотношении 9:1 эмбриональной телячьей сывороткой («Gibco Invitrogen», США), 0,3 мг/мл L- глутамином и 100 мкг/мл гентамицином в 5% CO2 атмосфере при 37°C, с оптимальной плотностью 1*106 клеток/мл. Оптимальную жизнеспособность клеток поддерживали пассажами через каждые три дня.
Мононуклеарные клетки выделяют из цельной венозной крови методом градиентного центрифугирования [Натвиг Дж. и соавт., 1980]. Венозную кровь, стабилизированную К3ЭДТА в соотношении 2:1 наслаивают на градиент плотности Ficoll-Paque (ρ=1,077 г/см3) («Pharmacia», Швеция) и центрифугируют при 1500 об/мин в течение 20 мин. Кольцо, образованное из смеси мононуклеарных лейкоцитов, собирают пипеткой с раздела фаз. Клетки трижды отмывают средой RPMI-1640, ресуспендируя и центрифугируя каждый раз в течение 10 мин при 1500 об/мин. Для определения жизнеспособности 7 мкл суспензии клеток смешивают со 140 мкл 0,5% трипанового синего («Serva», США), заполняют счетную камеру Горяева. Жизнеспособность клеток оценивают по содержанию «мертвых» клеток, окрашенных в синий цвет. Доля погибших клеток, содержащих краситель, не превышала 5 %. Выделенные на градиенте плотности мононуклеары ресуспендируют в полной питательной среде (90% RPMI-1640, 10% эмбриональной телячьей сыворотки («Gibco Invitrogen», США), 0,3 мг/мл L-глутамина, 100 мкг/мл гентамицина). Для стандартизации количества клеток суспензию мононуклеарных лейкоцитов разбавляют полной питательной средой до получения 1·106 клеток в 1 мл среды.
Для определения жизнеспособности 7 мкл суспензии клеток смешивают с 70 мкл 0,5% трипанового синего («Serva», США) и 70 мкл 0,9% NaCl, а затем заполняют счетную камеру Горяева. Жизнеспособность мононуклеарных лейкоцитов оценивают по содержанию «мертвых» клеток, окрашенных в синий цвет. Доля погибших клеток, содержащих краситель, обычно, не превышает 5%.
Готовят стоковый раствор CORM-2 (Sigma, USA), для этого 1 млг указанного вещества добавляют к 100 мкл DMSO (Sigma, USA) для получения 20 мМ раствора. Для проведения эксперимента клетки линии Jurkat и мононуклеарные лейкоциты в концентрации 1·106 клеток в 1 мл среды переносят в 96-луночные планшеты (по 200 мкл клеточной суспензии в 1 лунке), добавляют 0,5 мкл стокового раствора 20 мМ CORM-2 до получения конечной концентрации 50 мкМ. Экспериментальные образцы культивируют в течение 24 ч в 5% СО2 атмосфере при 37°С.
Для подтверждения активации апоптоза клеток используют тесты - аннексиновый тест, определение содержания белков семейства Bcl-2, тест с оценкой числа клеток со сниженным митохондриальным трансмембранным потенциалом, определение уровня экспрессии генов, кодирующих белки семейства bcl-2.
Предлагаемые условия способа (концентрация, время и температура инкубации способа) основаны на результатах экспериментальных исследований.
Приводим результаты тестов, подтверждающих активацию апоптоза клеток линии Jurkat при использовании CORM-2 в указанной концентрации и экпозиции и температуре.
Аннексиновый тест. Количество апоптотических клеток определяли с помощью проточной цитофлуориметрии (Facs CantoII («Beckman Dickenson», США)) с использованием набора «ANNEXIN V FITC» («Abeam», США). Полученные результаты выражали в процентах (отношение числа клеток, связавших аннексии V и/или пропидий иодид к общему числу клеток).
В Таблице 1 приведены результаты аннексинового теста. Процент клеток, связавших аннексии V, отражает число клеток с апоптотическими изменениями. Пропидий иодид-положительные клетки являются некротизированным (van England). 50 мкМ концентрация CORM-2 вызывала апоптоз опухолевых клеток линии Jurkat и не влияла на жизнедеятельность небласттрансфоримированных клеток (мононуклеарные лейкоциты) (* - различия достоверны (р<0,05) по сравнению с интактной культурой). Указанная концентрация донора монооксида углерода не вызывала индукция некротического пути гибели клеток.
Оценка числа клеток со сниженным митохондриальным трансмембранным потенциалом.
Количество клеток со сниженным уровнем потенциала митохондриальных мембран (Δψ) определяли с помощью проточной цитофлуориметрии (Facs CantoII («Beckman Dickenson», США)) с использованием набора «MitoScreen» («BD Pharmigen», США). Полученные результаты выражали в процентах (отношение числа клеток, со сниженным митохондриальным трансмембранным потенциалом к общему числу клеток).
В Таблице 2 приведены результаты, характеризующие состояние митохондриальных мембран после воздействия донора СО (* - различия достоверны (р<0,05) по сравнению с интактной культурой). Полученные данные свидетельствуют о том, что донор монооксида углерода в концентрации 50 мкМ вызывает падение митохондриального трансмембранного потенциала клеток. Таким образом, был сделан вывод о том, что монооксид углерода вызывает активацию апоптоза за счет индукции митохондриального пути запуска программированной клеточной гибели.
Определение содержания белков семейства Bcl-2
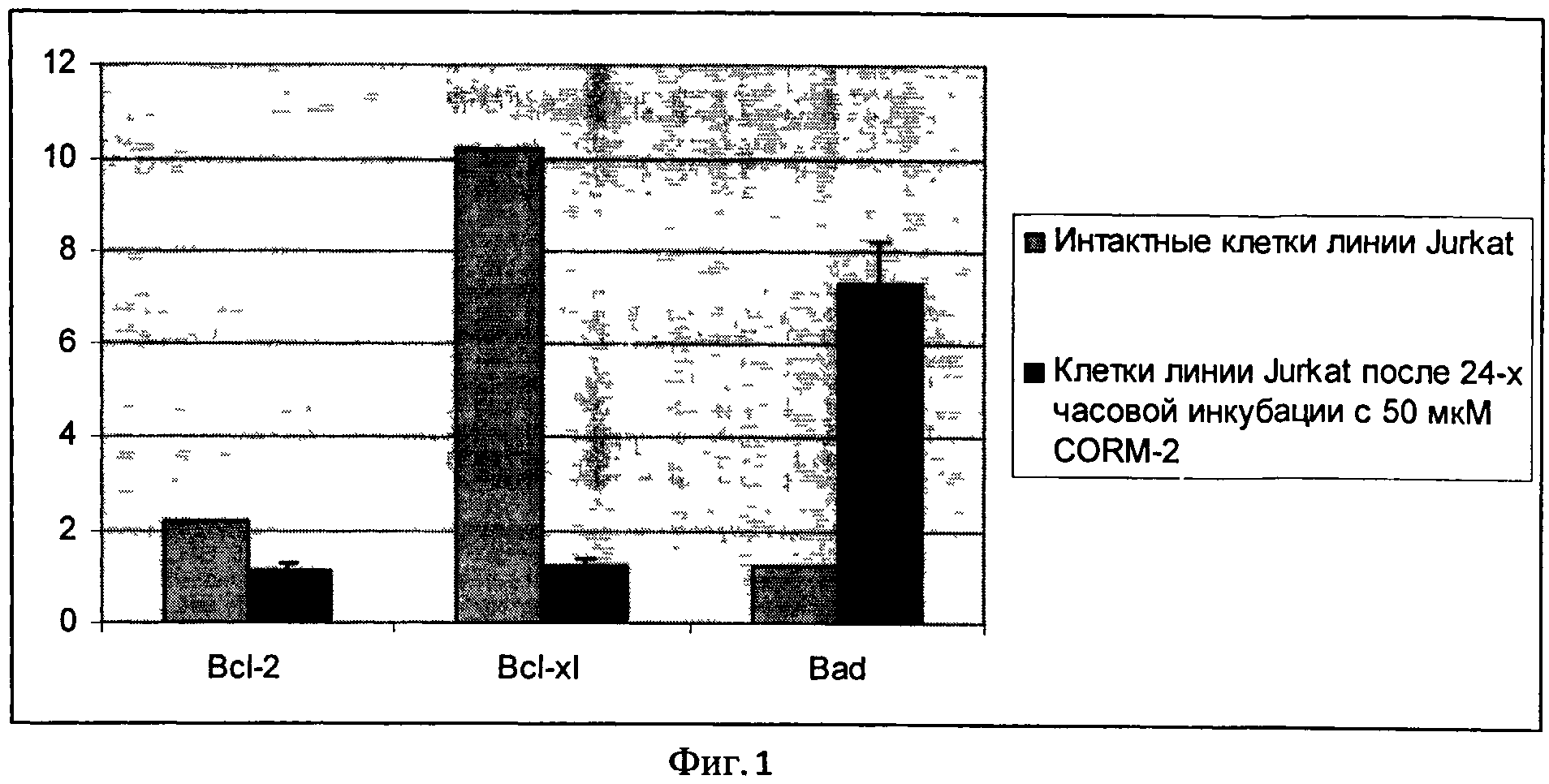
Содержание белков bcl-2, bcl-xl и bad определяли методом вестерн-блот. Равное количество цельноклеточных лизатов подвергали электрофорезу в 10% SDS полиакриламидном геле, затем осуществляли перенос белков на нитроцеллюлозную мембрану. Далее мембрану блокировали 1% желатином, трижды промывали TTBS (20 мМ/л Tris HCl, рН 7,6,137 мМ/л NaCl, и 0,05% Tween 20). Затем мембрану инкубировали с первичными антителами (anti-Bcl-XL («Sigma», США), anti-Bad («Biosource», США), anti-Bcl-2 («Biosource», США)) в течение часа. Трижды промывали TTBS и добавляли вторичные антитела с пероксидазной меткой («Biosource», США). Для визуализации результатов исследования использовали хемилюминесцентный метод («NOVEX ECL Chemiluminescent Substrate Reagent kit», Invitrogen, США). Количественное содержание белков определяли путем подсчета интенсивности бенда на рентгеновской пленке с помощью программы TotalLab v.2.01. В качестве стандарта и внутреннего контроля использовали белок глицеро-3-фосфат-дегидрогеназу («Chemicon», США), выражая содержание исследуемых протеинов как отношение сигнала определяемого белка к сигналу белка глицеро-3-фосфат-дегидрогеназы в исследуемых образцах. На Фиг.1 показано изменение содержания белков семейства Bcl-2 при воздействии на клетки донора монооксида углерода.
Таким образом, проапоптотический эффект донора внутриклеточного газового трансмиттера СО опосредован дисбалансом в системе белков семейства Bcl-2 (повышением содержания проапоптотического белка Bad и снижением содержания антиапоптотических белков Bcl-2 и Bcl-xl).
Определение уровня экспрессии генов, кодирующих белки семейства bcl-2
Уровень экспрессии генов bcl-2, bcl-xl и bad определяли методом полимеразной цепной реакции в реальном времени (Real-Time PCR). Суммарную РНК выделяли из клеток с использованием набора реагентов «QIAmp RNeasy mini Kit» (QIAGEN, Германия). Процедуру обратной транскрипции проводили с использованием случайных гексапраймеров и MMuLV-обратной транскриптазы («Promega», США). Амплификацию кДНК исследуемых генов, а также анализ продуктов амплификации в режиме реального времени проводили на приборе Mini Opticon («BioRad», США) с использованием реакционной смеси с интеркалирующим красителем SYBR Green I («Molecular Probe», США). В качестве референсного гена использовали ген b-actine. Результаты выражали в условных единицах (отношение числа циклов амплификации исследуемого гена к количеству циклов амплификации референсного гена).
В Таблице 3 приведены результаты оценки экспрессии мРНК генов, кодирующих белки регуляторы апоптоза семейства bcl-2 (* - различия достоверны (р<0,05) по сравнению с интактной культурой).
Таким образом, индуцированное монооксидом углерода снижение содержания белков Bcl-2 и Bcl-xl происходит за счет снижения экспрессии мРНК соответствующих генов.
Статистический анализ результатов
Статистический анализ проводили с использованием программного обеспечения SPSS V.11.0 (SPSS, Chicago, USA). Различия считались достоверными при уровне значимости р<0,05.
Таким образом, донор монооксида углерода вызывает апоптоз клеток линии Jurkat, за счет изменения экспрессии и содержания белков, регулирующих целостность митохондриальных мембран. Использование донора монооксида углерода является физиологичным для управления апоптозом в рамках организме в случае создания лекарственных веществ на основании данного подхода.
|
|
|
Источники информации
1. Антонеева И.И., Петров С.Б. Маркеры апоптоза и пролиферации опухолевых клеток по мере прогрессирования рака яичников // Онкология. - 2008. - Т.10. №2. - С.234-237
2. Абраменко И.В., Фильченков А.А., Оценка параметров апоптоза в диагностике онкологических заболеваний, их прогнозе и оптимизации схем терапии // Вопросы онкологии. - 2003. - Т.49. - С.21-30
3. Патент РФ № 2340349 Опубликовано: 10.12.2008
4. Патент SG №174455 Опубликовано: 28.10.2011.
5. Патент AU 2009322269 Опубликовано: 30.06.2011
6. Патент РФ №2340349, Опубликовано: 10.12.2008
7. Патент US № 2011111057 Опубликовано: 12.05.2011
8. Патент WO № 2011030106 Опубликовано: 17.03.2011
9. Патент YUP № 29903 Опубликовано 17.08.2006
10. Патент WO №2011019943 Опубликовано: 17.02.2011
11. Патент РФ № 2240125, Опубликовано: 20.11.2004
12. Патент РФ № 2379056, Опубликовано: 20.01.2010
13. Патент РФ № 2401661, Опубликовано: 20.10.2010
14. Патент РФ № 2200596, Опубликовано: 20.03.2003
15. Патент US № 2011059189 Опубликовано: 10.03.2011
16. Патент US № 2009264398 Опубликовано: 22.10.2009 (прототип)
17. Реутов В.П. Цикл оксида азота в организме млекопитающих и принцип цикличности / Биохимия. - 2002. - Т.67. - №3. - С.353-376.
18. Pacher P., Beckman J.S., Liaudet L. Nitric Oxide and Peroxynitrite in Health and Disease / Physiol. Rev. - 2007. - Vol.87. - P.315-424.
19. Vieira H.L., Belzac A.S., Haouzi D. The adenine nucleotide translocator: a target of nitric oxide, peroxynitrite, 4-hydroxynonenal / Oncogene. - 2001. - Vol.20. - P.4305-4316.
20. Wang R. Two′s company, three′s a crowd: can H2S be the third endogenous gaseous transmitter? / FASEB J. - 2002. - Vol.16. - P.1792-1798.
21. Inguaggiato P., Gonzalez-Michaca L., Croatt A.J., Haggard J.J., Alam J., Nath K.A. Cellular overexpression of heme oxygenase-1 up-regulates p21 and confers resistance to apoptosis / Kidney Int. - 2001. - Vol.60. - P.2181-2191
22. Zuckerbraun В.S., Billiar Т.R. Carbon monoxide protects against liver failure through nitric oxide-induced heme oxygenase 1 / J. Exp. Med. - 2003. - Vol.198. - P.1707-1716.
23. Song R., Zhou Z., Kim P.K., Shapiro R.A., Liu F., Ferran C., Choi A.M., Otterbein L.E. Carbon monoxide promotes Fas/CD95-induced apoptosis in Jurkat cells / J Biol Chem. - 2004. - Vol.279. - P.44327-44334.
24. Fujimoto H., Ohno M., Ayabe S., Kobayashi H., IshizakaN., Kimura H., Yoshida K., Nagai R. Carbon monoxide protects against cardiac ischemia-reperfusion injury in vivo via МАРK and Akt-eNOS pathways / Arterioscler Thromb Vase Biol. - 2004. - Vol.24. - P.1848-1853
25. Hidaka A, Azuma YT, Nakajima H, Takeuchi T. Nitric oxide and carbon monoxide act as inhibitory neurotransmitters in the longitudinal muscle of C57BL/6J mouse distal colon // J Pharmacol Sci. - 2010. - Vol.112. - P.231-241.