Результат интеллектуальной деятельности: СПОСОБ ВЫЯВЛЕНИЯ ГЕНОВ, ДЕТЕРМИНИРУЮЩИХ АДГЕЗИНЫ, ГЕМОЛИЗИНЫ, МАННОЗА-РЕЗИСТЕНТНЫЕ ГЕМАГГЛЮТИНИНЫ У ГЕНИТАЛЬНЫХ ШТАММОВ Escherichia coli
Вид РИД
Изобретение
Изобретение относится к микробиологии, генетической инженерии, биотехнологии и может быть использовано для обнаружения методом молекулярной гибридизации генитальных кишечных палочек, обладающих факторами патогенности, - адгезины, гемолизины, манноза-резистентные гемагглютинины.
В последние десятилетия Escherichia coli стала распространенным нозокомиальным патогеном. Escherichia coli, как представитель условно-патогенной микрофлоры, является причиной развития воспалительных заболеваний урогенитального тракта.
Усиление вирулентности среди гетерогенных популяций потенциально патогенных энтеробактерий в настоящее время является важным объектом исследований различных отраслей биологической и медицинской наук. Наиболее существенными для изменения патогенности условно-патогенных энтеробактерий, ввиду «скачкообразного» характера и кардинальности происходящих превращений микроорганизма, рассматривают генетические рекомбинации, которые определяют геномную пластичность микробов, реализуемую через несколько конкретных механизмов, связанных, в частности, с «островами» и «островками» патогенности, ассоциированных с фрагментами ДНК, включающими дискретные гены вирулентности [1]; [2].
В частности, среди патогенных для человека сероваров Escherichia coli обнаружены «острова патогенности», детерминирующие ключевые этапы взаимодействия любого патогена с макроорганизмом, включая адгезию, продукцию токсинов, способность противостоять факторам неспецифической резистентности [3].
Уропатогенные кишечные палочки, UPEC-uropathogenic E.coli, могут включать гены, контролирующие синтез фимбриальных адгезинов (Р и S), α-гемолизина (hly) и цитотоксического некротизирующего фактора-1 (cnf-1), сайтами интеграции которых являются локусы генов селеноцистеиновой (sel), фенилаланин (phe)-специфичной tRNA [3]. Известны «островки патогенности», контролирующие синтез белков, связанных с поглощением ионов железа, необходимого для размножения возбудителя в ткани, а также гены системы секреции III-го типа, ответственной за одноэтапный транспорт эффекторных молекул из бактериальной клетки в цитоплазму эукариотной клетки с последующей модификацией цитоплазматических белков поражаемых мишеней [4].
В связи с этим в ряде случаев обнаружение генетических детерминант, дополненное фенотипической характеристикой экспрессируемого фактора патогенности, позволяет объективно судить об этиологическом агенте заболевания, имеющем значение в лабораторной диагностике патологий урогенитального тракта.
В настоящее время наиболее перспективными считаются молекулярные методы, основанные на обнаружении ДНК возбудителей в исследуемом материале, в частности методы, основанные на технологии ПЦР. Эти методы обладают высокой чувствительностью и специфичностью и позволяют обнаруживать присутствие очень малого количества копий генетических последовательностей микроорганизмов в микроколичествах исследуемого материала и за короткое время. Кроме того, современные модификации полимеразной цепной реакции, проводимой в режиме реального времени, также позволяют определять количественные значения микроорганизмов.
Известен способ определения частоты встречаемости генетических детерминант вирулентности среди штаммов E.coli, выделенных у детей с инфекцией мочевой системы [2]. Данный способ позволил установить факт, что клиническая форма инфекции мочевой системы прямо зависит от частоты встречаемости маркеров уропатогенности hly A, cnf-1, pap С, sfa G.
Однако описанный способ рекомендован авторами только для выявления возбудителя в моче и не предназначен для обнаружения E.coli в других видах биологического материала (отделяемое влагалища, цервикального канала).
Существует способ выявления генетических детерминант факторов патогенности эшерихий, обеспечивающих адгезию и токсинообразование, в условиях ассоциативного симбиотического взаимодействия E.coli с B.hominis in vitro [5]. В результате данного исследования отмечена высокая частота встречаемости комбинаций генов pap С, pap Н, sfa A, hly В и рар С, fim А, ehx, что свидетельствует об их значимости в процессах адаптации к изменившимся условиям. Описанный способ рекомендован авторами для выявления возбудителя в фекалиях при кишечных инфекциях на фоне бластоцистной инвазии.
Недостатком данного способа является определение участков ДНК, ответственных за факторы вирулентности, не в системе «мультиплекс», т.е. не одновременно.
Известен способ определения мутантного термолабильного энтеротоксина E.coli [6]. Этот способ раскрывает выделенный полипептид, включающий мутантную А субъединицу термолабильного энтеротоксина Escherichia coli (LT), которая имеет только один мутированный остаток, представляющий собой K, R, Н или Y, по сравнению с термолабильным энтеротоксином дикого типа, содержащим определенную аминокислотную последовательность. Полипептид по способу может быть использован в качестве адъюванта.
В данном способе описано выделение только одного фактора патогенности - термолабильного энтеротоксина.
Задачей изобретения является создание способа выявления генов, детерминирующих адгезины, гемолизины, манноза-резистентные гемагглютинины у генитальных штаммов Escherichia coli, обеспечивающего получение технического результата, состоящего в повышении эффективности обнаружения упомянутых генов патогенности, возможности одновременного выявления всех трех генов патогенности за счет унифицикации программы амплификации путем подбора праймеров с одинаковой температурой отжига.
Технический результат достигается тем, что осуществляют отбор биоматериала, выделение бактериальной ДНК, амплификацию фрагментов ДНК исследуемого штамма методом полимеразной цепной реакции с использованием уникального набора олигонуклеотидных праймеров, имеющих нуклеотидные последовательности:
5'-TGG-CTG-CCG-CAC-TAT-TCG-CC-3',
5'-TAT-TGG-GAC-CAC-GCG-TGS-CG-3',
5'-ACG-CCG-GCC-TTA-ACA-GTG-GC-3',
которые обладают высокой специфичностью взаимодействия с фрагментами ДНК, причем продукты амплификации разделяют методом электрофореза в агарозном геле, а результаты ПЦР выявляют все три гена одновременно и учитывают визуализируя окрашиванием бромистым этидием; при этом при наличии в исследуемом биоматериале генов, детерминирующих адгезины, гемолизины, манноза-резистентные гемагглютинины у генитальных штаммов Escherichia coli, образуются фрагменты ДНК fim А размером - 248 п.о., hly А, В, С - 233 п.о., рар С - 251 п.о.
Изобретение иллюстрируется электрофореграммами ампликонов исследуемого штамма с маркерами молекулярного веса.
Результаты анализа представлены на фиг.1-3.
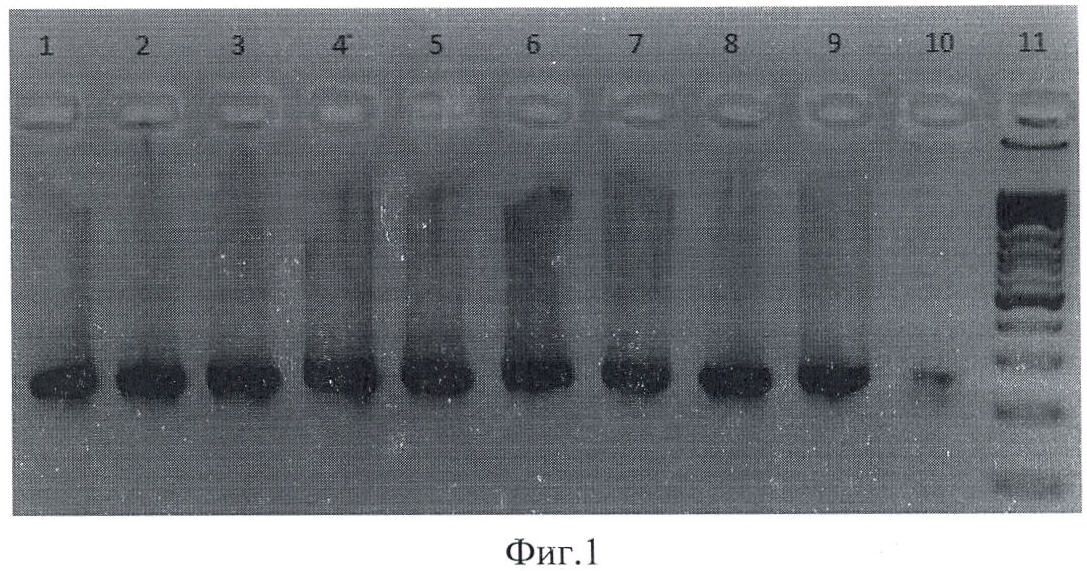
На фиг.1 приведена электрофореграмма продуктов амплификации, полученых при ПЦР-анализе фрагмента ДНК штамма Escherichia coli для гена fim А, где 1-10 - штаммы Escherichia coli, выделенные из клинического материала; 11 - маркер молекулярного веса.
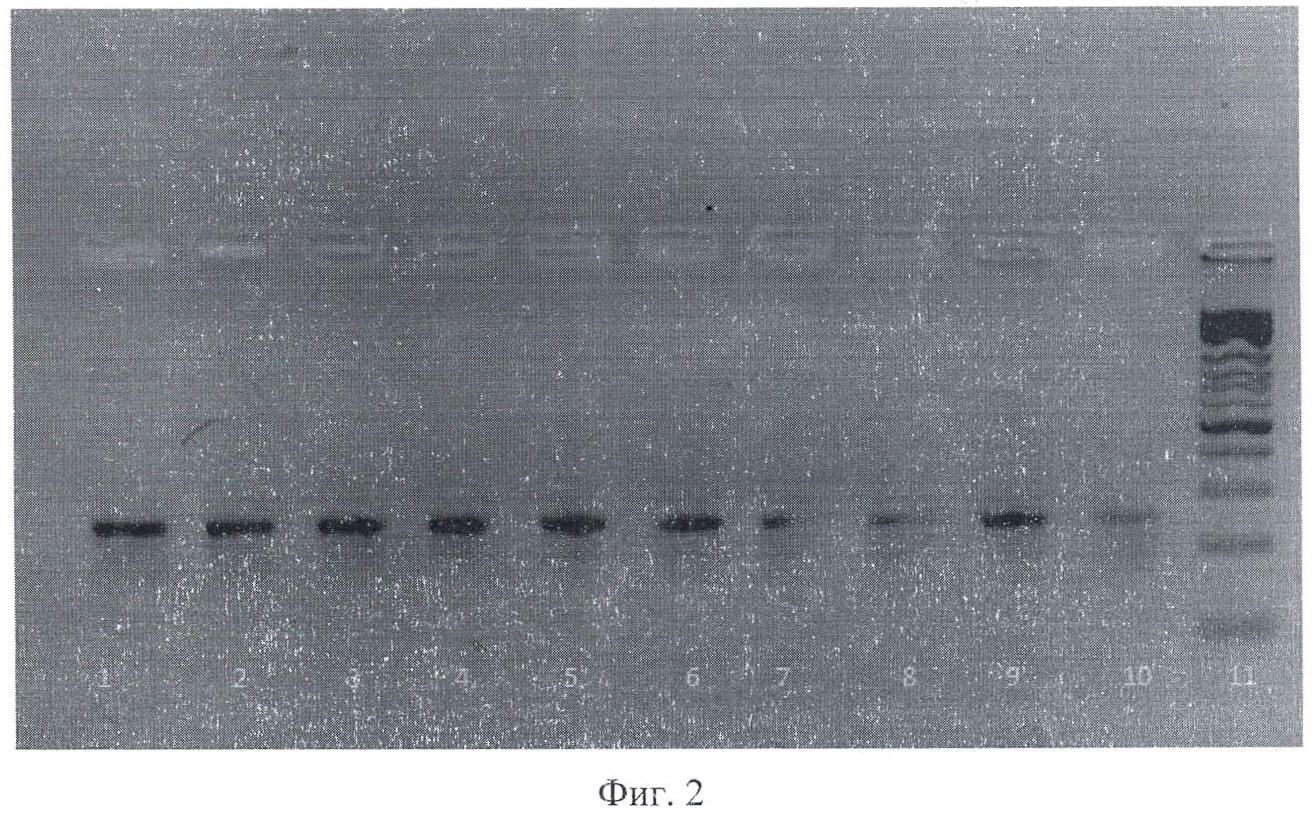
На фиг.2 приведена электрофореграмма продуктов амплификации, полученных при ПЦР-анализе фрагмента ДНК Escherichia coli для гена hly А, В, С, где 1-10 - штаммы Escherichia coli, выделенные из клинического материала; 11 - маркер молекулярного веса.
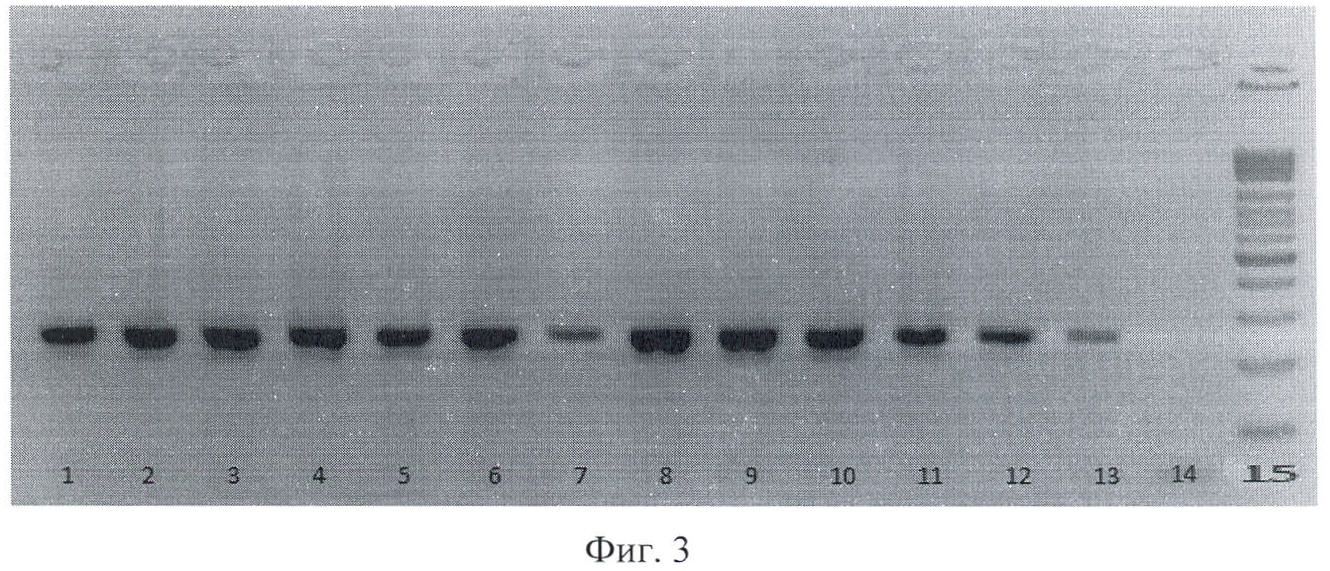
На фиг.3 приведена электрофореграмма продуктов амплификации фрагмента ДНК Escherichia coli для гена рар С, где 1-13 - штаммы Escherichia coli, выделенные из клинического материала; 14 - отрицательный контроль; 15 - маркер молекулярного веса.
Способ осуществляют следующим образом.
Отбор биоматериала (отделяемое влагалища, цервикального канала) осуществляют следующим образом. Влагалищное отделяемое забирают стерильной ложечкой Фолькмана из заднебоковых сводов влагалища при осмотре в зеркалах. Материал из цервикального канала, содержащий эпителиальные клетки, получают с помощью специального урогенитального зонда со щеточкой после предварительного удаления видимой слизи с шейки матки стерильным марлевым тампоном. Проводят культуральное исследование содержимого заднего и боковых сводов влагалища, и цервикального канала на энтеробактерии. Исследуемый биоматериал засевают на питательные среды Эндо или Левина. Посевы помещают в термостат на 24-48 часов при температуре 37°С. На среде Эндо лактозоположительные Escherichia coli растут в виде плоско-выпуклых колоний темно-красного цвета с металлическим блеском. На среде Левина колонии Escherichia coli темно-синие, с металлическим блеском, иногда розоватые. Лактозаотрицательные колонии бесцветны. После инкубации производят идентификацию на основании морфологических, тинкториальных (отрицательная окраска по Граму) свойств.
Далее проводят выделение бактериальной ДНК по стандартной методике с использованием комплекта реагентов для выделения ДНК из биопроб - «Проба ГС» (набор №1).
Олигонуклеотидные праймеры, используемые для амплификации в ПЦР фрагментов генов fim A, hly А, В, С, рар С, подобраны на основе нуклеотидных последовательностей этих генов у штамма Escherichia coli, представленных в базе данных GenBank NCBI (CШA), EMBL (Европейская молекулярно-биологическая библиотека) и DDBJ (Японская база данных нуклеотидных последовательностей), а также в результате секвенирования аналогичного участка у штаммов, выделенных на территории Российской Федерации.
В результате выравнивания нуклеотидных последовательностей генов fim А, hly А, В, С, рар С Escherichia coli (GenBank NCBI: CP001509.1, CP000819.1, CP001665.1, AM946981.1; M10133.1, CP000247.1, AM690760.1; CP001509.1) и штаммов Escherichia coli, выделенных на территории Российской Федерации, была подобрана их консенсусная последовательность и получен уникальный набор олигонуклеотидных праймеров на гены fim А, hly А, В, С, рар С, обладающих высокой специфичностью взаимодействия с фрагментами ДНК:
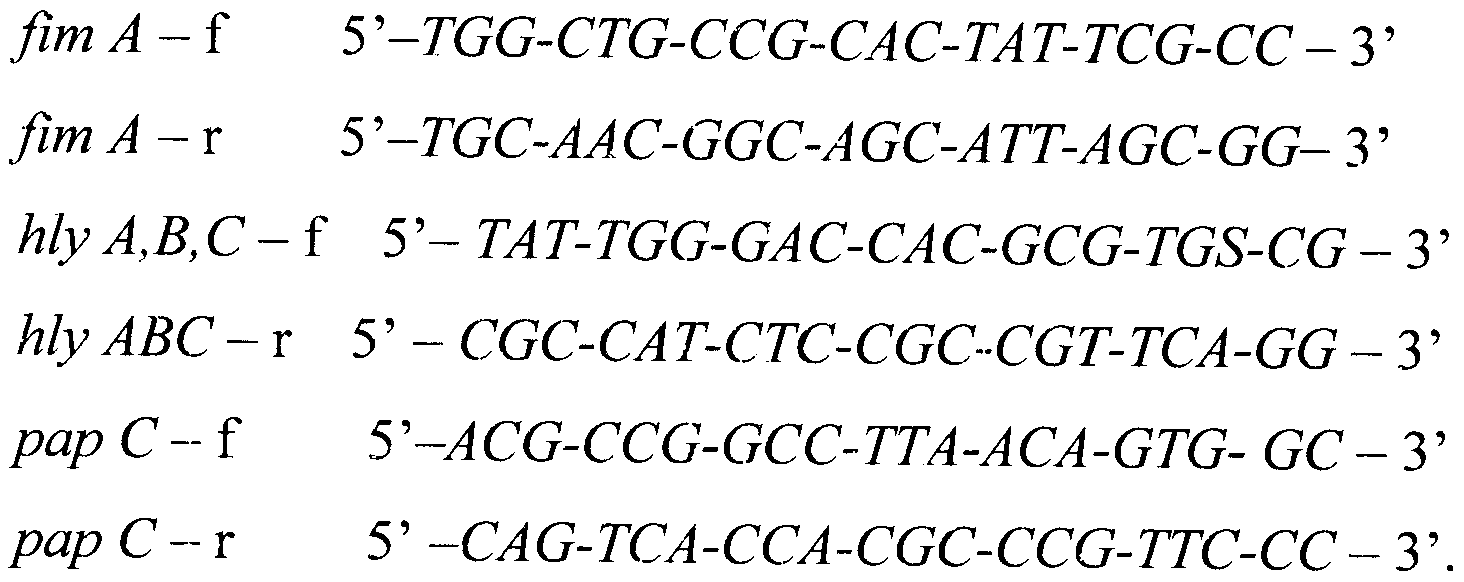
Олигонуклеотиды праймеров и зонда были синтезированы амидофосфитным методом (ЗАО «Синтол», г. Москва; паспорт №3873).
Характеристика олигонуклеотидных праймеров к участкам fim А, hly А, В, С, рар С представлена в табл.1.
|
Полимеразную цепную реакцию осуществляют по стандартной технологии.
Подобраны оптимальные параметры реакции амплификации с олигонуклеотидными праймерами и зондом. В частности, реакционная смесь имеет следующий состав: 0,5 мМ трис-Cl буфера, рН 8.6; 0,5 М KCl; 15 мМ MgCl2; 2,5 мМ дезоксинуклеотидтрифосфаты; по 0,2 мМ прямой и обратный праймеры; Taq ДНК-полимераза - 50 мкл.
ПЦР может быть проведена, например, в приборе «Терцик» (НПО «ДНК-Технология», Россия) с использованием программы, указанной в табл.2.
|
Значения пороговых циклов определяются автоматически прибором.
Регистрацию результатов ПЦР осуществляют путем электрофореза продуктов амплификации на окрашенном бромистым этидием агарозном геле, для чего используют готовые агарозные гели, содержащие 2-3% агарозы и бромистого этидия. Анализ электрофореграмм проводят с помощью видеосистемы Gel Imager и программного обеспечения Gel Analyzer.
Результаты ПЦР определяют одновременно все три гена патогенности и учитывают визуализируя окрашиванием бромистым этидием ПЦР в ультрафиолетовом свете.
В случае положительной реакции на Escherichia coli в электрофорезе появляется фрагмент ДНК fim А размером 248 п.о., hly А, В, С - размером 233 п.о., рар С - размером 251 п.о. При внесении в реакцию ДНК других видов микроорганизмов специфических полос на том уровне, где расположена полоса маркера с соответствующей длиной амплифицируемого участка, в ходе проведения ПЦР не наблюдалось.
Изобретение иллюстрируется следующим примером.
Для апробации предлагаемого способа использовали препараты тотальной ДНК, выделенной из клинических образцов биоматериала (отделяемое влагалища, цервикального канала), взятого у женщин репродуктивного возраста с различными воспалительными заболеваниями. Всего было подготовлено 13 образцов.
Выделение ДНК из 100,0 мкл подготовленного материала проводили с помощью набора №1. Предварительно проверяли однородность и прозрачность всех растворов. В лизирующем и промывочном растворе №1 допускается выпадение кристаллов, так как весь комплект реагентов хранится при 2-8°С. Перед началом работы кристаллы необходимо растворить нагреванием флаконов в течение 12-20 минут при 50°С.
Пробирки с пробами, содержащими анализируемый материал в 0,5 мл стерильного физиологического раствора, центрифугировали в течение 10 минут при 13000 об/мин для получения осадка. Супернатант удаляли с помощью колбы-ловушки, оставляя около 100 мкл над осадком.
Одновременно с выделением ДНК из биологического материала проводили подготовку отрицательного контрольного образца. Для этого в отдельную пластиковую пробирку объемом 1,5 мл вносили 100 мкл стерильного физиологического раствора.
Для обработки нескольких образцов с учетом отрицательного контроля смешивали в отдельной пробирке по 150 мкл на пробу лизирующего раствора и 20 мкл на пробу предварительно рассуспендированного сорбента. Затем добавляли по 170 мкл полученной смеси в каждую пробирку с образцом и в пробирку с отрицательным контролем и встряхивали все пробирки на вортексе в течение 3-5 сек для получения равномерной взвеси осадка с лизирующей смесью. После этого пробирки помещались в твердотельный термостат на 20 минут при 50°С.
После термостатирования пробирки центрифугировали в течение 1 минуты при 13000 об/мин. С помощью колбы-ловушки полностью удаляли надосадочную жидкость, стараясь не задеть при этом осадок. Затем добавляли к осадку по 200 мкл промывочного раствора №1, встряхивали пробирки на вортексе в течение 3-5 сек и центрифугировали в течение 1 мин при 13000 об/мин. После этого удаляли надосадочную жидкость из каждой пробирки, добавляли по 200 мкл промывочного раствора №2, интенсивно встряхивали пробирки на вортексе в течение 3-5 сек и центрифугировали в течение 1 минуты при 13000 об/мин.
После центрифугирования с помощью колбы-ловушки удаляли надосадочную жидкость и добавляли в каждую пробирку по 200 мкл промывочного раствора №3. Встряхивали пробирки на вортексе в течение 3-5 сек и центрифугировали в течение 1 минуты при 13000 об/мин. Удаляли надосадочную жидкость и термостатировали все пробирки с открытыми крышками в течение 5 минут при 50°С для подсушивания осадка.
После того как под визуальным контролем осадок становился сухим, добавляли по 100 мкл элюирующего раствора и встряхивали пробирки на вортексе в течение 5-10 сек.
После получения однородной взвеси термостатировали пробирки в течение 5 минут при 50°С.
По окончании инкубации пробирки центрифугировали в течение 1 минуты при 13000 об/мин. Если образец необходимо было длительно сохранить, то часть надосадочной жидкости, содержащей ДНК, отбиралась в новую пробирку с соответствующей маркировкой. Остальная часть была готова к внесению в реакционную смесь для амплификации.
Постановка реакции амплификации ДНК
Комплект реагентов для проведения реакции амплификации предварительно размораживался при комнатной температуре.
В штативе «рабочее место» располагали микропробирки объемом 0,5 мл и маркировали их в соответствии с протоколом исследования. Затем в отдельной пробирке из расчета на 1 пробу готовилась реакционная смесь.
В частности, реакционная смесь имеет следующий состав: 0,5 мМ трис-Cl буфера, рН 8.6; 0,5 М KCl; 15 мМ MgCl2; 2,5 мМ дезоксинуклеотидтрифосфаты; по 0,2 мМ прямой и обратный праймеры; Taq ДНК-полимераза - 50 мкл.
Сверху на реакционную смесь наносили по 1 капле минерального масла для предотвращения высыхания. Затем под слой масла вносили по 5 мкл раствора ДНК проб, подготовленных на этапе пробоподготовки. Сначала вносили отрицательный контрольный образец, а затем пробы в соответствии с протоколом. Подобраны оптимальные параметры реакции амплификации с олигонуклеотидными праймерами и зондом (табл.2).
После окончания реакции (в день проведения исследования или после хранения утром следующего дня) переставляли пробирки в штатив для детекционных пробирок и доставляли в помещение для анализа продуктов ПЦР, который проводился методом горизонтального электрофоретического разделения фрагментов ДНК в агарозном геле.
Электрофоретический анализ продуктов ПЦР
Содержимое пакета «Буфер трис-борат для электрофореза» (набора №3) помещалось в мерный цилиндр на 1000 мл, добавлялась дистиллированная вода в количестве 700 мл и тщательно перемешивалось до полного растворения. Затем общий объем буфера доводился до 1000 мл. Готовый буфер хранился в емкости с плотно закрывающейся крышкой при комнатной температуре и использовался в течение 1 недели.
После приготовления буфера готовили камеру для электрофореза к работе: заполняли ее буфером и помещали пластину с агарозным гелем между отсеками так, чтобы слой буфера покрывал пластину на 3-5 мм. Затем осторожно вносили в соответствующие лунки геля по 7,0 мкл продукта амплификации из каждой пробирки. В отдельную лунку вносили маркер молекулярного веса для определения размера амплификата. Затем на камеру устанавливали крышку, подсоединяли электроды и включали источник постоянного тока. Проводили электрофорез в направлении от катода (-) к аноду (+) в течение 15 минут при напряженности электрического поля 10-20 В/см (при ширине камеры 10 см напряжение составляет 200 В).
После окончания электрофореза отключали источник постоянного тока, снимали крышку с камеры, осторожно вынимали пластину с агарозным гелем и помещали ее на стекло трансиллюминатора.
Устанавливали защитный экран, включали трансиллюминатор и анализировали полученные результаты. Продукт амплификации был виден в ультрафиолетовом свете (длина волны 230-260 нм) в виде светящейся полосы красно-оранжевого цвета.
Для документирования гель регистрировали с помощью видеосистемы, соединенной с персональным компьютером, оснащенным соответствующей программой Gel Explorer. Учет результатов проводили согласно расчетным величинам длин продуктов амплификации генов fim А, hly А, В, С, рар С. С помощью программы Gel Analizer был проведен компьютерный анализ полученных электрофореграмм с целью более точной оценки размеров ампликонов с учетом калибровки по маркеру молекулярного веса. Все гены, детерминирующие факторы патогенности, fim А, hly А, В, С, рар С определяют одновременно.
Регистрацию результатов ПЦР осуществляют путем электрофоретического разделения продуктов амплификации на окрашенном бромистым этидием агарозном геле.
Определяют размеры образовавшихся фрагментов генов при помощи систем праймеров fim А, hly А, В, С, рар С. Они составляют 248 п.о., 233 п.о., 251 п.о., что соответствует размерам фрагментов генов у генитальных штаммов Escherichia coli. Положительными считаются пробы, содержащие специфическую полосу на том уровне, где расположена полоса маркера с соответствующей длиной амплифицируемого участка.
Таким образом, заявляемый способ позволяет быстро, эффективно и надежно выявлять гены, детерминирующие адгезины, гемолизины, манноза-резистентные гемагглютинины генитальных штаммов Escherichia coli при помощи систем праймеров fim A, hly А, В, С, рар С в образцах биологического материала.
Кроме того, определение указанных участков генов протекает в системе «мультиплекс», т.е. одновременно, что достигается за счет подбора праймеров с одинаковой температурой отжига 60°С и позволяет унифицировать программу амплификации.
ЛИТЕРАТУРА
1. Johson J.R. Extended virulence genotypes of Escherichia coli strains from patients with urosepsis in relation to phylogeny and host compromise // J. Infect. Dis. - 2000. - Vol.181. - P.261-272.
2. Бондаренко B.M., Халиуллина СВ., Фиалкина С.В. и др. Маркеры уропатогенности Е. coli у детей с инфекцией мочеполовой системы // Детские инфекции. - №3. - 2004. - С.21-23.
3. Мавзютов А.Р., Фиалкина С.В., Бондаренко В.М. «Острова» патогенности условно-патогенных энтеробактерий // ЖМЭИ. - №6. - 2002. - С.5-9.
4. Бондаренко В.М. «Острова» патогенности бактерий // Журн. микробиол. - №4. - 2001. - С.67-74.
5. Красноперова Ю.Ю. Характеристика изменений патогенного потенциала микроорганизмов-симбионтов в протозойно-бактериальных ассоциациях: Монография. - Москва: Флинта. - 2010.
6. Патент РФ №2441879, опубл. 10.02.2012.
Способ выявления генов, детерминирующих адгезины, гемолизины, манноза-резистентные гемагглютинины у генитальных штаммов Escherichia coli, включающий отбор биоматериала, выделение бактериальной ДНК, амплификацию фрагментов ДНК исследуемого штамма методом ПЦР с использованием уникального набора олигонуклеотидных праймеров, имеющих нуклеотидные последовательности:5'-TGG-CTG-CCG-CAC-TAT-TCG-CC-3',5'-TAT-TGG-GAC-CAC-GCG-TGS-CG-3',5'-ACG-CCG-GCC-TTA-ACA-GTG-GC-3',которые обладают высокой специфичностью взаимодействия с фрагментами ДНК, причем продукты амплификации разделяют методом электрофореза в агарозном геле, а результаты ПЦР определяют одновременно все три гена и которые учитывают визуализируя окрашиванием бромистым этидием; при этом при наличии в исследуемом биоматериале у генитальных штаммов Escherichia coli генов, детерминирующих адгезины, гемолизины, манноза-резистентные гемагглютинины, образуются фрагменты ДНК fim А размером - 248 п.о., hly А,В,С - 233 п.о., рар С - 251 п.о.