Результат интеллектуальной деятельности: 2-НИТРОГЕТЕРИЛТИОЦИАНАТЫ ДЛЯ ЛЕЧЕНИЯ ГРИБКОВЫХ ИНФЕКЦИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Изобретение относится к 2-нитрогетерилтиоцианатам, таким как производные 4-родано-5-нитропиримидины и 2-родано-3-нитропиридины, обладающим активностью в отношении грибковых инфекций человека, для предупреждения и лечения грибковых инфекций человека и животных.
Недостаточная эффективность современной противомикробной терапии обусловлена в значительной степени развитием резистентности у возбудителей к имеющимся лекарственным препаратам. Именно поэтому во всем мире проводится интенсивный поиск и разработка новых эффективных лекарственных соединений. Несмотря на все усилия, современный арсенал медицинских средств недостаточен и не позволяет проводить эффективное лечение многих заболеваний, в т.ч. грибковых инфекций. Особая трудность в лечении грибковых инфекций обусловлена сильным сходством грибов и млекопитающих как на биохимическом, так и на клеточном уровне. Данное обстоятельство значительно ограничивает потенциальный выбор мишеней, воздействие на которые позволяет эффективно подавлять рост возбудителей-грибов без одновременного пагубного воздействия на организм человека. Имеющиеся в настоящее время противогрибковые препараты - полиены и азолы, влияющие на главный компонент мембраны грибов - эргостерол, не обеспечивают должной избирательности действия. Они весьма токсичны, более того, многие штаммы возбудителей приобретают резистентность к препаратам группы азолов. На сегодняшний день механизмы, обеспечивающие реализацию антимикробного действия лекарственных препаратов, можно кратко сформулировать следующим образом: 1) влияние на синтез нуклеиновых кислот и белков, 2) воздействие на образование мукопептидов, нарушающее построение новой клеточной стенки, 3) повреждение плазматической мембраны микробов (J.M.Fostel, P.A.Lartey, Drug Disc. Today, 2000, 5, 25). Исходя из этого, к числу рациональных подходов к поиску противогрибковых средств следует отнести синтез гетероциклических соединений - в частности, аналогов оснований нуклеиновых кислот, содержащих в качестве функциональных групп фрагменты, содержащие серу. Эти группировки способны к взаимодействию с эндогенными нуклеофилами, такими как белки, аминокислоты, гликозидные фрагменты, тиолы, создавать дисульфидные мостики и вообще активно участвовать в образовании новых ковалентных и слабых (Н-связи, связи диполь-диполь и др.) связей с эндогенными системами.
Задача настоящего изобретения состояла в изыскании новых производных гетероциклических соединений, которые бы обладали высокой активностью в отношении грибковых инфекций, в том числе к штаммам, резистентным к существующим в настоящее время лекарственным препаратам (N.Berila, J.Subik. Epidemiol Mikrobiol Imunol. 2010, 59(2), 67-79; R. Di Santo, Nat. Prod. Rep., 2010, 27(7), 1084-98; R. Musiol, M.Serda, S.Hensel-Bielowka, J.Polanski. Curr. Med. Chem. 2010, 17(18), 1960-73)
Результатом решения данной задачи явился синтез серии производных 4-родано-5-нитропиримидинов и 2-родано-3-нитропиридинов, содержащих в своем составе ортонитротиоцианатный фрагмент. Была исследована их активность в отношении патогенных грибковых инфекций с целью создания на их основе нового противогрибкового препарата.
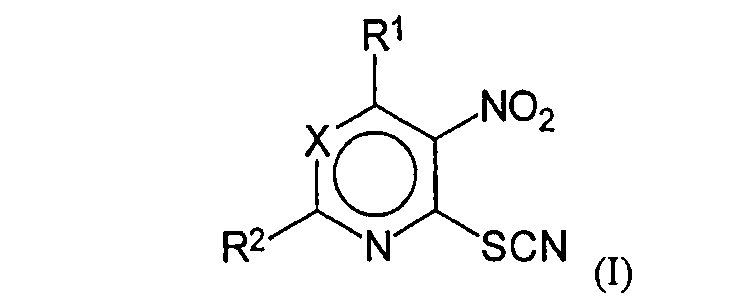
Согласно изобретению предлагаются новые соединения общей формулы (I):
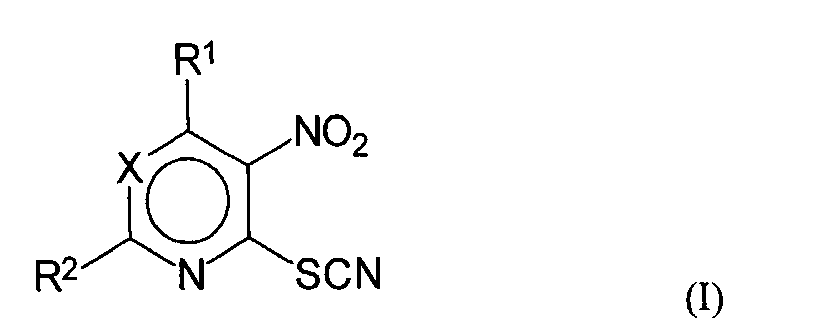
где X=N или C-R3;
R1 означает протон, насыщенный или не насыщенный линейный алкокси радикал, имеющий 2-5 атомов углерода; циклоалкилокси радикал, имеющий до 6 атомов углерода; насыщенный линейный алкилмеркапто радикал, имеющий 1-3 атомов углерода; амино радикал, имеющий 1-10 атомов углерода, выбранный из насыщенного или не насыщенного линейного моно- или диалкиламино радикала или циклоалкиламино радикала, циклического амино радикала, при этом каждая из циклических групп может быть замещена 1-2 метильными группами; или бензиламиногруппу;
R2 означает протон, насыщенный или не насыщенный, линейный алкилрадикал, имеющий 1-5 атомов углерода, или циклический алифатический радикал, имеющий до 6 атомов углерода, трифторметил, стирил или метилмеркаптогруппу;
R3 означает трифторметил, формил, ацетил, нитро, бензоил, цианогруппу или алкоксикарбонильный заместитель, имеющий 1-3 атомов углерода в алкоксигруппе,
за исключением следующих известных соединений 4-изопропил-амино-5-нитро-6-тиоцианопиримидин (Demina G.R. et al., PLoS One, 2009, 4(12), 8174), 4-азокано-5-нитро-6-тиоцианопиримидин (CA # 847188-01-6), 2-метилтио-4-метокси-5-нитро-6-тиоцианопиримидин (US 2007/0270433), 4-метокси-5-нитро-6-тиоцианопиримидин (RU 2312104 C1), 2-тиоцианато-3-нитропиридин (Ulrich H. Sci. Synth., 202, 11, 835), 4-тиоцианато-5-нитропиримидин и 2-этилмеркапто-4-тиоцианато-5-нитропиримидин (Takahashi Н., Torizo I. Che. Phar. Bull., 1958, 6, 334) и 3,5-динитро-2-тиоцианопиридин (Talik Z., Plazek E. Bulletin de'Academie Polonaise des Sciences, Serie des Sciences Chimiques, 1960, 8(5), 219).
Соединения, представленные общей формулой (I), способны образовывать аддитивные соли с кислотами. Соли с фармацевтически активными нетоксичными кислотами могут быть образованы обработкой соединения в виде оснований, представленных общей формулой (I), подходящими кислотами, выбранными из неорганических кислот, например: галоидводородной кислотой, хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, азотной или фосфорной кислотами; органических кислот, например: уксусной кислотой, гидроксиуксусной кислотой, пропионовой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, малеиновой и фумаровой кислотами, яблочной, винной или лимонной кислотами.
Соединения, представленные общей формулой (I), содержащие кислые протоны, могут также быть преобразованы в их фармацевтически активные аддитивные солевые формы с основаниями путем обработки подходящими органическими и неорганическими основаниями. Подходящие солевые формы включают, например, соли аммония, соли щелочных и щелочноземельных металлов, в частности соли натрия, калия, магния и кальция, соли с органическими основаниями, например гуанидином, триэтиламином, и соли с аминокислотами, например с аргинином или лизином.
Используемый в рамках данного изобретения термин «аддитивная соль» включает различные сольваты, которые способны образовывать соединения общей формулой (I). Соединения могут в аморфном виде или в виде кристаллов.
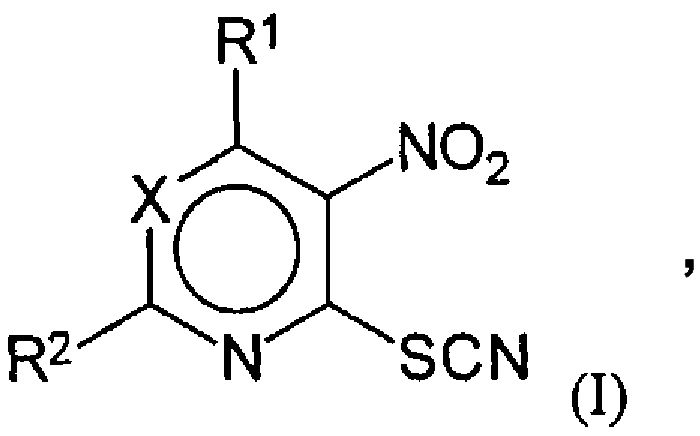
Изобретение также относится к применению соединений общей формулы (I)
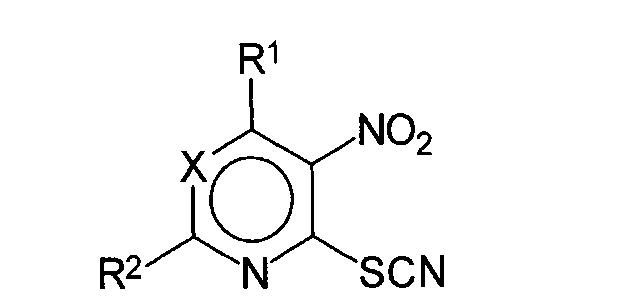
где значения X, R1, R2 указаны выше, включая известные соединения, указанные в дисклейме, или их фармацевтически приемлемых аддитивных солей с кислотой или основанием, возможно в кристаллическом виде, для получения фармацевтических композиций, обладающих активностью в отношении штаммов грибов, возбудителей грибковых инфекций, в том числе к штаммам, резистентным к существующим в настоящее время лекарственным препаратам.
Ранее не было известно использование известных соединений, указанных в дисклейме, по указанному назначению.
Изобретение также относится к фармацевтической композиции, обладающей противогрибковой активностью, которая содержит в качестве активного компонента соединение общей формулы (I) или его фармацевтически приемлемую аддитивную соль с кислотой или основанием в фармакологически эффективном количестве, а также фармацевтически приемлемый носитель и вспомогательные добавки.
Фармацевтическая композиция может быть выполнена в форме, пригодной для энтерального, парентерального, ректального, вагинального введения, включая трансбукальные и сублингвальные формы введения, в форме, пригодной для инъекции. Примерами таких форм могут быть таблетки, капсулы, свечи, инъекции, помещенные в упаковку.
Таким образом, изобретение может относиться к применению соединений настоящего изобретения, возможно в кристаллическом виде, или их фармацевтически приемлемых аддитивных солей с кислотами или основаниями или фармацевтической композиции для приготовления лекарственного средства для лечения и предупреждения грибковых инфекций.
Изобретение также относится к применению соединений настоящего изобретения или их фармацевтически приемлемых аддитивных солей с кислотами или основаниями или фармацевтической композиции в эффективном количестве для лечения и предупреждения грибковых инфекций у людей и животных.
Объектом изобретения является способ лечения или предупреждения грибковой инфекции у человека или животного, включающий введение или нанесение субъекту, который нуждается в указанном лечении, эффективного количества соединения или его фармацевтически приемлемой аддитивной соли с кислотой или основанием или фармацевтической композиции в эффективном количестве.
Термин «эффективное количество» означает количество активного ингредиента, которое при введении пациентам обеспечивает предупреждение, ослабление или устранение симптомов заболеваний, подлежащих профилактике или лечению.
Соединения или их фармацевтически приемлемые соли, фармацевтическая композиция на их основе в виде таблеток, капсул, инъекций, свечей и других готовых форм (см. ниже), могут быть использованы для лечения и предупреждения заболеваний или расстройств у людей и животных, вызванных штаммами возбудителей грибковых инфекций (микозов), в том числе резистентных к существующим в настоящее время лекарственным препаратам.
Введение соединений формулы (I) или их фармацевтически приемлемой соли, фармацевтической композиции или лекарственного средства на их основе при лечении или профилактике людей или животных может осуществляться обычными методами, в том числе:
- энтеральной формой введения, например, в форме таблеток, гранул, драже, шариков, порошков, капсул, суспензий, сиропов, эмульсий, ректальных свечей, включая трансбукальные и сублингвальные формы введения и др.;
- парентеральной формой введения в виде инъекционной формы введения, например, в форме растворов, эмульсий, суспензий, порошков и таблеток для получения растворов и имплантаций, лиофилизированных препаратов, вводимых в организм парентерально (подкожно, внутримышечно, внутривенно, внутриартериально, в различные полости) и др.; в виде неинъекционных форм введения, например, в форме суппозиториев для вагинального введения, аэрозоля, спрея, гелей, суспензий, эмульсий, линиментов, растворов, капель, пластырей, присыпок, порошков, пудр, примочек и др.
В качестве фармацевтически приемлемых вспомогательных веществ в составе фармацевтической композиции согласно изобретению могут быть использованы любые фармацевтически приемлемые компоненты, которые совместимы с активным ингредиентом и не наносят вреда пациентам, традиционно используемые для приготовления лекарственных форм, например наполнители, связующие агенты, гранулирующие агенты, солюбилизирующие агенты, средства для скольжения, стабилизаторы, разбавители, адъюванты, консерванты, компоненты буферных систем, растворители, диспергирующие агенты, консерванты, смазывающие агенты, вкусовые добавки, загустители, пищевые красители, эмульгаторы, регуляторы пролонгированной доставки и др.
Фармацевтически приемлемыми вспомогательными веществами являются, например, лактоза, инозит, глюкоза, маннит, декстран, циклодекстрин, сорбит, крахмал и его модификации, сахароза, алюмосиликат магния, синтетический алюмосиликат, кристаллическая целлюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилированный крахмал, карбоксиметилцеллюлоза кальция, ионообменные смолы, метилцеллюлоза, желатин, гуммиарабик, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, поливиниловый спирт, альгиновая кислота, альгинат натрия, безводная кремниевая кислота, стеарат магния, тальк, карбоксивиниловый полимер, оксид титана, эфир жирной кислоты и сорбита, натрия лаурилсульфат, глицерин, глицериновый эфир жирной кислоты, ланолин, глицерожелатин, полисорбат, макроголь, растительное масло, воск, парафины, пропиленгликоль, полиэтиленгликоль, вода, этанол, полиспирты, полиоксиэтиленгидрированное касторовое масло, хлорид натрия, гидроксид натрия, соляная кислота, двухосновный фосфат натрия, моноосновный фосфат натрия, лимонная кислота, глутаминовая кислота, бензиловый спирт, метил п-оксибензоат, этил п-оксибензоат и др.
Фармацевтически приемлемыми вспомогательными веществами при получении фармацевтической композиции в форме суппозиториев являются, например, природные или отвержденные масла, например масло какао, воска, жиры, эфир глицерина и насыщенной жирной кислоты, глицерожелатин, макрогол, полужидкие или жидкие полиолы, триглицериды и др. Основа суппозиториев может включать также поверхностно-активное вещество или стабилизатор.
Композиция по изобретению может содержать также такие компоненты; которые обеспечат быстрое продолжительное или замедленное высвобождение активного ингредиента после применения пациентами. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин.
Осуществление изобретения
Соединения по изобретению формулы (I) могут быть получены из соответствующего промежуточного соединения, содержащего подвижный атом галогена, по известной реакции нуклеофильного замещения, где в качестве нуклеофила выступает ион тиоцианата, и который может быть введен в реакцию в виде его натриевой, калиевой или аммониевой соли (схема 1). Реакция проходит в подходящем растворителе, например в низших спиртах, ацетоне, этилметилкетоне. Все радикалы имеют определения, как в формуле (I). Перемешивание может увеличить скорость реакции. Реакция может быть легко проведена при температуре в интервале от +10 до +100°С. Полученный продукт может быть очищен путем кристаллизации, например, из низших спиртов. При этом возможно получение различных кристаллических модификаций.
Схема 1
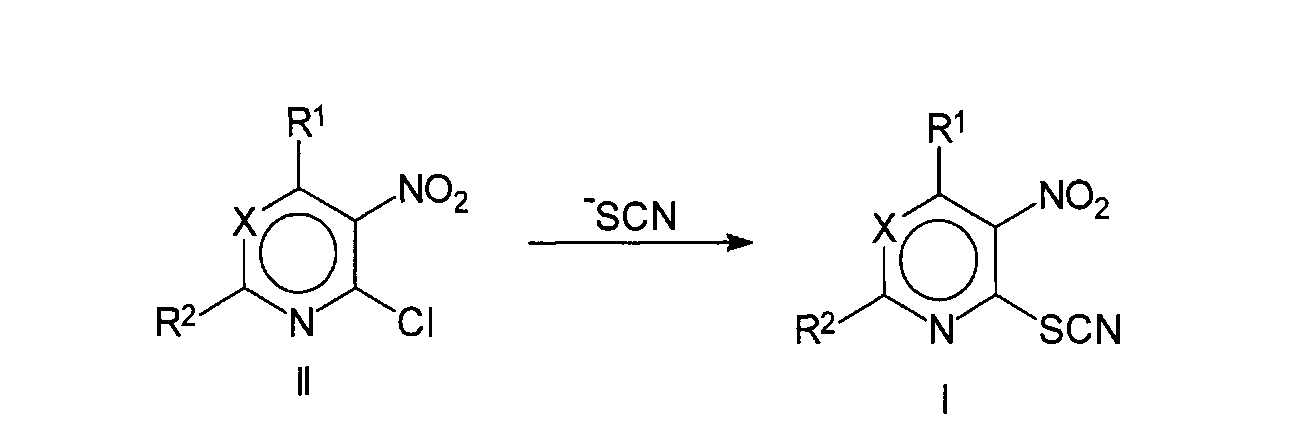
Исходные и промежуточные соединения формулы (II) являются соединениями, которые либо коммерчески доступны, либо могут быть получены обычными широко известными методами, описанными в литературе.
Ниже показаны примеры получения соединений по изобретению, которые не ограничивают рамки настоящего изобретения.
Пример 1.
4-Диметиламино-5-нитро-6-тиоцианатопиримидин (соединение 1)
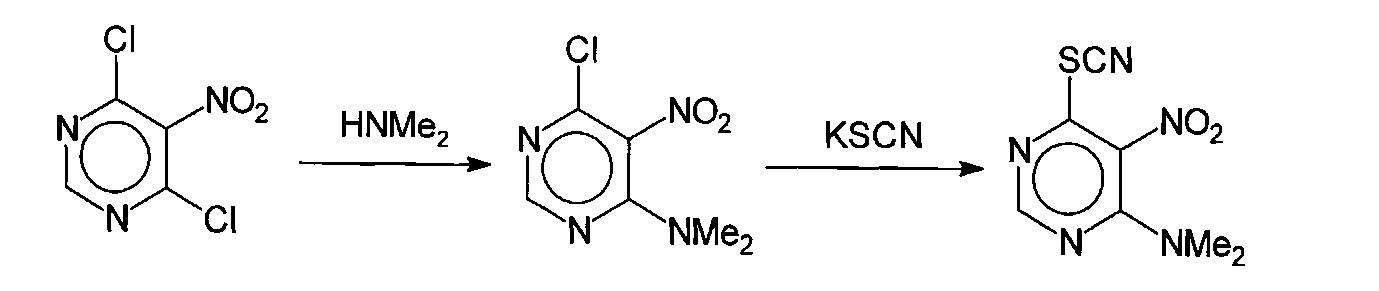
Раствор 2 г (9 ммоль) 4,6-дихор-5-нитропиримидина (Girard F., Demaison С, Lee M.-G., Agrofoglio L. A. Tetrahedron, 54 (1998) 30, 8745-8952; Scharn Dirk, Germeroth Lothar, Schneider-Mergener Jens, Wenschuh Holger, J. Org. Chem., 66 (2001) N 2, 507-513) в 40 мл диоксана был обработан предварительно приготовленным раствором ацетата диметиламина, содержащего 2,9 мл водного 40% диметиламина (22 ммоль) и нейтрализованного уксусной кислотой до рН 7. Реакционную массу выдерживают 3 часа при комнатной температуре и медленно разбавляют 200 мл холодной воды. Выпавший осадок 4-диметиламино-5-нитро-6-хлорпиримидина отфильтровывают, промывают водой и используют на следующей стадии без дополнительной очистки.
Раствор 1,3 г (6,4 ммоль) 4-диметиламино-5-нитро-6-хлорпиримидина в 30 мл этанола был обработан 0,7 г (7 ммоль) тиоцианата калия при комнатной температуре. Реакционную массу кипятят в течении 4 часов, обрабатывают 0,1 г активированного угля и в горячем виде фильтруют. Фильтрат охлаждают и разбавляют 100 мл воды. Выпавший светло-желтый осадок 4-диметиламино-5-нитро-6-тиоцианатопиримидина (соединение 1) промывают холодной водой и перекристаллизовывают из этанола.
Выход: 78%.
Т пл.: 142-144°С (EtOH)
MS (m/z): 225 (М+)
lH NMR (DMSO-d6): δ 8.37 (1H, s, Н), 3.48 (6Н, s, N(CH3)) ppm
Элементный анализ C7H7N5O2S:
Calc.: C, 37.33; Н, 3.13; N, 31.09
Found: С, 37.23; Н, 3.27; N, 29.97
Пример 2.
4-Метиламино-5-нитро-6-тиоцианатопиримидин (соединение 2)
Соединение 2 было синтезировано аналогично соединению 1, но с использованием в качестве амина 40% водного раствора метиламина.
Выход: 64%.
Т пл.: 187-189°С (EtOH)
MS (m/z): 211 (M+)
1H NMR (DMSO-d6): δ 13.03 (1H, broad s, NH), 8.22 (1H, s, H), 3.12 (3H, s, CH3) ppm
Элементный анализ C6H5C5O2S:
Calc.: С, 34.12; H, 2.39; N, 33.16
Found: С, 34.31; H, 2.41; N, 33.15
Пример 3.
4-Изопропиламино-5-нитро-6-тиоцианатопиримидин (соединение 3)
Соединение 3 было синтезировано по методу, описанному в Demina G.R. et al., PLoS One, 2009, 4(12), 8174, и его спектральные и аналитические характеристики соответствовали указанным в литературе.
Выход: 81%.
Т пл.: 151-153°С (EtOH)
MS (m/z): 239 (М+)
1H NMR (DMSO-d6): δ 13.16 (1Н, broad s, NH), 8.16 (1H, s, H), 4.86 (1H, m, CH), 1.37 (6H, s, 3CH3) ppm
Элементный анализ C6H5N5O2S:
Calc.: C, 40.16; H, 3.79; N, 29.27
Found: C, 40.03; H, 3.88; N, 29.11
Пример 4.
4-Гексагидрометиленимино-5-нитро-6-тиоцианатопиримидин (соединение 4)
Соединение 4 было синтезировано аналогично соединению 1, но с использованием в качестве амина приготовленного водного раствора гексагидрометиленимина.
Выход: 48%.
Т пл.: 107-109°С (этилацетат)
MS (m/z): 279 (М+)
1H NMR (DMSO-d6): δ 8.32 (1H, s, H), 3,85 (4H, m, N(CH2)2), 1.95 (4H, m, 2CH2), 1.57 (4H, m, CH2CH2) ppm
Элементный анализ C11H13N5O2S:
Calc.: C, 47.30; H, 4.69; N, 25.07
Found: C, 47.18; H, 4.53; N, 24.92
Пример 5.
4-N-азокан-5-нитро-6-тиоцианатопиримидин (соединение 5)
Соединение 5 было синтезировано аналогично соединению 1, но с использованием в качестве амина приготовленного водного раствора азокана.
Выход: 76%.
Т пл.: 95-98°С (метанол)
MS (m/z): 293 (М+)
1H NMR (DMSO-d6): δ 8.27 (1H, s, H), 3.91 (2H, broad s, N(CH2)2), 1.18-1.82 (10Н, broad m, 5CH2) ppm
Элементный анализ C12H15N5O2S:
Calc.: С, 49.13; H, 5.15; N, 23.87
Found: C, 49.01; H, 5.26; N, 23.94
Пример 6.
4-(3,5-Диметилпиперидин-1-ил)-5-нитро-6-тиоцианатопиримидин (соединение 6)
Соединение 6 было синтезировано аналогично соединению 1, но с использованием в качестве амина приготовленного водного раствора 3,5-диметилпиперидина.
Выход: 67%.
Т пл.: 123-125°С (метанол)
MS (m/z): 293 (М+)
1Н NMR (DMSO-d6): δ 8.34 (1Н, s, Н), 3.97 и 3.02 (4Н, 2 broad m, N(CH2)2), 1.97 (2Н, m, 2СН), 1.21 (2Н, m, СН2), 0.88 (6Н, s, 2СН3) ppm
Элементный анализ C12H15N5O2S:
Calc.: С, 49.13; Н, 5.15; N, 23.87
Found: С, 49.13; Н, 5.23; N, 23.97
Пример 7.
4-(2-Метилпиперидин-1-ил)-5-нитро-6-тиоцианатопиримидин (соединение 6)
Соединение 6 было синтезировано аналогично соединению 1, но с использованием в качестве амина приготовленного водного раствора 2-метилпиперидина.
Выход: 54%.
Т пл.: 158-160°С (этанол)
MS (m/z): 293 (М+)
1Н NMR (DMSO-d6): δ 8.21 (1Н, s, Н), 3,65 и 1,70 (9Н, two broad m, СН(СН2)4), 1.33 (3Н, s, СН3) ppm
Элементный анализ C11H13N5O2S:
Calc.: С, 47.30; Н, 4.69; N, 25.07
Found: С, 47.11; Н, 4.54; N, 25.12
Пример 8.
4-Диэтиламино-5-нитро-6-тиоцианатопиримидин (соединение 8)
Соединение 8 было синтезировано аналогично соединению 1, но с использованием в качестве амина готового 40% водного раствора диэтиламина.
Выход: 74%.
Т пл.: 114-116°С (метанол)
MS (m/z): 253 (М+)
1Н NMR (DMSO-d6): δ 8.31 (1Н, s, Н), 3.46 (4Н, m, 2СН2), 1.01 (6Н, m, 2СН3) ppm
Элементный анализ C9H11N5O2S:
Calc.: С, 42.68; H, 4.38; N, 27.65
Found: С, 42.60; H, 4.33; N, 27.74
Пример 9.
4-N-Бензиламино-5-нитро-6-тиоцианатопиримидин (соединение 9)
Соединение 9 было синтезировано аналогично соединению 1, но с использованием в качестве амина приготовленного водного раствора бензиламина.
Выход: 43%.
Т пл.: 144-146°С (изопропанол)
MS (m/z): 287 (М+)
1Н NMR (DMSO-d6): δ 8.38 (1Н, s, Н), 7.38-7.25 (5Н, m, Ph), 4.41 (2Н, s, СН2) ppm
Элементный анализ C12H9N5O2S:
Calc.: С, 50.17; Н, 3.16; N, 24.38
Found: С, 50.29; Н, 3.24; N, 24.29
Пример 10.
4-(N-бензил-N-метиламино)-5-нитро-6-тиоцианатопиримидин (соединение 10)
Соединение 10 было синтезировано аналогично соединению 1, но с использованием в качестве амина приготовленного водного раствора N-метил-N-бензиламина.
Выход: 46%.
Т пл.: 127-129°С (этанол)
MS (m/z): 301 (М+)
1Н NMR (DMSO-d6): δ 8.31 (1Н, s, Н), 7.4-7.20 (5Н, m, Ph), 4.34 (2Н, s, CH2), 3.15 (3H, s, СН3) ppm
Элементный анализ C13H11N5O2S:
Calc.: С, 51.82; Н, 3.68; N, 23.24
Found: С, 51.76; H, 3.57; N, 23.19
Пример 11.
4-N-метилциклогексиламино-5-нитро-6-тиоцианатопиримидин (соединение 11)
Соединение 11 было синтезировано аналогично соединению 1, но с использованием в качестве амина приготовленного водного раствора N-метилциклогексиламина.
Выход: 34%.
Т пл.: 112-114°С (этанол)
MS (m/z): 293 (М+)
lH NMR (DMSO-d6): δ 8.32 (1H, s, CH), 3.64 (1H, m, CH), 3.12 (3H, s, CH3), 2.0-1.0 (10H, broad m, 5CH2) ppm
Элементный анализ C12H15N5O2S:
Calc.: С, 49.13; H, 5.15; N, 23.87
Found: С, 49.17; H, 5.08; N, 23.84
Пример 12.
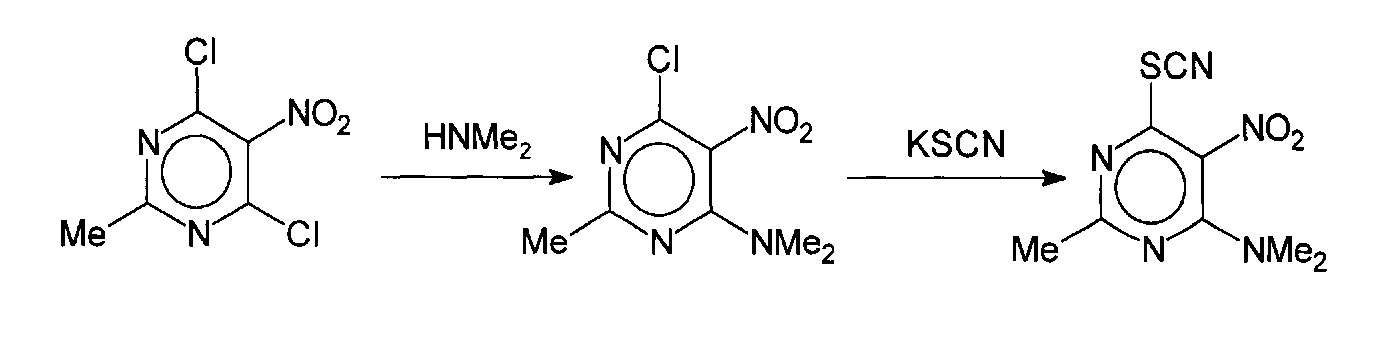
Раствор 3,8 г (16,8 ммоль) 4,6-дихор-2-метил-5-нитропиримидина (Hurst Derek Т., J. Heterocycl. Chem., 32, 1995, 697-699) в 40 мл диоксана был обработан предварительно приготовленным раствором ацетата диметиламина, содержащего 5,1 мл водного 40% диметиламина (42 ммоль) и нейтрализованного уксусной кислотой до рН 7, при температуре реакционной массы не выше 15°С. Реакционную массу выдерживают 3 часа при комнатной температуре и медленно разбавляют 200 мл холодной воды. Выпавший осадок 4-диметиламино-2-метил-5-нитро-6-хлорпиримидина отфильтровывают, промывают водой и используют на следующей стадии без дополнительной очистки.
Раствор 2,7 г (12,5 ммоль) 4-диметиламино-2-метил-5-нитро-6-хлорпиримидина в 30 мл этанола был обработан 1,3 г (13 ммоль) тиоцианата калия при комнатной температуре. Реакционную массу кипятят в течение 4 часов, обрабатывают 0,1 г активированного угля и в горячем виде фильтруют. Фильтрат охлаждают и разбавляют 100 мл воды. Выпавший светло-желтый осадок 4-диметиламино-2-метил-5-нитро-6-тиоцианатопиримидина (соединение 12) промывают холодной водой и перекристаллизовывают из этанола.
Выход: 86%.
Т пл.: 159-161°С (этанол)
MS (m/z): 239 (М+)
1Н NMR (DMSO-d6): δ 3.48 (6Н, s, 2СН3), 2.36 (3Н, s, СН3) ppm
Элементный анализ C8H9N5O2S:
Calc.: С, 40.16; Н, 3.79; N, 29.27
Found: С, 40.26; Н, 3.88; N, 29.34
Пример 13.
4-Амино-2-метил-5-нитро-6-тиоцианатопиримидин (соединение 13)
Соединение 13 было синтезировано аналогично соединению 12, но с использованием в качестве амина готового 25% водного раствора аммиака.
Выход: 39%.
Т пл.: 209-212°С (этанол)
MS (m/z): 211 (М+)
1Н NMR (DMSO-d6): δ 8.19 (2Н, broad s, NH2), 2.43 (3Н, s, СН3) ppm
Элементный анализ C6H5N5O2S:
Calc.: С, 34.12; Н, 2.39; N 33.16
Found: С, 34.25; Н, 2.47; N, 33.04
Пример 14.
4-Метиламино-2-метил-5-нитро-6-тиоцианатопиримидин (соединение 14)
Соединение 14 было синтезировано аналогично соединению 12, но с использованием в качестве амина готового 40% водного раствора метиламина.
Выход: 76%.
Т пл.: 200-202°С (метанол)
MS (m/z): 225 (М+)
1Н NMR (DMSO-d6): δ 3.12 (3Н, s, СН3), 2.35 (3Н, s, СН3) ppm
Элементный анализ C6H5N5O2S:
Calc.: С, 37.33; Н, 3.13; N, 31.09
Found: С, 37.21; Н, 3.27; N, 31.22
Пример 15.
4-Пирролидино-2-метил-5-нитро-6-тиоцианатопиримидин (соединение 15)
Соединение 15 было синтезировано аналогично соединению 12, но с использованием в качестве амина приготовленного водного раствора пирролидина.
Выход: 68%.
Т пл.: 142-144°С (метанол)
MS (m/z): 265 (М+)
1H NMR (DMSO-d6): δ 3.50 (4Н, m, N(CH2)2), 2.41 (3Н, s, СН3), 1.91 (4Н, m, СН2СН2) ppm
Элементный анализ C10H11N5O2S:
Calc.: С, 45.27; Н, 4.18; N, 26.40
Found: С, 45.29; Н, 4.34; N, 26.43
Пример 16.
4-Диэтиламино-2-метил-5-нитро-6-тиоцианатопиримидин (соединение 16)
Соединение 16 было синтезировано аналогично соединению 12, но с использованием в качестве амина готового 40% водного раствора диэтиламина.
Выход: 53%.
Т пл.: 69-70°С (метанол)
MS (m/z): 267 (М+)
1Н NMR (DMSO-d6): δ 3.44 (4Н, m, N(CH2)2), 2.56 (3Н, s, СН3), 1.10 (6Н, m, 2СН3) ppm
Элементный анализ C10H11N5O2S:
Calc.: С, 44.93; Н, 4.90; N, 26.20
Found: С, 45.08; Н, 4.93; N, 26.32
Пример 17.
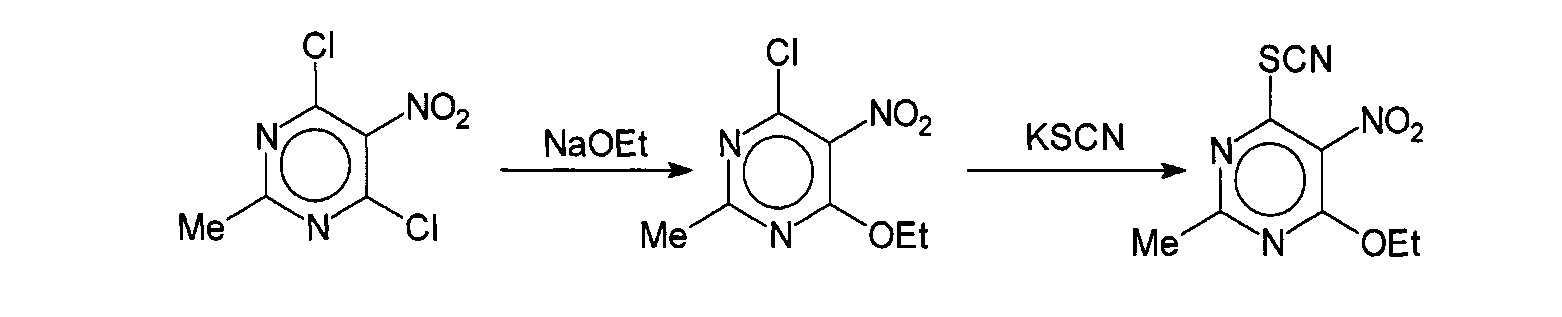
Раствор 4,0 г (19,2 ммоль) 4,6-дихор-2-метил-5-нитропиримидина (Hurst Derek Т., J. Heterocycl. Chem., 32, 1995, 697-699) в 40 мл безводного этанола был обработан 20 мл предварительно приготовленного раствора этилата натрия (из 0,4 г (19,2 ммоль) металлического натрия и 20 мл безводного этанола) при температуре реакционной массы не выше 0°С. После прибавления всего объема метилата натрия реакционную массу выдерживают 2 часа при комнатной температуре и медленно разбавляют 200 мл холодной воды. Выпавший осадок 4-этокси-2-метил-5-нитро-6-хлорпиримидина отфильтровывают, промывают водой и перекристаллизовывают из бензола.
Раствор 3,2 г (14,7 ммоль) 4-этокси-2-метил-5-нитро-6-хлорпиримидина в 30 мл этанола был обработан 1,5 г (15 ммоль) тиоцианата калия при комнатной температуре. Реакционную массу кипятят в течение 4 часов, обрабатывают 0,1 г активированного угля и в горячем виде фильтруют. Фильтрат охлаждают и разбавляют 100 мл воды. Выпавший белый осадок 4-этокси-2-метил-5-нитро-6-тиоцианатопиримидина (соединение 17) промывают холодной водой и перекристаллизовывают из этанола.
Выход: 42%.
Т пл.: 60-62°С (этанол)
MS (m/z): 240 (М+)
1Н NMR (DMSO-d6): δ 4.64 (2Н, q, СН2), 2.66 (3Н, s, СН3), 1.43 (3Н, t, СН3) ppm
Элементный анализ C8H8N4O3S:
Calc.: С, 40.00; Н, 3.36; N, 23.32
Found: С, 39.93; Н, 3.46; N, 23.31
Пример 18.
4-Пропокси-2-метил-5-нитро-6-тиоцианатопиримидин (соединение 18)
Соединение 18 было синтезировано аналогично соединению 17, но с использованием на всех этапах н-пропилового спирта взамен этанола.
Выход: 26%.
Т пл.: 50-52°С (метанол)
MS (m/z): 254 (М+)
1Н NMR (DMSO-d6): δ 4.32 (2Н, t, ОСН2), 2.58 (3Н, s, СН3), 1.77 (2Н, m, СН2), 1.17 (3Н, t, СН3) ppm
Элементный анализ C9H10N4O3S:
Calc.: С, 42.51; Н, 3.96; N, 23.03
Found: С, 42.45; H, 3.89; N, 23.09
Пример 19.
3,5-Динитро-2-тиоцианатопиридин (соединение 18)
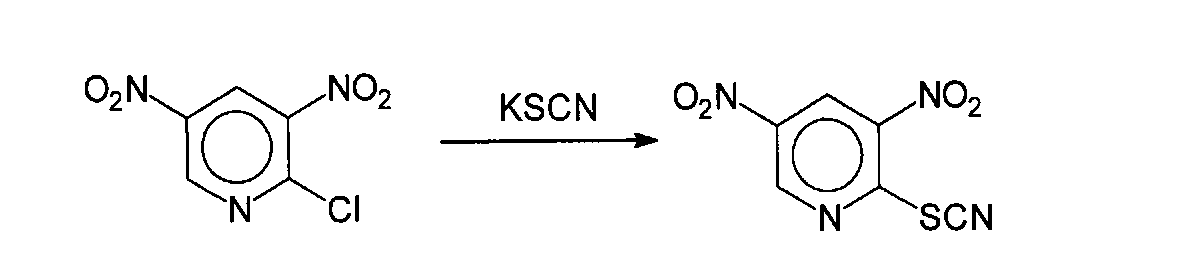
Соединение 19 было получено по известной методике Talik Z., Plazek Е. Roczniki Chemii (1960), 34, 165-75 в соответствии со следующей процедурой: раствор 2,0 г (9,8 ммоль) коммерчески доступного 3,5-динитро-2-хлорпиридина в смеси 20 мл этанола и 20 мл ацетона был обработан 1,1 г (11 ммоль) тиоцианата калия при комнатной температуре. Реакционную массу кипятят в течение 8 часов, обрабатывают 0,1 г активированного угля и в горячем виде фильтруют. Фильтрат охлаждают и разбавляют 100 мл воды.
Выход: 55%.
Т пл.: 160-62°С (этанол)
MS (m/z): 226 (М+)
1Н NMR (DMSO-d6): δ 9.42 и 9.15 (two 1H, two s, 2CH) ppm
Элементный анализ C8H8N4O3S:
Calc.: С, 31.86; H, 0.89; N, 24.77
Found: C, 31.71; H, 1.01; N, 24.70
Пример 20.
5-Метил-3-нитро-2-тиоцианатопиридин (соединение 20)
Соединение 20 было синтезировано аналогично соединению 19, исходя из коммерчески доступного 5-метил-3-нитро-2-хлорпиридина.
Выход: 53%.
Т пл.: 135-139°С (метанол)
MS (m/z): 195 (M+)
1H NMR (DMSO-d6): δ 8.37 и 8.08 (two 1H, two s, 2CH), 2.43 (3H, s, CH3) ppm
Элементный анализ C7H5N3O2S:
Calc.: С, 43.07; H, 2.58; N, 21.53
Found: С, 43.21; H, 2.52; N, 21.70
Пример 21.
6-Метокси-3-нитро-2-тиоцианатопиридин (соединение 21)
Соединение 21 было синтезировано аналогично соединению 19, исходя из коммерчески доступного 6-метокси-3-нитро-2-хлорпиридина.
Выход: 42%.
Т пл.: 121-123°С (метанол)
MS (m/z): 211 (М+)
1Н NMR (DMSO-d6): δ 8.41 (1Н, d, СН), 6.89 (1Н, d, СН), 3.91 (3Н, s, СН3) ppm
Элементный анализ C7H5N3O3S:
Calc.: С, 39.81; Н, 2.39; N, 19.90
Found: С, 39.68; Н, 2.47; N, 19.92
Описание противогрибковой активности соединений по изобретению.
1. Активность соединений общей формулы (I) в отношении патогенных грибов и дрожжей.
Полученные соединения общей формулы (I) показали заметную активность в отношении патогенных грибов и дрожжей, а также в отношении клинически изолированных штаммов грибов, в том числе чувствительных к флуконазолу, а также в отношении резистентных к противогрибковым препаратам культур.
Активность испытуемых соединений определяли методом двукратных серийных разведений (микрометодом) в жидкой питательной среде с выявлением минимальной подавляющей концентрации (МПК) в отношении различных лабораторных и клинических штаммов грибов [National Committee for Clinical Laboratory Standards. 1997. Reference method for broth dilution antifungal susceptibility testing of yeasts. Approved standard M27-A. National Committee for Clinical Laboratory Standards, Wayne, PA, USA.; National Committee for Clinical Laboratory Standards. 2002. Reference Method for Broth Dilution Antifungal Susceptibility Testing of Conidium-Forming Filamentous Fungi: Approved Standard M38-A. NCCLS, Wayne, PA, USA].
Для приготовления инокулята использовали суспензию клеток дрожжей и суспензию спор грибов в стерильном физиологическом растворе (0,85% NaCl). Плотность суспензий контролировали спектрофотометрически. Для получения инокулята исходные суспензии дрожжей и спор грибов разводили стандартной средой (RPMI 1640). Конечная концентрация клеток в опыте составляла (1-5)×103 клеток/мл для дрожжей и (0,4-5)×104 клеток/мл для грибов. Количество клеток в инокуляте проверяли путем высева на агар Сабуро и подсчета выросших колоний. Тестируемые вещества растворяли в диметилсульфоксиде (DMSO) с начальной концентрацией 1600 мкг/мл и в том же растворителе готовили серии разведений от 1600 до 3,13 мкг/мл. Для постановки эксперимента полученные растворы разводили в 50 раз в стандартной используемой для опыта среде RPMI 1640. Все растворы тестируемых препаратов готовили непосредственно перед использованием.
Эксперименты проводили в стерильных 96-луночных плоскодонных планшетах в среде RPMI 1640 в лунках, содержащих 200 мкл питательной среды. Конечная концентрация препаратов в опыте после внесения микробных инокулятов составляла от 16 до 0,03 мкг/мл при концентрации растворителя (DMSO) 1%. Каждый препарат в эксперименте присутствовал не менее чем в трех повторах. В панель эксперимента в качестве контроля были включены лунки, не содержащие тестируемых препаратов.
Планшеты инкубировали при 35°С (Candida albicans и грибы) или 25°С (Cryptococcus humicolus) без встряхивания. Оценку роста культур проводили визуально, применяя 4-ступенчатую шкалу: 0=оптическая прозрачность, полное отсутствие роста, 1=слабый рост (25% от уровня контроля), 2=существенное подавление роста (50% от уровня контроля), 3=слабое подавление роста (75% от уровня контроля), 4=отсутствие подавления роста. Минимальную подавляющую концентрацию (МПК) противогрибковых препаратов считывали при 24 час культивирования для Candida albicans и Cryptococcus humicolus и 48 час культивирования для Aspergillus niger и Fusarium oxysporum.
МПК определяли как минимальную концентрацию препарата, полностью предотвращающую рост тест-организма (шкала роста=0).
В результате проведенного эксперимента изучена способность соединений общей формулы (I) производных группы 2-нитроарилтиоцианатов к подавлению роста патогенных грибов и дрожжей и выявлены значения их МПК (табл.1).
|
2. Активность соединений общей формулы (I) в отношении клинически изолированных резистентных штаммов дрожжей, лабораторных штаммов грибов.
Для определения активности соединений общей формулы (I) в отношении клинически изолированных мультирезистентных штаммов патогенных грибов и дрожжей использовались тест-культуры грибов из РКПГ - диморфных (в дрожжевой фазе, Y): Candida albicans, штамм 1244, С.albicans, штамм 1242, С.tropicalis, штамм 531, С.krusei, штамм 526, С.parapsilosis, штамм 897, С.guilliermondii, штамм 594, С.glabrata, штамм 1188; нитчатых (F): Aspergillus fumigatus, штамм 1248, A. niger, штамм 1249, A. flavus, штамм 1247. Все тест-культуры являются клиническими изолятами от соответствующих больных, изоляты патогенов сохраняются в Российской коллекции патогенных грибов при НИИ медицинской микологии им. П.Н.Кашкина СПб МАПО.
Питательные среды: агаризованная и жидкая питательная среда Сабуро. Растворители и суспензионные среды: вода дистиллированная, диметилсульфоксид (ДМСО), раствор буферный фосфатный. Определение противогрибковой активности указанных выше субстанций проводили макрометодом (ГФХI, вып.2, 2002) при последовательных двукратных разведениях. Взвеси дрожжевых организмов рода Candida приготавливали из двухсуточных культур, выросших при 37°С на агаре Сабуро в пробирках. Культуры смывали раствором буферным фосфатным, густоту взвесей доводили до 10 Ед по стандарту мутности. Приготовленную взвесь тест-культуры разводили в 100 раз тем же раствором буферным фосфатным и в каждую пробирку рядов разведений испытуемых веществ в жидкой среде Сабуро вносили по 0,1 мл (2 капли) рабочей взвеси суспензии клеток. Культуры нитчатых грибов выращивали в течение 2-3 дней при 37°С на агаре Сабуро в пробирках, затем клеточную массу собирали с поверхности агара, помещали в стерильную пробирку и растирали, постепенно добавляя раствор буферный фосфатный до густоты рабочих взвесей 5 Ед по стандарту мутности. Количество вносимой рабочей взвеси в каждую пробирку ряда также было 0,1 мл.
В каждом опыте ставили контроли:
1) культуры тест-организма (1 мл питательной среды +0,1 мл рабочей взвеси микромицета; здесь отсутствовала испытуемая субстанция);
2) питательной среды (1 мл среды без культуры и без субстанции);
3) испытуемой субстанции (0,9 мл питательной среды +0,1 мл исходного разведения испытуемой субстанции, то есть в 1 мл содержалось 100 мкг данной субстанции).
Все ряды подготовленных в пробирках разведений с тест-культурами и контрольные выдерживали при температуре 37°С до появления роста гриба в первом контроле. Минимальной фунгистатической концентрацией антимикотика принято считать разведение в той последней пробирке, в которой визуально не наблюдают рост микромицета. Например, рост отсутствует в 1-9-й пробирках, и в последней из них разведение будет 214×104 (2140000) раз, когда концентрация субстанции снижалась до 0,39 мкг/мл, в оставшихся пяти пробирках рост культуры был почти (или равно) такой же, как в первом контроле. Тогда указанная концентрация 0,39 мкг/мл и есть фунгистатический титр (или концентрация).
При необходимости определения цидного действия антимикотика делают высев штрихами микробиологической петлей на секторы агаризованной среды Сабуро в чашках Петри из каждой пробирки, в которой визуально не отмечен рост культуры, и из первой контрольной пробирки. После этого чашки с секторальными высевами оставляют в термостате при необходимой температуре на срок до появления роста колоний в контрольном секторе. Если высевы оказались также позитивными, например из 7-9-й пробирок, то это означает, что фунгицидное действие проявляется при концентрации антимикотика 3,14 мкг/мл.
|
|
Ниже приводятся примеры получения фармацевтических композиций в виде различных форм, пригодных для использования в качестве лекарственного средства.
Пример А. Приготовление таблеток, содержащих 50-500 мг активного ингредиента. Активный ингредиент смешивают с 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и спрессовывают в брусок. Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 560 мг каждая.
Пример Б. Капсулы, содержащие 50-500 мг активного ингредиента согласно изобретению, получают тщательным смешиванием активного соединения с порошком лактозы в соотношении 2:1. Полученную порошкоообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера.
Пример В. Инъекционные композиции для внутримышечных, внутрибрюшинных или подкожных инъекций могут быть приготовлены смешиванием 50-500 мг активного соединения с 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают и стерилизуют в автоклаве.
Пример Г. Свечи могут быть изготовлены следующим образом: активное вещество расплавляют в небольшом количестве свечной основы. Получившийся расплав тщательно перемешивают с необходимым количеством основы, разогретой до (35-80)°С. Полученную смесь гомогенизируют. Готовую смесь в растопленном состоянии используют для изготовления свечей.