Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ
Вид РИД
Изобретение
Настоящее изобретение относится к области химии органических пероксидов, производных кетонов, конкретно к способу получения мостиковых 1,2,4,5-тетраоксанов, а именно замещенных 2,3,5,6-тетраоксабицикло-[2.2.1]гептанов, которые могут найти применение в химии полимеров, а также в медицине и фармакологии.
Химия органических пероксидов насчитывает уже более ста лет (Ваеуеr A; Villiger V. Einwirkung des Caro'schen Reagens auf Ketone. Chemische Berichte. 1899, 32, 3625-3633; Baeyer A; Villiger V. Ueber die Einwirkung des Caro'schen Reagens auf Ketone. Chemische Berichte. 1900, 33, 858-864). На протяжении этого периода времени кетоны являются ключевыми реагентами в синтезе пероксидов благодаря своей доступности и легкости протекания реакции между углеродным атомом карбонильной группы и высоконуклеофильным атомом кислорода гидропероксидной группы (например, в пероксиде водорода). Пероксиды, полученные из кетонов, производятся в многотоннажном количестве и широко используются как инициаторы радикальной полимеризации непредельных мономеров (Ullman's Encyclopedia of Industrial Chemistry, Elvers В., Hawkins S., and Russey W., Eds., VCH; New York, 1995, 5th ed.).
В последние десятилетия к химии органических пероксидов, в особенности, циклического строения наблюдается значительный всплеск интереса со стороны медицины и фармакологии, вследствие обнаружения у них высокой антималярийной (Jefford C.W. Peroxidic antimalarials. Adv. Drug Res. 1997, 29, 271-325; O'Neil P.M.; Posner G.H. A medicinal chemistry perspective on artemisinin and related endoperoxides. J. Med. Chem. 2004, 47, 2945-2964; Dong Y. Synthesis and Antimalarial Activity of 1,2,4,5-Tetraoxanes. Mini-Reviews in Med.Chem. 2002, 2, 113-123) и антигельминтной активности (Keiser J.; Xiao S.Н.; Tanner М.; Utzinger J. Artesunate and artemether are effective fasciolicides in the rat model and in vitro. J. Antimicrob. Chemother. 2006, 57,1139-1145; Keiser J.; Utzinger J.; Tanner М.; Dong Y.; Vennerstrom J. L. The synthetic peroxide OZ78 is effective against Echinostoma caproni and Fasciola hepatica. J. Antimicrob. Chemother. 2006, 58, 1193-1197; Keiser J.; Xiao S.-H.; Dong Y.; Utzinger J.; Vennerstrom J. L. Clonorchicidal properties of the synthetic trioxolane OZ78. J. Parasitol. 2007, 93, 1208-1213). Интерес к получению инициаторов радикальной полимеризации и лекарственных препаратов стимулирует развитие методов синтеза пероксидов, в которых карбонильные соединения, их производные и пероксид водорода (H2O2) играют ведущую роль как стартовые реагенты.
Анализ научно-технической и патентной литературы за последние сто лет демонстрирует, что количество публикаций, связанных с получением пероксидов в реакции Н2О2 с монокетонами исчисляется тысячами. (Žmitek, К.; Zupan, М.; Iskra, J. α-Substituted organic peroxides: synthetic strategies for a biologically important class of gem-dihydroperoxide and perketal derivatives. Org. Biomol. Chem. 2007, 5, 3895-3908). Так, например, известны циклические дипероксиды (содержат в молекуле два пероксидных O-O фрагмента) и циклические трипероксиды (содержат в молекуле три пероксидных O-O фрагмента), которые получают взаимодействием монокетонов с H2O2 (Kharasch, М.; Sosnovsky, G.Structure of Peroxides Derived from Cyclohexanone and Hydrogen Peroxide. J. Org. Chem. 1958, 23, 1322-1324) и трипероксиды (Story et al. Macrocyclic synthesis. II. Cyclohexanone peroxides. J. Org. Chem. 1970, 35, 3059-3061) по следующей схеме (1):
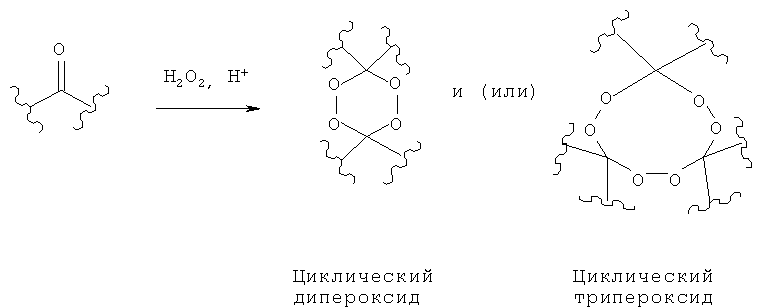
Публикаций, связанных с получением бициклических органических дипероксидов (мостиковых 1,2,4,5-тетраоксанов) с двумя пероксидными О-О фрагментами и мостиком из одного углеродного атома, по реакции Н2О2 с β-дикетонами (не с монокетонами), насчитывается несколько.
В работе (Milas N.A.; Mageli O.L.; Golubovic A.; Amdt R.W.; Ho J.C.J. Studies in Organic Peroxides. XXIX. The Structure of Peroxides Derived from 2,4-Pentanedione and Hydrogen Peroxide. J. Am. Chem. Soc. 1963, 85, 222-226) был получен только один мостиковый тетраоксан - 1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]гептан с общим выходом 18.5% в расчете на две стадии: образования 5-гидроперокси-3,5-диметил-1,2-диоксолан-3-ола в нейтральной среде из ацетилацетона и пероксида водорода, с последующей его внутримолекулярной циклизацией под действием Р2O5 в диэтиловом эфире.
Известен и принят авторами за прототип способ получения мостиковых 1,2,4,5-тетраоксанов - замещенных 2,3,5,6-тетраоксабицикло-[2.2.1]гептанов общей формулы I, где R=адамантил, незамещенный или замещенный бензил, незамещенный или замещенный алкил С1-С6, при этом заместителями могут быть CN, COOMe, COOEt или СН2=СН группа; R1=низший алкил или водород; R2=алкил С1-С6, R+R2=-(СН2)4-, взаимодействием соответствующих β-дикетонов общей формулы II с пероксидом водорода (Н2О2) в среде органического растворителя, например, EtOH, i-PrOH, THF, Et2O (в ацетонитриле реакция практически не идет), в присутствии сильной кислоты, например, H2SO4, HClO4 или HBF4 в качестве катализатора с выходом от 44 до 77% (Terent'ev A.O.; Borisov D.A.; Chemyshev V.V.; Nikishin G.I. Facile and Selective Procedure for the Synthesis of Bridged 1,2,4,5-Tetraoxanes; Strong Acids As Cosolvents and Catalysts for Addition of Hydrogen Peroxide to β-Diketones. J.Org.Chem. 2009, 74, 3335-3340) по следующей схеме (2):
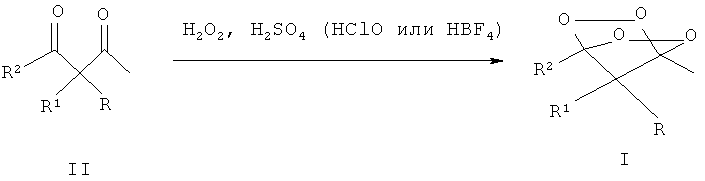
Эта реакция протекает в жестких условиях с использованием очень большого количества катализатора (1-2 г/5 мл реакционной массы) - сильной кислоты, например H2SO4, HClO4, HBF4. Использование большого количества сильных кислот в реакции требует строго соблюдения правил техники безопасности и специальной кислотно-стойкой аппаратуры. Кроме того, кислоты H2SO4, HClO4, HBF4 способны разлагать полученные пероксиды, что понижает выход целевого продукта.
Задачей настоящего изобретения является повышение безопасности и упрощение способа получения 1,2,4,5-мостиковых тетраоксанов замещенных 2,3,5,6-тетраоксабицикло-[2.2.1]гептанов, а также увеличение их выхода.
Поставленная задача достигается предлагаемым способом получения замещенных 2,3,5,6-тетраоксабицикло-[2.2.1]гептанов общей формулы I:
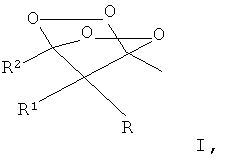
где R=адамантил, незамещенный или замещенный бензил, незамещенный или замещенный алкил С1-С6, при этом заместителями могут быть CN, СООМе, COOEt или CH2=CH группа; R1=низший алкил или водород; R2=алкил С1-С6, путем взаимодействия соответствующих β-дикетонов общей формулы II, где R, R1 и R2 имеют вышеуказанные значения, с пероксидом водорода в присутствии кислотного катализатора в среде органического растворителя, отличительной особенностью которого является, что в качестве кислотного катализатора используют фосфорномолибденовую кислоту, в качестве органического растворителя ацетонитрил и процесс проводят при мольном соотношении β-дикетон:пероксид водорода:фосфорномолибденовая кислота 1:3-5:0,1-0,3.
Процесс проводят при комнатной температуре (20-25°С) в течение 6-24 часов по следующей схеме:
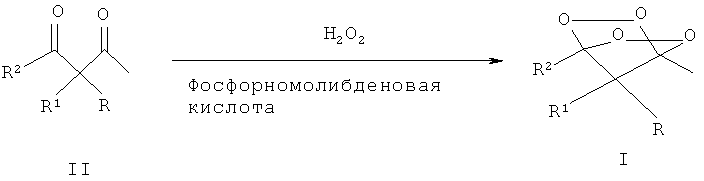
В процессе использовали фосфорномолибденовую кислоту (ФМК, Н3РО6·12МоО3·nH2O) в виде гидрата с содержанием кислоты 78% и водный раствор Н2О2 концентрацией 30-37%.
Проведение процесса в присутствии ФМК в среде ацетонитрила и мольном соотношении β-дикетона:пероксида водорода:фосфорномолибденовой кислоты 1:3-5:0,1-0,3 позволило увеличить выход целевого продукта до 87%.
Использование фосфорномолибденовой кислоты безопасно для промышленного производства в отличие от H2SO4, HClO4, HBF4, она в значительно меньшей степени вызывает коррозию стальных частей реакторов. По сравнению с H2SO4, HClO4, HBF4 фосфорномолибденовая кислота не способствует разложению пероксидов. Фосфорномолибденовая кислота малотоксична и сравнительно безопасна - в виде растворов не вызывает ожогов и поражений кожи.
Технический результат - безопасность и упрощение предлагаемого способа и увеличение выхода целевого продукта. Мостиковые 1,2,4,5-тетраоксаны получают селективно и с хорошим с выходом от 68 до 87%.
Изобретение соответствует критерию «новизна», так как в известной научно-технической и патентной литературе отсутствует полная совокупность признаков, характеризующих предлагаемое изобретение. Предлагаемое изобретение соответствует критерию «изобретательский уровень», так как до настоящего времени фосфорномолибденовая кислота не использовалась в реакциях со стадией внутримолекулярной циклизации пероксидов для получения мостиковых 1,2,4,5-тетраоксанов.
Именно найденное соотношение β-дикетона:пероксида водорода:фосфорномолибденовой кислоты и предложенные реакционные условия позволяют получать мостиковые тетраоксаны, то есть продукты конденсации β-дикетонов с двумя молекулами пероксида водорода, а не с одной, тремя или четырьмя.
В реакциях кетонов с пероксидом водорода может происходить межмолекулярная конденсация с участием карбонильных групп разных молекул с образованием олигомерных и полимерных пероксидов, в настоящем изобретении имеет место только стадия внутримолекулярной конденсации;
β-дикетоны существуют в растворе, в значительной степени, в виде кето-енола; таким образом, помимо пероксидирования кетогруппы, происходит пероксидирование енольной части молекулы, что ранее не наблюдалось, поскольку енолы являются соединениями с активированной для окисления двойной связью, то до осуществления настоящего изобретения можно было предполагать эпоксидирование этой двойной связи (М.N.Sheng, J.G.Zajacek. Hydroperoxide Oxidations Catalyzed by Metals. I. The Epoxidation ofOlefins. Chapter 57, pp.418-432. Advances in Chemistry, Vol.76, 1968), а не пероксидирование.
Изобретение соответствует условию «промышленная применимость», так как мостиковые 1,2,4,5-тетраоксаны могут найти применение в химии полимеров для получения инициаторов радикальной полимеризации непредельных мономеров, а также в медицине и фармакологии для получения лекарственных препаратов вследствие обнаружения у родственных классов пероксидов высокой антималярийной и антигельминтной активности.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Пример 1. Получение 1,4-диметил-7-(3-метилбензил)-2,3,5,6-тетра-оксабицикло[2.2.1]гептан (Ia) из 3-(3-метилбензил)пентан-2,4-диона (IIa).
К раствору 0.33 г (1.6 ммоль) дикетона IIа в 6 мл (MeCN) добавляли при перемешивании H2O2 (37% водный раствор, 4 моль H2O2/1 моль IIа, 6.4 ммоль, 588 мг), затем ФМК (0.42 ммоль, 1 г). Реакционную массу перемешивали в течение 24 часов. Добавляли CH2Cl2 (40 мл), промывали H2O (10 мл), затем 5% раствором NaHCO3 (2×10 мл), затем снова Н2О (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, упаривали в вакууме водоструйного насоса. Целевой тетраоксан Ia выделяли колоночной хроматографией на SiO2. Получали Ia (0.33 г, 1.39 ммоль), выход 87%. Белые кристаллы. Т пл.=75-77°С. 1Н ЯМР (300.13 МГц, CDCl3), δ: 1.39 (с, 6Н), 2.34 (с, 3Н), 2.89 (д, 2Н, J=7.3 Гц), 3.09 (т, 1Н J=7.0 Гц), 6.98-7.27 (м, 4Н). 13С ЯМР (50.32 МГц, CDCl3), δ: 9.8, 21.4, 30.2, 59.3, 110.7, 125.8, 127.6, 128.7, 129.6, 137.1, 138.5.
Пример 2. Получение 7-бутил-1,4-диметил-2,3,5,6-тетраоксабицикло-[2.2.1]гептана (Iб) из 3-бутилпентан-2,4-диона (IIб).
К раствору 0.25 г (1.6 ммоль) дикетона IIб в 5 мл (MeCN) добавляли при перемешивании H2O2 (37% водный раствор, 3 моль H2O2/1 моль IIб, 4.8 ммоль, 441 мг), затем ФМК (0.21 ммоль, 0.8 г). Реакционную массу перемешивали в течение 12 часов. Добавляли CH2Cl2 (30 мл), промывали H2O (10 мл), затем 5% раствором NaHCO3 (2×10 мл), затем снова Н2О (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, упаривали в вакууме водоструйного насоса. Целевой тетраоксан Iб выделяли колоночной хроматографией на SiO2. Получали Iб (0.24 г, 1.26 ммоль), выход 79%. Масло. 1H ЯМР (300.13 МГц, CDCl3), δ: 0.92 (т, 3Н, J=6.6 Гц), 1.30-1.61 (м, 12Н), 2.59 (т, 1Н, J=5.9 Гц). 13С ЯМР (50.32 МГц, CDCl3), δ: 9.8, 13.8, 22.8, 23.5, 29.7, 59.0, 110.8.
Пример 3. Получение 7-аллил-1,4-диметил-2,3,5,6-тетраоксабицикло-[2.2.1] гептана (Iв) из 3-аллилпентан-2,4-диона (IIв).
К раствору 0.22 г (1.6 ммоль) дикетона IIв в 4 мл (MeCN) добавляли при перемешивании Н2О2 (37% водный раствор, 4 моль H2O2/1 моль IIв, 6.4 ммоль, 587 мг), затем ФМК (0.34 ммоль, 0.8 г). Реакционную массу перемешивали в течение 6 часов. Добавляли CH2Cl2 (30 мл), промывали Н2О (10 мл), затем 5% раствором NaHCO3 (2×10 мл), затем снова Н2О (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, упаривали в вакууме водоструйного насоса. Целевой тетраоксан Iв выделяли колоночной хроматографией на SiO2. Получали Iв (0.2 г, 1.18 ммоль), выход 74%. Масло. 1Н ЯМР (300.13 МГц, CDCl2), δ: 1.50 (с, 6Н), 2.35 (т, 2Н, J=7.0 Гц), 2.75 (т, 1Н, J=6.6 Гц), 4.96-5.26 (м, 2Н), 5.65-5.91 (м, 1Н). 13С ЯМР (75.48 МГц, CDCl2), δ: 9.8, 28.4, 57.6, 110.5, 117.8, 133.9.
Пример 4. Получение 3-(1,4-диметил-2,3,5,6-тетраоксабицикло[2.2.1]-гептан-7-ил)пропионитрила (Iг) из 4-ацетил-5-оксогексаннитрила (IIг).
К раствору 0.245 г (1.6 ммоль) дикетона IIг в 6 мл (MeCN) добавляли при перемешивании Н2О2 (30% водный раствор, 3 моль H2O2/1 моль IIг, 4.8 ммоль, 544 мг), затем ФМК (0.17 ммоль, 0.4 г). Реакционную массу перемешивали в течение 24 часов. Добавляли CH2Cl2 (30 мл), промывали Н2О (10 мл), затем 5% раствором NaHCO3 (2×10 мл), затем снова Н2О (2×10 мл). Органический слой сушили над Na2SO4, фильтровали, упаривали в вакууме водоструйного насоса. Целевой тетраоксан Iг выделяли колоночной хроматографией на SiO2. Получали Iг (0.20 г, 1.09 ммоль), выход 68%. Белые кристаллы. Т пл.=78-80°С. 1Н ЯМР (300.13 МГц, CDCl2), δ: 1.59 (с, 6Н), 1.97 (кв, 2Н, J=6.6 Гц), 2.57 (т, 2Н, J=7.3 Гц), 2.83 (т, 1Н, J=5.9 Гц). 13С ЯМР (75.48 МГц, CDCl2), δ: 9.8, 15.6, 20.1, 57.3, 110.4, 118.4.
Аналогично получают другие замещенные 2,3,5,6-тетраоксабицикло-[2.2.1]гептаны общей формулы I, примеры которых представлены в таблице с указанием мольных соотношений исходных реагентов и выхода целевого продукта в %.



![СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ](https://fips.edrid.ru/images/rid/0b/8c/a4/6420d2a3d04355dfb70fbdc4bac160de.png)
![СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ](https://fips.edrid.ru/images/rid/0b/8c/a4/dce6a6286066d5a40dc85dd97483487d.png)
![СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ](https://fips.edrid.ru/images/rid/0b/8c/a4/9809deb21420a145f620fafe128967a2.png)
![СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ](https://fips.edrid.ru/images/rid/0b/8c/a4/d46632054335ee661a3e59520b6c0ba2.png)

