СЕЛЕКТИВНЫЕ СОЕДИНЕНИЯ ПЕПТИДА YY И ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Область изобретения
Данное изобретение относится к аналогам и/или производным пептида YY (PYY) и их фармацевтическому применению.
Включение списка последовательностей посредством ссылки
Список последовательностей под названием "ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ" представляет собой документ размером 35329 байт, созданный 22 октября 2014 года и включенный в данный документ посредством ссылки.
Уровень техники
PYY высвобождается во время еды из L-клеток в дистальном отделе тонкого кишечника и в толстом кишечнике. PYY, как известно, имеет периферические эффекты в желудочно-кишечном (ЖК) тракте, а также действует центрально как сигнал насыщения. PYY в природе секретируется как пептид, состоящий из 36 аминокислот (PYY(1-36)) с C-концевым амидом, но расщепляется до PYY(3-36), который составляет примерно 50% от циркулирующего PYY. Ферментом, ответственным за расщепление, является дипептидилпептидаза IV (DPPIV). PYY(3-36) быстро элиминируется за счет протеаз и других механизмов клиренса. Сообщалось, что период полужизни PYY(3-36) у свиней составляет менее 30 минут. Таким образом, PYY демонстрирует субоптимальные фармакокинетические свойства, а это означает, что пептид нужно вводить по меньшей мере два раза в день.
В то время как PYY(1-36) активирует рецепторы Y1, Y2 и Y5 с очень небольшой селективностью и рецептор Y4 с немного меньшей, DPPIV-процессированный PYY(3-36) демонстрирует повышенную селективность в отношении рецептора Y2 по сравнению с рецепторами Y1, Y4 и Y5, хотя некоторая аффинность к Y1 и Y5 сохраняется. Активация рецептора Y2, как известно, ведет к снижению аппетита и потребления пищи, в то время как активация рецепторов Y1 и Y5 ведет к повышению аппетита и потребления пищи. Кроме того, активация рецепторов Y1 и Y5 может привести к повышению кровяного давления.
PYY(3-36) были предложены для применения в лечении ожирения и связанных с ним заболеваний, основанном на демонстрируемых эффектах некоторых из этих пептидов на животных моделях и у человека, а также на том факте, что тучные люди имеют низкие базальные уровни PYY, а также более низкие пищевые ответы на этот пептид. Кроме того, было продемонстрировано, что агонисты Y2 имеют антисекреторные и проабсорбционные эффекты в желудочно-кишечном тракта (ЖК). Было предложено потенциальное применение агонистов Y2 в лечении ряда желудочно-кишечных нарушений.
На основе продемонстрированных эффектов, например, у крыс Zucker и мышей с ожирением, индуцированным диетой (DIO, от англ. Diet-Induced Obese), Y2-селективные аналоги PYY(3-36) оказывают положительное влияние на метаболизм глюкозы и, таким образом, предлагаются для применения в лечении сахарного диабета.
WO 2009/138511 А1 относится к агонистам рецептора Y2 и/или Y4 длительного действия. WO 2011/033068 А1 относится к аналогам PYY, стабилизированным в отношении C-концевого протеолитического распада. WO 2011/058165 А1 относится к рецепторным агонистам Y2 с пролонгированными фармакокинетическими свойствами.
Для лечения состояний, восприимчивых к Y-рецепторной модуляции, таких как ожирение и диабет, было бы привлекательным применение PYY-аналогов, которые являются специфическими для подтипа рецептора Y2 и, что важно, также демонстрируют пролонгированные фармакокинетические свойства и как таковые могут быть использованы в режиме дозирования с более низкой частотой введения, чем PYY или PYY(3-36).
Сущность изобретения
Изобретение относится к соединениям PYY. Эти соединения PYY согласно данному изобретению могут содержать до 10 аминокислотных модификаций по сравнению с человеческим PYY(3-36) (hPYY(3-36), SEQ ID NO 2) и имеют аминокислоту в позиции, соответствующей позиции 30 в человеческом PYY(1-36) (hPYY(1-36), SEQ ID NO 1), замещенную триптофаном.
В одном из аспектов соединения PYY также содержат N(альфа)-метиларгинин в позиции, соответствующей позиции 35 в hPYY(1-36).
Дополнительно или альтернативно, в одном из аспектов соединения PYY также содержат лизин в позиции, соответствующей позиции 7 в hPYY(1-36), и модифицирующую группу, присоединенную к эпсилон-аминогруппе этого лизина.
В одном аспекте данное изобретение также относится к фармацевтическим композициям, содержащим такие соединения PYY и фармацевтически приемлемые эксципиенты, а также к медицинскому применению соединений PYY.
Дополнительно или альтернативно, в одном из аспектов данное изобретение относится к соединениям PYY, которые являются агонистами рецептора Y2.
Дополнительно или альтернативно, в одном из аспектов данное изобретение относится к соединениям PYY, демонстрирующим селективность в отношении Y-рецептора подтипа Y2 по сравнению с Y-рецепторами подтипов Y1, Y4 и Y5.
Дополнительно или альтернативно, в одном из аспектов данное изобретение относится к соединениям PYY с более длительным периодом полужизни, чем период полужизни hPYY(3-36). Дополнительно или альтернативно, в одном из аспектов данное изобретение относится к соединениям PYY с более длительным периодом полужизни, чем период полужизни hPYY(1-36).
Описание изобретение
Данное изобретение относится к соединениям PYY. Эти соединения PYY согласно данному изобретению могут включать до 10 аминокислотных модификаций по сравнению с hPYY(3-36) и имеют аминокислоту в позиции, которая соответствует позиции 30 в hPYY(1-36), замещенную триптофаном.
Кроме того, в одном из аспектов остаток аргинина в позиции, соответствующей позиции 35 в hPYY(1-36), имеет метильную группу, добавленную к α-аминогруппе, и это означает, что остаток в позиции, соответствующей позиции 35 в hPYY(1 -36), является, таким образом, N(альфа)-метиларгинином.
Дополнительно или альтернативно, в одном из аспектов соединения PYY дополнительно включают лизин в позиции, соответствующей позиции 7 в hPYY(1-36), и модифицирующую группу, присоединенную к эпсилон-аминогруппе этого лизина.
Дополнительно или альтернативно, в одном из аспектов данное изобретение относится к соединениям PYY, которые являются агонистами Y-рецепторов подтипа Y2.
Дополнительно или альтернативно, в одном из аспектов данное изобретение относится к соединениям PYY, демонстрирующим селективность в отношении Y-рецептора подтипа Y2 по сравнению с Y-рецепторами подтипов Y1, Y4 и Y5.
В одном из аспектов пептиды, будучи "селективными" в отношении конкретных рецепторов по сравнению с другими рецепторами, относятся к пептидам, которые демонстрируют активность в отношении одного Y-рецептора, превышающую по меньшей мере в 10 раз, например, по меньшей мере в 20 раз, по меньшей мере в 50 раз или по меньшей мере в 100 раз активность в отношении других Y-рецепторов, что измеряли in vitro в анализе рецепторной функции, таком как функциональный анализ активности Actone, и сравнивали по значениям ЕС50, либо измеряли аффинность связывания с рецептором в анализе сцинтилляционного приближения (SPA) и сравнивали по значениям Ki.
В дальнейшем греческие буквы могут быть представлены их символами или соответствующим письменным обозначением, например: α - альфа; β - бета; ε - эпсилон; γ - гамма; ω - омега; и т.п.
Соединения PYY
Термин "hPYY(1-36)", используемый в данном документе, относится к человеческому пептиду YY, последовательность которого включена в список последовательностей как SEQ ID NO 1. Пептид, имеющий последовательность SEQ ID NO 1, также может быть обозначен как нативный hPYY.
Термин "соединение PYY", используемый в данном документе, относится к пептиду или соединению, которое является вариантом hPYY(1-36). Термин "соединение PYY", используемый в данном документе, также может относиться к пептиду или соединению, которое является вариантом hPYY(3-36) (SEQ ID NO 2).
Термин "соединение PYY", используемый в данном документе, также может относиться к пептиду или соединению, которое представляет собой вариант hPYY (4-36).
C-конец соединений PYY согласно данному изобретению представляет собой амид, как C-конец нативного hPYY(1-36) (SEQ ID NO 1) и hPYY(3-36) (SEQ ID NO 2), соответственно.
Соединения PYY согласно данному изобретению могут представлять собой аналоги PYY и/или их производные.
Термин "аналог PYY" используется для соединений PYY, где в основной цепи присутствует по меньшей мере одна аминокислотная модификация.
Термин "производное PYY" используется для соединений PYY, содержащих по меньшей мере один ковалентно присоединенный неаминокислотный заместитель.
Производное аналога PYY, таким образом, является соединением PYY, содержащим по меньшей мере одну аминокислотную модификацию и по меньшей мере один ковалентно присоединенный неаминокислотный заместитель.
Эти соединения PYY согласно данному изобретению могут содержать до 10 аминокислотных модификаций по сравнению с hPYY(3-36).
Термин "аминокислотная модификация", используемый в данной заявке, используется в значении модификации аминокислоты по сравнению с hPYY(3-36). Эта модификация может быть результатом делеции аминокислоты, добавления аминокислоты, замены одной аминокислоты на другую или ковалентного присоединения заместителя к аминокислоте пептида.
Соединения PYY согласно данному изобретению содержат триптофан в позиции, соответствующей позиции 30 в hPYY(1-36), а это означает, что соединения PYY согласно данному изобретению могут содержать до 9 аминокислотных модификаций по сравнению с hPYY(3-36) в дополнение к этой модификации в позиции, соответствующей позиции 30 в hPYY(1-36).
В качестве примера, [Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36) содержит 4 аминокислотных замены по сравнению с hPYY(3-36).
В качестве другого примера, [Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) содержит 5 аминокислотных замен и 1 делецию по сравнению с hPYY(3-36), а это означает, что это соединение имеет 6 аминокислотных модификаций по сравнению с hPYY(3-36).
В еще одном примере пептиды PYY согласно изобретению могут обладать по меньшей мере 70%, 75% или 80% идентичностью последовательности с hPYY(3-36). В качестве примера способа определения идентичности последовательности двух аналогов были выровнены два пептида, [NMeArg35]hPYY(3-36) и hPYY(3-36). Идентичность последовательности аналога [NMeArg35] hPYY(3-36) относительно hPYY(3-36) определяется общим числом выровненных остатков за вычетом числа отличающихся остатков (т.е. числом выровненных идентичных остатков), деленным на общее число остатков в hPYY(3-36). Соответственно, в указанном примере идентичность последовательности составляет (34-1)/34.
Соединения PYY или аналоги PYY согласно изобретению могут быть описаны со ссылкой на i) номер аминокислотного остатка в hPYY(1-36), который соответствует аминокислотному остатку, который изменен (т.е. соответствующая позиция в hPYY(1-36), и ii) фактическое изменение.
Ниже приводится неограничивающий пример подходящей номенклатуры аналогов.
[NMeArg35]hPYY(3-36) обозначает аналог человеческого PYY(1-36), в котором природный аргинин в позиции 35 был замещен N(альфа)-метиларгинином (остаток аргинина в позиции, соответствующей позиции 35 в hPYY(1-36), имеет метильную группу, добавленную к альфа-аминогруппе), а природный тирозин и пролин в позиции 1 и 2, соответственно, удалены.
Точно так же, [Trp30]hPYY(3-36) обозначает аналог человеческого PYY(3-36), в котором природный лейцин в позиции 30 человеческого PYY(1-36) был заменен триптофаном.
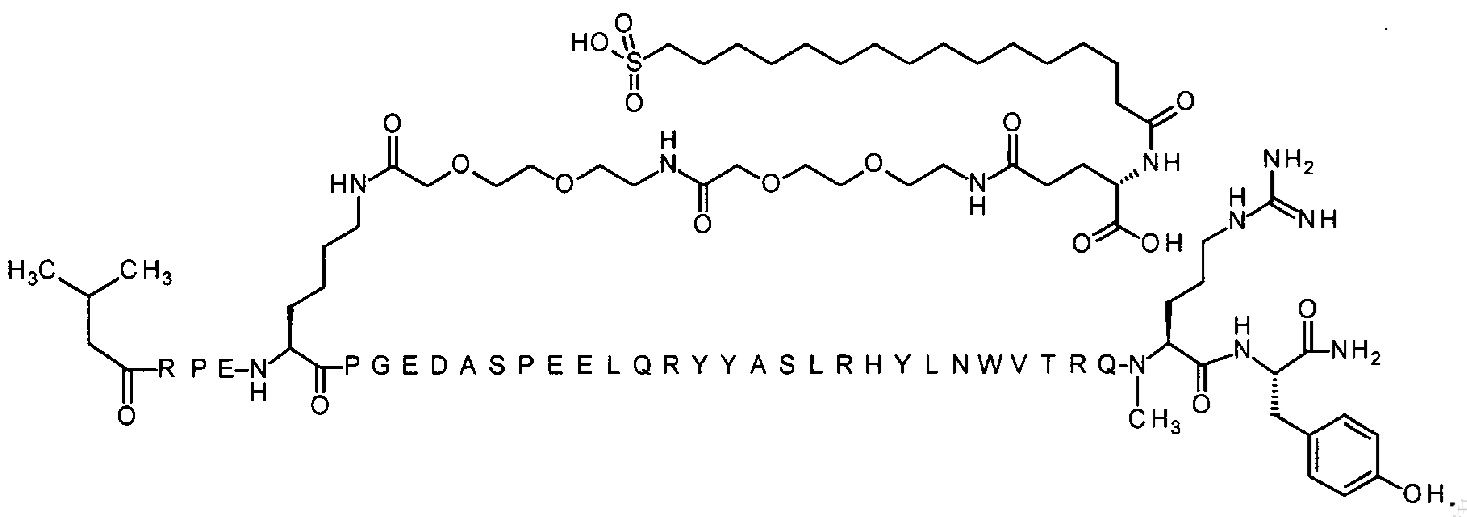
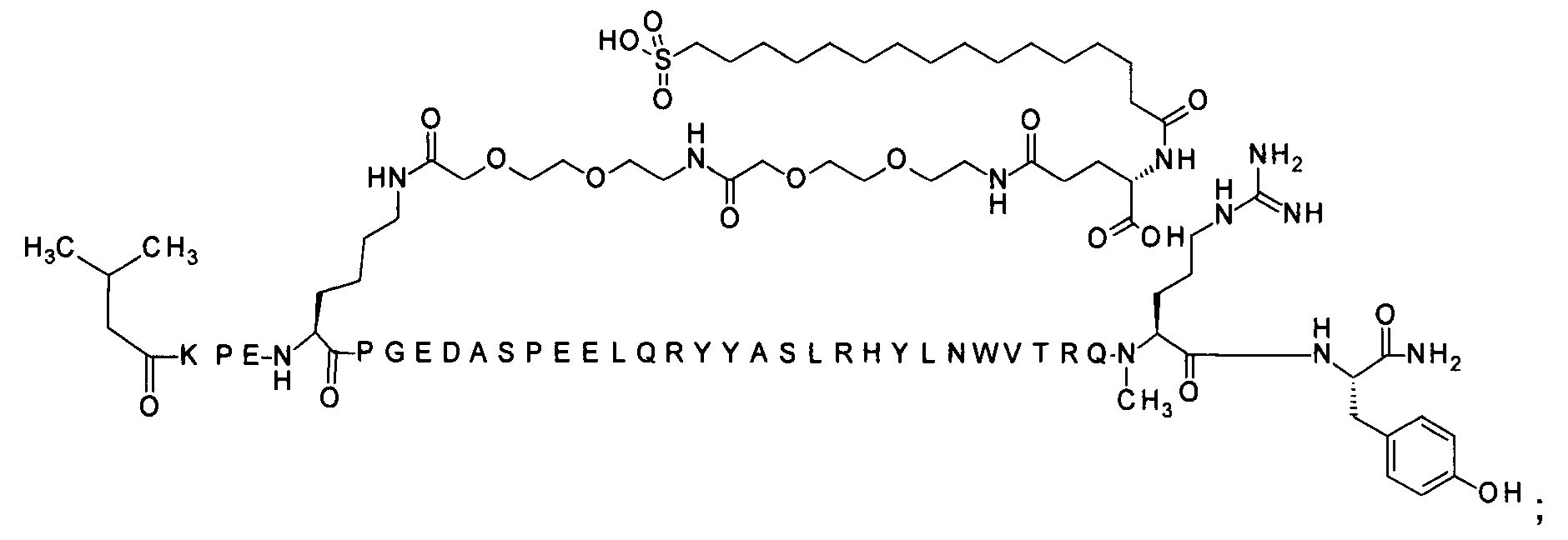
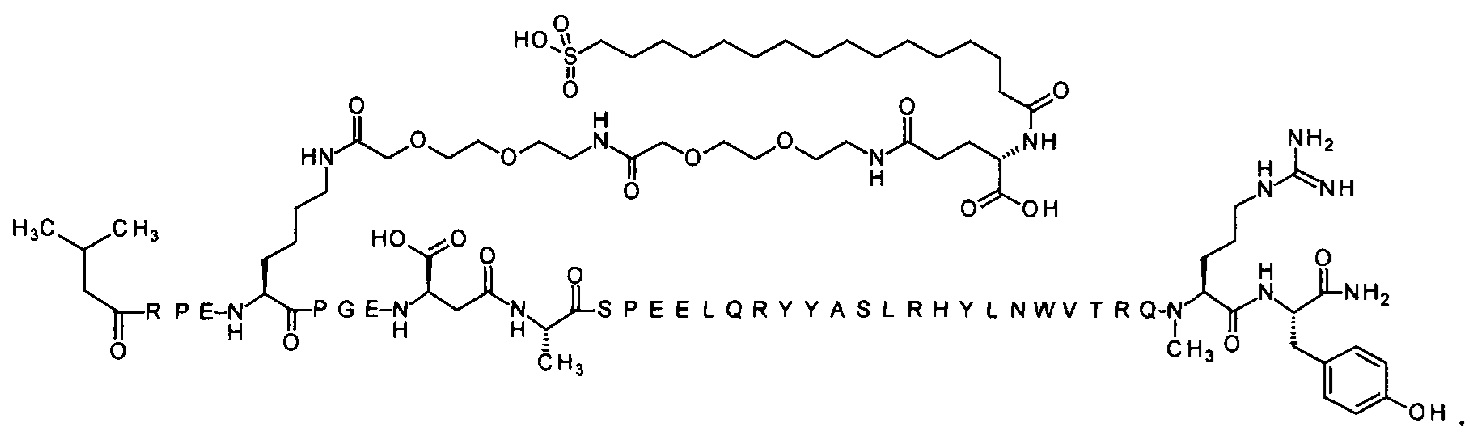
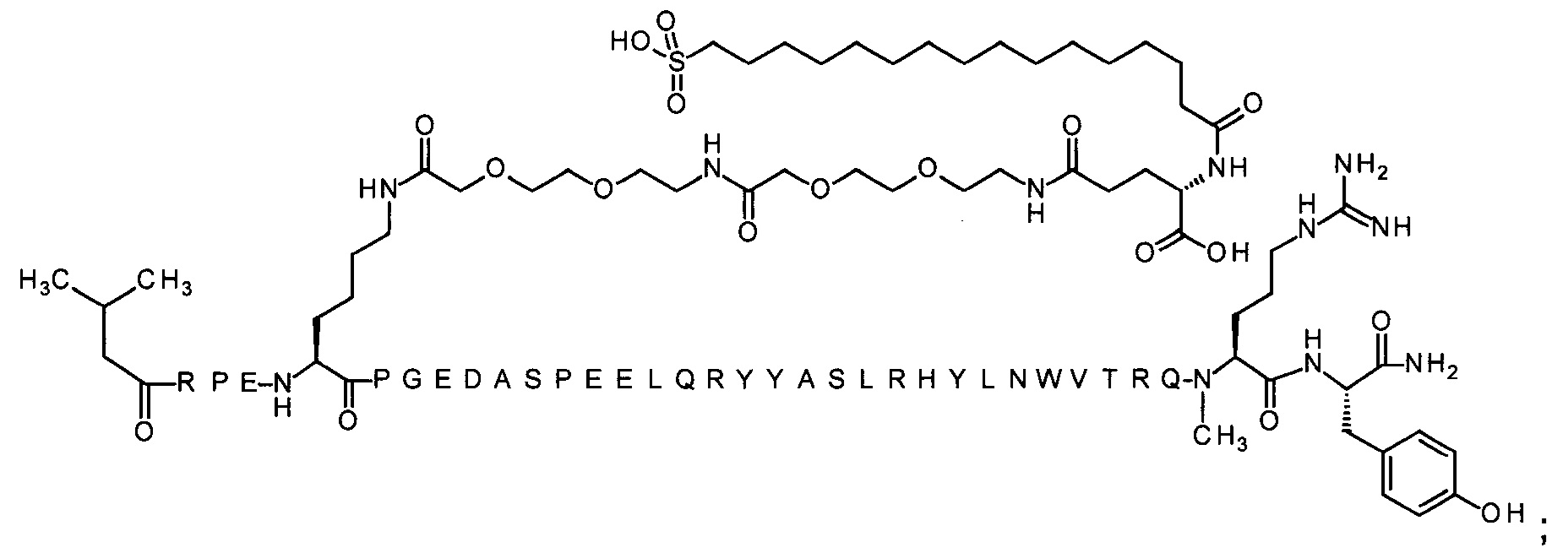
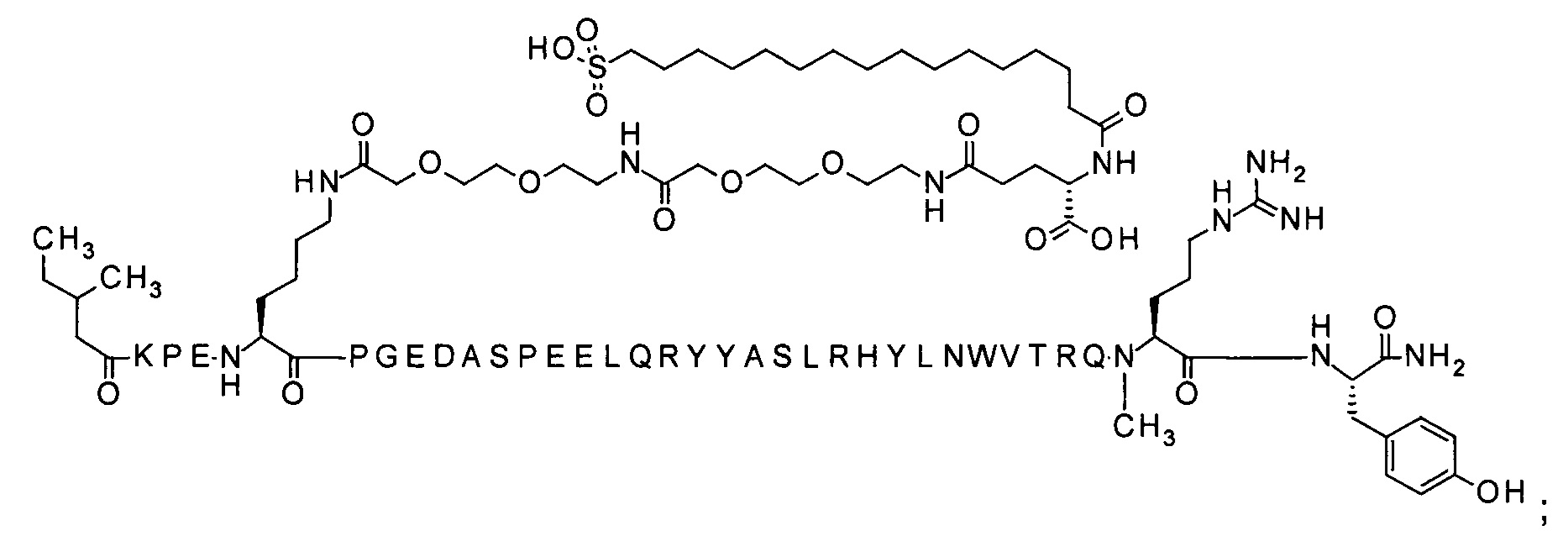
Ниже приводится неограничивающий пример подходящей номенклатуры для производного аналога PYY. 7-N{эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36) обозначает производное аналога hPYY(3-36) (SEQ ID NO 2), где [Lys7,Gln18,Trp30,NMeArg35] обозначает аминокислотные замены по сравнению с человеческим PYY(3-36) с номерами, относящимися к соответствующим позициям PYY(1-36), и где заместитель [2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]- присоединен к эпсилон-аминогруппе лизина в позиции, соответствующей позиции 7 в hPYY(1-36).
Выражения "позиция, эквивалентная" или "соответствующая позиция" используются, чтобы охарактеризовать сайт изменения в вариантной последовательности PYY со ссылкой на hPYY(1-36).
Как правило, когда в этой заявке речь идет о конкретной позиции в аналоге PYY, "позиция, относящаяся к" представляет собой позицию в аналоге PYY, соответствующую этой конкретной позиции в hPYY(1-36).
Используемое в данной заявке выражение о том, что соединение PYY содержит определенную аминокислоту в позиции, соответствующей определенной позиции в hPYY(1-36), означает, что нативная аминокислота в этой позиции заменена на эту конкретную аминокислоту.
Аминокислотные остатки могут быть идентифицированы по их полному имени, их однобуквенному коду и/или их трехбуквенному коду. Эти три способа полностью эквивалентны.
Аналоги, "содержащие" определенные указанные изменения, могут включать дополнительные изменения по сравнению с hPYY(1-36). В одном аспекте аналог "имеет" указанные изменения.
Аналоги PYY
Аналог PYY представляет собой пептид PYY, в котором более ряд аминокислотных остатков был изменен по сравнению с hPYY(1-36). Эти модификации включают замены, вставки и/или делеции, по отдельности или в комбинации.
В конкретном аспекте аналоги PYY согласно изобретению включают одну или более чем одну модификацию "заменимого" аминокислотного остатка. В контексте данного изобретения "заменимый" аминокислотный остаток представляет собой остаток, который может быть изменен, т.е. удален или замещен, в аминокислотной последовательности человеческого PYY без отмены или существенного снижения активности аналога PYY в отношении рецептора Y2.
Замены. В одном аспекте аминокислоты могут быть замещены путем консервативной замены. Термин "консервативная замена", используемый в данном документе, означает, что одна или более чем одна аминокислота заменена другим, биологически сходным остатком. Примеры включают замену аминокислотными остатками с аналогичными характеристиками, например, небольшими аминокислотами, кислыми аминокислотами, полярными аминокислотами, основными аминокислотами, гидрофобными аминокислотами и ароматическими аминокислотами.
В одном из аспектов аналоги PYY согласно изобретению могут содержать замены одной или более чем одной неприродной аминокислотой и/или неаминокислотой, например, аминокислотным миметиком, в последовательности PYY.
Делеиии и усечения. В одном из аспектов аналоги PYY согласно изобретению могут иметь один или более чем один аминокислотный остаток, удаленный из аминокислотной последовательности человеческого PYY, отдельно или в комбинации с одной или более чем одной вставкой или заменой.
Вставки. В одном из аспектов аналоги PYY согласно изобретению могут иметь один или более чем один аминокислотный остаток, вставленный в аминокислотную последовательность человеческого PYY, отдельно или в комбинации с одной или более чем одной делецией и/или заменой.
В одном из аспектов аналоги PYY согласно изобретению могут включать вставки одной или более чем одной неприродной аминокислоты и/или неаминокислоты в последовательность PYY.
Пептид PYY может быть получен от позвоночного, такого как человек, мышь, овца, коза, корова или лошадь. Термин "позвоночное" означает члена подтипа позвоночных, первичного разделения типа хордовых, который включает рыб, амфибий, рептилий, птиц и млекопитающих, каждый из которых характеризуется сегментированным позвоночником и отчетливой хорошо дифференцированной головой. Термин "млекопитающие" означает людей, а также всех других теплокровных членов животного царства, обладающих гомеостатическим механизмом, в классе млекопитающих, например, млекопитающих-компаньонов, млекопитающих зоопарка, а также млекопитающих - источников пищи. Некоторые примеры млекопитающих-компаньонов включают собачьих (например, собак), кошачьих (например, кошек) и лошадей; некоторые примеры млекопитающих - источников пищи включают свиней, крупный рогатый скот, овец и т.п. В одном из аспектов млекопитающее является человеком или млекопитающим-компаньоном. В одном из аспектов млекопитающим является человек, мужчина или женщина.
Термин "пептид", например, используемый в контексте соединений PYY согласно данному изобретению, относится к соединению, которое содержит ряд аминокислот, соединенных амидными (или пептидными) связями.
Пептиды PYY согласно изобретению содержат по меньшей мере 24 составляющих аминокислоты, соединенных пептидными связями. В конкретных воплощениях пептиды PYY содержат по меньшей мере 33 аминокислоты. В конкретных воплощениях пептиды PYY содержат по меньшей мере 34 аминокислоты.
Аминокислоты представляют собой молекулы, содержащие аминогруппу и карбоксильную группу и, возможно, одну или более чем одну дополнительную группу, которую часто называют боковой цепью.
Термин "аминокислота" включает протеиногенные (или кодируемые, или природные) аминокислоты (среди 20 стандартных аминокислот), а также непротеиногенные (или некодируемые, или неприродные) аминокислоты. Протеиногенные аминокислоты являются такими аминокислотами, которые в природе включены в белки. Стандартные аминокислоты являются такими аминокислотами, которые кодируются генетическим кодом. Непротеиногенные аминокислоты либо не встречаются в белках, либо не производятся стандартным клеточным механизмом (например, они могут подвергаться посттрансляционной модификации). Неограничивающие примеры непротеиногенных аминокислот включают Aib (α-аминоизомасляную кислота), N(альфа)-метиларгинин, а также D-изомеры протеиногенных аминокислот. Одним из примеров D-изомера протеиногенной аминокислоты является D-изомер аспарагиновой кислоты, который также может быть записан в виде D-Asp.
В дальнейшем все аминокислоты соединения PYY, для которых не указан оптический изомер, следует понимать как L-изомер (если не указано иное).
Производные PYY
Термин "производное", используемый в данном документе в контексте пептида или аналога PYY, означает химически модифицированный пептид PYY, в котором один или более чем один заместитель ковалентно присоединен к пептиду.
В одном из аспектов данного изобретения заместитель может представлять собой N-концевой заместитель.
Дополнительно или альтернативно, в одном из аспектов заместитель может быть модифицирующей группой, или, альтернативно, его называют пролонгирующей группировкой.
N-концевой заместитель
В одном аспекте данного изобретения соединение PYY содержит заместитель, ковалентно присоединенный к альфа-аминогруппе в аминокислотном остатке на N-конце соединения PYY. В одном из аспектов аминокислотные остатки в позициях, соответствующих позициям 1-3 в hPYY(1-36), отсутствуют, а N-концевой заместитель ковалентно присоединен к аминокислотному остатку в позиции, соответствующей позиции 4 в hPYY(1-36).
В одном из аспектов N-концевой заместитель представляет собой алкокси-группу. В одном из аспектов N-концевой заместитель представляет собой алкокси-группу, содержащую до 12 атомов углерода. В другом аспекте N-концевой заместитель представляет собой алкокси-группу, содержащую до 6 атомов углерода.
Модифицирующая группа/пролонгирующая группировка
В одном из аспектов соединение PYY содержит заместитель или модифицирующую группу, ковалентно присоединенную к аминокислотному остатку в позиции, соответствующей позиции 7 в hPYY(1-36). В еще одном аспекте заместитель или модифицирующая группа способна образовывать нековалентные конъюгаты с белками, тем самым способствуя циркуляции производного в кровотоке, а также удлиняя время действия производного благодаря тому факту, что конъюгат производного PYY и альбумина медленно удаляется почечным клиренсом. Таким образом, заместитель, или модифицирующая группа, в целом также может упоминаться как пролонгирующая группировка.
Модифицирующая группа может быть ковалентно присоединена к остатку лизина пептида PYY путем ацилирования, т.е. посредством амидной связи, образованной между карбоксильной группой модифицирующей группы и эпсилон-аминогруппой остатка лизина. Аминогруппа лизина также может быть соединена с альдегидом модифицирующей группы путем восстановительного аминирования. В другом аспекте тиоловая группа цистеина может быть соединена с малеимидной группой модифицирующей группы посредством присоединения Михаэля, либо может быть соединена с хлор- или иодоацетил-группой модифицирующей группы посредством нуклеофильного замещения.
В одном из аспектов модифицирующая группа может быть ковалентно присоединена к остатку лизина в позиции, соответствующей позиции 7 в hPYY(1-36), путем ацилирования, т.е. посредством амидной связи, образованной между карбоксильной группой модифицирующей группы и эпсилон-аминогруппой остатка лизина.
Производные согласно изобретению могут существовать в различных стереоизомерных формах, которые имеют одинаковую молекулярную формулу и последовательность связанных атомов, но отличаются только трехмерной ориентацией их атомов в пространстве. Стереоизомерия иллюстративных примеров производных изобретения указана в экспериментальном разделе, в названиях, а также в структурах, с использованием стандартной номенклатуры. Если не указано иное, то изобретение относится ко всем стереоизомерным формам заявленного производного.
При этом все аминокислоты соединения PYY, для которых не указан оптический изомер, следует понимать как L-изомеры (если не указано иное).
Фармацевтически приемлемые соли
Соединения PYY согласно данному изобретению могут находиться в форме фармацевтически приемлемой соли.
Соли формируются, например, в результате химической реакции между основанием и кислотой, например: 2NH3+H2SO4→(NH4)2SO4.
Соль может быть основной солью, кислой солью, или же она может быть ни основной, ни кислой (т.е. нейтральной солью). Основные соли дают в воде гидроксид-ионы, а кислые соли дают ионы гидроксония.
Соли производных согласно изобретению могут формироваться с добавленными катионами или анионами между анионными или катионными группами, соответственно. Эти группы могут быть расположены в пептидной группировке и/или в боковой цепи производных согласно изобретению.
Неограничивающие примеры анионных групп производных согласно изобретению включают свободные карбоксильные группы в боковой цепи, если таковые имеются, а также в пептидной группировке. Пептидная группировка часто включает свободные гидроксильные группы на внутренних кислых аминокислотных остатках, таких как Asp и Glu.
Неограничивающие примеры катионных групп в пептидной группировке включают свободную аминогруппу на N-конце, если она присутствует, а также любую свободную аминогруппу внутренних основных аминокислотных остатков, таких как His, Arg и Lys.
Функциональные свойства
В первом функциональном аспекте соединения PYY согласно данному изобретению имеют хорошую Y2-рецепторную активность. Дополнительно или альтернативно, во втором аспекте они очень хорошо связываются с рецептором Y2. Предпочтительно, они являются полными агонистами рецептора Y2, что отражается в их способности сильно связываться с рецептором Y2, что сочетается со способностью полностью активировать рецептор по сравнению с hPYY(1-36) и hPYY(3-36).
Дополнительно или альтернативно, во втором функциональном аспекте данное изобретение относится к соединениям PYY, демонстрирующим селективность в отношении рецептора Y подтипа Y2 по сравнению с рецептором Y подтипов Y1, Y4 и Y5.
Дополнительно или альтернативно, в третьем функциональном аспекте соединения PYY согласно данному изобретению обладают улучшенными фармакокинетическими свойствами. Дополнительно или альтернативно, в четвертом функциональном аспекте соединения PYY согласно данному изобретению обладают увеличенным периодом полужизни и/или сниженным клиренсом. Дополнительно или альтернативно, в пятом функциональном аспекте они способны in vivo снижать уровень глюкозы в крови. Дополнительно или альтернативно, в шестом функциональном аспекте они способны in vivo снижать потребление пищи. Дополнительно или альтернативно, в седьмом функциональном аспекте они способны in vivo снижать массу тела.
Биологическая активность - эффективность in vivo
В соответствии с первым функциональным аспектом соединения PYY согласно данному изобретению являются биологически активными, или эффективными.
В конкретном воплощении эффективность и/или активность относятся к эффективности in vitro, т.е. к производительности в функциональном Y2-рецепторном анализе, более конкретно, к способности активировать Y2-рецептор человека.
Термин "половина максимальной эффективной концентрации (ЕС50)", как правило, относится к концентрации, которая вызывает реакцию, находящуюся на середине между базальной линией и максимумом на кривой "доза - ответ". ЕС50 используется в качестве меры эффективности соединения и представляет собой концентрацию, при которой наблюдается 50% от его максимального эффекта.
Эффективность in vitro производных согласно изобретению можно определить, как описано в примере 39, и при этом определяют ЕС50 рассматриваемого производного. Чем ниже значение ЕС50, тем выше эффективность.
В одном из аспектов данного изобретения производное согласно изобретению имеет эффективность in vitro, определенную с использованием способа, описанного в примере 39, которая соответствует ЕС50 на уровне 100 нМ или ниже. В одном из аспектов производное согласно изобретению имеет эффективность in vitro, определенную с использованием способа, описанного в примере 39, которая соответствует ЕС50 на уровне 50 нМ или ниже. В одном из аспектов производное согласно изобретению имеет эффективность in vitro, определенную с использованием способа, описанного в примере 39, которая соответствует ЕС50 на уровне 25 нМ или ниже.
Биологическая активность - связывание рецептора in vitro
В соответствии со вторым функциональным аспектом соединения PYY согласно данному изобретению очень хорошо связываются с рецептором Y2. Это может быть определено так, как описано в примере 40.
Как правило, связывание с рецептором Y2 должно быть настолько хорошим, насколько это возможно, соответствуя низкому значению Ki. Значение Ki определяется уравнением Ченга-Прусоффа Ki=IC50/(1+[L]/Kd), где IC50 представляет собой половину максимальной ингибирующей концентрации агониста, [L] представляет собой концентрацию радиолиганда, a Kd представляет собой константу диссоциации.
В качестве примера, в определенном аспекте аффинность связывания рецептора Y2 (Ki) составляет менее 100 нМ. В одном аспекте данного изобретения аффинность связывания рецептора Y2 (Ki) составляет менее 50 нМ. В одном аспекте данного изобретения аффинность связывания рецептора Y2 (Ki) составляет менее 10 нМ.
Биологическая активность - фармакология in vivo
В другом конкретном воплощении соединения PYY согласно данному изобретению являются эффективными in vivo, что может быть определено, как известно в данной области, на любой подходящей животной модели, а также в клинических испытаниях.
Диабетическая мышь db/db является одним из примеров подходящей животной модели, и эффект снижения глюкозы в крови может быть определен у таких мышей in vivo, например, как описано в примере 42.
Кроме того, ингибирование потребления пищи у мышей db/db является подходящей моделью для определения влияния на потребление пищи и массу тела, что также описано в примере 42.
Как правило, эффект снижения глюкозы при дозе 1 мкмоль/кг должен быть настолько хорошим, насколько это возможно, соответствуя низкому относительному % уровню глюкозы.
В качестве примера, в конкретном аспекте данного изобретения через 16 часов после введения (1 мкмоль/кг) относительный % уровень глюкозы составляет менее 80%. В одном аспекте данного изобретения через 16 часов после введения (1 мкмоль/кг) относительный % уровень глюкозы составляет менее 70%. В одном аспекте данного изобретения через 16 часов после введения (1 мкмоль/кг) относительный % уровень глюкозы составляет менее 60%.
В качестве примера, в конкретном аспекте данного изобретения через 16 часов после введения (1 мкмоль/кг) % значение относительного потребления пищи составляет менее 40%. В одном аспекте данного изобретения через 16 часов после введения (1 мкмоль/кг) % значение относительного потребления пищи составляет менее 30%. В одном аспекте данного изобретения через 16 часов после введения (1 мкмоль/кг) % значение относительного потребления пищи составляет менее 20%.
В качестве примера, в конкретном аспекте данного изобретения через 4 часа после введения (1 мкмоль/кг) относительный % уровень глюкозы составляет менее 80%. В одном аспекте данного изобретения через 4 часа после введения (1 мкмоль/кг) относительный % уровень глюкозы составляет менее 70%. В одном аспекте данного изобретения через 4 часа после введения (1 мкмоль/кг) относительный % уровень глюкозы составляет менее 60%.
В качестве примера, в конкретном аспекте данного изобретения через 4 часа после введения (1 мкмоль/кг) % значение относительного потребления пищи составляет менее 40%. В одном аспекте данного изобретения через 4 часа после введения (1 мкмоль/кг) % значение относительного потребления пищи составляет менее 30%. В одном аспекте данного изобретения через 4 часа после введения (1 мкмоль/кг) % значение относительного потребления пищи составляет менее 20%.
Фармакокинетический профиль
В соответствии с третьим функциональным аспектом соединения PYY согласно данному изобретению обладают улучшенными фармакокинетическими свойствами, такими как удлиненный конечный период полужизни и/или сниженный клиренс.
Удлиненный конечный период полужизни и/или сниженный клиренс означает, что рассматриваемое соединение медленнее выводится из организма. Для соединений согласно данному изобретению это влечет увеличенную продолжительность фармакологического эффекта.
Фармакокинетические свойства производных согласно изобретению могут быть соответствующим образом определены в фармакокинетических (PK) исследованиях in vivo. Такие исследования проводятся для оценки того, как фармацевтические соединения абсорбируются, распределяются и выводятся из организма, и как эти процессы влияют на концентрацию соединения в организме с течением времени.
В фазе поиска и доклинической разработки фармацевтического препарата для выполнения этой характеризации могут быть использованы модели на животных, таких как мыши, крысы, обезьяны, собаки или свиньи. Любая из этих моделей может быть использована для анализа фармакокинетических свойств производных согласно изобретению.
Оценка конечного периода полужизни и/или клиренса имеет важное значение для оценки режимов дозирования и является важным параметром при разработке лекарственных средств, оценке новых лекарственных соединений.
Фармакокинетический профиль - период полужизни in vivo у карликовых свиней
В соответствии с третьим функциональным аспектом производные согласно изобретению имеют улучшенные фармакокинетические свойства.
В конкретном воплощении фармакокинетические свойства могут быть определены как конечный период полужизни 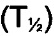 in vivo у карликовых свиней после внутривенного введения, например, как описано в примере 41 в данном документе.
in vivo у карликовых свиней после внутривенного введения, например, как описано в примере 41 в данном документе.
В одном из аспектов данного изобретения конечный период полужизни у карликовых свиней составляет по меньшей мере 10 часов. В одном из аспектов данного изобретения конечный период полужизни у карликовых свиней составляет по меньшей мере 20 часов. В одном из аспектов данного изобретения конечный период полужизни у карликовых свиней составляет по меньшей мере 40 часов.
Получение соединений PYY
Получение пептидов, таких как соединения PYY согласно данному изобретению, хорошо известно в данной области.
PYY-группировка производных согласно изобретению может, например, быть получена путем классического пептидного синтеза, например, твердофазного пептидного синтеза с использованием t-Boc- или Fmoc-химических групп, или с использованием других хорошо известных методик, см., например, Greene and Wuts, "Protective Groups in Organic Synthesis", John Wiley & Sons, 1999, Florencio Zaragoza  , "Organic Synthesis on solid Phase", Wiley-VCH Verlag GmbH, 2000, и "Fmoc Solid Phase Peptide Synthesis", Edited by W.C. Chan and P.D. White, Oxford University Press, 2000.
, "Organic Synthesis on solid Phase", Wiley-VCH Verlag GmbH, 2000, и "Fmoc Solid Phase Peptide Synthesis", Edited by W.C. Chan and P.D. White, Oxford University Press, 2000.
Дополнительно или альтернативно, они могут быть получены с помощью рекомбинантных способов, а именно путем культивирования клетки-хозяина, которая содержит последовательность ДНК, кодирующую аналог, и которая способна экспрессировать пептид в подходящей питательной среде в условиях, допускающих экспрессию пептида. Неограничивающие примеры клеток-хозяев, подходящих для экспрессии этих пептидов, включают: Escherichia coli, Saccharomyces cerevisiae, а также линии клеток млекопитающих BHK или СНО.
Соединения PYY согласно данному изобретению, которые включают неприродные аминокислоты и/или ковалентно присоединенные заместители, могут, например, быть получены, как описано в экспериментальной части.
Конкретные примеры способов получения ряда соединений PYY согласно изобретению включены в экспериментальную часть.
Очистка белка
Соединения PYY согласно данному изобретению могут быть очищены с помощью множества методик, известных в данной области, включая, но не ограничиваясь ими, хроматографию (например, ионообменную, аффинную, гидрофобную и обращенно-фазовую высокоэффективную жидкостную хроматографию (RP-HPLC)), электрофоретические процедуры или экстракцию (см., например, Protein Purification, J.-C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989).
Режим введения
Термин "лечение" включает как предупреждение, так и минимизацию рассматриваемого заболевания, нарушения или состояния (т.е. "лечение" относится как к профилактическому, так и к терапевтическому введению соединений PYY согласно данному изобретению или композиции, включающей соединения PYY согласно данному изобретению), если не указано иное, или если это явно не противоречит контексту.
Путь введения может быть любым путем, который эффективно транспортирует соединение согласно данному изобретению в желаемое или соответствующее место в организме, например, парентеральным, например, подкожным, внутримышечным или внутривенным. Альтернативно, соединение согласно данному изобретению можно вводить перорально, легочного, ректального, трансдермально, трансбуккально, подъязычно или назально.
Фармацевтические композиции
Инъекционные композиции, содержащие соединения PYY согласно данному изобретению, могут быть получены с использованием стандартных методик фармацевтической промышленности, которые включают растворение и смешивание ингредиентов таким образом, чтобы получить желаемый конечный продукт. Таким образом, в соответствии с одной процедурой соединение PYY согласно данному изобретению растворяют в подходящем буфере при подходящем pH, чтобы свести к минимуму осаждение или избежать его. Инъекционную композицию делают стерильной, например, путем стерильной фильтрации.
Композиция может представлять собой стабилизированный состав. Термин "стабилизированный состав" относится к составу с повышенной физической и/или химической стабильностью, предпочтительно с обеими. Как правило, состав должен быть стабильным в течение периода применения и хранения (в соответствии с рекомендуемыми условиями применения и хранения) до истечения срока годности.
Термин "физическая стабильность" относится к тенденции полипептида формировать биологически неактивные и/или нерастворимые агрегаты в результате воздействия термомеханического стресса и/или взаимодействия с дестабилизирующими границами раздела и поверхностями (например, гидрофобными поверхностями). Физическую стабильность водного полипептидного состава можно оценить путем визуального осмотра и/или измерения мутности после воздействия механической/физической нагрузки (например, встряхивания) при различных температурах в течение различных периодов времени. Альтернативно, физическую стабильность можно оценить с помощью спектроскопического агента или зонда конформационного состояния полипептида, такого как, например, тиофлавин Т или зонды "гидрофобного участка".
Термин "химическая стабильность" относится к химическим (в частности, ковалентным) изменениям в структуре полипептида, приводящим к образованию химических продуктов деградации, потенциально имеющих сниженную биологическую активность и/или повышенный иммуногенный эффект по сравнению с интактным полипептидом. Химическую стабильность можно оценить, измеряя количество продуктов химической деградации в различные временные точки после воздействия различных условий окружающей среды, например, с помощью эксклюзионная высокоэффективная жидкостная хроматография (эксклюзионная ВЭЖХ) и/или обращено-фазовая ВЭЖХ.
В одном из аспектов данное изобретение относится к соединениям PYY с повышенной физической стабильностью. В одном из аспектов данное изобретение относится к соединениям PYY с повышенной химической стабильностью.
Комбинированное лечение
Лечение соединением PYY в соответствии с данным изобретением также может быть объединено с одним или более чем один дополнительным фармакологически активным веществом, например, выбранным среди противодиабетических агентов, агентов против ожирения, агентов, регулирующих аппетит, антигипертензивных агентов, агентов для лечения и/или профилактики осложнений, вызванных или связанных с диабетом, и агентов для лечения и/или профилактики осложнений и нарушений, обусловленных или связанных с ожирением.
Примерами таких фармакологически активных веществ являются: агонисты рецептора GLP-1 (глюкагоноподобный пептид-1, от англ. glucagon-like peptide-1), инсулин, ингибиторы DPP-IV (дипептидилпептидазы-IV), агонисты амилина и агонисты рецептора лептина.
В одном аспекте данного изобретения соединение PYY в соответствии с данным изобретением объединено с агонистом GLP-1. Соединения могут поставляться в одной лекарственной форме, где одна лекарственная форма содержит оба соединения, либо в виде набора из нескольких частей, включающего препарат соединения PYY в качестве первой стандартной лекарственной формы и препарат агониста GLP-1 в качестве второй стандартной лекарственной формы.
Неограничивающие примеры агонистов GLP-1, которые будут объединены с соединениями PYY согласно данному изобретению, включают лираглутид, семаглутид, эксенатид, дулаглутид, ликсисенатид, таспоглутид и албиглутид.
Лираглутид, моноацилированное производное GLP-1 для введения один раз в день, которое поставляется как 2009 Novo Nordisk A/S, раскрыто в WO 98/08871, пример 37.
В WO 2006/097537 раскрыты дополнительные производные GLP-1, включая семаглутид (пример 4), моноацилированное производное GLP-1 для введения один раз в неделю, который находится в стадии разработки Novo Nordisk A/S.
Эксенатид представляет собой синтетический вариант эксендина-4, гормона, найденного в слюне Gila monster. Он демонстрирует биологические свойства, аналогичные GLP-1.
Дулаглутид представляет собой конструкцию GLP-1-Fc (GLP-1 - линкер - Fc из lgG4).
Ликсисенатид основан на эксендине-4 (1-39), модифицированном с C-конца шестью остатками Lys.
Таспоглутид представляет собой 8-(2-метилаланин)-35-(2-метилаланин)-36-L-аргининамидное производное с аминокислотной последовательностью с 7 по 36 из человеческого GLP-1.
Албиглутид представляет собой гибридный белок рекомбинантного человеческого сывороточного альбумина (HSA) и GLP-1, вероятно, димер GLP-1, слитый с HSA. Пептид GLP-1, который является составной частью, представляет собой аналог, в котором Ala в позиции 8 был заменен на Gly.
Фармацевтические показания
Данное изобретение также относится к соединениям PYY согласно данному изобретению для применения в качестве лекарственного средства.
В конкретных аспектах изобретения соединения PYY изобретения может быть использовано для следующих медицинских применений:
(i) профилактика и/или лечение всех форм диабета, таких как гипергликемия, сахарный диабет 2 типа, нарушение толерантности к глюкозе, сахарный диабет 1 типа, инсулиннезависимый диабет, MODY (диабет взрослого типа у молодых, от англ. maturity onset diabetes in youth), гестационный диабет и/или снижение HbA1C;
(ii) задержка или предотвращение прогрессирования диабетического заболевания, например, прогрессирования сахарного диабета 2 типа, задержка прогрессирования нарушения толерантности глюкозы (IGT) в сахарный диабет 2 типа с необходимостью инсулина, и/или задержка прогрессирования сахарного диабета 2 типа без необходимости инсулина в сахарный диабет 2 типа с необходимостью инсулина;
(iii) улучшение функционирования β-клеток, например, снижение апоптоза β-клеток, усиление функции β-клеток и/или увеличение β-клеточной массы и/или восстановление чувствительности β-клеток к глюкозе;
(iv) профилактика и/или лечение нарушений пищевого поведения, таких как ожирение, например, за счет уменьшения потребления пищи, уменьшения массы тела, подавления аппетита, вызывания сытости; лечения или профилактики компульсивного переедания, булимии и/или ожирения, вызванного введением антипсихотического агента или стероидов; снижения моторики желудка; задержки опорожнения желудка; повышения физической подвижности; и/или профилактика и/или лечение заболеваний, сопутствующих ожирению, таких как остеоартрит и/или недержание мочи;
(v) профилактика и/или лечение осложнений диабета, таких как ангиопатия; нейропатия, в том числе периферическая нейропатия; нефропатия; или ретинопатия;
(vii) улучшение параметров липидного обмена, например, профилактика и/или лечение дислипидемии, снижение общего уровня липидов в сыворотке крови; повышение уровня ЛПВП (липопротеины высокой плотности); снижение уровня мелких плотных ЛПНП (липопротеины низкой плотности), снижение уровня ЛПОНП (липопротеины очень низкой плотности), снижение уровня триглицеридов, снижение уровня холестерина, снижение плазменных уровней липопротеина a (Lp(a)) в организме человека; ингибирование образования аполипопротеина а (аро(а)) in vitro и/или in vivo;
(vii) профилактика и/или лечение сердечно-сосудистых заболеваний; и/или
(viii) профилактика и/или лечение апноэ во сне.
Следующие показания являются особенно предпочтительными: сахарный диабет 2 типа и/или ожирение.
В одном аспекте в данном документе раскрывается способ изменения энергетического метаболизма у субъекта. Способ включает введение субъекту терапевтически эффективного количества соединения PYY согласно данному изобретению и изменение тем самым расхода энергии. Энергия сжигается во всех физиологических процессах. Организм может изменять скорость расхода энергии напрямую, модулируя эффективность этих процессов или изменяя число и характер происходящих процессов. Например, в процессе пищеварения организм затрачивает энергию на перемещение пищи через кишечник и на переваривание пищи, а в клетках эффективность клеточного метаболизма может быть изменена для продукции большего или меньшего тепла.
В одном аспекте в данном документе раскрывается способ, включающие любые или все манипуляции согласно точной схеме, описанной в данной заявке, которые изменяют потребление пищи, координационно и обоюдно изменяя расход энергии. Расход энергии является результатом клеточного метаболизма, синтеза белков, скорости обмена веществ, а также использования калорий. Таким образом, в этом воплощении периферическое введение приводит к повышенным затратам энергии и сниженной эффективности использования калорий. В одном из аспектов терапевтически эффективное количество соединения PYY согласно данному изобретению вводят субъекту, тем самым увеличивая расход энергии.
Хотя "ожирение" обычно определяется как индекс массы тела выше 30, для целей данного описания в рамки "ожирения" входит любой субъект, в том числе с индексом массы тела менее 30, который нуждается или желает уменьшить массу тела. Не ограничиваясь какой-либо теорией, полагают, что эффекты периферически введенных соединений PYY согласно данному изобретению, которые заключаются в снижении потребления пищи, в задержке опорожнения желудка, в уменьшении доступности питательных веществ, а также причина потери веса определяются взаимодействием с одним или более чем одним уникальным классом рецепторов из семейства РР или аналогичных таковым. Более конкретно, очевидно, что вовлечен рецептор или рецепторы, подобные PYY-предпочитающим (или Y2) рецепторам.
Конкретные воплощения
Далее данное изобретение описывается следующими неограничивающими воплощениями изобретения:
1. Соединение PYY, содержащее триптофан в позиции, соответствующей позиции 30 в hPYY(1-36) (SEQ ID NO 1), и максимум 10 аминокислотных модификаций по сравнению с hPYY(3-36), и его фармацевтически приемлемая соль.
2. Соединение PYY, содержащее триптофан в позиции, соответствующей позиции 30 в hPYY(1-36) (SEQ ID NO 1), и максимум 10 аминокислотных модификаций по сравнению с hPYY(3-36), или его фармацевтически приемлемая соль.
3. Соединение PYY согласно любому из предыдущих воплощений, также содержащее N(альфа)-метил-L-аргинин в позиции, соответствующей позиции 35 в hPYY(1-36) (SEQ ID NO 1).
4. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY содержит N(альфа)-метил-L-аргинин в позиции, соответствующей позиции 35 в hPYY(1-36) (SEQ ID NO 1).
5. Соединение PYY согласно любому из предыдущих воплощений, также содержащее глутамин в позиции, соответствующей позиции 18 в hPYY(1-36) (SEQ ID NO 1).
6. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY содержит глутамин в позиции, соответствующей позиции 18 в hPYY(1-36)(SEQ ID NO 1).
7. Соединение PYY согласно любому из предыдущих воплощений, также содержащее аргинин в позиции, соответствующей позиции 4 в hPYY(1-36) (SEQ ID NO 1).
8. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY содержит аргинин в позиции, соответствующей позиции 4 в hPYY(1-36) (SEQ ID NO 1).
9. Соединение PYY согласно любому из предыдущих воплощений, также содержащее Aib в позиции, соответствующей позиции 28 в hPYY(1-36) (SEQ ID NO 1).
10. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY содержит Aib в позиции, соответствующей позиции 28 в hPYY(1-36) (SEQ ID NO 1).
11. Соединение PYY согласно любому из предыдущих воплощений, где позиции, соответствующие позициям 1 и 2 в hPYY(1-36) (SEQ ID NO 1), отсутствуют.
12. Соединение PYY согласно любому из предыдущих воплощений, где позиции, соответствующие позициям 1-3 в hPYY(1-36) (SEQ ID NO 1), отсутствуют.
13. Соединение PYY согласно любому из предыдущих воплощений, где позиции, соответствующие позициям 1-3 в hPYY(1-36) (SEQ ID NO 1), отсутствуют, и где соединение PYY также содержит N-концевой заместитель, где N-концевой заместитель представляет собой алкокси-группу, содержащую до 12 атомов углерода.
14. Соединение PYY согласно воплощению 13, где N-концевой заместитель представляет собой алкокси-группу, содержащую до 10 атомов углерода.
15. Соединение PYY согласно воплощению 13, где N-концевой заместитель представляет собой алкокси-группу, содержащую до 8 атомов углерода.
16. Соединение PYY согласно воплощению 13, где N-концевой заместитель представляет собой алкокси-группу, содержащую до 6 атомов углерода.
17. Соединение PYY согласно воплощению 13, где N-концевой заместитель представляет собой алкокси-группу, содержащую 6 атомов углерода.
18. Соединение PYY согласно воплощению 13, где N-концевой заместитель выбран среди 3-метилбутаноила, 3-метилпентаноила или гексаноила.
19. Соединение PYY согласно воплощению 13, где N-концевой заместитель представляет собой 3-метилбутаноил.
20. Соединение PYY согласно воплощению 13, где N-концевой заместитель представляет собой 3-метилпентаноил.
21. Соединение PYY согласно воплощению 13, где N-концевой заместитель представляет собой гексаноил.
22. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет максимум 8 аминокислотных модификаций по сравнению с hPYY(3-36).
23. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет максимум 6 аминокислотных модификаций по сравнению с hPYY(3-36).
24. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет минимум 4 аминокислотных модификаций по сравнению с hPYY(3-36).
25. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет минимум 6 аминокислотных модификаций по сравнению с hPYY(3-36).
26. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет минимум 8 аминокислотных модификаций по сравнению с hPYY(3-36).
27. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет от 4 до 10 аминокислотных модификаций по сравнению с hPYY(3-36).
28. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет от 6 до 8 аминокислотных модификаций по сравнению с hPYY(3-36).
29. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет от 4 до 6 аминокислотных модификаций по сравнению с hPYY(3-36).
30. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет 4 аминокислотных модификации по сравнению с hPYY(3-36).
31. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет 6 аминокислотных модификаций по сравнению с hPYY(3-36).
32. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет 8 аминокислотных модификаций по сравнению с hPYY(3-36).
33. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет по меньшей мере 70% идентичность последовательности с hPYY(3-36).
34. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет по меньшей мере 75% идентичность последовательности с hPYY(3-36).
35. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY имеет по меньшей мере 80% идентичность последовательности с hPYY(3-36).
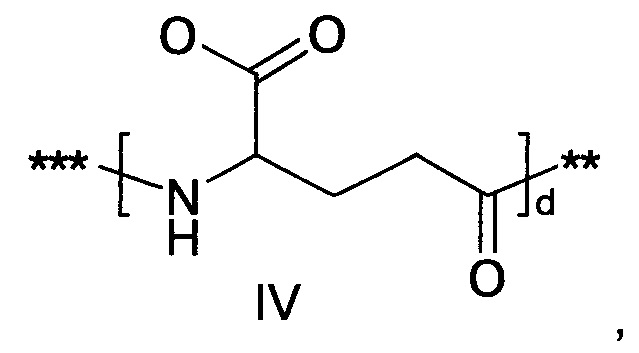
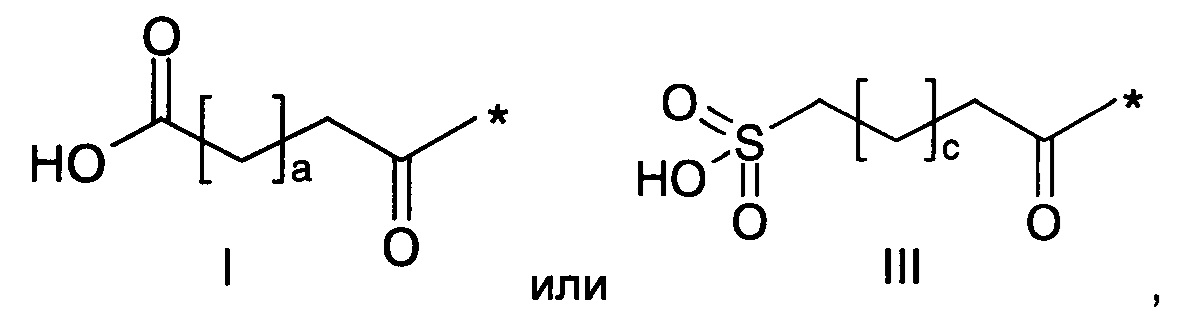
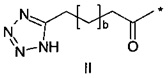
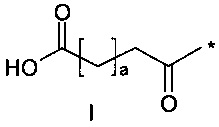
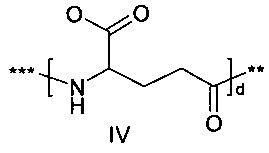
36. Соединение PYY согласно любому из предыдущих воплощений, также содержащее лизин в позиции, соответствующей позиции 7 в hPYY(1-36) (SEQ ID NO 1), и модифицирующую группу, присоединенную к эпсилон-аминогруппе остатка лизина в позиции 7, где указанная модифицирующая группа обозначена как А-В-C-, где А- содержит карбоновую кислоту, тетразол или сульфоновую кислоту
37. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY содержит лизин в позиции, соответствующей позиции 7 в hPYY(1-36) (SEQ ID NO 1), и модифицирующую группу, присоединенную к эпсилон-аминогруппе указанного лизина, где указанная модифицирующая группа обозначена как А-В-C-.
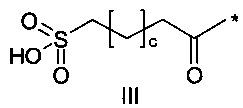
38. Соединение PYY согласно любому из воплощений с 36 по 37, где А-выбран среди
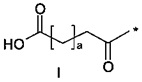 ,
, 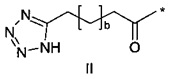 или
или 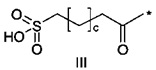 ,
,
где а представляет собой целое число от 12 до 19, b представляет собой целое число от 10 до 16, а с представляет собой целое число от 10 до 16, и где * обозначает точку присоединения к -В-.
39. Соединение PYY согласно воплощению 38, где а составляет 15, b составляет 13, а с составляет 13.
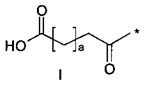
40. Соединение PYY согласно любому из воплощений с 36 по 37, где А- выбран среди
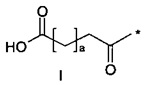 или
или 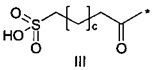 ,
,
где а представляет собой целое число от 12 до 19, с представляет собой целое число от 10 до 16, и где * обозначает точку присоединения к -В-.
41. Соединение PYY согласно воплощению 40, где а составляет 15, а с составляет 13.
42. Соединение PYY согласно любому из воплощений с 36 по 37, где А- представляет собой
 ,
,
где а представляет собой целое число от 12 до 19, и где * обозначает точку присоединения к -В-.
43. Соединение PYY согласно воплощению 42, где а составляет 15.
44. Соединение PYY согласно любому из воплощений с 36 по 37, где А- представляет собой
 ,
,
где b представляет собой целое число от 10 до 16, и где * обозначает точку присоединения к -В-.
45. Соединение PYY согласно воплощению 44, где b составляет 13.
46. Соединение PYY согласно любому из воплощений с 36 по 37, где А- представляет собой
 ,
,
где с представляет собой целое число от 10 до 16, и где * обозначает точку присоединения к -В-.
47. Соединение PYY согласно воплощению 46, где с представляет собой 13.
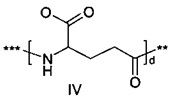
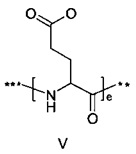
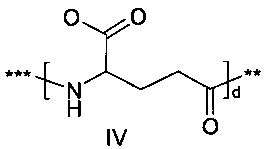
48. Соединение PYY согласно любому из воплощений с 36 по 47, где В- выбран среди
 ,
,  или
или 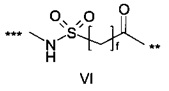 ,
,
где d составляет 1 или 2; е составляет 1 или 2; a f составляет 2, 3 или 4; и где *** обозначает точку присоединения к А-, а ** обозначает точку присоединения к -C-.
49. Соединение PYY согласно воплощению 48, где В- выбран среди
 или
или 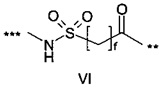 ,
,
где d составляет 1 или 2; a f составляет 2, 3 или 4; и где *** обозначает точку присоединения к А-, а ** обозначает точку присоединения к -C-.
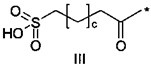
50. Соединение PYY согласно воплощению 49, где d составляет 1 или 2; а f составляет 3.
51. Соединение PYY согласно воплощению 48, где В- представляет собой
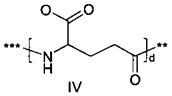
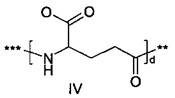 ,
,
где d составляет 1 или 2; и где *** обозначает точку присоединения к А-, а ** обозначает точку присоединения к -C-.
52. Соединение PYY согласно воплощению 48, где В- представляет собой
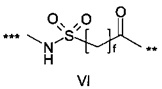 ,
,
где f составляет 2, 3 или 4; и где *** обозначает точку присоединения к А-, а ** обозначает точку присоединения к -C-.
53. Соединение PYY согласно воплощению 52, где f составляет 3.
54. Соединение PYY согласно любому из воплощений с 36 по 53, где -C- представляет собой
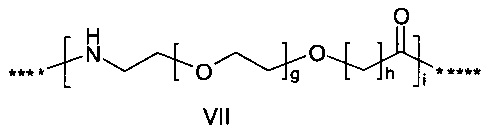 или
или
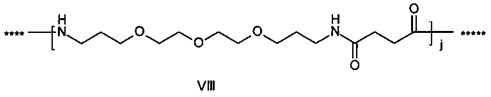 ,
,
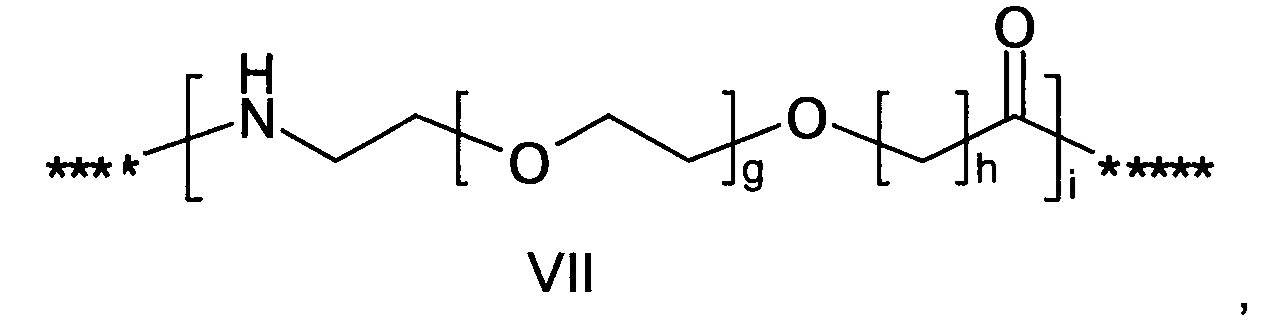
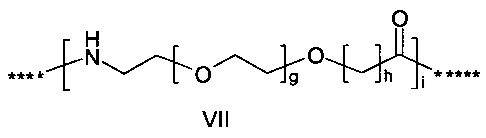
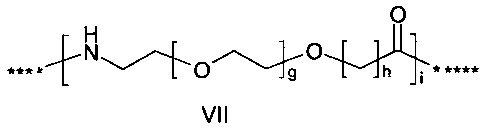
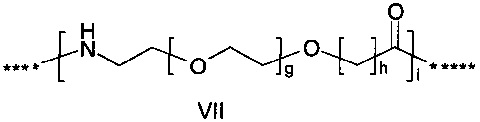
где g представляет собой целое число в диапазоне от 1 до 5, h представляет собой целое число в диапазоне от 1 до 5, i представляет собой целое число в диапазоне от 2 до 6, j представляет собой целое число в диапазоне от 2 до 6, и где **** обозначает точку присоединения к -В-, а ***** обозначает точку присоединения к эпсилон-аминогруппе остатка лизина в позиции, соответствующей позиции 7 в hPYY(1-36).
55. Соединение PYY согласно любому из воплощений с 36 по 53, где -C- представляет собой
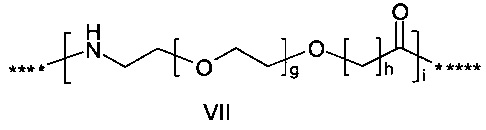 или
или
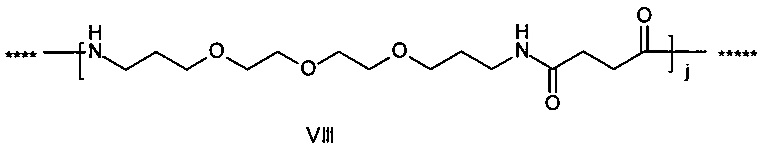 ,
,
где g представляет собой целое число в диапазоне от 1 до 5, h представляет собой целое число в диапазоне от 1 до 5, i представляет собой целое число в диапазоне от 2 до 6, j представляет собой целое число в диапазоне от 1 до 6, и где **** обозначает точку присоединения к -В-, а ***** обозначает точку присоединения к эпсилон-аминогруппе остатка лизина в позиции, соответствующей позиции 7 в hPYY(1-36).
56. Соединение PYY согласно любому из воплощений с 54 по 55, где каждый из g и h равен 1.
57. Соединение PYY согласно любому из воплощений с 54 по 56, где i выбран среди 2, 3, 4 или 5, a j выбран среди 1, 2 или 3.
58. Соединение PYY согласно любому из воплощений с 36 по 53, где -C- представляет собой
 ,
,
где g представляет собой целое число в диапазоне от 1 до 5, h представляет собой целое число в диапазоне от 1 до 5, i представляет собой целое число в диапазоне от 2 до 6, и где **** обозначает точку присоединения к -В-, а ***** обозначает точку присоединения к эпсилон-аминогруппе остатка лизина в позиции, соответствующей позиции 7 в hPYY(1-36).
59. Соединение PYY согласно воплощению 58, где каждый из g и h равен 1.
60. Соединение PYY согласно любому из воплощений с 58 по 59, где i выбран среди 2, 4 или 6.
61. Соединение PYY согласно воплощению 60, где i составляет 2.
62. Соединение PYY согласно воплощению 60, где i составляет 4.
63. Соединение PYY согласно воплощению 60, где i составляет 6.
64. Соединение PYY согласно воплощению 58, где каждый из g и h равен 1, a i составляет 2.
65. Соединение PYY, где соединение PYY имеет максимум 10 аминокислотных модификаций по сравнению с hPYY(3-36), и где соединение PYY содержит
(i) триптофан в позиции, соответствующей позиции 30 в hPYY(1-36) (SEQ ID NO 1);
(ii) N(альфа)-метил-L-аргинин в позиции, соответствующей позиции 35 в hPYY(1-36) (SEQ ID NO 1);
(iii) глутамин в позиции, соответствующей позиции 18 в hPYY(1-36) (SEQ ID NO 1);
(iv) лизин в позиции, соответствующей позиции 7 в hPYY(1-36) (SEQ ID NO 1); и
(v) модифицирующую группу, присоединенную к эпсилон-аминогруппе указанного лизина, где указанная модифицирующая группа обозначена как А-В-C-, где:
А- выбран среди
 или
или 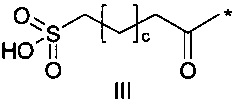
где а составляет 15, с составляет 13, и где * обозначает точку присоединения к -В-;
В- представляет собой
 ,
,
где d составляет 1 или 2; и где *** обозначает точку присоединения к А-, а ** обозначает точку присоединения к -C-; и
-C- представляет собой
 ,
,
где каждый из g и h равен 1, i выбран среди 2 или 4, и где **** обозначает точку присоединения к -В-, а ***** обозначает точку присоединения к эпсилон-аминогруппе остатка лизина в позиции, соответствующей позиции 7 в hPYY(1-36);
или его фармацевтически приемлемая соль.
66. Соединение PYY согласно воплощению 65, где соединение PYY содержит аргинин в позиции, соответствующей позиции 4 в hPYY(1-36) (SEQ ID NO 1).
67. Соединение PYY согласно любому из воплощений с 65 по 66, где позиции, соответствующие позициям 1 и 2 в hPYY(1-36) (SEQ ID NO 1), отсутствуют.
68. Соединение PYY согласно любому из воплощений с 65 по 67, где позиции; соответствующие позициям с 1 по 3 в hPYY(1-36) (SEQ ID NO 1), отсутствуют, и где соединение PYY также содержит N-концевой заместитель, где N-концевой заместитель выбран среди 3-метилбутаноила, 3-метилпентаноила или гексаноила.
69. Соединение PYY согласно любому из воплощений с 65 по 68, где соединение PYY имеет максимум 8 аминокислотных модификаций по сравнению с hPYY(3-36).
70. Соединение PYY, где соединение PYY имеет максимум 10 аминокислотных модификаций по сравнению с hPYY(3-36), где позиции, соответствующие позициям с 1 по 3 в hPYY(1-36) (SEQ ID NO 1), отсутствуют, и где соединение PYY содержит
(i) триптофан в позиции, соответствующей позиции 30 в hPYY(1-36) (SEQ ID NO 1);
(ii) N(альфа)-метил-L-аргинин в позиции, соответствующей позиции 35 в hPYY(1-36) (SEQ ID NO 1);
(iii) глутамин в позиции, соответствующей позиции 18 в hPYY(1-36) (SEQ ID NO 1);
(iv) лизин в позиции, соответствующей позиции 7 в hPYY(1-36) (SEQ ID NO 1);
(v) модифицирующую группу, присоединенную к эпсилон-аминогруппе указанного лизина, где указанная модифицирующая группа обозначена как А-В-C-, где
А- представляет собой
 ,
,
где с составляет 13, и где * обозначает точку присоединения к -В-;
В- представляет собой
 ,
,
где d составляет 1; и где *** обозначает точку присоединения к А-, а ** обозначает точку присоединения к -C-; и
-C- представляет собой
 ,
,
где каждый из g и h равен 1, i составляет 2, и где **** обозначает точку присоединения к -В-, а ***** обозначает точку присоединения к эпсилон-аминогруппе остатка лизина в позиции, соответствующей позиции 7 в hPYY(1-36);
(vi) аргинин в позиции, соответствующей позиции 4 в hPYY(1-36) (SEQ ID NO 1);и
(vii) N-концевой заместитель, где N-концевой заместитель выбран среди 3-метилбутаноила, 3-метилпентаноила или гексаноила;
или его фармацевтически приемлемая соль.
71. Соединение PYY согласно воплощению 70, где соединение PYY имеет максимум 8 аминокислотных модификаций по сравнению с hPYY(3-36).
71а. Соединение PYY согласно воплощению 70, где соединение PYY имеет 6 аминокислотных модификаций по сравнению с hPYY(3-36).
72. Соединение PYY согласно любому из предыдущих воплощений, где соединение PYY не является солью.
73. Соединение PYY согласно любому из предыдущих воплощений, выбранное среди следующих:
[Trp30]hPYY(3-36) (SEQ ID NO 3)
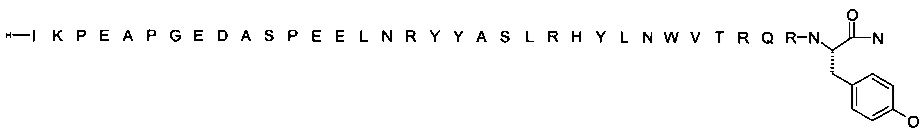
; [Trp30,NMeArg35]hPYY3-36 (SEQ ID NO 4)
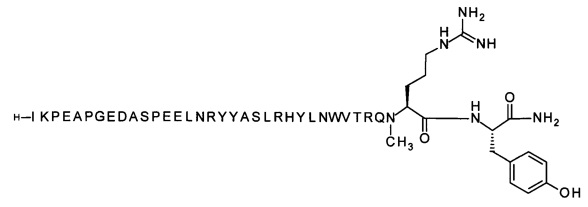
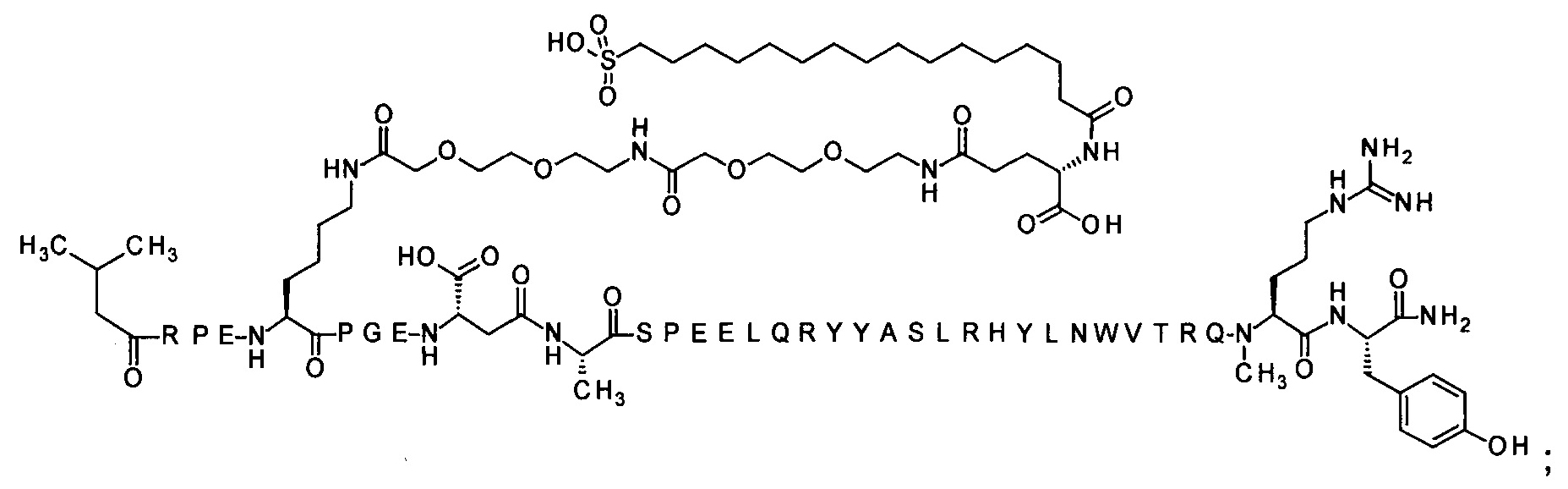
; 7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 5)
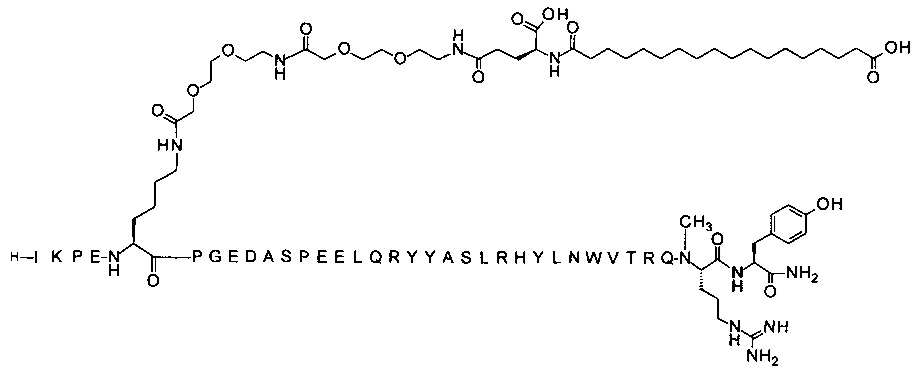
; 7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]бутаноил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 6)
 ;
;
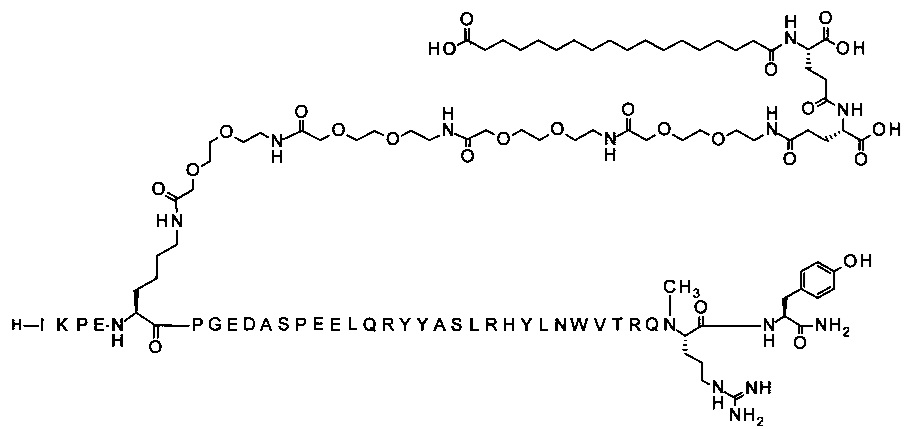
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 7)
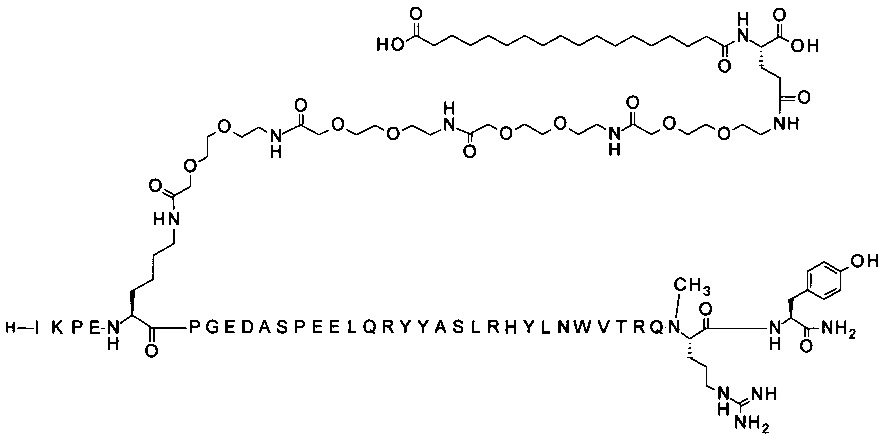 ;
;
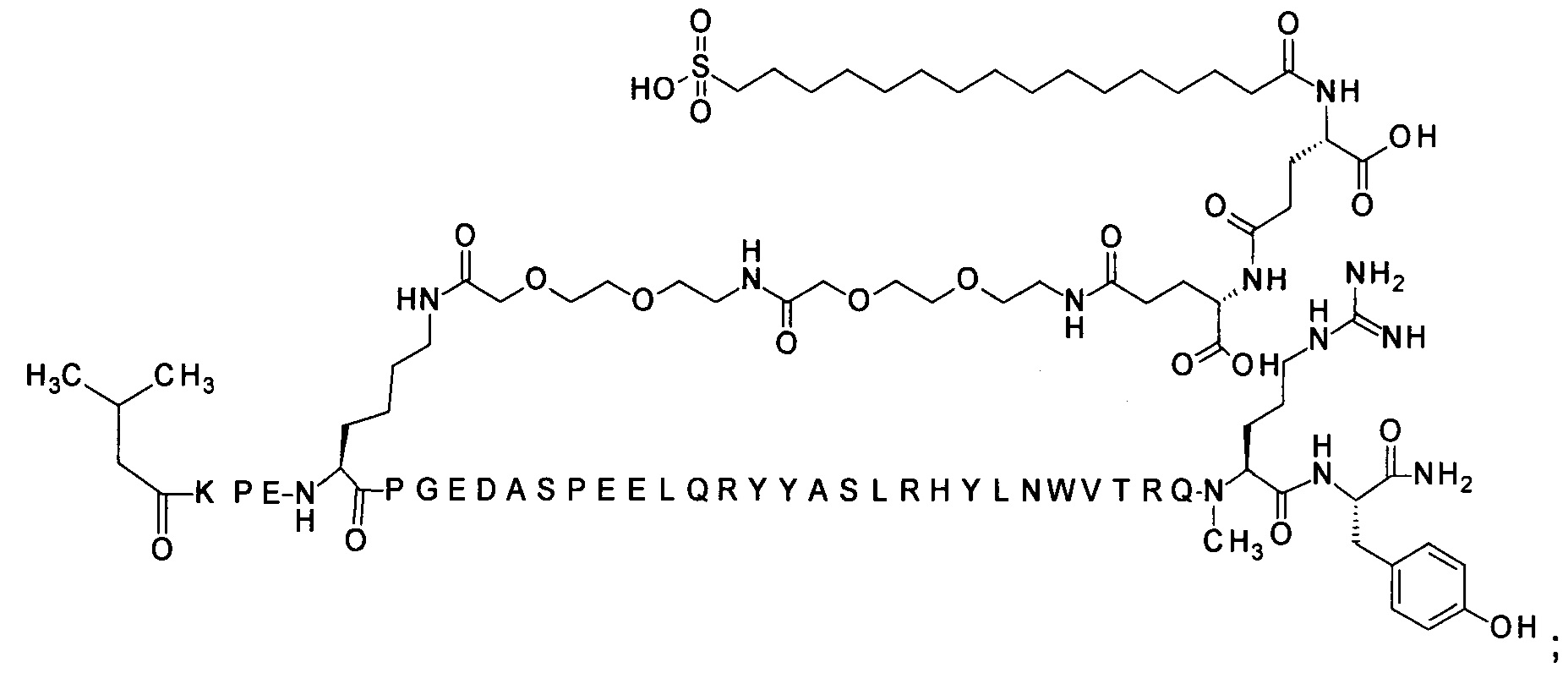
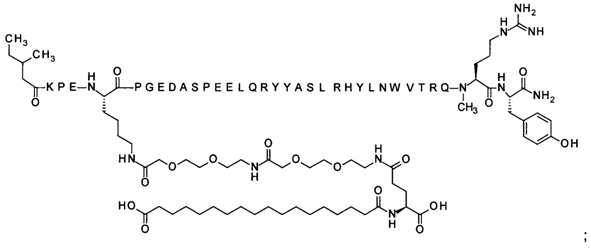
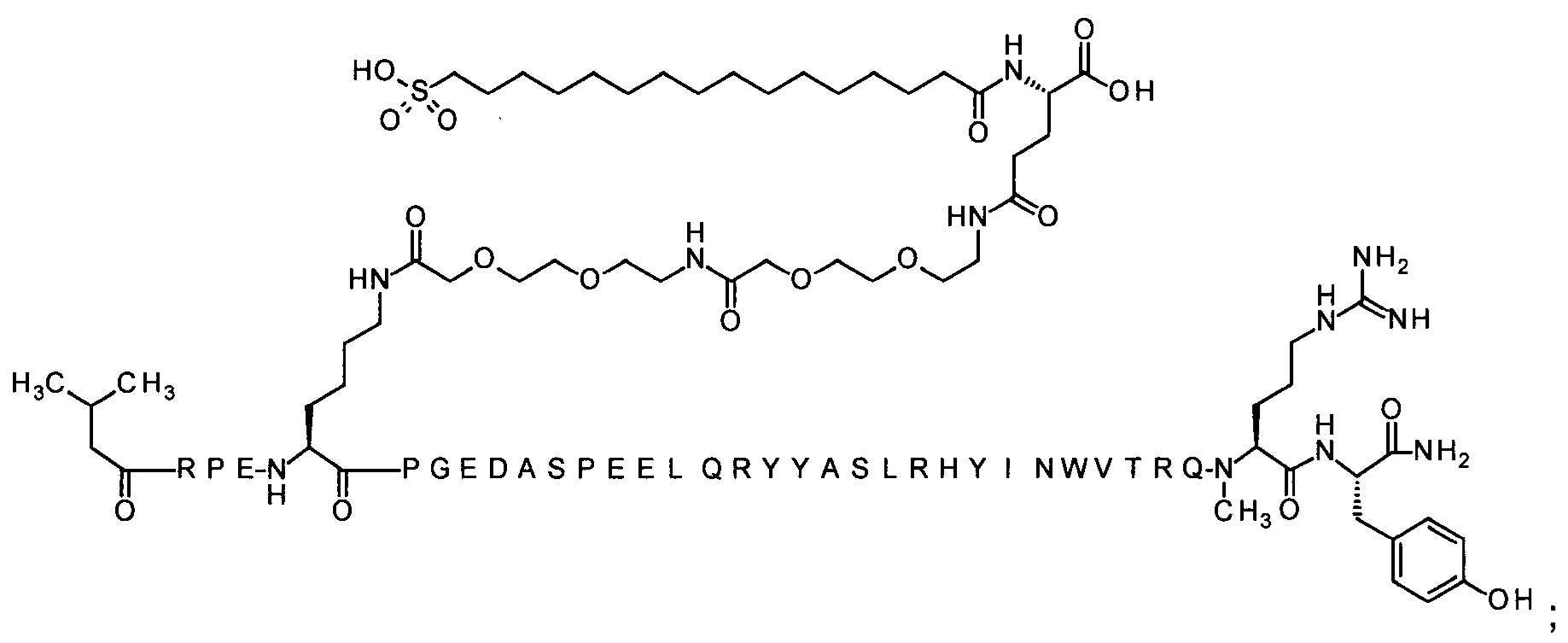
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 8)
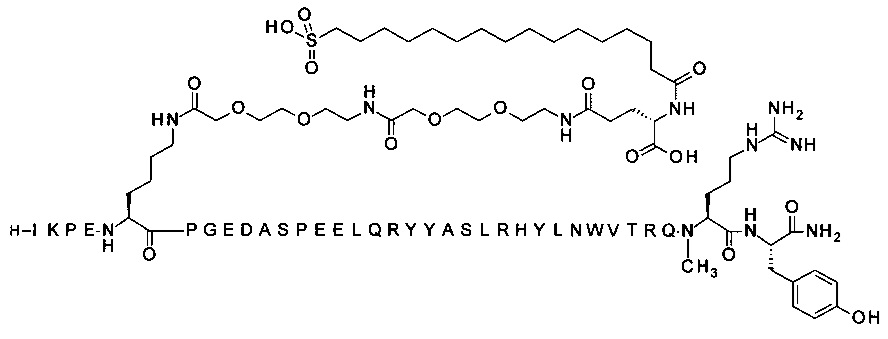 ;
;
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[4-[16-(1Н-тетразол-5-ил)-гексадеканоилсульфамоил]бутаноиламино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18, Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 9)
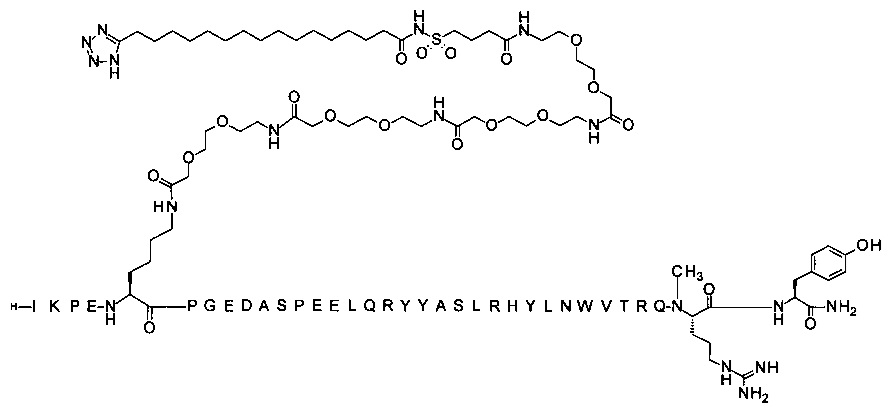 ;
;
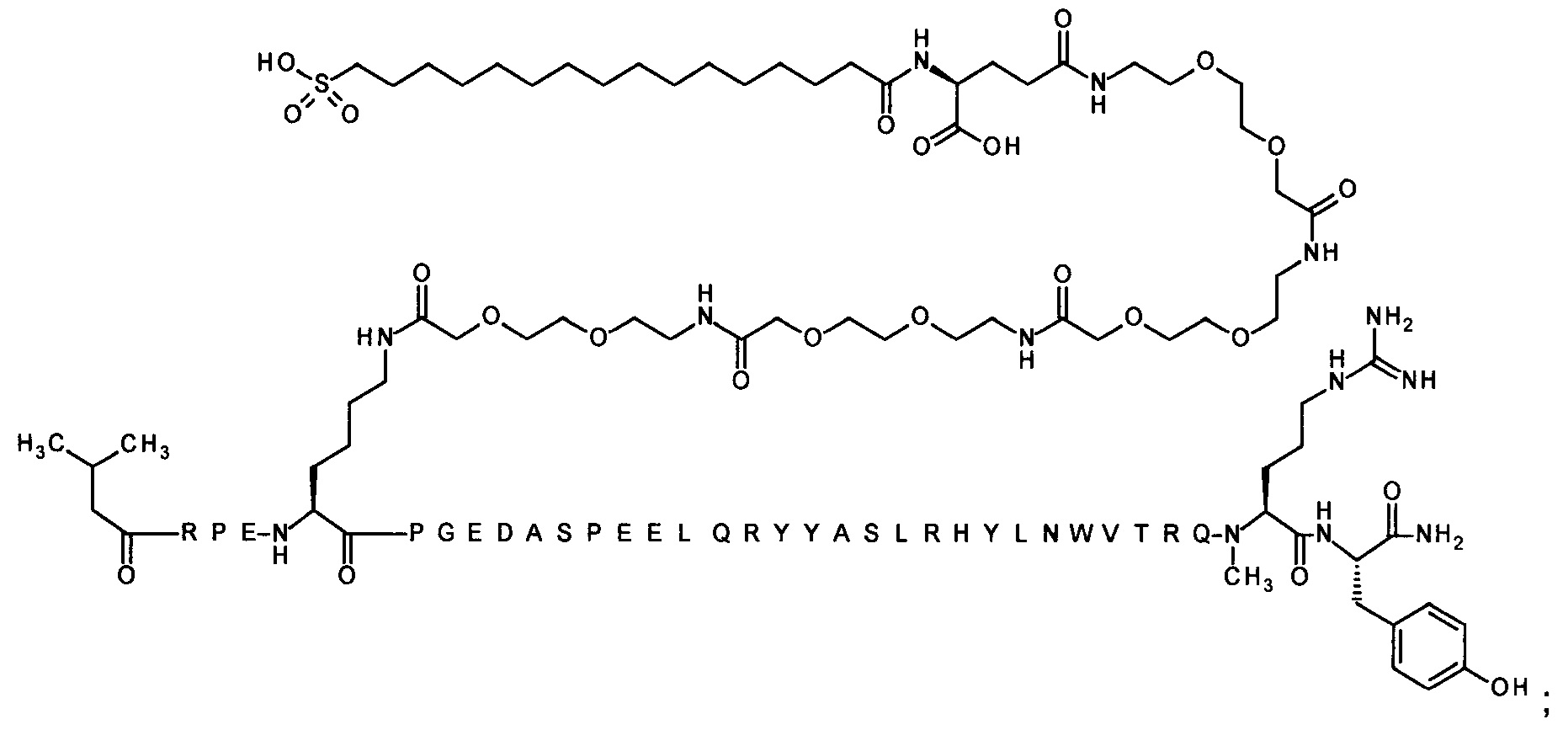
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]бутаноил]-амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Aib28,Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 10)
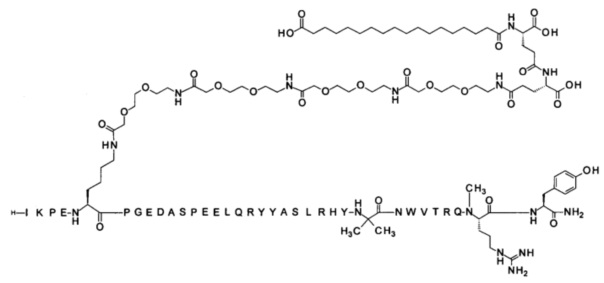 ;
;
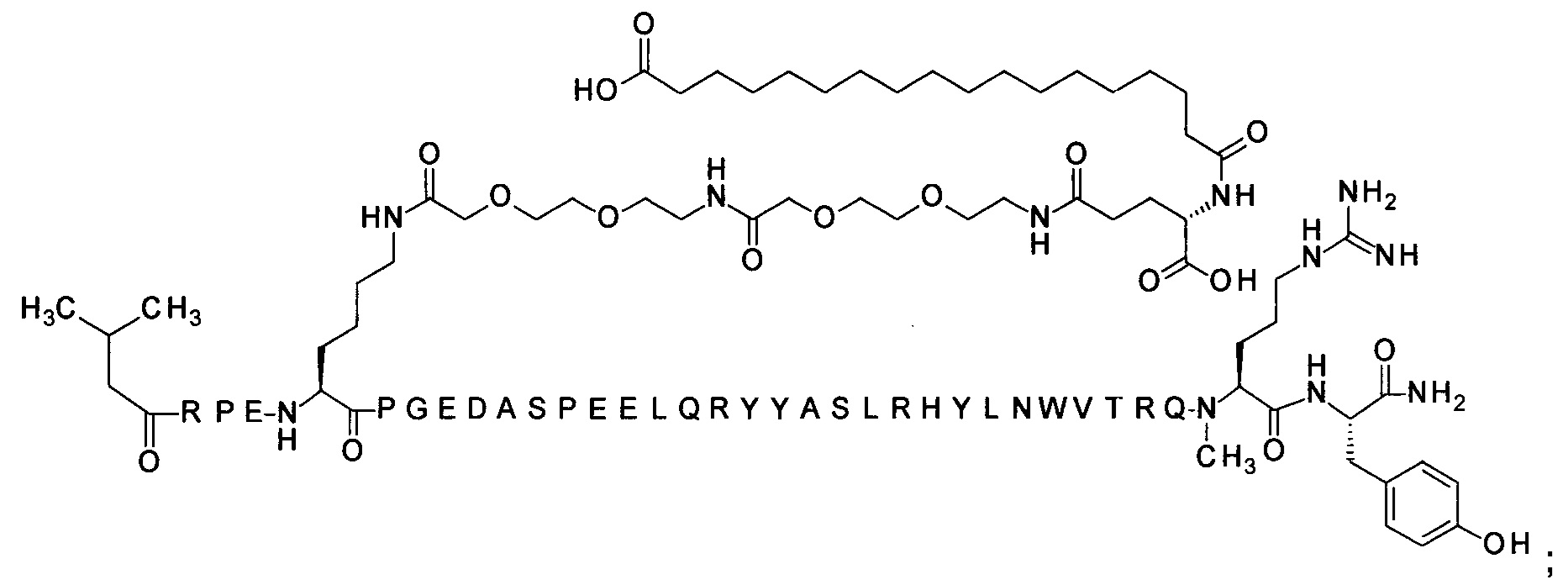
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg4,Lys7,Cln18, Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 11)
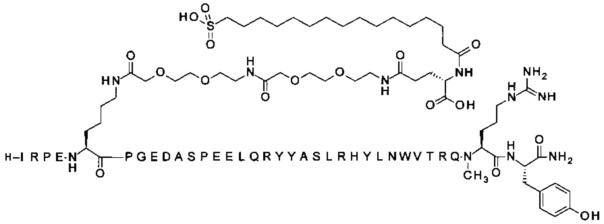 ;
;
4-N{альфа}-(гексаноил)-7-N{Эпсилон}-2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 12)
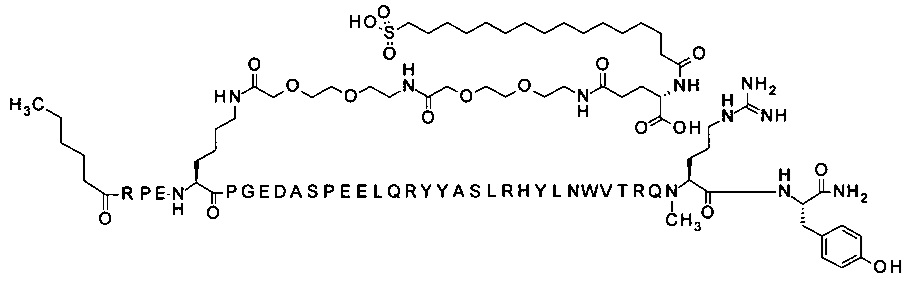 ;
;
4-N{альфа}-(3-метил-пентаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 13)
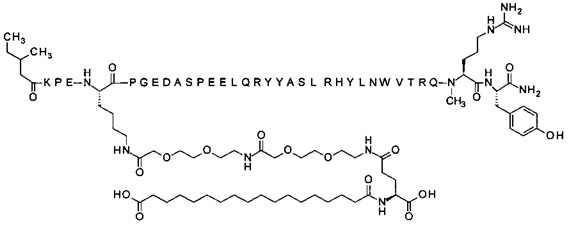 ;
;
4-N{альфа}-(3-метил-пентаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 14)
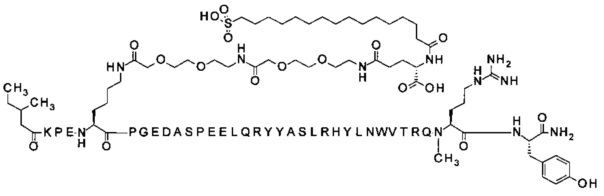 ;
;
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]бутаноил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 15)
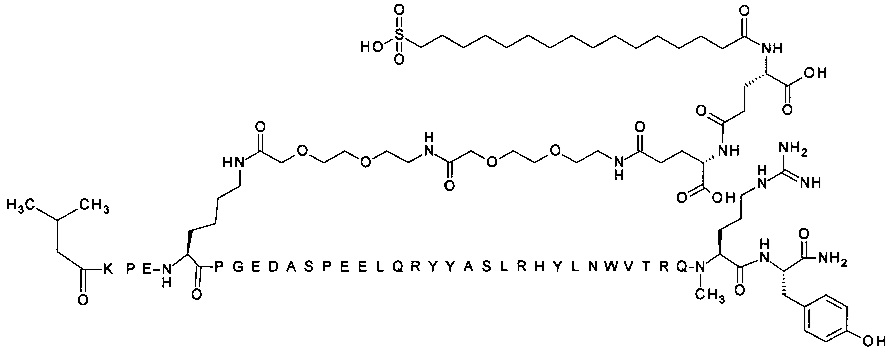 ;
;
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 16)
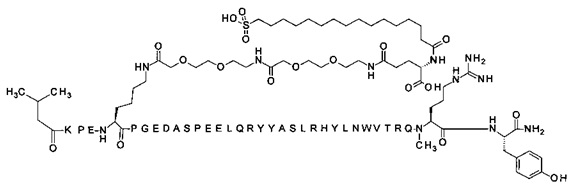 ;
;
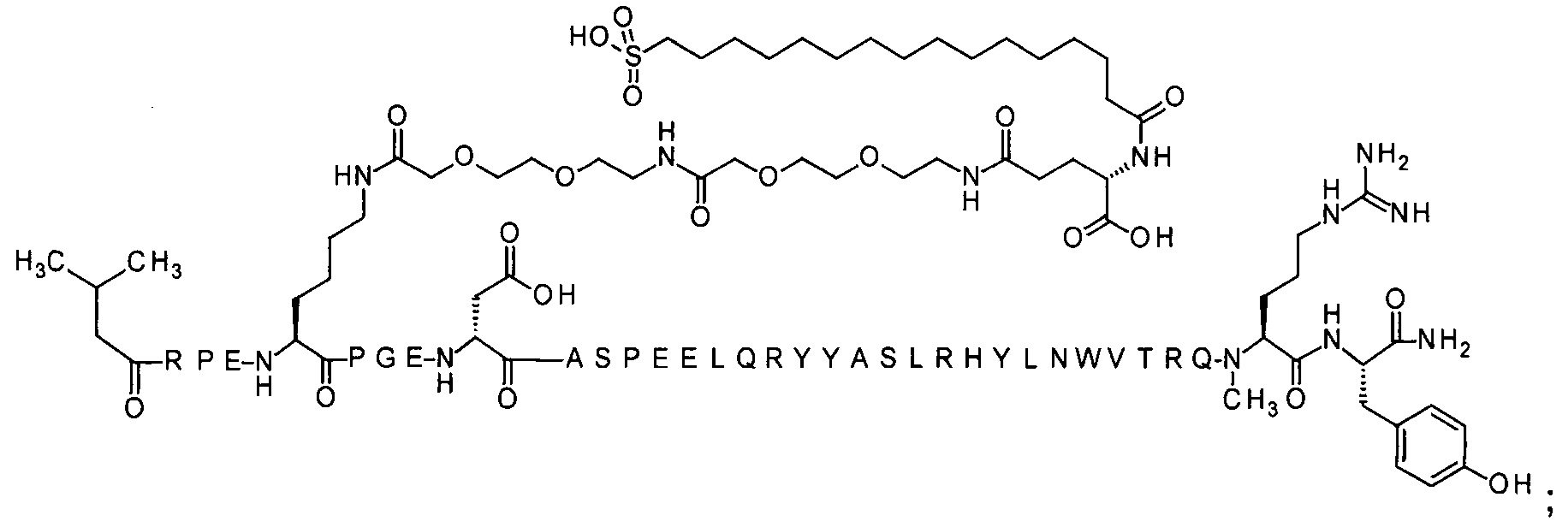
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]-амино]этокси]этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30]hPYY(4-36) (SEQ ID NO 17)
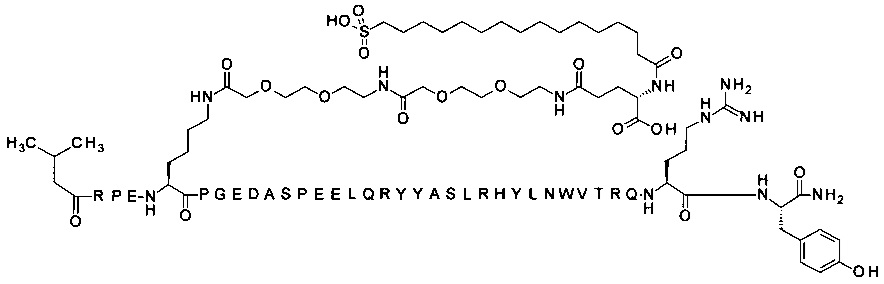 ;
;
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Cln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 18)
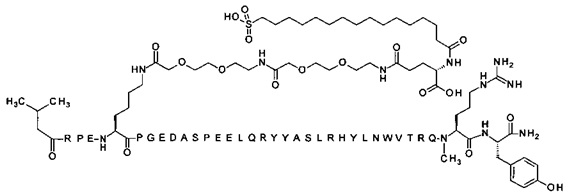 ;
;
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 19)
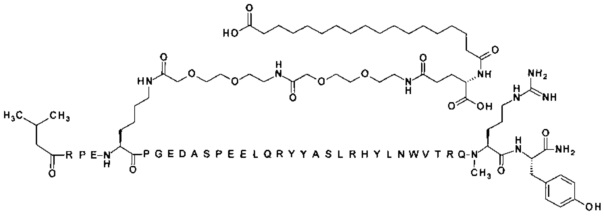 ;
;
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(14-сульфотетрадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 20)
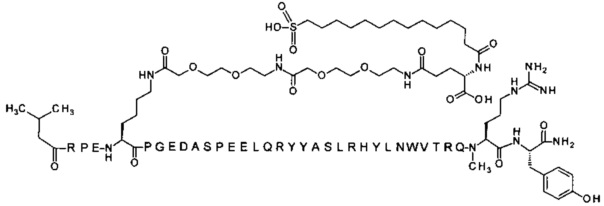
74. Соединение PYY согласно любому из предыдущих воплощений, выбранное среди следующих:
[Trp30]hPYY(3-36) (SEQ ID NO 3)
 ;
;
[Trp30,NMeArg35]hPYY3-36 (SEQ ID NO 4)
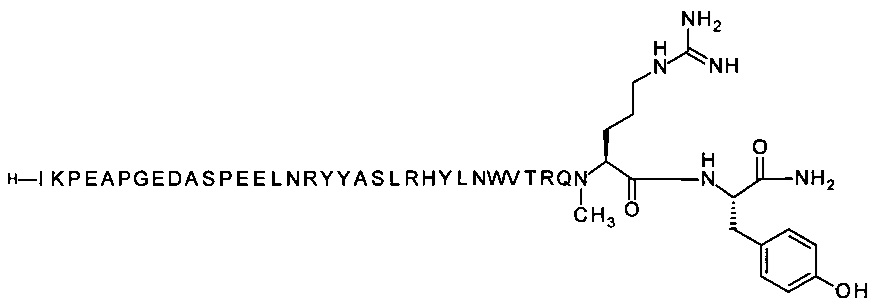 ;
;
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18, Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 5)
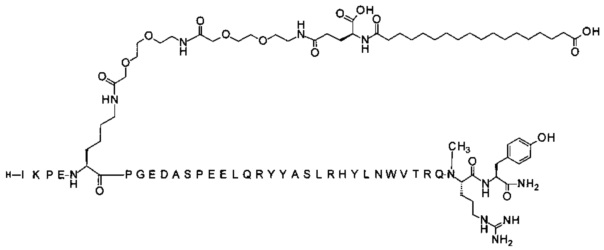 ;
;
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]бутаноил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 6)
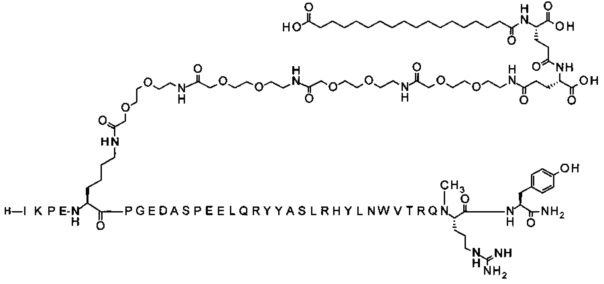 ;
;
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 7)
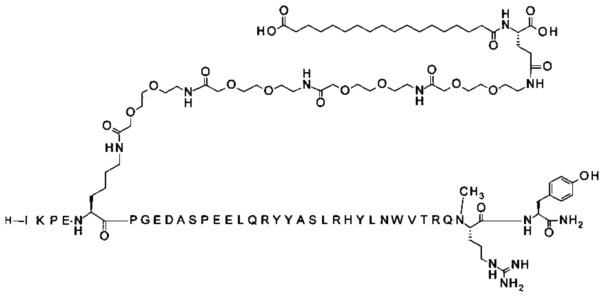 ;
;
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Trp30, NMeArg35]hPYY(3-36) (SEQ ID NO 8)
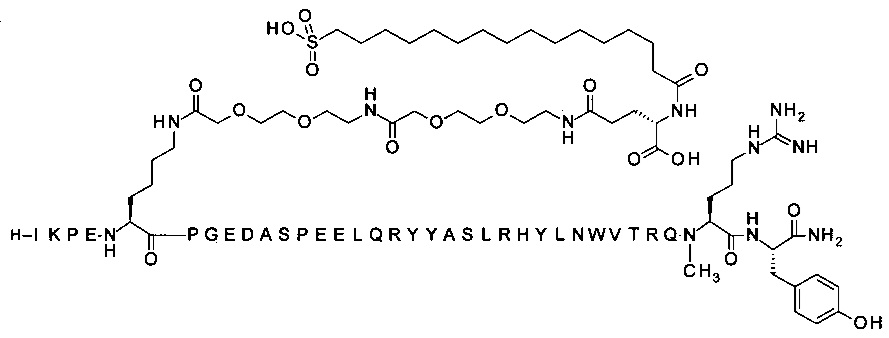 ;
;
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[4-[16-(1Н-тетразол-5-ил)-гексадеканоилсульфамоил]бутаноиламино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18, Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 9)
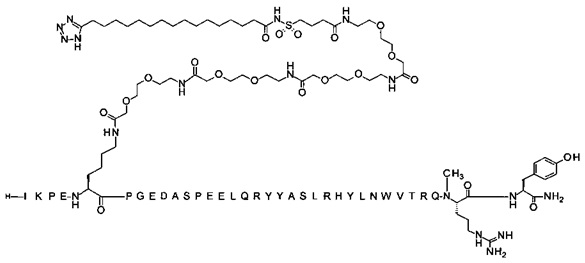
; 7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]бутаноил]-амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Aib28,Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 10)
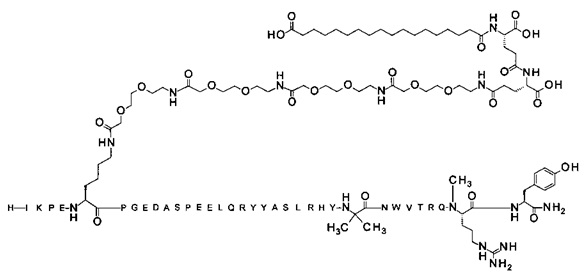
; 7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg4,Lys7,Cln18, Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 11)
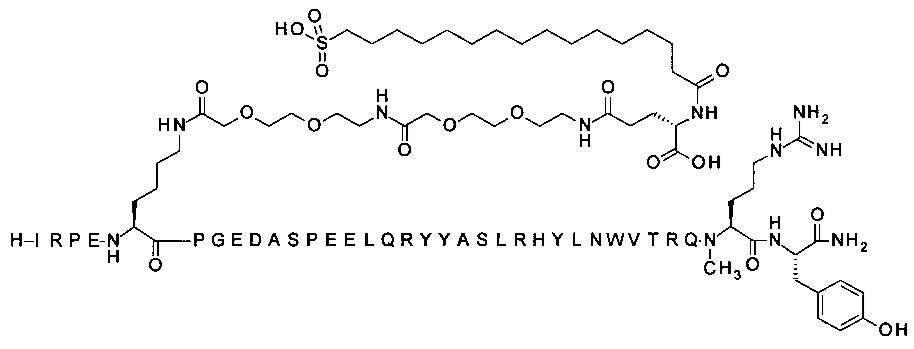
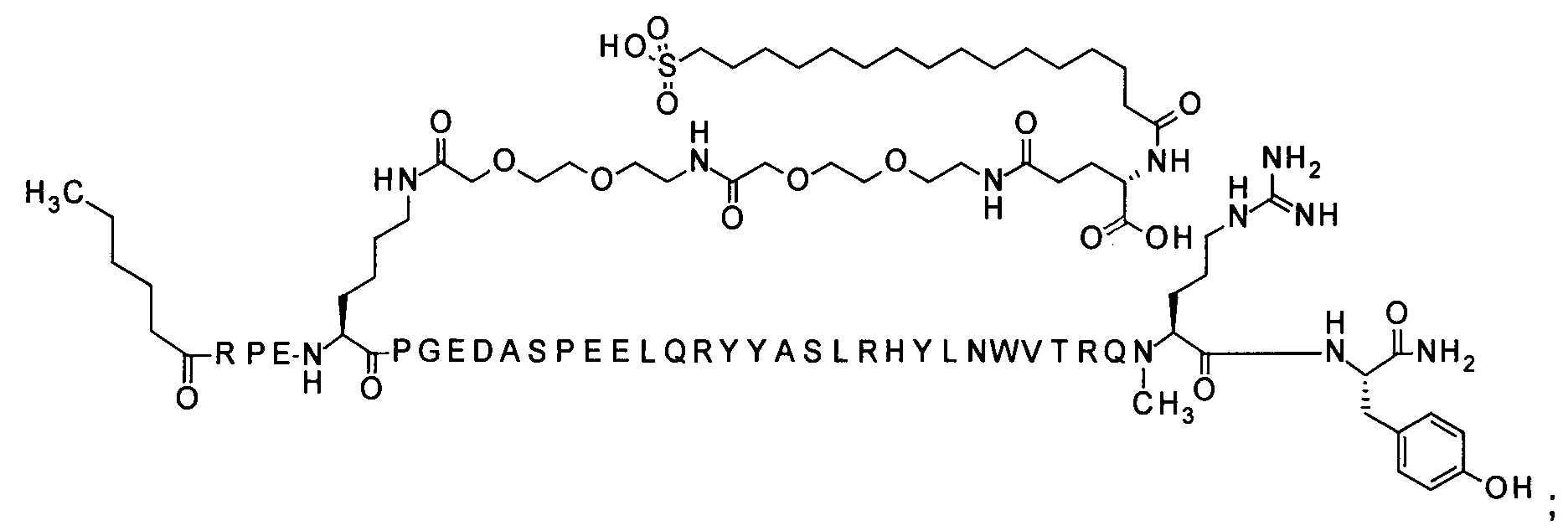
; 4-N{альфа}-(гексаноил)-7-N{Эпсилон}-2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 12)
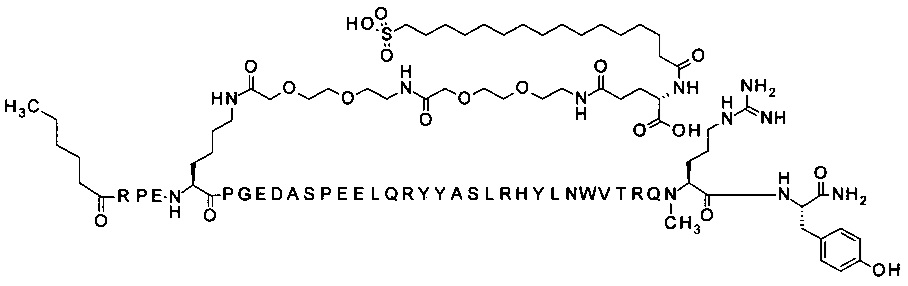
; 4-N{альфа}-(3-метил-пентаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 13)
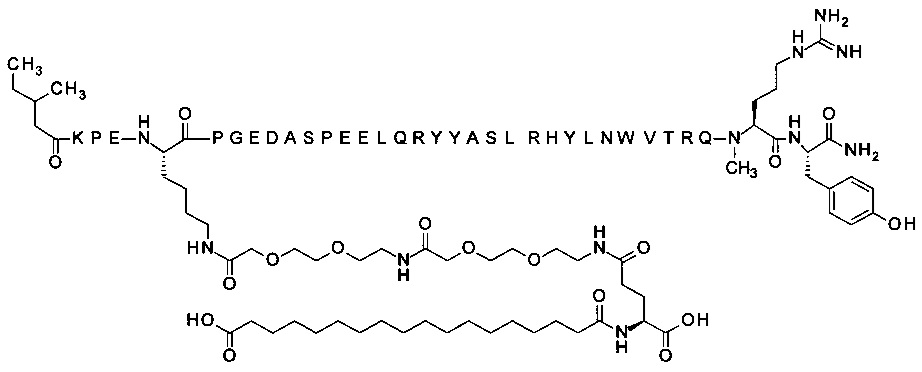
; 4-N{альфа}-(3-метил-пентаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 14)
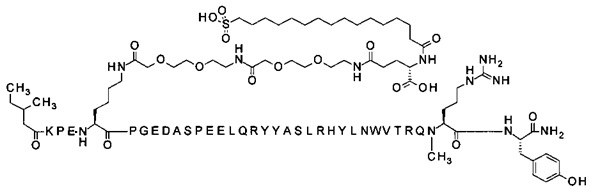
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]бутаноил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Cln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 15)
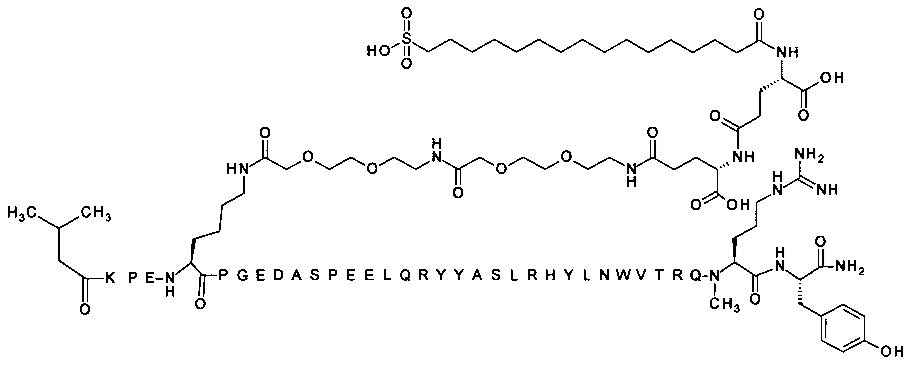
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 16)
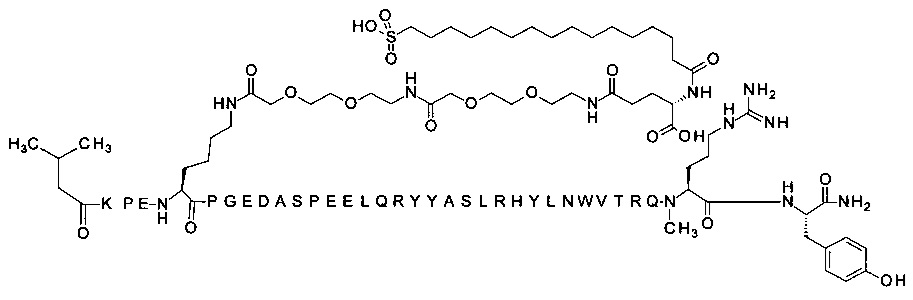
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]-амино]этокси]этокси]ацетил]-[Arg4,Lys7,Cln18,Trp30]hPYY(4-36) (SEQ ID NO 17)
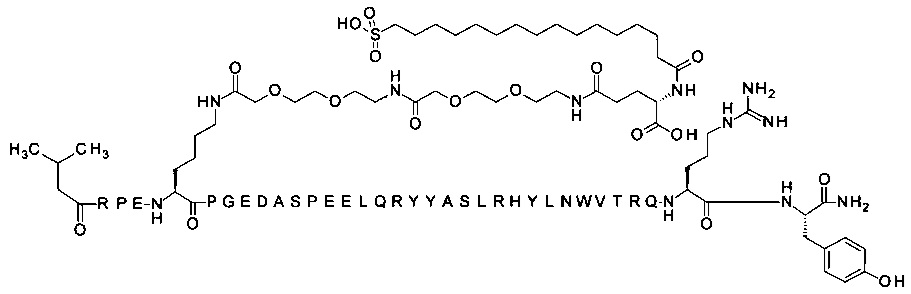
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 18)
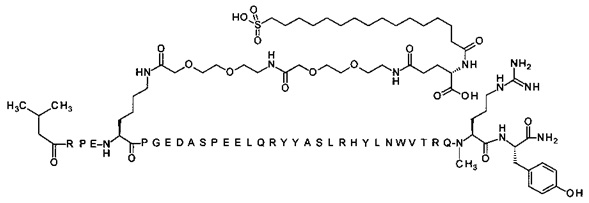
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 19)
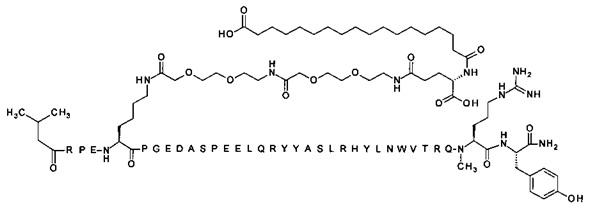
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(14-сульфотетрадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 20)
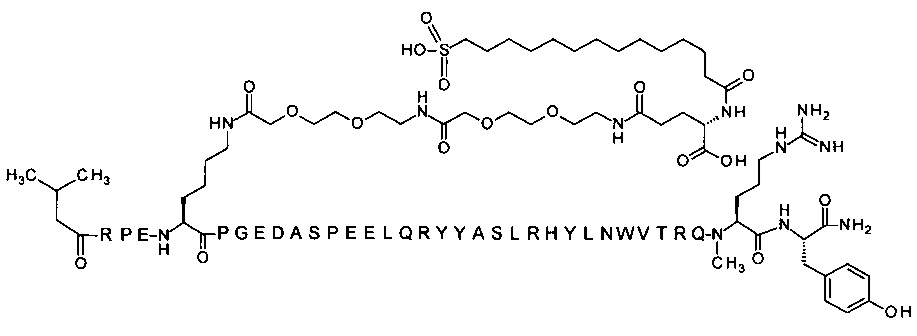
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-карбокси-гексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 21).
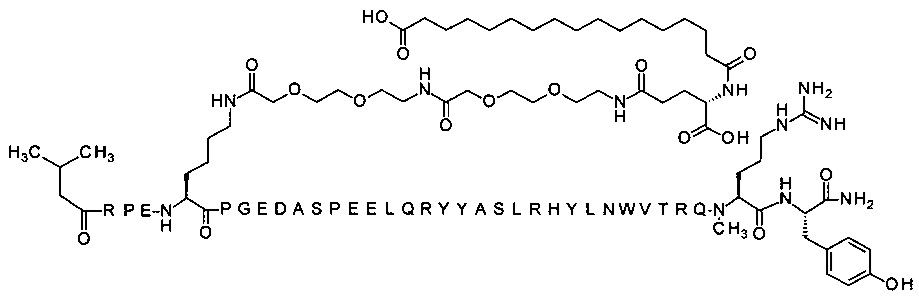
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(14-карбокси-тетраканоиламино)бутаноил]амино]этокси]этокси]ацетил]]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 22)
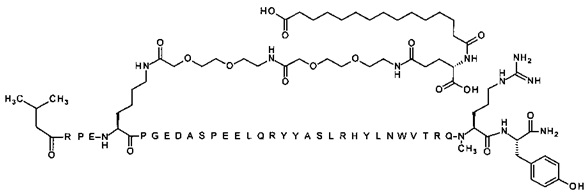
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Ile28,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 23)
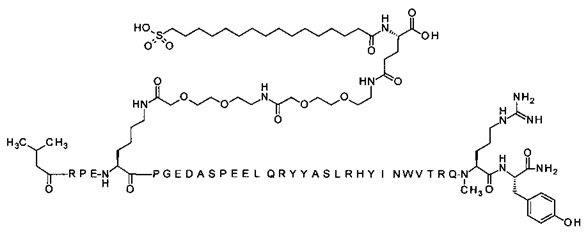
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]-амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 24)
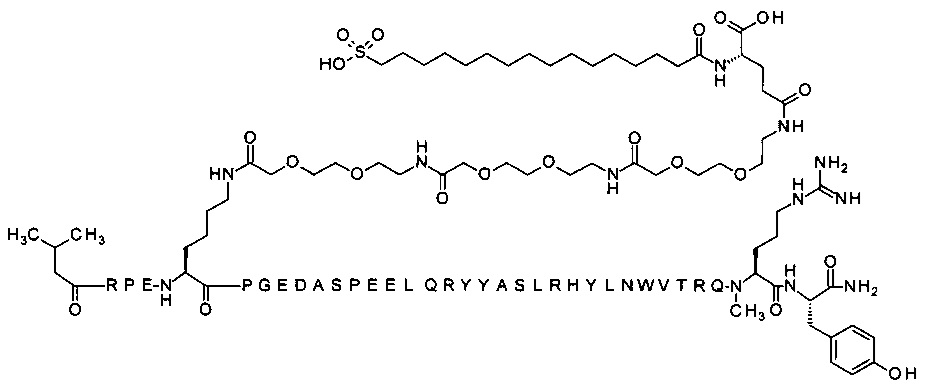
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]-этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 25)
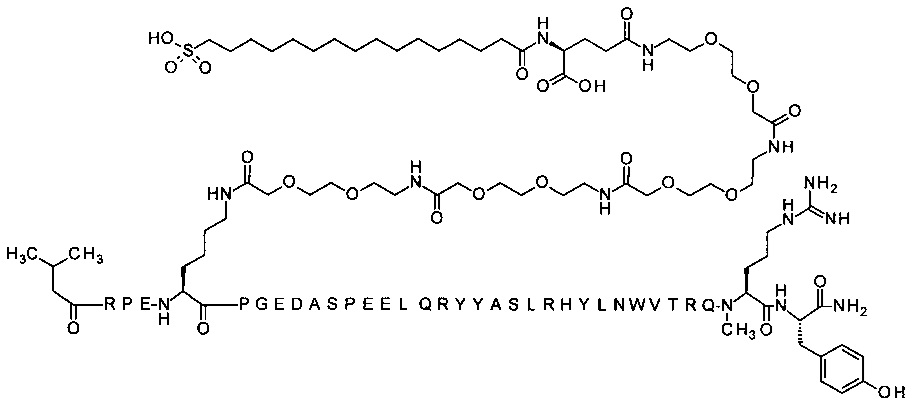
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 26)
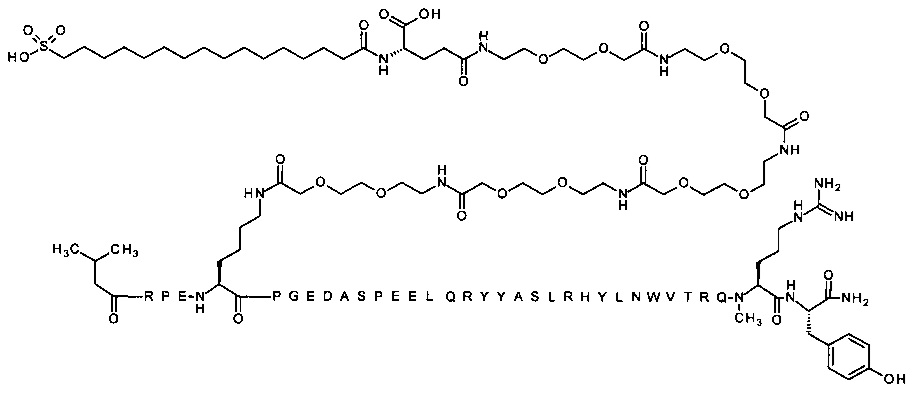
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[4-[3-[2-[2-[3-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]пропокси]этокси]этокси]пропиламино]-4-оксобутаноил]-[Arg4,Lys7,Cln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 27)
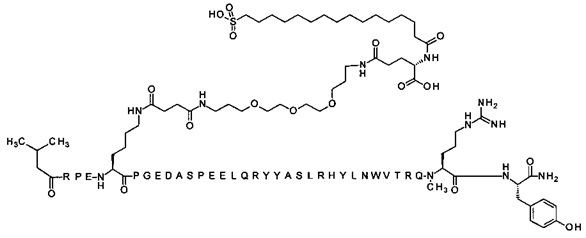
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[4-[3-[2-[2-[3-[[4-[3-[2-[2-[3-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]пропокси]этокси]-этокси]пропиламино]-4-оксобутаноил]амино]пропокси]этокси]этокси]пропиламино]-4-оксобутаноил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 28)
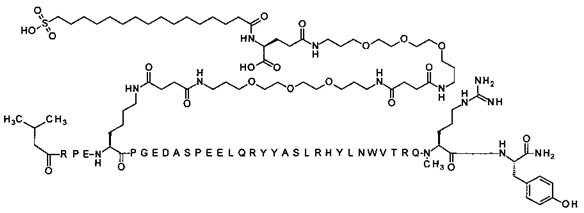
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[4-[3-[2-[2-[3-[[4-[3-[2-[2-[3-[[4-[3-[2-[2-[3-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]пропокси]-этокси]этокси]пропиламино]-4-оксобутаноил]амино]пропокси]этокси]-этокси]пропиламино]-4-оксобутаноил]амино]пропокси]этокси]этокси]пропиламино]-4-оксобутаноил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 29)
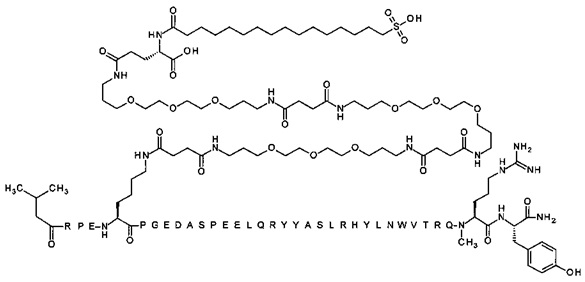
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[(2S)-2-амино-6-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]-амино]гексаноил]]-[Arg4,Lys7,Cln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 30)
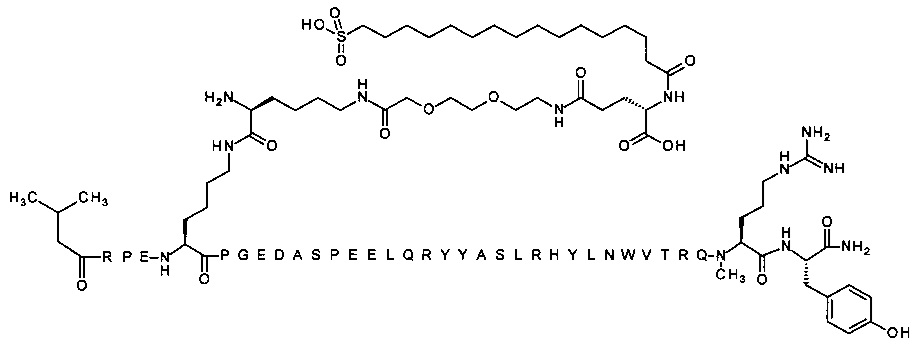
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 31)
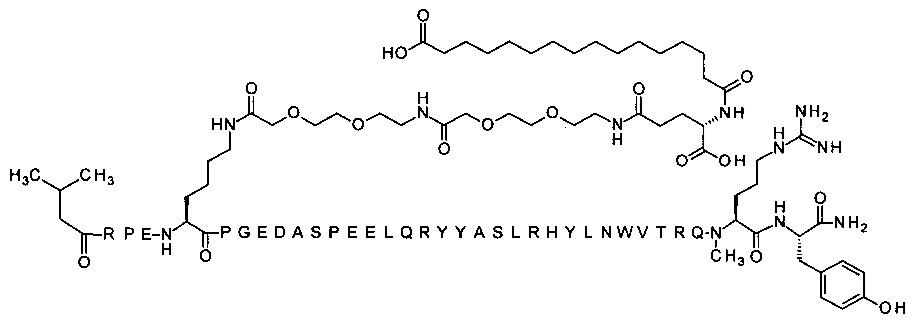
; 7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Val3,Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36) (SEQ ID NO 32)
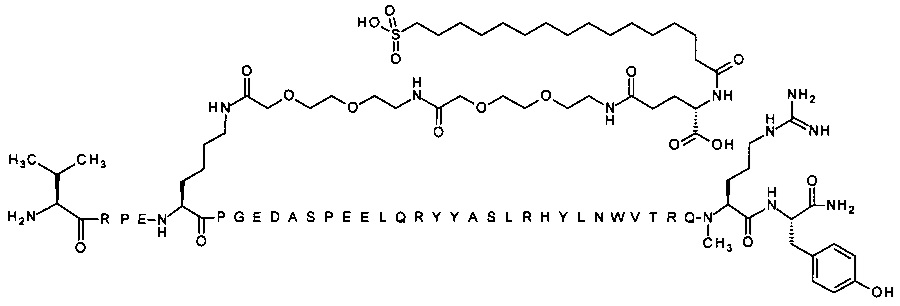
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,D-Asp11,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 33)
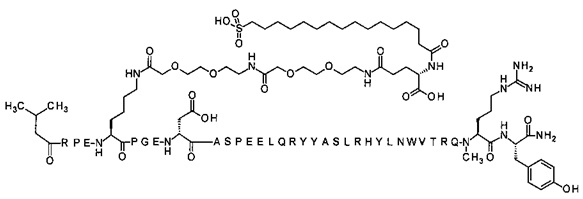
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,изоAsp11,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 34)
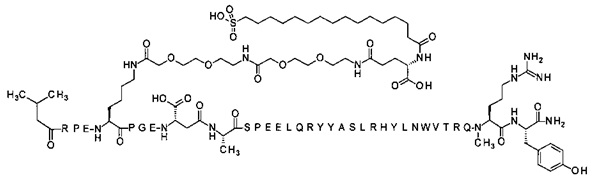
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,D-изоAsp11,Gln18,Trp30,NMeArg35]hPYY(4-36) (SEQ ID NO 35)
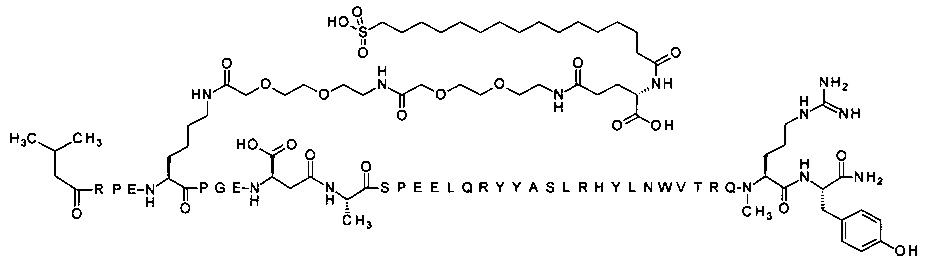
; 4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30]hPYY(4-36) (SEQ ID NO 36)
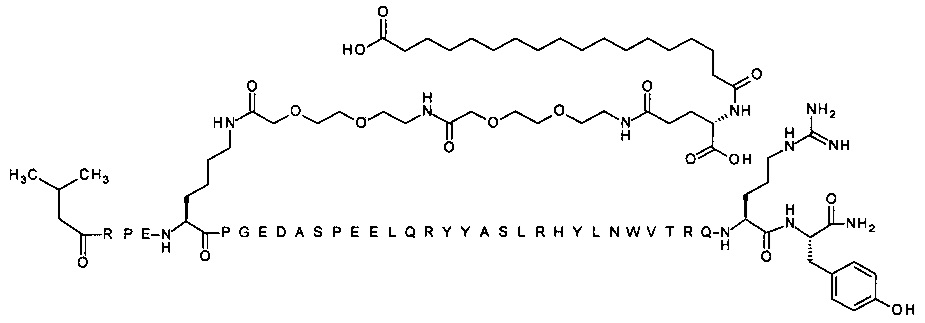
; 7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30]hPYY(3-36) (SEQ ID NO 37)
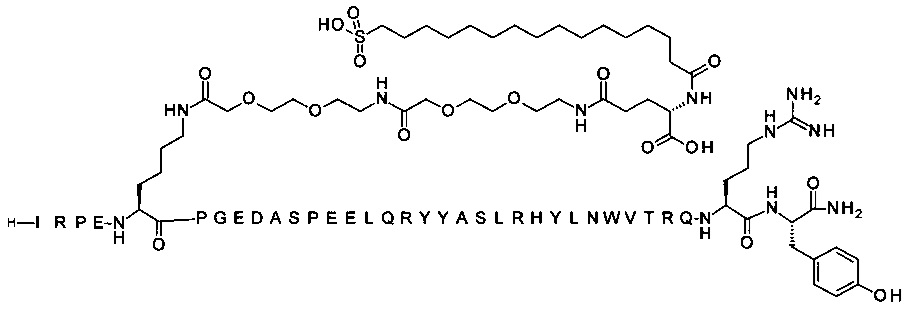
75. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 3.
76. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 4.
77. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 5.
78. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 6.
79. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 7.
80. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 8.
81. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 9.
82. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 10.
83. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 11.
84. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 12.
85. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 13.
86. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 14.
87. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 15.
88. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 16.
89. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 17.
90. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 18.
91. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 19.
92. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 20.
93. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 21.
94. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 22.
95. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 23.
96. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 24.
97. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 25.
98. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 26.
99. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 27.
100. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 28.
101. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 29.
102. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 30.
103. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 31.
104. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 32.
105. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 33.
106. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 34.
107. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 35.
108. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 36.
109. Соединение PYY согласно любому из воплощений 1 или 2, где соединение PYY представляет собой SEQ ID NO 37.
110. Соединение PYY согласно любому из предыдущих воплощений, которое является человеческим агонистом рецептора Y2.
111. Соединение PYY согласно любому из предыдущих воплощений, которое является полностью человеческим агонистом рецептора Y2.
112. Соединение PYY согласно любому из предыдущих воплощений, которое является селективным человеческим агонистом рецептора Y2.
113. Соединение PYY согласно любому из предыдущих воплощений, которое является селективным полностью человеческим агонистом рецептора Y2.
114. Соединение PYY согласно любому из предыдущих воплощений, которое способно активировать человеческий рецептор Y2.
115. Соединение PYY согласно любому из предыдущих воплощений, которое способно активировать человеческий рецептор Y2 в анализе с цельными клетками, экспрессирующими человеческий рецептор Y2.
116. Соединение PYY согласно любому из предыдущих воплощений, которое способно активировать человеческий рецептор Y2 в функциональном анализе активности Actone из примера 39.
117. Соединение PYY согласно любому из предыдущих воплощений, которое способно связываться с человеческим рецептором Y2.
118. Соединение PYY согласно любому из предыдущих воплощений, которое способно связываться с человеческим рецептором Y2, где связывание с человеческим рецептором Y2 измеряется в анализе конкурентного связывания, такого как анализ из примера 40.
119. Соединение PYY согласно любому из предыдущих воплощений, которое обладает улучшенными фармакокинетическим свойствами.
120. Соединение PYY согласно любому из предыдущих воплощений, которое обладает увеличенным периодом полужизни и/или сниженным клиренсом.
121. Соединение PYY согласно любому из предыдущих воплощений, которое in vivo имеет эффект снижения уровня глюкозы в крови, что определяется в исследовании с однократным введением на мышиной модели db/db.
122. Соединение PYY согласно любому из предыдущих воплощений, которое in vivo имеет эффект снижения потребления пищи, что определяется в исследовании с однократным введением на мышиной модели db/db.
123. Фармацевтическая композиция, содержащая соединение PYY согласно любому из воплощений 1-122 и по меньшей мере один фармацевтически приемлемый эксципиент.
124. Соединение PYY согласно любому из воплощений с 1 по 122 для применения в качестве лекарственного средства.
125. Соединение PYY согласно любому из воплощений с 1 по 122 для применения в лечении и/или профилактике всех форм сахарного диабета и связанных с ним заболеваний, таких как нарушение пищевого поведения, осложнения диабета, сердечно-сосудистые заболевания и/или апноэ во сне; и/или для улучшения параметров липидного обмена, улучшения функции β-клеток и/или для отсрочки или предотвращения прогрессирования диабетического заболевания.
126. Соединение PYY согласно любому из воплощений с 1 по 122 для применения в лечении и/или профилактике сахарного диабета.
127. Соединение PYY согласно любому из воплощений с 1 по 122 для применения в лечении и/или профилактике сахарного диабета 2 типа.
128. Применение соединения PYY согласно любому из воплощений с 1 по 122 для изготовления лекарственного препарата для лечения и/или профилактики всех форм сахарного диабета и связанных с ним заболеваний, таких как нарушение пищевого поведения, осложнения диабета, сердечно-сосудистые заболевания и/или апноэ во сне; и/или для улучшения параметров липидного обмена, улучшения функции β-клеток, и/или для отсрочки или предотвращения прогрессирования диабетического заболевания.
129. Применение соединения PYY согласно любому из воплощений с 1 по 122 для изготовления лекарственного препарата для лечения и/или профилактики сахарного диабета.
130. Применение соединения PYY согласно любому из воплощений с 1 по 122 для изготовления лекарственного препарата для лечения и/или профилактики сахарного диабета 2 типа.
131. Способ лечения и/или профилактики всех форм сахарного диабета и связанных с ним заболеваний, таких как нарушение пищевого поведения, осложнения диабета, сердечно-сосудистые заболевания и/или апноэ во сне; и/или улучшения параметров липидного обмена, улучшения функции β-клеток, и/или отсрочки или предотвращения прогрессирования диабетического заболевания путем введения фармацевтически активного количества соединения PYY согласно любому из воплощений с 1 по 122.
132. Способ лечения и/или профилактики сахарного диабета путем введения фармацевтически активного количества соединения PYY согласно любому из воплощений с 1 по 122.
133. Способ лечения и/или профилактики сахарного диабета 2 типа путем введения фармацевтически активного количества соединения PYY согласно любому из воплощений с 1 по 122.
134. Соединение PYY согласно любому из воплощений с 1 по 122 для применения в лечении и/или профилактике нарушений пищевого поведения, таких как ожирение, например, за счет уменьшения потребления пищи, уменьшения массы тела, подавления аппетита, вызывания сытости; лечения или профилактики компульсивного переедания, булимии и/или ожирения, вызванного введением антипсихотического агента или стероидов; снижения моторики желудка; задержки опорожнения желудка; повышения физической подвижности; и/или в профилактике и/или лечении заболеваний, сопутствующих ожирению, таких как остеоартрит и/или недержание мочи.
135. Соединение PYY согласно любому из воплощений с 1 по 122 для применения в лечении и/или профилактике ожирения.
136. Применение соединения PYY согласно любому из воплощений с 1 по 122 для изготовления лекарственного препарата для лечения и/или профилактики нарушений пищевого поведения, таких как ожирение, например, за счет уменьшения потребления пищи, уменьшения массы тела, подавления аппетита, вызывания сытости; лечения или профилактики компульсивного переедания, булимии и/или ожирения, вызванного введением антипсихотического агента или стероидов; снижения моторики желудка; задержки опорожнения желудка; повышения физической подвижности; и/или для профилактики и/или лечения заболеваний, сопутствующих ожирению, таких как остеоартрит и/или недержание мочи.
137. Применение соединения PYY согласно любому из воплощений с 1 по 122 для изготовления лекарственного препарата для лечения и/или профилактики ожирения.
138. Способ лечения и/или профилактики нарушений пищевого поведения, таких как ожирение, например, за счет уменьшения потребления пищи, уменьшения массы тела, подавления аппетита, вызывания сытости; лечения или профилактики компульсивного переедания, булимии и/или ожирения, вызванного введением антипсихотического агента или стероидов; снижения моторики желудка; задержки опорожнения желудка; повышения физической подвижности; и/или профилактики и/или лечения заболеваний, сопутствующих ожирению, таких как остеоартрит и/или недержание мочи, путем введения фармацевтически активного количества соединения PYY согласно любому из воплощений с 1 по 122.
139. Способ лечения и/или профилактики ожирения путем введения фармацевтически активного количества соединения PYY согласно любому из воплощений с 1 по 122.
140. Фармацевтическая композиция, содержащая соединение PYY согласно любому из воплощений с 1 по 122, агонист GLP-1 и по меньшей мере один фармацевтически приемлемый эксципиент.
141. Фармацевтическая композиция согласно воплощению 140, где агонист GLP-1 представляет собой лираглутид.
142. Фармацевтическая композиция согласно воплощению 140, где агонист GLP-1 представляет собой семаглутид.
143. Фармацевтическая композиция согласно любому из воплощений с 140 по 142, где соединение PYY представляет собой SEQ ID NO 18.
144. Фармацевтическая композиция согласно любому из воплощений с 140 по 143 для применения в качестве лекарственного средства.
145. Фармацевтическая композиция согласно любому из воплощений с 140 по 143 для применения в лечении и/или профилактике всех форм сахарного диабета и связанных с ним заболеваний, таких как нарушение пищевого поведения, осложнения диабета, сердечно-сосудистые заболевания и/или апноэ во сне; и/или для улучшения параметров липидного обмена, улучшения функции β-клеток, и/или для отсрочки или предотвращения прогрессирования диабетического заболевания и/или нарушений пищевого поведения, таких как ожирение, например, за счет уменьшения потребления пищи, уменьшения массы тела, подавления аппетита, вызывания сытости; лечения или профилактики компульсивного переедания, булимии и/или ожирения, вызванного введением антипсихотического агента или стероидов; снижения моторики желудка; задержки опорожнения желудка; повышения физической подвижности; и/или для профилактики и/или лечения заболеваний, сопутствующих ожирению, таких как остеоартрит и/или недержание мочи.
146. Фармацевтическая композиция согласно любому из воплощений с 140 по 143 для применения в лечении и/или профилактике сахарного диабета.
147. Фармацевтическая композиция согласно любому из воплощений с 140 по 143 для применения в лечении и/или профилактике сахарного диабета 2 типа.
148. Фармацевтическая композиция согласно любому из воплощений с 140 по 143 для применения в лечении и/или профилактике ожирения.
149. Применение фармацевтической композиции согласно любому из воплощений с 140 по 143 для изготовления лекарственного препарата для лечения и/или профилактики диабета и/или ожирения.
150. Способ лечения и/или профилактики всех форм сахарного диабета и связанных с ним заболеваний, таких как нарушение пищевого поведения, осложнения диабета, сердечно-сосудистые заболевания и/или апноэ во сне; и/или улучшения параметров липидного обмена, улучшения функции β-клеток, и/или отсрочки или предотвращения прогрессирования диабетического заболевания путем введения фармацевтически активного количества фармацевтической композиции согласно любому из воплощений с 140 по 143.
151. Способ лечения и/или профилактики нарушений пищевого поведения, таких как ожирение, например, за счет уменьшения потребления пищи, уменьшения массы тела, подавления аппетита, вызывания сытости; лечения или профилактики компульсивного переедания, булимии и/или ожирения, вызванного введением антипсихотического агента или стероидов; снижения моторики желудка; задержки опорожнения желудка; повышения физической подвижности; и/или профилактики и/или лечения заболеваний, сопутствующих ожирению, таких как остеоартрит и/или недержание мочи, путем введения фармацевтически активного количества фармацевтической композиции согласно любому из воплощений с 140 по 143.
Примеры
Эта экспериментальная часть начинается со списка сокращений, а за ним следует раздел, включающий общие способы синтеза и характеризации соединений согласно изобретению. Далее следует ряд примеров, которые относятся к получению конкретных соединений PYY, и в конце включен ряд примеров, которые относятся к активности и свойствам этих соединений (раздел, озаглавленный "Фармакологические способы").
Эти примеры служат для иллюстрации данного изобретения.
Список сокращений
ACN: ацетонитрил
Aib: α-аминоизобутановая кислота
Boc: трет-бутилоксикарбонил
CH3CN: ацетонитрил
СРМ: число импульсов в минуту
DCM: дихлорметан
DIC: диизопропилкарбодиимид
DIPEA: диизопропилэтиламин
DMF: N,N-диметилформамид
Et2O: диэтиловый эфир
Fmoc: 9Н-флуорен-9-илметоксикарбонил
HFIP: гексафторизопропанол
HMWP: высокомолекулярные белки
ч: часы
H2O: вода
НОАс: уксусная кислота
HOAt: 1-гидрокси-7-азабензотриазол
HOBt: 1-гидроксибензотриазол
мин: минуты
Mtt: 4-метилтритил
MW: молекулярная масса
NMeArg: N(альфа)-метил-L-аргинин
NMF: 1-метил-формамид
NMP: 1-метилпирролидин-2-он
OtBu: третбутиловый эфир
Pbf: 2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил
РуВОР: бензотриазол-1-ил-окситрипирролидинофосфония гексафторфосфат
rpm: оборотов в минуту
r.t: комнатная температура
tBu: третбутил
TFA: трифторуксусная кислота
TIPS: триизопропилсилан
Trt: трифенилметил
Материалы и методы
Общие способы получения
Этот раздел относится к способам твердофазного синтеза основной цепи пептида и синтеза боковой цепи, присоединенной к основной цепи (способы твердофазного пептидного синтеза (ТФПС), включая способы сочетания аминокислот, снятия защиты с Fmoc-аминокислот, способы отщепления пептида от смолы, а также его очистки).
1. Синтез связанной со смолой защищенной основной цепи пептида
Процедура автоматической пошаговой сборки пептидной основной цепи. Защищенную пептидил-смолу синтезировали в соответствии с Fmoc-стратегией на твердофазном пептидном синтезаторе Prelude (Protein Technologies, Туксон, США) в масштабе 0,25 ммоль или 0,4 ммоль с использованием протоколов работы от изготовителя. Используемые Fmoc-защищенные аминокислотные производные были стандартными рекомендуемыми: Fmoc-Ala-OH, Fmoc-Arg(Pbf)-OH, Fmoc-Asn(Trt)-OH, Fmoc-Asp(OtBu)-OH, Fmoc-Cys(Trt)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Glu(OtBu)-OH, Fmoc-Gly-OH, Fmoc-His(Trt)-OH, Fmoc-Ile-OH, Fmoc-Leu-OH, Fmoc-Lys(Boc)-OH, Fmoc-Lys(Mtt)-OH, Fmoc-Met-OH, Fmoc-Phe-OH, Fmoc-Pro-OH, Fmoc-Ser(tBu)-OH, Fmoc-Thr(tBu)-OH, Fmoc-Trp(Boc)-OH, Fmoc-Tyr(tBu)-OH или Fmoc-Val-OH и т.д., поставляемыми, например, Bachem, Iris Biotech, Protein Technologies или Novabiochem. Если не указано иное, то использовали природную L-форму аминокислот. Сочетание проводили с помощью опосредованного DIC (дициклогексилкарбодиимид) и Ozyma Pure (этил-2-циано-2-(гидроксиимино)ацетат, Merck, Novabiochem, Швейцария) сочетания в NMP (N-метилпирролидон). Сочетание Fmoc-аминокислоты проводили так, как описано выше, с использованием 4-8-кратного избытка аминокислоты относительно замещения смолы (4-8 экв.). Время сочетания колебалось от 1 часа до 4 часов. Fmoc-Arg(pbf)-OH сочетали с использованием процедуры двойного сочетания (1 час + 1 час). Смола, используемая для синтеза пептидных амидов, может представлять собой Tentagel RAM (Rapp Polymere, Германия), смолы Rink amid ChemMatrix (Matrix Innovation, Канада) и смолы Rink-Amide (Merck/Novabiochem). Используемые защищенные аминокислотные производные представляли собой стандартные Fmoc-аминокислоты (например, от Protein Technologies или Novabiochem). Эпсилон-аминогруппу лизина, которая должна быть дериватизирована, защищали с помощью Mtt. N-концевую аминокислоту или конструкцию связывали как Вос-защищенную аминокислоту, например, Вос-Ile. Альтернативно, изовалериановую кислоту связывали в соответствии с описанной выше процедурой сочетания для Fmoc-аминокислот. Твердофазную ступенчатую сборку на Prelude проводили с помощью следующих этапов: 1) удаление защитных групп (удаление Fmoc) с использованием 25% пиперидина в NMP в течение 2×4 мин., этап 2) промывание (удаление пиперидина) с помощью NMP и DCM, этап 3) сочетание избытка 4-8 экв. Fmoc-аминокислоты (0,3 М Fmoc-аминокислоты в 0,3 M Oxyma Pure в NMP) в течение 1-4 часов, инициированное добавлением 1/10 объема 3 М DIC в NMP и 1/10 объема коллидина в NMP. Смешивание проводили путем периодического барботирования азотом, этап 4) промывание (удаление избытка аминокислот и реагентов с использованием NMP и DCM). Последний этап включал промывку DCM, благодаря чему смола была готова к присоединению альбуминсвязывающей группировки на боковой цепи лизина.
2. Присоединение модифицирующих групп к связанной со смолой защищенной основной цепи пептида
Процедура ручного удаления Mtt-защиты (лизин(Mtt)): Перед проведением синтеза модифицирующей группы Mtt-группа на месте прикрепления (лизин) должна быть удалена. Смолу помещали в шприц или реакционную колбу и обрабатывали 75% гексафторизопропанолом (HFIP) + 25% DCM в течение 2×30 минут для удаления группы Mtt. Затем смолу промывали DCM и NMP, как описано выше, и нейтрализовали 5% раствором DIPEA (этап нейтрализации) в NMP или 25% пиперидином в NMP с последующей промывкой NMP перед соединением с альбуминовой группировкой. Альтернативно, этап нейтрализации пропускали.
Процедура удаления на Prelude Mtt-защиты (лизин(Mtt)): На Prelude смолу обрабатывали 75% гексафторизопропанолом (HFIP) + 25% DCM 2 раза по 2 минуты, а затем 2 раза по 30 минут, чтобы удалить группу Mtt на лизине. Затем смолу промывали DCM и NMP с последующим этапом нейтрализации с использованием 25% пиперидина в NMP в течение 4 минут, и после этого она была готова к синтезу модифицирующей группы.
Процедура ручного синтеза модифицирующих групп на остатке лизина:
Структурные блоки Fmoc-8-амино-3,6-диоксаоктановой кислоты (CAS №166108-71-0), Fmoc-TTDS-OH (CAS №172089-14-4, IRIS Biotech GmbH), Fmoc-L-Glu-OtBu (84793-07-7) и монотретбутилового эфира эйкозандиовой кислоты (CAS №843666-40-0) соединяли с использованием DIC и Oxyma Pure в 4-8 экв. относительно замещения смолы. Время реакции сочетания составляло 2-16 часов, после чего, как правило, следовал этап т.н. "кэппинга" с использованием 1 М ангидрида уксусной кислоты в течение 15-60 мин. Fmoc-группу удаляли 25% пиперидином в NMP в течение 10-30 мин с последующим промыванием.
16-сульфоновую гексадекановую кислоту солюбилизировали в NMP или N-метилформамиде (NMF) при 60 градусах по Цельсию или выше и активировали с помощью 1 экв. РуВОР по отношению к сульфоновой гексадекановой кислоте, и также было добавлено 2 экв. диизопропилэтиламина (DIPEA) по отношению к сульфоновой гексадекановой кислоте. Пептидил-смолу промывали горячим NMP или NMF непосредственно перед добавлением активированной сульфоновой гексадекановой кислоты. Использовали 3-4-кратный избыток сульфоновых структурных блоков и продолжали реакцию сочетания более 16 часов.
Процедура автоматического синтеза модифицирующих групп на остатке лизина:
Для синтеза модифицирующих групп были использованы следующие структурные блоки: Fmoc-8-амино-3,6-диоксаоктановая кислота, Fmoc-TTDS-OH, Fmoc-Glu-OtBu и монотретбутиловый эфир эйкозандиовой кислоты (CAS №843666-40-0). Модифицирующие группы соединяли с использованием DIC и Oxyma Pure в 4-8 экв. относительно замещения смолы. Время реакции сочетания составляло 2-16 часов, после чего, как правило, следовал этап кэппинга с использованием 1 М ангидрида уксусной кислоты в течение 20 мин. Fmoc-группу удаляли 25% пиперидином в NMP 2 раза по 4 мин с последующим промыванием, как описано в ТФПС основной цепи пептида. Все остальные этапы синтеза были также такими же, как описано выше для синтеза главной цепи. Сочетание 16-сульфоновой гексадекановой кислоты проводили путем ручной процедуры, как описано выше, с использованием руВОР в качестве соединяющего реагента.
3. Расщепление связанного со смолой пептида с присоединенными модифицирующими группами или без них и очистка
Перед TFA-удалением защитной группы пептидил-смолу промывали DCM или диэтиловым эфиром и сушили. Защитные группы основной и боковых цепей пептида удаляли добавлением от 20 до 40 мл (масштаб 0,25 ммоль) или от 30 до 60 мл (масштаб 0,4 ммоль) 92% TFA, 5% TIPS и 3% TIPS на 2-4 часа. Затем TFA фильтровали, а в некоторых случаях концентрировали в потоке аргона и добавляли диэтиловый эфир для осаждения пептида. Пептид промывали от 3 до 5 раз диэтиловым эфиром и сушили.
Общие способы обнаружения и характеризации
Этот раздел относится к способам обнаружения и характеризации полученных пептидов, включая способы: жидкостная хроматомасс-спектрометрия (LCMS, от англ. liquid chromatography-mass spectrometry), матрично-активированная лазерная десорбция/ионизация (MALDI, от англ. matrix-assisted laser desorption/ionization) и сверхэффективная жидкостная хроматография (UPLC, от англ. ultra-performance liquid chromatography).
1. Способ LC-MS (LCMS1)
Масс-спектрометр Agilent Technologies LC/MSD TOF (G1969A) использовали для идентификации молекулярной массы пептида после элюирования из ВЭЖХ-системы серии Agilent 1200. Деконволюцию данных рассчитывали с использованием программного обеспечения Agilents.
Элюенты:
Буфер А: 0,1% TFA в воде
Буфер В: 0,1% TFA в CH3CN
LC-MS Waters Acquity (LCMS2)
LC-система: Waters Acquity UPLC
Колонка: Waters Acquity UPLC ВЕН, C-18, 1,7 мкм, 2,1 мм × 50 мм
Детектор: Waters (Micromass) LCT Premier XE
Линейный градиент: от 5% до 95% В
Время цикла градиента: 4,0 мин
Общее время цикла: 7,0 мин
Скорость потока: 0,4 мл/мин
Температура колонки: 40°C
Растворитель А: 99,90% MQ-вода, 0,1% муравьиная кислота
Растворитель В: 99,90% ацетонитрил, 0,1% муравьиная кислота
2. Способы UPLC
Способ UPLC2
Буфер А: 0,05% TFA
Буфер В: CH3CN плюс 0,05% TFA
Поток: 0,4 мл/мин
Градиент: от 5 до 95% В, (16 мин),
Колонка: Acquity UPLC ВЕН С18, 1,7 мкм, 2,1 × 150 мм
Температура колонки: 40°C
Способ UPLC26v01
Буфер А: 0,05% TFA
Буфер В: CH3CN плюс 0,05% TFA
Поток: 0,45 мл/мин
Градиент: от 5 до 60% буфер В (от 0,5 до 4 мин)
Колонка: Acquity UPLC ВЕН С18 1,7 мкм, 2,1×50 мм
Температура колонки: 40°C
Способ UPLC29v01
Буфер А: 0,05% TFA
Буфер В CH3CN плюс 0,05% TFA
Поток: 0,45 мл/мин
Градиент: от 15 до 35% буфер В (от 0,5 до 4 мин)
Колонка: Acquity UPLC ВЕН С18 1,7 мкм, 2,1×50 мм
Температура колонки: 40°C
Способ UPLC30v01
Буфер А: 0,05% TFA
Буфер В: CH3CN плюс 0,05% TFA
Поток: 0,45 мл/мин
Градиент: от 20 до 40% буфер В (от 0,5 до 4 мин)
Колонка: Acquity UPLC ВЕН С18 1,7 мкм, 2,1×50 мм
Температура колонки: 40°C
Способ UPLC31v01
Буфер А: 0,05% TFA
Буфер В: CH3CN плюс 0,05% TFA
Поток: 0,45 мл/мин
Градиент: от 25 до 45% буфер В (от 0,5 до 4 мин)
Колонка: Acquity UPLC ВЕН С18 1,7 мкм, 2,1×50 мм
Температура колонки: 40°C
Способ UPLC02V01
Система: Waters Acquity UPLC
Буфер А: 0,05% TFA в H2O
Буфер В: CH3CN плюс 0,05% TFA
Поток: 0,40 мл/мин
Градиент: от 5 до 95% буфер В (16 мин)
Колонка: Acquity UPLC ВЕН С18 1,7 мкм, 2,1×150 мм
Температура колонки: 40°C
Способ UPLC07v01
Система: Waters Acquity UPLC
Буфер А: 0,09 М диаммония гидрофосфат (водн.) и 10% ацетонитрил, pH 3,6
Буфер В: 20% изопропанол, 20% вода и 60% ацетонитрил
Поток: 0,50 мл/мин
Градиент: от 35 до 65% буфер В (от 2 до 17 мин)
Колонка: Phenomenex Kinetex С18, 1,7 мкм, 2,1 мм × 150 мм
Температура колонки: 60°C
Способ UPLC16v01
Система: Waters Acquity UPLC
Буфер А: 0,2 М натрия сульфат, 0,02 М динатрия гидрофосфат, 0,02 М натрия дигидрофосфат, 90% вода и 10% ацетонитрил, pH 7,2
Буфер В: 70% ацетонитрил, 30% вода
Поток: 0,40 мл/мин
Градиент: от 20 до 50% буфер В (от 3 до 20 мин)
Колонка: ACQUITY UPLC ВЕН Shield RP18, 1,7 мкм, 2,1 мм × 150 мм
Температура колонки: 60°C
Способ UPLC60
Система: Система Waters Acquity UPLC
Буфер А: 0,02 М натрия сульфат, 0,02 М динатрия гидрофосфат, 0,02 М натрия дигидрофосфат, 90% вода и 10% ацетонитрил, pH 7,2
Буфер В: 70% ацетонитрил, 30% вода
Поток: 0,40 мл/мин
Градиент: от 20 до 50% буфер В (от 3 до 20 мин)
Колонка: ACQUITY UPLC ВЕН Shield RP18, 1,7 мкм, 2,1 мм × 150 мм
Температура колонки: 60°C
Способ UPLC17
Система: Система Waters Acquity UPLC
Буфер А: 0,2 М натрия сульфат, 0,02 М динатрия гидрофосфат, 0,02 М натрия дигидрофосфат, 90% вода и 10% ацетонитрил, pH 7,2
Буфер В: 70% ацетонитрил, 30% вода
Поток: 0,40 мл/мин
Ступенчатый градиент: от 10 до 20% В в течение 3 мин, затем от 20 до 80% В в течение 17 мин, затем от 80 до 90% В в течение 1 мин
Колонка: ACQUITY UPLC ВЕН Shield RP18, 1,7 мкм, 2,1 мм × 150 мм
Температура колонки: 60°C
Способ UPLC61
Система: Система Waters Acquity UPLC
Буфер А: 0,02 М натрия сульфат, 0,02 М динатрия гидрофосфат, 0,02 М натрия дигидрофосфат, 90% вода и 10% ацетонитрил, pH 7,2
Буфер В: 70% ацетонитрил, 30% вода
Поток: 0,40 мл/мин
Градиент: от 10 до 20% буфер В (от 0 до 3 мин) от 20 до 80% буфер В (от 3 до 20 мин)
Колонка: ACQUITY UPLC ВЕН Shield RP18, 1,7 мкм, 2,1 мм × 150 мм
Температура колонки: 60°C
Способ UPLC-АР-01
Буфер A: 0,1% TFA в H2O
Буфер В: СН CN плюс 0,1% TFA
Поток: 0,40 мл/мин
Градиент: от 5 до 95% буфер В (16 мин)
Колонка: Acquity UPLC ВЕН 130; 150×2,1; 1,7 мкм
Температура колонки: 40°C
Способ UPLC-АР-02
Буфер А: 20 мМ Na2HPO4, 20 мМ NaH2PO4, 200 мМ Na2SO4 в 90% вода/10% ацетонитрил, pH 7,20
Буфер В: 70% ацетонитрил/30% вода
Поток: 0,40 мл/мин
Градиент: от 10 до 20% буфер В (от 0 до 3 мин); от 20 до 50% буфер В (от 3 до 20 мин); от 50 до 80% (от 20 до 21 мин)
Колонка: Acquity UPLC ВЕН Shield, RP18 1,7 мкм, 2,1×150 мм
Температура колонки: 40°C
3. Способ матрично-активированная лазерная десорбция/ионизация - масспектрометрия MALDI-MS
Молекулярные массы пептидов определяли с помощью времяпролетной масс-спектрометрии с матрично-активированной лазерной десорбцией (MALDI-MS), записанной на Microflex (Bruker). Использовалась матрица альфа-циано-4-гидроксикоричная кислота. Молекулярная масса продукта рассчитывалась на основании результата анализа MALDI-MS с использованием программного обеспечения, поставляемого производителем.
Синтез промежуточных продуктов
Синтез 16-сульфо-гексадекановой кислоты
16-гексадеканолид (997 г, 3,92 моль) растворяли в метаноле (15,1 л) и добавляли моногидрат толуол-4-сульфоновой кислоты (90,0 г, 0,473 моль). Реакционную смесь нагревали в реакторе объемом 50 л при 55°C в течение 16 ч. После охлаждения добавляли натрия гидрокарбонат (56,0 г, 0,67 моль) и реакционную смесь встряхивали в течение 15 мин. Растворитель выпаривали на роторном испарителе Heidolph объемом 20 л. Добавляли этилацетат (12 л) и смесь экстрагировали с помощью 5% раствора натрия гидрокарбоната (10 л). Органический слой отделяли; эмульсионный слой экстрагировали этилацетатом (3×3 л), белый нерастворимый мутный материал отделяли, а этилацетатный слой снова промывали с помощью 5% раствора натрия гидрокарбоната (5 л). Органические слои объединяли и промывали насыщенным раствором натрия гидрокарбоната (5 л) и насыщенным раствором хлорида натрия (10 л). Растворитель выпаривали на роторном испарителе Heidolph объемом 20 л. Неочищенный продукт кристаллизовали из гексана (8 л). Горячий раствор в гексане декантировали и затем позволяли кристаллизоваться на ледяной бане. Материал фильтровали через большую фритту и промывали холодным раствором гексана (2 л). Чистый материал сушили в вакууме.
Выход: 1062,2 г (95%). RF (SiO2, дихлорметан/метанол 95:5): 0,65.
1Н ЯМР-спектр (300 MHz, CDCl3, δH): 3,67 (s, 3Н); 3,67-3,60 (m, 2Н); 2,30 (t, J равно 7,5 Hz, 2Н); 1,67-1,53 (m, 4Н); 1,25 (s, 22Н).
Указанный выше сложный эфир (957 г, 3,34 моль) растворяли в дихлорметане (7 л) на роторном испарителе Heidolph объемом 20 л. Добавляли триэтиламин (695 мл, 4,98 моль), реакционную смесь охлаждали до 0°C (путем погружения льда в ванну испарителя) и медленно добавляли метансульфонилхлорид (325 мл, 4,19 моль) в дихлорметане (200 мл) в течение 10 мин через наружную трубку с помощью небольшого вакуума. Затем реакционную смесь нагревали до 35°C в течение 1 ч. ЯМР-анализ показал полное завершение реакции. Добавляли воду (690 мл) и выпаривали растворители. Добавляли этилацетат (8 л) и смесь промывали 1 М соляной кислотой (4 л) и 5% раствором карбоната натрия (4 л). Поскольку экстракция карбонатом натрия давала эмульсию, этот слой экстрагировали этилацетатом (4 л) и добавляли к основной части. Объединенный этилацетатный слой промывали насыщенным раствором хлорида натрия (4 л), сушили над безводным сульфатом натрия и фильтровали. Растворитель выпаривали, получая метиловый эфир 16-метансульфонилокси-гексадекановой кислоты в виде белого тведого вещества.
Выход: 1225,4 г (100%).
1Н ЯМР-спектр (300 MHz, CDCl3, δН): 4,22 (t, J равно 6,6 Hz, 2H); 3,66 (s, 3Н); 3,00 (s, 3Н); 2,30 (t, J равно 7,5 Hz, 2H) 1,82-1,67 (m, 2H); 1,68-1,54 (m, 2H); 1,36-1,17 (m, 22H).
Указанный выше мезилат (1,23 кг, 3,34 моль) растворяли в ацетоне (8 л), добавляли бромид лития (585 г, 6,73 моль) и реакционную смесь нагревали на роторном испарителе Heidolph объемом 20 л при 50°C в течение 12 ч. После охлаждения растворитель выпаривали, добавляли этилацетат (10 л) и смесь промывали с помощью 5% раствора натрия гидрокарбоната (3×15 л) и насыщенного раствора хлорида натрия (8 л). Растворитель выпаривали досуха, получая метиловый эфир 16-бромгексадекановой кислоты в виде бледно-желтого масла, которое начинало кристаллизоваться.
Выход: 1219 г (105%); содержит ацетон и продукт альдолизации ацетона.
RF (SiO2, гексан/этилацетат 9:1): 0,90.
1Н ЯМР-спектр (300 MHz, CDCl3, δН): 3,65 (s, 3Н); 3,42 (t, J равно 6,9 Hz, 2H); 2,32 (t, J равно 7,5 Hz, 2H); 1,92-1,77 (m, 2H) 1,69-1,53 (m, 2H); 1,50-1,35 (m, 2H); 1,25 (bs, 10H).
Растворы натрия сульфита (327 г, 2,60 моль) в воде (1,26 л) и метилового эфира 16-бром-гексадекановой кислоты (728 г, 2,00 моль, 96% чистота) в 1-пропаноле (945 мл) и метаноле (420 мл) нагревали с обратным холодильником в реакторе объемом 6 л, снабженном механической мешалкой, в течение 48 ч. Реакционную смесь охлаждали до 27°C и разводили тетрагидрофураном (2 л). Реакционную смесь фильтровали и твердый материал промывали тетрагидрофураном (3×700 мл). Фильтрат охлаждали до 0°C и осаждали еще одну порцию материала. Этот преципитат фильтровали и промывали тетрагидрофураном (2×200 мл). Твердое вещество объединяли и смешивали с водой (8,4 л) в сосуде объемом 20 л. Добавляли раствор гидроксида натрия (120 г, 3,00 моль). Смесь нагревали до кипячения в течение примерно 5 ч. В реакционную смесь медленно добавляли раствор серной кислоты (430 мл, 8,00 моль) в воде (500 мл) (формировался диоксид серы). Реакционную смесь нагревали до кипячения в течение 10 мин и затем охлаждали до 15°C (ледяная баня). Смесь фильтровали на воронке Бюхнера через фильтровальную бумагу Seitz (фильтр из нескольких слоев) с помощью вакуума. Эта процедура была очень медленной и занимала два дня. Твердый материал несколько раз промывали дистиллированной водой до тех пор, пока pH фильтрата не достигал 2-3. Эта процедура занимала примерно три дня. Мутный белый материал сушили в печи при 80°C, получая нужный продукт.
Выход: 510 г (76%).
1Н ЯМР-спектр (300 MHz, DMSO-d6, δH): 2,45-2,33 (m, 2H); 2,18 (t, J равно 7,3 Hz, 2H); 1,60-1,40 (m, 4Н); 1,24 (s, 22H).
Массспектрометрия - ионизация электрораспылением (MS-ESI) (отр., образец в H2O/MeCN плюс NaHCO3; m/z): 335,5 (M-H)-, 357,5 (M-2H+Na)-, 167,3 (M-2H)2-
Синтез 14-сульфо-гексадекановой кислоты
1 М раствор комплекса "боран-тетрагидрофуран" в тетрагидрофуране (52 мл, 52,0 ммоль) добавляли по каплям в раствор монотретбутилового эфира тетрадекандиовой кислоты (10,0 г, 31,9 ммоль) в сухом тетрагидрофуране (75 мл) при 0°C в атмосфере аргона. Полученный раствор встряхивали при 0°C в течение 2 ч, затем охлаждающую баню удаляли, и смесь встряхивали при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор натрия гидрокарбоната (150 мл) и полученную смесь экстрагировали дихлорметаном (3×100 мл). Объединенные органические экстракты экстрагировали с помощью 5% водного раствора карбоната натрия (1×150 мл) и 10% водного раствора лимонной кислоты (1×100 мл). Объединенные органические экстракты сушили над безводным сульфатом магния и выпаривали досуха. Осадок подвергали колоночной хроматографии (Silicagel 60А, 0,060-0,200 мм; элюент: дихлорметан/метанол 100:0-99:1), получая третбутиловый эфир 14-гидрокситетрадекановой кислоты в виде желтоватого масла.
Выход: 9,19 г (96%).
Коэффициент удерживания (RF, от англ. retardation factor) (SiO2, хлороформ/метанол 9:1): 0,60.
1Н ЯМР-спектр (300 MHz, CDCl3, dH): 3,60 (t, J равно 6,4 Hz, 2H); 2,18 (t, J равно 7,2 Hz, 2H); 1,61-1,48 (m, 4H); 1,42 (s, 9H); 1,24 (bs, 18H).
Раствор гидроксида калия (8,60 г, 153 ммоль) в воде (100 мл) добавляли в раствор указанного выше сложного эфира (9,20 г, 30,6 ммоль) в метаноле (100 мл), и полученную смесь нагревали при 60°C в течение 2 дней. Смесь охлаждали до комнатной температуры; затем ее промывали гексаном (2×70 мл) и концентрировали в вакууме. Концентрированную соляную кислоту (32%, 20 мл, 0,65 моль) добавляли по каплям и смесь экстрагировали этилацетатом (2×150 мл). Объединенные органические слои сушили над безводным сульфатом магния и выпаривали досуха, получая 14-гидрокситетрадекановую кислоту в виде белого твердого вещества.
Выход: 7,10 г (95%).
RF (SiO2, хлороформ/метанол 85:15): 0,50.
1Н ЯМР-спектр (300 MHz, CDCl3, dH): 3,66 (t, J равно 6,6 Hz, 2H); 2,36 (t, J равно 7,4 Hz, 2H); 1,72-1,52 (m, 4H); 1,29 (bs, 18H).
Моногидрат п-толуолсульфоновой кислоты (0,28 г, 1,45 ммоль) добавляли в раствор указанной выше 14-гидрокси-тетрадекановой кислоты (7, 10 г, 29,1 ммоль) в метаноле (150 мл), и полученный раствор встряхивали при комнатной температуре в течение 3 дней. Метанол удаляли при пониженном давлении; осадок растворяли в этилацетате (170 мл); промывали 5% водным раствором карбоната натрия (3×50 мл) и насыщенным раствором хлорида натрия (25 мл); сушили над безводным сульфатом магния и выпаривали в вакууме, получая метил-14-гидрокси-тетрадеканоат в виде белого твердого вещества.
Выход: 7,28 г (97%).
RF (SiO2, дихлорметан/метанол 95:5): 0,45.
1Н ЯМР-спектр (300 MHz, CDCl3, dH): 3,61-3,71 (m, 5Н); 2,32 (t, J равно 7,5 Hz, 2H); 1,70-1,52 (m, 4H); 1,44 (s, 1H); 1,28 (bs, 18H).
Приготовленный ранее сложный эфир (7,28 г, 28,2 ммоль) растворяли в DCM (60 мл). Добавляли триэтиламин (5,30 мл, 52,3 ммоль), реакционную смесь охлаждали до 0°C и медленно добавляли мезилхлорид (2,45 мл, 31,7 ммоль) в течение 10 мин. Через 1 ч реакционную смесь согревали до комнатной температуры и встряхивали в течение ночи. Через 16 ч добавляли воду (1 мл) и смесь встряхивали 30 мин. Растворители выпаривали, добавляли этилацетат (80 мл) и смесь экстрагировали 1 М соляной кислотой (2×30 мл), 5% раствором натрия карбоната (2×20 мл) и водой (20 мл). После высушивания над безводным сульфатом магния, фильтрации и выпаривания растворителей получали метиловый эфир 16-мезилгексадекановой кислоты в виде белого твердого вещества.
Выход: 9,15 г (92%).
RF (SiO2, дихлорметан/метанол 95:5): 0,70.
1Н ЯМР-спектр (300 MHz, CDCl3, dH): 4,24 (t, J равно 6,6 Hz, 2H); 3,68 (s, 3H); 3,01 (s, 3H); 2,32 (t, J равно 7,5 Hz, 2H) 1,83-1,70 (m, 2H); 1,70-1,56 (m, 2H); 1,47-1,20 (m, 22H).
Приготовленный ранее мезилат (9,15 г, 26,0 ммоль) растворяли в ацетоне (230 мл) и добавляли бромид лития (4,50 г, 51,8 ммоль), и реакционную смесь подвергали нагреванию с обратным холодильником в течение ночи. После охлаждения растворитель выпаривали, добавляли этилацетат (530 мл) и смесь экстрагировали с помощью 5% раствора натрия гидрокарбоната (3×230 мл). Объединенные органические экстракты сушили над безводным сульфатом магния и выпаривали досуха, получая метиловый эфир 14-бромтетрадекановой кислоты в виде оранжевого масла.
Выход: 8,34 г (100%).
RF (SiO2, дихлорметан/метанол 95:5): 0,90.
1Н ЯМР-спектр (300 MHz, CDCl3, dH): 3,66 (s, 3Н); 3,42 (t, J равно 6,9 Hz, 2H); 2,32 (t, J равно 7,5 Hz, 2H); 1,93-1,80 (m, 2H) 1,69-1,56 (m, 2H); 1,50-1,38 (m, 2H); 1,28 (bs, 16H).
Приготовленную ранее 14-бромтетрадекановую кислоту (8,34 г, 26,0 ммоль) растворяли в н-пропаноле (10 мл), воде (25 мл) и 1М водном растворе гидроксида натрия (32 мл) и добавляли сульфит натрия (5,00 г, 39,7 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 22 ч. После охлаждения белый преципитат отфильтровывали. Добавляли концентрированную соляную кислоту, получая кислый pH, и преципитат центрифугировали и декантировали два раза водой (2×50 мл). После лиофилизации получали натриевую соль 14-сульфотетрадекановой кислоты в виде белого твердого вещества.
Выход: 7,3 г (85%).
RF (SiO2, дихлорметан/метанол 95:5): 0,60.
1Н ЯМР-спектр (300 MHz, DMSO-d6, dH): 2,40 (m, 2H); 2,18 (t, J равно 7,2 Hz, 2H); 1,61-1,40 (m, 4H); 1,23 (bs, 18H).
Синтез соединений по изобретению
Пример 1:.
SEQ ID NO 1
hPYY(1-36)
YPIKPEAPGEDASPEELNRYYASLRHYLNLVTRQRY-NH2
Пример 2:
SEQ ID NO 2
hPYY(3-36)
IKPEAPGEDASPEELNRYYASLRHYLNLVTRQRY-NH2
Время удерживания ВЭЖХ-методика UPLC16v01: 3,37 мин (91,4%)
Время удерживания ВЭЖХ-методика UPLC29v01: 10,07 мин (85,6%)
MW рассчитанная: 4049,6 г/моль
MALDI MS: 4048,2 г/моль
Пример 3:
SEQ ID NO 3
[Trp30]hPYY(3-36)
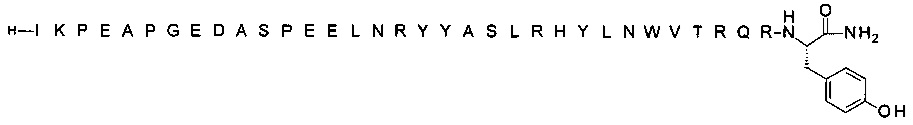
Время удерживания ВЭЖХ-методика UPLC-АР-01: (96,6%)
MW рассчитанная: 4123,6 г/моль
LCMS1: ((М/3)+3) 1374,8; ((М/4)+4) 1031,3
Пример 4:
SEQ ID NO 4
[Trp30,NMeArg35]hPYY3-36
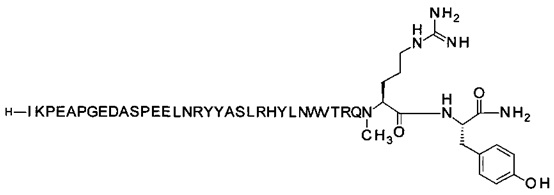
Время удерживания UPLC29v01: 3,43 мин (100%)
Время удерживания UPLC16v01: 10,93 (90,9%)
MW рассчитанная: 4136,6 г/моль
LCMS2: ((М/1)+1) 4136,03; ((М/2)+2) 2069,02 ((М/3)+3) 1379,68; ((М/4)+4) 1035,02
Пример 5:
SEQ ID NO 5
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Cln18,Trp30,NMeArg35]hPYY(3-36)
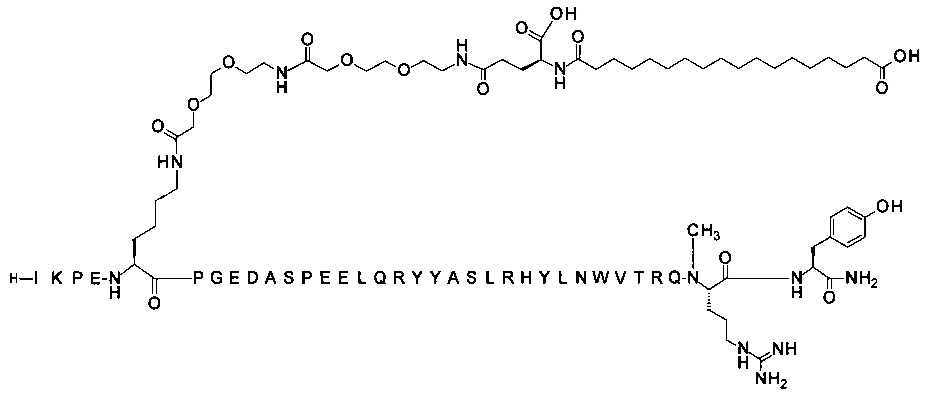
Время удерживания UPLC-АР-01: 7,44 мин (95,7%)
MW рассчитанная: 4923,6 г/моль
LCMS: ((М/3)+3) 1641,9; ((М/4)+4) 1231,5; ((М/5)+5) 985,6
Пример 6:
SEQ ID NO 6
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]бутаноил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36)
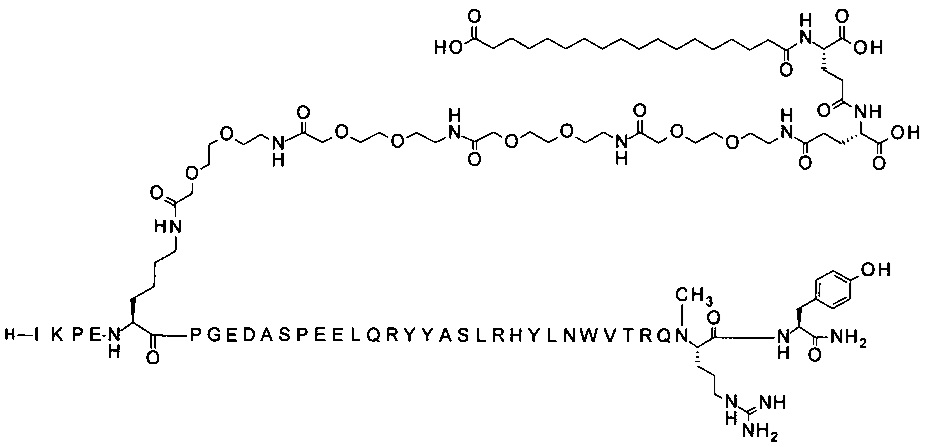
Время удерживания UPLC- АР-01: 7,46 мин (93%)
MW рассчитанная: 5343,1 г/моль
LCMS2: ((М/3+3) 1782,6; ((М/4)+4) 1336,6; ((М/5+5) 1069,6
Пример 7:
SEQ ID NO 7
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36)
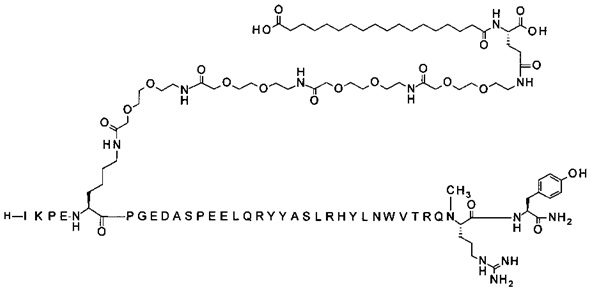
Время удерживания ВЭЖХ-методика UPLC30v01: 3,11 мин (91,6%)
Время удерживания ВЭЖХ-методика UPLC16v01: 13,89 мин (89,7%)
MW рассчитанная: 5213,97 г/моль
MALDI MS: 5215,8 г/моль
Пример 8:
SEQ ID NO 8
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Cln18,Trp30,NMeArg35]hPYY(3-36)
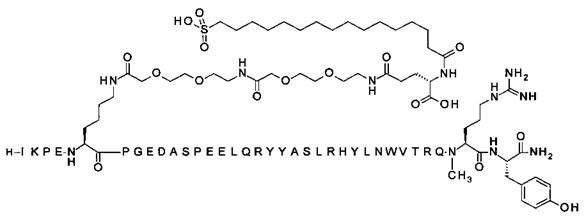
Время удерживания UPLC02v02: 6,63 мин (97%)
Время удерживания UPLC16v01: 11,94 мин (93,2%)
MW рассчитанная: 4945,67 г/моль
LCMS2: ((М/4)+4) 1237,47; ((М/3)+3) 1649,61; ((М/2)+2) 2473,87
Пример 9:
SEQ ID NO 9
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[4-[16-(1Н-тетразол-5-ил)-гексадеканоилсульфамоил]бутаноиламино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36)
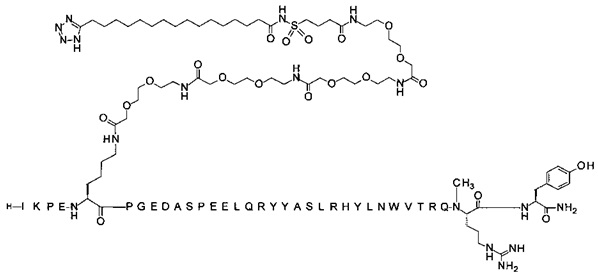
Время удерживания ВЭЖХ-методика UPLC30v01: 3,78 мин (100%)
Время удерживания ВЭЖХ-методика UPLC16v01: 12,41 мин (96,4%)
MW рассчитанная: 5244,0 г/моль
LCMS (LCMS1): m/z 1748,9 ((М/3)+3); 1311,9 ((М/4)+4); 875 ((М/6)+6)
Пример 10:
SEQ ID NO 10
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]бутаноил]-амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Gln18,Aib28,Trp30,NMeArg35]hPYY(3-36)
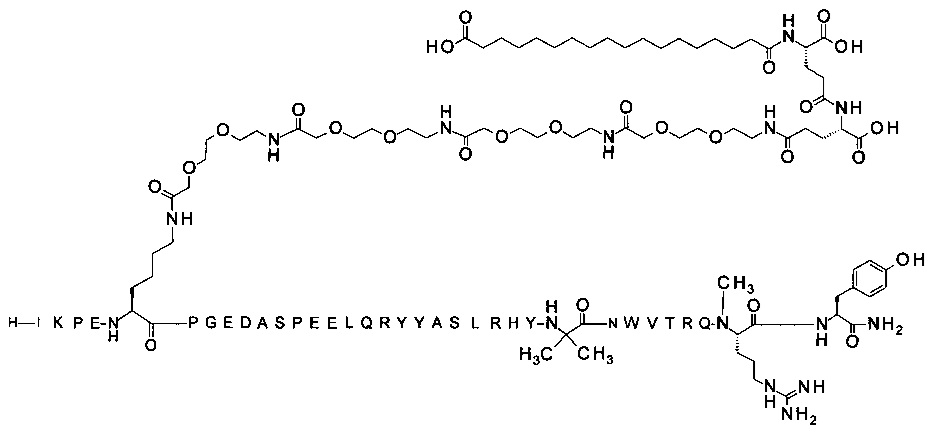
Время удерживания UPLC- АР-01: 7,26 (91,5%)
MW рассчитанная: 5315,0 г/моль
LCMS: ((M/3)+3) 1772,6; ((M/4)+4) 1329,6; ((М/5)+5) 1063,5
Пример 11:
SEQ ID NO 11
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg4,Lys7,Cln18,Trp30,NMeArg35]hPYY(3-36)
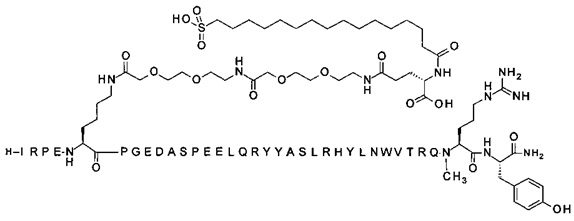
Время удерживания UPLC02v02: 6,64 мин (94,7%)
Время удерживания UPLC16v01: 12,05 мин (92%)
MW рассчитанная: 4973,69 г/моль
Mass (найденная): 4973,35 г/моль
LCMS2: ((М/4)+4) 1244,22; ((М/3)+3) 1658,94
Пример 12:
SEQ ID NO 12
4-N{альфа}-(гексаноил)-7-N{Эпсилон}-2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
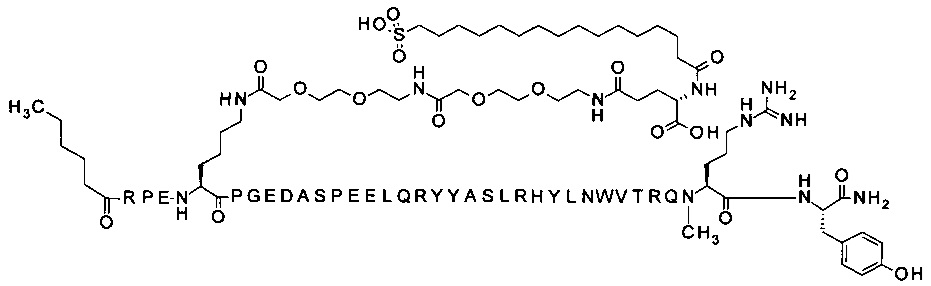
Время удерживания UPLC16v01: 12,72 мин (95,1%)
MW рассчитанная: 4958,67 г/моль
Масса найденная: 4959,22
LCMS2: ((М/4)+4) 1240,64
Пример 13:
SEQ ID NO 13
4-N{альфа}-(3-метил-пентаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
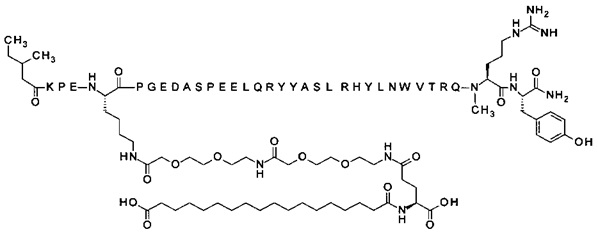
Время удерживания UPLC02v01: 7,76 мин (98%)
Время удерживания UPLC16v01: 9,2 мин (93,2%)
MW рассчитанная: 4908,63 г/моль
LCMS: не определено
Пример 14:
SEQ ID NO 14
4-N{альфа}-(3-метил-пентаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
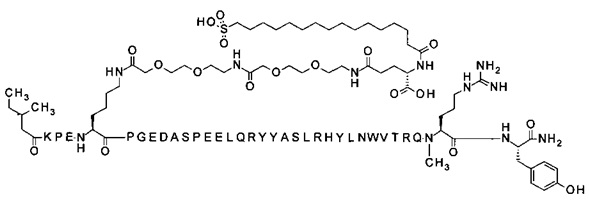
Время удерживания UPLC02v01: 6,96 мин (99%)
Время удерживания UPLC07v01: 5,04 мин (89%)
Время удерживания UPLC16v01: 13,01 мин (89,6%)
MW рассчитанная: 4930,65 г/моль
LCMS2: ((М/1)+1) 4931,6; ((М/3)+3) 1644,5; ((М/4)+4) 1233,4
Пример 15:
SEQ ID NO 15
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]бутаноил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys7,Cln18,Trp30,NMeArg35]hPYY(4-36)
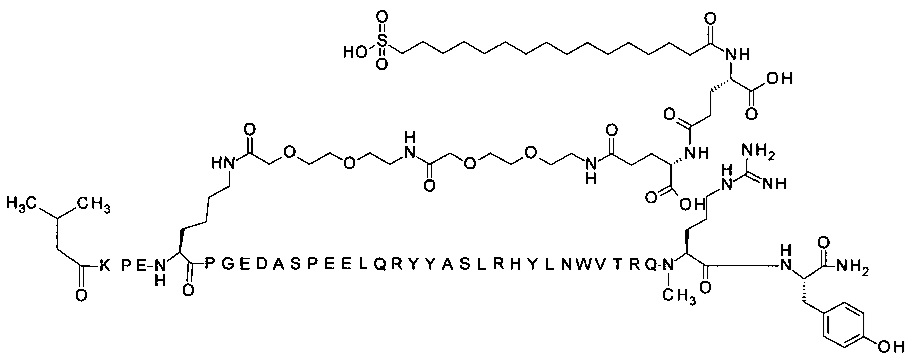
Время удерживания UPLC30v01: 3,37 мин (91,7%)
Время удерживания UPLC16v01: 12,18 мин (91,35%)
MW рассчитанная: 5045,7 г/моль
MALDI (найденная): 5045 г/моль
Пример 16:
SEQ ID NO 16
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
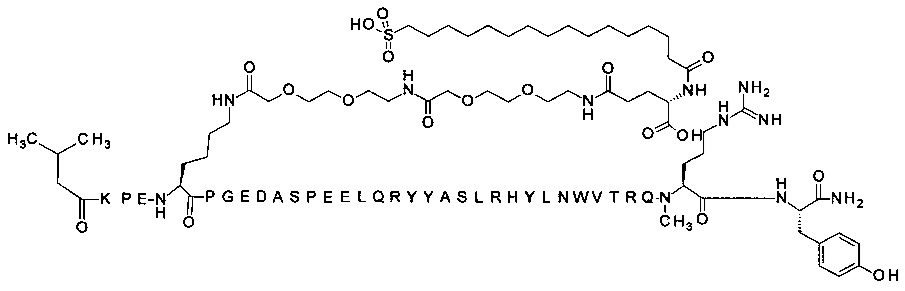
Время удерживания UPLC30v01: 3,43 мин (94,5%)
Время удерживания UPLC16v01: 12,39 мин (90,24%)
MW рассчитанная: 4916,6 г/моль
MALDI (найденная): 4915 г/моль
Пример 17:
SEQ ID NO17
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30]hPYY(4-36)
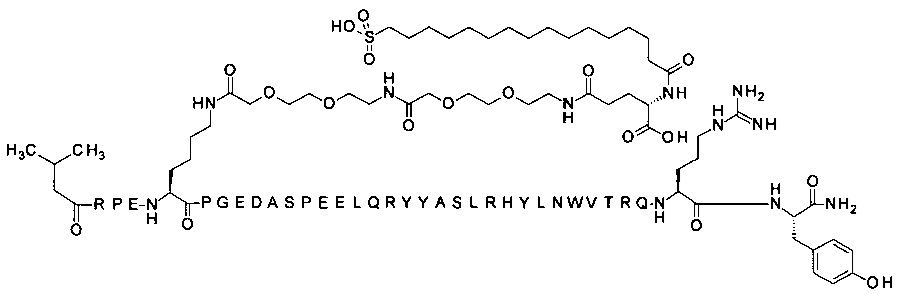
Время удерживания UPLC30v01: 3,50 мин (94%)
Время удерживания UPLC17v01: 8,56 (86,3%)
MW рассчитанная: 4930,62 г/моль
MALDI-MS (найденная): 4929,8 г/моль
Пример 18:
SEQ ID NO 18
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Cln18,Trp30,NMeArg35]hPYY(4-36)
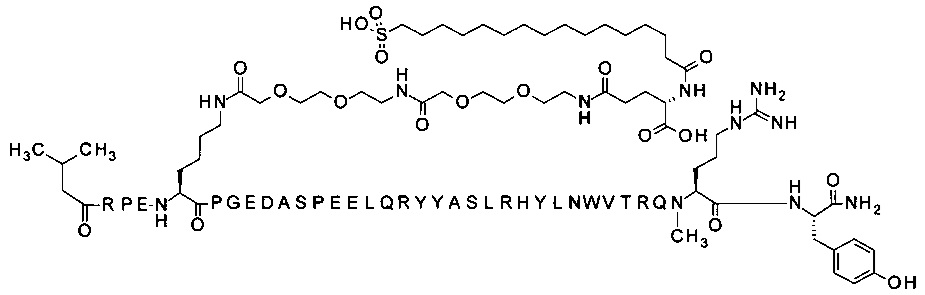
Время удерживания UPLC16v01: 12,23 мин (95,2%)
MW рассчитанная: 4944,6 г/моль
Масса найденная 4945,34
LCMS2: М((/4)+4) 1237,20
Пример 19:
SEQ ID NO 19
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
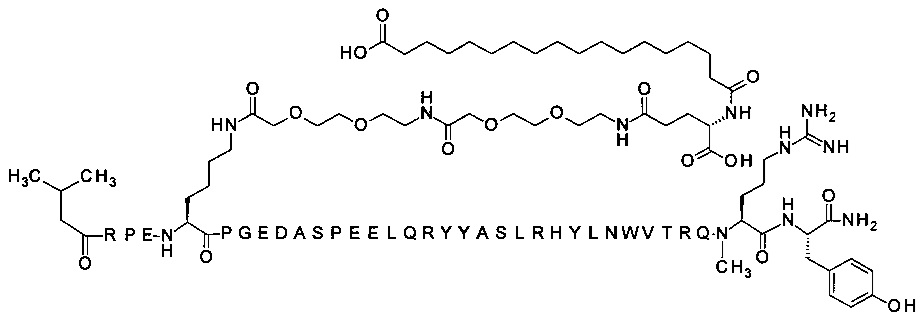
Время удерживания UPLC02v01: 7,69 мин (96,7%)
Время удерживания UPLC17v01: 9,50 мин (92,5%)
MW рассчитанная: 4922,62 г/моль
LCMS (LCMS1): m/z: 1231,7,0 ((М/4)+4); 985,3 ((М/5+5); 821,3 ((М/6+6)
Пример 20:
SEQ ID NO 20
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(14-сульфотетрадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
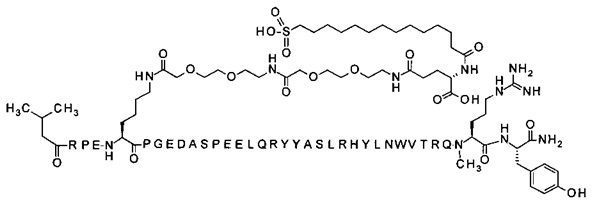
Время удерживания ВЭЖХ-методика UPLC30v01:3,32 мин (90,4%)
Время удерживания ВЭЖХ-методика UPLC60: 17,1 мин (85,2%)
MW рассчитанная: 4916,48 г/моль
LCMS (LCMS1): m/z: 1229,9 ((М/4)+4); 984,33 ((М/5+5)
Пример 21:
SEQ ID NO 21
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-карбокси-гексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
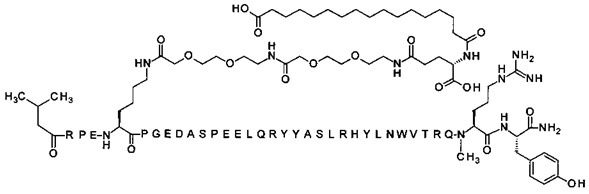
Время удерживания ВЭЖХ-методика UPLC31v01: 13,0 мин (97,4%)
Время удерживания ВЭЖХ-методика UPLC16v01: 3,3 мин (95,8%)
MW рассчитанная: 4908,6 г/моль
LCMS (LCMS1): m/z: 1637,20 ((М/3)+3); 1227,91 ((М/4)+4); 982,52 ((М/5+5)
Пример 22:
SEQ ID NO 22:
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(14-карбокси-тетраканоиламино)бутаноил]амино]этокси]этокси]ацетил]]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
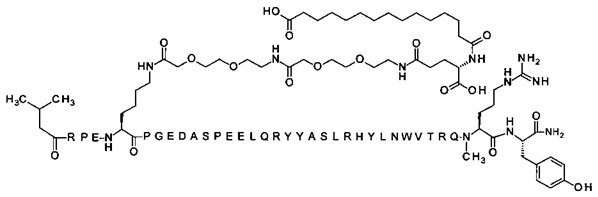
Время удерживания ВЭЖХ-методика UPLC30v01:3,8 мин (97%)
Время удерживания ВЭЖХ-методика UPLC16v01: 10,7 мин (100%)
MW рассчитанная: 4880,43 г/моль
LCMS (LCMS1): m/z: 1627,64 ((М/3)+3); 1220,98 ((М/4)+4); 977,19 ((М/5+5)
Пример 23:
SEQ ID NO 23:
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Cln18,Ile28,Trp30,NMeArg35]hPYY(4-36)
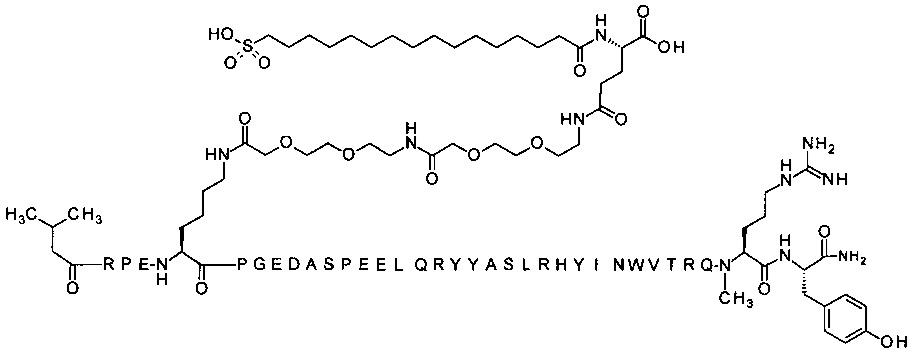
Время удерживания ВЭЖХ-методика UPLC2:6,8 мин (100%)
Время удерживания ВЭЖХ-методика UPLC17: 8,4 мин (91,8%)
MW рассчитанная: 4944,53 г/моль
LCMS (LCMS1): m/z: 1648,2 ((М/3)+3); 1236,2 ((М/4)+4); 988,7 ((М/5+5)
Пример 24:
SEQ ID NO 24
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]-амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
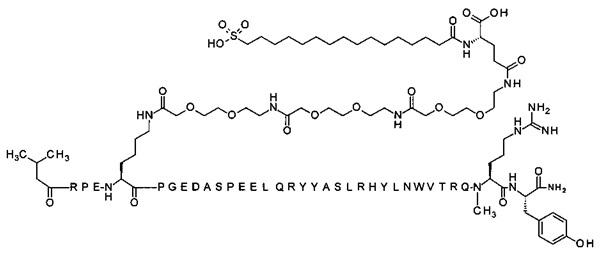
Время удерживания ВЭЖХ-методика UPLC2 6,76 мин (100%):
Время удерживания ВЭЖХ-методика UPLC17 8,4 мин (91,7%)
MW рассчитанная: 5089,69 г/моль
LCMS (LCMS1): m/z: 1696,8 ((М/3)+3); 1272,5 ((М/4)+4); 1017,7 ((М/5+5)
Пример 25:
SEQ ID NO 25
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]-этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
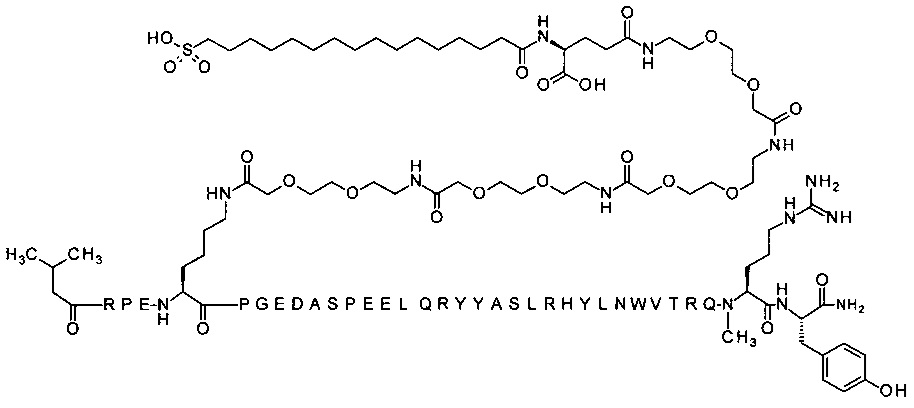
Время удерживания ВЭЖХ-методика UPLC30v01:
Время удерживания ВЭЖХ-методика UPLC16v01:
MW рассчитанная: 5234,84 г/моль
LCMS (LCMS1): m/z: 1745 ((М/3)+3); 1308,7 ((М/4)+4); 1046,7 ((М/5+5)
Пример 26:
SEQ ID NO 26
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
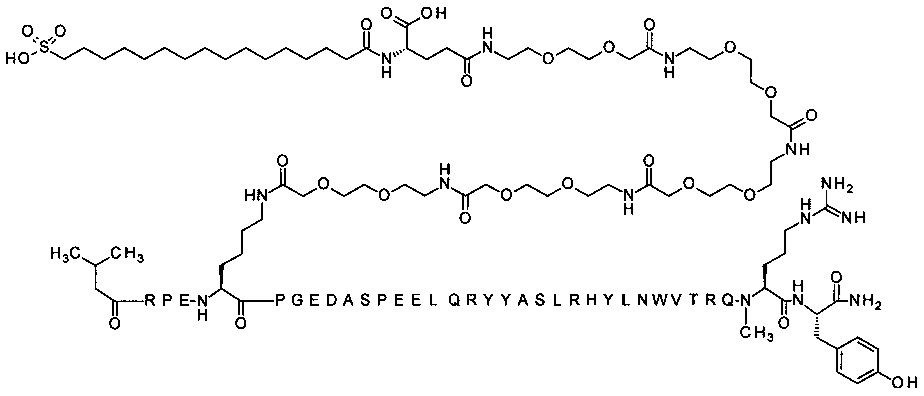
Время удерживания ВЭЖХ-методика UPLC2:6,7 мин (100%)
Время удерживания ВЭЖХ-методика UPLC16v01: 8,5 мин (88,9%)
MW рассчитанная: 5380,00 г/моль
LCMS (LCMS1): m/z: 1793 ((M/3)+3); 1344,9 ((M/4)+4); 1075,8 ((M/5+5)
Пример 27:
SEQ ID NO 27
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[4-[3-[2-[2-[3-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]пропокси]этокси]этокси]пропиламино]-4-оксобутаноил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
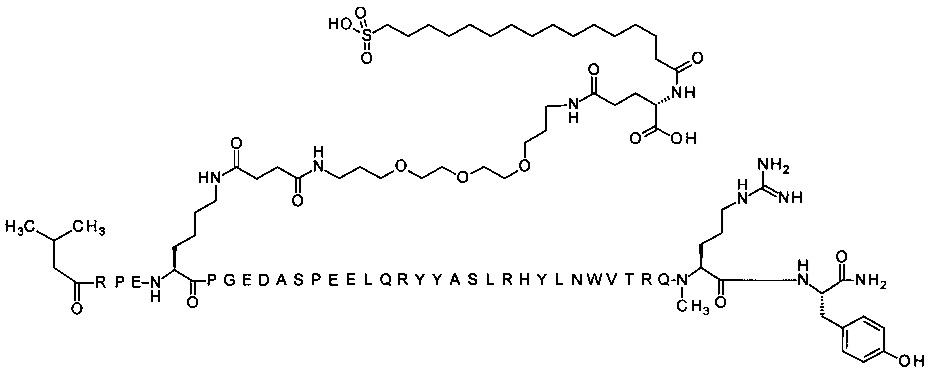
Время удерживания ВЭЖХ-методика UPLC30v01:3,69 мин (93,2%)
Время удерживания ВЭЖХ-методика UPLC16v01: 12,21 мин (84,6%)
MW рассчитанная: 4956,59 г/моль
MW (найденная): 4957,4 г/моль
LCMS (LCMS1): m/z: 1653,23 ((М/3)+3); 1240,19 ((М/4)+4); 992,36 ((М/5+5)
Пример 28:
SEQ ID NO 28
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[4-[3-[2-[2-[3-[[4-[3-[2-[2-[3-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]пропокси]этокси]-этокси]пропиламино]-4-оксобутаноил]амино]пропокси]этокси]этокси]пропиламино]-4-оксобутаноил]-[Arg4,Lys7,Cln18,Trp30,NMeArg35]hPYY(4-36)
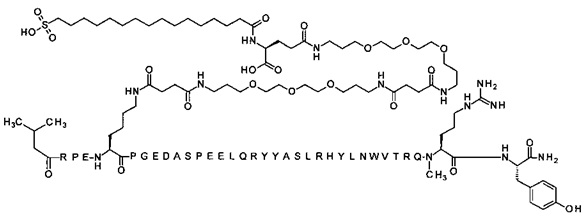
Время удерживания ВЭЖХ-методика UPLC30v01:3,66 мин (92,4%)
Время удерживания ВЭЖХ-методика UPLC16v01: 12,36 мин (65,6%)
MW рассчитанная: 5258,96 г/моль
MW (найденная): 5258,96 г/моль
LCMS (LCMS1): m/z: 1753,96 ((М/3)+3); 1315,80 ((М/4)+4); 1052,80 ((М/5+5)
Пример 29:
SEQ ID NO 29
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[4-[3-[2-[2-[3-[[4-[3-[2-[2-[3-[[4-[3-[2-[2-[3-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]пропокси]-этокси]этокси]пропиламино]-4-оксобутаноил]амино]пропокси]этокси]-этокси]пропиламино]-4-оксобутаноил]амино]пропокси]этокси]этокси]пропиламино]-4-оксобутаноил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
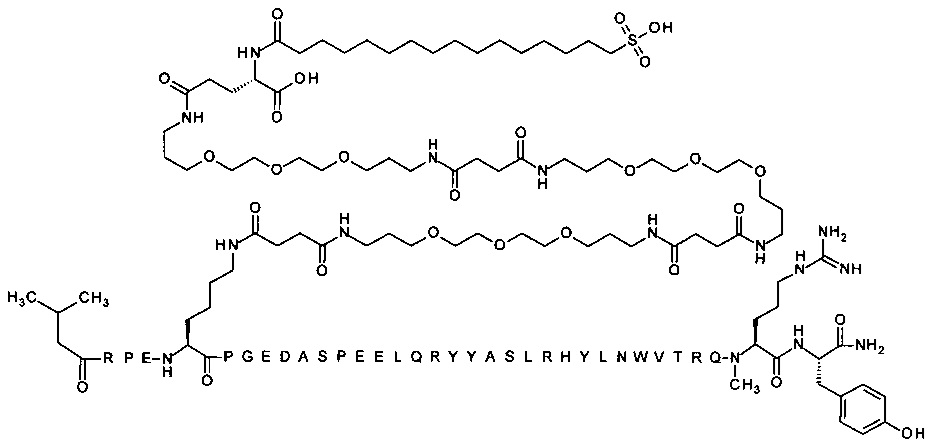
Время удерживания ВЭЖХ-методика UPLC30v01:3,68 мин (94,5%)
Время удерживания ВЭЖХ-методика UPLC16v01: 11,89 мин (85,8%)
MW рассчитанная: 5561,32 г/моль
MW (найденная): 5562,1 г/моль
LCMS (LCMS1): m/z: 1391,31 ((М/4)+4); 1113,26 ((М/5+5)
Пример 30:
SEQ ID NO 30
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[(2S)-2-амино-6-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]-амино]гексаноил]]-[Arg4,Lys7,Cln18,Trp30,NMeArg35]hPYY(4-36)
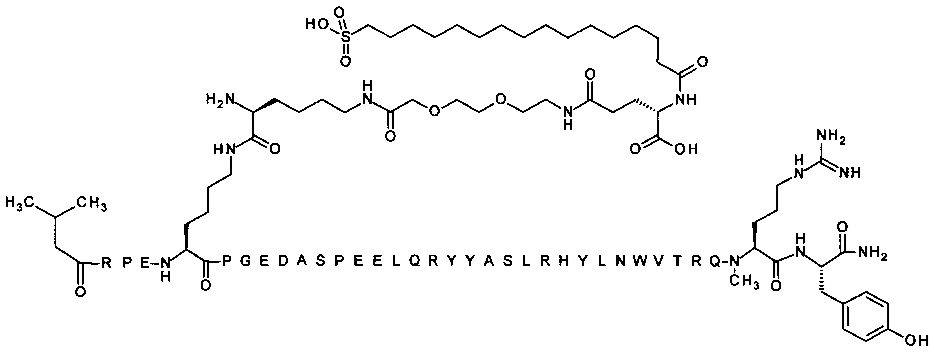
Время удерживания ВЭЖХ-методика UPLC16v01: 11,8 мин (93,29%)
MW рассчитанная: 4927,55 г/моль
MW (найденная): 4928,36 г/моль
LCMS (LCMS1): m/z: 1232,92 ((М/4)+4); 986,54 ((М/5+5)
Пример 31:
SEQ ID NO 31
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(15-карбоксипентадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]-этокси]этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(4-36)
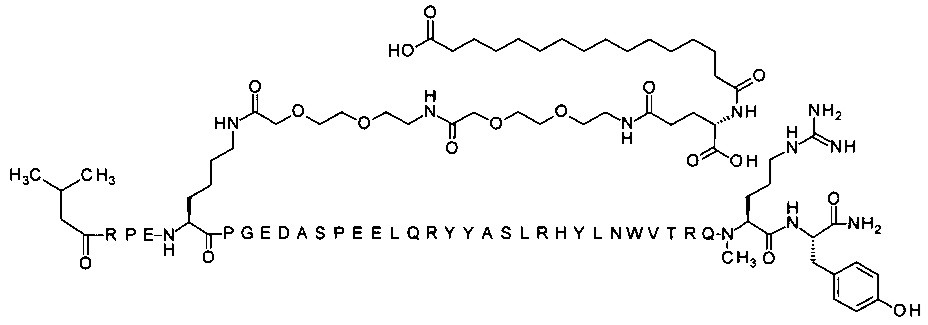
Время удерживания ВЭЖХ-методика UPLC31v01:3,21 мин (95,8%)
Время удерживания ВЭЖХ-методика UPLC61v01: 12,36 мин (85,9%)
MW рассчитанная: 4894,46 г/моль
MW (найденная): 4894,56 г/моль
LCMS (LCMS1): m/z: 1632,52 ((М/3)+3); 1224,64 ((М/4+4)
Пример 32:
SEQ ID NO 32
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Val3,Arg4,Lys7,Gln18,Trp30,NMeArg35]hPYY(3-36)
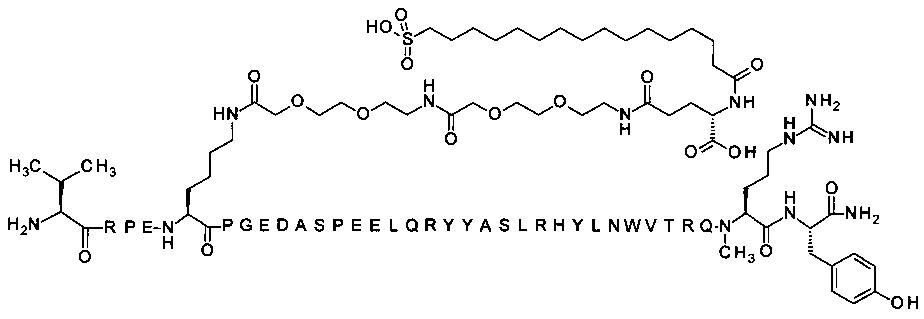
Время удерживания ВЭЖХ-методика UPLC16v01: 12,83 мин (88,6%)
MW рассчитанная: 4859,55 г/моль
MW (найденная): 4960,21 г/моль
LCMS (LCMS1): m/z: 1240-64 ((М/4)+4); 992,91 ((М/5+5)
Пример 33:
SEQ ID NO 33
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,D-Asp11,Gln18,Trp30,NMeArg35]hPYY(4-36)
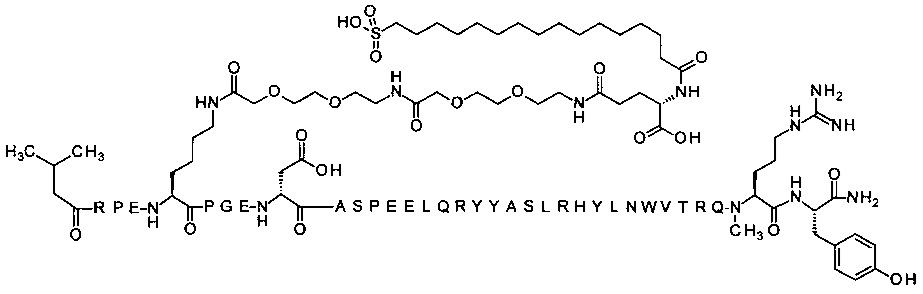
Время удерживания ВЭЖХ-методика UPLC30v01:3,82 мин (95,3%)
Время удерживания ВЭЖХ-методика UPLC17v01: 9,07 мин (90,5%)
MW рассчитанная: 4944,53 г/моль
MW (найденная): 4944,60 г/моль
LCMS (LCMS1): m/z: 1237,15 ((М/4)+4); 989,68 ((М/5+5)
Пример 34:
SEQ ID NO 34
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,изоAsp11,Gln18,Trp30,NMeArg35]hPYY(4-36)
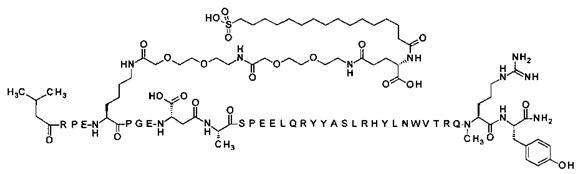
Время удерживания ВЭЖХ-методика UPLC30v01:1,87 мин (89,0%)
Время удерживания ВЭЖХ-методика UPLC17v01: 8,65 мин (74,3%)
MW рассчитанная: 4944,53 г/моль
MW (найденная): 4943,36 г/моль
LCMS (LCMS1): m/z: 1236,84 ((М/4)+4); 989,68 ((М/5+5)
Пример 35:
SEQ ID NO 35
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,D-изоAsp11,Gln18,Trp30,NMeArg35]hPYY(4-36)
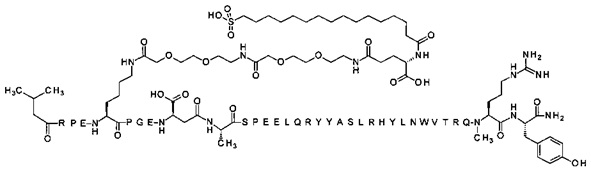
Время удерживания ВЭЖХ-методика UPLC30v01:3,72 мин (98,1%)
Время удерживания ВЭЖХ-методика UPLC61: 12,78 мин (96,2%)
MW рассчитанная: 4944,53 г/моль
Пример 36:
SEQ ID NO 36
4-N{альфа}-(3-метилбутаноил)-7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(17-карбоксигептадеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30]hPYY(4-36)
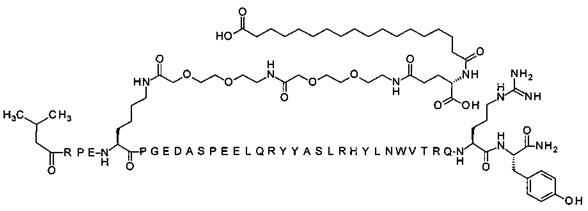
Время удерживания UPLC- АР-01: 7,78 мин (96%)
MW рассчитанная: 4909,48 г/моль
MW (найденная): 4909,8 г/моль
LCMS (LCMS1): m/z: 1637,6 ((М/3)+3); 1228,2 ((М/4)+4); 982,9 ((М/5+5)
Пример 37:
SEQ ID NO 37
7-N{Эпсилон}-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(16-сульфогексадеканоиламино)-бутаноил]амино]этокси]этокси]ацетил]амино]этокси]-этокси]ацетил]-[Arg4,Lys7,Gln18,Trp30]hPYY(3-36)
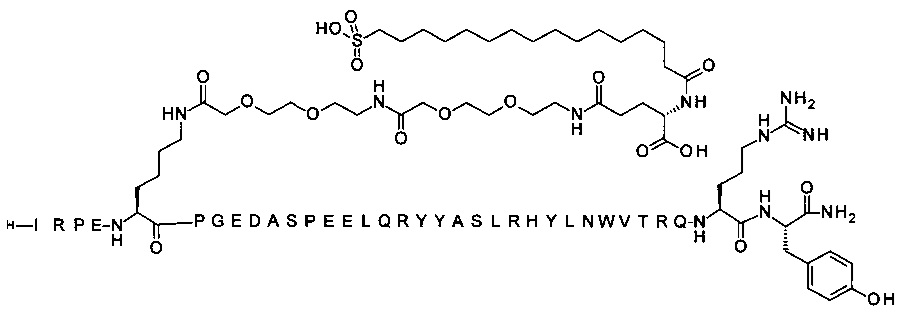
Время удерживания UPLC-AP-01: 6,51 мин (95,3%)
MW рассчитанная: 4960,7 г/моль
MW (найденная): 4960,2 г/моль
LCMS (LCMS1): m/z: 1654,46 ((M/3)+3); 1241,1 ((M/4)+4); 992,7 ((M/5+5)
Пример 38:
SEQ ID NO 38
4-N{альфа}-(3-метилбутаноил)-[Arg4,Gln18,Trp30,NMeArg35]hPYY(4-36)

Время удерживания UPLC16: 13,18 мин (62,5%)
Время удерживания UPLC29: 3,80 мин (92,3%)
MW рассчитанная: 4149,6 г/моль
MW (найденная): 4149,9,2 г/моль
LCMS (LCMSv27): m/z: 1384,04 ((М/3)+3); 1038,28 ((М/4)+4); 830,83 ((М/5+5)
Фармакологические способы
Выгода от производных пептида PYY или их аналогов согласно данному изобретению в качестве фармацевтически активных агентов, которая заключается в уменьшении массы тела и в лечении ожирения у млекопитающих (таких как человек), а также в лечении сахарного диабета, может быть продемонстрирована активностью агонистов в стандартных анализах in vitro и in vivo, описанных ниже.
Такие анализы также предлагают средства, посредством которых активность соединений PYY согласно данному изобретению можно сравнить с активностью известных соединений.
Пример 39: Рецепторная эффективность соединений PYY
Целью данного примера является анализ активности, или эффективности, соединений PYY in vitro. Активность in vitro является мерой активации человеческих рецепторов подтипов Y1, Y2, Y4 и Y5, соответственно, в анализе на цельных клетках.
Эффективность соединений PYY из примеров 3-38 определяли с использованием функционального анализа активности Actone, описанного ниже. hPYY(3-36) (пример 2, SEQ ID NO 2) был включен в качестве референса.
Функциональный анализ активности Actone
Рецепторы нейропептида Y (NPY) являются Gi-связанными рецепторами, семь раз пронизывающими мембрану, которые главным образом передают сигнал по цАМФ-зависимому пути, ингибируя активность аденилатциклазы, что приводит к снижению производства цАМФ из АТФ. Анализ Actone основан на модифицированном кальциевом канале, который имеет селективное связывание с цАМФ, что приводит к притоку кальция в клетку, что обнаруживается с помощью метки, чувствительной к кальцию. Чтобы измерить сниженные уровни цАМФ в результате активации рецептора NPY, добавляют (β1/β2-адренорецепторный агонист, изопротеренол, который активирует аденилатциклазу и повышает содержание цАМФ в клетке. Снижение клеточных концентраций кальция, которое отражает снижение уровней цАМФ вследствие активации рецептора NPY, определяется как снижение флуоресценции от метки, чувствительной к кальцию.
Клетки НЕК-293, экспрессирующие цАМФ-чувствительный кальциевый канал и один из человеческих NPY-рецепторов Y1, Y2, Y4 или Y5 (CodexBiosolution, Гейтерсберг, Мэриленд, США), высевали на 384-луночные планшеты, покрытые полилизином, с плотностью 14000 клеток/лунка в объеме 25 мкл в среде DMEM, содержащей 10% фетальной телячьей сыворотки (FCS), 1% пенициллина-стрептомицина, 250 мкг/мл аминогликозидного антибиотика G418 и 1 мкг/мл аминонуклеозидного антибиотика пуромицина. Клетки инкубировали в течение ночи при температуре +37°C в увлажненной среде с 5% CO2, а затем добавляли 25 мкл буфера с кальциевой меткой, содержащего: 1 флакон метки Calcium 5 (Molecular Devices, Саннивейл, Калифорния, США), растворенный в 100 мл буфера, содержащего 20 мМ HEPES, 0,1% овальбумин, 0,005% Tween 20, 1,5 мМ пробенецид, 250 мкМ PDE-ингибитор 4-(3-бутокси-4-метоксибензил)имидазолидин-2-он и 8 мМ CaCl2, и pH доводили до 7,40. Клетки инкубировали в течение 1 часа с буфером, содержащим кальциевую метку, а затем помещали в систему FLIPR Tetra System (Molecular Devices), где с помощью системы для переноса жидкости добавляли соединение PYY (в конечной концентрации 1000-1 нМ) и изопротеренол (в конечной концентрации 0,05 мкМ), одновременно напрямую измеряя сигнал флуоресценции (Ех540/Ет590) в течение 360 секунд с интервалом 30 секунд. Все измерения проводили в двух повторах и вычисляли значения ЕС50 с помощью нелинейного регрессионного анализа сигмоидальных кривых "доза-ответ", используя GraphPad Prism v 5,02 (программное обеспечение Graph Pad, Ла-Холья, Калифорния, США). Значения ЕС50 приведены в таблице 1.
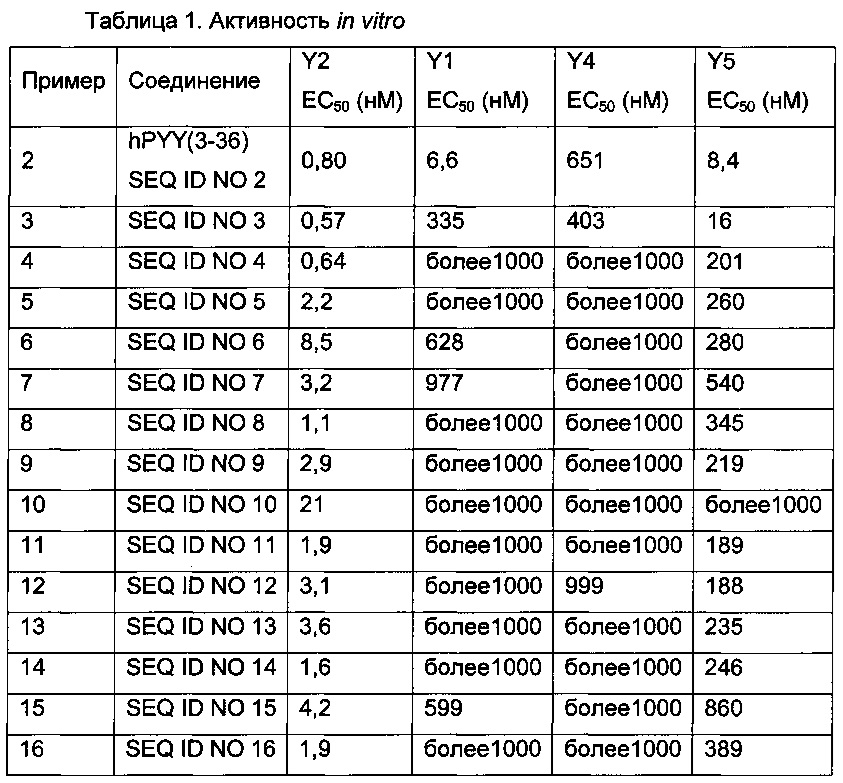
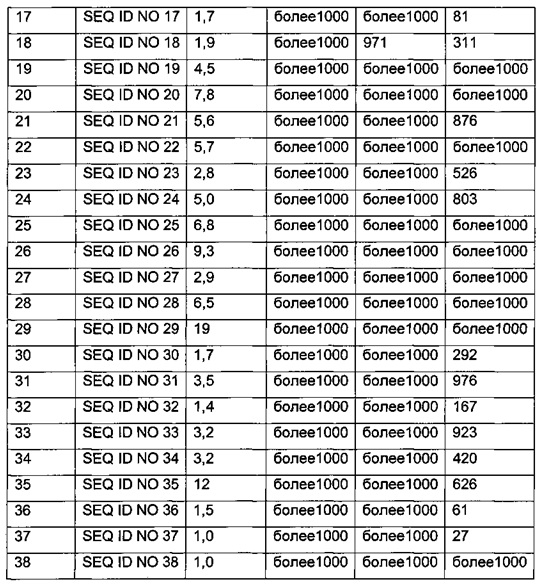
Все соединения PYY изобретения обладают хорошей Y2-активностью, в то время как активность в отношении рецепторов Y1, Y4 и Y5 сильно снижена.
Пример 40: связывание рецепторов подтипа Y1, Y2, Y4 и Y5
Целью данного примера является in vitro анализ связывания соединений PYY с рецепторами подтипов Y1, Y2, Y4 и Y5, соответственно. Аффинность рецепторного связывания является мерой аффинности соединения к человеческому рецептору подтипов Y1, Y2, Y4 и Y5, соответственно.
Связывание in vitro соединений PYY из примеров 3-38 определяли в анализе сцинтилляционной близости (SPA), описанном ниже. hPYY(3-36) (пример 2, SEQ ID NO 2) был включен в качестве референса.
Анализ сцинтилляционной близости (SPA)
Клеточные линии, экспрессирующие NPY-рецептор. Все клетки культивировали при +37°C в увлажненной атмосфере с 5% CO2. Клетки ВНК-482-8 с индуцибельной экспрессией человеческого рецептора Y1 (Р25929, NPY1R_HUMAN, UniProt) культивировали в среде Игла в модификации Дульбекко (DMEM) с 10% фетальной телячьей сыворотки (FBS), 1% пенициллина-стрептомицина (P/S), 1 мг/мл антибиотика G418, 1 мг/мл антибиотика гигромицина и 1% заменимых аминокислот.Для индукции экспрессии рецептора NPY-Y1 за 24 часа до сбора клеток добавляли 1 мМ изопропил-β-D-1-тиогалактопиранозид (IPTG). Клетки СНО-К1, стабильно экспрессирующие человеческий рецептор Y2 (Р49146, NPY2R_HUMAN, UniProt), культивировали в DMEM F-12 с добавлением 10% FBS, 1% P/S, 150 мкг/мл гигромицина В и 10 мкг/мл антибиотика пуромицина. Клетки СНО-К1, стабильно экспрессирующие человеческий рецептор Y4 (Р50391, NPY4R_HUMAN, UniProt), культивировали в DMEM F-12 с добавлением 10% FBS, 1% P/S, 10 мкг/мл пуромицина. Клетки НЕК-293, стабильно экспрессирующие человеческий рецептор Y5 (Q15761, NPY5R_HUMAN, UniProt), культивировали в среде DMEM F-12, содержащей 10% FBS, 1% пенициллина-стрептомицина, 250 мкг/мл G418 и 1 мкг/мл пуромицина.
Получение препарата мембран. Культивируемые клетки отделяли механически путем соскабливания и промывали ледяным PBS (137 мМ NaCl, 2,7 мМ KCl, 4,3 мМ Na2HPO4, 1,47 мМ KH2PO4, pH доводили до 7,4), переносили в пробирки и центрифугировали в течение 5 мин при 1000 g при +4°C. Осадок ресуспендировали в ледяном буфере для гомогенизации; Y1: 20 мМ Hepes, 10 мМ EDTA, с 2 полными таблетками смеси ингибиторов протеаз, свободной от EDTA, на 50 мл (Roche, Мангейм, Германия) pH 7,4); Y2, Y4: 20 мМ HEPES, 5 мМ MgCl2, 1 мг/мл бацитрацина, pH 7,1; Y5: 10 мМ NaCl, 20 мМ HEPES, 0,22 мМ KH2PO4, 1,26 мМ CaCl2, 0,81 мМ MgSO4, pH 7,4, и затем гомогенизировали в течение 30 секунд с помощью гомогенизатора тканей на средней скорости. Гомогенат центрифугировали при 35000 g, используя ультрацентрифугу, в течение 10 минут при +4°C, супернатант удаляли и добавляли свежий буфер для гомогенизации. Гомогенизацию осадка повторяли в общей сложности три раза. Конечный осадок ресуспендировали в нескольких миллилитрах буфера для гомогенизации, определяли концентрацию белка по методу Бредфорда, измеряя при длине волны 595 нм в ридере для микротитровальных планшетов. Концентрацию белка доводили до 1 мг/мл, переносили в криопробирки и хранили при -80°C. К Y5-мембранам перед замораживанием добавляли 250 мМ сахарозы.
Анализ. SPA-анализ связывания человеческого рецептора Y проводили в белых 96-луночных планшетах в общем объеме 200 мкл на лунку. Сцинтилляционную жидкость, содержащую гранулы, покрытые агглютинином зародышей пшеницы (PerkinElmer, Уолтем, Массачусетс, США), разводили в буфере для связывания; Y1, Y2: 50 мМ HEPES, 1 мМ CaCl2, 5 мМ MgCl2, 0,02% Tween 20, 0,25% овальбумин, pH 7,4; Y4, Y5: 20 мМ HEPES, 10 мМ NaCl, 0,22 мМ KH2PO4, 1,26 мМ CaCl2, 0,81 мм MgSO4, 0,1% бацитрацин и 0,25% овальбумин, pH 7,4, и смешивали с препаратом мембран, получая конечную концентрацию 1 мг гранул и 3 мкг мембран Y1/лунка, 3 мкг мембран Y2/лунка, 1 мкг мембран Y4/лунка или 20 мкг мембран Y5/лунка. В анализах связывания Y1, Y2 и Y5 добавляли 50000 срт/лунка радиоактивного лиганда человеческого [125I]-PYY, что соответствовало концентрации 100 пМ. В анализе связывания Y4 использовали 50000 срт/лунка радиоактивного лиганда человеческого [125I]-PYY-панкреатического полипептида (РР), что соответствовало концентрации 100 пМ.
Лиофилизированные аналоги растворяли в растворе, содержащем 80% диметилсульфоксида (DMSO), 19% H2O и 1% уксусной кислоты (СН3СООН), получая стоковые растворы с концентрацией 2000 мкМ (Y1, Y4 и Y5) и 200 мкМ (Y2), и выполняли серийные разведения (1:10) в связывающем буфере до конечной концентрации в диапазоне от 10000 нМ до 1 пМ в анализах Y1, Y4 и Y5 и от 1000 нМ до 0,1 пМ в анализе Y2. Планшеты герметизировали и инкубировали при 25°C в течение 2-х часов в планшетном шейкере, установленном на 400 об/мин, а затем центрифугировали при 1500 об/мин в течение 10 минут, после чего регистрировали люминесценцию на микропланшетном сцинтилляционном и люминесцентном счетчике. SPA-планшеты Y1 оставляли при комнатной температуре на 16 часов, а затем считывали сигнал. Вытеснение радиоактивного лиганда измеряли как уменьшение люминесценции и рассчитывали значения IC50 путем нелинейного регрессионного анализа сигмоидальных кривых "доза-ответ". Согласно уравнению Ченга-Прусоффа (Ki=IC50/(1+[L]/Kd) получали значения Ki для аффинности связывания, включая рецептор-специфические значения Kd (Y1 равно 0,556 нМ; Y2 равно 0,275 нМ; Y4 равно 0,111 нМ; Y5 равно 0,345 нМ), концентрацию радиоактивного лиганда и значения IC50.

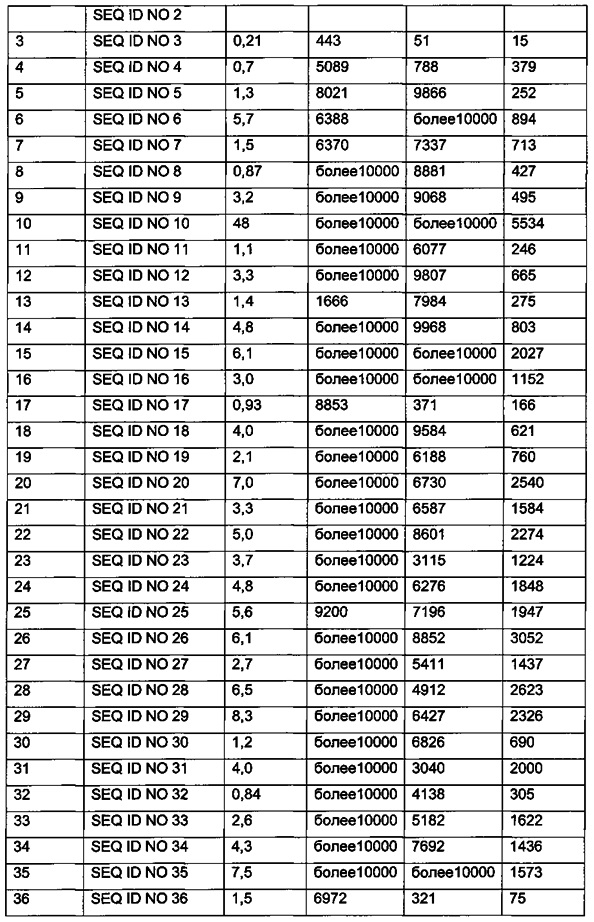
Все соединения PYY согласно данному изобретению обладают хорошей аффинностью связывания Y2, в то время как аффинность связывания по отношению к рецепторам Y1, Y4 и Y5 сильно снижается.
Пример 41: Фармакокинетические исследования на карликовых свиньях
Целью данного исследования является определение периода полужизни in vivo соединений PYY после внутривенного введения карликовым свиньям, т.е. удлинение времени их нахождения в организме и, следовательно, времени их действия. Это делается в фармакокинетическом (PK) исследовании, где определяется конечный период полужизни рассматриваемого производного. Под конечным периодом полужизни обычно понимается период времени, который требуется для того, чтобы вдвое сократить определенную концентрацию в плазме, измеренную после фазы начального распределения.
Исследования in vivo по оценке фармакокинетики у геттингенских карликовых свиней после внутривенного введения
Животные. Самки геттингенских карликовых свиней, от 15 до 25 кг, куплены у Ellegaard Minipigs, Дания. Животных содержали в Animal Unit, Novo Nordisk A/S в соответствии с обычной процедурой в Animal Unit. После акклиматизации минимум в течение 2 недель каждому животному устанавливали два постоянных центральных венозных катетера в хвостовую полую вену. После операции животные находились в их обычных индивидуальных загонах в течение фармакокинетических экспериментов.
Масса тела. Животных еженедельно взвешивали. Животных не кормили по утрам перед введением дозы, но предоставляли свободный доступ к воде; еда подавалась во время введения дозы.
Введение пептидов и дозирующих растворов. Внутривенные инъекции проводили через центральный короткий катетер, который промывали минимум 10 мл стерильного физиологического раствора после введения дозы. Исследуемое вещество вводили в концентрации 15 нмоль/кг, n равно 3, в объеме 0,05 мл/кг. Буфер: 50 мМ фосфат натрия, 70 мМ хлорида натрия, 0,05% Tween 80, pH 7,4, или 20 мМ HEPES, 2,2% глицерин, 0,05% полисорбат 80, pH 6,5.
Образцы крови и анализ. Образцы крови забирали через центральный катетер в соответствии со следующим расписанием: перед введением дозы, через 5, 15, 30, 45 мин, 1 ч, 1,5 ч, 2 ч, 3 ч, 4 ч, 6 ч, 8 ч, 10 ч, 24 ч, 48 ч, 72 ч, 96 ч, 120 ч, 168 ч, 192 ч, 216 ч, 240 ч, 264 ч и 288 ч. В первый день катетеры соединяли с катетерами-удлинителями, которые удаляли в конце первого дня. Образцы (0,8 мл) забирали через катетер. Кровь собирали в пробирки, содержащие EDTA-буфер (8 мМ) и 50 мкл Val-Pyr-буфера (добавляли стабилизирующий буфер, содержащий 3,097 г K3EDTA, растворенной в 50 мл трасилола и 0,5 мл 20 мМ Val-Pyr. Значение pH доводили до 7,4). После каждого забора крови катетер промывали минимум 5 мл стерильного 0,9% NaCl и 10 МЕ/мл гепарина. Асептическая техника была необходима, чтобы избежать роста бактерий в катетере, который повышал бы риск образования тромбов в катетере. Образцы хранили на мокром льду до центрифугирования (10 мин, 4°C, 1942 g). Затем плазму (минимум 200 мкл) немедленно переносили в пробирки Micronic и хранили при -20°C до анализа. Образцы плазмы анализировали с помощью LC/MS, как описано ниже.
Данные и результаты. Профили "плазменная концентрация-время" анализировали с помощью некомпартментного фармакокинетического анализа с использованием Phoenix (Pharsight Inc., Маунтин-Вью, Калифорния, США). Расчеты проводили с использованием индивидуальных значений "концентрация-время" для каждого животного.
Анализ образцов
Количественный анализ образцов плазмы. Анализируемые вещества исследовали в плазме с помощью хроматографии с турбулентным потоком в сочетании с жидкостной хроматографией с последующим масс-спектрометрическим обнаружением (TFC/LC/MS). Селективность методики позволяла количественно оценить различные соединения в одном образце, например, дозированные кассеты четырех соединений на одно животное. Концентрации исследуемого вещества в неизвестных образцах рассчитывали с использованием площади пика как функции от количества. Калибровочные графики, основанные на образцах плазмы с добавленными анализируемым веществом, строили путем регрессионного анализа. Типичный динамический диапазон для анализа составлял от 1 до 2000 нмоль/л. Эффективность методики была обеспечена за счет одновременного анализа образцов контроля качества (quality control, QC) в двух повторах на трех уровнях концентрации. Стоковые и рабочие растворы анализируемых веществ готовили в плазме и инкубировали при 37°C в течение 1 часа.
Подготовка образцов. К 40,0 мкл EDTA-плазмы добавляли 160 мкл 50% метанола, 1% муравьиной кислоты, а затем перемешивали и центрифугировали при 14300 об/мин (16457 g) при температуре 4°C в течение 20 минут. Супернатант переносили в 96-луночный планшет (планшеты предварительно инкубировали с 0,4% BSA, 37°C, в течение получаса). Объем введения составлял 25 мкл.
Для очистки образцов использовали колонку TurboFlow Cyclone (0,5×50 мм) от Thermo Scientific, Франклин, Массачусетс, США, а LC-разделение проводили на колонке Onyx С18 (2,0×50 мм) от Phenomenex, Торранс, Калифорния, США. Элюенты представляли собой изократические и градиентные комбинации метанола, ацетонитрила, воды Milli-Q и муравьиной кислоты. Селективное обнаружение проводили с помощью масс-спектрометрии, используемой в положительном режиме ионизации.
Обработка данных. Профили "плазменная концентрация-время" анализировали с помощью некомпартментного фармакокинетического анализа с использованием Phoenix (Pharsight Inc., Маунтин-Вью, Калифорния, США). Расчеты проводили с использованием индивидуальных значений "концентрация-время" для каждого животного.
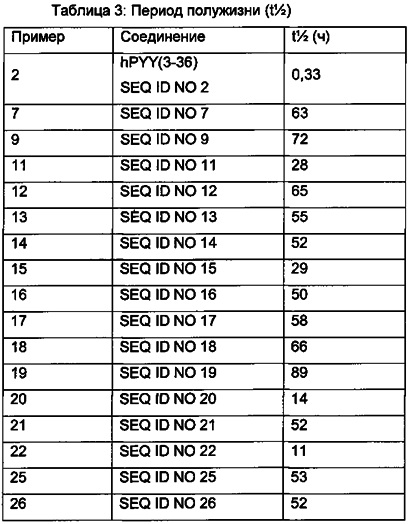
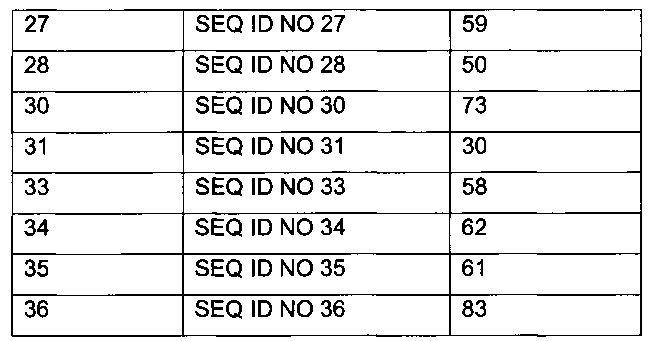
Анализируемые соединения PYY согласно данному изобретению имеют очень длительный период полужизни по сравнению с периодом полужизни hPYY(3-36).
Пример 42: Фармакодинамические исследования на мышах db/db
Для того чтобы определить in vivo влияние соединений PYY на содержание глюкозы в крови и на потребление пищи в условиях диабета, соединения анализировали на мышиной диабетической модели с ожирением (мыши db/db), как описано ниже.
Самцов мышей db/db помещали в нормальный суточный ритм (период темноты - с 18:00 до 6:00) и обеспечивали свободный доступ к корму Altromin. В возрасте от 11 до 13 недель мышей подбирали по содержанию глюкозы в крови, а также по массе тела, разделяли на соответствующие группы из 9 мышей и помещали по 3 мыши в клетке. Мышам подкожно вводили указанное соединение или носитель (50 мМ Na2HPO4, pH 7,4, 70 мМ NaCl, 0,05% Tween 80) в объеме 2,5 мл/кг в указанных дозах в 16:00 (момент времени равен 0), и в некоторых экспериментах второе введение осуществляли в момент времени равный 23 часам. Содержание глюкозы в крови и потребление корма измеряли в указанные моменты времени после введения, например через 4 часа (4 ч), 16 часов (16 ч), 23 часа (23 ч) и 40 часов (40 ч) после введения. Образцы крови для анализа уровня глюкозы в крови брали из хвостовой вены в стеклянный капилляр объемом 5 мкл, покрытый гепарином, который помещали в пробирку Эппендорф с раствором системы Biosen® (250 мкл). Образцы немедленно анализировали на приборе Biosen®.
Содержание глюкозы в крови (BG, от англ. blood glucose) представляли как среднее значение плюс/минус стандартная ошибка среднего (SEM, от англ. standard error of mean) скорректированного по носителю %BG относительно значений до введения и рассчитывали следующим образом:
100-[%BG(носитель, среднее)-% BG], где,
%BG равно 100*[BG(время - t)/BG (до введения)]
и %BG(носитель, среднее) = среднее для значений %BG в группе, получавшей носитель, в момент времени = t относительно значения до введения носителя.
Потребление пищи представляли как среднее значение плюс/минус SEM потребления корма в клетке в виде процента от среднего потребления пищи в группе, получавшей носитель, для указанного интервала.
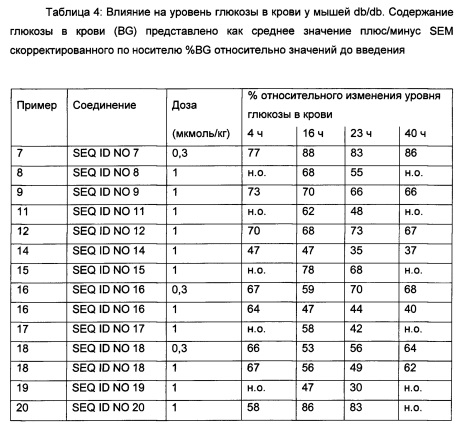

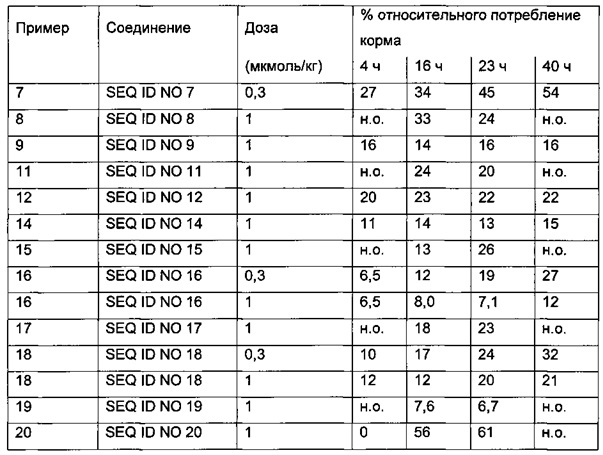
Эти данные решительно подтверждают эффект PYY соединений согласно данному изобретению, который заключается в снижении уровня глюкозы в крови и ингибировании потребления пищи.
Пример 43: Физическая стабильность
Целью данного исследования является определение стабильности пептидных составов в присутствии и в отсутствие фенола. В качестве меры стабильности пептидного состава анализировали формирование высокомолекулярных пептидных структур (%HMWP) с течением времени с помощью эксклюзионной ВЭЖХ (SEC-HPLC).
Составы: Аналоги солюбилизировали до 1 мМ в 30 мМ Na-фосфатном буфере, 10 мМ NaCl, pH 8,2. При необходимости pH стокового раствора подводили с помощью NaOH. Далее эти стоковые растворы разводили в указанном выше буфере или в соответствующем буфере, содержащем фенол, получая окончательные составы с композициями, как показано в таблице 6.
Инкубация: Образцы разделяли по флаконам для UPLC с плотно завинчивающимися крышками и инкубировали при температуре 37°C и 5°C, образцы из температуры 37°C переносили на 5°C или анализировали через 1, 2 и 4 недели. Образец при 5°C использовали в качестве исходного значения.
Способ анализа: Содержание HMWP анализировали с использованием диссоциационной эксклюзионной ВЭЖХ с SEC-колонкой Waters Insulin HMWP (7,8×300 мм) при температуре колонки 50°C. Образцы элюировали путем изократического элюирования элюентом, содержащим 500 мМ NaCl, 10 мМ NaH2PO4, 5 мМ H3PO4, 50% (об/об) 2-пропанол, со скоростью потока 0,5 мл/мин. Обнаружение проводили при 215 нм.
Как видно из таблицы 6, добавление N-концевого заместителя, такого как 3-метилбутаноил, уменьшает формирование агрегатов (высокомолекулярных белков - HMWP). Замена лизина в позиции 4 на аргинин также уменьшает образование агрегатов. Комбинация добавления N-концевого заместителя и замены лизина в позиции 4 на аргинин значительно снижает образование агрегатов.
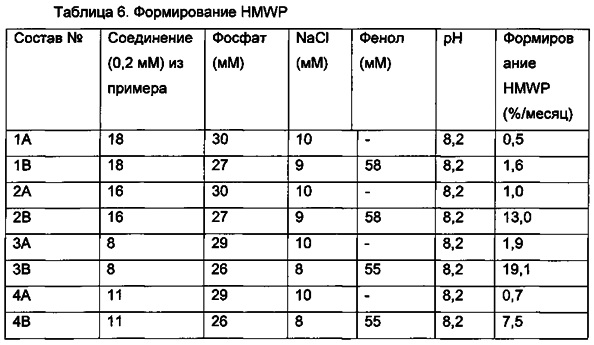
Пример 44: Фармакодинамический эффект комбинированного введения соединения PYY и агониста GLP-1 у самок свиней породы Ландрас-Йоркшир-Дюрок (LYD)
Для того чтобы определить влияние in vivo комбинированного введения соединения PYY и агониста GLP-1 на потребление пищи у свиней, измеряли эффект либо агониста GLP-1 лираглутида в одиночку, либо комбинации лираглутида и соединения PYY из примера 18 (SEQ ID NO 18), как описано ниже.
Материалы и методы
В WO 98/08871 описан лираглутид (пример 37), в том числе способ получения лираглутида.
Изучали влияние на потребление пищи у самок свиней породы Ландрас-Йоркшир-Дюрок (LYD) (Askelygaard, Роскилле, Дания) примерно 3-месячного возраста весом от 30 до 43 кг (n равно 4). Животные акклиматизировались в течение от 1 до 2 недель до начала исследования и получали корм для свиней без ограничения (Svine 5, Brogaarden, Дания) все время как в период акклиматизации, так и в экспериментальный период. В течение экспериментального периода животных помещали в индивидуальные загоны для измерения индивидуального потребления корма с использованием системы Mpigwin (Ellegaard Syste, Фоборг, Дания). Весь пролитый корм (пищевые отходы) собирали и взвешивали, и измеренное потребление пищи вручную корректировали на это количество (скорректированное потребление пищи).
Соединение PYY из примера 18 (SEQ ID NO 18) анализировали в виде одного подкожного введения в двух различных дозах, 25 и 50 нмоль/кг, в комбинации с 3 нмоль/кг лираглутида. Лираглутид вводили подкожно один раз в день с дня - 4 до дня 3 (0,017 мл/кг, что соответствует 2 нмоль/кг, в первые 2 дня, а затем 0,025 мл/кг, что соответствует 3 нмоль/кг, в оставшиеся 6 дней). Аналог PYY вводили один раз утром в день 0 (объем дозы составлял 0,025 мл/кг). Аналог PYY собирали в состав в следующем буфере, который также служил носителем для введений PYY: 50 мМ фосфат натрия, 70 мМ хлорид натрия, 0,05% Tween 80, pH 7,4. Лираглутид собирали в состав в следующем буфере, который также служил носителем для ежедневных введений лираглутида: 8 мМ фосфат, 184 мМ пропиленгликол, 58 мМ фенол, pH 8, 15.
Индивидуальное потребление пищи в процентах от среднего потребления пищи рассчитывали на день 0-4 и оценивали статистически в двухстороннем ANOVA с последующим апостериорным тестом Бонферрони.

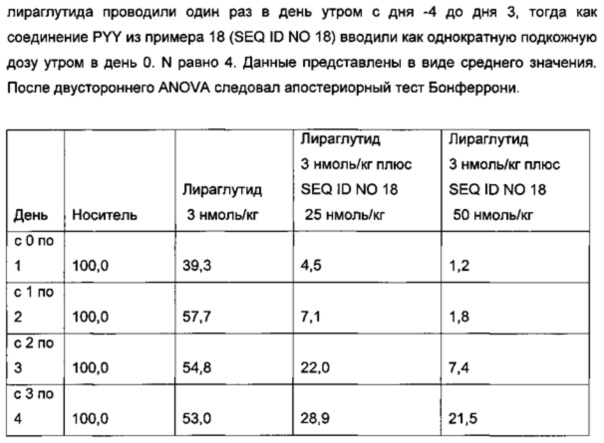
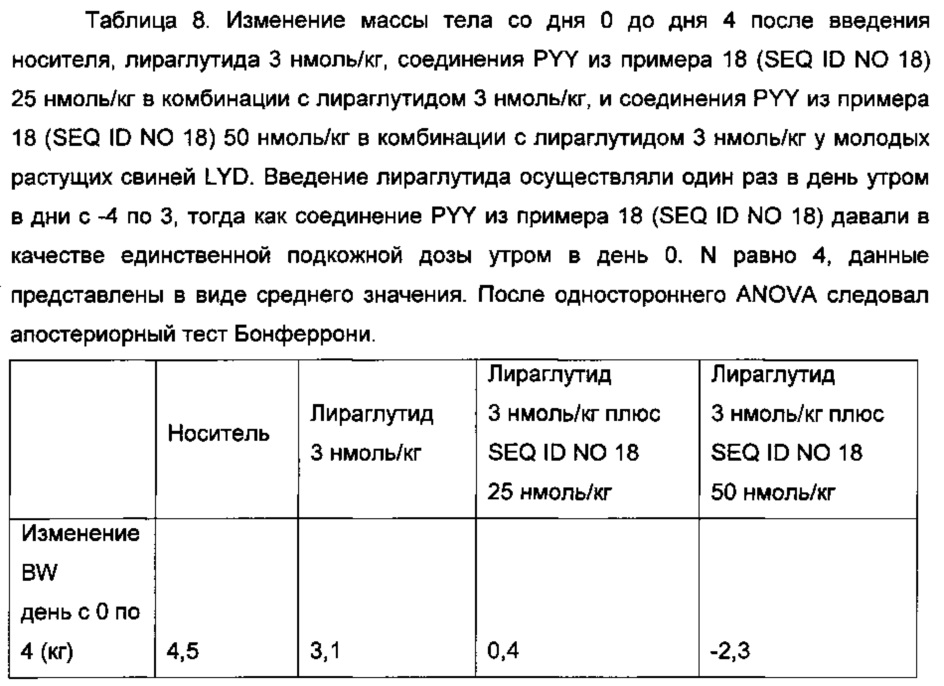
В заключение, эти данные решительно поддерживают дополнительные преимущества объединения аналогов PYY с аналогом GLP-1, которые заключаются в ингибировании потребления пищи и эффекте снижения массы тела.
Пример 45. Фармакодинамический эффект комбинированного введения аналога PYY и аналога GLP-1 мышам db/db
Для того чтобы определить влияние in vivo комбинированного введения соединения PYY и агониста GLP-1 на содержание глюкозы в крови и на массу тела, на мышиной диабетической модели с ожирением (мыши db/db) оценивали либо влияние соединения PYY, либо лираглутида в одиночку, либо их комбинации, как описано ниже.
Самцов мышей db/db (в возрасте от 9 до 10 недель) использовали для измерения влияния на содержание глюкозы в крови и на массу тела после введения различных доз PYY-производного аналога, PYY-соединения из примера 18 (SEQ ID NO 18), лираглутида (Lira) или обоих (комбинация). До начала исследования мышей случайным образом распределяли на группы, которые совпадали по массе тела, уровню глюкозы в крови не натощак и HbA1c. Различия в содержании глюкозы в крови между группами изучали в соответствии с графиком дозирования, показанным в таблице 9. Повышение дозы SEQ ID NO 18 и лираглутида использовали для предотвращения внезапной потери аппетита в дни с - 9 до 0, предшествующей введению первой дозы (данные не показаны).
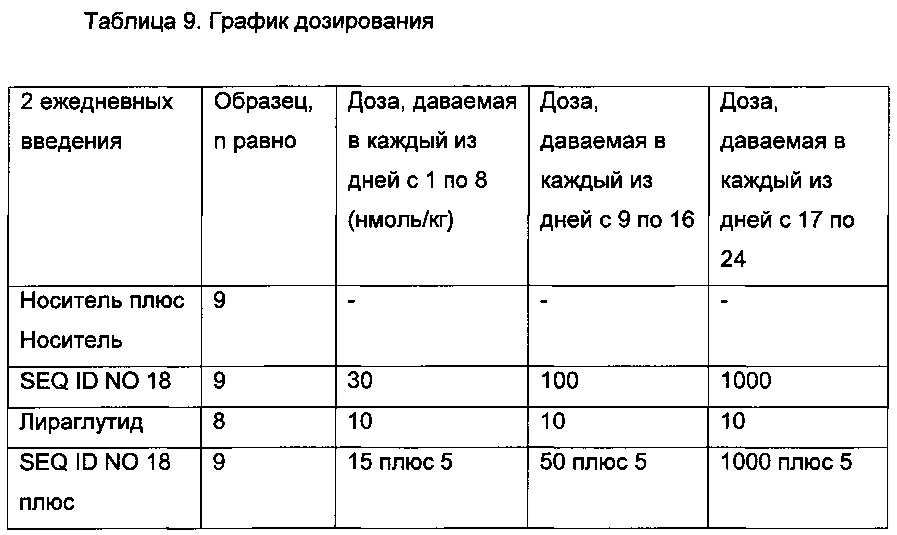
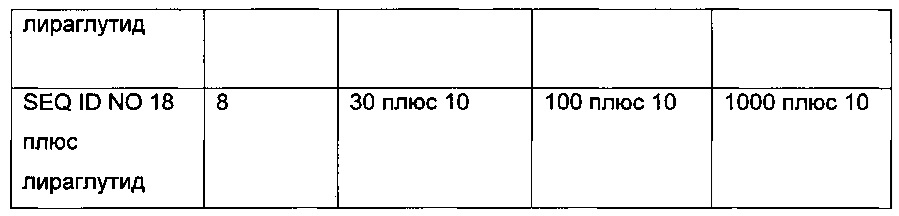
Вкратце, соединения вводили подкожно (2,5 мл/кг) в 11:00 и 17:00 каждый день. Соединение PYY из примера 18 (SEQ ID NO 18) вводили в буфере, содержащем 50 мМ фосфат; 70 мМ хлорид натрия; 0,05% полисорбат 80 (pH равно 8,0). Лираглутид вводили в буфере, содержащем 50 мМ фосфат; 70 мМ хлорид натрия; 0,05% полисорбат 80 (pH равно 7,4). Содержание глюкозы в крови измеряли в одной временной точке (9:00) после 3-5 дней введения каждой из доз на основе глюкозооксидазного способа с использованием анализатора глюкозы (Biosen 5040). Массу тела измеряли в тот же день. Результаты приведены в таблице 10 ниже.
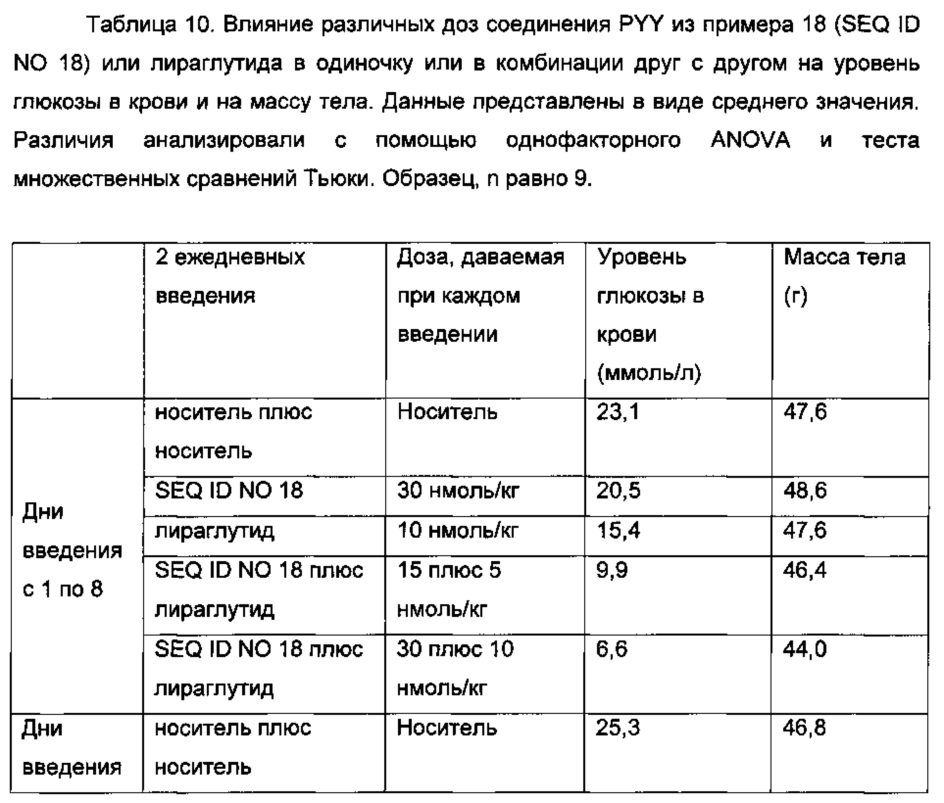
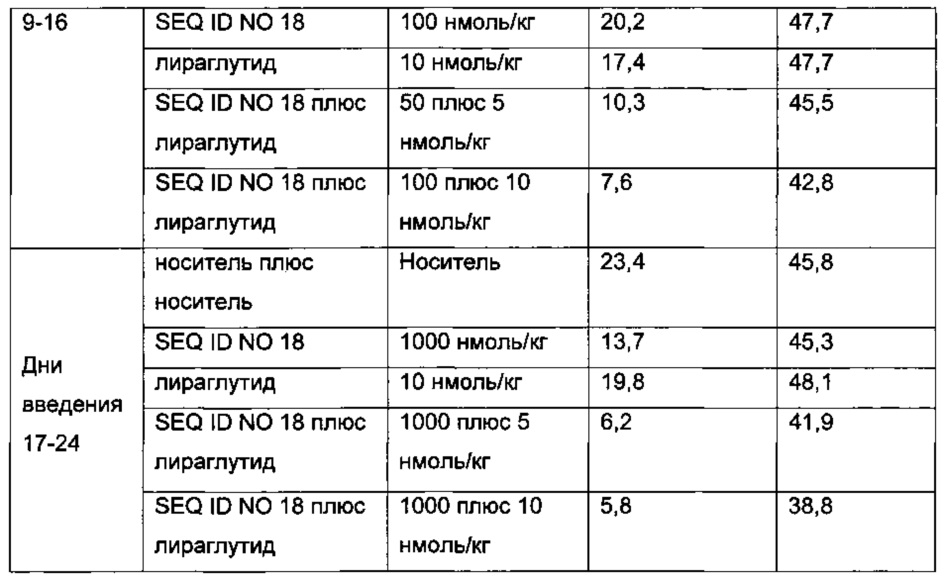
Эффект комбинации соединения PYY из примера 18 (SEQ ID NO 18) и лираглутида, который заключается в снижении уровня глюкозы в крови, был значительно сильнее, чем выгода, полученная при введении любого из этих соединений по одиночке. Гликемические уровни нормализовались у мышей, которым вводили комбинацию в большинстве проанализированных доз. Важно отметить, что не наблюдалось ни одного случая гипогликемии. Синергетический эффект комбинации соединения PYY из примера 18 (SEQ ID NO 18) и лираглутида также был очевиден в отношении снижения массы тела. В заключение, комбинация соединения PYY из примера 18 (SEQ ID NO 18) и лираглутида синергетически снижает уровень глюкозы в крови натощак и массу тела, что значительно снижает количество лекарственного препарата, которое необходимо ввести для получения той же или аналогичной выгоды при монотерапии.
Хотя в данном документе были проиллюстрированы и описаны некоторые детали данного изобретения, специалисты в данной области смогут теперь осуществить многие модификации, замены, изменения и эквиваленты. Поэтому следует понимать, что прилагаемая формула изобретения предназначена для охвата всех таких модификаций и изменений, которые попадают в истинный объем данного изобретения.