БИОЛОГИЧЕСКИЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к молекулам, вовлеченным в индукцию апоптоза, способам и фармацевтическим композициям для индукции апоптоза и их применению.
Уровень техники
Антитела недавно стали белками терапевтического выбора, нацеленными на рак, но также и на лечение по другим показаниям (Brekke et al., Nat Rev Drug Discov 2003; 2:52-62). Появление инженерии антител обеспечило инструменты для создания человеческих антител из библиотек синтетических фагов, проявляющих сниженную иммуногенность и повышенную специфичность и аффинность благодаря их человеческой природе и большему разнообразию (Weiner et al., Nat Biotechnol 2005; 23:556-7). Исходные библиотеки особенно привлекательны, поскольку они могут применяться для выделения антител по их специфичности, включая само-антигены (Griffiths et al., Embo J 1993; 12:725-34), независимо от иммунизации и реконструкции новых библиотек. Клеточные поверхностные рецепторы составляют значительно более успешную группу антигенов, на которые нацелены современные лечебные средства, включая низкомолекулярные ингибиторы и антитела. Особый интерес представляют клеточные поверхностные рецепторы, которые уникально экспрессированы или проявляют повышенный уровень экспрессии в клетках-мишенях, и дополнительно способны передавать сигналы гибели или выживания для клеток. Такие дифференциально экспрессируемые рецепторы с присущими сигнальными свойствами позволяют осуществлять основанный на антителах таргетинг инфицированных микробами, трансформированных или иных клеток с нарушением функции.
Для лечения опухолей антитела, имеющие способность к индукции апоптоза в опухолевой клетке-мишени, не влияя на нормальную ткань, представляют особый интерес. Некоторые такие антитела применяются, зарегистрированы в Управлении по контролю за продуктами и медикаментами США (FDA) и представляют альтернативу стандартному лечению онкологических заболеваний, например, лимфомы (ритуксимаб, нацеленный на CD20) или рака молочной железы (трастузумаб или цетуксимаб, нацеленные, соответственно, на Her-2 и EGFR).
В настоящее время в клинической разработке имеются также другие антитела с апоптоз-индуцирующими эффектами. Однако, даже если эти антитела демонстрируют благоприятные эффекты у пациентов или при анализах у животных, все еще остается неудовлетворенная клиническая потребность.
Анти-идиотипический иммуноглобулиновый таргетинг В-клеточных опухолей был первой терапией с применением моноклональных антител, проведенной у человека (Miller et al., N Engl J Med 1982; 306:517-22). Разрушение опухолевых клеток посредством такого пассивного применения антител (Riechmann et al., Nature 1988; 332:323-7), или активной вакцинации собственным белком иммуноглобулина против опухоли пациента (Kwak et al., N Engl J Med 1992; 327:1209-15), как было продемонстрировано, вызывает регрессию опухоли или затормаживает ее развитие у пациентов с различными видами В-клеточных новообразований. Более недавний отчет описывает выработку полных человеческих анти-идиотипических антител с применением трансгенных мышей, дефицитных по продукции мышиных антител и экспрессирующих избранные локусы цепи антитела человека (Suarez et al., Mol Immunol 2004; 41:519-26).
В настоящем изобретении использован способ конкурентного биопэннинга, где антиген клетки-мишени в форме цельных клеток и избыток вычтенного клеточного антигена в форме мембранных везикул одновременно подвергаются взаимодействию с фаговой библиотекой наивных антител n-CoDeR® (WO 2004/023140; Soderlind et al., Nat Biotechnol 2000; 18:852-6), для извлечения и последовательного тестирования фрагментов антител с отличной избирательностью в отношении клеток-мишеней В-лимфомы. Далее, функциональность избранных связывающих молекул была продемонстрирована по способности тестированных антител к индукции апоптоза в клетках-мишенях, но не в других клетках.
Идентифицированные специфичности антител включают HLA-DR/DP (B1 антитело изобретения) и поверхностный IgM (С11 антитело изобретения), а также ICAM-1 (В11 антитело изобретения), молекулу адгезии, не ассоциированную ранее с индукцией апоптоза. Выделенные антитела обладают аффинностью в суб-наномолярном и наномолярном диапазоне, непосредственно обеспечивая возможный выбор для целевой терапии антителами.
Раскрытие изобретения
В первом аспекте изобретение обеспечивает способ индукции апоптоза в клетке-мишени, включающий этапы:
а) обеспечения одной или более клеток-мишеней, несущих поверхностный клеточный антиген, ICAM-1;
b) обеспечения одной или более связывающих молекул, которые избирательно связываются с ICAM-1 клеточной поверхности и, при связывании с ICAM-1, индуцируют апоптоз клетки-мишени;
с) обработки клеток-мишеней согласно (а) связывающими молекулами согласно (b) для индукции апоптоза клеток-мишеней.
Предпочтительно связывающие молекулы являются молекулами антител.
Во втором аспекте изобретение обеспечивает способ индукции апоптоза в клетке-мишени, включающий этапы:
а) обеспечения одной или более клеток-мишеней, несущих поверхностный клеточный антиген, HLA-DR/DP и/или поверхностный IgM;
b) обеспечения одной или более молекул антител, избирательно связывающихся с HLA-DR/DP клеточной поверхности и/или поверхностным IgM и, при связывании с HLA-DR/DP и/или поверхностным IgM, индуцирующих апоптоз клетки-мишени;
с) обработки клеток-мишеней согласно (а) молекулами антител согласно (b) для индукции апоптоза клеток-мишеней.
В третьем аспекте изобретения обеспечивается связывающая молекула, которая избирательно связывается с ICAM-1 клеточной поверхности и, при связывании с ICAM-1, индуцирует апоптоз клетки-мишени. Альтернативно связывающая молекула является молекулой антитела, которая избирательно связывается с HLA-DR/DP клеточной поверхности и/или поверхностным IgM.
ICAM-1 также обозначается как CD54, но для целей данного применения будет использоваться ICAM-1.
Связывающие молекулы могут происходить от антител и основываться на молекулярном каркасе антител [Clackson Т et al., Nature. 1991 Aug 15; 352(6336):624-8, Marks JD et al., J Mol Biol. 1991 Dec 5; 222(3):581-97], который обширно используется во многих библиотеках, но связывающие молекулы также могут быть получены из других молекулярных каркасов, таких как каркас фибронектина [Weng S et al., Proteomics. 2002 Jan; 2(1):48-57] и каркас протеина A [Nord К, et al., Nat Biotechnol 1997 Aug; 15(8):772-7, Hogbom M et al., Proc Natl Acad Sci USA. 2003 Mar 18; 100(6):3191-6]. Каждый из этих каркасов может обладать преимуществом в зависимости от применения, и каркас антител, в качестве одного из примеров, может выгодно применяться для создания вариабельности, неотличимой от природной вариабельности.
Базовая структура антител, наиболее часто применяемый каркас, очень хорошо изучена. В принципе, каркасная структура, включающая бета-цепи, упорядоченные в виде двух слоев, представляет набор вариабельных петель, так называемых гипервариабельных участков (CDRs), которые обладают способностью связывать молекулы антигенов. Хотя антитела могут варьировать в структуре каркаса, наиболее обширная вариабельность наблюдается в CDRs. Значительная вариабельность между антителами является основой для их способности взаимодействовать специфическим образом с, в принципе, всеми типами молекулярных структур. Благодаря этой способности антитела обширно применяются для создания специфических связующих агентов, с применением для исследований, диагностики/прогноза заболевания и в качестве лечебных агентов, специфичных в отношении определенных структур-мишеней [Borrebaeck CA and Carlsson R, Curr Opin Pharmacol. 2001 Aug; 1(4):404-8].
Другими связывающими молекулами, не относящимися к антителам, применяющимися в данном изобретении, являются те, которые имеют структуры каркаса с высокой степенью стабильности, но допускающие вариабельность при введении в определенные позиции. Примером другой связывающей молекулы является домен фибронектина и большой домен протеина А из 58 аминокислот, который толерантен к вариабельности. Имеются также другие молекулярные складки, которые допускают определенную степень вариации. Такие примеры включают молекулы I и II классов главного комплекса гистосовместимости (МНС) и недавно открытый новый класс молекул, так называемых дефензинов, которые были идентифицированы как сходные по базовой структуре при сохранении значительной вариабельности последовательности между членами семейства генов, что свидетельствовало об их пригодности в качестве каркаса для сохранения молекулярного разнообразия. В дополнение, природный лиганд(ы), например, LFA-1 в случае ICAM-1 в качестве целевой молекулы, или его рекомбинантные варианты, могут являться специфическими связывающими молекулами, способными индуцировать апоптоз в клетках-мишенях.
Далее, связывающая молекула может быть любой молекулой, избирательно связывающей ICAM-1 клеточной поверхности клетки-мишени и, при связывании, индуцирующей апоптоз клетки-мишени.
Связывающая молекула является предпочтительно молекулой антитела.
В одном воплощении антигеном клеточной поверхности является ICAM-1.
Представленный скрининг обнаружил антитело (В11), специфичное в отношении ICAM-1 - рецептора, не связываемого ранее с апоптозом и, как считают, не обладающего существенными свойствами передачи отрицательных сигналов клеткам.
Идентификация ICAM-1 как молекулы, индуцирующей апоптоз, была прямым результатом скрининга, разработанного для выделения специфичностей в отношении всех поверхностных рецепторов, дифференциально экспрессируемых клетками-мишенями, и клетками, не являющимися мишенями, независимо от и без предшествующих знаний об их соответствующей идентичности. Было подтверждено, что ICAM-1 - индуцированная клеточная гибель была активным апоптотическим процессом, вовлекающим деполяризацию мембраны митохондрий. Деполяризация митохондриальной мембраны была ранее описана как при каспазо-зависимом, так и каспазо-независимом апоптозе (Nagy et al., J Mol Med 2003; 81:757-65).
Представленные находки далее показали, что эпитоп, связываемый В11 антителом, экспрессируется тканью В-лимфомы различного происхождения и позитивно регулируется в определенных клетках В-лимфомы по сравнению с покоящимися лейкоцитами периферической крови. Важно, что в дополнение к клеткам В-лимфомы клетки карциномы, экспрессирующие ICAM-1, также подвергаются апоптозу при обработке ICAM-1-специфичными В11-антителами in vitro (см. Пример 6).
Предварительные исследования продемонстрировали ограниченную экспрессию ICAM-1 нормальными тканями человека (Smith et al., J Clin Pathol 1990;43:893-900). ICAM-1 вовлекается в адгезию клетки к клетке и играет важную роль в иммунном ответе и воспалении посредством связывания с их рецептором LFA-1. Антитела, направленные на ICAM-1, используются для препятствия патологическому иммунному ответу и воспалению. Применение in vivo мышиных анти-ICAM-1 моноклональных антител (mAb) у яванских макак (Cosimi et al., J Immunol 1990; 144:4604-12), или применение при клинических испытаниях у людей, больных ревматоидным артритом, или пациентов с трансплантатом почки, также не выявило явной токсичности (Kavanaugh et al., Arthritis Rheum 1994; 37:992-9; Haug et al., Transplantation 1993; 55:766-72).
Новое открытие того, что ICAM-1-таргетинг может вести к апоптозу, демонстрирует возможность применения ICAM-1-специфичных связывающих молекул, таких как антитела, для лечения онкологических заболеваний различного происхождения, при условии, что они экспрессируют этот антиген.
На основании их экспрессии ICAM-1, типы онкологических заболеваний, которые могут быть лечены с помощью индуцирующего апоптоз анти- ICAM-1 антитела, такого как В11, включают: В-лимфому, миелому (Huang et al., (1993) Hybridoma 12 p661-75; Huang et al., (1995) Cancer Res 55 p610-6; Smallshaw et al., (2004) J Immunother 27 p419-24), рак желудка (Maruo et al., (2002) Int J Cancer 100 p486-90), рак молочной железы (Rosette et al., (2005) Carcinogenesis 26 p943-50), рак печени (Sun et al., (1999) J Cancer Res Clin Oncol 125 p28-34), рак легких (Grothey et al., (1998) Br J Cancer 77 p801-7), меланому (Wang et al., (2005) Int J Cancer 27 p419-24), рак мочевого пузыря (Roche et al., (2003) Thromb Haemost 89 1089-97) и рак простаты (Aalinkeel et al., (2004) Cancer Res 64 p5311-21). Экспрессия ICAM-1 также была выявлена на метастазах опухолей, как показано (Maruo et al., 2002), (Rosette et al., 2005), (Sun et al., 1999), (Grothey et al., 1998), (Aalinkeel et al., 2004), что указывает на возможность вмешиваться в процессы метастазирования с применением ICAM-1 специфических антител.
В другом воплощении поверхностным клеточным антигеном является HLA-DR/DP.
HLA-DR/DP в норме присутствует на, например, В-клетках и может выявляться как позитивно регулируемый на клетках В-лимфомы.
На сегодняшний день три различных вида HLA-DR специфических моноклональных антител проходят клинические испытания. Самым недавним дополнением к ним является человеческий IgG4 1D09C3, который был выделен из сходной по размеру наивной фаговой библиотеки, по сравнению с n-CoDeR®, но с применением твердофазного пэннинга очищенного антигена (Nagy et al., Nat Med 2002; 8:801-7).
В настоящем изобретении идентифицировано новое антитело человека (в1), направленное против HLA-DR/DP, которое быстро и с высокой эффективностью индуцирует апоптоз множества клеточных линий В-лимфомы, таким образом демонстрируя, что HLA-DR/DP связан с индукцией апоптоза клетки-мишени.
В1-антитело связывается с множеством клеточных линий В-лимфомы различного происхождения (см. Пример 1 и Таблицу 1) и. как было показано, индуцирует апоптоз в клетках, экспрессирующих HLA-DR/DP антиген. Далее, В 1-антитело показало более высокую мощность, чем Ритуксимаб при анализе на Raji клеточной линии В-лимфомы. Это особенно явно, когда применяется IgG4 формат В1 антител (Фиг.8).
На основании полученных данных, это антитело имеет подходящие характеристики для обработки HLA-DR/DP-экспрессирующих клеток В-лимфомы. В дополнение, наподобие таргетинга ревматоидного артрита и системной красной волчанки (СКВ) Ритуксимабом, В1 антитело может оказаться эффективным в элиминации активированных В-клеток при заболеваниях, где экспрессирующие HLA-DR/DP В-клетки являются вредоносными.
В еще одном воплощении поверхностным клеточным антигеном является поверхностный IgM.
IgM в его свободной форме существует в виде большой пентамерной структуры, чей высокий молекулярный вес способствует ее удержанию в пределах кровеносных сосудов.
Мономерный IgM может быть найден на клеточной стенке В-лимфоцитов и функционирует как рецептор антитела для распознавания антигена.
С11 антитело изобретения при связывании с поверхностным IgM, экспрессированным на клетках В-лимфомы, индуцирует апоптоз в быстрой и эффективной манере (см. Пример 1 и Таблицу 1). В противоположность идиотип-специфичным анти-IgM антителам, ранее использованным в клинике для лечения В-лимфомы, С11 антитело связывается с неполиморфным эпитопом, экспрессируемым на В-клетках от различных доноров, и таким образом, является пригодным для лечения пациентов, страдающих В-лимфомой, независимо от идиотипа В-лимфомы.
В особенности, эффекторная молекула, например, анти- IgM антитело, может также быть любым типом специфически связывающей молекулы, которая вызывает апоптоз в IgM-экспрессирующих клетках различных идиотипов.
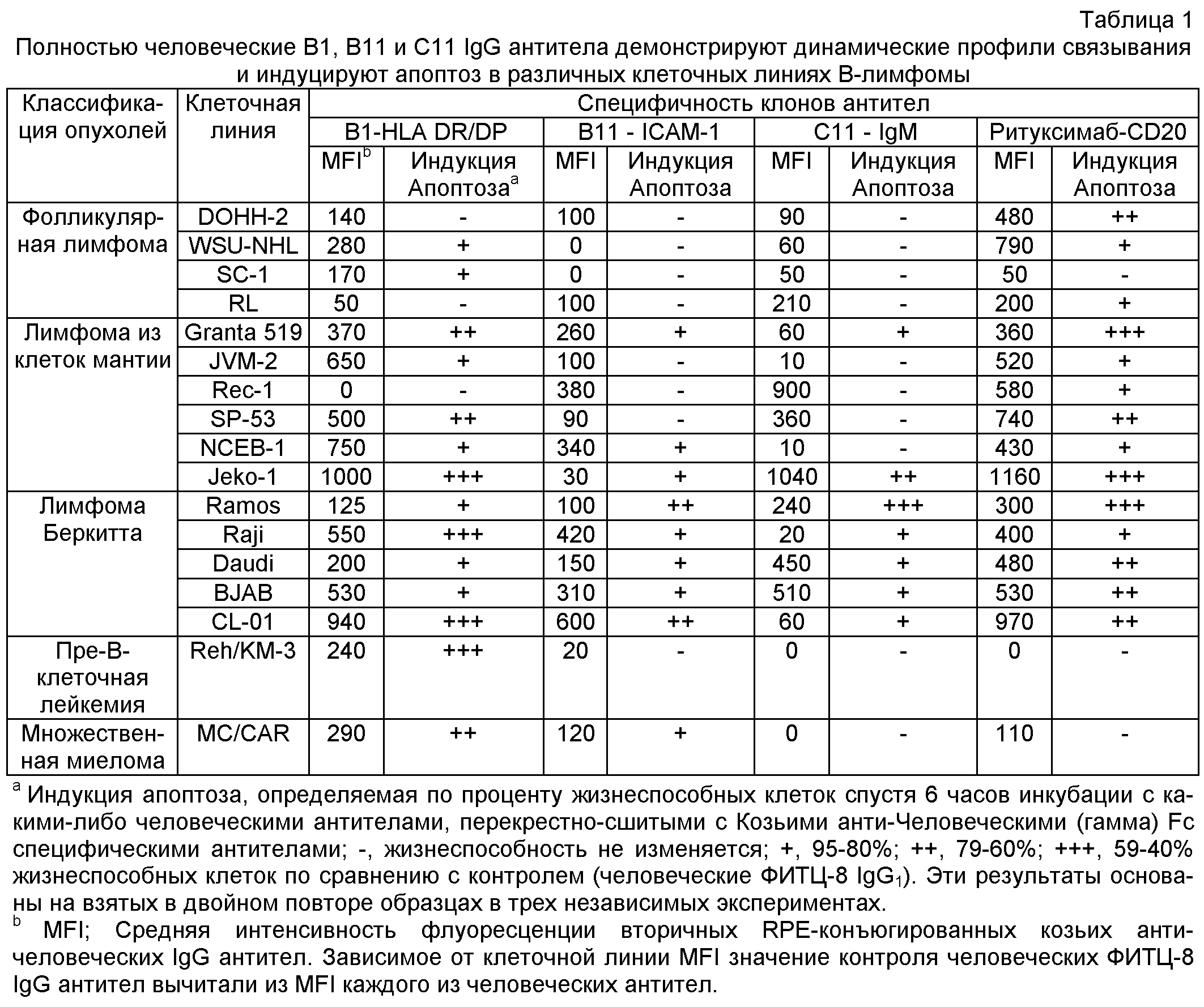
Кинетика В1-, В11- и С11-индуцированного апоптоза была быстрой, с максимальной эффективностью, наблюдавшейся уже спустя 3 часа в некоторых клеточных линиях. Быстрая эффекторная функция важна для лечебной эффективности, поскольку это снижает риск уклонения опухоли в результате, например, отсутствия экспрессии опухолевого антигена (Uyttenhove et al., J. Exp. Med. 1983; 157:1040-52; Kennedy et al., Br J Haematol 2002; 119:412-6) или мутации эпитопа (Weiner et al., J Immunol 1989; 142:343-51; Bai et al., J. Clin. Invest. 2003; 111:1487-96), и способно ограничить длительность лечения и побочные эффекты (Robert et al., Lancet Oncol 2005; 6:491-500).
Предпочтительно клеткой-мишенью является иммунная клетка или эпителиальная клетка и особо предпочтительно, чтобы иммунная клетка была В-лимфоцитом.
Удобно, чтобы клетка-мишень была связана с заболеванием. Предпочтительно, заболевание выбирают из группы, состоящей из: онкологического заболевания, аутоиммунного заболевания, включая, но не ограничиваясь, ревматоидный артрит и СКВ, острые и хронические воспалительные заболевания, сепсис и инфекционные заболевания, включая, но не ограничиваясь, СПИД.
Предпочтительно, заболевание является онкологическим, выбранным из лимфомы (лейкемии, миеломы), рака желудка, рака молочной железы, рака печени, рака легких, меланомы, рака мочевого пузыря, хориокарциномы, рака поджелудочной железы, рака толстой кишки и рака простаты.
Как определено в разделе определений данной заявки, фраза «молекула антитела» применяется для удобства и охвата, среди прочего, антител, фрагментов антител и производных антител.
Предпочтительно, молекулой антитела является IgG. IgG может быть представлен IgG1, IgG2, IgG3 или IgG4, но предпочтительно IgG1 и IgG4. Молекула антитела является предпочтительно гуманизированной или человеческой.
Предпочтительно, связывающая молекула или молекула антитела изобретения имеет последовательность любой из последовательностей вариабельного региона из Фигуры 9-11 или ее функционально эквивалентных гомологов.
В одном воплощении изобретения связывающая молекула или молекула антитела имеет последовательности вариабельных регионов из Фигуры 9 или их функционально эквивалентных гомологов.
В другом воплощении изобретения, связывающая молекула или молекула антитела имеет последовательности вариабельных регионов из Фигуры 10 или их функционально эквивалентных гомологов.
В еще одном воплощении изобретения, связывающая молекула или молекула изобретения имеет последовательность вариабельных регионов из Фигуры 11 или их функционально эквивалентных гомологов.
В четвертом аспекте изобретения обеспечивается нуклеиновая кислота, имеющая нуклеотидную последовательность, кодирующую связывающую молекулу или молекулу антитела, как указано в любом из предыдущих пунктов.
Предпочтительно нуклеиновая кислота имеет нуклеотидную последовательность из любой из фигур 9-11.
В пятом аспекте изобретения обеспечивается применение связывающей молекулы или молекулы антитела, как определено в первом или втором аспекте изобретения, для диагностики и/или лечения, и/или профилактики заболевания, требующего разрушения клетки-мишени. Также предусматривается применение связывающей молекулы или молекулы антитела, как определено в первом или втором аспекте изобретения, в производстве медикамента для лечения и/или профилактики заболевания, требующего разрушения клетки-мишени.
В предпочтительном воплощении связывающая молекула является молекулой антитела.
Предпочтительно, заболевание, при котором применяется лечение, выбирают из группы, состоящей из: онкологических заболеваний; аутоиммунных заболеваний, включая, но не ограничиваясь, ревматоидный артрит и СКВ, острые и хронические воспалительные заболевания, сепсис и инфекционные заболевания, включая, но не ограничиваясь, СПИД.
Предпочтительно заболевание, при котором применяется лечение, является онкологическим заболеванием, выбранным из лимфомы (лейкемии, миеломы), рака желудка, рака молочной железы, рака печени, рака легких, меланомы, рака мочевого пузыря, хориокарциномы, рака поджелудочной железы, рака толстой кишки и рака простаты.
В одном воплощении изобретения связывающая молекула или молекула антитела связывается специфически с ICAM-1 и/или имеет последовательность из фигуры 10, и применяется в отношении заболеваний, перечисленных выше.
В другом воплощении изобретения молекула антитела связывается специфически с HLA-DR/DP и/или имеет последовательность из фигуры 9, и применяется в отношении заболеваний: лимфомы (лейкемии, миеломы), рака желудка, рака молочной железы, рака печени, рака легких, меланомы, рака мочевого пузыря, хориокарциномы, рака поджелудочной железы, рака толстой кишки и рака простаты.
В еще одном воплощении изобретения молекула антитела связывается специфически с поверхностным IgM и/или имеет последовательность из фиг.11 и применяется в отношении заболеваний: лимфомы (лейкемии, миеломы), рака желудка, рака молочной железы, рака печени, рака легких, меланомы, рака мочевого пузыря, хориокарциномы, рака поджелудочной железы, рака толстой кишки и рака простаты.
В шестом аспекте изобретение обеспечивается фармацевтическая композиция, включающая связывающую молекулу или молекулу антитела изобретения и фармацевтически пригодный носитель, наполнитель или разбавитель.
В предпочтительном воплощении связывающая молекула является молекулой антитела.
В седьмом аспекте изобретения обеспечивается in vitro способ индукции апоптоза в клетке-мишени, включающий этапы:
(i) обеспечения одной или более клеток-мишеней;
(ii) обеспечения одной или более связывающих молекул, как определено в первом воплощении изобретения;
(iii) обработки клеток-мишеней согласно (i) связывающими молекулами или молекулами антител согласно (ii), с индукцией таким образом апоптоза в клетках-мишенях.
В предпочтительном воплощении связывающая молекула является молекулой антитела.
Предпочтительно клетки-мишени, обеспечиваемые на этапе (i), являются иммунными клетками или эпителиальными клетками. Предпочтительно, иммунные клетки являются В-лимфоцитами.
Предпочтительно клетки-мишени связаны с заболеванием, где заболевание выбирают из группы, состоящей из: онкологических заболеваний; аутоиммунных заболеваний, включая, но не ограничиваясь, ревматоидный артрит и СКВ, острые и хронические воспалительные заболевания, сепсис и инфекционные заболевания, включая, но не ограничиваясь, СПИД.
Предпочтительно, заболевание является онкологическим заболеванием, выбранным из лимфомы (лейкемии, миеломы), рака желудка, рака молочной железы, рака печени, рака легких, меланомы, рака мочевого пузыря, хориокарциномы, рака поджелудочной железы, рака толстого кишечника и рака простаты.
Значения применяемых терминов
Предполагается, что термин «молекула антитела» относится к любому из фрагмента антитела, или производного антитела. Он предназначен для охвата природных антител, синтетических антител, рекомбинантных антител или гибридов антител, таких как, без ограничений, одноцепочечные модифицированные молекулы антител, вырабатываемые фагом, отображающим вариабельные и/или константные участки легкой и/или тяжелой цепи иммуноглобулина, или другие иммунореактивные молекулы, способные связываться с антигеном в формате иммуноанализа, известном специалистам в данной области техники.
Термин «фрагмент антитела» применяется в отношении любого антитела, фрагмента антитела, или производного антитела. Он предназначен для охвата природных антител (т.е. молекулы, включающей четыре полипептидных цепи), синтетических антител, рекомбинантных антител или гибридов антител, таких как, без ограничений, одноцепочечные модифицированные молекулы антител, вырабатываемые фагом, отображающим вариабельные и/или константные участки легкой и/или тяжелой цепи иммуноглобулина, или другие иммунореактивные молекулы, способные связываться с антигеном в формате иммуноанализа, известном специалистам в данной области техники.
Термин «производное антитела» относится к модифицированной молекуле антитела, которая способна связываться с антигеном в формате иммуноанализа, известном специалистам в данной области техники, такой как фрагмент антитела (например, Fab или Fv фрагмент), или модифицированная молекула антитела, которая модифицирована добавлением одной или более аминокислот или других молекул для облегчения связывания антител с другим пептидом или полипептидом, с большим белком-носителем или с твердой подложкой (например, с аминокислотами тирозином, лизином, глутаминовой кислотой, аспарагиновой кислотой, цистеином и их производными, NH2-ацетильными группами или СООН-концевыми амидо-группами, среди прочего).
Термин "ScFv молекула" относится к любой молекуле, где VH и VL домены-партнеры соединены посредством гибкого олигопептида.
Термины «нуклеотидная последовательность» или «нуклеиновая кислота» или «полинуклеотид» используются взаимозаменяемо и по отношению к гетерополимеру нуклеотидов или последовательности этих нуклеотидов. Эти фразы также относятся к ДНК или РНК геномного или синтетического происхождения, которые могут быть одноцепочечными или двухцепочечными и могут представлять смысловую и антисмысловую цепь, к пептидной нуклеиновой кислоте (ПНК) или к любому ДНК-подобному или РНК-подобному материалу. В этих последовательностях А является аденином, Ц является цитозином, Т является тимином, Г является гуанином, а N является А, Ц, Г или Т(У). Понятно, что когда полинуклеотид является РНК, Т (Тимин) в представленной последовательности заменяется на У (урацил). В целом, сегменты нуклеиновых кислот, обеспечиваемые этим изобретением, могут быть собраны из фрагментов генома и коротких олигонуклеотидных линкеров, или из серий олигонуклеотидов, или из индивидуальных нуклеотидов, для обеспечения синтетической нуклеиновой кислоты, которая способна экспрессироваться в рекомбинантную транскрипционную единицу, включающую регуляторные элементы, полученные из микробного или вирусного оперона, или эукариотического гена.
Термин «полипептид», или «пептид», или «аминокислотная последовательность» относится к олигопептидной, пептидной, полипептидной или белковой последовательности или ее фрагменту и к молекулам природного происхождения или синтетическим. Полипептидный «фрагмент», «порция» или «сегмент» является последовательностью из аминокислотных остатков из по крайней мере 5 аминокислот, предпочтительно по крайней мере 7 аминокислот, наиболее предпочтительно из по крайней мере 17 или более аминокислот. Чтобы быть активными, любые полипептиды должны иметь достаточную длину для проявления биологической и/или иммунологической активности.
Термины «очищенный» или «существенно очищенный», как применяются здесь, обозначают, что указанные нуклеиновая кислота или полипептид присутствуют в основном свободными от других биологических макромолекул, например, полинуклеотидов, белков, и тому подобного. В одном воплощении, полинуклеотид или полипептид очищают так, что он состоит по крайней мере на 95% по весу, более предпочтительно по крайней мере на 99% по весу, из указанных представленных биологических макромолекул (но могут присутствовать вода, буферы, или другие малые молекулы, в особенности молекулы с молекулярной массой менее 1000 дальтон).
Термин «выделенный», как применяется здесь, относится к нуклеиновой кислоте или полипептиду, отделенному от по крайней мере одного другого компонента (например, нуклеиновой кислоты или полипептида), присутствующего с нуклеиновой кислотой или полипептидом в его природном источнике. В одном воплощении, нуклеиновая кислота или полипептид находятся в присутствии (если есть) только растворителя, буфера, иона или другого компонента, обычно присутствующего в его растворе. Термины «выделенный» и «очищенный» не охватывают нуклеиновые кислоты или полипептиды, присутствующие в их природном источнике.
Термин «рекомбинантный», как применяется здесь по отношению к полипептиду или белку, означает, что полипептид или белок получены из рекомбинантных (например, микробных, насекомых или млекопитающих) систем экспрессии. «Микробный» относится к рекомбинантным полипептидам или белкам, приготовленным из бактериальных или грибковых (например, дрожжевых) систем экспрессии. Как продукт «рекомбинантный микробный» обозначает полипептид или белок, по существу свободный от нативных эндогенных субстанций и не сопровождающийся связанным нативным гликозилированием. Полипептиды или белки, экспрессируемые в большинстве бактериальных культур, например, Escherichia coli, свободны от модификаций гликозилирования; полипептиды или белки, экспрессируемые в грибках, имеют форму гликозилирования, в общем отличающуюся от той, что экспрессируется в клетках млекопитающих.
Термин «избирательное связывание» и «избирательность связывания» указывает, что вариабельные участки антител изобретения распознают и связывают исключительно полипептиды изобретения (т.е. способны различать полипептид изобретения от других сходных полипептидов несмотря на идентичность, гомологию, или сходство последовательности, найденную в семействе полипептидов), но могут также взаимодействовать с другими белками (например, белком A Staphylococcus aureus или другими антителами в методике ИФА) посредством взаимодействий с последовательностями вне вариабельного участка антител, и в частности, в константном участке молекулы. Скрининговые анализы для определения избирательности связывания антител изобретения хорошо известны и рутинно практикуются в данной области техники. По исчерпывающему обсуждению таких анализов, см. Harlow et al. (Eds), Antibodies A Laboratory Manual; Cold Spring Harbor Laboratory; Cold Spring Harbor, N.Y. (1988), Chapter 6. Антитела, которые распознают и связывают фрагменты полипептидов изобретения, также обдуманы, обеспечивая, что антитела в первую очередь и наиболее избирательны для, как определено выше, полипептидов полной длины изобретения. Как с антителами, которые избирательны в отношении полипептидов полной длины, антитела изобретения, которые распознают фрагменты, являются теми, которые могут различать полипептиды из одного и того же семейства полипептидов несмотря на присущую идентичность, гомологию, или сходство, найденные в семействе белков.
Термин «аффинность связывания» включает обозначение силы связывания между молекулой антитела и антигеном.
Под термином «иммунная клетка» мы подразумеваем любые клетки, которые вовлекаются в иммунитет хозяина или воспалительный ответ, включая, но не ограничиваясь, В-клетки и Т-клетки.
Под термином «эпителиальная клетка» мы подразумеваем клетку эпителия. Эпителий является тканью, состоящей из слоя клеток. Эпителий может выстилать внутреннюю (например, эндотелий, который выстилает внутреннюю сторону кровеносных сосудов) или внешнюю (например, кожа) свободную поверхность тела.
Самый крайний слой нашей кожи построен из чешуйчатых эпителиальных клеток, как и слизистые мембраны, выстилающие внутреннюю поверхность рта и полостей тела. Внешние эпителиальные клетки выстилают внутреннюю часть легких, желудочно-кишечного тракта, репродуктивного и мочевого трактов и составляют экзокринные и эндокринные железы. Функции эпителиальных клеток включают секрецию, абсорбцию и защиту. Эпителиальные клетки находятся на базальной мембране.
Краткий перечень чертежей
Примеры, воплощающие конкретные предпочтительные аспекты изобретения, описаны со ссылкой на следующие чертежи, на которых:
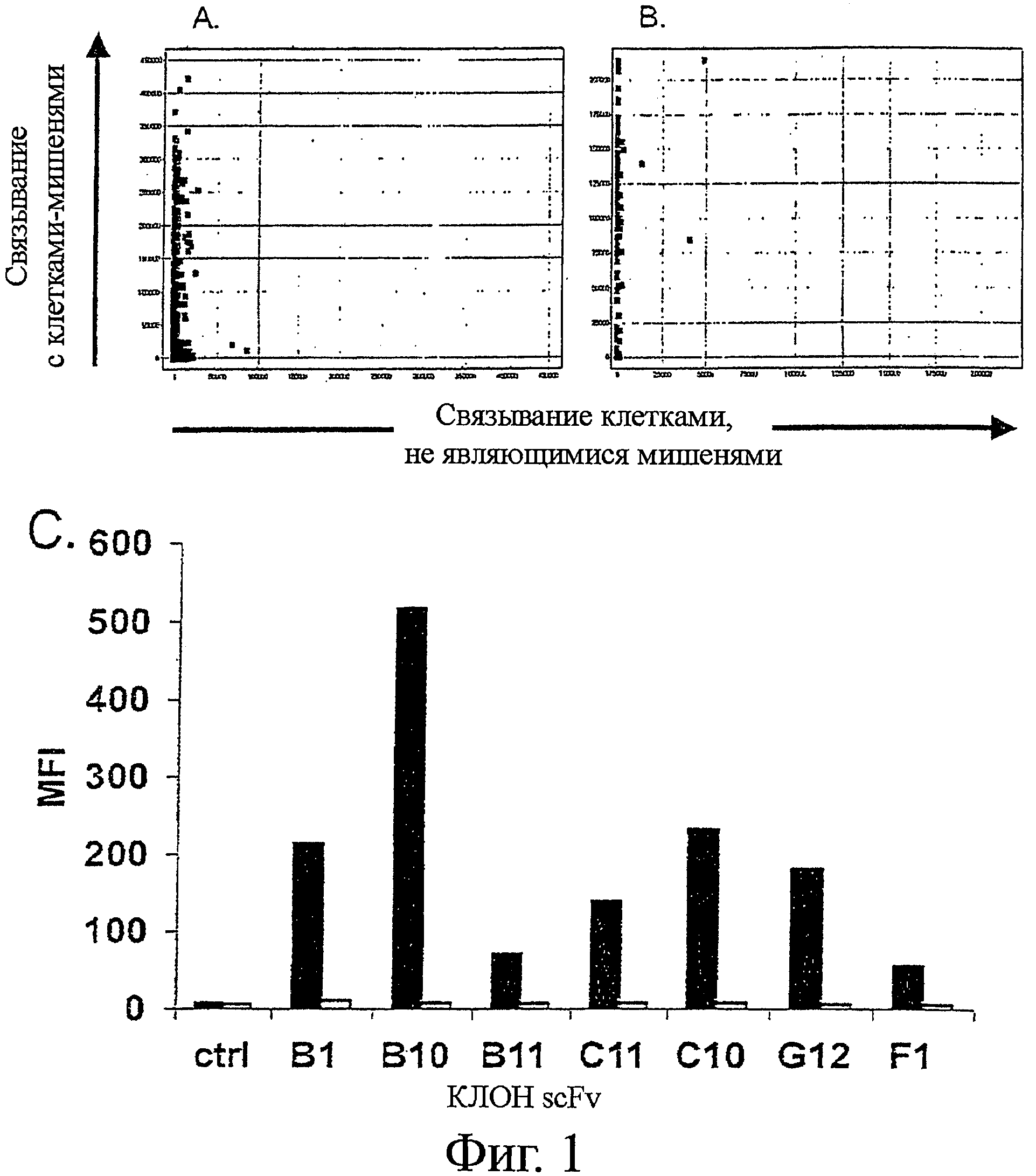
Фигура 1 - scFv, выделенный дифференциальным биопэннингом цельных клеток/ клеточных мембранных везикул, показывает высокую специфичность в отношении клеток-мишеней
Клоны scFv, выделенные дифференциальным биопэннингом, экспрессировали в Е.coli TOP10 клетках, и инкубировали с клетками Ramos или Jurkat и (А) scFv клонами, экспрессированными для первичного скрининга, или (В) семьюдесятью двумя произвольно выбранными и повторно экспрессированными scFv клонами. Связывание scFv выявляли с анти-Гис-MAb, и Су5-анти-мышиными поликлональными антителами. Клеточное связывание выявляли на макроконфокальном устройстве для скрининга с высокой производительностью FMAT. Клеточное связывание отображали в виде средней интенсивности флуоресценции с Ramos клетками-мишенями (Y-ось) и клетками не-мишенями Jurkat (Х-ось). (С) Связывание семи уникальных scFv клонов с клетками Ramos (закрашенные прямоугольники) и клетками Jurkat (не закрашенные прямоугольники). Контрольный scFv (ctrl) не связывается с какими-либо клетками.
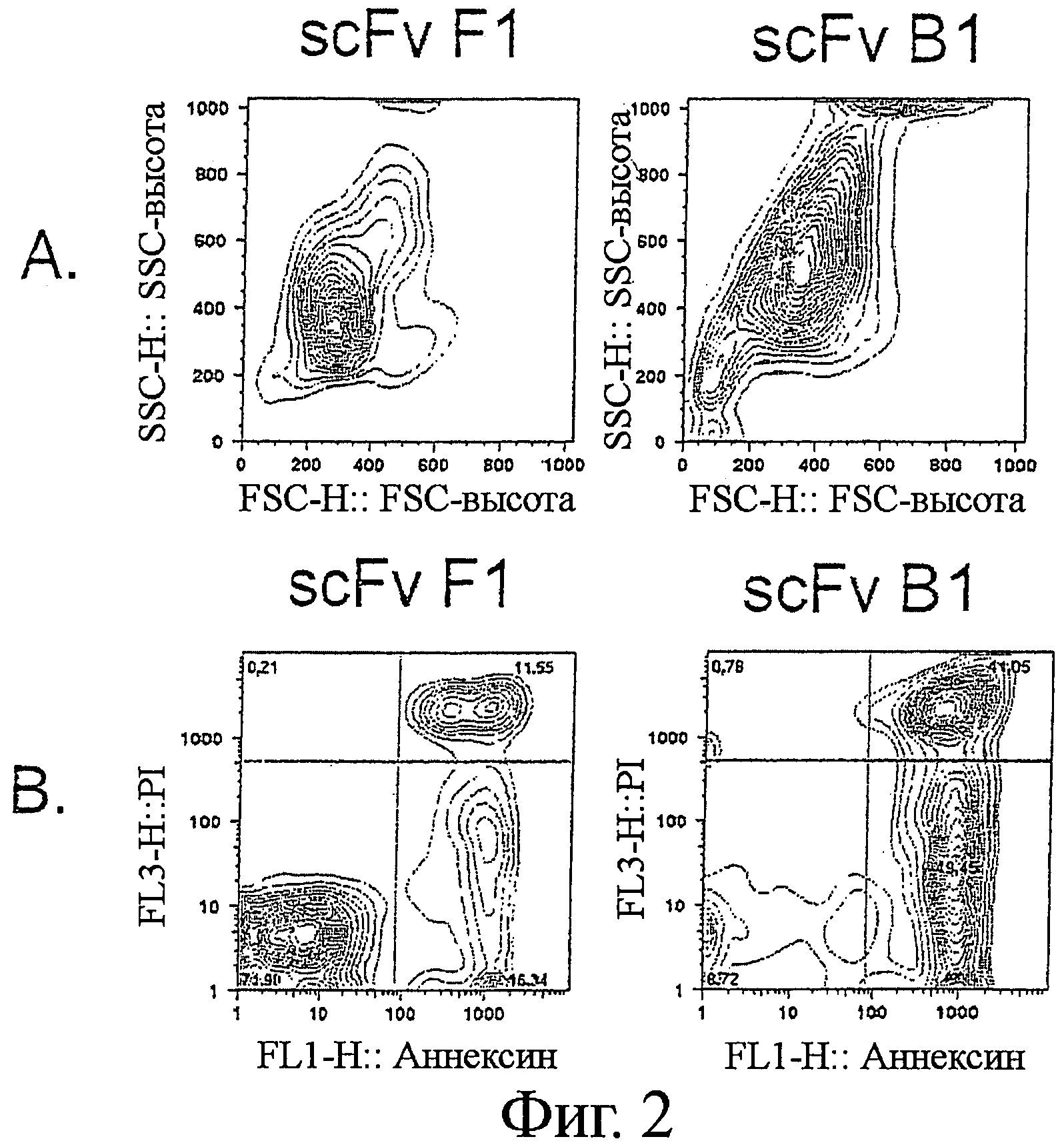
Фигура 2. Индукция апоптоза анти-Ramos scFv
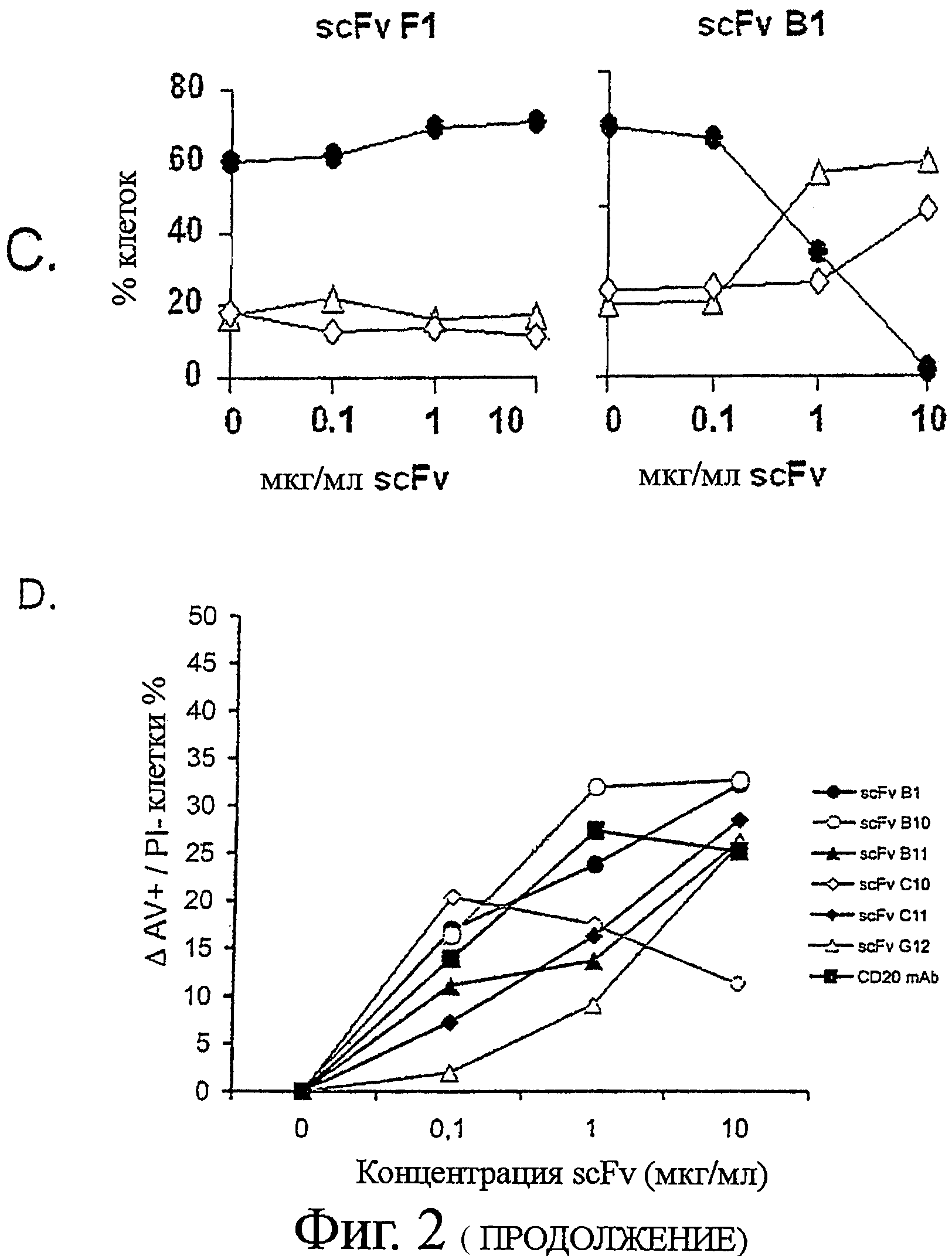
Клетки В-лимфомы Ramos последовательно инкубировали с анти-Ramos scFv, анти-Гис-mAb, и анти-мышиными поликлональными Ab на льду (с периодической отмывкой для удаления избытка несвязанного антитела), и инкубировали в увлажненной атмосфере при 5% CO2 и 37°С в течение 24 часов. Клетки собирали и подвергали комбинированному окрашиванию Аннексином V-AF488 (AV) и пропидиум-иодидом (PI). Клетки были оценены как жизнеспособные (AV- PI-, закрашенные круги Фиг.2С), ранние апоптотические (AV+ PI-, не закрашенные треугольники Фиг.2С), или поздние апоптотические/некротические (AV+PI+, не закрашенные ромбы Фиг.2С), на основании дифференциальной позитивности по AV и PI окрашиванию (определенному по квадратным координатам на Фиг.2 В). Результаты представлены построением (А) рассеяния в переднем направлении (FSC-высота) рассеяния в боковом направлении и (В) AV (FL-1) против PI (FL-3). Титруемый эффект scFv B1 и F1 также представлен (С). Семь уникальных клонов scFv инкубировали с клетками В-лимфомы (D) Ramos или (Е) Raji при 37°С в течение 24 часов при различной концентрации, и изучали влияние на индукцию апоптоза. Три scFv; B1, B11 и С11 показали титруемую активность по отношению к обеим клеточным линиям, в то время как апоптоз-индуцирующая способность scFv В10, С10, и G12 ограничивалась клетками В-лимфомы Ramos.
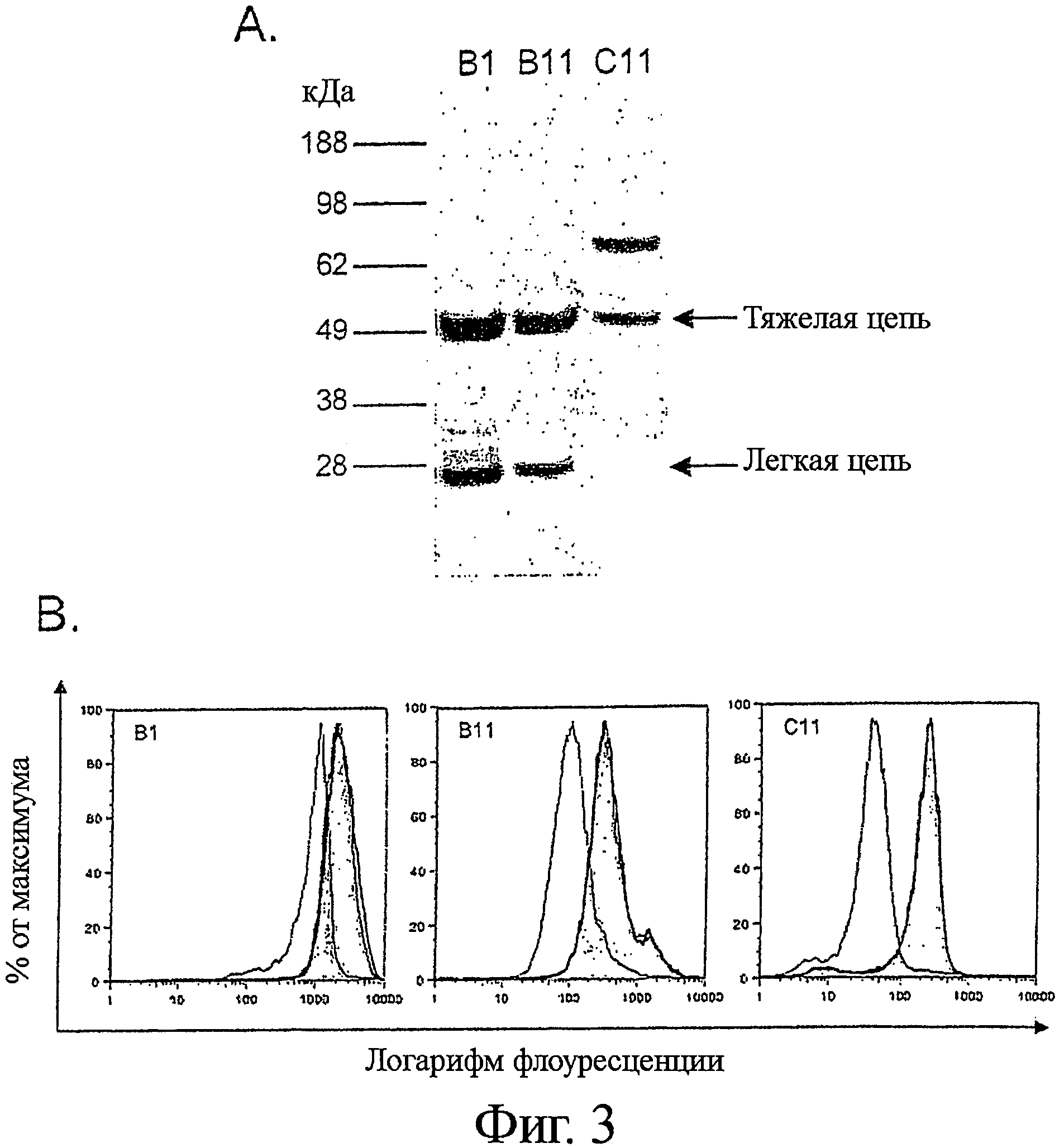
Фигура 3. Специфичности выделенных антител, включая HLA-DR/DP, IgM, и ICAM-1
A) 50-600×106 клеток В-лимфомы Raji лизировали с неионным детергентом Тритоном Х-100 при 0,5% об./об. и осаждали иммунопреципитацией со 100 мкг полного человеческого IgG1 формата B1 (полоса 1) и B11 (полоса 2) антитела, с последующей перекрестной сшивкой с Протеин-А-Сефарозой. Лизаты клеток В-лимфомы Ramos из 50×106 клеток использовали для осаждения 20 мкг С11 (полоса 3). Антитело-специфические полосы вырезали и подвергали расщеплению трипсином, и анализировали с помощью MALDI-TOF.
B) Связывание B1 IgG, B11 IgG и С11 IgG с клетками В-лимфомы специфически блокировалось пре-инкубированием с анти-HLA-DR/DP, анти-ICAM-1 или анти-IgM антителами, соответственно.
Чтобы подтвердить идентичность найденных с помощью MALDI-TOF антигенов клонов антител B1, B11 и С11, были проведены исследования по блокированию с коммерчески доступными антителами, с анализом проточной цитометрией. Клетки были предварительно блокированы с 10-кратным молярным избытком (по сравнению с человеческими антителами) видоспецифических блокирующих антител в течение 1 часа, с последующим добавлением какого-либо из выделенных клонов человеческих антител. Спустя 30 минут, клетки отмывали и выявляли связывание человеческого антитела с клетками при помощи ПЭ-конъюгированного козьего анти-человеческого IgG (Caltag Laboratories, Берлингейм, Калифорния, США). Блокирующими антителами, используемыми в исследовании, были: для B1 - мышиные моноклональные анти-HLA DR (Sigma, клон HK14) или анти-CD40 антитела (Beckton Dickinson, клон 5С3); для В11 - кроличьи поликлональные анти-ICAM-1 (Abcam, ab7815-250) или анти-CD22 антитела (Abeam, ab25135-100); для С11 - козьи поликлональные анти-IgM (Zymed, Южный Сан-Франциско, Калифорния, США, 62-7500) или анти-IgG антитела (Zymed, 62-8400).
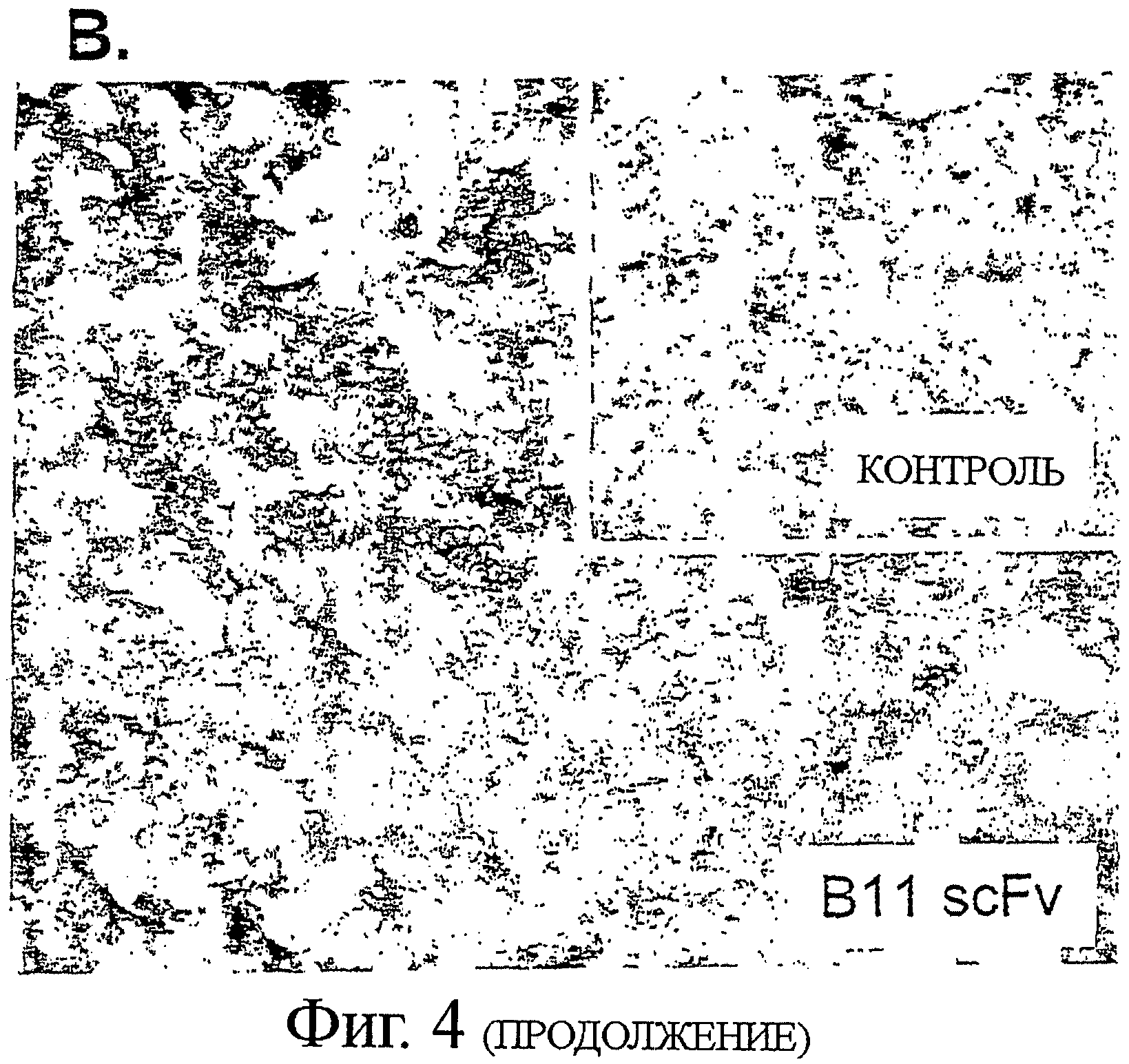
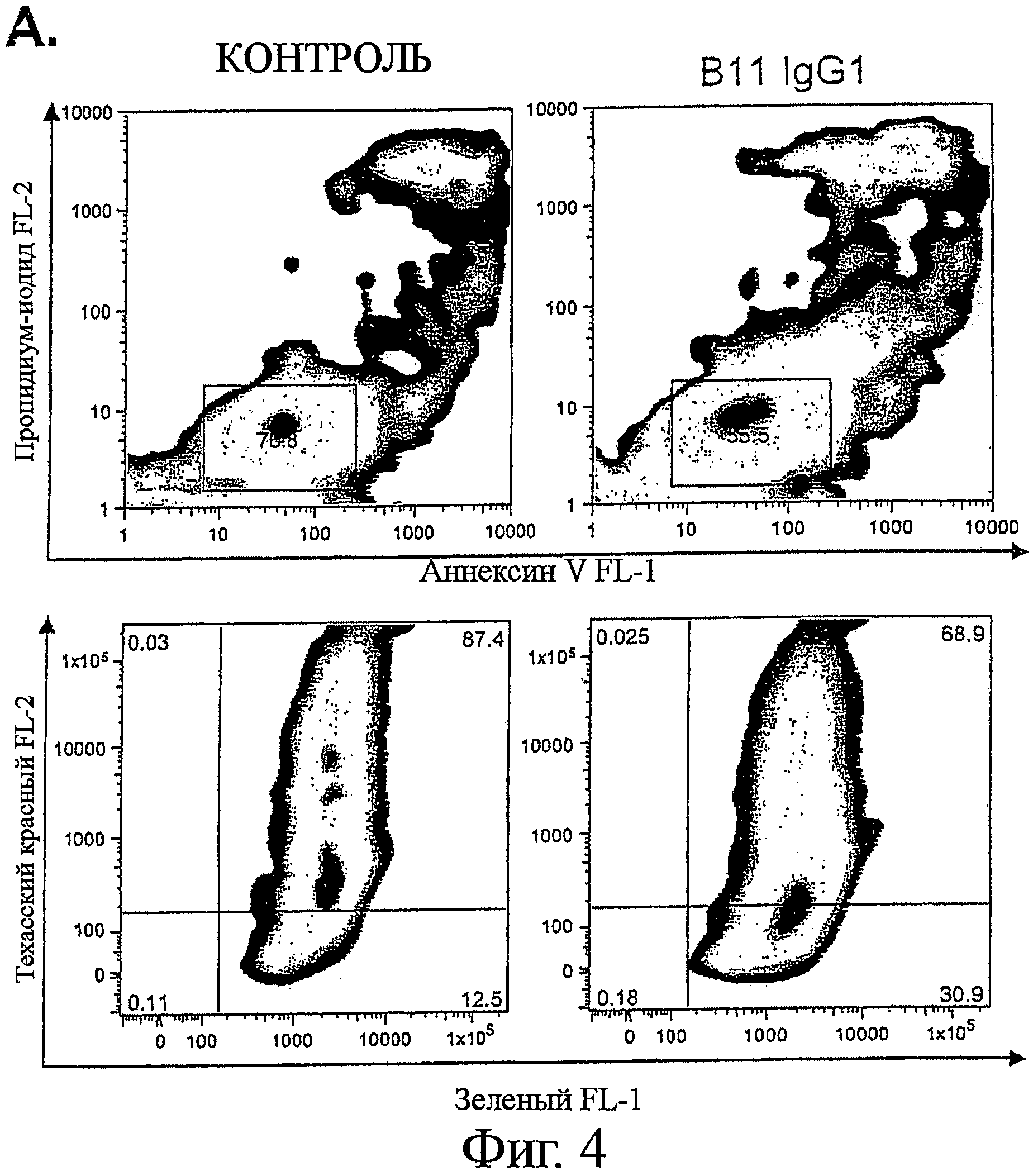
Фигура 4. ICAM-1 рецептором поверхности клетки, ассоциированным с В-лимфомой, способным опосредовать программируемую клеточную гибель
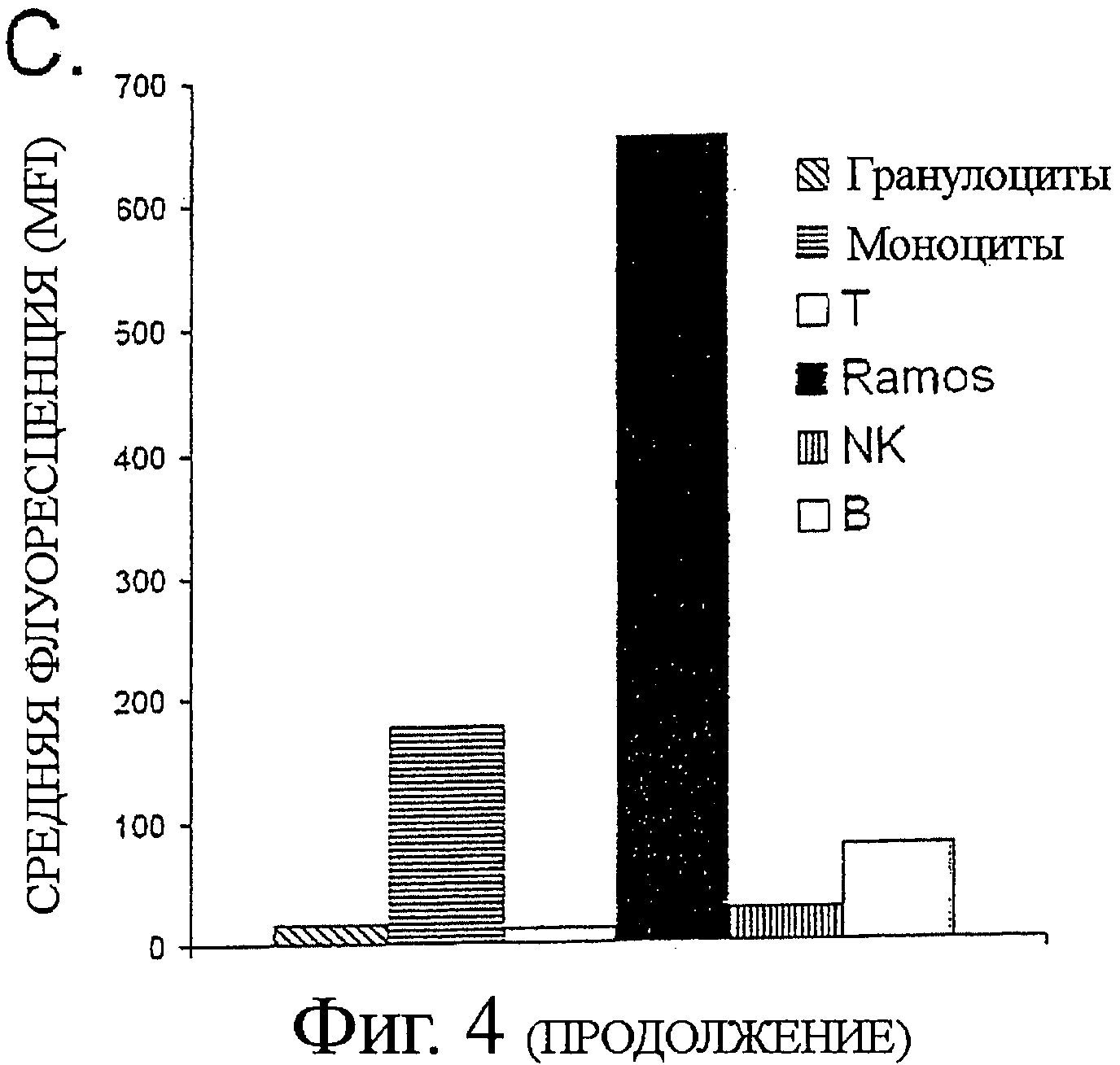
А. 2 мкг/мл В11 или анти-ФИТЦ-8 (контроль) IgG1 добавляли к 4×105 клеток В-лимфомы CL-01, инкубировали в течение 2 часов на льду, с последующим добавлением 10 мкг/мл перекрестно-связанных вторичных Fab'2 козьих анти-человеческих Fc антител. Клетки инкубировали при 37°С в течение 6 часов, и определяли эффект инкубации с антителами посредством двух независимых анализов апоптоза. Клетки окрашивали или AV/PI (верхняя панель), подобно тому, как описано выше, или инкубацией с 5 мкг/мл реагентом JC-1, деполяризующим мембрану митохондрий, в течение 30 мин при комнатной температуре (нижняя панель). Индукцию апоптоза обнаруживали по снижению отношения интенсивности красной (у-ось)/ зеленой (х-ось) флуоресценции. (В) Гистологическая секция показывает примерное связывание В11 антител с тканью В-лимфомы. Криоконсервированную ткань, взятую от пациента с анапластической крупноклеточной В-лимфомой, окрашивали с В11 или ФИТЦ-8 (контроль) scFv антителом. Связывание антител выявляли с DAB (коричневое окрашивание). Вложенная картинка показывает окрашивание с контролем scFv. (С) CD45-PerCp-Cy5.5 mAb предварительно меченые Ramos клетки смешивали с полученными от донора мононуклеарными клетками периферической крови (PBMCs), и окрашивали различные популяции клеток флуорохром-конъюгированными CD-специфическими антителами и Alexa Fluor 647 Zenon предварительно меченым В11 IgG1 или контрольным ФИТЦ-8 IgG1. IgG B11 связывание с различными клеточными популяциями регистрировали на FL4 канале.
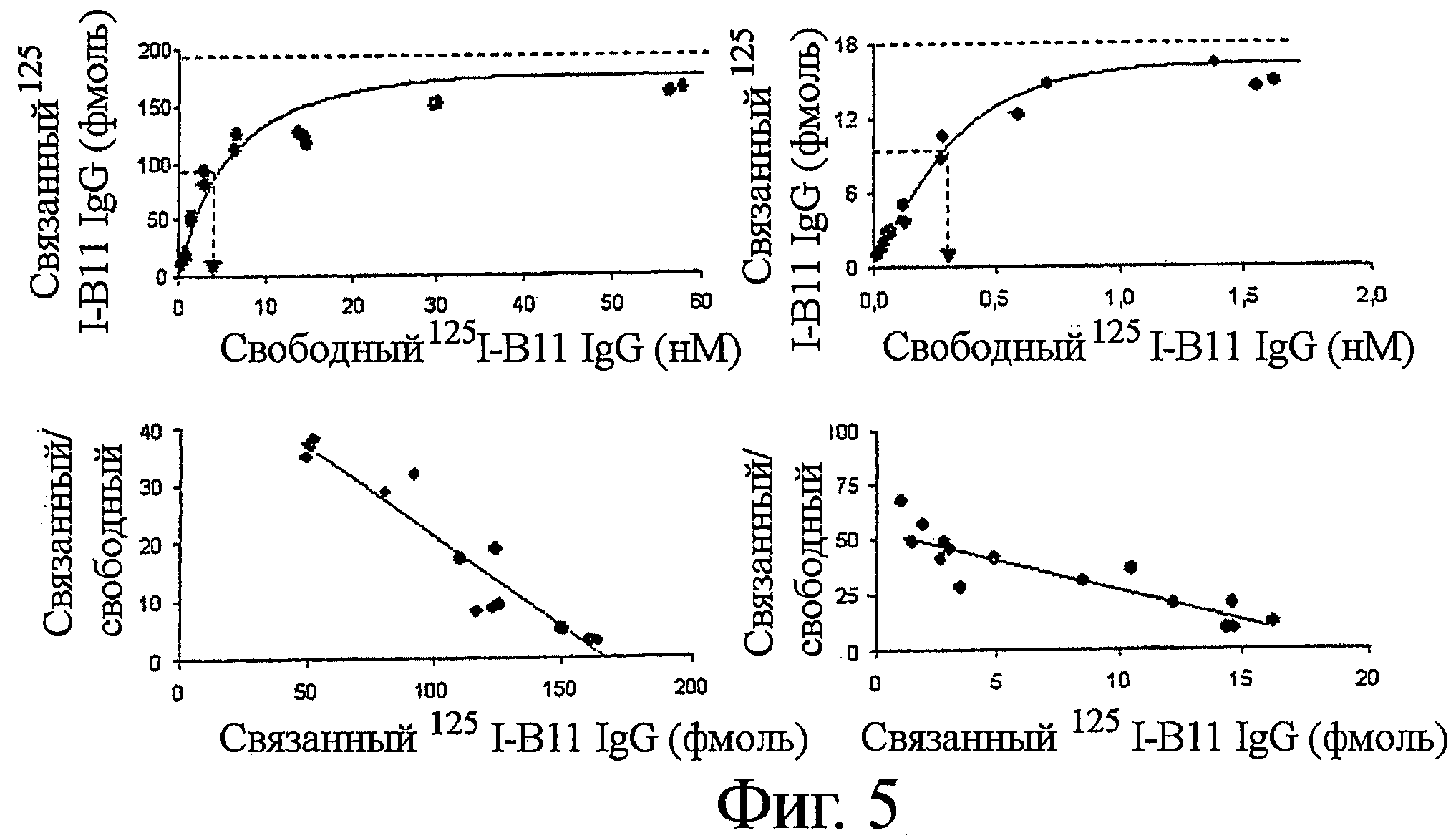
Фигура 5. Аффинность IgG B1 и IgG B11 в отношении клеток В-лимфомы
Клетки Raji (левые панели, IgG B1) или клетки Ramos (правые панели, IgG B11) инкубировали с повышающимися количествами радиоиодинированного IgG B1 или радиоиодинированного IgG B11 в присутствии или отсутствие 0,2 мг/мл соответствующего немеченого IgG белка. Специфическое связывание определяли путем вычитания связывания в присутствии немеченого белка из общего связывания. Количество связанного IgG B1 или IgG B11 белка возрастало с повышением количества свободного IgG белка с достижением насыщения связывания при ~30 нМ IgG B1 и ~1 нМ IgG B11, соответственно (верхние панели). Анализ с использованием графика Розенталя-Скетчарда (нижние панели) продемонстрировал константу диссоциации ~3 нМ с 400,000 функциональных сайтов связывания на клетку Raji для IgG B1, и константу диссоциации ~0,3 нМ с 47,400 функциональных сайтов связывания для IgG B11 (клетки Raji).
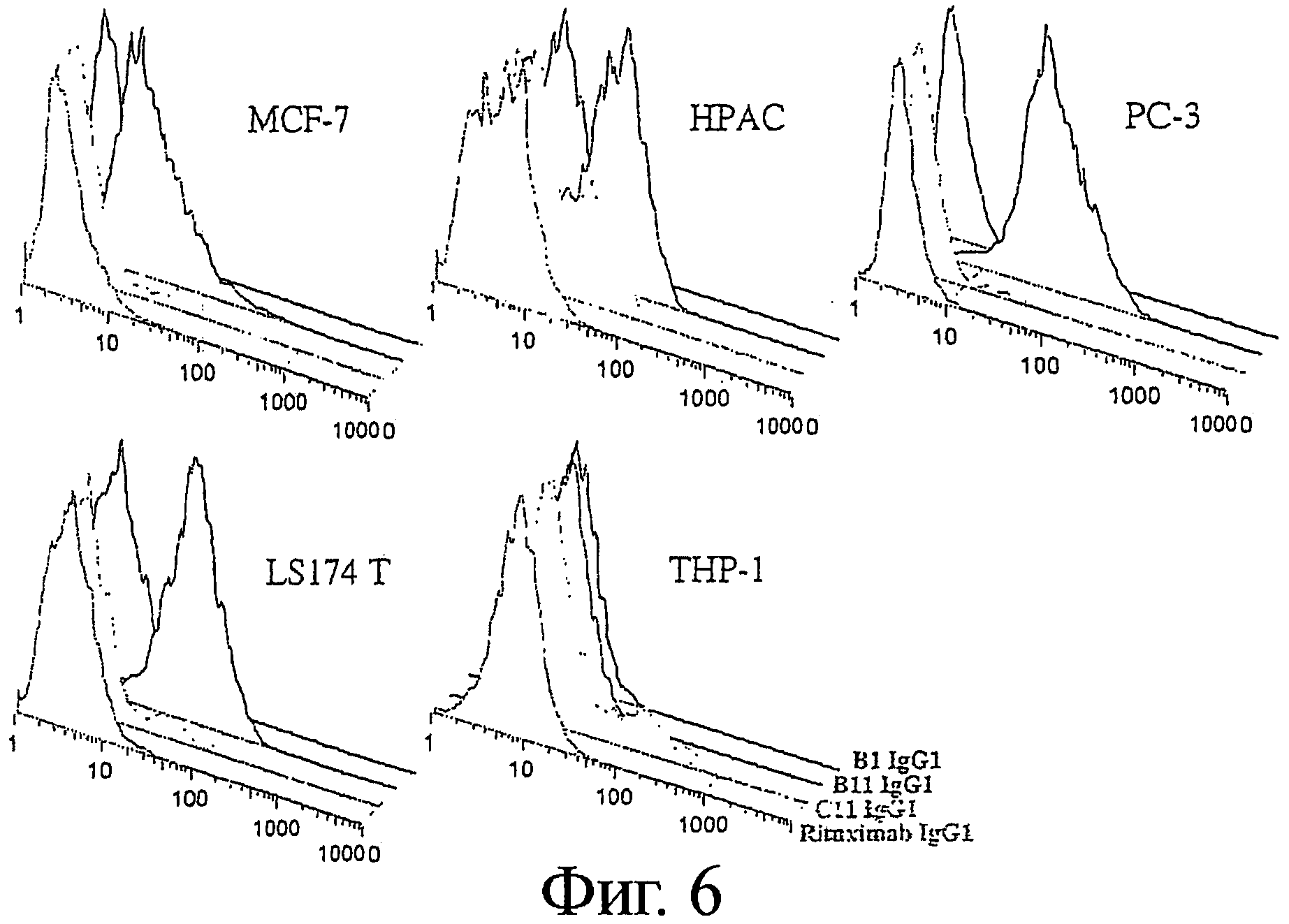
Фигура 6 - Связывание B1, В11, С11 IgG1 с клетками опухолевых линий различного происхождения
Антигенное распределение антигенов, являющихся мишенями для В1, В11 и С11 антител на различных клеточных линиях карциномы, исследовали с помощью проточной цитометрии. Гистограммы показали связывание анти-CD20 Mab Ритуксимаба (передние основные пики первого ряда), B1 IgG1 (пики второго ряда), В11 IgG1 (пики третьего ряда), или С11 IgG1 (основные задние пики четвертого ряда) с карциномой молочной железы MCF-7, карциномой поджелудочной железы НРАС, карциномой простаты РС-3, карциномой прямой кишки LS174 Т, и клетками моноцитарной лейкемии ТНР-1, как указано.
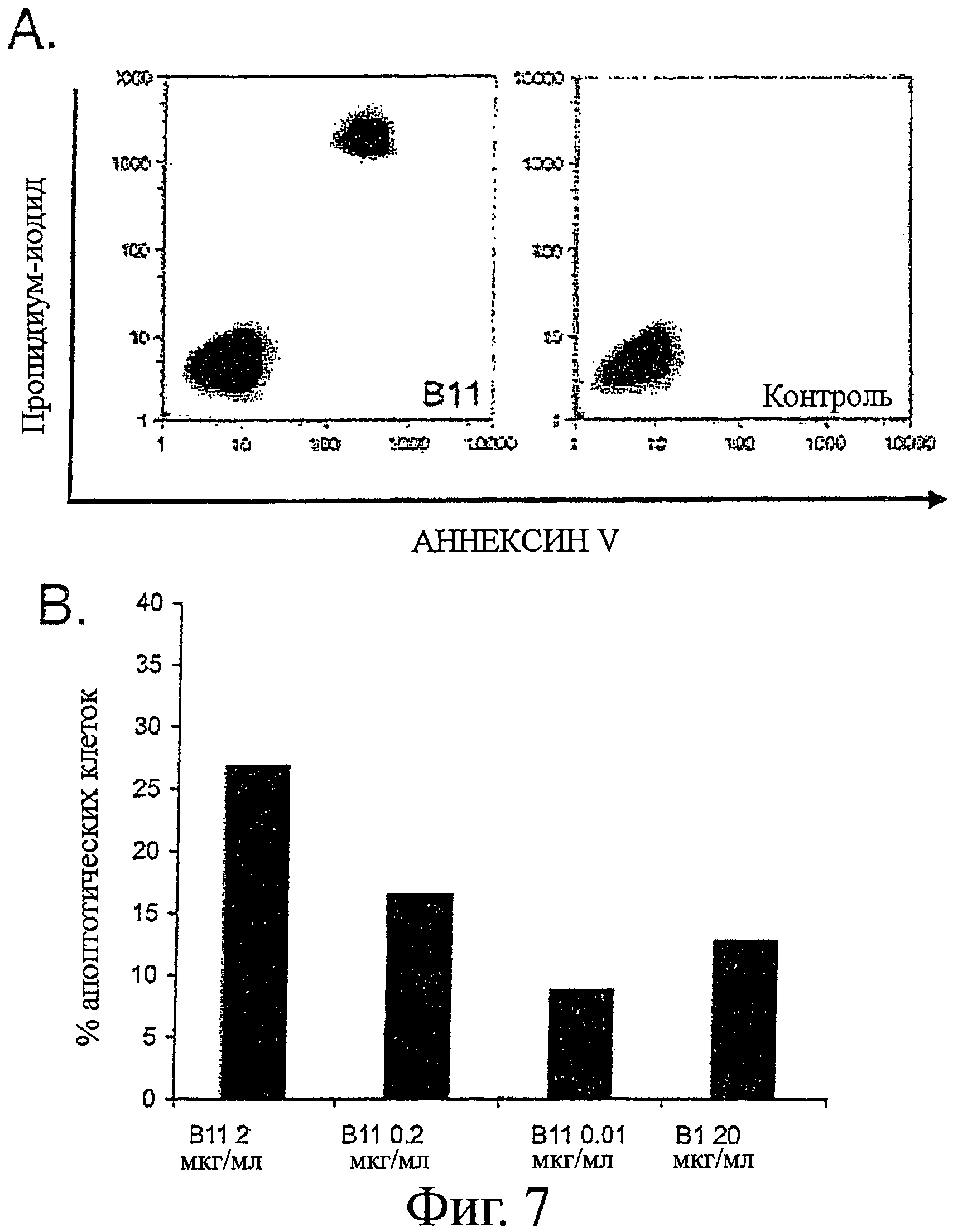
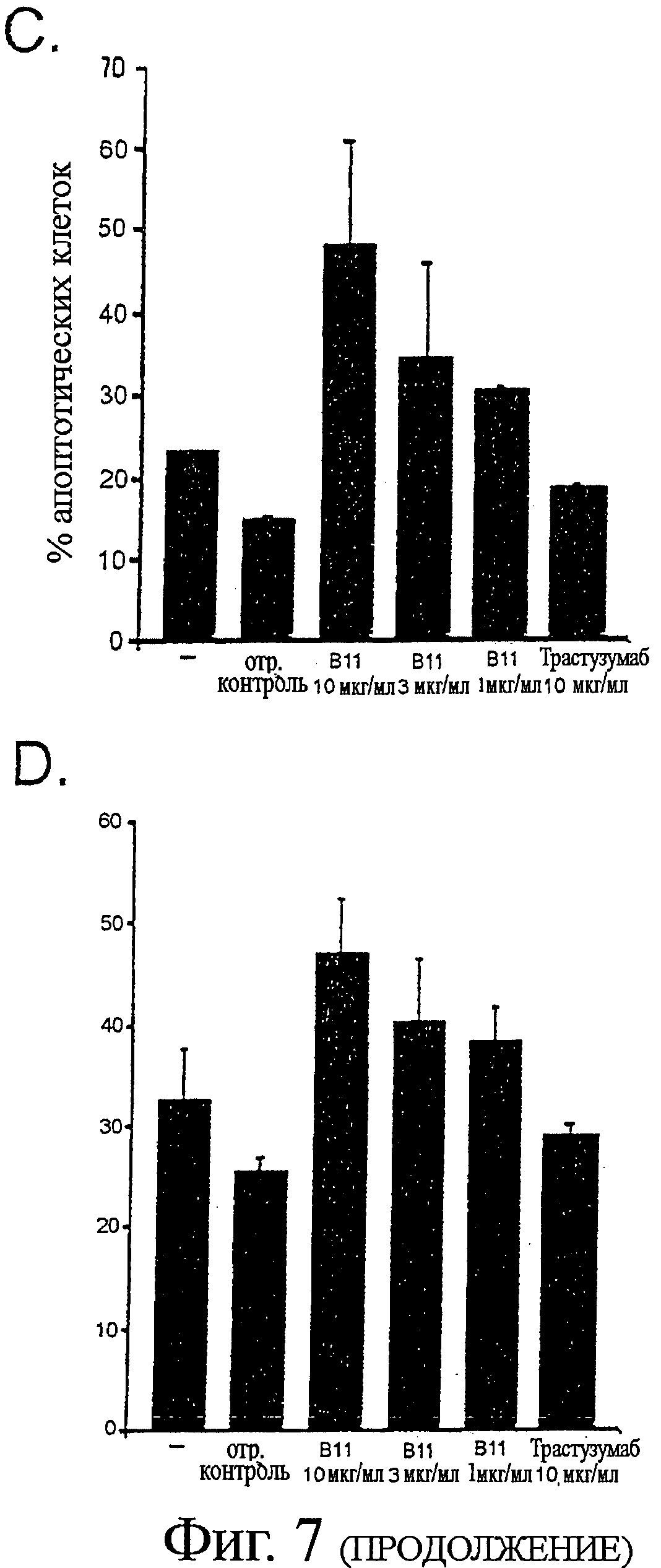
Фигура 7 - В11 IgG1 индукция апоптоза в клетках карциномы
Клеточную линию карциномы простаты PC-3 выращивали в полной ростовой среде (RPMI 1640, с добавлением 10% ЭТС, 10 мМ HEPES и 2 мМ L-глутамина) до 80% конфлюэнтности в 6-луночном планшете. Клеточную линию карциномы простаты DU145 выращивали на среде MEM с солями Эрла, с добавлением 10% эмбриональной телячьей сыворотки (ЭТС), 1 мМ пирувата натрия и 1 мМ заменимых аминокислот, а клеточную линию меланомы MDA MB 435 выращивали на среде DMEM с добавлением 10% ЭТС.
Для анализов апоптоза клетки отмывали фосфатно-солевым буферным раствором (ФБР) и добавляли серийные разведения В11 IgG1 (или B1 IgG1, Трастузумаба или отрицательного контроля антител для контролей) в отдельные лунки с последующей 1-2-часовой инкубацией при 4°С. Клетки отмывали и добавляли полную ростовую среду, содержащую перекрестно-сшивающее антитело. Fab'2 козы против человеческого Fab'2, при 10 мкг/мл. Клетки инкубировали в увлажненной атмосфере, с 5% CO2 при 37°С, в течение 16-24 часов. Клетки собирали трипсинизацией и окрашивали с Alexa Fluor 488-Аннексином V (AF488-AV) и пропидиум-иодидом (PI), в соответствии с инструкциями производителя. Процент апоптотических клеток определяли по формуле: % апоптотических клеток=100 - % AF488 - AV/PI -/-.
A. Контурные графики показывают относительное распределение клеток PC-3 как функцию позитивности по Аннексину V и Пропидиум-иодиду после инкубации, как указано выше, с 2 мкг/мл IgG В11 или IgG B1.
B. Графики в виде столбцов показывают средний процент апоптотических клеток РС-3 после инкубации с серийными разведениями В11 IgG1 или 20 мкг/мл B1 IgG1.
C. Графики в виде столбцов показывают средний процент апоптотических клеток MDA MB 435 после инкубации с контролем, не содержащим антител, 10 мкг/мл отрицательного контроля антител, серийными разведениями В11 IgG1, или 10 мкг/мл Трастузумаба IgG1.
D. Графики в виде столбцов показывают средний процент апоптотических DU145 клеток после инкубации с контролем, не содержащим антител, 10 мкг/мл отрицательного контроля антител, серийными разведениями В11 IgG1, или 10 мкг/мл Трастузумаба IgG1.
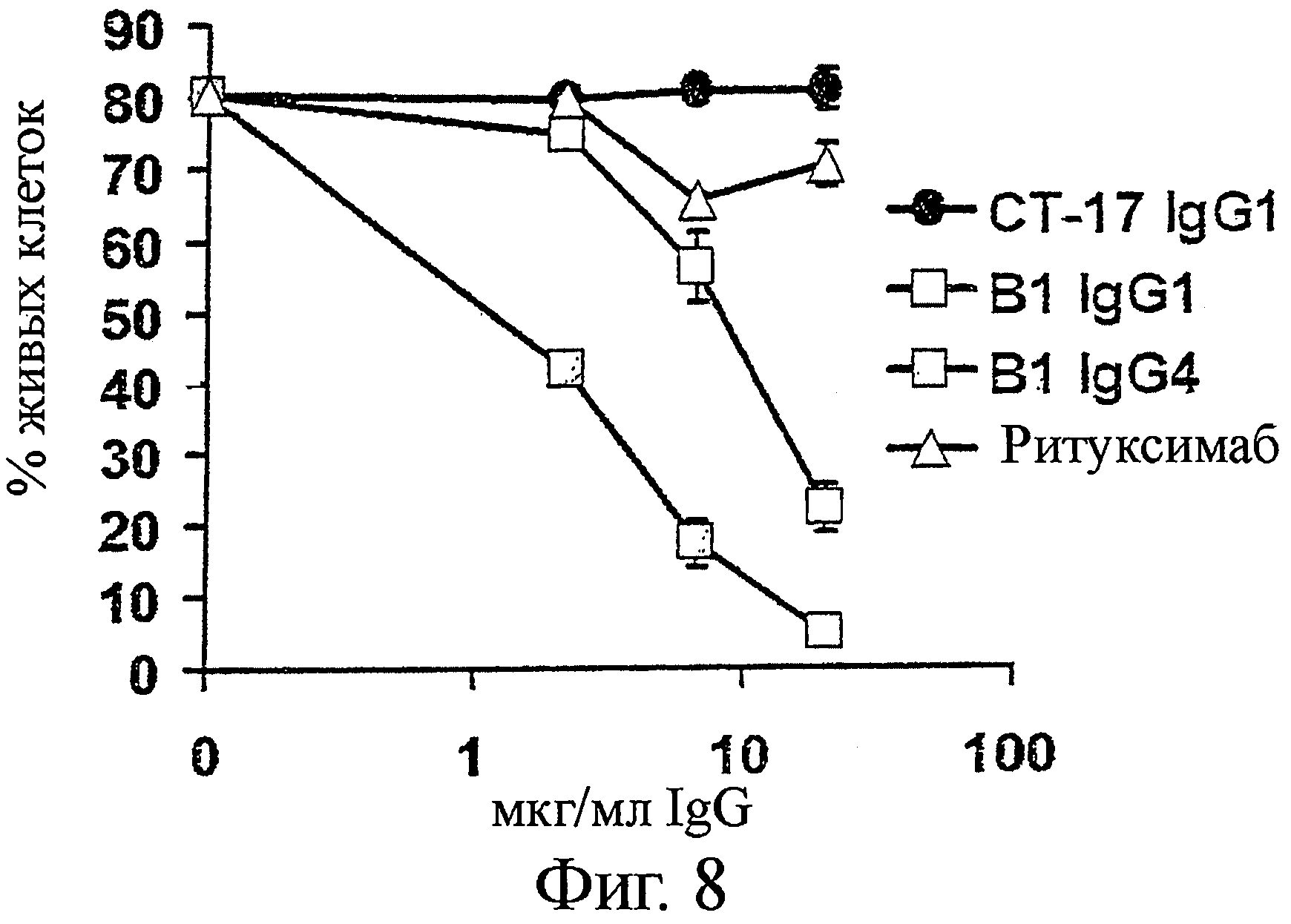
Фигура 8. В1 IgG1 и B1 IgG4 индуцируют прямую клеточную цитотоксичность на клетках Raji В-лимфомы в отсутствие перекрестно-связанных реагентов
Клетки Raji инкубировали с B1 IgG1, B1 IgG4, Ритуксимабом IgG1, или контрольным СТ-17 IgG1 при 20, 6,7 или 2,2 мкг/мл в течение 24 часов. Клетки собирали и определяли жизнеспособность как процент Аннексии V- и Пропидиум-иодид- двойных негативных клеток.
Фигура 9 - VH и VL последовательности (нуклеотидная и аминокислотная) для B1 антитела
Фигура 10 - VH и VL последовательности (нуклеотидная и аминокислотная) для В11 антитела
Фигура 11 - VH и VL последовательности (нуклеотидная и аминокислотная) для С11 антитела
Осуществление изобретения
Пример 1 - Выбор и скрининг (Биопэннинг) апоптоз-индуцирующих антител со специфичностью в отношении рецепторов клеточной поверхности, ассоциированных с В-лимфомой.
Культура клеток
Клеточную линию, применяемую в данном исследовании, получали из АТСС (Манассас, Вирджиния, США) или Deutsche Sammlung von Mikroorganismen und Zellkulturen (DSMZ) GmbH (Брауншвейг, Германия) и культивировали в среде RPMI 1640 с добавлением 10% ЭТС, 2 мМ L-Глутамина, 10 мМ HEPES и 1 мМ Na пирувата (все от Invitrogen, Карлсбад, Калифорния, США), если не указано иначе. Клеточная линия Т-лейкемии Jurkat (клон Е6-1, TIB-152, АТСС), клеточные линии В-лимфомы DOHH-2 (АСС47, DSMZ), SC-1 (ACC558, DSMZ), WSU-NHL (ACC58, DSMZ), JVM-2 (ACC12, DSMZ), Jeko-1 (ACC553, DSMZ выращенная в 20% ЭТС), Rec-1 (АСС 584, DSMZ), SP-53 (Daibata et al., Cancer 1989;64:1248-53), RL (CRL-2261, ATCC), Granta 519 (DSMZ), NCEB-1 (Saltman et al., Blood 1988; 72:2026-30), BJAB (Menezes et al., Biomedicine 1975; 22:276-84), Ramos (CRL-1596, ATCC), Raji (CCL-86, ATCC), Daudi (CCL-213, ATCC), CL-01 (Cerotti et al., J Immunol 1998; 160:2145-57), пре-В-клеточная лимфома KM-3/Reh (CRL-8286, ATCC) и множественная миелома MC/CAR (CRL-8083, ATCC, выращенная в IMDM (Invitrogen) с дополнением 20% ЭТС) все были свободны от микоплазмы и культивированы в увлажненной атмосфере при 37°С, с применением 5% CO2 атмосферы. Клетки поддерживали при 2×105-1×106 клеток/мл.
Приготовление мембранных везикул клеток Jurkat
Клетки Jurkat собирали центрифугированием при 300×g в течение 15 минут в 500 мл стаканах (Coming Inc. Life Sciences, Нью-Йорк, США), отмывали в ФБР Dulbecco (Invitrogen) и ресуспендировали в буфере А (1 мМ NaHCO3, 1.5 мМ MgAc, pH 7,4). Концентрация клеток составила приблизительно 5×107 клеток Jurkat/мл (5×109 клеток в 100 мл Буфера А).
Разрушения клеток добивались гипоосмотическим шоком (Буфер А) на льду в течение 10-30 минут и последующей кавитацией азотом в Азотной кавитационной бомбе (Parr Instrument Company, Молин, Иллинойс, США). Клетки выдерживали при постоянном давлении 40 бар (4000 кПа) в течение 15 минут при 0°С.
Разрушенные клетки собирали в 250 мл пробирку Sarstedt (Sarstedt AG & Со, Нумбрехт, Германия), содержащую 500 мкл 0,5 М ЭДТА до получения конечной концентрации ЭДТА 2,5 мМ. Добавление ЭДТА предотвращает агрегацию мембранных везикул. Гомогенат (100 мл) разделяли в 4×25 мл Бекмановские толстостенные центрифужные пробирки (Beckman Coulter, Inc., Фуллертон, Калифорния, США), которые центрифугировали в течение 10 минут при 1900×g (4000 об/мин на роторе Sorvall SS34) при 4°С для удаления не разрушенных клеток, ядер и тяжелых митохондрий.
Собирали надосадочную жидкость, и ресуспендировали осажденный материал в 25 мл 1 мМ NaHCO3 буфера, содержащего 1 мМ ЭДТА, и центрифугировали повторно (дополнительный выход осажденных неочищенных мембран Jurkat). Мембраны Jurkat объединяли с мембранами от первого центрифугирования. Надосадочные жидкости, содержащие неочищенные мембранные везикулы Jurkat, подвергали ультрацентрифугированию с применением ротора Beckman Типа 45Ti при 40000 об/мин (приблизительно 200000×g) в течение 2,5 часов при 4°С. Надосадочные жидкости отбрасывали, и остающийся буфер удаляли, переворачивая пробирку и помещая ее края на ткань (например, Kleenex™).
Осадок неочищенных мембран переносили в гомогенизатор Даунса с помощью металлического шпателя и ресуспендировали в 2,5 мл HES буфера (10 мМ Hepes, 1 мМ ЭДТА, 0,25 М сахарозы, рН 7,4) несколькими осторожными перемешиваниями в гомогенизаторе. Таким образом достигалась концентрация мембранной суспензии, эквивалентная 2×109 клеток/мл, содержащая 80-100 мг белка.
Селекция фаговых антител посредством конкретного биопэннинга с применением цельных клеток/клеточных мембранных везикул
Приблизительно 2×1013 фаговых частиц предварительно нагревали при 37°С в течение 15 мин при периодическом перемешивании, центрифугировали в течение 15 мин при 14000×g для удаления осадка, и надосадочную жидкость переносили в новую пробирку Эппендорф. Добавляли обезжиренное сухое молоко до конечной концентрации 2% (мас./об.). Препараты мембранных везикул Jurkat, полученные из 2×109 клеток (этап 1 отбора; 2×108 клеток этапов 2 и 3 отбора), оттаивали на льду и смешивали с блокировочными фаговыми частицами. Смесь инкубировали в течение 15 минут на льду.
5×107 (5×106 2-й и 3-й этапы) клеток Ramos собирали центрифугированием при 1200 об/мин в течение 6 минут при 4°С. Надосадочную жидкость отбрасывали, и клетки Ramos ресуспендировали в смеси молока, фагов и мембранных везикул Jurkat. Суспензию инкубировали при 10°С при медленном вращении от дна кверху в течение 4 часов.
Смесь клеток/клеточных мембранных везикул/фагов переносили в 15 мл пробирку Falcon (BD Biosciences, Бедфорд, Массачусетс, США), содержащую 0,5 мл 100% (окраска трипановым синим) Ficoll-Paque PLUS (Amersham Biosciences, Уппсала, Швеция) на дне, и наслоенные сверху 9,5 мл 40% (об./об.) Фиколла в 2% (мас./об.) БСА/ФБР (подушка фиколла). Пробирку центрифугировали при 1500 об/мин в течение 10 мин при 4°С. Пробирку вынимали из центрифуги, закрывали пробкой и герметично заклеивали.
Нижний конец пробирки Falcon, содержащий 100% Фиколл, срезали с использованием ножниц для резки сигар. Таким образом, материал очень высокой плотности, включающий слои мембранных везикул и клеточных ядер, удаляли из пробирки. Пробку пробирки осторожно открывали, нарушая вакуум внутри пробирки и позволяя жидкости стекать по каплям через отверстие (срезанное) на дне пробирки.
Суспензию собранных клеток отмывали ФБР один раз для удаления избытка Фиколла. Осадок ресуспендировали в 1 мл ФБР (не выполняя последующего конечного отмывания), суспензию повторно наносили на верх свежей подушки фиколла и повторяли процедуру отмывки (дважды на этапах 2 и 3).
Фаги элюировали с клеток добавлением 150 мкл 76 мМ лимонной кислоты (рН 2,5) в ФБР с последующей инкубацией при комнатной температуре в течение 5 минут. Смесь нейтрализовали добавлением 200 мкл 1 М Трис-HCl, рН 7,4. Надосадочную жидкость, содержащую элюированный фаг, сохраняли с последующим осаждением клеток при 300×g в течение 5 мин. Дальнейшую элюцию фага проводили ресуспендированием и инкубацией осадка клеток в 1 мл трипсина при комнатной температуре в течение 10 минут.
После инактивации с 40 мкм апротинина 1 мг/мл клетки центрифугировали и сохраняли надосадочную жидкость, содержащую элюированный фаг. Элюированный фаг применяли для заражения Escherichia coli HB101F, и помещали бактерии на среду ТВ, содержащую подходящие антибиотики и глюкозу. Подсчитывали бактериальные колонии, собранные с планшетов, и применяли в качестве инокулятов для следующего этапа биопэннинга.
Конверсия в формат scFv, экспрессия scFv, очистка и анализ связывания с клетками
Фагмидный пул, полученный после трех этапов селекции, обрабатывали EagI для удаления гена III. Полученный вектор связывали повторно. Векторы, содержащие повторно связанные фрагменты не разрезанного гена III, линеаризовали обработкой ферментом EcoRI. Пул вектора scFv, созданный таким образом, применяли для трансформации клеток Е.coli ТОР10 в основном, как описано ранее (Soderlind et al., Nat Biotechnol 2000; 18:852-6).
Бактерии помещали на большие 500 см2 агаровые пластины и отбирали индивидуальные клоны, переносили в 96-луночные планшеты и экспрессировали в ТВ среде при культивировании в течение ночи при 37°С, 220 об/мин с применением автоматизированной системы (Hallborn Biotechniques 2002; Suppl:30-7). Фрагменты рекомбинантного scFv продуцировались в среде ТВ, содержащей подходящие антибиотики.
Для первичного скрининга scFv клона, связывающегося с клетками-мишенями Ramos и клетками, не являющимися мишенью, Jurkat, 5,000 клеток Ramos или Jurkat инкубировали с каким-либо из 960 scFv клонов, полученных на 3-м этапе селекции, и продуцировали, как описано выше. Клетки инкубировали с 0,5 мкг/мл анти-6хГис моноклональных антител (R&D Systems, Миннеаполис, Миннесота, США) и 0,7 мкг/мл Су5-конъюгированного козьего анти-мышиного реагента (Amersham Biosciences). Связывание с клетками анализировали при помощи устройства 8200 Cellular Detection System Fluorescence Macroconfocal High Throughput Screening (FMAT) instrument (Applied Biosystems, Фостер Сити, Калифорния, США).
После первичного скрининга произвольно отбирали семьдесят два бактериальных клона (т.е. независимо от клеточной реактивности клеток-мишеней и клеток, не являющихся мишенью, в первичном скрининге) для ДНК-секвенирования, как описано ранее (Soderlind et al., Nat Biotechnol 2000; 18:852-6) (Soderlind et al., 2000). Для оценки связывания с клеточной поверхностью посредством проточной цитометрии, клетки Ramos и Jurkat (те и другие при добавлении 2×105 клеток на анализ) инкубировали с индивидуальными клонами scFv при концентрации 2-10 мкг/мл в ФБР (Invitrogen), содержащем 0,5% мас./об. БСА (DPBS-B) в течение 1 часа.
Клетки отмывали центрифугированием при 300×g в течение 6 минут. Затем клетки инкубировали с ФИТЦ-конъюгированными CD 19 моноклональными антителами и ПЭ-конъюгированными CD3 моноклональными антителами (BD), обеспечивая последующую идентификацию клеток-мишеней и клеток, не являющихся мишенью, соответственно. Обнаружение связывания scFv достигали инкубацией с RРЕ-Су5-стрептавидином (Dako Cytomation, Глоструп, Дания) с последующей инкубацией с биотинилированными анти-6хГис моноклональными антителами. Клетки инкубировали со вторичным и третичным реагентами в течение 40 минут и 15 минут, соответственно. Все инкубации проводили на льду с применением охлажденных на льду растворов.
Дифференциальный пэннинг цельных клеток/ клеточных мембранных везикул
В настоящем исследовании применяли новый протокол пэннинга для выделения антител, направленных на дифференциально экспрессируемые антигены в их исходной конфигурации для клеточной поверхности. После трех этапов конкурентного биопэннинга с применением цельных клеток В-лимфомы Ramos и мембранных везикул, полученных из клеток Т-лейкемии Jurkat, выделяли рекомбинантные фаги scFv. Их конвертировали в растворимые scFv и экспрессировали в клетках Е.coli TOP10.
Рекомбинантный scFv инкубировали с цельными клетками-мишенями (Ramos) или клетками, не являющимися мишенью (Jurkat), и оценивали связывание с клетками. Специфичность клонов антител в отношении антигенов клеток-мишеней была поразительной, поскольку было показано, что экспрессированные 482 scFv клоны избирательно связывались с клетками-мишенями Ramos при интенсивности от слабой до очень сильной (Фиг.1А). Были идентифицированы только два клона, слабо окрашивающих клетки Jurkat, не являющиеся мишенью (Фиг.1А).
Далее мы определили разнообразие генотипов изолированного ScFv, представленного на поверхности фагов. Семьдесят два scFv клона были произвольно отобраны (т.е. независимо от тропизма связывания, определенного при первичном скрининге) для ДНК-секвенирования.
Клоны одновременно повторно экспрессировали и повторно оценивали на специфичность в отношении клеток-мишеней (Ramos и Jurkat) посредством FMAT технологии, как описано (Фиг.1В). Идентифицировали семь различных генотипов антител, как было определено по их различным CDRH3 и CDRL3 последовательностям (данные не показаны).
Высокая специфичность анти-Ramos scFv была подтверждена трехцветной проточной цитометрией, с последующей инкубацией с равным числом клеток Ramos и Jurkat и детекцией scFv связывания с помощью анти-tag антитела (Фиг.1C).
Клетки-мишени и клетки, не являющиеся мишенью, определяли по CD19 и CD3 экспрессии, соответственно, с применением конъюгированных с флуорохромом CD-специфических моноклональных антител. Семь генотипически уникальных scFv клонов показали высокую и вариабельную интенсивность связывания с клетками-мишенями Ramos, но не связывания с клетками Jurkat, не являющимися мишенью, по сравнению с отрицательным контролем scFv.
Анализ апоптоза
Уровни липополисахарида в рекомбинантно произведенных фрагментах scFv снижали с применением колонок Detoxigel в соответствии с инструкциям производителя (Pierce Biotechnology, Рокфорд, Иллинойс, США). Уровень оставшегося эндотоксина определяли с помощью теста с использованием лизата амебоцитов LAL (Cambrex Bioscience, Уолкерсвилль, Мериленд, США).
Было установлено, что все образцы scFv содержат менее 0,1 МЕ/мл липополисахарида. Химерное анти-CD20 антитело Мабтера™ (Ритуксимаб) получали из Университетского госпиталя Лунда (Лунд, Швеция), 2×105 клеток В-лимфомы (Raji или Ramos) или Т-клеток Jurkat инкубировали с серийно разведенными и детоксицированными scFv в культуральной среде в течение 1 часа на льду.
Клетки последовательно инкубировали с вторичными анти-6хГис моноклональными антителами (5 мкг/мл) и третичными козьими Fab'2 анти-мышиными Fab'2 антителами (Jackson ImmunoResearch Laboratories, Inc., Вест Гроув, Пенсильвания, США). Периодическое отмывание обеспечивало удаление избытка несвязанного реагента антител. Клетки инкубировали при 37°С в увлажненной атмосфере с 5% CO2 в течение 24 часов.
Когда цельный IgG применяли для индукции апоптоза, перекрестно-связанный реагент заменяли на козьи Fab'2 анти-человеческие Fc γ антитела (Jackson ImmunoResearch) с минимальной перекрестной реактивностью с отличными от IgG изотипами антител (для избежания неспецифического перекрестного связывания с эндогенными иммуноглобулинами, ассоциированными с поверхностью В-лимфомы), и инкубировали, как описано выше, в течение 6 часов.
Апоптотические клетки выявляли, если не установлены иначе, комбинированным окрашиванием с Annexin V Alexa Fluor 488 (AV) и пропидиум-иодидом (PI) (оба от Molecular Probes, Invitrogen) и последующим анализом проточной цитометрией. Клетки были определены как жизнеспособные (AV-/PI-), ранние апоптотические (AV+/ PI-) или поздние апоптотические/некротические (AV+/PI+). AV и PI сигналы регистрировали на FL1 и FL2 или FL3 каналах (как указано в тексте), соответственно, с помощью прибора FACSCalibur (BD Biosciences).
Для того чтобы исследовать функциональность выделенного scFv, мы установили высокопроизводительный скрининговый анализ апоптоза, основанный на последовательной инкубации и отмывании от клеток с scFv и перекрестно-сшивающим реагентом. Зависимость от scFv клона и концентрации в анализе апоптоза продемонстрирована на Фиг.2А-С, где апоптотический эффект выбранного scFv клона В1 сравнивается с - эффектом scFv клона F1, не проявляющего индукции апоптоза. Клетки Jurkat, у которых отсутствует экспрессия целевого антигена, не погибают в результате апоптоза после обработки с каким-либо оцениваемым scFv, демонстрируя, что индукция апоптоза зависит от связывания с целевым антигеном (данные не показаны).
Применяя установленный анализ scFv-апоптоза, мы отобрали клоны для апоптоза на клетках В-лимфомы Ramos и Raji, scFv-индуцированные апоптотические эффекты сравнивали с теми, которые были индуцированы Ритуксимабом и анти-CD20 моноклональными антителами (Фиг.2D). Три scFv клона - B1, B11 и С11 - были идентифицированы как индуцирующие значительный апоптоз как в клетках Ramos, так и в Raji (Фиг.2D и Е). Индукция апоптоза scFv на клетках Raji коррелировала со связыванием с этими клетками (Фиг.2D), поскольку scFv клоны, неспособные связываться с клетками Raji, не индуцировали апоптоз.
B1, B11 и С11 клоны переводили в полностью человеческие антитела IgG1. Их специфичность и функциональность оставались интактными после реформатирования, как продемонстрировано по их сильному связыванию и мощной цитотоксичности по отношению к широкой панели клеточных линий В-лимфомы (Таблица 1). Примечательно, что индукция апоптоза была быстрой с максимальным процентом аннексин-V положительных клеток, достигаемых уже спустя три-шесть часов на некоторых клеточных линиях (Таблица 1 и не показанные данные).
Анализы продукции IgG и скрининг эндотоксина
Фрагменты антител scFv были конвертированы в формат полноразмерных человеческих IgG1λ посредством клонирования в модифицированный вектор pCDNA3 (Norderhaug et al., J Immunol Methods 1997; 204:77-87), и транзиторно трансфектировали в клетки HEK293 с применением реагента Липофектамин 2000 в соответствии с инструкциями производителя (Invitrogen).
Человеческий IgG очищали из отработанной культивационной среды на колонке MabSelect с протеином A (Amersham Biosciences). Чистота препаратов составила >98% по результатам электрофоретического анализа в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ). Препараты антител были проанализированы и, как было установлено, содержали <0,1 МЕ/мл эндотоксина при концентрациях, применяемых в настоящем исследовании, как было определено с помощью теста с лизатом амебоцитов LAL (Cambrex Bioscience).
Пример 2 - Анализ специфичности антител
Идентификация антигена
Подлинность антигенов-мишеней определяли иммунопреципитацией с лизатами клеток В-лимфомы. Клетки (50-600×106 на мл лизирующего буфера, в зависимости от антитела и клеточной линии) собирали центрифугированием, дважды отмывали в ФБР и инкубировали в течение 15 минут в лизирующем буфере (25 мМ Трис-HCl, рН 7,5, 150 мМ NaCl, 5 мМ ЭДТА, и полный коктейль ингибиторов протеаз без ЭДТА (Roche Diagnostics GmbH, Маннхейм, Германия)), содержащем детергент Тритон Х-100 (Sigma-Aldrich, Сент-Луис, Миссури, США) при 0,5% об./об.
Клеточный дебрис осаждали при 16000×g в течение 15 минут в стандартной настольной центрифуге и предварительно очищали на Протеин А-Сефарозе 4 Fast Flow (Amersham Biosciences) (1/10 объема реакционной смеси) в течение 1 часа при перемешивании. Для каждого образца 1 мл предварительно очищенного клеточного лизата осаждали иммунопреципитацией в течение 2 часов 20-100 мкг каких-либо человеческих антител. Протеин А-Сефарозу 4 Fast Flow добавляли вновь и инкубировали в течение 30 минут, а после интенсивного промывания иммунных комплексов в лизирующем буфере, кипятили в течение 5 минут, и окончательно ресуспендировали в Буфере для образцов (1X NuPAGE LDS буфер для образцов, 1X NuPAGE восстанавливающий агент для образцов) и разделяли в NuPAGE Novex 4-12% Бис-Трис Геле (все от Invitrogen).
После окрашивания (Simply Blue Safestain, Invitrogen), интересующие белковые цепи вырезали из ДСН-ПААГ и подвергали расщеплению трипсином, как описано (Edvardsson et al., Electrophoresis 1999; 20:935-42).
Вкратце, блоки геля отмывали от краски и уравновешивали трехкратным отмыванием с 200 мкл 50% ацетонитрила (ACN) при перемешивании. После высушивания в концентраторе SpeedVac (Savant, Farmingdale, Нью-Йорк, США) в течение 15 минут, образцы восстанавливали добавлением 25 мкл 10 мМ ДТТ/100 мМ NH4HCO3 и инкубировали в течение 56°С в течение 1 часа, и алкилировали добавлением 25 мкл 55 мМ иодоацетамида/100 мМ NH4HCO3 с последующей инкубацией в течение 45 минут при комнатной температуре.
После двух дополнительных 10-минутных этапов отмывания в 100 мМ NH4HCO3 с последующим отмыванием в 50% об./об. ACN, кусочки геля высушивали в концентраторе SpeedVac и повторно намачивали и переваривали в 15 мкл 15 нг/мкл трипсина (Promega Corporation, Мэдисон, Висконсин, США) в 25 мМ NH4HCO3 при 37°С в течение ночи. Пептиды экстрагировали добавлением 50% об./об. ACN /1% об./об. ТФУ и 10 мин инкубацией при комнатной температуре. 1 мкл экстракта наносили на пластины для образцов MALDI и оставляли до высыхания. 1 мкл раствора матрицы (5 мг/мл альфа-циано-4-гидрокси коричной кислоты (СНСА) в 75% об./об. ACN /1% об./об. ТФУ) наносили поверх пептидов
Массы пептидов определяли с применением 4700 Maldi Workstation фирмы Applied Biosystems. Протеины идентифицировали базе данных пептидных масс с использованием поисковых инструментов Mascot (Matrixscience, Великобритания). Антигенную специфичность клонов В10, С10 и G12 идентифицировали с применением сходной методологии, за исключением покрытых scFv- и анти-Гис магнитных микробусин (Miltenyi Biotec GmbH, Bergisch Gladbach, Германия), использованных для иммунопреципитации.
После конверсии до формата полных антител B1, B11 и С11 IgG использовали для преципитации антигенов из клеток В-лимфомы Raji и Ramos. IgG B1 преципитировал две полосы примерно 28 и 34 кДа, соответственно (Фиг.3А, полоса 1). Куски геля, содержащие эти полосы, вырезали, обрабатывали трипсином и анализировали масс-спектрометрией, идентифицируя HLADR/DP в качестве целевого антигена.
Специфичность IgG B1 в отношении HLA-DR/DP была подтверждена вестерн-блоттингом и детекцией HLA-DR/DP белка, с применением коммерчески доступных моноклональных антител, и блокированием B1 IgG связывания после предварительной инкубации клеток с коммерчески доступными HLA-DR специфическими моноклональными антителами (Фиг.3В).
Идентичность IgG B11 и С11 определяемых антигенов была установлена с применением сходной методологии. Было установлено, что IgG С11 преципитирует 68 кДа полосу белка, идентифицированного как мембранно-связанная форма µ-цепи В-клеточного рецептора (Фиг.3А, полоса 3). IgG B11 преципитировал 90 кДа полосу белка, идентифицированного как молекула клеточной адгезии -1 (ICAM-1) (Фиг.3А, полоса 2). Специфичность IgG В11 для ICAM-1 и С11 IgG для IgM были подтверждены тандемной масс-спектрометрией, исследованиями блокирования антител (Фиг.3В), и вестерн-блоттингом (данные не показаны) с применением коммерчески доступных антител.
Специфичность клонов В10, С10 и G12 определяли с применением scFv и анти-His покрытых магнитных микробусин для иммунопреципитации. Три scFv клона преципитировали полосу белка 68 кДа, и МС-анализ кусочков геля, содержащих эти полосы, после обработки трипсином выявил их специфичность в отношении поверхностного IgM. Возможно, эти антитела распознают Ramos IgM идиотип, поскольку ни одно из них не дает перекрестной реакции с В-лимфоцитами периферической крови или другими IgM-позитивными В-клеточными линиями.
Пример 3 - Анализ аффинности антител
Иодирование in vitro B1 и В11 иммуноглобулинов
Иодирование 1 мг/мл IgG1 B1 или IgG1 В11 белков с [125I] NaI проводили в ФБР в течение 10 минут с применением покрытых Иодогеном пробирок для иодирования (Pierce). Свободный [125I] NaI удаляли обессоливанием на колонках PD-10 (Amersham Biosciences), получая удельную радиоактивность в диапазоне 1000-1600 имп./мин на нг белка [125I] IgG1 B1 и [125I] IgG1 B11 применяли для определения аффинности антител.
Определение констант аффинности IgG B1 и IgG В11
Меченные радиоактивным иодом IgG B1 или IgG В11 инкубировали с клетками В-лимфомы в DPBS-B-hIgG (DPBS-B, содержащем 0,2 мг/мл человеческого IgG) в течение двух часов на льду с периодическим перемешиванием. Неспецифическое связывание определяли в присутствии 0,2 мг/мл немеченого IgG B1 или IgG В11 белка, соответственно. Анализы проводили в трех повторностях.
Клетки наносили поверх подушки 40% об./об. Ficoll/DPBS-B в отдельные пробирки и центрифугировали при 400×g в течение 6 минут при 4°С. Образцы замораживали при -80°С. Клеточные осадки и надосадочную жидкость выделяли и анализировали отдельно на содержание 125I-IgG белка в гамма-счетчике, после разрезания пробирок напополам.
Константы аффинности антител (значения Kd) и число эпитопов на клетку определяли с помощью анализа Скетчарда по Rosenthal et al., (Anal Biochem 1967; 20:525-32), Bylund and Yamamura (Methods in Neurotransmitter Analysed. New York: Raven Press Ltd., 1990), и Marquardt (J. Soc. Indust. Appl. Math 1963; 11:431-41), как описано ранее (Brix et al., J. Clin. Invest. 1998; 102:283-93).
Связывание IgG B1 и IgG В11 с HLA-DR и ICAM-1 характеризовали путем инкубации меченных радиоактивным иодом белков с клетками Raji или Ramos в присутствии или отсутствие 0,2 мг/мл соответствующего немеченого IgG белка при 4°С. Удельное связывание [125I] IgG с клеточной поверхностью подсчитывали путем вычитания неспецифического связывания (связывания в присутствии избытка немеченого IgG) из общего связывания.
Насыщение удельного связывания IgG B1 с клетками Raji достигалось при t ~30 нМ IgG B1 (Фиг.5). Анализ с использованием графика Розенталя-Скетчарда установил константу диссоциации ~3 нМ с 400000 функциональными сайтами связывания на клетку Raji, позволяя предположить бивалентное взаимодействие эпитоп-IgG (Фиг.5). Аналогично, константа диссоциации IgG B11 была определена как ~0,2 нМ с 47 400 рецепторами на клетку Ramos.
Пример 4 - ICAM-1 является антигеном, ассоциированным с В-лимфомой, с апоптоз-индуцирующими свойствами
Анализ связывания IgG с клетками Ramos с помощью проточной цитометрии
Клетки Ramos (13×106) окрашивали моноклональными антителами CD45-PerCp-Су5.5 путем инкубации на льду в течение 45 минут, отмывали DPBS-B и хранили на льду до смешивания с немечеными очищенными лейкоцитами периферической крови.
Лейкоциты от двух здоровых добровольцев были получены из Университетского госпиталя Лунда. Лейкоциты разбавляли 1:2 ФБР и отмывали центрифугированием при 500×g (1500 об/мин на центрифуге Beckman Spinchron) в течение 10 минут, с полным удалением надосадочной жидкости и ресуспендированием в DPBS, содержащем 1% инактивированной нагреванием ЭТС (DPBS-HI). Отмывание повторяли дважды. Красные кровяные клетки разрушали инкубацией с раствором, лизирующим эритроциты (BD Biosciences) в течение 15 минут при комнатной температуре. Клетки отмывали центрифугированием при 60×g (667 об/мин на центрифуге Beckman Spinchron) в течение 10 минут, и тщательно удаляли надосадочную жидкость аспирацией. Клетки подсчитывали в камере Бюркера с последующим окрашиванием трипановым синим (Invitrogen) и исключением мертвых клеток, отмывали в DPBS-HI, осаждали и ресуспендировали в DPBS-B, содержащем 200 мкг/мл очищенного человеческого IgG (блокирование Fc рецепторов).
Для каждого донора и условий анализа, приблизительно 2,5×106 лейкоцитов смешивали с 1,6×105 PerCpCy5.5 предварительно меченных клеток Ramos. Добавляли мышиные моноклональные CD3- ФИТЦ, CD56-PE и CD19-PerCpCy5.5 антитела (BD Biosciences) и инкубировали смеси на льду до добавления меченого человеческого IgG. Мечение на человеческих IgG антител n-CoDeR и положительного контроля - анти-CD20 мышиных-человеческих химерных антител Ритуксимаба при помощи AF647 Fab фрагментов (Molecular Probes, Invitrogen) проводили в соответствии с инструкциями производителя.
Вкратце, 4 мкг каждого из антител IgG В1, В11, С11 и Ритуксимаба инкубировали с 20 мкл метящего реагента AF647-Fab в течение 5 минут при комнатной температуре. После добавления 20 мкл человеческого IgG блокирующего реагента и последующей инкубации в течение 5 минут, готовили трехкратные серийные разведения AF647-меченного IgG в DBPS-B, и разбавленные IgG белки добавляли к смешанным растворам клеток Ramos/лейкоцитов периферической крови.
Образцы инкубировали в течение 1 часа, отмывали, ресуспендировали в DPBS-B и анализировали на связывание с различными субпопуляциями клеток проточной цитометрией, с последующей надлежащей калибровкой и компенсацией прибора для четырехцветного анализа. Клетки Ramos идентифицировали как PerCpCy5.5высокий популяцию, в отличие от PerCpCy5.5низкий популяции В-лимфоцитов.
Иммуногистохимия
Криосохраненные биоптаты лимфоузлов пациентов с анапластической крупноклеточной лимфомой (один пациент), центробластной/центроцитарной В-не-Ходжкинской лимфомой (три пациента) и В-клеточной хронической лимфоцитарной лейкемией (один пациент) были получены в Отделении патологии Университета Лунда (Лунд, Швеция). Срезы толщиной восемь микрометров криосохраненной ткани фиксировали в ацетоне в течение 10 минут при 4°С. Эндогенную биотин-связывающую активность блокировали последовательной обработкой Авидином и Биотином (Набор для блокирования Авидина/Биотина, Invitrogen) по 20 минут для каждого.
Ткани инкубировали с 5 мкг/мл контроля scFv или В11 scFv в течение 1 часа. После отмывания, секции инкубировали с биотин-конъюгированными мышиными анти-Гис моноклональными антителами (R&D Systems) в течение 30 минут. scFv связывание выявляли после обработки ABC Комплекс/ ПХ (пероксидаза хрена) реагентом (Dako Cytomation) в течение 30 минут, и последующей инкубацией с диаминобензидином (ДАБ) в течение 5 минут.
Секции фотографировали с применением цифровой камеры Leica DC 300F, установленной на световом/флуоресцентном микроскопе Leica DMR.
Обработку человеческих тканей проводили в соответствии с рекомендацией местного Комитета по этике Университетского госпиталя Лунда.
Анализ деполяризации митохондриальной мембраны
Деполяризацию митохондриальной мембраны анализировали, как предварительно описано (Kim et al., Mol Biol Cell 2004; 15:420-34). Вкратце, обработанные антителами клетки смешивали с реагентом JC-1 (Molecular Probes) при 5 мкг/мл и инкубировали в течение 30 минут при комнатной температуре. Клетки отмывали дважды в охлажденном льдом ФБР и ресуспендировали в 300 мкл ФБР и анализировали на FACS Aria (BD Biosciences). Зеленую и красную флуоресценцию анализировали с использованием пропускающих фильтров 494/518 нм (FL-1) и 595/615 нм (FL-2) соответственно.
ICAM-1 является гликопротеином суперсемейства иммуноглобулинов (Marlin et al., Cell 1987; 51:813-9), способным индуцировать двунаправленный сигналлинг (Rothlein et al., J Immunol 1994; 152:2488-95; Vyth-Dreese et al., Blood 1995; 85:2802-12). Ранее не было показано, что ICAM-1 вовлечен в программируемую гибель клеток В-лимфомы.
Таким образом, мы хотели подтвердить, что индуцированная IgG В11 клеточная гибель была активным процессом, посредством событий иных, чем транслокация фосфатидил-серина через клеточную мембрану.
Деполяризация митохондриальной мембраны была выбрана для подтверждения апоптоза, поскольку она является общей чертой каспазо-зависимого и каспазо-независимого апоптоза, который можно регистрировать путем окрашивания клеток с 5,5',6,6'-тетрахлоро-1,1',3,3'-тетраэтилбензимидазолил-карбоцианин иодидом (реагентом JC-1).
В соответствии с нашим Аннексии V/пропидиум-иодидным анализом (Фиг.4А, верхняя панель), IgG B11 индуцировал деполяризацию митохондриальной мембраны в клетках CL-01 В-лимфомы, как было определено анализом проточной цитометрией после окрашивания JC-1 реагентом (Фиг.4А, нижняя панель).
Для того чтобы исключить возможность того, что экспрессия ICAM-1 была in vitro артефактом, возникшим в результате общей позитивной регуляции при культивировании клеток, мы оценивали связывание IgG B11 с тканями, полученными от пяти различных пациентов с различными видами В-лимфомы.
При иммуногистохимии IgG B11 показал сильное связывание с пятью тканями лимфомы (Фиг.4В), при интенсивности, сопоставимой или слегка более низкой, чем анти-HLA-DR/DP антитело IgG B1 (Таблица 2).
Далее мы оценивали связывание IgG B11 с В-лимфомой по сравнению с покоящимися лейкоцитами периферической крови. Ramos были выбраны как представители клеточной линии В-лимфомы на основании их низкоуровневой экспрессии эпитопа при значительной интенсивности В11-индуцированного апоптоза. Анализ методом проточной цитометрии после смешанной инкубации предварительно меченых клеток Ramos с лейкоцитами цельной периферической крови IgG B1, B11 или С11 антител выявил, что IgG В11 показывает сильное связывание с клетками Ramos.
Что даже более важно, В11 демонстрировал наибольшее дифференциальное связывание (наиболее сильная позитивная регуляция антигена) из трех антител к клеткам В-лимфомы Ramos по сравнению с нормальными лейкоцитами периферической крови (Фиг.4С и не приведенные данные). IgG В11 связывание достигало пика уже при 0,1 мкг/мл и было 3,7-кратно позитивно-регулируемым на клетках Ramos по сравнению с моноцитами (MFI 654 против 176), 8,3-кратно позитивно регулируемым на клетках Ramos по сравнению с В-лимфоцитами периферической крови (MFI 654 против 78), и 23-кратно позитивно регулируемым по сравнению с NK-клетками. Связывание с другими исследуемыми субпопуляциями лейкоцитов периферической крови было отрицательным.

Пример 5 - Распределение антигенов B1, В11, C11 IgG1 в опухолевых клеточных линиях различного происхождения по данным проточной цитометрии
Исследовали распределение антигенов - мишеней человеческих антител, главным образом для B11, на различных клеточных линиях карциномы. Клетки (MCF-7 и MDA MB 435S карцинома молочной железы, JAR и JEG-3 хориокарцинома, А549 карцинома легких, TCC-SUP карцинома мочевого пузыря, MDA MB 435 меланома, НРАС, PANC-1 и ВхРС-3 карцинома поджелудочной железы, РС-3 и DU145 карцинома простаты, LS174 Т, СаСо2, и Lovo карцинома рака прямой кишки, и ТНР-1 клетки моноцитарной лейкемии), отмывали в ФБР и ресуспендировали до 4×106 клеток/мл в Полной среде (200000 клеток/50 мкл образца). Готовили 3-10-кратные серийные разведения B1 IgG1, B11 IgG1, С11 IgG1, отрицательного контроля ФИТЦ-8 IgG1, и Ритуксимаба анти-CD20 моноклональных антител (10-0,1 пкг/мл) в Полной среде (50 мкл на образец). Клетки инкубировали с какими-либо антителами в течение 1 часа на льду, отмывали ресуспендированием в ФБР/БСА 0,5%, центрифугировали при 1200 об/мин в течение 15 минут, и проводили полную аспирацию надосадочной жидкости. Клетки инкубировали с ПЭ-конъюгированными козьими F(ab')2 анти-человеческими IgG (Caltag Laboratories, Кат. № Н10104), разбавленными 1/50 в ФБР/БСА 0,5%, в течение 30 минут на льду. После ресуспендирования в 300 мкл ФБР/БСА 0,5%, клетки анализировали на связывание IgG с помощью прибора FACScan.
PC-3 клетки карциномы предстательной железы показали самую сильную экспрессию ICAM-1, как было продемонстрировано наиболее сильным связыванием B11 IgG с этими клетками (Фиг.6). Клетки карциномы молочной железы MCF-7, карциномы поджелудочной железы НРАС и карциномы прямой кишки LS1 74 Т также экспрессировали ICAM-1, хотя и с более низкой интенсивностью, по сравнению с клетками рака простаты. Напротив, клетки моноцитарной лейкемии ТНР-1 не экспрессировали ICAM-1. Все исходно анализированные клеточные линии карциномы были отрицательными по экспрессии CD20, HLA-DR/DP и IgM, как свидетельствовало отсутствие связывания Ритуксимаба IgG, B1 IgG и С11 IgG, соответственно. Дальнейшие исследования на дополнительных клеточных линиях карциномы показали, что все анализируемые клетки карциномы были положительными по экспрессии ICAM-1 (Таблица 3).
|
Пример 6 - Индукция апоптоза В11 IgG1 в клетках карциномы
В примере 5 было показано, что В11 IgG1 сильно связывается с клетками карциномы. В настоящем примере оцениваются апоптоз-индуцирующие свойства данных антител в отношении клеток карциномы.
Клетки выдерживали в 6-луночных планшетах с Полной ростовой средой в течение трех дней перед началом эксперимента. Клетки были на 50-75% конфлюэнтными ко времени эксперимента. Клетки отмывали охлажденным льдом ФБР и инкубировали с серийными разведениями (20-0,02 мкг/мл, как указано на фигурах, в 1 мл Полной ростовой среды) В11 IgG1, 20 мкг/мл контроля В1 IgG1, 10 мкг/мл отрицательного контроля IgG1 или 10 мкг/мл Трастузумаба IgG1, как указано, при 4°С в течение 1-2 часов. Клетки отмывали охлажденным на льду ФБР и добавляли вторичные F(ab'2) Козьи анти-человеческие F(ab'2) антитела (разбавленные в Полной ростовой среде до 10 мкг/мл). Клетки инкубировали при 37°С, в увлажненной атмосфере с 5% CO2 в течение 16-24 часов. Все клетки собирали первым выделением надосадочной жидкости, с последующим отмыванием ФБР и трипсинизацией оставшихся прилипших клеток. Ферментативную реакцию останавливали ресуспендированием в ФБР, содержащем 10% инактивированной нагреванием эмбриональной телячьей сыворотки. Клетки отмывали в охлажденном на льду ФБР, подвергали окрашиванию Аннексином V/пропидиум-иодидом и анализировали на жизнеспособность/апоптоз, как описано в примере 5 выше.
Было показано, что В11 IgG1 индуцирует апоптоз клеточных линий карциномы специфическим и титруемым образом (Фигура 7). Контроль IgG B1, который не связывался с клетками РС-3 (смотри пример 5), также не индуцировал апоптоз в клетках РС-3. Отрицательный контроль IgG1 или Трастузумаб IgG1 не были способны индуцировать апоптоз в клетках DU145 или MDA MB435.
Пример 7 - Фармацевтические составы и введение
Дальнейший аспект изобретения обеспечивает фармацевтический состав, включающий соединение в соответствии с первым аспектом изобретения в смеси с фармацевтически или ветеринарно приемлемым вспомогательным веществом, разбавителем или носителем.
Предпочтительно, состав представляет собой стандартную дозировочную форму, включающую суточную дозу или стандартную, суточную суб-дозу или ее подходящую долю активного ингредиента.
Соединения изобретения могут обычно применяться пероральным или любым парентеральным способом, в форме фармацевтического состава, включающего активный ингредиент, при необходимости в форме нетоксичной органической или неорганической кислотно- или основно-аддуктивной соли, в фармацевтически приемлемой лекарственной форме. В зависимости от заболевания и пациента, которому назначено лечение, а также способа введения, композиции могут применяться в различных дозах.
При лечении человека, соединения изобретения могут применяться по отдельности, но в общем могут применяться в смеси с подходящим фармацевтическим наполнителем, разбавителем или носителем, выбранным по отношению к назначенному способу введения и стандартной фармацевтической практике.
Например, соединения изобретения могут быть применены перорально, буккально или сублингвально в форме таблеток, капсул, овул, эликсиров, растворов или суспензий, которые могут включать ароматизирующие или красящие агенты, для применения с быстрым, замедленным или контролируемым высвобождением. Соединения изобретения могут также вводиться посредством интракавернозной инъекции.
Такие таблетки могут включать вспомогательные вещества, такие как микрокристаллическая целлюлоза, лактоза, натрия цитрат, кальция карбонат, двузамещенный кальция фосфат и глицин, дезинтегранты, такие как крахмал (предпочтительно кукурузный, картофельный, или крахмал тапиоки), натрия крахмал гликолят, кроскармеллозу натрия и некоторые комплексы силикатов, и связующие агенты для гранулирования, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза (ГПЦ), сахароза, желатин и гуммиарабик. Дополнительно могут быть включены лубриканты, такие как магния стеарат, стеариновая кислота, глицерил-бегенат и тальк.
Твердые композиции сходного типа также могут применяться как наполнители в желатиновых капсулах. Предпочтительные в этом отношении вспомогательные вещества включают лактозу, крахмал, целлюлозу, молочный сахар или полиэтиленгликоли с высокой молекулярной массой. Для водных суспензий или эликсиров соединения изобретения могут быть объединены с различными подсластителями или ароматизирующими агентами, подкрашивающими агентами или красителями, с эмульгирующими и/или суспендирующими агентами и разбавителями, такими как вода, этанол, пропиленгликоль и глицерин, и их комбинациями.
Соединения изобретения также могут применяться парентерально, например, внутривенно, интра-артериально, интраперитонеально, интратекально, интравентрикулярно, интрастернально, интракраниально, внутримышечно или подкожно, или могут применяться инфузионным способом. Наилучшим способом они применяются в форме стерильного водного раствора, который может включать другие вещества, например, достаточное количество солей или глюкозы для обеспечения изотонии раствора с кровью. Водные растворы должны быть забуферены подходящим способом (предпочтительно до рН от 3 до 9), если необходимо. Приготовление подходящих парентеральных составов в стерильных условиях легко достигается стандартными фармацевтическими методиками, хорошо известными специалистам в данной области техники.
Составы, пригодные для парентерального применения, включают водные и неводные стерильные растворы для инъекций, которые могут включать антиоксиданты, буферы, бактериостатики и растворенные вещества, обеспечивающие изотонию состава с кровью реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Составы могут быть представлены в контейнерах для стандартной дозы или множества доз, например, в запаянных ампулах и флаконах, и могут храниться в лиофилизированном состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, немедленно перед применением. Растворы и суспензии для введения, готовящиеся непосредственно перед применением, могут быть приготовлены из стерильных порошков, гранул и таблеток ранее описанного типа.
Для перорального и парентерального применения у пациентов-людей, уровень суточной дозировки соединений изобретения будет обычно составлять от 1 мг/кг до 30 мг/кг. Так, например, таблетки или капсулы из соединения изобретения могут включать дозу активного соединения для приема по отдельности или в двойном и большем объеме за один раз, как необходимо. Врач в каждом случае определяет необходимую дозировку, наиболее подходящую для любого отдельного пациента, и она может изменяться в зависимости от возраста, веса и ответа конкретного пациента. Вышеуказанные дозировки являются примерными для среднего случая. Могут, конечно, быть отдельные случаи, требуются более высокие или низкие диапазоны дозировки, и такие случаи относятся к области данного изобретения.
Соединения изобретения могут также применяться интраназально или посредством ингаляции и удобно выпускаться в форме ингалятора с сухим порошком или аэрозольного спрея, представленного в виде контейнера под давлением, насоса, спрея или распылителя с применением подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134A3 или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA3), диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением, единица дозирования может определяться путем обеспечения клапана для доставки измеренного количества. Контейнер под давлением, насос, спрей или распылитель могут включать раствор или суспензию активного соединения, например, с применением смеси этанола и пропеллента в качестве растворителя, дополнительно включающей лубрикант, например, сорбитан триолеат. Капсулы и картриджи (изготовленные, например, из желатина) для применения в ингаляторе или инсуффляторе могут быть сформированы для включения порошковой смеси соединения изобретения и подходящей порошковой основы, такой как лактоза или крахмал.
Составы в виде аэрозоля или сухого порошка предпочтительно составляются так, что каждая измеренная доза или «вспрыскивание» доставляет надлежащую дозу соединения изобретения пациенту. Важно понять, что в целом общая суточная доза аэрозоля может варьировать от пациента к пациенту и может применяться в виде единичной дозы или, более обычно, в виде разделенных доз в течение дня.
Альтернативно соединения изобретения могут применяться в форме суппозитория или пессария, или могут применяться местно в форме лосьона, раствора, крема, мази или порошка-присыпки. Соединения изобретения могут также применяться трансдермально, например, с применением трансдермального пластыря. Они могут также применяться окулярно, в частности для лечения заболеваний глаза.
Для офтальмологического применения, соединения изобретения могут быть составлены в виде микронизированных суспензий в изотоническом, с отрегулированным рН, стерильном солевом растворе, или, предпочтительно, в виде растворов в изотоническом, с отрегулированным рН, стерильном солевом растворе, по выбору в комбинации с консервантом, таким как хлорид бензалкония. Альтернативно они могут быть составлены в виде мази, такой как петролатум.
Для местного кожного нанесения соединения изобретения могут быть составлены в виде подходящей мази, включающей активное соединение, суспендированное или растворенное, например, в смеси одного или более следующих веществ: минерального масла, жидкого петролатума, белого петролатума, пропиленгликоля, полиоксиэтилен-полиоксипропиленового соединения, эмульгирующего воска и воды. Альтернативно, они могут быть составлены в виде подходящего лосьона или крема, суспендированного или растворенного, например, в смеси одного или более следующих веществ: минерального масла, сорбитан-моностеарата, полиэтиленгликоля, жидкого парафина, полисорбата 60, воска цетилового эфира, цетеарилового спирта, 2-октилдодеканола, бензилового спирта и воды.
Составы, подходящие для местного применения в полости рта, включают таблетки для рассасывания, включающие активный ингредиент на ароматизированной основе, обычно сахарозу и гуммиарабик или трагакант; пастилки, включающие активный ингредиент на инертной основе, такой как желатин и глицерин, или сахароза и гуммиарабик; и полоскание для рта, включающее активный ингредиент в подходящем жидком носителе.
В целом, у человека пероральное или местное применение соединений изобретения является предпочтительным способом, будучи наиболее удобным. При обстоятельствах, когда реципиент страдает расстройствами глотания или нарушением абсорбции лекарства после перорального применения, лекарство может применяться парентерально, например, сублингвально или буккально.
Для ветеринарного применения соединение изобретения применяется в виде подходящего состава в соответствии с нормальной ветеринарной практикой, и ветеринарный врач определяет режим дозирования и способ введения, наиболее подходящие для конкретного животного.