ДВАЖДЫ АЦИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ GLP-1
Вид РИД
Изобретение
Ссылка на родственные заявки
Данная заявка заявляет преимущество предварительной патентной заявки США с серийным номером 61/474913, поданной 13 апреля 2011 года под 37 CFR § 1,53 (с), которая включена в данное описание посредством ссылки во всей ее полноте.
Область изобретения
Изобретение относится к производным аналогов глюкагон-подобного пептида 1 (GLP-1), более конкретно к дважды ацилированным производным GLP-1, ацилированным на К27 и на другом остатке К пептида, и к их фармацевтическому применению.
Включение списка последовательностей посредством ссылки
Список последовательностей, озаглавленный как «Список последовательностей», является 568-байтовым, создан 11 апреля 2012 года и включен в данное описание посредством ссылки.
Уровень техники
Journal of Medicinal Chemistry (2000), vol.43, no.9, p.1664-1669, описывает производные GLP-1 (7-37), в том числе дважды ацилированные.
WO 98/08871 А1 описывает ряд производных GLP-1, включая дважды ацилированные. Лираглутид, моноацилированное производное GLP-1 для введения один раз в сутки, который доступен на рынке с 2009 от Novo Nordisk A/S, также описан в WO 98/08871 А1 (пример 37).
WO 99/43706 А1 описывает ряд моно- и дважды ацилированных производных GLP-1, включая некоторые K27,26 и K27,34-производные.
WO 06/097537 А2 описывает ряд производных GLP-1, включая семаглутид (пример 4), моноацилированное производное GLP-1 для введения один раз в неделю, которое находится у Novo Nordisk A/S в стадии разработки.
Angewandte Chemie International Edition 2008, vol.47, p.3196-3201, сообщает об открытии и описывает класс производных 4-(п-иодфенил)бутановой кислоты, которые предположительно демонстрируют стабильное нековалентное связывание и с мышиным сывороточным альбумином (mouse serum albumin, MSA), и с человеческим сывороточным альбумином (human serum albumin, HSA).
Сущность изобретения
Изобретение относится к производным пептидов GLP-1.
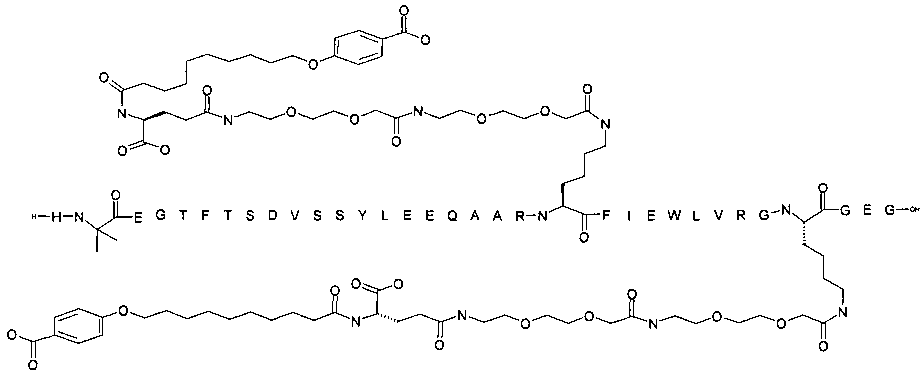
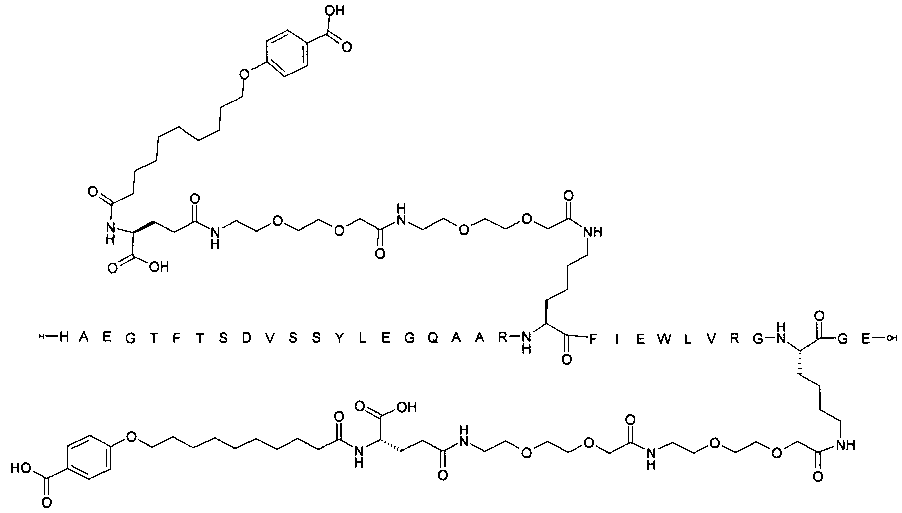
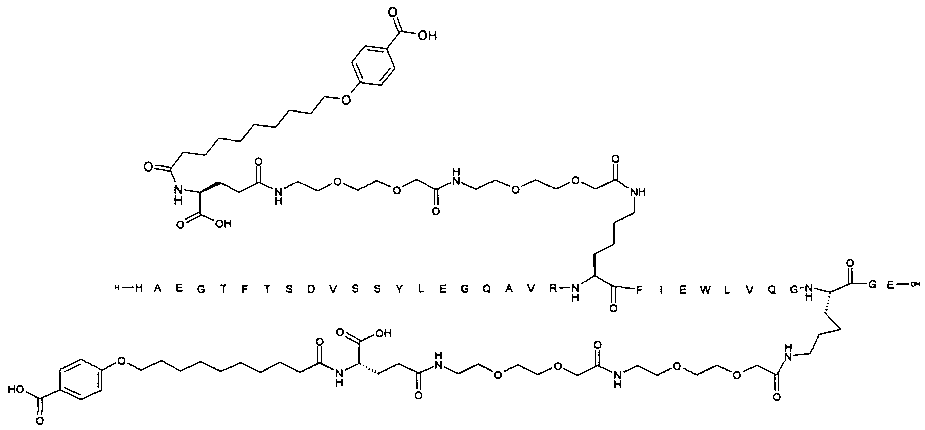
Производные подвергают ацилированию на лизине, заменяя нативную глутаминовую кислоту в позиции 27, а также на другом лизиновом остатке. Боковые цепи являются группировками, связывающими альбумин. Они включают пролонгирующую группировку, предпочтительно выбранную среди жирных двухосновных кислот, и жирные кислоты с дистальной феноксигруппой, все возможно замещенные. Карбоксильная группа жирной кислоты или жирной двухосновной кислоты ацилирована, возможно через линкер, на лизиновом остатке в пептида GLP-1, предпочтительно на эпсилон-аминогруппе.
Пептид GLP-1 может быть аналогом GLP-1 (7-37) (SEQ ID №1), имеющим в общей сложности до десяти аминокислотных различий с GLP-1 (7-37), например одно или более чем одно добавление, одну или более чем одну делецию и/или одно или более чем одно замещение.
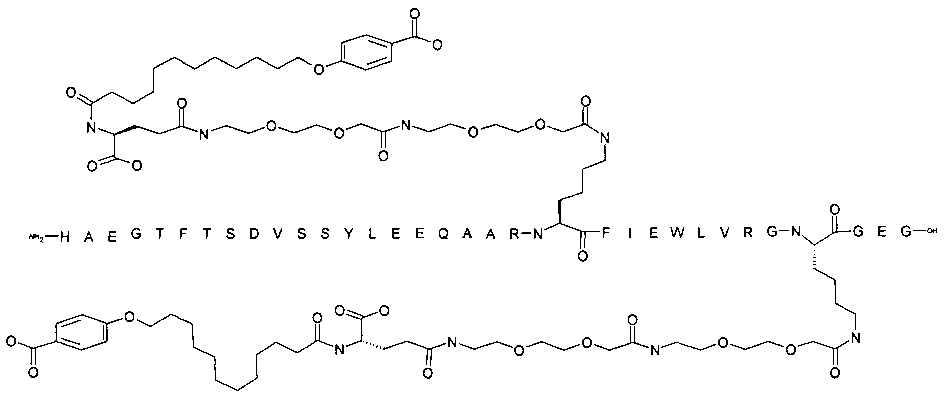
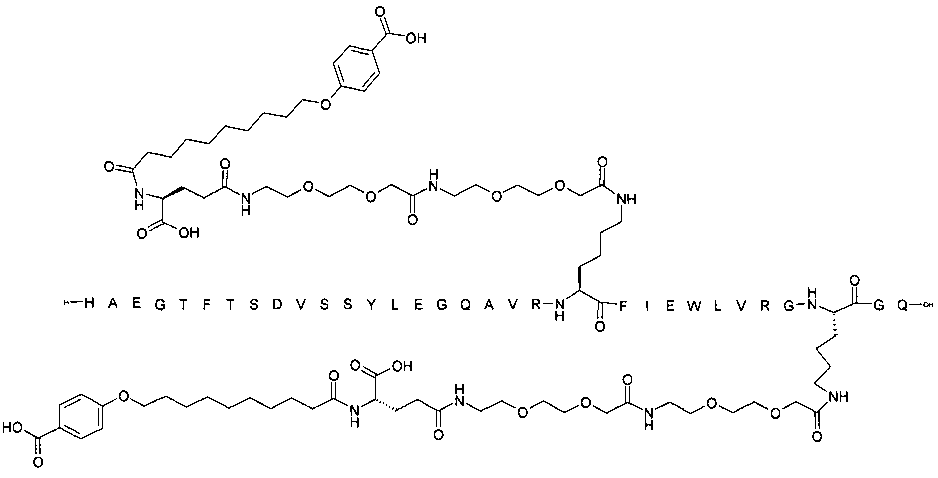
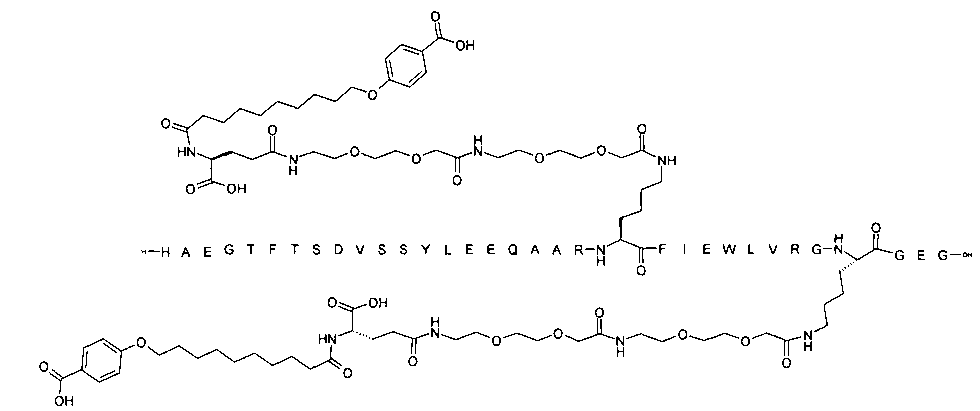
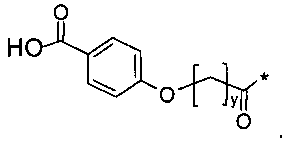
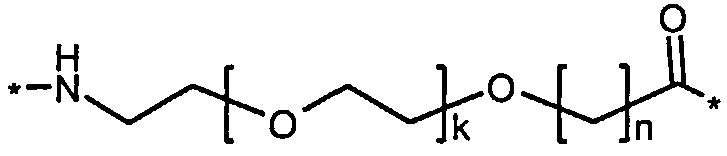
Более конкретно, данное изобретение относится к производному аналога GLP-1, где аналог содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1), второй остаток К в позиции, соответствующей позиции Т в GLP-1 (7-37), где Т представляет собой целое число в диапазоне 7-37 за исключением 18 и 27; а также до десяти аминокислотных замен в сравнении с GLP-1 (7-37); где первый остаток К обозначается как К27, а второй остаток К обозначается как KT; при этом указанное производное содержит две альбуминсвязывающие группировки, прикрепленные к К27 и KT, соответственно, посредством линкера, причем каждая альбуминсвязывающая группировка содержит пролонгирующую группировку, выбранную среди НООС-(СН2)x-СО-* и НООС-С6Н4-O-(СН2)y-СО-*, где x представляет собой целое число в диапазоне 6-16, а y обозначает целое число в диапазоне 3-17 и где линкер содержит линкерный элемент с формулой Соед. 5:
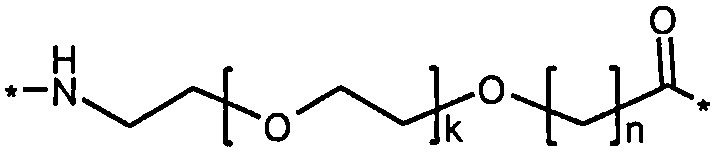 ,
,
где k представляет собой целое число в диапазоне 1-5 и n представляет собой целое число в диапазоне 1-5; или к его фармацевтически приемлемой соли, амиду или сложному эфиру.
Изобретение также относится к таким производным для применения в качестве лекарственного средства, в частности для применения в лечении и/или профилактике всех форм сахарного диабета и связанных с ним заболеваний, таких как пищевые расстройства, сердечно-сосудистые заболевания, желудочно-кишечные заболевания, осложнения диабета, критические заболевания и/или синдром поликистоза яичников, и/или для улучшения липидных параметров, улучшения функции β-клеток, и/или для отсрочки или предотвращения прогрессирования диабетического заболевания.
Кроме того, изобретение относится к промежуточным продуктам в форме новых аналогов GLP-1, которые подходят для изготовления некоторых производных в соответствии с изобретением.
Производные данного изобретения являются биологически активными. Кроме того, или альтернативно, они имеют пролонгированный фармакокинетический профиль. Кроме того, или альтернативно, они устойчивы к разрушению желудочно-кишечными ферментами. Кроме того, или альтернативно, они имеют высокую биодоступность. Эти свойства имеют большое значение в разработке следующего поколения соединений GLP-1 для подкожного, внутривенного и/или, в частности, перорального введения.
Подробное описание
Далее греческие буквы могут быть представлены их символами или соответствующими письменными названиями, например: α = альфа; β = бета; ε = эпсилон; γ = гамма; ω = омега и т.д. Кроме того, греческая буква µ может быть представлена как «u», например µl=ul, или µМ=uM
Звездочка (*) в химической формуле обозначает i) точку присоединения, ii) радикал и/или iii) неподеленный электрон.
В первом аспекте данное изобретение относится к производным аналога GLP-1, где аналог содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1); второй остаток К в позиции, соответствующей позиции Т в GLP-1 (7-37), где Т представляет собой целое число в диапазоне 7-37, за исключением 18 и 27; а также до десяти аминокислотных замен по сравнению с GLP-1 (7-37), где первый остаток К обозначается как К27, а второй остаток К обозначается как KT; где производное содержит две альбуминсвязывающие группировки, прикрепленные к К27 и KT, соответственно, через линкер, при этом альбуминсвязывающие группировки содержат пролонгирующие группировки, выбранные среди Соед. 1 и Соед. 2:
Соед. 1: НООС-(СН2)x-СО-*
Соед. 2: НООС-С6Н4-О-(СН2)y-СО-*
где x представляет собой целое число в диапазоне 6-16, y обозначает целое число в диапазоне 3-17, а линкер содержит Соед. 5:
Соед. 5:
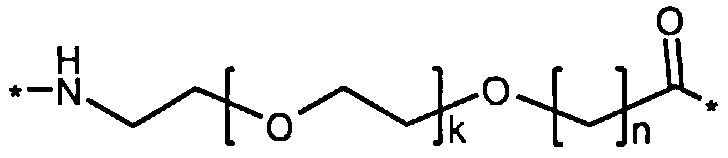
где k обозначает целое число в диапазоне 1-5, а n представляет собой целое число в диапазоне 1-5; или к их фармацевтически приемлемой соли, амиду или сложному эфиру.
Аналоги GLP-1
Термин «GLP-1-аналог» или «аналог GLP-1», используемый в данном документе, относится к пептиду, или соединению, представляющему собой вариант человеческого глюкагон-подобного пептида-1 (GLP-1 (7-37)), последовательность которого включена в список последовательностей как SEQ ID №1. Пептид с последовательностью SEQ ID №1 также может быть обозначен как «нативный GLP-1».
В списке последовательностей первому аминокислотному остатку SEQ ID №1 (гистидину) присваивается №1. Тем не менее, в дальнейшем - в соответствии с установившейся практикой в данной области - это остаток гистидина называют №7, и последующие аминокислотные остатки пронумерованы соответственно, заканчивая глицином №37. Поэтому, как правило, в данном документе любая ссылка на номер аминокислотного остатка или номер позиции в последовательности GLP-1 (7-37) является ссылкой на последовательность, начинающуюся с His в позиции 7 и заканчивающуюся Gly в позиции 37.
GLP-1-аналоги производных изобретения могут быть описаны посредством ссылки на i) номер аминокислотного остатка в нативном GLP-1 (7-37), который соответствует аминокислотному остатку, который был заменен (например, соответствующей позиции в нативном GLP-1), и на ii) фактическую замену. Ниже приведены неограничивающие примеры подходящей номенклатуры аналогов.
Неограничивающий пример GLP-1-аналога производного изобретения является аналогом, который изменен таким образом, что содержит первый остаток лизина в позиции, соответствующей позиции 27 GLP-1 (7-37), и второй остаток лизина в позиции 12. Аминокислотная последовательность этого аналога в остальном идентична нативному GLP-1, и этот аналог может быть обозначен как K12,K27-GLP-1 (7-37). Это обозначение представляет аминокислотную последовательность нативного GLP-1, где фенилаланин в позиции 12 был заменен на лизин, и глутамин в позиции 27 был заменен на лизин.
GLP-1-аналог, образующий часть производного в соответствии с изобретением, содержит до десяти аминокислотных замен по сравнению с нативным GLP-1 (7-37) (SEQ ID №1). Другими словами, это пептид GLP-1 (7-37), в котором ряд аминокислотных остатков был изменен по сравнению с нативным GLP-1 (7-37) (SEQ ID №1). Эти изменения могут представлять собой, независимо друг от друга, одно или более чем одно аминокислотное замещение, добавление и/или делецию.
Далее следуют неограничивающие примеры номенклатуры соответствующих аналогов.
Например, аналог [Aib8,Lys22,Val25,Arg26,Lys27,His31,Arg34]-GLP-1-(7-37) обозначает пептид GLP-1 (7-37), который по сравнению с нативным GLP-1 имеет следующие замены: замена аланина в позиции 8 на Aib (α-аминоизомасляную кислоту), глицина в позиции 22 на лизин, аланин в позиции 25 на валин, лизина в позиции 26 на аргинин, глутаминовой кислоты в позиции 27 на лизин, триптофана в позиции 31 на гистидин и лизина в позиции 34 на аргинин. Этот аналог может быть кратко обозначен как (8Aib, 22K, 25V, 26R, 27К, 31Н, 34R).
В качестве другого примера, аналог [Aib8,Lys20,Glu22,Arg26,Lys27,Glu30,Gly34]-GLP-1-(7-34) обозначается как пептид GLP-1 (7-37), который в сравнении с нативным GLP-1 изменена путем замены аланина в позиции 8 на Aib, замены лейцина в позиции 20 на лизин, замены глицина в позиции 22 на глутаминовую кислоту, замены лизина в позиции 26 на аргинин, замены глутаминовой кислоты в позиции 27 на лизин, замены аланина в позиции 30 на глутаминовую кислоту, замены лизина в позиции 34 на глицин, и путем делеции С-конца глицин-аргинин-глицина в позиции 35-36-37. Этот аналог может быть кратко обозначен как (8Aib, 20К, 22Е, 26R, 27К, 30Е, 34G, des35-37), где предполагается ссылка на GLP-1 (7-37), a «des» обозначает делецию.
В качестве еще одного примера, аналог, содержащий Glu38 и Gly39, относится к пептиду GLP-1 (7-37), который при сравнении с нативным GLP-1 содержит добавление дипептида (глутаминовая кислота-глицин) на С-конце GLP-1 (7-37). Можно также кратко сказать, что этот аналог содержит (38Е, 39G), где подразумевается ссылка на GLP-1 (7-37).
Аналоги, «содержащие» определенные указанные изменения, могут содержать дополнительные изменения по сравнению с SEQ ID №1. Одним из неограничивающих примеров аналога, содержащего (38Е, 39G), является пептидная часть Соед. 51.
Как видно из приведенных выше примеров, аминокислотные остатки могут быть идентифицированы по их полному имени, их однобуквенному коду и/или их трехбуквенному коду. Эти три способа полностью эквивалентны.
Выражения «позиция, эквивалентная чему-либо» или «соответствующая позиция» могут быть использованы для описания места введения замены в последовательность вариантного GLP-1 (7-37) со ссылкой на нативный GLP-1 (7-37) (SEQ ID №1). Эквивалентные или соответствующие позиции, а также ряд замен можно легко вывести, например, путем простой рукописной записи и визуального контроля; и/или можно использовать стандартную программу для выравнивания белков или пептидов, такую как «align», которая является выравниванием по Нидлману-Вуншу. Алгоритм описан в Needleman, S.B. and Wunsch, C.D., (1970), Journal of Molecular Biology, 48: 443-453, и программа для выравнивания описана в Myers and W. Miller "Optimal Alignments in Linear Space" CABIOS (computer applications in the biosciences) (1988) 4: 11-17. Для выравнивания могут быть использованы по умолчанию матрица весов выравнивания BLOSUM50 и матрица идентичности, и штраф на первый остаток в делеции может быть установлен на -12, или предпочтительно на -10, а штраф на дополнительные остатки в делеции на -2, или предпочтительно на -0,5.
Пример такого выравнивания приведен ниже, где последовательность №1 (SEQ_ID_NO_1) представляет собой SEQ ID №1, а последовательность №2 (АНАЛОГ) представляет собой ее аналог (22К, 26R, 27К, 30Е, 34G, des35-37).
# Выровненные последовательности: 2
# 1: SEQ_ID_NO_1
# 2: АНАЛОГ
# Матрица: EBLOSUM62
# Штраф на введение делеции: 10,0
# Штраф на удлинение делеции: 0,5
# Длина: 31
# Идентичность: 23/31 (74,2%)
# Сходство: 25/31 (80,6%)
# Делеции: 3/31 (9,7%)
# Оценка: 117,0
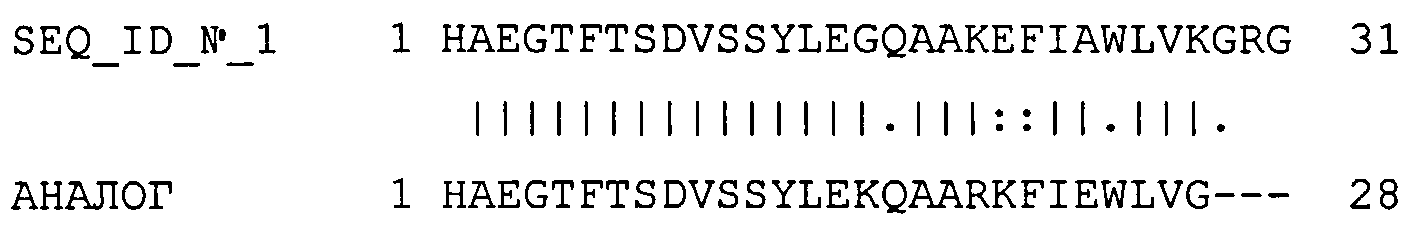
В случае неприродных аминокислот, таких как Aib, включенных в последовательность, они с целью выравнивания могут быть заменены на X. При необходимости Х в дальнейшем может быть исправлен вручную.
Термин «пептид», например, используемый в контексте GLP-1-аналогов производных изобретения, относится к соединению, которое содержит ряд аминокислот, связанных с помощью амидных (или пептидных) связей.
Пептиды изобретения содержат по меньшей мере пять конститутивных аминокислот, соединенных пептидными связями. В конкретных воплощениях пептид включает по меньшей мере 10, предпочтительно по меньшей мере 15, более предпочтительно по меньшей мере 20, более предпочтительно по меньшей мере 25, или наиболее предпочтительно по меньшей мере 28 аминокислот.
В конкретном воплощении пептид состоит по меньшей мере из пяти конститутивных аминокислот, предпочтительно состоит по меньшей мере из 10, по меньшей мере из 15, по меньшей мере из 20, по меньшей мере 25, или наиболее предпочтительно состоит по меньшей мере из 28 аминокислот.
В дополнительном конкретном воплощении пептид а) состоит из или б) содержит i) 28, ii) 29, iii) 30, iv) 31, v) 32 или vi) 33 аминокислоты.
В еще одном конкретном воплощении пептид состоит из аминокислот, соединенных пептидными связями.
Аминокислоты представляют собой молекулы, содержащие аминогруппу и карбоксильную группу и, возможно, одну или более чем одну дополнительную группу, которые часто называют боковыми цепями.
Термин «аминокислота» включает протеогенные аминокислоты (кодируемые генетическим кодом, в том числе природные аминокислоты и стандартные аминокислоты), а также непротеогенные (не найденные в белках и/или не закодированные стандартным генетическим кодом) и синтетические аминокислоты. Таким образом, аминокислоты могут быть выбраны из группы протеиногенных аминокислот, непротеиногенных аминокислот и/или синтетических аминокислот.
Неограничивающими примерами аминокислот, которые не кодируются генетическим кодом, являются гамма-карбоксиглутаминовая кислота, орнитин и фосфосерин. Неограничивающими примерами синтетических аминокислот являются D-изомеры аминокислот, такие как D-аланин и D-лейцин, Aib (α-аминоизомасляная кислота), β-аланин и дезаминогистидин (desH, альтернативное название имидазолпропионовой кислоты, сокращенно Imp).
В дальнейшем все аминокислоты, для которых не указан оптический изомер, будут пониматься как L-изомеры (если не указано иное).
GLP-1-производные и аналоги изобретения обладают GLP-1-активностью. Этот термин относится к способности связываться с GLP-1-рецептором и инициировать путь передачи сигнала, приводящий к инсулинотропному действию или другим физиологическим эффектам, известным в данной области. Например, аналоги и производные изобретения могут быть проверены на GLP-1-активность путем анализа, описанного в примере 33 данного документа. Анализ рецепторного связывания GLP-1, описанный в примере 34, также может быть использован для определения активности GLP-1 (эксперимент с низким HSA).
GLP-1-производные
Термин «производное», используемый в данном документе в связи с GLP-1-пептидом или аналогом, означает химически модифицированный GLP-1-пептид или аналог, в котором один или более чем один заместитель был ковалентно присоединен к пептиду. Заместители могут быть отнесены к боковой цепи.
В конкретном воплощении боковая цепь способна образовывать нековалентные агрегаты с альбумином, что способствует циркуляции производных с током крови, а также обеспечивает эффект увеличения времени действия производного в связи с тем фактом, что агрегат GLP-1-производного и альбумина медленно распадается, высвобождая активный фармацевтический ингредиент. Таким образом, заместитель, или боковая цепь, в целом предпочтительно относится к альбуминсвязывающей группировке.
В другом конкретном воплощении альбуминсвязывающая группировка содержит часть, которая особенно подходит для связывания альбумина и, следовательно, для пролонгирования, и может быть названа пролонгирующей группировкой. Пролонгирующая группировка может находиться на противоположном конце альбуминсвязывающей группировки по отношению к точке его прикрепления к пептиду или вблизи этого конца.
В еще одном конкретном воплощении альбуминсвязывающая группировка включает часть между пролонгирующей группировкой и точкой прикрепления к пептиду, которая может быть названа линкером, линкерной группировкой, спейсером и т.д. Линкер может быть необязательным, и, следовательно, в этом случае альбуминсвязывающая группировка может быть идентична пролонгирующей группировке.
В конкретных воплощениях альбуминсвязывающая группировка и/или пролонгирующая группировка является липофильной и/или отрицательно заряженной при физиологическом значении рН (7,4).
Альбуминсвязывающая группировка, пролонгирующая группировка или линкер могут быть ковалентно присоединены к остатку лизина пептида GLP-1 путем ацилирования.
В предпочтительном воплощении активный эфир альбуминсвязывающей группировки, предпочтительно включающий пролонгирующую группировку и линкер, ковалентно связан с аминогруппой остатка лизина, предпочтительно с его эпсилон-аминогруппой, с образованием амидной связи (это процесс называется ацилированием).
Если не указано иное, то когда дается ссылка на ацилирование остатка лизина, следует понимать, что оно происходит на эпсилон-аминогруппе.
Производное, содержащее две пролонгирующие группировки, присоединенные к первому и второму остаткам К (т.е. к К27 и KT) через линкер, может быть названо производным, ацилированным дважды, дважды ацилированным или производным с двойным ацилированием на эпсилон-аминогруппах первого и второго остатков лизина, например в позициях, соответствующих позициям 27 и Т, соответственно, пептида GLP-1.
Для данных целей термины «альбуминсвязывающая группировка», «пролонгирующая группировка» и «линкер» могут включать непрореагировавшие, а также прореагировавшие формы этих молекул. Либо имеется в виду ни одна из этих форм или другая форма, что становится ясно из контекста, в котором этот термин используется.
В одном аспекте каждая пролонгирующая группировка включает или состоит из пролонгирующей группировки, независимо выбранной среди Соед. 1 и Соед. 2:
Соед. 1: НООС-(СН2)x-СО-*
Соед. 2: НООС-С6Н4-O-(СН2)y-СО-*
где x является целым числом в диапазоне 6-16, а y является целым числом в диапазоне 3-17.
В одном воплощении *-(СН2)x-* относится к прямому или разветвленному, предпочтительно прямому, алкилену, где x является целым числом в диапазоне 6-16.
В другом воплощении *-(CH2)y-* относится к прямому или разветвленному, предпочтительно прямому, алкилену, где y является целым числом в диапазоне 3-17.
Термин «жирная кислота» относится к алифатическим одноосновным кислотам, имеющим от 4 до 28 атомов углерода, предпочтительно неразветвленным, и/или имеющим четное число атомов, которые могут быть насыщенными или ненасыщенными.
Термин «двухосновная жирная кислота» относится к жирным кислотам, описанным выше, но с дополнительной карбоксильной группой в позиции омега. Таким образом, двухосновные жирные кислоты являются дикарбоновыми кислотами.
Номенклатура является такой, которая обычно используется в данной области, например, в приведенных выше формулах *-СООН, а также НООС-* относится карбокси; *-С6Н4-* к фенилену; *-СО-*, а также *-ОС-* к карбонилу (O=С<**); С6Н5-O-* к фенокси. В конкретных воплощениях ароматические структуры, такие как фенокси- и фенилен-радикалы, могут находиться, независимо друг от друга, в орто-, мета- или пара-положении.
Как указывалось выше, GLP-1-производные данного изобретения являются дважды ацилированными, т.е. две альбуминсвязывающие группировки ковалентно прикреплены к GLP-1-пептиду.
В конкретном воплощении две альбуминсвязывающие группировки (т.е. целые боковые цепи) являются подобными, предпочтительно в значительной степени идентичными или, наиболее предпочтительно, идентичными.
В другом конкретном воплощении две пролонгирующие группировки являются подобными, предпочтительно в значительной степени идентичными или, наиболее предпочтительно, идентичными.
В еще одном конкретном воплощении два линкера являются подобными, предпочтительно в значительной степени идентичными или, наиболее предпочтительно, идентичными.
Термин «в значительной степени идентичны» включает отличия в идентичности, которые связаны с формированием одной или более чем одной соли, сложного эфира и/или амида; предпочтительно с формированием одной или более чем одной соли, метилового эфира и простого амида; более предпочтительно с формированием не более двух солей, метиловых эфиров и/или простых амидов; еще более предпочтительно с формированием не более одной соли, метилового эфира и/или простого амида; или наиболее предпочтительно с формированием не более чем одной соли.
В контексте химических соединений, таких как альбуминсвязывающие группировки, пролонгирующие группировки и линкеры, сходство и/или идентичность можно определить с помощью любой подходящей компьютерной программы и/или алгоритма, известного в данной области.
Например, сходство двух пролонгирующих группировок, двух линкеров и/или двух целых боковых цепей может соответственно быть определено с помощью методики «молекулярных отпечатков пальцев». Методика молекулярных отпечатков представляет собой математический способ представления химической структуры (см., например Cheminformatics: A textbook, Johann Gasteiger and Thomas Engel (Eds), Wiley-VCH Verlag, 2003).
Примеры подходящих отпечатков включают, но не ограничиваясь ими, отпечатки UNITY, отпечатки MDL и/или отпечатки ECFP, такие как отпечатки ECFP_6 (ECFP означает методику отпечатков с расширенной способностью к взаимодействию).
В конкретном воплощении две пролонгирующие группировки, два линкера и/или две целые боковые цепи представлены в виде а) отпечатков ECFP_6, b) отпечатков UNITY; и/или с) отпечатков MDL.
Для вычисления сходства двух отпечатков, будь то а), b) или с), предпочтительно используют коэффициент Танимото.
В конкретном воплощении, используется ли а), b) или с), две пролонгирующие группировки, два линкера и/или две целые боковые цепи, соответственно, имеют сходство по меньшей мере 0,5 (50%); предпочтительно по меньшей мере 0,6 (60%); более предпочтительно по меньшей мере 0,7 (70%) или по меньшей мере 0,8 (80%); еще более предпочтительно по меньшей мере 0,9 (90%); или наиболее предпочтительно по меньшей мере 0,99 (99%), например, сходство 1,0 (100%).
Отпечатки UNITY могут быть рассчитаны с помощью программы SYBYL (доступна от Tripos, 1699 South Hanley Road, St. Louis, МО 63144-2319 USA). Отпечатки ECFP_6 и MDL могут быть рассчитаны с использованием программы Pipeline Pilot (доступной от Accelrys Inc., 10188 Telesis Court, Suite 100, San Diego, CA 92121, USA).
Для получения дополнительной информации, см., например, J. Chem. Inf. Model. 2008, 48, 542-549; J. Chem. Inf. Comput. Sci. 2004, 44, 170-178; J. Med. Chem. 2004, 47, 2743-2749; J. Chem. Inf. Model. 2010, 50, 742-754, а также SciTegic Pipeline Pilot Chemistry Collection: Basic Chemistry User Guide, March 2008, SciTegic Pipeline Pilot Data Modeling Collection, 2008 - оба от Accelrys Software Inc., San Diego, US, и руководства http://www.tripos.com/tripos_resources/fileroot/pdfs/Unity_111408.pdf и http://www.tripos.com/data/SYBYL/SYBYL_072505.pdf.
Пример подсчета сходства приведен ниже, где целая боковая цепь Соед. 66 была сравнена с ее метиловым эфиром, а именно монометилэфиром глутаминовой линкерной группировки (Соед. 66а):
Соед. 66а:
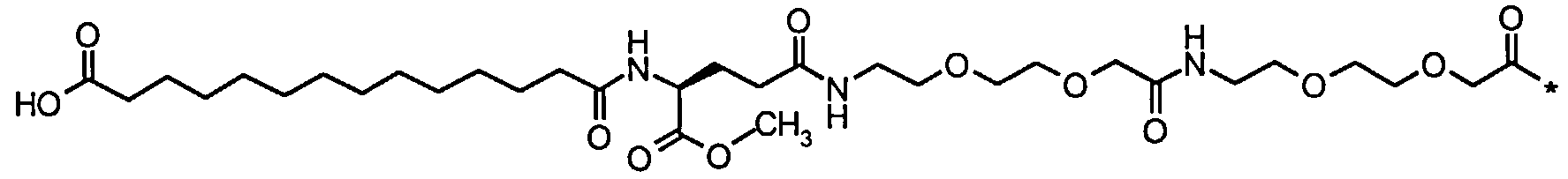
С использованием а) отпечатков ECFP_6 сходство составляло 0,798, с использованием б) отпечатков UNITY сходство составляло 0,957, и с использованием отпечатков MDL сходство составляло 0,905.
В случае двух одинаковых боковых цепей (альбуминсвязывающих группировок) производные могут быть обозначены симметрично.
В конкретных воплощениях коэффициент сходства составлял по меньшей мере 0,80, предпочтительно по меньшей мере 0,85, более предпочтительно по меньшей мере 0,90, более предпочтительно по меньшей мере 0,95 или, наиболее предпочтительно, по меньшей мере 0,99.
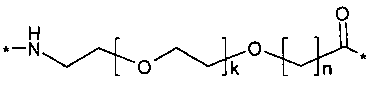
Каждый из двух линкеров производного изобретения может включать следующий первый линкерный элемент:
Соед. 5:
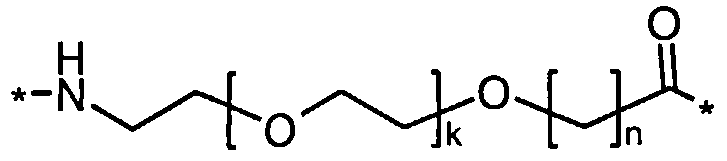
где k является целым числом в диапазоне 1-5 и n является целым числом в диапазоне 1-5.
В конкретном воплощении, когда k=1 и n=1, этот линкерный элемент может быть обозначен как OEG, или двойной радикал 8-амино-3,6-диоксаоктановой кислоты, и/или он может быть представлен следующей формулой:
Соед. 5а:
*-NH-(СН2)2-O-(СН2)2-O-СН2-СО-*.
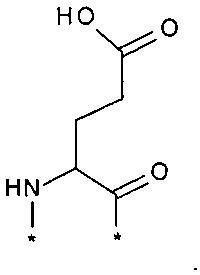
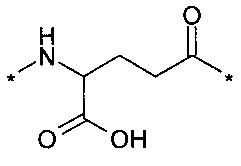
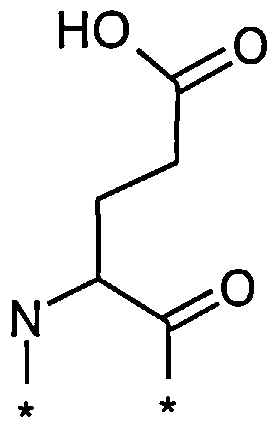
В другом конкретном воплощении каждый линкер производного изобретения может независимо включать второй линкерный элемент, предпочтительно двойной радикал Glu, такой как Соед. 6 и/или Соед. 7:
Соед. 6:
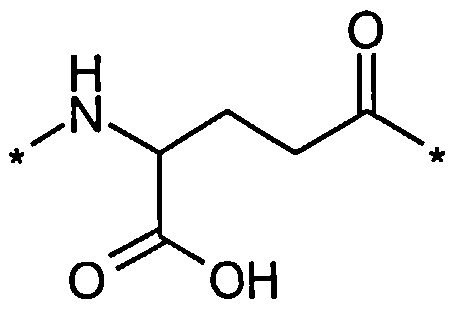
Соед. 7:
 ,
,
где двойной радикал Glu может быть включен p раз, где p является целым числом в диапазоне 1-2.
Соед. 6 может также относиться к гамма-Glu, или, сокращенно, gGlu, в связи с тем, что это гамма-карбоксильная группа аминокислоты глутаминовой кислоты, которая может использоваться здесь для соединения с другим линкерным элементом, или может относиться к эпсилон-аминогруппе лизина. Как объяснялось выше, другой линкерный элемент может, например, быть другим остатком Glu, или OEG-молекулой. Аминогруппа Glu, в свою очередь, может формировать амидную связь с карбоксильной группой пролонгирующей группировки, или с карбоксильной группой, например, OEG-молекулы, если она присутствует, или с гамма-карбоксильной группой, например, другого Glu, если он присутствует.
Соед. 7 может также относиться к альфа-Glu, или, сокращенно, aGlu, или просто Glu, в связи с тем, что это альфа-карбоксильная группа аминокислоты глутаминовой кислоты, которая может использоваться здесь для связывания с другим линкерным элементом или эпсилон-аминогруппой лизина.
Приведенные выше структуры Соед. 6 и Соед. 7 покрывают L-форму, а также D-форму Glu.
Производные изобретения могут существовать в различных стереоизомерных формах с одной и той же молекулярной формулой и последовательностью связанных атомов, но отличающихся только в трехмерной ориентации их атомов в пространстве. Стереоизомерия типичных производных изобретения указана в экспериментальной части, в названиях, а также в структурах с помощью стандартной номенклатуры. Если не указано иное, изобретение относится ко всем стереоизомерным формам заявленного производного.
Концентрация в плазме производных GLP-1 изобретения может быть установлена с помощью любого подходящего способа. Например, может быть использована LC-MS (жидкостная хроматография/масс-спектрометрия) или иммунологические анализы, такие как RIA (радиоиммуноанализ), ELISA (иммуноферментный сорбционный анализ) и LOCI (иммунологический анализ люминесценции кислородных каналов). Общие протоколы подходящих анализов RIA и ELISA можно найти, например, в WO 09/030738 на стр.116-118. Предпочтительным анализом является анализ LOCI, описанный в примерах 35, 39 и 40 данного документа.
Фармацевтически приемлемая соль, амид или эфир
Производные и промежуточные продукты изобретения могут находиться в форме фармацевтически приемлемой соли, амида или эфира.
Соли, например, образуются в результате химической реакции между основанием и кислотой, например: 2NH3+H2SO4→(NH4)2SO4.
Соль может быть основной солью, кислой солью, либо она может быть ни той, ни другой (т.е. нейтральной солью). Основные соли дают гидроксид-ионы в воде, а кислые соли дают ионы гидроксония.
Соли производных изобретения могут быть образованы с добавленными катионами или анионами, которые реагируют с анионными или катионными группами, соответственно. Эти группы могут быть расположены в пептидной группировке и/или в боковой цепи производных изобретения.
Неограничивающие примеры анионных групп производных изобретения включают свободные карбоксильные группы в боковой цепи, если таковые имеются, а также в пептидной группировке. Пептидная группировка часто включает свободную карбоксильную группу на С-конце, и также она может включать свободные карбоксильные группы на внутренних аминокислотных остатках, таких как Asp и Glu.
Неограничивающие примеры катионных групп в пептидной группировке включают свободную аминогруппу на N-конце, если она присутствует, а также любую свободную аминогруппу внутренних основных аминокислотных остатков, таких как His, Arg и Lys.
Эфир производных изобретения может быть сформирован, например, в результате реакции свободной карбоксильной группы со спиртом или фенолом, что приводит к замене по меньшей мере одной гидроксильной группы на алкокси- или арилокси-группу.
В образование эфира может быть вовлечена свободная карбоксильная группа на С-конце пептида и/или любая свободная карбоксильная группа в боковой цепи.
Амид производных изобретения может быть сформирован, например, в результате реакции свободной карбоксильной группы с амином или замещенным амином, или в результате реакции свободной или замещенной аминогруппы с карбоновой кислотой.
В образование амида может быть вовлечена свободная карбоксильная группа на С-конце пептида и/или любая свободная карбоксильная группа в боковой цепи, свободная аминогруппа на N-конце пептида и/или свободная или замещенная аминогруппа пептида в пептиде и/или боковой цепи.
В конкретном воплощении пептид или производное находится в форме фармацевтически приемлемой соли. В другом конкретном воплощении производное находится в форме фармацевтически приемлемого амида, предпочтительно с амидной группой на С-конце пептида. В еще одном конкретном воплощении пептид или производное находится в форме фармацевтически приемлемого эфира.
Промежуточные продукты
Во втором аспекте изобретение относится к промежуточным продуктам.
Один тип промежуточного продукта изобретения имеет форму GLP-1-аналога, который включает следующие модификации по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 38Q; и/или (ii) 39G; или его фармацевтически приемлемой соли, амида или сложного эфира.
Другой промежуточный продукт изобретения в форме аналога GLP-1 представляет собой аналог, включающий, предпочтительно имеющий, следующие аминокислотные замены по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 22E, 26R, 27К, 34R, 37К; (ii) 22E, 26R, 27K, 30Е, 34R, 36K, 38E, 39G; (iii) 22E, 26R, 27K, 34R, 36K, des37; (iv) 22E, 25V, 26R, 27K, 34R, 37К; (v) 8Aib, 20K, 22E, 26R, 27K, 30Е, 34G, des35-37; (vi) 26R, 27K, 30Е, 34R, 36K, 38E; (vii) 8Aib, 22K, 25V, 26R, 27K, 31H, 34R; (iix) 8Aib, 22K, 25V, 26R, 27K, 34R, des35-37; (ix) 8Aib, 22K, 25V, 26R, 27K, 34R, des36-37; (x) 26H, 27K, 30Е, 34R, 36K, 38E; (xi) 22K, 25V, 26R, 27K, 30Е, 34Q; (xii) 25V, 26R, 27K, 30Е, 34R, 36K, 38Q; (xiii) 25V, 26R, 27K, 30Е, 34Q, 36K, 38E; (xiv) 22K, 26R, 27K, 31H, 34G, des35-37; (xv) 8Aib, 25V, 26R, 27K, 31H, 34Q, 37К; (xvi) 25V, 26R, 27К, 31H, 34Q, 37К; (xvii) 22E, 23E, 25V, 26R, 27K, 31H, 34Q, 37К; (iixx) 8Aib, 12K, 22E, 26R, 27K, 31H, 34Q; (ixx) 8Aib, 22K, 26R, 27K, 31H, 34G, des35-37; (xx) 22E, 26H, 27K, 30Е, 34R, 36K, 38E; (xxi) 22E, 24K, 26R, 27K, 31H, 34G, des35-37; (xxii) 25V, 26R, 27K, 34Q, 36K; (xxiii) 22E, 24K, 25V, 26R, 27K, 31H, 34R; (xxiv) 22E, 24K, 25V, 26R, 27K, 34G, des35-37; (xxv) 22E, 24K, 25V, 26R, 27K, 34R; (xxvi) 8Aib, 22E, 24K, 25V, 26R, 27K, 31H, 34Q; или (xxvii) 8Aib, 22E, 26R, 27K, 30Е, 34R, 36K, 38E, 39G; или его фармацевтически приемлемую соль, амид или сложный эфир.
Функциональные свойства
В первом функциональном аспекте производные изобретения обладают высокой активностью. Кроме того, или альтернативно, во втором функциональном аспекте они обладают длительным фармакокинетическим профилем. Кроме того, или альтернативно, в третьем функциональном аспекте они обладают высокой пероральной биодоступностью. Кроме того, или альтернативно, в четвертом функциональном аспекте их биофизические свойства улучшены.
Биологическая активность (сила)
В соответствии с первым функциональным аспектом производные изобретения, а также конститутивные GLP-1-пептиды как таковые, обладают биологической активностью, или силой.
В конкретном воплощении сила и/или активность относится к активности in vitro, т.е. к производительности в функциональном GLP-1-рецепторном анализе, более конкретно к возможности стимулировать образование цАМФ в клеточной линии, экспрессирующей клонированный человеческий GLP-1-рецептор.
Стимуляция образования цАМФ в среде, содержащей человеческий GLP-1-рецептор, предпочтительно может быть определена с помощью стабильно трансфицированной клеточной линии, такой как ВНК467-12А (tk-ts13), и/или путем определения цАМФ в функциональном рецепторном анализе, например, на основании конкуренции между эндогенно образованным цАМФ и экзогенно добавленным биотин-меченым цАМФ, где цАМФ более предпочтительно захватывают с помощью специфического антитела, и/или где еще более предпочтительным является анализ AlphaScreen cAMP Assay, наиболее предпочтительно описанный в Примере 33.
Термин «половина максимальной эффективной концентрации» (EC50) обычно относится к концентрации, которая вызывает реакцию, находящуюся посередине между базальной и максимальной, со ссылкой на кривую «доза-реакция». ЕС50 используется как мера активности соединения и представляет собой концентрацию, при которой наблюдается 50% максимального эффекта.
Можно установить, как описано выше, активность производных изобретения in vitro, и определить ЕС50 рассматриваемого производного. Чем ниже ЕС50, тем выше активность.
Подходящая среда имеет следующий состав (концентрации при окончательном анализе): 50 мМ Трис-HCl, 5 мМ HEPES, 10 мМ MgCl2, 6H2O; 150 мМ NaCl, 0,01% Tween; 0,1% BSA, 0,5 мМ IBMX, 1 мМ АТР, 1 мкМ GTP, рН 7,4.
ЕС50 производных изобретения находится на уровне 3500 пМ или ниже, предпочтительно ниже 3200 пМ. ЕС50 может быть ниже 1200 пМ, предпочтительно ниже 1000 пМ, еще более предпочтительно ниже 500 пМ или, наиболее предпочтительно, ниже 200 пМ
В другом конкретном воплощении первого функционального аспекта сила и/или активность относится к способности связываться с рецептором GLP-1 в присутствии низкой концентрации альбумина. Связывание с рецептором GLP-1 в присутствии низкой концентрации альбумина должно быть настолько высоким, насколько это возможно, соответствуя низкому значению IC50. Оно может быть определено, как описано в примере 35. IC50 (при низком альбумине) производных изобретения составляет 500 нМ или ниже, у многих ниже 100 нМ или даже 10 нМ.
В другом конкретном воплощении производные изобретения являются активными in vivo, что можно определить, как известно в данной области, на любой подходящей животной модели, а также в клинических испытаниях.
Диабетическая db/db-мышь является одним из примеров подходящей животной модели, и на таких мышах можно определить in vivo также эффект снижения уровня глюкозы в крови, например, как описано в примере 36, или как описано в примере 43 WO 09/030738.
Кроме того, или альтернативно, влияние на потребление пищи in vivo можно определить в фармакодинамических исследованиях на свиньях, например, как описано в примере 38.
Пролонгирование - рецепторное связывание/низкий и высокий альбумин
В соответствии со вторым функциональным аспектом производные изобретения являются пролонгированными.
GLP-1-рецепторное связывание
В одном конкретном воплощении пролонгирование относится к способности производных изобретения связываться с GLP-1-рецептором при низкой и высокой концентрации альбумина, соответственно, которая может быть определена, как описано в примере 34.
Как правило, связывание с GLP-1-рецептором при низкой концентрации альбумина должно быть настолько высоким, насколько это возможно, соответствуя низким значениям IC50. В одном воплощении низкий уровень альбумина относится к 0,005% HSA. В другом воплощении низкий уровень альбумина относится к 0,001% HSA.
Значение IC50 при высокой концентрации альбумина является мерой влияния альбумина на связывание производного с GLP-1-рецептором. Как известно, производные GLP-1 также связываются с альбумином. Это, как правило, желательный эффект, который увеличивает их время жизни в плазме крови. Таким образом, значение IC50 при высоком альбумине, как правило, будет выше, чем значение IC50 при низком альбумине, соответствуя сниженному связыванию с GLP-1-рецептором, вызванному связыванием альбумина, конкурирующим со связыванием с GLP-1-рецептором.
Высокий коэффициент (значение IC50 (при высоком альбумине)/значение IC50 (при низком альбумине)) может, таким образом, рассматриваться как признак того, что производное в данном случае хорошо связывается с альбумином (может иметь длительный период полувыведения), а также само по себе хорошо связывается с GLP-1-рецептором (значение IC50 (при высоком альбумине) большое, а значение IC50 (при низком альбумине) малое). С другой стороны, связывание с альбумином не всегда может быть желательным, либо связывание с альбумином может стать слишком сильным. Таким образом, желательные диапазоны IC50 (при низком альбумине), IC50 (при высоком альбумине) и соотношения при высоком/низком могут отличаться у разных соединений в зависимости от предполагаемого применения и обстоятельств такого применения, а также других свойств соединений, представляющих потенциальный интерес.
Подходящий анализ для определения рецепторного связывания при высокой и низкой концентрации альбумина описан в примере 34 данного документа. Соединения изобретения обладают очень хорошей аффинностью связывания с рецептором (IC50) при низкой концентрации альбумина. В среднем IC50 (при низком альбумине) анализируемых соединений в примере 34 составляет 14 нМ.
Пролонгирование - период полужизни in vivo у крыс
В соответствии со вторым функциональным аспектом производные изобретения являются пролонгированными. В конкретном воплощении пролонгирование может, соответственно, быть определено как период полужизни (Т½) in vivo у крыс после внутривенного введения. Период полужизни у крыс составляет по меньшей мере 4 часа, и он может составлять 10 часов или больше.
Подходящий анализ для определения периода полужизни in vivo у крыс после внутривенного введения раскрыт в примере 39 данного документа.
Пролонгирование - период полужизни in vivo у мини-свиней
В соответствии со вторым функциональным аспектом производные изобретения являются пролонгированными. В конкретном воплощении пролонгирование, дополнительно или альтернативно, может быть определено как период полужизни (Т½) in vivo у мини-свиней после внутривенного введения. Период полужизни составляет по меньшей мере 12 часов, он может составлять по меньшей мере 24 часа, по меньшей мере 36 часов, по меньшей мере 48 часов или по меньшей мере 60 часов, или даже больше.
Подходящий анализ для определения периода полужизни in vivo у крыс после внутривенного введения раскрыт в примере 37 данного документа.
Пероральная биодоступность
В соответствии с третьим функциональным аспектом производные изобретения имеют высокую пероральную биодоступность.
Пероральная биодоступность коммерческих производных GLP-1 является очень низкой. Пероральная биодоступность производных GLP-1 для внутривенного или подкожного введения, находящихся в стадии разработки, также низкая.
Соответственно, в данной области существует потребность производных GLP-1 с улучшенной пероральной биодоступностью. Такие производные могут быть подходящими кандидатами для перорального введения до тех пор, пока их эффективность в целом удовлетворительна, и/или до тех пор, пока их период полужизни также в целом удовлетворительный.
Авторы данного изобретения выявили новый класс производных GLP-1, которые имеют неожиданно высокую пероральную биодоступность и, в то же время, удовлетворительную активность и/или период полужизни.
Кроме того, или альтернативно, эти производные имеют неожиданно улучшенную пероральную биодоступность и, в то же время, высокую аффинность связывания (т.е. низкое значение IC50) с рецептором GLP-1 при низкой концентрации альбумина.
Эти функции имеют важное значение для получения низкой суточной пероральной дозы активного фармацевтического ингредиента, которая является желательной по разным причинам, в том числе, например, с точки зрения экономики производства, вопросов вероятной безопасности, а также вопросов удобного введения и охраны окружающей среды.
Вообще, термин «биодоступность» относится к доле вводимой дозы активного фармацевтического ингредиента (active pharmaceutical ingredient, API), такого как производное изобретения, которая достигает системного кровотока без изменений. По определению, когда API вводят внутривенно, его биодоступность составляет 100%. Тем не менее, когда его вводят другими путями (например, перорально), его биодоступность уменьшается (из-за деградации и/или неполной абсорбции и метаболизма первого прохождения). Знания о биодоступности необходимы при расчете доз для невнутривенных путей введения.
Абсолютная пероральная биодоступность сравнивает биодоступность (рассчитанную как площадь под кривой, или AUC) API в системном кровотоке после перорального приема с биодоступностью того же API после внутривенного введения. Это фракция API, абсорбированная при невнутривенном введении, сравненная с соответствующим внутривенным введением того же API. Если используются различные дозы, то сравнение должно быть нормированным; следовательно, каждый AUC корректируется путем деления на соответствующую вводимую дозу.
Приведен график зависимости концентрации API в плазме от времени и для перорального, и для внутривенного введения. Абсолютная биодоступность (F) является скорректированной по дозе AUC после перорального введения, разделенной на AUC после внутривенного введения.
Производные изобретения имеют абсолютную пероральную биодоступность, которая выше, чем у а) лираглутида и/или б) семаглутида; предпочтительно по меньшей мере на 10% выше, более предпочтительно по меньшей мере на 20% выше, еще более предпочтительно по меньшей мере на 30% выше или, наиболее предпочтительно, по меньшей мере на 40% выше. Перед анализом пероральной биодоступности производные изобретения могут соответственно быть собраны в состав как известные в данной области пероральные составы инсулинотропных соединений, например, с использованием одного или более чем одного состава, описанного в WO 2008/145728.
Подходящие анализы для предсказания пероральной биодоступности описаны в примерах 35 и 40. В этих анализах после прямого введения производного GLP-1 в просвет кишечника крыс и/или после перорального введения крысам через зонд определяют концентрацию (экспозицию) его в плазме и измеряют последующую экспозицию производного GLP-1 в плазме.
Биофизические свойства
В соответствии с четвертым функциональным аспектом производные изобретения обладают улучшенными биофизическими свойствами. Эти свойства включают, но не ограничиваясь ими, физическую стабильность и растворимость. Улучшенные биофизические свойства могут быть результатом измененных свойств олигомеров. Биофизические свойства могут быть измерены с помощью стандартных биофизических способов химии белка. Биофизические свойства производных изобретения могут быть соответствующим образом сравнены с такими свойствами нативного GLP-1.
Дополнительные конкретные воплощения изобретения описаны в разделе, озаглавленном «Конкретные воплощения».
Технологические процессы
Производство пептидов, таких как аналоги GLP-1 (7-37) и GLP-1, хорошо известно в данной области.
GLP-1-группировка производных изобретения (или ее фрагменты), такая как K12,K27-GLP-1 (7-37) или ее аналог или фрагмент может быть, например, получена путем классического пептидного синтеза, например, твердофазного пептидного синтеза с помощью химии t-Boc или Fmoc или других хорошо известных методик, см., например, Greene and Wuts, "Protective Groups in Organic Synthesis", John Wiley & Sons, 1999, Florencio Zaragoza Dörwald, "Organic Synthesis on solid Phase", Wiley-VCH Verlag GmbH, 2000, и "Fmoc Solid Phase Пептид Synthesis", Edited by W.C. Chan and P.D. White, Oxford University Press, 2000.
Кроме того, или альтернативно, они могут быть получены с помощью рекомбинантных методик, а именно путем культивирования клетки-хозяина, которая содержит последовательность ДНК, кодирующую аналог, и способна экспрессировать пептид в подходящей питательной среде в условиях, позволяющих экспрессию пептида. Неограничивающими примерами клеток-хозяев, пригодных для экспрессии этих пептидов, являются: Escherichia coli, Saccharomyces cerevisiae, а также клеточные линии млекопитающих ВНК или СНО.
Такие производные изобретения, которые включают неприродные аминокислоты и/или ковалентно присоединенный N-концевой моно- или дипептидный миметик, могут, например, быть получены, как описано в экспериментальной части. Или см., например, Hodgson et al: "The synthesis of peptids and proteins containing non-natural amino acids", Chemical Society Reviews, vol.33, no.7 (2004), p.422-430; и WO 2009/083549 A1, озаглавленный "Semi-recombinant preparation of GLP-1 analogues".
Конкретные примеры способов получения ряда производных изобретения включены в экспериментальную часть.
Фармацевтические композиции
Фармацевтические композиции, содержащие производное изобретения или его фармацевтически приемлемую соль, амид или эфир и фармацевтически приемлемый эксципиент, могут быть получены способами, известными в данной области.
Термин «эксципиент» в широком смысле относится к любому компоненту, кроме активного терапевтического ингредиента(ов). Эксципиент может быть инертным веществом, неактивным веществом и/или нелечебным активным веществом.
Эксципиент может иметь различное назначение, например, выступать в качестве носителя, растворителя, вспомогательного средства для таблеток и/или улучшать введение и/или абсорбцию активного вещества.
Состав фармацевтически активных ингредиентов с различными эксципиентами известен в данной области, см., например, Remington: The Science and Practice of Pharmacy (e.g. 19th edition (1995), и более поздние издания).
Неограничивающими примерами эксципиентов являются растворители, разбавители, буферы, консерванты, агенты, регулирующие тоничность, хелатирующие агенты и стабилизаторы.
Примеры составов включают жидкие составы, т.е. водные составы, содержащие воду. Жидкий состав может быть в виде раствора или в виде суспензии. Водный состав обычно содержит по меньшей мере 50% (по массе) воды, по меньшей мере 60%, 70%, 80% или даже по меньшей мере 90% (по массе) воды.
Альтернативно, фармацевтическая композиция может быть твердым составом, например, лиофилизированная или высушенная распылением композиция, которая может быть использована как таковая, или к которой врач или пациент добавляет растворитель и/или разбавитель перед применением.
рН водного состава может быть любым в пределах от рН 3 до рН 10, например, от примерно 7,0 до примерно 9,5 или от примерно 3,0 до примерно 7,0.
Фармацевтическая композиция может содержать буфер. Буфер может быть выбран, например, из группы, состоящей из ацетата натрия, карбоната натрия, цитрата, глицилглицина, гистидина, глицина, лизина, аргинина, натрия дигидрофосфата, натрия гидрофосфата, натрия фосфата, трис(гидроксиметил)аминометана, бицина, трицина, яблочной кислоты, сукцината, малеиновой кислоты, фумаровой кислоты, винной кислоты, аспарагиновой кислоты и их смесей.
Фармацевтическая композиция может содержать консервант. Консервант может быть выбран, например, из группы, состоящей из фенола, о-крезола, м-крезола, п-крезола, метил-п-гидроксибензоата, пропил-п-гидроксибензоата, 2-феноксиэтанола, бутил-п-гидроксибензоата, 2-фенилэтанола, бензилового спирта, хлорбутанола и тиомеросала, бронопола, бензойной кислоты, имидуреи, хлоргексидина, натрия дегидроацетата, хлорокрезола, этил-п-гидроксибензоата, бензетония хлорида, хлорфенезина (3п-хлорфенокси)-1,2-пропандиола) или их смесей. Консервант может присутствовать в концентрации от 0,1 мг/мл до 20 мг/мл.
Фармацевтическая композиция может включать изотонический агент. Изотонический агент может быть выбран из группы, состоящей из солей (например, хлорид натрия), сахаров или сахарных спиртов, аминокислот (например, глицина, гистидина, аргинина, лизина, изолейцина, аспарагиновой кислоты, триптофана, треонина), алдитола (например, глицерола (глицерина), 1,2-пропандиола (пропиленгликоля), 1,3-пропандиола, 1,3-бутандиола), полиэтиленгликоля (например PEG 400) и их смесей. Могут быть использованы любые сахара, такие как моно-, ди- или полисахариды, или водорастворимые гликаны, включая, например, фруктозу, глюкозу, маннозу, сорбозу, ксилозу, мальтозу, лактозу, сахарозу, трегалозу, декстран, пуллулан, декстрин, циклодекстрин, альфа- и бета-HPCD, растворимый крахмал, гидроксиэтилкрахмал и натрий-карбоксиметилцеллюлозу. Сахарный спирт определяется как С4-С8-углеводород, имеющий по меньшей мере одну ОН-группу, и представляет собой, например, маннит, сорбит, инозит, галактитол, дульцитол, ксилитол и арабитол. В одном воплощении сахароспиртовой добавкой является маннит.
Фармацевтическая композиция может включать хелатообразователь. Хелатообразователь может быть выбран, например, среди солей этилендиаминтетрауксусной кислоты (EDTA), лимонной кислоты и аспарагиновой кислоты и их смесей. Фармацевтическая композиция может включать стабилизатор. Стабилизатор может быть, например, одним или более чем одним ингибитором окисления, ингибитором агрегации, поверхностно-активным веществом и/или одним или более чем одним ингибитором протеаз. Неограничивающие примеры этих типов стабилизаторов приведены далее.
Термин «образование агрегатов» относится к физическому взаимодействию между полипептидными молекулами, которое приводит к образованию олигомеров, которые могут оставаться растворимыми, или больших видимых агрегатов, которые выпадают из раствора. Образование агрегатов полипептидом при хранении жидкой фармацевтической композиции может отрицательно влиять на биологическую активность этого полипептида, что приводит к потере терапевтической эффективности фармацевтической композиции. Кроме того, образование агрегатов может привести к другим проблемам, таким как блокирование трубок, мембран или насосов, если фармацевтическую композицию, содержащую полипептид, вводят с использованием инфузионной системы.
Фармацевтическая композиция может включать некоторое количество аминокислотных оснований, достаточное для уменьшения формирования агрегатов полипептида при хранении композиции. Термин «аминокислотное основание» относится к одной или более чем одной аминокислоте (например, метионину, гистидину, имидазолу, аргинину, лизину, изолейцину, аспарагиновой кислоте, триптофану, треонину) или их аналогам. Любая аминокислота может находиться либо в свободной форме, либо в форме соли. Может присутствовать любой стереоизомер (например, L, D или их смесь) аминокислотного основания.
Метионин (или другая серосодержащая аминокислота или аминокислотный аналог) может быть добавлен для подавления окисления остатков метионина до метионинсульфоксида, когда полипептид, действующий в качестве терапевтического агента, представляет собой полипептид, содержащий по меньшей мере один остаток метионина, чувствительный к такому окислению. Может быть использован любой стереоизомер метионина (L или D) или их комбинации.
Фармацевтическая композиция может включать стабилизатор, выбранный из группы высокомолекулярных полимеров или низкомолекулярных соединений. Стабилизатор может быть выбран, например, среди полиэтиленгликоля (например, PEG 3350), поливинилового спирта (PVA), поливинилпирролидона, карбокси-/гидроксицеллюлозы или их производных (например, НРС, HPC-SL, HPC-L и НРМС), циклодекстринов, серосодержащих веществ, таких как монотиоглицерин, тиогликолевая кислота и 2-метилтиоэтанол, а также различных солей (например, хлорида натрия). Фармацевтическая композиция может включать дополнительные стабилизирующие агенты, такие как, но не ограничиваясь ими, метионин и EDTA, которые защищают полипептид от окисления метионина, и неионогенные поверхностно-активные вещества, который защищают полипептид от агрегации, связанной с замораживанием-оттаиванием или механической деформацией.
Фармацевтическая композиция может включать одно или более чем одно поверхностно-активное вещество, предпочтительно поверхностно-активное вещество, по меньшей мере одно поверхностно-активное вещество, или два различных поверхностно-активных вещества. Термин «поверхностно-активное вещество» относится к любым молекулам или ионам, которые содержат водорастворимую (гидрофильную) часть и жирорастворимую (липофильную) часть. Поверхностно-активное вещество может быть выбрано, например, из группы, состоящей из анионных поверхностно-активных веществ, катионных поверхностно-активных веществ, неионогенных поверхностно-активных веществ и/или цвиттерионных поверхностно-активных веществ.
Фармацевтическая композиция может содержать один или более чем один ингибитор протеаз, такой как, например, EDTA (этилендиаминтетрауксусная кислота) и/или бензамидинНСl.
Дополнительно, возможно, ингредиенты фармацевтической композиции включают, например, увлажняющие агенты, эмульгаторы, антиоксиданты, наполнители, ионы металлов, масляные носители, белки (например, человеческий сывороточный альбумин, желатин) и/или цвиттерион (например, аминокислоту, такую как бетаин, таурин, аргинин, глицин, лизин и гистидин).
Кроме того, фармацевтическая композиция может быть собрана в состав как известные в данной области составы инсулинотропных соединений для перорального введения, например, с использованием одного или более чем одно состава, описанного в WO 2008/145728.
Вводимая доза может содержать 0,01-100 мг производного, или 0,01-50 мг, или 0,01-20 мг, или 0,01-10 мг производного.
Производное может быть введено в форме фармацевтической композиции. Оно может быть введено пациенту, нуждающемуся в этом, в нескольких местах, например, в местах для местного введения, таких как кожа или слизистые оболочки; в местах, которые обходят абсорбцию, таких как артерия, вена или сердце; и в местах, которые предусматривают абсорбцию, например в кожу, под кожу, в мышцу или в брюшную полость.
Путь введения может быть, например, язычным; подъязычным; буккальным; в рот; пероральным; в желудок; в кишечник; назальным; легочным, например, через бронхиолы, альвеолы, или с их сочетанием; парентеральным, эпидермальным; дермальным; трансдермальным; конъюнктивальным; уретральным; вагинальным; ректальным и/или окулярным. Композиция может быть композицией для перорального введения, и путь введения может быть пероральным.
Композиция может быть введена в нескольких лекарственных формах, например, как раствор, суспензия, эмульсия, микроэмульсия, множественная эмульсия, пена, бальзам, паста, пластырь, мазь, таблетка, таблетка с покрытием, жевательная резинка, средство для промывания, капсула, например, жесткая или мягкая желатиновая капсула, суппозиторий, ректальная капсула, капли, гель, спрей, порошок, аэрозоль, ингалятор, глазные капли, глазная мазь, раствор для промывания глаз, вагинальный пессарий, вагинальное кольцо, вагинальная мазь, раствор для инъекций, раствор, преобразующийся in situ, например, in situ гелеобразующий, загустевающий, преципитирующий и in situ кристаллизующийся; инфузионный раствор или имплантат. Композиция может быть таблеткой, возможно, с покрытием, капсулой или жевательной резинкой.
Композиция также может быть собрана в состав с носителем лекарственного препарата или с системой доставки лекарственного препарата, например, для улучшения стабильности, биодоступности и/или растворимости. В конкретном воплощении композиция может быть присоединена к такой системе через ковалентные, гидрофобные и/или электростатические взаимодействия. Целью такой рецептуры может быть, например, уменьшение неблагоприятных последствий, достижение хронотерапии и/или увеличение комплаентности с пациентом.
Композиция также может быть использована в составе систем доставки лекарственного препарата с контролируемым, продолжительным, пролонгированным, отложенным и/или медленным высвобождением.
Парентеральное введение может быть выполнено путем подкожной, внутримышечной, внутрибрюшинной или внутривенной инъекции с помощью шприца, возможно, с помощью шприца-ручки или с помощью инфузионного насоса.
Композиция может быть введена через нос в форме раствора, суспензии или порошка; либо она может быть введена в легкие в форме жидкости или порошкового спрея.
Еще одним вариантом является трансдермальное введение, например, путем безыгольной инъекции, с помощью пластыря, такого как ионофоретический пластырь, или через слизистую, например, буккальным путем.
Композиция может представлять собой стабилизированный состав. Термин «стабилизированный состав» относится к составу с повышенной физической и/или химической стабильностью, предпочтительно одновременно. Как правило, состав должен быть стабильным в течение времени применения и хранения (в соответствии с рекомендуемыми условиями применения и хранения) до истечения срока действия.
Термин «физическая стабильность» относится к тенденции полипептида формировать биологически неактивные и/или нерастворимые агрегаты в результате воздействия термомеханической нагрузки и/или взаимодействия с дестабилизирующими границами раздела и поверхностями (например, гидрофобными поверхностями). Физическую стабильность водного полипептидного состава можно оценить путем визуального осмотра и/или измерения мутности после воздействия механических/физических нагрузок (например, перемешивания) при различных температурах в течение различных периодов времени. Альтернативно, физическую стабильность можно оценить с помощью спектроскопического агента или зонда конформационного состояния полипептида, например, тиофлавина Т или зондов «гидрофобного участка».
Термин «химическая стабильность» относится к химическим (в частности, ковалентным) изменениям в структуре полипептида, приводящим к образованию химических продуктов деградации, потенциально имеющих сниженную биологическую активность и/или повышенный иммуногенный эффект по сравнению с интактным полипептидом. Химическую стабильность можно оценить, измеряя количество продуктов химической деградации в различные временные точки после воздействия различных условий окружающей среды, например, с помощью SEC-HPLC и/или RP-HPLC.
Лечение с помощью производного в соответствии с данным изобретением также может быть объединено с одним или более чем одним дополнительным фармакологически активным веществом, например, выбранным среди антидиабетических агентов, агентов против ожирения, агентов, регулирующих аппетит, антигипертензивных агентов, агентов для лечения и/или профилактики осложнений, возникающих в результате диабета, и агентов для лечения и/или профилактики осложнений, возникающих в результате ожирения или связанных с ним. Примерами таких фармакологически активных веществ являются инсулин, сульфонилмочевина, бигуаниды, меглитиниды, ингибиторы глюкозидазы, антагонисты глюкагона, ингибиторы DPP-IV (дипептидилпептидазы-IV), ингибиторы печеночных ферментов, участвующих в стимуляции глюконеогенеза и/или гликогенолиза, модуляторы поглощения глюкозы, соединения, изменяющие липидный обмен, такие как антигиперлипидемические агенты, ингибиторы ГМГ-КоА (статины), желудочные ингибиторные полипептиды (аналоги GIP), соединения, снижающие потребление пищи, агонисты RXR и агенты, воздействующие на АТФ-зависимые калиевые каналы β-клеток; холестирамин, колестипол, клофибрат, гемфиброзил, ловастатин, правастатин, симвастатин, пробукол, декстротироксин, нетеглинид, репаглинид; β-блокаторы, такие как алпренолол, атенолол, тимолол, пиндолол, пропранолол и метопролол, ингибиторы АСЕ (ангиотензин-превращающего фермента), такие как беназеприл, каптоприл, эналаприл, фозиноприл, лизиноприл, алатриоприл, квинаприл и рамиприл, блокаторы кальциевых каналов, такие как нифедипин, фелодипин, никардипин, исрадипин, нимодипин, дилтиазем и верапамил, и α-блокаторы, такие как доксазозин, урапидил, празозин и теразозин; агонисты CART (кокаин- и амфетамин-регулируемого транскрипта), антагонисты NPY (нейропептиды Y), агонисты PYY, агонисты рецептора Y2, агонисты рецептора Y4, смешанные агонисты Y2/Y4-рецепторов, агонисты МС4 (меланокортина-4), антагонисты орексина, агонисты TNF (фактора некроза опухоли), агонисты CRF (кортикотропного рилизинг-фактора), антагонисты CRF-BP (белка, связывающего кортикотропный рилизинг-фактор), агонисты урокортина, β3-агонисты, оксинтомодулин и аналоги, агонисты MSH (меланоцит-стимулирующего гормона), антагонисты МСН (меланин-концентрирующего гормона), агонисты ССК (холецистокинина), ингибиторы обратного захвата серотонина, ингибиторы обратного захвата серотонина и норадреналина, смешанные соединения серотонина и норадреналина, агонисты 5НТ (серотонина), агонисты бомбезина, антагонисты галанина, гормон роста, соединения, высвобождающие гормон роста, агонисты TRH (тиреотропного рилизинг-гормона), модуляторы UCP 2 или 3 (разобщающего белка 2 или 3), агонисты лептина, агонисты DA (бромокриптин, допрексин), ингибиторы липазы/амилазы, модуляторы RXR (ретиноидного Х-рецептора), агонисты TR β, антагонисты гистамина Н3, агонисты или антагонисты желудочного ингибиторного полипептида (GIP-аналоги), гастрин и аналоги гастрина.
Лечение с помощью производного в соответствии с этим изобретением также может быть объединено с хирургической операцией, которая влияет на уровень глюкозы и/или на липидный обмен, такой как бандажирование желудка или желудочное шунтирование.
Фармацевтические показания
В третьем аспекте данное изобретение также относится к производным изобретению для применения в качестве лекарственного средства.
В конкретных воплощениях производное изобретения может быть использовано для следующих медицинских применений, при этом все предпочтительно касаются тем или иным образом диабета:
(i) профилактика и/или лечение всех форм диабета, таких как гипергликемия, сахарный диабет 2 типа, нарушение толерантности к глюкозе, сахарный диабет 1 типа, инсулиннезависимый диабет, MODY (диабет взрослого типа у молодых), гестационный диабет и/или снижение HbA1C;
(ii) задержка или предотвращение прогрессирования диабетического заболевания, например, прогрессирования сахарного диабета 2 типа, задержка прогрессирования нарушения толерантности глюкозы (IGT) в сахарный диабет 2 типа с необходимостью инсулина, и/или задержка прогрессирования сахарного диабета 2 типа без необходимости инсулина в сахарный диабет 2 типа с необходимостью инсулина;
(iii) улучшение функционирования β-клеток, например, снижение апоптоза β-клеток, усиление функции β-клеток и/или увеличение β-клеточной массы и/или восстановление чувствительности β-клеток глюкозе;
(iv) профилактика и/или лечение когнитивных расстройств;
(v) профилактика и/или лечение расстройств пищевого поведения, таких как ожирение, например, за счет уменьшения потребления пищи, уменьшения массы тела, подавления аппетита, вызывания сытости; лечение или профилактика компульсивного переедания, булимии и/или ожирения, вызванного введением антипсихотического агента или стероидов, снижение моторики желудка и/или задержка опорожнения желудка;
(vi) профилактика и/или лечение осложнений диабета, таких как нейропатия, в том числе периферическая нейропатия; нефропатия; или ретинопатия;
(vii) улучшение параметров липидного обмена, например, профилактика и/или лечение дислипидемии, снижение общего уровня липидов в сыворотке крови, снижение уровня ЛПВП, снижение уровня мелких плотных ЛПНП, снижение уровня ЛПОНП, снижение уровня триглицеридов, снижение уровня холестерина, повышение уровня ЛПВП, снижение плазменных уровней липопротеина a (Lp(a)) в организме человека; ингибирование образования аполипопротеина а (аро(а)) in vitro и/или in vivo;
(viii) профилактика и/или лечение сердечно-сосудистых заболеваний, таких как синдром X; атеросклероз; инфаркт миокарда; ишемическая болезнь сердца; инсульт, ишемия головного мозга; раннее сердечное или раннее сердечно-сосудистое заболевание, такое как гипертрофия левого желудочка; ишемическая болезнь сердца; эссенциальная гипертензия; острое гипертоническое состояние; кардиомиопатия; сердечная недостаточность; толерантность к физической нагрузке; хроническая сердечная недостаточность; аритмия; сердечная аритмия; синкопе; атеросклероз; мягкая хроническая сердечная недостаточность; стенокардия; повторная окклюзия сердечного обхода; перемежающаяся хромота (облитерирующий атеросклероз); диастолическая дисфункция и/или систолическая дисфункция;
(ix) профилактика и/или лечение желудочно-кишечных заболеваний, таких как воспалительные заболевания кишечника; тонкокишечный синдром, или болезнь Крона; диспепсия; и/или язвы желудка;
(х) профилактика и/или лечение критических заболеваний, например, лечение тяжелобольных пациентов, пациентов с критическим заболеванием полинефропатией (CIPNP) и/или потенциальных пациентов с CIPNP; профилактика критических заболеваний или развития CIPNP; профилактика, лечение и/или забота о пациентах с синдромом системного воспалительного ответа (SIRS); и/или профилактика или снижение вероятности развития у пациента бактериемии, септицемии и/или септического шока во время госпитализации; и/или
(xi) профилактика и/или лечение синдрома поликистоза яичников (PCOS).
В конкретном воплощении показание выбрано из группы, состоящей из (i)-(iii) и (v)-(viii), таких как показания (i), (ii) и/или (iii); или показание (v), показание (vi), показание (vii) и/или показание (viii).
В другом конкретном воплощении показание представляет собой (i). В другом конкретном воплощении показание представляет собой (v). В еще одном конкретном воплощении показание представляет собой (viii).
Следующие показания являются особенно предпочтительными: сахарный диабет 2 типа и/или ожирение.
Конкретные воплощения
Ниже приведены конкретные воплощения изобретения:
1. Производное аналога GLP-1,
где аналог GLP-1 содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1), второй остаток К в позиции, соответствующей позиции Т в GLP-1 (7-37), где Т представляет собой целое число в диапазоне 7-37 за исключением 18 и 27; а также до десяти аминокислотных замен по сравнению с GLP-1 (7-37), где первый остаток К обозначается как К27, а второй остаток К обозначается как KT;
где указанное производное включает первую и вторую пролонгирующие группировки, прикрепленные к K27 и KT, соответственно, через первый и второй линкер, соответственно, при этом
первая и вторая пролонгирующие группировки выбраны среди Соед. 1 и Соед. 2:
Соед. 1: НООС-(СН2)x-СО-*
Соед. 2: НООС-С6Н4-O-(СН2)y-СО-*
где x представляет собой целое число в диапазоне 6-16, y представляет собой целое число в диапазоне 3-17; и
первый и второй линкер содержат Соед. 5:
Соед. 5:
 ,
,
где k представляет собой целое число в диапазоне 1-5, и n представляет собой целое число в диапазоне 1-5;
или его фармацевтически приемлемая соль, амид или сложный эфир.
2. Производное по воплощению 1, где Т представляет собой целое число, выбранное из диапазона 7-37 за исключением 18 и 27.
3. Производное по любому из воплощений 1-2, где Т выбран из диапазона 7-17, 19-26 и 28-37.
4. Производное по любому из воплощений 1-3, где Т выбран из диапазона 7-17.
5. Производное по любому из воплощений 1-4, где Т составляет 12.
6. Производное по любому из воплощений 1-3, где Т выбран из диапазона 19-26.
7. Производное по любому из воплощений 1-3 и 6, где Т выбран из группы, состоящей из 20, 22 и 24.
8. Производное по любому из воплощений 1-3 и 6-7, где Т составляет 20.
9. Производное по любому из воплощений 1-3 и 6-7, где Т составляет 22 или 24.
10. Производное по любому из воплощений 1-3, 6-7 и 9, где Т составляет 22.
11. Производное по любому из воплощений 1-3, 6-7 и 9, где Т составляет 24.
12. Производное по любому из воплощений 1-3, где Т выбран из диапазона 28-37.
13. Производное по любому из воплощений 1-3 и 12, где Т выбран из группы, состоящей из 36 и 37.
14. Производное по любому из воплощений 1-3 и 12-13, где Т составляет 36.
15. Производное по любому из воплощений 1-3 и 12, где Т составляет 37.
16. Производное по любому из воплощений 1-16, где позиция, соответствующая позиции 27 из GLP-1 (7-37) (SEQ ID №1), определена путем рукописной записи и визуального контроля.
17. Производное по любому из воплощений 1-16, где позиция, соответствующая позиции Т в GLP-1 (7-37) (SEQ ID №1), определена путем рукописной записи и визуального контроля.
18. Производное по любому из воплощений 1-17, где позиция, соответствующая позиции 27 в GLP-1 (7-37) (SEQ ID №1), определена путем применения стандартной программы выравнивания белков или пептидов.
19. Производное по любому из воплощений 1-18, где позиция, соответствующая позиции Т в GLP-1 (7-37) (SEQ ID №1), определена путем применения стандартной программы выравнивания белков или пептидов.
20. Производное по воплощению 19, где программа для выравнивания представляет собой выравнивание по Нидлману-Вуншу.
21. Производное по любому из воплощений 19-20, где используется матрица весов выравнивания по умолчанию и матрица идентичности по умолчанию.
22. Производное по любому из воплощений 19-21, где матрица весов выравнивания представляет собой BLOSUM62.
23. Производное по любому из воплощений 19-22, где штраф на первый остаток в делеции составляет -10 (минус десять).
24. Производное по любому из воплощений 19-23, где штраф на дополнительные остатки в делеции составляет -0,5 (минус ноль целых пять десятых).
25. Производное по любому из воплощений 1-24, где аналог не содержит остатки К, кроме первого и второго остатков К.
26. Производное по любому из воплощений 1-25, где пролонгирующая группировка представляет собой Соед. 1.
27. Производное по любому из воплощений 1-26, где x представляет собой четное число.
28. Производное по любому из воплощений 1-27, где x составляет 12.
29. Производное по любому из воплощений 1-28, где Соед. 1 представлено Соед. 1а:
Соед. 1а:
 .
.
30. Производное по любому из воплощений 1-25, где пролонгирующая группировка представляет собой Соед. 2.
31. Производное по любому из воплощений 1-25 и 30, где Соед. 2 представлено Соед. 2а:
Соед. 2а:
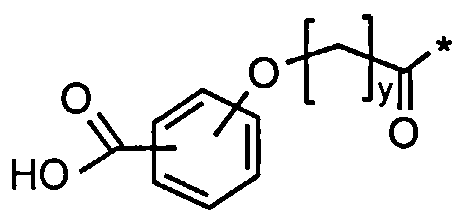 .
.
32. Производное по любому из воплощений 1-25 и 30-31, где y представляет собой нечетное число.
33. Производное по любому из воплощений 1-25 и 30-32, где y представляет собой целое число в диапазоне 9-11.
34. Производное по любому из воплощений 1-25 и 30-33, где y составляет 9.
35. Производное по любому из воплощений 1-25 и 30-33, где y составляет 11.
36. Производное по любому из воплощений 1-25 и 30-35, где Соед. 2 представлено Соед. 2b или Соед. 2с:
Соед. 2b:
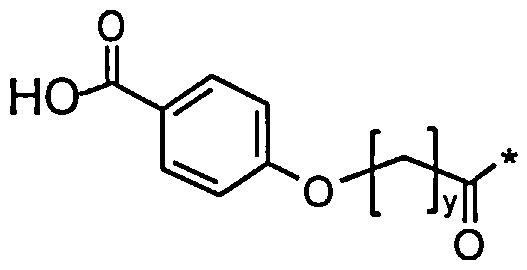 , или
, или
Соед. 2с:
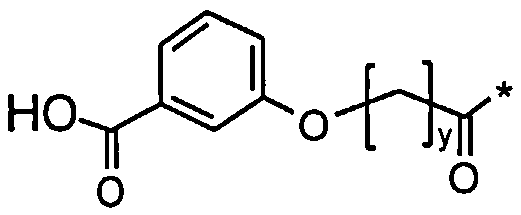 .
.
37. Производное по любому из воплощений 1-25 и 30-35, где Соед. 2 представлено Соед. 2b.
38. Производное по любому из воплощений 31-35, где Соед. 2а представлено Соед. 2b или Соед. 2с:
Соед. 2b:
 , или
, или
Соед. 2с:
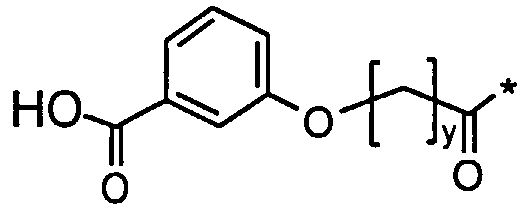 .
.
39. Производное по любому из воплощений 31-35 и 38, где Соед. 2а представлено Соед. 2b.
40. Производное по любому из воплощений 1-39, где Соед. 5 представляет собой первый линкерный элемент.
41. Производное по любому из воплощений 1-40, где k составляет 1.
42. Производное по любому из воплощений 1-41, где n составляет 1.
43. Производное по любому из воплощений 1-42, где Соед. 5 включено m раз, где m представляет собой целое число в диапазоне 1-10.
44. Производное по воплощению 43, где m составляет 2.
45. Производное по любому из воплощений 43-44, где если m не является 1, то элементы Соед. 5 соединены через амидный мостик(и).
46. Производное по любому из воплощений 1-45, где линкер также содержит второй линкерный элемент.
47. Производное по воплощению 46, где второй линкерный элемент представляет собой Glu-бирадикал.
48. Производное по любому из воплощений 46-47, где второй линкерный элемент выбран среди Соед. 6 и/или Соед. 7:
Соед. 6:
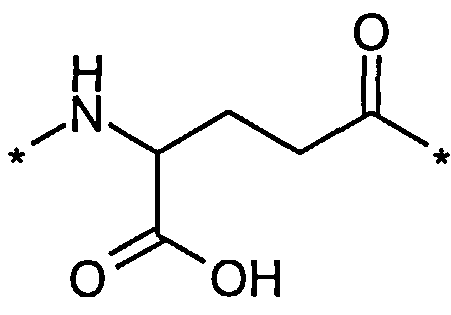 , и/или
, и/или
Соед. 7:
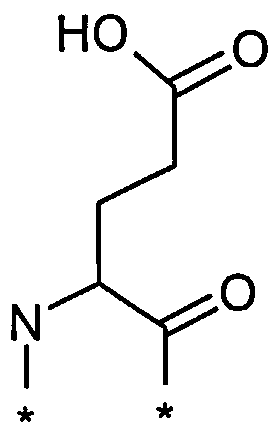 .
.
49. Производное по воплощению 48, где второй линкерный элемент представляет собой Соед. 6.
50. Производное по любому из воплощений 46-49, где Glu-бирадикал включен p раз, где p представляет собой целое число в диапазоне 1-2.
51. Производное по воплощению 50, где p составляет 1.
52. Производное по воплощению 50, где p составляет 2.
53. Производное по любому из воплощений 46-52, где Glu-бирадикал представляет собой радикал L-Glu.
54. Производное по любому из воплощений 46-53, где один или более чем один Glu-бирадикал и один или более чем один элемент Соед. 5 связаны через амидный мостик(и).
55. Производное по любому из воплощений 46-54, где линкер содержит m раз Соед. 5 и p раз Glu-бирадикал.
56. Производное по воплощению 55, где (m,p) составляют (2,2) или (2,1).
57. Производное по воплощению 56, где (m,p) составляют (2,1).
58. Производное по любому из воплощений 55-57, где m элементов Соед. 5 и p Glu-бирадикалов связаны через амидные мостики.
59. Производное по любому из воплощений 1-58, где линкер и пролонгирующая группировка связаны через амидный мостик.
60. Производное по любому из воплощений 1-59, где линкер и аналог GLP-1 связаны через амидный мостик.
61. Производное по любому из воплощений 1-60, где линкер присоединен к эпсилон-аминогруппе первого или второго К-остатка.
62. Производное по любому из воплощений 1-61, где линкер содержит от 5 до 41 С-атома.
63. Производное по любому из воплощений 1-62, где линкер содержит 17 или 22 С-атома.
64. Производное по любому из воплощений 1-63, где линкер содержит 17 С-атомов.
65. Производное по любому из воплощений 1-63, где линкер содержит 22 С-атома.
66. Производное по воплощениям 1-65, где линкер содержит от 4 до 28 гетороатомов.
67. Производное по любому из воплощений 1-66, где линкер содержит 12 или 16 гетороатомов.
68. Производное по любому из воплощений 1-67, где линкер содержит 12 гетороатомов.
69. Производное по любому из воплощений 1-67, где линкер содержит 16 гетороатомов.
70. Производное по любому из воплощений 66-70, где гетероатомы представляют собой N- и/или O-атомы.
71. Производное по любому из воплощений 1-70, где линкер содержит от 1 до 7 N-атомов.
72. Производное по любому из воплощений 1-71, где линкер содержит 3 или 4 N-атома.
73. Производное по любому из воплощений 1-72, где линкер содержит 3 N-атома.
74. Производное по любому из воплощений 1-72, где линкер содержит 4 N-атома.
75. Производное по любому из воплощений 1-74, где линкер содержит от 3 до 21 O-атома.
76. Производное по любому из воплощений 1-75, где линкер содержит 9 или 12 O-атомов.
77. Производное по любому из воплощений 1-76, где линкер содержит 9 O-атомов.
78. Производное по любому из воплощений 1-76, где линкер содержит 12 O-атомов.
79. Производное по любому из воплощений 1-78, где линкер содержит два раза Соед. 6 и три раза Соед. 5, связанные через амидные мостики и в указанной последовательности, при этом линкер связан на его *-NH-конце с *-СО-концом пролонгирующей группировки, и на его *-СО-конце с эпсилон-аминогруппой К27 или KT аналога GLP-1.
80. Производное по любому из воплощений 1-78, где линкер содержит два раза Соед. 5 и один раз Соед. 6, связанные через амидные мостики и в указанной последовательности, при этом линкер связан на его *-NH-конце с *-СО-концом пролонгирующей группировки, и на его свободном *-СО-конце с эпсилон-аминогруппой К27 или KT аналога GLP-1.
81. Производное по любому из воплощений 1-78, где линкер содержит один раз Соед. 6 и три раза Соед. 5, связанные через амидные мостики и в указанной последовательности, при этом линкер связан на его *-NH-конце с *-СО-концом пролонгирующей группировки, и на его *-СО-конце с эпсилон-аминогруппой К27 или KT аналога GLP-1.
82. Производное по любому из воплощений 1-78, где линкер содержит один раз Соед. 6, два раза Соед. 5, и один раз Соед. 6, связанные через амидные мостики и в указанной последовательности, при этом линкер связан на его *-NH-конце с *-СО-концом пролонгирующей группировки, и на его *-СО-конце с эпсилон-аминогруппой К27 или KT аналога GLP-1.
83. Производное по любому из воплощений 1-82, где две пролонгирующие группировки являются по существу идентичными.
84. Производное по любому из воплощений 1-83, где две пролонгирующие группировки идентичны а) по меньшей мере на 80%, b) по меньшей мере на 85%, с) по меньшей мере на 90%, d) по меньшей мере на 95%, или е) по меньшей мере 99%.
85. Производное по любому из воплощений 1-83, где две пролонгирующие группировки имеют сходство а) по меньшей мере 0,5; b) по меньшей мере 0,6; с) по меньшей мере 0,7, d) по меньшей мере 0,8; е) по меньшей мере 0,9; или f) по меньшей мере 0,99.
86. Производное по любому из воплощений 1-85, где две пролонгирующие группировки имеют сходство 1,0.
87. Производное по любому из воплощений 1-86, где два линкера являются по существу идентичными.
88. Производное по любому из воплощений 1-87, где два линкера имеют сходство по меньшей мере 0,5.
89. Производное по любому из воплощений 1-88, где два линкера имеют сходство а) по меньшей мере 0,6; b) по меньшей мере 0,7, с) по меньшей мере 0,8; d) по меньшей мере 0,9; или е) по меньшей мере 0,99.
90. Производное по любому из воплощений 1-89, где два линкера имеют сходство 1,0.
91. Производное по любому из воплощений 1-90, где две альбуминсвязывающие группировки, например две боковые цепи, состоящие из пролонгирующей группировки и линкера, по существу идентичны.
92. Производное по любому из воплощений 1-91, где две альбуминсвязывающие группировки, например две боковые цепи, состоящие из пролонгирующей группировки и линкера, идентичны а) по меньшей мере на 80%, b) по меньшей мере на 85%, с) по меньшей мере на 90%, d) по меньшей мере на 95%, или е) по меньшей мере на 99%.
93. Производное по любому из воплощений 1-92, где две альбуминсвязывающие группировки, например две боковые цепи, состоящие из пролонгирующей группировки и линкера, имеют сходство а) по меньшей мере 0,5; b) по меньшей мере 0,6; с) по меньшей мере 0,7; d) по меньшей мере 0,8; е) по меньшей мере 0,9; или f) по меньшей мере 0,99.
94. Производное по любому из воплощений 1-92, где две альбуминсвязывающие группировки, например две боковые цепи, состоящие из пролонгирующей группировки и линкера, имеют сходство 1,0.
95. Производное по любому из воплощений 83-94, где две сравниваемые химические структуры представлены в виде отпечатков пальцев.
96. Производное по воплощению 95, где отпечатки представляют собой а) отпечатки ECFP_6; б) отпечатки UNITY; и/или в) отпечатки MDL.
97. Производное по любому из воплощений 95-96, где для расчета сходства, или идентичности, двух отпечатков предпочтительно используется коэффициент Танимото.
98. Производное по любому из воплощений 1-97, где число аминокислотных замен по сравнению с GLP-1 (7-37) (SEQ ID №1) идентифицируют путем рукописной записи и визуального контроля.
99. Производное по любому из воплощений 1-98, где число аминокислотных замен по сравнению с GLP-1 (7-37) (SEQ ID №1) идентифицируют с использованием стандартной программы для выравнивания белков или пептидов.
100. Производное по воплощению 99, где программа для выравнивания представляет собой выравнивание по Нидлману-Вуншу.
101. Производное по любому из воплощений 99-100, где используется матрица весов выравнивания по умолчанию и матрица идентичности по умолчанию.
102. Производное по любому из воплощений 99-101, где указанная матрица весов выравнивания представляет собой BLOSUM62.
103. Производное по любому из воплощений 99-102, где штраф на первый остаток в делеции составляет -10 (минус десять).
104. Производное по любому из воплощений 99-103, где штраф на дополнительные остатки в делеции составляет -0,5 (минус ноль целых пять десятых).
105. Производное по любому из воплощений 1-104, где аминокислотная модификация(и) имеется в одной или более чем одной позиции, соответствующей следующим позициям в GLP-1 (7-37) (SEQ ID №1): 8, 12, 20, 22, 23, 24, 25, 26, 27, 30, 31, 34, 35, 36, 37, 38 и 39.
106. Производное по любому из воплощений 1-105, где аналог содержит по меньшей мере одну из следующих замен: Aib8, К12, К20, Е22 или К22, Е23, К24, V25, R26 или Н26, К27, Е30, Н31, G34 или R34 или Q34, Des35, К36 или Des36, К37 или Des37, Е38 или Q38 и/или G39.
107. Производное по любому из воплощений 1-106, где второй остаток К представляет собой К12 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34, R34 и Q34, ii) замену, выбранную среди R26 и Н26.
108. Производное по любому из воплощений 1-106, где второй остаток К представляет собой К20 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34, R34 и Q34, ii) замену, выбранную среди R26 и Н26.
109. Производное по любому из воплощений 1-106, где второй остаток К представляет собой К22 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34, R34 и Q34, ii) замену, выбранную среди R26 и Н26.
110. Производное по любому из воплощений 1-106, где второй остаток К представляет собой К24 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34, R34 и Q34, ii) замену, выбранную среди R26 и Н26.
111. Производное по любому из воплощений 1-106, где второй остаток К представляет собой К36 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34, R34 и Q34, ii) замену, выбранную среди R26 и Н26.
112. Производное по любому из воплощений 1-106, где второй остаток К представляет собой К37 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34, R34 и Q34, ii) замену, выбранную среди R26 и Н26.
113. Производное по любому из воплощений 1-112, где аналог содержит по меньшей мере одну из следующих замен: Aib8, Е22, Е23, V25, Е30, Н31, Des35, Des36, Des37, Е38 или Q38 и/или G39.
114. Производное по любому из воплощений 1-113, где аналог содержит Aib8.
115. Производное по любому из воплощений 1-114, где аналог содержит Е22.
116. Производное по любому из воплощений 1-115, где аналог содержит Е23.
117. Производное по любому из воплощений 1-116, где аналог содержит V25.
118. Производное по любому из воплощений 1-117, где аналог содержит Е30.
119. Производное по любому из воплощений 1-118, где аналог содержит Н31.
120. Производное по любому из воплощений 1-119, где аналог содержит Des37.
121. Производное по воплощению 120, где аналог содержит Des36.
122. Производное по воплощению 121, где аналог содержит Des35.
123. Производное по любому из воплощений 1-119, где аналог содержит Е38 или Q38.
124. Производное по воплощению 123, где аналог содержит Q38.
125. Производное по воплощению 123, где аналог содержит Е38.
126. Производное по любому из воплощений 123-125, где аналог содержит G39.
127. Производное по воплощению 122, которое представляет собой производное GLP-1 (7-34) (аминокислоты 1-28 из SEQ ID №1).
128. Производное по воплощению 121, которое представляет собой производное GLP-1 (7-35) (аминокислоты 1-29 из SEQ ID №1).
129. Производное по воплощению 120, которое представляет собой производное GLP-1 (7-36) (аминокислоты 1-30 из SEQ ID №1).
130. Производное по любому из воплощений 1-119, которое представляет собой производное GLP-1 (7-37) (аминокислоты 1-31 из SEQ ID №1).
131. Производное по любому из воплощений 123-125, которое представляет собой производное GLP-1 (7-38) (аминокислоты 1-31 из SEQ ID №1, плюс один добавленный на С-конце аминокислотный остаток).
132 Производное по любому из воплощений 126, которое представляет собой производное GLP-1 (7-39) (аминокислоты 1-31 из SEQ ID №1, плюс два добавленных на С-конце аминокислотных остатка).
133. Производное по любому из воплощений 1-132, где аналог содержит максимум девять аминокислотных замен.
134. Производное по любому из воплощений 1-132, где аналог содержит максимум восемь аминокислотных замен.
135. Производное по любому из воплощений 1-132, где аналог содержит максимум семь аминокислотных замен.
136. Производное по любому из воплощений 1-132, где аналог содержит максимум шесть аминокислотных замен.
137. Производное по любому из воплощений 1-132, где аналог содержит максимум пять аминокислотных замен.
138. Производное по любому из воплощений 1-132, где аналог содержит максимум четыре аминокислотные замены.
139. Производное по любому из воплощений 1-132, где аналог содержит максимум три аминокислотные замены.
140. Производное по любому из воплощений 1-132, где аналог содержит максимум две аминокислотные замены.
141. Производное по любому из воплощений 1-132, где аналог содержит максимум одну аминокислотную замену.
142. Производное по любому из воплощений 1-140, где аналог содержит по меньшей мере одну аминокислотную замену.
143. Производное по любому из воплощений 1-139, где аналог содержит по меньшей мере две аминокислотные замены.
144. Производное по любому из воплощений 1-138, где аналог содержит по меньшей мере три аминокислотные замены.
145. Производное по любому из воплощений 1-137, где аналог содержит по меньшей мере четыре аминокислотные замены.
146. Производное по любому из воплощений 1-136, где аналог содержит по меньшей мере пять аминокислотных замен.
147. Производное по любому из воплощений 1-135, где аналог содержит по меньшей мере шесть аминокислотных замен.
148. Производное по любому из воплощений 1-134, где аналог содержит по меньшей мере семь аминокислотных замен.
149. Производное по любому из воплощений 1-133, где аналог содержит по меньшей мере восемь аминокислотных замен.
150. Производное по любому из воплощений 1-132, где аналог содержит по меньшей мере девять аминокислотных замен.
151. Производное по любому из воплощений 1-132, где аналог содержит одну аминокислотную замену.
152. Производное по любому из воплощений 1-132, где аналог содержит две аминокислотные замены.
153. Производное по любому из воплощений 1-132, где аналог содержит три аминокислотные замены.
154. Производное по любому из воплощений 1-132, где аналог содержит четыре аминокислотные замены.
155. Производное по любому из воплощений 1-132, где аналог содержит пять аминокислотных замен.
156. Производное по любому из воплощений 1-132, где аналог содержит шесть аминокислотных замен.
157. Производное по любому из воплощений 1-132, где аналог содержит семь аминокислотных замен.
158. Производное по любому из воплощений 1-132, где аналог содержит восемь аминокислотных замен.
159. Производное по любому из воплощений 1-132, где аналог содержит девять аминокислотных замен.
160. Производное по любому из воплощений 1-132, где аналог содержит десять аминокислотных замен.
161. Производное по любому из воплощений 1-160, где замена(ы) представляет собой, независимо, замещения, добавления и/или делеции.
162. Производное по любому из воплощений 1-161, где аналог содержит аналог GLP-1 формулы I:
Формула I: Xaa7-Xaa8-Glu-Gly-Thr-Xaa12-Thr-Ser-Asp-Xaa16-Ser-Xaa18-Xaa19-Хаа20-Glu-Хаа22-Хаа23-Хаа24-Хаа25-Хаа26-Lys-Phe-Ile-Хаа30-Хаа31-Leu-Val-Хаа34-Хаа35-Хаа36-Хаа37-Хаа38-Хаа39, где
Хаа7 представляет собой L-гистидин, имидазопропионил, α-гидрокси-гистидин, D-гистидин, дезамино-гистидин, 2-амино-гистидин, β-гидрокси-гистидин, гомогистидин, Nα-ацетил-гистидин, Nα-формил-гистидин, α-фторметил-гистидин, α-метил-гистидин, 3-пиридилаланин, 2-пиридилаланин или 4-пиридилаланин;
Хаа8 представляет собой Ala, Gly, Val, Leu, Ile, Thr, Ser, Lys, Aib, (1-аминоциклопропил)карбоновую кислоту, (1-аминоциклобутил)карбоновую кислоту, (1-аминоциклопентил)карбоновую кислоту, (1-аминоциклогексил)карбоновую кислоту, (1-аминоциклогептил)карбоновую кислоту или (1-аминоциклооктил)карбоновую кислоту;
Xaa12 представляет собой Lys или Phe;
Xaa16 представляет собой Val или Leu;
Xaa18 представляет собой Ser, Arg, Asn, Gln или Glu;
Хаа19 представляет собой Tyr или Gln;
Хаа20 представляет собой Leu, Lys или Met;
Хаа22 представляет собой Gly, Glu, Lys или Aib;
Хаа23 представляет собой Gln, Glu или Arg;
Хаа24 представляет собой Ala или Lys;
Хаа25 представляет собой Ala или Val;
Хаа26 представляет собой Val, His или Arg;
Хаа30 представляет собой Ala, Glu или Arg;
Хаа31 представляет собой Trp или His;
Хаа34 представляет собой Glu, Asn, Gly, Gln или Arg;
Хаа35 представляет собой Gly, Aib или отсутствует;
Хаа36 представляет собой Arg, Gly, Lys или отсутствует;
Хаа37 представляет собой Gly, Ala, Glu, Pro, Lys, Arg или отсутствует;
Хаа38 представляет собой Ser, Gly, Ala, Glu, Gln, Pro, Arg или отсутствует; и
Хаа39 представляет собой Gly или отсутствует.
163. Производное по воплощению 162, где аналог представляет собой аналог GLP-1 формулы I.
164. Производное по любому из воплощений 162-163, где пептид формулы I представляет собой аналог GLP-1 (7-37) (SEQ ID №1).
165. Производное по любому из воплощений 162-164, где если Хаа38 отсутствует, то Хаа39 также отсутствует.
166. Производное по любому из воплощений 162-165, где если Хаа37 отсутствует, то Хаа38 и Хаа39 также отсутствуют.
167. Производное по любому из воплощений 162-166, где если Хаа36 отсутствует, то Хаа37, Хаа38 и Хаа39 также отсутствует.
168. Производное по любому из воплощений 162-167, где если Хаа35 отсутствует, то Хаа36, Хаа37, Хаа38 и Хаа39 также отсутствуют.
169. Производное по любому из воплощений 162-168, где Хаа7 представляет собой His; Xaa8 представляет собой Ala или Aib; Xaa12 представляет собой Lys или Phe; Xaa16 представляет собой Val; Xaa18 представляет собой Ser; Хаа19 представляет собой Tyr; Хаа20 представляет собой Leu или Lys; Хаа22 представляет собой Glu, Gly или Lys; Хаа23 представляет собой Gln или Glu; Xaa24 представляет собой Ala или Lys; Хаа25 представляет собой Ala или Val; Хаа26 представляет собой His или Arg; Хаа30 представляет собой Ala или Glu; Xaa31 представляет собой Trp или His; Хаа34 представляет собой Gly, Gln, или Arg; Хаа35 представляет собой Gly или отсутствует; Хаа36 представляет собой Arg, Lys или отсутствует; Хаа37 представляет собой Gly, Lys или отсутствует; Хаа38 представляет собой Glu или Gln; а Хаа39 представляет собой Gly или отсутствует.
170. Производное по любому из воплощений 162-169, где Хаа7 представляет собой His.
171. Производное по любому из воплощений 162-170, где Хаа8 представляет собой Ala.
172. Производное по любому из воплощений 162-170, где Xaa8 представляет собой Aib.
173. Производное по любому из воплощений 162-172, где Xaa12 представляет собой Lys.
174. Производное по любому из воплощений 162-172, где Хаа12 представляет собой Phe.
175. Производное по любому из воплощений 162-174, где Xaa16 представляет собой Val.
176. Производное по любому из воплощений 162-175, где Xaa18 представляет собой Ser.
177. Производное по любому из воплощений 162-176, где Хаа19 представляет собой Tyr.
178. Производное по любому из воплощений 162-177, где Хаа20 представляет собой Leu.
179. Производное по любому из воплощений 162-177, где Хаа20 представляет собой Lys.
180. Производное по любому из воплощений 162-179, где Хаа22 представляет собой Glu.
181. Производное по любому из воплощений 162-179, где Xaa22 представляет собой Gly.
182. Производное по любому из воплощений 162-179, где Xaa22 представляет собой Lys.
183. Производное по любому из воплощений 162-182, где Хаа23 представляет собой Gln.
184. Производное по любому из воплощений 162-182, где Хаа23 представляет собой Glu.
185. Производное по любому из воплощений 162-184, где Xaa24 представляет собой Ala.
186. Производное по любому из воплощений 162-184, где Хаа24 представляет собой Lys.
187. Производное по любому из воплощений 162-186, где Хаа25 представляет собой Ala.
188. Производное по любому из воплощений 162-186, где Xaa25 представляет собой Val.
189. Производное по любому из воплощений 162-188, где Xaa26 представляет собой His.
190. Производное по любому из воплощений 162-188, где Xaa26 представляет собой Arg.
191. Производное по любому из воплощений 162-190, где Хаа30 представляет собой Ala.
192. Производное по любому из воплощений 162-190, где Хаа30 представляет собой Glu.
193. Производное по любому из воплощений 162-192, где Хаа31 представляет собой Trp.
194. Производное по любому из воплощений 162-192, где Хаа31 представляет собой His.
195. Производное по любому из воплощений 162-194, где Хаа34 представляет собой Gly.
196. Производное по любому из воплощений 162-194, где Хаа34 представляет собой Gln.
197. Производное по любому из воплощений 162-194, где Хаа34 представляет собой Arg.
198. Производное по любому из воплощений 162-197, где Хаа35 представляет собой Gly.
199. Производное по любому из воплощений 162-198, где Хаа35 отсутствует.
200. Производное по любому из воплощений 162-199, где Хаа36 представляет собой Arg.
201. Производное по любому из воплощений 162-199, где Хаа36 представляет собой Lys.
202. Производное по любому из воплощений 162-199, где Хаа36 отсутствует.
203. Производное по любому из воплощений 162-202, где Хаа37 представляет собой Gly.
204. Производное по любому из воплощений 162-202, где Хаа37 представляет собой Lys.
205. Производное по любому из воплощений 162-202, где Хаа37 отсутствует.
206. Производное по любому из воплощений 162-205, где Хаа38 представляет собой Glu.
207. Производное по любому из воплощений 162-205, где Хаа38 представляет собой Gln.
208. Производное по любому из воплощений 162-205, где Хаа38 отсутствует.
209. Производное по любому из воплощений 162-208, где Хаа39 представляет собой Gly.
210. Производное по любому из воплощений 162-208, где Хаа39 отсутствует.
211. Производное по любому из воплощений 1-210, где аналог содержит следующие аминокислотные замены по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 22Е, 26R, 27К, 34R, 37К; (ii) 22E, 26R, 27K, 30Е, 34R, 36К, 38Е, 39G; (iii) 22E, 26R, 27К, 34R, 36К, des37; (iv) 22E, 25V, 26R, 27K, 34R, 37К; (v) 8Aib, 20K, 22E, 26R, 27K, 30Е, 34G, des35-37; (vi) 26R, 27K, 30Е, 34R, 36К, 38Е; (vii) 8Aib, 22K, 25V, 26R, 27K, 31H, 34R; (iix) 8Aib, 22K, 25V, 26R, 27K, 34R, des35-37; (ix) 8Aib, 22K, 25V, 26R, 27K, 34R, des36-37; (x) 26H, 27K, 30Е, 34R, 36К, 38Е; (xi) 22K, 25V, 26R, 27K, 30Е, 34Q; (xii) 25V, 26R, 27K, 30Е, 34R, 36К, 38Q; (xiii) 25V, 26R, 27K, 30Е, 34Q, 36К, 38Е; (xiv) 22K, 26R, 27K, 31H, 34G, des35-37; (xv) 8Aib, 25V, 26R, 27K, 31H, 34Q, 37К; (xvi) 25V, 26R, 27K, 31H, 34Q, 37К; (xvii) 22E, 23E, 25V, 26R, 27K, 31H, 34Q, 37К; (iixx) 8Aib, 12K, 22E, 26R, 27K, 31H, 34Q; (ixx) 8Aib, 22K, 26R, 27K, 31H, 34G, des35-37; (xx) 22E, 26H, 27K, 30Е, 34R, 36К, 38Е; (xxi) 22E, 24K, 26R, 27K, 31H, 34G, des35-37; (xxii) 25V, 26R, 27K, 34Q, 36K; (xxiii) 22E, 24K, 25V, 26R, 27K, 31H, 34R; (xxiv) 22E, 24K, 25V, 26R, 27K, 34G, des35-37; (xxv) 22E, 24K, 25V, 26R, 27K, 34R; (xxvi) 8Aib, 22E, 24K, 25V, 26R, 27K, 31H, 34Q; или (xxvii) 8Aib, 22E, 26R, 27K, 30Е, 34R, 36K, 38E, 39G.
212. Производное по воплощению 211, где аналог содержит ряд аминокислотных замен, определенных в любом из пп.(i)-(xxvii).
213. Соединение, выбранное среди следующих: Соед. 50, Соед. 51, Соед. 52, Соед. 53, Соед. 54, Соед. 55, Соед. 56, Соед. 57, Соед. 58, Соед. 59, Соед. 60, Соед. 61, Соед. 62, Соед. 63, Соед. 64, Соед. 65, Соед. 66, Соед. 67, Соед. 68, Соед. 69, Соед. 70, Соед. 71, Соед. 72, Соед. 73, Соед. 74, Соед. 75, Соед. 76, Соед. 77, Соед. 78, Соед. 79, Соед. 80 и Соед. 81; или его фармацевтически примелемая соль, амид или сложный эфир.
214. Соединение по воплощению 213, которое представляет собой соединение по любому из воплощений 1-212.
215. Соединение, характеризующееся его названием и выбранное из списка каждого из названий соединений примеров 1-32, или его фармацевтически приемлемая соль, амид или сложный эфир.
216. Соединение по воплощению 215, которое представляет собой соединение по любому из воплощений 1-214.
217. Производное по любому из воплощений 1-216, которое обладает активностью GLP-1.
218. Производное по воплощению 217, где активность GLP-1 относится к способности активировать человеческий рецептор GLP-1.
219. Производное по воплощению 217, где активация человеческого рецептора GLP-1 измеряется в анализе in vitro.
220. Производное по любому из воплощений 217-219, где активация человеческого рецептора GLP-1 измеряется как сила продукции цАМФ.
221. Производное по любому из воплощений 217-220, которое имеет активность, соответствующую EC50
a) менее 10000 пМ, более предпочтительно менее 5000 пМ, еще более предпочтительно менее 4000 пМ или, наиболее предпочтительно, менее 3000 пМ;
b) менее 2000 пМ, предпочтительно менее 1500 пМ, более предпочтительно менее 1200 пМ, еще более предпочтительно менее 1000 пМ или, наиболее предпочтительно, менее 500 пМ;
c) менее 400 пМ, предпочтительно менее 300 пМ, более предпочтительно менее 200 пМ, еще более предпочтительно менее 150 пМ или, наиболее предпочтительно, менее 100 пМ; или
d) менее 80 пМ, предпочтительно менее 60 пМ, более предпочтительно менее 40 пМ, еще более предпочтительно менее 30 пМ или, наиболее предпочтительно, менее 20 пМ.
222. Производное по любому из воплощений 217-221, где сила определяется как ЕС50 для кривой «доза-реакция», показывающей дозозависимое образование цАМФ в среде, содержащей человеческий рецептор GLP-1.
223. Производное по любому из воплощений 219-222, где подходящей трансфицированной клеточной линией является такая как ВНК467-12А (tk-ts13).
224. Производное по любому из воплощений 219-223, где для определения цАМФ используется функциональный рецепторный анализ.
225. Производное по любому из воплощений 219-224, где анализ основан на конкуренции между эндогенно образованным цАМФ и экзогенно добавленным биотин-меченым цАМФ.
226. Производное по любому из воплощений 219-225, где анализируемую цАМФ более предпочтительно захватывают с помощью специфического антитела.
227. Производное по любому из воплощений 219-226, где анализ представляет собой AlphaScreen cAMP Assay.
228. Производное по любому из воплощений 219-227, где анализ описан в примере 33.
229. Производное по любому из воплощений 217-228, где активация человеческого рецептора GLP-1 измеряется как способность связываться с рецептором в присутствии низкой концентрации альбумина, где низкая концентрация альбумина составляет 0,005% HSA или, предпочтительно, 0,001% HSA.
230. Производное по любому из воплощений 217-229, для которого отношение [аффинности связывания рецептора GLP-1 (IC50) в присутствии 2,0% HSA (высокий альбумин) и аффинности связывания рецептора GLP-1 (IC50) в присутствии 0,001% HSA (низкий альбумин)] составляет:
а) по меньшей мере 1,0, более предпочтительно по меньшей мере 10, еще более предпочтительно по меньшей мере 25 или, наиболее предпочтительно, по меньшей мере 50;
б) по меньшей мере 60, более предпочтительно по меньшей мере 70, еще более предпочтительно по меньшей мере 80, еще более предпочтительно по меньшей мере 90 или, наиболее предпочтительно, по меньшей мере 100;
в) по меньшей мере 125, предпочтительно по меньшей мере 150, более предпочтительно по меньшей мере 200, еще более предпочтительно по меньшей мере 250, еще более предпочтительно по меньшей мере 400, или, наиболее предпочтительно, по меньшей мере 500; или
г) по меньшей мере 600, предпочтительно по меньшей мере 800, еще более предпочтительно по меньшей мере 900 или, наиболее предпочтительно, по меньшей мере 1000.
231. Производное по любому из воплощений 217-230, для которого аффинность связывания с рецептором GLP-1 (IC50) в присутствии 0,001% HSA (низкий альбумин) составляет
a) менее 1000 нМ, предпочтительно менее 750 нМ, более предпочтительно менее 500 нМ, или наиболее предпочтительно менее 400 нМ; или
b) менее 300 нМ, предпочтительно менее 250 нМ, более предпочтительно менее 200 нМ, или наиболее предпочтительно менее 100 нМ; или
c) менее 50,0 нМ, предпочтительно менее 15,0 нМ, более предпочтительно менее 10,0 нМ, еще более предпочтительно менее 5,0 нМ, или наиболее предпочтительно менее 1,0 нМ
d) менее 0,80 нМ, предпочтительно менее 0,60 нМ, более предпочтительно менее 0,40 нМ, еще более предпочтительно менее 0,30 нМ или, наиболее предпочтительно, менее 0,20 нМ.
232. Производное по воплощениям 217-231, для которого аффинность связывания с рецептором GLP-1 (IC50) в присутствии 2,0% HSA (высокий альбумин) составляет
a) менее 1000 нМ, более предпочтительно менее 900 нМ, наиболее предпочтительно менее 800 нМ; или
b) менее 500 нМ, предпочтительно менее 400 нМ, более предпочтительно менее 300 нМ, еще более предпочтительно менее 150 нМ или, наиболее предпочтительно, менее 50,0 нМ.
166. Производное по любому из воплощений 217-232, где аффинность связывания с рецептором GLP-1 измеряется путем вытеснения 125I-GLP-1 из рецептора.
233. Производное по любому из воплощений 217-232, где используется SPA-связывающий анализ.
234. Производное по любому из воплощений 217-233, где рецептор GLP-1 получают с помощью подходящей трансфицированной клеточной линии.
235. Производное по любому из воплощений 217-234, где используется клеточная линия хомяка, предпочтительно клеточная линия почки детеныша хомяка, такая как ВНК tk-ts13.
236. Производное по любому из воплощений 229-235, где значение IC50 определяется как концентрация, которая вытесняет 50% 125I-GLP-1 из рецептора.
237. Производное по любому из воплощений 1-236, которое имеет пероральную биодоступность, предпочтительно абсолютную пероральную биодоступность, которая выше, чем у семаглутида.
238. Производное по воплощению 237, пероральную биодоступность которого измеряют in vivo у крыс.
239. Производное по любому из воплощений 237-239, где пероральную биодоступность измеряют как экспозицию в плазме после прямого введения в просвет кишечника.
240. Производное по любому из воплощений 237-239, для которого концентрация в плазме крови (пМ) производного, определяемая через 30 минут после введения раствора производного в тощую кишку крысы, разделенная на концентрацию (мкМ) введенного раствора (экспозиция, скорректированная по дозе, на 30 минуте), составляет а) по меньшей мере 39, b) по меньшей мере 40, с) по меньшей мере 60; d) по меньшей мере 80; е) по меньшей мере 100; f) по меньшей мере 125; или g) по меньшей мере 150.
241. Производное по любому из воплощений 237-240, для которого концентрация в плазме крови (пМ) производного, определяемая через 30 минут после введения раствора производного в тощую кишку крысы, разделенная на концентрацию (мкМ) введенного раствора (экспозиция, скорректированная по дозе, на 30 минуте), составляет а) по меньшей мере 160, b) по меньшей мере 180, с) по меньшей мере 200, или d) по меньшей мере 250.
242. Производное по любому из воплощений 237-241, где производное GLP-1 испытывают в концентрации 1000 мкМ в смеси с 55 мг/мл капрата натрия.
243. Производное по любому из воплощений 237-242, где используют крыс Sprague Dawley мужского пола.
244. Производное по любому из воплощений 237-243, где крысы имеют массу тела по прибытии примерно 240 г.
245. Производное по любому из воплощений 237-244, где крыс лишают пищи примерно за 18 часов до начала эксперимента.
246. Производное по любому из воплощений 237-245, где крысам дают общую анестезию после периода голодания и до введения производного в тощую кишку.
247. Производное по любому из воплощений 237-246, где производное вводят в проксимальную часть тощей кишки (10 см дистальнее двенадцатиперстной кишки) или в среднюю часть кишки (50 см проксимальнее слепой кишки).
248. Производное по любому из воплощений 237-247, где 100 мкл производного вводят в просвет тощей кишки через катетер с помощью шприца, а затем в просвет тощей кишки выталкивают 200 мкл воздуха с помощью другого шприца, который затем оставляют подключенным к катетеру для предотвращения обратного тока в катетер.
249. Производное по любому из воплощений 237-248, где в пробирки с EDTA собирают образцы крови (200 мкл) из хвостовой вены через требуемые промежутки времени, например в моменты времени 0, 10, 30, 60, 120 и 240 минут, и центрифугируют 5 минут, 10000g, при 4°С в течение 20 минут.
250. Производное по любому из воплощений 237-249, где плазму (например, 75 мкл) отделяют, немедленно замораживают и хранят при температуре -20°С до анализа на концентрацию производного в плазме.
251. Производное по любому из воплощений 237-249, где для анализа концентрации производного в плазме используют LOCI (иммунологический анализ люминесценции кислородных каналов).
252. Производное по любому из воплощений 1-251, которое является эффективным в снижении уровня глюкозы в крови in vivo у мышей db/db.
253. Производное по любому из воплощений 1-252, которое является эффективным в снижении массы тела in vivo у мышей db/db.
254. Производное по любому из воплощений 252-253, где мышам db/db вводят подкожно соответствующий диапазон доз производного GLP-1 и через соответствующие промежутки времени определяют уровень глюкозы в крови и/или массу тела.
255. Производное по любому из воплощений 252-254, где доза производного GLP-1 составляет 0,3 нмоль/кг, 1,0 нмоль/кг, 3,0 нмоль/кг, 10 нмоль/кг, 30 нмоль/кг и 100 нмоль/кг, где кг относится к весу тела мыши.
256. Производное по любому из воплощений 252-255, где контрольной группе подкожно вводят носитель, предпочтительно в среде, в которой растворено производное GLP-1, например, со следующим составом: 50 мМ фосфат натрия, 145 мМ хлорид натрия, 0,05% Tween-80, pH 7,4.
257. Производное по любому из воплощений 252-256, где определяют уровень глюкозы в крови и/или взвешивают мышей в момент времени -½ ч (за полчаса до введения дозы (t=0)) и в моменты времени 1, 2, 4 и 8 часов.
258. Производное по любому из воплощений 252-257, где концентрацию глюкозы измеряют глюкозооксидазным способом.
259. Производное по любому из воплощений 252-258, где
(i) ED50 (массы тела (body weight, BW)) рассчитывается как доза, дающая повышение до половины максимального эффекта на дельта (например, уменьшение) BW через 8 часов после подкожного введения производного; и/или
(ii) ED50 (уровня глюкозы в крови (blood glucose, BG)) рассчитывается как доза, дающая повышение до половины максимального эффекта на AUC (площади под кривой) на дельта (например, уменьшение) BG через 8 часов и/или через 24 часа после подкожного введения производного.
260. Производное по любому из воплощений 252-259, где существует сигмоидальное взаимоотношение «доза-реакция», предпочтительно с четким определением максимальной реакции.
261. Производное по любому из воплощений 1-260, которое имеет более длительный профиль действия, чем лираглутид.
262. Производное по воплощению 261, где пролонгирование означает период полужизни in vivo у соответствующих видов животных.
263. Производное по любому из воплощений 261-262, где животное представляет собой а) db/db-мышь, b) крысу, с) свинью и/или d) мини-свинью.
264. Производное по воплощению 263, где животное представляет собой мини-свинью.
265. Производное по любому из воплощений 261-264, где производное вводят i) подкожно и/или ii) внутривенно.
266. Производное по любому из воплощений 1-265, где производное вводят внутривенно.
267. Производное по любому из воплощений 1-266, где конечный период полужизни (Т½) после внутривенного введения мини-свиньям составляет
а) по меньшей мере 12 часов, предпочтительно по меньшей мере 24 часа, более предпочтительно по меньшей мере 36 часов, еще более предпочтительно по меньшей мере 48 часов или, наиболее предпочтительно, по меньшей мере 60 часов;
б) по меньшей мере 7 часов, предпочтительно по меньшей мере 16 часов, более предпочтительно по меньшей мере 24 часа, более предпочтительно по меньшей мере 30 часов или, наиболее предпочтительно, по меньшей мере 40 часов;
в) по меньшей мере 50 часов, предпочтительно по меньшей мере 60 часов, более предпочтительно по меньшей мере 70 часов, еще более предпочтительно по меньшей мере 80 часов или, наиболее предпочтительно, по меньшей мере 90 часов.
268. Производное по любому из воплощений 264-267, где мини-свиньи являются геттингенскими мини-свиньями мужского пола.
269. Производное по любому из воплощений 267-269, где возраст мини-свиней составляет 7-14 месяцев.
270. Производное по любому из воплощений 267-269, где вес мини-свиней составляет 16-35 кг.
271. Производное по любому из воплощений 267-270, где мини-свиньи размещены отдельно друг от друга и получают корм один или два раза в день, предпочтительно с соблюдением диеты SDS для мини-свиней.
272. Производное по любому из воплощений 267-271, дозу которого вводят внутривенно по меньшей мере после двух недель акклиматизации.
273. Производное по любому из воплощений 267-272, где животных лишают пищи в течение примерно 18 часов перед введением дозы и в течение по меньшей мере 4 часов после введения дозы, и обеспечивают им свободный доступ к воде в течение всего периода.
274. Производное по любому из воплощений 267-273, где производное GLP-1 растворяют в растворе с 50 мМ фосфатом натрия, 145 мМ хлоридом натрия, 0,05% Tween-80, pH 7,4 до подходящей концентрации, предпочтительно 20-60 нмоль/мл.
275. Производное по любому из воплощений 267-275, где внутривенное введение производного осуществляют в объеме, соответствующем 1-2 нмоль/кг.
276. Производное по любому из воплощений 1-275, которое вызывает сниженное потребление корма у свиней.
277. Производное по воплощению 276, где потребление снижено по сравнению с контролем, предпочтительно с введением носителя или без введения чего-либо.
278. Производное по любому из воплощений 276-277, где
потребление корма (0-24 ч) составляет
а) 90% или менее по сравнению с контролем, которому вводили носитель; b) предпочтительно 80% или менее; с) более предпочтительно 70% или менее; d) еще более предпочтительно 60% или менее; или е) наиболее предпочтительно 50% или менее.
279. Производное по любому из воплощений 276-278, где потребление пищи (0-24 ч) относится к первым 24 часам после введения производного или носителя.
280. Производное по любому из воплощений 276-279, где свиньи являются свиньями Ландрас Йоркшир Дюрок (LYD) женского пола.
281. Производное по любому из воплощений 276-280, где возраст свиней составляет 3 месяца.
282. Производное по любому из воплощений 276-281, где вес свиней составляет 30-35 кг.
283. Производное по любому из воплощений 276-282, где животные помещены в группу на 1-2 недели для акклиматизации.
284. Производное по любому из воплощений 276-283, где в течение экспериментального периода животные помещены в индивидуальные загоны с утра понедельника до дневного времени в пятницу для измерения индивидуального потребления корма.
285. Производное по любому из воплощений 276-284, где животных кормят кормом для свиней (например, Svinefoder, Антонио) без ограничения количества.
286. Производное по любому из воплощений 276-285, где потребление корма контролируют путем записи веса корма каждые 15 минут, предпочтительно с использованием системы Mpigwin.
287. Производное по любому из воплощений 276-286, которое дозируют по 0,3, 1,0, 3,0, 10 или 30 нмоль/кг.
288. Производное по любому из воплощений 276-287, которое растворяют в фосфатном буфере (50 мМ фосфата, 145 мМ хлорида натрия, 0,05% Tween-80, рН 8), предпочтительно в концентрации 12, 40, 120, 400 или 1200 нмоль/мл.
289. Производное по любому из воплощений 276-288, где фосфатный буфер служит носителем.
290. Производное по любому из воплощений 276-289, где животным однократно подкожно вводят дозу производного или носителя (предпочтительно с объемом дозы 0,025 мл/кг) утром 1-го дня, а потребление корма измеряют в течение 4 дней после введения дозы.
291. Производное по любому из воплощений 1-290, которое имеет период полужизни (Т½) in vivo у крыс после внутривенного введения а) по меньшей мере 4 часа, b) по меньшей мере 6 часов, с) по меньшей мере 8 часов, или d) по меньшей мере 10 часов.
292. Производное по любому из воплощений 1-291, которое имеет период полужизни (Т½) in vivo у крыс после внутривенного введения а) по меньшей мере 12 часов, b) по меньшей мере 15 часов, с) по меньшей мере 18 часов, или d) по меньшей мере 20 часов.
293. Производное по любому из воплощений 1-292, которое имеет период полужизни (Т½) in vivo у крыс после внутривенного введения а) по меньшей мере 24 часа, b) по меньшей мере 26 часов, или с) по меньшей мере 30 часов.
294. Производное по любому из воплощений 291-294, где использовали крыс Sprague Dawley мужского пола с массой тела примерно 400 г.
294. Производное по любому из воплощений 238-294, для которого AUC скорректированной по дозе (т.е. разделенной на дозу вводимого производного в пМ) кривой экспозиции в плазме (т.е. концентрации в плазме в пМ в зависимости от времени) определяют в течение времени с 30 по 180 мин (т.е. результат указывается в (мин × пМ/пмоль) или просто в мин/л).
295. Производное по воплощению 294, где AUC скорректированной по дозе кривой экспозиции в плазме составляет
a) по меньшей мере 50, предпочтительно по меньшей мере 100 или, более предпочтительно, по меньшей мере 150 мин/л;
b) по меньшей мере 200, предпочтительно по меньшей мере 250, более предпочтительно по меньшей мере 300 или, наиболее предпочтительно, по меньшей мере 320 мин/л; или
c) по меньшей мере 1,5 раза, предпочтительно по меньшей мере 2 раза, более предпочтительно по меньшей мере 3 раза, или наиболее предпочтительно по меньшей мере 4 раза от соответствующего значения AUC для семаглутида.
296. Производное по любому из воплощений 1-295, где пероральная биодоступность измеряется in vivo у крыс как экспозиция в плазме после введения через желудочный зонд.
297. Производное по воплощению 296, для которого AUC скорректированной по дозе (т.е. разделенной на дозу вводимого производного в пМ) кривой экспозиции в плазме (т.е. концентрации в плазме в пМ в зависимости от времени) определяют в течение времени с 30 по 180 мин (т.е. результат указывается в (мин × пМ/пмоль) или просто в мин/л).
298. Производное по воплощению 297, где AUC скорректированной по дозе кривой экспозиции в плазме составляет
a) по меньшей мере 10, предпочтительно по меньшей мере 20 или, более предпочтительно, по меньшей мере 30 мин/л;
b) по меньшей мере 40, предпочтительно по меньшей мере 50, более предпочтительно по меньшей мере 60 или, наиболее предпочтительно, по меньшей мере 70 мин/л; или
c) по меньшей мере 1,5 раза, предпочтительно по меньшей мере 2 раза, более предпочтительно по меньшей мере 3 раза, или наиболее предпочтительно по меньшей мере 4 раза от соответствующего значения AUC для семаглутида.
299. Производное по любому из воплощений 294-298, где производное GLP-1 анализируют в концентрации примерно 1000 мМ в растворе 250 мг/мл натрия N-[8-(2-гидроксибензоил)амино]каприлата (SNAC).
300. Производное по любому из воплощений 294-299, где используют крыс Sprague Dawley мужского пола, предпочтительно с массой тела по прибытии примерно 240 г.
301. Производное по любому из воплощений 294-300, где крыс лишают пищи примерно за 18 часов до начала эксперимента.
302. Производное по любому из воплощений 294-301, где крысам дают общую анестезию после периода голодания и до введения производного в тощую кишку или через желудочный зонд, соответственно.
303. Производное по любому из воплощений 294-302, где производное вводят в проксимальную часть тощей кишки (10 см дистальнее двенадцатиперстной кишки) или в среднюю часть кишки (50 см проксимальнее слепой кишки), предпочтительно в проксимальную часть тощей кишки.
304. Производное по любому из воплощений 294-303, где 100 мкл производного вводят в просвет тощей кишки через катетер с помощью шприца объемом 1 мл, а затем в просвет тощей кишки выталкивают 200 мкл воздуха с помощью другого шприца, который затем оставляют подключенным к катетеру для предотвращения обратного тока в катетер.
305. Производное по любому из воплощений 294-304, где в пробирки с EDTA собирают образцы крови (200 мкл) из хвостовой вены через требуемые промежутки времени, например в моменты времени 0, 10, 30, 60, 120 и 240 минут, и центрифугируют 5 минут, 10000g, при 4°С в течение 20 минут.
306. Производное по любому из воплощений 294-305, где плазму (например, 75 мкл) отделяют, немедленно замораживают и хранят при температуре -20°С до анализа на концентрацию производного в плазме.
307. Производное по любому из воплощений 294-306, где для анализа концентрации производного в плазме используют LOCI (иммунологический анализ люминесценции кислородных каналов).
308. Промежуточный продукт в форме аналога GLP-1, который включает следующие модификации по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 38Q; и/или (ii) 39G; или его фармацевтически приемлемая соль, амид или сложный эфир.
309. Аналог GLP-1 по воплощению 308, который содержит (38Е, 39G).
310. Промежуточный продукт в форме аналога GLP-1, который включает следующие модификации по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 22E, 26R, 27К, 34R, 37К; (ii) 22E, 26R, 27K, 30Е, 34R, 36К, 38Е, 39G; (iii) 22E, 26R, 27К, 34R, 36К, des37; (iv) 22E, 25V, 26R, 27К, 34R, 37К; (v) 8Aib, 20K, 22E, 26R, 27К, 30Е, 34G, des35-37; (vi) 26R, 27К, 30Е, 34R, 36К, 38Е; (vii) 8Aib, 22K, 25V, 26R, 27К, 31H, 34R; (iix) 8Aib, 22K, 25V, 26R, 27К, 34R, des35-37; (ix) 8Aib, 22K, 25V, 26R, 27К, 34R, des36-37; (x) 26H, 27К, 30Е, 34R, 36К, 38Е; (xi) 22K, 25V, 26R, 27К, 30Е, 34Q; (xii) 25V, 26R, 27К, 30Е, 34R, 36К, 38Q; (xiii) 25V, 26R, 27К, 30Е, 34Q, 36К, 38Е; (xiv) 22K, 26R, 27К, 31H, 34G, des35-37; (xv) 8Aib, 25V, 26R, 27К, 31H, 34Q, 37К; (xvi) 25V, 26R, 27К, 31H, 34Q, 37К; (xvii) 22E, 23E, 25V, 26R, 27К, 31H, 34Q, 37К; (iixx) 8Aib, 12K, 22E, 26R, 27К, 31H, 34Q; (ixx) 8Aib, 22K, 26R, 27К, 31H, 34G, des35-37; (xx) 22E, 26H, 27К, 30Е, 34R, 36К, 38Е; (xxi) 22E, 24K, 26R, 27К, 31H, 34G, des35-37; (xxii) 25V, 26R, 27К, 34Q, 36К; (xxiii) 22E, 24K, 25V, 26R, 27К, 31H, 34R; (xxiv) 22E, 24K, 25V, 26R, 27К, 34G, des35-37; (xxv) 22E, 24K, 25V, 26R, 27К, 34R; (xxvi) 8Aib, 22E, 24K, 25V, 26R, 27К, 31H, 34Q; или (xxvii) 8Aib, 22E, 26R, 27К, 30Е, 34R, 36К, 38Е, 39G; или его фармацевтически приемлемая соль, амид или сложный эфир.
311. Аналог GLP по воплощению 310, который включает ряд аминокислотных замен, определенных в любом из пп.(i)-(xxvii).
312. Производное по любому из воплощений 1-307 для применения в качестве лекарственного средства.
313. Производное по любому из воплощений 1-307 для применения в лечении и/или профилактике всех форм сахарного диабета и связанных с ним заболеваний, таких как пищевые расстройства, сердечно-сосудистые заболевания, желудочно-кишечные заболевания, диабетические осложнения, критические заболевания и/или синдром поликистоза яичников; и/или для улучшения параметров липидного обмена, улучшения функционирования β-клеток и/или для отсрочки или предотвращения прогрессирования диабетического заболевания.
314. Способ лечения или профилактики всех форм сахарного диабета и связанных с ним заболеваний, таких как пищевые расстройства, сердечно-сосудистые заболевания, желудочно-кишечные заболевания, диабетические осложнения, критические заболевания и/или синдром поликистоза яичников; и/или для улучшения параметров липидного обмена, улучшения функционирования β-клеток и/или для отсрочки или предотвращения прогрессирования диабетического заболевания путем введения фармацевтически активного количества производного по любому из воплощений 1-307.
Ниже приведены дополнительные конкретные воплощения изобретения:
1. Производное аналога GLP-1,
где аналог содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1); второй остаток К в позиции, соответствующей позиции Т в GLP-1 (7-37), где Т представляет собой целое число в диапазоне 7-37 за исключением 18 и 27; и максимум десять аминокислотных замен по сравнению с GLP-1 (7-37); где первый остаток К обозначается как К27, а второй остаток К обозначается как KT;
где производное содержит две альбуминсвязывающие группировки, прикрепленные к К27 и KT, соответственно, где
альбуминсвязывающая группировка содержит пролонгирующую группировку, выбранную среди Соед. 1 и Соед. 2:
Соед. 1: НООС-(СН2)x-СО-*
Соед. 2: НООС-С6Н4-O-(СН2)y-СО-*
где x представляет собой целое число в диапазоне 6-18, а y представляет собой целое число в диапазоне 3-17;
при условии, что когда пролонгирующая группировка представляет собой Соед. 1, альбуминсвязывающая группировка также содержит линкер формулы Соед. 5:
Соед. 5:
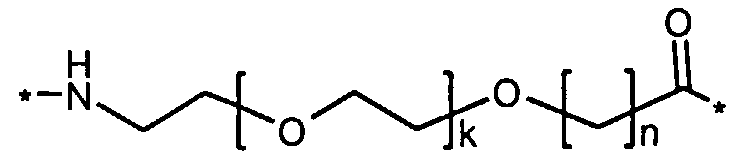
где k представляет собой целое число в диапазоне 1-5 и n представляет собой целое число в диапазоне 1-5;
или его фармацевтически приемлемая соль, амид или сложный эфир.
2. Производное по воплощению 1,
где аналог GLP-1 содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1); второй остаток К в позиции, соответствующей позиции Т в GLP-1 (7-37), где Т представляет собой целое число в диапазоне 7-37 за исключением 18 и 27; и максимум десять аминокислотных замен по сравнению с GLP-1 (7-37); где первый остаток К обозначается как К27, а второй остаток К обозначается как KT;
где производное содержит две альбуминсвязывающие группировки, прикрепленные к К27 и KT, соответственно, где
альбуминсвязывающая группировка содержит пролонгирующую группировку Соед. 2:
Соед. 2: НООС-С6Н4-O-(СН2)y-СО-*
где y представляет собой целое число в диапазоне 3-17;
или его фармацевтически приемлемая соль, амид или сложный эфир.
3. Производное по любому из предыдущих воплощений, где альбуминсвязывающая группировка также содержит линкер.
4. Производное по любому из предыдущих воплощений, где линкер содержит i) Glu-бирадикал; и/или ii) линкер формулы Соед. 5:
Соед. 5:
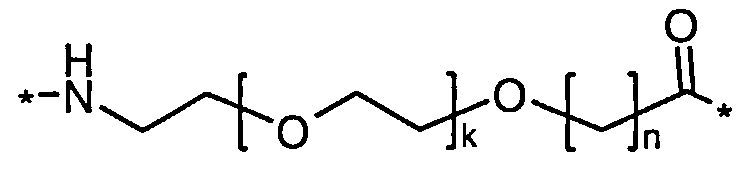
где k представляет собой целое число в диапазоне 1-5, и n представляет собой целое число в диапазоне 1-5.
5. Производное по любому из предыдущих воплощений, где Glu-бирадикал выбран среди Соед. 6 и/или Соед. 7:
Соед. 6:
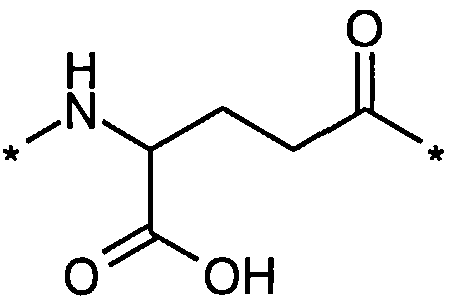
Соед. 7:
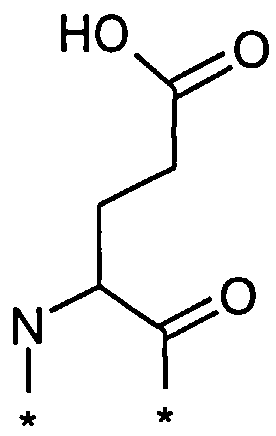 ;
;
предпочтительно Соед. 6.
6. Производное по любому из предыдущих воплощений,
где аналог GLP-1 содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1); второй остаток К в позиции, соответствующей позиции Т в GLP-1 (7-37), где Т представляет собой целое число в диапазоне 7-37 за исключением 18 и 27; и максимум десять аминокислотных замен по сравнению с GLP-1 (7-37); где первый остаток К обозначается как К27, а второй остаток К обозначается как KT;
где производное содержит две альбуминсвязывающие группировки, прикрепленные к К27 и KT, соответственно, где
альбуминсвязывающая группировка содержит
i) пролонгирующую группировку формулы Соед. 1:
Соед. 1: НООС-(СН2)x-СО-*
где x представляет собой целое число в диапазоне 6-18; и
ii) линкер формулы Соед. 5:
Соед. 5:
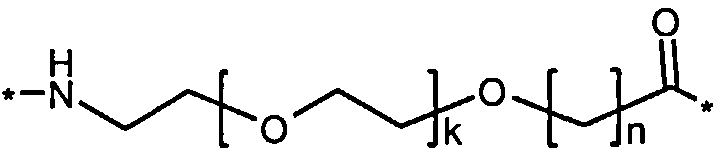 ,
,
где k представляет собой целое число в диапазоне 1-5 и n представляет собой целое число в диапазоне 1-5;
или его фармацевтически приемлемая соль, амид или сложный эфир.
7. Производное по любому из предыдущих воплощений,
где аналог GLP-1 содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1); второй остаток К в позиции, соответствующей позиции Т в GLP-1 (7-37), где Т представляет собой целое число в диапазоне 7-37 за исключением 18 и 27; и максимум десять аминокислотных замен по сравнению с GLP-1 (7-37); где первый остаток К обозначается как К27, а второй остаток К обозначается как KT;
где производное содержит две пролонгирующие группировки, присоединенные к К27 и KT, соответственно, через линкер, где
пролонгирующая группировка выбрана среди Соед. 1 и Соед. 2:
Соед. 1: НООС-(СН2)x-СО-*
Соед. 2: НООС-С6Н4-O-(СН2)y-СО-*
где x представляет собой целое число в диапазоне 6-18, y представляет собой целое число в диапазоне 3-17; и
линкер содержит Соед. 5:
Соед. 5:
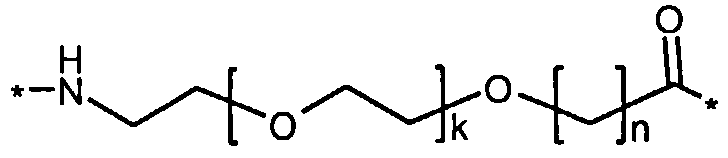 ,
,
где k представляет собой целое число в диапазоне 1-5 и n представляет собой целое число в диапазоне 1-5;
или его фармацевтически приемлемая соль, амид или сложный эфир.
8. Производное по любому из предыдущих воплощений, где Т представляет собой целое число, выбранное из диапазона 7-37 за исключением 18 и 27.
9. Производное по любому из предыдущих воплощений, где Т выбран из диапазона 7-17, 19-26 и 28-37.
10. Производное по любому из предыдущих воплощений, где Т выбран из диапазона 7-17.
11. Производное по любому из предыдущих воплощений, где Т составляет 12.
12. Производное по любому из предыдущих воплощений, где Т выбран из диапазона 19-26.
13. Производное по любому из предыдущих воплощений, где Т выбран из группы, состоящей из 20, 22 и 24.
14. Производное по любому из предыдущих воплощений, где Т составляет 20.
15. Производное по любому из предыдущих воплощений, где Т составляет 22 или 24.
16. Производное по любому из предыдущих воплощений, где Т составляет 22.
17. Производное по любому из предыдущих воплощений, где Т составляет 24.
18. Производное по любому из предыдущих воплощений, где Т выбран из диапазона 28-37.
19. Производное по любому из предыдущих воплощений, где Т выбран из группы, состоящей из 36 и 37.
20. Производное по любому из предыдущих воплощений, где Т составляет 36.
21. Производное по любому из предыдущих воплощений, где Т составляет 37.
22. Производное по любому из предыдущих воплощений, где позиция, соответствующая позиции 27 в GLP-1 (7-37) (SEQ ID №1), определена путем рукописной записи и визуального контроля.
23. Производное по любому из предыдущих воплощений, где позиция, соответствующая позиции Т в GLP-1 (7-37) (SEQ ID №1), определена путем рукописной записи и визуального контроля.
24. Производное по любому из предыдущих воплощений, где позиция, соответствующая позиции 27 в GLP-1 (7-37) (SEQ ID №1), определена путем применения стандартной программы выравнивания белков или пептидов.
25. Производное по любому из предыдущих воплощений, где позиция, соответствующая позиции Т в GLP-1 (7-37) (SEQ ID №1), определена путем применения стандартной программы выравнивания белков или пептидов.
26. Производное по любому из предыдущих воплощений, где программа для выравнивания представляет собой выравнивание по Нидлману-Вуншу.
27. Производное по любому из предыдущих воплощений, где используется матрица весов выравнивания по умолчанию и матрица идентичности по умолчанию.
28. Производное по любому из предыдущих воплощений, где матрица весов выравнивания представляет собой BLOSUM62.
29. Производное по любому из предыдущих воплощений, где штраф на первый остаток в делеции составляет -10 (минус десять).
30. Производное по любому из предыдущих воплощений, где штраф на дополнительные остатки в делеции составляет -0,5 (минус ноль целых пять десятых).
31. Производное по любому из предыдущих воплощений, где аналог не содержит остатки К, кроме первого и второго остатков К.
32. Производное по любому из предыдущих воплощений, где пролонгирующая группировка представляет собой Соед. 1.
33. Производное по любому из предыдущих воплощений, где x представляет собой четное число.
34. Производное по любому из предыдущих воплощений, где x составляет 12.
35. Производное по любому из предыдущих воплощений, где Соед. 1 представлено Соед. 1а:
Соед. 1а:
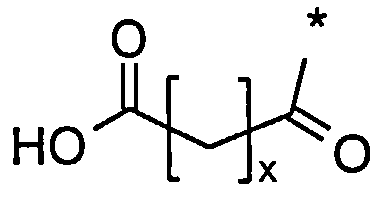 ,
,
где x определяется по любому из предыдущих воплощений.
36. Производное по любому из предыдущих воплощений, где пролонгирующая группировка представляет собой Соед. 2, предпочтительно Соед. 2а:
Соед. 2а:
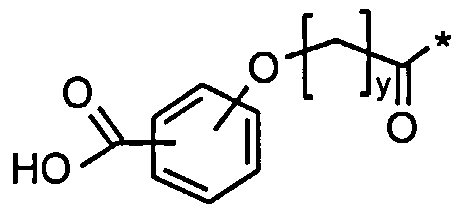
где y определяется по любому из предыдущих воплощений.
37. Производное по любому из предыдущих воплощений, где y представляет собой нечетное число.
38. Производное по любому из предыдущих воплощений, где y составляет 9.
39. Производное по любому из предыдущих воплощений, где Соед. 2 представлено Соед. 2b или Соед. 2с:
Соед. 2b:
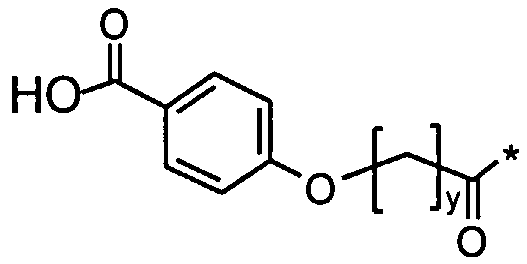
Соед. 2с:
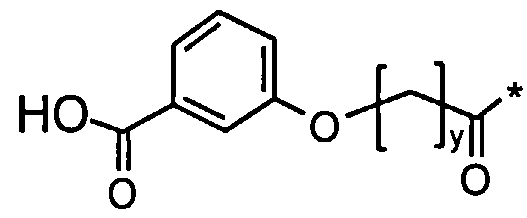 ;
;
предпочтительно Соед. 2b;
где y определяется по любому из предыдущих воплощений.
39а. Производное по любому из предыдущих воплощений, где Соед. 2а представлено Соед. 2b или Соед. 2с:
Соед. 2b:
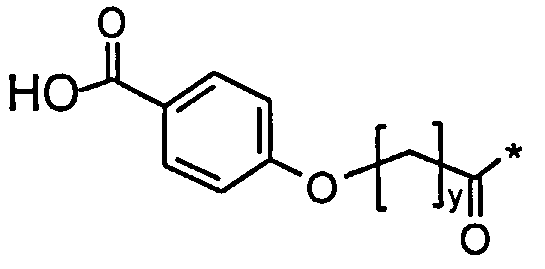
Соед. 2с:
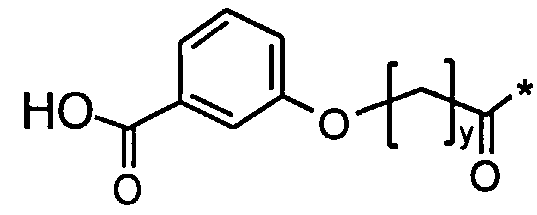 ;
;
предпочтительно Соед. 2b;
где y определяется по любому из предыдущих воплощений.
40. Производное по любому из предыдущих воплощений, которое содержит Соед. 5.
41. Производное по любому из предыдущих воплощений, где Соед. 5 представляет собой первый линкерный элемент.
42. Производное по любому из предыдущих воплощений, где k составляет 1.
43. Производное по любому из предыдущих воплощений, где n составляет 1.
44. Производное по любому из предыдущих воплощений, где Соед. 5 включено m раз, где m представляет собой целое число в диапазоне 1-10.
45. Производное по любому из предыдущих воплощений, где m составляет 2.
46. Производное по любому из предыдущих воплощений, где если m не является 1, то элементы Соед. 5 связаны через амидный мостик(и).
47. Производное по любому из предыдущих воплощений, где линкер также содержит второй линкерный элемент; предпочтительно Glu-бирадикал; более предпочтительно выбран среди Соед. 6 и/или Соед. 7:
Соед. 6:
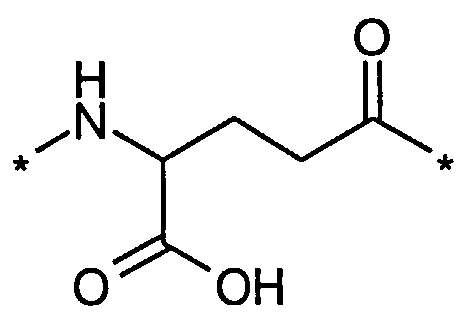
Соед. 7:
 ;
;
наиболее предпочтительно Соед. 6.
48. Производное по любому из предыдущих воплощений, где Glu-бирадикал включен p раз, где p представляет собой целое число в диапазоне 1-2.
49. Производное по любому из предыдущих воплощений, где p составляет 1.
50. Производное по любому из предыдущих воплощений, где p составляет 2.
51. Производное по любому из предыдущих воплощений, где Glu-бирадикал представляет собой радикал L-Glu.
52. Производное по любому из предыдущих воплощений, где один или более чем один Glu-бирадикал и один или более чем один элемент Соед. 5 связаны через амидный мостик(и).
53. Производное по любому из предыдущих воплощений, где линкер содержит m раз Соед. 5 и p раз Glu-бирадикал.
54. Производное по любому из предыдущих воплощений, где (m,p) составляют (2,2) или (2,1), предпочтительно (2,1).
55. Производное по предыдущим воплощениям, где m элементов Соед. 5 и p Glu-бирадикалов связаны через амидные мостики.
56. Производное по любому из предыдущих воплощений, где линкер и пролонгирующая группировка связаны через амидный мостик.
57. Производное по любому из предыдущих воплощений, где линкер и аналог GLP-1 связаны через амидный мостик.
58. Производное по любому из предыдущих воплощений, где линкер присоединен к эпсилон-аминогруппе первого и второго К-остатка.
59. Производное по любому из предыдущих воплощений, где линкер содержит от 5 до 41 С-атома; предпочтительно 17 или 22 С-атома.
60. Производное по любому из предыдущих воплощений, где линкер содержит 17 С-атомов.
61. Производное по любому из предыдущих воплощений, где линкер содержит 22 С-атома.
62. Производное по предыдущим воплощениям, где линкер содержит от 4 до 28 гетороатомов; предпочтительно 12 или 16 гетороатомов.
63. Производное по любому из предыдущих воплощений, где линкер содержит 12 гетороатомов.
64. Производное по любому из предыдущих воплощений, где линкер содержит 16 гетороатомов.
65. Производное по любому из предыдущих воплощений, где гетероатомы представляют собой N- и/или O-атомы.
66. Производное по любому из предыдущих воплощений, где линкер содержит от 1 до 7 N-атомов; предпочтительно 3 или 4 N-атома.
67. Производное по любому из предыдущих воплощений, где линкер содержит 3 N-атома.
68. Производное по любому из предыдущих воплощений, где линкер содержит 4 N-атома.
69. Производное по любому из предыдущих воплощений, где линкер содержит от 3 до 21 O-атома; предпочтительно 9 или 12 O-атомов.
70. Производное по любому из предыдущих воплощений, где линкер содержит 9 O-атомов.
71. Производное по любому из предыдущих воплощений, где линкер содержит 12 O-атомов.
72. Производное по любому из предыдущих воплощений, где линкер содержит два раза Соед. 6 и три раза Соед. 5, связанные через амидные мостики и в указанной последовательности, при этом линкер связан на его *-NH-конце с *-СО-концом пролонгирующей группировки, и на его *-СО-конце с эпсилон-аминогруппой К27 или KT аналога GLP-1.
73. Производное по любому из предыдущих воплощений, где линкер содержит два раза Соед. 5 и один раз Соед. 6, связанные через амидные мостики и в указанной последовательности, при этом линкер связан на его *-NH-конце с *-СО-концом пролонгирующей группировки, и на его свободном *-СО-конце с эпсилон-аминогруппой К27 или KT аналога GLP-1.
74. Производное по любому из предыдущих воплощений, где линкер содержит один раз Соед. 6 и три раза Соед. 5, связанные через амидные мостики и в указанной последовательности, при этом линкер связан на его *-NH-конце с *-СО-концом пролонгирующей группировки, и на его *-СО-конце с эпсилон-аминогруппой К27 или KT аналога GLP-1.
75. Производное по любому из предыдущих воплощений, где линкер содержит один раз Соед. 6, два раза Соед. 5 и один раз Соед. 6, связанные через амидные мостики и в указанной последовательности, при этом линкер связан на его *-NH-конце с *-СО-концом пролонгирующей группировки, и на его *-СО-конце с эпсилон-аминогруппой К27 или KT аналога GLP-1.
76. Производное по любому из предыдущих воплощений, где две пролонгирующие группировки по существу идентичны; например по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентичны.
77. Производное по любому из предыдущих воплощений, где две пролонгирующие группировки имеют сходство по меньшей мере 0,5; предпочтительно по меньшей мере 0,6; более предпочтительно по меньшей мере 0,7 или по меньшей мере 0,8; еще более предпочтительно по меньшей мере 0,9; или, наиболее предпочтительно, по меньшей мере 0,99, например, сходство 1,0.
78. Производное по любому из предыдущих воплощений, где два линкера имеют сходство по меньшей мере 0,5; предпочтительно по меньшей мере 0,6; более предпочтительно по меньшей мере 0,7 или по меньшей мере 0,8; еще более предпочтительно по меньшей мере 0,9; или наиболее предпочтительно по меньшей мере 0,99, например, сходство 1,0.
79. Производное по любому из предыдущих воплощений, где две альбуминсвязывающие группировки, такие как две боковые цепи, содержащие пролонгирующую группировку и линкер, по существу идентичны; например по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 99% идентичны.
80. Производное по любому из предыдущих воплощений, где две альбуминсвязывающие группировки, такие как две боковые цепи, содержащие пролонгирующую группировку и линкер, имеют сходство по меньшей мере 0,5; предпочтительно по меньшей мере 0,6; более предпочтительно по меньшей мере 0,7 или по меньшей мере 0,8; еще более предпочтительно по меньшей мере 0,9; или наиболее предпочтительно по меньшей мере 0,99, например сходство 1,0.
81. Производное по любому из предыдущих воплощений, где две сравниваемые химические структуры представлены в виде отпечатков пальцев, например а) отпечатков ECFP_6; б) отпечатков UNITY; и/или в) отпечатков MDL; и где для каждого из а), б) и в) для расчета сходства, или идентичности, двух отпечатков предпочтительно используется коэффициент Танимото.
82. Производное по любому из предыдущих воплощений, где число аминокислотных замен по сравнению с GLP-1 (7-37) (SEQ ID №1) определяют путем рукописной записи и визуального контроля.
83. Производное по любому из предыдущих воплощений, где число аминокислотных замен по сравнению с GLP-1 (7-37) (SEQ ID №1) определяют с использованием стандартной программы для выравнивания белков или пептидов.
84. Производное по любому из предыдущих воплощений, где программа для выравнивания представляет собой выравнивание по Нидлману-Вуншу.
85. Производное по любому из предыдущих воплощений, где используется матрица весов выравнивания по умолчанию и матрица идентичности по умолчанию.
86. Производное по любому из предыдущих воплощений, где указанная матрица весов выравнивания представляет собой BLOSUM62.
87. Производное по любому из предыдущих воплощений, где штраф на первый остаток в делеции составляет -10 (минус десять).
88. Производное по любому из предыдущих воплощений, где штраф на дополнительные остатки в делеции составляет -0,5 (минус ноль целых пять десятых).
89. Производное по любому из предыдущих воплощений, где аминокислотная замена(ы) имеется в одной или более чем одной позиции, соответствующей следующим позициям в GLP-1 (7-37) (SEQ ID №1): 8, 12, 20, 22, 23, 24, 25, 26, 27, 30, 31, 34, 35, 36, 37, 38 и 39.
90. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере одну из следующих замен: Aib8, К12, К20, Е22 или К22, Е23, К24, V25, R26 или Н26, К27, Е30, Н31, G34 или R34 или Q34, Des35, К36 или Des36, К37 или Des37, Е38 или Q38 и/или G39.
91. Производное по любому из предыдущих воплощений, где второй остаток представляет собой К12 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34 и Q34, и ii) замену, выбранную среди R26 и Н26.
92. Производное по любому из предыдущих воплощений, где второй остаток представляет собой К20 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34 и Q34, и ii) замену, выбранную среди R26 и Н26.
93. Производное по любому из предыдущих воплощений, где второй остаток представляет собой К22 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34 и Q34, и ii) замену, выбранную среди R26 и Н26.
94. Производное по любому из предыдущих воплощений, где второй остаток представляет собой К24 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34 и Q34, и ii) замену, выбранную среди R26 и Н26.
95. Производное по любому из предыдущих воплощений, где второй остаток представляет собой К36 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34 и Q34, и ii) замену, выбранную среди R26 и Н26.
96. Производное по любому из предыдущих воплощений, где второй остаток представляет собой К37 и где аналог, в дополнение к замене К27, также содержит i) замену, выбранную среди G34 и Q34, и ii) замену, выбранную среди R26 и Н26.
97. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере одну из следующих замен: Aib8, Е22, Е23, V25, Е30, Н31, Des35, Des36, Des37, Е38 или Q38 и/или G39.
98. Производное по любому из предыдущих воплощений, где аналог содержит Aib8.
99. Производное по любому из предыдущих воплощений, где аналог содержит Е22.
100. Производное по любому из предыдущих воплощений, где аналог содержит Е23.
101. Производное по любому из предыдущих воплощений, где аналог содержит V25.
102. Производное по любому из предыдущих воплощений, где аналог содержит Е30.
103. Производное по любому из предыдущих воплощений, где аналог содержит Н31.
104. Производное по любому из предыдущих воплощений, где аналог содержит Des35.
105. Производное по любому из предыдущих воплощений, где аналог содержит Des36.
106. Производное по любому из предыдущих воплощений, где аналог содержит Des37.
107. Производное по любому из предыдущих воплощений, где аналог содержит Е38 или Q38, предпочтительно Q38, или более предпочтительно Е38.
108. Производное по любому из предыдущих воплощений, где аналог содержит G39.
109. Производное по любому из предыдущих воплощений, где аналог содержит Des35, Des36 и Des37.
110. Производное по любому из предыдущих воплощений, где аналог содержит Des36 и Des37.
111. Производное по любому из предыдущих воплощений, которое представляет собой производное GLP-1 (7-34) (аминокислоты 1-28 из SEQ ID №1).
112. Производное по любому из предыдущих воплощений, которое представляет собой производное GLP-1 (7-35) (аминокислоты 1-29 из SEQ ID №1).
113. Производное по любому из предыдущих воплощений, которое представляет собой производное GLP-1 (7-36) (аминокислоты 1-30 из SEQ ID №1).
114. Производное по любому из предыдущих воплощений, которое представляет собой производное GLP-1 (7-37) (аминокислоты 1-31 из SEQ ID №1).
115. Производное по любому из предыдущих воплощений, которое представляет собой производное GLP-1 (7-38) (аминокислоты 1-31 из SEQ ID №1, плюс один добавленный с С-конца аминокислотный остаток).
116. Производное по любому из предыдущих воплощений, которое представляет собой производное GLP-1 (7-39) (аминокислоты 1-31 из SEQ ID №1, плюс два добавленных с С-конца аминокислотных остатка).
117. Производное по любому из предыдущих воплощений, где аналог содержит максимум десять аминокислотных замен.
118. Производное по любому из предыдущих воплощений, где аналог содержит максимум девять аминокислотных замен.
119. Производное по любому из предыдущих воплощений, где аналог содержит максимум восемь аминокислотных замен.
120. Производное по любому из предыдущих воплощений, где аналог содержит максимум семь аминокислотных замен.
121. Производное по любому из предыдущих воплощений, где аналог содержит максимум шесть аминокислотных замен.
122. Производное по любому из предыдущих воплощений, где аналог содержит максимум пять аминокислотных замен.
123. Производное по любому из предыдущих воплощений, где аналог содержит максимум четыре аминокислотные замены.
124. Производное по любому из предыдущих воплощений, где аналог содержит максимум три аминокислотные замены.
125. Производное по любому из предыдущих воплощений, где аналог содержит максимум две аминокислотные замены.
126. Производное по любому из предыдущих воплощений, где аналог содержит максимум одну аминокислотную замену.
127. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере одну аминокислотную замену.
128. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере две аминокислотные замены.
129. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере три аминокислотные замены.
130. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере четыре аминокислотные замены.
131. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере пять аминокислотных замен.
132. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере шесть аминокислотных замен.
133. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере семь аминокислотных замен.
134. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере восемь аминокислотных замен.
135. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере девять аминокислотных замен.
136. Производное по любому из предыдущих воплощений, где аналог содержит по меньшей мере десять аминокислотных замен.
137. Производное по любому из предыдущих воплощений, где аналог содержит одну аминокислотную замену.
138. Производное по любому из предыдущих воплощений, где аналог содержит две аминокислотные замены.
139. Производное по любому из предыдущих воплощений, где аналог содержит три аминокислотные замены.
140. Производное по любому из предыдущих воплощений, где аналог содержит четыре аминокислотные замены.
141. Производное по любому из предыдущих воплощений, где аналог содержит пять аминокислотных замен.
142. Производное по любому из предыдущих воплощений, где аналог содержит шесть аминокислотных замен.
143. Производное по любому из предыдущих воплощений, где аналог содержит семь аминокислотных замен.
144. Производное по любому из предыдущих воплощений, где аналог содержит восемь аминокислотных замен.
145. Производное по любому из предыдущих воплощений, где аналог содержит девять аминокислотных замен.
146. Производное по любому из предыдущих воплощений, где аналог содержит десять аминокислотных замен.
147. Производное по любому из предыдущих воплощений, где замена(ы) представляет(ют) собой, независимо, замещения, добавления и/или делеции.
148. Производное по любому из предыдущих воплощений, где аналог
а) содержит аналог GLP-1 формулы I; и/или b) представляет собой аналог GLP-1 формулы I:
Формула I: Xaa7-Xaa8-Glu-Gly-Thr-Xaa12-Thr-Ser-Asp-Xaa16-Ser-Xaa18-Xaa19-Xaa20-Glu-Xaa22-Xaa23-Xaa24-Xaa25-Xaa26-Lys-Phe-Ile-Xaa30-Xaa31-Leu-Val-Xaa34-Xaa35-Хаа36-Хаа37-Хаа38-Хаа39, где
Хаа7 представляет собой L-гистидин, имидазопропионил, α-гидрокси-гистидин, D-гистидин, дезамино-гистидин, 2-амино-гистидин, β-гидрокси-гистидин, гомогистидин, Nα-ацетил-гистидин, Nα-формил-гистидин, α-фторметил-гистидин, α-метил-гистидин, 3-пиридилаланин, 2-пиридилаланин или 4-пиридилаланин;
Хаа8 представляет собой Ala, Gly, Val, Leu, Ile, Thr, Ser, Lys, Aib, (1-аминоциклопропил)карбоновую кислоту, (1-аминоциклобутил)карбоновую кислоту, (1-аминоциклопентил)карбоновую кислоту, (1-аминоциклогексил)карбоновую кислоту, (1-аминоциклогептил)карбоновую кислоту или (1-аминоциклооктил)карбоновую кислоту;
Xaa12 представляет собой Lys или Phe;
Xaa16 представляет собой Val или Leu;
Xaa18 представляет собой Ser, Arg, Asn, Gln или Glu;
Xaa19 представляет собой Tyr или Gln;
Хаа20 представляет собой Leu, Lys или Met;
Хаа22 представляет собой Gly, Glu, Lys или Aib;
Хаа23 представляет собой Gln, Glu или Arg;
Хаа24 представляет собой Ala или Lys;
Хаа25 представляет собой Ala или Val;
Хаа26 представляет собой Val, His или Arg;
Хаа30 представляет собой Ala, Glu или Arg;
Хаа31 представляет собой Trp или His;
Хаа34 представляет собой Glu, Asn, Gly, Gln или Arg;
Хаа35 представляет собой Gly, Aib или отсутствует;
Хаа36 представляет собой Arg, Gly, Lys или отсутствует;
Хаа37 представляет собой Gly, Ala, Glu, Pro, Lys, Arg или отсутствует;
Хаа38 представляет собой Ser, Gly, Ala, Glu, Gln, Pro, Arg или отсутствует; и
Хаа39 представляет собой Gly или отсутствует.
149. Производное по любому из предыдущих воплощений, где пептид формулы I представляет собой аналог GLP-1 (7-37) (SEQ ID №1).
150. Производное по любому из предыдущих воплощений, где если Хаа38 отсутствует, то Хаа39 также отсутствует.
151. Производное по любому из предыдущих воплощений, где если Хаа37 отсутствует, то Хаа38 и Хаа39 также отсутствуют.
152. Производное по любому из предыдущих воплощений, где если Хаа36 отсутствует, то Хаа37, Хаа38 и Хаа39 также отсутствуют.
153. Производное по любому из предыдущих воплощений, где если Хаа35 отсутствует, то Хаа36, Хаа37, Хаа38 и Хаа39 также отсутствуют.
154. Производное по любому из предыдущих воплощений, где Хаа7 представляет собой His; Xaa8 представляет собой Ala или Aib; Xaa12 представляет собой Lys или Phe; Xaa16 представляет собой Val; Xaa18 представляет собой Ser; Хаа19 представляет собой Tyr; Хаа20 представляет собой Leu или Lys; Хаа22 представляет собой Glu, Gly или Lys; Хаа23 представляет собой Gln или Glu; Хаа24 представляет собой Ala или Lys; Хаа25 представляет собой Ala или Val; Хаа26 представляет собой His или Arg; Хаа30 представляет собой Ala или Glu; Хаа31 представляет собой Trp или His; Хаа34 представляет собой Gly, Gln, или Arg; Хаа35 представляет собой Gly или отсутствует; Хаа36 представляет собой Arg, Lys или отсутствует; Хаа37 представляет собой Gly, Lys или отсутствует; Хаа38 представляет собой Glu или Gln; и Хаа39 представляет собой Gly или отсутствует.
154а. Производное по любому из предыдущих воплощений, где Хаа7 представляет собой His.
154b. Производное по любому из предыдущих воплощений, где Хаа8 представляет собой Ala.
154b1. Производное по любому из предыдущих воплощений, где Хаа8 представляет собой Aib.
154с. Производное по любому из предыдущих воплощений, где Xaa12 представляет собой Lys.
154d. Производное по любому из предыдущих воплощений, где Xaa12 представляет собой Phe.
154е. Производное по любому из предыдущих воплощений, где Xaa16 представляет собой Val.
154f. Производное по любому из предыдущих воплощений, где Xaa18 представляет собой Ser.
154g. Производное по любому из предыдущих воплощений, где Хаа19 представляет собой Tyr.
154h. Производное по любому из предыдущих воплощений, где Хаа20 представляет собой Leu.
154i. Производное по любому из предыдущих воплощений, где Хаа20 представляет собой Lys.
154j. Производное по любому из предыдущих воплощений, где Хаа22 представляет собой Glu.
154k. Производное по любому из предыдущих воплощений, где Хаа22 представляет собой Gly.
154l. Производное по любому из предыдущих воплощений, где Хаа22 представляет собой Lys.
154m. Производное по любому из предыдущих воплощений, где Хаа23 представляет собой Gln.
154n. Производное по любому из предыдущих воплощений, где Хаа23 представляет собой Glu.
154о. Производное по любому из предыдущих воплощений, где Хаа24 представляет собой Ala.
154р. Производное по любому из предыдущих воплощений, где Хаа24 представляет собой Lys.
154q. Производное по любому из предыдущих воплощений, где Хаа25 представляет собой Ala.
154r. Производное по любому из предыдущих воплощений, где Хаа25 представляет собой Val.
154s. Производное по любому из предыдущих воплощений, где Хаа26 представляет собой His.
154t. Производное по любому из предыдущих воплощений, где Хаа26 представляет собой Arg.
154u. Производное по любому из предыдущих воплощений, где Хаа30 представляет собой Ala.
154v. Производное по любому из предыдущих воплощений, где Хаа30 представляет собой Glu.
154х. Производное по любому из предыдущих воплощений, где Xaa31 представляет собой Trp.
154y. Производное по любому из предыдущих воплощений, где Xaa31 представляет собой His.
154z. Производное по любому из предыдущих воплощений, где Хаа34 представляет собой Gly.
154аа. Производное по любому из предыдущих воплощений, где Хаа34 представляет собой Gln.
154ab. Производное по любому из предыдущих воплощений, где Хаа34 представляет собой Arg.
154ас. Производное по любому из предыдущих воплощений, где Хаа35 представляет собой Gly.
154ad. Производное по любому из предыдущих воплощений, где Xaa35 отсутствует.
154ае. Производное по любому из предыдущих воплощений, где Хаа36 представляет собой Arg.
154af. Производное по любому из предыдущих воплощений, где Хаа36 представляет собой Lys.
154ag. Производное по любому из предыдущих воплощений, где Хаа36 отсутствует.
154ah. Производное по любому из предыдущих воплощений, где Хаа37 представляет собой Gly.
154ai. Производное по любому из предыдущих воплощений, где Хаа37 представляет собой Lys.
154aj. Производное по любому из предыдущих воплощений, где Хаа37 отсутствует.
154ak. Производное по любому из предыдущих воплощений, где Xaa38 представляет собой Glu.
154al. Производное по любому из предыдущих воплощений, где Хаа38 представляет собой Gln.
154am. Производное по любому из предыдущих воплощений, где Хаа38 отсутствует.
154an. Производное по любому из предыдущих воплощений, где Хаа39 представляет собой Gly.
154ао. Производное по любому из предыдущих воплощений, где Хаа39 отсутствует.
155. Производное по любому из предыдущих воплощений, где аналог содержит, предпочтительно имеет, следующие аминокислотные замены по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 22E, 26R, 27К, 34R, 37К; (ii) 22E, 26R, 27K, 30Е, 34R, 36K, 38E, 39G; (iii) 22E, 26R, 27К, 34R, 36K, des37; (iv) 22E, 25V, 26R, 27К, 34R, 37К; (v) 8Aib, 20K, 22E, 26R, 27К, 30Е, 34G, des35-37; (vi) 26R, 27К, 30Е, 34R, 36K, 38E; (vii) 8Aib, 22K, 25V, 26R, 27К, 31H, 34R; (iix) 8Aib, 22K, 25V, 26R, 27К, 34R, des35-37; (ix) 8Aib, 22K, 25V, 26R, 27К, 34R, des36-37; (x) 26H, 27К, 30Е, 34R, 36K, 38E; (xi) 22K, 25V, 26R, 27К, 30Е, 34Q; (xii) 25V, 26R, 27К, 30Е, 34R, 36K, 38Q; (xiii) 25V, 26R, 27К, 30Е, 34Q, 36K, 38E; (xiv) 22K, 26R, 27К, 31H, 34G, des35-37; (xv) 8Aib, 25V, 26R, 27К, 31H, 34Q, 37К; (xvi) 25V, 26R, 27К, 31H, 34Q, 37К; (xvii) 22E, 23E, 25V, 26R, 27К, 31H, 34Q, 37К; (iixx) 8Aib, 12K, 22E, 26R, 27К, 31H, 34Q; (ixx) 8Aib, 22K, 26R, 27К, 31H, 34G, des35-37; (xx) 22E, 26H, 27К, 30Е, 34R, 36K, 38E; (xxi) 22E, 24K, 26R, 27К, 31H, 34G, des35-37; (xxii) 25V, 26R, 27К, 34Q, 36K; (xxiii) 22E, 24K, 25V, 26R, 27К, 31H, 34R; (xxiv) 22E, 24K, 25V, 26R, 27К, 34G, des35-37; (xxv) 22E, 24K, 25V, 26R, 27К, 34R; или (xxvi) 8Aib, 22E, 24K, 25V, 26R, 27К, 31H, 34Q.
156. Соединение, предпочтительно по любому из предыдущих воплощений, выбранное среди следующих: Соед. 50, Соед. 51, Соед. 52, Соед. 53, Соед. 54, Соед. 55, Соед. 56, Соед. 57, Соед. 58, Соед. 59, Соед. 60, Соед. 61, Соед. 62, Соед. 63, Соед. 64, Соед. 65, Соед. 66, Соед. 67, Соед. 68, Соед. 69, Соед. 70, Соед. 71, Соед. 72, Соед. 73, Соед. 74, Соед. 75, Соед. 76, Соед. 77, Соед. 78 и Соед. 79; или его фармацевтически приемлемая соль, амид или сложный эфир.
157. Соединение, предпочтительно по любому из предыдущих воплощений, характеризующееся его названием и выбранное из списка каждого из названий соединений примеров 1-30, приведенных здесь, или его фармацевтически приемлемая соль, амид или сложный эфир.
158. Производное по любому из предыдущих воплощений, которое обладает активностью GLP-1.
159. Производное по любому из предыдущих воплощений, где активность GLP-1 относится к способности активировать человеческий рецептор GLP-1.
160. Производное по любому из предыдущих воплощений, где активация человеческого рецептора GLP-1 измеряется в анализе in vitro как сила продукции цАМФ.
161. Производное по любому из предыдущих воплощений, которое имеет активность, соответствующую EC50
a) менее 10000 пМ, более предпочтительно менее 5000 пМ, еще более предпочтительно менее 4000 пМ или, наиболее предпочтительно, менее 3000 пМ;
b) менее 2000 пМ, предпочтительно менее 1500 пМ, более предпочтительно менее 1200 пМ, еще более предпочтительно менее 1000 пМ или, наиболее предпочтительно, менее 500 пМ;
c) менее 400 пМ, предпочтительно менее 300 пМ, более предпочтительно менее 200 пМ, еще более предпочтительно менее 150 пМ или, наиболее предпочтительно, менее 100 пМ; или
d) менее 80 пМ, предпочтительно менее 60 пМ, более предпочтительно менее 40 пМ, еще более предпочтительно менее 30 пМ или, наиболее предпочтительно, менее 20 пМ.
162. Производное по любому из предыдущих воплощений, где сила определяется как EC50 для кривой «доза-реакция», показывающей дозозависимое образование цАМФ в среде, содержащей человеческий рецептор GLP-1, предпочтительно с помощью подходящей трансфицированной клеточной линии, например ВНК467-12А (tk-ts13), и/или путем определения цАМФ с помощью функционального рецепторного анализа, например, основанного на конкуренции между эндогенно образованным цАМФ и экзогенно добавленным биотин-меченым цАМФ, где анализируемую цАМФ более предпочтительно захватывают с помощью специфического антитела, и/или где еще более предпочтительный анализ представляет собой AlphaScreen cAMP Assay, описанный в примере 31.
163. Производное по любому из предыдущих воплощений, для которого отношение [аффинности связывания рецептора GLP-1 (IC50) в присутствии 2,0% HSA (высокий альбумин) и аффинности связывания рецептора GLP-1 (IC50) в присутствии 0,005% HSA (низкий альбумин)] составляет:
a) по меньшей мере 1,0, более предпочтительно по меньшей мере 10, еще более предпочтительно по меньшей мере 25 или, наиболее предпочтительно, по меньшей мере 50;
b) по меньшей мере 60, более предпочтительно по меньшей мере 70, еще более предпочтительно по меньшей мере 80, еще более предпочтительно по меньшей мере 90 или, наиболее предпочтительно, по меньшей мере 100;
c) по меньшей мере 125, предпочтительно по меньшей мере 150, более предпочтительно по меньшей мере 200, еще более предпочтительно по меньшей мере 250, еще более предпочтительно по меньшей мере 400 или, наиболее предпочтительно, по меньшей мере 500; или
d) по меньшей мере 600, предпочтительно по меньшей мере 800, еще более предпочтительно по меньшей мере 900 или, наиболее предпочтительно, по меньшей мере 1000;
164. Производное по любому из предыдущих воплощений, для которого аффинность связывания с рецептором GLP-1 (IC50) в присутствии 0,005% HSA (низкий альбумин) составляет
a) менее 1000 нМ, предпочтительно менее 750 нМ, более предпочтительно менее 500 нМ или, наиболее предпочтительно, менее 100 нМ; или
b) менее 50,0 нМ, предпочтительно менее 15,0 нМ, более предпочтительно менее 10,0 нМ или, наиболее предпочтительно, менее 1,0 нМ.
165. Производное по любому из предыдущих воплощений, для которого аффинность связывания с рецептором GLP-1 (IC50) в присутствии 2,0% HSA (высокий альбумин) составляет
a) менее 1100 нМ, предпочтительно менее 1000 нМ, более предпочтительно менее 900 нМ или, наиболее предпочтительно, менее 600 нМ; или
b) менее 500 нМ, предпочтительно менее 350 нМ, более предпочтительно менее 200 нМ, еще более предпочтительно менее 100 нМ или, наиболее предпочтительно, менее 50,0 нМ.
166. Производное по любому из предыдущих воплощений, где аффинность связывания с рецептором GLP-1 измеряется путем замещения 125I-GLP-1 из рецептора, предпочтительно с помощью SPA-связывающего анализа.
167. Производное по любому из предыдущих воплощений, где рецептор GLP-1 получают с помощью подходящей трансфицированной клеточной линии, предпочтительно клеточной линии хомяка, более предпочтительно клеточной линии почки детеныша хомяка, например ВНК tk-ts13.
168. Производное по любому из предыдущих воплощений, где значение IC50 определяется как концентрация, которая вытесняет 50% 125I-GLP-1 из рецептора.
169. Производное по любому из предыдущих воплощений, которое имеет пероральную биодоступность, предпочтительно абсолютную пероральную биодоступность, которая выше, чем у семаглутида.
170. Производное по любому из предыдущих воплощений, пероральную биодоступность которого измеряют in vivo у крыс как экспозицию в плазме после прямого введения в просвет кишечника.
171. Производное по любому из предыдущих воплощений, для которого концентрация в плазме крови (пМ) производного, определяемая через 30 минут после введения раствора производного в тощую кишку крысы, разделенная на концентрацию (мкМ) введенного раствора (экспозиция, скорректированная по дозе, на 30 минуте), составляет по меньшей мере 39 или по меньшей мере 40; предпочтительно по меньшей мере 60; более предпочтительно по меньшей мере 80; еще более предпочтительно по меньшей мере 100; еще более предпочтительно по меньшей мере 125; или наиболее предпочтительно по меньшей мере 150.
172. Производное по любому из предыдущих воплощений, для которого концентрация в плазме крови (пМ) производного, определяемая через 30 минут после введения раствора производного в тощую кишку крысы, разделенная на концентрацию (мкМ) введенного раствора (экспозиция, скорректированная по дозе, на 30 минуте), составляет по меньшей мере 160, предпочтительно по меньшей мере 180, более предпочтительно по меньшей мере 200, или наиболее предпочтительно по меньшей мере 250.
173. Производное по любому из предыдущих воплощений, где производное GLP-1 испытывают в концентрации 1000 мкМ в смеси с 55 мг/мл капрата натрия.
174. Производное по любому из предыдущих воплощений, где используют крыс Sprague Dawley мужского пола, предпочтительно с массой тела по прибытии примерно 240 г.
175. Производное по любому из предыдущих воплощений, где крыс лишают пищи примерно за 18 часов до начала эксперимента.
176. Производное по любому из предыдущих воплощений, где крысам дают общую анестезию после периода голодания и до введения производного в тощую кишку.
177. Производное по любому из предыдущих воплощений, где производное вводят в проксимальную часть тощей кишки (10 см дистальнее двенадцатиперстной кишки) или в среднюю часть кишки (50 см проксимальнее слепой кишки).
178. Производное по любому из предыдущих воплощений, где 100 мкл производного вводят в просвет тощей кишки через катетер с помощью шприца, а затем в просвет тощей кишки выталкивают 200 мкл воздуха с помощью другого шприца, который затем оставляют подключенным к катетеру для предотвращения обратного тока в катетер.
179. Производное по любому из предыдущих воплощений, где в пробирки с EDTA собирают образцы крови (200 мкл) из хвостовой вены через требуемые промежутки времени, например в моменты времени 0, 10, 30, 60, 120 и 240 минут, и центрифугируют 5 минут, 10000g, при 4°С в течение 20 минут.
180. Производное по любому из предыдущих воплощений, где плазму (например, 75 мкл) отделяют, немедленно замораживают и хранят при температуре -20°С до анализа на концентрацию производного в плазме.
181. Производное по любому из предыдущих воплощений, где для анализа концентрации производного в плазме используют LOCI (иммунологический анализ люминесценции кислородных каналов).
182. Производное по любому из предыдущих воплощений, которое является эффективным в снижении уровня глюкозы в крови in vivo у мышей db/db.
183. Производное по любому из предыдущих воплощений, которое является эффективным в снижении массы тела in vivo у мышей db/db.
184. Производное по любому из предыдущих воплощений, где мышам db/db вводят подкожно соответствующий диапазон доз производного GLP-1 и через соответствующие промежутки времени определяют уровень глюкозы в крови и/или массу тела.
185. Производное по любому из предыдущих воплощений, где доза производного GLP-1 составляет 0,3 нмоль/кг, 1,0 нмоль/кг, 3,0 нмоль/кг, 10 нмоль/кг, 30 нмоль/кг и 100 нмоль/кг, где кг относится к весу тела мыши.
186. Производное по любому из предыдущих воплощений, где контрольной группе подкожно вводят носитель, предпочтительно в среде, в которой растворено производное GLP-1, например, со следующим составом: 50 мМ фосфат натрия, 145 мМ хлорид натрия, 0,05% Tween-80, pH 7,4.
187. Производное по любому из предыдущих воплощений, где определяют уровень глюкозы в крови и/или взвешивают мышей в момент времени -½ ч (за полчаса до введения дозы (t=0)) и в моменты времени 1, 2, 4 и 8 часов.
188. Производное по любому из предыдущих воплощений, где концентрацию глюкозы измеряют глюкозооксидазным способом.
189. Производное по любому из предыдущих воплощений, где
(i) ED50 (массы тела (BW)) рассчитывается как доза, дающая повышение до половины максимального эффекта на дельта (например, уменьшение) BW через 8 часов после подкожного введения производного; и/или
(ii) ED50 (уровня глюкозы в крови (BG)) рассчитывается как доза, дающая повышение до половины максимального эффекта на AUC (площади под кривой) на дельта (например, уменьшение) BG через 8 часов и/или через 24 часа после подкожного введения производного.
190. Производное по любому из предыдущих воплощений, где существует сигмоидальное взаимоотношение «доза-реакция», предпочтительно с четким определением максимальной реакции.
191. Производное по любому из предыдущих воплощений, которое имеет более длительный профиль действия, чем лираглутид.
192. Производное по любому из предыдущих воплощений, где пролонгирование означает период полужизни in vivo у соответствующих видов животных, например db/db-мыши, крысы, свиньи и/или, предпочтительно, мини-свиньи; где производное вводят i) подкожно и/или, предпочтительно, ii) внутривенно.
193. Производное по любому из предыдущих воплощений, где конечный период полужизни (Т½) после внутривенного введения мини-свиньям составляет
a) по меньшей мере 12 часов, предпочтительно по меньшей мере 24 часа, более предпочтительно по меньшей мере 36 часов, еще более предпочтительно по меньшей мере 48 часов или, наиболее предпочтительно, по меньшей мере 60 часов;
b) по меньшей мере 7 часов, предпочтительно по меньшей мере 16 часов, более предпочтительно по меньшей мере 24 часа, более предпочтительно по меньшей мере 30 часов или, наиболее предпочтительно, по меньшей мере 40 часов;
с) по меньшей мере 50 часов, предпочтительно по меньшей мере 60 часов, более предпочтительно по меньшей мере 70 часов, еще более предпочтительно по меньшей мере 80 часов или, наиболее предпочтительно, по меньшей мере 90 часов.
194. Производное по любому из предыдущих воплощений, где мини-свиньи являются геттингенскими мини-свиньями мужского пола.
195. Производное по любому из предыдущих воплощений, где возраст мини-свиней составляет 7-14 месяцев, а вес, предпочтительно, 16-35 кг.
196. Производное по любому из предыдущих воплощений, где мини-свиньи размещены отдельно друг от друга и получают корм один или два раза в день, предпочтительно с соблюдением диеты SDS для мини-свиней.
197. Производное по любому из предыдущих воплощений, дозу которого вводят внутривенно по меньшей мере после двух недель акклиматизации.
198. Производное по любому из предыдущих воплощений, где животных лишают пищи в течение примерно 18 часов перед введением дозы и в течение по меньшей мере 4 часов после введения дозы, и обеспечивают им свободный доступ к воде в течение всего периода.
199. Производное по любому из предыдущих воплощений, где производное GLP-1 растворяют в растворе с 50 мМ фосфатом натрия, 145 мМ хлоридом натрия, 0,05% Tween-80, pH 7,4 до подходящей концентрации, предпочтительно 20-60 нмоль/мл.
200. Производное по любому из предыдущих воплощений, где внутривенное введение производного производят в объеме, соответствующем 1-2 нмоль/кг.
201. Производное по любому из предыдущих воплощений, которое вызывает сниженное потребление корма у мини-свиней.
202. Производное по любому из предыдущих воплощений, где мини-свиньи являются геттингенскими мини-свиньями мужского пола.
203. Производное по любому из предыдущих воплощений, где возраст мини-свиней составляет 7-14 месяцев.
204. Производное по любому из предыдущих воплощений, где мини-свиньи размещены отдельно друг от друга и получают корм один или два раза в день, предпочтительно с соблюдением диеты SDS для мини-свиней.
205. Производное по любому из предыдущих воплощений, где одиночную дозу, возможно после периода с повышением дозы, вводят внутривенно или подкожно в тонкую кожу за ухом.
206. Производное по любому из предыдущих воплощений, где животных лишают пищи в течение примерно 18 часов перед введением дозы.
207. Производное по любому из предыдущих воплощений, где анализируется базальная группа и ряд групп с дозами производного, соответствующими 2-6 различным уровням концентрации в плазме крови, где животным в базальной группе а) вводят носитель или б) ничего не вводят.
208. Производное по любому из предыдущих воплощений, где концентрация в плазме крови составляет 3000-80000 пМ.
209. Производное по любому из предыдущих воплощений, где выполняют одно- или двухчасовой внутривенный тест толерантности к глюкозе (IVGTT).
210. Производное по любому из предыдущих воплощений, где 0,3 г/кг глюкозы вводят внутривенно в течение 30 секунд и отбирают образцы в соответствующие моменты времени, например, в следующие моменты времени (t=0 соответствует болюному введению глюкозы): -10, -5, 0, 2, 5, 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120 минут.
211. Производное по любому из предыдущих воплощений, где определяют концентрацию в плазме производного, глюкозы и инсулина.
212. Производное по любому из предыдущих воплощений, где концентрацию производного измеряют в момент времени t=0 мин и, возможно, в конце анализа (t=60 минут или t=120 минут).
213. Производное по любому из предыдущих воплощений, где уровень глюкозы анализируют глюкозооксидазным способом.
214. Производное по любому из предыдущих воплощений, где площадь под кривой инсулина (AUC инсулина) рассчитывают и используют как меру секреции инсулина.
215. Производное по любому из предыдущих воплощений, где по меньшей мере одна их его концентраций, AUC инсулина, выше базальной AUC инсулина, предпочтительно составляет по меньшей мере 110% от нее, более предпочтительно по меньшей мере 120% от нее, еще более предпочтительно по меньшей мере 130% от нее или, наиболее предпочтительно, по меньшей мере 140% от нее.
216. Производное по любому из предыдущих воплощений, которое приводит к снижению потребления корма у свиней по сравнению с контролем (предпочтительно с введением носителя, либо без введения чего-либо).
возможно, потребление корма (0-24 ч) может составлять 90% или менее по сравнению с контролем, которому вводили носитель, предпочтительно 80% или менее, более предпочтительно 70% или менее, еще более предпочтительно 60% или менее, или, наиболее предпочтительно, 50% или менее;
где потребление корма (0-24 ч) относится к первым 24 часам после введения производного или носителя.
217. Производное по любому из предыдущих воплощений, где свиньи являются свиньями Ландрас Йоркшир Дюрок (LYD) женского пола.
218. Производное по любому из предыдущих воплощений, где возраст свиней составляет 3 месяца, а вес, предпочтительно, 30-35 кг.
219. Производное по любому из предыдущих воплощений, где животные помещены в группу на 1-2 недели для акклиматизации.
220. Производное по любому из предыдущих воплощений, где в течение экспериментального периода животные помещены в индивидуальные загоны с утра понедельника до дневного времени в пятницу для измерения индивидуального потребления корма.
221. Производное по любому из предыдущих воплощений, где животных кормят кормом для свиней (например, Svinefoder, Антонио) без ограничения количества.
222. Производное по любому из предыдущих воплощений, где потребление корма контролируют путем записи веса корма каждые 15 минут, предпочтительно с использованием системы Mpigwin.
223. Производное по любому из предыдущих воплощений, которое дозируют по 0,3, 1,0, 3,0, 10, или 30 нмоль/кг, предпочтительно растворяют в фосфатном буфере (50 мМ фосфата, 0,05% Tween-80, pH 8), более предпочтительно в концентрации 12, 40, 120, 400 или 1200 нмоль/мл.
224. Производное по любому из предыдущих воплощений, где фосфатный буфер служит носителем.
225. Производное по любому из предыдущих воплощений, где животным однократно подкожно вводят дозу производного или носителя (предпочтительно с объемом дозы 0,025 мл/кг) утром 1-го дня, а потребление корма измеряют в течение 4 дней после введения дозы.
226. Производное по любому из предыдущих воплощений, которое имеет период полужизни (Т½) in vivo у крыс после внутривенного введения по меньшей мере 4 часа, предпочтительно по меньшей мере 6 часов, еще более предпочтительно по меньшей мере 8 часов или, наиболее предпочтительно, по меньшей мере 10 часов.
227. Производное по любому из предыдущих воплощений, которое имеет период полужизни (Т½) in vivo у крыс после внутривенного введения по меньшей мере 12 часов, предпочтительно по меньшей мере 15 часов, еще более предпочтительно по меньшей мере 18 часов или, наиболее предпочтительно, по меньшей мере 20 часов.
228. Производное по любому из предыдущих воплощений, которое имеет период полужизни (Т½) in vivo у крыс после внутривенного введения по меньшей мере 24 часа, предпочтительно по меньшей мере 26 часов или, наиболее предпочтительно, по меньшей мере 30 часов.
229. Производное по любому из предыдущих воплощений, где используют крыс Sprague Dawley мужского пола с массой тела 400 г.
230. Промежуточный продукт в форме аналога GLP-1, который включает следующие модификации по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 38Q; и/или (ii) 39G; или его фармацевтически приемлемая соль, амид или сложный эфир.
231. Аналог GLP-1 по воплощению 230, который содержит (38Е, 39G).
232. Промежуточный продукт в форме аналога GLP-1, который содержит, предпочтительно имеет, следующие аминокислотные замены по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 22Е, 26R, 27К, 34R, 37К; (ii) 22E, 26R, 27K, 30Е, 34R, 36K, 38Е, 39G; (iii) 22E, 26R, 27K, 34R, 36K, des37; (iv) 22E, 25V, 26R, 27K, 34R, 37К; (v) 8Aib, 20K, 22E, 26R, 27K, 30Е, 34G, des35-37; (vi) 26R, 27K, 30Е, 34R, 36K, 38Е; (vii) 8Aib, 22K, 25V, 26R, 27K, 31H, 34R; (iix) 8Aib, 22K, 25V, 26R, 27K, 34R, des35-37; (ix) 8Aib, 22K, 25V, 26R, 27K, 34R, des36-37; (x) 26H, 27K, 30Е, 34R, 36K, 38Е; (xi) 22K, 25V, 26R, 27K, 30Е, 34Q; (xii) 25V, 26R, 27K, 30Е, 34R, 36K, 38Q; (xiii) 25V, 26R, 27K, 30Е, 34Q, 36K, 38Е; (xiv) 22K, 26R, 27K, 31H, 34G, des35-37; (xv) 8Aib, 25V, 26R, 27K, 31H, 34Q, 37К; (xvi) 25V, 26R, 27K, 31H, 34Q, 37К; (xvii) 22E, 23E, 25V, 26R, 27K, 31H, 34Q, 37К; (iixx) 8Aib, 12K, 22E, 26R, 27K, 31H, 34Q; (ixx) 8Aib, 22K, 26R, 27K, 31H, 34G, des35-37; (xx) 22E, 26H, 27K, 30Е, 34R, 36K, 38Е; (xxi) 22E, 24K, 26R, 27K, 31H, 34G, des35-37; (xxii) 25V, 26R, 27K, 34Q, 36K; (xxiii) 22E, 24K, 25V, 26R, 27K, 31H, 34R; (xxiv) 22E, 24K, 25V, 26R, 27K, 34G, des35-37; (xxv) 22E, 24K, 25V, 26R, 27K, 34R; или (xxvi) 8Aib, 22E, 24K, 25V, 26R, 27K, 31H, 34Q; или его фармацевтически приемлемая соль, амид или сложный эфир.
233. Производное по любому из предыдущих воплощений для применения в качестве лекарственного средства.
234. Производное по любому из предыдущих воплощений для применения в лечении и/или профилактике всех форм сахарного диабета и связанных с ним заболеваний, таких как пищевые расстройства, сердечно-сосудистые заболевания, желудочно-кишечные заболевания, диабетические осложнения, критические заболевания и/или синдром поликистоза яичников; и/или для улучшения параметров липидного обмена, улучшения функционирования β-клеток и/или для отсрочки или предотвращения прогрессирования диабетического заболевания.
235. Способ лечения или профилактики всех форм сахарного диабета и связанных с ним заболеваний, таких как пищевые расстройства, сердечно-сосудистые заболевания, желудочно-кишечные заболевания, диабетические осложнения, критические заболевания и/или синдром поликистоза яичников; и/или для улучшения параметров липидного обмена, улучшения функционирования β-клеток и/или для отсрочки или предотвращения прогрессирования диабетического заболевания путем введения фармацевтически активного количества производного по любому из предыдущих воплощений.
Ниже приведены другие конкретные воплощения изобретения:
1. Производное аналога GLP-1,
где аналог содержит первый остаток К в позиции, соответствующей позиции 27 в GLP-1 (7-37) (SEQ ID №1); второй остаток К в позиции, соответствующей позиции Т в GLP-1 (7-37), где Т представляет собой целое число в диапазоне 7-37 за исключением 18 и 27; и максимум десять аминокислотных замен по сравнению с GLP-1 (7-37); где первый остаток К обозначается как К27, а второй остаток К обозначается как KT;
где производное содержит две пролонгирующие группировки, присоединенные к К27 и KT, соответственно, через линкер, где
пролонгирующая группировка выбрана среди Соед. 1 и Соед. 2:
Соед. 1: НООС-(СН2)x-СО-*
Соед. 2: НООС-С6Н4-O-(СН2)y-СО-*,
где x представляет собой целое число в диапазоне 6-18, а y представляет собой целое число в диапазоне 3-17; и
линкер содержит Соед. 5:
Соед. 5:
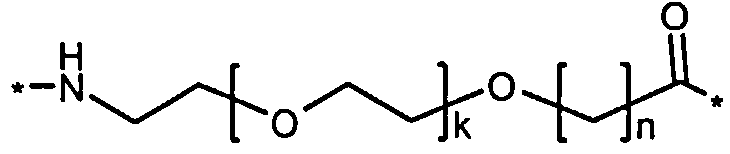 ,
,
где k представляет собой целое число в диапазоне 1-5 и n представляет собой целое число в диапазоне 1-5;
или его фармацевтически приемлемая соль, амид или сложный эфир.
2. Производное по воплощению 1, где линкер также содержит Glu-бирадикал, выбранный среди Соед. 6 и/или Соед. 7:
Соед. 6:
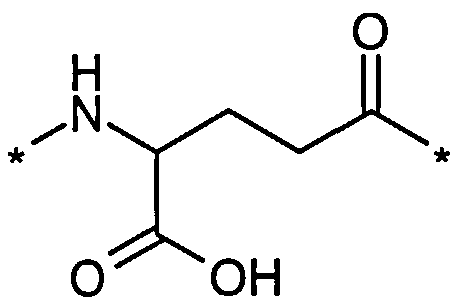
Соед. 7:
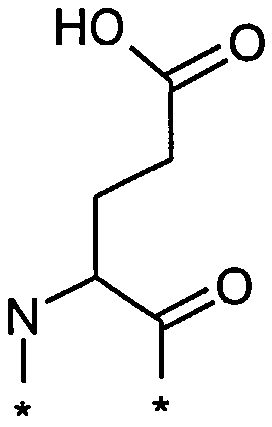 .
.
3. Производное по любому из предыдущих воплощений, где линкер присоединен к эпсилон-аминогруппе первого или второго К-остатка.
4. Производное по любому из предыдущих воплощений, где Т составляет 12, 20, 22, 24, 36 или 37.
5. Производное по любому из предыдущих воплощений, где аналог не содержит остатки К кроме первого и второго остатков К.
6. Производное по любому из предыдущих воплощений, где x составляет 12.
7. Производное по любому из предыдущих воплощений, где y составляет 9.
8. Производное по любому из предыдущих воплощений, где k составляет 1.
9. Производное по любому из предыдущих воплощений, где n составляет 1.
10. Производное по любому из предыдущих воплощений, где аналог содержит аналог GLP-1 формулы I:
Формула I:
Xaa7-Xaa8-Glu-Gly-Thr-Xaa12-Thr-Ser-Asp-Xaa16-Ser-Xaa18-Xaa19-Xaa20-Glu-Xaa22-Xaa23-Xaa24-Xaa25-Xaa26-Lys-Phe-Ile-Xaa30-Xaa31-Leu-Val-Xaa34-Xaa35-Xaa36-Хаа37-Хаа38-Хаа39,
где
Хаа7 представляет собой L-гистидин, имидазопропионил, α-гидрокси-гистидин, D-гистидин, дезамино-гистидин, 2-амино-гистидин, β-гидрокси-гистидин, гомогистидин, Nα-ацетил-гистидин, Nα-формил-гистидин, α-фторметил-гистидин, α-метил-гистидин, 3-пиридилаланин, 2-пиридилаланин или 4-пиридилаланин;
Хаа8 представляет собой Ala, Gly, Val, Leu, Ile, Thr, Ser, Lys, Aib, (1-аминоциклопропил)карбоновую кислоту, (1-аминоциклобутил)карбоновую кислоту, (1-аминоциклопентил)карбоновую кислоту, (1-аминоциклогексил)карбоновую кислоту, (1-аминоциклогептил)карбоновую кислоту или (1-аминоциклооктил)карбоновую кислоту;
Xaa12 представляет собой Lys или Phe;
Xaa16 представляет собой Val или Leu;
Xaa18 представляет собой Ser, Arg, Asn, Gln или Glu;
Xaa19 представляет собой Tyr или Gln;
Хаа20 представляет собой Leu, Lys или Met;
Хаа22 представляет собой Gly, Glu, Lys или Aib;
Хаа23 представляет собой Gln, Glu или Arg;
Хаа24 представляет собой Ala или Lys;
Хаа25 представляет собой Ala или Val;
Хаа26 представляет собой Val, His или Arg;
Хаа30 представляет собой Ala, Glu или Arg;
Хаа31 представляет собой Trp или His;
Хаа34 представляет собой Glu, Asn, Gly, Gln или Arg;
Хаа35 представляет собой Gly, Aib или отсутствует;
Хаа36 представляет собой Arg, Gly, Lys или отсутствует;
Хаа37 представляет собой Gly, Ala, Glu, Pro, Lys, Arg или отсутствует;
Хаа38 представляет собой Ser, Gly, Ala, Glu, Gln, Pro, Arg или отсутствует; и
Хаа39 представляет собой Gly или отсутствует.
11. Соединение по любому из предыдущих воплощений, выбранное среди следующих: Соед. 50, Соед. 51, Соед. 52, Соед. 53, Соед. 54, Соед. 55, Соед. 56, Соед. 57, Соед. 58, Соед. 59, Соед. 60, Соед. 61, Соед. 62, Соед. 63, Соед. 64, Соед. 65, Соед. 66, Соед. 67, Соед. 68, Соед. 69, Соед. 70, Соед. 71, Соед. 72, Соед. 73, Соед. 74, Соед. 75, Соед. 76, Соед. 77, Соед. 78 и Соед. 79; или его фармацевтически приемлемая соль, амид или сложный эфир.
12. Промежуточный продукт в форме аналога GLP-1, который содержит следующие аминокислотные замены по сравнению с GLP-1 (7-37) (SEQ ID №1): (i) 38Q; и/или (ii) 39G; или его фармацевтически приемлемая соль, амид или сложный эфир.
13. Производное по любому из воплощений 1-11 для применения в качестве лекарственного средства.
14. Производное по любому из воплощений 1-11 для применения в лечении и/или профилактике всех форм сахарного диабета и связанных с ним заболеваний, таких как пищевые расстройства, сердечно-сосудистые заболевания, желудочно-кишечные заболевания, диабетические осложнения, критические заболевания и/или синдром поликистоза яичников; и/или для улучшения параметров липидного обмена, улучшения функционирования β-клеток и/или для отсрочки или предотвращения прогрессирования диабетического заболевания.
15. Способ лечения или профилактики всех форм сахарного диабета и связанных с ним заболеваний, таких как пищевые расстройства, сердечно-сосудистые заболевания, желудочно-кишечные заболевания, диабетические осложнения, критические заболевания и/или синдром поликистоза яичников; и/или для улучшения параметров липидного обмена, улучшения функционирования β-клеток и/или для отсрочки или предотвращения прогрессирования диабетического заболевания путем введения фармацевтически активного количества производного по любому из воплощений 1-11.
Примеры
Эта экспериментальная часть начинается со списка сокращений, а за ним следует раздел, включающий общие способы синтеза и характеризации аналогов и производных изобретения. Затем следует ряд примеров, которые относятся к изготовлению конкретных производных GLP-1, и в конце включено несколько примеров, связанных с активностью и свойствами этих аналогов и производных (раздел, названный «Фармакологические способы»).
Примеры служат для иллюстрации изобретения.
Сокращения
В данном документе используются следующие сокращения, расположенные в алфавитном порядке:
Aib: аминоизомасляная кислота (α-аминоизомасляная кислота)
API: активный фармацевтический ингредиент
AUC: площадь под кривой
BG: уровень глюкозы в крови
ВНК: клетки почек детеныша хомяка
BW: масса тела
Вос: трет-бутилоксикарбонил
BSA: бычий сывороточный альбумин
коллидин: 2,4,6-триметилпиридин
DCM: дихлорметан
Dde: 1-(4,4-диметил-2,6-диоксоциклогексилиден)этил
DIC: диизопропилкарбодиимид
DIPEA: диизопропилэтиламин
DMAP: 4-диметиламинопиридин
DMEM: среда Игла, модифицированная по способу Дульбекко (DMEM)
EDTA: этилендиаминтетрауксусная кислота
EGTA: этиленгликольтетрауксусная кислота
FCS: эмбриональная телячья сыворотка
Fmoc: 9-фторенилметилоксикарбонил
HATU: (O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат)
HBTU: (2-(1Н-бензотриазол-1-ил-)-1,1,3,3-тетраметилурония гексафторфосфат)
HEPES: 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота
HFIP: 1,1,1,3,3,3-гексафтор-2-пропанол или гексафторизопропанол
HOAt: 1-окси-7-азабензотриазол
HOBt: 1-гидроксибензотриазол
HPLC: высокоэффективная жидкостная хроматография
HSA: человеческий сывороточный альбумин
IBMX: 3-изобутил-1-метилксантин
Imp: имидазолпропионовая кислота (также известная как дезаминогистидин, desH)
i.v. внутривенно
ivDde: 1-(4,4-диметил-2,6-диоксоциклогексилиден)-3-метилбутил
IVGTT: внутривенный тест толерантности к глюкозе
LCMS: жидкостная хроматография/масс-спектрометрия
LYD: Ландрас Йоркшир Дюрок
MALDI-MS: См. MALDI-TOF MS
MALDI-TOF MS: матрично-активированная лазерная десорбция/времяпролетная масс-спектрометрия с ионизацией
МеОН: метанол
Mmt: 4-метокситритил
Mtt: 4-метилтритил
NMP: N-метилпирролидон
OBz: бензоиловый эфир
OEG: 8-амино-3,6-диоксаоктановая кислота
OtBu: третбутиловый эфир
PBS: фосфатный буфер
PD: фармакодинамика
Pen/Strep: пенициллин/стрептомицин
РК: фармакокинетика
RP: обращенная фаза
RP-HPLC: обращенно-фазовая высокоэффективная жидкостная хроматография
RT: комнатная температура
Rt: время удерживания
s.c.: подкожно
SD: стандартное отклонение
SEC-HPLC: гель-проникающая высокоэффективная жидкостная хроматография
SEM: стандартная ошибка среднего
SPA: сцинтилляционный проксимальный анализ
SPPS: твердофазный синтез пептидов
tBu: трет-бутил
TFA: трифторуксусная кислота
TIS: триизопропилсилан
Tris: трис(гидроксиметил)аминометан или 2-амино-2-гидроксиметилпропан-1,3-диол
Trt: трифенилметил, или тритил
Trx: транексамовая кислота
UPLC: ультра высокоэффективная жидкостная хроматография
Способы получения
А. Общие способы
Этот раздел относится к способам твердофазного синтеза пептидов (способам SPPS, включая способы снятия защиты аминокислот, способы отщепления пептида от смолы, а также его очистки), а также способы обнаружения и характеризации полученного пептида (способы LCMS, MALDI и UPLC). Твердофазный синтез пептидов в некоторых случаях может быть улучшен за счет использования дипептидов, защищенных на дипептидной амидной связи группой, которая может быть расщеплена в кислой среде, такой как 2-Fmoc-окси-4-метоксибензил или 2,4,6-триметоксибензил, но не ограничиваясь ими. В случаях, когда в пептиде присутствуют серин или треонин, могут быть использованы псевдопролиновые дипептиды (доступные, например, от Novabiochem, см. также W.R. Sampson (1999), J. Pep. Sci. 5, 403). Используемые защищенные аминокислотные производные были стандартными Fmoc-аминокислотами (предоставляемыми, например, AnaSpec, IRIS или Novabiochem). N-концевая аминокислота была Вос-защищена на альфа-аминогруппе (например, Вос-His(Boc)-OH или Boc-His(Trt)-OH для пептидов с His на N-конце). Эпсилон-аминогруппа лизина в последовательности была защищена Mtt, Mmt, Dde, ivDde или Boc, в зависимости от пути присоединения альбуминсвязывающей группировки и спейсера. Альбуминсвязывающая группировка и/или линкер могут быть присоединены к пептиду либо путем ацилирования связанного со смолой пептида, либо путем ацилирования в растворе незащищенного пептида. В случае присоединения альбуминсвязывающей группировки и/или линкера к защищенной пептидил-смоле присоединение может быть модульным с использованием SPPS и соответственно защищенных блоков, таких как Fmoc-OEG-OH (Fmoc-8-амино-3,6-диоксаокгановая кислота), Fmoc-Trx-ОН (Fmoc-транексамовая кислота), Fmoc-Glu-OtBu, монотретбутиловый эфир октадекандиовой кислоты, монотретбутиловый эфир нонадекандиовой кислоты или третбутиловый эфир 4-(9-карбоксинонилокси)бензойной кислоты, но не ограничиваясь ими.
1. Синтез связанного со смолой пептида
Способ SPPS В
Способ SPPS В относится к синтезу защищенной пептидил-смолы с помощью Fmoc-химии на пептидном синтезаторе Liberty, основанном на микроволнах (СЕМ Corp., Северная Каролина). Подходящей смолой является предварительно загруженная смола Wang с низкой загрузкой, которую можно получить от Novabiochem (например, смола Wang Fmoc-Lys(Mtt)-Wang с низкой загрузкой, 0,35 ммоль/г). Снятие защиты Fmoc проводили с помощью 5% пиперидина в NMP при 70 или 75°С. Химическая раекция связывания представляла собой DIC/HOAt в NMP. К смоле добавляли растворы аминокислоты/HOAt (0,3 М в NMP в молярном избытке в 3-10 раз), а затем такой же молярный эквивалент DIC (0,75 М в NMP). Например, следующее количество 0,3 М раствора аминокислоты/HOAt использовали для реакций связывания со следующими масштабами: масштаб/мл, 0,10 ммоль/2,5 мл, 0,25 ммоль/5 мл, 1 ммоль/15 мл. Время связывания и температура, как правило, составляли 5 минут и 70 или 75°С. Для реакций более крупного масштаба использовали большее время связывания, например, 10 минут. Гистидиновые аминокислоты связывали дважды при 50°С или четырежды, если предыдущая аминокислота была пространственно-затрудненной (например, Aib). Аргининовые аминокислоты связывали при комнатной температуре в течение 25 минут, затем нагревали до 70 или 75°С на 5 минут. Некоторые аминокислоты, такие как Aib, но не ограничиваясь ею, были «дважды связанными», что означает, что после первого связывания (например, в течение 5 минут при 75°С), смолу сливали, добавляли больше реагентов (аминокислоту, HOAt и DIC) и смесь снова нагревали (например, в течение 5 минут при 75°С). Когда была необходима химическая модификация боковой цепи лизина, лизин встраивали как Lys(Mtt). Группу Mtt удаляли путем промывания смолы с DCM и суспендирования смолы в чистом (неразбавленном) гексафторизопропаноле в течение 20 минут с последующим промыванием DCM и NMP. Химическую модификацию лизина производили либо путем ручного синтеза (см. способ SPPS D), либо в одном или более чем одном автоматизированном этапе на пептидном синтезаторе Liberty, как описано выше, с использованием соответственно защищенных блоков (см. Общие способы), возможно, включая ручное связывание.
Способ SPPS D
Способ SPPS D относится к синтезу защищенной пептидил-смолы с помощью ручной Fmoc-химической реакции. Обычно он используется для присоединения линкеров и боковых цепей к пептидному остову. Следующие условия использовали при масштабе синтеза 0,25 ммоль. Химическая реакция связывания представляла собой DIC/HOAt/коллидин в NMP в 4-10-кратном молярном избытке. Условиями связывания были 1-6 часов при комнатной температуре. Снятие защиты Fmoc проводили с помощью 20-25% пиперидина в NMP (3 раза по 20 мл, каждый по 10 минут) с последующим промыванием NMP (4 раза по 20 мл). Снятие защиты Dde или ivDde проводили с помощью 2% гидразина в NMP (2 раза по 20 мл, каждый по 10 минут) с последующим промыванием NMP (4 раза по 20 мл). Снятие защиты Mtt или Mmt проводили с помощью 2% TFA и 2-3% TIS в DCM (5 раз по 20 мл, каждый по 10 минут), с последующим промыванием DCM (2 раза по 20 мл), 10% метанолом и 5% DIPEA в DCM (2 раза по 20 мл) и NMP (4 раза по 20 мл), или путем обработки читым гексафторизопропанолом (5 раз по 20 мл, каждый по 10 минут), с последующим промыванием, как указано выше. Альбуминсвязывающая группировка и/или линкер могут быть присоединены к пептиду либо путем ацилирования связанного со смолой пептида, либо путем ацилирования в растворе незащищенного пептида (см. пути, описанные ниже). В случае присоединения альбуминсвязывающей группировки и/или линкера к защищенной пептидил-смоле присоединение может быть модульным с использованием SPPS и соответственно защищенных блоков (см. Общие способы).
Присоединение к связанному со смолой пептиду - Путь I: Активированную (активный эфир или симметричный ангидрид) альбуминсвязывающую группировку или линкер, например, моно-(2,5-диоксо-пирролидин-1-ил)эфир октадекандиовой кислоты (Ebashi et al. EP511600, 4. молярных эквивалента по отношению к связанному со смолой пептиду) растворяли в NMP (25 мл), добавляли к смоле и встряхивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали и смолу тщательно промывали NMP, DCM, 2-пропанолом, метанолом и диэтиловым эфиром.
Присоединение к связанному со смолой пептиду - Путь II: Альбуминсвязывающую группировку растворяли в NMP/DCM (1:1, 10 мл). Добавляли активирующий реагент, такой как HOBt (4 молярных эквивалента по отношению к смоле), и DIC (4 молярных эквивалента по отношению к смоле), и раствор перемешивали в течение 15 минут. Раствор добавляли к смоле, и добавляли DIPEA (4 молярных эквивалента по отношению к смоле). Смолу встряхивали в течение 2-24 часов при комнатной температуре. Смолу промывали NMP (2 раза по 20 мл), NMP/DCM (1:1, 2 раза по 20 мл) и DCM (2 раза по 20 мл).
Присоединение к связанному со смолой пептиду - Путь III: Активированную (активный эфир или симметричный ангидрид) альбуминсвязывающую группировку или линкер, например, моно-(2,5-диоксо-пирролидин-1-ил)эфир октадекандиовой кислоты (Ebashi et al. EP511600), 1-1,5 молярных эквивалента по отношению к связанному со смолой пептиду, растворяли в органическом растворителе, таком как ацетонитрил, THF, DMF, DMSO, или в смеси вода/органический растворитель (1-2 мл) и добавляли к раствору пептида в воде (10-20 мл) вместе с 10 молярными эквивалентами DIPEA. В случае защитных групп на альбуминсвязывающем остатке, таких как трет-бутил, реакционную смесь лиофилизировали в течение ночи и затем с выделенного сырьевого пептида снимали защиту. В случае третбутиловых защитных групп снятие защиты проводили путем растворения пептида в смеси трифторуксусной кислоты, воды и триизопропилсилана (90:5:5). Затем в течение 30 минут смесь выпаривали в вакууме и сырьевой пептид очищали с помощью HPLC, как описано ниже.
Способ SPPS Е
Способ SPPS Е относится к пептидному синтезу с помощью Fmoc-химической реакции на пептидном синтезаторе Prelude Solid Phase Pepetide Synthesiser от Protein Technologies (Tucson, AZ 85714, США). Подходящей смолой является предварительно загруженная смола Wang с низкой загрузкой, доступной от Novabiochem. (например, смола Wang Fmoc-Lys(Mtt)-Wang с низкой загрузкой, 0,35 ммоль/г). Снятие защиты Fmoc проводили с помощью 25% пиперидина в NMP 2 раза в течение 10 минут. Химическая реакиция связывания представляла собой DIC/HOAt/коллидин в NMP. К смоле добавляли растворы аминокислоты/HOAt (0,3 М в NMP в молярном избытке в 3-10 раз), а затем такой же молярный эквивалент DIC (3 М в NMP) и коллидина (3 М в NMP). Например, следующее количество 0,3 М раствора аминокислоты/HOAt использовали для реакций связывания со следующими масштабами: масштаб/мл, 0,10 ммоль/2,5 мл, 0,25 ммоль/5 мл. Время связывания, как правило, составляло 60 минут. Некоторые аминокислоты, такие как аргинин, Aib или гистидин, но не ограничиваясь ими, были «дважды связанными», что означает, что после первого связывания (например, в течение 60 минут) смолу сливали, добавляли больше реагентов (аминокислоту, HOAt, DIC и коллидин) и смесь снова оставляли для реакции (например, на 60 минут). Некоторые аминокислоты и производные жирных кислот, включая, но не ограничиваясь ими, Fmoc-OEG-OH, Fmoc-Trx-OH, Fmoc-Glu-OtBu, монотретбутиловый эфир октадекандиовой кислоты, монотретбутиловый эфир нонадекандиовой кислоты или третбутиловый эфир 4-(9-карбоксинонилокси)бензойной кислоты, связывали в течение длительного времени, например, 6 часов. Когда была необходима химическая модификация боковой цепи лизина, лизин встраивали как Lys(Mtt). Группу Mtt удаляли путем промывания смолы в DCM и суспендирования смолы в гексафторизопропаноле/DCM (75:25) 3 раза в течение 10 минут с последующим промыванием DCM, 20% пиперидином и NMP. Химическую модификацию лизина производили либо путем ручного синтеза (см. способ SPPS D), либо в одном или более чем одном автоматизированном этапе на пептидном синтезаторе Prelude, как описано выше, с использованием соответственно защищенных блоков (см. Общие способы).
2. Отщепление пептида от смолы и очистка
После синтеза смолу промывали в DCM и пептид отщепляли от смолы путем 2-3-часовой обработки TFA/TIS/водой (95/2,5/2,5 или 92,5/5/2,5) с последующим осаждением диэтиловым эфиром. Пептид растворяли в подходящем растворителе (таком как, например, 30% уксусная кислота) и очищали путем стандартной RP-HPLC на колонке С18, 5 мкМ, используя ацетонитрил/воду/TFA. Фракции анализировали путем комбинации способов UPLC, MALDI и LCMS, и соответствующие фракции объединяли и лиофилизировали.
3. Способы выявления и характеризации
Способы LCMS
Способ LCMS 1 (LCMS1)
Для определения массы образца после элюирования из системы HPLC серии Agilent 1200 использовали масс-спектрометр Agilent Technologies LC/MSD TOF (G1969A). Деконволюцию белкового спектра рассчитывали с помощью программного обеспечения для подтверждения белка от Agilent.
Элюенты:
А: 0,1% трифторуксусная кислота в воде
В: 0,1% трифторуксусная кислота в ацетонитриле
Колонка: Zorbax 5u, 300SB-C3, 4,8×50 мм
Градиент: 25%-95% ацетонитрил в течение 15 минут
Способ LCMS 2 (LCMS2)
Для определения массы образца после элюирования из системы HPLC Perkin Elmer серии 200 использовали масс-спектрометр Elmer Sciex API 3000.
Элюенты:
А: 0,05% трифторуксусная кислота в воде
В: 0,05% трифторуксусная кислота в ацетонитриле
Колонка: Waters Xterra MS C-18 × 3 мм, внутренний диаметр 5 мкм
Градиент: 5%-90% ацетонитрил в течение 7,5 минут со скоростью 1,5 мл/мин
Способ LCMS 3 (LCMS3)
Для определения массы образца после элюирования из системы HPLC Waters Alliance НТ использовали масс-спектрометр Waters Micromass ZQ.
Элюенты:
А: 0,1% трифторуксусная кислота в воде
В: 0,1% трифторуксусная кислота в ацетонитриле
Колонка: Phenomenex, Jupiter C4 50×4,60 мм, внутренний диаметр 5 мкм
Градиент: 10%-90% В в течение 7,5 минут со скоростью 1,0 мл/мин
Способ LCMS 4 (LCMS4)
LCMS4 проводили на установке, состоящей из системы UPLC Waters Acquity и масс-спектрометра LCT Premier XE от Micromass. Насос UPLC подключали к двум резервуарам с элюентом, содержащим:
А: 0,1% муравьиную кислоту в воде
В: 0,1% муравьиную кислоту в ацетонитриле
Анализ проводили при комнатной температуре, вводя соответствующий объем образца (предпочтительно 2-10 мкл) в колонку, который элюировали с градиентом А и В.
Условия UPLC, настройки детектора и настройки масс-спектрометра были следующими:
Колонка: Waters Acquity UPLC ВЕН, C-18, 1,7 мкм, 2,1 мм × 50 мм
Градиент: линейный 5%-95% ацетонитрил в течение 4,0 мин (или 8,0 мин) со скоростью 0,4 мл/мин
Выявление: 214 нм (аналоговый выход с TUV (перестраиваемым УФ-детектором))
Режим ионизации MS: API-ES
Скан: 100-2000 а.е.м. (или 500-2000 а.е.м.) с шагом 0,1 а.е.м.
Способы UPLC и HPLC
Способ 05_В5_1
UPLC (способ 05_В5_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С.
Систему UPLC подключали к двум резервуарам с элюентом, содержащим:
А: 0,2 М Na2SO4, 0,04 М Н3РО4, 10% CH3CN (pH 3,5)
В: 70% CH3CN, 30% H2O
Использовали следующий линейный градиент: от 60% А, 40% В до 30% А, 70% В в течение 8 минут со скоростью потока 0,40 мл/мин.
Способ 05_В7_1
UPLC (способ 05_В7_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С.
Систему UPLC подключали к двум резервуарам с элюентом, содержащим:
А: 0,2 М Na2SO4, 0,04 М H3PO4, 10% CH3CN (pH 3,5)
В: 70% CH3CN, 30% H2O
Использовали следующий линейный градиент: от 80% А, 20% В до 40% А, 60% В в течение 8 минут со скоростью потока 0,40 мл/мин.
Способ 04_А2_1
UPLC (способ 04_А2_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С.
Систему UPLC подключали к двум резервуарам с элюентом, содержащим:
А: 90% H2O, 10% CH3CN, 0,25 М бикарбонат аммония
В: 70% CH3CN, 30% H2O
Использовали следующий линейный градиент: от 90% А, 10% В до 60% А, 40% В в течение 16 минут со скоростью потока 0,40 мл/мин.
Способ 04_A3_1
UPLC (способ 04_А3_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC BEH130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С.
Систему UPLC подключали к двум резервуарам с элюентом, содержащим:
А: 90% H2O, 10% CH3CN, 0,25 М бикарбонат аммония
В: 70% CH3CN, 30% H2O
Использовали следующий линейный градиент: от 75% А, 25% В до 45% А, 55% В в течение 16 минут со скоростью потока 0,40 мл/мин.
Способ 04_А4_1
UPLC (способ 04_А4_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC BEH130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С.
Систему UPLC подключали к двум резервуарам с элюентом, содержащим:
А: 90% H2O, 10% CH3CN, 0,25 М бикарбонат аммония
В: 70% CH3CN, 30% H2O
Использовали следующий линейный градиент: от 65% А, 35% В до 25% А, 65% В в течение 16 минут со скоростью потока 0,40 мл/мин.
Способ 08_В2_1
UPLC (способ 08_В2_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC BEH130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С.
Систему UPLC подключали к двум резервуарам с элюентом, содержащим:
А: 99,95% H2O, 0,05% TFA
В: 99,95% CH3CN, 0,05% TFA
Использовали следующий линейный градиент: от 95% А, 5% В до 40% А, 60% В в течение 16 минут со скоростью потока 0,40 мл/мин.
Способ 08_В4_1
UPLC (способ 08_В4_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С.
Систему UPLC подключали к двум резервуарам с элюентом, содержащим:
А: 99,95% H2O, 0,05% TFA
В: 99,95% CH3CN, 0,05% TFA
Использовали следующий линейный градиент: от 95% А, 5% В до 95% А, 5% В в течение 16 минут со скоростью потока 0,40 мл/мин.
Способ 05_В10_1
UPLC (способ 05_В10_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С.
Систему UPLC подключали к двум резервуарам с элюентом, содержащим:
А: 0,2 М Na2SO4, 0,04 М H3PO4, 10% CH3CN (pH 3,5)
В: 70% CH3CN, 30% H2O
Использовали следующий линейный градиент: от 40% А, 60% В до 20% А, 80% В в течение 8 минут со скоростью потока 0,40 мл/мин.
Способ 01_А4_2
UPLC (способ 01_А4_2): RP-анализ выполняли с помощью системы Waters 600S, оснащенной детектором с диодной матрицей Waters 996. УФ-выявление на 214 нм и 254 нм получали с помощью колонки Symmetry 300 С18, 5 мкм, 3,9 мм × 150 мм, 42°С. Систему HPLC подключали к трем резервуарам с элюентом, содержащим: А: 100% Н2О, В: 100% CH3CN, С: 1% трифторуксусную кислоту в H2O. Использовали следующий линейный градиент: от 90% А, 5% В, 5% С до 0% А, 95% В, 5% С в течение 15 минут со скоростью потока 1,0 мл/мин.
Способ 09_В2_1
UPLC (способ 09_В2_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С. Систему UPLC подключали к двум резервуарам с элюентом, содержащим: А: 99,95% Н2О, 0,05% TFA; В: 99,95% CH3CN, 0,05% TFA. Использовали следующий линейный градиент: от 95% А, 5% В до 40% А, 60% В в течение 16 минут со скоростью потока 0,40 мл/мин.
Способ 09_В4_1
UPLC (способ 09_В4_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC BEH130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С. Систему UPLC подключали к двум резервуарам с элюентом, содержащим: А: 99,95% H2O, 0,05% TFA; В: 99,95% CH3CN, 0,05% TFA. Использовали следующий линейный градиент: от 95% А, 5% В до 5% А, 95% В в течение 16 минут со скоростью потока 0,40 мл/мин.
Способ 05_В8_1
UPLC (способ 05_В8_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC BEH130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С. Систему UPLC подключали к двум резервуарам с элюентом, содержащим: А: 0,2 М Na2SO4, 0,04 М H3PO4, 10% CH3CN (рН 3,5); В: 70% CH3CN, 30% H2O. Использовали следующий линейный градиент: от 50% А, 50% В до 20% А, 80% В в течение 8 минут со скоростью потока 0,40 мл/мин.
Способ 10_В14_1
UPLC (способ 10_В14_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН ShieldRP18, 1,7 мкм, 2,1 мм × 150 мм, 50°С. Систему UPLC подключали к двум резервуарам с элюентом, содержащим: А: 99,95% H2O, 0,05% TFA; В: 99,95% CH3CN, 0,05% TFA. Использовали следующий линейный градиент: от 70% А, 30% В до 40% А, 60% В в течение 12 минут со скоростью потока 0,40 мл/мин.
Способ 04_А6_1
UPLC (способ 04_А6_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC BEH130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С. Систему UPLC подключали к двум резервуарам с элюентом, содержащим: 10 мМ Tris, 15 мМ сульфат аммония 80%, Н2О 20%, рН 7,3; В: 80% CH3CN, 20% H2O. Использовали следующий линейный градиент: от 95% А, 5% В до 10% А, 90% В в течение 16 минут со скоростью потока 0,35 мл/мин.
Способ 01_В4_1
HPLC (способ 01_В4_1): RP-анализ выполняли с помощью системы Waters 600S, оснащенной детектором с диодной матрицей Waters 996. УФ-выявление получали с помощью колонки Symmetry C-18, 3,5 мкм, 3 мм × 150 мм. Колонку нагревали до 42°С и элюировали линейным градиентом 5-95% ацетонитрила, 90-0% воды и 5% трифторуксусной кислоты (1,0%) в воде в течение 15 минут со скоростью потока 1 мл/мин.
Способ 04_А7_1
UPLC (Способ 04_А7_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С. Систему UPLC подключали к двум резервуарам с элюентом, содержащим: А: 10 мМ TRIS, 15 мМ сульфат аммония, 80% H2O, 20%, рН 7,3; В: 80% CH3CN, 20% H2O. Использовали следующий линейный градиент: от 95% А, 5% В до 40% А, 60% В в течение 16 минут со скоростью потока 0,40 мл/мин.
Способ 05_В9_1
UPLC (Способ 05_В9_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН130, С18, 130Ǻ, 1,7 мкм, 2,1 мм × 150 мм, 40°С. Систему UPLC подключали к двум резервуарам с элюентом, содержащим: А: 0,2 М Na2SO4, 0,04 М H3PO4, 10% CH3CN (рН 3,5); В: 70% CH3CN, 30% H2O. Использовали следующий линейный градиент: от 70% А, 30% В до 20% А, 80% В в течение 8 минут со скоростью потока 0,40 мл/мин.
Способ 10_В12_1
UPLC (Способ 10_В12_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН ShieldRP18, 1,7 мкм, 2,1 мм × 150 мм, 50°С. Систему UPLC подключали к двум резервуарам с элюентом, содержащим: А: 99,95% Н2О, 0,05% TFA; В: 99,95% CH3CN, 0,05% TFA. Использовали следующий линейный градиент: от 50% А, 50% В до 0% А, 100% В в течение 16 минут со скоростью потока 0,40 мл/мин.
Способ 04_А9_1
UPLC (Способ 04_А9_1): RP-анализ выполняли с помощью системы Waters UPLC, оснащенной детектором двойного бэнда. УФ-выявление при 214 нм и 254 нм получали с помощью колонки ACQUITY UPLC ВЕН ShieldRP18, 1,7 мкм, 2,1 мм × 150 мм, 60°С. Систему UPLC подключали к двум резервуарам с элюентом, содержащим: А: 200 мМ Na2SO4 + 20 мМ Na2HPO4 + 20 мМ NaH2PO4 в 90% H2O/10% CH3CN, рН 7,2; В: 70% CH3CN, 30% H2O. Использовали следующий ступенчатый градиент: от 90% А, 10% В до 80% А, 20% В в течение 3 минут, от 80% А, 20% В до 50% А, 50% В в течение 17 минут со скоростью потока 0,40 мл/мин.
Способ MALDI-MS
Молекулярные массы определяли с помощью матрично-активированной лазерной десорбции и время-пролетной масс-спектрометрии с ионизацией с записью на Microflex или Autoflex (Bruker). Использовали матрицу альфа-циано-4-гидроксикоричной кислоты.
Способ NMR
Протонные спектры NMR записывали с помощью Brucker Avance DPX 300 (300 МГц) с тетраметилсиланом в качестве внутреннего стандарта. Химические сдвиги (δ), приведенные в ppm (частях на миллион), и структуры расщепления обозначены следующим образом: s, синглет; d, дублет; dd, дублет дублетов; dt, триплет дуплетов; t, триплет; tt, триплет триплетов; q, квартет; quint, квинтет; sext, секстет; m, мультиплет; и br = свободный.
В. Синтез промежуточных продуктов
1. Синтез моноэфиров жирных двухосновных кислот
Перегонка в течение ночи С12-, С14-, С16- и С18-двухосновных кислот с Вос-ангидридом, DMAP и трет-бутанолом в толуоле дает преимущественно трет-бутиловый моноэфир. Была получена смесь монокислоты, двухосновной кислоты и диэфира. Очистку осуществляли путем промывания, фильтрации через короткий кремниевый фильтр и кристаллизации.
В. Синтез соединений изобретения
Пример 1
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε37-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,Arg26,Lys27,Arg34,Lys37]-GLP-1-(7-37)-пептид
Соед. 50:
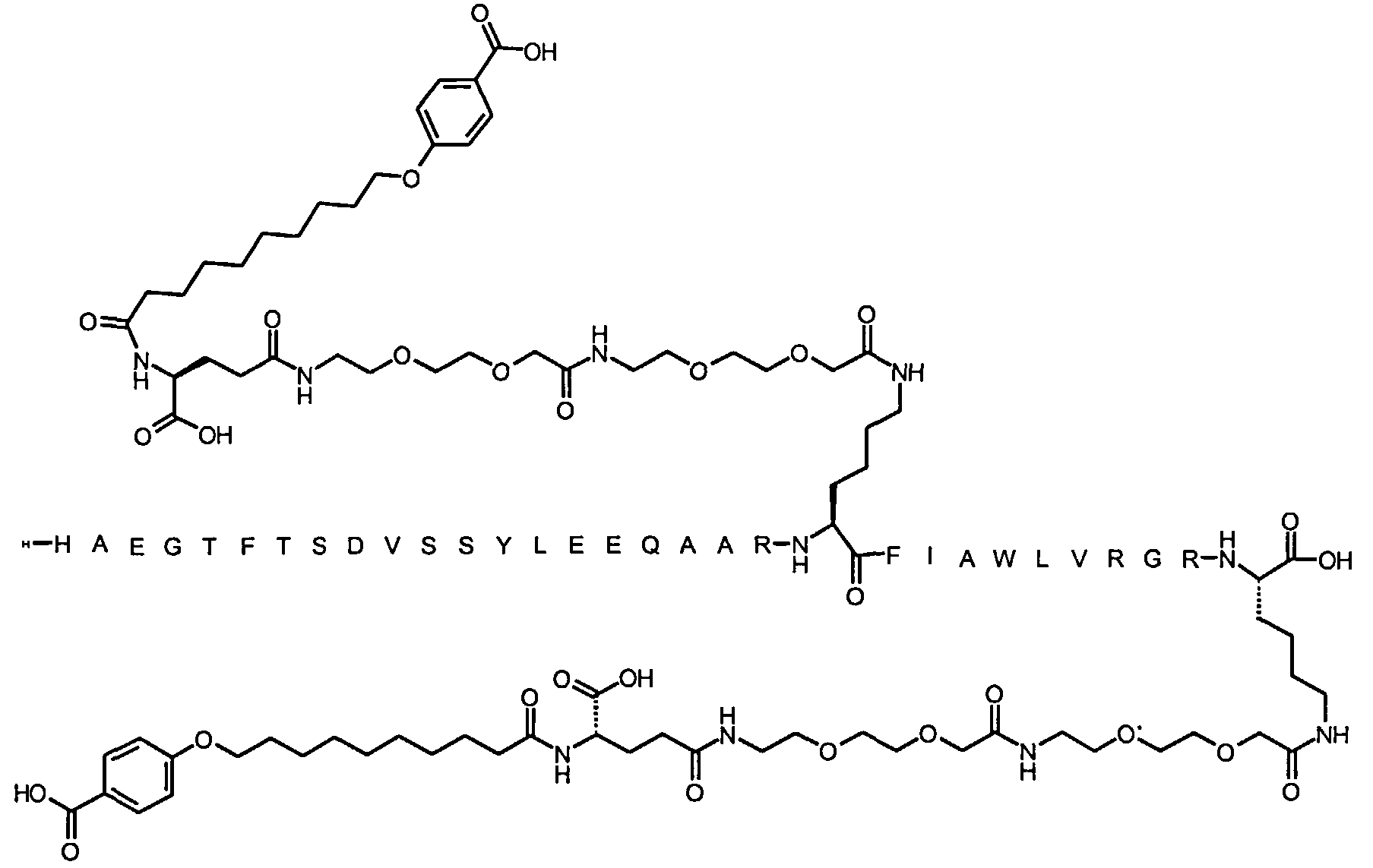
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В2_1): Rt=12,4 мин
UPLC (Method: 04_A3_1): Rt=8,3 мин
LCMS4: Rt=2,0 мин, m/z=1659 (m/3), 1244 (m/4), 996 (m/5)
Пример 2
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,Arg26,Lys27,Glu30,Arg34,Lys36]-GLP-1-(7-37)-пептидил-Glu-Gly
Соед. 51:
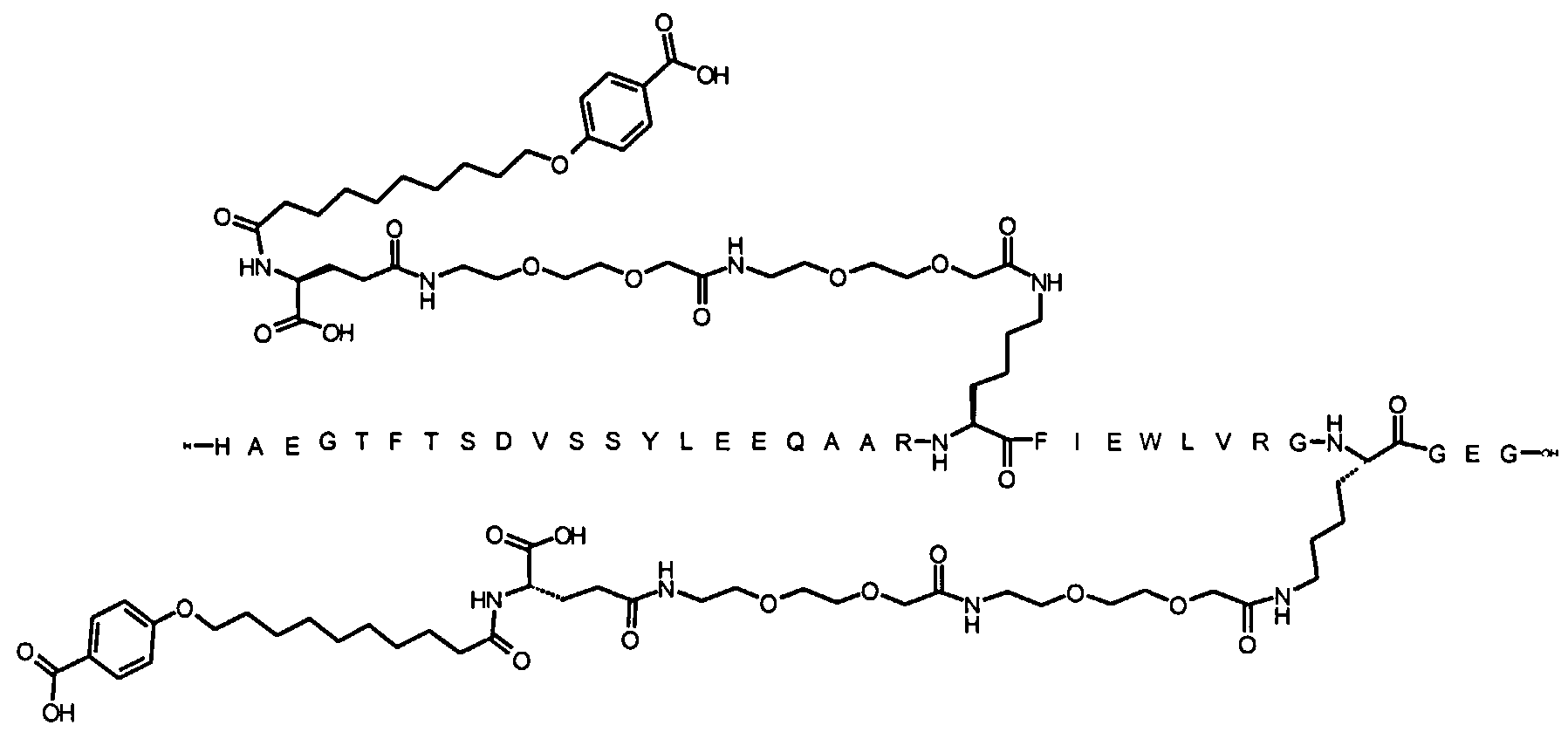
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В2_1): Rt=13,1 мин
UPLC (Способ 04_А7_1): Rt=6,3 мин
LCMS4: Rt=2,1 мин, m/z=1707 (m/3), 1280 (m/4), 1025 (m/5)
Пример 3
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,Arg26,Lys27,Arg34,Lys36],des-Gly37-GLP-1-(7-36)-пептид
Соед. 52:
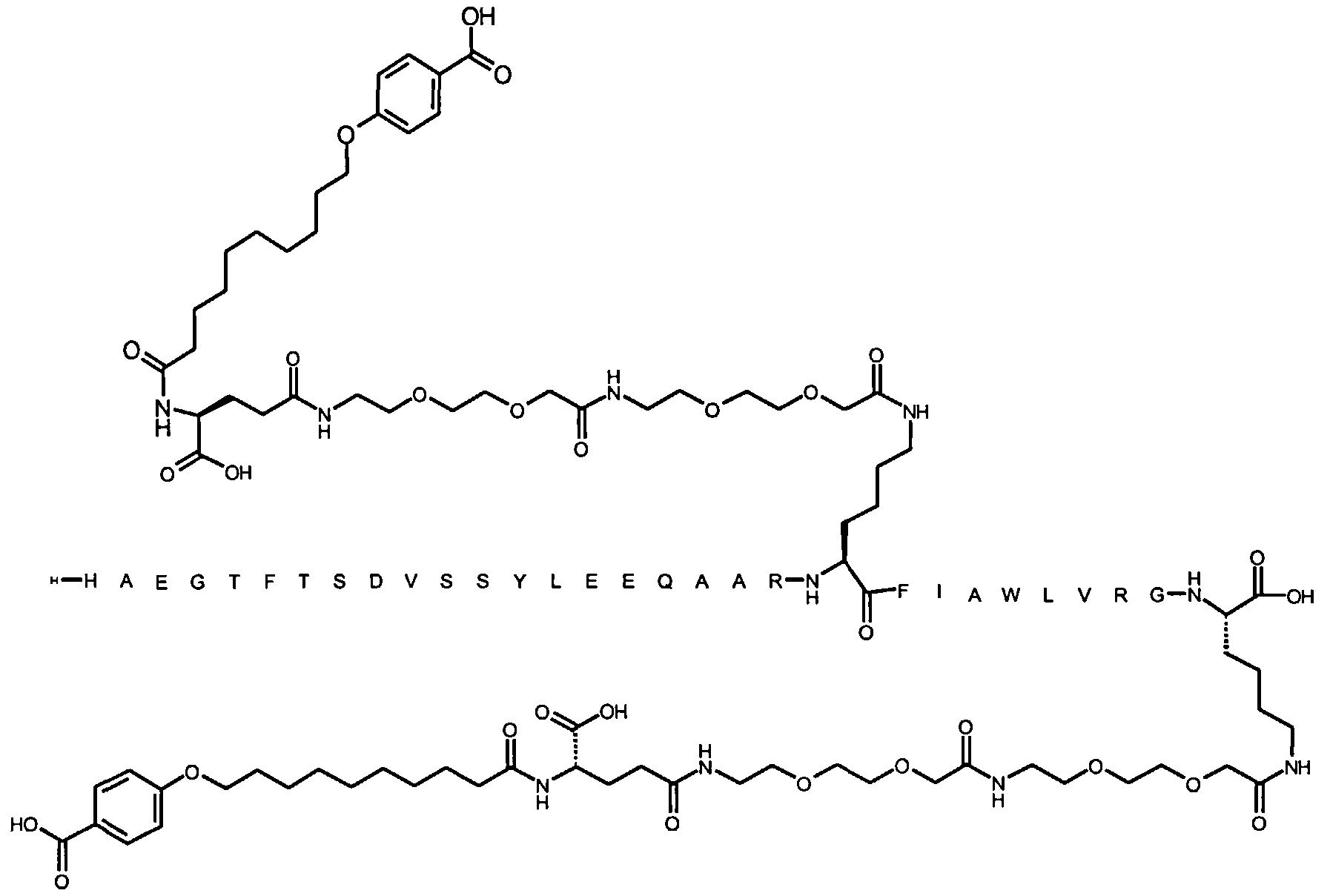
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В2_1): Rt=13,3 мин
UPLC (Способ 05_В5_1): Rt=6,5 мин
LCMS4: Rt=2,3 мин, m/z=1607 (m/3), 1205 (m/4), 964 (m/5)
Пример 4
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε37-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,Val25,Arg26,Lys27,Arg34,Lys37]-GLP-1-(7-37)-пептид
Соед. 53:
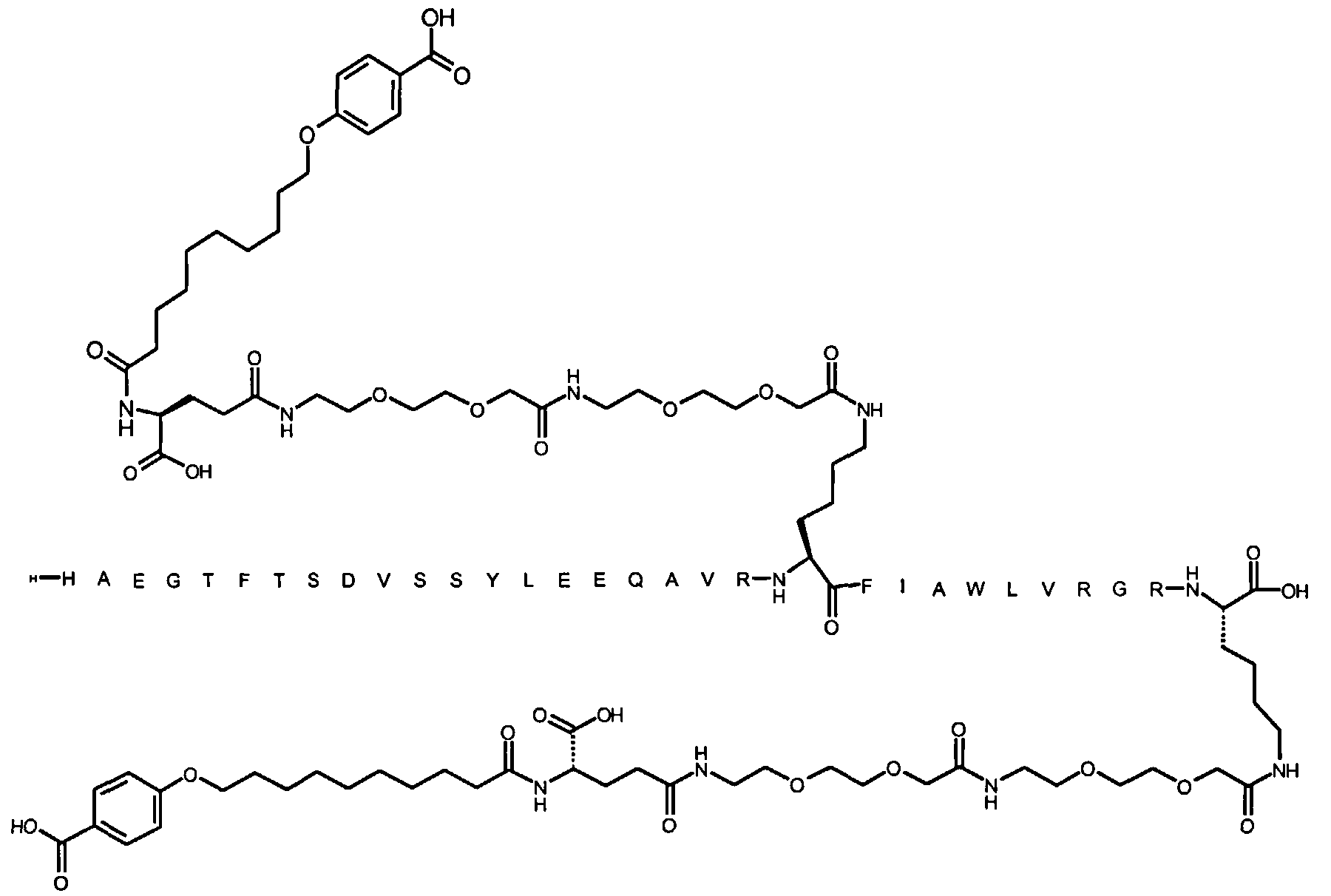
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В2_1): Rt=13,0 мин
UPLC (Способ 04_А7_1): Rt=6,9 мин
LCMS4: Rt=2,0 мин, m/z=1668 (m/3), 1251 (m/4), 1001 (m/5)
Пример 5
Nε20-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Lys20,Glu22,Arg26,Lys27,Glu30,Gly34]-GLP-1-(7-34)-пептид
Соед. 54:
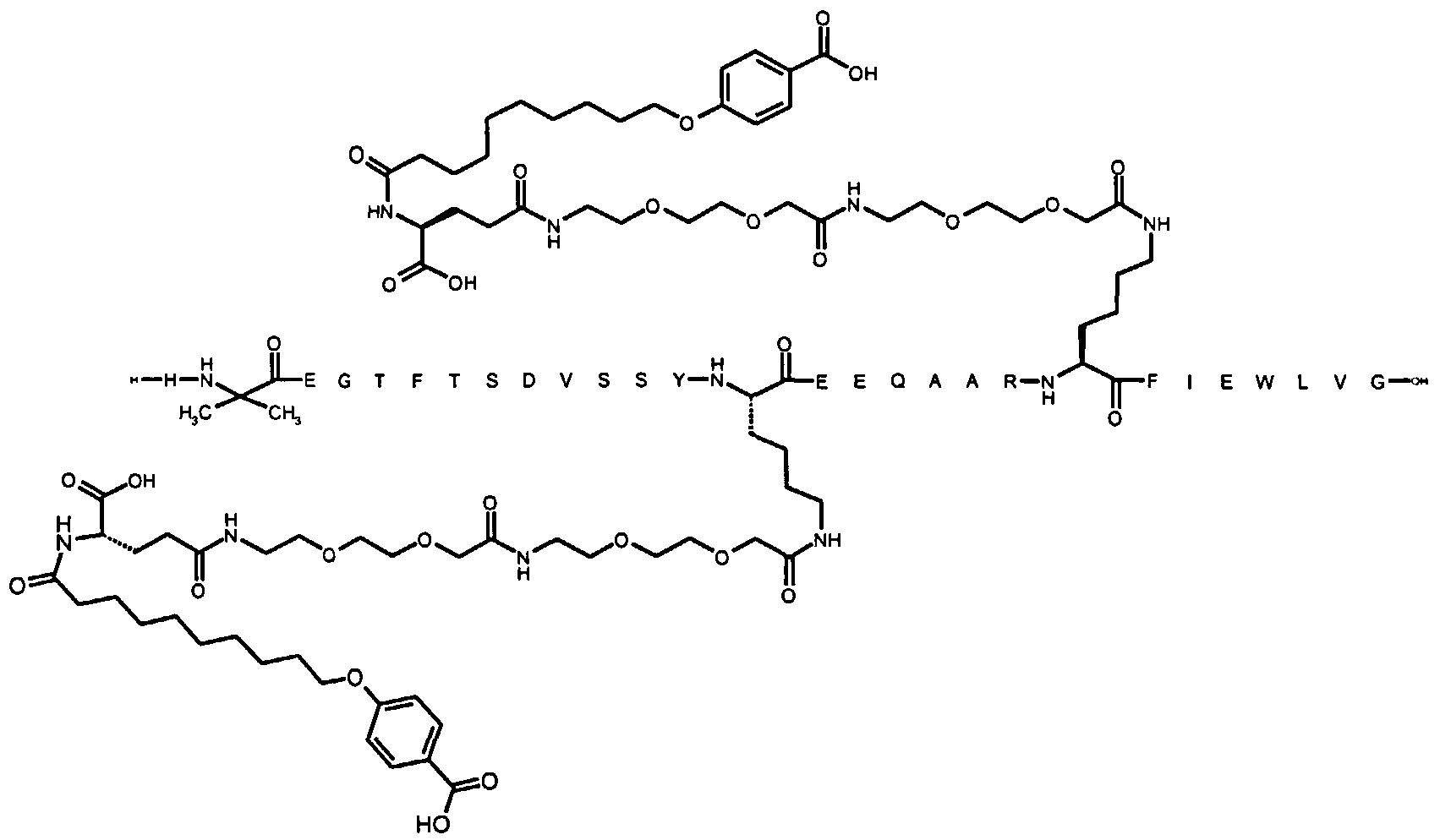
Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=9,02 мин
UPLC (Способ 04_А6_1): Rt=4,61 мин
LCMS4: Rt=2,17 мин, m/z=1540 (m/3), 1155 (m/4)
Пример 6
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Arg26,Lys27,Glu30,Arg34,Lys36]-GLP-1-(7-37)-пептидил-Glu
Соед. 55:

Способ изготовления: Способ SPPS В
UPLC (Способ 09_В2_1): Rt=13,0 мин
UPLC (Способ 05_В5_1): Rt=5,6 мин
LCMS4: Rt=2,2 мин, m/z=1664 (m/3), 1248 (m/4), 999 (m/5)
Пример 7
Nε22-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Lys22,Val25,Arg26,Lys27,His31,Arg34]-GLP-1-(7-37)-пептид
Соед. 56:
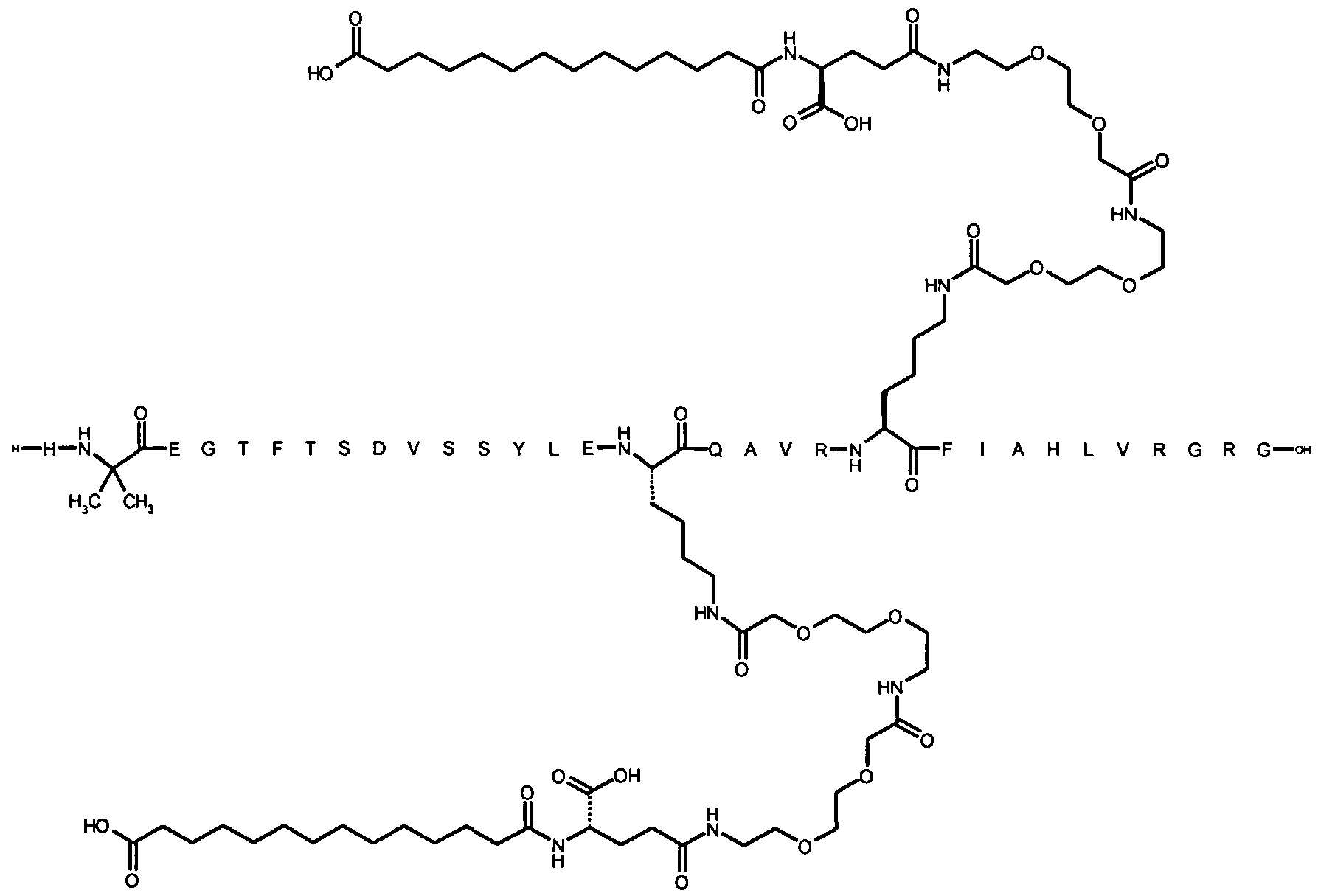
Способ изготовления: Способ SPPS В
LCMS2: Rt=4,00 мин, m/z=1599 (m/3), 1199 (m/4)
UPLC (Способ 08_В4_1): Rt=7,83 мин
UPLC (Способ 05_В9_1): Rt=7,45 мин
Пример 8
Nε22-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Lys22,Val25,Arg26,Lys27,Arg34]-GLP-1-(7-34)-пептид
Соед. 57:

Способ изготовления: Способ SPPS В
UPLC (Способ 10_В12_1): Rt=8,92 мин
LCMS4: Rt=2,58 мин, m/z=1525 (m/3), 1144 (m/4), 915 (m/5)
Пример 9
Nε22-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Lys22,Val25,Arg26,Lys27,Arg34]-GLP-1-(7-35)-пептид
Соед. 58:
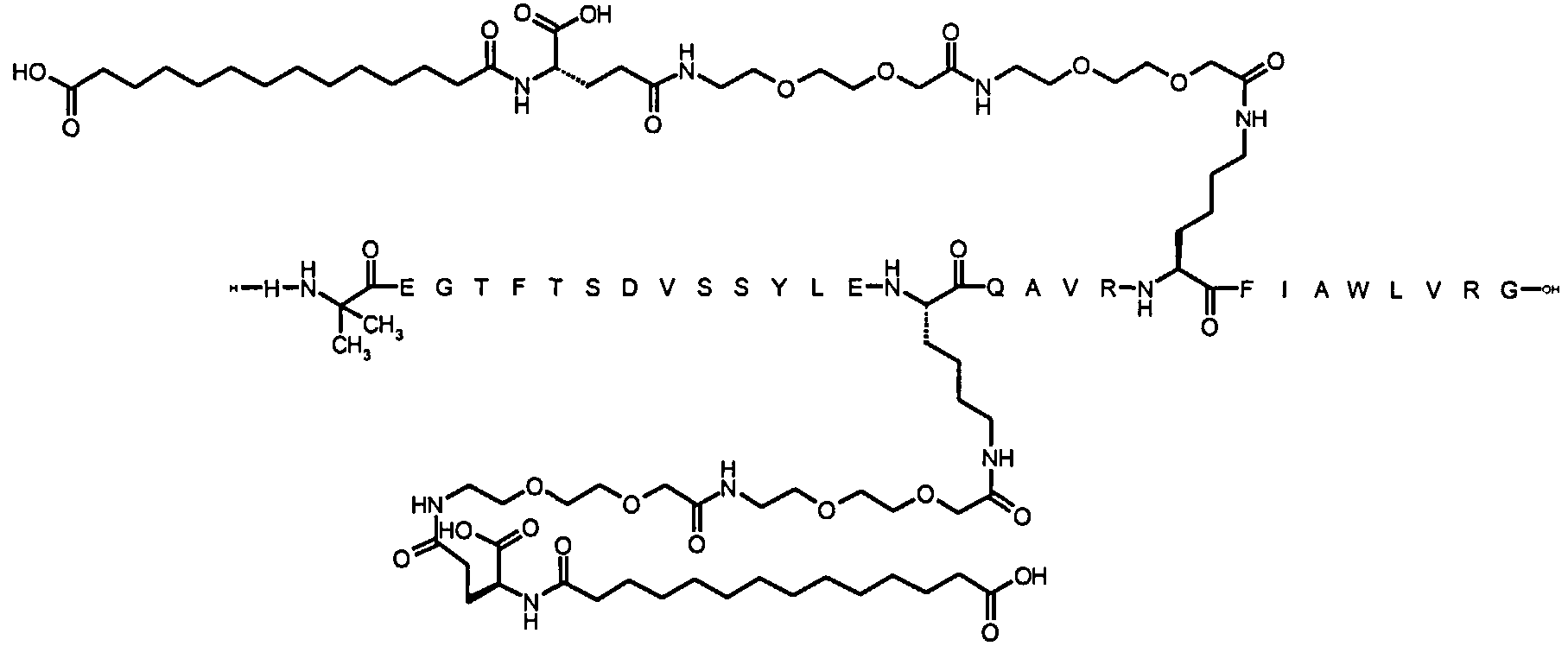
Способ изготовления: Способ SPPS E
Теоретическая молекулярная масса 4628 Да была подтверждена с помощью MALDI-MS
UPLC (Способ 09_В4_1): Rt=9,29 мин
UPLC (Способ 04_А6_1): Rt=6,49 мин
Пример 10
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[His26,Lys27,Glu30,Arg34,Lys36]-GLP-1-(7-37)-пептидил-Glu
Соед. 59:

Способ изготовления: Способ SPPS В
UPLC (Способ 08_В2_1): Rt=12,9 мин
UPLC (Способ 05_В5_1): Rt=5,5 мин
LCMS4: Rt=2,2 мин, m/z=1657 (m/3), 1243 (m/4), 995 (m/5)
Пример 11
Nε22-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Lys22,Val25,Arg26,Lys27,Glu30,Gln34]-GLP-1-(7-37)-пептид
Соед. 60:
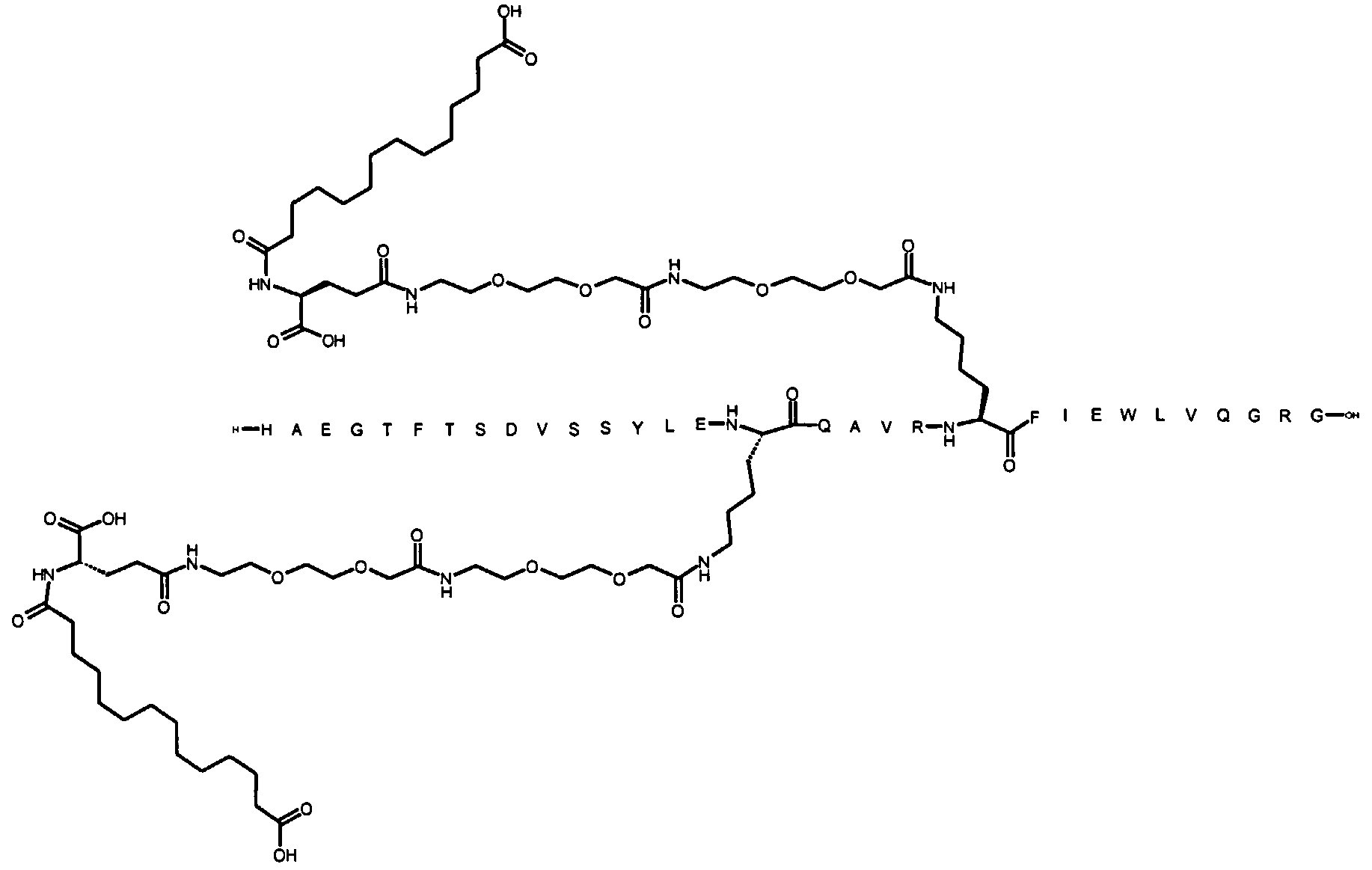
Способ изготовления: Способ SPPS В
UPLC (Способ 08_В2_1): Rt=13,5 мин
LCMS4: Rt=2,2 мин, m/z=1621 (m/3), 1216 (m/4), 973 (m/5)
Пример 12
Nα(Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Val25,Arg26,Lys27,Glu30,Arg34,Lys36]-GLP-1-(7-37)-пептидил)-Gln
Соед. 61:
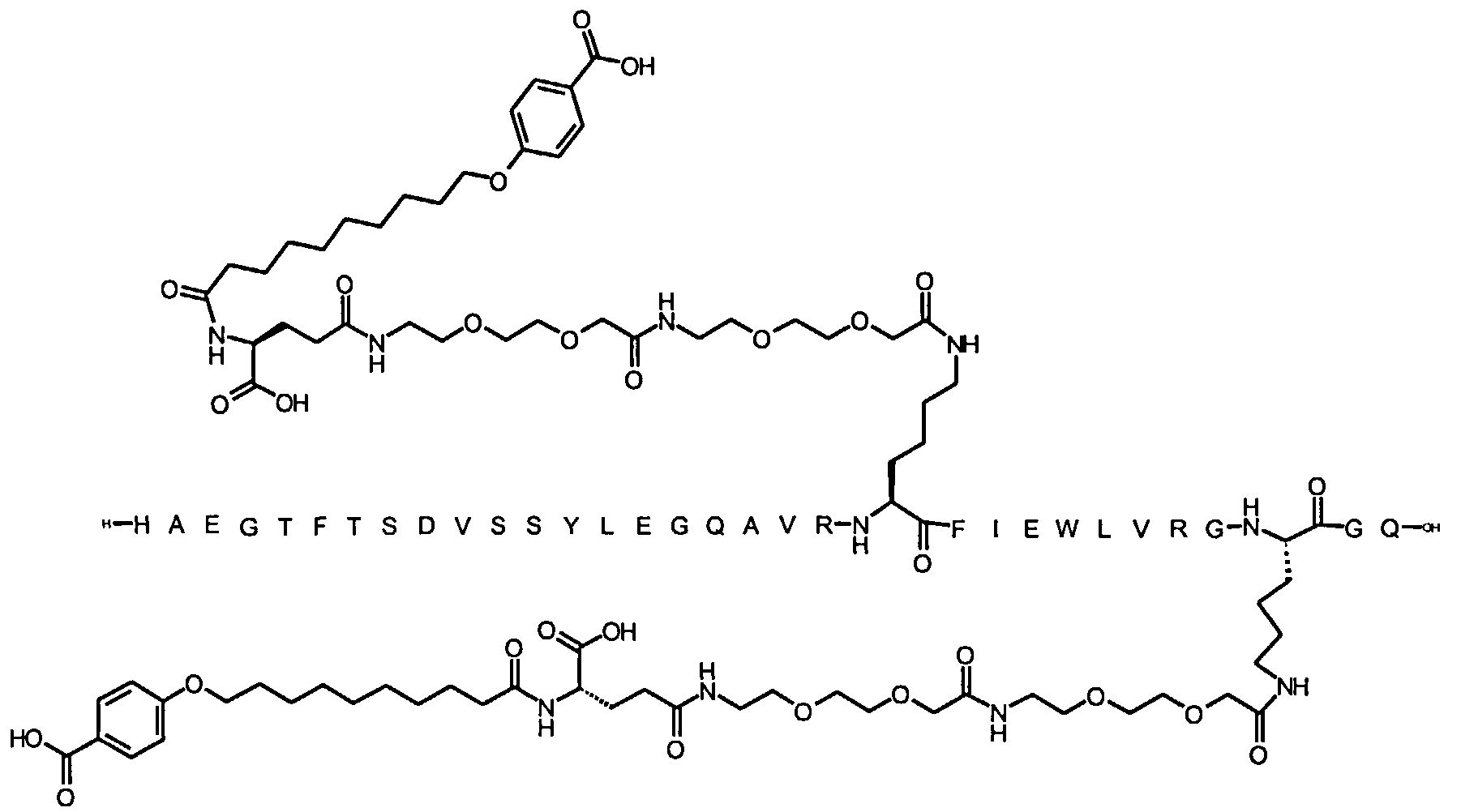
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В4_1): Rt=8,9 мин
UPLC (Способ 05_В7_1): Rt=8,8 мин
LCMS4: Rt=2,2 мин, m/z=1673 (m/3), 1255 (m/4), 1004 (m/5)
Пример 13
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Val25,Arg26,Lys27,Glu30,Gln34,Lys36]-GLP-1-(7-37)-пептидил-Glu
Соед. 62:
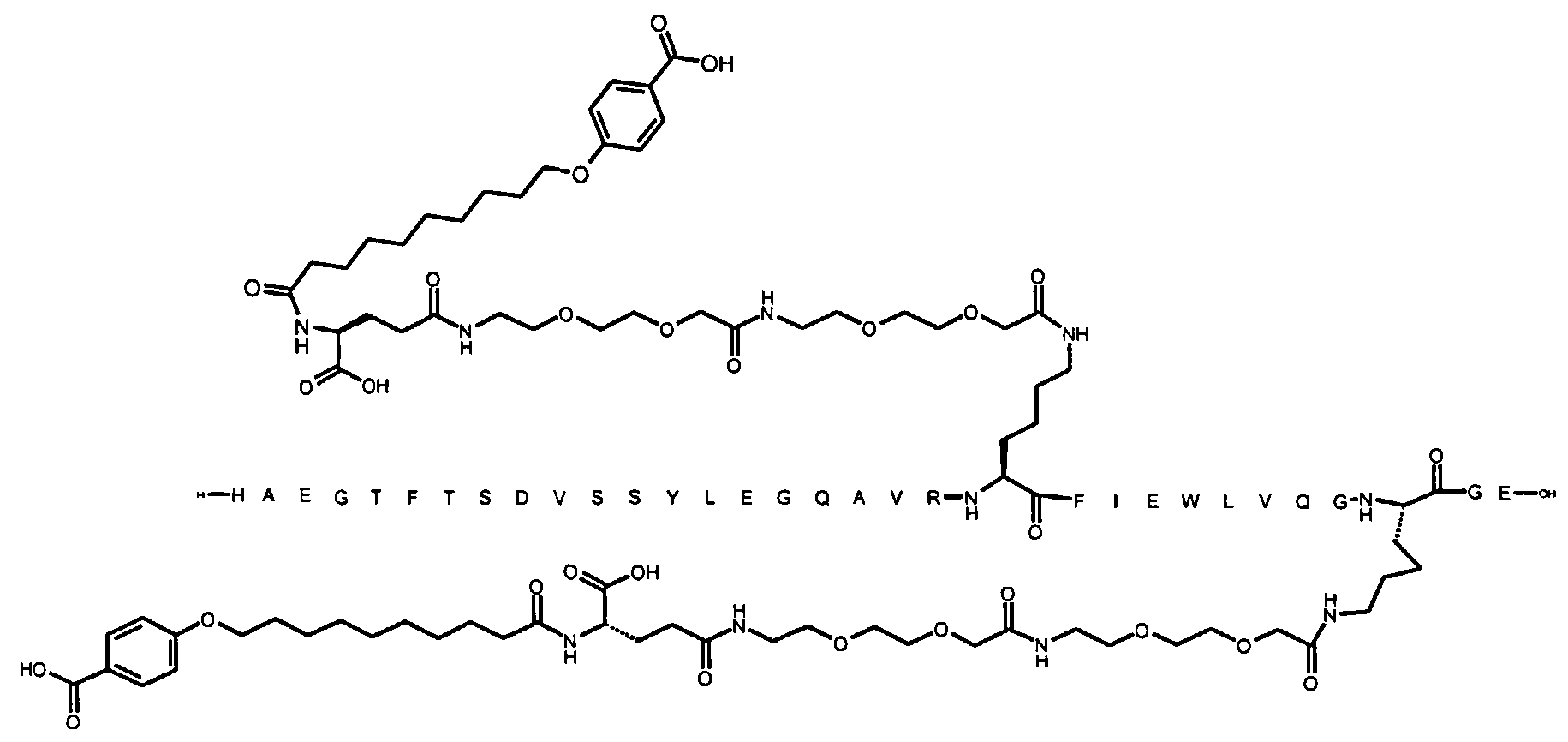
Способ изготовления: Способ SPPS В
UPLC (Способ 05_В9_1): Rt=7,9 мин
UPLC (Способ 05_В7_1): Rt=8,8 мин
LCMS4: Rt=2,3 мин, m/z=1663 (m/3), 1248 (m/4), 999 (m/5)
Пример 14
Nε22-[(4S)-4-карбокси-4-[[2-[2-[2-[[2-[2-[2-(13-карбокситридеканоиламино)этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]бутаноил], Nε27-[(4S)-4-карбокси-4-[[2-[2-[2-[[2-[2-[2-(13-карбокситридеканоиламино)этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]бутаноил]-[Lys22,Arg26,Lys27,His31,Gly34]-GLP-1-(7-34)-пептид
Соед. 63:
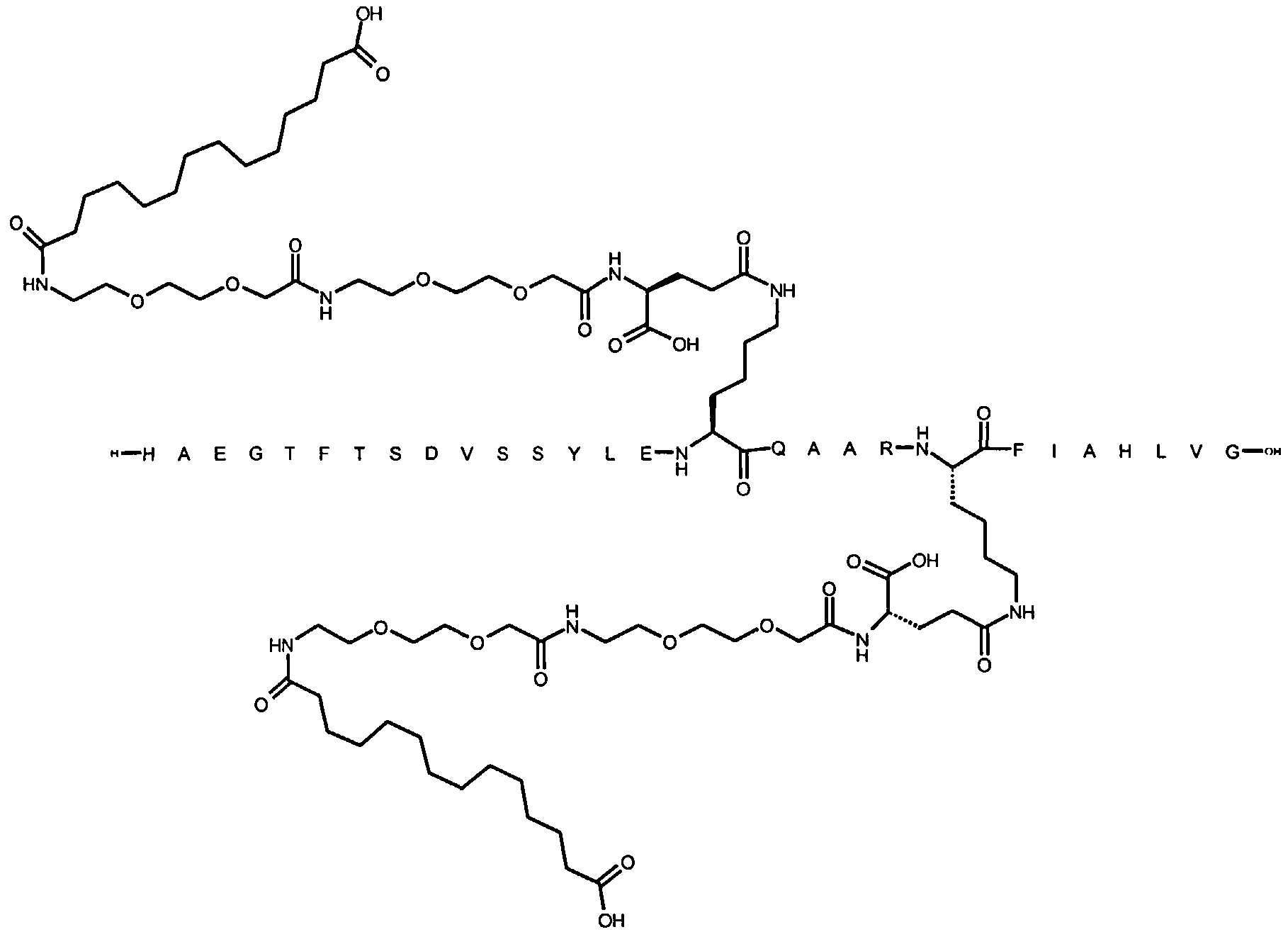
Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=8,5 мин
UPLC (Способ 05_В7_1): Rt=8,8 мин
LCMS4: Rt=2,1 мин, m/z=1462 (m/3), 1097 (m/4), 878 (m/5)
Пример 15
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε37-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Val25,Arg26,Lys27,His31,Gln34,Lys37]-GLP-1-(7-37)-пептид
Соед. 64:
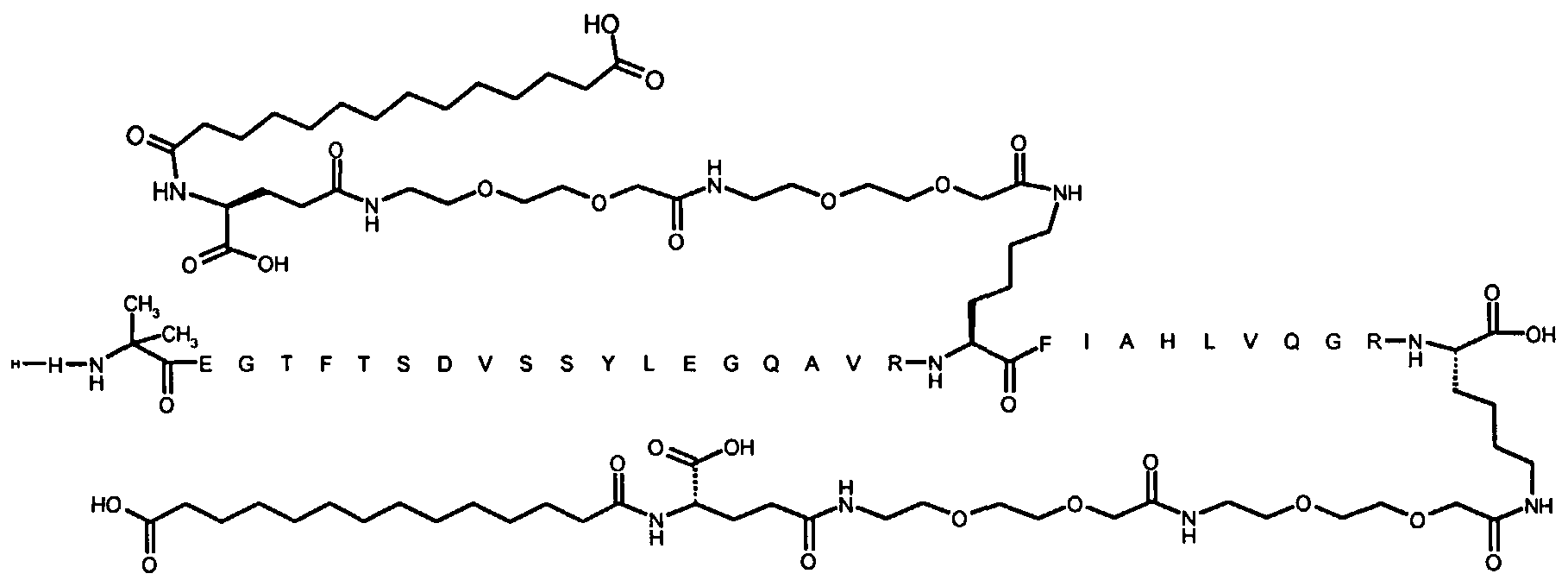
Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=8,3 мин
UPLC (Способ 05_В9_1): Rt=7,1 мин
LCMS4: Rt=2,1 мин, m/z=1589 (m/3), 1192 (m/4), 954 (m/5)
Пример 16
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε37-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Val25,Arg26,Lys27,His31,Gln34,Lys37]-GLP-1-(7-37)-пептид
Соед. 65:
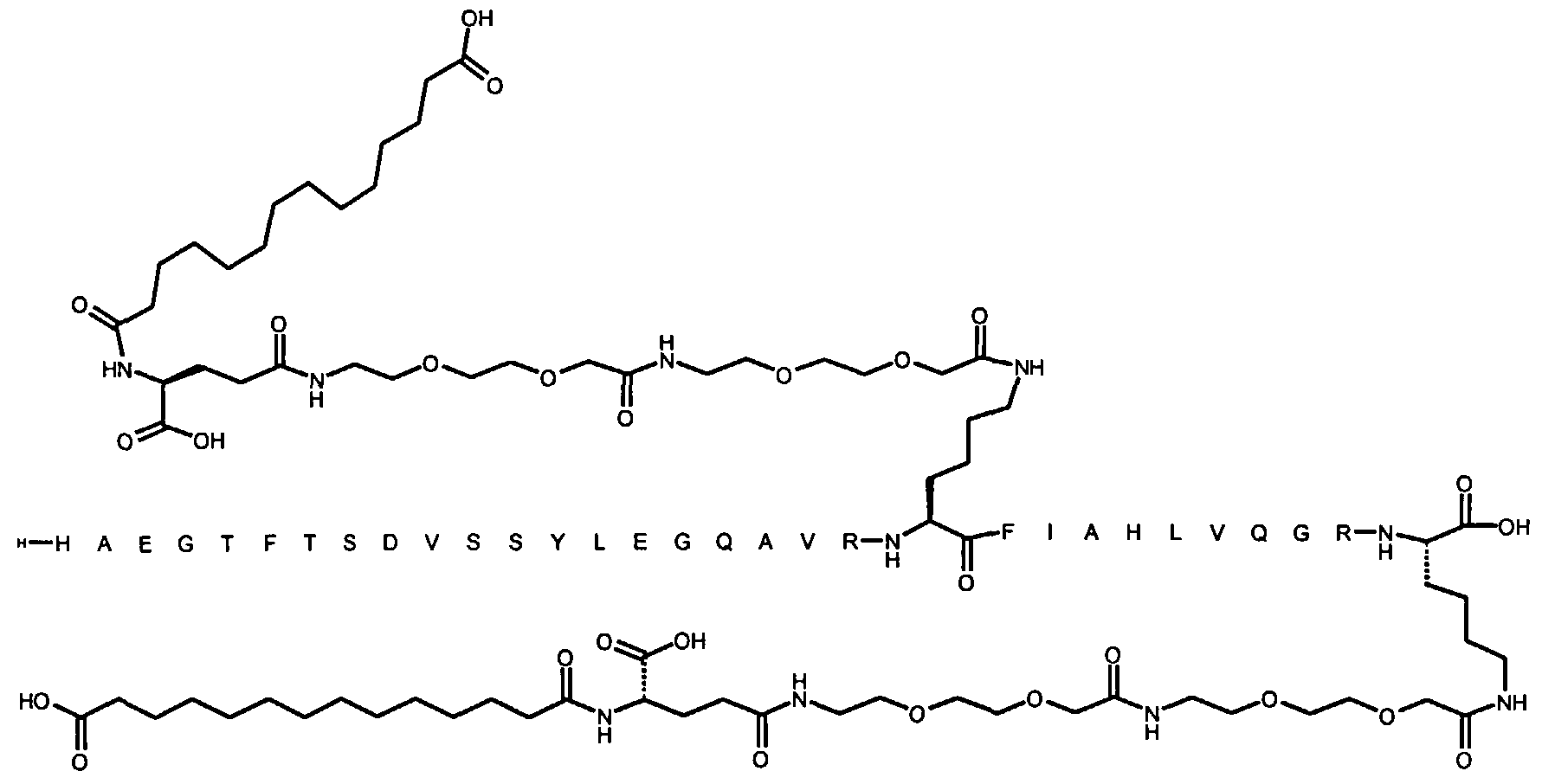
Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=8,1 мин
LCMS4: Rt=2,1 мин, m/z=1585 (m/3), 1189 (m/4), 951 (m/5)
Пример 17
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε37-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,Glu23,Val25,Arg26,Lys27,His31,Gln34,Lys37]-GLP-1-(7-37)-пептид
Соед. 66:
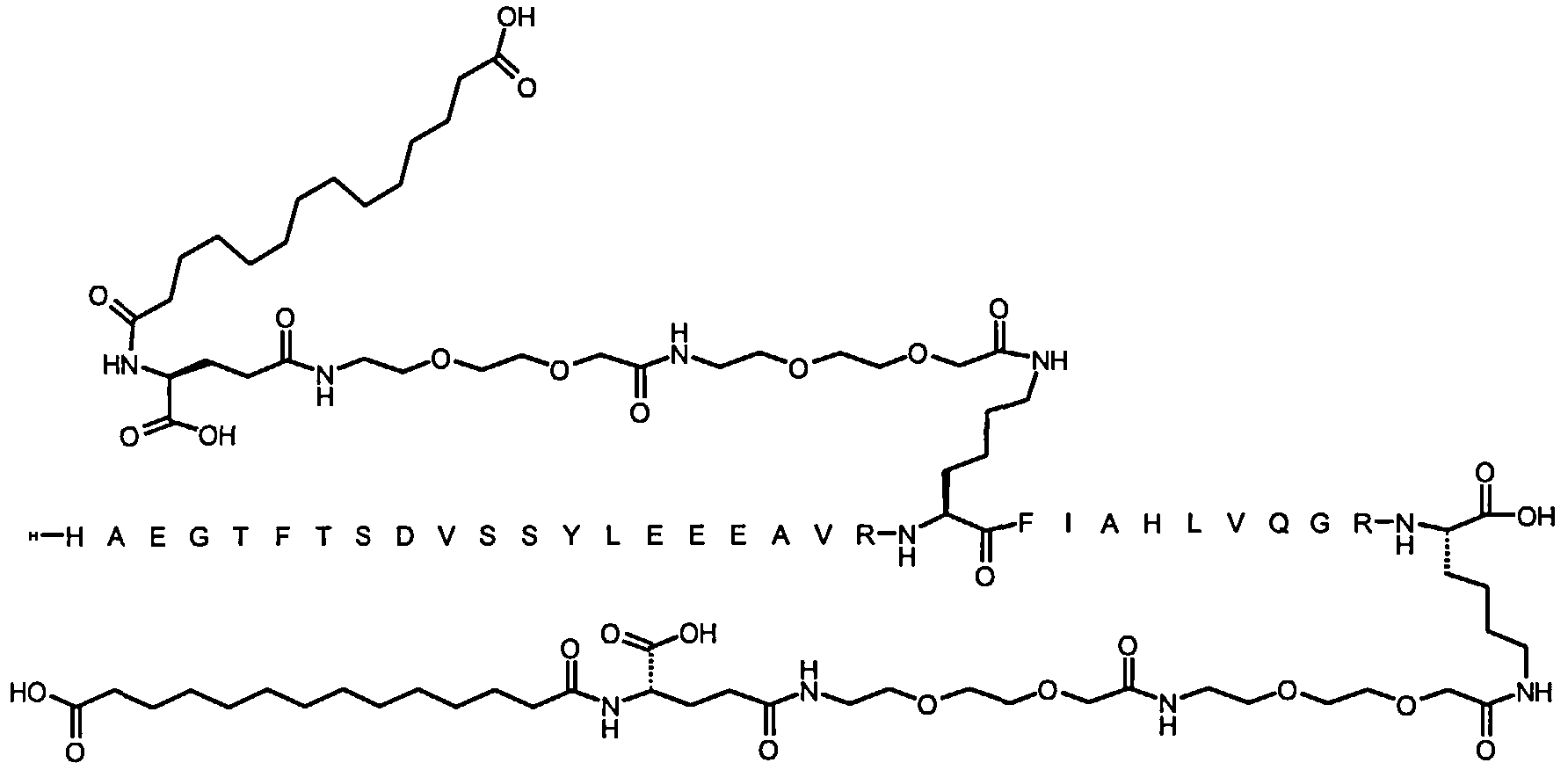
Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=8,0 мин
UPLC (Способ 05_В9_1): Rt=6,6 мин
LCMS4: Rt=2,1 мин, m/z=1609 (m/3), 1206 (m/4), 966 (m/5)
Пример 18
Nε12-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Lys12,Glu22,Arg26,Lys27,His31,Gln34]-GLP-1-(7-37)-пептид
Соед. 67:
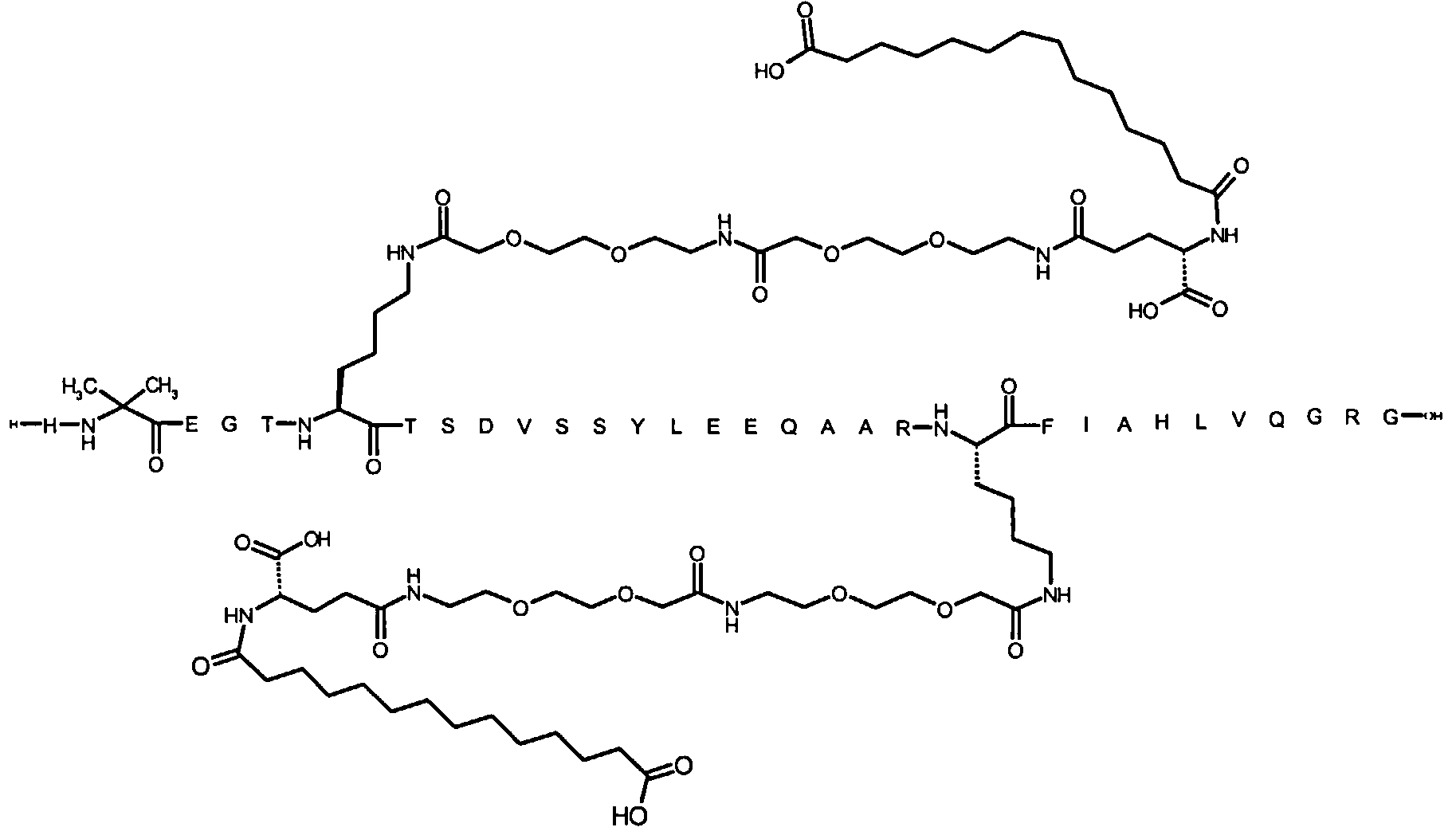
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В4_1): Rt=7,66 мин
UPLC (Способ 04_А6_1): Rt=4,09 мин
LCMS4: Rt=1,83 мин, m/z=1181 (m/4), 945 (m/5)
Пример 19
Nε22-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Lys22,Arg26,Lys27,His31,Gly34]-GLP-1-(7-34)-пептид
Соед. 68:
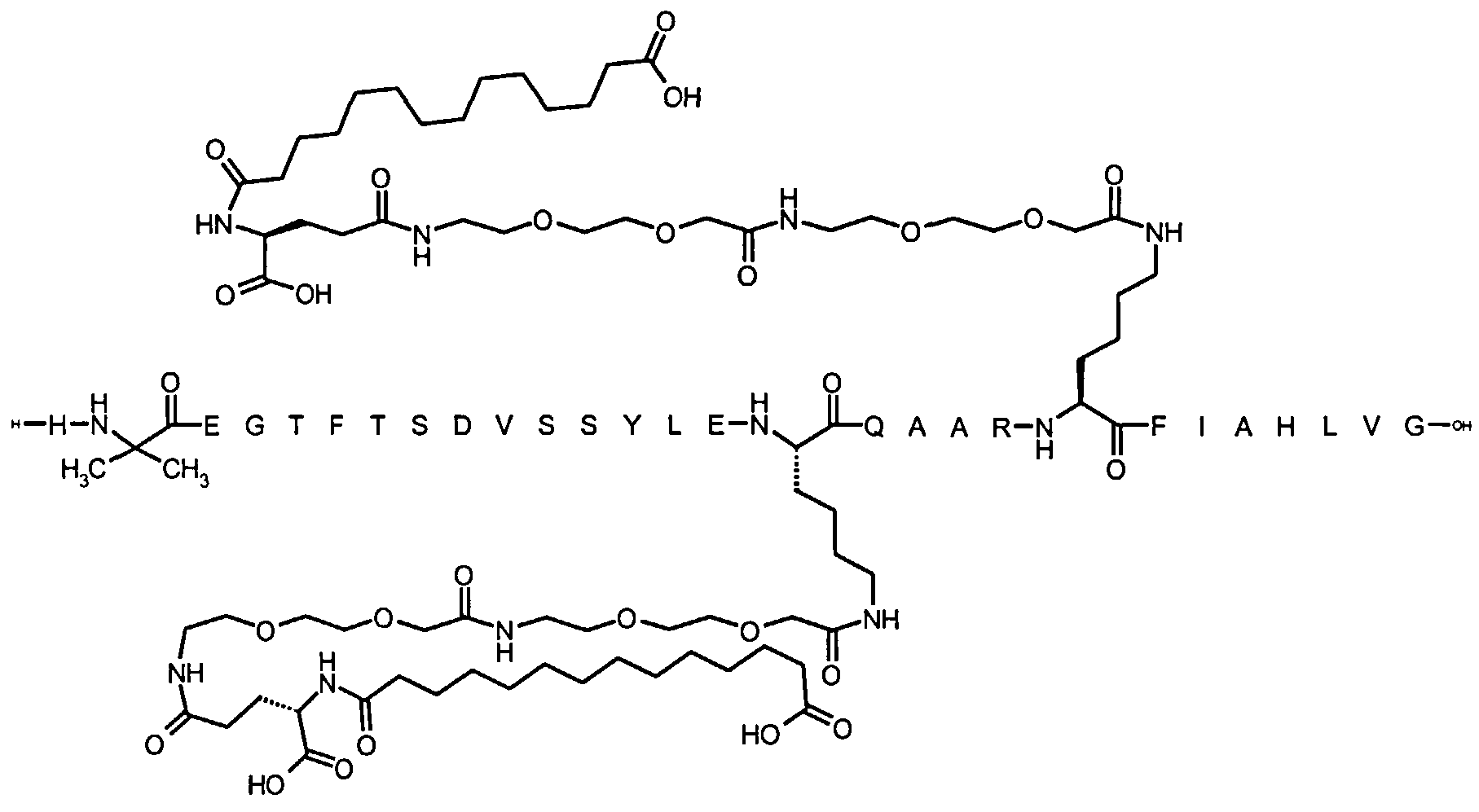
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В4_1): Rt=8,37 мин
UPLC (Способ 04_А6_1): Rt=4,41 мин
LCMS4: Rt=2,00 мин, m/z=1466 (m/3), 1100 (m/4)
Пример 20
Nε22-[(4S)-4-карбокси-4-[[2-[2-[2-[[2-[2-[2-(13-карбокситридеканоиламино)этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]бутаноил], Nε27-[(4S)-4-карбокси-4-[[2-[2-[2-[[2-[2-[2-(13-карбокситридеканоиламино)этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]бутаноил]-[Lys22,Val25,Arg26,Lys27,Glu30,Gln34]-GLP-1-(7-37)-пептид
Соед. 69:
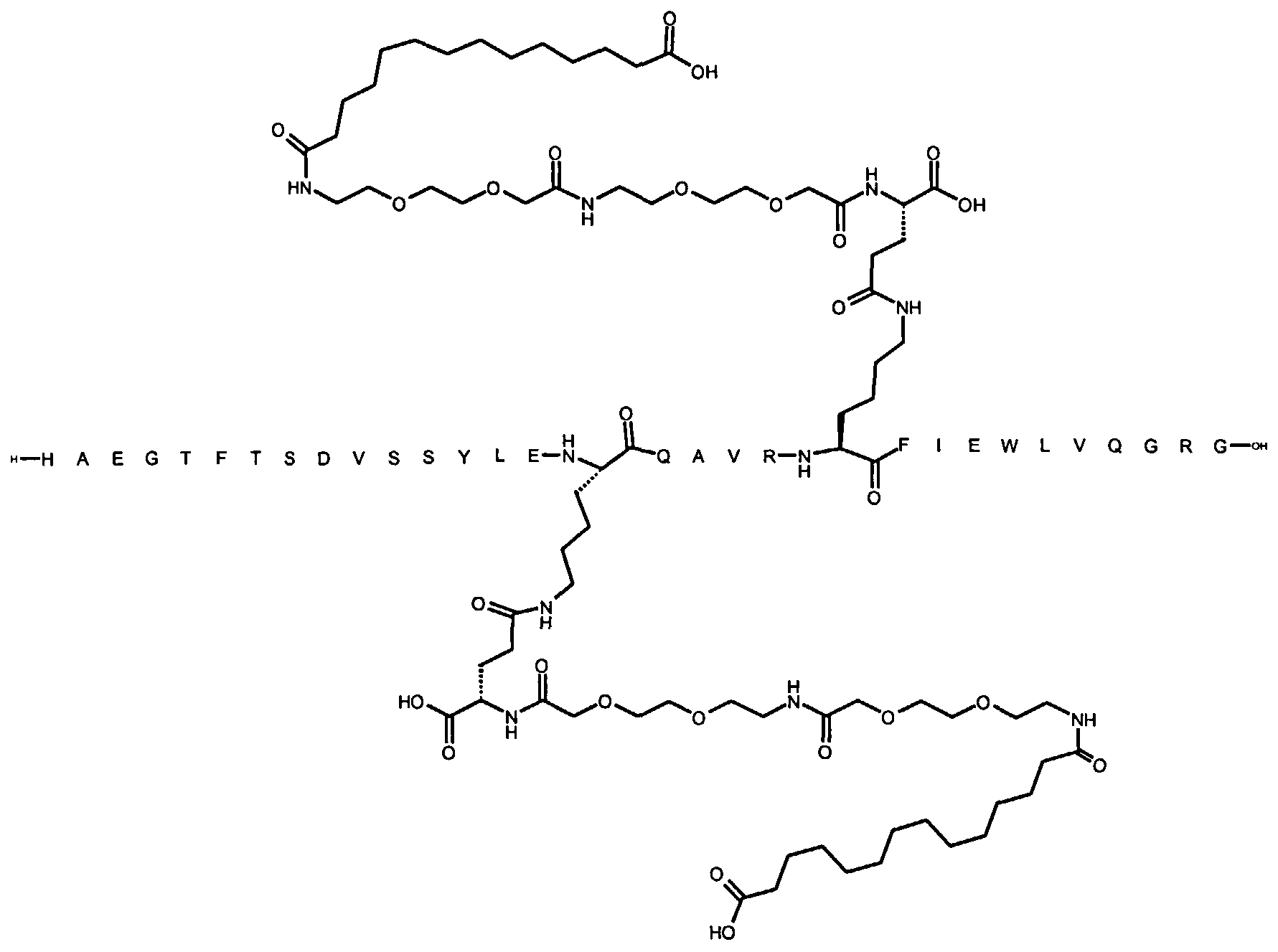
Способ изготовления: Способ SPPS Е
UPLC (Способ 09_В4_1): Rt=9,00 мин
UPLC (Способ 04_А6_1): Rt=6,50 мин
LCMS4: Rt=2,23 мин, m/z=1215 (m/4), 972 (m/5)
Пример 21
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,His26,Lys27,Glu30,Arg34,Lys36]-GLP-1-(7-37)-пептидил-Glu
Соед. 70:
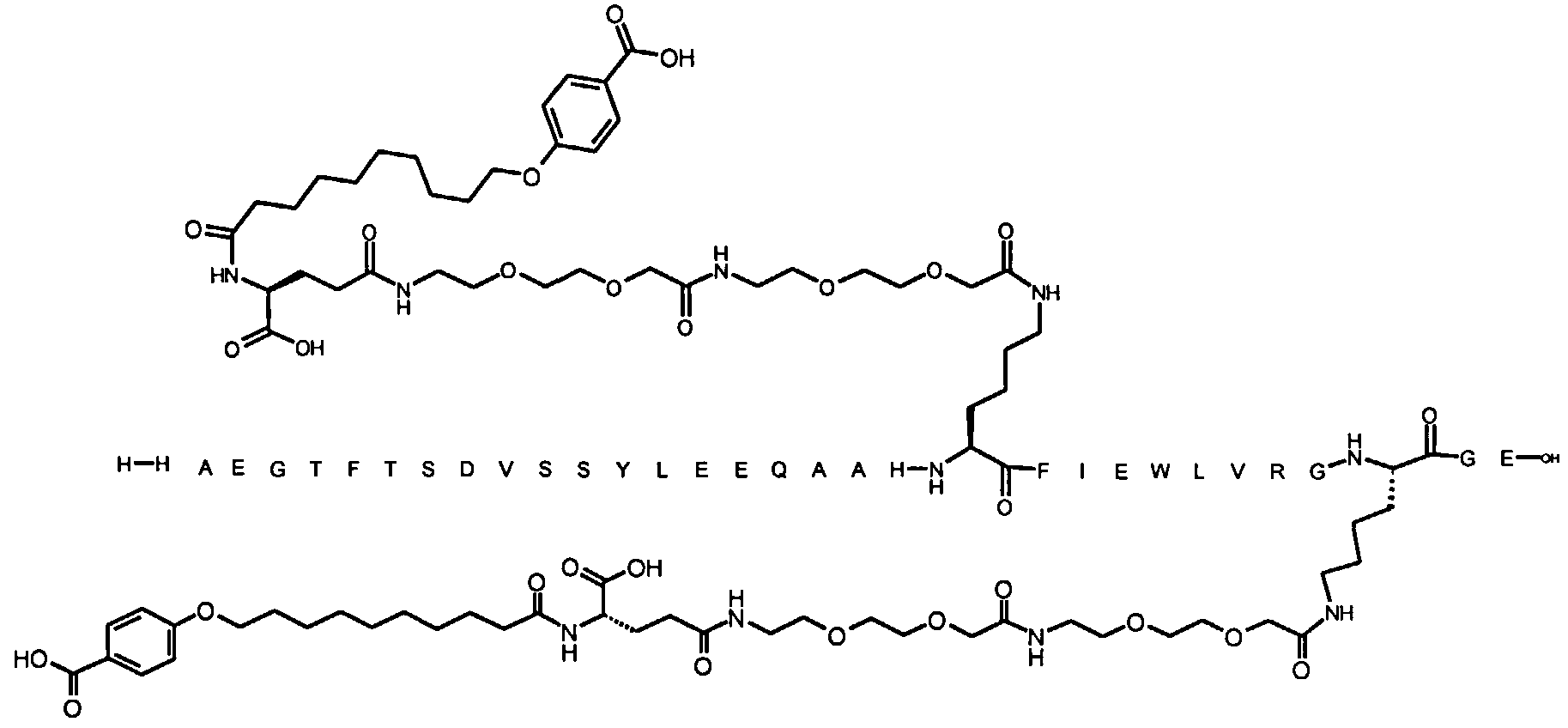
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В4_1): Rt=8,4 мин
UPLC (Способ 04_А6_1): Rt=9,3 мин
LCMS4: Rt=2,2 мин, m/z=1681 (m/3), 1261 (m/4), 1009 (m/5)
Пример 22
Nε24-[(4S)-4-карбокси-4-[[2-[2-[2-[[2-[2-[2-(13-карбокситридеканоиламино)этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]бутаноил], Nε27-[(4S)-4-карбокси-4-[[2-[2-[2-[[2-[2-[2-(13-карбокситридеканоиламино)этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]бутаноил]-[Glu22,Lys24,Arg26,Lys27,His31,Gly34]-GLP-1-(7-34)-пептид
Соед. 71:
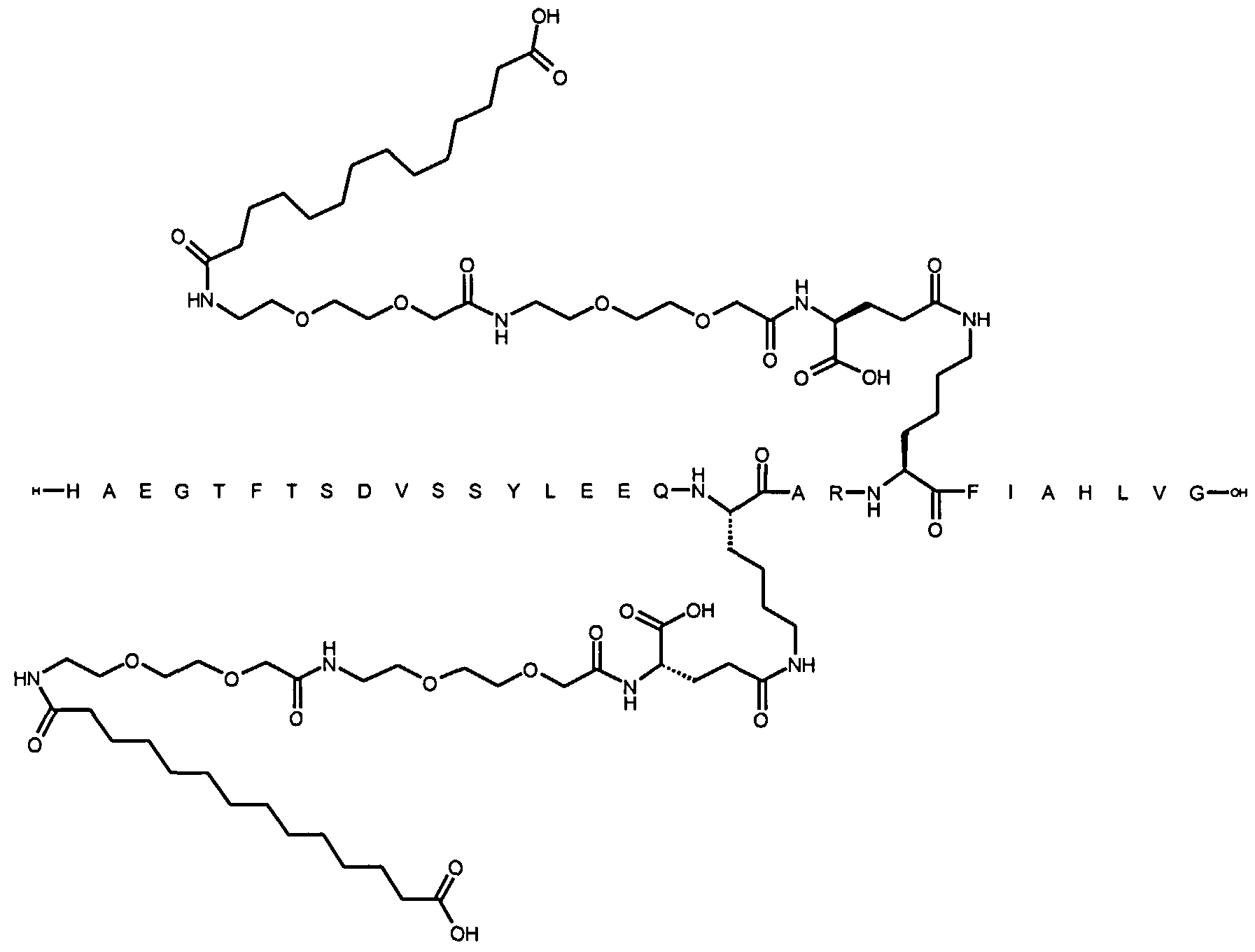
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В4_1): Rt=8,17 мин
UPLC (Способ 04_А6_1): Rt=4,65 мин
LCMS4: Rt=1,98 мин, m/z=1481 (m/3), 1111 (m/4)
Пример 23
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Val25,Arg26,Lys27,Gln34,Lys36]-GLP-1-(7-37)-пептид
Соед. 72:
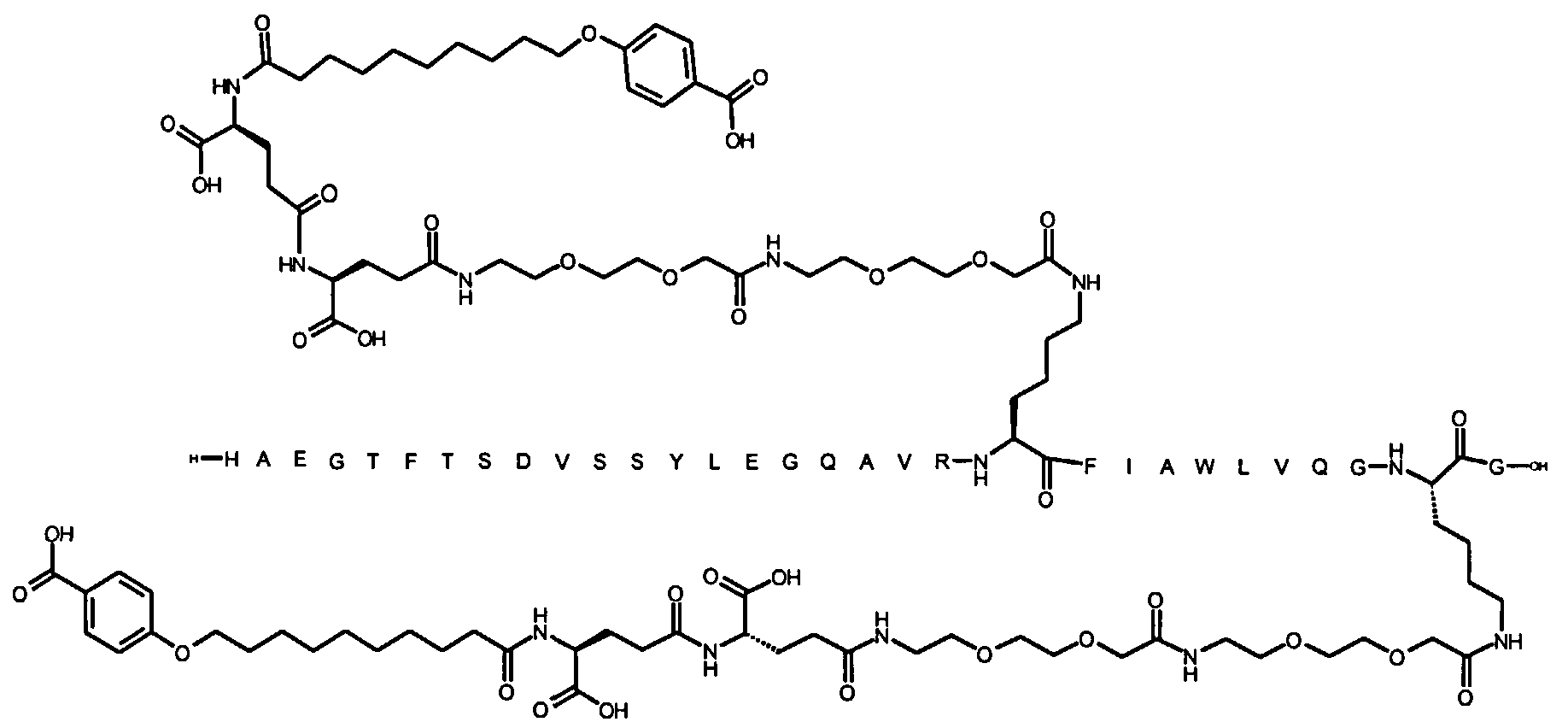
Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=8,82 мин
UPLC (Способ 05_В5_1): Rt=6,10 мин
LCMS4: Rt=2,37 мин, m/z=1687 (m/3), 1266 (m/4), 1013 (m/5)
Пример 24
Nε24-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,Lys24,Val25,Arg26,Lys27,His31,Arg34]-GLP-1-(7-37)-пептид
Соед. 73:
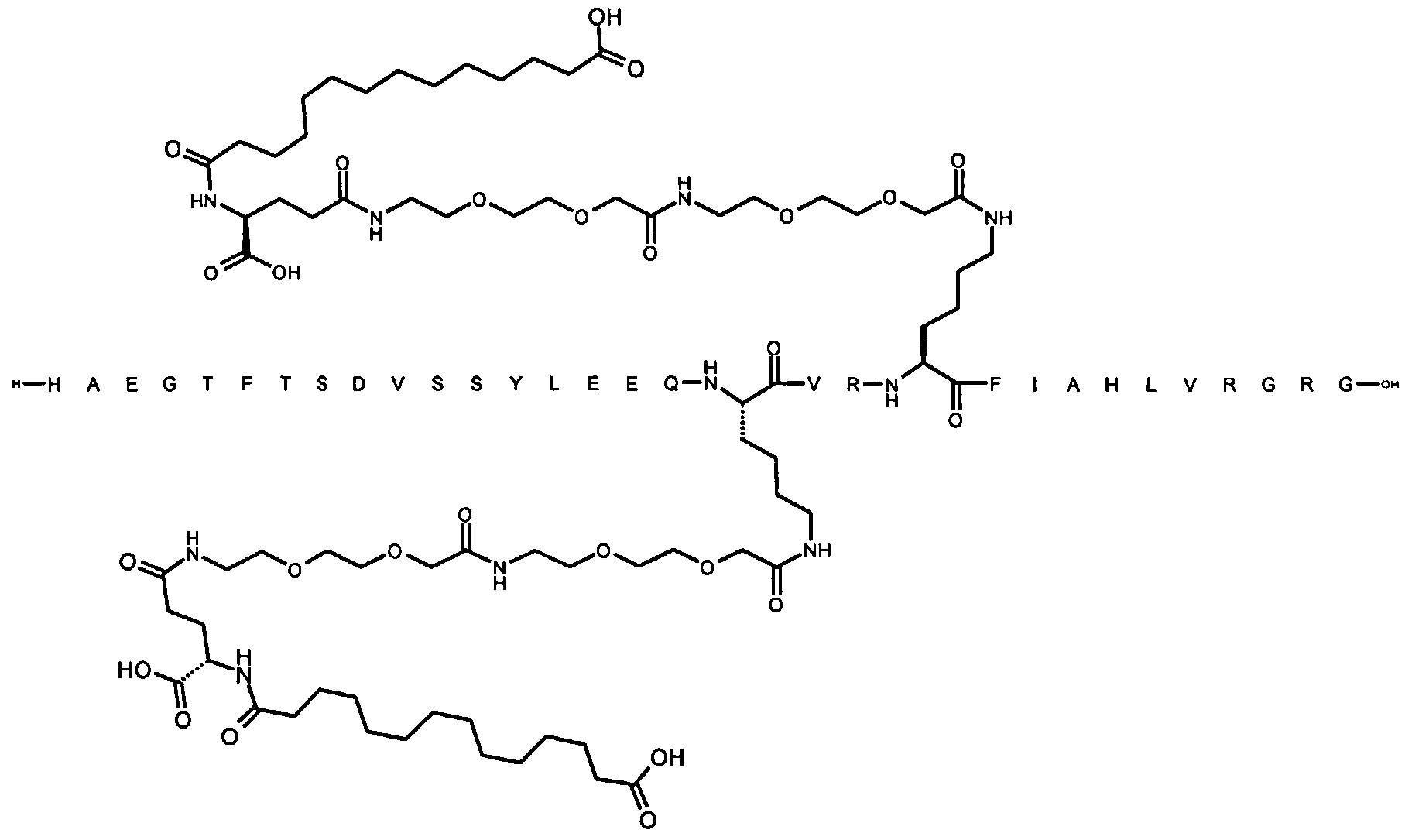
Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=7,52 мин
UPLC (Способ 04_А9_1): Rt=10,35 мин
LCMS4: Rt=1,92 мин, m/z=1613 (m/3), 1210 (m/4), 968 (m/5), 807 (m/6)
Пример 25
Nε24-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,Lys24,Arg26,Lys27,His31,Gly34]-GLP-1-(7-34)-пептид
Соед. 74:
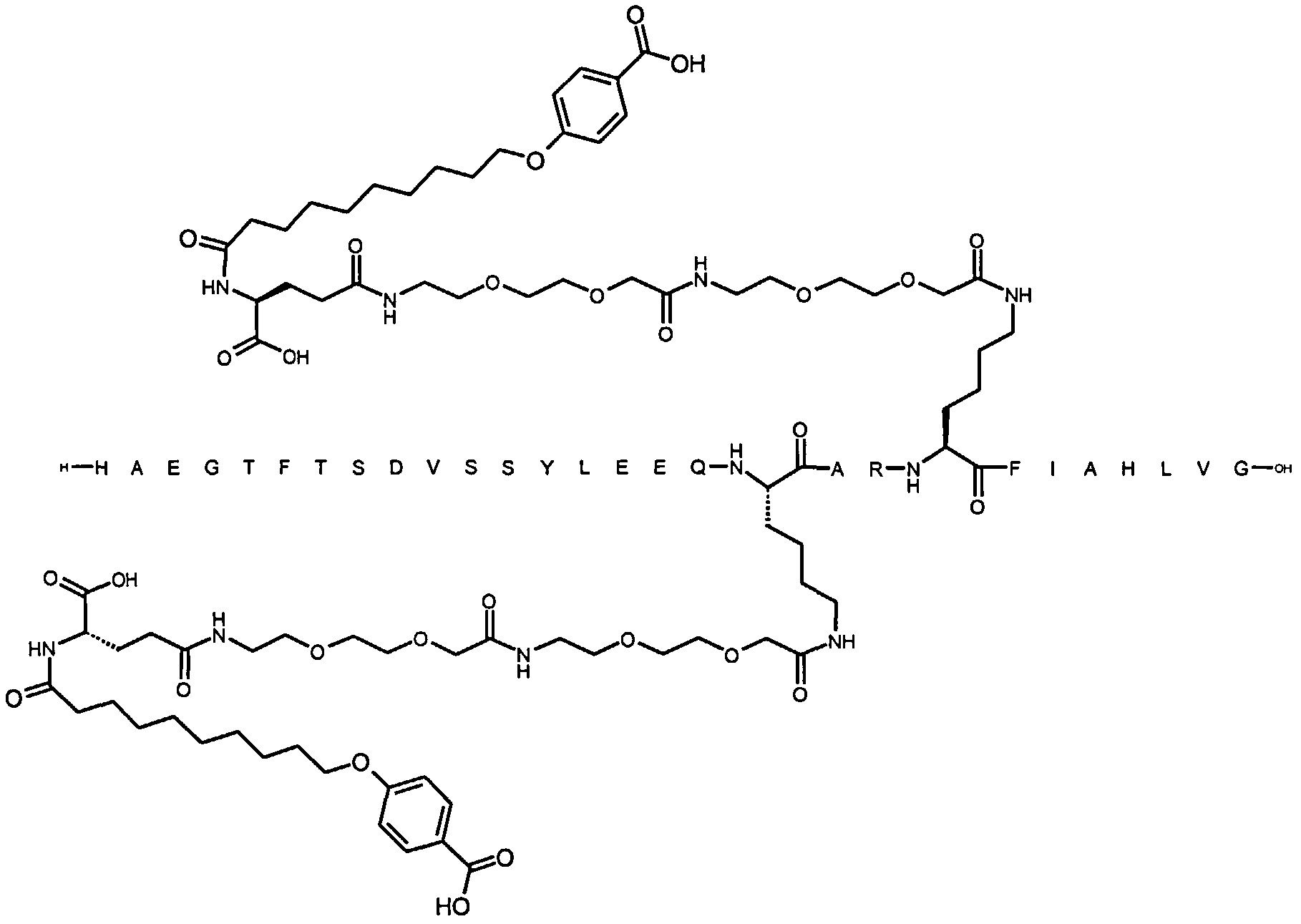
Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=8,01 мин
UPLC (Способ 04_А9_1): Rt=8,00 мин
LCMS4: Rt=2,08 мин, m/z=1513 (m/3), 1135 (m/4), 908 (m/5)
Пример 26
Nε27-[(4S)-4-карбокси-4-[[2-[2-[2-[[2-[2-[2-[[(4R)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]бутаноил], Nε36-[(4S)-4-карбокси-4-[[2-[2-[2-[[2-[2-[2-[[(4R)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]бутаноил]-[Val25,Arg26,Lys27,Gln34,Lys36]-GLP-1-(7-37)-пептид
Соед. 75:
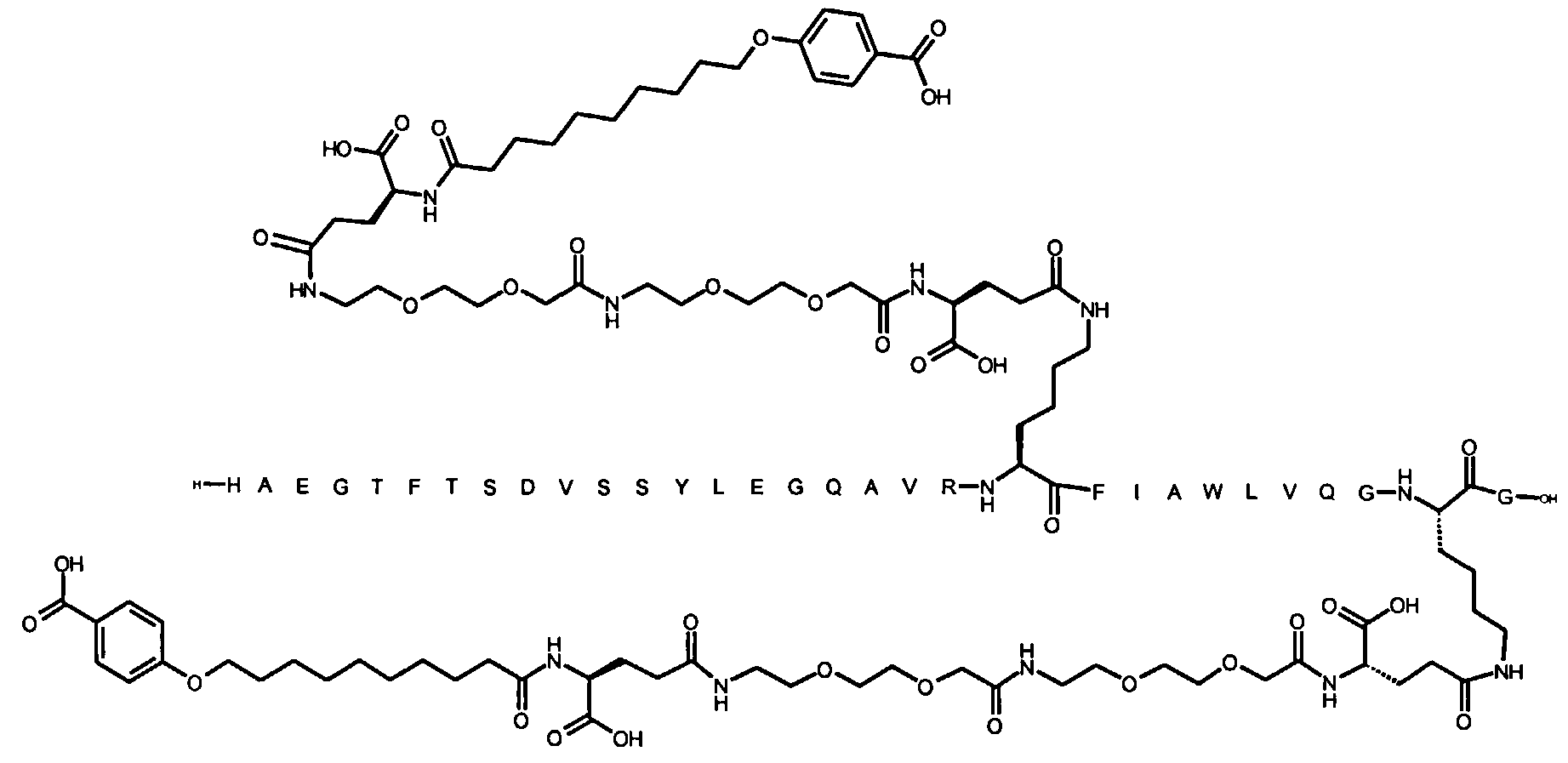
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В4_1): Rt=8,96 мин
UPLC (Способ 05_В5_1): Rt=6,54 мин
UPLC (Способ 04_А6_1): Rt=5,69 мин
LCMS4: m/z: Rt=3,07 мин, m/z=1687 (m/3), 1266 (m/4), 1013 (m/5)
Пример 27
Nε24-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,Lys24,Val25,Arg26,Lys27,Gly34]-GLP-1-(7-34)-пептид
Соед. 76:
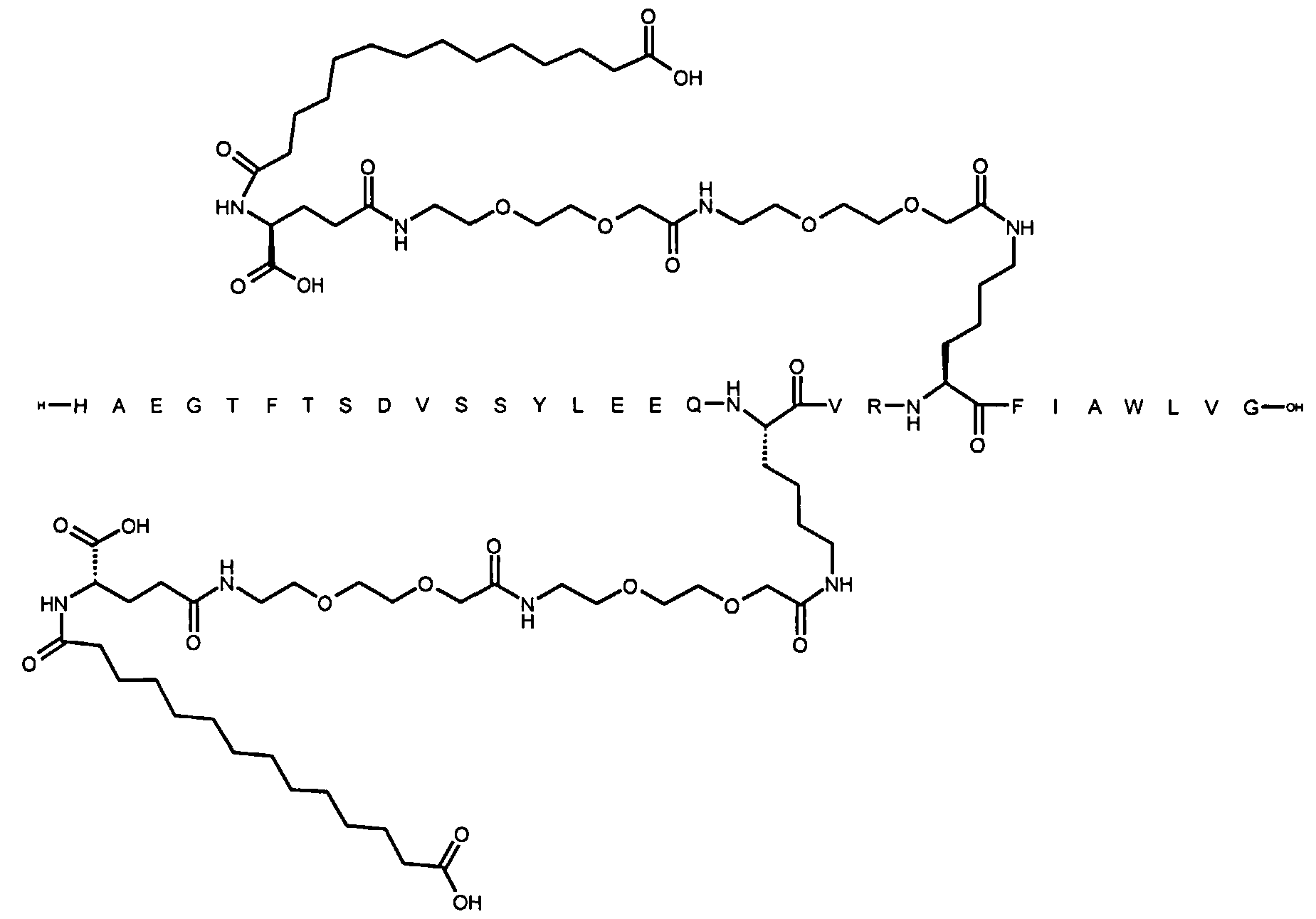
Способ изготовления: Способ SPPS В
UPLC (Способ 09_В4_1): Rt=9,25 мин
UPLC (Способ 04_А6_1): Rt=6,01 мин
LCMS4: Rt=3,31 мин, m/z=1506 (m/3), 1130 (m/4), 4520 (m/5)
Пример 28
Nε24-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,Lys24,Val25,Arg26,Lys27,Arg34]-GLP-1-(7-37)-пептид
Соед. 77:
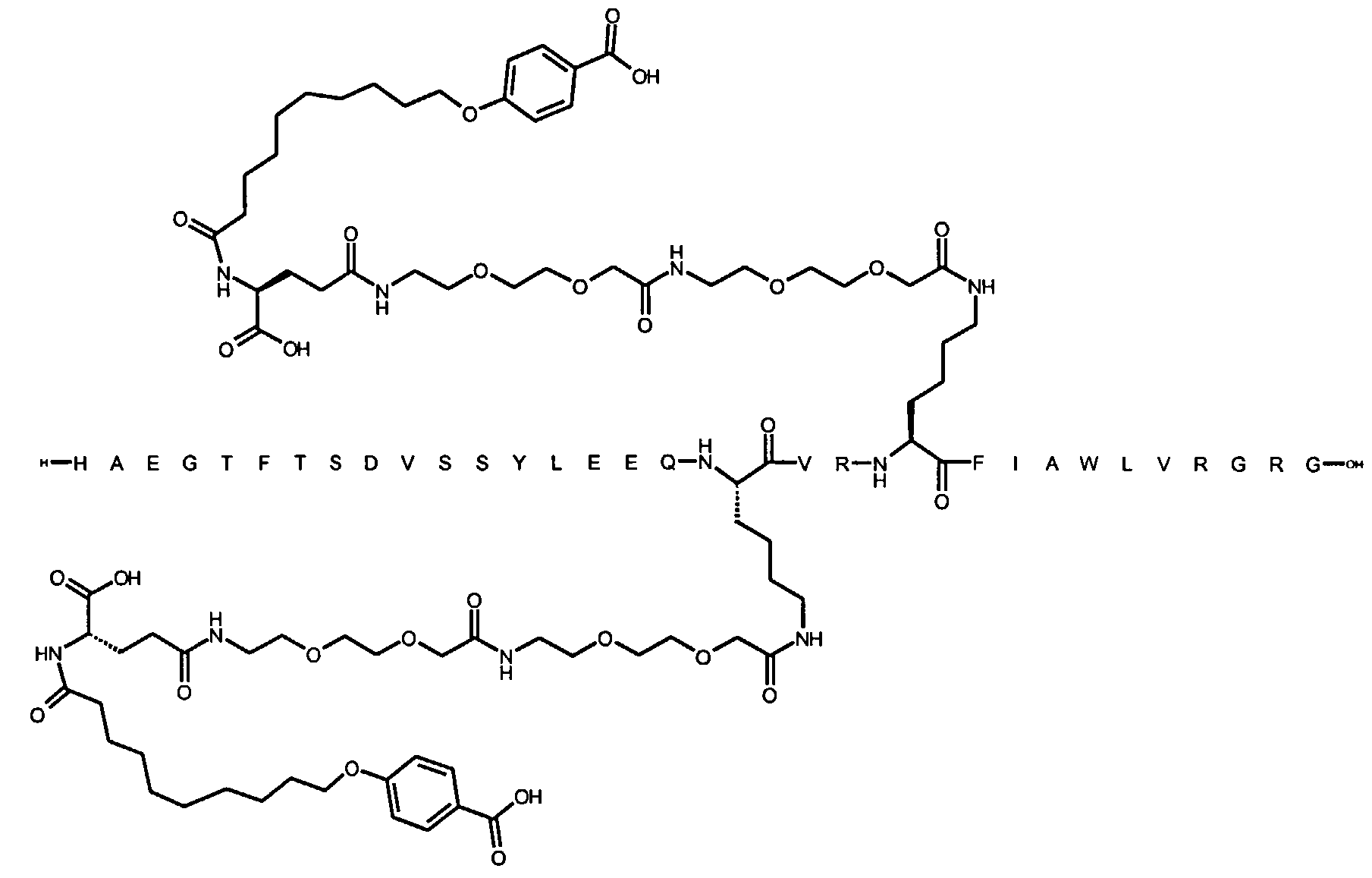
Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=8,19 мин
UPLC (Способ 04_А6_1): Rt=5,24 мин
LCMS4: Rt=3,22 мин, m/z=1663 (m/3), 1247 (m/4), 998 (m/5), 832 (m/6)
Пример 29
Nε24-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-(13-карбокситридеканоиламино)бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Glu22,Lys24,Val25,Arg26,Lys27,His31,Gln34]-GLP-1-(7-37)-пептид
Соед. 78:

Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=7,79 мин
UPLC (Способ 04_А6_1): Rt=4,87 мин
Пример 30
Nε24-[(4S)-4-карбокси-4-[[2-[2-[2-[[2-[2-[2-(13-карбокситридеканоиламино)этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]бутаноил], Nε27-[(4S)-4-карбокси-4-[[2-[2-[2-[[2-[2-[2-(13-карбокситридеканоиламино)этокси]этокси]ацетил]амино]этокси]этокси]ацетил]амино]бутаноил]-[Glu22,Lys24,Val25,Arg26,Lys27,Gly34]-GLP-1-(7-34)-пептид
Соед. 79:

Способ изготовления: Способ SPPS В
UPLC (Способ 08_В4_1): Rt=9,33 мин
UPLC (Способ 04_А6_1): Rt=6,13 мин
LCMS4: Rt=2,98 мин, m/z=1506 (m/3), 1130 (m/4), 904 (m/5)
Пример 31
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[10-(4-карбоксифенокси)деканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Aib8,Glu22,Arg26,Lys27,Glu30,Arg34,Lys36]-GLP-1-(7-37)-пептидил-Glu-Gly
Соед. 80:
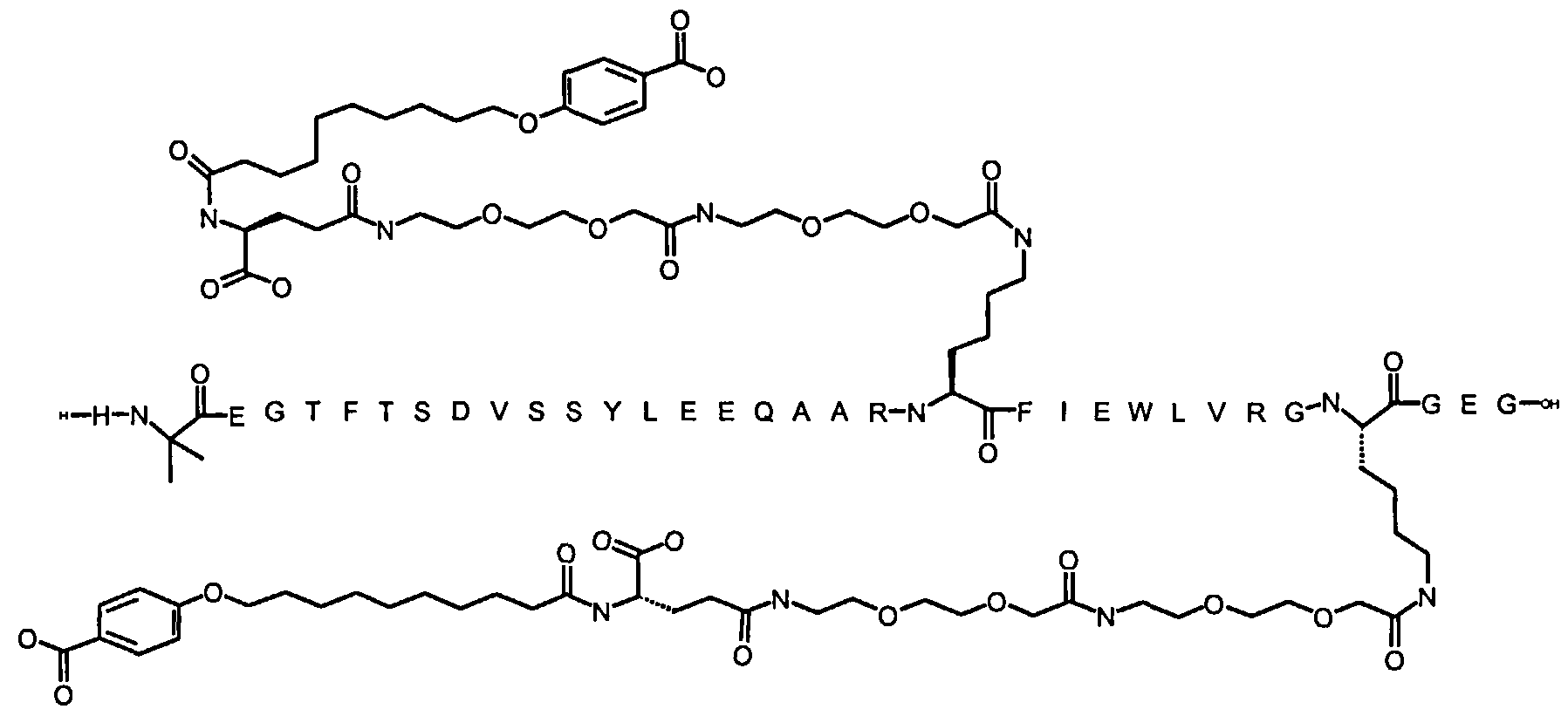
Способ изготовления: Способ SPPS В
UPLC (Способ 09_B4_1):_Rt=8,58 мин
UPLC (Способ 10_В29_1): Rt=10,6 мин
UPLC (Способ 04_А6_1): Rt=4,43 мин
LCMS4: Rt=3,72 min; m/3: 1712; m/4: 1284; m/5: 1028
Пример 32
Nε27-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[12-(4-карбоксифенокси)додеканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил], Nε36-[2-[2-[2-[[2-[2-[2-[[(4S)-4-карбокси-4-[12-(4-карбоксифенокси)додеканоиламино]бутаноил]амино]этокси]этокси]ацетил]амино]этокси]этокси]ацетил]-[Glu22,Arg26,Lys27,Glu30,Arg34,Lys36]-GLP-1-(7-37)-пептидил-Glu-Gly
Соед. 81:

Способ изготовления: Способ SPPS В
UPLC (Способ 09_В4_1): Rt=9,19 мин
UPLC (Способ 10_В29_1): Rt=13,73 мин
UPLC (Способ 04_А6_1): Rt=5,40 мин
LCMS4: Rt=2,44 мин; m/3: 1726; m/4: 1294; m/5: 1036
Фармакологические способы
Пример 33: Активность in vitro
Цель этого примера состояла в анализе активности, или силы, производных GLP-1 in vitro.
Активности этих производных GLP-1 из Примеров 1-32 определяли, как описано ниже, т.е. как стимуляцию образования циклического АМФ (цАМФ, сАМР) в среде, содержащей мембраны, экспрессирующие человеческий рецептор GLP-1.
Принцип
Очищенные плазматические мембраны из стабильно трансфицированной клеточной линии, ВНК467-12А (tk-ts13), экспрессирующей человеческий рецептор GLP-1, стимулировали аналогом GLP-1 или рассматриваемым производным и измеряли активность продукции цАМФ с помощью набора для анализа AlphaScreenTM сАМР от Perkin Elmer Life Sciences. Основной принцип анализа AlphaScreen заключается в конкуренции между эндогенным цАМФ и экзогенно добавленным биотин-цАМФ. Захват цАМФ осуществляется с помощью специфического антитела, конъюгированного с акцепторными бусинами (бидсами).
Культура клеток и получение мембран
Стабильно трансфицированную клеточную линию и высоко экспрессирующие клоны отбирали для скрининга. Клетки выращивали в 5% CO2 в DMEM, 5% FCS, 1% Pen/Strep (пенициллин/стрептомицин) и 0,5 мг/мл маркера селекции G418.
Клетки с конфлюентностью приблизительно 80% промывали 2 раза PBS и собирали с помощью Versene (водного раствора тетранатриевой соли этилендиаминтетрауксусной кислоты), центрифугировали 5 минут со скоростью 1000 об/мин и удаляли супернатант. Дополнительные этапы проводили на льду. Осадок клеток гомогенизировали в Ultrathurax в течение 20-30 секунд в 10 мл буфера 1 (20 мМ Na-HEPES, 10 мМ EDTA, рН=7,4), центрифугировали 15 минут со скоростью 20000 об/мин, а осадок ресуспендировали в 10 мл буфера 2 (20 мМ Na-HEPES, 0,1 мМ EDTA, pH=7,4). Суспензию гомогенизировали в течение 20-30 секунд и центрифугировали 15 минут со скоростью 20000 об/мин. Суспендирование в буфере 2, гомогенизацию и центрифугирование повторяли еще раз, и мембраны ресуспендировали в буфере 2. Определяли концентрацию белка и сохраняли мембраны при -80°С до использования.
Анализ проводили в 96-луночных планшетах с плоским дном (Costar, кат. №3693). Конечный объем на одну лунку составлял 50 мкл.
Растворы и реагенты
Набор для анализа AlphaScreen cAMP от Perkin Elmer Life Sciences (кат. №: 6760625M), содержащий анти-цАМФ акцепторные бидсы (10 Ед/мкл), стрептавидиновые донорные бидсы (10 Ед/мкл) и биотинилированный цАМФ (133 Ед/мкл).
Буфер AlphaScreen, рН=7,4: 50 мМ Трис-HCl (Sigma, кат. №Т3253), 5 мМ HEPES (Sigma, кат. №Н3375), 10 мМ MgCl2, 6H2O (Merck, кат. №5833); 150 мМ NaCl (Sigma, кат. №S9625), 0,01% Tween (Merck, кат. №822184). Следующие вещества были добавлены к буферу AlphaScreen перед использованием (указаны конечные концентрации): BSA (Sigma, кат. №А7906): 0,1%; IBMX (Sigma, кат. №I5879): 0,5 мМ; АТР (Sigma, кат. №А7699): 1 мМ; GTP (Sigma, кат. №G8877): 1 мкМ.
цАМФ-стандарт (коэффициент разведения в анализе равен 5): раствор цАМФ: 5 мкл 5 мМ цАМФ-стока + 495 мкл буфера AlphaScreen.
Были приготовлены серии подходящих разведении в буфере AlphaScreen цАМФ-стандарта, а также аналога GLP-1 или анализируемого производного, например, следующие восемь концентраций соединения GLP-1: 10-7, 10-8, 10-9, 10-10, 10-11, 10-12, 10-13 и 10-14 М, а также серии, например, от 10-6 до 3×10-11 цАМФ.
Мембрана/Акцепторные бидсы
Мембраны получали из клеток hGLP-1/BHK 467-12А с концентрацией 6 мкг/лунка, что соответствует 0,6 мг/мл (количество мембран, используемое на лунку, может варьировать).
«Нет мембран»: акцепторные бидсы (конечная концентрация 15 мкг/мл) в буфере AlphaScreen
«6 мкг/лунка мембран»: мембраны + акцепторные бидсы (конечная концентрация 15 мкг/мл) в буфере AlphaScreen
Добавление аликвоты (10 мкл) «Нет мембран» к стандарту цАМФ (на лунку в двух повторах) и положительный и отрицательный контроли
Добавление аликвоты (10 мкл) «6 мкг/лунка мембран» к GLP-1 и аналогам (на лунку в двух или трех повторах)
Положительный контроль: 10 мкл «Нет мембран» + 10 мкл буфера AlphaScreen
Отрицательный контроль: 10 мкл «Нет мембран» + 10 мкл стокового раствора цАМФ (50 мкМ)
Такак бидсы чувствительны к прямому свету, любые манипуляции проводят в темноте (как можно более темном месте) или в зеленом свете. Все разведения осуществляют на льду.
Процедура
1. Приготовить буфер AlphaScreen.
2. Растворить и разбавить GLP-1/аналоги/стандарт цАМФ в буфере AlphaScreen.
3. Приготовить раствор донорных бидсов путем смешивания донорных бидсов со стрептавидином (2 Ед/лунка) и биотинилированного цАМФ (1,2 Ед/лунка) и инкубировать 20-30 минут в темноте при комнатной температуре.
4. Добавить цАМФ/GLP-1/аналоги в планшет: 10 мкл на лунку.
5. Приготовить раствор мембран/акцепторных бидсов и добавить в планшет: 10 мкл на лунку.
6. Добавить донорные бидсы: 30 мкл на лунку.
7. Обернуть планшет алюминиевой фольгой и инкубировать на шейкере (очень медленно) в течение 3 часов при комнатной температуре.
8. Рассчитать на AlphaScreen - каждый планшет предварительно инкубировать в AlphaScreen в течение 3 минут перед подсчетом.
Результаты
Значения ЕС50 [пМ] рассчитаны с использованием программного обеспечения Graph-Pad Prism (версия 5) и показаны в Таб.1 ниже. Активность всех производных in vitro подтверждена.
|
Средняя активность in vitro для анализированных соединений (среднее ЕС50) составляла 340 пМ. Большинство производных имели высокую активность in vitro, соответствующую ЕС50 менее 1200 пМ.
Для сравнения, соединение №13 в таблице 1 в Journal of Medicinal Chemistry (2000), vol.43, no.9, p.1664-669 (GLP-1 (7-37), ацилированное на К26,34 бис-С12-двухосновной кислотой), обладало активностью in vitro, соответствующей ЕС50 1200 пМ.
Пример 34: GLP-1-рецепторное связывание
Цель данного эксперимента состояла в изучении связывания производных GLP-1 с рецептором GLP-1 и того, как связывание потенциально влияет на присутствие альбумина. Изучение проводилось в эксперименте in vitro, как описано ниже.
Аффинность связывания производных GLP-1 из Примеров 1-32 с человеческим рецептором GLP-1 измеряли по их способности вытеснять 125I-GLP-1 из рецептора. Лираглутид и семаглутид были включены в качестве сравнительных соединений. Для того чтобы проверить связывание производных с альбумином, был проведен анализ с низкой концентрацией альбумина (0,001%, соответствующей остаточному количеству в трейсере), а также с высокой концентрацией белка (добавлено 2,0%). Сдвиг в аффинности связывания, IC50, является свидетельством того, что рассматриваемый пептид связывается с альбумином, и тем самым предсказывает потенциально пролонгированный фармакокинетический профиль рассматриваемого пептида на животных моделях.
Условия
Виды (in vitro): хомяк
Биологическая конечная точка: связывание с рецептором
Способ анализа: SPA
Рецептор: рецептор GLP-1
Клеточная линия: BHK tk-ts13
Культура клеток и очистка мембран
Для скрининга отбирали стабильно трансфицированную клеточную линию и высоко экспрессирующий клон. Клетки выращивали в 5% CO2 в DMEM, 10% FCS, 1% Pen/Strep (пенициллин/стрептомицин) и 1,0 мг/мл маркера селекции G418.
Клетки (с конфлюентностью приблизительно 80%) промывали 2 раза PBS и собирали с помощью Versene (водного раствора тетранатриевой соли этилендиаминтетрауксусной кислоты), после чего их отделяли путем центрифугирования со скоростью 1000 об/мин в течение 5 минут. На последующих этапах клетки/осадок клеток по мере возможности должны находиться на льду. Осадок клеток гомогенизировали в Ultrathurax в течение 20-30 секунд в соответствующем количестве буфера 1 (в зависимости от количества клеток, например, в 10 мл). Гомогенизат центрифугировали 15 минут со скоростью 20000 об/мин. Осадок ресуспендировали в 10 мл буфера 2 и повторно центрифугировали. Этот этап повторяли еще один раз. Полученный осадок ресуспендировали в буфере 2 и определяли концентрацию белка. Мембраны сохраняли при -80°С.
Буфер 1: 20 мМ Na-HEPES + 10 мМ EDTA, pH 7,4
Буфер 2: 20 мМ Na-HEPES + 0,1 мм EDTA, pH 7,4
Анализ связывания:
SPA:
Анализируемые соединения, мембраны, SPA-частицы и [125I]-GLP-1(7-36)NH2 разводили в буфере для анализа. 50 мкл (микролитров) HSA (эксперимент с «высоким альбумином» с 2% HSA) или буфера (эксперимент с «низким альбумином» с 0,001% HSA) (50 мкл) вносили в Optiplate и добавляли 25 мкл анализируемых соединений. Добавляли 5-10 мкг мембранного белка/образца (50 мкл), что соответствует 0,1-0,2 мг белка/мл (предпочтительно оптимизировать для каждого препарата мембран). SPA-частицы (SPA-бидсы из агглютинина зародышей пшеницы, Wheatgerm agglutinin SPA beads, Perkin Elmer, № RPNQ0001) добавляли в количестве 0,5 мг/лунка (50 мкл). Инкубацию начинали с 125I-GLP-1(7-36)NH2 (конечная концентрация 0,06 нМ, соответствующая 49,880 DPM, 25 мкл). Планшеты запечатывали с помощью PlateSealer и инкубировали в течение 120 минут при 30°С со встряхиванием. Планшеты центрифугировали (1500 об/мин, 10 минут) и подсчитывали в Topcounter.
Аналитический буфер:
50 мМ HEPES
5 мМ EGTA
5 мМ MgCl2
0,005% Tween-20
pH 7,4
HSA SIGMA A1653.
Расчеты
Значение IC50 считывали с кривой как концентрацию, которая вытесняет 50% 125I-GLP из рецептора, и определяли отношение [(IC50/нМ) при высоком HSA]/[(IC50/нМ при низком HSA].
Как правило, связывание рецептора GLP-1 при низкой концентрации альбумина должно быть настолько сильным, насколько это возможно, соответствуя низкому значению IC50.
Значение IC50 при высокой концентрации альбумина является мерой влияния альбумина на связывание производного с рецептором GLP-1. Как известно, производные GLP-1 также связываются с альбумином. Это, как правило, является желаемым эффектом, который увеличивает их время жизни в плазме крови. Таким образом, значение IC50 при высоком альбумине, как правило, будет выше, чем значение IC50 при низком альбумине, соответствуя сниженному связыванию с рецептором GLP-1, вызванному конкурентным связыванием альбумина со связыванием с рецептором GLP-1.
Таким образом, высокий коэффициент (значение IC50 (при высоком альбумине)/значение IC50 (при низком альбумине)) может рассматриваться как признак того, что рассматриваемое производное хорошо связывается с альбумином (может иметь длительный период полужизни), а также само по себе хорошо связывается с рецептором GLP-1 (значение IC50 (при высоком альбумине) является высоким, а значение IC50 (при низком альбумине) является низким).
Результаты
Были получены следующие результаты, где «отношение» относится к [(IC50/нМ) при высоком HSA]/[(IC50/нМ) при низком HSA]):
|
Среднее соотношение было очень хорошим (примерно 300). Большинство производных имели соотношение более 50.
Кроме того, что касается IC50 (при низком альбумине), среднее значение IC50 анализируемых соединений составляло 14 нМ, и у большиства производных менее 15,0 нМ.
Наконец, что касается IC50 (при высоком альбумине), большиство производных имели IC50 (при высоком альбумине) менее 900 нМ.
Для сравнения, соединение №13 в таблице 1 в Journal of Medicinal Chemistry (2000), vol.43, no.9, p.1664-669 (GLP-1 (7-37), ацилированное на К26,34 бис-С12-двухосновной кислотой), имело IC50 (при низком альбумине) 17,7 нМ и IC50 (при высоком альбумине) 908 нМ.
Пример 35: Оценка пероральной биодоступности - введение крысам в кишечник (карпат)
Цель этого эксперимента состояла в оценке пероральной биодоступности производных GLP-1.
С этой целью изучали экспозицию в плазме после прямого введения в просвет кишечника производных GLP-1 из Примеров 2-17 и 19-22 in vivo у крыс, как описано далее.
Производные GLP-1 анализировали в концентрации 1000 мкМ в растворе 55 мг/мл капрата натрия.
Крысы линии Sprague Dawley мужского пола с массой тела по прибытии примерно 240 г были получены из Taconic (Дания) и распределены в различные группы эксперимента путем простой рандомизации, по 4 крысы в каждой группе. Крыс лишали пищи в течение примерно 18 часов до начала эксперимента и проводили общую анестезию (Hypnorm/Dormicum).
Производные GLP-1 вводили в тощую кишку либо в проксимальную часть (10 см дистальнее двенадцатиперстной кишки), либо в среднюю часть кишки (50 см проксимальнее от слепой кишки). Катетер РЕ50 длиной 10 см вставляли в тощую кишку, направляли вперед по меньшей мере на 1,5 см в тощую кишку и закрепляли перед введением дозы с помощью лигатуры вокруг кишечника и катетера нитью 3/0 дистальнее среза, чтобы предотвратить утечку или перемещение катетера. Катетер помещали без шприца и иглы и вводили 2 мл физиологического раствора в брюшную полость, прежде чем закрыть разрез зажимами для ран.
100 мкл соответствующего производного GLP-1 вводили в просвет тощей кишки через катетер с помощью шприца объемом 1 мл. Затем с помощью другого шприца в просвет тощей кишки выталкивали 200 мкл воздуха, чтобы «промыть» катетер. Этот шприц затем оставляли подключенным к катетеру для предотвращения обратного тока в катетер.
Образцы крови (200 мкл) из хвостовой вены собирали в пробирки с EDTA через необходимые промежутки времени (обычно в моменты времени 0, 10, 30, 60, 120 и 240 минут) и центрифугировали 5 минут, 10000g, при 4°С в течение 20 минут. Плазму (75 мкл) отделяли в пробирки Micronic, немедленно замораживали и хранили при температуре -20°С до анализа на концентрацию соответствующего производного GLP-1 в плазме с помощью LOCI (иммунологического анализа люминесценции кислородных каналов), в целом, как описано для определения инсулина Poulsen и Jensen в Journal of Biomolecular Screening 2007, vol.12, p.240-247. Донорные бидсы были покрыты стрептавидином, а акцепторные бидсы конъюгированы с моноклональным антителом, распознающим mid-/С-концевой эпитоп пептида. Другое моноклональное антитело, специфичное для N-конца, было биотинилированным. Три реагента объединяли с аналитом и формировали иммунокомплекс с двумя сайтами. При облучении комплекса из донорных бидсов высвобождались атомы синглетного кислорода, которые направлялись в акцепторные бидсы и вызывали хемилюминесценцию, которую измеряли на планшетном ридере Envision. Количество света было пропорционально концентрации соединения.
После забора крови крыс умерщвляли под наркозом и брюшную полость вскрывали для проверки правильности размещения катетера.
Средние (n=4) концентрации в плазме (пмоль/л) определяли в зависимости от времени. Отношение концентрации в плазме крови (пмоль/л) и концентрации в дозированном растворе (мкмоль/л) рассчитывали для каждого введения дозы, и оценивали результаты для t=30 мин (через 30 минут после введения соединения в тощую кишку) (экспозиция, скорректированная по дозе, на 30 минуте) в качестве косвенного показателя кишечной биодоступности. Было показано, что скорректированная по дозе экспозиция достоверно коррелирует с фактической биодоступностью.
Были получены следующие результаты, где скорректированная по дозе экспозиция на 30 минуте относится к (концентрации в плазме крови через 30 минут после введения соединения в тощую кишку (пМ)), деленной на (концентрацию соединения в дозированном растворе (мкМ)):
|
Все производные имели скорректированную по дозе экспозицию на 30 минуте выше 38.
Для сравнения, соединение №13 в таблице 1 в Journal of Medicinal Chemistry (2000), vol.43, no.9, p.1664-669 (GLP-1 (7-37)), ацилированное на К26,34 бис-С12-дикислотой, имело скорректированную по дозе экспозицию на 30 минуте со значением 38.
Пример 36: Влияние на уровень глюкозы в крови и массу тела
Цель данного исследования состояла в проверке влияния производных GLP-1 на содержание глюкозы в крови (BG) и массу тела (BW) при диабетических состояниях.
Производные GLP-1 анализировали в исследовании зависимости «доза-реакция» на мышиной модели диабета и ожирения (мышах db/db), как описано далее.
Мышей db/db (Taconic, Дания), которых с рождения кормили в соответствии с диетой NIH31 (NIH 31М Rodent Diet, коммерчески доступен от Taconic Farms, Inc., US, см. www.taconic.com NIH 31М), включали в исследование в возрасте 7-9 недель. Мыши получали свободный доступ к стандартному корму (например, Altromin 1324, Brogaarden, Gentofte, Дания) и водопроводной воде и содержались при 24°С. Через 1-2 недели акклиматизации в крови дважды оценивали базальный уровень глюкозы в течение двух дней подряд (т.е. в 9 часов утра). Мыши с самыми низкими значениями глюкозы в крови были исключены из экспериментов. На основании средних значений глюкозы в крови остальные мыши были отобраны для дальнейших экспериментов и разделены на 7 групп (n=6) с соответствующим уровнем глюкозы в крови. Мышей использовали в экспериментах продолжительностью 48 часов до 4 раз. После последнего эксперимента мышей умерщвляли.
Семь групп получали следующее:
1: Носитель, подкожно
2: Производное GLP-1, 0,3 нмоль/кг, подкожно
3: Производное GLP-1, 1,0 нмоль/кг, подкожно
4: Производное GLP-1, 3,0 нмоль/кг, подкожно
5: Производное GLP-1, 10 нмоль/кг, подкожно
6: Производное GLP-1, 30 нмоль/кг, подкожно
7: Производное GLP-1, 100 нмоль/кг, подкожно
Носитель: 50 мМ фосфат натрия, 145 мМ хлорид натрия, 0,05% Tween-80, pH 7,4.
Производное GLP-1 растворяли в носителе до концентрации 0,05, 0,17, 0,5, 1,7, 5,0 и 17,0 нмоль/мл. Животным вводили подкожно дозу-объем 6 мл/кг (т.е. 300 мкл на 50 г мышь).
В день введения дозы уровень глюкозы в крови оценивали в момент времени -½ ч (8:30 утра), после чего мышей взвешивали. Производное GLP-1 вводили примерно в 9 часов утра (момент времени 0). В день введения дозы уровень глюкозы в крови оценивали в моменты времени 1, 2, 4 и 8 ч (10 часов утра, 11 часов утра, 13 часов и 17 часов).
В последующие дни уровень глюкозы в крови оценивали в моменты времени 24 и 48 ч после приема препарата (т.е. в 9 часов утра на 2 и 3 дни). Каждый день после забора крови для анализа уровня глюкозы мышей взвешивали.
Мышей взвешивали по отдельности на цифровых весах.
Образцы для измерения уровня глюкозы в крови получали из капилляров на кончике хвоста мыши, находящейся в сознании. Кровь, 10 мкл, собирали в гепаринизированные капилляры и переносили в 500 мкл глюкозного буфера (системный раствор EKF, Eppendorf, Германия). Концентрацию глюкозы измеряли глюкозооксидазным способом (анализатор глюкозы Biosen 5040, EKF Diagnostic, GmbH, Барлебен, Германия). Образцы хранили при комнатной температуре в течение 1 часа до анализа. Если анализ был отложен, образцы хранили при температуре 4°С в течение максимум 24 часов.
ED50 представляет собой дозу, которая приводит к половине максимального эффекта, в нмоль/кг. Это значение рассчитывается на основании способности производных снижать массу тела, а также способности снижать уровень глюкозы в крови, как описано ниже.
ED50 для массы тела рассчитывается как доза, дающая половину максимального эффекта на дельта BW в течение 8 часов после подкожного введения производного. Например, если максимальное снижение массы тела через 8 часов составляет 2,0 г, то ED50 массы тела будет такой дозой в нмоль/кг, которая приводит к снижению массы тела на 1,0 г через 8 часов. Эта доза (ED50 массы тела) может быть считана с кривой «доза-реакция».
ED50 для глюкозы в крови рассчитывается как доза, дающая половину максимального эффекта на AUC дельта BG в течение 8 часов и/или 24 часа после подкожного введения аналога.
Значение ED50 может быть вычислено, только если существует подходящее сигмоидальное отношение «доза-реакция» с четким определением максимального ответа. Таким образом, если это не так, то рассматриваемое производное могут повторно анализировать в другом диапазоне доз, чтобы посмотреть, не будет ли получено сигмоидальное отношение «доза-реакция».
Пример 37: Период полужизни у мини-свиней
Цель данного исследования состояла в определении пролонгирования in vivo производных GLP-1 после внутривенного введения мини-свиньям, т.е. увеличения времени действия. Это делалось в фармакокинетическом (РК) исследовании, в котором определяли конечный период полужизни рассматриваемого производного. Период полужизни, как правило, означает период времени, который нужен, чтобы вдвое сократить определенную концентрацию в плазме крови, измеренную после начальной фазы распределения.
В исследованиях использовали геттингенских мини-свиней мужского пола, полученных от Ellegaard Göttingen Minipigs (Dalmose, Дания), примерно 7-14-месячного возраста, с весом примерно 16-35 кг. Мини-свиньи были размещены отдельно друг от друга и получали корм один или два раза в день с соблюдением диеты SDS для мини-свиней (Special Diets Services, Эссекс, Великобритания). По меньшей мере после двух недель акклиматизации каждому животному в верхнюю или нижнюю полую вену имплантировали постоянные центральные венозные катетеры. На 1 неделю животных оставляли для восстановления после операции, а затем использовали для повторных фармакокинетических исследований с соответствующим периодом вымывания между введениями доз следующих подряд производных GLP-1.
Животных лишали пищи в течение примерно 18 часов перед введением дозы и 0-4 часов после введения дозы, но обеспечивали им свободный доступ к воде в течение всего периода.
Производные GLP-1 растворяли в 50 мМ фосфате натрия, 145 мМ хлориде натрия, 0,05% Tween-80, pH 7,4 до концентрации, как правило, 20-60 нмоль/мл. Внутривенные инъекции соединений (объем, соответствующий обычно 1-2 нмоль/кг, например 0,033 мл/кг) проводили через один катетер, а образцы крови забирали в заданные моменты времени вплоть до 13 дня после введения дозы (предпочтительно через другой катетер). Образцы крови (например, 0,8 мл) собирали в буфер EDTA (8 мМ), а затем центрифугировали при 4°С и 1942G в течение 10 минут. Плазму пипетировали в пробирках Micronic на сухом льду и хранили при -20°С до анализа на концентрацию в плазме соответствующего соединения GLP-1 с помощью ИФА, или аналогичного анализа на основе антител, или LC-MS. Индивидуальные плазменные профили «концентрация-время» анализировали с помощью некомпартментной модели Phoenix WinNonLin верс. 6.2. (Pharsight Inc, Маунтин-Вью, Калифорния, США), и определяли полученные конечные периоды полужизни (среднее гармоническое).
Результаты
Производное из примера 2 было проанализировано и имело время полужизни 87 часов.
Для сравнения, соединение №13 в таблице 1 в Journal of Medicinal Chemistry (2000), vol.43, no.9, p.1664-669 (GLP-1 (7-37), ацилированное на К26,34 бис-С12-дикислотой, имело время полужизни 5 часов.
Пример 38: Влияние на потребление корма
Цель данного эксперимента состояла в изучении влияния производных GLP-1 на потребление корма у свиней. Это делали в фармакодинамическом (PD) исследовании, как описано ниже, в котором потребление корма измеряли в течение 1-4 дней после введения одной дозы производного GLP-1 по сравнению с контрольной группой, в которой животным вводили носитель.
Использовали свиней Ландрас Йоркшир Дюрок (LYD) женского пола, приблизительно 3-месячного возраста, весом примерно 30-35 кг (n=3-4 в группе). Животных помещали в группу примерно на 1 неделю для акклиматизации к помещению для животных. В течение экспериментального периода животных помещали в индивидуальные загоны по меньшей мере за два дня до введения дозы и на время эксперимента для измерения индивидуального потребления корма. Животных кормили кормом для свиней (Svinefoder Danish Top) без ограничения количества в течение всего периода акклиматизации и эксперимента. Потребление корма контролировали путем записи веса корма каждые 15 минут. Использовали систему Mpigwin (Ellegaard Systems, Фоборг, Дания).
Производные GLP-1 растворяли в фосфатном буфере (50 мМ фосфат натрия, 145 мМ хлорид натрия, 0,05% Tween-80, pH 7,4) в концентрациях 12, 40, 120, 400 или 1200 нмоль/мл, соответствующих дозам 0,3, 1, 3, 10 или 30 нмоль/кг. Фосфатный буфер служил носителем. Животным подкожно вводили одну дозу производного GLP-1 или носителя (объемная доза 0,025 мл/кг) утром 1-го дня, и потребление корма измеряли в течение 1-4 дней после введения дозы. В последний день каждого исследования, 1-4-й день после введения дозы, из сердца у анестезированных животных брали образец крови для измерения экспозиции в плазме производного GLP-1. Затем животных умерщвляли путем внутрисердечной передозировки фенобарбитала. Плазменное содержание производных GLP-1 анализировали с помощью ИФА или аналогичного анализа на основе антител, либо с помощью LC-MS.
Потребление корма рассчитывали как среднее ± SEM потребление корма за 24 часа за каждый из экспериментальных дней. Статистическое сравнение 24-часового потребления корма в группе с введением носителя и в группе с введением производного GLP-1 проводили путем двухфакторного повторного анализа ANOVA или другого соответствующего статистического анализа, а затем теста Бонферрони.
Соединение из примера 10 испытывали в дозе 3 нмоль/кг, и при этой дозе не было отмечено влияние на потребление корма. Соединение из примера 2 испытывали в дозе 3 нмоль/кг, и было показано значительное снижение потребления корма в течение обоих дней эксперимента (23% в 1-й день и 35% во 2-й день).
Пример 39: Фармакокинетика у крыс
Цель этого примера состояла в исследовании периода полужизни in vivo у крыс.
Фармакокинетические исследования in vivo на крысах проводили с производными GLP-1 из примеров 2, 10, 17-18 и 31, как описано далее. Семаглутид был включен для сравнения.
Крыс Sprague Dawley мужского пола одного и того же возраста с массой тела примерно 400 г получали от Taconic (Дания) и разделяли на группы путем простой рандомизации по массе тела, примерно по 4 крысы в каждой группе, так что все животные в каждой группе имели близкую массу тела.
Производные GLP-1 (примерно 6 нмоль/мл) растворяли в 50 мМ фосфате натрия, 145 мМ хлориде натрия, 0,05% Tween-80, pH 7,4. Внутривенные инъекции (1,0 мл/кг) соединений производили через катетер, имплантированный в правую яремную вену. Образцы крови отбирали из подъязычной вены в течение 5 дней после введения дозы. Образцы крови (200 мкл) собирали в EDTA буфер (8 мМ), а затем центрифугировали при 4°С и 10000g течение 5 минут. Образцы плазмы хранили при -20°С до анализа концентрации в плазме соответствующего соединения GLP-1.
Плазменные концентрации соединений GLP-1 определяли путем иммунологического анализа люминесценции кислородных каналов (LOCI), в целом, как описано для определения инсулина Poulsen и Jensen в Journal of Biomolecular Screening 2007, vol.12, p.240-247. Донорные бидсы были покрыты стрептавидином, а акцепторные бидсы конъюгированы с моноклональным антителом, распознающим mid-/С-концевой эпитоп пептида. Другое моноклональное антитело, специфичное для N-конца, было биотинилированным. Три реагента объединялись с анализируемым веществом, и формировался иммунокомплекс с двумя сайтами. При освещении комплекса из донорных бидсов высвобождалоись атомы синглетного кислорода, которые направлялись в акцепторные бидсы и вызывали хемилюминесценцию, которую измеряли на планшетном ридере Envision. Количество света было пропорционально концентрации соединения.
Плазменные профили «концентрация-время» анализировали с помощью Phoenix WinNonLin верс. 6.2, Pharsight Inc, Маунтин-Вью, Калифорния, США), а период полужизни (Т½) рассчитывали с использованием индивидуальных плазменных профилей «концентрация-время» от каждого животного.
Результаты
Период полужизни семаглутида, анализируемого в тех же условиях (но с n=8), составлял 11 часов.
|
Проанализированные производные изобретения имели время полужизни, подобное таковому у семаглутида, или большее.
Пример 40: Оценка пероральной биодоступности - введение крысам через желудочный зонд (SNAC)
Цель этого эксперимента состояла в оценке пероральной биодоступности производных GLP-1 на крысиной модели. Вкратце, жидкий раствор производных GLP-1 в натрий-N-[8-(2-гидроксибензоил)амино]каприлате (SNAC) вводили в кишечник (в тонкий кишечник), либо перорально через зонд (в желудок) и измеряли последующую экспозицию производного GLP-1 в плазме.
250 мг/мл стокового раствора SNAC получали путем растворения SNAC (12,5 г) в лабораторной воде высокой степени чистоты (MilliQ) (50,0 мл). рН доводили до 8,5 с помощью 1N NaOH (водн.).
Растворы с примерно 1000 мкМ (800-1200 мкМ) производных GLP-1 в 250 мг/мл SNAC получали путем растворения необходимого количества соответствующего производного GLP-1 в стоковом растворе SNAC. Концентрацию производного GLP-1 определяли перед введением с помощью стандартного способа, например CLND-HPLC (ВЭЖХ с хемилюминесцентным обнаружением азота).
32 крысы линии Sprague Dawley мужского пола с массой тела по прибытии примерно 240 г были получены из Taconic (Дания) и распределены в различные экспериментальные группы путем простой рандомизации, по 8 крыс в каждой группе. Крыс лишали пищи в течение примерно 18 часов до начала эксперимента.
Для введения в кишченик в день эксперимента крыс подвергали общей анестезии (Hypnorm/Dormicum) и оставляли их под анестезией в течение всего эксперимента. Производные GLP-1 из примеров 5-7 вводили в проксимальную часть тощей кишки (10 см дистальнее двенадцатиперстной кишки). Катетер РЕ50 длиной 10 см вставляли в тощую кишку, направляли вперед по меньшей мере на 1,5 см в тощую кишку и закрепляли перед введением дозы с помощью лигатуры вокруг кишечника и катетера нитью 3/0 дистальнее среза, чтобы предотвратить утечку или перемещение катетера. Катетер помещали без шприца и иглы и вводили 2 мл физиологического раствора в брюшную полость, прежде чем закрыть разрез зажимами для ран.
100 мкл раствора SNAC с соответствующим производным GLP-1 вводили в просвет тощей кишки через катетер с помощью шприца объемом 1 мл. Затем с помощью другого шприца в просвет тощей кишки выталкивали 200 мкл воздуха, чтобы «промыть» катетер. Этот шприц затем оставляли подключенным к катетеру для предотвращения обратного тока в катетер.
Образцы крови (200 мкл) из хвостовой вены собирали в пробирки с EDTA через необходимые промежутки времени (обычно в моменты времени 0, 30, 60, 120 и 180 минут).
В эксперименте с желудочным зондом животные находились в сознании в течение всего эксперимента.
100 мкл раствора SNAC с производным GLP-1 вводили через желудочный зонд непосредственно в желудок.
Образцы крови (200 мкл) из сублингвального сплетения собирали через необходимые промежутки времени (обычно в моменты времени 0, 30, 60, 120 и 180 минут) в пробирки с EDTA.
Все полученные образцы крови держали на льду и центрифугировали 5 минут, 10000g, при 4°С в течение 20 минут. Плазму (75 мкл) отделяли в пробирки Micronic, немедленно замораживали и хранили при температуре -20°С до анализа на концентрацию соответствующего производного GLP-1 в плазме с помощью LOCI (иммунологического анализа люминесценции кислородных каналов), в целом, как описано для определения инсулина Poulsen и Jensen в Journal of Biomolecular Screening 2007, vol.12, p.240-247. Донорные бидсы были покрыты стрептавидином, а акцепторные бидсы конъюгированы с моноклональным антителом, распознающим mid-/C-концевой эпитоп пептида. Другое моноклональное антитело, специфичное для N-конца, было биотинилированным. Три реагента объединялись с аналитом, и формировался иммунокомплекс с двумя сайтами. При освещении комплекса из донорных бидсов высвобождались атомы синглетного кислорода, которые направлялись в акцепторные бидсы и вызывали хемилюминесценцию, которую измеряли на планшетном ридере Envision. Количество света было пропорционально концентрации соединения.
После забора крови крыс умерщвляли под наркозом и брюшную полость вскрывали для проверки правильности размещения катетера.
Средние (n=8) концентрации в плазме (пмоль/л) определяли в зависимости от времени. AUC кривой экспозиции в плазме (пмоль/л) с течением времени с момента 30 до момента 180 (мин) корректировали по дозе, т.е. делили на количество (дозу) производного в дозированном растворе (пМ). Таким образом, скорректированную по дозе AUC экспозиции в плазме в течение времени с 30 по 180 мин (в единицах мин × пМ/пмоль = мин/л) использовали для замены измерения биодоступности - измерения для ранжирования производных с учетом их абсорбции на крысиной модели.
Хотя некоторые особенности изобретения были проиллюстрированы и описаны в данном документе, многие модификации, замены, изменения и эквиваленты будут приходить на ум специалистам в данной области. Поэтому следует понимать, что формула изобретения предназначена для покрытия всех этих модификаций и изменений, которые находятся в пределах сущности изобретения.