КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ
Вид РИД
Изобретение
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к новым полиморфным формам 6-[2-(метилкарбамоил)фенилсульфанил]-3-Е-[2-(пиридин-2-ил)этенил]индазола и к способам их получения. Изобретение также относится к фармацевтическим композициям, содержащим, по меньшей мере, одну полиморфную форму, и к терапевтическому или профилактическому применению таких полиморфных форм и композиций.
УРОВЕНЬ ТЕХНИКИ
Данное изобретение относится к новым полиморфным формам 6-[2-(метилкарбамоил)фенилсульфанил]-3-Е-[2-(пиридин-2-ил)этенил]индазола (также называемым Соединением 1)
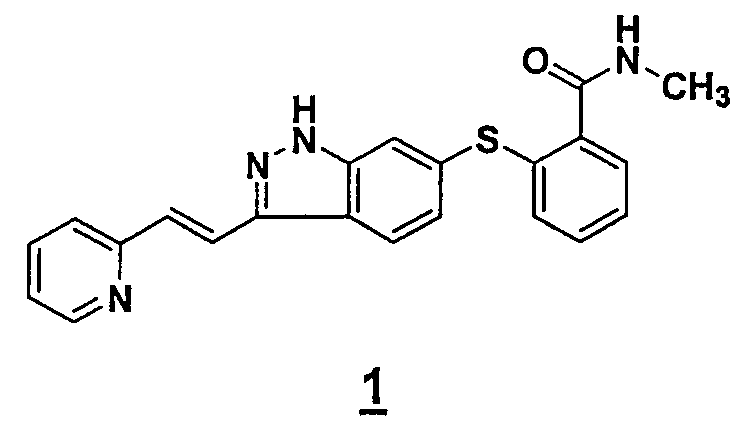
которые пригодны для лечения аномального роста клеток, такого как рак, у млекопитающих. Данное изобретение также относится к композициям, включающим такие полиморфные формы, и к способам применения таких композиций при лечении аномального роста клеток у млекопитающих, в особенности, человека.
Соединение 1, а также его фармацевтически приемлемые соли, описывается в патенте США № 6534524 и патенте США № 6531491. Способы получения соединения 1 описываются в патенте США № 7232910, и публикациях заявок на патент США № 2006-0091067 и 2007-0203196, и в международной публикации № WO 2006/048745. Полиморфные формы и фармацевтические композиции соединения 1 также описываются в публикации заявки на патент США № 2006-0094763 и международной публикации WIPO № WO 2006/123223. Лекарственные формы соединения 1 также описываются в публикации заявки на патент США № 2004-0224988.
Соединение 1 представляет собой эффективный и селективный ингибитор рецептора тирозинкиназы (РТК) фактора роста эндотелия сосудов (VEGF)/фактора роста тромбоцитов (PDGF), разрабатываемый для использования при лечении рака от ранних до поздних стадий. Протеины тирозинкиназы были идентифицированы в качестве ключевых целей при терапевтическом лечении рака. Лиганды фактора роста и их соответствующие РТК требуются для ангиогенеза и роста опухоли. VEGF и PDGF являются критическими компонентами в процессе, ведущем к разветвлению, распространению и выживанию клеток эндотелия, формирующих новые кровеносные сосуды в течение ангиогенеза. Нежелательный ангиогенез является признаком серьезных заболеваний, таких как ретинопатии, псориаз, ревматоидный артрит, возрастная дегенерация желтого пятна (AMD) и рак (включая солидные опухоли) Folkman, Nature Med., 1, 27-31 (1995).
Как понятно специалистам в данной области техники, желательно иметь кристаллические или аморфные формы, которые обладают физическими свойствами, позволяющими надежное составление и изготовление рецептуры. Такие свойства включают фильтруемость, гигроскопичность и текучесть, а также устойчивость к теплу, влажности и свету.
Полиморфы представляют собой различные кристаллические формы одного и того же соединения. Термин полиморф может включать или не включать другие молекулярные формы в твердом состоянии, включая гидраты (например, в кристаллической структуре присутствует связанная вода) и сольваты (например, связанные растворители, отличные от воды) одного и того же соединения. Кристаллические полиморфы типично имеют различные кристаллические структуры вследствие различной упаковки молекул в кристаллической решетке. Это приводит к различным симметриям кристаллов и/или параметрам элементарных ячеек, что непосредственно влияет на их физические свойства, такие как характеристики дифракции рентгеновских лучей кристаллов или порошков.
Полиморфные формы представляют интерес для фармацевтической промышленности и, в особенности, для специалистов, вовлеченных в разработку подходящих лекарственных форм. Если полиморфная форма не остается постоянной в течение клинических исследований или исследований стабильности, используемая или исследуемая соответствующая лекарственная форма может различаться от одной партии к другой. Также желательно иметь способы получения соединения с выбранной полиморфной формой с высокой чистотой, когда соединение используют в клинических исследованиях или в коммерческих продуктах, поскольку присутствующие примеси могут дать нежелательные токсикологические эффекты. Определенные полиморфные формы также могут показывать увеличенную термодинамическую устойчивость, или их можно более легко изготавливать с высокой чистотой в значительных количествах, и, таким образом, они больше подходят для включения в фармацевтические рецептуры. Определенные полиморфы могут показывать другие полезные физические свойства, такие как отсутствие гигроскопических тенденций, улучшенная растворимость и увеличенные скорости растворения вследствие различающихся энергий кристаллической решетки.
Обсуждение уровня техники изобретения в настоящем описании включается для объяснения контекста настоящего изобретения. Это не следует принимать в качестве признания, что любой материал, на который идет ссылка, был опубликован, известен или является частью общих знаний в любой стране, что касается даты приоритета любого из пунктов формулы изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Хотя некоторые полиморфы соединения 1 были идентифицированы, каждая полиморфная форма может быть однозначно идентифицирована несколькими различными аналитическими параметрами, по отдельности или в комбинации, такими как, но не ограничиваясь этим, пики порошковой рентгенограммы или комбинации двух или более пиков; химические сдвиги ЯМР 13C и/или 15N в твердом теле или комбинации двух или более химических сдвигов; пики комбинационного сдвига или комбинации двух или более пиков комбинационного сдвига; или их комбинации.
Один аспект настоящего изобретения предлагает кристаллическую форму 6-[2-(метилкарбамоил)фенилсульфанил]-3-Е-[2-(пиридин-2-ил)этенил]индазола, представленного в виде соединения 1

где указанная кристаллическая форма представляет собой полиморф формы XXV. Например, в одном варианте осуществления настоящее изобретение предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пик при угле дифракции (2θ) 5,1±0,1. В дальнейшем варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, дополнительно включающую пик при угле дифракции (2θ) 15,9±0,1. В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, дополнительно включающую пики при углах дифракции (2θ) 7,9±0,1, 10,7±0,1 и 18,2±0,1. В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, дополнительно включающую пики при углах дифракции (2θ) 7,9±0,1, 15,9±0,1 и 18,2±0,1. В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, дополнительно включающую пики при углах дифракции (2θ) 10,7±0,1, 15,9±0,1 и 26,2±0,1. В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, дополнительно включающую пики при углах дифракции (2θ) 7,9±0,1, 10,7±0,1, 15,9±0,1 и 26,2±0,1. В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, дополнительно включающую пики при углах дифракции (2θ) 7,9±0,1, 10,7±0,1, 15,9±0,1, 18,2±0,1 и 26,2±0,1.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 7,9±0,1, 10,7±0,1 и 18,2±0,1. Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 7,9±0,1, 15,9±0,1 и 18,2±0,1. Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,7±0,1, 15,9±0,1 и 26,2±0,1. Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 7,9±0,1, 10,7±0,1, 15,9±0,1 и 26,2±0,1.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.1.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 167,4±0,2, 157,7±0,2 и 116,6 ±0,2 м.д.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 167,4±0,2, 157,7±0,2, 116,6 ±0,2 и 25,6±0,2 м.д.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.2.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 5,1±0,1 и 15,9±0,1, и где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 167,4±0,2, 157,7±0,2 и 116,6±0,2 м.д.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 5,1±0,1 и 15,9±0,1, и где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 167,4±0,2, 157,7±0,2, 116,6±0,2 и 25,6±0,2 м.д.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.1, и где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.2.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет спектр комбинационного рассеивания, включающий пики комбинационного сдвига (см-1) в позициях по существу таких же, как показанные на фиг.3.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма представляет собой полиморф формы XVI. Например, в одном варианте осуществления настоящее изобретение предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,2±0,1, 10,6±0,1 и 16,8±0,1. В дальнейшем варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,2±0,1, 10,6±0,1 и 17,9±0,1. В дальнейшем варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,2±0,1, 10,6±0,1 и 18,2±0,1. В дальнейшем варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,2±0,1, 10,6±0,1 и 25,4±0,1.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.4.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма представляет собой полиморф формы XLI. Например, в одном варианте осуществления настоящее изобретение предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 6,0±0,1 и 11,5±0,1.
В дальнейшем варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пик при угле дифракции (2θ) 6,0±0,1 и 21,0±0,1.
В дальнейшем варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пик при угле дифракции (2θ) 6,0±0,1 и 26,9±0,1.
В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 6,0±0,1, 11,9±0,1 и 22,8±0,1.
В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,9±0,1, 21,0±0,1 и 22,8±0,1.
В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,9±0,1, 21,0±0,1 и 26,9±0,1.
В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,9±0,1, 21,0±0,1 и 23,1±0,1.
В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,5±0,1, 15,6±0,1 и 16,2±0,1.
В другом варианте осуществления кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,5±0,1, 15,6±0,1 и 16,5±0,1.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.6.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 150,1±0,2, 136,6±0,2, 135,0±0,2, 116,9±0,2 и 27,5±0,2 м.д.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.7.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 15N химические сдвиги -50,2±0,2, -79,0±0,2, -187,1±0,2 и -263,2±0,2 м.д.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 15N химические сдвиги в позициях по существу таких же, как показанные на фиг.8.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 6,0±0,1 и 11,5±0,1, и где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 150,1±0,2 и 27,5±0,2 м.д.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 6,0±0,1, 11,5±0,1 и 11,9±0,1, и где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 150,1±0,2, 136,6±0,2, 135,0±0,2, 116,9±0,2 и 27,5±0,2 м.д.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.6, и где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.7.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.6, и где указанная кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 15N химические сдвиги в позициях по существу таких же, как показанные на фиг.8.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет спектр комбинационного рассеивания, включающий пики комбинационного сдвига (см-1) в позициях по существу таких же, как показанные на фиг.9.
Дальнейший аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма представляет собой полиморф формы IX. Например, в одном варианте осуществления настоящее изобретение предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 7,7±0,1, 8,1±0,1, 8,5±0,1 и 14,3±0,1. В другом аспекте указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 7,7±0,1, 8,1±0,1, 8,5±0,1 и 18,3±0,1. В другом аспекте указанная кристаллическая форма соединения 1 имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.10.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 171,4±0,2 и 28,0±0,2 м.д. В другом аспекте указанная кристаллическая форма соединения 1 имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.11.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.10, и где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.11.
Дальнейший аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма представляет собой полиморф формы XII. Например, в одном варианте осуществления настоящее изобретение предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,9±0,1, 18,1±0,1 и 31,2±0,1. В другом варианте осуществления настоящее изобретение предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,9±0,1, 28,1±0,1 и 31,2±0,1. В другом варианте осуществления настоящее изобретение предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 16,8±0,1, 28,1±0,1 и 31,2±0,1. В другом варианте осуществления настоящее изобретение предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 25,3±0,1, 28,1±0,1 и 31,2±0,1.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.12.
Дальнейший аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма представляет собой полиморф формы XV. Например, в одном варианте осуществления настоящее изобретение предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,1±0,1, 11,9±0,1, 15,2±0,1, 21,5±0,1 и 26,3±0,1. В другом варианте осуществления настоящее изобретение предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,1±0,1, 21,5±0,1, 25,0±0,1 и 25,3±0,1.
Другой аспект настоящего изобретения предлагает кристаллическую форму соединения 1, где указанная кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.13.
Другой аспект настоящего изобретения предлагает аморфную форму соединения 1, где указанная аморфная форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.14 и 15.
Другой аспект настоящего изобретения предлагает аморфную форму соединения 1, где указанная аморфная форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.16.
В дальнейшем аспекте настоящее изобретение предполагает, что описанные здесь кристаллические формы соединения 1 могут существовать в присутствии других кристаллических или аморфных форм, или их смесей, соединения 1. Соответственно, в одном варианте осуществления настоящее изобретение предлагает любую кристаллическую форму соединения 1, описанную здесь, где указанная кристаллическая форма присутствует в твердой форме, которая включает менее 95%, менее 90%, менее 80%, менее 70%, менее 60%, менее 50%, менее 40%, менее 30%, менее 20%, менее 10%, менее 5%, менее 3%, или менее 1% по массе любых других физических форм соединения 1. Например, один вариант осуществления представляет собой твердую форму соединения 1, включающую кристаллическую форму соединения 1, которая имеет порошковую рентгенограмму, включающую пик при угле дифракции (2θ) 5,1±0,1, и где указанная твердая форма включает менее 95%, менее 90%, менее 80%, менее 70%, менее 60%, менее 50%, менее 40%, менее 30%, менее 20%, менее 10%, менее 5%, менее 3%, или менее 1% по массе любых других физических форм соединения 1.
Далее в качестве примера, настоящее изобретение предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пик при угле дифракции (2θ) 5,1±0,1. В дальнейшем варианте осуществления указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 5,1±0,1 и 15,9±0,1. В дальнейшем варианте осуществления указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 5,1±0,1, 7,9±0,1, 10,7±0,1 и 18,2±0,1. В дальнейшем варианте осуществления указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 5,1±0,1, 7,9±0,1, 15,9±0,1 и 18,2±0,1. В дальнейшем варианте осуществления указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 5,1±0,1, 10,7±0,1, 15,9±0,1 и 26,2±0,1. В дальнейшем варианте осуществления указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 5,1±0,1, 7,9±0,1, 10,7±0,1, 15,9±0,1 и 26,2±0,1. В дальнейшем варианте осуществления указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 5,1±0,1, 7,9±0,1, 10,7±0,1, 15,9±0,1, 18,2±0,1 и 26,2±0,1.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.1.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 167,4±0,2, 157,7±0,2 и 116,6 ±0,2 м.д.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 167,4±0,2, 157,7±0,2, 116,6 ±0,2 и 25,6±0,2 м.д.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.2.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма представляет собой по существу чистый полиморф формы XXV.
Далее в качестве примера, настоящее изобретение предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,2±0,1, 10,6±0,1 и 16,8±0,1. В дальнейшем варианте осуществления указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,2±0,1, 10,6±0,1 и 17,9±0,1. В дальнейшем варианте осуществления указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,2±0,1, 10,6±0,1 и 18,2±0,1. В дальнейшем варианте осуществления указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,2±0,1, 10,6±0,1 и 25,4±0,1.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.4.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма представляет собой полиморф формы XVI.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма представляет собой полиморф формы XLI. Например, в одном варианте осуществления настоящее изобретение предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пик при углах дифракции (2θ) 6,0±0,1 и 11,5±0,1.
В дальнейшем варианте осуществления по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пик при угле дифракции (2θ) 6,0±0,1 и 21,0±0,1.
В дальнейшем варианте осуществления по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пик при угле дифракции (2θ) 6,0±0,1 и 26,9±0,1.
В другом варианте осуществления по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 6,0±0,1, 11,9±0,1 и 22,8±0,1.
В другом варианте осуществления по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,9±0,1, 21,0±0,1 и 22,8±0,1.
В другом варианте осуществления по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,9±0,1, 21,0±0,1 и 26,9±0,1.
В другом варианте осуществления по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,9±0,1, 21,0±0,1 и 23,1±0,1.
В другом варианте осуществления по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,5±0,1, 15,6±0,1 и 16,2±0,1.
В другом варианте осуществления по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,5±0,1, 15,6±0,1 и 16,5±0,1.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.6.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 150,1±0,2, 136,6±0,2, 135,0±0,2, 116,9±0,2 и 27,5±0,2 м.д.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.7.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 15N химические сдвиги -50,2±0,2, -79,0±0,2, -187,1±0,2 и -263,2±0,2 м.д.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 15N химические сдвиги в позициях по существу таких же, как показанные на фиг.8.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 6,0±0,1, 11,5±0,1 и 11,9±0,1, и где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 150,1±0,2, 136,6±0,2, 135,0±0,2, 116,9±0,2 и 27,5±0,2 м.д.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.6, и где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.7.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.6, и где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 15N химические сдвиги в позициях по существу таких же, как показанные на фиг.8.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет спектр комбинационного рассеивания, включающий пики комбинационного сдвига (см-1) в позициях по существу таких же, как показанные на фиг.9.
Дальнейший аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная кристаллическая форма представляет собой полиморф формы IX. Например, в одном варианте осуществления настоящее изобретение предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 7,7±0,1, 8,1±0,1, 8,5±0,1 и 14,3±0,1. В дальнейшем варианте осуществления указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 7,7±0,1, 8,1±0,1, 8,5±0,1 и 18,3±0,1.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги 171,4±0,2 и 28,0±0,2 м.д.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.10, и где указанная по существу чистая кристаллическая форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.11.
Дальнейший аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма представляет собой полиморф формы XII. Например, в одном варианте осуществления настоящее изобретение предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,9±0,1, 18,1±0,1 и 31,2±0,1. В другом варианте осуществления настоящее изобретение предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 11,9±0,1, 28,1±0,1 и 31,2±0,1. В другом варианте осуществления настоящее изобретение предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 16,8±0,1, 28,1±0,1 и 31,2±0,1. В другом варианте осуществления настоящее изобретение предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 25,3±0,1, 28,1±0,1 и 31,2±0,1.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.12.
Дальнейший аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма представляет собой полиморф формы XV. Например, в одном варианте осуществления настоящее изобретение предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,1±0,1, 11,9±0,1, 15,2±0,1, 21,5±0,1 и 26,3±0,1. В другом варианте осуществления настоящее изобретение предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) 10,1±0,1, 21,5±0,1, 25,0±0,1 и 25,3±0,1.
Другой аспект настоящего изобретения предлагает по существу чистую кристаллическую форму соединения 1, где указанная по существу чистая кристаллическая форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.13.
Другой аспект настоящего изобретения предлагает по существу чистую аморфную форму соединения 1, где указанная по существу чистая аморфная форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.14. Другой аспект настоящего изобретения предлагает по существу чистую аморфную форму соединения 1, где указанная по существу чистая аморфная форма имеет порошковую рентгенограмму, включающую пики при углах дифракции (2θ) по существу таких же, как показанные на фиг.15.
Другой аспект настоящего изобретения предлагает по существу чистую аморфную форму соединения 1, где указанная по существу чистая аморфная форма имеет ЯМР спектр в твердом теле, включающий 13C химические сдвиги в позициях по существу таких же, как показанные на фиг.16.
Дальнейший аспект настоящего изобретения предлагает фармацевтическую композицию, включающую любую кристаллическую форму или аморфную форму описанного здесь соединения 1. В дальнейшем аспекте изобретение предлагает оральную лекарственную форму, включающую любую кристаллическую форму или аморфную форму соединения 1 или фармацевтические композиции, описанные здесь. Например, в одном варианте осуществления оральная лекарственная форма представляет собой таблетку, пилюлю, сердцевину драже или капсулу. Например, в одном варианте осуществления оральная лекарственная форма представляет собой таблетку или капсулу. Далее, например, в одном варианте осуществления изобретение предлагает таблетку, включающую любую кристаллическую форму или аморфную форму соединения 1 или фармацевтические композиции, описанные здесь. Например, в одном варианте осуществления таблетка включает примерно от 1 до 10 мг кристаллической формы или аморфной формы соединения 1. Далее, например, таблетка включает примерно от 1 до 5 мг кристаллической формы или аморфной формы соединения 1. Далее, например, таблетка включает примерно 1 мг кристаллической формы или аморфной формы соединения 1. Далее, например, таблетка включает примерно 2 мг, примерно 3 мг, примерно 4 мг или примерно 5 мг кристаллической формы или аморфной формы соединения 1. Далее, например, кристаллическая форма соединения 1 представляет собой форму XXV. Далее, например, кристаллическая форма соединения 1 представляет собой форму XLI.
Дальнейший аспект настоящего изобретения предлагает способ получения соединения 1 в кристаллической форме XXV, причем указанный способ включает нагрев кристаллической формы XVI соединения 1. Например, в одном варианте осуществления указанный нагрев осуществляют в присутствии соответствующего растворителя. В одном варианте осуществления растворитель представляет собой этанол. В дальнейшем варианте осуществления затравочные кристаллы формы XXV объединяют с кристаллической формой XVI до или в течение нагрева.
Дальнейший аспект настоящего изобретения предлагает способ получения соединения 1 в кристаллической форме XVI, причем указанный способ включает растворение формы VIII соединения 1 в соответствующем растворителе и нагрев.
Дальнейший аспект настоящего изобретения предлагает способ получения соединения 1 в кристаллической форме XLI, причем указанный способ включает нагрев кристаллической формы XVI соединения 1. Например, в одном варианте осуществления указанный нагрев осуществляют в присутствии соответствующего растворителя. В одном варианте осуществления растворитель представляет собой этанол. В дальнейшем варианте осуществления затравочные кристаллы формы XLI объединяют с кристаллической формой XVI до или в течение нагрева.
Дальнейший аспект настоящего изобретения предлагает способ получения соединения 1 в аморфной форме из кристаллической формы XLI, причем указанный способ включает измельчение кристаллической формы XLI соединения 1. Например, в одном варианте осуществления указанное измельчение осуществляют размолом на шаровой мельнице.
Дальнейший аспект настоящего изобретения предлагает способ лечения рака у млекопитающего, причем способ включает введение млекопитающему терапевтически эффективного количества любой кристаллической формы соединения 1 или любой фармацевтической композиции, которые здесь описаны.
В конкретном аспекте любого предшествующего варианта осуществления способа, способ далее включает введение одного или нескольких противоопухолевых средств, антиангиогенезных средств, ингибиторов сигнальной трансдукции или антипролиферативных средств.
ОПРЕДЕЛЕНИЯ
Термин ″лечение″, если не указывается иным образом, обозначает обратное развитие, облегчение, подавление развития или профилактику заболевания или состояния, к которому данный термин применяют, или одного или нескольких симптомов такого заболевания или состояния. Термин ″терапия ″, если не указывается иным образом, относится к ″лечению″, как определено непосредственно выше.
Термин ″соединение 1″ обозначает химическое соединение 6-[2-(метилкарбамоил)фенилсульфанил]-3-Е-[2-(пиридин-2-ил)этенил]индазол, также представленное структурной формулой

Термин ″по существу чистая″ со ссылкой к конкретной кристаллической или аморфной форме означает, что кристаллическая или аморфная форма включает менее 10%, предпочтительно менее 5%, предпочтительно менее 3%, предпочтительно менее 1% по массе любых других физических форм данного соединения.
Термин ″по существу такие же″ со ссылкой к положению пиков порошковой рентгенограммы означает, что положение типичных пиков и колебания интенсивности приняты во внимание. Например, специалист в данной области поймет, что положения пиков (2θ) будут показывать некоторую нестабильность, типично вплоть до 0,1-0,2 градусов в зависимости от используемых растворителей, а также от используемого прибора для измерения дифракции. Кроме того, специалист в данной области поймет, что относительные интенсивности пиков будут показывать межприборную нестабильность, а также нестабильность вследствие степени кристалличности, предпочтительной ориентации, поверхности приготовленного образца и других факторов, известных специалисту в данной области, и их следует рассматривать только в качестве качественных измерений. Аналогичным образом, используемый здесь термин ″по существу такие же″ со ссылкой к спектрам ЯМР в твердом теле и спектрам комбинационного рассеивания предназначен для охвата нестабильностей, связанных с данными аналитическими методиками, которые известны специалистам в данной области. Например, химические сдвиги 13C, измеренные ЯМР в твердом теле, типично будут иметь нестабильность вплоть до 0,2 м.д. для хорошо разрешенных пиков, или даже больше для широких линий, в то время как комбинационный сдвиг типично будет иметь нестабильность примерно 2 см-1.
Термин ″полиморф″ относится к различным кристаллическим формам одного и того же соединения и включает, но не ограничивается этим, другие молекулярные формы твердого тела, включая гидраты (например, в кристаллической структуре присутствует связанная вода) и сольваты (например, связанные растворители, отличные от воды) одного и того же соединения.
Термин ″величина 2 тета″ или ″2θ″ относится к положению пика в градусах, исходя из экспериментальной установки рентгеноструктурного эксперимента, и представляет собой обычную единицу абсциссы в рентгенограмме. Экспериментальная установка требует, что при дифракции отражения, когда входящий пучок образует угол тета (θ) с конкретной кристаллографической плоскостью, отраженный пучок записывают при угле 2 тета (2θ). Следует понимать, что ссылка в настоящем описании к конкретным величинам 2θ для конкретной полиморфной формы предназначена для обозначения величин 2θ (в градусах), измеренных с использованием описанных здесь рентгеноструктурных экспериментальных условий. Например, как описано здесь, в качестве источника излучения использовали CuKα (длина волны 1,54056 Å).
Термин ″аморфный″ относится к твердому веществу, в котором (i) отсутствует порядок в трех измерениях или (ii) которое показывает порядок менее чем в трех измерениях, порядок только на коротких расстояниях (например, менее чем 10 Å) или и то и другое. Таким образом, аморфные вещества включают частично кристаллические вещества и кристаллические мезофазы, например, с одно- или двухмерным трансляционным порядком (жидкие кристаллы), ориентационной неупорядоченностью (ориентационно неупорядоченные кристаллы) или конформационной неупорядоченностью (конформационно неупорядоченные кристаллы). Аморфные твердые вещества можно характеризовать известными методами, включая рентгеновскую порошковую дифрактометрию, ядерный магнитный резонанс в твердом теле (ssЯМР), дифференциальную сканирующую калориметрию (ДСК) или комбинации данных методов. Как иллюстрируется ниже, аморфные твердые вещества дают размытую порошковую рентгеновскую дифрактограмму, типично состоящую из одного или двух широких пиков (т.е. пиков, имеющих ширину основания примерно 5° 2θ или больше).
Термин ″кристаллический″ относится к твердому веществу, показывающему трехмерный порядок, которое в отличие от аморфного твердого вещества дает характерную порошковую рентгенограмму с резко определенными пиками.
Термин ″сольват″ описывает молекулярный комплекс, включающий лекарственное вещество и стехиометрическое или нестехиометрическое количество молекул одного или нескольких растворителей (например, этанола). Когда растворитель плотно связан с лекарственным веществом, полученный в результате комплекс будет иметь хорошо определенную стехиометрию, которая не зависит от влажности. Однако когда растворитель связан слабо, как в ″канальных″ сольватах и гигроскопичных соединениях, содержание растворителя будет зависеть от влажности и условий сушки. В таких случаях комплекс часто будет нестехиометрическим.
Термин ″гидрат″ описывает сольват, включающий лекарственное вещество и стехиометрическое или нестехиометрическое количество воды.
Термин ″порошковая рентгенограмма″ или ″порошковая дифрактограмма″ относится к экспериментально наблюдаемой дифрактограмме или получаемым из нее параметрам. Порошковая дифрактограмма характеризуется положением пика (абсцисса) и интенсивностями пика (ордината).
Термин ″фармацевтическая композиция″ относится к композиции, включающей одну или несколько полиморфных форм описанного здесь соединения 1, и другие химические компоненты, такие как физиологически/фармацевтически приемлемые носители, разбавители, растворители и/или наполнители. Цель фармацевтической композиции состоит в содействии введению соединения в организм, например, человеку или другому млекопитающему.
Термин ″фармацевтически приемлемый″ ″носитель″, ″разбавитель″, ″растворитель″ и/или ″наполнитель″ относится к материалу (или материалам), который(ые) можно включить с конкретным фармацевтическим агентом с образованием фармацевтической композиции, и он может быть твердым или жидким. Примерами твердых носителей являются лактоза, сахароза, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния, стеариновая кислота и аналогичное. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, вода и аналогичное. Аналогичным образом, носитель или разбавитель может включать материал замедленного или пролонгированного действия, известный из уровня техники, такой как глицерилмоностеарат или глицерилдистеарат по отдельности или с воском, этилцеллюлозой, гидроксипропилметилцеллюлозой, метилметакрилатом и аналогичным.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 показывает порошковую рентгенограмму формы XXV соединения 1, полученную на дифрактометре Bruker D5000.
Фиг.2 показывает 13C ЯМР спектр в твердом теле формы XXV соединения 1, полученный на Bruker-Biospin 4 мм BL CPMAS датчике тройного резонанса, расположенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометре с широким зазором.
Фиг.3 показывает спектр комбинационного рассеивания формы XXV соединения 1, полученный на ThermoNicolet 960 FT-Raman спектрометре, оборудованном 1064 нм NdYAG лазером и InGaAs детектором.
Фиг.4 показывает порошковую рентгенограмму формы XVI соединения 1, полученную на дифрактометре Bruker D5000.
Фиг.5 показывает порошковую рентгенограмму формы VIII соединения 1, полученную на дифрактометре Bruker D5000.
Фиг.6 показывает порошковую рентгенограмму формы XLI соединения 1, полученную на дифрактометре Bruker D5000.
Фиг.7 показывает 13C ЯМР спектр в твердом теле формы XLI соединения 1, полученный на Bruker-Biospin 4 мм BL CPMAS датчике тройного резонанса, расположенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометре с широким зазором.
Фиг.8 показывает 15N ЯМР спектр в твердом теле формы XLI соединения 1, полученный на Bruker-Biospin 4 мм BL CPMAS датчике тройного резонанса, расположенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометре с широким зазором.
Фиг.9 показывает спектр комбинационного рассеивания формы XLI соединения 1, полученный на ThermoNicolet 960 FT-Raman спектрометре, оборудованном 1064 нм NdYAG лазером и InGaAs детектором.
Фиг.10 показывает порошковую рентгенограмму формы IX соединения 1, полученную на дифрактометре Bruker D5000.
Фиг.11 показывает 13C ЯМР спектр в твердом теле формы IX соединения 1, полученный на Bruker-Biospin 4 мм BL CPMAS датчике тройного резонанса, расположенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометре с широким зазором.
Фиг.12 показывает порошковую рентгенограмму формы XII соединения 1, полученную на дифрактометре Bruker D5000.
Фиг.13 показывает порошковую рентгенограмму формы XV соединения 1, полученную на дифрактометре Bruker D5000.
Фиг.14 показывает порошковую рентгенограмму аморфной формы соединения 1, полученную на дифрактометре Bruker D5000.
Фиг.15 показывает порошковую рентгенограмму аморфной формы соединения 1, полученную на дифрактометре Bruker D5000. Рентгенограмма такая же, как на фиг.14, за исключением того, что она была обработана функцией полиномиального сглаживания для улучшения деталей.
Фиг.16 показывает 13C ЯМР спектр в твердом теле аморфной формы соединения 1, полученный на Bruker-Biospin 4 мм BL CPMAS датчике тройного резонанса, расположенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометре с широким зазором.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было обнаружено, что соединение 1 может существовать во множестве кристаллических форм (полиморфов) или в виде аморфной формы. Данные формы можно использовать в составленном продукте для лечения гиперпролиферативных показаний, включая рак. Каждая форма может иметь преимущества относительно других с точки зрения таких свойств, как биодоступность, стабильность и технологичность. Были открыты новые кристаллические формы соединения 1, которые, по-видимому, являются более подходящими для массового производства и обращения по сравнению с другими полиморфными формами. Способы получения полиморфных форм соединения 1 высокой чистоты описываются здесь и в заявке на патент США № 2006-0094763. Другая цель настоящего изобретения состоит в предложении способа получения каждой полиморфной формы соединения 1, по существу не содержащей другие полиморфные формы соединения 1. Кроме того, цель настоящего изобретения состоит в предложении фармацевтической рецептуры, включающей соединение 1 в различных полиморфных формах, как обсуждено выше, и способов лечения гиперпролиферативных состояний введением таких фармацевтических рецептур.
I. Полиморфные формы соединения 1
Каждую кристаллическую форму соединения 1 можно характеризовать одной или несколькими из следующих ниже характеристик: порошковой рентгенограммой (т.е. пиками дифракции рентгеновских лучей при различных углах дифракции (2θ)), спектром ядерного магнитного резонанса (ЯМР) в твердом теле, спектром комбинационного рассеивания, растворимостью в воде, светостойкостью при условиях света высокой интенсивности согласно Международной конференции по гармонизации (ICH) и физической и химической устойчивостью при хранении. Например, каждая из полиморфных форм XXV, XVI, VIII, XLI, IX, XII, XV и аморфная форма (обсужденная ниже) соединения 1 были характеризованы положениями и относительными интенсивностями пиков на их порошковых рентгенограммах. Параметры порошковой рентгенограммы отличаются для каждой полиморфной формы соединения 1. Например, полиморфные формы XXV, XVI, VIII, XLI, IX, XII, XV и аморфную форму соединения 1, следовательно, можно отличить друг от друга и от других полиморфных форм соединения 1, используя рентгеновскую порошковую дифрактометрию.
Порошковые рентгенограммы различных полиморфных форм (формы XXV, XVI, VIII, XLI, IX, XII, XV) и аморфной формы соединения 1 получали на дифрактометре Bruker D5000 с использованием излучения меди (CuKα, длина волны 1,54056 Å). Напряжение и силу тока трубки устанавливали до 40 кВ и 40 мА соответственно. Дивергенцию и щели рассеивания устанавливали при 1 мм, а приемную щель устанавливали при 0,6 мм. Дифрагированное излучение определяли детектором Kevex PSI. Использовали тета-два тета непрерывное сканирование при 2,4 градусах/мин (шаг 1 секунда/0,04 градуса) от 3,0 до 40 градусов 2θ. Стандарт из оксида алюминия анализировали для проверки настойки прибора. Данные собирали и анализировали, используя программный продукт Bruker axis Версию 7,0. Образцы готовили, помещая их в кварцевый держатель. Необходимо отметить, что приборы Bruker закуплены Siemans; таким образом, прибор Bruker D5000 по существу представляет собой то же самое, что и Siemans D5000. Программный продукт Eva Application 9.0.0.2 использовали для визуализации и оценки порошкового рентгеновского дифракционного спектра. Файлы данных порошковой рентгенограммы (.raw) кристаллических форм не обрабатывали до поиска пиков. Фактор полиномиального сглаживания 0,3 применяли для файла данных порошковой рентгенограммы аморфной формы в одном примере для усиления деталей. Как правило, значение порога 1 и значение ширины 0,3 использовали для получения предварительной интерпретации пиков. Выходные данные автоматической интерпретации визуально проверяли, чтобы обеспечить достоверность, и по мере необходимости вручную проводили корректировку. Данные значения пиков для каждой формы суммируются в таблицах, приведенных ниже. Файлы данных порошковой рентгенограмм аморфной формы были.
Для проведения измерения дифракции рентгеновских лучей на приборе Брэгга-Бретано, подобном системе Bruker, использованной для сообщенных здесь измерений, образец типично помещают в держатель, который имеет полость. Порошкообразный образец прессуют стеклянной пластинкой или ее эквивалентом, чтобы обеспечить неупорядоченную поверхность и надлежащую высоту образца. Затем держатель образца помещают в прибор. Падающий рентгеновский пучок направляют на образец, вначале под малым углом относительно плоскости держателя, а затем двигают по дуге, что непрерывно увеличивает угол между падающим пучком и плоскостью держателя. Разница измерений, связанных с таким анализом порошковых рентгенограмм, является результатом различных факторов, включая: (a) ошибки при приготовлении образца (например, высота образца); (b) ошибки прибора (например, ошибки плоскости образца); (c) ошибки калибровки; (d) ошибки оператора (включая ошибки, присутствующие при определении положений пиков); и (e) природу материала (например, предпочтительную ориентацию и ошибки прозрачности). Ошибки калибровки и ошибки в высоте образца часто в результате дают сдвиг всех пиков в одном и том же направлении. Небольшие различия в высоте образцов при использовании плоского держателя будут приводить к существенным сдвигам в положениях пиков порошковой рентгенограммы. Систематическое исследование показало, что, используя Shimadzu XRD-6000 в типичной конфигурации Брэгга-Бретано, разница в высоте образца в 1 мм ведет к сдвигу пика до 1 градуса (2θ) (Chen et al., J. Pharmaceutical and Biomedical Analysis 26:63 (2001)). Данные сдвиги можно идентифицировать из рентгенограммы и их можно исключить, компенсируя сдвиг (используя систематический корректирующий фактор для всех значений положений пиков) или повторно калибруя прибор. Как указано выше, можно уточнить измерения от различных приборов, применяя систематический корректирующий фактор для приведения положений пиков в согласие. Как правило, данный корректирующий фактор будет приводить положения измеренных пиков от Bruker в согласие с ожидаемыми положениями пиков, и он может быть в диапазоне от 0 до 0,2 градусов (2θ).
Специалист в данной области поймет, что положения пиков (2θ) будут показывать некоторую межприборную нестабильность, типично до 0,1-0,2 градусов (2θ). Соответственно, когда сообщаются положения пиков (2θ), специалист в данной области поймет, что такие числа предназначены для охвата такой межприборной нестабильности. Более того, когда описывается, что кристаллические формы по настоящему изобретению имеют порошковую рентгенограмму по существу такую же, как показанная на данной фигуре, термин ″по существу такая же″ также предназначен для охвата такой межприборной нестабильности положений пиков дифракции. Более того, специалист в данной области поймет, что относительные интенсивности пиков будут показывать межприборную нестабильность, а также нестабильность вследствие степени кристалличности, предпочтительной ориентации, поверхности приготовленного образца и других факторов, известных специалистам в данной области, и их следует принимать только в качестве качественных измерений.
Различные кристаллические формы и аморфную форму по настоящему изобретению также можно характеризовать, используя ЯМР спектроскопию в твердом состоянии.
Спектры 13C в твердом теле можно получить следующим образом. Примерно 80 мг образца плотно набивали в 4-мм вращающее устройство из ZrO2. Спектры записывали при комнатной температуре и давлении на 4-мм Bruker-Biospin CPMAS датчике, расположенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометре с широким зазором. Образец располагали под магическом углом и вращали с частотой 15,0 кГц. Высокая скорость вращения минимизировала интенсивности сателлитов вращения. Спектры 13C в твердом теле записывали, используя эксперимент кросс-поляризации с вращением под магическим углом с развязкой спин-спинового взаимодействия протонов (CPMAS). Время кросс-поляризации устанавливали при 2,0 мс. Применяли поле развязки спин-спинового взаимодействия протонов примерно 90 кГц. Число сканов регулировали, чтобы получить надлежащее соотношение сигнал/шум. Задержку повторения регулировали примерно до 1,5-кратного времени продольной релаксации протона, вычисленного, исходя из эксперимента ″инверсия-восстановление″. В качестве стандарта для углеродного спектра использовали внешний стандарт кристаллического адамантана, устанавливая значение его резонанса в области сильного поля при 29,5 ч./млн.
Спектры 15N в твердом теле можно получить следующим образом. Примерно 270 мг образца плотно набивали в 7-мм вращающее устройство из ZrO2. Спектры записывали при комнатной температуре и давлении на 7-мм Bruker-Biospin CPMAS датчике, расположенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометре с широким зазором. Образец располагали под магическом углом и вращали с частотой 7,0 кГц. Высокая скорость вращения минимизировала интенсивности сателлитов вращения. Спектры 15N в твердом теле записывали, используя эксперимент кросс-поляризации с вращением под магическим углом с развязкой спин-спинового взаимодействия протонов (CPMAS). Время кросс-поляризации устанавливали при 3,0 мс. Применяли поле развязки спин-спинового взаимодействия протонов примерно 70 кГц. Число сканов регулировали, чтобы получить надлежащее соотношение сигнал/шум. Задержку повторения регулировали примерно до 1,5-кратного времени продольной релаксации протона, вычисленного, исходя из эксперимента ″инверсия-восстановление″. В качестве стандарта для азотного спектра использовали внешний стандарт кристаллического D,L-аланина, устанавливая значение его резонанса при -331,5 ч./млн.
Кристаллические формы также можно характеризовать, используя спектроскопию комбинационного рассеивания. Например, форму XXV соединения 1 характеризовали используя спектроскопию комбинационного рассеивания следующим образом. Спектры комбинационного рассеивания записывали используя ThermoNicolet 960 FT-Raman спектрометр, оборудованный 1064 нм NdYAG лазером и InGaAs детектором. Образцы анализировали в ампулах ЯМР. Спектры получали используя мощность лазера 1 Вт и число сканирований 100. Диапазон регистрации составлял 3700-100 см-1. Пики идентифицировали, используя программный продукт ThermoNicolet Omnic 6.0a, предоставляющий алгоритм отбора пиков, используя установку чувствительности, равную 70, и порог интенсивности 0,4. Все спектры записывали используя разрешение 4 см-1 и аподизацию Хаппа-Гензеля. Калибровку длин волн проводили используя полистирол.
Твердые формы по настоящему изобретению также могут включать более чем одну полиморфную форму. Специалист в данной области также поймет, что кристаллические формы данного соединения могут существовать в по существу чистых формах одного полиморфа, но также могут существовать в кристаллической форме, которая включает две или более различные полиморфные или аморфные формы. Когда твердая форма включает два или более полиморфа, рентгенограмма будет иметь пики, характерные для каждого индивидуального полиморфа по настоящему изобретению. Например, твердая форма, которая включает два полиморфа, будет иметь порошковую рентгенограмму, которая представляет собой конволюцию двух рентгенограмм, которые соответствуют по существу чистым полиморфным формам. Например, твердая форма соединения 1 может содержать первую и вторую полиморфные формы, где твердая форма содержит, по меньшей мере, 10% по массе первого полиморфа. В дальнейшем примере, твердая форма содержит, по меньшей мере, 20% по массе первого полиморфа. Дальнейшие примеры содержат, по меньшей мере, 30%, по меньшей мере, 40% или, по меньшей мере, 50% по массе первого полиморфа. Специалист в данной области поймет, что возможны многие такие комбинации нескольких индивидуальных полиморфов и аморфных форм в варьирующихся количествах.
A. Полиморфная форма XXV
Кристаллическая форма XXV соединения 1 представляет собой безводную кристаллическую форму, которую можно получить, как описано в примере 1. Форма XXV имеет несколько неожиданных преимуществ по сравнению с открытыми ранее кристаллическими формами соединения 1. Например, хотя описанная здесь форма XLI является наиболее термодинамически устойчивой кристаллической формой соединения 1 при условиях обработки и хранения, форма XXV является более термодинамически устойчивой, чем открытые ранее кристаллические формы соединения 1 (исходя из плотности, теплоты плавления и растворимости). Кроме того, при сравнении формы IV (идентифицированной ранее в качестве наиболее подходящей полиморфной формы соединения 1 для фармацевтической рецептуры - смотри публикацию заявки на патент США № 2006-0094763), форма XXV обладает улучшенной светостойкостью, имеет более правильную кристаллическую структуру, не имеет тенденции образовывать агломераты, имеет лучшие характеристики текучести и не прилипает к погружным зондам. Такие улучшенные свойства являются важными для лучшей обработки и изготовления таблеток. Более того, в течение современной процедуры изготовления требуется 26 часов для фильтрации порции формы IV и только 4 часа для фильтрации порции формы XXV, которая была сравнима по размеру, с использованием того же оборудования фильтра-влагоотделителя. Наконец, в способе получения формы XXV можно использовать этанол, тогда как в способе получения формы IV используется н-гептан. Как будет понятно специалистам в данном уровне техники, использование этанола вместо н-гептана может иметь несколько значительных преимуществ, включая: этанол не удерживает статический заряд в отличие от н-гептана (т.е. накопление статического заряда представляет собой проблему безопасности вследствие возможности пожара, следовательно, при обработке гептаном необходима специальная конфигурация оборудования для улучшения заземления); обработку гептаном нельзя провести в сосудах, облицованных стеклом, из-за проблем статического рассеивания; гептан имеет температуру вспышки -4°C, в сравнении с 13°C для этанола; гептан имеет код риска R50/53 (демонстрируя высокую токсичность к водным организмам, и может вызывать долговременные неблагоприятные воздействия в водной среде), в то время как этанол не содержит такого риска.
Кристаллическую форму XXV соединения 1 характеризовали порошковой рентгенограммой, показанной на фиг.1. Порошковая рентгенограмма формы XXV, выраженная в единицах градусов (2θ) и относительной интенсивности с относительной интенсивностью ≥2,0%, измеренная на дифрактометре Bruker D5000 с CuKα излучением, также показана в таблице 1.
|
Кристаллическую форму XXV соединения 1 также характеризовали ЯМР спектром в твердом теле, показанным на фиг.2, измеренным на Bruker-Biospin 4 мм BL CPMAS датчике, помещенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометр с широким зазором. Химические сдвиги 13C формы XXV соединения 1 показаны в таблице 2.
|
Кристаллическую форму XXV соединения 1 также характеризовали следующим ниже спектром комбинационного рассеивания, представленным на фиг.3, полученным на спектрометре TermoNicolet 960 FT-Raman, оборудованном 1064 мм NdYAG лазером и InGaAs детектором. Пики спектра комбинационного рассеивания формы XXV соединения 1 показаны в таблице 3.
|
B. Полиморфная форма XVI
Кристаллическая форма XVI соединения 1 представляет собой сольватную форму, которую можно получить, как описано в примере 1.
Кристаллическую форму XVI соединения 1 характеризовали порошковой рентгенограммой, показанной на фиг.4. Порошковая рентгенограмма формы XVI, выраженная в единицах градусов (2θ) и относительных интенсивностей с относительной интенсивностью ≥6,0%, измеренная на дифрактометре Bruker D5000 с CuKα излучением, также показана в таблице 4.
|
C. Полиморфная форма VIII
Кристаллическая форма VIII соединения 1 представляет собой сольватную форму, которую можно получить, как описано в примере 1. Форму VIII также можно получить, как описано в публикации заявки на патент США № 2006-0094763.
Кристаллическую форму VIII соединения 1 характеризовали порошковой рентгенограммой, показанной на фиг.5. Порошковая рентгенограмма формы VIII, выраженная в единицах градусов (2θ) и относительных интенсивностей с относительной интенсивностью ≥2,0%, измеренная на дифрактометре Bruker D5000 с CuKα излучением, также показана в таблице 5.
|
|
D. Полиморфная форма XLI
Кристаллическая форма XLI соединения 1 представляет собой безводную кристаллическую форму, которую можно получить, как описано в примере 1. Форма XLI имеет несколько неожиданных преимуществ по сравнению с ранее открытыми кристаллическими формами соединения 1. Например, форма XLI является наиболее термодинамически устойчивой полиморфной формой (исходя из плотности, теплоты плавления и растворимости), известной для соединения 1. Кроме того, при сравнении формы IV (идентифицированной ранее в качестве наиболее подходящей полиморфной формы соединения 1 для фармацевтической рецептуры - смотри публикацию заявки на патент США № 2006-0094763) форма XLI обладает улучшенной светостойкостью, имеет более правильную форму кристаллов, не имеет тенденции образовывать агломераты, имеет лучшие характеристики текучести и не прилипает к погружным зондам. Такие улучшенные свойства являются важными для лучшей обработки и изготовления таблеток. Поскольку форма XLI имеет более правильную кристаллическую форму и образует более крупные кристаллы по сравнению с формой IV, скорость фильтрования и скорость промывки осадка на фильтре является улучшенной для формы XLI по сравнению с формой IV. Наконец, в способе получения формы XLI можно использовать этанол, тогда как в способе получения формы IV используется н-гептан. Как будет понятно специалистам в данной области, использование этанола вместо н-гептана может иметь несколько значительных преимуществ, включая: этанол не удерживает статический заряд в отличие от н-гептана (т.е. накопление статического заряда представляет собой проблему безопасности вследствие возможности пожара, следовательно, при обработке гептаном необходима специальная конфигурация оборудования для улучшения заземления); обработку гептаном нельзя провести в сосудах, облицованных стеклом, из-за проблем статического рассеивания; гептан имеет температуру вспышки -4°C, в сравнении с 13°C для этанола; гептан имеет код риска R50/53 (демонстрируя высокую токсичность к водным организмам, и может вызывать долговременные неблагоприятные воздействия в водной среде), в то время как этанол не содержит такого риска.
Кристаллическую форму XLI соединения 1 характеризовали порошковой рентгенограммой, показанной на фиг.5. Порошковая рентгенограмма формы XLI, выраженная в единицах градусов (2θ) и относительных интенсивностях с относительной интенсивностью ≥2,0%, измеренная на дифрактометре Bruker D5000 с CuKα излучением, также показана в таблице 6.
|
Кристаллическую форму XLI соединения 1 также характеризовали ЯМР спектром в твердом теле, показанным на фиг.7, измеренным на Bruker-Biospin 4 мм BL CPMAS датчике, помещенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометр с широким зазором. Химические сдвиги 13C формы XLI соединения 1 показаны в таблице 7.
|
|
Кристаллическую форму XLI соединения 1 также характеризовали ЯМР спектром в твердом теле, показанным на фиг.8, измеренным на Bruker-Biospin 4 мм BL CPMAS датчике, помещенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометр с широким зазором. Химические сдвиги 15N формы XLI соединения 1 показаны в таблице 8.
|
|
Кристаллическую форму XLI соединения 1 также характеризовали следующим ниже спектром комбинационного рассеивания, представленным на фиг.9, полученным на спектрометре TermoNicolet 960 FT-Raman, оборудованном 1064 мм NdYAG лазером и InGaAs детектором. Пики спектра комбинационного рассеивания формы XLI соединения 1 показаны в таблице 9.
|
E. Полиморфная форма IX
Кристаллическая форма IX соединения 1 представляет собой гидратную кристаллическую форму, которую можно получить, как описано в примере 2. Кристаллическая форма IX соединения 1 является предпочтительной формой для разработки фармацевтических рецептур на водной основе. Кристаллическая форма IX соединения 1 является более стабильной, чем форма IV в фармацевтических рецептурах на водной основе, поскольку, как показано в примере 2, форма IV может превращаться в форму IX в водной среде. Гидраты, типично, имеют более низкую растворимость в воде в сравнении с безводными формами. Это может являться преимуществом при разработке фармацевтических препаратов с контролируемым или замедленным высвобождением.
Кристаллическую форму IX соединения 1 характеризовали порошковой рентгенограммой, показанной на фиг.10. Порошковая рентгенограмма формы IX, выраженная в единицах градусов (2θ) и относительных интенсивностях с относительной интенсивностью ≥2,0%, измеренная на дифрактометре Bruker D5000 с CuKα излучением, также показана в таблице 10.
|
Кристаллическую форму IX соединения 1 также характеризовали ЯМР спектром в твердом теле, показанным на фиг.11, измеренным на Bruker-Biospin 4 мм BL CPMAS датчике, помещенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометр с широким зазором. Химические сдвиги 13C формы IX соединения 1 показаны в таблице 11.
|
E. Полиморфная форма XII
Кристаллическая форма XII соединения 1 представляет собой кристаллическую форму этанольного сольвата, которую можно получить, как описано в примере 3.
Кристаллическую форму XII соединения 1 характеризовали порошковой рентгенограммой, показанной на фиг.12. Порошковая рентгенограмма формы XII, выраженная в единицах градусов (2θ) и относительных интенсивностях с относительной интенсивностью ≥2,0%, измеренная на дифрактометре Bruker D5000 с CuKα излучением, также показана в таблице 12.
|
F. Полиморфная форма XV
Кристаллическая форма XV соединения 1 представляет собой кристаллическую форму этанольного сольвата, которую можно получить, как описано в примере 4.
Кристаллическую форму XV соединения 1 характеризовали порошковой рентгенограммой, показанной на фиг.13. Порошковая рентгенограмма формы XV, выраженная в единицах градусов (2θ) и относительных интенсивностях с относительной интенсивностью ≥2,0%, измеренная на дифрактометре Bruker D5000 с CuKα излучением, также показана в таблице 14.
|
G. Аморфная форма
Аморфную форму соединения 1 можно получить, как описано в примере 5. Аморфную форму соединения 1 также можно получить, как описано в международной публикации WIPO № WO 2006/123223.
Аморфную форму соединения 1 характеризовали порошковой рентгенограммой, показанной на фиг.14 и 15, измеренной на дифрактометре Bruker D5000 с CuKα излучением.
Аморфную форму соединения 1 также характеризовали ЯМР спектром в твердом теле, показанным на фиг.16, измеренным на Bruker-Biospin 4 мм BL CPMAS датчике, помещенном в Bruker-Biospin Avance DSX 500 МГц ЯМР спектрометр с широким зазором. Химические сдвиги 13C аморфной формы соединения 1 показаны в таблице 15.
|
II. Фармацевтические Композиции Изобретения
Активные агенты (т.е. полиморфы, или твердые формы, включающие два или более таких полиморфа, соединения 1, описанные здесь или в заявке на патент США № 2006-0094763) настоящего изобретения могут быть составлены в фармацевтические композиции, подходящие для медицинского использования в млекопитающих. Для обеспечения пациента эффективной дозировкой любой полиморфной формы соединения 1 можно использовать любой подходящий маршрут введения. Например, можно использовать пероральные или парентеральные рецептуры и аналогичные. Лекарственные формы включают капсулы, таблетки, дисперсии, суспензии и аналогичное, например, капсулы и/или таблетки с кишечно-растворимым покрытием, капсулы и/или таблетки, содержащие пилюлю соединения 1 с кишечно-растворимым покрытием. Во всех лекарственных формах полиморфные формы соединения 1 можно вводить с другими подходящими компонентами. Композиции могут быть легко представлены в стандартных лекарственных формах и приготовлены методами, известными в фармацевтике. Фармацевтические композиции по изобретению включают терапевтически эффективное количество активного агента и один или несколько инертных, фармацевтически приемлемых носителей и, необязательно, любые другие терапевтические ингредиенты, стабилизаторы или аналогичное. Носитель(и) должен(ы) быть фармацевтически приемлем(ы) в смысле совместимости с другими ингредиентами рецептуры и не должен быть чрезмерно вредным для реципиента. Композиции могут далее включать разбавители, буферные вещества, связующие вещества, вещества, способствующие распадаемости лекарственной формы, загустители, смазывающие вещества, консерванты (включая антиоксиданты), ароматизаторы, вещества, корригирующие вкус и запах лекарственного средства, неорганические соли (например, хлорид натрия), противомикробные средства (например, хлорид бензалкония), подсластители, антистатические вещества, поверхностно-активные вещества (например, полисорбаты, такие как ″TWEEN 20″ и ″TWEEN 80″, и плюрониловые поверхностно-активные вещества, такие как F68 F88, продаваемые BASF), сложные эфиры сорбита, липиды (например, фосфолипиды, такие как лецитин и другие фосфатидилхолины, фосфатидилэтаноламины, жирные кислоты и сложные эфиры жирных кислот, стероиды (например, холестерин)) и хелатообразующие агенты (например, ЭДТУ, цинк и другие такие подобные катионы). Другие фармацевтические наполнители и/или добавки, подходящие для использования в композициях по настоящему изобретению, перечисляются в Remington: The Science & Practice of Pharmacy, 19th ed., Williams & Williams, (1995), в ″Physician's Desk Reference″, 52nd ed., Medical Economics, Montvale, NJ (1998) и в Handbook of Pharmaceutical Excipients, 3rd Ed., Ed. A.H. Kibbe, Pharmaceutical Press, 2000. Активные вещества по изобретению можно составлять в композиции, включая композиции, подходящие для орального, ректального, местного, назального, офтальмологического или парентерального (включая внутрибрюшинную, внутривенную, подкожную или внутримышечную инъекции) введения.
Количество активного вещества в рецептуре будет различаться в зависимости от различных факторов, включая лекарственную форму, состояние, которое лечат, целевую обследуемую группу больных и другие рассмотрения, и обычно будет легко определяться специалистом в данной области. Терапевтически эффективное количество будет представлять собой количество, необходимое для модулирования, регулирования или подавления протеинкиназы. На практике оно будет сильно различаться в зависимости от конкретного активного вещества, серьезности состояния, которое лечат, обследуемой группы больных, стабильности рецептуры и аналогичного. Композиции, как правило, будут содержать в пределах примерно от 0,001% по массе до 99% по массе активного вещества, предпочтительно примерно от 0,01% до 5% по массе активного вещества и, более предпочтительно, примерно от 0,01% до 2% по массе активного вещества, а также будут зависеть от относительных количеств наполнителей/добавок, содержащихся в композиции.
Фармацевтическую композицию по изобретению вводят в обычных лекарственных формах, приготовленных объединением терапевтически эффективного количества активного вещества в качестве активного ингредиента с одним или несколькими соответствующими фармацевтическими носителями согласно обычным процедурам. Данные процедуры могут включать смешивание, гранулирование и прессование или растворение ингредиентов, в соответствии с желаемым приготовлением.
Используемый фармацевтический(е) носитель(и) может быть твердым или жидким. Примеры твердых носителей включают лактозу, сахарозу, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния, стеариновую кислоту и аналогичное. Примеры жидких носителей включают сироп, арахисовое масло, оливковое масло, воду и аналогичное. Аналогичным образом, носитель(и) может включать материалы замедленного или пролонгированного действия, известные из уровня техники, такие как глицерилмоностеарат или глицерилдистеарат по отдельности или вместе с воском, этилцеллюлозой, гидроксипропилметилцеллюлозой, метилметакрилатом или аналогичным.
Можно использовать различные фармацевтические формы. Так, если используют твердый носитель, препарат может быть таблетирован, помещен в твердую желатиновую капсулу в виде порошка или пилюли, или в форме пастилки или леденца для рассасывания. Количество твердого носителя может различаться, но, как правило, оно будет составлять примерно от 25 мг до 1 г. Если используют жидкий носитель, препарат может быть в форме сиропа, эмульсии, мягкой желатиновой капсулы, стерильного раствора или суспензии для инъекций в ампуле или сосуде или неводной жидкой суспензии.
Для получения стабильных водорастворимых лекарственных форм фармацевтически приемлемую соль активного вещества можно растворить в водном растворе органической или неорганической кислоты, например 0,3М растворе янтарной или лимонной кислоты. Если растворимой солевой формы не имеется в наличии, активное вещество можно растворить в подходящем вспомогательном растворителе или комбинациях вспомогательных растворителей. Примеры подходящих вспомогательных растворителей включают, но не ограничиваются этим, спирт, пропиленгликоль, пропиленгликоль 300, полисорбат 80, глицерин и аналогичные в концентрациях в диапазоне 0-60% от общего объема. Композиция также может быть в форме раствора солевой формы активного вещества в соответствующем водном растворителе, таком как вода или изотонический солевой или декстрозный раствор.
Будет понятно, что действительные дозировки соединения 1, используемого в композициях по данному изобретению, будут различаться согласно используемой конкретной полиморфной форме, конкретной рецептуре композиции, режиму введения и конкретному подвергаемому терапии участку, хозяину и заболеванию. Специалисты в данной области, используя обычные тесты определения дозы, принимая во внимание экспериментальные данные для вещества, могут установить оптимальные дозировки для данного ряда условий. Для орального введения иллюстративная обычно используемая суточная доза составляет примерно от 0,001 до 1000 мг/кг массы тела, более предпочтительно, примерно от 0,001 до 50 мг/кг массы тела, причем курсы лечения повторяются с соответствующими интервалами. Введение пролекарств типично дозируют при массовых уровнях, которые являются химическим эквивалентом массовым уровням полностью активной формы. При осуществлении на практике изобретения, наиболее подходящий маршрут введения, а также величина терапевтической дозы будут зависеть от природы и серьезности заболевания, которое лечат. Доза и частота дозы также могут различаться в соответствии с возрастом, массой тела и реакцией индивидуального пациента. Как правило, подходящая оральная лекарственная форма может включать диапазон дозы от 0,5 мг до 100 мг общей суточной дозы активного ингредиента, вводимой однократной дозой или равномерно разделенными дозами. Предпочтительное количество соединения 1 в таких рецептурах составляет примерно от 0,5 мг до 20 мг, например, примерно от 1 мг до 10 мг или примерно от 1 мг до 5 мг.
Композиции по изобретению можно изготовить способами, обычно, известными для приготовления фармацевтических композиций, например, используя обычные методы, такие как смешивание, растворение, гранулирование, изготовления драже, растирание в порошок, эмульгирование, инкапсулирование, включение или лиофилизация. Фармацевтические композиции можно составить традиционным способом, используя один или несколько физиологически приемлемых носителей, которые могут быть выбраны из наполнителей и вспомогательных веществ, которые содействуют переработке активных соединений в препараты, которые можно использовать фармацевтически.
Для орального введения можно легко составить рецептуру из полиморфной формы соединения 1, объединяя активное вещество с фармацевтически приемлемыми носителями, известными из уровня техники. Такие носители дают возможность составить рецептуру из соединений по изобретению в виде таблеток, пилюль, драже, капсул, гелей, сиропов, кашиц, суспензий и аналогичного для орального приема внутрь пациентом, которого необходимо лечить. Фармацевтические препараты для орального использования можно получить используя твердый наполнитель в смеси с активным веществом, необязательно, измельчая полученную в результате смесь и перерабатывая смесь гранул после добавления подходящих вспомогательных добавок. Подходящие наполнители включают такие наполнители, как сахара, включая лактозу, сахарозу, маннит или сорбит; и препараты целлюлозы, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, камедь, метилцеллюлозу, гидроксипропилметилцеллюлозу, натрий карбоксиметилцеллюлозу или поливинилпирролидон (ПВП). Если желательно, можно добавить вещества, способствующие распадаемости лекарственной формы, такие как сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, например, альгинат натрия.
Сердцевины драже обеспечиваются подходящими покрытиями. Для данной цели можно использовать концентрированные растворы сахара, которые могут необязательно содержать гуммиарабик, поливинилпирролидон, гель Карбопол, полиэтиленгликоль и/или диоксид титана, растворы глазури и подходящие органические растворители или смеси растворителей. К покрытиям таблеток или драже можно добавлять красители или пигменты для идентификации или для характеризации различных комбинаций активных веществ.
Фармацевтические препараты, которые можно использовать орально, включают плотно заполненные капсулы, изготовленные из желатина, а также мягкие герметичные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Плотно заполненные капсулы могут содержать активные ингредиенты в смеси с наполнителями, такими как лактоза, связующими, такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах активные вещества могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Все рецептуры для орального введения должны быть в дозировках, подходящих для такого введения. При буккальном введении композиция может принимать форму таблеток или леденцов, составленных в традиционной манере.
Для введения в глаза активное вещество доставляют в фармацевтически приемлемом офтальмологическом растворителе, так что соединение поддерживается в контакте с глазной поверхностью в течение достаточного периода времени, чтобы дать возможность соединению проникнуть в корнеальные или внутренние области глаза, включая, например, переднюю камеру, заднюю камеру, стекловидное тело, внутриглазную жидкость, жидкую часть стекловидного тела, роговицу, радужную оболочку/ресничное тело, хрусталик, сосудистую оболочку/сетчатую оболочку и белочную оболочку. Фармацевтически приемлемый офтальмологический растворитель может представлять собой, например, мазь, растительное масло или инкапсулирующий материал. Активное вещество по изобретению можно непосредственно вводить инъекцией в жидкую часть стекловидного тела или внутриглазную жидкость или субтеноновое пространство глаза.
Альтернативно, активный ингредиент может быть в порошковой форме для составления с подходящим растворителем, например стерильной не содержащей пироген водой, перед использованием. Соединения также можно составлять в ректальные или вагинальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие традиционные основы суппозиториев, такие как масло какао или другие глицериды.
Кроме описанных выше рецептур, полиморфные формы также можно составлять в виде препарата пролонгированного действия. Такие препараты пролонгированного действия можно вводить имплантацией (например, подкожно или внутривенно) или внутримышечной инъекцией. Таким образом, например, полиморфные формы можно составлять с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде плохо растворимых производных, например, в виде плохо растворимой соли.
Кроме того, полиморфные формы соединения 1 могут доставляться используя системы с замедленным высвобождением, такие как полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих терапевтический агент. Были созданы и известны специалистам в данной области различные материалы с замедленным высвобождением. Капсулы с замедленным высвобождением могут, в зависимости от их химической природы, высвобождать соединение в течение периода от нескольких недель до более 100 дней.
Фармацевтические композиции также могут включать подходящие твердофазные и гелеобразные носители или наполнители. Примеры таких носителей или наполнителей включают карбонат кальция, фосфат кальция, сахара, крахмалы, производные целлюлозы, желатин и полимеры, такие как полиэтиленгликоли.
III. Способы использования полиморфов по изобретению
Полиморфные формы соединения 1 применимы для опосредования активности протеинкиназ. Более конкретно, полиморфные формы применимы в качестве антиангиогенезных средств и в качестве средств модуляции и/или подавления активности протеинкиназ, например, активности, связанной с VEGF, FGF, CDK комплексами, TEK, CHK1, LCK, FAK, и фосфорилазкиназы среди прочего, таким образом, обеспечивая лечение рака или других заболеваний, связанных с пролиферацией клеток, опосредованной протеинкиназами у млекопитающих, включая человека.
Терапевтически эффективные количества соединения 1 можно вводить, типично, в форме фармацевтической композиции для лечения заболеваний, опосредуемых модуляцией или регуляцией протеинкиназ. Подразумевается, что ″эффективное количество″ обозначает такое количество вещества, которое, при введении млекопитающему, нуждающемуся в таком лечении, достаточно для эффективного лечения для заболевания, опосредуемого активностью одной или нескольких протеинкиназ, таких как тиразинкиназы. Таким образом, терапевтически эффективное количество соединения 1 представляет собой количество, достаточное для модуляции, регуляции или подавления активности одной или нескольких протеинкиназ, так что болезненное состояние, которое опосредуется данной активностью, облегчается или смягчается. Имеется в виду, что ″лечение″ обозначает, по меньшей мере, облегчение болезненного состояния у млекопитающего, такого как человек, которое обусловлено, по меньшей мере частично, активностью одной или нескольких протеинкиназ, таких как тирозинкиназы, и включает: профилактику возникновения болезненного состояния у млекопитающего, в частности, когда обнаружено, что млекопитающее предрасположено к болезненному состоянию, но оно еще у него не диагностировано; модуляцию и/или подавление болезненного состояния; и/или облегчение болезненного состояния. Иллюстративные болезненные состояния включают диабетическую ретинопатию, неоваскулярную глаукому, ревматоидный артрит, псориаз, возрастную макулярную дегенерацию (AMD) и аномальный рост клеток, такой как рак.
В одном варианте осуществления данного способа аномальный рост клеток представляет собой рак, включая, но не ограничиваясь этим, мезотелиому, гепатобилиарную опухоль (печени и желчевыводящих путей), первичную или вторичную опухоль ЦНС, первичную или вторичную опухоль головного мозга, рак легкого (NSCLC или SCLC), рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, кожную или внутриглазную меланому, рак яичников, рак ободочной кишки, рак прямой кишки, рак анального канала, рак желудка, рак желудочно-кишечного тракта (желудочный, колоректальный, дуоденальный), рак молочной железы, рак матки, карциному фаллопиевой трубы, карциному эндометрия, карциному шейки матки, карциному влагалища, карциному вульвы, болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидных желез, рак надпочечника, саркому мягких тканей, рак уретры, рак пениса, рак простаты, тестикулярный рак, хроническую или острую лейкемию, хроническую миелоидную лейкемию, лимфоцитарную лимфому, рак мочевого пузыря, рак почек или мочеточника, почечно-клеточную карциному, карциному почечной лоханки, опухоль центральной нервной системы (ЦНС), первичную лимфому ЦНС, неходжкинскую лимфому, опухоли позвоночника, глиому стволовой части головного мозга, аденому гипофиза, адренокортикальный рак, рак желчного пузыря, множественную миелому, холангиокарциному, фибросаркому, нейробластому, ретинобластому или комбинацию одного или нескольких вышеуказанных раков.
В одном варианте осуществления настоящего изобретения рак представляет собой рак легкого (NSCLC или SCLC), рак головы или шеи, рак яичников, рак ободочной кишки, рак прямой кишки, рак анального канала, рак желудка, рак молочной железы, рак почек или мочеточника, почечно-клеточную карциному, карциному почечной лоханки, опухоль центральной нервной системы (ЦНС), первичную лимфому ЦНС, неходжкинскую лимфому или опухоли позвоночника, или комбинацию одного или нескольких вышеуказанных раков.
В особом варианте осуществления рак представляет собой рак щитовидной железы, рак паращитовидных желез, рак поджелудочной железы, рак ободочной кишки или почечно-клеточную карциному.
В другом варианте осуществления указанного способа указанный аномальный рост клеток представляет собой доброкачественное пролиферативное заболевание, включая, но не ограничиваясь этим, псориаз, доброкачественную гипертрофию простаты или рестеноз.
Данное изобретение также относится к способу лечения аномального роста клеток у млекопитающих, который включает введение указанному млекопитающему некоторого количества полиморфной формы соединения 1, которое является эффективным при лечении аномального роста клеток в комбинации с противоопухолевым средством, выбранным из группы, состоящей из митотических ингибиторов, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов фактора роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического отклика, антител, цитотоксинов, антигормонов и антиандрогенов.
ПРИМЕРЫ
Примеры, которые следуют ниже, будут дополнительно иллюстрировать приготовление отдельных полиморфных форм по изобретению, т.е. полиморфных форм XXV и XVI соединения 1, но они не имеют намерения ограничивать объем изобретения, определенный здесь или заявленный ниже.
В настоящем описании могут использоваться следующие сокращения: ТГФ (тетрагидрофуран); NMP (N-метилпирролидинон); Xantphos (9,9-диметил-4,5-бис(дифенилфосфино)ксантен); Pd2(dba)3 (трис(дибензилиденацетон)дипалладий(0); и MeOH (метанол).
Пример 1: Приготовление и характеризация полиморфных форм VIII, XVI, XXV и XLI соединения 1
Формы XXV и XLI соединения 1 можно приготовить из формы XVI, которую можно приготовить из формы VIII, как показано в следующих ниже примерах.
a) Приготовление формы VIII
Форма VIII представляет собой ТГФ сольватную полиморфную форму соединения 1, которую можно приготовить в течение конечной стадии приготовления соединения 1 следующим образом. Методы приготовления соединения 1 были раскрыты ранее с использованием методологию реакции Хека (например, WO 2006/048745 и US 2006-0094881). Чтобы приготовить соединение 1 в полиморфной форме VIII, соединение 1 готовили следующим образом. Неочищенный материал соединения 1 из реакции Хека (приблизительно 55 кг) повторно суспендировали теплым в смеси ТГФ (210 л) с 1,2-диаминопропаном (13 кг) и затем охлаждали для фильтрования. Отфильтрованное твердое вещество промывали ТГФ (210 л), сушили под вакуумом при нагревании до 40-70°C и выделяли, получая неочищенное соединение 1 (форма VIII, ТГФ сольват), (52,5 кг, 73%). Форму VIII характеризовали порошковой рентгенограммой, как описано ранее и показано на фиг.5.
b) Приготовление формы XVI
Форма XVI представляет собой изопропанольную сольватную полиморфную форму соединения 1, которую можно приготовить из формы VIII следующим образом. Форму VIII (приготовленную выше) растворяли (50 кг) в смеси N-метилпирролидинона (150 л) и ТГФ (необязательно, 50 л) с 1,2-диаминопропаном (28,8 кг). Раствор нагревали и пропускали через микронный фильтр для удаления нерастворимого вещества. Затем к теплому раствору добавляли метанол (300 л). Продукт кристаллизовали из раствора и нагревание продолжали. После некоторого периода времени добавляли дополнительное количество метанола (400 л). Суспензию охлаждали и перемешивали в течение, по меньшей мере, 12 часов. Суспензию фильтровали, промывали изопропанолом (150 л) и продували до сухого состояния. Твердое вещество повторно суспендировали в изопропаноле (200 л) при нагревании. Затем суспензию охлаждали, фильтровали и промывали изопропанолом (150 л). Полученное в результате твердое вещество (форма XVI, изопропанольный сольват) сушили под вакуумом при 40-70°C в течение, по меньшей мере, 24 часов, так что уровни остаточного изопропанола были ниже 5% по массе, и выделяли. Форму XVI характеризовали порошковой рентгенограммой, как описано ранее и показано на фиг.4.
c) Приготовление формы XXV
Форма XXV представляет собой безводную полиморфную форму соединения 1, которую можно приготовить из формы XVI следующим образом. Форму XVI (приготовленную выше) загружали (11,9 кг, 1 эквивалент) в сосуд без дефектов. Следует отметить, что важно использовать чашеобразный сосуд, а не конический сосуд, и что используется энергичное взбалтывание для достижения хорошего перемешивания в данной стадии. Превращение будет гетерогенным.
Затем в сосуд загружали затравочные кристаллы формы XXV (120 г, 0,01 эквивалента). Следует отметить, что данный процесс также был успешно осуществлен без каких-либо затравочных кристаллов. Затем к твердому веществу в сосуде загружали этанол (120 л), после чего нагревали до температуры флегмообразования (цель 79°C, настройка рубашки приблизительно 85°C). Затем полученную в результате суспензию кипятили с обратным холодильником в течение, по меньшей мере, 8 часов. Следует отметить, что существует сильная корреляция между более высокими температурами реакции, ведущими к более быстрой полиморфной конверсии. Это обусловлено фактом, что процесс, по-видимому, лимитируется растворимостью. Следует отметить, что при 90°C и в 30 мл/г (относительно подачи формы XVI) растворителя активный фармацевтический ингредиент растворяется в этаноле, приводя к процессу перекристаллизации.
Затем отбирали пробу суспензии, чтобы убедиться, что конверсия в форму XXV была полной. Если конверсия не полная, с формой XXV может присутствовать этанольный сольват. Если конверсия не является полной, нагревание продолжали в течение, по меньшей мере, дополнительных 8 часов. Как только конверсия становилась полной примерно после 24 часов, реакционную смесь охлаждали до 15-25°C.
Затем суспензию перемешивали в течение, по меньшей мере, 1 часа при комнатной температуре. Затем материал отфильтровывали, и осадок на фильтре промывали этанолом (36 л). Затем твердое вещество сушили (для удаления этанола и других спиртов) под вакуумом при менее чем 70°C в течение минимум 12 часов. Затем отделяли кристаллы формы XXV (11,4 кг, выход 96%). Форму XXV характеризовали порошковой рентгенограммой, ЯМР в твердом теле и спектроскопией комбинационного рассеивания, как описано ранее и показано на фиг.1, 2 и 3.
Альтернативно, форму XXV готовили без затравочных кристаллов следующим образом. В сосуд добавляли 2,0 г соединения 1 (форма XVI) и 40 мл этанола (денатурированного 1% метанола). Суспензию нагревали до 77-78°C под атмосферой азота в течение 24 часов. Суспензии дали охладиться до комнатной температуры, гранулировали в течение 1 часа, фильтровали и промывали абсолютным этанолом (4 мл). Все твердое вещество высушили в сушильном шкафу при 50-55°C в течение 16 часов. Это дало 1,6 г соединения 1 (форма XXV) в виде белого твердого вещества.
d) Приготовление формы XLI
Форма XLI представляет собой безводную полиморфную форму соединения 1, которую можно приготовить из формы XVI следующим образом. Форму XVI (приготовленную выше) загружали (11,9 кг, 1 эквивалент) в сосуд без дефектов. Следует отметить, что важно использовать чашеобразный сосуд, а не конический сосуд, и что используется энергичное взбалтывание для достижения хорошего перемешивания в данной стадии. Превращение будет гетерогенным.
Затем в сосуд загружали затравочные кристаллы формы XLI (120 г, 0,01 эквивалента). Следует отметить, что данный процесс также был успешно осуществлен без каких-либо затравочных кристаллов. Затем к твердому веществу в сосуде загружали этанол (120 л), после чего нагревали до температуры флегмообразования (цель 79°C, настройка рубашки приблизительно 85°C). Затем полученную в результате суспензию кипятили с обратным холодильником в течение, по меньшей мере, 2 часов. Следует отметить, что существует сильная корреляция между более высокими температурами реакции, ведущими к более быстрой полиморфной конверсии. Это обусловлено фактом, что процесс, по-видимому, лимитируется растворимостью. Следует отметить, что при 90°C и в 30 мл/г (относительно подачи формы XVI) растворителя активный фармацевтический ингредиент растворяется в этаноле, приводя к процессу перекристаллизации.
Затем отбирали пробу суспензии, чтобы убедиться, что конверсия в форму XLI была полной. Если конверсия не полная, с формой XLI может присутствовать этанольный сольват. Если конверсия не является полной, нагревание продолжают в течение, по меньшей мере, дополнительных 2 часов. Как только конверсия становилась полной примерно после 24 часов, реакционную смесь охлаждали до 15-25°C.
Затем суспензию перемешивали в течение, по меньшей мере, 1 часа при комнатной температуре. Затем материал отфильтровывали, и осадок на фильтре промывали этанолом (36 л). Затем твердое вещество сушили (для удаления этанола и других спиртов) под вакуумом при менее чем 70°C в течение минимум 12 часов. Затем кристаллы формы XLI отделяли (11,4 кг, выход 96%). Форму XLI характеризовали порошковой рентгенограммой и ЯМР в твердом теле, как описано ранее и показано на фиг.6, 7 и 8.
Альтернативно, форму XLI готовили без затравочных кристаллов следующим образом. В сосуд добавляли 4,0 г неочищенного соединения 1 и 40 л изопропанола. Суспензию нагревали до 50-70°C и выдерживали в течение 3 часов. После этого суспензию охладили до комнатной температуры и фильтровали, отделяя твердое вещество. Влажный осадок на фильтре промывали 12 л изопропанола, сушили на фильтре под продувкой азотом в течение примерно 2 часов и затем переносили в лотковую сушилку для дальнейшей сушки под вакуумом с нагревом до 55-65°C. Примерно после 18 часов твердое вещество выгружали в сосуд с 40 л абсолютного этанола и нагревали до температуры флегмообразования (примерно 79°C). Реакционную смесь перегоняли, удаляя примерно 12 л растворителя. Затем полученную в результате реакционную смесь кипятили с обратным холодильником в течение дополнительных 2 часов. Затем смесь охлаждали до комнатной температуры и перемешивали в течение примерно 1 часа. Твердое вещество отфильтровывали и влажный осадок на фильтре промывали 12 л абсолютного этанола. Твердое вещество переносили в лотковую сушилку и сушили под вакуумом при 50-60°C в течение примерно 24 часов. Твердое вещество выгружали, получая соединение 1, форма XLI, в виде белого кристаллического твердого вещества, 3,8 кг.
Пример 2: Приготовление и характеризация полиморфной формы IX соединения 1
Формы IX соединения 1 можно приготовить из формы IV, как показано в следующих ниже примерах. Форма IV представляет собой безводную полиморфную форму соединения 1, которую можно приготовить, как описано в заявке на патент США № 2006-0094763.
Приготовление формы IX
Форма IX представляет собой гидратную форму соединения 1, которую можно приготовить из формы IV следующим образом: форму IV добавляли (1 г) к смеси 1:1 изопропанол/вода (50 мл). Суспензию нагревали и перемешивали при 45°C в течение двух суток, затем ей дали охладиться до 25°C. Суспензию фильтровали, промывали смесью 1:1 изопропанол/вода и сушили под вакуумом при 40°C в течение одних суток.
Пример 3: Приготовление и характеризация полиморфной формы XII соединения 1
Форма XII представляет собой этанольную сольватную полиморфную форму соединения 1, которую можно приготовить из формы XVI следующим образом. Форму XVI (приготовленную в примере 1) добавляли (1 г) к этанолу (100 мл). Раствор нагревали и перемешивали при 40°C в течение двух часов, затем давали охладиться до 25°C. Суспензию фильтровывали, промывали этанолом и сушили под вакуумом при 45°C в течение трех часов.
Пример 4: Приготовление и характеризация полиморфной формы XV соединения 1
Форма XV представляет собой этанольную сольватную полиморфную форму соединения 1, которую можно приготовить из формы XVI следующим образом. Форму XVI (приготовленную в примере 1) добавляли (1 г) к этанолу (450 мл) и перемешивали при комнатной температуре в течение одного часа. Суспензию фильтровали на гравитационном фильтре в кристаллизатор, и выпаривали под потоком азота в течение нескольких дней до сухого состояния.
Пример 5: Приготовление и характеризация аморфного соединения 1
Аморфную форму соединения 1 можно приготовить из формы XLI следующим образом: форму XLI (приготовленную выше в примере 1) добавляли (135 мг) в Wig-L-Bug® дробилку/смеситель (модель 30) с шарами из нержавеющей стали. Твердое вещество измельчали в течение 150 минут, получая аморфное твердое вещество.
Пример 6: Фотохимическая стойкость формы XLI и формы XXV по сравнению с IV
Проводили фотохимическое сравнительное исследование формы XLI, формы XXV и формы IV. Полученные в результате данные показали значительное улучшение в стойкости как формы XLI, так и формы XXV относительно формы IV. Улучшенная стойкость одного полиморфа относительно другого потенциально является преимуществом в лекарственных препаратах. В случае фотохимической стойкости, для формы XXV и формы XLI можно избежать специальных предосторожностей при обращении или упаковке для защиты соединения от света, которые могли бы увеличить стоимость изготовления и хранения. Увеличенная стойкость формы XXV и формы XLI также будет значительно снижать потенциал продуктов фотохимического разложения, возникающих в фармацевтических препаратах (например, таблетках) при хранении с течением времени. Относительное отсутствие фоторазложения формы XXV и формы XLI также снижает их потенциал вызвать фоточувствительные реакции у пациентов, получающих лекарственный препарат при воздействии солнечного света.
Экспериментальные условия
Приблизительно 50 мг каждой формы помещали в 20 мл стеклянные сосуды. Глубина образца составляла <3 мм. Сосуды накрывали чашкой из кварцевого стекла и помещали в световой бокс Atlas Suntest XLS+, оборудованный 320 нм отсекающим фильтром. Спектральный выход аналогичен ID65 эмиссионному стандарту, 320-380 нм (ID65 представляет собой ISO стандарт непрямого дневного света в помещении). На образцы воздействовали искусственным светом, эквивалентным указаниям Международной конференции по гармонизации (ICH) по тестированию светостойкости новых лекарственных веществ, воздействие Вариант 1. Полученные в результате данные представлены ниже.
Фотохимическая стойкость под действием света 1X ICH Вариант 1: Активность (масс./масс. %) после воздействия света
|
Пример 7: Время обработки фильтрованием формы XLI и формы XXV по сравнению с IV
Проводили сравнение времени обработки фильтрованием формы XLI, формы XXV и формы IV.
Полученные в результате данные показывают значительное улучшение во временах фильтрования формы XLI и формы XXV относительно формы IV. Это можно приписать сниженной тенденции агломерации частиц формы XXV и формы XLI. Данное улучшение приводит к значительному уменьшению времени для фильтрования конечного продукта, что приводит к значительному снижению стоимости процесса изготовления.
Экспериментальные условия
Все три партии, показанные ниже, размером приблизительно 20 кг, фильтровали в течение изготовления соединения формулы 1. Фильтр имел площадь фильтра 0,25 м2 и максимальный применимый объем осадка на фильтре 40 литров. Все партии фильтровали используя одно и то же оборудование.
Время фильтрования (часы)
|
В то время как изобретение было иллюстрировано со ссылкой к конкретным и предпочтительным вариантам осуществления, для специалистов в данной области понятно, что могут быть сделаны изменения и модификации посредством обычного экспериментирования и осуществления изобретения на практике. Таким образом, изобретение, как подразумевается, не ограничивается предшествующим описанием, а определяется прилагаемой формулой изобретения и ее эквивалентами.
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/ac0f40eed077949e066adbd03741e2ae.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/38fb7e541a16e05696cb0945e0f09167.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/16845044a314a5d6c4b4dafc4ad5e312.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/1ad151979e25eaaa15d110b76813b908.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/b00bc7d8f74b0a917cb0e0909e75d92f.jpg)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/6420d2a3d04355dfb70fbdc4bac160de.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/29af2d006e30932633377425d6929c94.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/dce6a6286066d5a40dc85dd97483487d.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/65ed78f68cc53cd7c87cb4ce56c99573.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/ef03e035fb36a53672bce391182cb091.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/06f12c377b29306e153c7b842b068284.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/9809deb21420a145f620fafe128967a2.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/1fa11cc71e3183f9e8d7f40a9260055f.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/f9f604a5ad793ec00512647615fb6513.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/8e7659f5dc0c5e9d04b73120e27e232f.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/cbab18a7fc6e2cb980499cae54dfc544.png)
![КРИСТАЛЛИЧЕСКИЕ ФОРМЫ 6-[2-(МЕТИЛКАРБАМОИЛ)ФЕНИЛСУЛЬФАНИЛ]-3-Е-[2-(ПИРИДИН-2-ИЛ)ЭТЕНИЛ]ИНДАЗОЛА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ АНОМАЛЬНОГО РОСТА КЛЕТОК У МЛЕКОПИТАЮШИХ](https://fips.edrid.ru/images/rid/66/65/7d/d46632054335ee661a3e59520b6c0ba2.png)

